Изобретение относится к области микробиологии, в частности к микробиологическим процессам очистки воды, например к очистке бытовых стоков или отработанных вод предприятий, к системам локальной очистки сточных вод химических и нефтехимических производств, к локальным системам очистки технологических стоков транспортных средств, например на флоте и т.д.
Известны микробиологические методы очистки, в которых для окисления органических загрязнителей используется кислород воздуха, являющийся конечным акцептором электронов. Газ-окислитель (O2) доставляется в ферментационную систему различными методами, сводящимися к диспергированию воздуха или обогащенного кислорода [1] в очищаемой жидкости, являющейся одновременно питательной средой для микроорганизмов. В реальных условиях процесс, как правило, осуществляется нестерильно [2], в открытых аппаратах (аэротенках), снабженных устройствами для барботажа или другими диспергаторами газа. В целом, изменения, происходящие в подобной системе, могут быть выражены общим уравнением (1):
Аэробные процессы распространены в самых различных технологических модификациях и, в настоящее время, широко используются в технологии очистки сточных вод от органических соединений [1, 4].
Главным недостатком процессов аэробной очистки является их высокая энергоемкость и неэкономичность. Основной расход энергии происходит в процессе осуществления межфазного переноса в системе газ-жидкость и тратится на активное и постоянное диспергирование воздуха в культуральной среде, а также на компрессию газа. Другой существенный недостаток метода заключается в том, что постоянная подача свежих порций воздуха в биореактор, в котором присутствуют легколетучие соединения, такие, например, как легкие углеводороды, спирты, кетоны, эфиры, хлорорганические ингредиенты, вещества, обладающие сильным запахом, приводит к уносу последних из системы, попаданию их в атмосферу, что в свою очередь, вызывает загрязнение воздушного бассейна.
Известны методы очистки сточных вод, осуществляемые в анаэробных аппаратах, в основе которых лежат биохимические процессы брожения [3]. Деструкция органических примесей в этом случае происходит без подачи воздуха или кислорода и без дополнительного внесения солей-окислителей. В процессе реализации данной технологии, окисление многих загрязнителей до углекислого газа невозможно из-за отсутствия акцепторов электронов и существует лишь вероятность перераспределения электронов между молекулами различного типа. В целом, процессы, протекающие в подобной системе, могут быть выражены общим уравнением (2).

Электроны в ходе подобных реакций перераспределяются от соединений с высокой степенью окисления на соединения с меньшей, при этом могут образовываться углекислый газ или метан. Анаэробные технологии очистки в анаэротенках, основанные на биохимических процессах брожения, обычно применяются лишь в комбинациях с системами аэробной очистки [3] при этом, так как они остаются весьма чувствительными к составу загрязнителей. Подобные технологии могут быть использованы для удаления из воды, например, примесей сбраживаемых углеводов, оставаясь малоэффективными в случае с насыщенными или галогенированными углеводородами. Таким образом, главными недостатками анаэробных систем очистки сточных вод от органических и неорганических примесей является их низкая производительность, зависимость эффективности от химического состава загрязнителей, необходимость введения дополнительных стадий аэробной очистки и, как следствие, невысокие технико-экономические показатели процесса в целом.
Известны методы очистки сточных вод, основанные на создании условий для развития культур сульфатвосстанавливающих бактерий (СВБ), способных развиваться анаэробно и использовать сульфаты (в частности, натрия или кальция) в качестве акцепторов электронов, необходимых для окисления разнообразных органических соединений, в том числе и углеводородов [5, 6]. В целом, процессы, протекающие в подобной системе, могут быть выражены общим уравнением (3):
Вместе с тем, скорость подобных процессов весьма невелика, что связано с энергетикой происходящих в данном случае биохимических реакций. Образующийся в процессе восстановления сульфатов сероводород в свою очередь создает проблемы утилизации, являясь весьма опасным загрязнителем воздушного бассейна. Как и в предыдущем случае, технологии очистки, основанные на использовании сульфатвосстанавливающих бактерий, требуют введения дополнительных стадий аэробной очистки, что, в свою очередь, снижает технико-экономические показатели процесса в целом.
Также известны анаэробные процессы очистки воды от окисляемых примесей, в которых в качестве рабочей культуры выступают микроорганизмы-денитрификаторы, а роль акцептора электронов играет нитрат натрия. Процессы, протекающие в подобной системе, могут быть выражены общим уравнением (4):
Известно, что нитраты натрия и других металлов являются прекрасными акцепторами электронов, обеспечивая устойчивое биохимическое окисление многих органических соединений [6-8]. Сумма биохимических реакций, протекающих в микробных клетках в процессе денитрификации, отражена общим уравнением (5), из которого следует, что первым интермедиатом в цепи восстановления нитрата до азота является нитрит (NaNO2):
NaNO3-->NaNO2-->...-->N2 (5)
Вместе с тем, NaNO2 весьма токсичен для микроорганизмов [9]. Поэтому его содержание в культуральной жидкости, равно как и NaNO3, из которого нитрит образуется, ограничено 0,02-0,05 мас.%. Превышение этого порога приводит к угнетению жизнедеятельности микроорганизмов. Как следствие, концентрация органического субстрата в этих условиях также лимитирована. Таким образом, очевидно, что для технологической реализации анаэробного окисления, основанного на микробной денитрификации, следует разбавлять очищаемые растворы, что увеличивает объемы культивирования и повышает капитальные затраты. Низкие концентрации окислителя в ферментационной среде (всего 0,02-0,05% NaNO3) делают процесс технологически нестабильным, достигаемая интегральная скорость окисления, в конечном счете, оказывается невысокой по сравнению с окислительными процессами, происходящими в аэробных условиях.
Наиболее близким к предлагаемому по технической сущности является способ очистки сточных вод [10], основанный на денитрификации, в котором для повышения устойчивости активного ила (микроорганизмов) к нитрату в 2,25 раза применяются добавки рибофлавина, за счет чего частично решаются проблемы, свойственные технологиям с низкими концентрациями нитратов. Вместе с тем, из-за высокой стоимости рибофлавина использование данного изобретения затруднительно.
Целью изобретения является преодоление типичных недостатков, свойственных аэробным процессам (большой энергоемкости, побочных эффектов очистки в виде загрязнения воздушного бассейна). Целью изобретения является также преодоление слабых технологических сторон анаэробных процессов: большой капиталоемкости, чувствительности к химической природе загрязнителей, низких скоростей окисления, образования в ходе процесса токсичных продуктов (сероводорода) и т.д.
Поставленная цель достигается тем, что в предлагаемом изобретении очистка осуществляется с помощью денитрифицирующих бактерий, в аппаратах анаэробного типа, однако, в отличие от прототипа, в качестве окислителя и акцептора электронов используется азотная кислота, которая подается непосредственно в ферментационную среду по мере ее защелачивания, при этом работа анаэробного ферментера организована в режиме рН-стата с поддержанием фиксированных значений водородного показателя культуральной жидкости, находящегося в пределах рН 8,0-10,0. Неожиданно обнаружено, что при подобной схеме организации процесса, исчезает эффект ингибирования денитрифицирующей активности микроорганизмов, вследствие чего окисление загрязняющей субстанции происходит с высокими скоростями, характерными для реакторов аэробного типа. В общем виде, процессы, протекающие в подобной системе, могут быть выражены общим уравнением (6)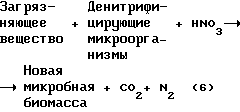
Известные технические решения (аналоги), имеющие признаки, сходные с признаками, отличающими заявляемое решение от прототипа, не обнаружены.
Заявляемое решение, по мнению авторов, соответствует критерию "существенные отличия".
Возможности предлагаемого изобретения могут быть проиллюстрированы предлагаемыми ниже примерами. При постановке опытов использованы разнообразные ассоциации денитрифицирующих микроорганизмов, выделенные на накопительных средах из разнообразных природных источников и охарактеризованные в таблице 1.
Пример 1. Иллюстрируется возможность анаэробного окисления модельного стока, содержащего высокие концентрации органических соединений (5% гидролизата казеина), при разных рН в лабораторной установке для периодического культивирования, схема которой показана на фиг.1.
Эксперименты по периодическому культивированию были поставлены следующим образом. В стеклянный биореактор (1) с рабочим объемом 500 мл, имеющий рубашку для термостатирования (2), помещали 500 мл нестерильной модельной смеси, содержавшей окисляемую органическую субстанцию и имевшей следующий состав: гидролизат казеина - 50 г, карбонат натрия - 5 г, натрий фосфорнокислый двузамещенный - 2 г, карбонат кальция - 2 г, карбонат магния - 2 г, вода водопроводная до 1000 мл. рН исходного раствора контролировали с помощью универсального рН электрода (5). Требуемые значения рН ферментационной жидкости перед началом эксперимента доводили до указанных в таблице 2 значений с помощью 20% раствора азотной кислоты. Исходные среду и аппарат для культивирования продували азотом в течение 5 мин, затем инокулировали в бактериальной ассоциации DDS (таблица 1), содержавшей смешанную культуру денитрифицирующих бактерий. Температурный режим в реакторе (30oС) поддерживали путем циркуляции воды из ультратермостата (4) в рубашку ферментера (2) и обратно. Перемешивание осуществляли с помощью магнитной мешалки (3), поддерживающей скорость 150-200 об/мин. рН ферментационной среды в ходе опытов контролировали при помощи цифрового рН-метра (6), совмещенного с пороговым регулятором. Исполнительным устройством порогового регулятора являлся электромагнитный клапан (7), который, в случае защелачивании среды в биореакторе (1) выше порогового значения, указанного в таблице 2 и соответствовавшего условиям опыта, открывался, освобождая проток для поступления 10% раствора азотной кислоты из емкости (8). Кислота небольшими порциями поступала в рабочий объем биореактора (1) и перемешивалась с ферментационной средой при помощи магнитной мешалки. После закисления культуральной жидкости до необходимого уровня, оговоренного в таблице 2, клапан (7) закрывался. Динамику микробного окисления органического материала, происходившего под действием азотной кислоты, фиксировали по объему выделившегося газа (азота), который собирали в сосуде (10), заполненном 2% раствором гидроокиси калия. Режимы процесса показаны в таблице 2.
Пример 2. Показана возможность анаэробного окисления модельного раствора органического материала высокой концентрации (10%-ный гидролизат казеина) на установке непрерывного действия, схема которой отображена на фиг.2.
В стеклянный биореактор (1) с рабочим объемом 500 мл, снабженный термостатируемой рубашкой (2), помещали 500 мл нестерильной модельной смеси А, имевшей следующий состав: гидролизат казеина - 50 г, карбонат натрия - 5 г, карбонат кальция - 10 г, вода водопроводная до 1000 мл.
рН исходного раствора доводили до величины 8,5 с помощью 20% раствора азотной кислоты, далее продували жидкость и биореактор азотом в течение 5 мин и инокулировали бактериальной ассоциацией денитрификаторов DDS (табл.1).
Температурный режим в реакторе (35oС) поддерживали путем циркуляции воды требуемой температуры из ультратермостата (4) в рубашку ферментера (2) и обратно. Перемешивание осуществляли посредством магнитной мешалки (3), поддерживая скорость 150-200 об/мин. рН ферментационной среды в ходе опыта контролировали при помощи стеклянного универсального электрода (5), присоединенного к цифровому рН-метру (6), совмещенному с пороговым регулятором. Исполнительным устройством порогового регулятора, служащего для поддержания рН на заданном уровне, являлся электромагнитный клапан (7), который в случае защелачивании среды в биореакторе выше установленного значения рН=8,5 открывался, освобождая проток для поступления титрующего агента в виде 20% азотной кислоты из емкости (8).
Выход на проточный режим работы аппарата осуществляли через 10 ч после инокуляции, путем подачи среды состава Б из емкости (14) в биореактор (1). Подачу раствора через силиконовый капилляр (9) осуществляли за счет работы перистальтического насоса (13). Вывод избытка ферментационной жидкости из биореактора происходил через капилляр (16) под действием образующегося азота, накапливавшегося в герметически закрытом аппарате (1), и приводил к появлению в нем новых порций питательной среды. Образующийся в ходе окисления органической субстанции азот собирали через отвод (12) в сепараторе газа (11) и направляли в емкость для измерения объема (на схеме не показано). Отработанную (очищенную) культуральную жидкость собирали в емкости (15).
Модельная смесь Б включала: 100 г гидролизата казеина и 5 г карбоната натрия, растворенных в 1000 мл водопроводной воды. После выхода на непрерывный режим, изменение скорости разбавления в процессе длительного опыта (120 ч) осуществляли с периодичностью 1 раз в 24 ч в направлении возрастания. Параметры лабораторного процесса, зафиксированные при разных скоростях разбавления, представлены в табл. 3.
Пример 3. Данный пример иллюстрирует возможность применения метода для анаэробного окисления труднодоступного органического субстрата эпихлоргидрина. Опыт проводили в периодическом режиме рН 8,5 на установке, схема которой показана на фиг.1. Модельная смесь с эпихлоргидрином включала в своем составе: эпихлоргидрин - 2 г, карбонат натрия - 1,5 г, калий фосфорнокислый двузамещенный - 2 г, карбонат магния - 0,5 г, карбонат кальция - 0,5 г, воду до 1000 мл. рН смеси доводили до требуемого значения 10% азотной кислотой, жидкость и аппарат продували азотом и инокулировали соответствующей микробной ассоциацией денитрификаторов (табл. 1). Зафиксированные параметры лабораторного процесса показаны в табл. 4.
Пример 4. Данный пример иллюстрирует возможность анаэробного окисления углеводородного материала (нефти). Опыт был поставлен в установке для периодической ферментации (фиг.1) при фиксированном рН 8,5 на среде, имевшей следующий состав: нефть - 20 г, эмульгатор (Твин 80) - 0,3 г, карбонат натрия - 1,5 г, калий фосфорнокислый двузамещенный - 2 г, карбонат магния - 0,5 г, карбонат кальция - 0,5 г, вода до 1000 мл. Перед ферментацией нефть эмульгировали в воде путем 10-минутной ультразвуковой обработки. рН смеси доводили до требуемого значения 10% азотной кислотой, жидкость и аппарат продували азотом и инокулировали подходящей микробной ассоциацией денитрификаторов (табл. 1). Динамика лабораторного процесса проиллюстрирована данными табл. 4.
Пример 5. Показана возможность анаэробного окисления отходов производства синтетических жирных кислот (СЖК), представляющих собой смесь уксусной, пропионовой, масляной и других низкомолекулярных кислот. Опыт был поставлен в установке для периодической ферментации (фиг.1) при фиксированном рН 8,5 на среде, имевшей следующий состав, г: жидкие отходы СЖК, нейтрализованные карбонатом кальция - 30 г, карбонат натрия - 1,5 г, калий фосфорнокислый двузамещенный - 2 г, карбонат магния - 0,5 г, вода до 1000 мл. рН смеси доводили до требуемого значения 10% азотной кислотой, жидкость и аппарат продували азотом и инокулировали соответствующей микробной ассоциацией денитрификаторов (табл. 1). Динамика лабораторного процесса проиллюстрирована данными табл. 4.
Источники информации
1. Быков В.А., Крылов И.А., Манаков М.Н. Микробиологическое производство биологически активных веществ и препаратов. Москва, Высшая школа, 1987, 143 с.
2. Ротмистров М. Н., Гвоздяк П.И., Ставская С.С. Микробиология очистки воды. Киев, Наукова думка, 1978, 268 с.
3. Чурбанова И.Н. Микробиология, Москва, Высшая школа, 1987, 239 с.
4. Мосичев М. С., Складнев А.А., Котов В.Б. Общая технология микробиологических производств, М., "Легкая и пищевая промышленность", 1982, 230 с.
5. Илялетдинов А.Н., Алиева P.M. Микробиология и биотехнология очистки промышленных сточных вод. Алма-Ата, Гылым, 1990, 224 с.
6. Heider J., Spormann A. M.; Beller H.R., Widdel F. Anaerobic bacterial metabolism of hydrocarbons // FEMS Microbiology Reviews, 1999, v.22, p. 459-473.
7. Knowles R. Denitrification // Microbiological Reviews, V.46, (1982), 43-70.
8. Zumft W. G. Cell Biology and molecular basis ofdenitrification // Microbiology and Molecular biology reviews. - 1997 - V.61, p.533-616.
9. Готтшалк Г. Метаболизм бактерий. Под ред. Кондратьевой Е.Н., Москва, "Мир", 1982, 310 с.
10. SU 785224 А (Гродненское производственное объединение "АЗОТ" им. С. О. Притыцкого), 07.12.1980.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ биохимической очистки сточных вод | 1990 |
|
SU1717556A1 |
| СПОСОБ ОЧИСТКИ СТОЧНЫХ ВОД ОТ АММОНИЙНОГО АЗОТА | 1996 |
|
RU2136612C1 |
| СПОСОБ БИОЛОГИЧЕСКОЙ ОЧИСТКИ ВЫСОКОКОНЦЕНТРИРОВАННЫХ СТОЧНЫХ ВОД ОТ МЕТАНОЛА | 2020 |
|
RU2768939C1 |
| Бактериальный препарат для нитрификации и денитрификации воды | 2022 |
|
RU2826455C2 |
| СПОСОБ ОЧИСТКИ СТОЧНЫХ ВОД ОТ АММОНИЯ И ОРГАНИЧЕСКОГО ВЕЩЕСТВА | 2015 |
|
RU2605325C1 |
| УСТРОЙСТВО ДЛЯ БИОХИМИЧЕСКОЙ ОЧИСТКИ СТОЧНЫХ ВОД И УДАЛЕНИЯ СОЕДИНЕНИЙ АЗОТА | 1992 |
|
RU2051134C1 |
| СПОСОБ БИОЛОГИЧЕСКОЙ ОЧИСТКИ СТОЧНЫХ ВОД ОТ АЗОТНО-ФОСФОРНЫХ И ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | 2017 |
|
RU2644904C1 |
| Блок биологической очистки сточных вод (варианты) и вторичный отстойник, использующийся в этом блоке (варианты) | 2022 |
|
RU2790712C1 |
| Способ биологической очистки высококонцентрированных сточных вод от фенолов, роданидов и соединения азота | 1991 |
|
SU1799366A3 |
| Способ биохимической очистки сточных вод от нитратов | 1978 |
|
SU789426A1 |





Изобретение относится к области микробиологии, в частности к микробиологическим процессам очистки воды, например, к очистке бытовых стоков или отработанных вод предприятий, к системам локальной очистки сточных вод химических и нефтехимических производств, к локальным системам очистки технологических стоков транспортных средств, например на флоте и т.д. Способ основан на использовании ассоциаций денитрифицирующих бактерий. В качестве акцептора электронов используют азотную кислоту, подаваемую в биохимический реактор в чистом виде или в водном растворе синхронно с окислением субстрата. Процесс осуществляют в режиме рН-стата, при этом величина водородного показателя культуральной жидкости поддерживается на фиксированном уровне, находящемся в интервале 8,0-10,0. Кислота в биореактор подается по мере защелачивания среды. Технический эффект - снижение энергоемкости и чувствительности к химической природе загрязнителей, повышение скорости окисления загрязнений. 2 ил., 4 табл.
Способ микробиологической очистки воды от органических примесей, осуществляемый с помощью денитрифицирующих бактерий, отличающийся тем, что в качестве акцептора электронов используют азотную кислоту, которую, по мере окисления загрязнителя, добавляют в анаэробный биореактор, работающий в режиме рН-стата с поддержанием фиксированных значений водородного показателя культуральной жидкости в пределах рН 8,0-10,0.
| Способ очистки сточных вод | 1979 |
|
SU785224A1 |
| Способ биологической очистки сточных вод от трудноокисляемых органических соединений | 1978 |
|
SU681002A1 |
| US 4505819 А, 19.03.1985 | |||
| РОУЗ Э | |||
| Химическая микробиология | |||
| - М.: Мир, 1971, с.144. | |||
Авторы
Даты
2004-01-27—Публикация
2002-04-16—Подача