Настоящее изобретение относится к вкусовым веществам.
Известно использование гидролизованных дрожжевых экстрактов в качестве вкусовых веществ. Дрожжи являются нетоксичными для человека и обычно культивируются с высокой плотностью (с высоким весом клеток по сухому веществу на литр).
Содержание нуклеиновых кислот в мицелиевых грибах может быть уменьшено путем их контакта с водой при высоких температурах и отделения их от воды, и этот способ описан для Fusarium в заявке РСТ WO 95/23843. Мы обнаружили, что вода, из которой выделены эти грибы, содержит вещества, которые можно использовать в качестве пищевых вкусовых веществ или превратить в них, особенно, если грибок является Fusarium, например Fusarium IMI 145, 425.
Настоящее изобретение включает способ, с помощью которого растворимые компоненты, потерянные грибковыми клетками в результате тепловой обработки, могут быть выделены и использованы в качестве пищевых веществ или превращены в них.
Настоящее изобретение включает способ обработки мицелиевого гриба для улучшения их пищевой пригодности, предусматривающий его нагревание в присутствии воды до температуры, достаточной для значительного снижения его содержания нуклеиновых кислот, характеризующийся в основном тем, что вещества, удаленные из гриба в этом способе непосредственно, или после химической реакции, используют в качестве пищевого вкусового вещества.
Настоящее изобретение также включает вкусовое вещество, представляющее собой водный раствор, содержащий нуклеиновые кислоты, удаленные из мицелиевого гриба при его контакте с водой при повышенной температуре, причем концентрация растворенных сухих веществ в нем является достаточно высокой, чтобы сделать вкусовое вещество стабильным при хранении при температуре 20oС в течение одного месяца, или представляющее собой твердый материал, содержащий такие нуклеиновые кислоты, или представляющее собой материал, содержащий продукт взаимодействия таких нуклеиновых кислот с серосодержащей аминокислотой, сероводородом или сульфидом аммония.
Вкусовые вещества в форме водного раствора предпочтительно содержат по меньшей мере 30 вес.% и более предпочтительно от 45 до 60 вес.% сухих веществ.
Наряду со вкусом, являющимся важным фактором для вкусовых веществ, также важны и их запахи.
Растворимые компоненты предпочтительно концентрируют из водного раствора, полученного на стадии уменьшения содержания нуклеиновых кислот посредством удаления воды, например, выпариванием, отгонкой (предпочтительно при пониженном давлении), обратным осмосом, лиофилизацией или вымораживанием воды в виде льда, удаляемого из водного концентрата. Можно также удалять воду выпариванием при пониженном давлении, например, при температуре от 40 до 70oС.
Растворенные сухие вещества могут быть отделены как таковые или оставлены в виде концентрированного раствора, у которого влагоактивность (Aw) существенно снижена для обеспечения биостазиса в интервале температур хранения.
Если содержание нуклеиновых кислот в мицелиевых грибах снижено путем повышения температуры ростовой среды, то извлеченная вода, в дополнение к нуклеиновым кислотам и другим веществам грибов, будет содержать соли и другие питательные вещества, например, глюкозу и/или сложные азотсодержащие питательные вещества. Если требуется вкус, придаваемый такими веществами, то они могут быть оставлены в композициях, если нет, то они могут быть либо удалены, например, осмосом или ультрафильтрацией, либо грибок может быть промыт до снижения содержания в нем нуклеиновых кислот, что тем самым исключает присутствие этих веществ. В WO 95/23843 описано извлечение нуклеиновых кислот из мицелиевого гриба, находящегося в состоянии роста; такой способ является усовершенствованием обработки гриба в состоянии покоя, например в чистой воде. Мы обнаружили однако, что данному организму требуется короткое время для перехода от состояния роста к состоянию покоя, и что, обеспечивая удаление нуклеиновых кислот сразу после выделения из ростовой среды, можно удовлетворительно выделить нуклеиновые кислоты способом по WO 95/23843.
Мы обнаружили, что после частичного или полного удаления воды, как описано выше, полученный концентрат может использоваться в качестве пищевой добавки в качестве альтернативы гидролизованным растительным белкам, дрожжевым автолизатам или дрожжевым экстрактам. Вещества, удаляемые из грибка, представляют ценность для производства вкусовых препаратов и ароматизаторов. Вкусовые свойства этого вещества позволяют использовать его непосредственно в приправе для закусок, печенья, бульонов, супов, тушеного мяса и соусов в количестве предпочтительно от 0,1 до 15, например, от 1 до 10 вес.% по сухому веществу.
Мы также обнаружили, что при нагревании этого вещества оно дает привлекательный аромат жареного мяса. Если требуется, то можно модифицировать жареный вкус путем частичного гидролиза этого вещества перед нагреванием, например гидролизом уксусной кислотой.
Для получения приятного вкуса, это вещество можно подвергать реакции, возможно, после по меньшей мере частичного гидролиза, с серосодержащими аминокислотами, предпочтительно цистеином или, возможно, с H2S и/или с (NH4)2S.
Вкус этого вещества может быть изменен химической реакцией для обеспечения другого вкусового профиля с усиленным вкусом жареного мяса. Такие "реакционные вкусовые вещества" могут быть использованы для приправы к мясу (говядине, цыпленку, баранине, свинине и т.д.), к продуктам, альтернативных мясу (например, на основе белков сои, пшеницы, гороха, микопротеина), к готовым блюдам, закускам и напиткам при внесении его в количестве от 0,1 до 10, например от 1 до 8 вес.%, по сухому веществу.
Эти вкусовые вещества могут быть получены путем реакции веществ, удаленных из грибов, как указано выше, с цистеином. Если требуется, эту реакцию можно проводить в присутствии воды; например, 1,5-75, предпочтительно 5-50 вес. %-ный раствор таких композиций может реагировать с цистеином, взятым в количестве до 10%, например, 1-5 вес.% (от веса этих веществ). Эту реакцию можно проводить при температуре, например, 110-140oС при рН от 5,5-9. Реакцию обычно продолжают в течение 0,5-7,5 часов.
Полагают, что гидролиз повышает содержание в концентрате свободной рибозы, и это может быть удовлетворительным, когда требуются определенные вкусы. Желательно избегать обработки соляной кислотой с учетом требований к пищевым продуктам (из-за возможного образования производных хлорпропанола), но гидролиз, например, уксусной кислотой, может быть желателен.
В нижеприведенном описании термин "Центрат" использован для обозначения внеклеточной жидкости, извлекаемой посредством теплового шока Fusarium при примерно 70oС в присутствии его ростовой среды после отделения клеточного материала. Термин FDC обозначает "лиофилизированный центрат".
Экспериментальная часть
Исходный материал
Жидкий центрат был лиофилизирован для того, чтобы:
- понизить содержание воды и таким образом задержать микробный рост;
- провести исследования при высокой концентрации центрата;
- облегчить обращение с продуктом.
Все дальнейшие анализы, описанные в экспериментальной части касаются центрата после сушки замораживанием, т. е. лиофилизированного центрата, сокращенно - FDC.
Методы анализа композиции
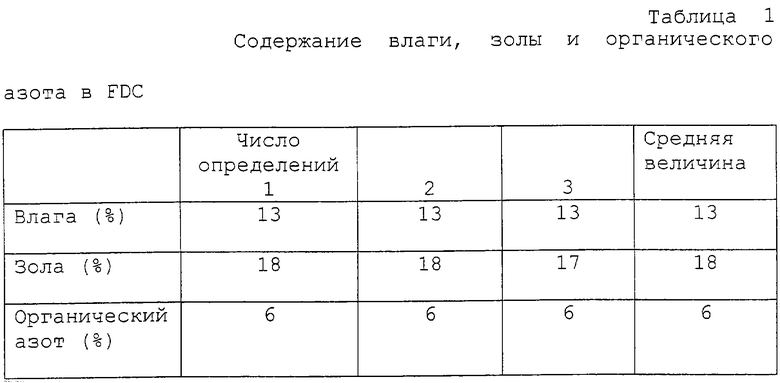
Влажность
Содержание влаги определяли измерением снижения веса FDC до достижения постоянного веса, помещая образец в печь при 100oС.
Зола
Содержание золы определяли нагреванием FDC в печи при 600oС до постоянной массы.
Органический азот
Проводили определение азота по Къельдалю; в качестве эталона отсутствия азота использовали сахарозу, в качестве стандарта использовали глицин. Полученные результаты приведены в таблице 1.
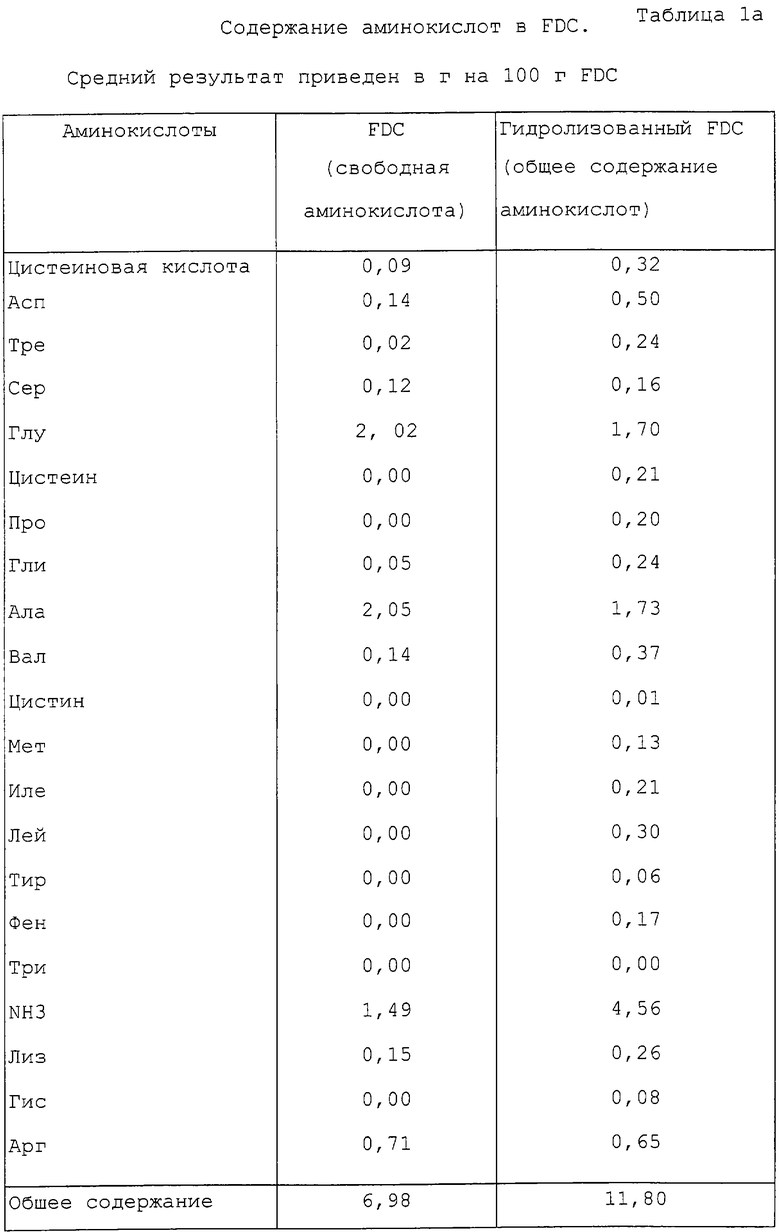
Аминокислоты
Определение аминокислот проводили на автоматическом анализаторе 6300 Бекман. Анализ присутствия в FDC свободных аминокислот проводили с использованием 0,06% раствора FDC. Можно было рассчитать общее содержание аминокислоты после предварительного гидролиза FDC (HCl 6 N, 24 час, в термостате при 110oС), однако известно, что кислота гидролизует триптофан и серосодержащие аминокислоты. Можно избежать гидролиза серосодержащих аминокислот предварительным окислением цистеина в цистеиновую кислоту, а метионина в сульфон метионина. Это осуществляют обработкой FDC раствором из муравьиной кислоты, пероксида водорода и метанола в соотношении 48,5/1/0,5 в течение 4 часов при 0oС в темноте. Результаты приведены в таблице 1а.
Общее содержание углеводов
Содержание углеводов в FDC оценивали количественным аналитическим методом с использованием фенола и серной кислоты (в книге "Carbohydrate analysis: a practical approach", ed. Chaplin, Kennedy, IRL Press). Растворы FDC и глюкозы (стандарт для калибровки) смешивались с раствором фенола в воде (5% вес/об. ). Быстро добавляли концентрированную серную кислоту (1 мл) непосредственно на поверхность раствора, не касаясь стенок пробирки. Растворы оставляли спокойно стоять в течение 10 мин перед энергичным встряхиванием. Еще через 30 мин измеряли оптическую плотность при 490 нм.
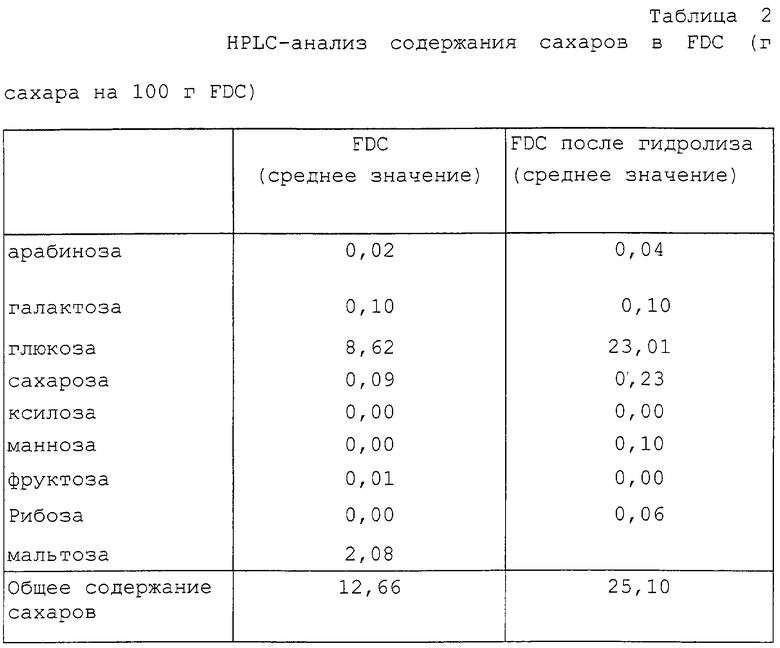
Сахара
Анализ сахаров проводили с использованием жидкостной хроматографии (HPLC) высокого разрешения, Dionex System, при этом в качестве элюента использовали чистую воду (1 мл/мин) в анионнообменной колонке Dionex PA-1, а также импульсный амперометрический детектор. Для количественного определения и определения времени удерживания в качестве стандартов использовали чистые соединения. Чистые сахара анализировали с использованием 0,15% раствора FDC после фильтрации раствора через 0,45 мкм мембрану Minisart 25. Общее содержание сахаров определяли после предварительного кислотного гидролиза FDC (15%-ный раствор в 1 н. НСl, выдерживание в термостате при 110oС в течение 2 час) и фильтрования, сначала через Аg фильтр (осажденный АgСl) и затем через 0,45 мкм фильтр Minisart 25. Полученные результаты приведены в таблице 2.
Производные нуклеиновых кислот
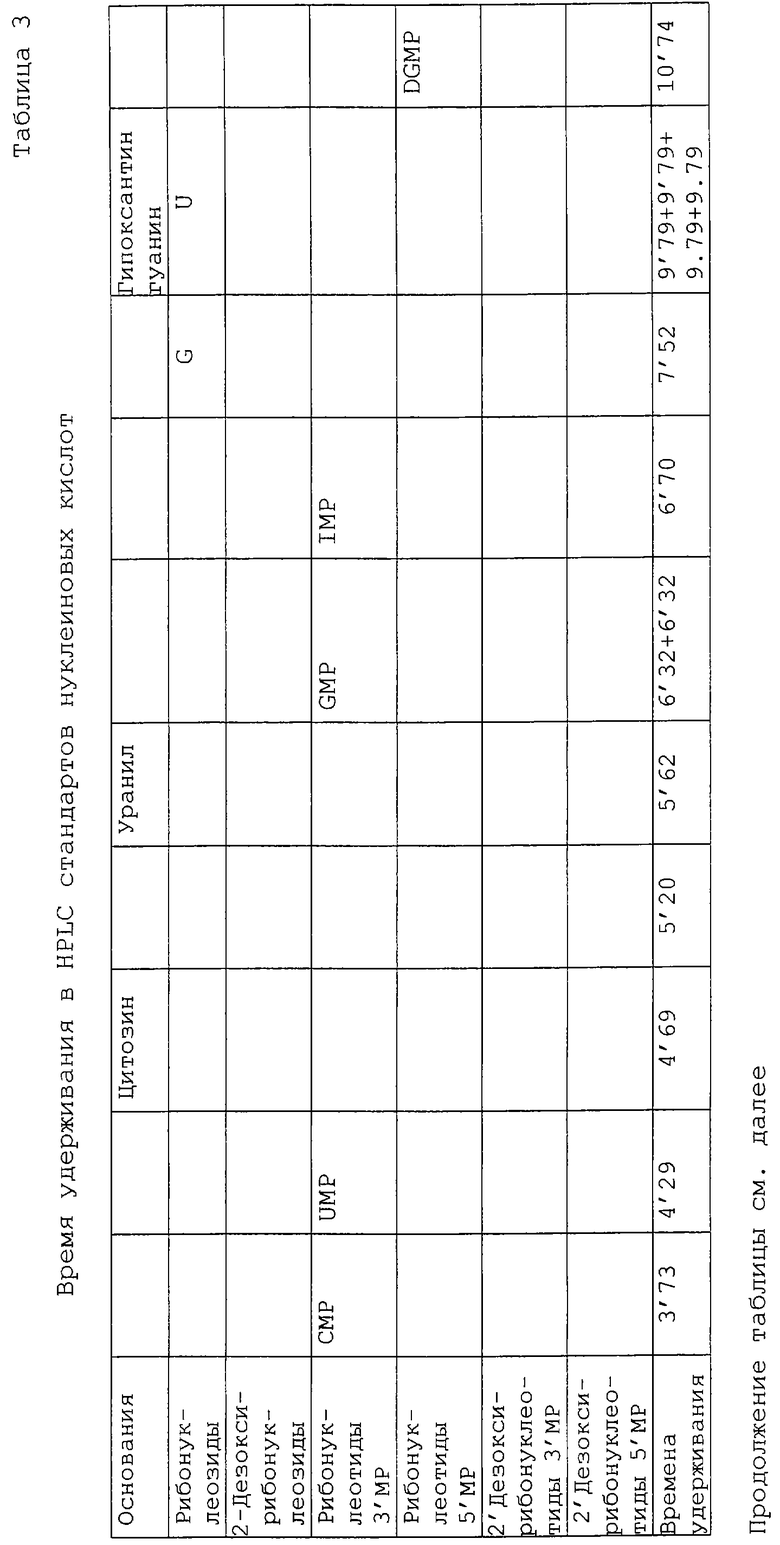
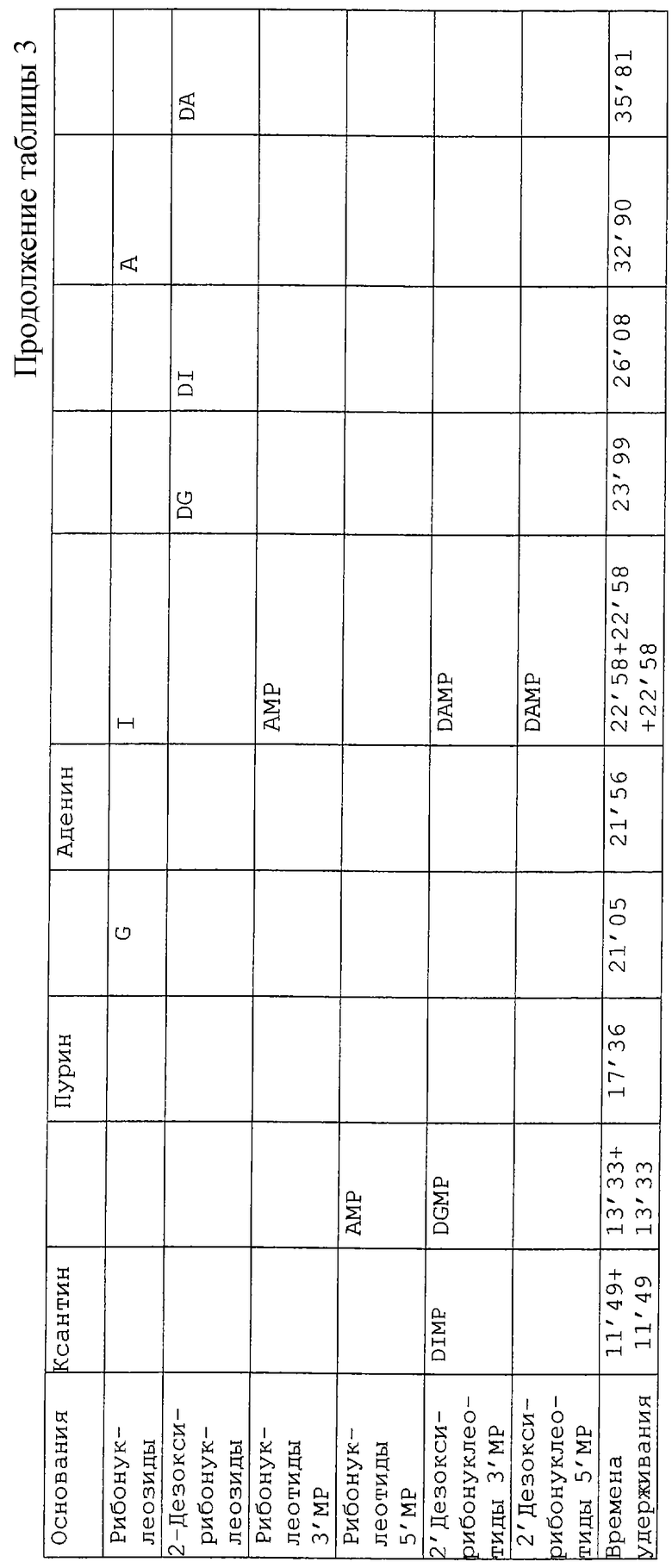
Использовали HPLC-хроматограф Перкин-Элмер с двойным насосом 250, укомплектованный поточным спектрометром 757 ABI фирмы Analytical Kratos Division. Стандарты и образцы отфильтровывали через 0,45 мкм мембранные фильтры Acrodisk фирмы Gelman Science и вводили, используя инжекторный клапан с 20 мкл инжекторной петлей, в аналитическую колонку с обращенной фазой μBondapack C18 Waters (3,9•300 мм), защищенную колонкой μBondapack C18. Используемая длина волны составляла 254 нм. Использовали градиентную программу с двумя подвижными фазами: подвижный растворитель А представлял собой смесь 60/40 метанол/вода и подвижный раствор В являлся 0,02 М раствором КН2РО4 (рН 5,5), полученным растворением дигидрофосфата в дистиллированной воде; величину рН регулировали 1 М раствором КОН. Все подвижные растворители были отфильтрованы (мембранные фильтры Nylaflo 0,2 мк, Gelman Sciences) и перед использованием обезгажены гелием. Общее время прогона составляло 52 мин, скорость потока 1 мл/мин, в потоке содержалось 100% растворителя в течение 5 мин, с последующим градиентом от 0% до 36% растворителя А в течение 36 мин и 36% растворителя А в течение 5 мин. Затем использовали обратный градиент от 36% до 0% А в течение 5 мин и HPLC-система была готова для следующего введения после 15-ти минутного уравновешивания.
Идентификацию соединений осуществляли путем сравнения с временем удерживания, полученным из стандартов, проанализированных в тех же условиях HPLC. Стандарты анализировали по отдельности для установления их времени удерживания, а затем все вместе, чтобы проверить возможную задержку элюирования, которая может произойти для конкретного образца. Эти стандарты приведены в таблице 3.
Гидролиз FDC
Поскольку свободная рибоза очень активно вступает в реакцию Майяра, было исследовано влияние мягких условий гидролиза на FDC и последующие действия на генерацию вкуса. Кислотный гидролиз проводили с использованием 0,01 М раствора ацетата натрия, доводя величину рН до 4 уксусной кислотой. Стандарты (инозин, аденозин-5'-монофосфат АМР5', гуанозин и гуанозин-5'-монофосфат-GMP5') получали в виде 4000 мкм растворов в виде двух образцов и брали аликвоту каждого раствора; работу проводили в тех же HPLC условиях, как выше, для анализа производных нуклеиновых кислот. Затем растворы подвергали гидролизу в течение 7,5 час в термостате при 100oС (термостат GC Carlo Erba). Реакцию останавливали, помещая пробирки в баню со льдом, сохраняя их до анализа в морозильной камере.
FDC в концентрации 2% вес./об. подвергали гидролизу в аналогичных условиях.
Приготовление вкусовой смеси
Как указывалось ранее, считается, что FDC может потенциально использоваться в качестве вкусового вещества как сам по себе, так и как предшественник в последующей реакции, превращающей его во вкусовое вещество.
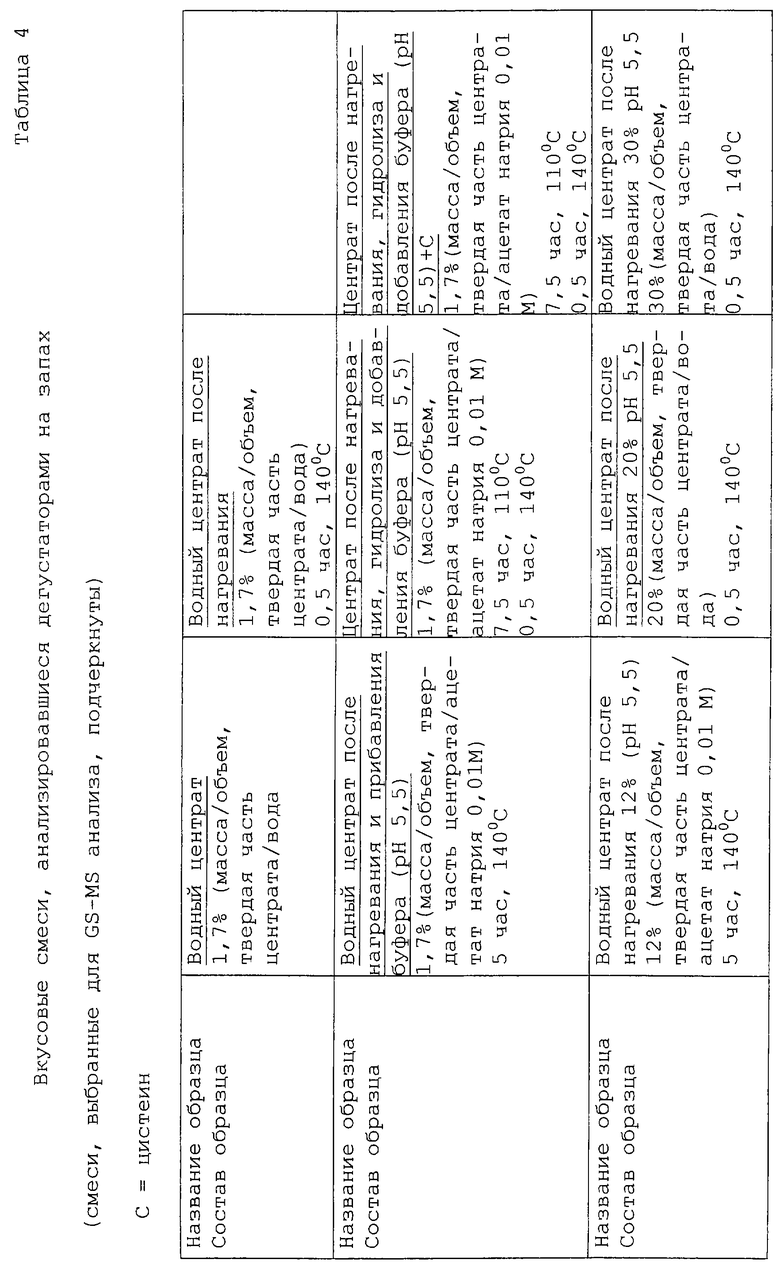
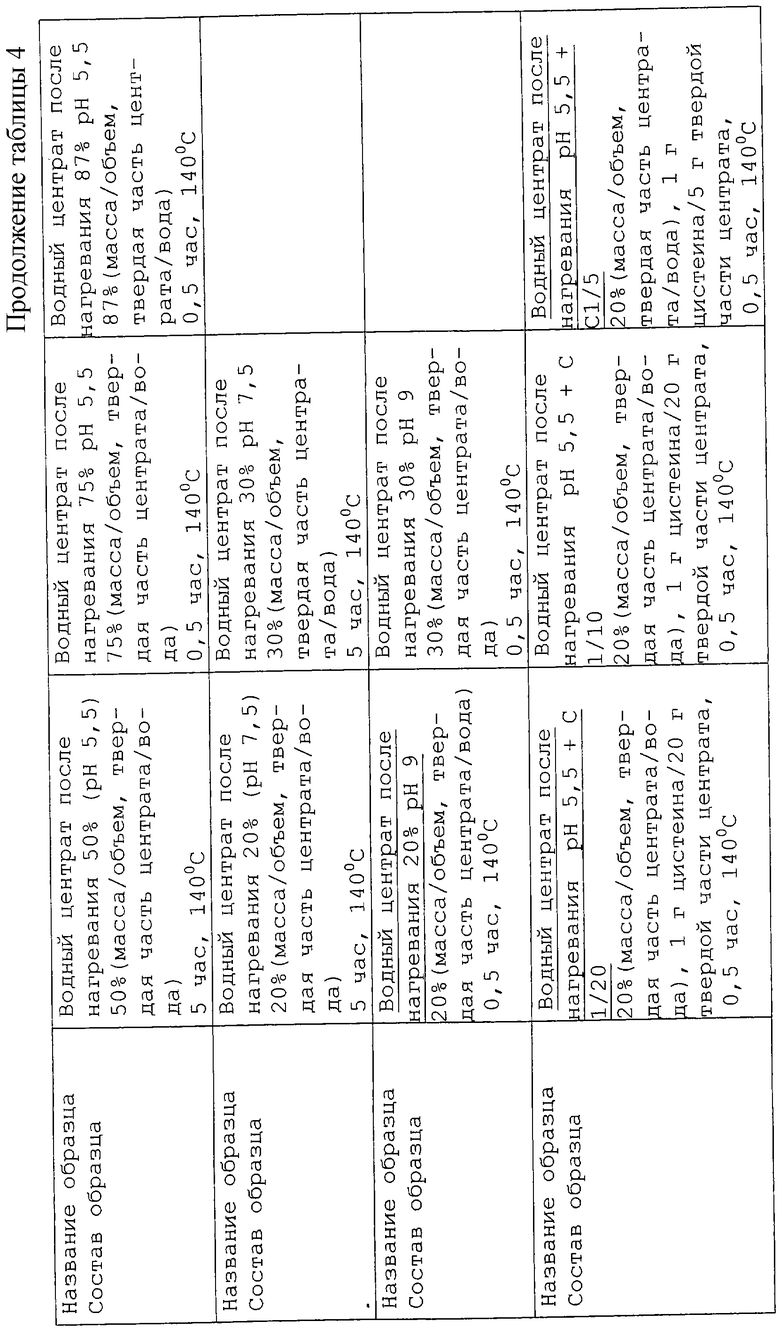
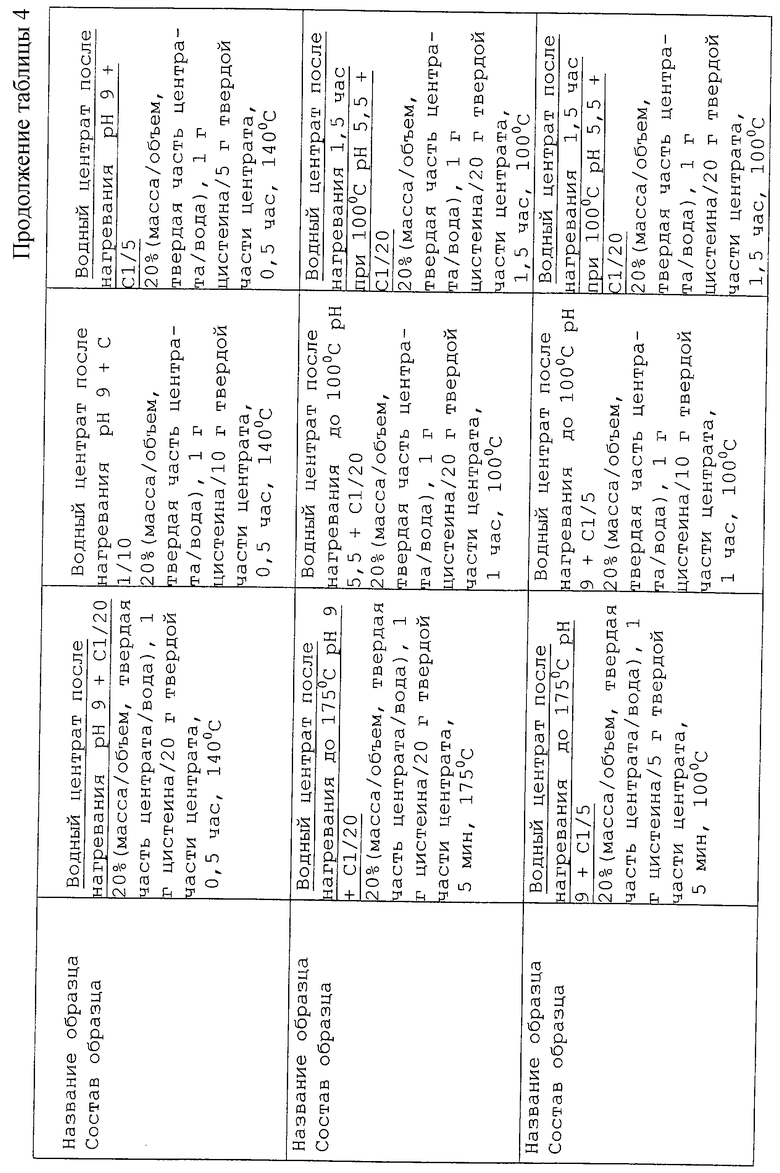
Поэтому был подготовлен ряд реакционных смесей, представленных в таблице 4.
Реакционные смеси (2 мл) приготавливали в стеклянных пробирках смешиванием подходящих количеств исходных растворов и затем переносили в 20 мл пробирки Kimble, которые запаивали на пламени. Запаянные пробирки помещали в металлический кожух и нагревали в термостате газового хроматографа Carlo Erba 4200.
Реакционные смеси хранили до анализа в морозильнике при -20oС. Для проведения анализа пробирки разбивали и нагревали реакционные смеси до комнатной температуры.
Органолептическая оценка ароматических летучих компонентов.
Для оценки собрали дегустационную комиссию из 6 человек (3 женщины и 3 мужчин), имеющих опыт в оценке ароматизаторов.
Для органолептической оценки аликвоты (1 мл) образцов для исследования были перенесены в коричневые склянки с завинчивающимися крышками и разбавлены в 10 раз (за исключением исследования влияния концентрации, когда разбавление не применяли). Закодированные образцы предоставляли каждому дегустатору в одно и тоже время при комнатной температуре, и участников дегустационной комиссии просили описать запахи, пользуясь собственными терминами.
Инструментальная оценка путем определения содержания ароматических летучих компонентов
Использовали процедуру сбора с динамическим свободным пространством. Каждый образец (1,7 мл) реакционной смеси, эквивалентный 0,4 г FDC, помещали в 250 мл коническую колбу с насадкой Дрекселя. Добавляли дистиллированную воду до конечного объема в 10 мл и смесь осторожно встряхивали. Над образцом пропускали бескислородный азот в течение 1 часа со скоростью 40 мл/мин. Летучие компоненты продували на ловушку из нержавеющей стали (100 мм•3 мл, внутренний диаметр), покрытой стеклом, в которую было загружено 85 мг Теnaх GC (система CHIS фирмы SGE Limited). В течение сбора образец выдерживали при 37oС, используя водяную баню. Внутренним стандартом служил 1,2-дихлорбензол в эфире (130 мкл/мл), 1 мкл его вдували на ловушку в конце сбора, и ловушку затем продували азотом в течение 10 мин.
Для анализа ароматических летучих компонентов использовали хромато-масс-спектрометр (Hewlett-Packard (HP) 5890/5972 (GS-MS), снабженный 50 м•0,32 мм (внутренний диаметр) набитой силикагелем капиллярной колонкой, покрытой пленкой толщиной 0,5 мкм ВРХ-5 SGE Limited. Летучие компоненты подвергали термической десорбции при 250oС во впускном патрубке системы CHIS (SGE Limited) и криофокусировали непосредственно на переднюю сторону газохроматографической колонки, при этом температуру печи выдерживали при 0oС в течение 5 мин. Затем ее температуру поднимали до 40oС за период в 1 мин и выдерживали в течение 5 мин перед тем, как поднять температуру до 250oС со скоростью 4oС/мин и выдерживать ее в течение последующих 10 мин. Скорость потока газа-носителя (гелия) составляла 1,5 мл/мин. Масс-спектры записывали в режиме электронного удара при напряжении 70 эВ и температуре источника 200oС. Область сканирования составляла 29-400 m/z, а время сканирования - 0,69 с. Данные контролировались и обрабатывались системой баз данных HP G 1034C Chemstation.
Летучие компоненты определяли путем сравнения их масс-спектров со спектрами стандартных соединений в лаборатории Reading Laboratory или по базе данных NIST/EPA/MSDC Mass Spectral Database или по другим опубликованным спектрам. Линейный индекс удерживания (LRI) рассчитывали для каждого компонента, используя время удерживания гомологичного ряда С6-С22-алканов.
Производные нуклеиновых кислот
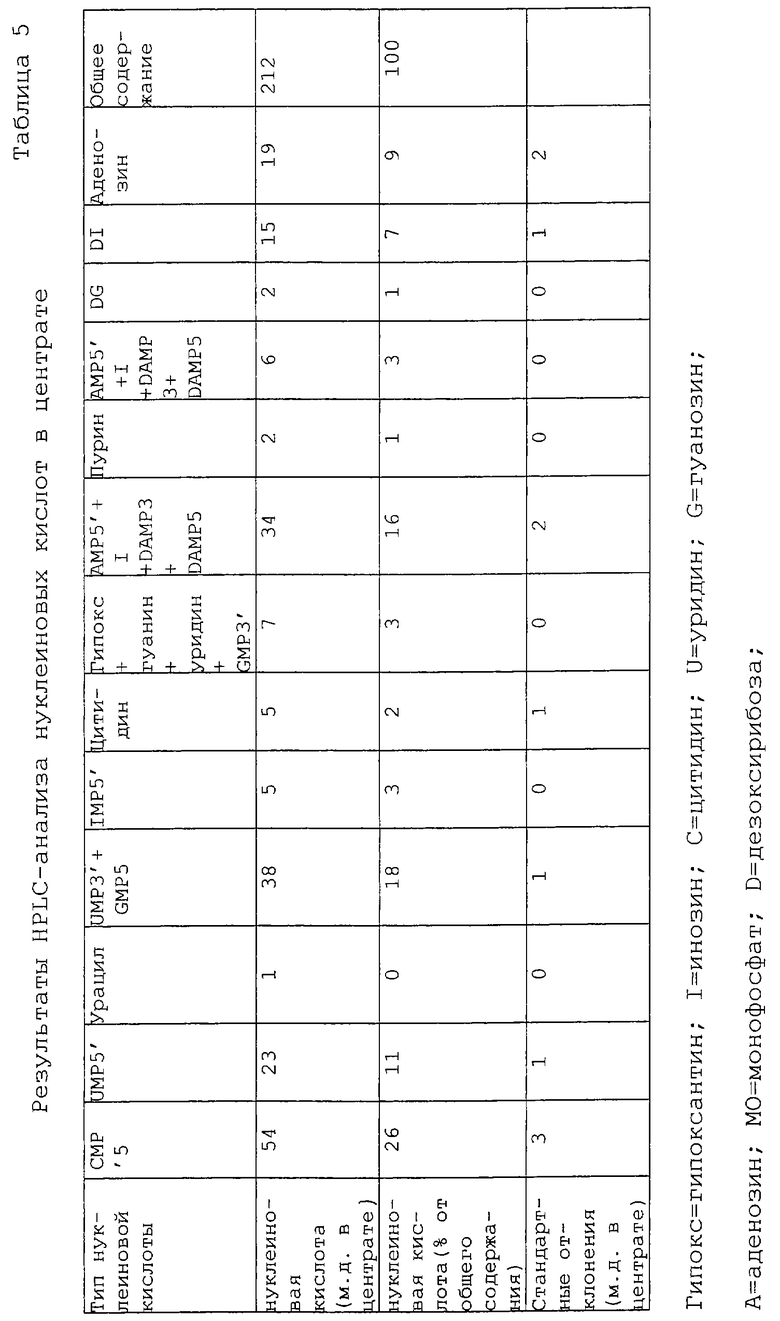
Композицию нуклеиновых кислот центрата определяли из трех репликатов. Этот анализ представлен в таблице 5, которая объясняет большинство элюированных HPLC пиков. Было установлено несколько совместно элюированных соединений, однако не представлялось возможным изучать условия альтернативного анализа, и поэтому для совместно элюированных соединений было невозможно определить, какое из этих соединений сделало свой вклад в пик, полученный при анализе центрата.
Как и ожидалось, несколько соединений, полученных из дезоксирибонуклеиновой кислоты, имеют более высокое естественное содержание по сравнению с соединениями, полученными из рибонуклеиновой кислоты. Компонентами основной нуклеиновой кислоты являются цитозин-5'-монофосфат (26% от общего содержания нуклеиновой кислоты) уридин-3'-монофосфат и/или гуанозин-5'-монофосфат (18%), аценозин-5'-монофосфат (16%). Все эти соединения являются потенциальными источниками рибозы и ее фосфата, которые являются хорошими реакционными предшественниками для реакции Майяра. Исключая основания, потенциальный источник рибозы или фосфата рибозы составляет 96% от содержания нуклеиновых кислот в центрате, что эквивалентно их содержанию в центрате в количестве 202 ppm (частей на миллион).
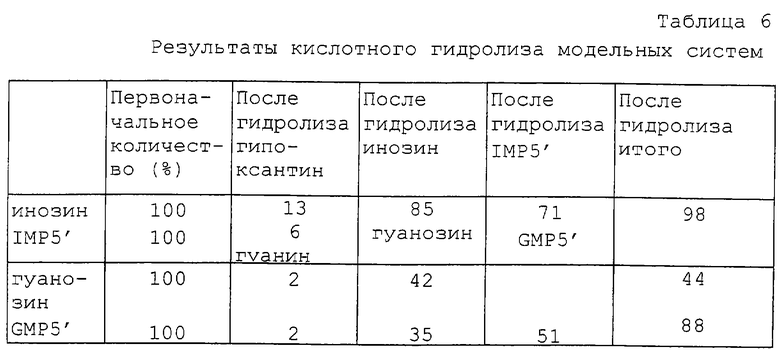
Действие кислотного гидролиза на производные нуклеиновых кислот
В таблице 6 представлены результаты гидролиза растворов инозина, гуанозина и соответствующих им 5'-фосфат-рибонуклеозидов. Способ основан на методике, которая использовалась Matoba с сотр. (J. Food Science, vol. 53, n. 4, 1156). Последняя колонка таблицы дает данные о выходах веществ в этой реакции и видно, что результаты гидролиза гуанозина показали существенные потери, что подтверждает нестабильность молекулы гуанина.
Большинство интересных модельных систем представляют собой нуклеозиды, так как они являются основными компонентами центрата. Они подверглись гидролизу наполовину или менее, образуя соответствующие нуклеозиды, которые далее при гидролизе превращались в свои основания. Несмотря на то, что можно провести гидролиз рибонуклеотидов до их оснований и соответственно получить рибозу и/или фосфат рибозы, были получены относительно небольшие выходы оснований и следовало бы осуществить оптимизацию этого процесса.
Заключение
Охарактеризована композиция нуклеиновых кислот в FDC. Она содержит, главным образом, рибонуклеотиды с относительно небольшими количествами дезоксирибонуклеотидов. Гидролиз нуклеотидов, образующий свободную рибозу и ее фосфат, происходит только в относительно небольшой степени в ацетатном буфере при рН 4.
Результаты органолептической оценки летучих ароматических компонентов
Было решено представить результаты по каждому отдельному дегустатору, а не группировать их по конкретным общим признакам из-за слишком большого разброса описательных оценок.
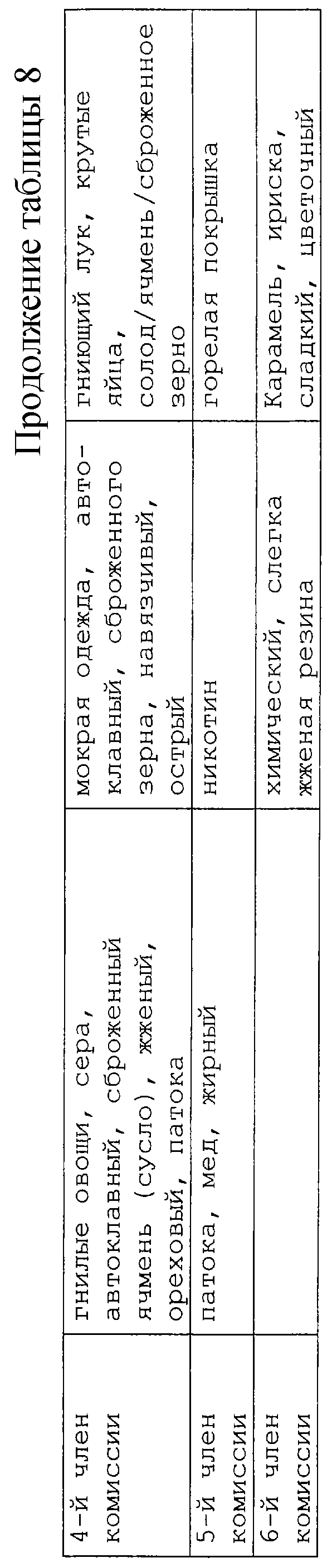
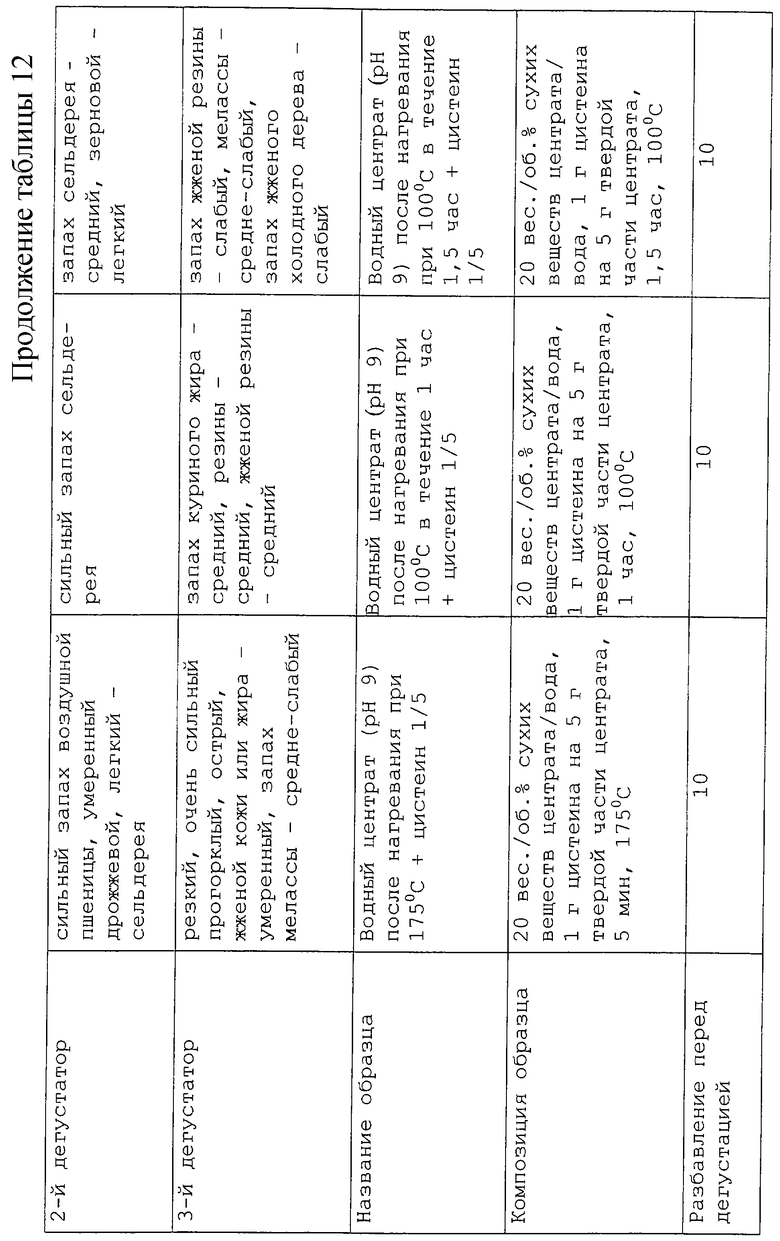
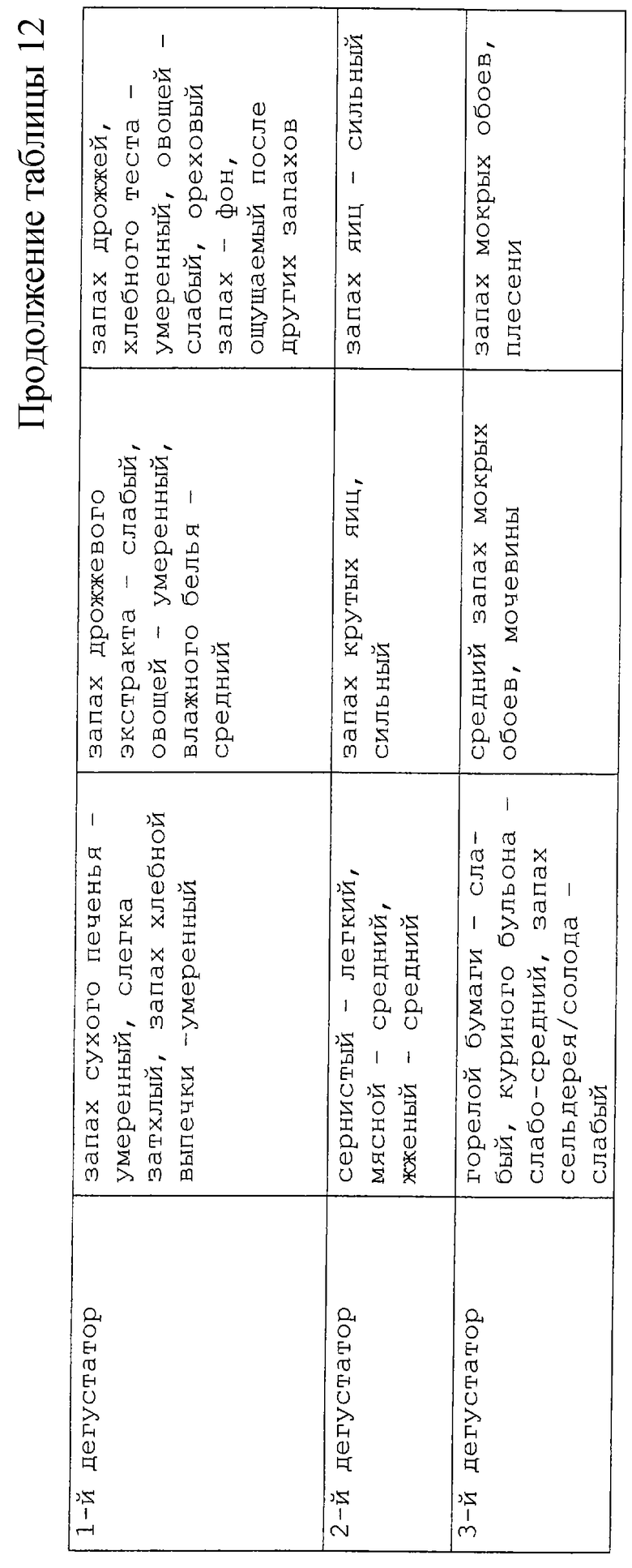
В таблицах 7 и 8 представлено влияние нагревания и воздействия гидролиза с добавлением цистеина и без его добавления.
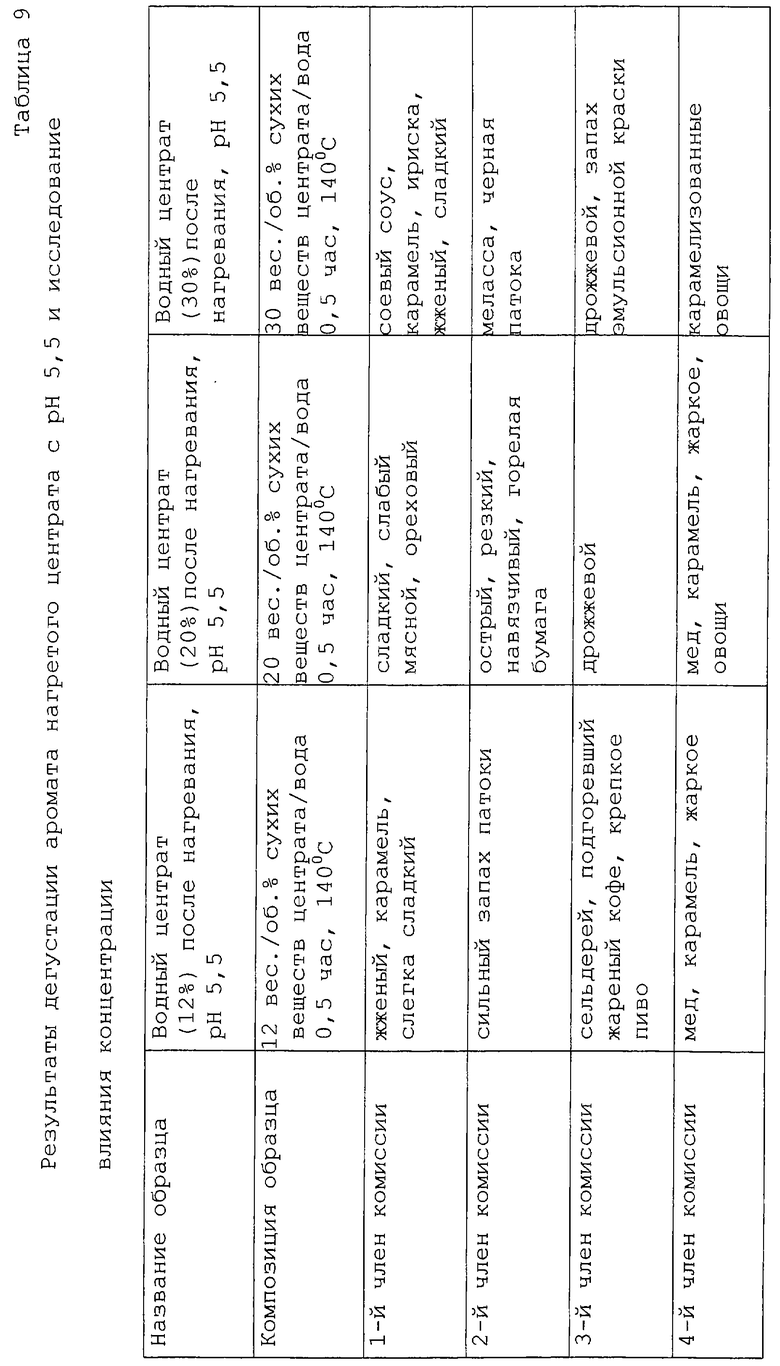
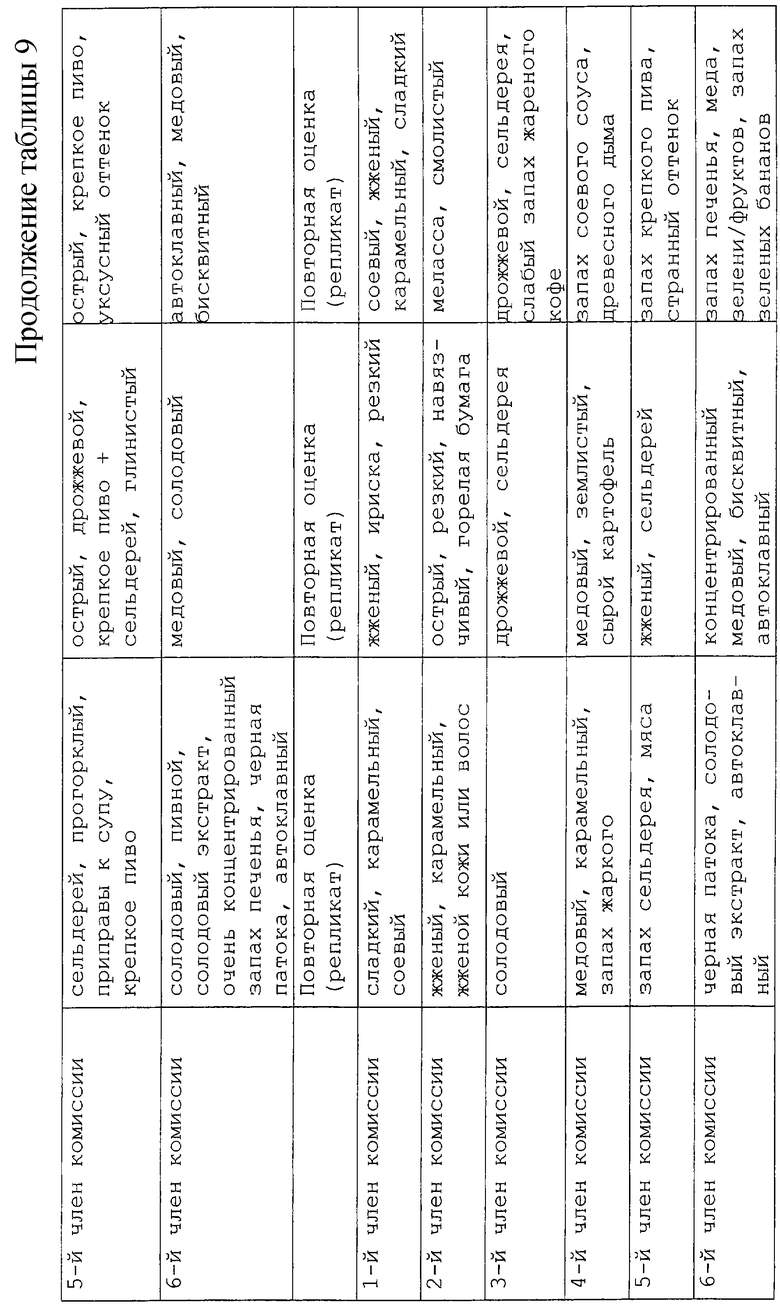
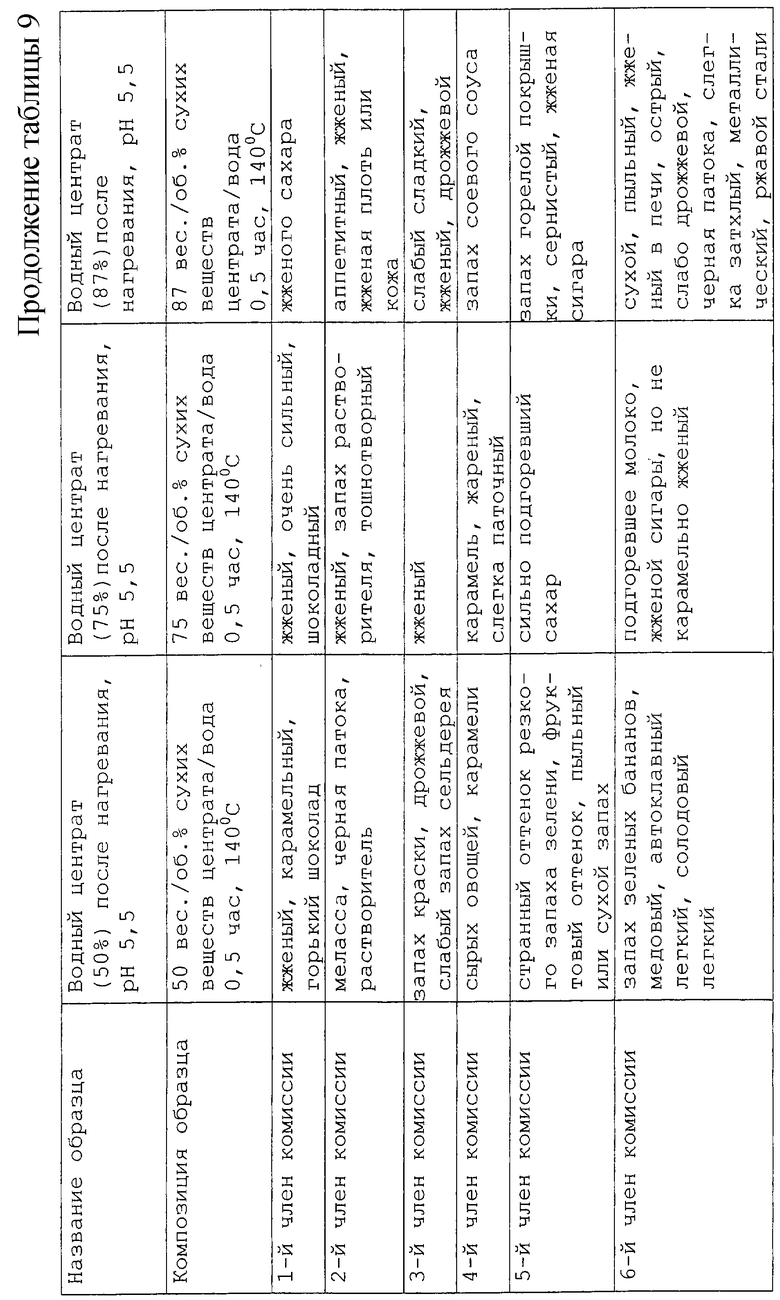
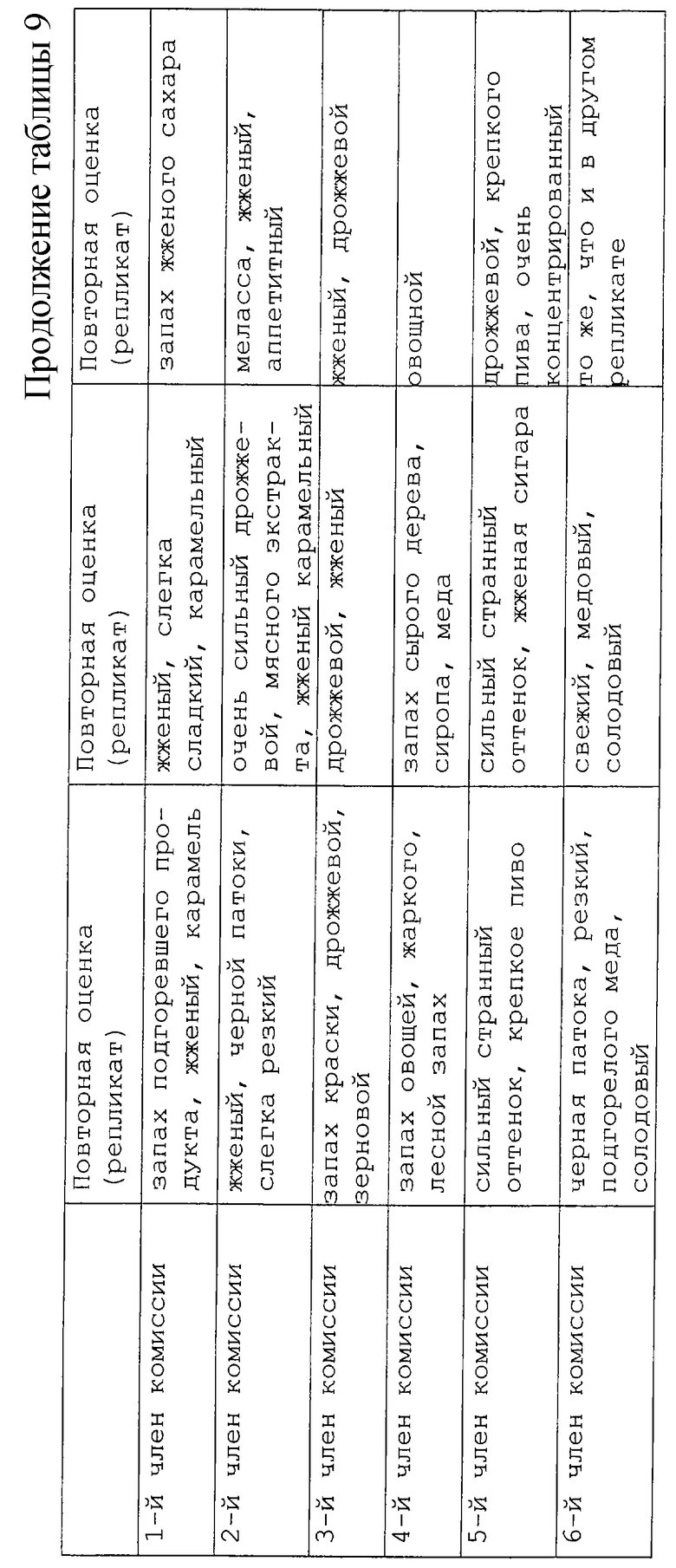
Исследование влияния концентрации центрата проводили в области тех же концентраций, которые используются в коммерческой практике, то есть в интервале от 12%-30% сухих веществ. Эти образцы сравнивали с действием неразбавленного лиофилизированного порошкообразного центрата (87% сухого вещества). Остальные условия получения поддерживали постоянными, например, рН 5,5 и нагревание при 140oС в течение 30 мин. Результаты представлены в таблице 9. Запахи были очень сильными и воспроизводимость результатов, полученная для двух репликатов у каждого дегустатора, была довольно плохой. Однако установлена заветная тенденция для ряда образцов с концентрациями от низкой до высокой: при 12% запахи были в основном сладкими, овощными, запахами мелассы. Эти оттенки стали ассоциироваться с жженым и острым запахами наряду с мясными оттенками при содержании сухих веществ от 20 до 30%. При содержании 50% образец имеет жареный запах и запах краски, которые становятся преобладающими при 75%. Для 87%-ного образца был установлен запах жженой резины с оттенками сернистого запаха. Образцы с содержанием 20 и 30% сухого вещества представляются более интересными из-за их мясного аромата и поэтому они были отобраны для дальнейшего анализа. Также было решено разбавить исходные реакционные смеси вкусовых веществ перед дегустацией следующих реакционных смесей.
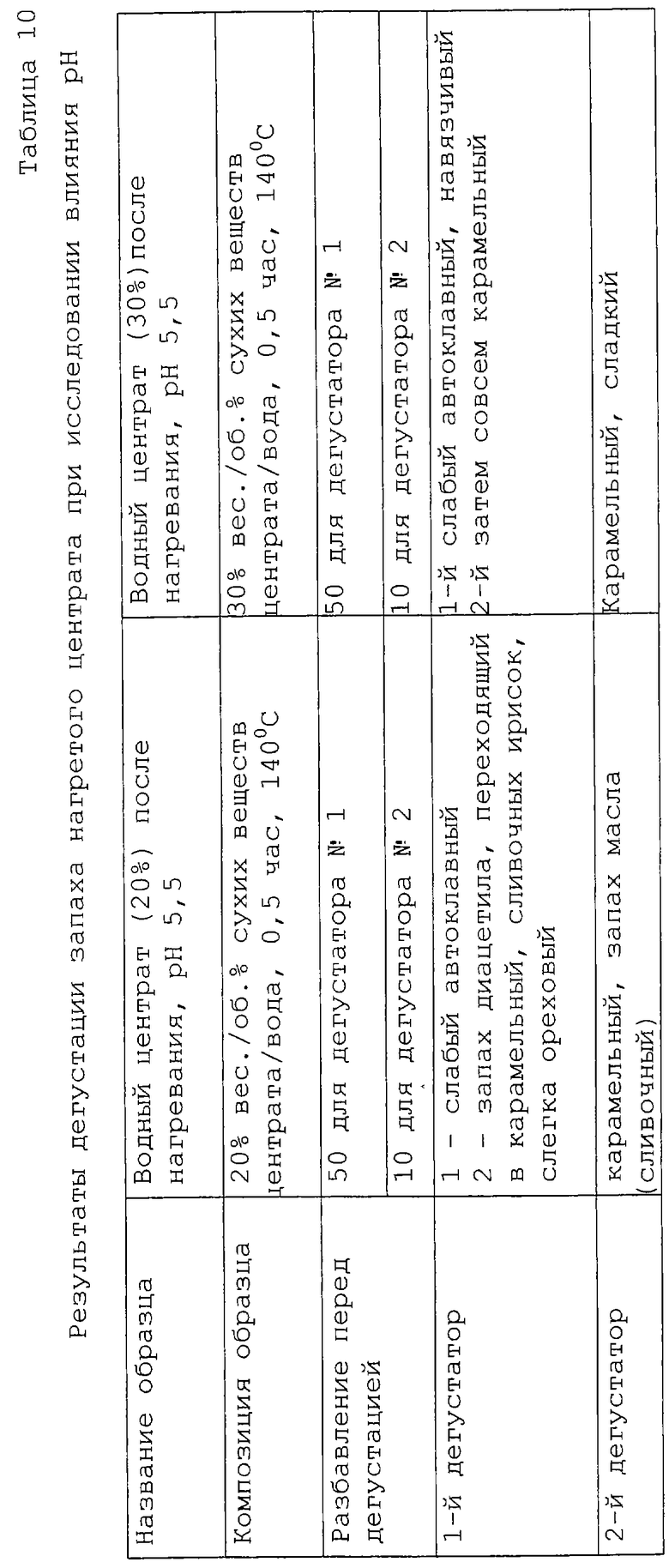
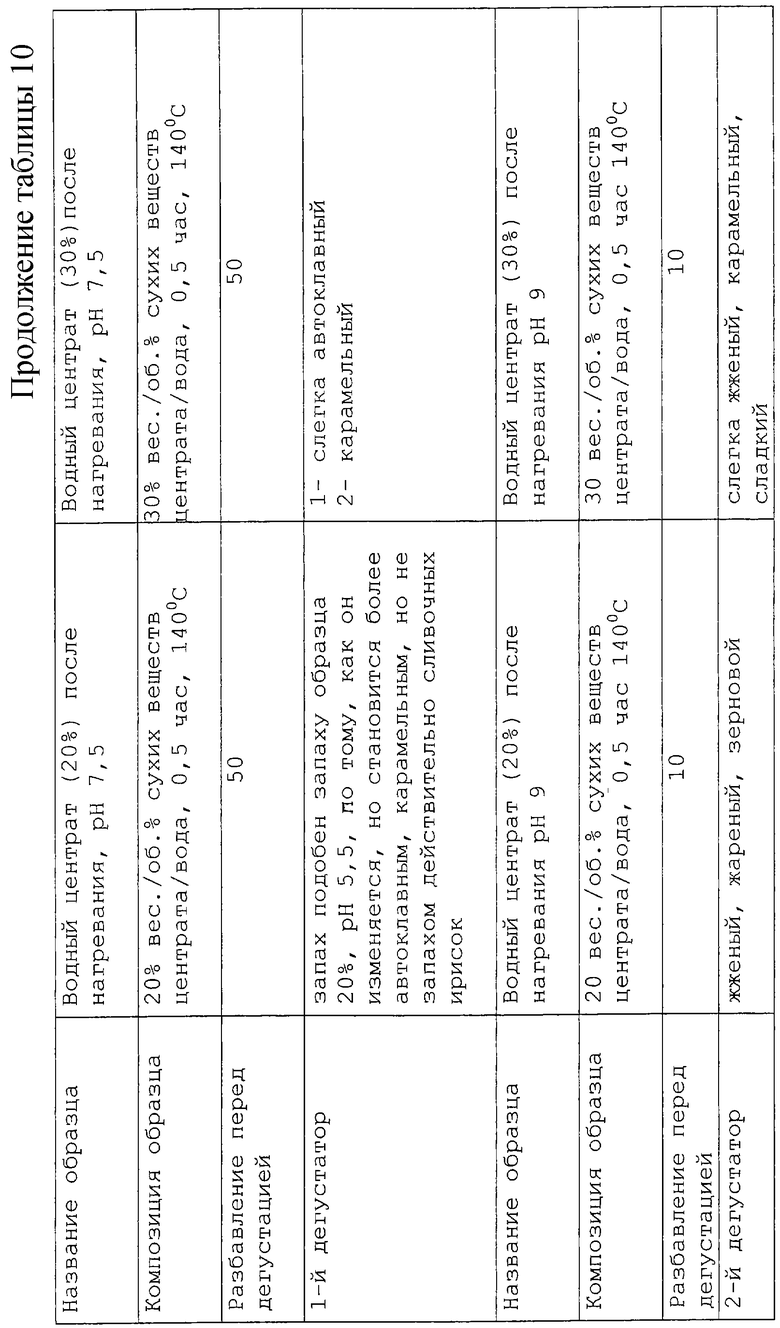
Было изучено влияние рН среды на центрат при 3 разных значениях рН 5,5, 7,5 и 9, при сохранении условий нагревания (140oС в течение 30 мин). Результаты приведены в таблице 10. Согласно полученным результатам между образцами с содержанием сухих веществ 20% и 30% оказалось не так много отличий. Результаты, полученные для рН 7,5, оказались подобными полученным для рН 5,5, но запахи были в основном автоклавными и карамельными. Аромат становился "жженым" при рН 9. Поэтому мы решили осуществить дегустацию запахов, выбрав два экстремальных значения рН и взяв только одну концентрацию (20% сухих веществ).
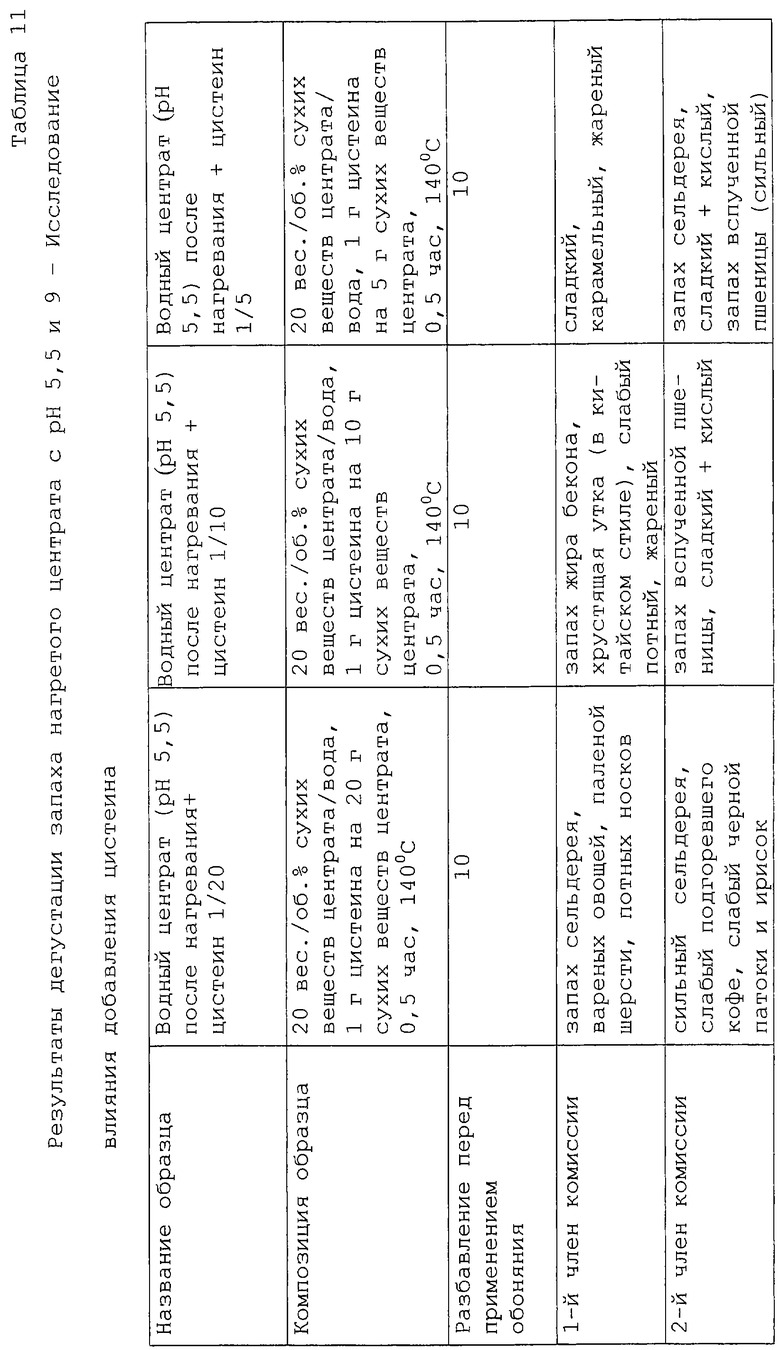
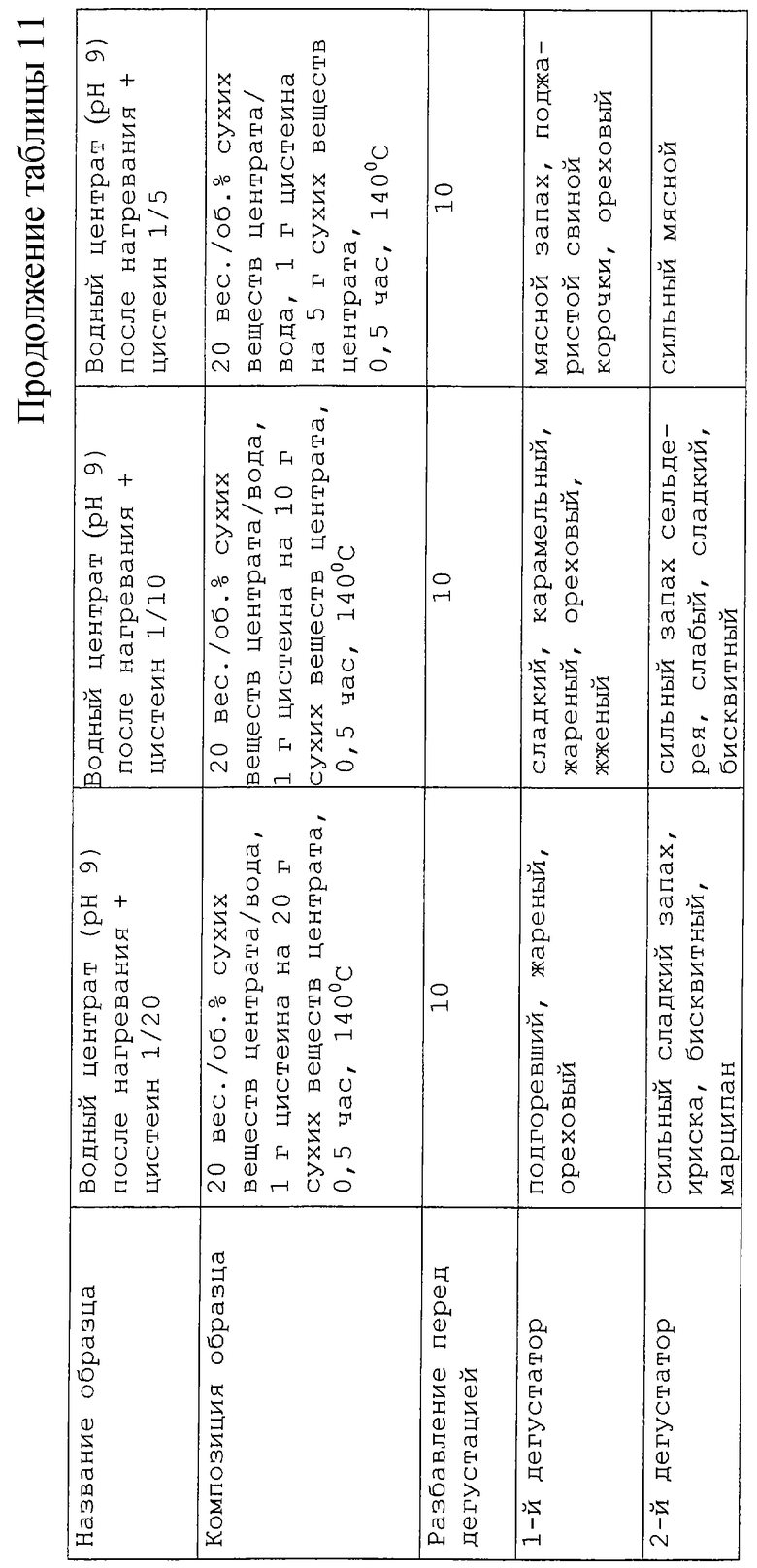
Изучено влияние добавления цистеина к центрату в раствор, содержащий 20% сухих веществ при рН 5,5 и 9. Протестированы три концентрации цистеина: соотношения 1/20, 1/10 и 1/15 цистеина (г)/твердая часть центрата (г). Условия нагревания сохраняли те же, что и ранее (104oС в течение 30 мин).
Результаты представлены в таблице 11. Для ряда образцов с рН 5,5 низкая концентрация цистеина в образце приводит к слабому приятному сладкому, жирному, мясному запаху, который постепенно уступает место оттенкам жареного и резины при повышении концентрации цистеина. При рН 9 оттенки подгоревшего зерна, уже упоминавшиеся в предыдущем эксперименте, вновь начинают присутствовать при понижении концентрации цистеина. При увеличении содержания цистеина аромат становится сильным и более ореховым и затем приближается к запаху ароматного мясного бульона. Поэтому для последующей серии экспериментов мы решили выбрать образец с рН 5,5 и содержанием цистеина 1/20 и образец с рН 9 и содержанием цистеина 1/5.
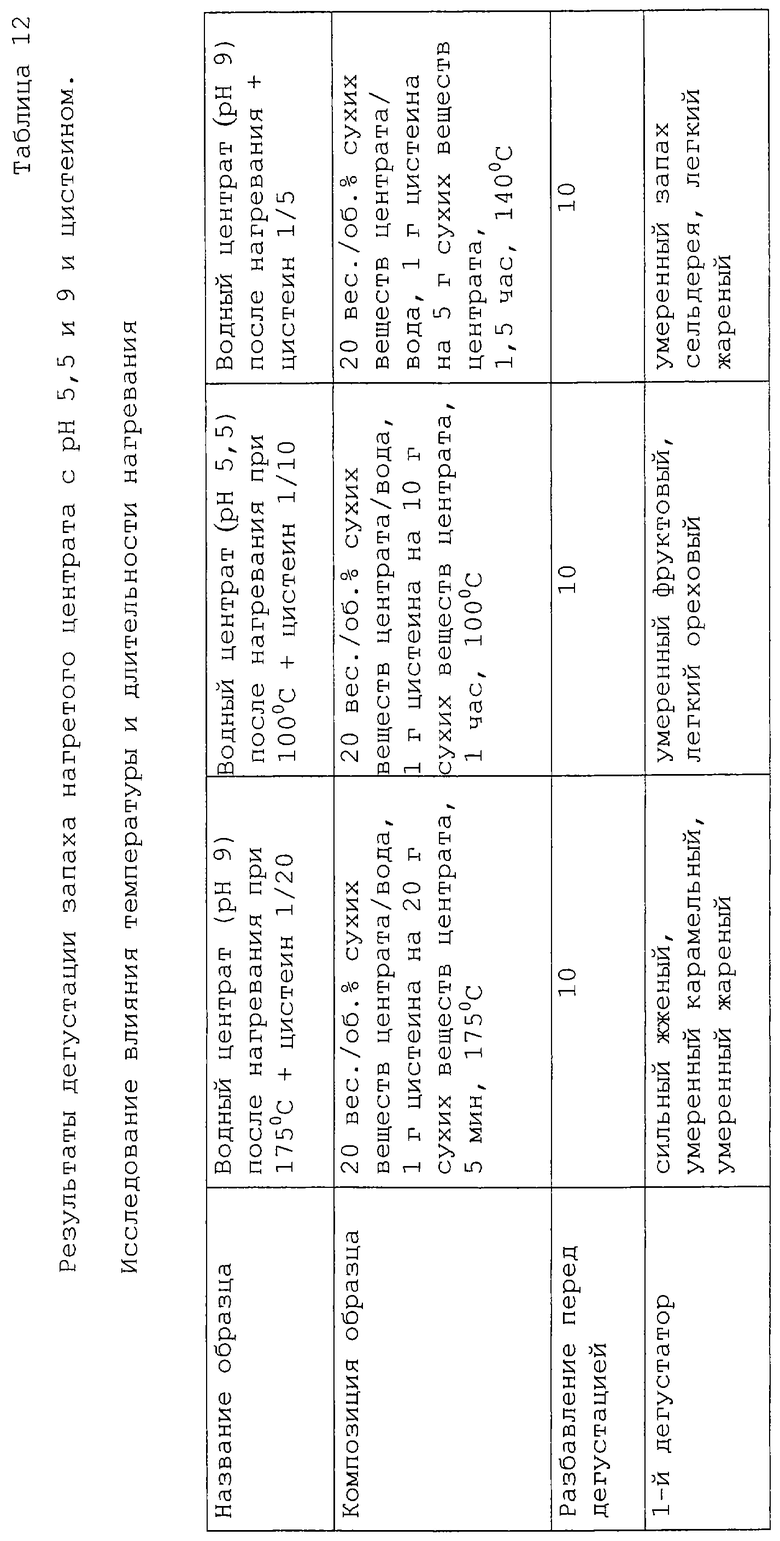
Результаты изучения условий, а именно температуры и продолжительности нагревания, представлены в таблице 12. В нее включены данные по двум выбранным ранее описанным образцам, которые были затем прогреты при более низкой температуре и более продолжительном времени: 100oС в течение 60 мин и 90 мин, и при более высокой температуре, но более короткое время: 175oС в течение 5 мин. Если сравнивать с первоначальными условиями нагревания, то были получены аналогичные результаты для образца с рН 5,5 с содержанием цистеина 1/20 при нагревании его при 100oС в течение 60 мин. Более длительное время нагревания при 100oС привело к образованию оттенков более жареного и подгоревшего продукта, и аналогичный тип аромата был получен после 5 мин нагревания при 175oС. Что касается образца с рН 9 и содержанием цистеина 1/5, то мясных оттенков при 30 мин нагревании при 140oС, удалось достичь при обработке в течение 5 мин при 175oС. Для 100oС были получены очень сильные запахи мочевины и вареных яиц.
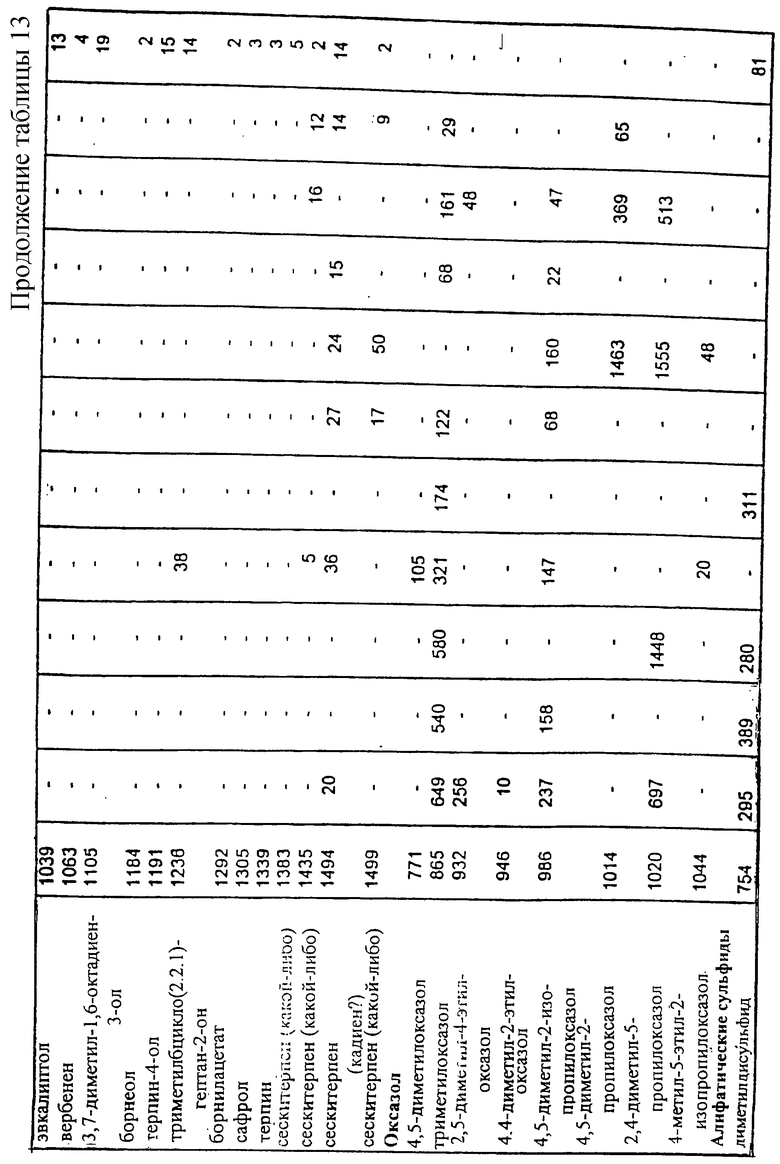
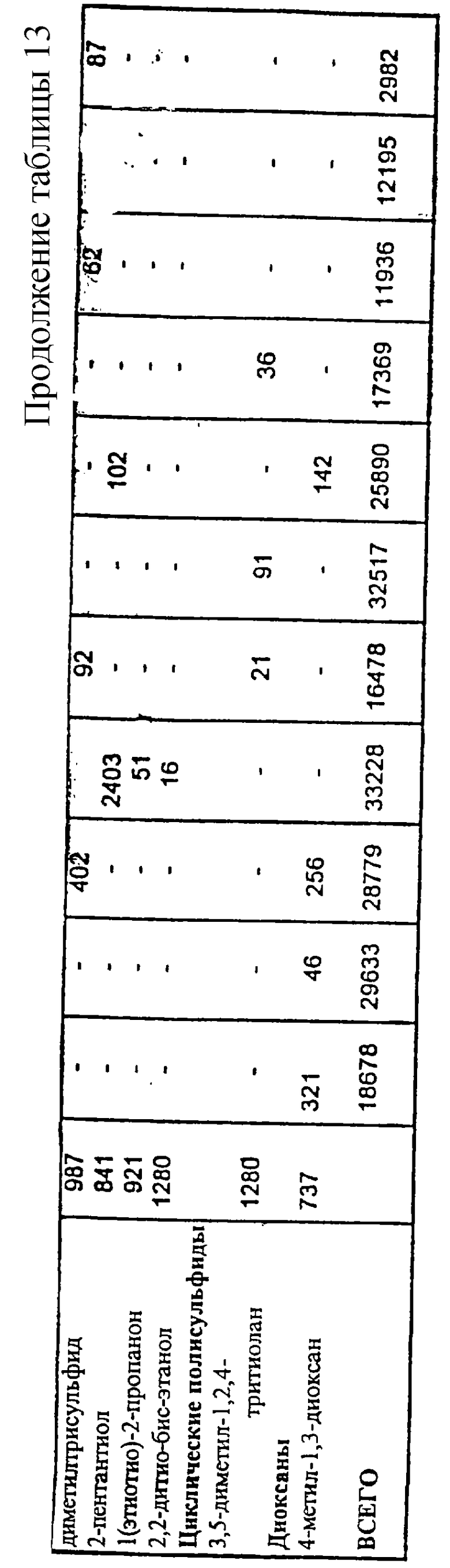
Результаты инструментального анализа ароматических летучих компонентов лиофилизированного центрата (CF) методом хромато-масс-спектрометрии.
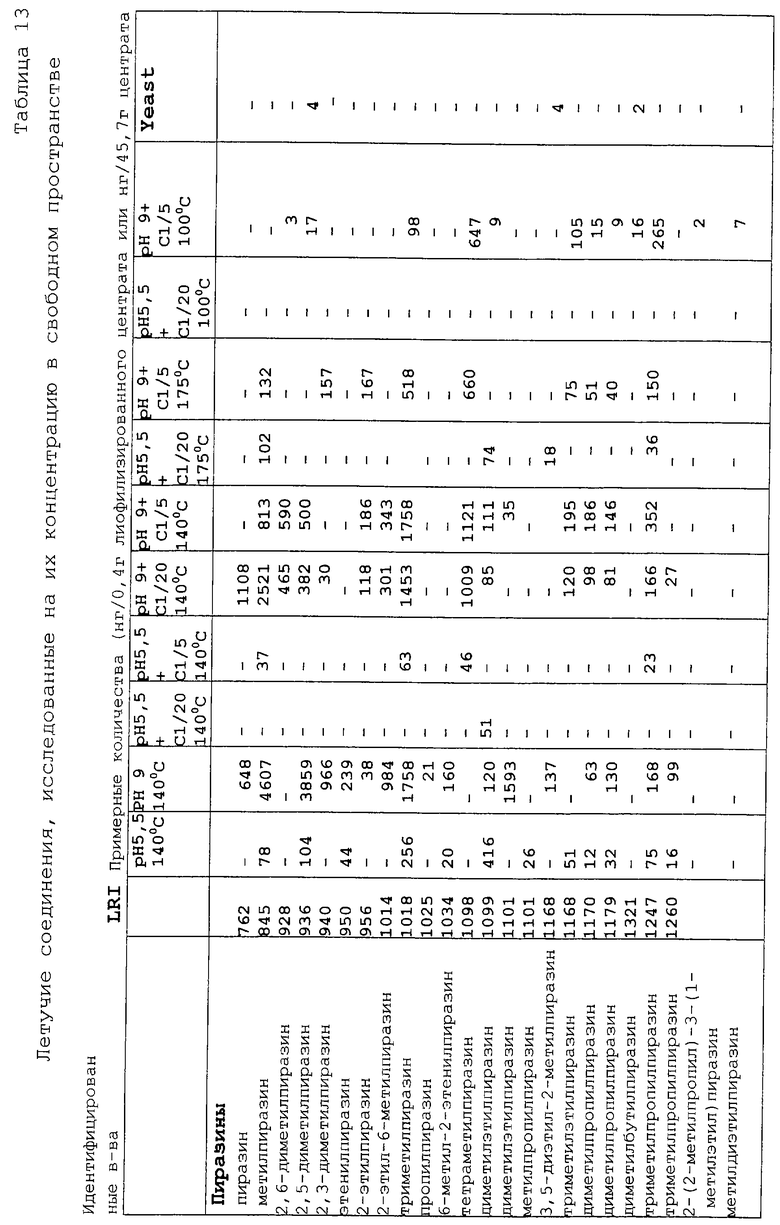
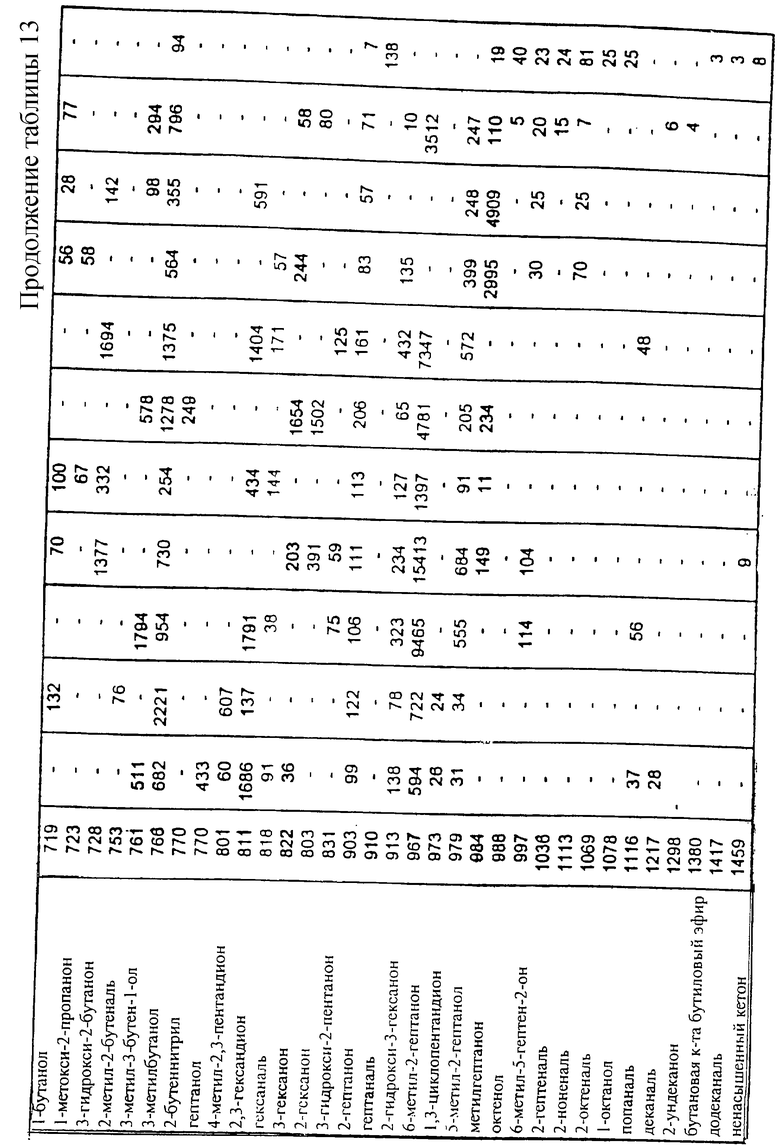
Отобранные реакционные смеси, из описанных выше, были в дальнейшем изучены хромато-масс-спектрометрическим анализом на присутствующие в свободном пространстве летучие компоненты с использованием описанного выше способа. Эти смеси подчеркнуты в таблице 2. Образец автолизных дрожжей анализировали в тех же условиях для сравнения с данными по летучим компонентам. Результаты исследования подробно представлены в таблице 13.
На содержание пиразинов, тиазолов и тиофенов очень сильно влияли условия реакции. Самые высокие уровни содержания пиразинов были установлены для рН 9, как это и ожидалось, поскольку образование N-гетероциклических соединений в реакции Майяра является предпочтительным при высоком значении рН. За некоторыми исключениями, сернистые соединения образовывались только в присутствии цистеина, подтверждая тем самым, что содержание серосодержащих аминокислот в мофилизированном центрате было очень низким.
Ароматические летучие составляющие дрожжевого автолизата в основном представлены терпенами и их композиция очень сильно отличалась от других летучих составляющих, полученных из центрата.
Заключение
Вкусы, получаемые из центрата, свидетельствуют о его потенциале в качестве вкусового ингредиента или в качестве источника предшественников вкусовых продуктов реакции. В данном исследовании были изучены концентрация центрата, величина рН, присутствие добавленного цистеина и температура/длительность нагревания. Добавление цистеина было необходимо для создания мясных ароматов, происхождение которых связано с серосодержащими летучими компонентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ВОЗДЕЙСТВИЯ НА ПРОФИЛЬ ВКУСА И АРОМАТА ПРИГОДНЫХ К ПОТРЕБЛЕНИЮ ВЕЩЕСТВ | 2014 |
|
RU2701852C2 |
| Способ получения натурального говяжьего корригента | 2014 |
|
RU2647508C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВКУСОВОЙ ДОБАВКИ | 1994 |
|
RU2136179C1 |
| УСИЛИТЕЛИ ВКУСОВОЙ ПРИВЛЕКАТЕЛЬНОСТИ, СОДЕРЖАЩИЕ АМИНОРЕАГЕНТЫ И КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ, ДЛЯ ПРИМЕНЕНИЯ В КОРМАХ ДЛЯ КОШЕК | 2014 |
|
RU2654646C1 |
| Способ получения ферментированного бульона с IMP или ферментированного бульона с глутаминовой кислотой в качестве сырья для получения натурального корригента | 2014 |
|
RU2632955C2 |
| БЕЛКОВЫЙ СОУС | 2008 |
|
RU2365291C1 |
| Способ получения натурального корригента "кокуми" | 2014 |
|
RU2637320C2 |
| Способ получения белкового гидролизата из подсолнечного шрота | 1983 |
|
SU1081843A1 |
| Способ получения натурального нейтрального корригента | 2014 |
|
RU2639545C2 |
| ОСНОВА, ПРОДУКТЫ ЕЕ СОДЕРЖАЩИЕ, СПОСОБЫ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЕ | 2009 |
|
RU2495596C2 |







Изобретение относится к вкусовым веществам. Вкусовое вещество получают экстракцией мицелиевых грибов водой при температуре, достаточной для снижения содержания нуклеиновых кислот в мицелиевом грибе. Затем полученный раствор концентрируют. Способ позволяет получить вкусовое вещество, которое может использоваться в качестве альтернативы гидролизованным растительным белкам, дрожжевым автолизатам и дрожжевым экстрактам. 4 с. и 12 з.п. ф-лы, 14 табл.
| WO 9523843 A, 08.09.1995 | |||
| CH 556647 A, 13.12.1974 | |||
| JP 61158761 A, 15.02.1980 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
Авторы
Даты
2004-02-20—Публикация
1998-12-11—Подача