Область техники, к которой относится изобретение
Настоящее изобретение относится к устройству для чрескожной доставки электропереносом, которое включает в себя катодный резервуар, содержащий антибактериальный агент, совместимый с материалом, из которого изготовлен катодный резервуар. Кроме того, настоящее изобретение относится к способу чрескожной доставки лекарственного средства пациенту посредством электропереноса из устройства для доставки лекарственного средства и к способу изготовления устройства для чрескожной доставки электропереносом.
Уровень техники
Чрескожная доставка лекарственных средств посредством диффузии через эпидермис имеет преимущества по сравнению с более традиционными способами доставки, такими как подкожные инъекции и оральная доставка. Чрескожная доставка лекарственного средства позволяет также избежать действия, связанного с первоначальным поступлением в печень, которым сопровождается доставка лекарственного средства оральным способом. В прошлом термин "Чрескожная" доставка в широком смысле означал доставку агента через поверхность тела, такую как кожа, слизистая, ногти и другие поверхности тела (например, поверхность органа) животного.
Функцией кожи является первичный барьер для чрескожного проникновения материалов внутрь тела, и кожа представляет основное сопротивление тела чрескожной доставке целебных агентов, таких как лекарственные средства. В настоящее время внимание сфокусировано на снижении физического сопротивления или усилении проницаемости кожи для доставки лекарственных средств посредством пассивной диффузии. Были предприняты попытки разработать различные способы увеличения скорости чрескожного потока лекарственного средства, причем в основном при использовании химических усилителей потока.
Другие подходы увеличения скорости чрескожной доставки включают использование других источников энергии, таких как электрическая энергия и ультразвуковая энергия. Электрическая чрескожная доставка названа также "электропереносом". Термин "электроперенос", использованный в данном описании, в основном означает доставку лечебного агента (то есть лекарственного средства) через мембрану, такую как кожа, мембрана слизистой оболочки, ногти или другие поверхности тела, причем доставку индуцируют или ускоряют наложением электрического потенциала. Например, лечебный агент может быть введен в большой круг кровообращения тела человека посредством доставки электропереносом через кожу. Широко распространенный способ электропереноса, называемый электромиграцией (также называемый ионтофорезом), включает электрически индуцированный транспорт (перенос) заряженных ионов. Другой тип электропереноса, называемый электроосмосом, обеспечивает поток жидкости, содержащей предназначенный для доставки агент, под действием электрического поля. Другой тип процесса электропереноса, называемый электропорацией, обеспечивает образование временно существующих пор в биологической мембране посредством наложения электрического поля. Агент может быть чрескожно доставлен либо пассивно (то есть без наложения электрического поля), либо активно (то есть под действием электрического потенциала). Однако в любом из данных процессов электропереноса могут происходить до некоторой степени одновременно более одного из этих процессов, включая по крайней мере некоторую степень "пассивной" диффузии. Соответственно, термин "электроперенос" используется в данном описании по возможности в самом широком смысле и таким образом включает электрически индуцированный или усиленный перенос по крайней мере одного агента, который может быть заряжен, не заряжен или содержать смесь (заряженных и незаряженных молекул), независимо от специфического механизма или механизмов, по которым действительно происходит перенос агента.
В устройстве для доставки электропереносом используют по крайней мере два электрода, которые находятся в электрическом контакте с некоторым участком кожи, ногтей, мембраны слизистой или другой поверхности тела. Один электрод, обычно называемый "донорным" электродом, является электродом, из которого агент доставляется внутрь тела. Другой электрод, обычно называемый "противоэлектродом", служит для замыкания электрической цепи внутри тела. Например, если предназначенный для доставки агент является положительно заряженным, то есть катионом, то анод является донорным электродом, в то время как катод является противоэлектродом, который служит для замыкания электрической цепи. В другом случае, если агент заряжен отрицательно, то есть является анионом, то катод является донорным электродом, а анод противоэлектродом. Кроме того, анод и катод оба рассматриваются как донорные электроды, если для доставки предназначены агенты в виде анионов и катионов или незаряженные растворенные агенты.
Более того, в устройстве для доставки электропереносом в основном требуется использовать по крайней мере один резервуар или источник лечебного агента, предназначенного для доставки внутрь тела. Примеры таких донорных резервуаров включают карман или полость, пористую губку или прокладку и гидрофильный полимер или гелевый связующий материал. Такие донорные резервуары соединены электрически и расположены между анодом или катодом и поверхностью тела, чтобы обеспечить фиксированный или возобновляемый источник одного или более лечебных агентов. Электротранспортное устройство содержит также источник электроэнергии, такой как по крайней мере одна батарея. Обычно в любое время один полюс источника питания электрически соединен с донорным электродом, в то время как противоположный полюс электрически соединен с противоэлектродом. Так как было показано, что скорость электропереносной доставки лекарственного средства приблизительно пропорциональна приложенному к устройству электрическому току, обычно многие электропереносные устройства содержат электрический регулятор, с помощью которого контролируют напряжение и/или ток, который приложен к электродам, и тем самым регулируют скорость доставки лекарственного средства. В таких регуляторных схемах используют ряд электрических характеристик электрического тока и/или напряжения, обеспечиваемых источником электроэнергии, для регулировки амплитуды, полярности, синхронизации, формы сигнала и т.п. См., например, McNichols и др. патент США 5047007.
Bosniak и др. в патенте США 5169384 описывают устройство для ионтофореза с регулируемой температурой для наложения на тело пациента. С помощью устройства можно селективно прилагать или отводить термическую энергию от участков тела пациента, а также вводить соединение методом ионтофореза. В различных вариантах воплощения изобретения устройство конфигурируют, чтобы можно было приложить его к лицу или колену пациента.
В результате дальнейшего усовершенствования электропереносных устройств особенно предпочтительным является использование гидрогелей в качестве связующего материала для резервуара для лекарственного средства и электролита частично в связи с тем, что вода является предпочтительным жидким растворителем для использования при электропереносной доставке лекарственного средства благодаря своей чрезвычайно высокой биосовместимости по сравнению с другими жидкими растворителями, такими как спирты и гликоли. Гидрогели характеризуются высоким равновесным содержанием воды и могут быстро абсорбировать воду. Кроме того, гидрогели характеризуются хорошей биосовместимостью с кожей и мембранами слизистой.
Устройства для электропереносной доставки изготавливают, перевозят и хранят (или хранят, перевозят и хранят), назначают и затем используют. В результате устройства должны включать компоненты с продолжительными сроками хранения, которые в некоторых случаях должны соответствовать требованиям контролирующих органов. Например, согласно требованиям Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) сроки хранения некоторых материалов составляют от 6 до 18 месяцев. Сложностью в достижении продолжительных сроков хранения является тот факт, что водная окружающая среда в электродном резервуаре представляет собой прекрасную среду для роста микроорганизмов. Соответственно, в водную среду электродного резервуара должен быть включен антибактериальный агент для подавления пролиферации микроорганизмов.
Ряд антибактериальных агентов используют в различных целях. Известные антибактериальные агенты (иногда называемые биоцидами) включают хлорированные углеводороды, металлоорганические соединения, выделяющие галоген соединения, соли металлов, органические серосодержащие соединения, соединения четвертичного аммония и производные фенола. Иллюстративные соединения включают сорбиновую кислоту, бензойную кислоту, метилпарабен и хлорид цетилпиридиния. Например, в патенте США № 5434144 описаны композиции для местного применения, некоторые из которых включают метилпарабен или соль цетилпиридиния.
Относительно электропереносных устройств в патенте США № 5668120, столбец 8, строки 16-21 описано, что консерванты, такие как метилпарабен и хлорид цетилпиридиния, могут быть по выбору включены в жидкий носитель среды для ионтофореза и такие соединения включены в несколько примеров данного патента. Кроме того, в патентах США № 4585652 и № 5788666 описано, что хлорид цетилпиридиния может быть введен посредством ионторофореза, в то время как в патенте США № 5298017 описан ряд материалов различного типа, которые могут быть введены посредством электропереноса.
Сущность изобретения
Было обнаружено, что различные антибактериальные агенты абсорбируются полимерным материалом, из которого состоит корпус, содержащий водную среду, тем самым снижая эффективность антибактериального агента в водной среде. Показано также, что эффективность антибактериального агента можно сохранить путем исключения чрескожной доставки антибактериального агента в процессе доставки лекарственного средства пациенту посредством электропереноса.
Соответственно, объектом настоящего изобретения является устройство для чрескожной доставки лекарственного средства электропереносом, включающее анод, катод и источник электроэнергии, электрически присоединенный к аноду и катоду, причем катод включает катодный электрод и катодный резервуар, имеющий корпус, выполненный из полимерного материала, и водную среду, находящуюся в контакте с корпусом, а упомянутая водная среда содержит i) лекарственное средство или соль-электролит или их смесь и ii) соль цетилпиридиния в количестве, достаточном для подавления роста микроорганизмов в водной среде, причем упомянутый полимерный материал является совместимым с солью цетилпиридиния.
Другим объектом настоящего изобретения является способ чрескожной доставки лекарственного средства пациенту посредством электропереноса из устройства для доставки лекарственного средства, включающего анод, катод и источник электроэнергии, электрически присоединенный к аноду и катоду, причем анод включает анодный электрод и анодный резервуар, содержащий лекарственное средство, и катод, включающий катодный электрод и катодный резервуар, состоящий из полимерного материала и содержащий водную среду, которая включает i) соль-электролит и ii) соль цетилпиридиния в количестве, достаточном для подавления роста микроорганизмов в водной среде, причем упомянутый полимерный материал является совместимым с солью цетилпиридиния, а упомянутый способ включает наложение электрического тока из источника электроэнергии и, таким образом, лекарственное средство доставляется пациенту чрескожным способом посредством электропереноса из анодного резервуара и при этом не наблюдается чрескожная доставка соли цетилпиридиния пациенту посредством электропереноса из катодного резервуара.
Другим объектом настоящего изобретения является способ изготовления устройства для чрескожной доставки лекарственного средства электропереносом. Способ включает приготовление водной среды, содержащей i) лекарственное средство или соль-электролит или их смесь и ii) соль цетилпиридиния в количестве, достаточном для подавления роста микроорганизмов в водной среде, и помещение водной среды в катодный резервуар устройства, включающего анод, катод и источник электроэнергии, электрически присоединенный к аноду и катоду, причем катод включает катодный электрод и катодный резервуар, состоящий из корпуса, содержащего полимерный материал, при этом водная среда находится в контакте с корпусом катодного резервуара, а упомянутый полимерный материал выбирают таким образом, чтобы он являлся совместимым с солью цетилпиридиния.
На чертеже показан перспективный покомпонентный вид устройства для доставки лекарственного средства электропереносом в соответствии с одним из вариантов воплощения настоящего изобретения.
Сведения, подтверждающие возможность осуществления изобретения
Как указано выше, один объект настоящего изобретения относится к устройству для чрескожной доставки лекарственного средства электропереносом, которое разработано для доставки лекарственного средства пациенту через кожу или мембрану слизистой. Устройство для чрескожной доставки лекарственного средства электропереносом содержит анод, катод и источник электроэнергии, электрически присоединенный к аноду и катоду, причем катод включает в себя катодный электрод и катодный резервуар, содержащий корпус, состоящий из полимерного материала, и водную среду в контакте с корпусом, причем водная среда содержит i) лекарственное средство или соль-электролит, или их смесь и ii) соль цетилпиридиния в количестве, достаточном для подавления роста микроорганизмов в водной среде, причем упомянутый полимерный материал является совместимым с солью цетилпиридиния.
Соль цетилпиридиния, использованная в настоящем изобретении, является чрезвычайно эффективным антибактериальным агентом и может убивать или по крайней мере подавлять рост ряда микроорганизмов - как бактерий, так и грибов. Антибактериальная эффективность в катодном резервуаре прежде всего связана с величиной рН в диапазоне от приблизительно 3 до приблизительно 7,5, предпочтительно от приблизительно 3,5 до приблизительно 6,5, которую поддерживают в водной среде катодного резервуара, причем низкая величина рН в указанных диапазонах сама по себе может обеспечивать определенный уровень антимикробной активности.
Соль цетилпиридиния присутствует в количестве, достаточном для подавления роста микроорганизмов в водной среде. В основном, водная среда содержит по крайней мере приблизительно 0,005 мас.% соли цетилпиридиния. Более подробно, водная среда содержит от приблизительно 0,005 мас.% до приблизительно 2 мас.% соли цетилпиридиния и предпочтительно содержит от приблизительно 0,01 мас.% до приблизительно 1 мас.% соли цетилпиридиния. При расчете массы водной среды количество гелевого связующего материала (если он присутствует) не учитывается.
Солью цетилпиридиния может быть галогенид цетилпиридиния или их смесь. Солью цетилпиридиния предпочтительно является галогенид цетилпиридиния и наиболее предпочтительно хлорид цетилпиридиния.
Соль цетилпиридиния может быть использована в катодном резервуаре практически любого устройства для чрескожной доставки электропереносом. В основном, электропереносное устройство обеспечивает чрескожную доставку лекарственного средства посредством электрического индуцирования или усиления переноса лекарственного средства в форме, которая может быть заряжена, не заряжена или в виде смеси заряженных и незаряженных молекул, независимо от специфического механизма или механизмов, по которым происходит транспорт лекарственного средства. Электроперенос основан на электрическом потенциале, который увеличивает поток или скорость доставки лекарственного средства по сравнению с системами пассивной (т.е. без помощи электричества) чрескожной доставки, при которой лекарственное средство доставляется через кожу только посредством диффузии. Особенно применимым механизмом является ионтофорез, при котором лекарственное средство вводят в заряженной (ионизированной) форме. Как было уже упомянуто выше, если лекарственное средство вводят в виде катиона, то в исходном состоянии лекарственное средство присутствует в анодном резервуаре устройства для доставки лекарственного средства. С другой стороны, если лекарственное средство вводят в виде аниона, то в исходном состоянии лекарственное средство присутствует в катодном резервуаре устройства для доставки лекарственного средства. Возможно также иметь лекарственные средства как в виде анионов, так и в виде катионов, которые одновременно доставляются из анодного и катодного резервуаров соответственно.
Любое лекарственное средство, которое может быть доставлено посредством электропереноса чрескожным способом, может быть использовано по настоящему изобретению, включая (без ограничения перечисленным): антибактериальные средства, такие как антибиотики и противовирусные агенты; анальгетики, такие как фентанил, суфентанил и бупренорфин и комбинации анальгетиков; анестезирующие средства; средства, снижающие аппетит; средства для лечения артритов; противоастматические агенты, такие как тербуталин; противосудорожные средства; антидепрессанты; противодиабетические средства; средства для лечения диареи; противогистаминные средства; противовоспалительные агенты; препараты для лечения мигрени; препараты, уменьшающие двигательную активность, такие как скополамин и ондансетрон; противорвотные средства; противоопухолевые средства; средства для лечения паркинсонизма; противозудные средства; нейролептические средства; жаропонижающие средства; спазмолитические средства, включая средства для желудочно-кишечного тракта и мочевых путей; антихолинергические средства; симпатомиметические средства; производные ксантина; сердечно-сосудистые препараты, включая блокаторы кальциевых каналов, такие как нифедипин; бета-агонисты, такие как добутамин и ритодрин; бета-блокаторы; антиаритмические средства; гипотензивные средства, такие как атенолол; ингибиторы ангиотензинпревращающего фермента (АПФ), такие как ранитидин; мочегонные средства; сосудорасширяющие средства, включающие средства общего, коронарного, периферического и церебрального действия; средства, возбуждающие центральную нервную систему; противопростудные и противокашлевые препараты; противоотечные средства; диагностические средства; гормоны, такие как паратиреоидные гормоны; снотворные средства; иммунодепрессивные средства; миорелаксанты; парасимпатолитические средства; парасимпатомиметические средства; простагландины; белки; пептиды; психостимулянты; седативные средства и транквилизаторы.
Более подробно лекарственные средства включают баклофен, беклометазон, бетаметазон, бушпирон, хромолин натрия, дилтиазем, доксазозин, дроперидол, энкаинид, фентанил, гидрокортизон, индометацин, кетопрофен, лидокаин, метотрексат, метоклопрамид, миконазол, мидазолам, никардипин, пироксикам, празозин, скополамин, суфентанил, тербуталин, тестостерон, тетракаин и верапамил.
Настоящее изобретение может быть также использовано для контролируемой доставки пептидов, полипептидов, белков или других макромолекул, доставка которых чрескожным или подслизистым способом затруднена в связи с их размером. Такие макромолекулярные соединения обычно имеют молекулярную массу по крайней мере приблизительно 300 Да и более типично имеют молекулярную массу в диапазоне от приблизительно 300 до 40000 Да. Примеры пептидов и белков, которые могут быть доставлены с использованием устройства по настоящему изобретению, включают, без ограничения перечисленным, лютеинизирующий гормонвысвобождающий фактор (LHRH), аналоги LHRH, такие как бусерелин, госерелин, гонадорелин, нафрелин, натурелин, лейпролид, соматотропный гормон-рилизинггормон (GHRH), соматотропный гормонвысвобождающий фактор (GHRF), аналоги GHRF, инсулин, инсулинотропин, гепарин, кальцитонин, эндорфин, тиреотропный гормон (TRH), NT-36 (химическое название N-[[(s)-4-оксо-2-азетидинил]карбонил]-L-гистидил-L-пролинамид], липрецин, гормоны гипофиза (например, гормон роста человека (HGH), гонадотропин менопаузы человека (HMG), хорионический гонадотропин человека (HCG), десмопрессина ацетат), гормоны желтого тела яичника, антинуклеарный фактор (α-ANF), фактор роста-высвобождающий фактор (GFRF), β-меланостимулирующий гормон (β-МSН), соматостатин, брадикинин, соматотропин, тромбоцитарный фактор роста, аспарагиназа, блеомицина сульфат, химопапаин, холецистокинин, хорионический гонадотропин, кортикотропин (АСТН), эритропоэтин, эпопростенол (ингибитор агрегации тромбоцитов), глюкагон, гирулог, гиалуронидаза, интерферон, интерлейкин-2, менотропины (урофоллитропин (FSH) и лютеинизирующий гормон (LH)), окситоцин, стрептокиназа, тканевой активатор плазминогена, урокиназа, вазопрессин, десмопрессин, аналоги АСТН, атриальный натрийуретический пептид (ANP), ингибиторы клиранса ANP, антагонисты ангиотензина II, агонисты антидиуретического гормона, антагонисты антидиуретического гормона, антагонисты брадикинина, CD-4, цередаза, цереброспинальная жидкость (CSF'S), энкефалины, фрагменты FAB, пептидные супрессоры IgE, инсулиноподобный фактор роста-1 (IGF-1), нейротропные факторы, колонийстимулирующие факторы, паращитовидные гормоны и агонисты, антагонисты паращитовидных гормонов, антагонисты простагландинов, пентигетид, протеин С, протеин S, ингибиторы ренина, тимозин альфа-1, тромболитические средства, фактор некроза опухоли (TNF), вакцины, аналоги антагонистов вазопрессина, альфа-1 антитрипсин (рекомбинантный) и бета-трансформирующий фактор роста (бета-TGF).
Прежде всего, предпочтительными лекарственными средствами, которые могут быть доставлены с использованием устройства и способа по настоящему изобретению, являются фентанил и суфентанил, которые представляют собой синтетические наркотические вещества, характеризующиеся быстрым обезболивающим действием и короткой продолжительностью действия. Эти препараты являются чрезвычайно активными и их активность превышает активность морфина в 80 и 800 раз соответственно. Оба лекарственных средства являются аминами и, следовательно, слабыми основаниями, основная часть которых находится в форме катионов в кислой водной среде. Если фентанил или суфентанил используют в качестве лекарственного средства, которое вводят из анодного резервуара, то обычно катодный резервуар по существу не содержит лекарственного средства. Примеры устройств для чрескожной доставки фентанила и суфентанила электропереносом описаны в публикациях международных заявок на выдачу патента WO 96/39222, WO 96/39223 и WO 96/39224, описания которых включены в данный текст в качестве ссылок.
Если фентанил используют в устройстве, то обычно его используют в форме кислотно-аддитивной соли, прежде всего, в форме хлорида, а исходная концентрация в водной среде в анодном резервуаре (то есть перед началом введения любого лекарственного средства пациенту) составляет от приблизительно 10 до приблизительно 50 мг/мл, предпочтительно от приблизительно 20 до приблизительно 55 мг/мл в расчете на число молей соли фентанила, содержащейся в донорном резервуаре, а не в расчете на эквивалентное число молей фентанила в форме свободного основания. Кроме того, при расчете концентрации учитывают объем жидкого растворителя, а не общий объем резервуара. Другими словами, концентрация не включает объем резервуара, который представлен связующим материалом резервуара (например, гидрогелем или другим связующим материалом).
В контексте настоящего изобретения фентанил является предпочтительнее суфентанила. При концентрации по крайней мере 5,7 мг/мл в практически нейтральной среде анодного резервуара фентанил проявляет антибактериальные свойства против микроорганизмов, таких как споровые S. aureus, Е. соli, Р. aerugi№ sa, В. pumilus и С. albicans. При указанной концентрации фентанил подавляет также рост других микроорганизмов, таких как A. niger, а также подавляет этот гриб при концентрации порядка 22,7 мг/мл. Соответственно, если в качестве лекарственного средства, предназначенного для введения пациенту из анодного резервуара, используют фентанил или лекарственное средство с аналогичными антибактериальными свойствами, то при этом не требуется, чтобы в анодном резервуаре содержался отдельный антибактериальный агент.
Катодный электрод и анодный электрод состоят из электропроводящего материала, такого как металл. Например, электроды могут быть изготовлены из металлической фольги, металлической пластины, из металлизированной или покрытой металлом подходящей подложки или путем каландрования, напыления пленки или смешивания электропроводящего материала с полимерсвязующей матрицей. Примеры подходящих электропроводящих материалов включают уголь, графит, серебро, цинк, алюминий, платину, нержавеющую сталь, золото и титан. Например, как было указано выше, анодный электрод может состоять из серебра, которое также подвергается электрохимическому окислению. Катодный электрод может состоять из угля и хлорида серебра, который подвергается электрохимическому восстановлению. Предпочтительным среди других металлов является серебро благодаря его относительно низкой токсичности для млекопитающих. Хлорид серебра предпочтителен, так как в ходе реакции электрохимического восстановления, протекающей на катоде (AgCl+e- → Ag+Сl-), образуются ионы хлора, которые преобладают у большинства млекопитающих и являются нетоксичными для них.
В другом варианте электроды могут быть изготовлены из полимерной матрицы, содержащей проводящий наполнитель, такой как металлический порошок, порошкообразный графит, угольные волокна или другой известный электропроводящий материал-наполнитель. Электроды на основе полимера могут быть изготовлены путем смешивания проводящего наполнителя с полимерным связующим материалом, предпочтительно со смесью гидрофильного и гидрофобного полимеров. Гидрофобные полимеры обеспечивают структурную целостность, в то время как гидрофильные полимеры могут усиливать ионный перенос. Например, порошок цинка, порошок серебра, порошкообразный уголь, угольные волокна и их смеси могут быть смешаны с гидрофобным полимерным связующим материалом, причем предпочтительное количество проводящего наполнителя находится в диапазоне от приблизительно 30 до приблизительно 90 об.%, а остальное количество представляет полимерный связующий материал или другие инертные добавки.
Источник электроэнергии, электрически присоединенный к аноду и катоду, может быть любой конструкции. Например, если донорный электрод и противоэлектрод являются разноименными металлами или характеризуются различными полуэлементными реакциями, то существует возможность генерирования собственной электроэнергии в системе. Типичные материалы, которые обеспечивают гальваническую пару, включают цинковый донорный электрод и противоэлектрод из хлорида серебра. При такой комбинации образуется потенциал, равный приблизительно 1 В. Если используют гальваническую пару, то донорный электрод и противоэлектрод являются составляющими процесса генерирования энергии. Такая система гальванической пары с генерированием энергии при отсутствии определенных контролирующих средств активизируется автоматически, когда в ткани тела и/или в текучей среде образуется замкнутая цепь с системой. Существуют другие многочисленные примеры систем гальванических пар, которые также могут быть использованы в настоящем изобретении.
В некоторых случаях может существовать необходимость увеличить энергию, генерируемую электродами гальванической пары. Такое увеличение можно осуществить с использованием отдельного источника электроэнергии. Таким источником электроэнергии обычно является батарея или множество батарей, соединенных последовательно или параллельно и расположенных между катодом и анодом таким образом, что один электрод присоединен к одному полюсу источника питания, а другой электрод - к противоположному полюсу. Обычно для питания электропереносного устройства подходящими являются одна или несколько 3 В батарей кнопочного типа. Предпочтительной батареей является литиевая батарея кнопочного типа на 3 В.
Источник электроэнергии может включать электронную схему для управления работой электропереносного устройства. Например, источник питания может включать электронную схему, предназначенную для выключения и включения системы пациентом вручную, например, в соответствии со схемой лекарственного лечения или при необходимости включения и выключения через определенные промежутки времени, например, в соответствии с естественными и суточными функциями тела. Кроме того, управляющие устройства могут ограничивать число доз, которые могут быть введены пациенту. Относительно простой регулятор или микропроцессор может контролировать силу тока как функцию времени или может генерировать сложные формы сигнала, такие как импульсы или синусоидальные волны. Схема управления может также включать биосенсор и определенный тип системы обратной связи, с помощью которой анализируют биосигналы и которая обеспечивает оценку терапии и регулирует соответствующую доставку лекарственного средства. Типичным примером является анализ уровня сахара в крови при контролируемом введении инсулина.
Водной средой в катодном резервуаре, а также водной средой, которая обычно содержится в анодном резервуаре, может быть любой материал, подходящий для абсорбции и удерживания в нем достаточного количества жидкости, чтобы обеспечивать транспорт агента посредством электропереноса. Например, могут быть использованы марля, прокладки или губки, изготовленные из хлопка или других абсорбирующих натуральных или синтетических тканей. Наиболее предпочтительными водными средами являются среды, которые по крайней мере частично состоят из одного или более гидрофильных полимеров. Обычно гидрофильные полимеры являются предпочтительными, так как вода является предпочтительной средой для ионного транспорта и гидрофильные полимеры характеризуются относительно высоким равновесным содержанием воды. Наиболее предпочтительными водными средами в резервуарах являются полимерные связующие материалы, которые по крайней мере частично состоят из гидрофильного полимера. Нерастворимые гидрофильные полимерные связующие материалы являются предпочтительными по сравнению с растворимыми гидрофильными полимерами в связи с их структурными свойствами (например, более низкая набухаемость при абсорбции воды).
Водной средой может быть гель, причем гель образован из гидрофильного полимера, нерастворимого или растворимого в воде. Такие полимеры могут быть смешаны в любом соотношении с компонентами, но они предпочтительно должны присутствовать в количестве от нескольких процентов до приблизительно 50 мас.% от массы резервуара. Полимеры могут быть линейными или поперечносшитыми. Подходящие гидрофильные полимеры включают сополимеры сложных полиэфиров, таких как HYTREL® (производства фирмы DuPont De Nemours & Co., Wilmington, Del.), поливинилпирролидоны, поливиниловый спирт, полиэтиленоксиды, такие как POLYOX (производства фирмы Union Carbide Corp.), CARBOPOL® (производства фирмы BF Goodrich of Akron, Ohio), смеси полиоксиэтилена или полиэтиленгликолей с полиакриловой кислотой, такие как POLYOX®, смешанный с CARBOPOL®, полиакриламид, KLUCEL®, поперечносшитый декстран, такой как SEPHADEX® (производства фирмы Pharmacia Fine Chemicals, AB, Uppsala, Швеция), WATER LOCK® (производства фирмы Grain Processing Corp., Muscatine, Iowa), который представляет собой крахмалпривитойполи(сополимер натрий акрилата и акриламида), производные целлюлозы, такие как гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза с низкой степенью замещения и поперечносшитая натрийкарбоксиметилцеллюлоза, такая как Ac-DiSol (производства фирмы FMC Corp., Филадельфия, Пенсильвания), гидрогели, такие как полигидроксиэтилметакрилат (производства фирмы National Patent Development Corp.), природные камеди, хитозан, пектин, крахмал, гуаровая камедь, камедь плодов рожкового дерева и т.п., наряду с их смесями. Из перечисленных полимеров предпочтительными являются поливиниловые спирты в количестве, которое находится в диапазоне от приблизительно 5 до приблизительно 35 мас.%, предпочтительно от приблизительно 19 до приблизительно 23 мас.% от массы содержимого резервуара. Перечисленный список приведен просто в качестве примера материалов, подходящих для использования по настоящему изобретению. Другие подходящие гидрофильные полимеры можно найти в книге J.R.Scott и W.J.Roff, Handbook of Common Polymers (Справочник по стандартным полимерам) (CRC Press, 1971), которая включена в данное описание в качестве ссылки.
По выбору может присутствовать гидрофобный полимер с целью улучшения структурной целостности. Гидрофобный полимер предпочтительно должен быть термоплавким, чтобы усилить прилипание к соседним слоям. Подходящие гидрофобные полимеры включают, без ограничения перечисленным, полиизобутилены, полиэтилен, полипропилен, полиизопрены и полиалкены, каучуки, сополимеры, такие как KRATON®, поливинилацетат, сополимеры этилена и винилацетата, полиамиды, такие как найлоны, полиуретаны, поливинилхлорид, акриловые или метакриловые смолы, такие как полимеры сложных эфиров акриловой или метакриловой кислоты и спиртов, таких как н-бутанол, 1-метилпентанол, 2-метилпентанол, 3-метилпентанол, 2-этилбутанол, изооктанол, н-деканол, в отдельности или в виде сополимеров с этиленненасыщенными мономерами, такими как акриловая кислота, метакриловая кислота, акриламид, метакриламид, N-алкоксиметилакриламиды, N-алкоксиметилметакриламиды, N-трет-бутилакриламид, итаконовая кислота, N-разветвленные алкилполуамиды малеиновой кислоты, в которых алкильная группа включает 10-24 атома углерода, гликольдиакрилаты и их смеси. Большинство из вышеупомянутых гидрофобных полимеров являются термоплавкими. Однако при выборе материалов, используемых для катодного резервуара, следует учитывать их совместимость с солью цетилпиридиния.
Среда в анодном и катодном резервуарах может быть получена путем смешивания требуемого лекарственного средства, электролита или другого компонента (компонентов) с инертным полимером посредством таких процессов, как смешивание в расплавленном состоянии, литье с растворителем или экструзия. В типичном случае среда в анодном резервуаре содержит лекарственное средство, предназначенное для доставки, в то время как среда в катодном резервуаре содержит электролит, обычно биосовместимую соль, такую как хлорид натрия, и соль цетилпиридиния. Присутствие соли цетилпиридиния в катодном резервуаре является предпочтительным, так как при ионизации катион цетилпиридиния не доставляется пациенту посредством электропереноса, когда в устройство подают электрический ток.
Кроме лекарственного средства и электролита, анодный и катодный резервуары могут содержать другие традиционные материалы, такие как инертные наполнители и т.п. Например, катодный резервуар может содержать от приблизительно 0,01 до приблизительно 1,0 мас.% соли электролита, такой как хлорид натрия, от приблизительно 0,1 до приблизительно 1,0 мас.% лимонной кислоты или сопоставимого материала и от приблизительно 0,1 до приблизительно 1,0 мас.% дигидрата тринатрийцитрата или сопоставимого материала, причем лимонная килота и дигидрат тринатрийцитрата используются в качестве буферной системы.
Кроме лекарственного средства в виде катиона, воды и гидрогеля, анодный резервуар может содержать усилители потока, как описано в патенте США № 5023085, буферные вещества, как указано в патенте США № 5624415, галогенированные смолы, как описано в публикации международной заявки на выдачу патента WO 95/27530, и другие известные наполнители. Дополнительные специфические компоненты включают натрий ЭДТУ в количестве от приблизительно 0,01 до приблизительно 1,0 мас.% или L-гистидин или гидрохлорид L-гистидина в количестве от приблизительно 0,1 до приблизительно 2,5 мас.%.
Кроме того, между донорным резервуаром и поверхностью тела могут быть расположены одна или более мембран, контролирующих скорость, как описано в патентах США № 5080646 и № 5147296, для контроля скорости доставки лекарственного средства или для ограничения пассивной доставки агента, когда источник питания отключен.
На чертеже изображен пример выполнения устройства для электропереноса согласно настоящему изобретению. На чертеже показан перспективный покомпонентный вид электропереносного устройства 10, снабженного активационным переключателем в виде кнопочного переключателя 12 и индикатором в виде светодиода (СИД) 14. Устройство 10 включает в себя верхний корпус 16, монтажную плату 18, нижний корпус 20, анод 22, катод 24, анодный резервуар 26, катодный резервуар 28 и совместимый с кожей адгезив 30. Верхний корпус 16 имеет боковые крылья 15, которые способствуют удерживанию устройства 10 на коже пациента. Верхний корпус 16 предпочтительно состоит из эластомера, который поддается литью под давлением (например, этиленвинилацетат).
Монтажная (печатная) плата 18 включает в себя интегральную схему 19, соединенную с дискретными электрическими компонентами 40 и батареей 32. Монтажная (печатная) плата 18 соединена с корпусом 16 с помощью штырей (не показаны), которые проходят в отверстия 13а и 13b. Концы штырей нагревают/расплавляют с целью термического припаивания монтажной платы 18 к корпусу 16. Нижний корпус 20 прикреплен к верхнему корпусу 16 с помощью адгезива 30, причем верхняя поверхность 34 адгезива 30 приклеена как к нижнему корпусу 20, так и к верхнему корпусу 16, включая нижние поверхности крыльев 15.
На нижней части блока монтажной (печатной) платы 18 показана (частично) батарея 32, которая предпочтительно является батареей кнопочного типа и наиболее предпочтительно литиевой батареей. Для питания устройства 10 могут быть использованы другие типы батарей (аккумуляторов).
Выводы (не показаны) монтажной платы 18 обеспечивают электрический контакт с электродами 24 и 22 через отверстия 23, 23' в углублениях 25, 25', сформированных в нижнем корпусе, и посредством полосок 42, 42' из электропроводящего адгезива. В свою очередь электроды 22 и 24 находятся в прямом механическом и электрическом контакте с верхними поверхностями 44, 44' резервуаров 26 и 28. Нижние поверхности 46', 46 резервуаров 26, 28 находятся в контакте с кожей пациента через отверстия 29', 29 в адгезиве 30.
После нажатия на кнопочный переключатель 12 электронная схема блока монтажной платы 18 подает на электроды/резервуары 22, 26 и 24, 28 предварительно заданный постоянный ток для доставки препарата в течение предварительно определенного интервала времени, например в течение 10-20 мин. Устройство предпочтительно передает пользователю визуальное и/или звуковое подтверждение начала интервала доставки лекарственного средства или вливания с помощью СИД 14, который загорается, и/или звукового сигнала из, например, устройства звуковой сигнализации. Затем анальгетическое средство, например фентанил или суфентанил, доставляется через кожу пациента, например на руке в течение предварительно определенного интервала доставки. Практически пользователь имеет обратную связь в отношении интервала начала доставки лекарственного средства с помощью визуального (загорается СИД 14) и/или звукового сигналов (зуммерного сигнала из устройства звуковой сигнализации).
Анодный электрод 22 предпочтительно включает в себя серебро, а катодный электрод 24 предпочтительно включает в себя уголь и хлорид серебра, нанесенные на материал полимерной матрицы, такой как полиизобутилен. Оба резервуара 26 и 28 предпочтительно состоят из материалов полимерных гидрогелей, описанных в данном тексте. Электроды 22, 24 и резервуары 26, 28 закреплены на нижнем корпусе 20. В случае использования солей фентанила и суфентанила анодный резервуар 26 является донорным резервуаром, который содержит лекарственное средство, и катодный резервуар 28 содержит биосовместимый электролит и соль цетилпиридиния. Если электродный материал состоит из материалов, которые абсорбируют соль цетилпиридиния, то между электродом 24 и резервуаром 28 может быть расположена ионообменная мембрана. Таким образом, например, анионообменная мембрана (не показана), такая как анионообменная мембрана SYВRОN® или RAIPORE®, может быть расположена между катодным электродом 24 и катодным резервуаром 28, чтобы катионы цетилпиридиния не проникали через такую мембрану, и следовательно, не контактировали с катодным электродом.
Кнопочный переключатель 12, электронная схема в монтажной плате 18 и батарея 32 закреплены с помощью адгезива между верхним корпусом 16 и нижним корпусом 20. Верхний корпус 16 предпочтительно может быть выполнен из каучука или другого эластомерного материала. Нижний корпус состоит из полимерной пластины, которая может быть легко расплавлена для формирования углублений 25, 25' и в ней могут быть вырезаны отверстия 23, 23'. Нижний корпус, прежде всего его части, содержащие анодный резервуар 26 и катодный резервуар 28, выполнен из полимерного материала. Полимерный материал является совместимым с солью цетилпиридиния, чтобы соль цетилпиридиния в основном не абсорбировалась полимерным материалом. Подходящие полимерные материалы включают полиэтилентерефталат, полиэтилентерефталат, модифицированный циклогександиметилолом (называемый полиэтилентерефталатгликолем или ПЭТГ), который придает полимеру более аморфные свойства, полипропилен и их смеси. Предпочтительными полимерными материалами являются полиэтилентерефталат и ПЭТГ, которые выпускаются фирмами, наиболее предпочтительным является ПЭТГ. Подходящий ПЭТГ выпускается фирмой Easan Chemical Products Inc. под торговым названием сополи(сложный эфир) KODAR® ПЭТГ 6763.
Собранное устройство 10 предпочтительно является водостойким (т.е. брызгонепроницаемым) и наиболее предпочтительно водонепроницаемым. Система имеет низкий профиль, который легко прилегает к телу, тем самым обеспечивая свободу движения в месте и рядом с участком, на котором располагается устройство. Анодный резервуар 26 для лекарственного средства и катодный резервуар 28 расположены со стороны контактирования устройства 10 с кожей и разделены на достаточное расстояние, чтобы исключить случайное электрозамыкание в процессе обычного обращения и использования.
Устройство 10 приклеивают к поверхности тела пациента (например, к коже) с помощью периферийного адгезива 30, который имеет верхнюю поверхность 34 и контактирующую с телом поверхность 36. Адгезивная поверхность 36 обладает свойствами адгезива, который обеспечивает фиксацию устройства 10 на теле в процессе нормальной активности пользователя, и все же позволяет удалить устройство приемлемым способом через предварительно определенный период использования (например, через 24 ч). Верхнюю поверхность 34 адгезива приклеивают к нижнему корпусу 20 и упомянутая поверхность удерживает электроды и резервуары для лекарственного средства внутри углублений 25, 25' корпуса, а также удерживает нижний корпус 20, присоединенный к верхнему корпусу 16. Устройство обычно снабжено также удаляемой (защитной) пленкой (не показана), которая в исходном состоянии присоединена к контактирующей с телом поверхности 36 адгезива 30 и которую удаляют перед приклеиванием на кожу пациента. Удаляемая пленка обычно является силиконизированным полиэтилентерефталатом, который также является совместимым с солью цетилпиридиния.
Кнопочный переключатель 12 расположен на верхней поверхности устройства 10 и легко активируется через одежду. Для доставки лекарственного средства предпочтительно используют двойное нажатие на кнопочный переключатель 12 в короткий промежуток времени, например в течение 3 с, с целью активации устройства 10. Таким образом сводится к минимуму случайная активация устройства 10.
После активации переключателя звуковой сигнал оповещает о начале доставки лекарственного средства, в момент которого к электродам/резервуарам подается предварительно определенный уровень постоянного тока в течение предварительно определенного интервала доставки (например, 10 мин). СИД 14 остается включенным в течение интервала доставки, указывая на то, что устройство 10 находится в активном режиме доставки лекарственного средства. Батарея предпочтительно имеет достаточную мощность для непрерывной подачи электроэнергии к устройству 10 при предварительно определенном уровне постоянного тока в течение всего периода использования (например, 24 ч). Интегральная схема 19 может быть сконструирована таким образом, чтобы предварительно определенное количество лекарственного средства доставлялось пациенту в течение предварительно определенного времени, затем устройство отключается до тех пор, пока переключатель не будет активирован снова и чтобы после введения предварительно определенного числа доз исключить возможность дальнейшей доставки несмотря на присутствие дополнительного лекарственного средства в донорном резервуаре.
Материал для катодного резервуара выбирают таким образом, чтобы он был совместимым с солью цетилпиридиния и чтобы антибактериальная эффективность соли цетилпиридиния внутри резервуара могла быть сохранена даже в течение долгосрочного периода, необходимого для перевозки и хранения или для хранения, перевозки и хранения перед использованием устройства для чрескожной доставки лекарственного средства электропереносом. Это означает, что материал, содержащий водную среду катодного резервуара, такой как нижний корпус устройства, показанный на чертеже выбирают таким образом, чтобы он не абсорбировал значительные количества соли цетилпиридиния, что снижает его антибактериальную эффективность в катодном резервуаре. Такой материал также может быть использован для удаляемой пленки (не показана), которая обычно расположена на контактирующей с телом поверхности 36 периферийного адгезива 30. Термин "совместимый", использованный в контексте настоящего изобретения, означает, что материал не абсорбирует значительное количество соли цетилпиридиния из водной среды в процессе хранения. Для определения совместимости полимерного материала с солью цетилпиридиния необходимо приготовить водный раствор соли цетилпиридиния в концентрации 0,1 мг/мл, погрузить образец полимера на период в четыре недели при 25°С и определить количество соли цетилпиридиния, абсорбированной полимерным материалом, с помощью ВЭЖХ. Полимерный материал можно считать совместимым с солью цетилпиридиния, если количество абсорбированной соли цетилпиридиния составляет менее 0,25 мг на 1 г полимерного материала, предпочтительно менее 0,10 мг на 1 г полимерного материала, наиболее предпочтительно менее 0,025 мг на 1 г полимерного материала.
Как было указано выше, подходящие полимерные материалы, которые могут быть использованы для изготовления катодного резервуара, включают полиэтилентерефталат, полиэтилентерефталат, модифицированный циклогександиметилолом, и их смеси. Предпочтительным материалом являются полиэтилентерефталат или полиэтилентерефталат, модифицированный циклогександиметилолом. Полимерные материалы могут быть сформированы в необходимую форму (например, в форму нижнего корпуса) методом горячего формования или любым другим подходящим способом.
Водная среда, содержащаяся в анодном резервуаре, может быть приготовлена в соответствии со стандартным методом. Например, если водная среда является композицией гидрогеля, она может содержать от приблизительно 10 до приблизительно 30 мас.% поливинилового спирта, от приблизительно 0,1 до приблизительно 0,4 мас.% буферного вещества и необходимое количество лекарственного средства, такого как соль фентанила или суфентанила, прежде всего гидрохлорид. Остальными компонентами являются вода и другие традиционные компоненты. Композиция гидрогеля может быть получена путем смешивания всех компонентов, включая соль фентанила или соль суфентанила, в одном сосуде при повышенной температуре от приблизительно 90 до приблизительно 95°С по крайней мере в течение 0,5 ч. Затем горячую смесь заливают в форму для формования пенопластов и хранят в замороженном виде при температуре приблизительно -35°С в течение периода (например, в течение ночи), достаточного для образования поперечных связей в поливиниловом спирте. После нагревания до температуры окружающей среды получают вязкий эластомерный гель, подходящий для заполнения анодного резервуара устройства для чрескожной доставки лекарственного средства электропереносом.
Водная среда, предназначенная для заполнения катодного резервуара, может быть приготовлена в соответствии с любым стандартным способом. Например, если водной средой является композиция гидрогеля, она может содержать от приблизительно 10 до приблизительно 30 мас.% поливинилового спирта и компоненты, такие как хлорид натрия, тринатрий цитрат, лимонная кислота и соль цетилпиридиния, в количествах, указанных ранее, причем остальное количество составляет вода. Композиция гидрогеля может быть получена посредством смешивания всех компонентов с использованием процедуры, описанной для получения композиции гидрогеля, которая используется в анодном резервуаре.
Различные аспекты настоящего изобретения будут очевидными из следующих примеров и примеров для сравнения. Следует, однако, понимать, что объем настоящего изобретения не ограничивается представленными вариантами воплощения изобретения, которые показаны в примерах.
Пример 1
Чтобы проиллюстрировать эффективность антибактериального действия соли цетилпиридиния по настоящему изобретению, готовят композиции катодного гидрогеля, содержащие 0,01, 0,02 и 0,03% хлорида цетилпиридиния, три штамма бактерий, один штамм дрожжей, один штамм плесневых грибов (эти микроорганизмы рекомендованы для проведения испытаний на эффективность антибактериального консервирующего действия) и штамм плесени из окружающей среды. В данном примере процентное содержание компонентов дано в массовых процентах (мас.%), если не указано иное. Жизнеспособность посевного материала (инокулята) в катодном гидрогеле определяют согласно инструкции Antimicrobial Effectiveness Test ("Проведение испытаний на эффективность антибактериального действия"), которая включена в текст заявки в качестве ссылки, и в соответствии с методами, описанными в фармакопее США (USP) (раздел 23<51> Antimicrobial Preservatives-Effectiveness ("Эффективность антибактериальных консервантов")), в британской фармакопее (ВР) (приложение XVI С Efficacy of Antimicrobial Preservation ("Эффективность антибактериальной защиты") и в европейской фармакопее (ЕР) (раздел VIII. 15 Efficacy of Antimicrobial Preservation ("Эффективность антибактериальной защиты")).
Используют следующие микроорганизмы:
Бактерии:
Staphylococcus aureus ATCC 6538
Eschenchia coli ATCC 8739
Pseudomonas aerugi№ sa ATCC 9027
Дрожжи:
Candida albicans ATCC 10231
Плесневые грибы:
Aspergillus niger ATCC 16404
Изолят окружающей среды:
Cladosporium sp. (изолят среды)
При испытании используют композиции следующего состава:
Для приготовления образцов композиции гидрогеля состава 1 в стеклянный стакан с рубашкой (объемом 250 мл) добавляют 80,28 г очищенной воды (USP), 0,10 г хлорида натрия (USP), 0,37 г тринатрий цитрата, 0,24 г лимонной кислоты и 0,01 г хлорида цетилпиридиния. Полученную смесь перемешивают в течение 5-10 мин с использованием стеклянного стержня до полного растворения солей. Затем добавляют 19,00 г отмытого поливинилового спирта и стакан закрывают резиновой пробкой, снабженной термоэлектрическим термометром и стеклянным стержнем с пропеллером из делрина. Смесь нагревают при перемешивании до 90-95°С и выдерживают при указанной температуре в течение приблизительно 60 мин. Горячий раствор поливинилового спирта охлаждают до приблизительно 60°С и переносят в полипропиленовый шприц объемом 60 мл. Полипропиленовый шприц с содержимым помещают в нагревательный блок из алюминия, предварительно нагретый до 60°С, а затем содержимым заполняют катодный корпус из ПЭТГ площадью 2,0 см2, содержащий электрод следующего состава (хлорид серебра/полиизобутилен/черный уголь) и электропроводящую липкую ленту, такую как самоклеющая лента, состоящая из полиизобутилена и черного угля. Затем заполненный корпус из ПЭТГ покрывают удаляемой (защитной) пленкой из полиэтилентерефталата (ПЭТ) и образцы выдерживают в холодильнике при -35°С в течение приблизительно 24 ч. Замороженные гидрогели нагревают до температуры окружающей среды, получая при этом катодный гидрогель, содержащий в качестве антибактериальной добавки хлорид цетилпиридиния. Величина рН катодного гидрогеля составляет 4,5.
Образцы гидрогеля состава 2 и 3 готовят аналогичным способом за исключением того, что содержание каждого из компонентов соответствует данным, приведенным в таблице.
Испытания проводят с использованием следующих сред:
- Триптиказа + соевый соус + агар (ТСА) в воде/лецитин и полисорбат 80, код №0553-17-2 (фирма Difco), или эквивалентная среда.
- Среда сабуро+декстроза + агар (СДА), код №0305-17-3 (фирма Difco), или эквивалентная среда.
- Триптиказа + соевый соус + агар (ТСА), код №11043 (фирма BBL), или эквивалентная среда.
- Фосфатный буфер, код №11544 (фирма BBL), или эквивалентная среда с добавлением 0,1% полисорбата 80, код №11925 (фирма BBL), или эквивалентная среда.
Приготовление стандартного посевного материала
Суспензию посевного материала (инокулята) готовят для каждого из шести исследованных микроорганизмов по стандартной методике и используют культуры, перенесшие не более пяти пассажей. Суспензию доводят до концентрации приблизительно 1,0×108 колониеобразующих единиц (КОЕ)/мл по стандартной методике. Непосредственно перед посевом концентрацию посевного материала подтверждают методом разведений в чашках (см. описание в издании "Фармакопея США", 1995 и в книге "Biology of Microorganisms" ("Биология микроорганизмов"), 3 издание, 1979, которые включены в текст заявки в качестве ссылки).
Метод разведений в чашках в среде триптиказа + соевый соус + агар (ТСА) используют при работе с бактериями, а в среде сабуро + декстроза + агар (СДА) - при работе с дрожжами и плесневыми грибами. Чашки с ТСА инкубируют при 30-35°С в течение 48-72 ч. Чашки с СДА, инокулированные А. niger, инкубируют при 20-25°С в течение 3 суток. Чашки с СДА, инокулированные С. albicans и видом Cladosporium, инкубируют при 20-25°С в течение 5-7 суток. После инкубации подсчитывают число колоний. Среднее число колоний, определенное по трем чашкам, умножают на фактор разведения, получая число микроорганизмов в системе.
Методика проведения испытаний образцов
Для проведения испытаний с корпусов резервуара в асептических условиях снимают удаляемую пленку. В каждый образец гидрогеля вносят 6 мкл суспензии микроорганизма (приблизительно 6,0×105 КОЕ/корпус). Непосредственно после инокуляции корпус вновь покрывают удаляемой пленкой и инокулированный корпус возвращают в исходный блок, который герметизируют с помощью термосклеивания. Склеенные блоки с инокулированными корпусами инкубируют при 20-25°С.
Инокулированные корпуса анализируют в трех повторах в точки времени 0 ч, 2, 7, 14, 21 и 28 суток после инокуляции. Процедуру повторяют с каждым из шести исследованных микроорганизмов. Для оценки образцов каждый гидрогель анализируют: извлекают его из блока и корпуса, помещают в пробирку с завинчивающейся крышкой, содержащую 5,4 мл фосфатного буферного раствора, включающего 0,1% полисорбата 80. Каждую пробирку перемешивают на мешалке вортекс в течение 2 мин. При тестировании микроорганизмов используют метод разведений в чашках, при этом серийные разведения экстракта высевают на среду ТСА с лецитином и полисорбатом 80 для всех видов бактерий, при тестировании дрожжей и плесневых грибов - на среду СДА. Затем чашки инкубируют и анализируют, как указано выше.
Результаты испытаний, приведенные в таблицах 1-3, свидетельствуют о том, что композиции катодного гидрогеля, содержащие 0,01, 0,02 и 0,03% хлорида цетилпиридиния, соответствуют необходимым критериям эффективности антибактериального консервирующего действия, представленным в Фармакопее США (глава 23 "Микробиологические испытания", раздел <51>. "Эффективность антибактериального действия консервантов"), которые заключаются в следующем: 1) концентрация жизнеспособных бактерий должна уменьшаться минимум на 3 логарифма через 14 суток и после этого не возрастать, 2) концентрация жизнеспособных дрожжей и плесневых грибов сохраняется неизменной или становится меньше исходных концентраций на протяжении всего 28 суточного исследования.
При всех трех концентрациях хлорида цетилпиридиния количество жизнеспособных клеток для всех исследованных бактерий и дрожжей снижается на второй день испытаний до уровня ниже предела детектирования, который составляет 10 КОЕ/корпус. При концентрации 0,03% хлорида цетилпиридиния количество жизнеспособных клеток плесневых грибов на второй день также снижается до уровня менее 10 КОЕ/корпус. При концентрации хлорида цетилпиридиния 0,02% через двое суток выживает менее 0,1% клеток А. niger, а концентрация клеток Cladosporium sp. снижается до уровня ниже 10 КОЕ/корпус. При концентрации хлорида цетилпиридиния 0,01% через 14 суток концентрация клеток А. niger снижается до уровня ниже 10 КОЕ/корпус, a Cladosporium sp. - до уровня ниже 0,1%.
Дальнейший анализ результатов экспериментов показывает, что композиции катодного гидрогеля, содержащие 0,01, 0,02 и 0,03% хлорида цетилпиридиния, также соответствуют критериям эффективности антибактериального консервирующего действия препаратов для местного применения, представленных в Британской Фармакопее, которые заключаются в следующем: 1) концентрация жизнеспособных бактерий должна уменьшаться минимум на 3 логарифма через 48 ч и не восстанавливаться через 7 суток или после этого и 2) концентрации жизнеспособных грибов снижаются минимум на два логарифма через 14 суток и не увеличиваются через 28 суток.
Кроме того, катодные композиции гидрогеля, содержащие 0,01, 0,02 и 0,03% хлорида цетилпиридиния, также соответствуют критериям эффективности консервантов для местных препаратов, представленных в Разделе А Европейской Фармакопеи, которые заключаются в следующем: 1) концентрация жизнеспособных бактерий уменьшается минимум на 2 логарифма и 3 логарифма через 2 суток и через 7 суток соответственно и не возрастает после этого и 2) концентрация жизнеспособных грибов снижается минимум на два логарифма через 14 суток и не увеличивается через 28 суток.
Пример 2
Чтобы дополнительно проиллюстрировать эффективность антибактериального действия соли цетилпиридиния по настоящему изобретению, готовят композиции катодного гидрогеля, содержащие 0,08% хлорида цетилпиридиния и включающие различные микроорганизмы, в том числе бактерии, дрожжи и плесневые грибы. Использованные микроорганизмы включают S. aureus, E. coli, P. aerugi№ sa, С. albicans и A. niger, а также 4 изолята грибов из окружающей среды. Используют стандартные методы, приведенные выше и описанные в Фармакопее США, Британской Фармакопее и Европейской Фармакопее.
Используют следующие микроорганизмы:
Бактерии:
S. aureus ATCC 6538
Е. соli ATCC 8739
Р. aeruginosa ATCC 9027
Дрожжи:
С. albicans ATCC 10231
Плесневые грибы:
A. niger ATCC 16404
Изоляты окружающей среды:
Penicillium sp. (изолят окружающей среды)
Cladosporium sp. (изолят окружающей среды)
Aspergillus sp. (изолят окружающей среды)
Cryptococcus albidus (изолят окружающей среды)
Композиция 4 имеет следующий состав:
Очищенная вода (USP) (84,21%), отмытый поливиниловый спирт (15,00%), лимонная кислота (USP) (0,24%), тринатрий цитрат дигидрат (USP) (0,37%), хлорид натрия (USP) (0,10%), хлорид цетилпиридиния (0,08%), рН 4,5.
Образцы композиции готовят, как описано выше в примере 1.
В эксперименте используют следующие среды:
- Триптиказа + соевый соус + агар (ТСА) с лецитином и полисорбатом 80, код №4311764 (фирма BBL), или эквивалентная среда.
- Среда сабуро + декстроза + агар (СДА), код №4311584 (фирма BBL), или эквивалентная среда.
- Триптиказа + соевый бульон (TSB), код №4311768 (фирма BBL), или эквивалентная среда.
- Солевой раствор + триптиказа + соевый соус (TS), содержащий 0,05% полисорбата 80.
- Жидкость А (USP): 0,1% бактопептамин, код №0905-01 (фирма Difco), или эквивалентная среда.
- Жидкость D (USP): 0,1% бактопентамин, код №0905-01 (фирма Difco), или эквивалентная среда.
- 0,1% полисорбат 80, код №х257-07 (фирма Difco), или эквивалентная среда.
Стандартизация исследованного посевного материала
Микробные культуры готовят, как описано в Фармакопеях США, Британии и Европы. Прежде всего культуры бактерий культивируют в среде TSB и инкубируют при 30-35°С в течение 18-24 ч, культуры дрожжей (С. albicans и Cryptococcus albidus) культивируют в среде TSB и инкубируют при 20-25°С в течение 48 ч при встряхивании (аэрируют для получения более высокой концентрации). После инкубирования суспензию каждой культуры промывают центрифугированием при 10000 об/мин при 4°С в течение 10 мин. Затем культуры дважды промывают стерильной дистиллированной водой и осадок суспендируют в стерильной воде. Концентрацию в полученной суспензии определяют турбидиметрически, регистрируя поглощение света при 530 нм. Концентрацию в суспензии доводят до приблизительно 108 колониеобразующих единиц (КОЕ) в миллилитре и непосредственно после этого используют в эксперименте.
Споры плесневых грибов выращивают, как описано в Фармакопее США. Прежде всего, культуры A. niger, Cladosporium sp., Aspergillus sp. и Penicillium sp. выращивают на поверхности чашек со средой СДА при 20-25°С в течение недели или до наступления обильной споруляции. После инкубирования каждую культуру собирают в стерильный солевой раствор TS, содержащий 0,05% полисорбата 80. Величину КОЕ/мл определяют методом разведений в чашках в среде СДА. Концентрацию спор доводят до приблизительно 108 КОЕ/мл.
Методика проведения испытаний
Образцы инокулируют по следующей методике, общей для всех микроорганизмов. 30 образцов композиций гидрогеля в стерильных условиях с использованием асептической техники помещают в чашки Петри диаметром 45 мм (по одному образцу геля в чашку). С образцов снимают защитную удаляемую пленку и хранят в чашках Петри в асептических условиях. Каждый корпус инокулируют тремя аликвотными частями суспензии микроорганизмов по 3 мкл (приблизително 106 КОЕ/корпус). Концентрацию в посевном материале определяют методом разведений в чашках в начале, середине и в конце процедуры инокуляции. Непосредственно после инокуляции чашки Петри с инокулированными корпусами помещают в их исходные мешочки, ламинированные фольгой для защиты образцов от света и предохранения от потери влаги. Избыток воздуха в мешочках из фольги удаляют, слегка сжимая мешочек с обеих сторон, при этом следят за тем, чтобы стенки мешочков не контактировали с посевным материалом на поверхности гидрогелей. Мешочки запаивают с помощью устройства для термоэлектрического запаивания. Через 24 ч каждый мешочек надрезают и удаляемую пленку помещают на инокулированную поверхность каждого образца (имитируя условия хранения), после чего мешочек вновь запаивают с помощью устройства для термоэлектрического запаивания. Запаянные мешочки с инокулированными корпусами хранят при 20-25°С в течение 28 суток. По пять инокулированных каждой тест-культурой корпусов вскрывают через 2, 7, 14, 21 и 28 суток после инокуляции.
Для проведения анализа каждый из пяти инокулированных корпусов с удаляемой пленкой извлекают из мешочков и помещают в пять пробирок с завинчивающейся крышкой, каждая из которых содержит по 20 мл жидкости D (USP). Пробирки с образцами и удаляемой пленкой помещают на горизонтальную качалку и содержимое перемешивают при 200 об/мин в течение 30 мин. Затем пробирки вынимают из качалки и интенсивно перемешивают на мешалке вортекс в течение 1 мин. Готовят серию десятикратных разведений для содержимого каждой пробирки и аликвоты культивируют методом разведений в чашках в 20-30 мл питательной среды: ТСА с лецитином и полисорбатом 80 для бактерий и СДА для грибов. Культуры бактерий инкубируют при 30-35°С в течение 48 ч, а культуры грибов - при 20-25°С в течение 3-5 суток.
Результаты приведены в таблице 4. Как следует из таблицы 4, после выдерживания в течение двух суток и в последующие дни количество жизнеспособных бактерий S. aureus, E. coli и Р. aerugi№ sa, а также жизнеспособных дрожжевых клеток С. albicans и Cryptococcus albidus (изолят окружающей среды) на поверхности инокулированных образцов снижается до уровня менее 10 КОЕ/корпус (снижение более чем на 4 логарифма), что означает предел максимальной чувствительности метода анализа. Количество жизнеспособных клеток A. niger изолятов окружающей среды (Cladosporium sp., Penicillium sp. и Aspergillus sp.) на инокулированных образцах снижается более чем на три логарифма на вторые сутки и не возрастает через 28 суток. Результаты испытаний показывают, что композиция катодного гидрогеля, содержащая 0,08% хлорида цетилпиридиния, соответствует критериям эффективности антибактериальной консервирующей активности, представленным, как упоминалось выше, в Фармакопеях США, Британии и Европы.
Примеры для сравнения
Для сравнения в таблицах 5 и 6 представлены результаты испытаний в течение 12 месяцев образцов гидрогеля (для композиций, описанных ниже в каждой таблице), не содержащих хлорида цетилпиридиния. Как видно в таблицах, в этих композициях наблюдается рост грибов.
Пример 3
Чтобы проиллюстрировать совместимость хлорида цетилпиридиния с полиэтилентерефталатом, модифицированным циклогександиметилолом (производства фирмы Easan Chemical Products, Inc. под торговым названием KODAR® ПЭТГ сополи(сложный эфир)6763) с использованием композитного катодного электрода, состоящего из полиизобутилена (ПИБ), угля и хлорида серебра, готовят следующую композиция гидрогеля (табл.7).
Для приготовления композиции в стеклянный стакан с рубашкой (объемом 250 мл) добавляют 84,2 г очищенной воды (USP), 0,24 г лимонной кислоты, 0,37 г тринатрий цитрата дигидрата, 0,10 г хлорида натрия и 15,0 г отмытого поливинилового спирта. Стакан закрывают резиновой пробкой, снабженной вводным отверстием для азота, воронкой для сыпучих веществ, термоэлектрическим термометром и стержнем из нержавеющей стали с пропеллером из делрина. Смесь перемешивают (мешалка Arrow 850, положение регулятора от 1 до 2) при нагревании до 90-95°С и выдерживают при этой температуре в течение 70 мин. Раствор поливинилового спирта в цитратном буфере охлаждают до 50°С, в стакан добавляют 0,075 г хлорида цетилпиридиния и перемешивают в течение 15 мин, после чего хлорид цетилпиридиния полностью растворяется. Раствор полимера переносят в полипропиленовый шприц объемом 60 мл, предварительно нагретый до 55°С в нагревательном блоке из алюминия, и с помощью дозирующего устройства для мазей Multicore распределяют по нижним корпусам из ПЭТГ, изготовленным термическим формованием (которые содержат композитный катод, состоящий из 29 мас.% полиизобутилена, 2,5 мас.% угля и 68 мас.% хлорида серебра и имеют плотность поверхности приблизительно 0,35 мг/см2). Заполненные образцы композиции катодного гидрогеля покрывают удаляемой пленкой из силиконизированного полиэтилентерефталата, заполненные системы выдерживают в холодильнике при -20°С в течение 18 ч, а затем нагревают на рабочем столе до температуры окружающей среды. Образцы сшитого геля, корпус из полимерного материала и удаляемую пленку из полиэтилентерефталата взвешивают и по отдельности герметично упаковывают в мешочки из ламинированной фольги Surlyn.
Образцы композиции катодного гидрогеля извлекают из мешочков после хранения при 4, 25 и 40°С в течение 1, 4, 8, 12, 24 и 48 недель. Образцы композиции катодного гидрогеля экстрагируют мобильной фазой, вода (60%)/ацетонитрил (40%) и определяют содержание хлорида цетилпиридиния (ХЦП) методом ВЭЖХ. Результаты испытания представлены в таблице 8.Для более полной оценки полученных результатов следует отметить, что масса катодного гидрогеля равна 0,64 г. Следовательно, содержание хлорида цетилпиридиния (если принять, что концентрация ХЦП=0,075 мас.%) составляет 0,48 мг/г геля или 0,75 мг/г геля. Через 48 недель хранения при 4, 25 и 40°С концентрация ХЦП в катодном гидрогеле уменьшается до 0,055, 0,053 и 0,043 мас.% соответственно. Концентрация ХЦП в блоке катодного гидрогеля через 48 недель хранения при 4, 25 и 40°С составляет 0,55, 0,53 и 0,43 мг/г гидрогеля. Количество потерь ХЦП на композитном катоде через 48 недель хранения при 4, 25 и 40 составляет 0,20, 0,22 и 0,32 мг/г гидрогеля соответственно. Площадь композитного катода из AgCl/ПИБ равна 2,33 см2. Количество потерь ХЦП через 48 недель хранения при 4, 25 и 40°С, приходящееся на 1,0 см2 композита AgCl/ПИБ, согласно расчету составляет 0,086, 0,094 и 0,137 мг/г гидрогеля/см2 композита соответственно.
Последующие опыты по экстракции показали, что хлорид цетилпиридиния преимущественно поглощается композитным катодом. Как отмечалось выше, возможным решением в этом случае является расположение анионообменной мембраны, такой как анионобменная мембрана SYBRON® или RAIPORE®, между электродом и содержимым резервуара с тем, чтобы катионы цетилпиридиния задерживались мембраной и не попадали на катодный электрод.
Исследование абсорбции ХЦП на полимерных материалах
Для исследования абсорбции ХЦП и бензилхлорида на дополнительных полимерных материалах готовят два набора растворов. В первом наборе растворы образцов содержат 0,01% хлорида натрия, 0,24% лимонной кислоты, 0,37% цитрата натрия, 0,03% бензойной кислоты (БК) и 76% воды. Концентрация БК в данном случае составляет 397 мкг/мл, что является верхним пределом определения БК в данном эксперименте, но составляет лишь 1/10 от концентрации БК, которая обычно используется в композициях гидрогеля.
Другой набор представляет собой водный раствор ХЦП с концентрацией 58,1 мкг/мл, что находится приблизительно в середине исследуемого диапазона концентраций ХЦП.
Исследуют абсорбцию на следующих полимерных материалах:
ЕХХ-216 полипропилен с наполнителем ТiO2 (производства фирмы Еххоn Chemical Co.);
ЕХХ-210 полипропилен (толщиной 0,1 мм);
ACLAR слоистый материал из полимера Techniplex, включающий 0,13 мм поливинилхлорида (ПВХ)/0,05 мм полиэтилена/0,15 мм ACLAR® (фторгалогенуглеродная пленка).
Для проведения испытаний 150 см2 исследуемого материала нарезают на мелкие кусочки и погружают в 50 мл приготовленного раствора. По одному образцу каждого материала хранят в стеклянном сосуде для экстракции объемом 100 мл при 25°С, второй образец хранят при 40°С. Поскольку ожидается, что две стороны исследуемого трехслойного материала (одна сторона - ПВХ, вторая сторона - ACLAR®) будут отличаться по свойствам, готовят второй набор образцов из двух отрезков проводящей адгезивной пленки, ламинированных с двух сторон исследуемым материалом ACLAR®, таким образом, чтобы с исследуемым раствором контактировала только сторона, покрытая ACLAR®.
Поскольку проводящая адгезивная лента также может абсорбировать антибактериальные агенты, готовят контрольный образец, помещая адгезивную пленку между предметными стеклами для микроскопа. Другой контрольный образец представляет собой обычные предметные стекла. Все образцы обрабатывают испытываемыми растворами при одинаковом отношении площади исследуемой поверхности образца к объему раствора в мл. Все образцы, полученные с использованием проводящей адгезивной пленки, имеют приблизительно одинаковую площадь поверхности, приходящуюся на мл раствора.
Сосуды с образцами взвешивают и хранят при 25 и 40°С в течение 8 недель. Через интервалы времени, равные 1 сутки, 1 неделя, 2 недели, 4 недели, 8 недель, образцы уравновешивают при комнатной температуре и взвешивают. Образцы, потерявшие при предварительном хранении более 0,1 г, доводят до исходного веса, добавляя воду перед проведением испытаний. Выдерживают небольшие образцы, чтобы свести к минимуму воздействие в оставшихся точках времени. Новые значения массы регистрируют каждый раз перед продолжением испытаний в камерах. В завершении эксперимента образцы извлекают из раствора для визуального осмотра.
Результаты испытаний приведены в таблице 9. В таблице термин "ACLAR (прозрачный)" относится к образцам ACLAR, полностью погруженным в раствор. "Aclar (ламинированный)" относится к ACLAR, ламинированному на проводящую адгезивную пленку таким образом, что только одна его сторона контактирует с раствором. Аналогичные обозначения приняты для образцов с предметными стеклами. Кроме того, следует заметить, что испытания с бензойной кислотой заканчивают через 4 недели, так как для любых образцов при любой температуре не наблюдаются изменения концентрации.
Из результатов испытаний и визуальных наблюдений видно, что для всех испытанных материалов наблюдается некоторое уменьшение содержания ХЦП по сравнению с контролем. Наибольшие потери наблюдаются в контрольных образцах, содержащих предметные стекла. Аналогичные результаты получены при испытании одних стекол и стекол с адгезивной проводящей пленкой.
Дополнительные данные по абсорбции из катодных растворов, содержащих ХЦП, получены для полипропилена с тальком в качестве наполнителя, ПЭТГ и удаляемой пленки из силиконизированного ПЭТ.
В эксперименте используют следующие растворы и образцы полимеров:
Приготовление катодного раствора (1,0 мг/м ХЦП)
В мерную колбу объемом 1000 мл добавляют 1,379 г лимонной кислоты, 6,321 г дигидрата тринатрий цитрата, 1,149 г хлорида натрия и 1,0 г ХЦП. Колбу заполняют до отметки водой, очищенной в системе миллипор, и перемешивают в течение приблизительно 15 мин до полного растворения солей.
Приготовление катодного раствора (0,1 мг/мл ХЦП)
В мерную колбу объемом 500 мл добавляют 50 мл раствора с концентрацией ХЦП 1,0 мг/мл с помощью пипетки на 50 мл. Колбу заполняют до отметки водой, очищенной в системе миллипор, и содержимое перемешивают до получения гомогенного раствора.
Приготовление образцов ХЦП/полипропиден + тальк
Из листа полипропилена с тальком в качестве наполнителя (выпускаемого под названием Proprint) вырезают штамповкой диски площадью 2 см2. В каждый стеклянный флакон помещают по 24 диска. Масса 24 дисков составляет приблизительно 1,0 г. В каждый флакон пипеткой отмеряют по 2 мл соответствующего раствора. Для каждого раствора готовят 18 образцов. Во всех флаконах регистрируют начальную массу (t=0). Образцы хранят в камере под воздействием окружающей среды при 25°С.
Приготовление образцов ХЦП/ПЭТГ
В каждый флакон для микробиологических сред объемом 125 мл добавляют приблизительно 9,5 г нижних корпусов из голубого трехслойного материала. Корпуса разрезают на небольшие кусочки, чтобы они проходили через горловину флакона. В каждый флакон добавляют 16,6 мл соответствующего раствора ХЦП. Для каждой концентрации раствора готовят по три образца. Регистрируют начальную массу (t=0) материала ПЭТГ, помещенного в каждый раствор. Затем образцы перемешивают на качалке при температуре окружающей среды.
Приготовление образцов ХЦП/ПЭТ
В каждый флакон для микробиологических сред объемом 125 мл добавляют приблизительно 8,2 г удаляемой пленки из силиконизированного ПЭТ. Удаляемую пленку разрезают на небольшие кусочки, чтобы они проходили через горловину флакона. В каждый флакон добавляют 16,6 мл соответствующего раствора ХЦП. Для каждой концентрации раствора готовят по три образца. Регистрируют начальную массу (t=0) материала ПЭТ, помещенного в каждый раствор. Затем образцы перемешивают на качалке при температуре окружающей среды.
Приготовление контрольных растворов
В экспериментах на совместимость в качестве контрольных растворов используют исходные растворы ХЦП, которые хранят в стеклянных мерных колбах при температуре окружающей среды.
Контрольные растворы ХЦП и испытуемые образцы извлекают из тест-камер, находящихся под воздействием окружающей среды, и качалки через 24 ч, 1, 2, 4, 8 и 16 недель. Образцы материала Prоprint взвешивают, чтобы определить потерю воды за счет испарения. Если наблюдается потеря воды, то в сосуд добавляют воду до достижения массы, соответствующей предыдущему взвешиванию. После анализа образцы ПЭТ и ПЭТГ вновь запаивают и помещают на качалку, образцы материала Prоprint после анализа отбрасывают. Из растворов отбирают пробы, в которых определяют содержание ХЦП методом ВЭЖХ.
Результаты, приведенные в таблицах 10 и 11, отражают фактическое количество ХЦП, абсорбированного одним граммом субстрата. Эти величины определяют, рассчитывая потерю ХЦП в мг на мл раствора. Для получения суммарной потери ХЦП найденную величину умножают на общий объем раствора. Суммарную потерю ХЦП делят на общую массу субстрата, получая величину потери ХЦП в мг на г полимера.
Пример 4
Для иллюстрации совместимости ХЦП с композитным катодом (хлорид серебра/уголь) и другими материалами корпуса готовят и испытывают катодный гидрогель. Для приготовления катодного гидрогеля 3,0 г L-гистидина и 148,84 г очищенной воды (USP) добавляют в стеклянный стакан с рубашкой объемом 250 мл. В стакан помещают магнитный перемешивающий стержень с тефлоновым покрытием и перемешивают до полного растворения L-гистидина. В полученный раствор погружают электрод рН-метра и рН доводят до 4,5 добавлением концентрированной соляной кислоты (1,968 г). Затем добавляют дополнительное количество очищенной воды (8,032 г) (USP) и получают 200 г смеси. Из стакана с рубашкой извлекают перемешивающий стержень, добавляют 38,0 г отмытого поливинилового спирта, после чего стакан закрывают резиновой пробкой, снабженной термоэлектрическим термометром и стеклянным стержнем с пропеллером из делрина. Смесь нагревают при перемешивании до 90°С и выдерживают при указанной температуре в течение 70 мин. Раствор поливинилового спирта охлаждают до 60°С и добавляют в стакан с рубашкой 0,16 г ХЦП. Смесь перемешивают в течение приблизительно 10 мин до полного растворения ХЦП. Полученный раствор переносят в полипропиленовый шприц объемом 60 мл, предварительно нагретый в блоке из алюминия до 60°С, и с помощью дозирующего устройства для мазей (Multicore) распределяют по нижним корпусам, изготовленным из полипропилена с тальком в качестве наполнителя (выпускаемого под названием Prоprint). Заполненные катодным гелем резервуары покрывают удаляемой пленкой из силиконизированного полиэтилентерефталата и заполненные системы выдерживают в холодильнике при -20°С в течение 18 часов, при 4°С в течение 2 ч, после чего нагревают до температуры окружающей стреды. Сшитый гидрогель извлекают из резервуара и взвешивают, определяя начальную массу. В катодном гидрогеле начальная величина рН 4,53. Образцы по отдельности герметично упаковывают в мешочки из ламинированной фольги Surlyn и хранят при 40°С.
Гидрогели извлекают из нижних корпусов через 1, 4, 8, 12, 32 и 56 недель и экстрагируют мобильной фазой вода (60%)/ацетонитрил (40%). Концентрацию ХЦП определяют методом ВЭЖХ (ААМ 1,443). Отдельно экстрагируют детали нижнего корпуса с целью определения количества ХЦП, диффундирующего в материал корпуса. Полученные результаты приведены в таблице 12.
Хотя настоящее изобретение представлено в виде наиболее предпочтительных вариантов его осуществления, представляется очевидным, что специалистами в данной области могут быть реализованы его модификации и вариации, не выходящие за пределы объема притязаний изобретения, как это определено в пунктах формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ ДЛЯ ЧРЕСКОЖНОЙ ДОСТАВКИ КАТИОННЫХ ДЕЙСТВУЮЩИХ ВЕЩЕСТВ | 2009 |
|
RU2517241C2 |
| УСТРОЙСТВО ДЛЯ ТРАНСДЕРМАЛЬНОГО ЭЛЕКТРОТРАНСПОРТНОГО ВВЕДЕНИЯ, СОДЕРЖАЩЕЕ РЕЗЕРВУАР С ПРОТИВОМИКРОБНОЙ СОВМЕСТИМОЙ КОМПОЗИЦИЕЙ | 2002 |
|
RU2290216C2 |
| ДВУХМОДУЛЬНОЕ УСТРОЙСТВО ЭЛЕКТРОПЕРЕНОСА | 2012 |
|
RU2564084C2 |
| САМОТЕСТИРОВАНИЕ ДЛЯ ОБЕЗБОЛИВАЮЩЕГО СРЕДСТВА | 2013 |
|
RU2629242C2 |
| УПРАВЛЕНИЕ ТОКОМ ДЛЯ ЭЛЕКТРОПЕРЕНОСА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2013 |
|
RU2637560C2 |
| СИСТЕМА ДЛЯ ЧРЕСКОЖНОЙ ОТДАЧИ ДЕЙСТВУЮЩЕГО ВЕЩЕСТВА | 2014 |
|
RU2687090C1 |
| ЧРЕСКОЖНОЕ ВВЕДЕНИЕ СОЕДИНЕНИЙ ПИПЕРАЗИНИЛ-2 (3Н)-БЕНЗОКСАЗОЛОНА ПОСРЕДСТВОМ ЭЛЕКТРОФОРЕЗА | 2005 |
|
RU2371179C2 |
| КОМПОЗИЦИЯ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2010 |
|
RU2589823C2 |
| СРЕДСТВО ДЛЯ ЧРЕСКОЖНОГО ВВЕДЕНИЯ НИКОТИНА | 2005 |
|
RU2334507C2 |
| УПАКОВКА ДЛЯ СИСТЕМЫ ЧРЕСКОЖНОЙ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА (ВАРИАНТЫ) | 2002 |
|
RU2301185C2 |
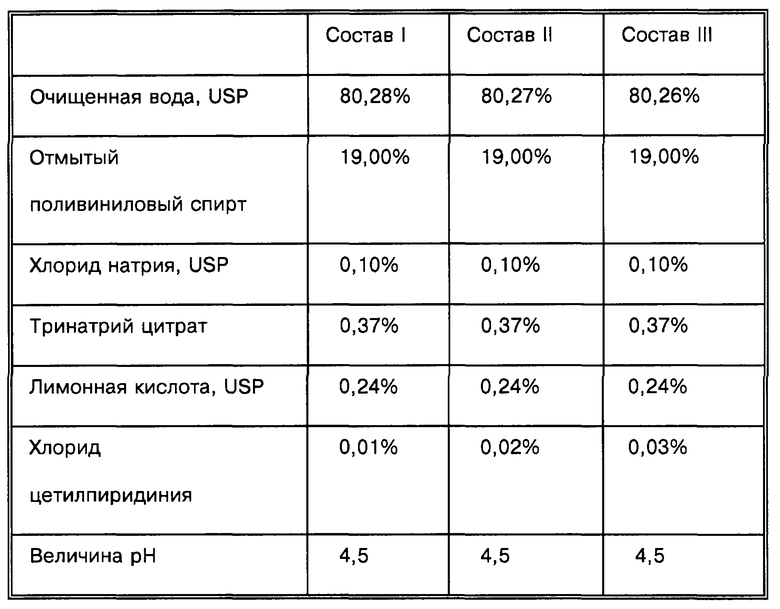
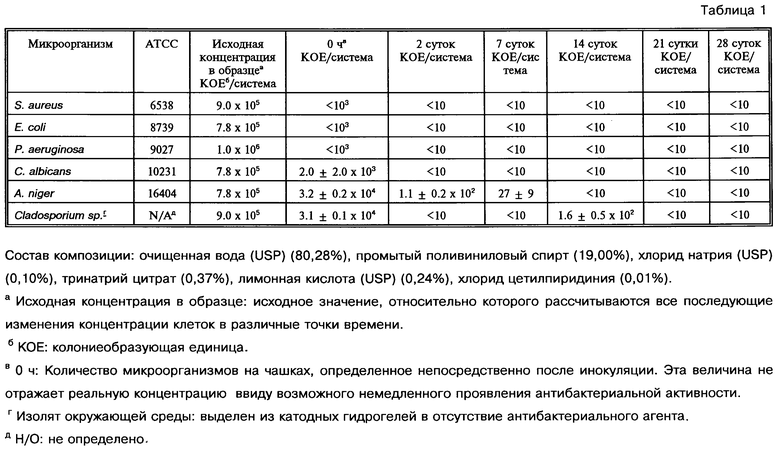












Изобретение относится к области медицины, а именно к устройству и способу доставки лекарственных средств посредством диффузии через эпидермис. Устройство для чрескожной доставки лекарственного средства электропереносом включает анод, катод и источник электроэнергии, электрически присоединенный к катоду и аноду. Катод включает в себя катодный электрод и катодный резервуар. Резервуар содержит корпус, выполненный из полимерного материала, и водную среду, контактирующую с корпусом. Водная среда включает лекарственное средство или соль-электролит, или их смесь и соль цетилпиридиния в количестве, достаточном для подавления роста микроорганизмов в водной среде. Полимерный материал является совместимым с солью цетилпиридиния. В способе переноса при подаче электрического тока от источника электроэнергии осуществляется чрескожная доставка пациенту лекарственного средства из анодного резервуара посредством чрезкожной диффузии и при этом не происходит чрескожной доставки пациенту соли цетилпиридиния из катодного резервуара. Устройство и способ позволяют обеспечить эффективную доставку лекарственного средства в форме, которая может быть заряжена, не заряжена или содержать смесь заряженных или незаряженных молекул. Устройство и способ позволяют предотвратить абсорбцию цетилпиридиния полимерным материалом корпуса, снижающую его антибактериальную эффективность внутри резервуара, а также позволяют обеспечить длительный срок хранения устройства. 3 н. и 22 з.п. ф-лы, 13 табл., 1 ил.

| US 5668120 А, 16.09.1997 | |||
| US 5647844 А, 15.06.1997 | |||
| US 5582587 А, 09.05.1994 | |||
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
Авторы
Даты
2004-07-20—Публикация
1999-10-29—Подача