Область, к которой относится изобретение
Настоящее изобретение относится к вирулентным генам и белкам и к их применению. Более конкретно, настоящее изобретение относится к генам и белкам/пептидам, полученным из Neisseria meningitidis, и к их применению в терапии и в скрининге лекарственных средств.
Предпосылки создания изобретения
Neisseria meningitidis представляет собой грам-отрицательный бактериальный патоген, который вызывает септический шок и бактериальный менингит. Эта бактерия является основным возбудителем бактериального менингита в развитых странах и причиной широкомасштабных эпидемий в Африке и Китае. В Великобритании Neisseria meningitidis является главной после дорожно-транспортных происшествий причиной смертности детей. Эта бактерия обычно заселяет носоглотку человека, а затем попадает в кровоток, где она вызывает тяжелый сепсис или менингит. Хотя современные антимикробные средства являются эффективными для элиминации бактерий из организма, однако смертность от менингококкового сепсиса все еще остается высокой. Поэтому необходима разработка новых средств для лечения или предупреждения состояний, вызываемых Neisseria meningitidis, например, путем иммунизации.
Краткое описание изобретения
Настоящее изобретение основано на обнаружении генов вирулентности в Neisseria meningitidis.
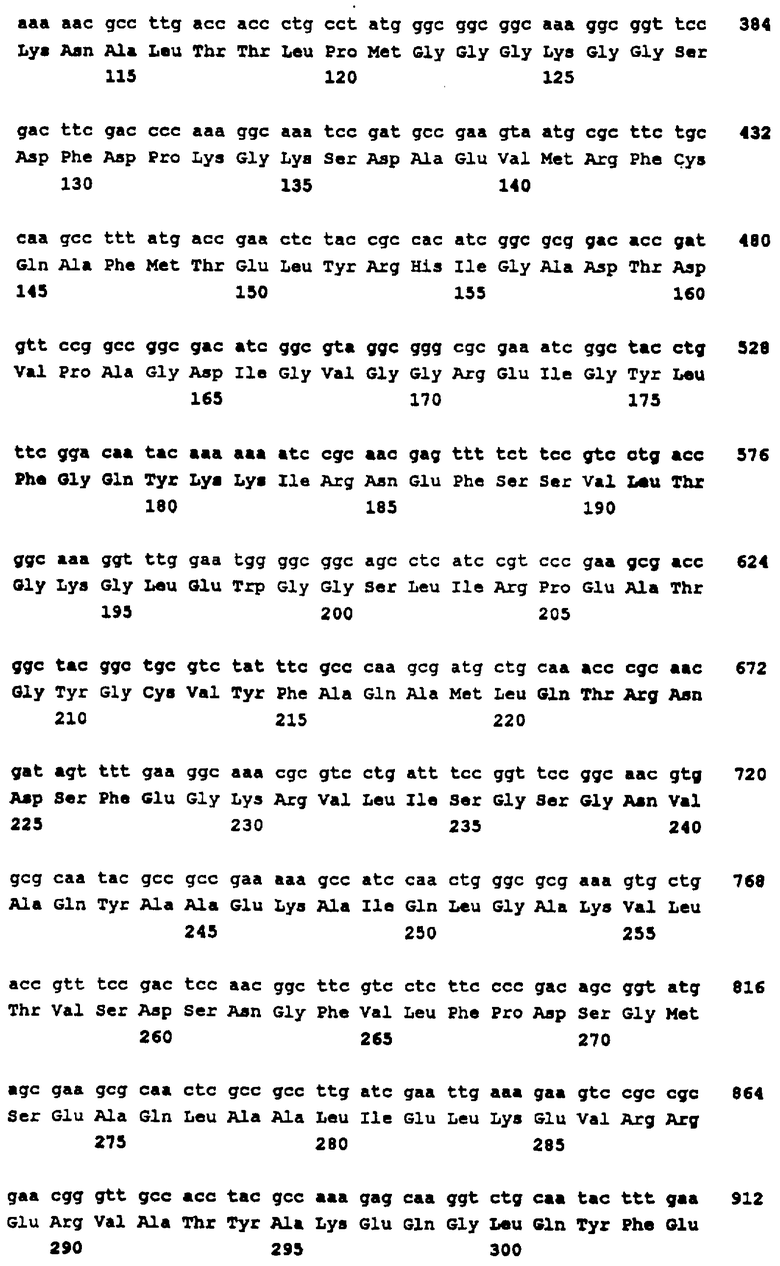
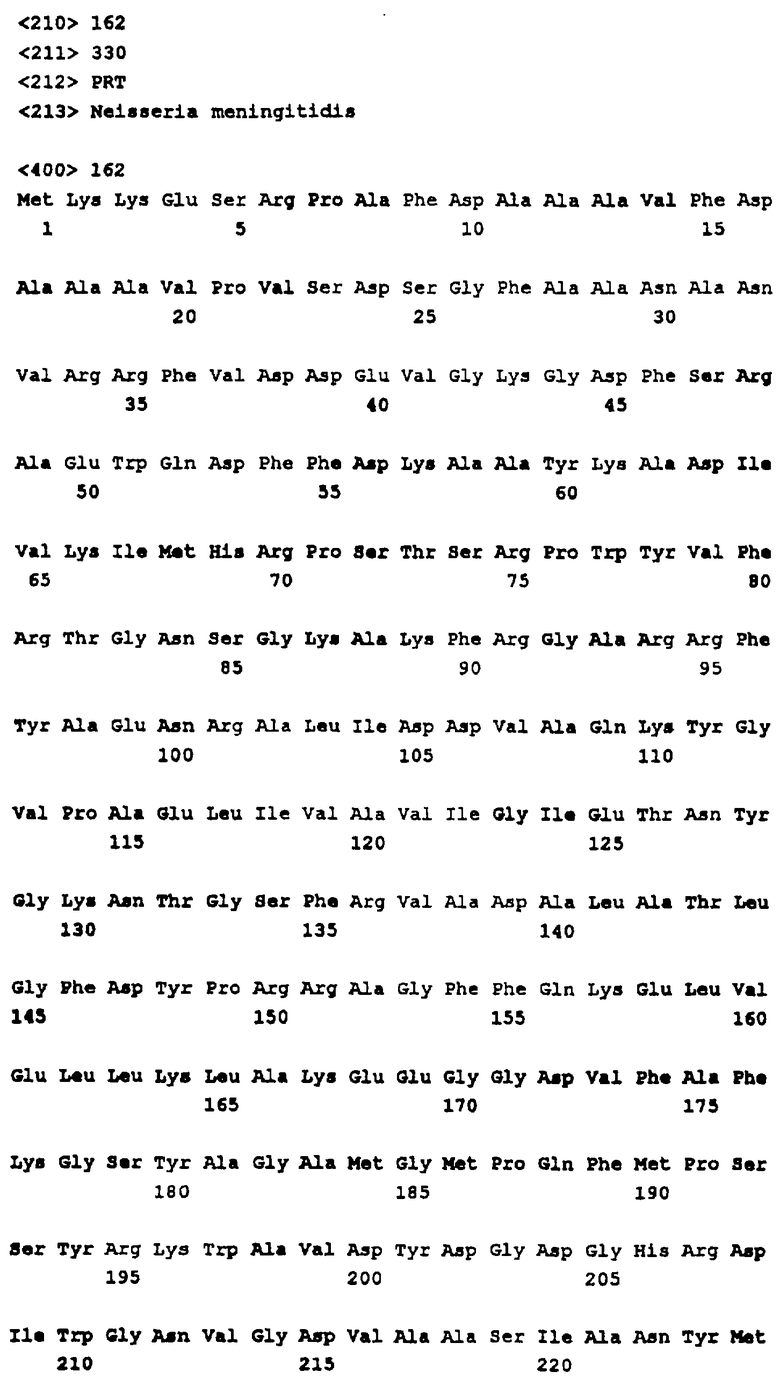
В соответствии со своим первым аспектом настоящее изобретение относится к пептиду, кодируемому опероном, включающим любую нуклеотидную последовательность, идентифицированную в п.1 формулы изобретения, или к его гомологу в грам-отрицательной бактерии, или его функциональному фрагменту, которые могут быть использованы в терапевтических или диагностических целях.
Эти пептиды могут иметь много терапевтических применений для лечения инфекций Neisseria, включая использование в вакцинах для профилактических целей.
В соответствии со вторым аспектом изобретения полинуклеотид, кодирующий пептид, определенный выше, может быть также использован для терапии или диагностики.
В соответствии с третьим аспектом изобретения гены, кодирующие указанные пептиды, могут быть использованы для получения аттенуированных микроорганизмов. Эти аттенуированные микроорганизмы обычно имеют мутацию, которая нарушает экспрессию одного или несколько идентифицированных здесь генов, в результате чего образуется штамм, у которого отсутствует вирулентность. Указанные микроорганизмы могут быть также использованы в терапии и в диагностике.
В соответствии с четвертым аспектом изобретения указанные пептиды, гены и аттенуированные микроорганизмы настоящего изобретения могут быть использованы для лечения и предупреждения состояния, ассоциированного с инфекциями, вызываемыми Neisseria или грам-отрицательными бактериями.
Описание изобретения
Настоящее изобретение основано на обнаружении генов, кодирующих пептиды, которые ответственны за вирулентность. Поэтому пептиды и гены настоящего изобретения могут быть использованы в целях получения терапевтических агентов для лечения инфекций. Следует отметить, что термин “терапия” также включает превентивные методы лечения, например вакцинацию. Кроме того, хотя продукты настоящего изобретения используются главным образом для лечения инфекции у человека, однако, предполагается, что их применение в ветеринарии также входит в объем настоящего изобретения.
Настоящее изобретение описано в применении к Neisseria meningitidis. Однако все штаммы Neisseria и многие другие штаммы грам-отрицательных бактерий также содержат родственные пептиды или белки, имеющие аминокислотную последовательность, идентичную или аналогичную идентифицированным здесь последовательностям. Микроорганизмами, которые, вероятно, содержат указанные пептиды, являются, но не ограничиваются ими, бактерии рода Salmonella, Enterobacter, Klebsiella, Shigella и Yersinia.
Эксперименты для идентификации генов вирулентности настоящего изобретения осуществляли с использованием штамма В N. meningitidis. Скрининг на гомологию осуществляли на базе данных штамма А, однако предпочтительными являются белки и гены, происходящие от штамма В.
Предпочтительно пептиды, которые могут быть использованы в различных аспектах настоящего изобретения, имеют более чем 40%-ное сходство с идентифицированными здесь пептидами. Более предпочтительно эти пептиды имеют более чем 60%-ное сходство последовательности. Наиболее предпочтительно указанные пептиды имеют более чем 80%-ное сходство последовательности, например 95%-ное сходство. Что касается идентифицированных здесь полинуклеотидных последовательностей, то родственные полинуклеотиды, которые могут быть использованы в различных аспектах настоящего изобретения, могут иметь более чем 40%-ную идентичность с идентифицированными здесь последовательностями. Более предпочтительно полинуклеотидные последовательности имеют более чем 60%-ную идентичность последовательности. Наиболее предпочтительно указанные полинуклеотидные последовательности имеют более чем 80%-ную идентичность последовательности, например 95%-ную идентичность.
Термины “сходство” и “идентичность” понятны специалистам. Используемый здесь термин “идентичность” относится к сравнению последовательностей, исходя из абсолютной совместимости сравниваемых последовательностей в соответствующих идентичных положениях. Термин “сходство” относится к сравнению аминокислотных последовательностей и подразумевает не только идентичность аминокислот в соответствующих положениях, но также и их функциональное сходство. Такое сходство между полипептидами, помимо сходства их последовательностей, указывает на их функциональное сходство.
Степени идентичности между генными последовательностями и уровни идентичности или сходства между аминокислотными последовательностями могут быть вычислены известными методами. В настоящем изобретении для определения идентичности и сходства могут быть использованы методы, основанные на использовании общедоступных компьютерных программ BLASTP, BLASTN и FASTA (Atschul et al., Molec. Biol., 1990; 215:403-410), а также программ BLASTX, доступных от NCBI, и программы “Gap” от Genetics Computer Group, Madison WI. Представленные здесь степени сходства и идентичности были получены с использованием программы Gap, причем для сравнения аминокислотных последовательностей были введены “бреши”, где “штраф на брешь-пропуск” был равен 12, а “штраф на брешь-удлинение” был равен 4, и при сравнении полинуклеотидных последовательностей “штраф на брешь-пропуск” был равен 50, а “штраф на брешь-удлинение” был равен 3.
При характеризации гена настоящего изобретения может быть использована генная последовательность для поиска родственных генов или пептидов в других микроорганизмах. Это может быть осуществлено путем поиска в имеющихся базах данных, например в EMBL или GenBank.
Пептиды или белки настоящего изобретения могут быть очищены и выделены методами, известными специалистам. В частности, при идентификации генной последовательности могут быть использованы рекомбинантные методы для экспрессии генов в подходящем хозяине. Активные фрагменты и родственные молекулы могут быть идентифицированы и использованы в терапии. Так, например, пептиды или их активные фрагменты могут быть использованы в вакцине в качестве антигенных детерминант для выработки иммунного ответа. Они могут быть также использованы для получения антител в целях пассивной иммунизации или для диагностики. Подходящими антителами являются моноклональные антитела или их фрагменты, включая одноцепочечные Fv-фрагменты. Методы получения антител известны специалистам.
Активные фрагменты пептидов представляют собой такие фрагменты, которые сохраняют биологическую функцию данного пептида. Так, например, при использовании для выработки иммунного ответа этот фрагмент должен иметь достаточный размер, такой, чтобы антитела, генерированные этим фрагментом, могли отличать этот пептид от других пептидов в бактериальном микроорганизме. Обычно этот фрагмент имеет размер, по крайней мере, в 30 нуклеотидов (10 аминокислот), а предпочтительно в 60 нуклеотидов (20 аминокислот), а наиболее предпочтительно более чем в 90 нуклеотидов (30 аминокислот).
Следует также отметить, что помимо родственных молекул, происходящих от других микроорганизмов, настоящее изобретение охватывает модификации, которые могут быть внесены в идентифицированные здесь пептиды и полинуклеотиды и которые не оказывают значительного влияния на биологическую функцию. Для специалиста очевидно, что вырожденность генетического кода может приводить к получению полинуклеотидов, которые имеют небольшие замены оснований по сравнению с определенными здесь основаниями, но которые, тем не менее, кодируют те же самые пептиды. Комплементарные полинуклеотиды также входят в объем настоящего изобретения. Также рассматриваются консервативные замены на аминокислотном уровне, то есть различные кислотные или основные аминокислоты могут быть заменены без значительной потери их функциональных свойств.
Получение вакцин на основе аттенуированных микроорганизмов известно специалистам. При необходимости или по желанию вакцинные композиции могут быть получены с использованием подходящих носителей или адъювантов, например, на основе алюминия для эффективной иммунизации против инфекции. Получение вакцинных композиций известно специалисту. Аттенуированные микроорганизмы могут быть получены путем внесения мутации, которая нарушает экспрессию любого идентифицированного здесь гена. Методы нарушения экспрессии конкретных генов известны специалисту. Методы, которые могут быть использованы для этих целей, предусматривают инсерционную инактивацию или делецию гена. Аттенуированные микроорганизмы настоящего изобретения могут также включать дополнительные мутации в других генах, например во втором идентифицированном здесь гене или в отдельном гене, необходимом для роста микроорганизма, например, мутацию в гене аrо, или, что касается Salmonella, в гене, локализованном в области SP12, идентифицированной в WO-A-96/17951.
Аттенуированные микроорганизмы могут быть также использованы в качестве систем носителей для доставки гетерологичных антигенов, терапевтических белков или нуклеиновых кислот (ДНК или РНК). В этом варианте осуществления изобретения аттенуированные микроорганизмы используют для доставки гетерологичного антигена, белка или нуклеиновой кислоты в конкретный участок in vivo. Введение гетерологичного антигена, пептида или нуклеиновой кислоты в аттенуированный микроорганизм может быть осуществлено стандартными методами, включая использование рекомбинантных конструкций, например векторов, которые содержат полинуклеотиды, экспрессирующие гетерологичный антиген или терапевтический белок, а также подходящие промоторные последовательности. Альтернативно ген, который кодирует гетерологичный антиген или белок, может быть введен в геном данного микроорганизма, и эндогенные промоторы используют для регуляции экспрессии.
В более общих чертах и как хорошо известно специалисту для терапевтического использования может быть выбрано подходящее количество активного компонента настоящего изобретения, а также могут быть выбраны подходящие носители или эксципиенты и способы введения. Эти факторы должны быть выбраны или определены в соответствии с известными критериями, такими как природа/тяжесть состояния, подвергаемого лечению, тип и/или состояние здоровья индивидуума и т.п.
В отдельном варианте осуществления изобретения продукты настоящего изобретения могут быть использованы в скринирующих анализах для идентификации потенциальных антимикробных лекарственных средств или для детекции на вирулентность. Рутинные скринирующие анализы известны специалисту и могут быть соответствующим образом адаптированы с использованием продуктов настоящего изобретения. Так, например, продукты настоящего изобретения могут быть использованы в качестве мишени для потенциального лекарственного средства, где способность лекарственного средства инактивировать мишень или связываться с этой мишенью указывает на его потенциальную антимикробную активность.
Различные продукты настоящего изобретения могут быть также использованы в ветеринарии.
Ниже приводится краткий обзор экспериментальной процедуры, используемой для идентификации генов вирулентности.
Для идентификации генов в N. meningitidis, которые играют главную роль в септической инфекции, может быть использован мутагенез с сигнатурным мечением (STM) (Hensel et al., Science, 1995; 269:400-403). При осуществлении STM отдельные мутанты метят идентификаторами с уникальными последовательностями, что позволяет одновременно анализировать большое число мутантов. Однако для этого необходимо сконструировать библиотеки инсерционных мутантов, и такая необходимость до сих пор ограничивала исследование N. meningitidis. Мутагенез был успешно осуществлен с использованием метода, в котором ДНК Neisseria модифицируют in vitro с использованием очищенных компонентов транспозиции Тn10. Поскольку N. meningitidis эффективно поглощает экзогенную ДНК, то модифицированные аллели вводят в N. meningitidis путем трансформации. Эти мутанты могут быть затем скринированы на их способность вызывать системную инфекцию.
Вектор pSTM115 (Sun et al. Nature Medicine, 2000; 6(11):1269-1273) использовали в качестве донора транспозона для in vitro-мутагенеза. Каждое из 96 производных pSTM115, содержащее уникальную метку-сигнатуру, участвовали в 96 отдельных реакциях транспозиции. Модифицированная геномная ДНК подвергалась репарации и возвращалась в хозяина при трансформации. Для того чтобы определить, присутствует ли Тn10-инсерция в других сайтах, 40 трансформантов были оценены на реакцию транспозиции в одном локусе с помощью Саузерн-блот-анализа. Каждый из трансформантов имел одну отличающуюся инсерцию в Тn10. Для того чтобы определить, была ли Tn10-интеграция стабильной в процессе системного инфицирования детенышей крыс, проводили сравнение картин гибридизации шести мутантов до и после пересевов с использованием крыс. В результате получали идентичные картины гибридизации до и после инфицирования.
При этом были использованы нижеследующие экспериментальные условия:
Бактериальные штаммы и рост:
С311+ представляет собой изолят ЕТ-5 N. meningitidis, серологической группы В, выделенный у пациента с инвазивной менингококковой инфекцией (Virji et al., Mol. Microbiol., 1991; 5:1831-1841). N. meningitidis культивировали на среде с сердечно-мозговым экстрактом, содержащей 5% добавку Левинталя. Штаммы Е. coli культивировали на среде Луриа-Бертани. По необходимости, к твердой среде добавляли канамицин в концентрациях 75 и 50 мкг/мл для N. meningitidis и Е. coli соответственно.
Характеризация in vitro-транспозиции и сайтов инсерции:
Сайт инициации репликации pACYC184 в pSTM115 использовали для выделения сайта инсерции путем “спасения” маркера. Секвенирование нуклеотидов осуществляли методом терминации с красителем (Perkin Elmer, Norwalk, Connecticut) с использованием праймеров NG62 (5'-TTGGTTAATTGGTTGTAACACTGG-3') (SEQ ID NO:209) или NG99 (5' -ATTCTCATGTTTGACAGCG-3') (SEQ ID NO:210). Поиски гомологии осуществляли в базах данных белков (http://www.ncbi.nlm.nih.gov/), включающих геномные последовательности серологических групп А и В N. meningitidis и N. gonorrhoeae (http://www.sanger.ас.uk/Projects/N_meningitidis, http://www.tigr.org и http://dnal.chem.ou.edu/gono.html соответственно).
Амплификация метки, клонирование и Саузерн-блот-анализы:
Гибридизацию и получение дот-блотов осуществляли как описано Hensel и др., см. выше, за исключением того, что метки амплифицировали с использованием праймеров NG13 (5'- ATCCTACAACCTCAAGCT-3') (SEQ ID NO:211) и NG14 (5'-АТСССАТТСТААССААСС-3') (SEQ ID NO:212) и ПЦР-продуктов, но не с использованием плазмидной ДНК, и фиксировали на мембранах. Олигонуклеотиды S1 (5'-AAGAGATTACGCGCAGACC-3') (SEQ ID NO:213) и S2 (5'-AATACGCAACCGCCTCTC-3') (SEQ ID NO:214) отжигали с последовательностями в pSTM115, фланкирующими “сигнатурные метки”, и использовали для амплификации продукта в 367 пар оснований из каждого производного рSТМ115. Для Саузерн-блот-анализа кластер генов резистентности к канамицину, происходящих от pSTM115, метили методом рандомизированных праймеров (NEB) и использовали в качестве зондов для геномной ДНК, гидролизованной Clal.
Модель на животных
Для скрининга пулов STM мутанты культивировали отдельно на микротитрационных планшетах в течение 18 ч. Бактерии собирали, затем ресуспендировали в PBS. Крыс Wistar (в возрасте 5 дней) инокулировали внутрибрюшинно 100 мкл суспензии и проводили мониторинг в течение 48 часов. Для определения индекса конкурентоспособности мутанта бактерию дикого типа и мутантную бактерию культивировали в течение 18 ч на твердой среде и собирали в PBS, после чего крыс инокулировали клетками мутанта и дикого типа в отношении 1:1 при уровне заражения для всего инокулята 5 х 106 к.о.е. Количество мутантных бактерий (резистентных к канамицину) по отношению к количеству бактерий дикого типа (чувствительных к канамицину) определяли путем посева образцов (в дубликатах) на среды, которые содержали или не содержали антибиотики.
Результаты поиска гомологов представлены в таблице 1.
Для остальных идентифицированных здесь последовательностей не было получено каких-либо данных о гомологии последовательностей.
Указанные генные продукты использовали для продуцирования поликлональных антител, которые были протестированы иммуноферментным способом (ELISA) против различных штаммов N. meningitidis для оценки их эффективности в качестве вакцин-кандидатов. Для этого использовали следующие штаммы:
Neisseria meningitidis (В) тип 1000
Neisseria meningitidis (В) тип NGE31
Neisseria meningitidis (В) тип NGH15
Neisseria meningitidis (В) тип SW2107
Neisseria meningitidis (В) тип NHG38
Neisseria meningitidis (В) тип NGE28
Neisseria meningitidis (В) тип 2996
Этот анализ дает информацию относительно разнообразия штаммов N. meningitidis, которые распознаются этими антителами.
N. meningitidis культивировали на “шоколадном” агаре Columbia с лошадиной кровью (Oxoid) в течение 14 часов при 37°С в 5% СO2. Клетки соскребали с агаровых чашек и ресуспендировали в 20 мл PBS в 50-мл пробирке. Клеточную суспензию нагревали в течение 30 минут при 56°С для инактивации бактерий.
50 мкл образца термоинактивированной N. meningitidis распределяли на “шоколадном” агаре Columbia с лошадиной кровью и инкубировали в течение 18 часов при 37°С в 5% СO2. В результате этого подтвердили, что все N. meningitidis были инактивированы. OD620 данной суспензии доводили до 0,1 единиц OD с использованием PBS в качестве контроля.
ELISA с использованием термоинактивированной N. Meningitidis
ELISA-анализы проводили с использованием термоинактивированной N. meningitidis в соответствии с нижеследующим протоколом. ELISA-планшеты сенсибилизировали в течение ночи термоинактивированными клетками (50 мкл инактивированных бактерий в PBS на каждую лунку 96-луночного планшета) и инкубированными при 4°С.
Ниже описаны стандартные протоколы ELISA, где все инкубирования проводили при 37°С в течение 1 часа. При этом были использованы PBS/3% BSA-блокирующий раствор, PBS/0,1% раствор твина для промывки, конъюгат вторичного антикроличьего антитела, конъюгированного со щелочной фосфатазой (ЩФ) (Sigma) и нитрофенилфосфатный реагент для детекции (Sigma, Fast Р). Данные считывали при 405 нм с использованием соответствующего ридера для микротитрационных планшетов. При этом использовали сыворотки, полученные через семь дней после первой бустер-вакцинации (через 35 дней после первой вакцинации).
Тестируемые антитела вырабатывались против генных продуктов, идентифицированных как SEQ ID NO:8, 102, 140, 158 и 202. В каждом случае результаты показали, что антисыворотка распознавала несколько различных штаммов N. meninglkidis В.
Ex vivo/in vivo-скрининг
Защита против менингококковых заболеваний у человека ассоциируется с присутствием бактерицидных антител против N. meningitidis (Goldscheider et al., J. Exp. Med., 1969; 129:1307-1326). Имеются также данные, которые позволяют предположить, что существует корреляция между присутствием детектируемой бактерицидной активности и протективным эффектом в in vivo-модели (работа Martin, J. Bacteriol., 2000; 83; 27-31). Поэтому генерированную антисыворотку использовали для оценки бактерицидной активности продуцированных антител.
Бактерицидные анализы были проведены с использованием неиммунной сыворотки и соответствующей кроличьей антисыворотки, вырабатываемой в ответ на антигены-кандидаты.
Коммерчески доступная кроличья сыворотка была использована как дополнительный источник после предварительного скрининга для предотвращения гибели комплемента. Там, где это необходимо, в качестве буфера использовали PBS Дульбекко (Gibco). Перед использованием в анализе штамм МС58 N. meningitidis культивировали при 37°С (5% CO2) в течение 14 часов.
200-400 к.о.е. МС58 в объеме 50 мкл инкубировали в присутствии добавки (50 мкл) со 100 мкл серийных разведений термоинактивированной сыворотки. В момент времени 0 образцы высевали на “шоколадный” агар Columbia с лошадиной кровью (Oxoid). После 60-минутного инкубирования число выживших бактерий оценивали путем их посева на “шоколадный” агар Columbia с лошадиной кровью (Oxoid). Бактерицидную активность выражали в процентах бактерий, выживших через 60 минут. Все образцы тестировали в дубликатах и высевали с тремя повторностями. При этом были использованы все соответствующие позитивные и негативные контроли. В каждом тестируемом образце бактерицидная активность значительно превышала бактерицидную активность неиммунной сыворотки.
Скрининг in vivo
Для оценки протективной эффективности вакцин-кандидатов взрослых мышей иммунизировали рекомбинантными белками, идентифицированными здесь как SEQ ID NO:102 и 108, и определяли протективный ответ путем заражения живой бактерией. Для каждого кандидата на вакцинирование 15-недельных мышей (6-недельных мышей balb/c) вакцинировали (подкожно) 25 мкг антигена в двух отдельных процедурах через интервалы в три недели.
Через одну неделю после проведения процедуры иммунизации эту группу заражали гомологичным бактериальным штаммом МС58. Бактерии инокулировали внутрибрюшинно в объеме 500 мкл в среде с сердечно-мозговым экстрактом/декстрановая среда с 0,5% железом в дозе 107 к.о.е. Предварительные результаты показали, что железо необходимо для инициации у этих животных бактериальных заболеваний. Указанную модель использовали ранее для демонстрации протективной эффективности вакцинации (Lissolo et al., Infect. Immujn, 1995; 63:884-890).
Контрольные группы включали животных, вакцинированных одним адъювантом (негативный контроль) или адъювантом вместе с очищенным РоrА (позитивный контроль). РоrА представляет собой внешний мембранный белок, экспрессируемый исключительно в N. meningitidis, и является главной мишенью для бактерицидных антител, индуцированных вакцинами на основе внешних мембранных везикул. Было также показано, что моноклональные антитела против РоrА обеспечивают пассивную защиту детенышей крыс, используемых в качестве модели. Однако РоrА значительно варьируется у разных штаммов, и, хотя он вырабатывает определенный иммунитет при заражении гомологичным штаммом, однако, он не является идеальным вакцинным кандидатом. После заражения проводили мониторинг на выживание животных. Крысы негативного контроля не выживали более 48 часов. Из мышей, вакцинированных РоrА, через 72 часа после вакцинации выживали 6 мышей. Из мышей, вакцинированных SEQ ID NO:102 и 108, выживали 5 и 3 мышей соответственно.












































































































































































































































































































































































































| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИД NEISSERIA MENINGITIDIS ДЛЯ ТЕРАПЕВТИЧЕСКОГО И ДИАГНОСТИЧЕСКОГО ПРИМЕНЕНИЯ | 2001 |
|
RU2313535C2 |
| КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2665841C2 |
| НЕЛИПИДИЗИРОВАННЫЕ ВАРИАНТЫ АНТИГЕНОВ NEISSERIA MENINGITIDIS ORF2086 | 2011 |
|
RU2546873C2 |
| ПОЛИПЕПТИДЫ ИЗ NEISSERIA MENINGITIDIS | 2007 |
|
RU2450019C2 |
| АНТИГЕНЫ NEISSERIA MENINGITIDIS | 1999 |
|
RU2343159C2 |
| АНТИГЕННЫЕ ПЕПТИДЫ NEISSERIA | 2000 |
|
RU2281956C2 |
| АНТИГЕННЫЕ ПЕПТИДЫ NEISSERIA | 2000 |
|
RU2284332C2 |
| ГЕН И БЕЛОК ВИРУЛЕНТНОСТИ И ИХ ИСПОЛЬЗОВАНИЕ | 2000 |
|
RU2240327C2 |
| КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2739504C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ИНФЕКЦИИ, ВЫЗВАННОЙ БАКТЕРИЕЙ NEISSERIA | 2000 |
|
RU2244749C2 |
Изобретение относится к биотехнологии, в частности к вирулентным генам и белкам. Пептид, проявляющий свойства антигена Neisseria meningitidis, и полинуклеотид, его кодирующий, применяются при изготовлении лекарственного препарата для лечения или предупреждения состояний, ассоциированных с инфекцией, вызываемой Neisseria или грамм-отрицательными бактериями. С помощью указанного пептида получают антитела. Вакцины, используемые для лечения или предотвращения заболеваний или состояний, вызванных Neisseria meningitidis, содержат аттенуированный мутантный штамм Neisseria meningitidis, имеющий мутацию или инсерцию, или делецию гена, нарушающую экспрессию определенной нуклеотидной последовательности. Данное изобретение позволяет повысить эффективность лечения и профилактики инфекции Neisseria. 7 с. и 6 з.п. ф-лы, 1 табл.
| J.PARKHILL et al | |||
| Вертикальный ветряный двигатель | 1924 |
|
SU2491A1 |
| Nature | |||
| Vol | |||
| Катодный усилитель с промежуточными контурами и батарейным коммутатором для цепей сетки | 1923 |
|
SU404A1 |
| WO 9924578 A, 20.05.1999 | |||
| US 6015669, 18.01.2000 | |||
| WO 9612020 A, 25.04.1996 | |||
| ПОЛИСАХАРИД NEISSERIA MENINGITIDIS С МОДИФИЦИРОВАННОЙ ГРУППОЙ B, КОНЪЮГИРОВАННЫЙ АНТИГЕН, ВАКЦИНА ПРОТИВ МЕНИНГИТА ГРУППЫ B И СПОСОБ ИНДУКЦИИ ОТВЕТА АНТИТЕЛ К МЕНИНГИТУ ГРУППЫ B | 1990 |
|
RU2105568C1 |
Авторы
Даты
2005-05-20—Публикация
2001-05-08—Подача