Изобретение относится к медицине, а именно к офтальмологии.
Активизация увеосклерального оттока - важное направление в лечении глаукомы. Это вызвано тем обстоятельством, что играющий вспомогательную роль в оттоке внутриглазной жидкости в норме увеосклеральный путь становится практически единственным реальным путем оттока водянистой влаги при глаукоме, когда основной - отток через корнеосклеральные трабекулы (так называемый передний путь оттока) - в основном не функционирует (Нестеров А.П., 1985). На активизации увеосклерального пути основано действие современных наиболее действенных антиглаукоматозных препаратов (простагландинов, эйкозаноидов). Однако в условиях, когда медикаментозное лечение перестает быть эффективным, встает вопрос об операции, и в этом случае особое значение имеет усиление фильтрации внутриглазной жидкости в супрахориоидальное пространство, иными словами - создание нового пути оттока, направленного по увесклеральному пути. Следует подчеркнуть, что большинство классических антиглаукоматозных вмешательств направлено на активизацию переднего пути - через склеральный синус или под конъюнктиву. В то же время многие хирурги признают необходимость создания условий для усиления заднего пути оттока - увеосклерального. С этой целью, например, в ходе операции частично обнажается сосудистая оболочка (Н.В.Косых. Применение множественной задней склерэктомии при лечении "бесперспективной" глаукомы //Офтальмохирургия. - 1989. - № 1-2. - С.40-41; С.Ю.Астахов. Патент на изобретение № 2189208; A.Mermoid, T.Sharaawy. Surgery for glaucoma in the 21-th century// Br.Ophthalmol. - 2003. - Vol.87. - P.250).
Целью предлагаемого средства является создание максимально возможных предпосылок для усиления увеосклерального пути оттока внутриглазной жидкости.
Важным аспектом в современной хирургии глаукомы является использование вискоэластиков, которым придается все большее значение в последние годы, особенно при непроникающих антиглаукоматозных операциях. Полагают, что инъекции вискоэластика высокой плотности в просвет шлеммова канала (метод, предложенный R.Stegmann в 1998 г.) приводят к микроразрывам его внутренней эндотелиальной стенки, что расширяет трабекулярную сеть и пространства в юкстаканаликулярной ее части. Представляет интерес, по-видимому, введение вискоэластика также и в супрахориоидальное пространство.
Другим аспектом разрабатываемого способа хирургического лечения глаукомы явилось предупреждение избыточного рубцевания созданных в ходе операции путей оттока, что предполагает использование физиологических регуляторов репаративных процессов. Применение физиологических регуляторов репарации, в частности тех, что обладают иммуномодулирующей активностью, представляется наиболее перспективным в настоящее время (P.Khaw, 2000, 2003), поскольку данное направление терапии лишено осложнений, свойственных для традиционно применяемых в хирургии глаукомы антиметаболитов (Митомицина С и 5-фторурацила) (WuDunn D., Cantor L. A prospective randomized trial comparing intraoperative 5-fluorouracil vs mitomycin С in primary trabeculectomy //American J. of Ophthalmology. - 2002. - Vol.134. - P.52-528, Nuyts R., Van Diemen H., Greve E. Occlusion of the retinal vasculature after trabeculectomy with mitomicin С //Int. Ophthalmol. - 1994. - Vol.18. - P.167-170, Daugeliene L., Yamamoto Т., Kitazawa Y. Cataract development after trabeculectomy with mitomycin C: a one-year study // Jap. J. Ophthalmol. - 2000. - Vol.44. - P.52-57).
В последние годы в различных областях медицины, в частности в офтальмологии, с успехом применяется подвергнутая криоконсервации амниотическая мембрана (Tseng SCG, Prabhasawat P., Barton К. Amniotic membrane transplantation with or without limbal autografts for comeal surface reconstruction in patients with limbal sterm cell deficiency // Arch. Oththalmol. - 1998. - Vol.116. - P.431-441). Одним из достоинств амниона является его иммунная ареактивность. К другим важным свойствам амниона относятся его способность ускорять эпителизацию, снижать воспаление, подавлять избыточное рубцевание, уменьшать адгезивные процессы в тканях и васкуляризацию (Trelford J.D., Sander M. The amnion in surgery, past and present // Am J Obstet and Gynecol. - 1979. - Vol.134. - P.833-845). Перечисленные биологические эффекты амниона связывают с тем, что в нем содержится ряд цитокинов, в том числе IL-4, 6 и 10, факторы роста (EGF, FGF, TGF, HGF), а также ингибиторы протеаз. Важной особенностью амниона является его способность подавлять активность систем, ответственных за выработку факторов роста в фибробластах конъюнктивы и склеры (TGF-signaling system), что существенно снижает их митогенную активность. С этих позиций существенное значение имеет возможность использования амниона для предупреждения избыточного рубцевания тканей глаза после антиглаукоматозных операций (АГО), поскольку данное осложнение хирургии глаукомы связывают с гиперпродукцией ряда цитокинов, в частности фактора роста TGF-β1. Данный цитокин обладает наиболее сильным пролиферативным действием [Cordeiro M., Reichel M., Gay J. et al. Transforming growth factor beta-1 in cultured human Tenon's capsule fibroblasts //Eur. J. Ophthalmol. - 2000. - Vol.10. - P.110-115], который даже подавляет эффект ММС in vivo [Khaw P., Doyle J., Sherwood M. et al. Prolonged localized tissue effects from 5-minute exposures to fluorouracil and mitomycin С //Arch. Ophthalmol. - 1993. - Vol.111. - P.263-267]. В литературе имеются данные о способности амниона ингибировать пролиферацию фибробластов (Lee S., Li D., Tan D., Tseng S. Suppression of TGF-β signaling in both normal conjunctival fibroblasts and pterygial body fibroblasts by amniotic membrane // Curr. Eye Res. - 2000. - Vol.20. - P.325-334) путем модулирования продукции TGF-β1.
Вместе с тем до сих пор амниотическая мембрана применялась чаще всего как покрытие конъюнктивы при наружной фильтрации после антиглаукоматозных операций (Mucuno H., Kanamori A. Revision of filtrering bleb with late-on-set leakage by transplantation of amniotic membrane //Japanese Journal of Clinical Ophthalmology. - 2003. - Vol.57. - P.1699-1704, Barton K., Budenz D., Khaw P., Tseng S. Glaucoma filtration surgery using amniotic membrane transplantation// Invest. Ophthalmol. Vis. Sci. - 2001. - Vol.42, N 8. - P.1762-1768). В единичных работах описано применение амниона в качестве интрасклерального имплантата (А.А.Каспаров, 2003; Zhong P., Dong Y., Li R. The combination of non-perforating trabeculecular surgery and amniotic membrane implantation in the treatment of secondary open-angle glaucoma //Chinese Ophthalmic Research. - 2003. - Vol.21. - P.524-526; Demir Т., Turgut В., Akyol N., Ozercan I., Via F., Celiker U. Effects of amniotic membrane transplantation and mitomycin С on wound healing in experimental glaucoma surgery //Ophthalmologica - 2002. - Vol.216. - P.438-442).
Рассмотренные выше теоретические предпосылки легли в основу предлагаемого способа хирургического лечения глаукомы. Технический результат заявляемого способа направлен на повышение эффективности антиглаукоматозных операций за счет усиления увеосклерального пути оттока внутриглазной жидкости, а также иммунорегулирующих свойств амниона, ингибирующего продукцию эндогенного TGF-β1.
Исследование включало экспериментальную часть и комплексное обследование больных глаукомой, оперированных по разработанному нами методу (описание операции см ниже).
Описание операции.
Операцию начинали с разреза конъюнктивы на 12 часах, затем выкраивали четырехугольный поверхностный склеральный лоскут размером 5×5 мм. Из глубоких слоев склеры формировали лоскут размером 3×4 мм, обнажая шлеммов канал, затем удаляли поверхностные слои роговицы выше шлеммова канала на 1-1,5 мм, добиваясь фильтрации через периферические отделы эндотелиального слоя. Затем в 2 мм от лимба производили линейный разрез склеры размером 2 мм, в который вводили 0,05 мл препарата Healon (Pharmacia), представляющего собой вискоэластик на основе гиалуроновой кислоты. Благодаря этой манипуляции формировалось пространство между склерой, цилиарным телом и сосудистой оболочкой, заполненное раствором гиалуроната натрия. Затем в сформированное пространство вводили дренаж из амниотической мембраны человека размером 2×5 мм. Амниотическая мембрана изготавливалась предварительно из плаценты человека и подвергалась криоконсервации по методу S.Tseng. Дренаж размещали с таким расчетом, чтобы один его конец находился над десцеметовой мембраной, а второй конец погружался под склеру над цилиарным телом и сосудистой оболочкой. Данный способ фиксации дренажа, формируя локальную экссудативную отслойку сосудистой оболочки, активизирует увеосклеральный отток в зоне имплантации дренажа. Склеральную рану герметизировали двумя узловыми швами. Операцию заканчивали инъекцией кортикостероидов и антибиотика под конъюнктиву.
Экспериментальные исследования выполнены на 20 глазах кроликов породы шиншилла. В первой группе животных произведена склерэктомия с субсклеральной имплантацией амниотической мембраны (10 глаз); во второй - склерэктомия с аппликацией антиметаболита - митомицина С (0,2 мг/мл) в течение двух минут (5 глаз); в третьей (контроль) - склерэктомия без имплантации амниона и применения антиметаболитов (5 глаз).
В сроки одна, три, шесть и двенадцать недель после операции животных выводили из эксперимента путем воздушной эмболии. Глазные яблоки консервировали в 10% растворе формалина. Препараты подвергались гистологическому исследованию, которое выполнялось на парафиновых срезах толщиной 4-6 мкм. Окрашенные гематоксилин-эозином срезы исследовались на световом микроскопе "Фотомикроскоп III" (Opton, Германия).
Клинические исследования проведены на 42 больных (42 глаза) первичной открытоугольной глаукомой в развитой (20 глаз) и далеко зашедшей стадиях (22 глаза) с некомпенсированным офтальмотонусом, которым были выполнены АГО по описанной выше методике. Группу сравнения составили 15 больных (15 глаз), которым выполнялась обычная НГСЭ (без имплантации амниона, вскрытия супрахориоидального пространства и введения вискоэластика), а с целью предупреждения избыточного рубцевания тканей глаза применяли субконъюнктивальные инъекции 5-фторурацила через день (на курс: 5 инъекций). Группы были сопоставимы по полу и возрасту (больные были в возрасте от 40 до 80 лет; средний возраст составил 64 года) и стадиям глаукомы.
Наблюдение в динамике осуществляли в течение 6 месяцев. О состоянии созданных в ходе операции путей оттока внутриглазной жидкости судили по данным биомикроскопии (обращали внимание на состояние фильтрационной подушки), данными ультразвуковой биомикроскопии (обращали внимание на размеры интрасклеральной и супрахориоидальной полостей) и результатам гониоскопии, а также по уровню офтальмотонуса.
Всем больным определяли содержание трансформирующего фактора роста TGF-β1 в слезной жидкости как до, так и в динамике после операции. Исследование проводили методом иммуноферментного анализа с применением коммерческих тест-систем (фирма "BIOSOURCE", Бельгия). Чувствительность метода 15 пкг/мл. Для сравнения исследовали слезную жидкость 10 здоровых доноров того же возраста.
Статистическая обработка проведена с помощью критерия Стьюдента и χ2.
Морфологические исследования показали, что субсклеральная имплантация амниона ведет к расширению подлежащих хориоидальных сосудов (фиг.1), в результате чего значительная часть внутриглазной жидкости попадает в супрахориоидальное пространство и далее дренируется интра- и эписклеральными сосудами. Другими словами, создаются условия шунтированного увеосклерального пути оттока: задняя камера → губчатая фильтрующая структура имплантата → супрахориоидальное пространство → эписклеральные вены. Сравнительные морфологические исследования, выполненные на глазах кроликов, получавших аппликации митомицина С во время операции, выявили сниженную регенерацию тканей (фиг.2).
Результаты клинических исследований показали высокую эффективность предложенного хирургического метода лечения.
Так, в случаях имплантации в супрахориоидальное пространство амниотической мембраны офтальмотонус сохранялся в пределах нормы в 40 глазах (97%). При этом фильтрационная подушка визуализировалась и могла быть охарактеризована как невысокая разлитая. При гониоскопии прослеживалась достаточно выраженная интрасклеральная щель. Результаты ультразвуковой биомикроскопии выявили формирование выраженного супрахориоидального пространства, сохранявшегося на всех этапах обследования (фиг.3).
В группе сравнения стойкая нормализация офтальмотонуса наблюдалась в 13 глазах (87%), что также указывает на высокую эффективность применения антиметаболита 5-фторурацила для предупреждения избыточного рубцевания после АГО. Однако в этой группе больных чаще наблюдались осложнения в раннем послеоперационном периоде: если отслойка сосудистой оболочки развилась у двух больных основной группы (амнион), то в группе сравнения (5-фторурацил) она наблюдалась в два раза чаще. На фоне лечения 5-фторурацилом в трех случаях наблюдалось расхождение конъюнктивальной раны, причем у одного больного расхождение краев раны повторялось дважды, по поводу чего была выполнена пластика конъюнктивы амниотической мембраной.
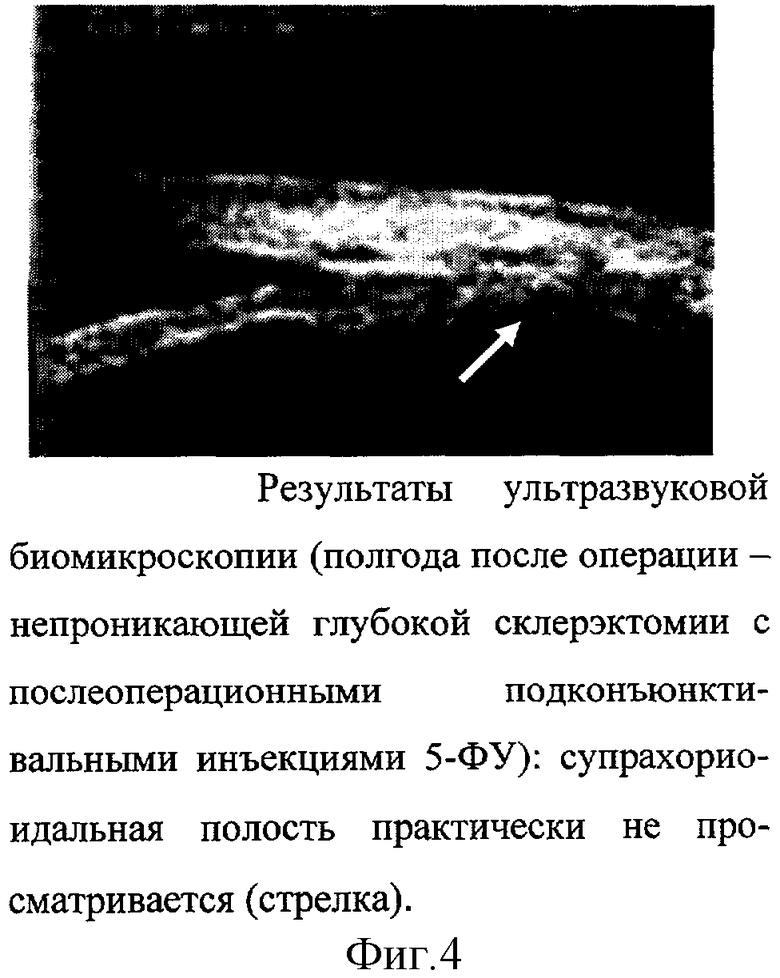
Результаты ультразвуковой биомикроскопии свидетельствовали о формировании интрасклеральной щели, однако супрахориоидальное пространство было менее выраженным или вовсе не прослеживалось (Рис.4).
Сравнивая течение послеоперационного периода и его исходы у больных основной группы и тех, кто получал 5-фторурацил, мы отметили явные преимущества предложенного нами метода хирургического лечения по сравнению с традиционным способом борьбы с избыточным рубцеванием. Действительно, использование 5-фторурацила после операции хотя и способствовало сохранению нормального офтальмотонуса (средние его показатели к концу шестого месяца составили 16,3±5,1 мм рт.ст.), но сопровождалось большим количеством осложнений, основным из которых явилось расхождение краев операционной раны.
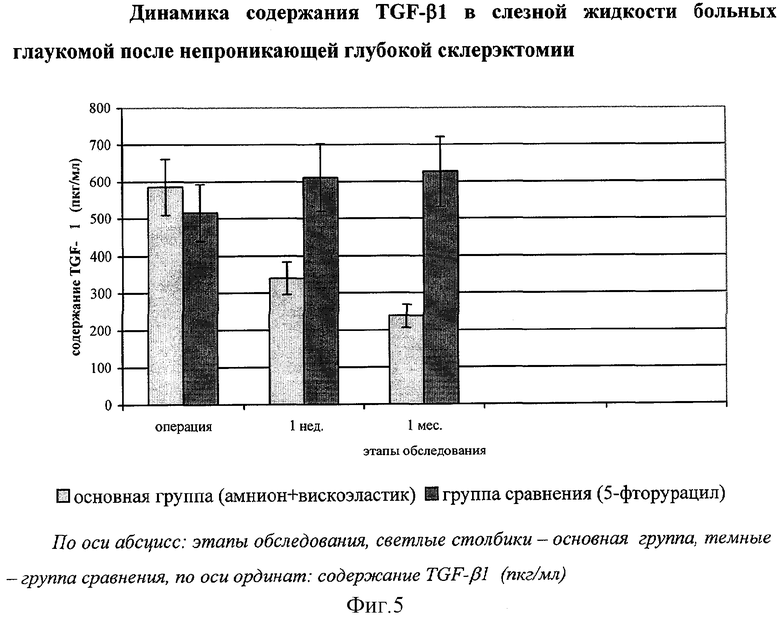
Клинико-иммунологический анализ показал неуклонное снижение уровня TGF-β1 в слезной жидкости больных основной группы с исходно высоких значений накануне операции до нормальных уже к концу первого месяца после операции (фиг.5).
На фоне лечения 5-фторурацилом не наблюдалось столь значительного снижения уровня TGF-β1 в слезной жидкости (фиг.6), что по-видимому связано с иными механизмами воздействия данного антиметаболита на пролиферацию фибробластов, возможно, путем блокады синтеза ДНК (Michalikova L., Ferkova S., Stremen P. Antimatabolites in glaucoma surgery: long term study // Ceska a Slovenska Oftalmologie. - 2002. - Vol.58. - P.180-186).
Иммуномодулирующее действие амниотического имплантата в сочетании с его супрахориоидальным введением после предварительного расширения супрахориоидального пространства вискоэластиком позволяет объяснить эффективность предложенного метода.
Важным преимуществом заявляемого способа лечения глаукомы является поддержание увеосклерального пространства, обеспечивающего отток внутриглазной жидкости по заднему пути.
Эффективность предлагаемого лечения подтверждается клиническим примером.
Пример. Больная К., 59 лет. Диагноз: открытоугольная развитая глаукома с высоким офтальмотонусом правого глаза. Показатели гидродинамики: Р0=35,5 мм рт.ст.; С=0,02. Выполнена глубокая непроникающая склерэктомия, в ходе которой выполнена имплантация в супрахориоидальное пространство дренажа из амниотической мембраны. Течение операции без осложнений. В послеоперационном периоде больная получала раствор макситрола и наклофа в инстилляциях. Послеоперационный период протекал спокойно: воспалительная реакции в виде незначительной смешанной инъекции наблюдалась только в первые двое суток после операции. Результаты биомикроскопии показали, что фильтрационная подушечка была невысокой, умеренно выраженной, влага передней камеры прозрачной, реакция зрачка сохраненной, рефлекс глазного дна розовым. Спустя неделю после операции показатели гидродинамики: Р0=11,0 мм рт.ст.; С=0,31. Наблюдение в динамике показало сохранение фильтрационной подушечки на всех этапах обследования. Гониоскопически определялась хорошо выраженная интрасклеральная щель. Результаты ультразвуковой биомикроскопии показали формирование выраженной интрасклеральной щели и супрахориоидального пространства.
Через полгода после операции Р0=16,0 мм рт.ст.; С=0,23. Исследование TGF-β1 слезной жидкости показало снижение его уровня с 780,0 пкг/мл накануне операции до 386,0 пкг/мл в конце первой недели после операции и до 294,5 пкг/мл через месяц. Результаты ультразвуковой биомикроскопии показали сохранение интрасклеральной щели и супрахориоидального пространства.
Таким образом, заявляемое средство оказывает целенаправленное терапевтическое действие, предотвращающее рубцевание путей оттока после антиглаукоматозной операции, что позволяет добиться стойкой нормализации внутриглазного давления у больных первичной глаукомой.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРЕДУПРЕЖДЕНИЯ ИЗБЫТОЧНОГО РУБЦЕВАНИЯ ПОСЛЕ АНТИГЛАУКОМАТОЗНЫХ ОПЕРАЦИЙ | 2004 |
|
RU2281117C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИЗБЫТОЧНОГО РУБЦЕВАНИЯ ПОСЛЕ НЕПРОНИКАЮЩЕЙ ГЛУБОКОЙ СКЛЕРЭКТОМИИ | 2000 |
|
RU2177155C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ГЛАУКОМЫ | 2009 |
|
RU2396927C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ВТОРИЧНОЙ ЗАКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ | 2006 |
|
RU2307631C1 |
| СПОСОБ ДОЗИРОВАНИЯ ОТТОКА ВНУТРИГЛАЗНОЙ ЖИДКОСТИ ПРИ НЕПРОНИКАЮЩЕЙ ХИРУРГИИ ГЛАУКОМЫ | 2015 |
|
RU2577506C1 |
| Хирургический способ лечения первичной глаукомы в сочетании с катарактой | 2019 |
|
RU2705254C1 |
| СПОСОБ ПРЕДУПРЕЖДЕНИЯ РУБЦЕВАНИЯ ИНТРАСКЛЕРАЛЬНОЙ ПОЛОСТИ ПРИ МИКРОХИРУРГИИ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ | 2017 |
|
RU2638765C1 |
| СПОСОБ ЛЕЧЕНИЯ РЕФРАКТОРНОЙ ГЛАУКОМЫ | 2002 |
|
RU2240086C2 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ГЛАУКОМЫ ПУТЕМ РЕЗЕКЦИИ СКЛЕРЫ | 2015 |
|
RU2587856C1 |
| Способ профилактики пристеночной гиперфильтрации внутриглазной жидкости при проведении антиглаукоматозных операций | 2018 |
|
RU2691315C1 |


Изобретение относится к офтальмологии и предназначено для хирургического лечения глаукомы. Проводят непроникающую глубокую склерэктомию. После этого вскрывают супрахориоидальное пространство и вводят в него вискоэластик. Далее в сформированное между склерой, цилиарным телом и сосудистой оболочкой пространство имплантируют дренаж из амниотической мембраны. Способ создает условия для функционирования шунтированного увеосклерального пути оттока и предотвращает рубцевание путей оттока в послеоперационном периоде. 5 ил.
Способ хирургического лечения глаукомы, включающий проведение непроникающей глубокой склерэктомии, отличающийся тем, что дополнительно вскрывают супрахориоидальное пространство и вводят в него вискоэластик, после чего в сформированное между склерой, цилиарным телом и сосудистой оболочкой пространство имплантируют дренаж из амниотической мембраны.
| КОЗЛОВА Т.В | |||
| и др | |||
| Непроникающая хирургия глаукомы: эволюция и перспективы развития (обзор литературы), Офтальмохирургия, 2000, №3, с.39-49 | |||
| Способ лечения глаукомы | 1990 |
|
SU1806704A1 |
| СПОСОБ ЛЕЧЕНИЯ ГЛАУКОМЫ | 1995 |
|
RU2118142C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ГЛАУКОМЫ | 2000 |
|
RU2195903C2 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ | 2000 |
|
RU2196555C2 |
| SOURDILLE P | |||
| et al., Transition to nonpenetrating trabecular surgery: sclerotrabeculectomy, J | |||
| Cataract Refract | |||
| Surg., 2002, Dec, vol.28, №12, p.2080-2083. | |||
Авторы
Даты
2006-08-10—Публикация
2004-10-26—Подача