Изобретение относится к области биотехнологии растений, использующей методы генной инженерии, и может быть применено для направленного изменения свойств растений капусты белокочанной.
Капуста белокочанная (Brassica oleracea var. capitata) выращивается в России повсеместно, практически во всех климатических зонах. Относительно высокая продуктивность при известной простоте возделывания позволяет капусте белокочанной стабильно занимать третье место после злаковых культур и картофеля в отечественном сельскохозяйственном производстве. Капуста белокочанная по содержанию в своем составе витамина С занимает первое место, превышая по этому показателю лимоны и черную смородину, поэтому считается незаменимым его источником в зимнее время на основной территории РФ. В связи с этим получение стабильного урожая капусты белокочанной является одной из важнейших задач отечественного растениеводства.
Решение этой проблемы предусматривает как увеличение продуктивности культивируемых в России сортов капусты, так и повышение их устойчивости к неблагоприятным воздействиям окружающей среды. Сегодня наиболее перспективным путем в этом плане представляется получение трансгенных растений с направленно измененными свойствами, приобретение которых обеспечивается введением в геном растения чужеродных генов, ответственных за проявление нужных фенотипических признаков (генетическая модификация).
Уровень техники
Первые попытки получения трансгенных растений семейства Капустные (Brassicaced) относятся к концу восьмидесятых годов, когда были опубликованы работы по созданию генетически-модифицированных растений капусты белокочанной (В.oleracea) и рапса (B.napus) с помощью агробактерии [De Block M, De Brouwer D, Tenning P. Plant Physiology, 1989, v.91, p.694-701; David C, Tempe J. Plant Cell Report, 1988, v.7, p.88-91; Christey MC, Sinclair BK, 1992, v.87, p.161-169]. Последующие работы в этом направлении были посвящены, главным образом, модификации и оптимизации процедуры трансформации. Однако несмотря на значительные усилия, пока не удалось разработать единую эффективную методику трансформации для различных генотипов (линий) даже внутри одного вида (например, Brassica oleraced). Поэтому при необходимости получения модифицированных растений капусты белокочанной в настоящее время приходится проводить оптимизацию протокола для каждого сорта или родительской формы будущего гибрида [Puddephat I.J., Riggs T.J., Fenning T.M., 1996, Molecular Breeding, v.2, p.185-210].
Известен способ получения генетически модифицированных растений Brassica oleracea var. capitata [P.K.Pius, P.N.Achar, Трансформация с помощью Agrobacterium и регенерация растений Brassica oleracea var. capitata Plant Cell Reports, 2000, 19:888-892], который по совокупности общих признаков наиболее близок к предлагаемому в рамках настоящего изобретения. Он осуществляется следующим образом. Семена капусты стерилизуют, проращивают на среде Murashige-Skoog (1962) с уменьшенной в два раза концентрацией солей. Из агробактериального штамма, содержащего подлежащий введению в растение чужеродный ген, получают ночную культуру, которую перед обработкой эксплантов разводят до конечной концентрации 5·108 клеток/мл. Семядольные листья проростков помещают на несколько минут в суспензию агробактериальной культуры, а затем отмывают в среде, содержащей карбенициллин в концентрации 1 г/л. Для формирования каллуса и регенерации экспланты переносят на среду MS, содержащую 2,2 мг/л 6-бензиламинопурина (БАП) и 0,17 мг/л индолилуксусной кислоты. Из полученных регенерантов отбирают растения, геном которых включает чужеродный ген (GUS).
Основным недостатком данного способа, как, впрочем, и большинства других известных методик, является то, что он разработан для модельного сорта зарубежной селекции и не эффективен в отношении линий отечественной селекции, районированных на территории РФ.
Таким образом, задача создания эффективной методики трансформации, пригодной для широкого круга родительских генотипов, особенно отечественной селекции, сохраняет свою актуальность.
Дополнительные сложности в работе по разработке такой методики возникают в связи с тем, что, миновав первый этап разработки и освоения методов трансформации, к настоящему моменту во многих странах перешли к этапу внедрения полученных результатов в производство. Это обусловило необходимость перехода от работы с модельными генотипами к использованию продуктивных коммерческих линий (родительских линий, образующих гибриды для производства), большинство из которых, как выяснилось, трансформируются значительно хуже, чем лабораторные. Не являются исключением в этом смысле и линии капусты белокочанной российской селекции.
С учетом этого при создании настоящего изобретения ставилась задача создания единого эффективного способа получения трансгенных растений капусты белокочанной, пригодного для широкого круга перспективных в коммерческом отношении отечественных родительских линий. Ожидаемым техническим результатом было повышение эффективности и унификация процедуры трансформации.
Раскрытие изобретения
Запланированный результат достигается за счет оптимальной комбинации приемов и средств, применяемых при осуществлении процедуры трансформации. Предлагаемый способ получения генетически модифицированных растений капусты белокочанной включает следующие стадии: а) получение и подготовку к сокультивации штамма A. tumefaciens, содержащего предназначенный для введения в растение полезный ген, б) получение и подготовку к сокультивации растительных эксплантов, в) сокультивацию эксплантов со штаммом агробактерии, г) перенос обработанных эксплантов на питательную среду для инициации каллусообразования и последующей регенерации до фенотипически нормальных растений, д) отбор регенерантов, содержащих интересующий полезный ген. При этом существенно, что для трансформации используют растения коммерческой линии отечественной селекции, экспланты получают из стебля проростка, сокультивацию проводят на стерильном бумажном фильтре, помещенном на поверхность агаризованной питательной среды, на которую предварительно наносят суспензию штамма агробактерии, а для инициации каллусообразования и регенерации используют питательную среду, дополнительно содержащую БАП и кинетин, в которую также вносят антибиотик карбенициллин для одновременной элиминации избытка клеток агробактерии.
Предпочтительно использовать питательную среду, содержащую 1-4,5 мг/л БАП, 0,5-2,0 мг/л кинетина, 40-50 мг/л карбенициллина и при необходимости 100-200 мг/л борной кислоты; при этом наиболее высокие показатели регенерации и трансформации достигаются при использовании БАП в концентрации 1-2,5 мг/л, кинетина в концентрации 0,6-1,0 мг/л, карбенициллина в концентрации 40-50 мг/л и там, где это необходимо, борной кислоты в концентрации 100-150 мг/л.
В предпочтительном варианте подготовку рекомбинантного штамма A. tumefaciens проводят следующим образом: штамм засевают штрихом на питательную среду и выращивают в течение 3÷0,5 суток в темноте при 24-29°С, за двое суток до сокультивации полученной смесью колоний засевают первую ночную культуру, за одни сутки до сокультивации засевают вторую ночную культуру путем внесения в питательную среду первой ночной культуры; для сокультивации используют вторую ночную культуру без предварительного разведения.
В зависимости от поставленной задачи в способе по изобретению могут использоваться различные трансформирующие агенты. Для создания растений, устойчивых к различным болезням хранения (серой и белой гнили, ризоктониозу, слизистому бактериозу), возможно использование генов устойчивости дикого сородича капусты белокочанной - Brassica fruticulosa. Для создания растений, устойчивых к засолению почвы, может быть введен ген codA, обеспечивающий устойчивость к повышенной концентрации солей в почвенном растворе, либо гены вакуолярных Н+ пирофосфатаз, которые выводят ионы Н+ в вакуоли. Для создания растений, устойчивых к различным гербицидам, может быть проведена трансформация генами, определяющими устойчивость к глифосату (гербицид ″Раундап″, ген СР4), фосфинотрицину (гербицид ″Баста″, ген bar). Для устранения самонесовместимости, присущей всему роду Brassica, возможно внесение генов семейства SIG из близкородственного Arabidopsis thaliana. Для устранения эффекта пожелтения цветоносов после уборки у капусты цветной и брокколи может использоваться ген ipt.
Для осуществления процесса трансформации целесообразно использовать штаммы Agrobacterium tumefaciens, хорошо зарекомендовавшие себя по степени вирулентности. Например, таковыми являются штаммы LBA4404, GV3101, AGL1, AGL0.
В качестве исходных форм для трансформации выбирались линии, которые используются в качестве одного из родителей при создании перспективных, высокоурожайных российских сортов, устойчивых к целому ряду заболеваний, в том числе к киле и некоторым болезнями хранения. При выборе исходных линий учитывались сроки созревания, в частности то, что раннеспелые формы не имеют большого практического значения, поскольку используются только в свежем виде, а поздние и среднепоздние могут закладываться на хранение и использоваться при квашении и приготовлении переработанной продукции.
Лучшие показатели регенерации и трансформации капусты белокочанной способом по изобретению были получены для перспективных в коммерческом отношении линий отечественной селекции Гэс-2, Дрв2 и Мэг-2.
Описание чертежей
Фиг.1. Электрофоретический анализ продуктов ПЦР на препаратах ДНК растений капусты белокочанной линии Гэс-2, трансформированных геном bar.
Дорожки: 1-10 - ПЦР на препаратах ДНК из трансформированных линий,
11 - положительный контроль (трансгенный картофель),
12 - отрицательный контроль ПЦР на препаратах ДНК из нетрансформированных растений,
13 - положительный контроль продукт ПЦР на плазмидной ДНК (0,1 нг/реакцию), использованной для трансформации растений (плазмида pBAR),
14 - маркер размера (λ HindIII + EcoRI).
Осуществление изобретения
Данный протокол рассчитан на постановку одного трансформационного эксперимента, исходя из среднего количества исходных стерильных проростков - 50±5 шт. Среднее количество эксплантов - 100±10 шт.
Исходные линии: Гэс-2 и Мэг-2 - среднепоздние, Дрв2 - поздняя.
Трансформирующий агент: ген bar, кодирующий фермент фосфинотрицинацетилтрансферазу, который обуславливает устойчивость к гербициду L-фосфинотрицину [Падегимас Л. и др., 1994]. Агробактериальный штамм: Agrobacterium tumefaciens LBA 4404, содержащий плазмиду рВаг [Грибова Т.Н. и др., 2003].
Методики
1. Получение исходного растительного материала.
Семена стерилизуют в течение 1 мин в 70% этаноле, затем 7 мин в 4% гипохлорите натрия и отмывают 3 раза по 5 мин в стерильной дистиллированной воде. Стерильные семена для получения полноценных растений in vitro помещают в контейнеры на агаризованную питательную безгормональную среду (например, среда Gamborg, табл.1). Контейнеры инкубируют при освещенности 120 μЕ в условиях фотопериода 16 часов день/8 часов ночь при температуре +19÷21°С.
2. Подготовка рекомбинантного штамма A. tumefaciens к сокультивации.
Штамм засевают штрихом на питательную среду (например, среда LB, табл.4) и выдерживают в течение на 3±0,5 суток в темноте при +25-28°С±1°С.
За два дня до планируемой трансформации засевают смесью колоний первую (I) ночную культуру штамма в питательной среде (например, среда LB, табл.4) объемом 1-6 мл ±0,2 и культивируют при +25-28°С±1°С и 100-140±10 об/мин.
За день до сокультивации засевают вторую (II) ночную культуру объемом 5-10±0,3 мл. Для этого вносят в питательную среду (например, среда LB, табл.4) ночную культуру I в количестве 1/100 от конечного объема и культивируют при +25-28°С±1°С и 100-140±10 об./мин.
3. Получение эксплантов и прекультивация.
От проростка отделяют корень и семядоли вместе с пазушной почкой, стебель нарезают на сегменты длиной 5-7±2 мм. Заливают чашки Петри небольшим количеством (4-5±1 мл) питательной среды (например, среда Gamborg, табл.1) и накрывают бумажным стерильным фильтром. Экспланты раскладывают поверх фильтра и оставляют на 24±4 часа при 18-21°С±1°С в темноте.
4. Трансформация.
А. Первый день (сокультивация).
Фильтры с эксплантами после прекультивации аккуратно снимают с поверхности агаризованной среды, наносят на среду ночную культуру II рекомбинантного штамма A. tumefaciens (0,2-0,5±0,05 мл), равномерно распределяя ее по поверхности, а затем помещают фильтры с эксплантами поверх нанесенной суспензии штамма и оставляют для сокультивации на 24±2 часа при 16-20°C±1°C. В контрольных вариантах вместо суспензии агробактерии используют такое же количество жидкой питательной среды (например, среда LB, табл.4).
Б. Второй день.
Переносят экспланты без фильтра на питательную среду, содержащую антибиотик для элиминации агробактерии в концентрации 20 мг/л, и компоненты, необходимые для инициации каллусообразования и последующей регенерации: БАП в концентрации 1,0÷2,5 мг/л и кинетин в концентрации 0,5÷2,0 мг/л (для Мэг-2 дополнительно борную кислоту в концентрации 100-200 мг/л). Для этих целей может быть использована среда Gamborg. Инициация каллусообразования и последующая регенерация ведется при фотопериоде 16 часов день/8 часов ночь и при температуре +19÷21°С.
В. Последующие дни до появления регенерантов.
Через каждые 14 дней переносят экспланты на свежие чашки Петри со средой для каллусообразования и регенерации того же состава.
5. Первичный отбор регенерантов.
Появившиеся регенеранты срезают и переносят в пробирки со средой для укоренения (например, среда RIM, табл.1), в которую добавляют селективный агент, выбранный в зависимости от используемой генетической конструкции.
Первичные регенеранты, укоренившиеся на селективной среде, считают прошедшими первичный отбор.
6. Отбор трансформированных растений.
А. Выделение ДНК
25-50 мг ткани листовой пластинки растирают в гомогенизаторе в 120 мкл буфера I (50 mM Tris HCl, рН 8.0; 10 mМ EDTA; 50 мкг/мл панкреатической РНКазы) до получения гомогенной суспензии. Затем к полученной суспензии добавляют 125 мкл лизирующего буфера II (0.2 М NaOH; 1% додецил сульфата Na). Полученную смесь обрабатывают в шейкере 2 мин при комнатной температуре, переносят в пробирки, которые помещают в термостат и инкубируют при 65°С в течение 45 мин. По окончании инкубации лизат охлаждают до температуры 20-25°С и добавляют в каждую пробирку по 125 мкл нейтрализующего раствора III (2.5 mM ацетата К, рН 4.5). Содержимое пробирок тщательно перемешивают на шейкере и центрифугируют при 14000 об/мин в течение 10 мин. Надосадочную жидкость переносят в новые микроцентрифужные пробирки, содержащие 500 мкл смолы Wizard MaxiPreps и далее выделяют ДНК согласно рекомендациям фирмы Promega для набора Wizard Preps.
Б. ПЦР-анализ образцов ДНК
Для проведения ПЦР используют ДНК-амплификатор (″Терцик-2000″). Условия проведения ПЦР:
35 циклов (94°С - 30 сек, 55°С - 30 сек, 72°С - 90 сек) и окончательная полимеризация - 7 мин.
В качестве матрицы используют выделенные образцы геномной ДНК, в качестве прамеров - bar1 и bar2.
Состав реакционной смеси для ПЦР:
- Праймеры - по 25 пМ каждого;
- 10X буфер - 2,5 мкл;
- 2 мМ dNTP - 2,5 мкл;
- BioTaq полимераза 5Е мкл - 0,5 мкл;
- ДНК-матрица - 100 нг;
- Н2О - до 25 мкл.
Для центрифугирования используют настольную микроцентрифугу (Eppendorf 5415C) с максимальной скоростью вращения ротора 14000 об/мин. Термостатирование образцов осуществляют в сухом термостате (″Термо 28-23″).
Анализ продуктов ПЦР осуществляют методом электрофореза в агарозном геле при напряженности электрического поля 6 В/см с последующим окрашиванием гелей бромистым этидием (концентрация красящего раствора 1 мкг/мл в воде, время окрашивания - 20 мин при комнатной температуре) и фотографированием полученной картины в ультрафиолете (длина волны - 260-280 нм) цифровым фотоаппаратом. Обработку оцифрованной информации проводят при помощи пакета Adobe Photoshop 7.0.
Заключение о встраивании в геном растения чужеродного гена делают на основании появления продукта ПЦР с ожидаемым (в зависимости от используемых специфических праймеров) размером.
Далее приводятся конкретные примеры осуществления изобретения, которые не могут рассматриваться как ограничивающие его объем.
Пример 1. Получение трансгенных растений капусты белокочанной линии Гэс-2, содержащих ген bar.
1.1 В качестве родительской линии использовали Гэс-2. Для получения исходного растительного материала для трансформации семена обрабатывали и проращивали, как описано в п.1 раздела ″Методики″. При этом использовали агаризованную безгормональную среду Gamborg.
1.2 Для трансформации использовали штамм Agrobacterium tumefaciens LBA 4404, содержащий плазмиду pBar, которая включает генетическую конструкцию:
промотор 35S - ген bar - NOS терминатор.
Подготовку штамма A. tumefaciens LBA 4404 проводили в соответствии с п.2 раздела ″Методики″, используя питательную среду LB.
1.3 Готовили и прокультивировали эксплантаты на питательной среде Gamborg, как описано в п.3 раздела ″Методики″.
1.4 Трансформацию осуществляли в полном соответствии со схемой, приведенной в разделе ″Методики″.
При сокультивации (первый день трансформации) параллельно с опытными образцами ставились контрольные, в которых вместо суспензии штамма A. tumefaciens LBA 4404 использовали такое же количество жидкой питательной среды LB.
Через 24 часа после начала сокультивации (второй день трансформации) помещали экспланты на питательную среду Gamborg, содержащую БАП в концентрации 2,0±0,01 мг/л и кинетин в концентрации 1,0±0,01 мг/л, к которой добавляли антибиотик карбенициллин в концентрации 50 мг/л.
Через 14 дней после сокультивации переносили экспланты на свежие чашки Петри со средой для каллусообразования и регенерации того же состава. Далее повторяли эту операцию через каждые 14 дней.
1.5. При появлении регенерантов их срезали и переносили для укоренения в пробирки, содержащие среду Gamborg с НУК в концентрации 0,2±0,02 мг/л и глюфосинатом аммония (селективный агент) в концентрации 5,0±0,1 мг/л. Регенеранты, укоренившиеся на среде с селективным агентом, отбирали для дальнейших анализов.
Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для укоренения без добавления селективного агента (среда RIM, табл.1).
1.6 Прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции. Для этого из ткани листовых пластинок растения выделяли геномную ДНК, как это описано в п.6А раздела ″Методики″. Концентрация ДНК в полученных препаратах составляла 15-100 мкг/мл. Полученные препараты ДНК были хорошего качества (λ260: λ280>1-8, содержание РНК по данным электрофоретического анализа менее 1%), позволяющего использовать их для амплификации.
Выделенную из регенерантов ДНК использовали в качестве матрицы при проведении ПЦР (состав реакционной среды и условия проведения описаны выше).
Для ПЦР-анализа генома растений на наличие гена bar были использованы праймеры:
Bar1 primer: 5'ТСА АСС ACT АСА TCG АСА САА G 3'
bar2 primer: 5'TGA AGT CCA GCT GCC AGA AAC C 3'
Расстояние между участками связывания праймеров в использованной генетической конструкции составляет 356 нуклеотидов, поэтому появление ПЦР-продукта с таким размером (при отсутствии его в контроле) должно расцениваться как свидетельство включения гена bar в геномную ДНК анализируемой линии.
Анализ ПЦР-продуктов проводился в полном соответствии с методикой, приведенной в п.6Б раздела ″Методики″.
Результаты. При проведении одного трансформационного эксперимента (по описанному выше протоколу) было получено 98 регенерантов из 113 эксплантов от 45 исходных растений. Таким образом, эффективность регенерации (процентное отношение количества регенерантов к количеству эксплантов) составила 86,7%.
Молекулярный анализ методом ПЦР (фиг.1) подтвердил наличие перенесенного гена bar в геноме 7 растений, следовательно, эффективность трансформации (процентное отношение трансформантов к количеству регенерантов) составила в данном эксперименте 7,1%.
По результатам пяти экспериментов она варьировала от 6% до 7,1%.
Пример 2. Получение трансгенных растений капусты белокочанной линии Мэг-2, содержащих ген bar.
1.1 В качестве родительской линии использовали Мэг-2.
Стадии 1.2-1.6 осуществляли так же, как в примере 1.
Результаты. При проведении одного трансформационного эксперимента (по описанному выше протоколу) было получено 35 регенерантов из 91 эксплантов от 45 исходных растений. Таким образом, эффективность регенерации (процентное отношение количества регенерантов к количеству эксплантов) составила 38,4%.
Молекулярный анализ методом ПНР подтвердил наличие перенесенного гена bar в геноме 1 растения, следовательно, эффективность трансформации (процентное отношение трансформантов к количеству регенерантов) составила в данном эксперименте 2,8%.
Повысить эффективность регенерации и трансформации до уровня, достигнутого с двумя другими линиями, удалось при добавлении в среду для каллусообразования и регенерации борной кислоты в концентрации 150 мг\л. При проведении одного трансформационного эксперимента по модифицированной методике было получено 72 регенеранта из 114 эксплантов от 40 исходных растений. Таким образом, эффективность регенерации (процентное отношение количества регенерантов к количеству эксплантов) составила 63,2%. Молекулярный анализ методом ПЦР подтвердил наличие перенесенного гена bar в геноме 4 растений, следовательно, эффективность трансформации (процентное отношение трансформантов к количеству регенерантов) составила в данном эксперименте 5,5%.
По результатам трех экспериментов по модифицированной методике эффективность трансформации варьировала от 4,2% до 5,5%.
Пример 3. Получение трансгенных растений капусты белокочанной линии Дрв-2, содержащих ген bar.
1.1. В качестве родительской линии использовали Дрв-2. Для получения исходного растительного материала для трансформации семена обрабатывали и проращивали, как описано в п.1 раздела ″Методики″. При этом использовали агаризованную безгормональную среду Gamborg.
Стадии 1.2-1.6 осуществляли так же, как в примере 1, за исключением того, что на стадии 1.4 экспланты после 24 часов сокультивации переносили на питательную среду Gamborg, содержащую БАП в концентрации 0,75±0,01 мг/л и кинетин в концентрации 0,5±0,01 мг/л, к которой добавляли антибиотик карбенициллин в концентрации 50 мг/л.
Результаты. При проведении одного трансформационного эксперимента (по описанному выше протоколу) было получено 82 регенеранта из 110 эксплантов от 45 исходных растений. Таким образом, эффективность регенерации (процентное отношение количества регенерантов к количеству эксплантов) составила 74,7%.
Молекулярный анализ методом ПЦР подтвердил наличие перенесенного гена bar в геноме 9 растений, следовательно, эффективность трансформации (процентное отношение трансформантов к количеству регенерантов) составила в данном эксперименте 10,9%.
По результатам трех экспериментов по модифицированной методике эффективность трансформации варьировала от 7,4% до 10,9%.
При проведении трансформации любой из трех линий капусты белокочанной, использованной в примерах 1-3, замена кинетина другим ростовым гормоном, а также отклонение от предлагаемого интервала его концентрации (0,5-2,0 мг/л) в питательной среде для инициации каллусообразования и регенерации приводило к существенному снижению эффективности трансформации. Аналогичный результат наблюдался и в тех случаях, когда сокультивацию осуществляли без использования стерильного фильтра, а обработку антибиотиком (карбенициллином) проводили как отдельную стадию перед инициацией каллусообразования. Это свидетельствует о существенности для получения запланированного результата всех указанных признаков в совокупности.
Используемые в работе препараты, приготовление, состав и хранение питательных сред.
Состав питательных сред для поддержания культуры in vitro и трансформационного процесса
** Gamborg OL, Miller RA, Ojima К (1968).
Для приготовления сред, представленных в табл.1, готовили раствор Gamborg-солей в деионизованной воде, доводя рН до значения 5,6-5,8±0,1 с помощью растворов 1N КОН и 1N HCl. Стерилизацию сред осуществляли в автоклаве при 1 атм, 121°С в течение 20 минут. После охлаждения среды до +45÷50°С добавляли витамины (табл.2), гормоны, антибиотики и селективные агенты (методика приготовления и концентрации стоков см. табл.3) соответственно составу сред и заливали чашки Петри (⊘ 9 см) по 20±5 мл среды в каждую.
Состав комплекса витаминов
Приготовление и условия хранения компонентов питательных сред
25 мг/мл
*** - стоки антибиотиков хранятся 1 месяц при +4°С; при -20°С большинство антибиотиков сохраняют стабильность в течение нескольких месяцев.
Состав питательной среды Luria-Bertani

Список сокращений
Изобретение относится к биотехнологии, в частности к способу получения генетически модифицированных растений капусты белокочанной. Проводят сокультивацию эксплантов капусты белокочанной отечественных сортов со штаммом агробактерии, несущим плазмиды с селективными маркерными и полезными генами. Суспензию штамма наносят равномерно на поверхность агаризованной питательной среды, накрывают ее бумажным фильтром и раскладывают на фильтры экспланты на 24±2 часа при 16-20±1°С. С целью инициации каллусообразования и регенерации экспланты помещают на питательную среду, содержащую кинетин в количестве 0,5-20 мг/л, БАП в количестве 1,0-4,5 мг/л и антибиотик карбенициллин в концентрации 40-50 мг/л. Настоящее изобретение позволяет повысить эффективность способа и унифицировать процедуру трансформации. 6 з.п. ф-лы, 1 ил., 5 табл.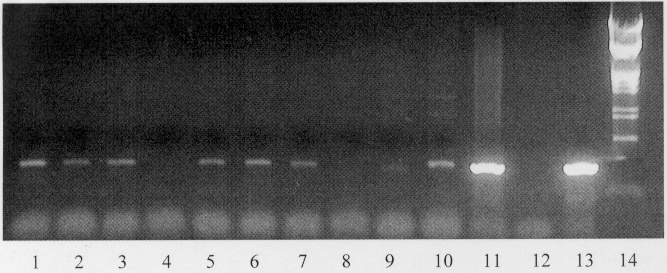
| Р.К.PIUS, P.N.ACHAR | |||
| Трансформация с помощью Agrobacterium и регенерация растений Brassica oleracea var | |||
| capitata Plant Cell Reports, 2000, 19:888-892 | |||
| US 5750871, 30.03.1995 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ РАСТЕНИЙ КАРТОФЕЛЯ СОРТА ЧАРОДЕЙ С ПОМОЩЬЮ AGROBACTERIUM TUMEFACIENS | 2002 |
|
RU2231548C2 |
Авторы
Даты
2006-11-10—Публикация
2005-04-15—Подача