Изобретение относится к селекции и биотехнологии растений, в частности генной инженерии. Изобретение может быть использовано для получения генетически модифицированных растений картофеля сорта Голубизна, экспрессирующего различные гетерологичные гены.
Способ получения трансгенных растений картофеля сорта Голубизна заключается в генетической трансформации сегментов стебля (эксплантов) in vitro культивируемых растений картофеля методом сокультивирования с Agrobacterium tumefaciens, несущей рекомбинантные плазмиды с селективными, маркерными и полезными генами, и в последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и сохраняющих все признаки исходного сорта.
Картофель (Solanum tuberosum var. tuberosum) выращивается в России повсеместно, практически во всех климатических зонах. Относительно высокая продуктивность при известной простоте возделывания позволяет картофелю стабильно занимать второе место после злаковых культур в отечественном сельскохозяйственном производстве. Сегодня более 90% товарного картофеля производится в личных подсобных хозяйствах (ЛПХ), а для наименее обеспеченных слоев населения картофель находится на первом месте в рационе питания.
Таким образом, проблема получения стабильного урожая картофеля является одной из важнейших. В России решение этой проблемы осложняется рядом неблагоприятных факторов, среди которых основное место занимают потери урожая от болезней, вредителей и сорной растительности.
Первые работы по трансформации картофеля были начаты в восьмидесятых годах XX века [Ooms G., Hooykaas P.J.J., van Veen R.J.M., van Bellen P., Regensburg-Tuink T.J.G., Schilperoort R.A. Plasmid 1985 7: 15-29], и в 1986 году впервые была показана возможность получения картофеля с использованием Agrobacterium tumefaciens [An G., Watson B.D., Chiang C.C. Plant Physiology, 1986, v.81, p.301-305], сотрудниками Центра "Биоинженерия" РАН в 1990-1992 г.г. [Глагоцкая Т.Ц., Шульга О.А., Сидоров В.А., Захарьев В.М., Скрябин К.Г., Глеба Ю.Ю. ДАН СССР 314, №5, с.1240-1242, 1990, Feher A., Skryabin K.G., Balazs E., Preiszner J., Shulga O.A., Zakharyev V.M., Dudits D. Plant Cell Reports, 1992, v.ll, p.48-52].
За первыми попытками последовало более 200 работ, многие из которых посвящены модификации и оптимизации процедуры трансформации [Tavazza R., Tavazza М., Ordas R.J., Ancora G., Benvenuto E. Plant Science, 1988. v.59, p.175-181; Snyder G.W. & Belknap W.R. Plant Cell Reports, 1993, v.l2, p.324-327]. Миновав первый этап разработки и освоения методов трансформации, к настоящему моменту во многих странах перешли к этапу внедрения полученных результатов в производство, что в свою очередь обусловило переход от работы с модельными легко трансформируемыми генотипами к коммерческим генотипам (сортам). Однако подавляющее большинство коммерческих сортов картофеля, включая и основные российские сорта, не относится к легко трансформируемым.
Несмотря на усилия по созданию единой эффективной методики трансформации такая система трансформации для различных генотипов (сортов) до сих пор не создана. При необходимости получения модифицированных растений трудно трансформируемых коммерческих сортов приходится проводить оптимизацию протокола для каждого генотипа [Wordragen M.F. & Dons H.J.M. Plant Molecular biology reporter, 1992, v.l0(l), p.l2-36].
Наиболее близким к предложенному является способ получения генетически модифицированных растений [Гулина И.В. Создание трансгенных растений картофеля, экспрессирующих модифицированный ген δ-эндотоксина из В. thuringiensisvar tenebrionis. Диссертация, М., 1994, с.9, б-ка Института молекулярной биологии им. В.А.Энгельгардта].
Стеблевые сегменты картофеля получали из растений, выращенных асептически в течение четырех недель на среде S1, и переносили их в жидкую среду MS. Ночную культуру штамма Agrobactenum tumefaciens добавляли к стеблевым сегментам, находящимся в чашке Петри в 10 мл жидкой среды MS таким образом, чтобы соотношение культуры штамма Agrobacterium и среды инкубирования составляло 1:20. Сокультивирование штамма Agrobacterium и стеблевых сегментов растений картофеля проводили в течение 16-18 часов при 28°С в темноте. По окончании инкубации сегменты переносили на среду MS, содержащую агар в концентрации 0,7%. Через трое суток сегменты переносили на среду MSV с фитогормонами состава: 0,2 мг/л НУК, 1 мг/л зеатина, 0,02 мг/л ГК3, 1 мг/л БАП, соли MS, 0,7% агар, 100 мкг/мл цефотаксима, 200 мкг/мл карбенициллина, 50 мкг/мл канамицина. Регенеранты переносили на среду S1, содержащую селективный агент и цефотаксим, чтобы предупредить агробактериальное заражение растений. Этот способ получения генетически модифицированных растений картофеля осуществляется следующим образом (модификация известного метода Horsch R.B., Rogers S.G., Fraley R.T. Transgenic plants. Cold Spring Harb Symp Quant Biol. 1985; 50:433-7).
Данная методика не является эффективной для картофеля сорта Голубизна.
В ближайшем аналоге раскрыта методика получения трансгенного картофеля на примере другого сорта. По мнению авторов заявки и большинства специалистов в данной области процессы регенерации и трансформации растений являются генотипзависимыми, то есть эффективность и возможность получения положительного результата во многом определяются самим генотипом (в данном случае - сортом).
Из этого следует, что для достижения высокой эффективности необходимо заново подобрать все условия (параметры) регенерации -трансформации для каждого конкретного сорта (генотипа).
Авторы использовали методику для сорта Голубизна и получили низкую эффективность регенерации и трансформации (эти цифры приведены ниже).
Задачей изобретения является создание эффективной методики трансформации растений картофеля сорта Голубизна.
Технический результат изобретения заключается в повышении эффективности трансформации данного генотипа.
Развитие биотехнологии привело к переходу от фундаментальных работ к решению практических задач сельского хозяйства, фармацевтики, медицины. Для решения таких задач возникает проблема не просто получения трансгенного растения, а получения достаточного (по разным оценкам от сотен до нескольких тысяч) количества первичных трансгенных растений - индивидуальных трансформационных событий, среди общего пула которых возможно будет выбрать удовлетворяющие всем требованиям селекционеров - оригинаторов (трансгенное растение не должно отличаться от исходного по сортовым характеристикам), требованиям биобезопасности (стабильности введенной вставки в геноме в поколениях и т.д.), требованиям пищевой безопасности (генетически модифицированное не должно отличаться от исходного растения по пищевым и токсикологическим характеристикам). Таким образом, чем большее количество первичных трансгенных растений будет получено, тем быстрее и эффективнее будет решена конкретная задача.
Эффективность трансформации, понимаемая как отношение количества первичных трансгенных растений (для которых подтверждено наличие вставки в геноме) к общему количеству полученных регенерантов, напрямую зависит от эффективности регенерации, которая определяется как отношение количества полученных регенерантов (среди них могут быть как трансгенные, так и “пустые” не трансгенные растения) к количеству эксплантов (то есть к количеству затраченного исходного материала). Оба показателя обычно представляют в процентах.
Технический результат достигается тем, что в способе получения генетически модифицированных растений картофеля, заключающемся в сокультивировании эксплантов со штаммом Agrobacterium tumefaciens, несущим рекомбинантные плазмиды с селективными маркерными и полезными генами, помещении эксплантов на питательную среду для инициации каллусообразования и последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и признаки исходного сорта, сокультивацию эксплантов картофеля сорта Голубизна предпочтительно осуществлять путем раскладывания эксплантов на бумажном фильтре, накрывающем поверхность агаризованной питательной средой с равномерно нанесенной на ней разведенной суспензией штамма Agrobacterium или смоченном разведенной суспензией штамма Agrobacterium, и выдержки в течение 48±4 часов при 18-21°C±1°C, для инициации каллусообразования используют питательную среду, содержащую БАЛ в количестве 2,5÷5,5 мг/л и НУК в количестве 0,01-0,05 мг/л, а на среду для регенерации, содержащую БАП в количестве 2,2-5,5 мг/л и ГК3 в количестве 0,01÷0,05 мг/л, экспланты переносят на восьмой день.
Для подготовки штамма Agrobacterium целесообразно его предварительно засевать штрихом на питательную среду на 3±0,5 суток в темноте при 24-29°С, за двое суток до сокультивации засевают полученной смесью колоний первую ночную культуру штамма Agrobacterium в питательной среде, за одни сутки до сокультивации засевают вторую ночную культуру путем внесения в питательную среду первой ночной культуры, в день сокультивации концентрируют ночную культуру, то есть осаждают и разводят осадок в жидкой среде.
Кроме того, после сокультивации отмывку эксплантов предпочтительно осуществлять путем помещения эксплантов в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium, на 5-10 минут при комнатной температуре.
В другом варианте после помещения эксплантов в раствор отмывку можно проводить с использованием ротационной качалки.
Перечень графических материалов.
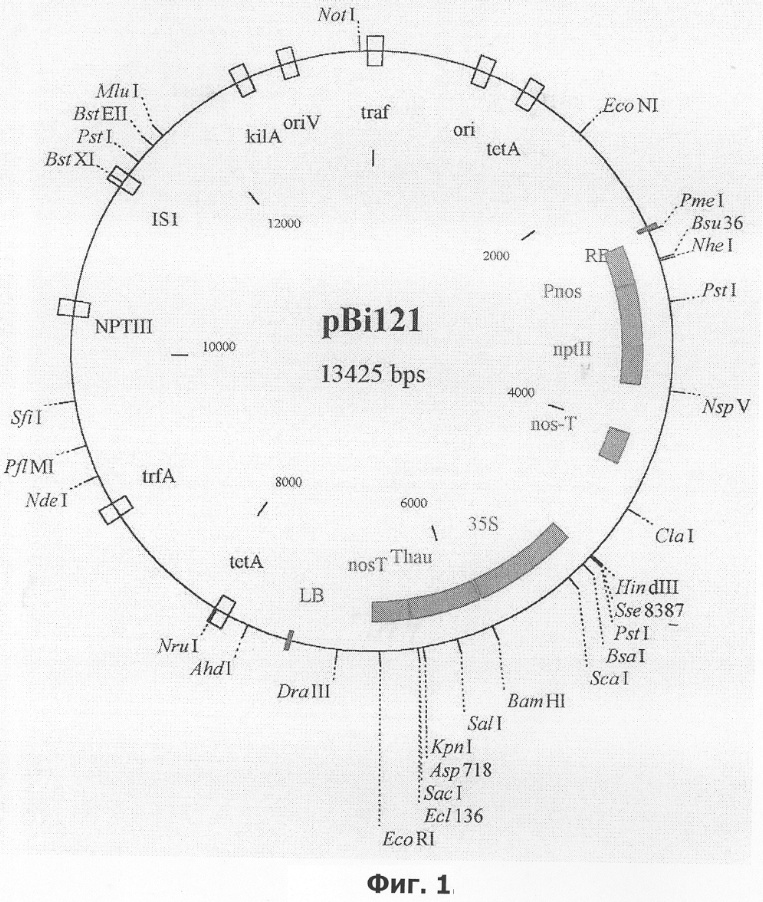
На фиг.1 приведена карта плазмиды pBI121.
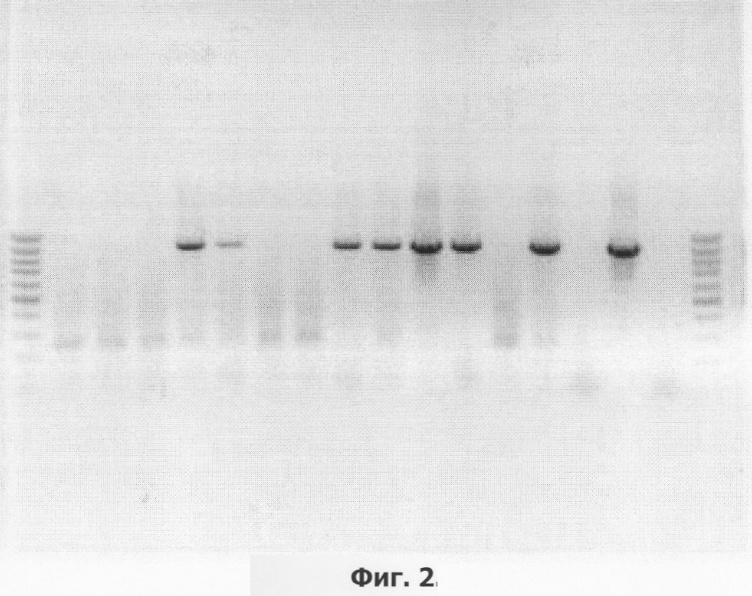
На фиг.2 приведен пример электрофоретического анализа продуктов ПНР на препаратах ДНК модифицированных линий сорта Голубизна (негатив).
Дорожки:
1,18 - маркер молекулярной массы GeneRuler Fermentas, 100 bp;
2, 3, 4, 7, 8, 13 - ПНР на препаратах ДНК растений, в которых не обнаружена трансгенная вставка;
5, 6, 9, 10, 11, 12, 14 - ПЦР на препаратах ДНК растений, в которых обнаружен перенесенный ген thau II;
15 - ПЦР на препарате ДНК растений исходного нетрансформированного сорта Голубизна;
16 - продукт ПЦР на плазмидной ДНК (0,1 нг/реакцию), использованной для трансформации растений;
17 - ПЦР в отсутствие ДНК-матрицы (контроль качества реакционной смеси).
Способ получения генетически модифицированных растений картофеля сорта Голубизна осуществляется следующим образом.
Данный протокол рассчитан на постановку одного трансформационного эксперимента исходя из среднего количества исходных материнских растений - 100±10 шт. Среднее количество эксплантов - 500±50 шт.
Культура исходных растений: исходные растения, свободные от вирусной и вироидной инфекции, культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (например, среда Msbase, табл.1) при температуре +18-22°С±1°С в дневное и +15-18°С±1°С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120 μE) 3-5 недель.
Подготовку штамма Agrobacterium проводили следующим способом.
Засевали штамм Agrobacterium tumefaciens штрихом на питательную среду (например, среда LB, табл.4) на 3±0,5 суток в темноте при +25-28°С±1°С.
За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма Agrobacterium объемом 1-6 мл ±0,2 в питательной среде (например, среда LB, табл.4) при +25-28°С±1°С, 100-140±10 об/мин.
За день до сокультивации засевали вторую (II) ночную культуру объемом 5-10±3 мл. Для этого вносили в питательную среду (например, среда LB, табл.4) ночную культуру I в количестве 1/100 от конечного объема ночной культуры I. Культивировали при +25-28°С±1°С, 100-140±10 об/мин.
Первый день трансформации
1. Концентрировали ночную культуру II, осадив при 3,5-5±0,5 тыс. об./мин в течение 3-10±1 мин. Разводили полученный осадок в 3-10±1 мл жидкой среды (например, среда СМ, табл.1).
2. Нарезали стебель на сегменты без пазушных почек длиной 5-10±2 мм.
3. Сокультивация:
Вариант I. Заливали чашки Петри небольшим количеством (4-5±1 мл) питательной среды (например, среда Msbase, табл.1), наносили разведенную суспензию штамма Agrobacterium 300-500±100 равномерно по поверхности агара, сверху накрывали бумажным фильтром, экспланты раскладывали на фильтре для сокультивации на 48±4 часов при 18-22°С±1°С.
Вариант II. В чашки Петри помещали стерильные бумажные фильтры, равномерно смачивали их небольшим количеством разведенной бактериальной суспензии (1-3±0,5 мл), экспланты раскладывали на влажном фильтре для сокультивации на 48±4 часов при 18-22°С±1°С.
В контрольном варианте использовали вместо суспензии штамма Agrobacterium такое же количество жидкой питательной среды (например, среда СМ, табл.1).
4. Отмывка эксплантов:
Вариант I. Помещали экспланты в раствор (1550±10 мл), содержащий жидкую среду (например, среда Msbase, табл.1) и раствор антибиотика, подавляющего развитие штамма Agrobacterium, на 10-30±5 минут при комнатной температуре (18-20°С±1°С).
Вариант II. Экспланты в растворе жидкой среды и антибиотика, приготовленном как в варианте I, отмывали с использованием ротационной качалки (шейкера) при 50-70±10 об/мин в течение 15-30±10 минут при комнатной температуре (18-20°С±1°С).
Третий день трансформации
После сокультивации (включая этап отмывки, когда она необходима) помещали экспланты на питательную среду (например, среда CIM, табл.1) для инициации каллусообразования.
Использовали в питательной среде для инициации каллусообразования: БАП в концентрации от 3 до 5±0,5 мг/л и НУК в концентрации от 0,02 до 0,04±0,01 мг/л.
Восьмой день
Переносили экспланты на чашки со средой для регенерации (например, среда RM, табл.1) с добавлением селективного агента, выбранного в зависимости от используемой генетической конструкции.
Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации без добавления селективного агента (например, среда RM, табл.1).
Использовали в питательной среде для регенерации: БАП в концентрации от 3 до 5±0,5 мг/л и ГК3 в концентрации от 0,02 до 0,04±0,01 мг/л.
Через каждые 14 дней
Переносили экспланты на свежие чашки Петри со средой для регенерации того же состава.
При появлении регенерантов
Срезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (например, среда RIM, табл.1).
Первичные регенеранты, укоренившиеся на селективной среде, считали прошедшими первичный отбор.
Далее прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Уровень экспрессии целевого гена проверяли при помощи иммуноферментного анализа [Towbin H., Staehelin Т., Gordon J. Proc. Natl. Acad. Sci. USA 1979, v. 76(9): 4350-4].
Эффективность регенерации для предлагаемого способа составила 174,5% по сравнению с 95,6% для способа по ближайшему аналогу.
Эффективность трансформации в целом составила 22,2% по сравнению с 14,7% для способа по ближайшему аналогу.
Экспериментальный пример использования патентуемого способа получения трансгенных растений картофеля сорта Голубизна
Эксперимент по получению трансгенных растений картофеля сорта Голубизна, экспрессирующих ген thou II суперсладкого белка из тропического растения Thaumatococcus danielli.
Культура исходных растений: исходные растения, свободные от вирусной и вироидной инфекции в количестве 98 шт. культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (среда Msbase, табл.1) при температуре +18-21°С±l°C в дневное и +15-18°С±1°С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120 μE) 4 недели.
Для трансформации использовали штамм Agrobacterium tumefaciens СВЕ 121, содержащий плазмиду рВI121 (фиг.1), в состав кассеты экспрессии которой входят генетические конструкции:
промотор pNOS - ген NPTII - NOS-T терминатор 35S промотор-ген than II- NOS Т терминатор.
Подготовку штамма A. tumefaciens СВЕ 121 проводили следующим образом. Засевали штамм A. tumefaciens СВЕ 121, штрихом на питательную среду LB (табл.4) содержащую селективные антибиотики рифампицин и канамицин в концентрации 25 мг/л и 50 мг/л соответственно, на 3±0,5 суток в темноте, при +26°С±1°С.
За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма A. tumefaciens СВЕ 121 объемом 6 мл ±0,2 в питательной среде среда LB (табл.4), содержащей селективные антибиотики рифампицин и канамицин в концентрации 25 мг/л и 50 мг/л соответственно, при +26°С±1°С, 100-140±10 об/мин.
За день до сокультивации засевали вторую (II) ночную культуру объемом 6±1 мл. Для этого вносили в питательную среду LB (табл.4), содержащую селективные антибиотики рифампицин и канамицин в концентрации 25 мг/л и 50 мг/л соответственно, ночную культуру I в количестве 1/100 от конечного объема. Культивировали при +26°С±1°С, 100-140±10 об/мин.
Первый день трансформации
Концентрировали ночную культуру II, осадив при 3,5±0,5 тыс. об/мин в течение 3±1 мин. Разводили полученный осадок в 5±1 мл жидкой среды (среда СМ, табл.1).Нарезали стебель на сегменты без пазушных почек длиной 5-10±2 мм.
Для проведения этапа сокультивации заливали чашки Петри небольшим количеством (5±1 мл) питательной среды (например, среда Msbase, табл.1), наносили разведенную суспензию штамма Agrobacterium 200±10 мкл равномерно по поверхности агара, сверху накрывали бумажным фильтром, экспланты раскладывали на фильтре для сокультивации на 48±4 часов при 18-22°С±1°С.
В контрольном варианте вместо суспензии штамма A. tumefaciens СВЕ 121 использовали такое же количество жидкой питательной среды (среда СМ, табл.1).
После проведения этапа сокультивации экспланты не отмывали, так как это не было необходимо.
Третий день трансформации
После сокультивации помещали экспланты на питательную среду (среда CIM, табл.1) для инициации каллусообразования.
Использовали в питательной среде для инициации каллусообразования: БАП в концентрации от 5±0,01 мг/л и НУК в концентрации от 0,02±0,001 мг/л.
Восьмой день
Переносили экспланты на чашки со средой RM для регенерации (среда RM, табл.1) с добавлением селективного агента антибиотика канамицина в концентрации 100 мг/л. В качестве селективного агента использовали антибиотик канамицин, так как генетическая конструкция содержит ген NPT II, кодирующий фермент неомицинфосфотранцферазу, экспрессия которого обеспечивает устойчивость к антибиотику канамицину.
Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации без добавления селективного агента (среда RM, табл.1).
Использовали в питательной среде для регенерации: БАП в концентрации 5±0,01 мг/л и ГК3 в концентрации 0,02±0,001 мг/л.
Через каждые 14 дней
Переносили экспланты на свежие чашки Петри со средой для регенерации того же состава.
При появлении регенерантов
Срезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (среда RIM, табл.1).
Первичные регенеранты, укоренившиеся на селективной среде, содержащей антибиотик канамицин в концентрации 100 мг/л, считали прошедшими первичный отбор.
Далее прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Для ПЦР-анализа генома растений на наличие гена thaull были использованы праймеры ThauF и ThauR, последовательность которых была сконструирована на основе данных генбанка о последовательности гена тауматина T.daniellii (gi|3319903|emb|AJ007626.1|СМУ7626) и промотора E35S (gi|170190|gb|J01209.1|TDATHAU2). Оба праймера находятся на расстоянии 907 нуклеотидов друг от друга.
TF primer: 5'- СТG CCG ACA GTG GTC CCA AAG ATG GAC СС- 3'29 bp
>gi|3319903|emb|AJ007626.1|CMV7626 Cauliflower mosaic virus 35S promoter with artifical insert of 80 bp Length = 423
Score = 58.0 bits (29), Expect = 2e-07
Identities = 29/29 (100%) Strand = Plus/Minus
Query: 1 ctgccgacagtggtcccaaagatggaccc 29
Sbjct: 294 ctgccgacagtggtcccaaagatggaccc 266
TR primer: 5'- CAG TAG GGC AGA AAG TGA CCC TGT AGT TG- 3' 29 bp
>gi|170190|gb|J01209.1|TDATHAU2 T.daniellii preprothaumatin-2 mRNA, complete cds Length = 931
Score =58.0 bits (29), Expect = 2e-07
Identities = 29/29 (100%) Strand = Plus/Minus
Query: 1 cagtagggcagaaagtgaccctgtagttg 29
Sbjct: 716 cagtagggcagaaagtgaccctgtagttg 688
Методика проведения ПЦР - анализа
Проведение ПЦР осуществляли на ДНК-амплификаторе Techne Genius. Центрифугирование осуществляли на настольной микроцентрифуге Eppendorf 5415C, с максимальной скорость вращения ротора 14000 об/мин. Термостатирование образцов осуществляли в сухом термостате “Термо 28-23”. Анализ продуктов ПЦР производили путем электрофореза в агарозном геле соответствующей концентрации при напряженности электрического поля 6 В/см с последующим окрашиванием гелей бромистым этидием (концентрация красящего раствора 1 мкг/мл в воде, время окрашивания - 20 минут при комнатной температуре) и фотографированием полученной картины в ультрафиолете (длина волны - 260-280 нм) на фотопленку “Микрат-Изопан” при помощи TTL-фотоаппарата типа “Зенит” (светофильтр КС-8). Ввод полученных данных электрофореза в компьютер осуществляли посредством прямого сканирования негативов на сканере Mustek 9600. Обработку оцифрованной информации проводили при помощи пакета Adobe Photoshop 5.0.
Состав реакционной смеси для ПЦР:
- Праймеры - по 25 пМ каждого;
- 10× буфер - 2,5 мкл;
- 2 мМ dNTP - 2,5 мкл;
- BioTaq полимераза 5Е мкл - 0,5 мкл;
- ДНК-матрица - 100 нг;
- Н2O - до 25 мкл.
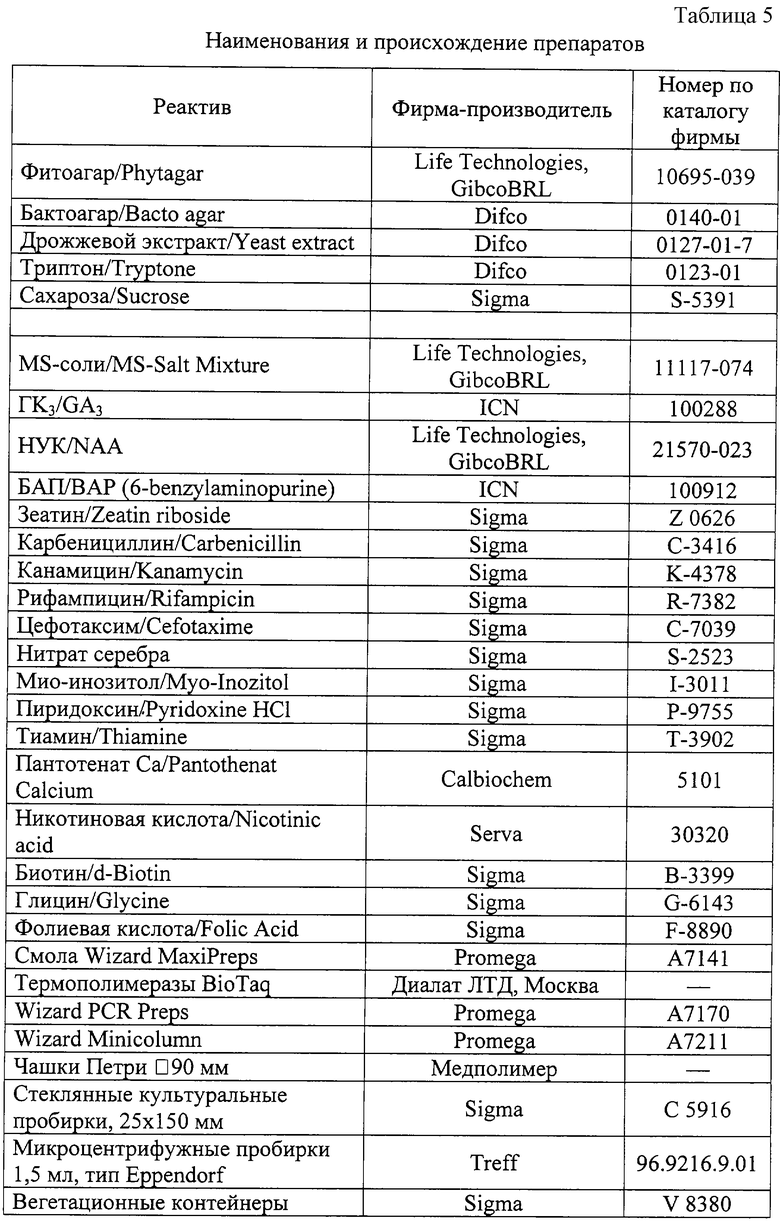
В табл. 5 приведены наименования и происхождение препаратов.
Условия проведения ПНР были выбраны следующие: 43 цикла: 94°С - 5 сек, 55°С - 5 сек, 72°С - 20 сек, окончательная полимеризация -7 минут.
Появление продукта ПЦР с указанными праймерами и длиной 907 нуклеотидов при условии отсутствия его в реакциях, поставленных на контрольной ДНК, свидетельствовало о присутствии искомого гена в геномной ДНК анализируемой линии.
Иммуноферментный анализ белка тауматин II
Ткани трансформированных и контрольных растений замораживали в жидком азоте и разрушали растиранием в ступке. К полученным лизатам добавляли однократный буфер нанесения для SDS-электрофореза и разделяли растительные белки вместе с маркерными по Лэмми [Laemmli, 1970]. Фракционные белки электрофоретически переносили на нитроцеллюлозную мембрану и проводили иммунное проявление по Тоубину [Towbin et al., 1979]. Полученные блоты инкубировали со специфическими антителами против белка тауматин II, затем с антикроличьими антителами, конъюгированными с пероксидазой. Для визуализации сигналов на блотах их обрабатывали раствором диаминобензидина с перикисью водорода. Для количественной детекции белка тауматин II одновременно с исследуемыми образцами на форез наносили образцы с известной концентрацией белка тауматин II. После иммуноблотинга количество белка в исследуемых образцах определяли путем сравнения интенсивности сигналов с сигналами контрольных образцов.
Результаты эксперимента по получению трансгенных растений картофеля сорта Голубизна, экспрессирующих ген thau II
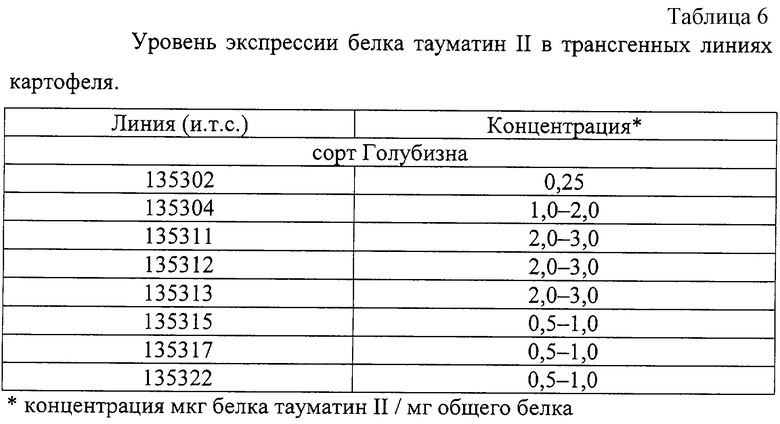
В результате проведения данного трансформационного эксперимента (по описанному выше протоколу) было получено 787 регенерантов из 451 эксплантов от 98 исходных растений. Для сорта Голубизна отмечено явление каллусообразования и регенерации с обеих сторон экспланта. Таким образом, эффективность регенерации (процентное отношение количества регенерантов к количеству эксплантов) составила 174,4%.
Последующий после получения регенерантов и первичного отбора на селективной среде первичный молекулярный анализ методом ПНР (фиг.2) подтвердил наличие перенесенного гена thau И в геноме 175 растений, следовательно, эффективность трансформации (процентное отношение трансформантов к количеству регенерантов) составила 22,2%.
Дальнейший молекулярно-биологический анализ выявил различия в уровнях экспрессии белка тауматин II в полученных трансгенных линиях картофеля сорта Голубизна (табл.6)
В период с 15 июня 2001 по 20 сентября 2001 года на сертифицированном МВК ГИД участке ВНИИ Фитопатологии РАСХН, пос. Б. Вяземы, Московская обл., были проведены ограниченные полевые испытания отобранных трансгенных линий картофеля сорта Голубизна, экспрессирующих ген белка тауматин II.
Были высажены 140 растений трансгенных линий (и.т.с.) сорта Голубизна, также были высажены 30 контрольных нетрансформированных растений сорта Голубизна. В конце вегетационного периода были получены клубни всех трансгенных линий.
Урожайность трансгенных линий (и.т.с.) оценивали по следующим показателям: средняя масса клубней, г/куст и среднее количество клубней на куст. Статистическую обработку полученных данных проводили при помощи пакета программ Statistica 5.5. Математический анализ урожайности контрольных и трансгенных линий (и.т.с.) картофеля показал, что между трансгенными и контрольными растениями нет существенных различий по показателям урожайности, т.к. уровень значимости (вероятность существенности различий) (см. табл.7) не превысил ни по одному показателю 95%.
В результате проведения полевых испытаний было отобрано 8 трансгенных линий (и.т.с.) сорта Голубизна, экспрессирующих ген белка тауматин II. Отобранные линии жизнеспособны и фенотипически не отличаются от контрольных нетрансформированных растений исходного сорта.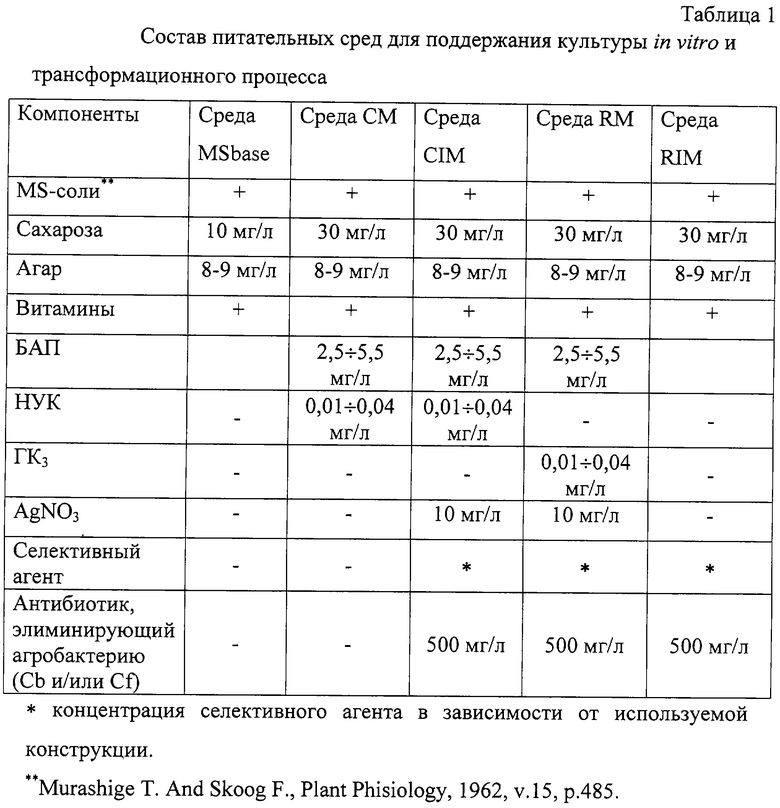
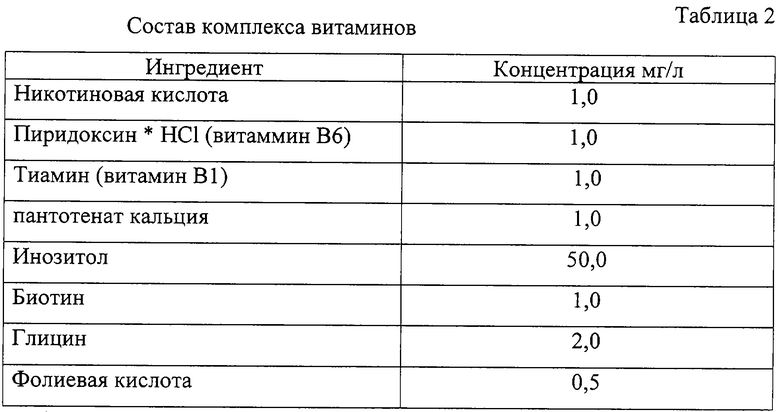
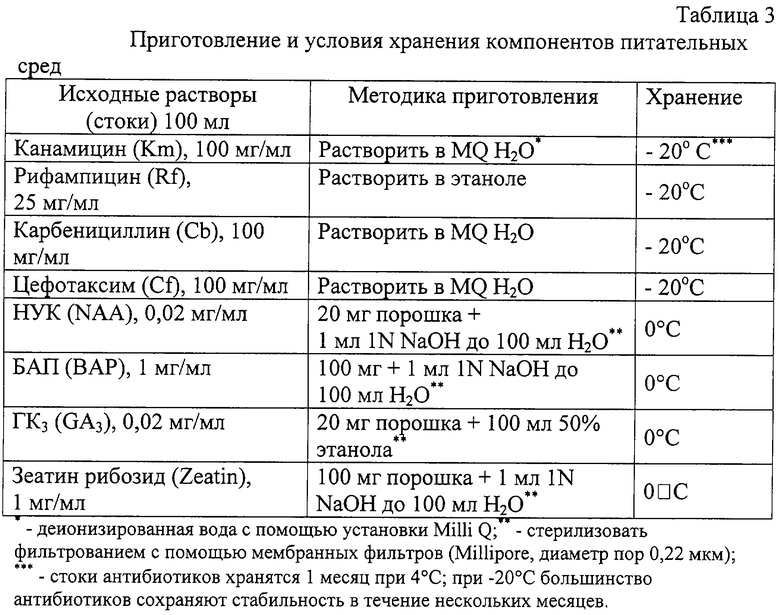
Для приготовления сред, представленных в табл.1, готовили раствор MS-солей в деионизованной воде, доводя pH до значения 5,6-5,8±0,1 с помощью растворов 1N KOH и 1N HCl. Стерилизацию сред осуществляли в автоклаве при 1 атм, 121°C в течение 20 минут. После охлаждения среды до +45÷50°C добавляли витамины (табл.2), гормоны, антибиотики и селективные агенты (методика приготовления и концентрации стоков, см. табл.3) соответственно составу сред и заливали в чашки Петри (⊘ 9 см) по 20±5 мл среды в каждую.





Изобретение относится к селекции растений. Экспланты растений картофеля сорта Голубизна сокультивируют с трансформированным штаммом A. tumefaciens, а затем помещают на питательную среду для инициации каллусообразования с последующей регенерацией из них фертильных трансгенных растений. Сокультивирование осуществляют контактированием эксплантов с фильтром, наложенным на поверхность агаризованной среды, с нанесенной на нее с бактериальной суспензией в течение 48±4 часа. Для инициации каллусообразования эксплантов используют питательную среду, содержащую БАП в количестве 2,5÷5,5 мг/л и НУК - 0,01÷0,05 мг/л. Регенерацию начинают на восьмой день на среде, содержащей БАП в количестве 2,5÷5,5 мг/л и ГКз - 0,01÷0,05 мг/л. В результате увеличивается выход трансформированных растений. 4 з.п. ф-лы, 2 ил., 7 табл.
| СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ ТРАНСФОРМИРОВАННЫХ РАСТЕНИЙ С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ КРАХМАЛА И РЕКОМБИНАНТНАЯ ДВУХЦЕПОЧЕЧНАЯ ДНК-МОЛЕКУЛА | 1991 |
|
RU2148081C1 |
| СПОСОБ ИНДУЦИРОВАНИЯ ОБРАЗОВАНИЯ ЦВЕТКОВ У РАСТЕНИЙ | 1995 |
|
RU2145636C1 |
| ПРОДУЦИРОВАНИЕ ТРЕГАЛОЗЫ В РАСТЕНИЯХ | 1994 |
|
RU2143496C1 |
| WO 00/55303 А, 21.09.2000. | |||
Авторы
Даты
2004-06-27—Публикация
2002-04-24—Подача