Изобретение относится к медицине, а именно к кардиологии, в частности к неинвазивным способам диагностики электрофизиологических механизмов развития аритмий.
В настоящее время наиболее обоснованным считается лечение наджелудочковых и желудочковых нарушений сердечного ритма (НСР) с учетом механизмов их формирования. Классическим механизмом развития этих НСР является re-entry, хотя известны и другие - ранней и поздней (задержанной) постдеполяризации [3, 7]. В настоящее время выявление механизмов развития аритмий возможно в эксперименте, а в клинической практике только при операциях на открытом сердце с использованием инвазивных методов картирования распространения возбуждения по миокарду [2, 16, 17].
Известен способ диагностики неинвазивных механизмов развития экстрасистолии (прототип) путем одновременного проведения электрокардиографического и эхокардиографического исследования одновременно в "В" и "М" режимах, причем при развитии трех механических сокращений в момент экстрасистолии диагностируют механизм ее формирования в виде задержанной постдеполяризации, а двух - re-entry [8].
Недостатки прототипа - трудоемкость метода (одновременное проведения электрокардиографического и эхокардиографического исследования одновременно в "В" и "М" режимах), трудность диагностики механизмов при достаточно редкой экстрасистолии - I-II классов по классификации В.Lown, М.Wolf (1976), а также упрощение способа при определении механизмов экстрасистолии.
Задачей изобретения является сокращение времени определения механизмов желудочковой экстрасистолии (ЖЭ).
Поставленная задача решается тем, что при регистрации электрокардиограммы и определении предэктопического интервала (ПЭИ) ЖЭ и при выявлении мономорфной ЖЭ с расбросом ПЭИ≤10% как минимум в 10 экстрасистолических комплексах диагностируют механизм re-entry, при регистрации мономорфной ЖЭ с расбросом ПЭИ более 10% как минимум в 10 экстрасистолических комплексах или полиморфной эктсрасистолии диагностируют механизм задержанной постдеполяризации, причем разброс ПЭИ рассчитывают по формуле:
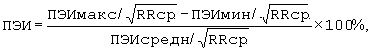
где ПЭИ - предэктопический интервал в %, ПЭИмакс., ПЭИмин. - максимальный, минимальный предэктопический интервал ЖЭ в секундах, ПЭИсредн. - усредненный предэктопический интервал ЖЭ в секундах, RRcp. - интервал RR синусового ритма перед экстрасистолой в секундах.
Способ осуществляется следующим образом. Больному регистрируют электрокардиограмму и при выявлении ЖЭ рассчитывают ПЭИ как минимум в 10 экстрасистолических комплексах. При выявлении мономорфной ЖЭ с разбросом ПЭИ≤10% диагностирют механизм re-entry, при регистрации мономорфной ЖЭ с разбросом ПЭИ более 10% или полиморфной эктсрасистолии диагностируют механизм задержанной постдеполяризации, причем разброс ПЭИ рассчитывают по формуле:
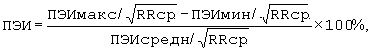
где ПЭИ - предэктопический интервал в %, ПЭИмакс., ПЭИмин. - максимальный, минимальный предэктопический интервал ЖЭ в секундах, ПЭИсредн. - усредненный предэктопический интервал ЖЭ в секундах, RRcp. - интервал RR синусового ритма перед экстрасистолой в секундах.
В настоящее время известно, что появлению задержанных постдеполяризаций предшествует гиперполяризация клеточной мембраны в пределах 60-70 mV [13], причем для их развития необходимо повышение концентрации ионов кальция в кардиомиоцитах и увеличение частоты ритма. При наличии этих условий наблюдается повышение порогового потенциала с развитием подпороговых колебаний с последующим достижением порога возбуждения и возникновением преждевременного потенциала действия. Для формирования re-entry требуется локальное замедление проведения возбуждения участков миокарда, в которых мембранный потенциал клеток постоянно уменьшается и составляет от -50 до -60 mV. При этих значениях мембранного потенциала более 50% натриевых каналов закрыто, развитие фазы "О" замедлено, а амплитуда потенциала действия уменьшена и характеризуется медленным распространением возбуждения - менее 0,1 м/с [10, 12, 14, 15]. В такой угнетенной области выявляется однонаправленный блок проведения, частотно-зависимый блок распространения возбуждения и явления Венкебаха [10, 14]. Аналогичные данные были получены при регистрации электрограмм с поверхности сердца у больных ИБС с желудочковыми НСР, причем механизм re-entry чаще наблюдался у пациентов с выраженными структурными изменениями сердечной мышцы [14, 15].
Пример конкретного выполнения.
Пример 1.
ИБ №29765. Больной С., 45 лет поступил в стационар 01.11.2001 г. по направлению врача поликлиники по поводу ИБС: стенокардии, ЖЭ, рефрактерной к проводимой терапии. Из анамнеза известно, что больной страдает ИБС: стенокардией IV функционального класса в течение последних 8 лет. 5 лет назад перенес трансмуральный инфаркт миокарда с локализацией в области задней стенки левого желудочка, Постоянно принимает нитросорбид, антиагреганты, антагонисты кальция. Около 1,5 месяцев до госпитализации у больного появились перебои в работе сердца. При обращении к врачу на ЭКГ были зарегистрированы ЖЭ. Амбулаторно проводилась терапия этмозином, этацизином, новокаинамидом, без эффекта. Госпитализация в стационар.
В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: прогрессирующая стенокардия напряжения, данных за наличие "свежих" очаговых изменений миокарда выявлено не было. Больному проведено суточное мониторирование ЭКГ с помощью системы Кардиотехника-4000 (АОЗТ "ИНКАРТ" НИИ кардиологии МЗ и МП России, Санкт-Петербург). При мониторировании была выявлена полиморфная ЖЭ с частотой 60-80 экстрасистол в час. Затем был определен ПЭИ по формуле:
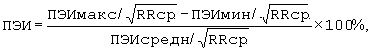
где ПЭИ - предэктопический интервал в %, ПЭИмакс., ПЭИмин. - максимальный, минимальный предэктопический интервал ЖЭ в секундах, ПЭИсредн. - усредненный предэктопический интервал ЖЭ в секундах, RRcp. - интервал RR синусового ритма перед экстрасистолой в секундах.
У больного С., 45 лет по данным суточного мониторирования ЭКГ 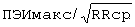 составил - 682 мс/
составил - 682 мс/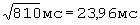 ;
; 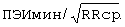 составил - 486 мс/
составил - 486 мс/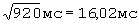 ;
; 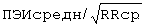 составил - 522 мс/
составил - 522 мс/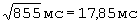 .
.
ПЭИ=[(23,96 мс-16,02 мс)÷17,84 мс]×100%=44,48%.
Таким образом, у больного С., 45 лет была выявлена полиморфная ЖЭ с расбросом ПЭИ 44,48%, на основании чего электрофизиологический механизм ее формирования был расценен как задержанная постдеполяризация.
Больному была продолжена терапия нитросорбидом в 40 мг в сутки, аспирином в дозе 300 мг в сутки, поляризующей смесью с нитроглицерином (1%-1,0 мл), метопрололом 50 мг в сутки. Через 2 дня ЖЭ купировалась.
Больной был выписан из стационара в удовлетворительном состоянии, при суточном мониторировании ЭКГ ЖЭ не регистрировалась.
Данный пример показал, что при выявлении полиморфной ЖЭ с ПЭИ более 10% диагностируется механизмом экстрасистолии, вызванной задержанной постдеполяризации, причем ЖЭ с этим механизмом развития у больных ИБС купируется с помощью преимущественно адекватной антиангинальной терапии.
Пример 2.
ИБ №35766. Больной Г., 52 года, поступил в стационар 01.03.2001 г. по направлению врача поликлиники по поводу некупирующейся ЖЭ. Из анамнеза известно, что больной страдает ИБС: стенокардией III функционального класса в течение последних 4-5 лет. Постоянно принимает сустонит, аспирин в дозе 300-400 мг в сутки, анаприлин в дозе 60-80 мг в сутки. В последние 3-4 недели стал отмечать появление перебоев в работе сердца, а при ЭКГ исследовании была выявлена частая ПЭ, очаговые изменения не обнаружены. Больному была проведена терапия пропафеноном, этацизином, финоптином, кордароном, без эффекта. Госпитализация в стационар.
В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: прогрессирующая стенокардия напряжения, данных за наличие "свежих" очаговых изменений миокарда выявлено не было. Больному проведено суточное мониторирование ЭКГ с помощью системы Кардиотехника-4000 (АОЗТ "ИНКАРТ" НИИ кардиологии МЗ и МП России, Санкт-Петербург). При мониторировании была выявлена мономорфная ЖЭ с частотой 90-100 экстрасистол в час. Затем был определен ПЭИ по формуле:
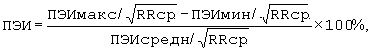
где ПЭИ - предэктопический интервал в %, ПЭИмакс., ПЭИмин. - максимальный, минимальный предэктопический интервал ЖЭ в секундах, ПЭИсредн. - усредненный предэктопический интервал ЖЭ в секундах, RRcp. - интервал RR синусового ритма перед экстрасистолой в секундах.
У больного Г., 52 года по данным суточного мониторирования ЭКГ 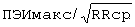 составил - 442 мс/
составил - 442 мс/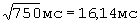 ;
; 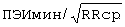 составил - 421 мс/
составил - 421 мс/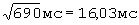 ;
; 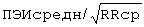 составил - 433 мс
составил - 433 мс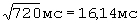 .
.
ПЭИ=[(16,14 мс-16,03 мс)÷16,14 мс]×100%=0,68%.
Таким образом, у больного Г., 52 лет была выявлена мономорфная ЖЭ с расбросом ПЭИ 0,68%, на основании чего электрофизиологический механизм ее формирования был расценен как re-entry.
Больному была продолжена терапия сустонитом в 19,5 мг в сутки, аспирином, анаприлином в дозе 120 мг в сутки, кордароном 400 мг в сутки.
Наличие ЖЭ, рефрактерной к проводимой фармакологической терапии, явилось основанием использования дополнительно к проводимому лечению лазерного облучения длиной волны 0,89 мкм [4]. После достижения суммарной терапевтической дозы лазеротерапии составляет 1,0 Дж/кг [5].
После проведения курса лазеротерапии ЖЭ купировалась. Больной был выписан из стационара в удовлетворительном состоянии. Амбулаторно ему было рекомендовано принимать сустонит в дозе 19,5 мг в сутки, аспирин в дозе 300 мг в сутки, кордарон в дозе 200 мг в сутки, при повторном обследовании через 2 месяца как ЖЭ, так и других нарушений сердечного ритма, выявлено не было.
Данный пример показал, что при выявлении мономорфной ЖЭ с расбросом ПЭИ до 10% диагностируется механизм re-entry экстрасистолии. Использование неинвазивного способа диагностики электрофизиологических механизмов развития ЖЭ повышает эффективность проведения антиаритмической терапии (ААТ), тем самым предупреждая развитие осложнений.
Пример 3.
ИБ №18766. Больной В., 65 лет поступил в стационар 11.08.2002 г. по направлению врача поликлиники по поводу ИБС: стенокардии III-IV функционального класса, ЖЭ, рефракторной к проводимой терапии. Из анамнеза известно, что больной страдает ИБС: стенокардией IV функционального класса в течение последних 3 лет. Год назад перенес трансмуральный инфаркт миокарда с локализацией в области задней стенки левого желудочка. Постоянно принимает нитросорбид, антиагреганты, антагонисты кальция. Около 1,5 месяцев до госпитализации у больного появились перебои в работе сердца. При обращении к врачу на ЭКГ были зарегистрированы ЖЭ. Амбулаторно проводилась терапия этмозином, этацизином, пропафеноном, без эффекта. Госпитализация в стационар.
В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: прогрессирующая стенокардия напряжения, данных за наличие "свежих" очаговых изменений миокарда выявлено не было. Больному проведено суточное мониторирование ЭКГ с помощью системы Кардиотехника-4000 (АОЗТ "ИНКАРТ" НИИ кардиологии МЗ и МП России, Санкт-Петербург). При мониторировании была выявлена мономорфная ЖЭ с частотой 100-120 экстрасистол в час. Затем был определен ПЭИ по формуле:
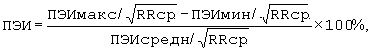
где ПЭИ - предэктопический интервал в %, ПЭИмакс., ПЭИмин. - максимальный, минимальный предэктопический интервал ЖЭ в секундах, ПЭИсредн. - усредненный предэктопический интервал ЖЭ в секундах, RRcp. - интервал RR синусового ритма перед экстрасистолой в секундах.
У больного В., 65 лет по данным суточного мониторирования ЭКГ 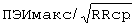 составил - 756 мс/
составил - 756 мс/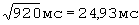 ;
; 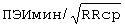 составил - 484 мс/
составил - 484 мс/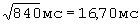 ;
; 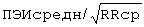 составил - 632 мс/
составил - 632 мс/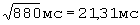 .
.
ПЭИ=[(24,93 мс-16,70 мс)÷21,31 мс]×100%=38,62%.
Таким образом, у больного В., 65 лет была выявлена мономорфная ЖЭ с расбросом ПЭИ 38,62%, на основании чего электрофизиологический механизм ее формирования был расценен как задержанная постдеполяризация.
Больному была продолжена терапия нитросорбидом в 40 мг в сутки, аспирином в дозе 300 мг в сутки, поляризующей смесью с нитроглицерином (1%-1,0 мл), состалолом 120 мг в сутки. Через 1 день ЖЭ купировалась.
Больной был выписан из стационара в удовлетворительном состоянии, при суточном мониторировании ЭКГ ЖЭ не регистрировалась.
Данный пример показал, что при выявлении мономорфной ЖЭ с ПЭИ более 10% диагностируется механизмом экстрасистолии, вызванной задержанной постдеполяризации, причем ЖЭ с этим механизмом развития у больных ИБС купируется с помощью преимущественно адекватной антиангинальной терапии.
Экспериментальное исследование.
Опыты проведены на 24 беспородных собаках массой 5,5-12,3 кг (в среднем 8,57+00,1 кг). Под гексеналовым наркозом был снят перикард.
Для определения критериев, позволяющих выявить механизмы развития экспериментальных аритмий (ранней и задержанной постдеполяризации, reentry), НСР моделировались у собак на открытом сердце путем аппликации аритмогена на миокард левого желудочка (аконитиновая, перекисная, строфантиновая аритмии). Аритмии моделировались у животных путем аппликации аритмогена на миокард в области среднего электрода в области передней стенки верхушки левого желудочка. У 8 животных аппликацией 0,05% раствора строфантина, у 6 - 0,02% раствора аконитина, у 10 - 0,06% раствора перекиси водорода.
У всех животных проводилось картирование проведения возбуждения (ПВ) по миокарду прямым методом путем фиксации 6 электродов на эпикардиальной поверхности сердечной мышцы: один в области верхушки, три - в передней, по одному в задней и боковой стенке левого желудочка. Регистрация электрограммы предсердий осуществлялась на шестиканальном электрокардиографе ЭКНТ-06 на бумаге с прямоугольной сеткой координат со скоростью 100 и 250 мм/с.
Выбор экспериментальных аритмий производился с учетом электрофизиологических механизмов, участвующих в их формировании. НСР с механизмом ранней постдеполяризации моделировалась по общепринятой методике с помощью аконитина, задержанной постдеполяризации - строфантина, хлоридбария, хлоридкальция, re-entry - перекиси водорода [1, 10, 11].
С помощью предлагаемого способа были выделены критерии, позволяющие определить ЖЭ с механизмом задержанной постдеполяризации и re-entry:
при выявлении мономорфной ЖЭ с разбросом ПЭИ до 10% диагностируют механизм re-entry, при регистрации мономорфной ЖЭ с разбросом ПЭИ более 10% или полиморфной эктсрасистолии диагностируют механизм задержанной постдеполяризации, причем расброс ПЭИ расчитывают по формуле:
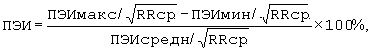
где ПЭИ - предэктопический интервал в %, ПЭИмакс., ПЭИмин. - максимальный, минимальный предэктопический интервал ЖЭ в секундах, ПЭИсредн. - усредненный предэктопический интервал ЖЭ в секундах, RRcp. - интервал RR синусового ритма перед экстрасистолой в секундах.
Корреляция между экспериментальными результатами и данными, полученными при использовании предлагаемого способа и прототипа [8], составила для ЖЭ, вызванной механизмом re-entry и ЗП r=0,96 и r=0,97 соответственно.
Клиническое исследование.
Наблюдалось 84 больных ИБС с желудочковыми НСР. Диагноз ИБС основывался на критериях ВОЗ. У 43(51,19%) больных была выявлена прогрессирующая стенокардия, у 10(11,19%) - впервые возникшая стенокардия, у 10(11,19%) - стабильная стенокардия, у 17(20,24%) - основным проявлением ИБС была ЖЭ. У 38(45,24%) больных была выявлена гипертоническая болезнь, у 10(11,19%) - хронический бронхит, у 17(20,24%) - сахарный диабет и 38(45,24%) - ранее перенесли крупноочаговый инфаркт миокарда (ИМ). У 46(54,76%) больных отмечалась ЖЭ I-II класса, у 38(45,24%) - III-V класса по Лауну, в том числе у 6(25,00%) из них наблюдалась ЖЭ с участками ЖТ (пробежки ЖТ длительностью 1"-10").
Всем обследуемым пациентом, помимо общеклинического обследования, проводилось суточное мониторирование ЭКГ с помощью системы Кардио-техника-4000 (АОЗТ "ИНКАРТ" НИИ кардиологии МЗ и МП России, Санкт-Петербург), исследование центральной и внутрисердечной гемодинамики с помощью эхокардиографа SIM-5000 по общепринятой методике [9]. Расчет параметров гемодинамики описаны ранее [6].
Всем обследованным больным проводилось определение электрофизиологических механизмов развития ЖЭ с помощью прототипа и предлагаемого способа. Согласно критериям, выявленным при использовании прототипа, позволяющий желудочковые НСР разделить по механизму их развития, все больные были разделены на две группы. В I группу вошло 50(59,52%) больных, у которых желудочковые НСР были обусловленными механизмом задержанной постдеполяризацией, во II группу было включено 34(40,58%) больных - re-entry. Достоверного различия по полу, возрасту, сопутствующим заболеваниям, ранее перенесенному ИМ, а также остальных изучаемых показателей у пациентов I и II групп выявлено не было. Согласно предлагаемому способу у 22(44,00%) больных I группы была выявлена мономорфная, у остальных больных этой группы - полиморфная ЖЭ с разбросом ПЭИ от 12,6% до 51,7% (в среднем 36,3±0,5%), в то время как у всех больных II группы была выявлена мономорфная ЖЭ с разбросом ПЭИ от 0,3% до 9,5% (в среднем 5,7±0,1%). Корреляция определения механизмов ЖЭ в помощью предлагаемого способа в сравнении с прототипом составила практически 100%.
Продолжительность определения механизмов ЖЭ с помощью предлагаемого способа в сравнении с прототипом представлена в таблице 1. Как видно из таблицы, продолжительность определения механизмов ЖЭ с помощью предлагаемого способа в сравнении с прототипом уменьшалось в зависимости от класса ЖЭ в среднем в 3,4-4 раза (р<0,001). Следует отметить, что при использовании прототипа наложение электродов ЭКГ, визуализация сердца при эхокардиографии сначала в «В», а затем одновременно в «В» и «М» режимах занимает от 8 до 14 минут (в среднем 12±1 минуты), при применении предлагаемого способа наложение электродов и регистрация ЭКГ - от 1 до 3 минут (в среднем 2±0,5 минут), что в 5 раз меньше в сравнении с прототипом (р<0,001).
Таким образом, заявляемый способ по сравнению с прототипом сокращает время определения механизмов ЖЭ, при редкой экстрасистолии - I-II класса (по Лауну) в среднем в 4 раза, III-IV класса - в 3,4 раза, V класса - в 4 раза, а также значительно снижает трудоемкость при определении механизмов ЖЭ: сокращение времени определения механизмов ЖЭ уменьшается в среднем в 5 раз в сравнении с прототипом.
Продолжительность определения механизмов ЖЭ с помощью предлагаемого способа в сравнении с прототипом (М±м).
Литература
1. Бердяев С.Ю. Поиск и фармакологическое изучение средств, повышающих электрическую стабильность миокарда. Автореф. докт. мед. наук. М., 1992, - 45 с.
2. Бокерия Л.А. Тахииаритмии: диагностика и хирургическое лечение. - Л.: Медицина, Ленингр. отделение. - 1989. - 296 с.
3. Кушаковский М.С.Аритмии сердца: Руководство для врачей. - СПб.: Гиппократ, 1992. - 544 с.
4. Олесин А.И., Павлова Р.Н., Сорокина B.C., Мажара Ю.П. Способ лечения желудочковой экстрасистолии. - А.с. N 1782389, бюл. № 8 от 10.07.1992.
5. Олесин А.И., Павлова Р.Н., Мажара Ю.П., Сорокина B.C. Способ определения однократной и суммарной доз лазерного излучения при проведении лазерного облучения в красном и инфракрасном диапазонах. - Решение на выдачу патента РФ по заявке на изобретение от 12.10.1992 N 4773758/14.
6. Олесин А.И., Ловкачева М.К. Дифференцированное лечение пароксизмальных наджелудочковых нарушений сердечного ритма у больных ишемической болезнью сердца на догоспитальном этапе в зависимости от состояния гемодинамики в момент аритмии. // Тер. архив. - 1988. - N 12. - С.98-104).
7. Сметнев А.С., Гросу А.А., Шевченко Н.М. Диагностика и лечение нарушений ритма сердца. - Кишинев: Штиинца, 1990. - 325 с.
8. Шабров А.В., Олесин А.И., Разумова Т.В., Голуб Я.В. Способ определения электрофизиологических механизмов развития экстрасистолии. - Патент №2214161 от 23.10.2003 г. - Бюл. №29.
9. Шиллер Н., Осипов М.А. Клиническая эхокардиография (пер.с англ.). М.: Медицина, 1993.
10. Физиология и патофизиология сердца: T.1: Пер. с англ. / Под ред. Н.Сперлаксисиса. - М.: Медицина, 1990. - 624 с.
11. Хрусталева Г.В. Фармакология хлоридкальциевой и аконитиновой аритмии. - Автореф. канд. мед. наук. - Ярославль, 1978. - 23 с.
12. Allessie М.А., Bonke F.I.M. Atrial arrhythmias: basic concehts. // Cardiac arrhythmias / Ed. by W.Mandel. - Philadelphia; Toronto, 1980. - P.145-166.
13. Cranefield P.F. Action potential afterpotentials and arrhythmias. // Circulat. res. - 1977. - Vol.41. - N4. - P.415-423.
14. Cranefield P.F. The conduction of the cardiac impulse. // The slow response and cardiac arrhythmias. - New York: Mount Kisco, 1975. - P.199-265.
15. Josephson M.E., Buxton A.E., Marchlinski F.R. et al. Sustained ventricular tachycardia in coronary artery disease: evidence for re-entrant mechanism. // Cardiac electrophysiology and arrhythmias / Ed. by D.P.Zipes, J. Jalife. - Orlando, 1985. - P.343-352).
16. Olshansky В., Okumura К., Hess P.O., Waldo A.L. Demonstration of the area of slow conduction in human atrial flytter. // J. Amer. Coll. Cardiol. - 1991. - Vol.16, N 6. - P.1639-1648.
17. Shimisu A., Nosaki A., Rudy Y., Waldo A.L. Multiplexing studies of effects of rapid atrial pacing on the area of slow conduction during atrial flutter in canine pericarditis model. // Circulation. - 1991. - Vol.83, N.3. - P.983-994.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ РИСКА ВНЕЗАПНОЙ СМЕРТИ У БОЛЬНЫХ С ЛЕВО- И ПРАВОЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИЕЙ | 2006 |
|
RU2312591C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ПАРОКСИЗМОВ МЕРЦАНИЯ И ТРЕПЕТАНИЯ ПРЕДСЕРДИЙ У БОЛЬНЫХ С НАДЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИЕЙ | 2005 |
|
RU2294137C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭЛЕКТРОФИЗИОЛОГИЧЕСКИХ МЕХАНИЗМОВ РАЗВИТИЯ ЭКСТРАСИСТОЛИИ | 1998 |
|
RU2214161C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПРОДОЛЖИТЕЛЬНОСТИ СОХРАНЕНИЯ ПОЛОЖИТЕЛЬНОГО ЭФФЕКТА ФАРМАКОЛОГИЧЕСКОЙ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ У БОЛЬНЫХ С ЭКСТРАСИСТОЛИЕЙ | 2020 |
|
RU2749851C1 |
| СПОСОБ ВЫБОРА НАИБОЛЕЕ ЭФФЕКТИВНОГО АНТИАРИТМИЧЕСКОГО ПРЕПАРАТА ДЛЯ БОЛЬНЫХ С ЭКСТРАСИСТОЛИЕЙ | 2017 |
|
RU2641164C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА РАЗВИТИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У БОЛЬНЫХ С ПРЕДСЕРДНОЙ ЭКСТРАСИСТОЛИЕЙ | 2014 |
|
RU2556602C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ПАРОКСИЗМОВ МЕРЦАНИЯ И ТРЕПЕТАНИЯ ПРЕДСЕРДИЙ У БОЛЬНЫХ С НАДЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИЕЙ | 2006 |
|
RU2303390C1 |
| Способ дифференциации стрессиндуцированной и стрессингибированной желудочковой эктопии при проведении пробы с физической нагрузкой | 2019 |
|
RU2724841C1 |
| СПОСОБ ВЫБОРА ЭФФЕКТИВНОГО АНТИАРИТМИЧЕСКОГО ПРЕПАРАТА ДЛЯ БОЛЬНЫХ С ЭКСТРАСИСТОЛИЕЙ | 2019 |
|
RU2707261C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ПРОВЕДЕНИЯ МОДУЛИРОВАННОЙ КИНЕЗОТЕРАПИИ В КАЧЕСТВЕ ПЕРВИЧНОЙ ПРОФИЛАКТИКИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У БОЛЬНЫХ С ПРЕДСЕРДНОЙ ЭКСТРАСИСТОЛИЕЙ | 2017 |
|
RU2667827C1 |
Изобретение относится к медицине, а именно к кардиологии. Регистрируют электрокардиограмму и определяют предэктопический интервал (ПЭИ) желудочковой экстрасистолии (ЖЭ). При этом при выявлении мономорфной ЖЭ с разбросом ПЭИ ≤10% как минимум в 10 экстрасистолических комплексах диагностируют механизм re-entry. При регистрации мономорфной ЖЭ с разбросом ПЭИ ≥10% как минимум в 10 экстрасистолических комплексах или полиморфной экстрасистолии диагностируют механизм задержанной постдеполяризации. Разброс ПЭИ рассчитывают по формуле:
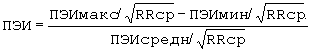
где ПЭИ - предэктопический интервал в %, ПЭИмакс., ПЭИмин. - максимальный, минимальный предэктопический интервал ЖЭ в секундах, ПЭИсредн. - усредненный предэктопический интервал ЖЭ в секундах, RRcp. - интервал RR синусового ритма перед экстрасистолой в секундах. Способ позволяет сократить время определения механизмов желудочковой экстрасистолии и значительно снизить трудоемкость определения ЖЭ. 1 табл.
Способ диагностики механизмов желудочковой экстрасистолии (ЖЭ) путем регистрации электрокардиограммы и определения предэктопического интервала (ПЭИ) ЖЭ, отличающийся тем, что при выявлении мономорфной ЖЭ с разбросом ПЭИ до 10% как минимум в 10 экстрасистолических комплексах диагностируют механизм re-entry, при регистрации мономорфной ЖЭ с разбросом ПЭИ более 10% как минимум в 10 экстрасистолических комплексах или полиморфной экстрасистолии диагностируют механизм задержанной постдеполяризации, причем разброс ПЭИ рассчитывают по формуле
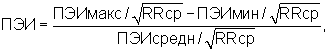
где ПЭИ - предэктопический интервал, %; ПЭИмакс., ПЭИмин. - максимальный, минимальный предэктопический интервал ЖЭ, с; ПЭИсредн. - усредненный предэктопический интервал ЖЭ, с; RRcp. - интервал RR синусового ритма перед экстрасистолой, с.
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭЛЕКТРОФИЗИОЛОГИЧЕСКИХ МЕХАНИЗМОВ РАЗВИТИЯ ЭКСТРАСИСТОЛИИ | 1998 |
|
RU2214161C2 |
| СПОСОБ ЭЛЕКТРОКАРДИОГРАФИЧЕСКОЙ ТОПИЧЕСКОЙ ДИАГНОСТИКИ ЖЕЛУДОЧКОВЫХ АРИТМИЙ | 1995 |
|
RU2110949C1 |
| СПОСОБ Т.Ф. И В.А.МИРОНОВЫХ ИССЛЕДОВАНИЯ ВЕГЕТАТИВНОЙ РЕГУЛЯЦИИ СЕРДЦА И ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ КЛИНИЧЕСКИХ ФОРМ АРИТМИЙ | 1996 |
|
RU2099004C1 |
| А.Б | |||
| де ЛУНА | |||
| Руководство по клинической ЭКГ | |||
| - М.: Медицина, 1993, с.703 | |||
| JOSEPHSON М.Е | |||
| et al | |||
| Sustained ventricular tachycardia in coronary artery disease: evidence for re-entrant mechanism | |||
| Caardiac electrophysiology and arrhymias | |||
| Ed | |||
| by D.P.Zipes, J Jalife | |||
| Orlando, 1985, p/343-352. | |||
Авторы
Даты
2007-02-27—Публикация
2005-04-07—Подача