Область техники
Данное изобретение относится к фотообработке живой биоткани, вызывающей светоиндуцированный апоптоз, приводящий к атравматичной модификации, в т.ч. удалению, определенных частей живой биоткани.
Уровень техники
Световое излучение от ламп, лазеров и светоизлучающих диодов широко применяется в современной лечебной и косметологической практике для хирургической фотообработки живой биоткани, содержащей хромофоры - вещества естественного или искусственного происхождения, обладающие высоким коэффициентом поглощения светового излучения. Фотообработка приводит к селективной фотодеструкции или фототермолизу за счет импульсного светового излучения (Anderson, R.R. et al., "Selective Photothermolysis: Precise Microsurgery by Selective Absorption of Pulsed Radiation", Science 1983, 220:524-527). Селективный фототермолиз применяется в тех случаях, когда биоткань содержит подлежащие деструктивной модификации или удалению хромофоросодержащие части, например, такие как сосудистые дефекты, пигментные поражения, нежелательные волосы. Для селективного фототермолиза длина волны светового излучения выбирается исходя из спектрального диапазона максимального поглощения хромофора, при этом длительность импульса не превышает время термической релаксации хромофоросодержащей части биоткани, а плотность мощности выбирается достаточной для ее нагрева и коагуляции. В этом случае достигается деструкция этой части биоткани без светового повреждения остальной, не содержащей хромофоры, биоткани.
Будучи клинически результативной при решении задач по модификации или для удаления определенных частей биоткани, фотообработка с селективной фотодеструкцией обладает рядом недостатков. Клеточная гибель вследствие действия внешних повреждающих факторов проходит по некротическому сценарию, что, как известно, означает нарушение целостности клеточных оболочек и вынос внутриклеточного содержимого в межклеточное пространство. Это, естественно, сопровождается образованием локального воспалительного процесса. В область воспалительной реакции могут быть также вовлечены близлежащие здоровые части биоткани, что с большей степенью вероятности приводит к побочным эффектам и осложнениям. Клинически эти побочные эффекты и осложнения проявляются в виде дисхромии, волдырей, пурпуры, рубцов, общего дискомфорта из-за болевого синдрома. Эти побочные эффекты и осложнения особо нежелательны в тех случаях, когда повышены требования к косметическому результату, например при обработке кожи в дерматологии и косметологии (C.A. Nanni, T.S. Alster, "Complications of Cutaneous Laser Surgery", Dermatologic Surgery, 1998; 24:209-219, B. Greve, C. Raulin, "Professional Errors Caused by Laser and Intense Pulsed Light Technology in Dermatology and Aesthetic Medicine: Preventive Strategies and Case Stadies", Dermatologic Surgery 2002; 28:156-161). Побочные эффекты и осложнения, связанные с термонекрозом клеток и ткани наносят не только моральный, но и материальный вред пациентам, поскольку повышают совокупную стоимость лечения и приводят к потере рабочего времени социально активными пациентами.
Таким образом, существует необходимость в атравматичном и менее затратном способе клинически результативной селективной фотообработки живой биоткани для целей ее модификации, в том числе удаления, особенно в случаях, связанных с повышенными требованиями к косметическому результату.
Сущность изобретения
Целью настоящего изобретения является создание такого способа фотообработки, при котором возможно получение радикального клинического результата атравматично и менее затратно по сравнению с селективным фототермолизом.
Настоящее изобретение основано на открытии, заключающемся в том, что при определенных условиях в живой хромофоросодержащей биоткани при ее облучении световым излучением может индуцироваться апоптоз жизненно значимых клеток этой биоткани - форма «мягкой» физиологически естественной смерти клеток, при которой клетки активно участвуют в своем уничтожении. Процесс апоптотической смерти клеток, в отличие от некроза при деструкции ткани, проходит без воспаления. Таким образом, становится осуществимой такая фотообработка живой биоткани, при которой модификация, в том числе удаление ее определенных частей, может происходить атравматично.
В соответствии со способом, раскрываемым в настоящем изобретении биоткань, содержащая определенную часть с хромофором, облучается световым излучением с длиной волны от 500 нм до 2500 нм, с плотностью энергии, недостаточной для деструкции, но достаточной для индуцирования апоптоза клеток этой части биоткани. Отношение апоптозоиндуцирующей плотности мощности светового излучения к деструктивной включает диапазон от 45% до 90%. Отношение апоптозоиндуцирующей длительности импульсов к деструктивной включает диапазон от 10% до 90%, в зависимости от времени термической релаксации биоткани.
В соответствии с другими способами, раскрываемыми в настоящем изобретении, биоткань облучают для целей ингибирования роста нежелательных волос, удаления сосудистых дефектов и пигментных пятен кожи, ремоделирования кожи, редукции сальных желез при акне, удаления новообразований, редукции, в т.ч. удаления гипертрофических и келоидных рубцов с плотностью энергии, недостаточной для деструкции, но достаточной для индуцирования апоптоза клеток этих частей биоткани.
Поскольку признаки воспаления при светоиндуцированном апоптозе отсутствуют, то раскрываемые в настоящем изобретении способы фотообработки позволяют осуществлять модификацию, в т.ч. удаление биоткани атравматично, без косметически неприемлемых осложнений.
Краткое описание фигур
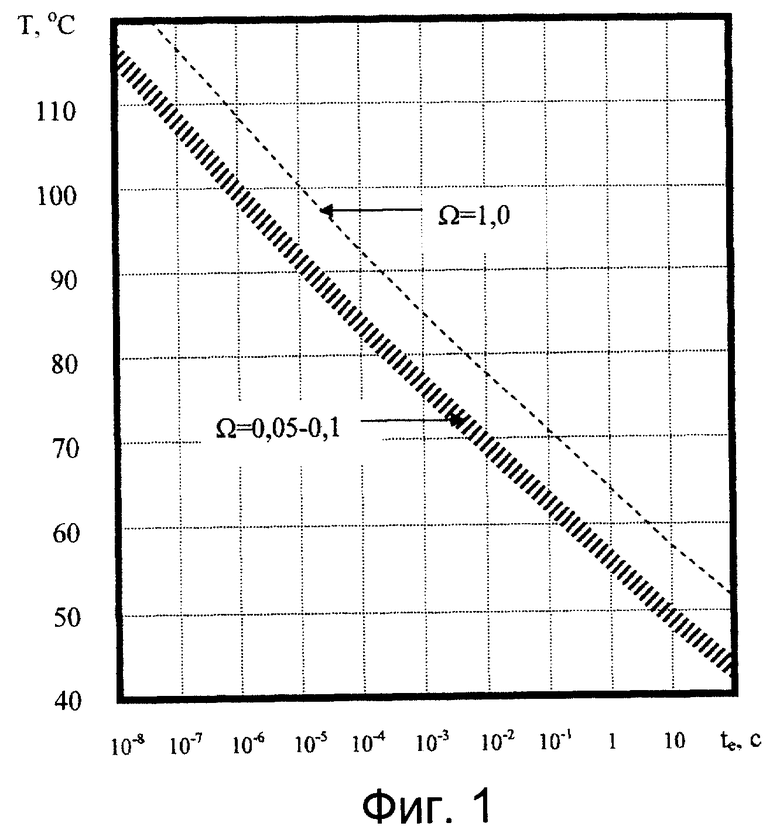
Фиг.1 - зависимость температуры T апоптоза и деструкции от длительности изотермической экспозиции te. Указанная стрелкой заштрихованная область соответствует степени термоповреждения Ω=0,05-0,1 (апоптоз); указанная стрелкой штриховая линия соответствует степени термоповреждения Ω=1 (деструкция).
Фиг.2 - зависимость отношения Pa/Pd апоптоиндуцирующей плотности мощности Pa к деструктивной плотности мощности Pd от длительности импульсов светового излучения tp. Указанная стрелкой заштрихованная область соответствует степени термоповреждения при апоптозе Ωa=0,05-0,1.
Фиг.3 - зависимость отношения tpa/tpd апоптозоиндуцирующей длительности импульсов tpa к деструктивной длительности импульсов tpd от времени термической релаксации tr.Указанные стрелками области соответствуют степени термоповреждения при апоптозе Ωа=0,05-0,1: заштрихованная область в верхней части графика для «коротких» импульсов tpd/tr<10-1, заштрихованная область в нижней части графика для «длинных» импульсов tpd/tr>10, область между верхней и нижней заштрихованными областями для импульсов, длительностью порядка времени термической релаксации 10-1<tpd/tr<10.
Подробное раскрытие изобретения
Поглощенная в хромофоре энергия светового излучения порождает ряд стрессовых факторов для клеток. Возможна пластическая деформация клеток упругой акустической волной, распространяющейся от хромофора к клеткам при фотомеханическом преобразовании поглощенной энергии. Фотохимическое преобразование может привести к появлению свободных радикалов или, например, к нарушению связей в ДНК при УФ облучении. С точки зрения настоящего изобретения особый интерес представляет тепловой стрессовый фактор, доминирующий при длине волны светового излучения, превышающей 500 нм, и обусловленный теплопередачей от хромофора к клеткам при фототермическом преобразовании поглощенной в хромофоре энергии. В области сублетальных, т.е. потенциально, но не обязательно деструктивных, температур, существует определенный диапазон температур, при которых апоптотическая смерть превалирует над коагуляционной (N.P. Matylevitch et al., "Apoptosis and Accidental Cell Death in Cultured Human Keratinocytes After Thermal Injury", American Journal of Pathology 1998, 153:567-577, H.-K.B. Dihn et al., "Gene expression profiling of the response to thermal injury in human cells", Physiol Genomics 2001, 7:3-13), при наличии соответствующих физиологических регулирующих факторов в самой биоткани.
Идея, послужившая основанием для настоящего изобретения заключается в том, что световое излучение, при определенных оптических характеристиках может служить индуктором апоптоза, поскольку апоптозоиндуцирующая сублетальная температура может быть обусловлена теплом, выделившимся при фототермическом преобразовании энергии светового излучения, поглощенного в хромофорах этой биоткани.
Значения температуры, при которых преимущественно происходит термокоагуляция, составляют от около 50°С при температурных экспозициях около 100°С и выше 100°С при снижении экспозиции до микросекундного диапазона (D. Simanovski et al., "Cellular tolerance to pulsed heating", SPIE Proc, BIOS 2005, v.5695, pp.1-6). С точки зрения настоящего изобретения, полный термонекроз и апоптоз, должны быть разделены достаточно широким температурным диапазоном, при наличии в клетках соответствующих физиологических механизмов. В этом случае возможна реализации преимущественного апоптоза без существенной термокоагуляции, т.е. степень термокоагуляции для апоптоиндуцирующих температур не должна превышать 10%. Например, изотермическая экспозиция кератиноцитов длительностью 1 с при температуре около 64°С приводит к их термокоагуляции. Апоптоз же индуцируется преимущественно при достижении температуры 56-58°С при той же экспозиции. Исходя из экспериментальных данных, аппроксимированных решениями уравнения Аррениуса:
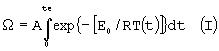
где:
Е0 - энергия активации коагуляции (ДжМ-1);
R - универсальная газовая постоянная (ДжМ-1К-1);
А - фактор частоты (с-1);
te - длительность температурной экспозиции (с);
T(t) - температура биоткани (К);
Ω - степень термоповреждения (доля);
в изотермическом приближении и представленными на Фиг.1 и в Таблице 1, соответствует область (указанная стрелкой, заштрихованная на Фиг.1) с несущественной термокоагуляцией в пределах значений Ω от 5·10-2 до 10-1, в которой концентрация коагулированных клеток составляет от 5% до 10% соответственно. Апоптозоиндуцирующие температуры включают диапазон от 43°С до 145°С при соответствующих временах температурной экспозиции te, обеспечивающих сублетальный характер стресса. Приближение «изотермичности», в данном случае, означает, что во время экспозиции температуру (т.е. воздействие тепла на кератиноциты) можно считать постоянной.
Значения температур T, приводящих к степени термоповреждения Ω=0,05-0,1 (апоптоз) и Ω=1 (деструкция) в зависимости от длительности изотермической экспозиции te
При меньшей степени термокоагуляции доминирует повышенная активность протеинов теплового шока - молекул-шаперонов, концентрация которых в подверженных умеренному тепловому стрессу клетках составляет около 5-10%. Благодаря активности шаперонов жизнедеятельность клетки в случае умеренного теплового стресса восстанавливается (J.T. Beckham et al., "Assessment of Cellular Response to Thermal Laser Injury Through Bioluminescence Imaging of Heat Shock Protein 70", Photochemistry and Photobiology 2004, 79:76-85). Возможно также старение клетки с остановкой развития (C. Soti et al., "Apoptosis, necrosis and cellular senescence: chaperone occupancy as a potential switch", Aging Cell 2003, 2:39-45), но не ее апоптоз.
Температура биоткани, а значит и степень термокоагуляции биоткани при фототермическом преобразовании зависит от значений плотности мощности (Вт/см2) и длительности импульса (с) светового излучения. С точки зрения настоящего изобретения особый интерес представляет сравнение апоптозоиндуцирующих и деструктивных плотности мощности и длительности импульсов светового излучения. В общем случае значение плотности мощности может меняться за время импульса из-за характерных для того или иного типа светового источника изменений мощности, обусловленных особенностями генерации. В этом случае следует говорить о мгновенной мощности, т.е. мощности в данный момент времени. Например, значение мгновенной мощности может линейно расти от нуля в начале и до максимума к концу импульса, формируя пилообразные импульсы. Другой случай, когда мгновенная мощность максимальна в начале импульса и спадает до нуля к концу, как в случае свечения ламп-вспышек, питающихся от конденсаторов. Тем не менее, на практике любая форма импульса аппроксимируется прямоугольной, с некоторым эффективным или усредненным значением мощности, постоянным во время импульса, если речь не идет о специальных задачах, касающихся особенностей фототермического преобразования светового излучения, имеющего ту или иную заданную форму импульсов. В случае прямоугольных импульсов плотность мощности и длительность импульсов определяют плотность энергии светового излучения следующим выражением:
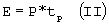
где:
Е - плотность энергии светового излучения (Дж/см2);
P - плотность мощности светового излучения (Вт/см2);
tp - длительность импульса светового излучения (с).
Можно сравнить апоптоиндуцирующие и деструктивные значения плотности мощности и длительности прямоугольных импульсов, решив уравнение Аррениуса для случаев полного термоповреждения (при Ω=1) и для апоптоиндуцирующей области ( Ω=5·10-2-10-1). Зависимость температуры биоткани от мощности и длительности прямоугольного импульса светового излучения при фототермическом преобразовании энергии известна из решений уравнений распространения света и теплопереноса и может быть представлена в следующем обобщенном виде:
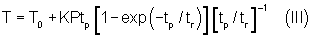
где
tp, P - определены выше;
tr - время термической релаксации биоткани (с), определяемое выражением tr≅d2/kα, в котором d - характеристический размер хромофоросодержащей части биоткани (см), α - коэффициент термодиффузии биоткани (см2с-1), k - геометрический фактор; импульсы светового излучения считаются «длинными» при tp≫tr и «короткими» при tp≪tr;
К - коэффициент  зависящий от оптических и геометрических параметров биоткани;
зависящий от оптических и геометрических параметров биоткани;
T0 - физиологически нормальная температура биоткани 
Таким образом, отношение апоптозоиндуцирующих и деструктивных плотностей мощностей при данной длительности импульсов будет определяться следующим выражением:
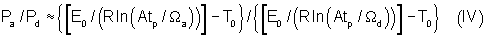
где:
Pa - апоптозоиндуцирующая плотность мощности (Вт/см2);
Pd - деструктивная плотность мощности (Вт/см2);
Ωa - степень термоповреждения при апоптозе (доля);
Ωd - степень термоповреждения при деструкции (доля),
обычно принимается Ωd=1;
E0, R, А, tp, E0 - определены выше.
На Фиг.2 и в Таблице 2 представлены значения отношения плотностей мощности Pa/Pd при Ωа=5·10-2-10-1 (указанная стрелкой заштрихованная область на Фиг.2) в зависимости от заданных длительностей импульсов, откуда видно, что отношение апоптозоиндуцирующей и деструктивной мощностей падает от 90% до 45% с увеличением длительности импульсов. В этом приближении отношение Pa/Pd не зависит от соотношения длительности импульсов и времени термической релаксации биоткани. Таким образом, апоптозоиндуцирующая и деструктивная плотности мощности отделены достаточно широкими, с точки зрения практических применений, интервалами значений.
Значения отношений Pa/Pd апоптоиндуцирующей плотности мощности Pa к деструктивной плотности мощности Pd в зависимости от длительностей импульсов tp для разных значений степени термоповреждения при апоптозе Ωa
Отношение апоптозоиндуцирующих и деструктивных длительностей импульсов для данной плотности мощности светового излучения будет определяться следующими выражениями:
в случае «длинных» импульсов:
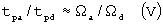 и
и
в случае «коротких» импульсов:
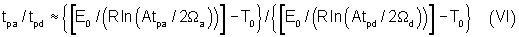
где:
tpa - длительность импульсов при апоптозе (с);
tpd - длительность импульсов при полной деструкции (с);
E0, R, T0, A, Ωa, Ωd - определены выше.
В большинстве практических применений длительности импульсов соотносят с временем термической релаксации, поэтому на Фиг.3 и Табл.3 представлены значения отношения длительностей импульсов tpa/tpd в зависимости от времени термической релаксации tr при Ωа=5·10-2-10-1 для «коротких» (tpd/tr<10-1, указанная стрелкой заштрихованная область в верхней части графика Фиг.3) и «длинных» (tpd/tr>10, указанная стрелкой заштрихованная область в нижней части графика Фиг.3) импульсов. Как видно из Фиг.3 и Табл.3, отношение tpa/tpd сильно зависит от соотношения длительности импульсов tpd и времени термической релаксации tr. Апоптозоиндуцирующие длительности импульсов составляют от 5-10% до 75-90% от деструктивных при данной плотности мощности светового излучения в области «длинных» и «коротких» импульсов соответственно. Таким образом, апоптозоиндуцирующие и деструктивные длительности импульсов также отделены достаточно широкими, с точки зрения практических применений, интервалами значений.
В области «коротких» импульсов апоптоз индуцируется со снижением длительности импульсов при неизменной плотности мощности приблизительно в той же пропорции, что и при снижении мощности при неизменной длительности импульсов (см. Фиг.2 и Табл.2) на 10-30%. В области же «длинных» импульсов чувствительность к изменению мощности по сравнению к изменению длительности импульсов значительно выше. Физически это объясняется тем, что при «длинных» импульсах устанавливается квазистационарный с точки зрения времени тепловой баланс между теплом, выделяющимся при поглощении света в хромофоросодержащей части биоткани, и теплом, рассеивающимся в окружающую биоткань. При этом установившаяся температура зависит преимущественно от мощности, а не от длительности импульса, в отличие от «коротких» импульсов, в случае которых рассеивание тепла в окружающую биоткань отсутствует и температура зависит в равной степени от мощности и от длительности импульса.
«Длинные» импульсы могут быть применимы в тех случаях, когда термодиффузия в окружающую ткань является приемлемой в соответствии с целями фотообработки. Например, при облучении культуры клеток, имеющей расчетное время термической релаксации единицы миллисекунд световыми импульсами длительностью из секундного диапазона, для обеспечения условия изотермичности. Тем не менее, в большинстве случаев фотообработки особый интерес представляют длительности импульсов, не превышающие время термической релаксации более чем на порядок (указанные стрелками значения tpa/tpd, попадающие между заштрихованными областями графика на Фиг.3).
Диапазоны отношений tpa/tpd апоптозоиндуцирующих длительностей импульсов tpa и деструктивных длительностей импульсов tpd, соответствующие степени термоповреждения при апоптозе Ωa=0,05-0,1, в зависимости от времени термической релаксации tr при разных соотношениях деструктивной длительности импульса tpd с временем термической релаксации tr
Таким образом, учитывая, что произведение плотности мощности и длительности импульсов определяет плотность энергии светового излучения, можно сделать вывод о том, что апоптозоиндуцирующая плотность энергии светового излучения при фотообработке может составлять от 10% до 90% плотности энергии, вызывающей деструкцию ткани, обусловленную термонекрозом.
В клинической практике фотообработки, во многом связанной с индивидуальными особенностями патологий, невозможно с необходимой точностью теоретически предсказать требуемые параметры светового излучения. Поэтому, как правило, следуют оценочным диапазонам параметров и затем, после точечных тест-облучений, устанавливают соответствующие для выбранного типа обработки и конечных целей параметры светового излучения. С точки зрения реализации настоящего изобретения на практике, в качестве критерия для выбора необходимой плотности мощности могут быть использованы известные клинические признаки, характерные для реакции живой биоткани на летальное повреждение, например, отек, эритема. Для получения светоиндуцированного апоптоза в соответствии с настоящим изобретением плотность энергии, т.е. плотность мощности и/или длительность импульсов должны быть снижены до исчезновения этих признаков. Затем необходимо дополнительно либо снизить плотность мощности, в пределах 10-55%, при неизменной длительности импульсов в соответствии с Фиг.2 и Табл.2, либо снизить длительность импульсов на 10-95% при неизменной плотности мощности в соответствии с Фиг.3 и Табл.3.
Соотношения апоптозоиндуцирующих и деструктивных температур, плотностей мощности и длительностей импульсов для разных типов биоткани и клеток могут отличаться. Эти отличия обусловлены характером температурной чувствительности, отражающимся в т.ч. и на значениях фактора частоты А и энергии активации коагуляции Е0, которые могут принимать значения в диапазонах 105-106 ДжМ-1 и 1040-10105 с-1, соответственно (J. Pearce, S. Thomsen, "Rate process analysis of thermal damage", Optical-Thermal Response of Laser Irradiated Tissue, A.J. Welsh and MJC van Gemert, eds., Plenum, New York, 1995, pp.561-606), в зависимости от типа биоткани. Однако закономерность останется той же и служит критерием оценки того отличия, которое существует в значениях мощности и длительности импульсов светового излучения, обеспечивающих фототермолиз и светоиндуцированный апоптоз.
Поскольку температура является только одним из физических факторов, приводящих к индуцированию апоптоза, и существуют другие потенциально апоптозоиндуцирующие факторы - химические или механические, проявляющиеся при фотохимическом или фотомеханическом взаимодействии светового излучения с биотканью, то раскрываемый в настоящем изобретении способ светового индуцирования апоптоза может быть соответствующим образом расширен с учетом этих факторов. Светоиндуцированный апоптоз возможен во всем спектральном диапазоне, используемом для селективной фотообработки живой биоткани.
С точки зрения изменений в биоткани сразу после облучения, апоптоз, в отличие от некроза, в большинстве случаев известными методами не фиксируется, т.е. ткань остается такой же, что и до облучения. Процесс апоптотической клеточной гибели проявляется спустя часы после облучения и может продолжаться недели.
Для оперативного неинвазивного мониторинга апоптоза может быть использовано высокочастотное 40-100 МГц ультразвуковое сканирование высокого разрешения (G. Czarnota et al., "Ultrasound Imaging of Apoptosis", Methods in Molecular Biology, v.203, 2002, pp.257-277, G. Czarnota et al.," Ultrasound imaging of apoptosis: high-resolution non-invasive monitoring of programmed cell death in vitro, in situ and in vivo", Br J Cancer. 1999 Oct; 81 (3):520-527). Апоптоз характеризуется серией специфических морфологических изменений клетки, отличных от некроза, и в несколько раз повышающих интенсивность рассеяния ультразвука и эхогенность, как по сравнению с нормальной биотканью, так и по сравнению с некротической. Следовательно, появление на УЗ-изображении биоткани участков с увеличивающейся диффузной яркостью при снижении энергетических параметров светового излучения от летальных к сублетальным означает, с наибольшей степенью вероятности, инициирование апоптоза, если при этом не ожидаются какие-либо другие изменения биоткани, обычно приводящие к повышению интенсивности УЗ рассеяния. Глубина такого ультразвукового сканирования обычно ограничена 3-5 мм, однако часто этого вполне достаточно, например, для дерматологических и косметологических применений.
Облучение биоткани может осуществляться не только моноимпульсным, но и мультиимпульсными режимами, используемыми для предотвращения нежелательного нагрева не подлежащих воздействию, но попадающих в поле облучения, частей биоткани с конкурирующими хромофорами.
Рассматриваемый в настоящем изобретении спектральный диапазон светового излучения имеет верхний предел с длиной волны 2500 нм из-за сильного поглощения внутритканевой водой выше этого значения, что соответственно ограничивает селективность воздействия. Тем не менее, не исключено появление задач, требующих фотообработки, вызывающей индукцию апоптоза на глубину, оцениваемую одним или несколькими клеточными слоями, например, при поверхностном воздействии на культуры клеток эрбиевым (2900 нм) или СО2 (10600 нм) лазерами. Не существует принципиальных причин, по которым настоящее изобретение не могло быть применено и в этих случаях.
Облучение биоткани может производиться как интерстициально, так и чресповерхностно. Интерстициальное, в том числе внутрисосудистое, облучение целесообразно при глубокой локализации подлежащих воздействию клеток, например, адипоцитов жировой ткани, остеобластов костной ткани или клеток крови. Интерстициальное облучение может производиться с использованием тонких световодов, в том числе и в упрочняющей металлической оболочке, вводимых в биоткань с помощью инъекторов, подобно введению игл. Если подлежащая воздействию биоткань локализована неглубоко, как, например, базальный слой кожи или ограничена оптически прозрачной частью биоткани, как, например, стекловидное тело глаза, то целесообразно (в случаях, когда это технически возможно) производить чресповерхностное облучение. Понятие чресповерхностного облучения по настоящему изобретению включает также облучение через поверхность внутренних полостей, например, при эндоскопических вмешательствах с использованием соответствующих технических средств.
При чресповерхностном облучении может оказаться необходимым отвод тепла с поверхности, через которую производят облучение, например, при недостаточно сильном поглощении хромофоров. Теплоотвод может производиться разными способами, например обдувом холодным воздухом, нанесением на поверхность биоткани быстроиспаряющегося хладоагента, в том числе и в форме аэрозоля, контактированием с биотканью тонкой оптически прозрачной пластины из материала с относительно высокой теплопроводностью, например сапфира, при необходимости принудительно охлаждаемой, например, термоэлектрическим элементом, хладоагентами или за счет обдува потоком газа. Эту пластину прикладывают к поверхности кожи и через нее пропускают световое излучение в биоткань во время облучения. Для улучшения оптического и термического контакта между поверхностью биоткани и пластиной, поверхность биоткани либо пластина могут увлажняться оптически прозрачной жидкостью или гелем. Эта пластина, в тех случаях, например, когда гемоглобин оказывается конкурирующим хромофором, может прикладываться с некоторым давлением на биоткань для достижения эффекта компрессии, при котором кровь вытесняется из сосудов, находящихся в зоне облучения. Эта пластина, при согласованных с биотканью коэффициентах преломления и рассеяния, может также служить для выведения обратно рассеянного излучения из биоткани. Будучи выбранной достаточно тонкой, эта же пластина, при необходимости, может служить для ввода части отраженного излучения обратно в биоткань за счет полного внутреннего отражения на внутренней грани.
Во многих случаях, особенно при фотообработке биоткани, содержащей циклично развивающие клетки или клеточные структуры, может потребоваться проведение многократных сеансов облучений одной и той же части биоткани. В этом случае, при выборе режима длительного лечения, необходимо учитывать продолжительность цикла развития этих клеток или структур. Необходимо также учитывать продолжительность процесса апоптотической гибели, которая может составлять от дней до недель.
Хромофоры по настоящему изобретению могут включать как натуральные, так и искусственные. Примерами натуральных, естественно вырабатываемых в этой части биоткани хромофоров, являются меланин, гемоглобин, вода, липиды, протеин, ДНК, цитохромы. Исскуственные хромофоры, вводятся в ткань извне. Искусственными хромофорами могут быть, например, растворы красителей, суспензии пигментов, наночастиц. Эти хромофоры могут локализоваться как внутри, так и вне клеток, подлежащих воздействию в соответствии с целями фотообработки.
В качестве источников светового излучения по настоящему изобретению могут быть использованы различные типы когерентных и некогерентных излучателей: лазеров, светоизлучающих диодов и ламп видимого и инфракрасного диапазонов. Выбор того или иного типа светового источника обусловлен длиной или диапазоном длин волн, соответствующим хромофорам биоткани, длительностью импульсов и мощностью, необходимыми для достижения результатов фотообработки за счет апоптоза. Могут быть использованы такие лазеры, как, например, аргоновые (515 нм), калий-титан-фосфатные КТР (532 нм), на красителях (575-610 нм), рубиновые (694 нм), александритовые (755 нм), диодные (810-1050 нм), неодимовые (1064 нм), гольмиевые (2100 нм) и другие известные типы лазеров непрерывной, свободной генерации и модулированной добротности. Лампы, в отличие от лазеров, являются широкополосными источниками света. Необходимый диапазон длин волн может быть получен фильтрацией светового излучения ксеноновых, ртутных, галогенных и других известных типов ламп, способных после фильтрации обеспечить необходимые энергетические характеристики светового излучения. Могут быть использованы одиночные, точечные источники, а также линейки и матрицы из них.
Фотообработка с использованием индуцированного апоптоза клеток части живой биоткани может сопровождаться стимулированной биологической активностью других компонентов этой части биоткани через обусловленную апоптозом экспрессию цитокинов, таких, например, как TGF-β, PDGF, FGF, IL-1β, TNF-α. Раскрываемый способ фотообработки с индуцированием апоптоза может быть использован для различных целей, включающих эпиляцию и ингибирование роста нежелательных волос, ремоделирование кожи, сосудов, костной и хрящевой ткани, удаление сосудистых дефектов, контроль рубцевания, в т.ч. ингибирование роста гипертрофических рубцов и келоидов, удаление жировой ткани и сальных желез при акне, удаление новообразований кожи, в т.ч. обусловленных дисбалансом в апоптозе и пролиферации клеток, в т.ч. за счет апоптоза васкулярных клеток кровеносных сосудов, питающих эти новообразования. Настоящее изобретение может применяться при обработке тканей растительного происхождения и микроорганизмов, культур клеток живой биоткани, в том числе в сканирующей лазерной микроскопии.
Отличие способа по настоящему изобретению от способов, основанных на селективной фотодеструкции, состоит в возможности достижения клинически результативной «мягкой» атравматичной модификации, в том числе удаления, определенной части биоткани без характерной для ранее известных способов воспалительной реакции и обусловленных этой реакцией побочных эффектов и осложнений. Отсутствие осложнений и побочных эффектов также снижает совокупную стоимость лечения, в т.ч. за счет экономии потерь рабочего времени работоспособными пациентами. Поскольку для светового индуцирования апоптоза требуется на 10-90% меньше световой энергии, чем при фотодеструкции, а следовательно, мощность световых источников и затраты на их производство будут ниже, то снижается стоимость оборудования, расходы на его эксплуатацию и, соответственно, стоимость лечения.
Примеры осуществления изобретения
Нижеприведенные примеры не носят ограничительного характера, а предназначены для демонстрации выполнения изобретения.
Пример 1. Ингибирование роста, в т.ч. удаление нежелательных волос
Апоптоз является центральным элементом, определяющим цикличность в эволюции фолликула, поскольку запрограммированно запускается в определенное время роста, перебрасывая фолликул из фазы роста в стадию покоя. В соответствии с настоящим изобретением посредством неповреждающего «мягкого» внешнего светового воздействия может быть индуцирован апоптоз жизненно значимых клеток фолликула, включающих кератиноциты эпителия и васкулярные клетки питающих микрососудов, приводящий к атрофии фолликула или, по крайней мере, преждевременной регрессии анагенного фолликула в стадию катагена. Преждевременное с точки зрения нормального развития фолликула и управляемое циклическое переключение анагенного фолликула в стадию катагена позволяет ингибировать развитие фолликула, что соответствует целям контроля за ростом нежелательных волос. В отличие от известных способов фотоэпиляции за счет деструкции, в настоящем изобретении удаление жизненно значимых клеток и субструктур происходит за счет их физиологически естественной атравматичной гибели.
Был собран макет устройства, состоящий из головки, включающей низковольтную 15 В/10 А кварцевую галогенную лампу (OSRAM), интегрированную в эллипсоидальный рефлектор, покрытый отражающей золотой пленкой и фокусирующий световое излучение через тонкую кварцевую пластину. Между этой кварцевой пластиной и лампой устанавливались фильтры, отсекающие коротковолновую и длинноволновую части спектра таким образом, чтобы обеспечить спектральную полосу от 500 нм до 1200 нм, в которой поглощение основного хромофора фолликула - меланина волосяного стержня максимально. Управление лампой обеспечивалось источником питания и таймером для установки длительности импульса от 0,5 до 3 с. Облучение производилось на фронтальной части голени с типом кожи II-III по Фицпатрику и цветом волос от коричневого до пепельно-коричневого с плотностью волос 13 шт/см2. За несколько минут до облучения выбривался участок площадью 20 см × 4,5 см таким образом, чтобы волосы выступали на 0,5-1 мм над поверхностью кожи. Облучению подвергался участок 16 см × 4,5 см. Остальной участок (4 см × 4,5 см) не подвергался фотообработке и служил для контроля. Облучаемый участок, в свою очередь, был поделен на 4 квадранта размером 4 см × 4,5 см. На двух соседних квадрантах производилось однократное облучение, на третьем - двукратное, на четвертом - трехкратное. Промежуток времени между последующими многократными облучениями был выбран 1 месяц. Непосредственно до облучения кожа размечалась красным маркером и увлажнялась водой. Головка при облучении плотно прикладывалась кварцевой пластиной на поверхность кожи с небольшим давлением. Для уточнения необходимых параметров светового излучения производились пробные облучения. Показателем ограничения энергии служил признак термоповреждения фолликула - перифолликулярная эдема и выпадение волосяного стержня с внутренней оболочкой фолликула при легком вытягивании пинцетом сразу после облучения.
На одном из квадрантов, предназначенных для однократного облучения, плотность энергии и время экспозиции устанавливались таким образом, чтобы получить перифолликулярную эдему, т.е. термоповреждение фолликула сразу после облучения. Для данного типа волос и данного участка кожи пороговая плотность мощности, при которой проявлялся перифолликулярный отек, составила около 40 Вт/см2 при длительности импульса 1 с. На остальных участках прооизводилось облучение с плотностью мощности, меньшей на 25% при той же длительности импульсов, т.е. 30 Вт/см2, в соответствии с Фиг.2 и Табл.2. После установки необходимых параметров светового излучения весь участок кожи подвергался однократному облучению.
Через несколько дней выявилось слабое пруриго на облученном участке. Волосы на облученном и контрольном участке стали появляться одновременно. Однако через 1,5-2 недели стало наблюдаться массовое выпадение волос на облученном участке и разница между контрольным и облученным участками стала визуально очевидной. Выпадающие волосы были лишены луковиц и их появление на поверхности было обусловлено не столько ростом, сколько вытеснением волосяных «пеньков» из сокращающихся фолликулов. Через 4 недели на контрольном участке выросло до 60% волос, в то время как на облученных участках выросло менее 20% волос. С течением времени эта разница сократилась, но к 18 неделе стабилизировалась на уровне 100% и 80% соответственно. К 28 неделе, т.е. по прошествии 6 месяцев после фотообработки, существенных изменений между контролем и обработанным участком не наблюдалось. Если учесть, что цикл роста волос на голени составляет в среднем от 3 до 6 месяцев, то можно сделать вывод, что 20% фолликулов погибло или, по крайней мере, их активность была остановлена на долгое время. Если далее учесть, что из всех волос на голени в любой момент времени около 20% находится в анагене, то можно сделать также вывод о том, что эти погибшие или остановленные фолликулы являлись анагенными. Плотность вновь растущих волос через 5 месяцев после двукратного облучения снизилась до 60%, через 4 месяца после трехкратного облучения - до 50%, через 3 месяца после четырехкратного - до 40%.
Был также использован диодный лазер с длиной волны 810 нм, мощностью до 90 Вт, длительностью импульсов от 0,1 с до 1 с и диаметром светового пятна 5 мм, обеспечивающим максимальную плотность мощности до 450 Вт/см2.
За несколько минут до облучения выбривался участок площадью 22 см × 4 см с плотностью волос 13 шт/см2 таким образом, чтобы волосы выступали на 0,5-1 мм над поверхностью кожи. Облучению подвергался участок 20 см × 4 см. Остальной участок (2 см × 4 см) не подвергался фотообработке и служил для контроля. Облучаемый участок, в свою очередь, был поделен на 10 квадрантов размером 4 см × 2 см. Средний диаметр волос составлял около 70 микрон, с расчетным временем термической релаксации фолликулов около 0,1 секунды. Облучение производилось через нанесенный на кожу предварительно охлажденный оптически прозрачный гель (обычно используемый при УЗ сканировании).
Пороговая плотность мощности, при которой проявлялся перифолликулярный отек составил около 60 Вт/см2 при длительности импульса 1 с. На 5 из 10 квадрантов производилось однократное облучение с плотностью мощности 60 Вт/см2, 50 Вт/см2, 45 Вт/см2, 40 Вт/см2 и 35 Вт/см2 при фиксированной длительности импульсов 1 с. На остальных 5 квадрантах производилось однократное облучение с длительностью импульсов 1 с, 0,9 с, 0,7 с, 0,4 с, 0,1 с, при фиксированной плотностью мощности 60 Вт/см2.
Снижение плотности мощности ниже 40 Дж/см2 и длительности импульсов ниже 0,4 с оказалось клинически значимым с точки зрения плотности вновь растущих волос, которая приближалась к контрольной.
Заданный эффект по показателю достоверности отличия от контроля наблюдался в диапазоне длин волн от 500 нм до 1200 нм при значениях плотности мощности от 80% вплоть до 70% и длительности импульсов от 80% вплоть до 50% от деструктивных значений плотности мощности и длительности импульсов соответственно.
Пример 2. Удаление сосудистых дефектов кожи
Апоптоз васкулярных клеток, т.е. клеток эндотелия и гладких мышц сосудов, сопровождается усилением проадгезивных и коагулятивных свойств, приводящих к образованию тромба сосудов. В соответствии с настоящим изобретением посредством неповреждающего «мягкого» внешнего светового воздействия может быть индуцирован апоптоз васкулярных клеток, приводящий к тромбозу и атрофии сосудов васкулярных патологий, таких, например, как телеангиэктазии, ангиомы, гемангиомы. В отличие от известных способов фотокоагуляции, в настоящем изобретении удаление сосудистых дефектов происходит атравматично.
В макете светового устройства, описанного в вышеупомянутом примере, был установлен фильтр для обеспечения спектральной полосы от 500 нм до 1200 нм, в которой достаточно сильно поглощают гемоглобины и вода - основные хромофоры в крови кровеносных сосудов.
Облучение производилось на участке лица с кожей типа II÷III по Фицпатрику размером 5 см × 10 см с телеангиоэктазией на щеке в виде сосудов диаметром около 0,5 мм с расчетным временем термической релаксации около 0,5-1 с. Непосредственно до облучения кожа увлажнялась водой. Головка источника света при облучении прикладывалась кварцевой пластиной к коже без давления. Ограничителем потока мощности и длительности экспозиции служили визуальное осветление сосудов, эритема и эдема вдоль сосудов сразу после пробного облучения. Длительность импульсов при этом пробном облучении составила 1 с при плотности мощности в световом пятне около 40 Вт/см2.
Плотность мощности и длительность импульсов были снижены до 40 Вт/см2 при 0,6 с и 28 Вт/см2 при 1 с. Первые признаки визуального осветления и исчезновения сосудов стали заметны через 10 дней после облучения.
Был также использован диодный лазер с длиной волны 810 нм, плотностью мощности 140 Вт/см2 и 100 Вт/см2, при длительности импульсов 0,3 с и 0,5 с соответственно.
Заданный эффект по показателю достоверности отличия от контроля наблюдался в диапазоне длин волн от 500 нм до 1200 нм при значениях плотности мощности от 80% вплоть до 70% и длительности импульсов от 80% вплоть до 65% от деструктивных значений плотности мощности и длительности импульсов соответственно.
Пример 3. Удаление пигментных пятен
Пигментные пятна характеризуются избыточным содержанием меланина в виде меланосом в кератиноцитах и меланоцитах, обусловленным либо избыточным производством меланина меланоцитами (например, солнечное лентиго, веснушки, кофейные макулы), либо избыточной пролиферацией меланоцитов (например, невусы Оты, монгольские пятна). В соответствии с настоящим изобретением, посредством неповреждающего «мягкого» внешнего светового воздействия может быть индуцирован апоптоз избыточных меланосомосодержащих меланоцитов и кератиноцитов, приводящий к осветлению и редукции пигментации, вплоть удаления пигментного пятна. В отличие от известных способов фотодеструкции пигментных пятен, в настоящем изобретении их удаление происходит атравматично.
В качестве источника светового излучения использовался неодимовый лазер с модулированной добротностью и удвоением частоты с длительностью импульсов 10 наносекунд и длиной волны 532 нм, на которой сильно поглощает меланин - основной хромофор пигментных пятен, содержащийся в меланосомах, размер и расчетное время термической релаксации которых составляет около 1 микрона и 0,5-1 микросекунда соответственно. Облучение производилось на коже типа II-III по Фицпатрику с солнечными лентиго на спине. Ограничителем потока мощности и длительности экспозиции служила эдема и эритема в области пигментного пятна сразу после пробного облучения. Поток мощности при этом пробном облучении составил 500 МВт/см2 при длительности импульсов 10 наносекунд. Плотность мощности была снижена до 450 Вт/см2 при той же длительности импульсов. Облучение проводилось последовательными сеансами через 30 дней каждый. Показатель пигментации пятна измерялся аппаратом Mexameter (Courage + Khazaka electronic, Германия). Первые признаки осветления стали заметны через 10 дней после второго сеанса.
В вышеприведенном примере пигментное пятно рассматривалось как совокупность термически не связанных друг с другом поглощающих частей биоткани в виде одиночных меланосомосодержащих клеток. При допустимо изотропном распределении меланина и длительностях импульсов, превышающих характерное время диффузии тепла от одной меланосомосодержащей клетки к другой, следует рассматривать пигментное пятно как единую часть биоткани с определенной толщиной и соответствующим временем термической релаксации. В этом случае может быть включен механизм апоптоза других клеток, в том числе васкулярных, локализованных между меланиносодержащими клетками, приводящий к ремоделированию ткани в целом. Данный подход может быть, в принципе, обобщен и на другие подобные случаи соотношения длительности импульсов и характерного времени термодиффузии между поглощающими центрами. С этой точки зрения был использован диодный лазер с длиной волны 810 нм, на которой меланин поглощает слабее, чем на 532 нм, но достаточно сильно для проявления фототермического эффекта. Толщина лентиго не превышала 20 микрон с расчетным временем термической релаксации около 0,01 секунды. Были получены результаты, аналогичные вышеизложенным, при пороговых для деструкции плотности мощности около 150 Вт/см2 при длительности импульсов 0,02 с, далее сниженных до 150 Вт/см2 при 0,015 с и 120 Вт/см2 при 0,02 с.
Заданный эффект по показателю достоверности отличия от контроля наблюдался в диапазоне длин волн от 500 нм до 900 нм при значениях плотности мощности от 90% вплоть до 70% и длительности импульсов от 90% вплоть до 70% от деструктивных значений плотности мощности и длительности импульсов соответственно.
Пример 4. Ремоделирование кожи при преждевременном старении
Преждевременное старение кожи обусловлено воздействием ультрафиолетового излучения и других вредных факторов и характеризуется рядом показателей, в том числе преждевременными морщинами и потерей упругости из-за разрушения коллагеновых волокон дермы, неоднородностями пигментации эпидермиса, телеангиэктазией. В соответствии с настоящим изобретением посредством неповреждающего «мягкого» внешнего светового воздействия может быть индуцирован апоптоз кератиноцитов эпидермиса и васкулярных клеток субсосочковой васкулатуры дермы в области базального слоя. Апоптоз кератиноцитов и васкулярных клеток сопровождается экспрессией цитокинов, активирующих фибробласты к коллагеногенезу, ремоделированию матрицы, неоваскуляризации в области верхней дермы и ремоделированию эпидермиса. В отличие от известных способов фотодеструкции пигментных пятен, в настоящем изобретении их удаление происходит атравматично.
Фотообработке подвергался участок фотоповрежденной кожи типа II по Фицпатрику размером 50 мм × 50 мм на лице. Фотообработка проводилась в несколько сеансов с промежутком времени в 2 недели.
Субсосочковая васкулатура дермы и базальные кератиноциты эпидермиса рассматривались либо как совокупность термически не связанных друг с другом одиночных поглощающих кератиноцитов и микрососудов размером порядка 10 микрометров с расчетным временем термической релаксации около 1 мс, либо как единая часть биоткани толщиной около 150-200 мкм с расчетным временем термической релаксации около 500-800 мс, значительно превышающим характерное время термодиффузии от одного кератиноцита к другому и от одного микрососуда к другому. Соответственно выбирались источники светового излучения.
Был использован КТР-лазер с длиной волны 532 нм, на которой сильно поглощает гемоглобин и меланин - основные хромофоры васкулатуры и базальных кератиноцитов на этой длине волны. Непосредственно до облучения кожа увлажнялась водой. Ограничителем потока мощности и длительности экспозиции служила эдема и эритема кожи сразу после пробного облучения. Плотности мощности при этом пробном облучении составила около 4000 Вт/см2 при длительности импульсов 2 мс. Плотность мощности и длительность импульсов были снижены до 3200 Вт/см2 при 2 мс и 4000 Вт/см2 при 1,5 мс. Упругость кожи и профиль морщин дополнительно контролировались аппаратами Cutometer и Visioscan (Courage + Khazaka, Германия). Первые признаки в улучшении текстуры и пигментации кожи стали заметны после третьего сеанса облучения. Аналогичные результаты наблюдались при использовании в качестве источника светового излучения макета светового устройства, описанного в вышеупомянутых примерах, в котором был установлен фильтр для обеспечения спектральной полосы от 500 нм до 2500 нм, в которой достаточно сильно поглощает гемоглобин, меланин и вода. Длительность импульсов при пробном облучении составила 1 с при плотности мощности в световом пятне около 15 Вт/см2. Плотность мощности и длительность импульсов были снижены до 10 Вт/см2 при 1 с и 15 Вт/см2 при 0,7 с.
Заданный эффект по показателю достоверности отличия от контроля наблюдался в диапазоне длин волн от 500 нм до 2500 нм при значениях плотности мощности от 80% вплоть до 45% и длительности импульсов от 80% вплоть до 10% от деструктивных значений плотности мощности и длительности импульсов соответственно.
Пример 5. Редукция, в т.ч. удаление сальных желез при акне
Сальные железы при акне характеризуются увеличенным размером и усиленной секрецией кожного жира, приводящей к разрыву волосяного фолликула и воспалению. В соответствии с настоящим изобретением посредством неповреждающего «мягкого» внешнего светового воздействия может быть индуцирован апоптоз себоцитов и васкулярных клеток сальной железы, приводящий к редукции секреции кожного жира и ремоделированию нормальной ткани. В отличие от известных способов фотокоагуляции сальных желез при акне, в настоящем изобретении удаление сосудистых дефектов происходит атравматично.
В качестве источника светового излучения использовался диодный лазер с длиной волны 920 нм, на которой достаточно сильно поглощают липиды - основные хромофоры сальных желез акне.
Облучение производилось на коже типа II-III по Фицпатрику с акне на спине диаметром около 0,3 мм с расчетным временем термической релаксации около 0,5 с. Непосредственно до облучения кожа увлажнялась водой. Ограничителем потока мощности и длительности импульсов служила эдема и эритема кожи в области акне сразу после пробного облучения. Длительность импульсов при этом пробном облучении составила 0,5 с при плотности мощности в световом пятне около 80 Вт/см2.
Плотность мощности и длительность импульсов были снижены до 80 Вт/см2 при 0,3 с и 60 Вт/см2 при 1 с. Первые признаки визуального исчезновения акне стали заметны через 7 дней после облучения.
Аналогичные результаты были получены с использованием макета светового устройства, описанного в вышеупомянутом примерах, в котором был установлен фильтр для обеспечения спектральной полосы 500-1800 нм поглощения гемоглобина/оксигемоглобина и липидов. Плотность мощности и длительность импульсов составляли 30 Вт/см2, 20 Вт/см2 и 1 с, 1,5 с соответственно.
Заданный эффект по показателю достоверности отличия от контроля наблюдался в диапазоне длин волн от 500 нм до 1800 нм при значениях плотности мощности от 80% вплоть до 45% и длительности импульсов от 80% вплоть до 35% от деструктивных значений плотности мощности и длительности импульсов соответственно.
Пример 6. Удаление новообразований
Рост новообразований при размерах более 1-2 мм3 сопровождается интенсивной неоваскуляризацией по периферии и внутри этих новообразований. Васкулатура новообразования обеспечивает его необходимое питание и представляет собой преимущественно хаотическое переплетение сосудов с плотностью, превышающей от нескольких единиц до нескольких десятков раз плотность сосудов в нормальной ткани. В соответствии с настоящим изобретением посредством неповреждающего «мягкого» внешнего светового воздействия может быть индуцирован апоптоз васкулярных клеток сосудов новообразования, например бородавки, папилломы, карциномы, псориатической бляшки, приводящий к тромбозу и атрофии этих сосудов с последующей атрофией самого новообразования и ремоделированием нормальной ткани. В случае пигментированных новообразований может быть использовано поглощение в меланине. В отличие от известных способов фотодеструкции, в настоящем изобретении удаление новообразований происходит атравматично.
Фотообработке подвергались бородавки на среднем и указательном пальцах правой руки с кожей типа II по Фицпатрику. Фотообработка проводилась в несколько сеансов с промежутком времени в 2-3 недели.
Васкулатура бородавок рассматривалась либо как совокупность термически не связанных друг с другом одиночных поглощающих микрососудов размером порядка десятков микрон с расчетным временем термической релаксации около 1 мс, либо как единая часть биоткани толщиной около 2-3 мм с расчетным временем термической релаксации около 50-100 с, значительно превышающим характерное время термодиффузии от одного сосуда к другому. В последнем случае может быть включен механизм апоптоза клеток новообразования, расположенных между микрососудами, приводящий к ремоделированию ткани в целом. Соответственно выбирались источники светового излучения.
Был использован КТР-лазер с длиной волны 532 нм, на которой сильно поглощает гемоглобин крови - основной хромофор васкулатуры в этом спектральном диапазоне. Непосредственно до облучения кожа увлажнялась водой. Ограничителем потока мощности и длительности экспозиции служила эдема и эритема кожи сразу после пробного облучения. Плотности мощности при этом пробном облучении составила около 2500 Вт/см2 при длительности импульсов 2 мс.
Плотность мощности и длительность импульсов были снижены до 2000 Вт/см2 при 2 мс и 2500 Вт/см2 при 1,5 мс. Первые признаки визуального исчезновения бородавок стали заметны после второго сеанса облучения.
Аналогичные результаты наблюдались при использовании в качестве источника светового излучения макета светового устройства, описанного в вышеупомянутых примерах, в котором был установлен фильтр для обеспечения спектральной полосы от 500 нм до 1200 нм, в которой достаточно сильно поглощает гемоглобин крови. Длительность импульсов при пробном облучении составила 20 с при плотности мощности в световом пятне около 5 Вт/см2. Плотность мощности и длительность импульсов были снижены до 3 Вт/см2 при 20 с и 5 Вт/см2 при 12 с.
Заданный эффект по показателю достоверности отличия от контроля наблюдался в диапазоне длин волн от 500 нм до 1200 нм при значениях плотности мощности от 80% вплоть до 55% и длительности импульсов от 80% вплоть до 65% от деструктивных значений плотности мощности и длительности импульсов соответственно.
Пример 7. Редукция, в т.ч. удаление гипертрофических и келоидных рубцов
Развивающиеся гипертрофические и келоидные рубцы характеризуются цветом красного оттенка, от розового до пурпурного, обусловленного питающей капиллярной васкулатурой. В соответствии с настоящим изобретением, посредством неповреждающего «мягкого» внешнего светового воздействия может быть индуцирован апоптоз васкулярных клеток сосудов микроваскулатуры рубцов, приводящий к тромбозу этих сосудов с атрофией рубца. В случае гиперпигментированных рубцов может быть использовано поглощение в меланине. В отличие от известных способов фотодеструкции в настоящем изобретении редукция гипертрофических и келоидных рубцов происходит атравматично.
Фотообработке подвергался гипертрофический постоперационный рубец размером 2 мм × 50 мм на руке с кожей типа II по Фицпатрику. Фотообработка проводилась в несколько сеансов с промежетком времени в 4 недели. Часть рубца длиной 5 мм использовалась для пробных облучений.
Васкулатура рубцов рассматривалась либо как совокупность термически не связанных друг с другом одиночных поглощающих микрососудов размером порядка десятков микрон с расчетным временем термической релаксации около 1 мс, либо как единая часть биоткани толщиной около 2 мм с расчетным временем термической релаксации около 50-100 с, значительно превышающим характерное время термодиффузии от одного сосуда к другому. В последнем случае может быть также включен механизм апоптоза фибробластов, расположенных между микрососудами с последующим ремоделированием ткани в целом. Соответственно выбирались источники светового излучения.
Был использован КТР-лазер с длиной волны 532 нм, на которой сильно поглощает гемоглобин крови - основной хромофор васкулатуры в этом спектральном диапазоне. Непосредственно до облучения кожа увлажнялась водой. Ограничителем потока мощности и длительности экспозиции служила эдема и эритема кожи сразу после пробного облучения. Плотности мощности при этом пробном облучении составила около 3000 Вт/см2 при длительности импульсов 2 мс.
Плотность мощности и длительность импульсов были снижены до 2400 Вт/см2 при 2 мс и 3000 Вт/см2 при 1,5 мс. Рубцы в отличие от нормальной дермы не обладают повышенной эхогенностью, по-видимому, в силу неупорядоченности коллагеновых волокон. Первые признаки визуальной редукции рубца стали заметны после третьего сеанса облучения.
Аналогичные результаты наблюдались при использовании в качестве источника светового излучения макета светового устройства, описанного в вышеупомянутых примерах, в котором был установлен фильтр для обеспечения спектральной полосы от 500 нм до 1200 нм, в которой достаточно сильно поглощает гемоглобин крови. Длительность импульсов при пробном облучении составила 20 с при плотности мощности в световом пятне около 4 Вт/см2. Плотность мощности и длительность импульсов были снижены до 2,4 Вт/см2 при 20 с и 4 Вт/см2 при 12 с.
Заданный эффект по показателю достоверности отличия от контроля наблюдался в диапазоне длин волн от 500 нм до 1200 нм при значениях плотности мощности от 85% вплоть до 60% и длительности импульсов от 80% вплоть до 70% от деструктивных значений плотности мощности и длительности импульсов соответственно.
Следует отметить, что при фотообработке на участках, облученных световым излучением с апоптоиндуцирующей плотностью энергии, косметически значимых побочных эффектов и осложнений не наблюдалось. В то же время, при деструктивной для хромофоросодержащих частей плотности энергии, примерно в 80% облучений, наблюдались волдыри и гиперпигментация из-за конкурирующего поглощения части светового излучения в меланиносодержащем базальном слое. Данный результат свидетельствует о том, что использование деструктивных значений плотности энергии с неизбежностью приводит к повреждению эпидермиса при чрескожном облучении и требует в большинстве случаев специальных охлаждающих систем.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТРОЙСТВО ДЛЯ ТЕРАПЕВТИЧЕСКОЙ И КОСМЕТОЛОГИЧЕСКОЙ ФОТООБРАБОТКИ БИОТКАНЕЙ И СПОСОБ ЕГО ИСПОЛЬЗОВАНИЯ | 1999 |
|
RU2181571C2 |
| Способ удаления сосудистых поражений кожи | 2017 |
|
RU2669551C1 |
| ГЕНЕРАТОР АЭРОЗОЛЯ | 2021 |
|
RU2805045C2 |
| ГЕНЕРАТОР АЭРОЗОЛЯ | 2019 |
|
RU2792826C2 |
| ГЕНЕРАТОР АЭРОЗОЛЯ | 2019 |
|
RU2789673C2 |
| СИСТЕМЫ И СПОСОБЫ ПРЕДВАРИТЕЛЬНОГО КОНДИЦИОНИРОВАНИЯ ДЛЯ СОЗДАНИЯ ТЕРМИЧЕСКОГО ГРАДИЕНТА С ЦЕЛЬЮ СЕЛЕКТИВНОГО ФОТОТЕРМИЧЕСКОГО ТАРГЕТИРОВАНИЯ | 2017 |
|
RU2785336C2 |
| СПОСОБ ПОДАВЛЕНИЯ ПАТОГЕННЫХ И УСЛОВНО-ПАТОГЕННЫХ МИКРООРГАНИЗМОВ | 2010 |
|
RU2430757C1 |
| СПОСОБ ЭПИЛЯЦИИ | 1998 |
|
RU2192295C2 |
| Способ удаления татуировок на коже | 2018 |
|
RU2692936C1 |
| СПОСОБ МОДУЛЯЦИИ РОСТА ВОЛОС И МОДУЛИРУЮЩЕЕ УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2007 |
|
RU2435619C2 |


Изобретение относится к фотообработке живой биоткани. Осуществляют фотообработку биоткани, содержащей определенную часть с хромофором, выполняемую за счет светоиндуцированного апоптоза клеток этой части биоткани, приводящего к ее атравматичной модификации, в том числе удалению. Способ заключается в облучении биоткани световым излучением с длиной волны от 500 нм до 2500 нм с плотностью энергии, недостаточной для деструкции, но достаточной для индуцирования апоптоза клеток части биоткани, содержащей хромофор. Способ позволяет осуществить фотообработку для целей ингибирования роста нежелательных волос, удаления сосудистых дефектов и пигментных пятен кожи, ремоделирования кожи, редукции сальных желез при акне, удаления новообразований, редукции, в т.ч. удаления гипертрофических и келоидных рубцов с индукцией светоиндуцированного апоптоза клеток этих частей биоткани. Кроме того, способ позволяет осуществлять модификацию, в т.ч. удаление биоткани атравматично, без косметически неприемлемых осложнений. 8 н. и 14 з.п. ф-лы, 3 ил., 3 табл.
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 1996 |
|
RU2169015C2 |
| US 6676655 B2, 13.01.2004 | |||
| US 6887260 B1, 03.05.2005 | |||
| ГЕИНИЦ А.В | |||
| и др | |||
| Фотодинамическая терапия в лечебной практике | |||
| Лечащий врач, М., 2005, №2, с.74-75 | |||
| Фотодинамическая терапия гнойных и длительно незаживающих ран | |||
| Пособие для врачей | |||
| М., 2004, с.3-12. | |||
Авторы
Даты
2007-02-27—Публикация
2005-05-05—Подача