Данное изобретение относится к молекуле антитела, имеющей специфичность в отношении антигенных детерминант фактора некроза альфа опухоли человека (TNFα). Данное изобретение относится также к терапевтическим применениям данной молекулы антитела и способам получения данной молекулы антитела.
Данное изобретение относится к молекулам антител. В молекуле антитела имеются две тяжелые цепи и две легкие цепи. Каждая тяжелая цепь и каждая легкая цепь имеет на ее N-концевой стороне вариабельный домен. Каждый вариабельный домен состоит из четырех каркасных районов (FR), перемежающихся с тремя определяющими комплементарность (гипервариабельными) районами (CDR). Остатки в вариабельных доменах обычно нумеруются в соответствии с системой, изобретенной Kabat et al. Эта система приведена в Kabat et al., 1987, in Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, NIH, USA (далее называемой «Kabat et al. (supra)»). Эта система нумерации используется в данном описании, за исключением случаев, где дается иное указание.
Обозначение остатков по Kabat не всегда прямо соответствует линейной нумерации аминокислотных остатков. Фактическая линейная последовательность аминокислот может содержать меньше аминокислот или дополнительные аминокислоты по сравнению со строгой нумерацией по Kabat в соответствии с укорочением структурного элемента или вставкой в структурный компонент либо каркасной области, либо CDR, базовой структуры вариабельного домена. Точная нумерация остатков по Kabat может быть определена для конкретного антитела сопоставлением гомологичных остатков в последовательности антитела со «стандартной» пронумерованной по Kabat последовательностью.
CDR вариабельного домена тяжелой цепи расположены при остатках 31-35 (CDRH1), остатках 50-65 (CDRH2) и остатках 95-102 (CDRH3) в соответствии с нумерацией по Kabat.
CDR вариабельного домена легкой цепи расположены при остатках 24-34 (CDRL1), остатках 50-56 (CDRL2) и остатках 89-97 (CDRL3) в соответствии с нумерацией по Kabat.
Конструкция CDR-привитых антител описана в Европейской заявке на патент ЕР-А-0239400, раскрывающей способ, в котором CDR мышиного моноклонального антитела пересаживают на каркасные области вариабельных доменов иммуноглобулина человека посредством сайт-направленного мутагенеза с использованием длинных олигонуклеотидов. CDR определяют антигенсвязывающую специфичность антител и являются относительно короткими пептидными последовательностями, несомыми каркасными областями вариабельных доменов.
Самая ранняя работа по гуманизации моноклональных антител CDR-пересадкой проводилась на моноклональных антителах, узнающих синтетические антигены, такие как NP. Однако примеры, в которых мышиное моноклональное антитело, узнающее лизоцим, и крысиное моноклональное антитело, узнающее антиген на Т-клетках человека, были гуманизированы CDR-пересадкой, были описаны Verhoeyen et al. (Science, 239, 1534-1536, 1988) и Riechmann et al. (Nature, 332, 323-324, 1988) соответственно.
Riechmann et al. нашли, что перенос только CDR (определенного Kabat (Kabat et al. (supra) и Wu et al., J. Exp.Med., 132, 211-250, 1970)) был недостаточным для обеспечения удовлетворительной антигенсвязывающей активности в CDR-привитом продукте. Было обнаружено, что ряд каркасных остатков должны быть изменены таким образом, чтобы они соответствовали остаткам донорской каркасной области. Предлагаемые критерии для выбора, какие каркасные остатки необходимо изменить, описаны в Международной заявке на патент WO 90/07861.
Был опубликован ряд обзоров, обсуждающих CDR-привитые антитела, в том числе Vaughan et al. (Nature Biotechnology, 16, 535-539, 1998).
TNFα представляет собой провоспалительный цитокин, который высвобождается клетками иммунной системы и взаимодействует с клетками иммунной системы. Так, TNFα высвобождается макрофагами, которые были активированы липополисахаридами (ЛПС) грамотрицательных бактерий. Как таковой TNFα является, по-видимому, эндогенным медиатором центральной важности, участвующим в развитии и патогенезе эндотоксического шока, связанного с бактериальным сепсисом. Было показано, что TNFα положительно регулируется при ряде заболеваний человека, в том числе хронических заболеваниях, таких как ревматоидный артрит, болезнь Крона, язвенный колит и множественный склероз. Мыши, трансгенные в отношении TNFα человека, продуцируют высокие уровни TNFα конститутивно и развивают спонтанный деструктивный полиартрит, напоминающий ревматоидный артрит (Kaffer et al., EMBO J., 10, 4025-4031, 1991). Таким образом, TNFα называют провоспалительным цитокином.
Моноклональные антитела против TNFα известны из предшествующего уровня техники. Meager et al. (Hybridoma, 6, 305-311, 1987) описывают мышиные моноклональные антитела против рекомбинантного TNFα. Fendly et al. (Hybridoma, 6, 359-370, 1987) описывают применение мышиных моноклональных антител против рекомбинантного TNFα для определения нейтрализующих эпитопов на TNF. Shimamoto et al. (Immunology Letters, 17, 311-318, 1988) описывают применение мышиных моноклональных антител против TNFγ и их применение для предупреждения эндотоксического шока у мышей. Кроме того, в Международной заявке на патент WO 92/11383 описаны антитела, в том числе CDR-привитые антитела, специфические для TNFα. Rankin et al. (British J. Rheumatology, 34, 334-342, 1995) описывают применение таких CDR-привитых антител для лечения ревматоидного артрита. В US-A-5919452 описаны химерные антитела против TNF и их применение для лечения патологий, связанных с присутствием TNF.
Антитела к TNFα были предложены для профилактики и лечения эндотоксинового бактериально-токсического шока (эндотоксического шока) (Beutler et al., Science, 234, 470-474, 1985). Boomer et al. (Critical Care Medicine, 21, S441-S446, 1993) и Wherry et al., (Critical Care Medicine, 21, S436-S440) обсуждают терапевтический потенциал антител против TNFα для лечения септического шока. Применение антител против TNFα для лечения септического шока обсуждается также Kirschenbaum et al. (Critical Care Medicine, 26, 1625-1626, 1998). Индуцируемый коллагеном артрит может эффективно лечиться с использованием моноклонального антитела против TNFα (Williams et al. (PNAS-USA, 89, 9784-9788, 1992)).
Увеличенные уровни TNFα обнаруживают как в синовиальной жидкости, так и в периферической крови пациентов, страдающих от ревматоидного артрита. При введении TNFα-блокирующих агентов пациентам, страдающим от ревматоидного артрита, у них уменьшается воспаление, улучшаются симптомы и замедляется повреждение суставов (McKown et al. (Arthritis Rheum., 42, 1204-1208, 1999).
Применение антител против TNFα для лечения ревматоидного артрита и болезни Крона обсуждается в Feldman et al. (Transplantation Proceedings, 30, 4126-4127, 1998), Adorini et al. (Trends in Immunology Today, 18, 209-211, 1997) и в Feldman et al. (Advances in Immunology, 64, 283-350, 1997). Антитела к TNFα, используемые в таких способах лечения, обычно являются химерными антителами, такими как описано в US-A-5919452.
Два TNFα-блокирующих продукта лицензированы в настоящее время для лечения ревматоидного артрита. Первый, названный этанерцептом, продается Immunex Corporation в виде Enbrel™. Он представляет собой рекомбинантный слитый белок, содержащий два р75 растворимых TNF-рецепторных домена, связанных с Fc-частью иммуноглобулина человека. Второй, названный инфликсимабом, продается Centocor Corporation в виде Remicade™. Он представляет собой химерное антитело, имеющее мышиные вариабельные домены анти-TNFα и константные домены IgG1 человека.
Молекулы рекомбинантного антитела к TNFα предшествующего уровня техники обычно имеют пониженную аффинность в отношении TNFα по сравнению с антителами, из которых получены вариабельные районы или CDR, и обычно должны продуцироваться в клетках млекопитающих и их производство является дорогостоящим. Антитела к TNFα предшествующего уровня техники описаны в Stephens et al. (Immunology, 85, 668-674, 1995), GB-A-2246570 и GB-A-2297145.
Существует потребность в молекуле антитела для лечения хронических воспалительных заболеваний, которая может быть использована повторно и может быть легко и эффективно получена. Существует также потребность в молекуле антитела, которая имеет высокую аффиность в отношении TNFα и низкую иммуногенность у человека.
В первом аспекте данное изобретение обеспечивает молекулу антитела, имеющую специфичность в отношении TNFα, содержащую тяжелую цепь, в которой вариабельный домен содержит CDR (как определено Kabat et al. (supra)), имеющий последовательность, приведенную в виде H1 на фигуре 3 (SEQ ID NO: 1) для CDRH1, в виде Н2' на фигуре 3 (SEQ ID NO: 2) или в виде Н2 на фигуре 3 (SEQ ID NO: 7) для CDRH2 или в виде Н3 на фигуре 3 (SEQ ID NO:3) для CDRH3.
Молекула антитела первого аспекта данного изобретения содержит по меньшей мере один CDR, выбранный из H1, Н2' или Н2 и H3 (SEQ ID NO: 1; SEQ ID NO: 2 или SEQ ID NO: 7 и SEQ ID NO: 3) для вариабельного домена тяжелой цепи. Предпочтительно данная молекула антитела содержит по меньшей мере два и более, предпочтительно все три, CDR в вариабельном домене тяжелой цепи.
Во втором аспекте данного изобретения обеспечена молекула антитела, имеющая специфичность в отношении TNFα человека, содержащая легкую цепь, в которой вариабельный домен содержит CDR (как определено Kabat et al. (supra)), имеющий последовательность, представленную в виде L1 на фигуре 3 (SEQ ID NO: 4) для CDRL1, L2 на фигуре 3 (SEQ ID NO: 5) для CDRL2 или L3 на фигуре 3 (SEQ ID NO: 6) для CDRL3.
Молекула антитела второго аспекта данного изобретения содержит по меньшей мере один CDR, выбранный из L1, L2 и L3 (SEQ ID NO: 4 - SEQ ID NO: 6) для вариабельного домена легкой цепи. Предпочтительно данная молекула антитела содержит по меньшей мере два или более, предпочтительно все три, CDR в вариабельном домене легкой цепи.
Молекулы антител первого и второго аспектов данного изобретения предпочтительно имеют комплементарную легкую цепь или комплементарную тяжелую цепь соответственно.
Предпочтительно молекула антитела первого или второго аспектов данного изобретения содержит тяжелую цепь, в которой вариабельный домен содержит CDR (как определено Kabat et al. (supra)), имеющий последовательность, представленную в виде H1 на фигуре 3 (SEQ ID NO: 1) для CDRH1, в виде Н2' или Н2 на фигуре 3 (SEQ ID NO: 2 или SEQ ID NO: 7) для CDRH2 или в виде H3 на фигуре 3 (SEQ ID NO: 3) для CDRH3, и легкую цепь, в которой вариабельный домен содержит CDR (как определено Kabat et al. (supra)), имеющий последовательность, представленную в виде L1 на фигуре 3 (SEQ ID NO:4) для CDRL1, в виде L2 на фигуре 3 (SEQ ID NO: 5) для CDRL2 или в виде L3 на фигуре 3 (SEQ ID NO: 6) для CDRL3.
CDR, представленные в SEQ ID NO: 1 и 3-7 на фигуре 3, цитированные выше, получены из мышиного моноклонального антитела hTNF40. Однако SEQ ID NO: 2 состоит из гибридного CDR. Этот гибридный CDR содержит часть CDR2 тяжелой цепи из мышиного моноклонального антитела hTNF40 (SEQ ID NO: 7) и часть CDR2 тяжелой цепи из последовательности V-области зародышевой линии группы 3 человека.
Полные последовательности вариабельных доменов мышиного антитела hTNF40 показаны на фигуре 6 (легкая цепь) (SEQ ID NO: 99) и фигуре 7 (тяжелая цепь) (SEQ ID NO: 100). Это мышиное антитело называют ниже «донорским антителом».
Первым альтернативно предпочтительным вариантом первого или второго аспекта данного изобретения является мышиное моноклональное антитело hTNF40, имеющее последовательности вариабельных доменов легкой и тяжелой цепи, показанные на фигуре 6 (SEQ ID NO: 99) и фигуре 7 (SEQ ID NO: 100) соответственно. Константная область легкой цепи hTNF40 является каппа-цепью, а константная область тяжелой цепи является IgG2a.
Во втором альтернативно предпочтительном варианте антитело в соответствии либо с первым, либо со вторым аспектами данного изобретения является химерной молекулой мышь/человек, называемой здесь химерной молекулой антитела hTNF40. Химерная молекула антитела содержит вариабельные домены мышиного моноклонального антитела hTNF40 (SEQ ID NO: 99 и 100) и константные домены человека. Предпочтительно молекула химерного антитела hTNF40 содержит С-каппа-домен человека (Hieter et al., Cell, 22, 197-207, 1980; номер доступа Genebank J00241) в легкой цепи и 4 гамма-домена человека (Flanagan et al., Nature, 300, 709-713, 1982) в тяжелой цепи.
В третьем альтернативно предпочтительном варианте антитело в соответствии с первым и вторым аспектами данного изобретения является CDR-привитой молекулой антитела (молекулой антитела с пересаженным CDR). Термин «CDR-привитая молекула антитела» в применении здесь относится к молекуле антитела, в которой тяжелая и/или легкая цепь содержит один или несколько CDR (в том числе, если желательно, гибридный CDR) из донорского антитела (например, мышиного моноклонального антитела), пересаженный в каркас вариабельной области тяжелой или легкой цепи акцепторного антитела (например, антитела человека).
Предпочтительно такое CDR-привитое антитело имеет вариабельный домен, содержащий акцепторные каркасные районы человека, а также один или несколько донорских CDR, указанных выше.
При пересадке CDR может быть использована любая каркасная последовательность вариабельного района подходящего акцептора с учетом класса/типа донорского антитела, из которого происходят данные CDR, в том числе каркасные районы мыши, приматов и человека. Примерами каркасов человека, которые могут быть использованы в данном изобретении, являются KOL, NEWM, REI, EU, TUR, TEI, LAY и РОМ (Kabat et al. (supra)). Например, KOL и NEWM могут быть использованы для тяжелой цепи, REI может быть использован для легкой цепи, a EU, LAY и РОМ могут быть использованы как для тяжелой, так и для легкой цепи. Предпочтительными каркасными областями для легкой цепи являются каркасные области группы 1 человека, показанные на фигуре 1 (SEQ ID NO: 83, 85, 87 и 89). Предпочтительными каркасными областями для тяжелой цепи являются каркасные области группы 1 и группы 3 человека, показанные на фигуре 2 (SEQ ID NO: 91, 93, 95 и 97 и SEQ ID NO: 106, 107, 108 и 109) соответственно.
В CDR-привитом антителе данного изобретения предпочтительно использовать в качестве акцепторного антитела такое антитело, которое имеет цепи, гомологичные цепям донорского антитела. Акцепторные тяжелая и легкая цепи не должны быть обязательно получены из одного и того же антитела и могут, если желательно, содержать композиционные (составные) цепи, имеющие каркасные области, происходящие из различных цепей.
В CDR-привитом антителе данного изобретения каркасные области не должны обязательно иметь ту же самую последовательность, которую имеет акцепторное антитело. Например, необычные остатки могут быть изменены на более часто встречающиеся остатки для этого класса или типа акцепторной цепи. Альтернативно, выбранные остатки в акцепторных каркасных областях могут быть изменены таким образом, что они соответствуют остаткам, обнаруживаемым в том же самом положении в донорском антителе. Такие изменения должны поддерживаться до минимума, необходимого для восстановления аффинности донорского антитела. Протокол для выбора остатков в акцепторных каркасных областях, которые должны быть изменены, представлен в WO 91/09967.
Предпочтительно в молекуле CDR-привитого антитела данного изобретения, если акцепторная тяжелая цепь имеет каркасные области группы 1 человека (показанные на фигуре 2) (SEQ ID NO: 91, 93, 95 и 97), то данные акцепторные каркасные области тяжелой цепи содержат, кроме одного или нескольких донорских CDR, донорские остатки в положениях 28, 69 и 71 (в соответствии с Kabat et al. (supra)).
Альтернативно, если акцепторная тяжелая цепь имеет каркасные области группы 1, то данные акцепторные каркасные области тяжелой цепи содержат, кроме одного или нескольких донорских CDR, донорские остатки в положениях 28, 38, 46, 67, 69 и 71 (в соответствии с Kabat et al. (supra)).
Предпочтительно в молекуле CDR-привитого антитела данного изобретения, если акцепторная тяжелая цепь имеет каркасные области группы 3 человека (показанные на фигуре 2) (SEQ ID NO: 106, 107, 108 и 109), то данные акцепторные каркасные области тяжелой цепи содержат, кроме одного или нескольких донорских CDR, донорские остатки в положениях 27, 28, 30, 48, 49, 69, 71, 73, 76 и 78 (в соответствии с Kabat et al. (supra)).
Предпочтительно в молекуле CDR-привитого антитела данного изобретения, если акцепторная легкая цепь имеет каркасные области группы 1 человека (показанные на фигуре 1) (SEQ ID NO: 83, 85, 87 и 89), то данные акцепторные каркасные области легкой цепи содержат донорские остатки в положениях 46 и 60 (в соответствии с Kabat et al., (supra)).
Донорские остатки являются остатками из донорского антитела, т.е. антитела, из которого первоначально происходят CDR.
Молекула антитела данного изобретения может содержать полную молекулу антитела, имеющую полноразмерные тяжелую и легкую цепи; его фрагмент, такой как Fab, модифицированный Fab, Fab'-, F(ab')2- или Fv-фрагмент; мономер или димер легкой цепи или тяжелой цепи; одноцепочечное антитело, например одноцепочечный Fv, в котором вариабельные домены тяжелой и легкой цепей соединены пептидным линкером. Подобным образом, вариабельные домены тяжелой и легкой цепей могут быть скомбинированы с доменами другого антитела, если необходимо.
Предпочтительно молекула антитела данного изобретения является Fab-фрагментом. Предпочтительно Fab-фрагмент имеет тяжелую цепь, имеющую последовательность, представленную в виде SEQ ID NO: 111, и легкую цепь, имеющую последовательность, представленную в виде SEQ ID NO: 113. Аминокислотные последовательности, приведенные в SEQ ID NO: 111 и SEQ ID NO: 113, предпочтительно кодируются нуклеотидными последовательностями, представленными в SEQ ID NO: 110 и SEQ ID NO: 112 соответственно.
Альтернативно, предпочтительно, чтобы молекула антитела данного изобретения была модифицированным Fab-фрагментом, в котором данная модификация является добавлением к С-концевой стороне его тяжелой цепи одной или нескольких аминокислот для создания возможности присоединения эффекторной или репортерной молекулы. Предпочтительно дополнительные аминокислоты образуют модифицированную шарнирную область, содержащую один или два остатка цистеина, к которым может быть присоединена эффекторная или репортерная молекула. Такой модифицированный Fab-фрагмент предпочтительно имеет тяжелую цепь, имеющую последовательность, приведенную в виде SEQ ID NO: 115, и легкую цепь, имеющую последовательность, приведенную в виде SEQ ID NO: 113. Аминокислотная последовательность, представленная в SEQ ID NO: 115, предпочтительно кодируется нуклеотидной последовательностью, представленной в SEQ ID NO: 114.
Предпочтительной эффекторной группой является полимерная молекула, которая может быть присоединена к модифицированному Fab-фрагменту для увеличения его биологического полупериода существования in vivo.
Данная полимерная молекула может обычно быть синтетическим или природно встречающимся полимером, например необязательно замещенным имеющим прямую или разветвленную цепь полиалкиленовым, полиалкениленовым или полиоксиалкиленовым полимером, или разветвленным или неразветвленным полисахаридом, например гомо- или гетерополисахаридом.
Конкретные необязательные заместители, которые могут присутствовать на указанных выше синтетических полимерах, включают в себя одну или несколько гидрокси, метильных или метоксигрупп. Конкретные примеры синтетических полимеров включают в себя необязательно замещенные, имеющие прямую или разветвленную цепь поли(этиленгликоль), поли(пропиленгликоль), поли(виниловый спирт) или их производные, особенно необязательно замещенный поли(этиленгликоль), такой как метоксиполи(этиленгликоль) или его производные. Конкретные природно встречающиеся полимеры включают в себя лактозу, амилозу, декстран, гликоген или их производные. «Производные» в применении здесь включают в себя реакционноспособные производные, например тиол-селективные реакционноспособные группы, такие как малеимиды, и т.п. Реакционноспособная группа может быть связана непосредственно или через линкерный сегмент с данным полимером. Должно быть понятно, что остаток такой группы будет в некоторых случаях образовывать часть продукта в виде связывающей группы между фрагментом антитела и полимером.
Размер полимера может варьироваться, если желательно, но обычно будет находиться в диапазоне средней молекулярной массы от 500 Да до 50000 Да, предпочтительно от 5000 до 40000 Да и более предпочтительно от 25000 до 40000 Да. Размер полимера может быть, в частности, выбран на основании предполагаемого применения данного продукта. Так, например, если продукт должен покидать кровоток и проникать в ткань, например, для использования для лечения опухоли, может быть выгодным применение полимера с небольшой молекулярной массой, например с молекулярной массой около 5000 Да. Для применений, в которых этот продукт остается в кровотоке, может быть выгодным применение полимера с более высокой молекулярной массой, например имеющего молекулярную массу в диапазоне от 25000 Да до 40000 Да.
Особенно предпочтительные полимеры включают в себя полиалкиленовый полимер, такой как поли(этиленгликоль), или, особенно, метоксиполи(этиленгликоль) или его производное, и особенно с молекулярной массой в диапазоне от приблизительно 25000 Да до приблизительно 40000 Да.
Каждая полимерная молекула, присоединенная к фрагменту модифицированного антитела, может быть ковалентно связана с атомом серы остатка цистеина, локализованного в данном фрагменте. Ковалентная связь будет обычно дисульфидной связью или, в частности, сера-углеродной связью.
Если желательно, фрагмент антитела может иметь присоединенные к нему эффекторные или репортерные молекулы. Эффекторные или репортерные молекулы могут быть присоединены к фрагменту антитела через любую доступную функциональную группу боковой цепи аминокислоты или терминальной аминокислоты, расположенной в данном фрагменте, например через любую свободную амино, имино, гидроксильную или карбоксильную группу.
Активированный полимер может быть использован в качестве исходного материала в приготовлении модифицированных полимером фрагментов антител, описанных выше. Активированный полимер может быть любым полимером, содержащим тиол-реактивную группу, такую как α-галогенкарбоновая кислота или эфир, например иодацетамид, имид, например малеимид, винилсульфон или дисульфид. Такие исходные материалы могут быть получены коммерчески (например, из Shearwater Polymers Inc., Huntsville, AL, USA) или могут быть получены из коммерчески доступных исходных материалов при помощи общепринятых химических процедур.
Что касается присоединения поли(этиленгликоля) (ПЭГ-частей), делается ссылка на «Poly (ethyleneglycol) Chemistry, Biotechnical and Biomedical Applications», 1992, J. Milton Harris (ed.). Plenum Press, New York, «Poly (ethyleneglycol) Chemistry, Biotechnical and Biomedical Applications», 1997, J. Milton Harris and S. Zalipsky (eds.), American Chemical Society, Washington DC and «Bioconjugation Protein Coupling Techniques for the Biomedical Sciences», 1998, M. Aslam and A. Dent, Grove Publishers, New York.
Если желательно получение фрагмента антитела, связанного с эффекторной или репортерной молекулой, он может быть получен стандартными химическими процедурами или процедурами рекомбинантных ДНК, в которых фрагмент антитела связывают либо непосредственно, либо через связывающий агент с эффекторной или репортерной молекулой либо до, либо после реакции с активированным полимером, по необходимости. Конкретные химические процедуры включают в себя, например, процедуры, описанные в WO 93/06231, WO 92/22583, WO 89/00195 и WO 89/01476. Альтернативно, если эффекторная или репортерная молекула является белком или полипептидом, эта связь может быть достигнута с использованием процедур рекомбинантных ДНК, например, описанных в WO 86/01533 и ЕР-А-0392745.
Предпочтительно модифицированный Fab-фрагмент данного изобретения является ПЭГилированным (т.е. имеет ковалентно присоединенный к нему ПЭГ (поли(этиленгликоль)) в соответствии со способом, описанным в ЕР-А-0948544. Предпочтительно молекула антитела данного изобретения является ПЭГилированным модифицированным Fab-фрагментом, как показано на фигуре 13. Как показано на фигуре 13, модифицированный Fab-фрагмент имеет малеимидную группу, ковалентно связанную с единственной тиоловой группой в модифицированной шарнирной области. Остаток лизина ковалентно связан с данной малеимидной группой. К каждой аминогруппе на остатке лизина присоединен полимер метоксиполи(этиленгликоль), имеющий молекулярную массу приблизительно 20000 Да. Общая молекулярная масса всей эффекторной молекулы равна, следовательно, приблизительно 40000 Да.
Предпочтительно в соединении, показанном на фигуре 13, тяжелая цепь относящейся к антителу части имеет последовательность, представленную в виде SEQ ID NO: 115, а легкая цепь имеет последовательность, представленную в SEQ ID NO: 113. Данное соединение называется как CDP870.
Домены константной области молекулы антитела данного изобретения, если они присутствуют, могут быть выбраны с учетом предполагаемой функции молекулы антитела и, в частности, эффекторных функций, которые могут требоваться. Например, домены константной области могут быть доменами IgA, IgD, IgE, IgG или IgM человека. В частности, могут быть использованы домены константной области IgG человека, в частности изотипов IgG1 и IgG3, когда данная молекула антитела предназначается для терапевтических применений и требуются эффекторные функции антитела. Альтернативно, могут быть использованы изотипы IgG2 и IgG4, когда данная молекула антитела предназначается для терапевтических целей и не требуются эффекторные функции антитела, например, просто для блокирования TNFα-активности.
Молекула антитела данного изобретения может также иметь присоединенную к ней эффекторную или репортерную молекулу. Например, она может иметь макроцикл для хелатирования атома тяжелого металла, или токсин, такой как рицин, присоединенные к ней ковалентной мостиковой структурой. Альтернативно, могут быть использованы процедуры технологии рекомбинантных ДНК для получения молекулы антитела, в котором Fc-фрагмент (СН2, СН3 и шарнирный домены), домены СН2 и СН3 или домен СН3 полной молекулы иммуноглобулина были заменены функциональным неиммуноглобулиновым белком или имеют присоединенный к ним пептидной связью функциональный не-иммуноглобулиновый белок, такой как молекула фермента или токсина.
Молекула антитела данного изобретения предпочтительно имеет связывающую аффинность по меньшей мере 0,85×10-10 М, более предпочтительно по меньшей мере 0,75×10-10 М и наиболее предпочтительно по меньшей мере 0,5×10-10 М. (Стоит отметить, что предпочтительная гуманизированная молекула антитела данного изобретения, описанная ниже, имеет аффинность около 0,5×10-10 М, что превышает аффинность мышиного моноклонального антитела, из которого она получена. Мышиное антитело имеет аффинность около 0,85×10-10 М.)
Предпочтительно молекула антитела данного изобретения содержит вариабельный домен легкой цепи hTNF40-gL1 (SEQ ID NO: 8) и вариабельный домен тяжелой цепи gh3hTNF40.4 (SEQ ID NO: 11). Последовательности вариабельных доменов легкой и тяжелой цепей показаны на фигурах 8 и 11 соответственно.
Данное изобретение относится также к вариантам молекулы антитела данного изобретения, которые имеют улучшенную аффинность в отношении TNFα. Такие варианты могут быть получены посредством ряда протоколов достижения аффинности, включающих в себя мутацию CDR (Yang et al., J. Mol. Biol., 254, 392-403, 1995), перетасовку цепей (Marks et al., Bio/Technology, 10, 779-783, 1992), применение штаммов-мутаторов Е. coli (Low et al., J. Mol. Biol., 250, 359-368, 1996), перетасовку ДНК (Patten et al., Curr. Opin. Biotechnol. 8, 724-733, 1997), фаговое представление (Thompson et al., J. Mol. Biol., 256, 77-88, 1996) и связанную с полом ПЦР (Crameri et al., Nature, 391, 288-291, 1998). Vaughan et al. (supra) обсуждает эти способы достижения аффинности.
Данное изобретение обеспечивает также последовательность ДНК, кодирующую тяжелую и/или легкую цепь молекулы антитела данного изобретения.
Предпочтительно данная последовательность ДНК кодирует тяжелую или легкую цепь молекулы антитела данного изобретения.
В одном предпочтительном варианте данная последовательность ДНК кодирует легкую цепь и содержит последовательность, показанную в SEQ ID NO: 8 (hTNF40-gL1) или SEQ ID NO: 9 (hTNF40-gL2), или ее вырожденный эквивалент.
В альтернативном предпочтительном варианте данная последовательность ДНК кодирует тяжелую цепь и содержит последовательность, показанную в SEQ ID NO:10 (gh1hTNF40.4) или SEQ ID NO: 11 (gh3hTNF40.4), или ее вырожденный эквивалент.
Последовательность ДНК данного изобретения может содержать синтетическую ДНК, например, полученную химической процедурой, кДНК, геномную ДНК или любую их комбинацию.
Данное изобретение относится также к вектору для клонирования или экспрессии, содержащему одну или несколько последовательностей ДНК данного изобретения. Предпочтительно вектор для клонирования или экспрессии содержит две последовательности ДНК, кодирующие легкую и тяжелую цепь молекулы антитела данного изобретения соответственно.
В предпочтительном варианте данное изобретение обеспечивает экспрессирующий вектор E.coli, содержащий последовательность ДНК данного изобретения. Предпочтительно этот экспрессирующий вектор представляет собой pTTO(CDP870), показанный схематически на фигуре 22.
Данное изобретение включает в себя также вектор pDNAbEng-G1, показанный на фигуре 19.
Общие способы, при помощи которых данные векторы могут быть сконструированы, способы трансфекции и способы культивирования являются хорошо известными специалистам в данной области. В этой связи делается ссылка на «Current Protocols in Molecular Biology», 1999, F.M.Ausubel (ed.), Wiley Interscience, New York and Maniatis Manual, выпускаемый Cold Spring Harbor Publishing.
Последовательности ДНК, которые кодируют молекулу антитела данного изобретения, могут быть получены способами, хорошо известными специалистам в данной области. Например, последовательности ДНК, кодирующие часть тяжелой и легкой цепей или полные тяжелую и легкую цепи антитела, могут быть синтезированы, если желательно, из определенных последовательностей ДНК или на основе соответствующих аминокислотных последовательностей.
ДНК, кодирующие акцепторные каркасные последовательности, являются широко доступными для специалистов в данной области и могут быть легко синтезированы на основе их известных аминокислотных последовательностей.
Стандартные способы молекулярной биологии могут быть использованы для получения последовательностей ДНК, кодирующих молекулу антитела данного изобретения. Желаемые последовательности ДНК могут быть синтезированы полностью или частично с использованием способов синтеза олигонуклеотидов. Способы сайт-направленного мутагенеза и полимеразной цепной реакции (ПЦР) могут быть использованы при необходимости.
Любая подходящая система клетка-хозяин-вектор может быть использована для экспрессии последовательностей ДНК, кодирующих молекулу антитела данного изобретения.
Бактериальные, например E.coli, или другие микробные системы могут быть использованы отчасти для экспрессии фрагментов антител, таких как Fab и F(ab')2-фрагменты и, особенно Fv-фрагменты и одноцепочечные фрагменты антител, например, одноцепочечные Fv. Системы экспрессии эукариотических клеток-хозяев, например системы экспрессии клеток млекопитающих, могут быть использованы для продуцирования более крупных молекул антител, в том числе полных молекул антител. Подходящие клетки-хозяева млекопитающих включают в себя СНО, клетки миеломы или гибридомные клетки.
Данное изобретение обеспечивает также способ получения молекулы антитела данного изобретения, предусматривающий культивирование клетки-хозяина, содержащей вектор данного изобретения, в условиях, пригодных для проведения экспрессии белка из ДНК, кодирующей молекулу антитела данного изобретения, и выделение данной молекулы антитела.
Предпочтительно способ получения молекулы антитела данного изобретения предусматривает культивирование E.coli, содержащей экспрессирующий вектор, содержащий последовательность ДНК данного изобретения, в условиях, пригодных для проведения экспрессии белка из данной последовательности ДНК, и выделение молекулы антитела. Молекула антитела может секретироваться из клетки или нацеливаться на периплазму посредством подходящих сигнальных последовательностей. Альтернативно данные молекулы антител могут накапливаться в цитоплазме клетки. Предпочтительно молекула антитела нацелена на периплазму. В зависимости от продуцируемой молекулы антитела и используемого способа желательно давать молекулам антител повторно укладываться и принимать функциональную конформацию. Процедуры для создания возможности повторной укладки молекул антител хорошо известны специалистам в данной области.
Молекула антитела может содержать только полипептид тяжелой цепи или полипептид легкой цепи, и в этом случае только кодирующая последовательность полипептида тяжелой цепи или полипептида легкой цепи должна быть использована для трансфекции клетки-хозяина. Для получения продуктов, содержащих как тяжелую, так и легкую цепи, клеточная линия может быть трансфицирована двумя векторами, причем первый вектор кодирует полипептид легкой цепи, а второй вектор кодирует полипептид тяжелой цепи. Альтернативно, может быть использован единственный вектор, причем данный вектор включает в себя последовательности, кодирующие полипептиды легкой цепи и тяжелой цепи.
Данное изобретение обеспечивает также терапевтическую или диагностическую композицию, содержащую молекулу антитела данного изобретения в комбинации с фармацевтически приемлемым наполнителем, разбавителем или носителем.
Данное изобретение обеспечивает также способ получения терапевтической или диагностической композиции, предусматривающий смешивание молекулы антитела данного изобретения вместе с фармацевтически приемлемым наполнителем, разбавителем или носителем.
Молекула антитела может быть единственным активным ингредиентом в терапевтической или диагностической композиции или может сопровождаться другими активными ингредиентами, в том числе ингредиентами антител, например антител против Т-клеток, против IFNγ или против ЛПС, или не являющихся антителами ингредиентами, такими как ксантины.
Фармацевтические композиции должны предпочтительно содержать терапевтически эффективное количество антитела данного изобретения. Термин «терапевтически эффективное количество» в применении здесь обозначает количество терапевтического агента, необходимое для лечения, ослабления или предупреждения подлежащего лечению заболевания или состояния или для проявления детектируемого терапевтического или превентивного эффекта. Для любого антитела терапевтически эффективная доза может быть первоначально определена либо в тестах на культуре клеток, либо на моделях животных, обычно грызунов, кроликов, собак, свиней или приматов. Модель животного может быть также использована для определения подходящего диапазона концентраций и пути введения. Такая информация может быть затем использована для определения применимых доз и способов для введения людям.
Точное эффективное количество для субъекта-человека будет зависеть от тяжести патологического состояния, общего здоровья субъекта, возраста, веса и пола субъекта, диеты, времени и частоты введения, комбинации (комбинаций) лекарственных средств, чувствительности реакции и переносимости/ответной реакции на терапию. Это количество может быть определено рутинным экспериментированием и находится в пределах способности суждения лечащего врача. Обычно эффективная доза будет от 0,01 мг/кг до 50 мг/кг, предпочтительно 0,1 мг/кг-20 мг/кг, более предпочтительно около 15 мг/кг. Как показано в примерах ниже, дозы 1, 5 и 20 мг/кг использовали для лечения пациентов, страдающих от ревматоидного артрита.
Композиции могут вводиться индивидуально пациенту или могут вводиться в комбинации с другими агентами, лекарственными средствами или гормонами.
Доза, при которой вводят молекулу антитела данного изобретения, зависит от природы подлежащего лечению состояния, степени, в которой уровень подлежащего нейтрализации TNFα повышен, или ожидается, что он повышен, выше желаемого уровня, и от того, используется ли молекула антитела профилактически или для лечения существующего состояния.
Так, например, если продукт предназначен для лечения или профилактики хронического воспалительного заболевания, такого как ревматоидный артрит, подходящие дозы молекулы антитела данного изобретения лежат в диапазоне между 0,5 и 50 мг/кг, более предпочтительно между 1 и 20 мг/кг и наиболее предпочтительно около 15 мг/кг. Частота дозы будет зависеть от периода полувыведения молекулы антитела и продолжительности ее действия.
Если молекула антитела имеет короткий период полувыведения (например, 2-10 часов), может быть необходимым предоставление только одной или нескольких доз в день. Альтернативно, если молекула антитела имеет продолжительный период полувыведения (например, 2-15 дней), может быть необходимым предоставлять дозу один раз в день, в неделю или даже один раз каждые 1 или 2 месяца.
Фармацевтическая композиция может также содержать фармацевтически приемлемый носитель для введения данного антитела. Носитель сам не должен индуцировать продуцирование антител, вредных для индивидуума, принимающего данную композицию, и не должен быть токсичным. Подходящими носителями могут быть большие, медленно метаболизируемые макромолекулы, такие как белки, полипептиды, липосомы, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы.
Могут использоваться фармацевтически приемлемые соли, например соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты и сульфаты, или соли органических кислот, такие как ацетаты, пропионаты, малонаты и бензоаты.
Фармацевтически приемлемые носители в терапевтических композициях могут дополнительно содержать жидкости, такие как вода, солевой раствор, глицерин и этанол. Дополнительно в таких композициях могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты или рН-буферящие вещества. Такие носители позволяют фармацевтическим композициям формироваться в таблетки, пилюли, драже, капсулы, жидкости, гели, сиропы, взвеси и суспензии для приема внутрь пациентом.
Предпочтительные формы для введения включают в себя формы, пригодные для парентерального введения, например инъекцией или инфузией, например болюсной инъекцией или непрерывной инфузией. Если продукт предназначен для инъекции или инфузии, он может иметь форму суспензии, раствора или эмульсии в масляном или водном носителе и он может содержать формирующие агенты, такие как суспендирующие, консервирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно молекула антитела может быть в сухой форме и восстанавливаться в требуемом виде перед использованием с применением подходящей стерильной жидкости.
После приготовления композиции данного изобретения могут вводиться непосредственно субъекту. Подлежащими лечению субъектами могут быть животные. Однако предпочтительно, чтобы эти композиции были приспособлены для введения субъекту-человеку.
Фармацевтические композиции данного изобретения могут вводиться любым из путей, в том числе, но не только, пероральным, внутривенным, внутримышечным, внутриартериальным, интрамезуллярным, внутриоболочечным, внутрижелудочковым, трансдермальным, чрескожным (например, см. WO 98/20734), подкожным, внутрибрюшинным, интраназальным, энтеральным, местным, сублингвальным, интравагинальным или ректальным путями. Гипоспреи могут быть также использованы для введения фармацевтических композиций данного изобретения. Обычно терапевтические композиции могут быть приготовлены в виде инъекционных растворов, либо в виде жидких растворов, либо в виде суспензий. Могут быть также приготовлены твердые формы, пригодные для растворения или для суспендирования в жидких носителях перед инъекцией.
Прямая доставка композиций обычно выполняется инъекцией, подкожно, внутрибрюшинно, внутривенно или внутримышечно, или композиции доставляются в интерстициальное пространство ткани. Композиции могут также вводиться в повреждение. Схема лечения может быть схемой применения одной дозы или схемой применения множественных доз.
Должно быть понятно, что активным ингредиентом в композиции будет молекула антитела. Как таковая, она будет чувствительной к деградации в желудочно-кишечном тракте. Таким образом, если композиция должна вводиться путем, использующим желудочно-кишечный тракт, данная композиция должна содержать агенты, которые защищают антитело от деградации, но которые высвобождают данное антитело, как только оно абсорбируется из желудочно-кишечного тракта.
Обстоятельное обсуждение фармацевтически приемлемых носителей доступно в Remington's Pharmaceutical Sciences (Mack Publishing Company, N.J. 1991).
Рассматривается также вопрос о том, что антитело данного изобретения будет вводиться с использованием генной терапии. Для достижения этого последовательности ДНК, кодирующие тяжелую и легкую цепи молекулы антитела под контролем подходящих ДНК-компонентов, вводят пациенту таким образом, что цепи антитела экспрессируются из данных последовательностей ДНК и собираются in situ.
Данное изобретение обеспечивает также молекулу антитела данного изобретения для применения для лечения заболевания, опосредованного TNFα.
Далее, данное изобретение обеспечивает применение молекулы антитела согласно данному изобретению для приготовления лекарственного средства для лечения заболевания, опосредованного TNFα.
Молекула антитела данного изобретения может быть также использована в любой терапии, где желательным является снижение уровня биологически активного TNFα, присутствующего в теле человека или животного. TNFα может циркулировать по телу или присутствовать при нежелательно высоком уровне в конкретном участке в теле.
Например, повышенные уровни TNFα наблюдаются при острых и хронических иммунных и иммунорегуляторных нарушениях, инфекциях, включающих в себя септический, эндотоксиновый бактериально-токсический и сердечно-сосудистый шок, воспалительных нарушениях, нейродегенеративных заболеваниях, злокачественных заболеваниях и индуцированном алкоголем гепатите. Подробности многочисленных нарушений, связанных с повышенными уровнями TNFα, изложены в патенте США US-A-5919452. Молекулы антитела данного изобретения могут быть использованы в терапии заболеваний, опосредуемых TNFα. Конкретные релевантные заболевания, которые могут лечиться молекулой антитела данного изобретения, включают в себя сепсис, застойную сердечную недостаточность, септический или эндотоксический шок, кахексию, респираторный дистресс-синдром взрослых, СПИД, аллергии, псориаз, туберкулез, воспалительные костные нарушения, нарушения, связанные с коагуляцией крови, ожоги, случаи отторжения после трансплантации органов или тканей, болезнь Крона и аутоиммунные заболевания, такие как тиреоидит и ревматоидный артрит или остеоартрит.
Дополнительно, молекула или композиция антитела может быть использована для уменьшения побочных эффектов, связанных с генерированием TNFα во время неопластической терапии; для элиминации или уменьшения связанных с шоком симптомов, ассоциированных с лечением или предупреждением отторжения трансплантата с использованием антител против лимфоцитов; или для лечения недостаточности многочисленных органов.
Молекулу антитела данного изобретения предпочтительно используют для лечения ревматоидного артрита или остеоартрита.
Данное изобретение обеспечивает также способ лечения субъектов-людей или субъектов-животных, страдающих от нарушения или имеющих риск приобретения нарушения, опосредованного TNFα, причем данный способ предусматривает введение данному субъекту эффективного количества молекулы антитела данного изобретения.
Молекула антитела данного изобретения может быть также использована в диагностике, например в диагностике in vivo и визуализации патологических состояний, при которых наблюдаются повышенные уровни TNFα.
Данное изобретение обеспечивает также молекулу антитела, содержащую гибридный CDR, включающий в себя укороченную донорскую последовательность CDR, причем отсутствующая часть укороченной донорской CDR заменена отличающейся последовательностью и образует функциональный CDR. Термин «гидридный CDR» в применении здесь означает CDR, содержащий донорский CDR, который был укорочен при одном или нескольких положениях, например на одном или обоих его концах. Отсутствующая часть укороченного донорского CDR заменена отличающейся последовательностью для образования полной и функциональной CDR. Гибридная CDR имеет по меньшей мере одну аминокислотную замену по сравнению с полной донорской CDR. Последовательность, заменяющая укороченную часть CDR, может быть любой последовательностью. Предпочтительно недонорской частью данной последовательности CDR является последовательность из антитела, из которого получены каркасные области данной молекулы антитела, например последовательность антитела зародышевой линии.
Было обнаружено, что молекулы антител, содержащие гибридный CDR, сохраняют по существу такую же связывающую аффинность, что и молекула антитела, содержащая полные донорские CDR. Термин «по существу та же самая связывающая аффинность» в применении здесь означает по меньшей мере 70%, более предпочтительно по меньшей мере 85% и наиболее предпочтительно по меньшей мере 95% связывающей аффинности соответствующей молекулы антитела, содержащей полные донорские CDR. Как отмечалось выше, в некоторых случаях аффинность антитела данного изобретения может быть более высокой, чем аффинность донорского антитела. Применение гибридного CDR обеспечивает преимущество снижения количества чужеродной (т.е. донорской) последовательности, присутствующего в молекуле антитела, и может увеличивать связывающую аффинность молекулы этого антитела по сравнению с соответствующей молекулой антитела, содержащей полные донорские CDR.
Любой из CDR молекулы антитела может быть гибридным. Предпочтительно CDR2 тяжелой цепи является гибридом в данной молекуле антитела.
Предпочтительно укорочение донорского CDR составляет от 1 до 8 аминокислот, более предпочтительно от 4 до 6 аминокислот. Кроме того, предпочтительно, чтобы укорочение было произведено при С-конце CDR.
В зависимости от последовательности укороченной части CDR и отличающейся последовательности, заменяющей отсутствующую часть, может быть произведен ряд аминокислотных замен. Предпочтительно производят по меньшей мере 2 аминокислотные замены, более предпочтительно по меньшей мере 3 аминокислотные замены и наиболее предпочтительно по меньшей мере 4 аминокислотные замены.
Конкретным вариантом данного аспекта данного изобретения является антитело, соответствующее первому аспекту данного изобретения, в котором второй CDR в тяжелой цепи имеет последовательность, представленную в виде SEQ ID NO: 2. Оно имеет более высокую аффинность в отношении его антигена, чем донорское антитело, из которого произведена часть данного CDR.
Данное изобретение обеспечивает также последовательность нуклеиновой кислоты, которая кодирует молекулу антитела, содержащую гибридный CDR данного изобретения.
Данное изобретение обеспечивает также экспрессирующий вектор, содержащий последовательность нуклеиновой кислоты, кодирующую молекулу антитела, содержащую гибридный CDR данного изобретения.
Данное изобретение обеспечивает также клетку-хозяина, трансформированную вектором данного изобретения.
Данное изобретение обеспечивает также способ получения молекулы антитела, содержащей гибридный CDR, предусматривающий культивирование клетки-хозяина данного изобретения и выделение молекулы антитела.
Данное изобретение описывается далее только для целей иллюстрации в следующих примерах, которые ссылаются на сопутствующие фигуры, в которых:
Фигура 1 показывает каркасные области подгруппы 1 легкой цепи человека по сравнению с каркасными областями легкой цепи hTNF40 (SEQ ID NO: 83-90).
Фигура 2 показывает каркасные области подгруппы 1 и подгруппы 3 тяжелой цепи человека по сравнению с каркасными областями тяжелой цепи hTNF40 (SEQ ID NO: 91-98 и 106-109).
Фигура 3 показывает аминокислотную последовательность CDR hTNF40 (SEQ ID NO: 1-7), где CDR H2' является гибридным CDR, в котором С-концевые шесть аминокислот являются аминокислотами из CDR-последовательности Н2 антитела зародышевой линии подгруппы 3 человека, и аминокислотные замены в данной последовательности, происходящие в результате такой гибридизации, являются подчеркнутыми.
Фигура 4 показывает вектор pMR15.1.
Фигура 5 показывает вектор pMR14.
Фигура 6 показывает нуклеотидную и предсказанную аминокислотную последовательность мышиного hTNF40V1 (SEQ ID NO: 99).
Фигура 7 показывает нуклеотидную и предсказанную аминокислотную последовательность мышиного hTNF40Vh (SEQ ID NO: 100).
Фигура 8 показывает нуклеотидную и предсказанную аминокислотную последовательность hTNF40-gL1 (SEQ ID NO: 8).
Фигура 9 показывает нуклеотидную и предсказанную аминокислотную последовательность hTNF40-gL2 (SEQ ID NO: 9).
Фигура 10 показывает нуклеотидную и предсказанную аминокислотную последовательность gh1hTNF40.4 (SEQ ID NO: 10).
Фигура 11 показывает нуклеотидную и предсказанную аминокислотную последовательность gh3hTNF40.4 (SEQ ID NO: 11).
Фигура 12 показывает вектор CTIL5-gL6.
Фигура 13 показывает структуру соединения, названного CDP870, содержащего модифицированный Fab-фрагмент, полученный из антитела hTNF40, ковалентно связанный через остаток цистеина с лизилмалеимидным линкером, причем каждая аминокислотная группа на лизил-остатке имеет ковалентно присоединенный к ней метокси-ПЭГ-остаток, где n равно приблизительно 420.
Фигура 14 показывает вектор pTTQ9.
Фигура 15 показывает последовательность олигонуклеотидного адаптера OmpA (SEQ ID NO: 101).
Фигура 16 показывает вектор pACYC184.
Фигура 17 показывает вектор рТТО-1.
Фигура 18 показывает вектор рТТО-2.
Фигура 19 показывает вектор pDNAbEng-G1.
Фигура 20 показывает олигонуклеотидные кассеты, кодирующие различные межгенные последовательности для экспрессии модифицированного Fab E.coli (SEQ ID NO: 102-105);
Фигура 21 показывает накопление модифицированного Fab в периплазме вариантов IGS.
Фигура 22 показывает вектор pTTO (CDP870).
Фигура 23 показывает балльную оценку активности заболевания (DAS) у пациентов, получавших различные дозы CDP870 и плацебо. Медиана и диапазоны IQ представлены для группы больных, согласно протоколу, в которой последнее наблюдение свидетельствует об улучшении. Малые квадраты показывают плацебо, ромбы показывают 1 мг/кг, треугольники показывают 5 мг/кг и большие квадраты показывают 20 мг/кг.
Фигура 24 показывает число болезненных суставов, число распухших суставов, балльную оценку боли, глобальную оценку активности заболевания медицинским экспертом, модифицированную анкету оценки здоровья (HAQ), С-реактивный белок (CRP) и скорость оседания эритроцитов (ESR) у пациентов, получавших различные дозы CDP870 и плацебо. Медиана и диапазон IQ представлены для группы больных, согласно протоколу, в которой последнее наблюдение свидетельствует об улучшении. Малые квадраты показывают плацебо, ромбы показывают 1 мг/кг, треугольники показывают 5 мг/кг и большие квадраты показывают 20 мг/кг.
ПРИМЕРЫ
Клонирование и экспрессия генов химерной молекулы антитела hTNF40
Получение РНК из гибридомных клеток hTNF40
Тотальную РНК получали из 3×107 гибридомных клеток hTNF40, как описано ниже. Клетки промывали в физиологическом солевом растворе и растворяли в РНКзоле (0,2 мл на 106 клеток). Добавляли хлороформ (0,2 мл на 2 мл гомогената), смесь интенсивно встряхивали в течение 15 секунд и затем оставляли на льду на 15 минут. Полученные водную и органическую фазы разделяли центрифугированием в течение 15 минут в центрифуге Эппендорфа и РНК осаждали из водной фазы добавлением равного объема изопропанола. После 15 минут выдерживания на льду РНК осаждали центрифугированием, промывали 70% этанолом, высушивали и растворяли в стерильной не содержащей РНКазы воде. Выход РНК был 400 мкг.
ПЦР-клонирование Vh и Vl hTNF40
кДНК-последовательности, кодирующие вариабельные домены тяжелой и легкой цепей hTNF40, синтезировали с использованием обратной транскриптазы для получения одноцепочечных кДНК-копий мРНК, присутствующей в тотальной РНК, с последующей полимеразной цепной реакцией (ПЦР) на данных кДНК со специфическими олигонуклеотидными праймерами.
а) Синтез кДНК
кДНК синтезировали в реакционном объеме 20 мкл, содержащем следующие реагенты: 50 мМ Трис-HCl рН 8,3, 75 мМ KCl, 10 мМ дитиотреитол, 3 мМ MgCl2, 0,5 мМ каждый из дезоксирибонуклеозидтрифосфатов, 20 единиц RNAsin, 75 нг рандомизированного гексануклеотидного праймера, 2 мкг РНК hTNF40 и 200 единиц обратной транскриптазы вируса мышиного лейкоза Moloney. После инкубирования при 42°С в течение 60 минут реакцию останавливали нагреванием при 95°С в течение 5 минут.
b) ПЦР
Аликвоты кДНК подвергали ПЦР с использованием комбинации праймеров, специфических для тяжелой и легкой цепей. Нуклеотидные последовательности 5'-праймеров для тяжелой и легкой цепей показаны в таблицах 1 и 2 соответственно. Все последовательности содержат в следующем порядке: сайт рестрикции, начинающийся после 7 нуклеотидов от их 5'-концов, последовательность GCCGCCACC (SEQ ID NO: 12) для оптимальной трансляции полученных мРНК, инициирующий кодон и 20-30 нуклеотидов на основе последовательностей лидерных пептидов известных мышиных антител (Kabat et al., Sequences of proteins of immunological interest, 5th Edition, 1991, U.S. Department of Health and Human Services, Public Health Service, National Institutes of Health).
3'-праймеры показаны в таблице 3. Праймер легкой цепи простирается через J-C-соединение антитела и содержит сайт рестрикции для фермента SplI для облегчения клонирования ПЦР-фрагмента Vl. 3'-праймеры тяжелой цепи являются смесью, сконструированной для того, чтобы простираться через J-C-соединение антитела. 3'-Праймер включает в себя сайт рестрикции ApaI для облегчения клонирования. 3'-район данных праймеров содержит смешанную последовательность на основе последовательностей, обнаруженных в известных мышиных антителах (Kabat et al., 1991 (supra)).
Описанные выше комбинации праймеров позволяют клонировать ПЦР-продукты для Vh и Vl непосредственно в подходящий экспрессирующий вектор (см. ниже) для получения химерных (мышь-человек) тяжелой и легкой цепей и экспрессировать эти гены в клетках млекопитающих с получением химерных антител желательного изотипа.
Инкубирования (100 мкл) для ПЦР устанавливали следующим образом. Каждая реакция содержала 10 мМ Трис-HCl рН 8,3, 1,5 мМ MgCl2, 50 мМ KCl, 0,01% масса/объем желатин, 0,25 мМ каждый дезоксирибонуклеозидтрифосфат, 10 пмоль смеси 5'-праймеров (таблица 4), 10 пмоль 3'-праймера (CL12 (легкая цепь) или R2155 (тяжелая цепь) (таблица 3)), 1 мкл кДНК и 1 единица полимеразы Taq. Реакции инкубировали при 95°С в течение 5 минут и затем проводили циклы при 94°С в течение 1 минуты, 55°С в течение 1 минуты и 72°С в течение 1 минуты. После 30 циклов аликвоты каждой реакции анализировали электрофорезом на агарозном геле. Реакции легкой цепи, содержащие смеси 5'-праймеров из пулов 1, 2 и 7 легкой цепи, давали полосы с размерами, согласующимися с полноразмерными Vl-фрагментами, тогда как реакция из пула 3 реакции тяжелой цепи давала фрагмент с размером, ожидаемым для гена Vh. Полоса, даваемая праймерами пула 1 легкой цепи, не обрабатывалась до конца, так как предварительные результаты показали, что данная полоса соответствует псевдогену легкой цепи, продуцируемому гибридомной клеткой. Полоса, производимая праймерами пула 7 легкой цепи, была более слабой, чем полоса из праймеров пула 2, и, следовательно, не обрабатывалась до конца. Только полосу из пула 2 реакции легкой цепи, которая была наиболее сильной полосой, прослеживали до конца.
c) Молекулярное клонирование ПЦР-фрагментов
ДНК-фрагменты, продуцируемые в пуле 2 реакции легкой цепи, расщепляли ферментами BstBI и SplI, концентрировали осаждением этанолом, подвергали электрофорезу на 1,4% агарозном геле и полосы ДНК в диапазоне 400 п.н. извлекали. Их клонировали лигированием в вектор pMR15.1 (фигура 4), который был расщеплен с помощью BstBI и SplI. После лигирования смеси трансформировали в E.coli LM 1035 и плазмиды из полученных бактериальных колоний подвергали скринингу на вставки расщеплением BstBI и SplI. Характерные плазмиды со вставками из каждого лигирования анализировали далее секвенированием нуклеотидов.
Подобным образом, ДНК-фрагменты, продуцируемые в пуле 3 реакции тяжелой цепи, расщепляли HindIII и ApaI и клонировали в вектор pMRl4 (фигура 5), который был расщеплен HindIII и ApaI. Характерные плазмиды, содержащие вставки, анализировали секвенированием нуклеотидов.
d) Анализ нуклеотидной последовательности
Плазмидную ДНК из ряда изолятов, содержащих Vh-вставки, секвенировали с использованием праймеров R1053 (см. таблицу 5) (который праймирует в 3'-районе промотора HCMV в pMR14) и R720 (см. таблицу 5) (который праймирует в 5'-районе С-гамма 4 человека и позволяет проводить секвенирование через ДНК-вставку на pMR14). Было обнаружено, что нуклеотидные последовательности Vh-вставки в ряде клонов были идентичными, за исключением различий в районе сигнального пептида и J-районе. Это указывает на то, что исследованные клоны являются независимыми изолятами, возникающими вследствие применения различных праймеров из смеси олигонуклеотидов во время ПЦР-стадии. Определенная нуклеотидная последовательность и предсказанная аминокислотная последовательность вариабельного домена тяжелой цепи антитела hTNF40 (hTNF40Vh) приведены на фигуре 7 (SEQ ID NO: 100).
Для анализа клонов легкой цепи исследовали последовательность, полученную из праймирования R1053 (см. таблицу 5) и R684 (SEQ ID NO: 62) (который праймирует в 5'-районе С-каппа человека и позволяет проводить секвенирование через ДНК-вставку на pMR15.1). Нуклеотидную последовательность и предсказанную аминокислотную последовательность генов Vl, возникающих из реакций в пуле 2, анализировали аналогичным образом. Опять было обнаружено, что нуклеотидные последовательности Vl-вставки в ряде клонов были идентичными, за исключением различий в районе сигнального пептида и J-районе, что показывает, что исследованные клоны были независимыми изолятами, возникающими вследствие применения различных праймеров из смеси олигонуклеотидов, используемой во время ПЦР-стадии. Определенная нуклеотидная последовательность и предсказанная аминокислотная последовательность вариабельного домена легкой цепи антитела hTNF40 (hTNF40V1) приведены на фигуре 6 (SEQ ID NO: 99).





Оценка активности химерных генов
Активности химерных генов оценивали экспрессией их в клетках млекопитающих и очисткой и количественным определением вновь синтезированных антител. Методология для этого описана ниже, с последующим описанием биохимических анализов и анализов на основе клеток, используемых для биологической характеристики данных антител.
а) Получение химерной молекулы антитела hTNF40
Химерное антитело для биологической оценки получали временной экспрессией подходящих пар тяжелой и легкой цепей после котрансфекции в клетки яичника Китайского хомячка (СНО) с использованием осаждения фосфатом кальция.
В день перед трансфекцией полуконфлюентные колбы с клетками CHO-L761 трипсинизировали, клетки считали и колбы Т75 устанавливали таким образом, что каждая содержала 107 клеток.
На следующий день культуральную среду меняли за 3 часа перед трансфекцией. Для трансфекции кальций-фосфатный осадок получали смешиванием 1,25 мл 0,25 М CaCl2, содержащего 50 мкг каждого из экспрессирующих векторов тяжелой и легкой цепей, с 1,25 мл 2×HBS (16,36 г NaCl, 11,0 г HEPES и 0,4 г Na2HPO4 в 1 литре воды с рН, доведенным до 7,1 при помощи NaOH) и добавлением непосредственно в среду данных клеток. После 3 часов при 37°С в СО2-термостате среду и осадок извлекали и клетки подвергали шоку добавлением 15 мл 15% глицерина в забуференном фосфатом солевом растворе (ФСБ) в течение 1 минуты. Глицерин удаляли, клетки промывали один раз ФСБ и инкубировали в течение 48-96 часов в 25 мл среды, содержащей 10 мМ бутират натрия. Антитело можно было очистить из культуральной среды связыванием с протеин А-сефарозой и элюцией с протеин А-сефарозы.
b) ELISA
Для ELISA планшеты Nunc ELISA покрывали в течение ночи при 4°С F(ab') 2-фрагментом поликлонального козьего специфического против Fc-фрагмента человека антитела (Jackson Immunoresearch, code 109-006-098) при 5 мкг/мл в буфере для нанесения покрытия (15 мМ карбонат натрия, 35 мМ гидрокарбонат натрия, рН 6,9). Несвязавшееся антитело удаляли промыванием 5 раз дистиллированной водой. Пробы и очищенные стандарты, подлежащие количественному определению, разбавляли до приблизительно 1 мкг/мл в буфере для конъюгации (0,1 Трис-HCl, рН 7,0, 0,1 М NaCl, 0,2% об/об Твин 20, 0,2% масса/об казеин Hammersten). Пробы титровали в микротитрационных лунках в 2-кратных разведениях с получением конечного объема 0,1 мл в каждой лунке и планшеты инкубировали при комнатной температуре в течение 1 часа со встряхиванием. После первой инкубационной стадии планшеты промывали 10 раз дистиллированной водой и затем инкубировали в течение 1 часа, как и прежде, с 0,1 мл мышиного моноклонального антитела против каппа человека (клона GD12), конъюгированного с пероксидазой (The Binding Site, code MP135), при разведении 1 в 700 в буфере для конъюгации. Планшет промывали опять и в каждую лунку добавляли раствор субстрата (0,1 мл). Раствор субстрата содержал 150 мкл N,N,N,N-тетраметилбензидина (10 мг/мл в ДМСО), 150 мкл пероксида водорода (30% раствор) в 10 мл 0,1 М ацетат натрия/цитрат натрия, рН 6,0. Планшет проявляли в течение 5-10 минут, пока поглощение при 630 нм не было приблизительно 1,0 для верхнего стандарта. Поглощение при 630 нм измеряли с использованием планшет-ридера и концентрацию пробы определяли сравнением кривых титрования с кривыми стандарта.
с) Определение констант аффинности (сродства) с использованием BiaCore-анализа
Связывающее взаимодействие между hTNF40 и TNF человека исследовали с использованием технологии BIA. Аффинно очищенные козьи поликлональные антитела, направленные против константной области hTNF40, иммобилизовали на поверхности сенсорного чипа декстранового полимера при помощи стандартной химии NHS/EDC. Относительно низкие уровни (200-500 RU) hTNF40 иммобилизовали для гарантии минимизации эффекта массопереноса. TNF человека при различных концентрациях пропускали через иммобилизованное hTNF40 для оценки кинетики ассоциации. После инъекции лиганда буфер пропускали через данную поверхность таким образом, что можно было измерить диссоциацию. Константы скоростей ассоциации и диссоциации для взаимодействия между твердофазным hTNF40 и TNF человека рассчитывали и определяли величину КD.
ПРИМЕР 1
CDR-пересадка (прививка) hTNF40
Молекулярное клонирование генов для вариабельных областей тяжелой и легкой цепей антитела hTNF40 и их применение для получения химерных (мышь-человек) антител hTNF40 было описано выше. Нуклеотидные и аминокислотные последовательности Vl и Vh мышиного hTNF40 показаны на фигурах 6 и 7 (SEQ ID NO:99 и 100) соответственно. Данный пример описывает CDR-прививку антитела hTNF40.
CDR-прививка легкой цепи hTNF40
Сопоставление выстраиванием каркасных областей легкой цепи hTNF40 с каркасными областями четырех подгрупп легких цепей человека (Kabat et al., 1991 (supra)) выявило, что hTNF40 был наиболее гомологичным антителам в подгруппе 1 легкой цепи человека. Поэтому для конструирования CDR-привитой легкой цепи выбранные каркасные области соответствовали каркасным областям консенсусной последовательности группы 1 человека.
Сравнение аминокислотных последовательностей каркасных областей мышиного hTNF40 и консенсусных легких цепей группы 1 человека представлено на фигуре 1 и показывает, что имеются 22 различия (подчеркнутые) между данными двумя последовательностями. Анализ влияния, которое любое из каркасных различий может оказывать на связывание антигена, идентифицировал 2 остатка для исследования; они находятся в положениях 46 и 60. На основе этого анализа были сконструированы две версии CDR-привитой легкой цепи. В первой из них, hTNF40-gL1 (SEQ ID NO:8), остатки 46 и 60 происходят из легкой цепи hTNF40, тогда как во второй, hTNF40-gL2 (SEQ ID NO:9), все остатки являются согласующимися с остатками человека, за исключением остатка с номером 60, который является остатком из легкой цепи hTNF40.
Конструирование hTNF40-gL1, CDR-привитой легкой цепи
Конструирование hTNF40-gL1 дается подробно ниже. Следующие перекрывающиеся олигонуклеотиды (Р7982-Р7986) использовали в полимеразных цепных реакциях (ПЦР) для сборки укороченной прививаемой легкой цепи. Собранный фрагмент не содержит лидерной последовательности антитела и первых 17 аминокислот каркасной области 1.
олигонуклеотид 1 Р7982:
5'GAATTCAGGGTCACCATCACTTGTAAAGCCAGTCAGAACGTAGGTACTAAC
GTAGCCTGGTATCAGCAAA3' (SEQ ID NO: 52)
олигонуклеотид 2 Р7983:
5'ATAGAGGAAAGAGGCACTGTAGATGAGGGCTTTTGGGGCTTTACCTGGTTT
TTGCTGATACCAGGCTACGT3' (SEQ ID NO: 53)
олигонуклеотид 3 Р7984:
5'TACAGTGCCTCTTTCCTCTATAGTGGTGTACCATACAGGTTCAGCGGATCCG
GТАGТGGТАСTGАТTTСАС3' (SEQ ID NO: 54)
олигонуклеотид 4 P7985:
5'GACAGTAATAAGTGGCGAAATCTTCTGGCTGGAGGCTACTGATCGTGAGGGT
GAAATCAGTACCACTACCG3' (SEQ ID NO: 55)
олигонуклеотид 5 P7986:
5'ATTTCGCCACTTATTACTGTCAACAGTATAACATCTACCCACTCACATTCGGT
CAGGGTACTAAAGTAGAAATCAAACGTACGGAATTC3' (SEQ ID NO: 56)
Fwd P7981:
5'GAATTCAGGGTCACCATCACTTGTAAAGCC3' (SEQ ID NO: 57)
Fwd P7980:
5'GAATTCCGTACGTTTGATTTCTACTTTAGT3' (SEQ ID NO: 58)
ПЦР-реакцию, 100 мкл, устанавливали таким образом, что она содержала 10 мМ Трис-HCl рН 8,3, 1,5 мМ MgCl2, 50 мМ KCl, 0,01% масса/об желатин, 0,25 мМ каждый дезоксирибонуклеозид-трифосфат, 2 пмоль Р7982, Р7983, Р7984, Р7985, Р7986, 10 пмоль P7980, Р7981 и 1 единицу полимеразы Taq. Реакции проводили с циклами 94°С в течение 1 минуты, 55°С в течение 1 минуты и 72°С в течение 1 минуты. После 30 циклов каждую реакцию анализировали при помощи электрофореза в агарозном геле и ПЦР-фрагмент вырезали из геля и извлекали с использованием набора Mermaid. Извлеченный фрагмент расщепляли ферментами BstEII и SplI в подходящем буфере. Полученный продукт в конце концов подвергали электрофорезу в агарозном геле и ДНК-фрагмент размером 270 п.н. извлекали из среза геля и лигировали в вектор CTIL5-gL6 (фигура 12), который был предварительно расщеплен теми же самыми ферментами. Вышеуказанный вектор обеспечивает отсутствующую лидерную последовательность антитела и первые 17 аминокислот каркасной области 1.
Смесь для лигирования использовали для трансформации штамма E.coli LM1035 и полученные колонии анализировали при помощи ПЦР, расщеплений рестриктазами и нуклеотидного секвенирования. Нуклеотидная и аминокислотная последовательность Vl-области hTNF40-gL1 показана на фигуре 8 (SEQ ID NO: 8).
Конструирование hTNF40-gL2, CDR-привитой легкой цепи
hTNF40-gL2 (SEQ ID NO: 9) конструировали с использованием ПЦР. Следующие олигонуклеотиды использовали для введения аминокислотных замен:
R1053: 5'GCTGACAGACTAACAGACTGTTCC3' (SEQ ID NO: 59)
R5350: 5'TCTAGATGGCACACCATCTGCTAAGTTTGATGCAGCATAGAT
CAGGAGCTTAGGAGC3' (SEQ ID NO: 60)
R5349: 5'GCAGATGGTGTGCCATCTAGATTCAGTGGCAGTGGATCA
GGCACAGACTTTACCCTAAC3' (SEQ ID NO: 61)
R684: 5'TTCAACTGCTCATCAGAT3' (SEQ ID NO: 62)
Две реакции, каждая по 20 мкл, устанавливали таким образом, что они содержали 10 мМ Трис-HCl рН 8,3, 1,5 мМ MgCl2, 50 мМ KCl, 0,01% масса/об желатин, 0,25 мМ каждый дезоксирибонуклеозидтрифосфат, 0,1 мкг hTNF40-gL1, 6 пмоль R1053/R5350 или R5349/R684 и 0,25 единиц полимеразы Taq. Реакции проводили с циклами 94°С в течение 1 минуты, 55°С в течение 1 минуты и 72°С в течение 1 минуты. После 30 циклов каждую реакцию анализировали при помощи электрофореза в агарозном геле и ПЦР-фрагменты вырезали из геля и извлекали с использованием набора Mermaid.
Аликвоты этих фрагментов подвергали затем второму раунду ПЦР. Реакция, 100 мкл, содержала 10 мМ Трис-HCl рН 8,3, 1,5 мМ MgCl2/50 мМ KCl, 0,01% масса/об желатин, 1/5 каждого из ПЦР-фрагментов из первого набора реакций, 30 пмоль R1053 и R684 и 2,5 единиц полимеразы Taq. Температуры реакции были такими же, что и описанные выше. После ПЦР смесь экстрагировали смесью фенол/хлороформ и затем хлороформом и осаждали этанолом. Этанольный осадок извлекали центрифугированием, растворяли в подходящем буфере и расщепляли ферментами BstEII и Spll. Полученный продукт наконец подвергали электрофорезу в агарозном геле и ДНК-фрагмент размером 270 п.н. извлекали из среза геля и лигировали в вектор pMR15.1 (фигура 4), который был предварительно расщеплен теми же самыми ферментами.
Смесь для лигирования использовали для трансформации штамма E.coli LM1035 и полученные колонии анализировали при помощи ПЦР, расщеплений рестриктазами и нуклеотидного секвенирования. Нуклеотидная и аминокислотная последовательность Vl-области hTNF40-gL2 показана на фигуре 9 (SEQ ID NO:9).
CDR-прививка тяжелой цепи hTNF4Q
CDR-прививку тяжелой цепи hTNF40 выполняли с использованием той же самой стратегии, которая описана для легкой цепи. Было обнаружено, что тяжелая цепь является наиболее гомологичной тяжелым цепям человека, принадлежащим к подгруппе 1, и поэтому консенсусная последовательность каркасных областей подгруппы 1 человека была выбрана для акцептирования CDR тяжелой цепи hTNF40.
Для исследования необходимости гомологичной каркасной области человека для использования в качестве акцепторного каркаса для CDR-прививки вторая каркасная область, группы 3 человека, была выбрана для гуманизации тяжелой цепи hTNF40.
Сравнение hTNF40 с двумя различными каркасными областями показано на фигуре 2, где можно видеть, что hTNF40 отличается от консенсуса подгруппы 1 человека в 32 положениях (подчеркнутых) и отличается от консенсуса подгруппы 3 человека в 40 положениях (подчеркнутых). После анализа влияния, которое каждое из этих различий может производить на связывание антигена, остатки 28, 38, 46, 67, 69 и 71 сохраняли в качестве доноров в gh1hTNF40.1, CDR-привитой тяжелой цепи, с использованием каркаса группы 1. Остатки 27, 28, 30, 48, 49, 69, 71, 73, 76 и 78 сохраняли в качестве донора в gh3hTNF40.4, CDR-привитой тяжелой цепи, с использованием каркаса группы 3. Остатки 28, 69 и 71 сохраняли в качестве донора в gh1hTNF40.4, CDR-привитой тяжелой цепи, с использованием каркаса группы 1.
Конструирование gh1hTNF40.4, CDR-привитой тяжелой цепи
gh1hTNF40.4 (SEQ ID NO:10) собирали подверганием перекрывающихся олигонуклеотидов ПЦР в присутствии подходящих праймеров. Следующие олигонуклеотиды использовали в ПЦР:
Трансплантат группы 1 олигонуклеотид 1 Р7989:
5'GAAGCACCAGGCTTCTTAACCTCTGCTCCTGACTGGACCAGCTGCACCTGAG
AGTGCACGAATTC3' (SEQ ID NO: 63)
олигонуклеотид 2 Р7990:
5'GGTTAAGAAGCCTGGTGCTTCCGTCAAAGTTTCGTGTAAGGCCTCAGGCTAC
GTGTTCACAGACTATGGTA3' (SEQ ID NO: 64)
олинуклеотид 3 Р7991:
5'CCAACCCATCCATTTCAGGCCTTGTCCCGGGGCCTGCTTGACCCAATTCATAC
CATAGTCTGTGAACACGT3' (SEQ ID NO: 65)
олинуклеотид 4 Р7995:
5'GGCCTGAAATGGATGGGTTGGATTAATACTTACATTGGAGAGCCTATTTATGT
TGACGACTTCAAGGGCAGATTCACGTTC3' (SEQ ID NO: 66)
олигонуклеотид 5 Р7992:
5'CCATGTATGCAGTGCGTTGTGGAGGTGTCTAGAGTGAACGTGAATCTGCCCTT
GAA3' (SEQ ID NO: 67)
олигонуклеотид 6 Р7993:
5'CCACAAGCACTGCATACATGGAGCTGTCATCTCTGAGATCCGAGGACACCGC
AGTGTACTAT3' (SEQ ID NO: 68)
олигонуклеотид 7 P7994:
5'GAATTCGGTACCCTGGCCCCAGTAGTCCATGGCATAAGATCTGTATCCTCTAG
CACAATAGTACACTGCGGTGTCCTC3' (SEQ ID NO: 69)
Fwd: P7988:
5'GAATTCGTGCACTCTCAGGTGCAGCTGGTC3' (SEQ ID NO: 70)
Bwd P7987:
5'GAATTCGGTACCCTGGCCCCAGTAGTCCAT3' (SEQ ID NO: 71)
Реакция сборки, 100 мкл, содержала 10 мМ Трис-HCl рН 8,3, 1,5 mm MgCl2, 50 мМ KCl, 0,01% масса/об желатин, 0,25 мМ каждый дезоксирибонуклеозидтрифосфат, 2 пмоль каждого из р7989, р7990, р7991, р7995, р7992, р7993 и р7994, 10 пмоль каждого из р7988 и р7987 и 1 единицу полимеразы Taq. Реакции проводили с циклами 94°С в течение 1 минуты, 55°С в течение 1 минуты и 72°С в течение 1 минуты. После 30 циклов реакцию экстрагировали смесью фенол/хлороформ (1/1), затем хлороформом и осаждали этанолом. После центрифугирования ДНК растворяли в подходящем буфере и расщепляли ApaLI и KpnI. Полученный фрагмент выделяли из агарозного геля и лигировали в pMR14 (фигура 5), который был предварительно расщеплен теми же самыми ферментами. pMR14 содержит константную область тяжелой цепи гамма 4 человека; когда pMR14 расщепляют ApaLI и KpnI, расщепленный вектор способен принимать расщепленную ДНК, так что 3'-конец расщепленной ДНК соединяется в рамке считывания с 5'-концом последовательности, кодирующей константную область гамма 4. Таким образом, тяжелая цепь, экспрессируемая из данного вектора, будет иметь изотип гамма 4. Смесь для лигирования использовали для трансформации E.coli LM1035 и полученные бактериальные колонии подвергали скринингу посредством расщепления рестриктазами и анализа нуклеотидной последовательности. Таким путем идентифицировали плазмиду, содержащую правильную последовательность для gh1hTNA40.4 (фигура 10) (SEQ ID NO: 10).
Конструирование gh3hTNF40.4, CDR-привитой тяжелой цепи
gh3hTNF40.4 (SEQ ID NO: 11) собирали подверганием перекрывающихся олигонуклеотидов ПЦР в присутствии подходящих праймеров. Следующие олигонуклеотиды использовали в ПЦР:
Трансплантат группы 3
олигонуклеотид 1 Р7999:
5*GATCCGCCAGGCTGCACGAGACCGCCTCCTGACTCGACCAGCTGAACCTCAG
AGTGCACGAATTC3' (SEQ ID NO: 72)
олигонуклеотид 2 Р8000:
5'TCTCGTGCAGCCTGGCGGATCGCTGAGATTGTCCTGTGCTGCATCTGGTTACG
ТСTTСАСАGАСTАТGGАА3' (SEQ ID NO: 73)
олигонуклеотид 3 Р8001:
5'CCAACCCATCCATTTCAGGCCCTTTCCCGGGGCCTGCTTAACCCAATTCATTC
CATAGTCTGTGAAGACGT3' (SEQ ID NO: 74)
олинуклеотид 4 Р7995:
5'GGCCTGAAATGGATGGGTTGGATTAATACTTACATTGGAGAGCCTATTTATGT
TGACGACTTCAAGGGCAGATTCACGTTC3' (SEQ ID NO: 66)
олигонуклеотид 5 Р7997:
5'GGAGGTATGCTGTTGACTTGGATGTGTCTAGAGAGAACGTGAATCTGCCCTT
GАА3' (SEQ ID NO: 75)
олигонуклеотид 6 Р7998:
5'CCAAGTCAACAGCATACCTCCAAATGAATAGCCTGAGAGCAGAGGACACCGC
AGTGTACTAT3' (SEQ ID NO: 76)
олигонуклеотид 7 P7993:
5'GAATTCGGTACCCTGGCCCCAGTAGTCCATGGCATAAGATCTGTATCCTCTAG
CACAATAGTACACTGCGGTGTCCTC3' (SEQ ID NO: 77)
Fwd P7996:
5'GААТTСGТGСАСТСТGАGGТТСАGСTGGТС3' (SEQ ID NO: 78)
Bwd P7987:
5'GAATTCGGTACCCTGGCCCCAGTAGTCCAT3' (SEQ ID NO: 71)
Реакция сборки, 100 мкл, содержала 10 мМ Трис-HCl рН 8,3, 1,5 мМ MgCl2, 50 мМ KCl, 0,01% масса/об желатин, 0,25 мМ каждый дезоксирибонуклеозидтрифосфат, 2 пмоль каждого из р7999, р8000, р8001, р7995, р7997, р7998 и р7993, 10 пмоль каждого из р7996 и р7987 и 1 единицу полимеразы Taq. Реакции проводили с циклами 94°С в течение 1 минуты, 55°С в течение 1 минуты и 72°С в течение 1 минуты. После 30 циклов реакцию экстрагировали смесью фенол/хлороформ (1/1), затем хлороформом и осаждали этанолом. После центрифугирования ДНК растворяли в подходящем буфере для рестрикции расщепляли ApaLI и KpnI. Полученный фрагмент выделяли из агарозного геля и лигировали в pMR14 (фигура 5), который был предварительно расщеплен теми же самыми ферментами. PMR14 содержал константную область тяжелой цепи гамма 4 человека. Когда pMR14 расщепляют ApaLI и KpnI, расщепленный вектор способен принимать расщепленную ДНК, так что 3'-конец расщепленной ДНК соединяется в рамке считывания с 5'-концом последовательности, кодирующей константную область гамма 4. Таким образом, тяжелая цепь, экспрессируемая из этого вектора, будет иметь изотип гамма 4. Смесь для лигирования использовали для трансформации E.coli LM1035 и полученные бактериальные колонии подвергали скринингу посредством расщепления рестриктазами и анализа нуклеотидной последовательности. Таким путем идентифицировали плазмиду, содержащую правильную последовательность для gh3hTNF40.4 (фигура 10) (SEQ ID NO: 11).
Получение CDR-привитого модифицированного Fab-фрагмента
CDR-привитый, модифицированный Fab-фрагмент, на основе антитела hTNF40, конструировали с использованием вектора рТТО-1 E.coli. Вариабельные области антитела hTNF40 субклонируют в этот вектор и межгенную последовательность оптимизируют для получения pTTO(CDP870). Данный экспрессирующий вектор рТТО предназначен для вызывания накопления в периплазме растворимых рекомбинантных белков в E.coli. Основными признаками этой плазмиды являются:
(i) маркер устойчивости к тетрациклину - антибиотик не инактивировался продуктом гена устойчивости, так что поддерживается отбор на плазмидусодержащие клетки;
(ii) низкая копийность - начало репликации, происходящее из плазмиды р15А, которое совместимо с плазмидами, содержащими происходящими из colE1 репликонами;
(iii) сильный индуцируемый промотор tac для транскрипции клонируемого гена (генов);
(iv) lacIq ген - дает конститутивную экспрессию lac-репрессорного белка, поддерживающего промотор tac в репрессированном состоянии, пока он не индуцируется IPTG/аллолактозой;
(v) сигнальная последовательность OmpA - дает периплазматическую секрецию клонированного гена (генов); и
(vi) трансляционное связывание сигнальной последовательности OmpA с коротким пептидом lacZ, дающее эффективную инициацию трансляции.
Данный вектор был создан для экспрессии модифицированных Fab-фрагментов из дицистронной матрицы посредством создания способа для отбора эмпирически оптимальной межгенной последовательности из ряда четырех сконструированных целенаправленно кассет. Описано применение данного способа в конструировании pTTO(CDP870).
Материалы и способы
Способы ДНК
Стандартные процедуры использовали для протоколов, в том числе рестрикцию ДНК, электрофорез в агарозном геле, лигирование и трансформацию. Рестриктазы и модифицирующие ДНК ферменты получали из New England Biolabs или Boehringer Mannheim и использовали их в соответствии с рекомендациями изготовителей. ДНК-фрагменты очищали от агарозы с использованием протокола GeneClean (BIO 101). Олигонуклеотиды получали из Oswell Oligonucleotide Service и синтезировали при масштабе 40 нм. Плазмидную ДНК выделяли с использованием наборов Plasmid DNA Mini/Midi kits из Qiagen. ПЦР выполняли с использованием «Amplitaq» Perkin Eitner в соответствии с рекомендациями. Секвенирование ДНК проводили с использованием набора для секвенирования Applied Biosystems Taq cycle sequencing kit.
Индукция во встряхиваемых колбах
Культуры E.coli W3110 выращивали в L-бульоне, дополненном тетрациклином (7,5 мкг/мл). Для индукций свежие ночные культуры (росшие при 30°С) разбавляли до OD600 0,1 в 200 мл L-бульона в колбе с перегородкой на 2 л и выращивали при 30°С в орбитальном термостате. При OD600 0,5 добавляли IPTG до 200 мкМ. Пробы (нормализованные в отношении OD) брали с интервалами.
Экстракция периплазмы
Пробы культуры охлаждали на льду (5 минут), затем клетки собирали центрифугированием. После ресуспендирования в буфере для экстракции (100 мМ Трис-HCl, 10 мМ ЭДТА, рН 7,4) пробы инкубировали в течение ночи при 30°С, затем осветляли центрифугированием.
Анализ сборки
Концентрации модифицированного Fab определяли при помощи ELISA. Планшеты покрывали при 4°С в течение ночи антителом против Fd 6045 человека (2 мкг/мл в буфере для нанесения покрытия, физиологический солевой раствор, 100 мкл на лунку). После промывания 100 мкл пробы вносили на лунку; очищенный А5 В7 гамма-1 Fab', исходно при 2 мкг/мл, использовали в качестве стандарта. Пробы серийно разводили 2-кратно по всему планшету в буфере для конъюгации проб (на литр: 6,05 г трисаминометана; 2,92 г NaCl; 0,1 мл Твина-20; 1 мл казеина (0,2%)); планшеты инкубировали в течение 1 часа при комнатной температуре при перемешивании. Планшеты промывали и сушили, затем добавляли 100 мкл антитела против С-каппа (GD12) человека, конъюгированного с пероксидазой (разбавленного буфером для проб для конъюгации). Инкубирование проводили при комнатной температуре в течение 1 часа при перемешивании. Планшеты промывали и сушили, затем добавляли 100 мкл раствора субстрата (10 мл раствора ацетата/цитрата натрия (0,1 М рН 6); 100 мкл раствора H2O2; 100 мкл раствора тетраметилбензидина (10 мг/мл в диметилсульфоксиде)). Поглощение при 630 нм считывали спустя 4-6 минут после добавления субстрата.
Конструирование плазмиды рТТО-1
(а) Замена полилинкера pTTQ9
Плазмида pTTQ9 была получена из Amersham и показана на фигуре 14. Аликвоту (2 мкг) расщепляли рестриктазами SalI и EcoRI, продукт расщепления подвергали электрофорезу на 1% агарозном геле и большой ДНК-фрагмент (4520 п.н.) очищали. Синтезировали два олигонуклеотида, которые при отжиге вместе кодируют полилинкерный район OmpA, показанный на фигуре 15. Данная последовательность имеет липкие концы, которые совместимы с концами SalI и EcoRI, генерируемыми рестрикцией pTTQ9. При клонировании данной олигонуклеотидной «кассеты» в вектор pTTQ9 сайт SalI не регенерируется, но сайт EcoRI сохраняется. Кассета кодирует первые 13 аминокислот сигнальной последовательности белка наружной мембраны E.coli Omp-A, перед которой находится сайт связывания рибосомы Шайна-Далгарно гена OmpA. Кроме того, присутствуют сайты рестрикции для ферментов XbaI, MunI, StyI и SplI. Сайты MunI, StyI и SplI находятся внутри кодирующего района сигнальной последовательности OmpA и предназначены в качестве 5'-клонирующих сайтов для инсерции генов. Два олигонуклеотида, которые образуют эту кассету, отжигали вместе смешиванием при концентрации 5 пмоль/мкл и нагреванием на водяной бане до 95°С в течение 3 минут и затем медленным охлаждением до комнатной температуры. Затем отожженную (гибридизованную) последовательность лигировали в разрезанный SalI/EcoRI вектор pTTQ9. Полученный плазмидный промежуточный продукт, названный pTQOmp, подтверждали ДНК-секвенированием.
(b) Получение и лигирование фрагментов
Плазмиду рТТО-1 конструировали лигированием одного ДНК-фрагмента из плазмиды pACYC184 с двумя фрагментами, генерируемыми из pTQOmp.Плазмиду pACYC184 получали из New England Biolabs и ее рестрикционная карта показана на фигуре 16. Аликвоту (2 мкг) расщепляли полностью рестриктазой StyI, затем обрабатывали нуклеазой маша (фасоли золотистой); такая обработка создает тупые концы отрезанием 5'-выступов оснований. После фенольной экстракции и осаждения этанолом ДНК расщепляли ферментом PvuII с образованием фрагментов размером 2348, 1081, 412 и 403 п.н. Фрагмент размером 2348 п.н. очищали после электрофореза на агарозном геле. Данный фрагмент кодирует маркер устойчивости к тетрациклину и сайт инициации репликации р14А. Затем данный фрагмент обрабатывали щелочной фосфатазой кишечника теленка для удаления 5'-концевых фосфатов, предотвращая тем самым самолигирование данной молекулы.
Аликвоту (2 мкг) плазмиды pTQOmp расщепляли ферментами SspI и EcoRI и фрагмент размером 2350 п.н. очищали от нежелательных фрагментов размером 2040 п.н. и 170 п.н. после электрофореза в агарозном геле; данный фрагмент кодирует район терминатора транскрипции и ген lacIq. Другую аликвоту (2 мкг) pTQOmp расщепляли EcoRI и XmnI с получением фрагментов размером 2289, 1670, 350 и 250 п.н. Фрагмент размером 350 п.н., кодирующий промотор tac, сигнальную последовательность OmpA и сайт мультиклонирования, очищали от геля.
Затем данные три фрагмента лигировали с использованием приблизительно эквимолярных количеств каждого фрагмента для генерирования плазмиды рТТО-1. Все клонирующие соединения проверяли ДНК-секвенированием. Рестрикционная карта данной плазмиды показана на фигуре 17. Затем создавали плазмиду рТТО-2 вставкой ДНК, кодирующей константную область легкой цепи каппа 1g человека. Ее получали в виде фрагмента рестрикции SplI-EcoRI из плазмиды рНС132 и встраивали в соответствующие сайты в рТТО-1. Плазмида рТТО-2 показана на фигуре 18.
Встраивание гуманизированных вариабельных областей hTNF40 в рТТО-2
hTNF40gL1 (SEQ ID NO:8), вариабельную область легкой цепи, получали посредством ПЦР-"спасения" из соответствующего вектора для экспрессии в клетках млекопитающих pMR10.1. Лидерная последовательность OmpA заменяет нативный лидер Ig. Последовательность ПЦР-праймеров показана ниже:
5'-праймер:
CGCGCGGCAATTGCAGTGGCCTTGGCTGGTTTCGCTACCGTAGCGCAAGCTGACATT CAAATGACCCAGAGCCC (SEQ ID NO: 79)
3'-праймер: TTCAACTGCTCATCAGATGG (SEQ ID NO: 80)
После ПЦР при стандартных условиях продукт очищали, расщепляли ферментами MunI и SplI и затем очищали от геля. Затем очищенный фрагмент вставляли в сайты MunI/SplI pTTO-2 для создания промежуточной плазмиды с легкой цепью pTTO (hTNF40L).
Вариабельную область тяжелой цепи gh3hTNF40.4 получали таким же образом из вектора р-гамма-4. Последовательность ПЦР-праймеров показана ниже:
5'-праймер:
GCTATCGCAATTGCAGTGGCGCTAGCTGGTTTCGCCACCGTGGCGCAAGCTGAGGT TCAGCTGGTCGAGTCAGGAGGC (SEQ ID NO: 81)
3'-праймер: GCCTGAGTTCCACGACAC (SEQ ID NO: 82)
После ПЦР продукт очищали, расщепляли ферментами NheI и ApaI и затем субклонировали в вектор pDNAbEng-G1 (фигура 19). После подтверждения ДНК-секвенированием тяжелую цепь рестрицировали ферментом EcoRI и субклонировали в сайт EcoRI рТТО (hTNF40L) для создания экспрессионной плазмиды pTTO (hTNF40) E.coli.
Оптимизация межгенной последовательности для экспрессии модифицированного Fab
В векторе рТТО экспрессия модифицированного Fab происходит из дицистронной матрицы, кодирующей сначала легкую цепь, а затем тяжелую цепь. ДНК-последовательность между двумя генами (межгенная последовательность, IGS) может влиять на уровень экспрессии тяжелой цепи действием на скорость инициации трансляции. Например, короткая межгенная последовательность может приводить к трансляционному сопряжению между легкой и тяжелой цепями вследствие того, что транслирующая рибосома может не полностью диссоциироваться от мРНК после завершения синтеза легкой цепи перед инициацией синтеза тяжелой цепи. «Сила» любого сайта связывания рибосомы Шайна-Далгарно (SD) (гомология относительно рРНК 16S) может также оказывать действие, как и расстояние и состав последовательности между SD и стартовым кодоном ATG. Потенциальная вторичная структура мРНК вокруг ATG является другим важным фактором; ATG должен находиться в «петле», а не быть заключенным в «стебле», тогда как обратная ситуация относится к SD. Таким образом, посредством модификации состава и длины IGS можно модифицировать силу инициации трансляции и, следовательно, уровень продуцирования тяжелой цепи. Кажется вероятным, что оптимальная скорость инициации трансляции должна достигаться для максимизации экспрессии тяжелой цепи конкретного модифицированного Fab. Например, с одним модифицированным Fab высокий уровень экспрессии может быть переносимым, но для другого модифицированного Fab с отличающейся аминокислотной последовательностью высокий уровень экспрессии может оказаться токсичным, возможно, вследствие отличающихся эффективностей секреции или укладки. По этой причине была сконструирована серия из четырех межгенных последовательностей (фигура 20), позволяющих эмпирически определить оптимум IGS для модифицированного на основе hTNF40 Fab. IGS1 и IGS2 имеют очень короткие межгенные последовательности (-1 и +1 соответственно), и можно ожидать, что они дают тесно сопряженную трансляцию; эти SD-последовательности (подчеркнутые) являются слегка отличающимися. Данные две последовательности, наиболее вероятно, будут сообщать высокий уровень инициации трансляции. IGS3 и IGS4 имеют большее расстояние между стартовыми кодонами и стоп-кодонами (+13) и отличаются по составу их последовательности; IGS3 имеет «более сильную» SD-последовательность. Все последовательности исследовали в отношении вторичной структуры (с использованием программы m/fold) и «оптимизировали», насколько это возможно; однако, с тесным сопряжением трансляции данных двух цепей отсутствие диссоциации рибосомы означает, что мРНК может не быть «обнаженной», что предотвращает образование вторичной структуры.
Клонирование вариантов IGS
IGS-кассеты, показанные на фигуре 20, имеют фланкирующие клонирующие сайты SacI и MunI. Они построены отжигом комплементарных олигонуклеотидных пар. Фрагмент вектора получали расщеплением рТТО (hTNF40) SacI и NotI, а фрагмент тяжелой цепи получали расщеплением pDNAbEng1 (hTNF40H) MunI и NotI. Затем выполняли трехступенчатые лигирования с использованием эквимолярных количеств этих двух рестрикционных фрагментов и приблизительно 0,05 пмоль каждой отожженной олиго-кассеты. Это создавало четыре экспрессионных плазмиды pTTO (hTNF40 IGS-1), pTTO (hTNF40 IGS-2), pTTO (hTNF40 IGS-3), pTTO (hTNF40 IGS-4).
Анализ экспрессии во встряхиваемых колбах
Данные четыре плазмиды трансформировали в штамм Е.coli W3110, вместе с исходной экспрессионной конструкцией, и затем анализировали на экспрессию во встряхиваемых колбах, как описано. Результаты типичного эксперимента показаны на фигуре 21. Различные межгенные последовательности сообщают различные профили экспрессии. IGS1 и IGS2 накапливают периплазматический, модифицированный Fab быстро с пиком при 1 часе после индукции, после чего извлекаемый уровень падает. Указанный пик является более высоким и падает более резко для IGS1. Приведенные результаты согласуются с высоким уровнем синтеза, как ожидалось для тесного трансляционного сопряжения для данных конструкций. IGS1, очевидно, придает более высокий уровень экспрессии тяжелой цепи, чем это делает IGS2. В этом случае, кажется, что такой высокий уровень экспрессии является плохо переносимым, так как периплазматические уровни экспрессии падают после 1-часового пика. Это видно на профиле роста IGS1-культуры (не показано), которая достигает максимума при 1-часовой пост-индукции перед падением, что предполагает смерть и лизис клеток. IGS3 накапливает модифицированный Fab более медленно, но достигает максимума при 2 часах после индукции с более высокой величиной пика (325 нг/мл/OD), перед тем как уровни падают. Рост данной культуры продолжался до 3 часов после индукции и достигал более высокой биомассы при максимуме (не показано). Это согласуется с более низким уровнем синтеза тяжелой цепи. IGS4 накапливает материал при еще более медленной скорости и не может достигать высокого пика продуктивности других 3 конструкций. Все варианты IGS значительно превосходят исходный вектор. Гипотеза, что различные последовательности IGS сообщают различные скорости инициации трансляции, поддерживается данными экспериментальными результатами. В отношении модифицированного на основе hTNF40 Fab, кажется, что высокая скорость инициации трансляции тяжелой цепи плохо переносится и, следовательно, не является оптимальной. Более медленная скорость, такая как сообщаемая IGS3, приводит к лучшим характеристикам роста, и вследствие этого накапливается лучший выход на протяжении времени.
После сравнения продуктивности в ферментере конструкция IGS3 была выбрана как наиболее продуктивная и была названа pTTO(CDP870) - см. фигуру 22.
Тяжелая цепь, кодируемая плазмидой pTTO(CDP870), имеет последовательность, приведенную в SEQ ID NO: 115, а легкая цепь имеет последовательность, приведенную в SEQ ID NO: 113.
ПЭГилирование CDR-привитого, созданного на основе hTNF40 модифицированного Fab
Очищенный модифицированный Fab конъюгируют сайт-специфически с разветвленной молекулой ПЭГ. Это достигается активацией единственного остатка цистеина в укороченной шарнирной области модифицированного Fab с последующей реакцией с (ПЭГ)-лизилмалеимидом, как описано ранее (А.Р.Chapman et al., Nature Biotechnology, 17, 780-783, 1999). ПЭГилированная молекула показана на фигуре 13, и она названа соединением CDP870.
Эффективность ПЭГилированного CDR-привитого, созданного на основе hTNF40 модифицированного Fab (CDP870) в лечении ревматоидного артрита
CDP870 имеет продолжительный полупериод существования в организме приблизительно 11 дней.
Авторы оценивали безопасность и эффективность внутривенно вводимого CDP870 в рандомизированном двояко-слепом контролируемом плацебо испытании с увеличением дозы на пациентах с ревматоидным артритом (RA).
Способы
Пациенты
Пациенты в возрасте между 18 и 75 годами, которые удовлетворяли пересмотренным в 1987 году диагностическим критериям Американского Колледжа ревматологии (ACR) для ревматоидного артрита (RA) (Arnett et al., Arthritis Rheum., 31, 315-324, 1988), были набраны из амбулаторных больных ревматологических клиник в Лондоне, Кембридже, Норфольке и Норвиче (Соединенное Королевство Великобритании и Северной Ирландии). Требовалось, чтобы пациенты имели клинически активное заболевание, определяемое по наличию по меньшей мере 3 из следующих критериев: ≥6 болезненных или чувствительных при прикосновении суставов; ≥45 минут тугоподвижности рано утром и скорость оседания эритроцитов (ESR) ≥28 мм/ч. Они должны были быть неспособными отвечать на по меньшей мере одно модифицирующее заболевание противоревматическое лекарственное средство (DRARD) и не подвергаться лечению в течение по меньшей мере 4 недель. Кортикостероиды разрешались, если доза была ≥7,5 мг/день преднизолона. Беременные женщины, кормящие женщины и женщины, потенциально способные к деторождению, не использующие эффективного способа контрацепции, исключались из исследования. Пациенты исключались, если они имели предшествующую историю злокачественности, сопутствующие тяжелые медицинские состояния, предыдущую неудачу в TNF-нейтрализующей терапии или аллергию на полиэтиленгликоль. Письменное информированное согласие получали от каждого пациента перед внесением в списки для исследования. Исследование было одобрено местными комитетами по исследовательской этике.
Протокол лечения
36 пациентов с RA делили на 3 группы, причем каждая получала увеличивающуюся дозу испытуемого лекарственного средства (1, 5 или 20 мг/кг). Каждая группа из 12 пациентов была разделена на 8 пациентов для получения CDP870 и 4 пациента для получения плацебо. CDP870 предоставляли в виде единственной внутривенной инфузии (100 мл в целом) на протяжении 60 минут. Плацебо (натрий-ацетатный буфер) вводили подобным образом в виде единственной внутривенной инфузии 100 мл на протяжении 60 минут. Лечение проводили амбулаторно. Спустя 8 недель все пациенты имели возможность получать инфузию либо 5, либо 20 мг/кг CDP870 открытым образом (т.е. с уведомлением пациента о величине дозы).
Клиническая оценка
Заболевание ревматический артрит (RA) оценивали на основе наборов главных данных Всемирной организации здравоохранения и Международной Лиги Ассоциаций по Ревматологии (Boers et al., J. Rheumatol. - Supplement, 41, 86-89, 1994) и Европейской Лиги против ревматизма (EULAR) (Scott et al., Clin. Exp.Rheumatol., 10, 521-525, 1992) с числом суставов 28. Изменения в активности заболевания оценивали при помощи балльной оценки активности заболевания (Prevoo et al., Arthritis Rheum., 38, 44-48, 1995) и критериев ACR-ответов (Felson et al., Arthritis Rheum., 38, 727-735, 1995). Оценки проводили перед лечением и при 1, 2, 4, 6 и 8 неделях после лечения. Пациентов также оценивали в отношении безопасности и переносимости испытуемого лекарственного средства. Гематологию, биохимию, антитела против CDP870 и вредные явления оценивали при каждом визите.
Концентрация CDP870 в плазме и антитела против CDP870
CDP870 измеряли при помощи твердофазного иммуноферментного анализа (ELISA). Серийные разведения плазмы пациентов инкубировали в микротитрационных планшетах (Nunc), покрытых рекомбинантным TNFα человека (Strathmann Biotech GmbH, Hannover). Уловленные CDP870 обнаруживали конъюгированными с пероксидазой хрена козьими антителами против легкой цепи каппа человека (Cappel, ICN), с последующим субстратом тетраметилбензидином (ТМВ).
Антитела к CDP870 подвергали скринингу (при разведении плазмы 1/10) с использованием ELISA с двойным сэндвичем антигена с биотинилированным CDP870 в качестве второго слоя. Связанные антитела выявляли с использованием HRP-стрептавидина и субстрата ТМВ. Анализ калибровали с использованием стандарта IgG гипериммунного кролика. Единица активности эквивалентна 1 мкг кроличьего стандарта.
Статистический анализ
Это испытание было исследовательским по характеру и размер пробы был основан на предыдущем опыте с подобными агентами. Эффективность CDP870 анализировали при помощи расчета балльной оценки активности заболевания (DAS) и АСR20/50-ответных реакций с целью лечения и с использованием закрытой процедуры тестирования для каждого протокола. Балл активности заболевания рассчитывали следующим образом: DAS=0,555×квадратный корень из (28 болезненных суставов)+0,284×квадратный корень из (28 распухших суставов)+0,7×In(ESR)+0,0142×(глобальная оценка пациента). Сначала объединенные активные группы сравнивали с плацебо. Если это сравнение было значимым при 5% уровне, каждую группу доз сравнивали с плацебо. Все сравнения имели двустороннее распределение с уровнем достоверности 5%. Все величины Р были получены из исследовательского анализа и не должны быть использованы для интерпретации с окончательными выводами.
Результаты
Демография
Были зарегистрированы 36 пациентов с RA. Их демографические детали приведены в таблице 6. Средний возраст был 56 лет и 30 пациентов были женщинами. Средняя продолжительность RA была 13 лет, и 21 пациент имели положительный ревматоидный фактор. Пациенты в различных группах имеют сходные демографические характеристики. В периоде слепого введения доз 6/12 получавших плацебо пациентов вышли из испытания из-за ухудшения RA в момент ≥4 недель после введения доз. 2/24 получавших CDP870 пациентов вышли из испытания, оба в группе 1 мг/кг, из-за ухудшения RA/отсутствия возможности проверки результатов испытания в момент>4 недель после введения доз. Различие было статистически значимым (р=0,009, точный тест Фишера).
Демографические детали (среднее ± стандартное отклонение)
Клиническая эффективность
Доля пациентов с улучшением ACR20 для популяции согласно протоколу с последним наблюдением, свидетельствующим об улучшении, была 16,7, 50, 87,5 и 62,5% после плацебо, 1, 5 и 20 мг/кг CDP870 (р=0,012 эффекта объединенной обработки) при 4 неделях и 16,7, 25, 75 и 75% (р=0,032) при 8 неделях. Снижение оценок DAS (медианы) для популяции согласно протоколу с последним наблюдением, свидетельствующим об улучшении, было 0,15, 1,14, 1,91 и 1,95 после плацебо, 1, 5 и 20 мг/кг CDP870 (р=0,001 эффекта объединенной обработки) при 4 неделях и 0,31, 0,09, 2,09 и 1,76 (р=0,008) при 8 неделях (фигура 23).
Изменения в индивидуальных компонентах набора главных данных Всемирной организации здравоохранения и Международной Лиги Ассоциаций по Ревматологии показаны на фигуре 24.
После раскрытой для пациентов дозы CDP870 были получены аналогичные благоприятные эффекты. Из 36 пациентов, набранных в это испытание, 32 получили вторую инфузию CDP870. Доля пациентов с улучшением ACR20 из предыдущей первой инфузии была 72,2 и 55,6% после 5 и 20 мг/кг CDP870 при 4 неделях и 55,6 и 66,7% при 8 неделях.
Побочные эффекты
Лечение хорошо переносилось без связанной с инфузией реакции. Не сообщалась аллергическая реакция или кожная сыпь. В двояко-слепой фазе были 19, 38, 8 и 14 побочных действий в группах плацебо, 1, 5 и 20 мг/кг соответственно. Самым общим явлением была головная боль с 9 случаями у 5 пациентов (1 плацебо, 3 при 1 мг/кг, 1 при 20 мг/кг). Один пациент, который получал плацебо, и 3 пациента, которые получали CDP870 (1 при 5 мг/кг и 2 при 20 мг/кг), развивали инфекции нижних дыхательных путей. Они сообщались как слабые или умеренные. Их лечили перорально антибиотиками, и они проходили на протяжении периода 1-2 недель. Три пациента, каждый в группах 1 и 5 мг/кг и один в группе 20 мг/кг, имели инфекцию мочевых путей спустя 1-2 месяца после лечения CDP870. Одно неблагоприятное событие было описано как тяжелое, которое было случаем боли в области шеи, появившейся спустя 3 дня после инфузии 1 мг/кг. Увеличение антинуклеарных антител наблюдали у 4 пациентов: 1 в группе плацебо (отрицательные в отношении 1/40), 2 в группе 1 мг/кг (отрицательные в отношении 1/40, отрицательные в отношении 1/80) и 1 в группе 20 мг/кг (отрицательные в отношении 1/40). Не было обнаружено изменение в антителах против ДНК или антителах против кардиолипина.
Концентрация CDP870 в плазме и уровни анти-СРР870
Как и ожидалось, для всех уровней доз CDP870 максимальная концентрация в плазме наблюдалась в конце инфузии и она была пропорциональна дозе, после чего концентрация в плазме медленно снижалась. Профиль концентрации CDP870 в плазме кажется очень похожим на профиль, наблюдаемый ранее у волонтеров, когда было рассчитано, что биологический период полураспада был приблизительно 14 дней. При повторном введении доз наблюдали аналогичный профиль по сравнению с инфузией единственной дозы.
После единственного внутривенного вливания уровни антител против CDP870 были низкими или недетектируемыми.
Обсуждение
Нейтрализация TNFα является эффективной стратегией лечения в случае ревматоидного артрита (RA). В настоящее время она требует применения биологических агентов, таких как химерные mAb или растворимый слитый белок рецептор/Fc человека, которые являются дорогостоящими в приготовлении. Терапевтический нейтрализующий TNFα агент должен связывать TNFα с высокой аффинностью и иметь продолжительный период полураспада в плазме, низкую антигенность и высокую переносимость и безопасность. Он должен быть также доступным для всех пациентов с RA, которые могли бы получить пользу от блокады TNFα. Одной технологией, которая могла бы достичь этих целей, является конъюгирование с полиэтиленгликолем TNFα-связывающего фрагмента антитела, образованного в E.coli. В данном предварительном исследовании авторы нашли, что CDP870, ПЭГилированный, направленный против TNFα, модифицированный Fab, является эффективным и хорошо переносимым пациентами с RA.
Исследования in vitro показали, что CDP870 имеет аналогичную TNFα нейтрализующую активность относительно мышиного исходного антитела против TNFα. Данное исследование подтверждает, что CDP870 уменьшал воспаление и улучшал симптомы в RA. Клиническое улучшение, измеренное посредством критериев АСР20-ответных реакций в группах 5 и 20 мг/кг (75%, 75%), было сравнимо с этанерцептом (60%) (Moreland et al., Annals Int. Med., 130, 478-486, 1999) и инфликсимабом (50%) (Maini et al., Lancet, 354, 1932-1939, 1999). При среднем и наивысшем уровнях испытанных доз терапевтический эффект длился 8 недель, что сравнимо с предыдущими другими mAb (Elliot et al., Lancet, 344, 1105-1110, 1994 и Rankin et al., Br. J. Rheumatol., 34, 334-342, 1995). Более раннее исследование показало, что терапевтический эффект антитела против TNFα связан с его периодом полураспада в плазме и образованием циркулирующих антител (Maini et al., Arthritis Rheum. 38, (Supplement): S186 1995 (Abstract)). Исследование авторов показало, что CDP870 имеет полупериод существования в плазме 14 дней, что эквивалентно полупериоду существования целого антитела (Rankin et al., (supra)) и гораздо больше, чем полупериод существования не конъюгированных Fab'-фрагментов. Кроме того, CDP870 генерировал лишь очень низкие уровни ответной реакции в виде образования антител.
Одной из важных целей данного изобретения является исследование переносимости и безопасности введения этого ПЭГилированного Fab'. В исследовании авторов CDP870, по-видимому, хорошо переносился. Хотя необходимо дополнительное исследование для оценки долгосрочной токсичности, особенно риска демиелинизирующего заболевания, инфекции и кожных высыпаний, которые сообщались для этанерцепта и инфликсимаба.
В целом, CDP870 является терапевтически эффективным в RA и был хорошо переносимым в этом краткосрочном исследовании.
Должно быть понятно, что описанные выше примеры являются лишь иллюстративными и не ограничивают объем данного изобретения, определенный следующей формулой изобретения.










































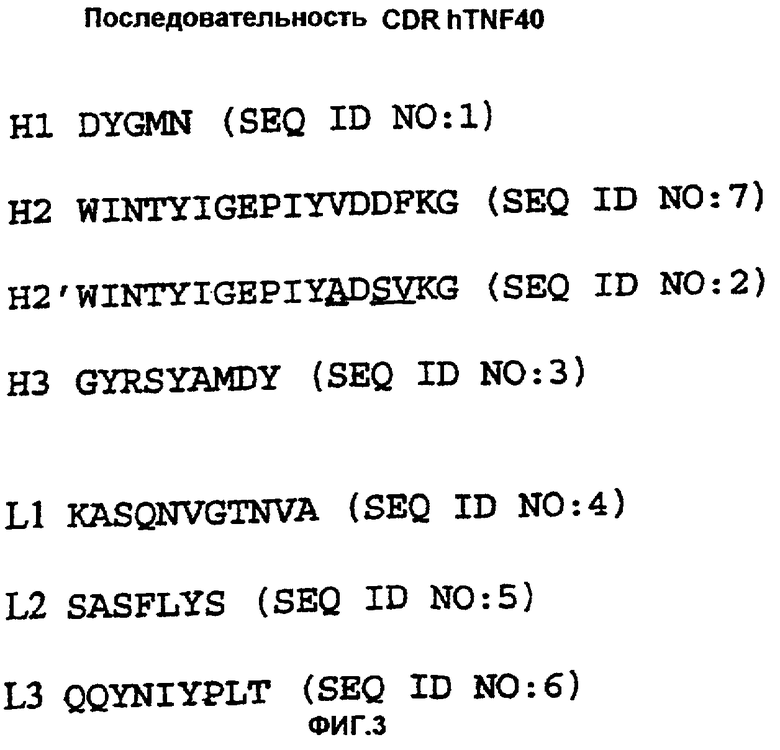
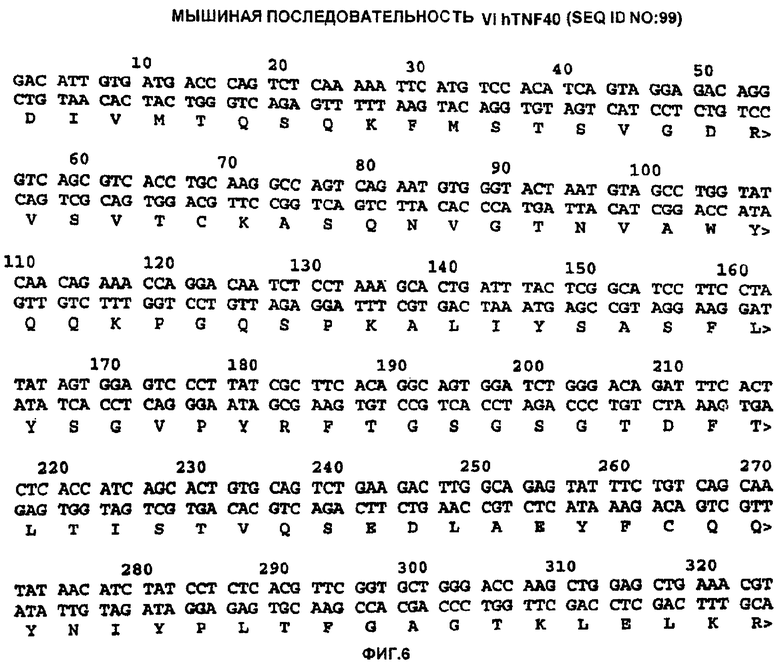


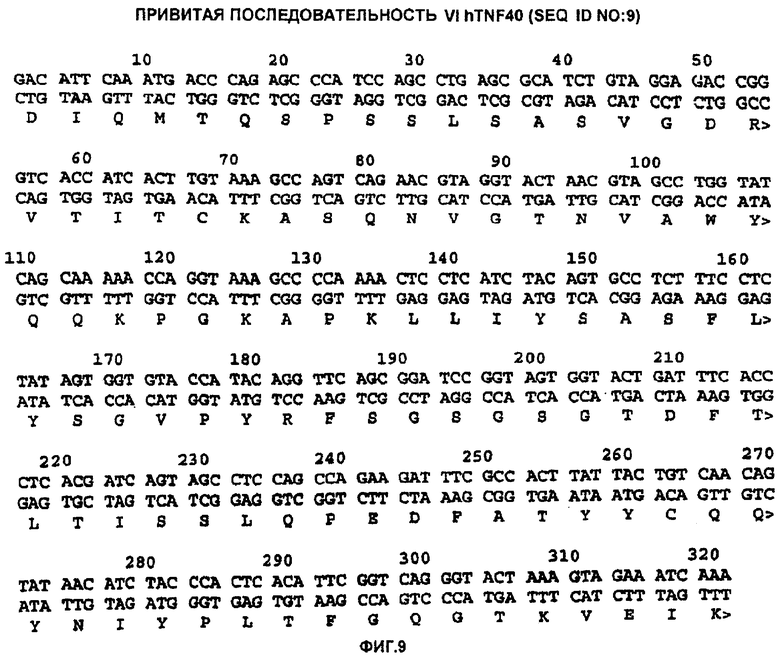


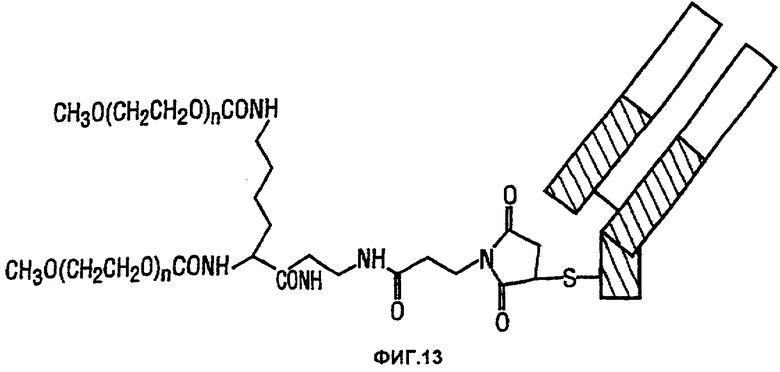
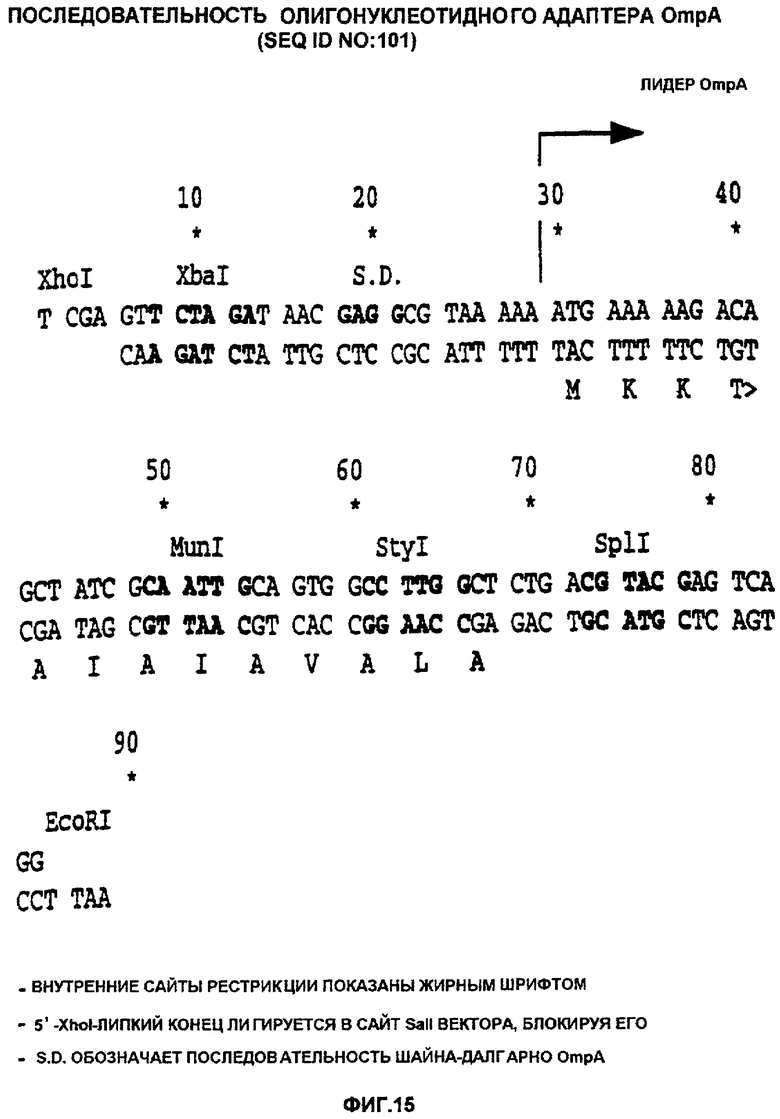
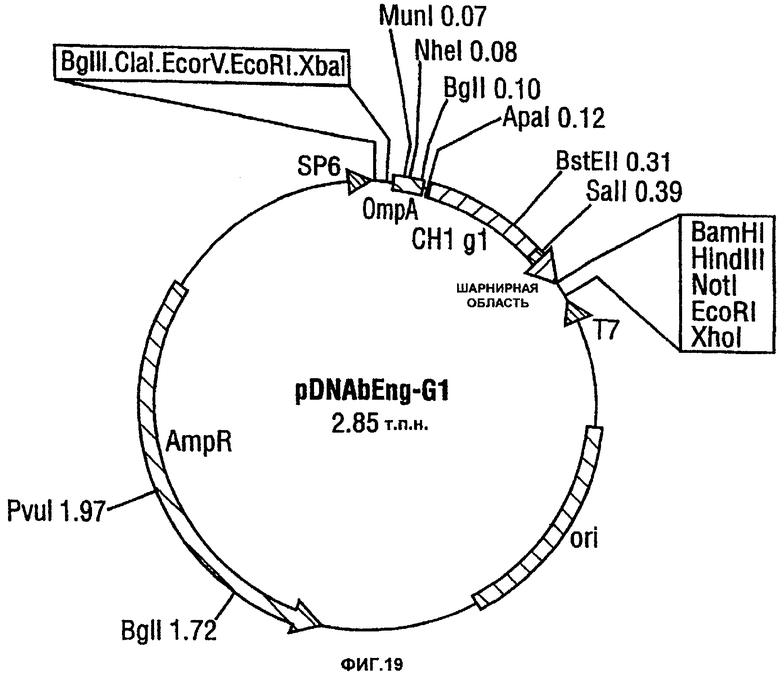

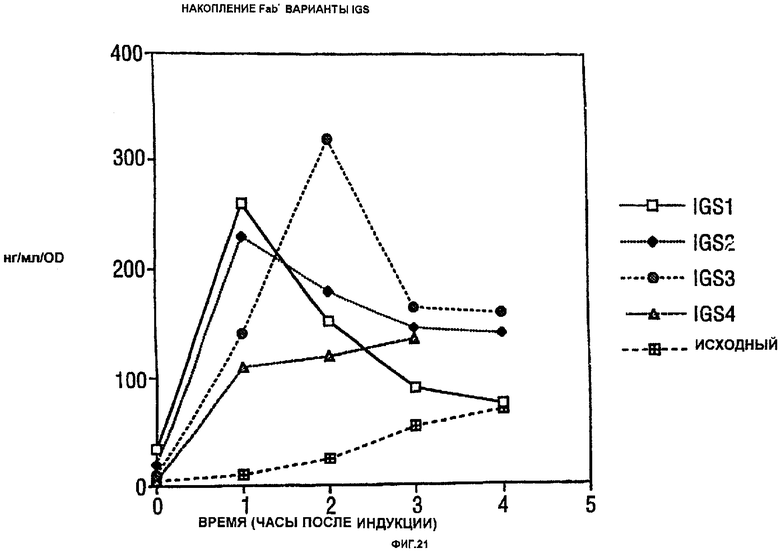
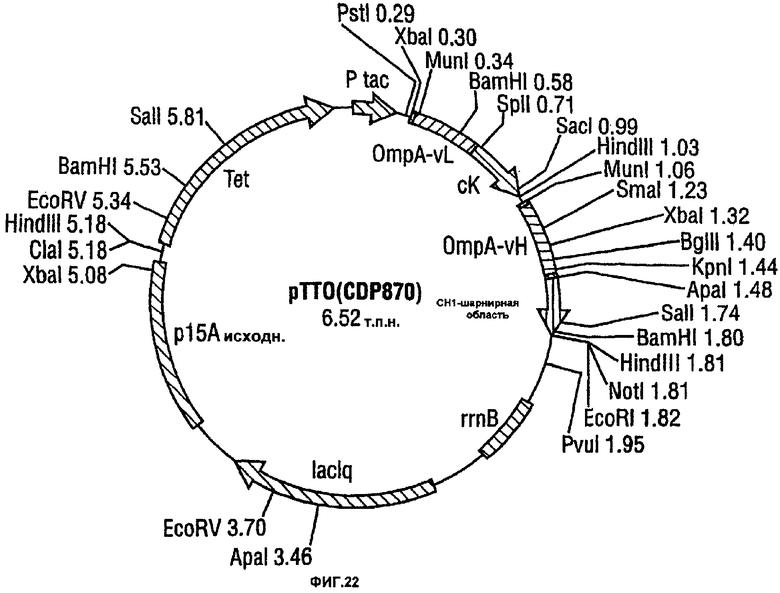
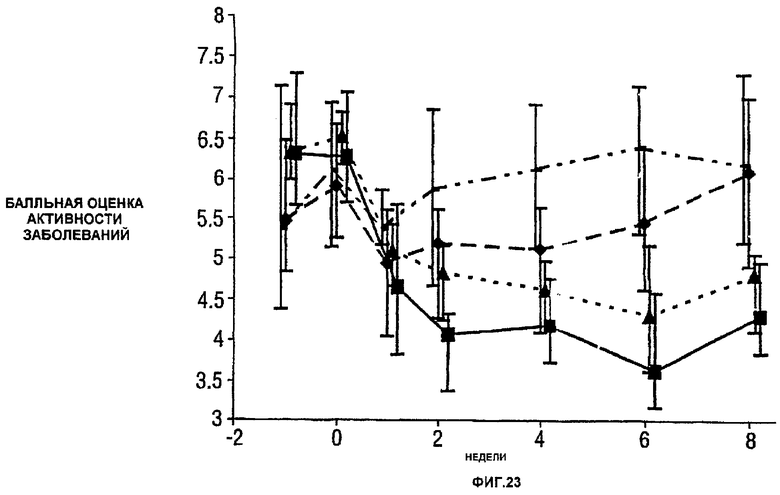
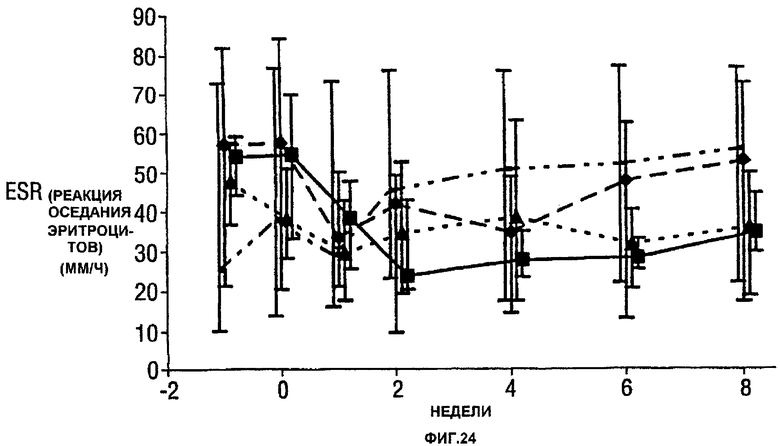
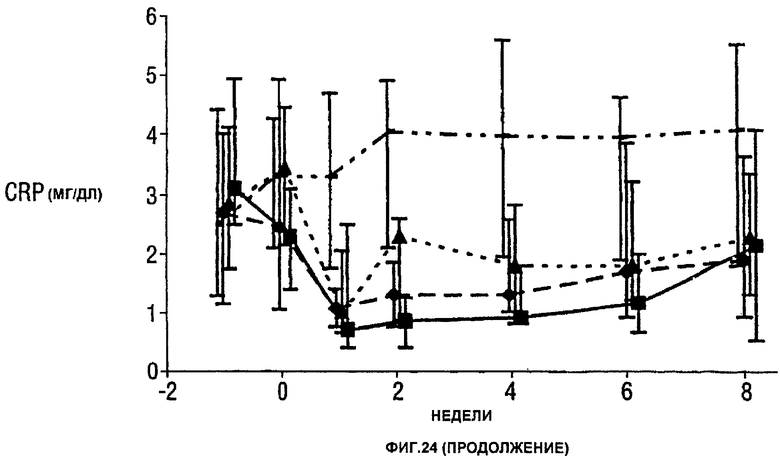
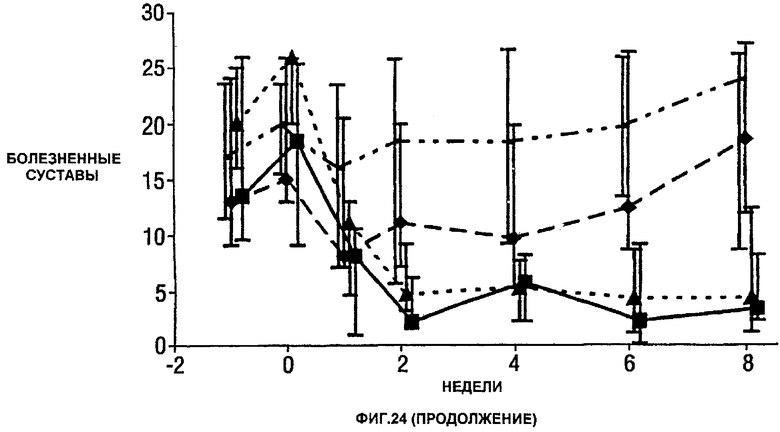
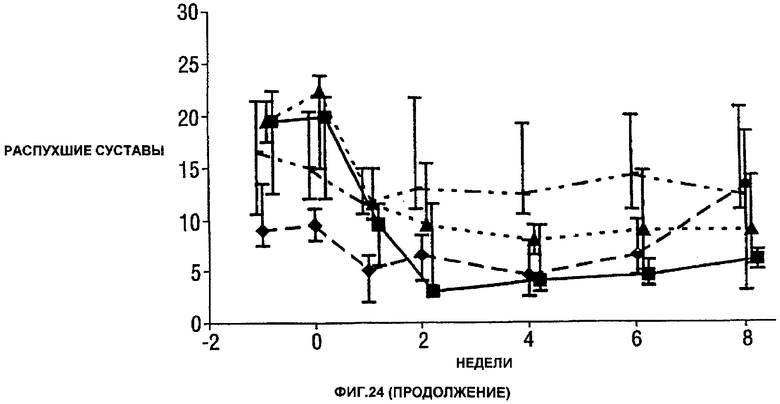
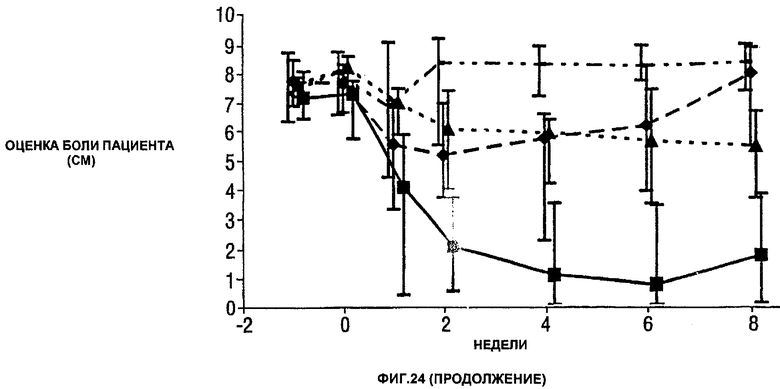
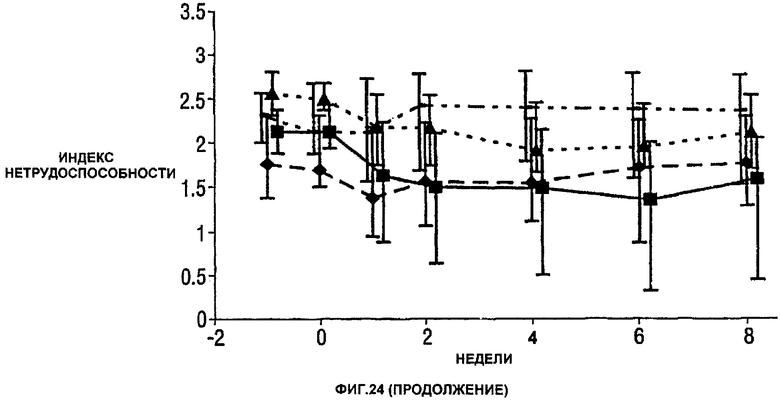
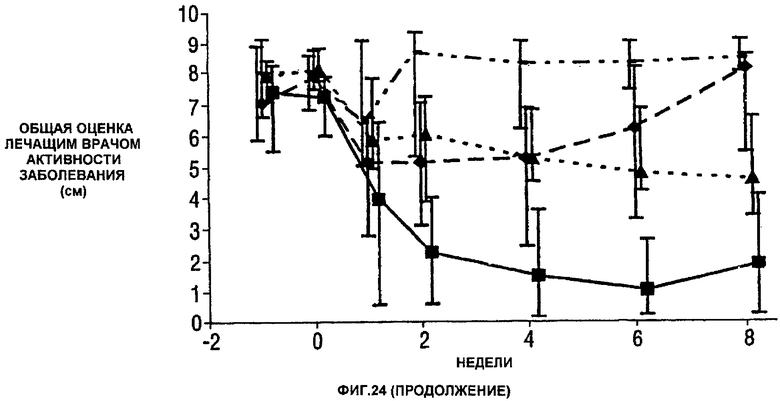
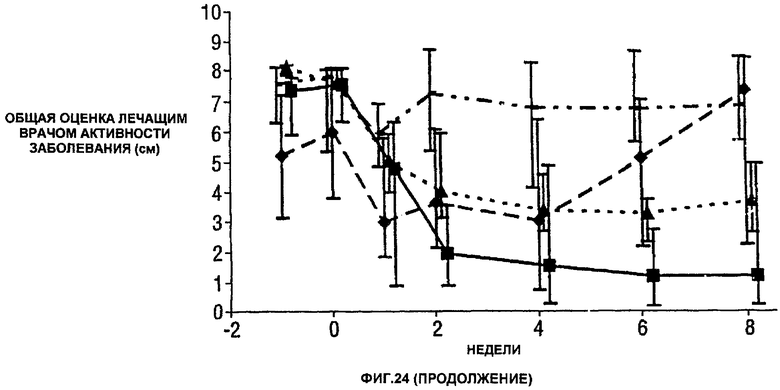
Изобретение относится к иммунологии и биотехнологии. В изобретении описывается мышиное антитело и его гуманизированный вариант (CDP870), специфичные к фактору некроза опухоли альфа человека. Аминокислотная последовательность представлена в описании. Описаны также соединения с аффинностью в отношении фактора некроза опухоли альфа человека на основе гуманизированного антитела, у которых к одному из остатков цистеина на С-конце тяжелой цепи присоединена лизилмалеимидная группа, ковалентно связанная по лизильному остатку с одной или несколькими молекулами метоксиполи(этиленгликоля). Раскрыты последовательности ДНК, кодирующих антитела, специфичные к фактору некроза опухоли альфа человека, и варианты векторов экспрессии, содержащие указанные ДНК. Описаны варианты способа получения клетки-хозяина с использованием векторов экспрессии и варианты способа получения антител на основе полученных клеток-хозяев. Раскрыты терапевтические композиции для лечения патологии, опосредованной фактором некроза опухоли альфа, на основе антител. Изобретение обеспечивает антитела с высокой аффинностью: для мышиного антитела 0,85×10-10 М, для его гуманизированного варианта 0,5×10-10 М, и низкой иммуногенностью у человека - для гуманизированного антитела. Доля пациентнов с улучшенным ACR20 составила при введении 5 и 20 мг/кг CDP870 соответственно 75% и 75% через 8 недель. Полупериод существования в плазме CDP870 составил 14 дней. 21 н. и 37 з.п. ф-лы, 24 ил., 6 табл.
| WO 9825971 A, 18.06.1998 | |||
| WO 9964460 A, 16.12.1990 | |||
| WO 9211383 A, 09.07.1992 | |||
| ФРАГМЕНТЫ АНТИТЕЛ В ТЕРАПИИ | 1994 |
|
RU2139092C1 |
Авторы
Даты
2007-07-27—Публикация
2001-06-05—Подача