Изобретение относится к медицине и касается создания местного анальгезирующего средства растительного происхождения.
В лечебной практике существует проблема отсутствия широкого ассортимента обезболивающих и местно-анестезирующих средств, не обладающих наркотическими свойствами. В соответствии с действующим законодательством Российской Федерации обычный врач и частнопрактикующий специалист лишены возможности приобретать и хранить наркотические средства (препараты группы А). Указанная проблема вынуждает применять различные анальгезирующие препараты, способные избирательно ослабить или устранить (купировать) ощущение боли.
Обезболивающие средства, применяемые в клинической практике, на разных уровнях воздействуют на ноцицептивный канал. Выделяют анальгетики следующих классов (Ivashkin, Shulpekova, 2002):
морфиноподобные препараты (опиаты), фармакологическая мишень которых - центральная нервная система;
нестероидные противовоспалительные препараты (НПВП), воздействующие на уровне центральной нервной системы и периферических рецепторов;
локальные анестетики, блокирующие периферические рецепторы.
Противоболевой активностью обладают также центрально-действующие неопиоидные препараты:
антидепрессанты (амитриптилин и др.), которые обладают способностью усиливать ингибиторные моноаминергические пути регуляции болевых импульсов;
средства, применяемые при специфических болевых синдромах, - карбамазепин (применяется при невралгии тройничного нерва), эрготамин (используется для лечения мигрени) [Ivashkin V.T., Shulpekova Yu.O. Nervous mechanisms of painful sensitivity // Russian J. Gastrointer. Hepatol. Coloproctol. - 2002. - Vol.12. - P.16-20].
Один из перспективных путей борьбы с болью - разработка способов активации функции антиноцицептивной системы.
Фармакологическая блокада механизмов развития боли может осуществляться благодаря введению: НПВП, опиатов, опиоидного пептида динорфина (+/-); энкефалинов, гамма-аминомасляной кислоты (GABA); серотонина и норадреналина.
Учитывая разную продолжительность, интенсивность и причину боли, уменьшить боль могут местно-анестезирующие средства, спазмолитические и холинолитические препараты, коронаролитики, спазмолитики, в качестве коанальгетиков нейролептики и транквилизаторы, кортикостероиды и нестероидные противовоспалительные средства и т.д. Из местных анестезирующих средств помимо новокаина, лидокаина, которые применяются для купирования острой и хирургической боли, есть и другие группы фармакологических веществ, действующие на окончания афферентных нервов - понижающие и стимулирующие их чувствительность [Mashkovskiyi M.D. Drugs // М.: Medicina, 1993. - 736 с. (in Russian)].
К средствам, понижающим чувствительность афферентных путей, относят следующие группы препаратов. Адсорбирующие - при контакте со слизистой или кожей адсорбируют на своей поверхности химические соединения, препятствуют их воздействию на окончания чувствительных нервов - активированный уголь, тальк.
Вяжущие - уплотняют коллоиды внеклеточной жидкости, образуя своеобразную пленку, предохраняющую окончания афферентных нервов от ноцицептивного (болевого) воздействия, ослабляя тем самым боль с противовоспалительным эффектом - кора дуба, висмута нитрат и др. Обволакивающие - болеутоление осуществляется за счет защиты от воздействия внешних раздражителей афферентных нервов - крахмал, отвар семени льна.
Средства, раздражающие (стимулирующие) чувствительность афферентных нервов, оказывают эффект болеутоления рефлекторным путем. К ним относятся ментол, масло терпентинное, яды пчел и змей и т.д. Существует точка зрения, что эти вещества способствуют высвобождению в ЦНС эндогенных опиоидов (эндорфинов и энкефалинов), гистамина и других субстанций. [Raymond S.A., Gissen A.J. Mechanism of differential nerve block // In: Handbook of Experimental Pharmacology. Edited by Strichartz G.R. Heidelberg, Springer-Verlag. 1987. - Vol.81. - P.95-164].
Группой перспективных обезболивающих средств являются аналоги капсаицина. Капсаицин является одним из основных компонентов экстракта растений из семейства стручкового перца. Он обладает уникальными свойствами селективно активировать ноцицепторы после местного и системного назначения. Давно известно, что большие дозы капсаицина, назначаемые животным, обладают нейротоксическим действием для малых немиелинизированных С-волокон. Его назначение в больших дозах приводит к длительному повышению порога болевой чувствительности. Однако использование препаратов горького перца в клинической практике ограничивается их выраженным местным раздражающим действием [Perkins М., Dray A. Novel pharmacological strategies for analgesia // Annals of the Rheumatic Diseases. - 1996. - Vol.55. - P.715-722].
Трициклические антидепрессанты (ТСА) являются эффективными для лечения невропатической боли. Их анальгетический эффект связан как со специфическим, так и неспецифическим ингибированием обратного захвата моноаминов, в частности серотонина и норадреналина [Onghena P. and Van Houdenove В. Antidepressant-induced analgesia in chronic non-malignant pain: a meta-analysis of 39 placebo-controlled studies // Pain. - 1992. - Vol.49. - P.205-219]. Однако по последним данным применение ТСА в качестве местных анестетиков может быть ограничено из-за достаточно выраженного нейротоксического действия [Estebe J.P., Myers R.R. Amitriptyline neurotoxicity: dose-related pathology after topical application to rat sciatic nerve // Anesthesiology. - 2004. - Vol.100. P.1519-1525]. Среди возможных побочных эффектов терапии ингибиторами обратного захвата серотонина наиболее значимым является развитие серотонинового синдрома, проявляющегося явлениями диспепсии: тошнотой, рвотой, головной болью. Данное явление связано с нежелательной стимуляцией 5НТ2- и 5НТ3-рецепторов. При этом наблюдается ажитация, нервозность, бессонница, сексуальные нарушения [Ivashkin V.T., Shulpekova Yu.O. Nervous mechanisms of painful sensitivity // Russian J. Gastrointer. Hepatol. Coloproctol. - 2002. - Vol.12. - P.16-20].
Задача изобретения - снижение побочных отрицательных нейротропных эффектов, уменьшение токсичности и расширение арсенала природных средств, обладающих местным анальгезирующим действием.
Задача решена созданием средства, обладающего местным анальгезирующим действием, характеризующегося тем, что оно представляет собой масло, полученное из семян растения Cartamus tincturius L. путем давления и микрофильтрации, с содержанием серотонина в масляной липофильной основе в количестве 109,0±5,0 нмоль.
В качестве липофильной основы оно содержит сафоровое маслоненасыщенную линолевую кислоту.
Заявляемое средство, обозначенное нами CF, получают из семян однолетнего растения сафлора красильного Cartamus tincturius L., относящегося к семейству сложноцветных. Cartamus tincturius L. - это единственный вид рода, имеющий довольно большое практическое значение. Из цветков растения добывается картамин, служащий красной краской для материй и притом без протравы, а также применяется в пищевой промышленности вместо шафрана. Семена дают сафлоровое масло, по свойствам приближающееся к подсолнечному и конопляному. Оно идет в пищу, применяется в технике для приготовления нежелтеющих белых эмалей и в парфюмерии [Флора СССР. - Изд. АН СССР, Москва, 1963, с.256-257]. Экстракт цветков оказывает слабительное, мочегонное, противовоспалительное действие [Растительные ресурсы СССР. - Наука, С.Петербург, 1993, с.83].
Для получения заявляемого средства семена тщательно моют, очищают от шелухи, помещают под винтовой пресс и производят механическое давление. Жмых отделяют, а маслянистую часть сливают в емкость для хранения. Затем масло центрифугируют. Верхний слой собирают и подвергают трехступенчатой микрофильтрации через миллипоровые фильтры размером 0,45 μм, 0,2 μм. Отфильтрованное чистое масло помещают в стеклянные пузырьки. Это прозрачная маслянистая жидкость светло-желтого цвета со слабым специфичным запахом. Препарат не растворим в воде, щелочи и при нагревании, не содержит минеральных остатков и серы.
Изучение химического состава заявляемого средства показало наличие в его масляной липофильной основе серотонина в количестве 109,0±5,0 нмоль. Масляную основу препарата CF составляет ненасыщенная (С18:2) линолевая кислота (более 70%).
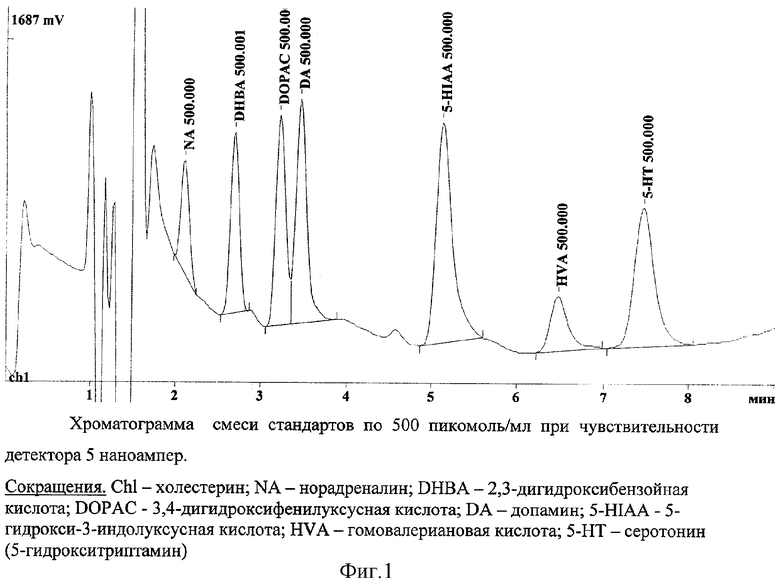
Концентрацию серотонина определяли методом высокоэффективной жидкостной хроматографии с применением электрохимического детектора.
Количественное определение серотонина проводили на хроматографе «Bioanalytical Systems Inc.» (BAS), оснащенном изократической помпой «РМ-80», электрохимическим детектором LC-4B с стеклоуглеродным электродом и соответствующим программным обеспечением для регистрации и обсчета хроматограмм МУЛЬТИХРОМ (Амперсенд).
Расчет концентрации проводили методом нормализации по площади пиков хроматограммы.
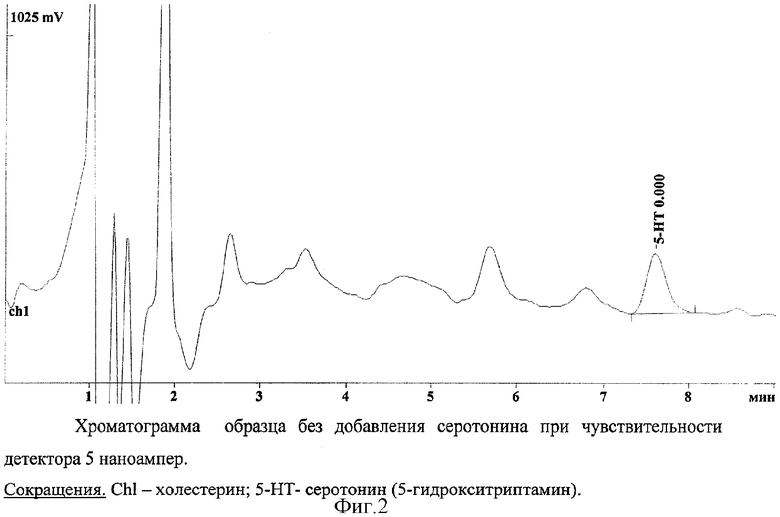
На основании данных (Табл.1 и 2) стандартных образцов по формуле (Y)=A+B(X) рассчитывали содержание серотонина в опытном образце. Оценка концентрации серотонина проводилась по соотношению площадей серотонина в хроматограммах при добавлении его в смеси стандартов различных нейротрансмиттеров в концентрациях по 500 пмоль/мл (фиг.1). Типичная хроматограмма экстракта из масляного образца без добавления внешнего серотонина приведена на фиг.2.
Полученные результаты свидетельствуют о линейном характере распределения серотонина в системе фаз "масло/вода" в исследуемом интервале концентраций.
Полученные данные позволяют утверждать, что исследуемые образцы (n=6) содержат серотонин в концентрации 109±5 нмоль.
В результате проведенных экспериментальных исследований авторами обнаружено, что действие заявляемого препарата CF сопровождается существенным снижением болевой, моторной и тактильной функции седалищного нерва мышей. При этом 100 мкл CF достаточно для достижения частичной локальной анестезии задней конечности, иннервируемой седалищным нервом.
Пероральное или внутрибрюшинное введение заявляемого средства экспериментальным животным в дозах 0,1 мл в течение 20 дней не оказывает токсического действия, не вызывает побочных эффектов во внутренних органах (печень, селезенка, тимус) и нарушений в общей картине крови.
Масленая липофильная основа заявляемого средства, которая выступает в роли носителя серотонина, создает оптимальные условия для его проникновения в области расположения серотонинергических синапсов, что способствует его избыточному накоплению в синаптической щели и, тем самым, вызывает изменение в нейромышечной передаче сигналов.
Нами экспериментально показано, что водный (ACF) и спиртовый (ECF) экстракты из семян однолетнего растения Cartamus tincturius L. даже в высоких дозах (до 500 мг/кг) не обладают обезболивающим действием и не проявляют токсических свойств, хотя, судя по УФ-спектрам, эти экстракты содержат серотонин. Отсутствие обезболивающего эффекта у данных препаратов можно объяснить тем, что серотонин без гидрофобного носителя, очевидно, слабо проникает в области прохождения нервных серотонинергических путей, и поэтому не может вызвать анальгезирующего эффекта.
Следует отметить, что частичное блокирование функций седалищного нерва при введении заявляемого средства напоминает действие специфических трициклических антидепрессантов (ТСА), которые проявляют активность как специфические, так и неспецифические ингибиторы обратного захвата серотонина. Это, как и в случае с CF, приводит к накоплению избыточного количества серотонина в области синаптической щели и вызывает сильный анальгетический эффект.
Однако в отличие от ТСА заявляемое средство, постепенно увеличивающее содержание серотонина в синаптической щели, обладает мягким анальгетическим действием и не вызывает остаточных невропатических эффектов.
Сведения, подтверждающие возможность осуществления изобретения с получением вышеуказанных результатов, заключаются в следующем.
Определение острой и хронической токсичности.
Определение острой и хронической токсичности проводили на линейных мышах (самцах) линии СВА весом 20±2 г. При определении острой токсичности CF вводили однократно в разных дозах. Максимальная доза препарата CF составляла 0,5 мл. Оценку хронической токсичности CF проводили путем перорального или внутрибрюшинного введения в течение 20 дней по 100-200 мкл препарата. Контрольная группа получала такой же объем физиологического раствора.
Изучение действия препарата CF на организм животных проводили с использованием линейных мышей (самцов) СВА весом 18-22 г. В течение 20 дней животным водили по 100 мкл препарата перорально (р.о.) через зонд или внутрибрюшинно ежедневно. На следующий день после последнего введения определяли массу тела лимфоидных органов (тимуса и селезенки), осуществляли забор крови для биохимического анализа и вырезали желудки. Полученные результаты сравнивали с показателями состояния интактных животных. Приведенные данные являются совокупными для всех животных каждой отдельной группы. За весь период эксперимента погибших животных не было.
Биохимический анализ крови.
Для биохимических анализов у опытных животных осуществляли забор крови путем декапитации в орбитальной области. Плазму крови получали центрифугированием гепаринизированной крови при 2000 об./мин в течение 10 мин.
Определение гемолитической активности.
При изучении гемолитического действия препаратов in vitro в качестве тест-системы использовали 0,5% суспензию мышиных эритроцитов. Инкубирование эритроцитов в изотоническом растворе NaCl, содержащем различные дозы препаратов, осуществляли в термостате при 37°С в течение 2 час. Оценку гемолитической активности производили визуально.
Токсикологические испытания показали, что заявляемое средство не вызывает инволюции органов иммунной системы, нарушений липидного обмена, деструкции печени и сердечной мышцы, воспалительных и свободнорадикальных процессов и возрастания уровня продуктов перекисного окисления липидов. Пероральное применение CF в течение 20 дней не вызывает патологических изменений в слизистой желудка опытных животных. Препарат не вызывает существенного изменения биохимических показателей крови. Препарат не обладает гемолитической активностью в отношении мышиных эритроцитов в условиях in vitro.
Таким образом, заявляемое средство относится к группе нетоксичных препаратов.
Функциональная оценка блокады седалищного нерва у крыс и мышей
Протокол для нейрофизиологических испытаний был составлен по международным стандартам. Исследуемые вещества вводили в седалищный вырез в объеме 100-200 мкл иглой 27-G, соединенной с туберкулиновым шприцом, в левую заднюю ногу (по линии большой бедренной кости и седалищного бугра и около одной трети расстояния до большой бедренной кости). При проведении функциональных испытаний правая задняя нога служила в качестве контроля. Для однотипности введений их производил один опытный экспериментатор. Оценку ноцицептивных и проприоцептивных реакций проводили в соответствии с методическими рекомендациями, которые были использованы при изучении функциональной блокады седалищного нерва лидокаином [Thalhammer J.G, Vladimirova M., Bershadsky В., Strichartz G.R. Neurologic evaluation of a rat during sciatic nerve block with lidocaine // Anesthesiology. - 1995. Vol.82. - P.1013-1025].
За животными наблюдали до исчезновения внешних признаков блокирования функций седалищного нерва. Оценку функциональных нарушений осуществляли в 1, 5, 10, 20, 30, 45, 60, 75, 90, 105 и 120 минуту после введения препаратов.
Измерение всех перечисленных параметров занимало не больше 2 мин. Оценку неврологического статуса всегда производили в следующей последовательности: (1) проприоцепция, (2) поза, (3) ноцицепция, (4) моторная функция и (5) психическое состояние. Последовательность устанавливали на данных предварительных экспериментов, указавших возможность минимизации влияния одной процедуры на результаты последующего теста.
При определении функционального дефицита нижних конечностей животных разделяли на категории: норма, слабое уменьшение и полная блокада. При оценке общего и психического состояния животных во все время блокирования нерва учитывались их подвижность, тревожность и реакция на слабые внешние раздражения.
Болевая и моторная функции.
Болевую функцию оценивали путем наблюдения за реакцией одергивания конечности на сильное раздражение. Рефлекс одергивания, также называемый рефлекс сгибания конечности, является одним из основных рефлексов, используемых для иллюстрации многих признаков рефлекторного действия сгибающих мышц в бедра, колена и лодыжки. Это полисинаптический рефлекс, который индуцируется раздражающей стимуляцией конечности, и его латентный период, амплитуда и величина зависят от интенсивности стимула. Рефлекс сгибания конечности индуцировали путем сильной температурной стимуляции кожи при интенсивности и повторяемости, не приводящих к гиперальгезии (менее 10 сек).
После введения исследуемых препаратов оценку анальгезирующего эффекта проводили путем измерения латентного времени отдергивания в секундах при воздействии теплового раздражения. При этом задние конечности погружали попеременно в циркулирующую горячую воду при температуре 51°С. Промежуток времени между тепловым воздействием на контрольную и опытную конечности составлял не менее одной минуты.
Моторную функцию у животных количественно оценивали одновременно в тесте определения толчковой силы разгибательной мышцы. Мышей поддерживали вертикально на вытянутых задних конечностях, так что вес тела поддерживался периферической плюсной и пальцами ног, а удар мышцы-разгибателя измеряли как силу, действующую на цифровые платформенные весы и возникающую при контакте пятки с платформой. Нормальную моторную функцию определяли измерением силы толчка ноги по платформе перед введением исследуемых препаратов (соответствовал 0% блокирования моторной функции). Уменьшение этой силы, представляющее уменьшение мышечного тонуса, рассматривалась как дефицит моторной функции и выражалась в % контролю.
Кроме того, моторную функцию у животных оценивали одновременно в тесте определения болевой функции. Нарушения моторной функции проявлялись в замедлении рефлекторного отдергивания конечности и по его незавершенности.
Проприоцепция.
Сохранение проприоцепции оценивали по реакции на тактильное размещение конечности при помещении животного на металлическую сетку, установленную вертикально. Нарушение проприоцептивной функции отмечали в случае неточного помещения лапки строго на прутья сетки, расстояние между которыми составляла около 1 см. Оценка проприоцепции также основывалась на анализе позы покоя и позовых реакций. Для этого после инъекции препаратов регистрировали положение конечности по отношению к корпусу, расположение пальцев задней ноги и степень вытягивания ноги в коленном суставе.
Психическое состояние считали нормальным, если мыши проявляли исследовательскую активность и реагировали на внешние окружающее.
Сбор данных и анализ.
Для оценки последовательности функциональных нарушений от начала до полного восстановления мы сравнивали частоту и интенсивность видимых изменений сразу после введения исследуемых препаратов до полного восстановления. Когда латентный период отдергивания WRL при тепловой стимуляции достигал времени окончания (10 с), ноцицептивную функцию на тепло рассматривали как максимально заблокированную. Величину изменения конкретной функции сравнивали с величиной измерения контралатеральной, необработанной ноги.
Статистическая обработка данных.
Все величины выражали как среднее±стандартное отклонение. Статистическую обработку полученных данных проводили с помощью t-критерия Стьюдента. Последовательность начала и конца полного блокирования различных функций сравнивали и значения различий между функциями оценивали с помощью непараметрического теста Фишера. Величина вероятности р<0,05 рассматривалась как значимая. Статистические расчеты проводили по программе Microsoft Excel, 6.0 (Redmond WA).
Оценка функциональной блокады седалищного нерва у крыс и мышей.
Количественная оценка начала, окончания и интенсивности различных функциональных нарушений или блокирования во времени создает возможность установить дозы и условия, которые приводят к различной нервной блокаде и позволяют сравнивать эти изменения с различными лекарственными веществами и клиническими протоколами. Когда происходит блокада периферического нерва локальными анестетиками начало и продолжительность различных функциональных изменений могут сильно зависеть от химической структуры исследуемого анестетика и места блокирования (Raymond, Gissen, 1987).
Методы для оценки неврологического статуса, включающие анализ общего состояния, двигательной активности, положения конечностей, походки, проприоцептивных и моторных функций, а также болевых реакций, принятые в ветеринарной неврологии, были адаптированы к мышам и использовались для контроля функциональных изменений при блокировании седалищного нерва.
Начало и окончание времени блокады седалищного нерва под действием CF в сравнении с лидокаином и амитриптилином.
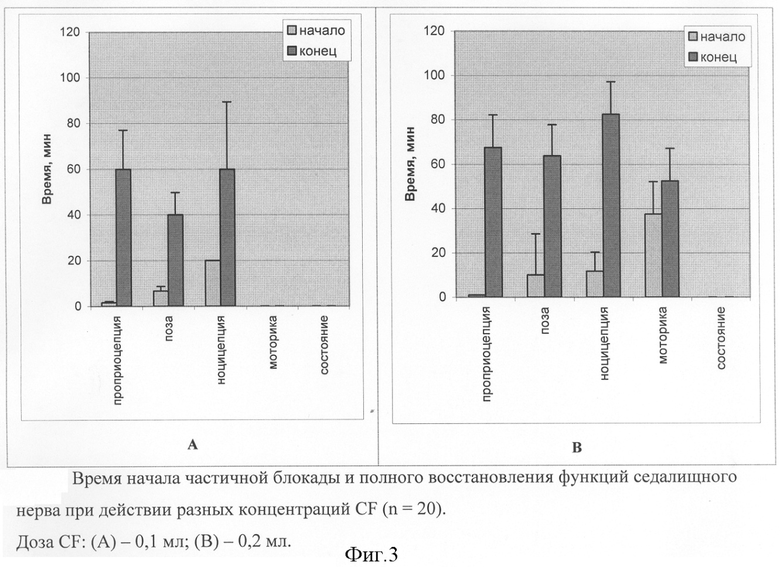
Как видно из фиг.3, введение препарата CF в дозах 0,1-0,2 мкл в область прохождения седалищного нерва у мышей не вызывало раздражения кожи в месте инъекции и негативного действия на общее состояние опытных животных. Однако через 10-15 мин после введения CF в дозе 100 мкл у животных наблюдали резкое снижение проприоцептивной функции («эффект проваливания ноги»), мыши слабо удерживались на вертикальной металлической сетке при встряхивании. Состояние животных полностью нормализовалось в течение последующих 30-40 мин. Полное восстановление рассматриваемых функций происходило в течение 1 час.
Увеличение дозы CF со 100 мкл до 200 мкл приводило к появлению нарушения моторной функции, показано увеличение времени проприоцептивного и ноцицептивного действия в среднем на 15 и 30%, соответственно. Необходимо отметить, что интенсивность ноцицептивного нарушения слабо зависит от применяемой дозы в концентрационном пределе 100-200 мкл. Препарат CF в дозе 0,2 мл частично блокирует болевую, моторную и проприоцептивную функции. После инъекции CF моторная блокада появляется медленно в течение 10 мин и сопровождается как болевой, так проприоцептивной блокадой. Возвращение в нормальное состояние начинается через 0,8-1 ч после инъекции CF (фиг.3В).
Локальный анестетик лидокаин и трициклический антидепрессант амитриптилин были использованы нами в качестве положительного контроля эффективности блокирования функциональной активности седалищного нерва мышей.
Лидокаин по химической структуре относится к производным ацетанилида и представляет собой сильное местно анестезирующее средство, вызывающее все виды местной анестезии. Амитриптилин - основной представитель типичных трициклических антидепрессантов (ТСА). По механизму действия он представляет собой неспецифический ингибитор обратного захвата серотонина и норадреналина.
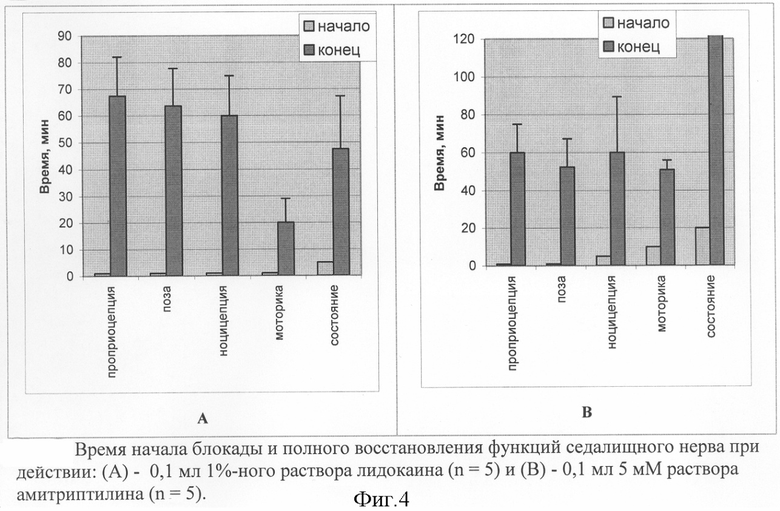
Как видно из фиг.4А, введение 0,1 мл 1%-ного раствора лидокаина вызывало полное блокирование проприоцептивной, ноцицептивной и моторной функций в течение первой минуты после введения. По сравнению с другими препаратами лидокаин обладал наибольшим анальгезирующим действием и только он вызывал полное блокирование функций (с 5 по 20 мин после воздействия). При оценке проприоцептивных реакций через 40-60 сек после инъекции лидокаина наблюдалось выворачивание и волочение ноги с перенесением веса на контрольную заднюю ногу. Пальцы были полностью вытянуты. Полное восстановление позы происходило через 105 мин после инъекции.
Амитриптилин обладал менее выраженными, чем у лидокаина, анальгезирующими свойствами. Через 30 мин после введения этот ТСА оказывал системное действие на организм, в частности, у животных наблюдали резкое снижение активности, вялость и замедление рефлекторных реакций, в том числе на температурное воздействие. Восстановление до нормального состояния происходило через 3-4 час после введения 0,1 мл 5 мМ раствора амитриптилина (фиг.4В).
В результате наших исследований с использованием мышиной модели блокады седалищного нерва было показано, что масленый препарат из семян Cartamus tincturius L. (CF) в дозе 0,1-0,2 мл вызывает частичную блокаду болевой и проприоцептивной функции седалищного нерва, и, следовательно, может быть использован, прежде всего, как местный анестетик для наружного применения.
Таким образом, можно заключить, что заявляемое средство в дозах 100-200 мкл обладает умеренной анальгезирующей активностью, оказывает влияние на проприоцептивные и моторные функции. Продолжительность анальгезирующего действия заявляемого средства в указанных выше дозах сравнима с оптимальными действующими концентрациями местного анестетика лидокаина и ТСА амитриптилина. При этом заявляемое средство оказывает значительно меньшее влияние на моторные функции и общее нервно-психическое состояние организма животного по сравнению с лидокаином и амитриптилином (см. фиг.3 и 4).
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЧЕТАННЫЕ ПРЕПАРАТЫ НЕОСАКСИТОКСИНА ДЛЯ ПРОЛОНГИРОВАННОЙ МЕСТНОЙ АНЕСТЕЗИИ | 2017 |
|
RU2673081C1 |
| ПРИМЕНЕНИЕ ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА ДЛЯ МОРФОФУНКЦИОНАЛЬНОГО ВОССТАНОВЛЕНИЯ ПЕРИФЕРИЧЕСКИХ НЕРВОВ ПРИ ДИАБЕТИЧЕСКОЙ НЕВРОПАТИИ | 2007 |
|
RU2460536C2 |
| СПОСОБ ПРЕДУПРЕЖДАЮЩЕЙ КОМБИНИРОВАННОЙ АНАЛЬГЕЗИИ У БОЛЬНЫХ С ДИАФИЗАРНЫМИ ПЕРЕЛОМАМИ БЕДРА И ГОЛЕНИ | 2005 |
|
RU2283101C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ НЕРВНОЙ СИСТЕМЫ | 2006 |
|
RU2324429C2 |
| СПОСОБ ОБЕЗБОЛИВАНИЯ ПРИ ОПЕРАТИВНОМ ЛЕЧЕНИИ ДИСКОГЕННОГО ПОЯСНИЧНО-КРЕСТЦОВОГО РАДИКУЛИТА | 2003 |
|
RU2248814C2 |
| СПОСОБ БЛОКАДЫ ГЕНИКУЛЯРНЫХ НЕРВОВ ПРИ ОПЕРАЦИИ НА КОЛЕННОМ СУСТАВЕ | 2016 |
|
RU2645936C1 |
| Способ купирования болевого синдрома | 2024 |
|
RU2826787C1 |
| Способ лечения фантомной боли в нижней конечности | 2023 |
|
RU2817812C1 |
| СПОСОБ ЛЕЧЕНИЯ ТРИГЕМИНАЛЬНОЙ НЕВРАЛГИИ И НЕЙРОПАТИИ ТРОЙНИЧНОГО НЕРВА В СТАДИИ ОБОСТРЕНИЯ | 2002 |
|
RU2223758C1 |
| Способ лечения корешкового болевого синдрома поясничного отдела позвоночника (варианты) | 2015 |
|
RU2618460C2 |
Изобретение относится фармацевтической промышленности и касается создания местного анальгезирующего средства растительного происхождения. Средство представляет собой масло, полученное из семян растения Carthami-Tinctorii fructus путем давления и микрофильтрации, с содержанием серотонина в масляной липофильной основе в количестве 109,0±5,0 нмоль. В качестве липофильной основы оно содержит в основном ненасыщенную линолевую кислоту. Препарат действует мягко и не вызывает остаточных невропатических эффектов, снижает токсичность и расширяет арсенал природных анальгезирующих средств. 1 з.п. ф-лы, 2 табл., 4 ил.
| ПОЛНЫЙ СПРАВОЧНИК ЛЕКАРСТВЕННЫХ РАСТЕНИЙ | |||
| - М., 2001, с.203, 204 | |||
| ФЛОРА СССР | |||
| - М.: Изд | |||
| АН СССР, 1963, с.256, 257 | |||
| ANNALS OF RHEUMATIC DISEASES, 1996, vol.55, p.715-722. |
Авторы
Даты
2007-10-20—Публикация
2005-09-14—Подача