Область техники
Настоящее изобретение относится к одностадийному способу гидролиза зернистого крахмала в растворимый гидролизат крахмала при температуре ниже начальной температуры желатинизации данного зернистого крахмала.
Уровень техники
Было описано большое количество процессов конверсии крахмала в крахмальные гидролизаты, такие как мальтозу, глюкозу или специальные сиропы, или для использования в качестве подсластителей, или в качестве прекурсоров для других сахаридов, таких как фруктоза. Также глюкоза может быть ферментирована до этанола или других продуктов ферментации.
Крахмал является высокомолекулярным полимером, состоящим из цепей глюкозных звеньев. Он обычно состоит из приблизительно 80% амилопектина и 20% амилозы. Амилопектин является разветвленным полисахаридом, в котором линейные цепи остатков альфа-1,4-D-глюкозы соединены альфа-1,6-глюкозидными связями.
Амилоза является линейным полисахаридом, состоящим из D-глюкопиранозных звеньев, соединенных между собой альфа-1,4 глюкозидными связями. В случае преобразования крахмала в растворимый гидролизат крахмала крахмал деполимеризуется. Обычный процесс деполимеризации состоит из стадии жалатинизации и двух последовательных стадий процесса, а именно процесса ожижения и процесса осахаривания.
Зернистый крахмал состоит из микроскопических гранул (зерен), которые являются нерастворимыми в воде при комнатной температуре. При нагревании водной суспензии крахмала зерна набухают и в конечном счете разрываются, высвобождая молекулы крахмала в раствор. В течение этого процесса "желатинизации" происходит резкое увеличение вязкости. Т.к. уровень сухого вещества в обычном технологическом процессе составляет 30-40%, то крахмал должен быть разжижен или «ожижен», для того чтобы он мог быть обработан. Это снижение вязкости сегодня главным образом достигается ферментативным разрушением. В течение стадии ожижения длинноцепочечный крахмал разлагается на менее разветвленные и линейные звенья (мальтодекстрины) альфа-амилазой. Процесс ожижения обычно выполняется при примерно 105-110оC в течение приблизительно от 5 до 10 минут, после примерно 1-2 часов при примерно 95оC. Температуру затем понижают до 60оC, добавляют глюкоамилазу или бета-амилазу и, по выбору, фермент, расщепляющий разветвленную структуру, типа изоамилазы или пуллуланазы, и процесс осахаривания длится приблизительно от 24 до 72 часов.
Как видно из вышеупомянутого обсуждения, традиционный процесс конверсии крахмала очень энергоемкий из-за различных требований к температурным условиям в течение различных стадий. Таким образом, желательно выбрать ферменты, используемые в процессе так, чтобы весь процесс мог быть выполнен без необходимости желатинизации крахмала. Такой процесс был описан в патентах US4591560, US4727026 и US4009074 и EP0171218.
Настоящее изобретение относится к одностадийному способу конверсии зернистого крахмала в растворимый гидролизат крахмала при температуре ниже начальной температуры желатинизации крахмала.
Сущность изобретения
В первом аспекте изобретение обеспечивает одностадийный способ производства растворимого гидролизата крахмала, где способ включает воздействие на водную суспензию зернистого крахмала при температуре ниже начальной температуры желатинизации указанного зернистого крахмала одновременного действия следующих ферментативных активностей, где первый фермент, который является членом семейства 13 гликозидгидролазы, имеет альфа-1,4-глюкозидную гидролитическую активность и включает углеводно-связывающий модуль семейства 20, и второго фермента, который является грибковой альфа-амилазой (EC 3.2.1.1), бета-амилазой (EC 3.2.1.2) или глюкоамилазой (EC 3.2.1.3).
Во втором аспекте изобретение обеспечивает способ для производства высокофруктозного сиропа на основе крахмала (HFSS), где способ включает производство растворимого гидролизата крахмала по способу первого аспекта изобретения и дополнительно содержит стадию конверсии растворимого гидролизата крахмала в высокофруктозный сироп на основе крахмала (HFSS).
В третьем аспекте изобретение обеспечивает способ производства топливного или питьевого этанола; включая производство растворимого гидролизата крахмала по способу первого аспекта изобретения, и дополнительно включает стадию ферментации растворимого гидролизата крахмала в этанол, в котором стадия ферментации осуществляется одновременно или отдельно/последовательно от гидролиза зернистого крахмала.
Подробное описание изобретения
Определения
Под термином "зернистый крахмал" понимается сырой, необработанный крахмал, т.е. крахмал, который не был подвергнут желатинизации. Крахмал формируется в растениях как крошечные зерна, не растворимые в воде. Эти зерна (гранулы) сохраняются в крахмалах при температурах ниже начальной температуры желатинизации. При помещении в холодную воду зерно может поглотить малое количество жидкости. Вплоть до 50-70оC набухание обратимо, степень обратимости зависит от определенного крахмала. С более высокими температурами начинается необратимое набухание, называемое желатинизацией.
Под термином "начальная температура желатинизации" понимается самая низкая температура, при которой начинается желатинизация крахмала. Крахмал начинает желатинизироваться между 60оC и 70оC, точная температура зависит от определенного крахмала. Начальная температура желатинизации зависит от сырья, из которого получен крахмал. Начальная температура желатинизации для пшеничного крахмала приблизительно 52оC, для картофельного крахмала приблизительно 56оC и для кукурузного крахмала примерно 62оC. Однако качество крахмала изначально может изменяться из-за индивидуального разнообразия видов растения, так же как и условий роста, и поэтому исходная температура желатинизации должна быть определена для каждой индивидуальной партии крахмала.
Под термином "растворимый гидролизат крахмала" понимаются растворимые продукты способов изобретения и могут включать моно-, ди- и олигосахариды, такие как глюкоза, мальтоза, мальтодекстрины, циклодекстрины и любые их смеси. Предпочтительно по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% сухого вещества зернистого крахмала конвертированы в растворимый гидролизат крахмала.
Под термином "специальные сиропы" понимается признанный в данной области термин, и он охарактеризован согласно DE и спектру углевода (См. статью "New Speciality Glucose Syrups", p. 50+, в справочнике "Molecular Structure and Function of Food Carbohydrate", под редакцией G. G. Birch и L. F. Green, Applied Science Publishers LTD., London). Типичные специальные сиропы имеют DE в диапазоне от 35 до 45.
«Семейство 13 гликозидгидролазы» в контексте этого изобретения определяется как группа гидролаз, включающих каталитическую область, имеющую (бета/альфа)8 структуру или структуру TIM цилиндра и действующую на крахмал и связанные вещества посредством механизма реакции альфа-удерживания (Koshland, 1953, Biol. Rev. Camp. Philos. Soc 28, 416-436).
Ферменты, имеющие «альфа-1,4-глюкозидную гидролитическую активность» в контексте этого изобретения, определяются как группа ферментов, которые катализируют гидролиз и/или синтез альфа-1,4-глюкозидных связей, как было определенно Takata (Takata et al, 1992, J. Biol.Chem. 267,18447-18452) и Koshland (Koshland, 1953, Biol. Rev. Camp. Philos. Soc. 28, 416-436).
«Углеводсвязывающий модуль семейства 20» или CBM-20 модуль в контексте этого изобретения определяется как последовательность приблизительно 100 аминокислот, имеющих по меньшей мере 45% гомологию к углеводсвязывающему модулю семейства (CBM) полипептида, раскрытого на фиг.1 в Joergensen et al (1997) в Biotechnol. Lett. 19:1027-1031. CBM включает последние 102 аминокислоты полипептида, то есть субпоследовательность от аминокислоты 582 до аминокислоты 683.
Ферменты, которые: (a) являются членами семейства 13 гликозидгидролазы; (b) имеют альфа-1,4-глюкозидную гидролитическую активность и (c) включают углеводсвязывающий модуль семейства 20, и определенно рассмотрены для этого изобретения, включают ферменты, классифицируемые как EC 2.4.1.19: циклодекстрин глюканотрансферазы, и EC 3.2.1.133: мальтогенные альфа-амилазы и отдельные члены 3.2.1.1 альфа-амилаз, и 3.2.1.60: мальтотетраозообразующие амилазы.
«Гидролитическая активность» ЦГТаз и мальтогенных альфа-амилаз определяется измерением увеличения восстановительной способности в течение инкубации с крахмалом согласно Wind, R. D. et al 1995 в Appl. Environ. Microbiol. 61: 1257-1265. Концентрации восстанавливающих сахаров измерены динитросалициловым кислотным методом согласно Bernfield (Bernfield, P. 1955. Amylases alpha and beta. Methods Enzymol. 1: 149-158) с небольшими модификациями. Разведенный фермент был инкубирован на приемлемое время с 1% (масс/объем) растворимым крахмалом (Paselli SA2 крахмал от Avebe, The Netherlands или альтернативный растворимый крахмал от Merck) в 10 мМ буфере цитрата натрия (pH 5,9) при 60оС. Одна единица гидролитической активности определяется как количество фермента, продуцирующего 1 микромоль мальтозы в минуту при стандартных условиях.
Под полипептидной "гомологией", упомянутой в этом раскрытии, понимается степень идентичности между двумя последовательностями, указывающими отклонение первой последовательности от второй. Гомология может соответствующим образом быть определена посредством известных в данной области компьютерных программ, типа GAP, представленных в GCG пакете программы (Program Manual for the Wisconsin Package, Version 8, August 1994, Genetics Computer Group, 575 Science Drive, Madison, Wisconsin, USA 53711) (Needleman, S. B. and Wunsch, C. D., (1970), Journal of Molecular Biology, 48,443-453). Для сравнения последовательности полипептида используются следующие установочные параметры: GAP штраф за образование 3,0 и GAP штраф за удлинение 0,1.
Циклодекстрин глюканотрансферазы (ЦГТазы)
Специфический фермент, который используется как первый фермент в способах изобретения, может быть цикломальтодекстрин глюканотрансферазой (EC 2.4.1.19). Цикломальтодекстрин глюканотрансфераза, также обозначаемая как циклодекстрин глюканотрансфераза или циклодекстрин гликозилтрансфераза, далее называемая ЦГТазой, катализирует конверсию крахмала и подобных веществ в цикломатодекстрины через внутримолекулярную реакцию трансгликозилирования, таким образом формируя цикломальтодекстрины различных размеров. Большинство ЦГТаз имеют и трансгликозилированную активность и крахмал-деградирующую активность. Рассмотренные ЦГТазы предпочтительно микробного происхождения, и наиболее предпочтительно бактериального происхождения. Специфически рассмотренные ЦГТазы включают ЦГТазы, имеющие 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или даже 90% гомологию к последовательности, показанной как аминокислоты 1 - 679 из SEQ ID No: 2 в WO02/06508, ЦГТазы, имеющие 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или даже 90% гомологию к аминокислотной последовательности полипептида, раскрытого в Joergensen et al, 1997 на фиг. 1 в Biotechnol. Lett. 19: 1027-1031, и ЦГТазы, описанные в US5278059 и US5545587. Предпочтительно ЦГТаза, которая будет использоваться как первый фермент способа, должна иметь гидролитическую активность по меньшей мере 3,5, предпочтительно по меньшей мере 4, 4,5, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или наиболее предпочтительно по меньшей мере 23 микромоль в минуту/мг. ЦГТазы могут быть добавлены в количествах 0,01-100,0 NU/г DS, предпочтительно 0,2-50,0 NU/г DS, предпочтительно 10,0-20,0 NU/г DS.
Мальтогенная альфа-амилаза
Другой специфический фермент, который используется как первый фермент в способах изобретения, является мальтогенной альфа-амилазой (EC 3.2.1.133). Мальтогенная альфа-амилаза (глюкан 1,4-альфа-мальтогидролаза) способна гидролизовать амилозу и амилопектин до мальтозы в альфа-конфигурации. Кроме того, мальтогенная альфа-амилаза способна гидролизовать мальтотриозу так же, как и циклодекстрины. В частности, рассмотренная мальтогенная альфа-амилаза может быть получена из Bacillus sp., предпочтительно из Bacillus stearothermophilus, наиболее предпочтительно от Bacillus stearothermophilus C599 как описано в ЕР 120693. Эта специфическая мальтогенная альфа-амилаза имеет аминокислотную последовательность, показанную как аминокислоты 1-686 в SEQ ID No:5 (цитируется по US 6162628, SEQ ID No:1). Предпочтительная мальтогенная альфа-амилаза имеет аминокислотную последовательность, имеющую по меньшей мере 70% идентичность с аминокислотами 1-686 из SEQ ID No:5, предпочтительно по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или особенно по меньшей мере 99%. Большинство предпочтительных вариантов мальтогенной альфа-амилазы включают варианты, раскрытые в WO 99/43794.
Мальтогенная альфа-амилаза, имеющая аминокислотную последовательность, показанную как аминокислоты 1-686 в SEQ ID No:5, имеет гидролитическую активность 714. Предпочтительно мальтогенная альфа-амилаза, которая используется в качестве первого фермента в процессе, имеет гидролитическую активность по меньшей мере 3,5, предпочтительно по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 100, 200, 300, 400, 500, 600 или наиболее предпочтительно по меньшей мере 700 микромоль на минуту/мг.
Мальтогенные альфа-амилазы могут быть добавлены в количествах 0,01-40,0 MANU/г DS, предпочтительно от 0,02-10 MANU/г DS, предпочтительно 0,05-5,0 MANU/г DS.
Грибковая альфа-амилаза
Специфический фермент, который используется как второй фермент в способах изобретения, может быть грибковой альфа-амилазой (ЕС 3.2.1.1.), такой как фунгамил-подобная альфа-амилаза. В настоящем раскрытии термин "фунгамил-подобная альфа-амилаза" указывает альфа-амилазу, которая показывает высокую гомологию, то есть больше чем 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или даже 90% гомологию к аминокислотной последовательности, показанной в SEQ ID No:7 (цитируется по WO 96/23874, SEQ ID No:10). Грибковые альфа-амилазы могут быть добавлены в количестве 0,001-1,0 AFAU/г DS, предпочтительно 0,002-0,5 AFAU/г DS, предпочтительно 0,02-0,1 AFAU/г DS.
Бета-амилаза
Другой специфический фермент, который используется как второй фермент в способах изобретения, может быть бета-амилаза (ЕС 3.2.1.2), Бета-амилаза - название, традиционно данное экзо-действующим мальтогенным амилазам, которые катализируют гидролиз 1,4-альфа-глюкозидных связей в амилозе, амилопектине и родственных полимерах глюкозы.
Бета-амилаза была выделена из различных растений и микроорганизмов (W.M.Fogarty and С.Т.Kelly, Progress in Industrial Microbiology, vol.15, pp.112-115, 1979). Эти бета-амилазы характеризуются наличием оптимальных температур в диапазоне от 40°С до 65°С и оптимумом рН в диапазоне от 4,5 до 7,0. Рассмотренная бета-амилаза включает бета-амилазу из ячменя Spezyme® BBA 1500, Spezyme® DBA и OptimalТМ ME, OptimalТМ BBA из Genencor int так же, как NovozymТМ WBA от Novozymes A/S.
Глюкоамилаза
Дополнительный специфический фермент, который используется как второй фермент в способах изобретения, также может быть глюкоамилаза (EC 3.2.1.3), полученная из микроорганизмов или растений. Предпочтительны глюкоамилазы грибкового или бактериального происхождения, выбранные из группы, состоящей из глюкоамилазы из Aspergillus, в частности глюкоамилазы G1 или G2 из A. niger (Boel et al. (1984), EMBO J. 3 (5), p. 1097-1102), или её вариантов, таких как раскрытых в WO92/00381 и WO00/04136; глюкоамилазы из A.awamori (W084/02921), A. oryzae (Agric.Biol. Chem.(1991), 55 (4), p. 941-949), или вариантов или частей её.
Другие рассмотренные варианты глюкоамилазы из Aspergillus включают варианты для увеличения термической устойчивости: G137A и G139A (Chen etal. (1996), Prof. Engng.9,499-505); D257E и D293E/Q (Chen etal. (1995), Prot. Engng. 8,575-582);N182 (Chen et al. (1994), Biochem. J. 301,275-281); дисульфидные связи, A246C (Fierobe et al. (1996), Biochemistry, 35, 8698-8704; и введения остатков Pro в положения A435 и S436 (Li et al. (1997), Protein Engng.10,1199-1204. Кроме того, Clark Ford предоставил 17 октября 1997 г. статью ENZYME ENGINEERING 14, Beijing/China Oct 12-17,97, Abstract book p. 0-61. Реферат предлагает мутации в позициях G137A, N20C/A27C и S30P в глюкоамилазе Aspergillus awamori, для того чтобы улучшить термическую устойчивость. Другие рассмотренные глюкоамилазы включают глюкоамилазы из Talaromyces, в особенности полученные из Talaromyces emersonii (WO99/28448), Talaromyces leycettanus (патент США no Re.32,153), Talaromyces duponti, Talaromyces thermophilus (патент США 4587215). Рассмотренные бактериальные глюкоамилазы включают глюкоамилазы из рода Clostridium, в особенности C.thermoamylolyticum (EP135, 138), и C.thermohydrosulfuricum (WO 86/01831). Предпочтительные глюкоамилазы включают глюкоамилазы, полученные из Aspergillus niger, типа глюкоамилаз, имеющих 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или даже 90% гомологию к аминокислотной последовательности, указанной в SEQ ID No:6 (цитируется по WO 00/04136, SEQ ID No:2). Также рассмотрены коммерческие продукты AMG 200L; AMG 300L; SANТМ SUPER и AMGТМ E (из Novozymes); OPTIDEXТМ 300 (из Genencor Int.); AMIGASEТМ и AMIGASEТМ PLUS (из DSM); G-ZYMEТМ G900 (из Enzyme Bio-Systems); G-ZYMEТМ G990 ZR (глюкоамилаза A. Niger с низким содержанием протеазы).
Глюкоамилазы могут быть добавлены в количестве 0,02-2,0 AGU/г DS, предпочтительно 0,1-1,0 AGU/г DS, так же как 0,2 AGU/г DS.
Дополнительные ферменты
Способы изобретения могут быть также выполнены в присутствии третьего фермента. Специфический третий фермент может быть альфа-амилазой из Bacillus (часто называемый "Термамил-подобной альфа-амилазой"). Известные термамил-подобные альфа-амилазы включают альфу-амилазу, полученную из рода В. licheniformis (коммерчески доступная как Termarnyl), альфа-амилазу из В. amyioliquefaciens и В. stearothermophilus. Другие термамил-подобные альфа-амилазы включают альфа-амилазу, полученную из рода Bacillus sp.NCIB 12289, NCIB 12512, NCIB 12513 или DSM 9375, все из которых описаны подробно в WO 95/26397, и альфа-амилазу, описанную Tsukamoto et al., Biochemical and Biophysical Research Communications, 151 (1988), pp.25-31. В контексте настоящего изобретения термамил-подобная альфа-амилаза является альфа-амилазой, определенной в W099/19467 со страницы 3, строка 18 до страницы 6, строки 27. Рассмотренные варианты и гибриды описаны в WO96/23874, WO97/41213 и WO99/19467. Специфически рассмотренным является рекомбинантный альфа-амилазный вариант из B. stearothermophilus с мутациями:I181* +G182* +N193F. Альфа-амилазы из Bacillus можно добавить в эффективных количествах, °°известных специалисту, квалифицированному в данной области.
Другой специфический третий фермент способа может быть ферментом расщепления разветвленной структуры, типа изоамилазы (EC 3.2.1.68) или пуллуланаз (EC 3.2.1.41). Изоамилаза гидролизует альфа-1,6-D-глюкозидные разветвленные связи в амилопектине и бета-ограниченных декстринах и может быть отличена от пуллулуназ по неспособности изоамилазы действовать на пуллулан, и ограниченным действием на альфа-ограниченные декстрины. Фермент расщепления разветвленной структуры может быть добавлен в эффективных количествах, известных специалисту, квалифицированному в данной области.
Осуществление изобретения
Суспензия крахмала, подвергнутая обработке по способам по изобретению, может содержать 20-55% сухого вещества зернистого крахмала, предпочтительно 25-40% сухого вещества зернистого крахмала, более предпочтительно 30-35% сухого вещества зернистого крахмала.
Будучи подвергнутым способу первого аспекта изобретения по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или предпочтительно 99% сухого вещества зернистого крахмала были конвертированы в растворимый гидролизат крахмала.
Согласно изобретению способы по первому и второму аспекту проводятся при температуре ниже начальной температуры желатинизации. Предпочтительно температура, при которой проводятся процессы, по меньшей мере, должна быть 30оC, 31оC, 32оC, 33оC, 34оC, 35оC, 36оC, 37оC, 38оC, 39оC, 40оC, 41оC, 42оC, 43оC, 44оC, 45оC, 46оC, 47оC, 48оC, 49оC, 50оC, 51оC, 52оC, 53оC, 54оC, 55оC, 56оC, 57оC, 58оC, 59оC или предпочтительно по меньшей мере 60оC.
pH, при котором осуществляется способ по первому аспекту изобретения, может находиться в диапазоне от 3,0 до 7,0, предпочтительно от 3,5 до 6,0, или более предпочтительно от 4,0 - 5,0.
Точный состав продуктов способа по первому аспекту изобретения, растворимого гидролизата крахмала, зависит от комбинации ферментов, которые были использованы так же, как от типа обрабатываемого зернистого крахмала. Предпочтительно растворимый гидролизат является мальтозой с чистотой по меньшей мере 85%, 90%, 95,0%, 95,5%, 96,0%, 96,5%, 97,0%, 97,5%, 98,0%, 98,5%, 99,0% или 99,5%. Еще более предпочтительно растворимый гидролизат крахмала - глюкоза, и наиболее предпочтительно гидролизат крахмала имеет DX (процент глюкозы от общего количества растворенного сухого вещества) по меньшей мере 94,5%, 95,0%, 95,5%, 96,0%, 96,5%, 97,0%, 97,5%, 98,0%, 98,5%, 99,0% или 99,5%. Однако эквивалентным рассмотренному способу является способ, в котором продуктом способа по изобретению, растворимым гидролизатом крахмала, является специальный сироп, такой как специальный сироп, содержащий смесь глюкозы, мальтозы, DP3 и DPn для использования в производстве мороженых, пирогов, леденцов, фруктовых консервов.
Зернистый крахмал, который обрабатывается в способах по изобретению, может в частности быть получен из клубней, корней, стеблей, бобов, хлебных злаков или целого зерна. Более конкретно зернистый крахмал может быть получен из кукурузы, зерновых, пшеницы, ячменя, ржи, мило, саго, маниоки, тапиоки, сорго обыкновенного, риса, гороха, боба, банана или картофеля. Конкретно рассмотренными являются и восковые и невосковые типы кукурузы и ячменя. Зернистый крахмал, который обрабатывается, может быть крахмалом с высокой степенью качества очистки, предпочтительно больше, чем 90%, 95%, 97% или 99,5% чистоты, или это может быть более грубый крахмал, содержащий материал, включающий измельченное целое зерно, включая некрахмальные фракции типа остатков зародышей и волокон. Сырье, такое как цельное зерно, измельчается для того, чтобы открыть структуру и позволить дальнейшую обработку. Согласно изобретению два способа измельчения являются предпочтительными: влажное и сухое размалывание. При сухом размалывании целое ядро мелется и используется. Влажное размалывание дает хорошее разделение зародыша и муки крупного помола (зерна крахмала и белок) и с несколькими исключениями, применяется в местах, где гидролизат крахмала используется в производстве сиропов. И сухое и влажное размалывание известно в данной области обработки крахмала и одинаково приемлемо для способов изобретения. Способ по первому аспекту изобретения может быть осуществлен в системе для ультрафильтрации, где остаток удерживается при рециркуляции в присутствии ферментов, сырого крахмала и воды, и где удаляемым продуктом является растворимый гидролизат крахмала. Эквивалентным рассмотренному способу является способ, проводимый в мембранном реакторе непрерывного действия с мембранами для ультрафильтрации, и где остаток удерживается при рециркуляции в присутствии ферментов, сырого крахмала и воды, и где удаляемый продукт является растворимым гидролизатом крахмала. Также рассматривается способ, осуществляемый в мембранном реакторе непрерывного действия с мембранами для микрофильтрации, и где остаток удерживается при рециркуляции в присутствии ферментов, сырого крахмала и воды, и где удаляемым продуктом является растворимый гидролизат крахмала.
В способе по второму аспекту изобретения растворимый гидролизат крахмала способа по первому аспекту изобретения подвергается конверсии в высокофруктозный сироп на основе крахмала (HFSS), типа высокофруктозного сиропа из кукурузы (HFCS). Эта конверсия предпочтительно достигается при использовании глюкозоизомеразы и более предпочтительно иммобилизованной глюкозоизомеразы зафиксированной на твердойоснове. Рассмотренные изомеразы включают торговую продукцию Sweetzyme IT от Novozymes A/S,G-zyme IMGI и G-zyme G993,Ketomax и G-zyme G993 от Rhodia,G-zymeT" G993 liquid и GenSweet IGI от Genemcor Int.
В способе по третьему аспекту изобретения растворимый гидролизат крахмала способа по первому аспекту изобретения используется для производства топливного или питьевого этанола. В способе по третьему аспекту ферментация может быть выполнена одновременно или отдельно/последовательно с гидролизом суспензии зернистого крахмала. Когда ферментация выполнена одновременно с гидролизом, температура предпочтительно должна быть между 30оC и 35оC и более предпочтительно между 31оC и 34оC. Способ по третьему аспекту изобретения может осуществляться в системе ультрафильтрации, где остаток удерживается при рециркуляции в присутствии ферментов, сырого крахмала, дрожжей, питательных веществ для дрожжей и воды, и где удаляемый продукт является жидкостью, содержащей этанол. Эквивалентно рассмотренному способу является способ, проводимый в проточном мембранном реакторе с мембранами для ультрафильтрации, и где остаток удерживается при рециркуляции в присутствии ферментов, сырого крахмала, дрожжей, питательных веществ для дрожжей и воды, и где удаляемый продукт является жидкостью, содержащей этанол.
МАТЕРИАЛЫ И МЕТОДЫ
Активность альфа-амилазы (KNU)
Амилолитическая активность может быть определена при использовании картофельного крахмала в качестве субстрата. Этот метод базируется на разложении модифицированного картофельного крахмала ферментом, и реакции предшествует смешивание образцов раствора крахмал/фермент с раствором йода. Первоначально формируется черновато-синий цвет, но при разложении крахмала синий цвет становится более слабым и постепенно превращается в красновато-коричневый цвет, который сравнивается с окрашенным стеклом стандарта.
Одна тысяча альфа-амилазных единиц Novo(KNU) определяется как количество фермента, который при стандартных условиях (то есть при 37оC +/-0.05; 0.0003 MCa2+; и pH 5,6), декстринизует5.26 г сухого растворимого крахмала Merck Amylum.
Руководство AF 9/6, описывающее этот аналитический метод более подробно, доступно после запроса в Novozymes A/S, Дания, данное руководство включено сюда ссылкой.
Активность ЦГТазы(KNU)
Альфа-амилазная активность ЦГТазы определяется методом, в котором используются таблетки Phadebas® в качестве субстрата. Таблетки Phadebas (Phadebas® Амилазный Тест, от Pharmacia Diagnostic) содержат сшитый нерастворимый, окрашенный в синий цвет полимер крахмала, который смешан с бычьим сывороточным альбумином и буферным веществом.
Для каждого отдельного измерения одна таблетка суспензируется в пробирке, содержащей 5 мл 50 мМ буфера Britton-Robinson (50 мМ уксусной кислоты,50 мМ фосфорной кислоты, 50 мМ борной кислоты, 0,1 мМ CaCl2, требуемое значение pH регулируется с помощью NaOH). Тест осуществляется на водяной бане при требуемой температуре. Тестируемая альфа-амилаза растворяется в x мл 50 мМ буфера Britton-Robinson. 1 мл этого альфа-амилазного раствора добавляется к 5 мл 50 мМ буфера Britton-Robinson. Крахмал гидролизуется альфа-амилазой, давая растворимые синие фрагменты. Поглощение полученного синего раствора, измеренное спектрофотометрически при 620 нм, является функцией альфа-амилазной активности.
Важно, что измеренное при 620 нм поглощение после 10 или 15 минут инкубации (время испытания) находится в диапазоне от 0,2 до 2,0 единиц поглощения при 620 нм. В этом диапазоне спектральной поглощательной способности существует линейная зависимость между активностью и поглощением (закон Ламберта-Бера). Поэтому разведение фермента должно быть отрегулировано, чтобы соответствовать этому критерию. При заданном наборе условий (температура, pH, время реакции, буферные условия) 1 мг данной альфа-амилазы будет гидролизовать некоторое количество вещества, и будет появляться синий цвет. Цветовая интенсивность измеряется при 620 нм. Измеренное поглощение непосредственно пропорционально специфической активности (активность/мг чистого белка альфа-амилазы) альфа-амилазы, рассматриваемой при данном наборе условий.
Руководство EAL-SM-0351, описывающее этот аналитический метод более подробно, доступно после запроса в Novozymes A/S, Дания, данное руководство включено сюда ссылкой.
Активность мальтогенной альфа-амилазы(MANU)
Одна Мальтогенная Амилазная Единица Novo (MANU) определяется как количество фермента, который при стандартных условиях разлагает один микромоль мальтотриозы в минуту. Стандартными условиями являются 10 мг/мл мальтотриозы, 37оC, pH 5,0, и время реакции 30 минут. Образованная глюкоза конвертируется глюкозодегидрогеназой (GlucDH, Merck) в глюконолактон при образовании NADH, который определяется спектрофотометрически при 340 нм. Руководство (EAL-SM-0203.01), описывающее этот аналитический метод более подробно, доступно после запроса в Novozymes A/S, Дания, данное руководство включено сюда ссылкой.
Активность глюкоамилазы(AGU)
Глюкоамилазная Единица Novo (AGU) определяется как количество фермента, который гидролизует 1 микромоль мальтозы в минуту при 37оC и pH 4,3.
Активность определяется как AGU/мл при помощи модифицированного метода (AEL-SM-0131, доступно после запроса в Novozymes) после использования Glucose GOD-Perid набора из Boehringer Mannheim, 124036. Стандарт: AMG-стандарт, партия 7-1195, 195 AGU/мл. 375 микролитров субстрата (1% мальтозы в 50 мМ ацетата натрия, pH 4,3) инкубируют 5 минут при 37оC. Добавляют 25 микролитров фермента, растворенного в ацетате натрия. Реакцию останавливают через 10 минут добавлением 100 микролитров 0,25М NaOH. 20 микролитров помещают в 96-ти ячеечные планшеты и добавляют 200 микролитров раствора GOD-PERID (124036, Boehringer Mannheim). Через 30 минут при комнатной температуре измеряют поглощение при 650 нм и активность рассчитывают в AGU/мл по AMG-стандарту. Руководство (AEL-SM-0031), описывающее этот аналитический метод более подробно, доступно после запроса в Novozymes A/S, Дания, данное руководство включено сюда ссылкой.
Активность грибковой альфа-амилазы (FAU)
Альфа-амилазная активность измеряется в FAU (Единицы Грибковой Альфа-Амилазы). Одна (1) FAU - количество фермента, который при стандартных условиях (то есть при 37оC и pH 4,7) разлагает 5260 мг сухого растворимого крахмала (Amylum, Merck) за час. Руководство AF 9.1/3, описывающее этот метод определения FAU более подробно, доступно после запроса в Novozymes A/S, Дания, и данное руководство включено сюда ссылкой.
Активность кислотной альфа-амилазы (AFAU)
Активность кислотной альфа-амилазы измеряется в AFAU (Единицы Кислотной Грибковой Альфа-амилазы), которые определяются относительно стандарта фермента.
Используемым стандартом является AMG 300 L (от Novozymes A/S, глюкоамилаза из дикого штамма Aspergillus niger G1, также раскрытого в Boel et al. (1984), EMBO J. 3 (5), p. 1097-1102 и в W092/00381). Нейтральная альфа-амилаза в AMG снижается после хранения при комнатной температуре в течение 3 недель приблизительно от 1 FAU/мл до менее чем 0,05 FAU/мл.
Активность кислотной альфа-амилазы в этом AMG стандарте определяется в соответствии со следующим описанием. В этом методе 1 AFAU определяется как количество фермента, который разлагает 5,29 мг сухого вещества крахмала в час при стандартных условиях.
Иод образует синий комплекс с крахмалом, а не с его продуктами разложения. Поэтому интенсивность цвета непосредственно пропорциональна концентрации крахмала. Активность амилазы определятся, используя обратную колориметрию уменьшения концентрации крахмала при указанных аналитических условиях.
Стандартные условия/условия реакции: (в минуту)
Если дальнейшие детали предпочтительны, они могут быть найдены в EB-SM-0259.02/01 доступном при запросе в Novozymes A/S, и включены сюда в виде ссылки.
Бета-амилазная активность (DPo)
Активность SPEZYMEO ® BBA 1500 выражается в Градусах Диастатической Силы (DPo). Активность определяется как количество фермента, содержавшегося в 0,1 мл 5% раствора образца препарата фермента, который продуцирует достаточное количество восстанавливающих сахаров для того, чтобы восстановить 5 мл раствора Фелинга, когда образец инкубируется с 100 мл вещества в течение 1 часа при 20оC.
Активность пуллуланазы (Новая пуллуланазная единица Novo (NPUN))
Активность пуллуланазы может быть определена относительно субстрата пуллулана. Пуллулан является линейным полимером D-глюкозы, состоящий по существу из мальтотриозильных звеньев, соединенных 1,6-альфа-связями. Эндопуллуланазы гидролизуют 1,6-альфа-связи случайно, давая мальтотриозы, 63-альфа-мальтотриозил-мальтотриозу, 63-альфа-(63-альфа-мальтотриозил-мальтотриозил)-мальтотриозу.
Одна новая Пуллуланазная Единица Novo (NPUN) является единицей активности эндо-пуллуланазы и измеряется относительно стандарта от Novozymes A/S Promozyme D. Стандартными условиями являются время реакции 30 минут при 40°С и рН 4,5; и с 0,7% пуллулана в качестве субстрата. Количество красного продукта разложения субстрата измеряется спектрофотометрически при 510 нм и пропорционально активности эндо-пуллуланазы в образце. Руководство (EB-SM.0420.02/01), описывающее этот аналитический метод более подробно, доступно после запроса в Novozymes A/S, Дания, данное руководство включено сюда ссылкой.
При стандартных условиях один NPUN приблизительно равен количеству фермента, который освобождает восстанавливающий углевод с восстановительной способностью, эквивалентной 2,86 микромоля глюкозы в минуту.
Определение ЦГТазной гидролитической активности
ЦГТазная гидролитическая активность определена измерением, увеличением восстановительной способности при инкубации с кархмалом PaseHi SA2 (от Avebe, Нидерланды), как описано в Wind et al. 1995 в Appl. Environ. Microbiol. 61:1257-1265.
Определение сахарного профиля и растворенных сухих веществ
Сахарный состав гидролизатов крахмала был определен при помощи ВЭЖХ, и выход глюкозы был впоследствии рассчитан как DX. Растворенное (растворимое) сухое вещество гидролизатов крахмала в °BRIX было определено измерением показателя преломления.
Материалы
Были использованы следующие ферментативные активности. Мальтогенная альфа-амилаза с последовательностью аминокислот 1-686 показана в SEQ ID No:5 (цитируется по WO 9/943794, см. SEQ ID No:1). Глюкоамилаза, полученная из A. niger, имеющая аминокислотную последовательность, показанную в SEQ ID No:6 (цитируется по WO 00/04136, SEQ ID No:2) или один из раскрытых вариантов. Кислотная грибковая альфа-амилаза получена из Aspergillus niger. Альфа-амилаза из Bacillus, которая является рекомбинантным альфа-амилазным вариантом из В. stearothermophilus с мутациями:I181 *+G182*+N193F. Грибковая альфа-амилаза получена из Aspergillus oryzae. ЦГТаза N с последовательностью, показанной здесь как SEQ ID No:1. ЦГТаза О с последовательностью, показанной здесь как SEQ ID No:2. ЦГТаза Т с аминокислотной последовательностью, раскрытой на фиг.1 в Joergensen et al. 1997), в Biotechnol. Lett. 19:1027-1031 и показанной здесь как SEQ ID No: 3. ЦГТаза А, имеющая последовательность, показанную здесь как SEQ ID No: 4.
Обычный кукурузный крахмал (С×PHARM 03406) был получен от Cerestar.
Пример 1
Этот пример иллюстрирует конверсию зернистого крахмала в глюкозу с использованием ЦГТазы Т и глюкоамилазы, и кислотной грибковой амилазы. Суспензия с 33% сухого вещества (DS) зернистого крахмала была приготовлена добавлением 247,5 г обычного кукурузного крахмала при примешивании к 502,5 мл воды, рН был установлен при помощи HCl до 4,5. Суспензия зернистого крахмала была распределена по колбам с синими крышками, вместимостью 100 мл, по 75 г в каждую колбу. Колбы были инкубированы при 60°С на водяной бане с магнитным перемешиванием. В нулевое время активности фермента, приведенные в таблице 1, были дозированы в колбы. Образцы были отобраны после 24, 48, 72, и 96 часов.
Таблица 1
Активности ферментов, которые были использованы
KNU/кг DS
AGU/кг DS
Общее количество сухого вещества крахмала было определено, используя следующий метод. Крахмал был полностью гидролизован добавлением избыточного количества альфа-амилазы (300 KNU/кг сухого вещества) и с последующем помещением образца в масляную баню при 95оC на 45 минут. После фильтрации через 0,22 мкм фильтр сухое вещество было определено измерением показателя преломления.
Растворимое сухое вещество в гидролизате крахмала было определено в образцах после фильтрации через 0,22 мкм фильтр. Растворимое сухое вещество было определено измерением показателя преломления, и сахарный профиль был определен ВЭЖХ. Количество глюкозы было рассчитано как DX. Результаты приведены в таблице 2 и 3.
Растворимое сухое вещество, как процент от общего количества сухого вещества, при трех уровнях активности ЦГТазы
DX растворимого гидролизата при трех уровнях активности ЦГТазы
Пример 2
Этот пример иллюстрирует конверсию зернистого крахмала в глюкозу, используя ЦГТазу T, глюкоамилазу, кислотную грибковую альфа-милазу и альфа-амилазу из Bacillus.
Колбы с 33% DS зернистого крахмала были приготовлены и инкубированы, как описано в примере 1. В нулевой момент активности ферментов, приведенные в таблице 4, были дозированы в колбу.
Таблица 4
Активности ферментов, которые были использованы
KNU/кг DS
AGU/кг DS
AFAU/кг DS
KNU/кг DS
Образцы были отобраны после 24, 48, 72 и 96 часов и проанализированы, как описано в примере 1. Результаты приведены в таблице 4 и 5.
Таблица 5
Растворимое сухое вещество, как процент от общего количества сухого вещества
DX растворимого гидролизата
Пример 3
Этот пример иллюстрирует конверсию зернистого крахмала в глюкозу, используя мальтогенную альфа-амилазу, глюкоамилазу и кислотную грибковую альфа-амилазу.
Колбы с 33% DS зернистого крахмала были приготовлены и инкубированы, как описано в примере 1. В нулевой момент активности ферментов, приведенные в таблице 6, были дозированы в колбу.
Таблица 6
Активности ферментов, которые были использованы
Образцы были отобраны после 24, 48, 72 и 96 часов и проанализированы как описано в примере 1. Результаты приведены в таблицах 7 и 8.
Растворимое сухое вещество, как процент от общего количества сухого вещества, при двух уровнях активности мальтогенной альфа-амилазы
Таблица 8
DX растворимого гидролизата при двух уровнях активности мальтогенной альфа-амилазы
Пример 4.
Этот пример иллюстрирует только частичную конверсию зернистого крахмала в глюкозу, используя глюкоамилазу и кислотную грибковую альфа-амилазу.
Колбы с 33% DS зернистого крахмала были приготовлены и инкубированы, как описано в примере 1. В нулевой момент активности ферментов, приведенные в таблице 9, были дозированы в колбу.
Образцы были отобраны после 24, 48, 72 и 96 часов и проанализированы, как описано в примере 1. Результаты приведены в таблицах 9 и 10.
Таблица 9
Активности ферментов, которые были использованы:
Растворимое сухое вещество как процент от общего количества сухого вещества
DX растворимого гидролизата
Пример 5
Этот пример иллюстрирует корреляцию между гидролитической активностью четырех различных ЦГТаз (ЦГТаза A, ЦГТаза N, ЦГТаза О и ЦГТаза T) и выходом при конверсии зернистого крахмала в сироп глюкозы, с использованием ЦГТазы и глюкоамилазы, измерением растворимого сухого вещества и превращением в DX.
Колбы с 33% DS зернистого крахмала были приготовлены и инкубированы, как описано в примере 1. В нулевой момент все ЦГТазы были дозированы при 100KNU/кг в комбинации с глюкоамилазой при 200AGU/кг. Образцы были отобраны через 48 часов и проанализированы, как описано в примерах 1. Результаты представлены в таблице 12.
Таблица 12
Гидролитическая активность (микромоль на мин/мг белка), и растворимое сухое вещество (DS) и DX после 48 часов
Пример 6
Этот пример иллюстрирует способ, осуществляемый в системе для ультрафильтрации, где остаток удерживается при рециркуляции в присутствии ферментов, сырого крахмала и воды, и где удаляемый продукт является растворимым гидролизатом крахмала. Суспензия, содержащая 100 кг зернистого кукурузного крахмала, растворенного в 233 л водопроводной городской воды, и ЦГТазу T (12,5 KNU/кг крахмала), альфа-амилазу из Bacillus (300 KNU/кг крахмала) и глюкоамилазу (200AGU/кг крахмала), была обработана в системе для периодической ультрафильтрации (типа PCI) с трубчатым мембранным модулем (типа PU 120). Суспензия перемешивалась при 100 оборотах в минуту, pH был установлен до 4,5 с использованием 170 мл 30% HCl, и температура реакции была установлена как 57оC.
Образцы растворенного продукта и остатка были проанализированы по содержанию сухого вещества и сахарному составу.
Фактор коррекции для нерастворимого материала: q = (100-S%)/(100-оBRIX). Индекс центрифугирования для сахара: ciS% = oBRIX/S% (без коррекции). Теоретический выход сахара (глюкоза) Syjeld = ciS%·q·100/111·100%. Таким образом, коррекция была сделана для 100 кг крахмала в пересчете на сухой материал, дающего в результате реакции гидролиза приблизительно 111 кг сухого материала глюкозы.
Испытание было осуществлено в простой системе периодического действия, используя ту же самую ферментативную систему, что и в мембранном испытании. Сравнение данных в таблице 15 а и b показывает, что мембранная система достигла максимальной солюбилизации крахмала ранее.
Таблица 13
Содержание сухого вещества и сахарный состав остатка и удаляемого продукта
Таблица 14
Распределение сухого вещества в остатке при 3, 28, 53 и 77 часах
Таблица 15 a
Теоретический выход глюкозы в зависимости от времени для мембранной системы
Таблица 15 b
Теоретический выход глюкозы в зависимости от времени для системы реактора периодического действия
Результатом явилось то, что когда насыщенность субстрата была поддержана при осахаривании в мембранной системе, степень солюбилизации была улучшена по сравнению с простой системой реактора периодического действия для холодного осахаривания необработанного крахмала.
Пример 7
Этот пример иллюстрирует одновременное холодное ожижение и способ осахаривания изобретения, выполненные в непрерывно работающем мембранном микрофильтрационном реакторе, с использованием керамического модуля.
200 литровый питающий резервуар смешения был связан с реакторным питающим насосом с 200 литровым реакторным резервуаром с температурным контролем. Используя насос с производительностью 0-20 л/час, смесь из реактора возвращается через APV, керамический модуль микрофильтрации для отделения глюкозы. Размер пор составлял 0,2 мкм и площадь мембраны составляла 0,2 м2.
Реактор работал в течение приблизительно 200 часов, используя дозировку 100 KNU/kg DS ЦГТазы T и 300 AGU/kg DS глюкоамилазы. Со средним временем удерживания в реакторе 35-45 часов система работала в устойчивом состоянии в течение полного периода, производя DP1 = 93% глюкозного сиропа с выходом, близким к 100%.
В реакторный резервуар было загружено 60 кг кукурузного крахмала типа Cerestar C x PHARM 03406, суспензированного в 140 л водопроводной городской воды при 58оC при перемешивании. Используя паровой наргевательный кожух, температура была доведена до 60оC. Используя 30% HCl значение pH было понижено от 6,1 до 4,5. pH был перепроверен (pH=4,5) через 15 минут. В нулевой момент времени, немедленно перед добавлением ферментов, ЦГТазы T (100 KNU/кг крахмала) и глюкоамилазы (300 AGU/кг крахмала) были взяты пробы для определения % объема осадка после центрифугирования при 3000 оборотах в минуту в течение 3 минут в настольной центрифуге. Кроме того, был измерен оBRIX супернатантов, используя рефрактометр. Процесс реакции сопровождался регулярными измерениями объемов отстоя и оBRIX супернатантов, как описано выше.
В питающий резервуар смешения было загружено 186 л холодной водопроводной городской воды и 80 кг кукурузного крахмала типа Cerestar C x PHARM 03406. В питающем смесителе поддерживалось аккуратное смешение, и pH был доведен до 4,8 с использованием 30% HCl. Температура поддерживалась в 7-8оC с использованием охлаждающей воды, и были добавлены ферменты ЦГТаза T (100 KNU/кг крахмала) и глюкоамилаза (300 AGU/кг крахмала). Низкая температура обеспечивала то, что никакая реакция не проходила.
Работа реактора была продолжена до тех пор, пока значения оBRIX после 30 часов стабилизировались около значения 27. Тогда была начата микрофильтрация, используя перепад давления 0,15 Бар и максимальную скорость остатка, чтобы обеспечить это давление. Фильтрат был возвращен в реакторный резервуар в первые 5,7 часов. После этого фильтрат был собран в отдельном резервуаре, и объем был измерен как функция от времени. С этого момента времени реакторный питающий насос был включен и был установлен по эквиваленту скорости потока к потоку фильтрата (л/мин). Таким способом объем в реакторном резервуаре был сохранен постоянным.
Подача суспензии крахмала была продолжена, в то время как образцы были взяты, как описано выше. Кроме того, были взяты образцы фильтратов. Любое уменьшение в потоке фильтрата было компенсировано увеличением потока остатка, посредством чего был разрушен осадок на фильтре на мембране. Таким образом, перепад давления был также увеличен. Образцы были взяты как функция от времени фильтрата для ВЭЖХ и оBRIX, так же как был измерен собранный объем. Одновременно образцы были взяты из реактора для того, чтобы измерить весь DS, осадок, оBRIX и ВЭЖХ для сахарного состава.
Испытание продолжалось 220 часов. В этот момент времени перепад давления был увеличен приблизительно до 0,4 бар.
Определение потока фильтрата (основанное на отдельных определениях) и средних значений потока фильтрата (объединенных) как функции времени процесса показало, что ферментативная система, состоящая только из ЦГТазы и глюкоамилазы, поддержала и обеспечила стабильность потоку в течение продолжительного времени обработки. Это подчеркивает потенциальные промышленные преимущества этой устойчивой системы.
Результаты и массовый баланс представлены в таблицах 16-18
Анализы собранных фильтратов
*Начало непрерывной подачи на реактор
Состав полученного сиропа
Массовый баланс для испытания по примеру 7
(t=28,75 час до t=174,5 час)
(t=28,75 час до t=174,5 час)
*Основано на расход субстрата при непрерывном процессе
По сравнению с испытанием, выполненным в простом резервуаре периодического действия с перемешиванием, было получено существенное сокращение времени реакции при использовании установки для гидролиза зернистого крахмала, описанного выше. Поскольку никаких проблем с вязкостью с 30% DS не возникло, то можно полагать выполнимым увеличение DS до 40%, или даже так высоко, как до 45% и все еще поддерживать беспрепятственную работу.
Пример 8
Этот пример сравнивает способ по изобретению и обычного способа производства топливного этанола или питьевого спирта из необработанного крахмала в виде сухой молотой кукрузы, Yellow Dent No. 2.
Суспензия 30% DS сухой молотой кукурузы была приготовлена из водопроводной воды в колбах с синей крышкой вместимостью 250 мл и необработанного кукурузного крахмала, подвергнутого одновременному холодному ожижению и предварительному осахариванию по способу изобретения. Суспензия была нагрета до 60оC на водяной бане с магнитной мешалкой, pH был установлен до 4,5 с использованием 30% HCl и были добавлены ЦГТаза T (75 KNU/кг DS) и глюкоамилаза (500 AGU/кг DS). После 48 часов колба была охлаждена на водяной бане до 32оC.
Суспензия 30% DS сухой молотой кукурузы была предварительно ожижена в обычном непрерывном процессе, состоящем из предварительного ожижения в емкости, струйной обработки, выпуска в емкость после ожижения. Альфа-амилаза из Bacillus была добавлена в течение предварительного ожижения при 70-90оC (10KNU/кг DS) и снова после ожижения при 85-90оC (20KNU/кг DS). Струйная обработка была выполнена при 115-120оC. Предварительное осахаривание было выполнено при нагревании пульпы в колбах c синей крышкой при 60оC на водяной бане с магнитной мешалкой. После того, как значение pH было установлено до 4,5 с использованием 30% HCl, была добавлена глюкоамилаза в эквивалентной дозировке 500 AGU/кг DS. После 48 часов колба была охлаждена на водяной бане при 32оC.
Ферментация была осуществлена непосредственно в колбах с синей крышкой, с дрожжевым замком, заполненными соевым маслом. Пекарские дрожжи (Saccharomyces cerevisiae) были добавлены в эквивалентном количестве 10 миллионов жизнеспособных дрожжевых клеток в мл, и питательные вещества для дрожжей в виде 0,25% мочевины были добавлены к каждой колбе. Каждая обработка была выполнена в 3 повторностях.
Ферментация контролировалась по потере CO2, как определялось взвешиванием колбы через равномерные интервалы. Объем EtOH/100кг зернового сухого вещества (DS) был рассчитан, используя следующую формулу:
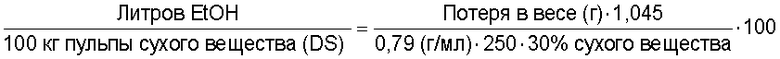
Пульпа содержала 30% вес./вес. сухого зернового вещества. 0,79 г/мл - плотность этанола.
В таблицах 19a и 19b показаны полученные результаты ферментации для повторностей, включая результаты статистической обработки двух типов необработанного сырья, подвергнутого испытаниям (недостающие результаты предполагаются интерполяцией).
Результаты ферментации по способу изобретения, с использованием ЦГТазы Т (75 KNU/кг DS) и глюкоамилазы (500 AGU/кг DS)
*предполагаемое значение
Результаты ферментации для обычного процесса, с использованием альфа-амилазы из Bacillus (10+20 KNU/кг DS) и глюкоамилазы (500 AGU/кг DS)
* предполагаемое значение
Использование моделируемого промышленного времени ферментации в интервале приблизительно 48-70 часов, эквивалентный или более высокий выход спирта был получен из пульпы, полученной по способу изобретения, чем могло бы быть получено из пульпы, полученной способом с большими затратами количества энергии, включающим две стадии горячего предожижения суспензии и струйной обработки.
Пример 9
Этот пример иллюстрирует преобразование гранулированной пшеницы и обычного кукурузного крахмала в глюкозу, используя ЦГТазу, глюкоамилазу и кислотную грибковую альфа-амилазу при 60оC.
Колбы или с 33% DS обычной кукурузным, или с пшеничным зернистым крахмалом были приготовлены и инкубированы, как описано в примере 1. В нулевой момент времени ферментные активности, приведенные в таблице 20, были дозированы к колбам. Образцы были отобраны после 24, 48, 72 и 96 часов и проанализированы, как описано в примере 1. Результаты показаны в таблице 21 и таблице 22.
Таблица 20
Активность ферментов, которые были использованы:
NU/г DS
AGU/г DS
AFAU/г DS
Таблица 21
Растворимое сухое вещество, как процент от общего количества сухого вещества, при использовании двух различных видов крахмала
Таблица 22
DX растворимого гидролизата, при использовании двух различных видов крахмала


















| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЗАТИРАНИЯ | 2007 |
|
RU2524413C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТОВ ФЕРМЕНТАЦИИ | 2008 |
|
RU2486235C2 |
| СПОСОБ ПОЛУЧЕНИЯ САХАРОВ И СИРОПОВ | 2014 |
|
RU2705243C2 |
| ВАРИАНТЫ ГЛЮКОАМИЛАЗЫ | 2006 |
|
RU2439153C2 |
| СПОСОБ ПИВОВАРЕНИЯ | 2009 |
|
RU2524118C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПИВНОГО СУСЛА | 2012 |
|
RU2600885C2 |
| ВАРИАНТЫ АЛЬФА-АМИЛАЗЫ TS-23 С ИЗМЕНЕННЫМИ СВОЙСТВАМИ | 2009 |
|
RU2526516C2 |
| ПОЛИПЕПТИД | 2007 |
|
RU2539776C2 |
| СПОСОБ ПРЕОБРАЗОВАНИЯ ГРАНУЛИРОВАННОГО КРАХМАЛА В ЭТАНОЛ | 2007 |
|
RU2460798C2 |
| Композиции для получения глюкозных сиропов | 2015 |
|
RU2706297C2 |
Изобретение относится к биотехнологии и пищевой промышленности и касается способа ферментативного гидролиза зернистого крахмала в растворимый гидролизат крахмала при температуре ниже, чем начальная температура желатинизации указанного зернистого крахмала. Способ предусматривает одновременное воздействие первого фермента, который является членом семейства 13 гликозидгидролазы, имеет альфа-1,4-глюкозидную гидролитическую активность и включает углеводсвязанный модуль семейства 20, и, по меньшей мере, одного второго фермента, который является бета-амилазой или глюкоамилазой. Изобретение позволяет проводить гидролиз крахмала с высокой степенью эффективности. 34 з.п. ф-лы, 24 табл.
первого фермента, который
(a) является членом семейства 13 гликозидгидролазы;
(b) имеет альфа-1,4-глюкозидную гидролитическую активность; и
(c) включает углевод-связанный модуль семейства 20, и по меньшей мере одного второго фермента, который является бета-амилазой (ЕС 3.2.1.2), или глюкоамилазой (ЕС 3.2.1.3).
| СПОСОБ ПОЛУЧЕНИЯ САХАРИСТЫХ ПРОДУКТОВ ИЗ РЖИ | 1995 |
|
RU2085590C1 |
| WO 9510627 A, 20.04.1995 | |||
| ITKOR P et al | |||
| ТЕЛЕФОННЫЙ АППАРАТ | 1923 |
|
SU1018A1 |
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
Авторы
Даты
2008-01-27—Публикация
2003-02-10—Подача