В настоящем описании приводится ссылка на предварительные заявки на патент США регистрационные №№ 60/485413, 60/485539 и 60/485616, поданные 7 июля 2003. Также приводится ссылка на международные заявки PCT/US2004/021723 и PCT/US2004/021739, поданные 7 июля 2004. с указанием США (заявитель: Genencor International, Inc). Кроме того, приводится ссылка на заявки США на полезную модель регистрационные №№ 10/886905 и 10/866903, также поданные 7 июля 2004.
Также приводится ссылка на предварительную заявку на патент США регистрационный № 60/608919 (поданную 7 июля 2004., как заявка США на полезную модель регистрационный № 10/887056, но преобразованную в предварительную заявку 15 сентября 2004.). Также приводится ссылка на предварительную заявку на патент США регистрационный № 60/612407, поданную 22 сентября 2004.
Кроме того, приводится ссылка на заявку США регистрационный № 60/485539, поданную 7 июля 2003. Также приводится ссылка на международную заявку PCT/IB2004/002487, поданную 7 июля 2004. с указанием США (заявитель: Danisco A/S). Также приводится ссылка на заявку США на полезную модель регистрационный № 10/886023, поданную 7 июля 2004.
Также приводится ссылка на заявки США на полезную модель с регистрационными №№ 10/886505, 10/886527 и 10/886,504, каждая из которых была подана 7 июля 2004. Также приводится ссылка на заявку США на полезную модель регистрационный № 10/947612, поданную 22 сентября 2004.
Также приводится ссылка на международную патентную заявку регистрационный № PCT/GB2005/002675, поданную 7 июля 2005. с указанием США (заявители: Danisco A/S & Genencor International, Inc, D Young & Co Attorney Reference: P020161WO). Также приводится ссылка на предварительную заявку США регистрационный № 60/697302, поданную 7 июля 2005.
Вышеуказанные заявки и каждый из документов, цитируемых или упомянутых в настоящем описании и в каждой из вышеуказанных заявок, включая рассматриваемые заявки («документы, цитируемые в заявке и статье»), и любые инструкции производителей, или каталоги любых продуктов, цитируемые или упоминаемые в каждой из указанных заявок и статей и в любом документе, цитируемом в указанной заявке и статье, включены в настоящее описание посредством ссылки. Кроме того, все документы, цитируемые в настоящем описании и все документы, цитируемые или упоминаемые в документах, цитируемых в настоящем описании, и любые инструкции производителей или каталоги любых продуктов, цитируемые или упоминаемые в настоящей заявке или в любом документе, цитируемом в данной заявке, включены в настоящее описание посредством ссылки. Документы, включенные в настоящее описание посредством ссылки или любая имеющаяся там информация, могут быть использованы для осуществления настоящего изобретения. Документы, включенные в настоящее описание посредством ссылки, не рассматриваются как прототипы.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к полипептидам, а в частности, к полипептидам амилазы и к нуклеиновым кислотам, кодирующим эти полипептиды, а также к их применению в качестве не-мальтогенных экзоамилаз в целях получения пищевых продуктов. Амилазы согласно изобретению были сконструированы так, чтобы они обладали улучшенными свойствами. В частности, амилазы согласно изобретению обладают измененной экзоспецифичностью и/или измененной термостабильностью. В частности, указанные полипептиды происходят от полипептидов, обладающих не-мальтогенной экзоамилазной активностью, а в частности, глюкан-1,4-альфа-мальтотетрагидролазной (EC 3.2.1.60) активностью.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Амилазы с улучшенными свойствами позволяют решить проблемы, возникающие при осуществлении некоторых процессов, таких как выпекание. Кристаллизация амилопектина происходит в крахмальных гранулах через несколько дней после выпекания, что приводит к ускорению уплотнения и черствения хлеба. После черствения, мякиш хлеба теряет свою мягкость и влагу. В результате этого мякиш становится менее эластичным, и хлеб покрывается кожистой коркой.
Ферментативный гидролиз (например, под действием амилаз) боковых цепей амилопектина может приводить к снижению степени кристаллизации и к снижению степени черствения. Кристаллизация зависит от длины боковых цепей амилопектина, а именно, чем длиннее боковые цепи, тем выше степень кристаллизации. Большинство крахмальных гранул состоит из смеси двух полимеров: амилопектина и амилозы, в которой примерно 75% составляет амилопектин. Амилопектин представляет собой очень крупную разветвленную молекулу, состоящую из цепей α-D-глюкопиранозильных звеньев, связанных (1-4)-связями, где указанные цепи присоединены друг к другу посредством α-D-(l-6)-связей с образованием ответвлений. Амилоза представляет собой линейную цепь α-D-глюкопиранозильных звеньев, связанных (1-4)-связями и имеющих несколько α-D-(l-6)-ответвлений.
Мучные хлебобулочные изделия, такие как белый хлеб; хлеб, выпекаемый из просеянной ржаной муки и пшеничной муки, и булочки, выпекают из теста в печи при температуре 180°С - 250°С в течение примерно 15-60 минут. В процессе выпекания, на внешних слоях теста, где образуется корочка выпеченного продукта, в основном, происходит резкое снижение температуры (200→120°С). Однако, по окончании процесса выпекания, из-за образования пара, температура мякиша, составляет всего лишь 100°С. При температуре примерно выше 85°С может происходить инактивация фермента, и такой фермент не будет обладать свойствами, препятствующими черствению. Таким образом, лишь термостабильные амилазы обладают способностью эффективно модифицировать крахмал в процессе выпекания.
Эндоамилазная активность может негативно влиять на качество готового хлебобулочного изделия, а именно, приводить к образованию липкого или клейкого мякиша из-за накопления декстринов с разветвенной цепью. Предпочтительной является экзоамилазная активность, поскольку она позволяет осуществлять желаемую модификацию крахмала, что приводит к замедлению черствения, при этом, экзоамилазная активность дает меньше негативных эффектов, чем эндоамилазная активность. Снижение эндоамилазной активности может приводить к повышению экзоспецифичности, что, в свою очередь, позволяет снижать уровень разветвленных декстринов и получать хлеб лучшего качества.
ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к полипептиду варианта PS4, заявленному в формуле изобретения. Настоящее изобретение также относится к применению такого полипептида варианта PS4, который может быть включен в пищевые добавки, пищевые продукты, хлебобулочные изделия, композиции с улучшенными свойствами, продуктов питания, включая корма для животных и т.п., и использован в качестве пищевых добавок, где указанное применение заявлено в формуле изобретения. Настоящее изобретение относится к нуклеиновым кислотам, кодирующим и связанным с полипептидами варианта PS4, заявленными в формуле изобретения. В формуле изобретения также заявлены способы получения таких полипептидов вариантов PS4, а также другие аспекты настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
На фиг.1 представлен пример кривой, полученный с помощью анализатора консистенции.
На фиг.2 представлены результаты эксперимента по определению термостабильности описанных в настоящем описании полипептидов варианта PS4. Ось Х: температура, ось Y: время полужизни (минуты). Ромбы: pSac-D34/pMD3 (SEQ ID NO: 2), квадраты: pSac-pMD229 (SEQ ID NO: 13), треугольники: pSac-pMS382 (SEQ ID NO: 21).
На фиг.3 представлены результаты пробной выпечки, где тестируют плотность хлеба, обработанного различными концентрациями полипептида варианта PS4, и плотность необработанного хлеба. На оси Х отложено число дней, а на оси Y отложена плотность, выраженная в ГПа (см. пример 13). Ромб: 20000 бетамиловых звеньев/кг pSac-pMS382. Квадрат: 40000 бетамиловых звеньев/кг pSac-pMS382. Треугольник: 60000 бетамиловых звеньев/кг pSac-pMS382. Крестик: контроль (без фермента).
На фиг.4 представлены результаты пробной выпечки, где тестируют упругость хлеба, обработанного различными концентрациями полипептида варианта PS4, и упругость необработанного хлеба. На оси Х отложено число дней, а на оси Y отложена упругость, выраженная в единицах упругости (см. пример 14). Ромб: 20000 бетамиловых звеньев/кг pSac-pMS382. Квадрат: 40000 бетамиловых звеньев/кг pSac-pMS382. Треугольник: 60000 бетамиловых звеньев/кг pSac-pMS382. Крестик: контроль (без фермента).
На фиг.5 представлены результаты пробной выпечки, где тестируют слипаемость хлеба, обработанного различными концентрациями полипептида варианта PS4, и слипаемость необработанного хлеба. На оси Х отложено число дней, а на оси Y отложена слипаемость, выраженная в единицах слипаемости (см. пример 15). Ромб: 20000 бетамиловых звеньев/кг pSac-pMS382. Квадрат: 40000 бетамиловых звеньев/кг pSac-pMS382. Треугольник: 60000 бетамиловых звеньев/кг pSac-pMS382. Крестик: контроль (без фермента).
На фиг.6 представлены результаты пробной выпечки, где тестируют плотность хлеба, обработанного полипептидом варианта PS4 с заменой в положении 307. На оси Х отложено число дней, а на оси Y отложена плотность, выраженная в ГПа (см. пример 13). Ромб: контроль (без фермента). Квадрат: 60000 бетамиловых звеньев/кг pSac-D34/pMD3 (SEQ ID NO:2). Треугольник: 60000 бетамиловых звеньев/кг pSac-pMD229 (SEQ ID NO:13). Крестик: 60000 бетамиловых звеньев/кг pSac-pMS382.
На фиг.7 представлены результаты пробной выпечки, где тестируют упругость хлеба, обработанного полипептидом варианта PS4 с заменой в положении 307. На оси Х отложено число дней, а на оси Y отложена упругость, выраженная в единицах упругости (см. пример 14). Ромб: контроль (без фермента). Квадрат: 60000 бетамиловых звеньев/кг pSac-D34/pMD3 (SEQ ID NO:2). Треугольник: 60000 бетамиловых звеньев/кг pSac-pMD229 (SEQ ID NO:13). Крестик: 60000 бетамиловых звеньев/кг pSac-pMS382.
На фиг.8 представлены результаты пробной выпечки, где тестируют слипаемость хлеба, обработанного полипептидом варианта PS4 с заменой в положении 307. На оси Х отложено число дней, а на оси Y отложена слипаемость, выраженная в единицах слипаемости (см. пример 15). Ромб: контроль (без фермента). Квадрат: 60000 бетамиловых звеньев/кг pSac-D34/pMD3 (SEQ ID NO:2). Треугольник: 60000 бетамиловых звеньев/кг pSac-pMD229 (SEQ ID NO:13). Крестик: 60000 бетамиловых звеньев/кг pSac-pMS382.
Фиг.9. Тест на сворачиваемость лепешек, проводимый через 8 дней после выпекания лепешек с 400 м.д. NovamylTM 1500 и 50 BMK/кг pSac-pMS382 (SEQ ID NO: 21).
Фиг.10. Тест на сворачиваемость лепешек, проводимый через 8 дней после выпекания лепешек с 400 м.д. NovamylTM 1500 и 50 BMK/кг pSac-pMS382 (SEQ ID NO: 21).
Фиг.11. Тест на плотность тостов (США), приготовленных с SSM 471 B10 (SEQ ID NO: 27) и SSM 471 C04 (SEQ ID NO: 29).
Фиг.12. Тест на упругость тостов (США), приготовленных с SSM 471 B10 (SEQ ID NO: 27) и SSM 471 C04 (SEQ ID NO: 29).
Фиг.13. Тест на упругость тостов (США), приготовленных с pMS370 (SEQ ID NO: 31) и SSM 471 C04 (SEQ ID NO: 29).
Фиг.14. Анализ остающейся активности после теплового воздействия для вариантов с различными заменами в положении 307.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 представляет собой исходную последовательность PS4, происходящую от аминокислотной последовательности мальтотетрагидролазы Pseudomonas saccharophila. SEQ ID NO: 2 представляет собой последовательность pSac-D34, то есть, аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila с 11 заменами и делецией крахмал-связывающего домена. SEQ ID NO: 3 представляет собой последовательность pSac-D20, то есть, аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila с 13 заменами и делецией крахмал-связывающего домена. SEQ ID NO:4 представляет собой последовательность pSac-D14, то есть, аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila с 14 заменами и делецией крахмал-связывающего домена. SEQ ID NO: 5 представляет собой предшественник глюкан-1,4-альфа-мальтотетрагидролазы (EC 3.2.1.60) (G4-амилаза) (мальтотетраозо-образующая амилаза) (экзомальтотетрагидролаза) (мальтотетраозо-образующая экзоамилаза) Pseudomonas saccharophila, SWISS-PROT, регистрационный № P22963. SEQ ID NO: 6 представляет собой ген mta P. saccharophila, кодирующий мальтотетрагидролазу (номер по EC=3.2.1.60), GenBank, регистрационный № X16732. SEQ ID NO:7 представляет собой исходную последовательность PS4, происходящую от аминокислотной последовательности мальтотетрагидролазы Pseudomonas stutzeri. SEQ ID NO: 8 представляет собой последовательность PStu-D34, т.е. аминокислотную последовательность мальтотетрагидролазы Pseudomonas stutzeri с 9 заменами. SEQ ID NO: 9 представляет собой последовательность PStu-D20, т.е. аминокислотную последовательность мальтотетрагидролазы Pseudomonas stutzeri с 11 заменами. SEQ ID NO: 10 представляет собой последовательность PStu-D14, т.е. аминокислотную последовательность мальтотетрагидролазы Pseudomonas stutzeri с 12 заменами. SEQ ID NO: 11 представляет собой последовательность Pseudomonas stutzeri {Pseudomonas perfectomarina), предшественник глюкан-1,4-альфа-мальтотетрагидролазы (EC 3.2.1.60) (G4-амилаза) (мальтотетраозо-образующая амилаза) (экзомальтотетрагидролаза)(мальтотетраозо-образующая экзоамилаза), SWISS-PROT, регистрационный № P13507. SEQ ID NO: 12 представляет собой ген мальтотетраозо-образующей амилазы (amyP) P.stutzeri, полноразмерные кодирующие последовательности, GenBank, регистрационный № M24516.
SEQ ID NO: 13 представляет собой аминокислотную последовательность pSac-pMD229, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272Q, 303E, 307L, 309P и 334P. SEQ ID NO: 14 представляет собой последовательность нуклеиновой кислоты pSac-pMD229. SEQ ID NO: 15 представляет собой аминокислотную последовательность pSac-pMD248, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 145D, 146G, 157L, 178F, 179T, 223E, 229P, 272Q, 303E, 307L и 334P. SEQ ID NO: 16 представляет собой последовательность нуклеиновой кислоты pSac-pMD248. SEQ ID NO: 17 представляет собой аминокислотную последовательность pSac-pMD253, имеющую мутации 33Y, 34N, 121D, 134R, 141P, 146G, 157L, 178F, 179T, 223E, 229P, 272Q, 303E, 307L, 309P и 334P. SEQ ID NO: 18 представляет собой последовательность нуклеиновой кислоты pSac-pMD253. SEQ ID NO: 19 представляет собой аминокислотную последовательность pSac- pMD271, имеющую мутации 3S, 33Y, 34N, 70D, 121D, 134R, 141P, 146G, 157L, 178F, 179T, 223E, 229P, 272Q, 303E, 307L, 309P и 334P. SEQ ID NO: 20 представляет собой последовательность нуклеиновой кислоты pSac-pMD271.
SEQ ID NO: 21 представляет собой аминокислотную последовательность pSac-pMS382, имеющую мутации 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K, 309P и 334P. SEQ ID NO: 22 представляет собой нуклеотидную последовательность pSac-pMS382. SEQ ID NO: 23 представляет собой аминокислотную последовательность pSac-pMS382R, имеющую мутации 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307R, 309P и 334P. SEQ ID NO: 24 представляет собой нуклеотидную последовательность pSac-pMS382R. SEQ ID NO: 25 представляет собой аминокислотную последовательность pSac-pMS382H, имеющую мутации 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 309P и 334P. SEQ ID NO: 26 представляет собой нуклеотидную последовательность pSac-pMS382H.
SEQ ED NO: 27 представляет собой аминокислотную последовательность SSM471 Bl0, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272Q, 303E, 307R, 309P и 334P. SEQ ED NO: 28 представляет собой последовательность нуклеиновой кислоты SSM471 Bl0. SEQ ED NO: 29 представляет собой аминокислотную последовательность SSM471 C04, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272Q, 303E, 307K, 309P и 334P. SEQ ID NO: 30 представляет собой последовательность нуклеиновой кислоты SSM471 C04. SEQ ED NO: 31 представляет собой аминокислотную последовательность PMS 370, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272Q, 303E, 309P и 334P. SEQ ID NO: 32 представляет собой последовательность нуклеиновой кислоты PMS 370.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем описании и в примерах, если это не указано иначе, дозы полипептидов варианта PS4 даны в миллионных долях (мкг/г) муки. Так, например, "1 D34" означает 1 миллионную долю pSac-D34 (масс./масс.). Уровни или количества ферментов, предпочтительно, определяют исходя из анализов на активность как эквивалента чистого ферментного белка, измеренного с использованием альбумина бычьей сыворотки (BSA) в качестве стандарта, где указанный анализ описан у Брэдфорда (1976, A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72:248-254).
В описании настоящего изобретения, различные варианты полипептидов варианта PS4, которые были получены в соответствии с настоящим изобретением или которые рассматриваются в настоящем изобретении, имеют следующие номенклатурные названия, принятые для простоты ссылок, где:
(i) замену обозначают числом и буквой, например, 141P означает [положение аминокислоты в соответствии с выбранной системой нумерации/замененную аминокислоту]. В соответствии с этим, например, замена аминокислоты пролином в положении 141 обозначается 141P;
(ii) замену обозначают буквой, числом и буквой, например, А141P означает [исходную аминокислоту/положение аминокислоты в соответствии с выбранной системой нумерации/замененную аминокислоту]. В соответствии с этим, например, замена аланина пролином в положении 141 обозначается A141P.
Если в конкретном положении могут присутствовать два или более заместителя, то они обозначаются двумя буквами подряд, которые могут быть, но необязательно, разделены косой чертой «/», например, G303ED или G303E/D. Если релевантная аминокислота в конкретном положении может быть заменена любой аминокислотой, то это может быть выражено как [положение этой аминокислоты в соответствии с выбранной системой нумерации/Х], например, 121X.
Множественные мутации могут быть обозначены разделяющими знаками, такими как косая черта «/», например, A141P/G223A или запятая, «,», например, A141P, G223A представляют собой мутации в положении 141 и 223, где аланин заменен пролином, а глицин заменен аланином, соответственно.
Если не указано иначе, то все описанные в настоящем описании технические и научные термины имеют общепринятые значения, понятные специалисту в данной области, к которой относится настоящее изобретение. В публикации Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994), and Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, NY (1991) приводится общий словарь многих терминов, употребляемых в настоящем изобретении. Хотя для осуществления настоящего изобретения или для проведения тестов в соответствии с настоящим изобретением могут быть применены любые методы и материалы, аналогичные или эквивалентные описанным в настоящем описании методам и материалам, однако в настоящем изобретении описаны предпочтительные методы и материалы. Численные интервалы включают числа, определяющие пределы данного интервала. Если не указано иначе, то последовательности нуклеиновых кислот считываются слева направо в направлении 5'→3', а аминокислотные последовательности считываются слева направо в направлении от амино-конца до карбокси-конца, соответственно.
В настоящем изобретении, если не указано иначе, могут быть применены стандартные химические методы, молекулярной биологии, микробиологии, рекомбинантных ДНК и иммунологии, которые известны специалисту в данной области. Такие методы подробно описаны в литературе. См., например, руководства J. Sambrook, E. F. Fritsch & T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press; Ausubel, F. M. et al. (1995 и приложения к периодическим изданиям; Current Protocols in Molecular Biology, ch. 9, 13, and 16, John 235 Wiley & Sons, New York, N.Y.); B. Roe, J. Crabtree, and A. Kahn, 1996, DNA Isolation and Sequencing: Essential Techniques, John Wiley & Sons; J. M. Polak and James O'D. McGee, 1990, In Situ Hybridization: Principles and Practice; Oxford University Press; M. J. Gait (Editor), 1984, Oligonucleotide Synthesis: A Practical Approach, IrI Press; D. M. J. Lilley and J. E. Dahlberg, 1992, Methods of Enzymology: DNA Structure Part A: Synthesis and Physical Analysis of DNA Methods in Enzymology, Academic Press; Using Antibodies: A Laboratory Manual: Portable Protocol NO. I by Edward Harlow, David Lane, Ed Harlow (1999, Cold Spring Harbor Laboratory Press, ISBN 0-87969-544-7); Antibodies: A Laboratory Manual by Ed Harlow (Editor), David Lane (Editor) (1988, Cold Spring Harbor Laboratory Press, ISBN 0-87969-314-2), 1855, Lars-Inge Larsson "Immunocytochemistry: Theory and Practice", CRC Press inc., Baca Raton, Florida, 1988, ISBN 0-8493-6078-1, John D. Pound (ed); "Immunochemical Protocols, vol 80", in the series: "Methods in Molecular Biology", Humana Press, Totowa, New Jersey, 1998, ISBN 0-89603-493-3, Handbook of Drug Screening, edited by Ramakrishna Seethala, Prabhavathi B. Fernandes (2001, New York, NY, Marcel Dekker, ISBN 0-8247-0562-9); and Lab Ref: A Handbook of Recipes, Reagents, and Other Reference Tools for Use at the Bench, Edited Jane Roskams and Linda Rodgers, 2002, Cold Spring Harbor Laboratory, ISBN 0-87969-630-3. Общее содержание каждой из этих публикаций включены в настоящее описание посредством ссылки.
Все патенты и публикации, включая все последовательности, описанные в указанных патентах и публикациях, полностью включены в настоящее описание посредством ссылки.
Полипептиды варианта PS4
Настоящее изобретение относится к полипептиду, имеющему замену в одном или нескольких положениях, сообщающую измененное свойство, которое может представлять собой любую комбинацию измененной экзоспецифичности или измененной термостабильности, или измененное технологическое свойство, по сравнению со свойствами родительского фермента. В настоящей заявке, такие полипептиды для удобства будут называться «полипептидами варианта PS4».
Полипептиды варианта PS4, предпочтительно, обладают ферментативной активностью. Более предпочтительно, полипептиды варианта PS4 обладают амилазной активностью, предпочтительно, экзоамилазной активностью. В особенно предпочтительных вариантах изобретения, полипептиды варианта PS4 обладают не-мальтогенной экзоамилазной активностью.
Кроме того, настоящее изобретение относится к композициям, включая пищевые добавки, пищевые продукты, хлебобулочные изделия, улучшенные композиции, корма, включая корма для животных и т.п., содержащие указанные полипептиды варианта PS4, предпочтительно, полипептиды, обладающие не-мальтогенной экзоамилазной активностью, а также к способам получения таких полипептидов и композиций и к их применению.
Как указывалось выше, полипептиды варианта PS4 могут обладать одним или несколькими улучшенными технологическими свойствами, предпочтительно, улучшенными хлебопекарными свойствами. Так, например, полипептидами варианта PS4 являются такие полипептиды, которые при обработке ими пищевых продуктов, сообщают этим продуктам одно или несколько из следующих свойств (предпочтительно, все эти свойства), пониженную плотность мякиша, более высокую упругость, более высокую слипаемость, пониженную раскрашиваемость или более высокую сворачиваемость. Такие улучшенные технологические или хлебопекарные свойства, сообщаемые полипептидами варианта PS4, более подробно описаны ниже.
Настоящее изобретение относится к обработке пищевых продуктов указанными полипептидами, в частности, таких продуктов, как тесто и хлебобулочные изделия, в результате чего они приобретают желаемые свойства, указанные выше.
Настоящее изобретение относится к другим применениям таких композиций, например, для получения детергентов, таких как подсластители, сиропы и т.п. Эти композиции включают полипептид в сочетании по меньшей мере с одним другим компонентом. В частности, настоящее изобретение относится к пищевым или кормовым добавкам, содержащим указанные полипептиды.
Такие полипептиды и нуклеиновые кислоты отличаются от их родительских последовательностей тем, что они включают ряд мутаций. Другими словами, последовательность полипептида варианта PS4 или нуклеиновой кислоты, кодирующей такой полипептид, отличается от родительской последовательности в различных положениях или остатках. В предпочтительных вариантах изобретения, мутациями являются аминокислотные замены, то есть, замены одного аминокислотного остатка другим остатком. Таким образом, полипептиды варианта PS4 включают ряд замен природных аминокислотных остатков в одном или нескольких положениях родительской последовательности.
Под используемым в настоящем описании термином «вариант» следует подразумевать молекулу, происходящую от родительской молекулы. Вариантами являются полипептиды, а также нуклеиновые кислоты. Варианты включают делеции, инсерции и замены на аминокислотном уровне, а также трансверсии, транзиции и инверсии на уровне нуклеиновых кислот и т.п. в одном или нескольких положениях. Варианты также включают усечения. Вариантами являются гомологичные и функциональные производные родительских молекул. Вариантами являются последовательности, комплементарные последовательностям, способным гибридизоваться с представленными в настоящем описании нуклеотидными последовательностями.
Мутации основных остатков в положении 307
Настоящее изобретение относится к полипептидам варианта PS4, имеющим изменения в последовательности, содержащие аминокислотные замены в последовательности амилазы, предпочтительно, экзоамилазы, а более предпочтительно, последовательности не-мальтогенной экзоамилазы.
В частности, настоящее изобретение относится к полипептиду варианта PS4, происходящему от родительского полипептида, обладающего не-мальтогенной экзоамилазной активностью и имеющего аминокислотную мутацию в положении 307 по сравнению с положением последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1. Заменой в положении 307 предпочтительно, является замена основной или положительно заряженной аминокислотой, предпочтительно, лизином (K) или аргинином (R).
В одном из вариантов, настоящее изобретение относится к полипептиду варианта PS4, в котором аминокислотной заменой в положении 307 является замена лизином (307K), предпочтительно, H307K. В другом варианте, настоящее изобретение относится к полипептиду варианта PS4 по п.1 или 2 формулы изобретения, где аминокислотной заменой в положении 307 является замена аргинином (307R), предпочтительно, H307R.
Полипептид варианта PS4 может также иметь мутацию в положении 70, а именно замену аспаргиновой кислотой (D), предпочтительно, 70D. В предпочтительных вариантах изобретения, указанной заменой является G70D. В соответствии с этим, в некоторых вариантах, настоящее изобретение относится к полипептиду варианта PS4, содержащему замены G70D, H307K или G70D, H307R по сравнению с последовательностью экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1.
Остатки в положениях 272 и 303 могут представлять собой остатки «дикого типа», либо они могут быть мутированными. В предпочтительных вариантах изобретения, остатком в положении 272 является остаток дикого типа, то есть, гистидин (H). Предпочтительным остатком в положении 303 также является остаток дикого типа, то есть, глицин (G). Поэтому настоящее изобретение относится к полипептиду варианта PS4, содержащему замены G70D и H307K, где указанным остатком в положении 272 является H, а остатком в положении 303 является G, либо замены G70D и H307R, где остатком в положении 272 является H, а остатком в положении 303 является G, по сравнению с последовательностью экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1.
Такие полипептиды варианта и другие варианты, описанные в настоящей заявке, называются «полипептидами варианта PS4». В настоящей заявке также описаны нуклеиновые кислоты, кодирующие такие полипептиды варианта, и для удобства, эти нуклеиновые кислоты называются здесь «нуклеиновыми кислотами варианта PS4». Полипептиды и нуклеиновые кислоты варианта PS4 более подробно описаны ниже.
«Родительские» последовательности, то есть, последовательности, на основе которых получены полипептиды и нуклеиновые кислоты варианта PS4, предпочтительно, представляют собой полипептиды, обладающие не-мальтогенной экзоамилазной активностью. Термины «родительские ферменты» и «родительские полипептиды» должны быть интерпретированы соответствующим образом, и означают ферменты и полипептиды, на основе которых были получены полипептиды варианта PS4. Такие ферменты и полипептиды более подробно описаны ниже.
Мутации и аминокислотные замены могут быть внесены в любой подходящий остов или каркас полипептида, который представляет собой полипептид дикого типа или мутированный полипептид, как более подробно описано ниже.
В особенно предпочтительных вариантах изобретения, родительскими последовательностями являются не-мальтогенные экзоамилазные ферменты, предпочтительно, бактериальные не-мальтогенные экзоамилазные ферменты. В наиболее предпочтительных вариантах изобретения, родительская последовательность содержит глюкан-1,4-альфа-мальтотетрагидролазу (EC 3.2.1.60). При этом, предпочтительно, чтобы родительская последовательность происходила от Pseudomonas species, например, от Pseudomonas saccharophilia или Pseudomonas stutzeri.
В некоторых вариантах изобретения, родительский полипептид содержит последовательность не-мальтогенной экзоамилазы дикого типа, например, Pseudomonas spp., или является гомологичным этой последовательности.
Так, например, родительский полипептид может содержать последовательность не-мальтогенной экзоамилазы Pseudomonas saccharophilia, представленную в SEQ ID NO: 1. В других предпочтительных вариантах изобретения, родительский полипептид содержит последовательность не-мальтогенной экзоамилазы Pseudomonas stutzeri, представленную в SEQ ID NO: 11, или последовательность не-мальтогенной экзоамилазы Pseudomonas stutzeri, имеющую регистрационный номер P13507 в SWISS-PROT.
С другой стороны, родительским полипептидом может быть вариант любой из последовательностей дикого типа, то есть, можно сказать, что родительский полипептид сам может быть сконструирован, либо он может содержать полипептид варианта PS4.
В предпочтительных вариантах изобретения, мутации и замены были внесены в последовательность PS4, которая уже содержала мутации, предпочтительно, pMD 229 (SEQ ID NO: 13 или 14).
Для специалиста в данной области очевидно, что хотя полипептиды варианта PS4 могут быть получены в результате мутаций уже мутированных последовательностей, однако такие полипептиды варианта PS4 могут быть сконструированы исходя из последовательности дикого типа (или фактически любой подходящей последовательности), путем идентификации различий между исходной последовательностью и нужным вариантом, и введения требуемых мутаций в исходную последовательность с получением желаемого варианта.
В настоящей заявке, белки и нуклеиновые кислоты, родственные последовательность не-мальтогенной экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1, или последовательность не-мальтогенной экзоамилазы Pseudomonas stutzeri, представленной в SEQ ID NO: 11, либо, предпочтительно, имеющие указанные последовательности или функционально гомологичные этим последовательностям, называются членами «семейства PS4». Примеры не-мальтогенных экзоамилазных ферментов «семейства PS4», подходящих для их применения в целях получения полипептидов и нуклеиновых кислот варианта PS4 более подробно описаны ниже.
Полипептиды варианта PS4, описанные в настоящей заявке, предпочтительно, сохраняют отличительные признаки родительских полипептидов, и кроме того, предпочтительно, обладают дополнительными полезными свойствами, например, повышенной активностью или термостабильностью, либо резистентностью к изменению pH или любыми комбинациями таких свойств (предпочтительно, всеми свойствами). Эти варианты более подробно описаны ниже.
Описанные в настоящей заявке мутанты PS4 с заменами могут быть использованы в любых подходящих целях. Предпочтительно, они могут быть использованы в любых случаях, где подходящим является родительский фермент. В частности, они могут быть применены в любых случаях, где используется экзомальтотетрагидролаза. В наиболее предпочтительных вариантах изобретения, они могут обладать дополнительными преимуществами, а именно, повышенной термостабильностью, или повышенной экзоамилазной активностью, или повышенной стабильностью к изменению рН или любыми их комбинациями. Примерами подходящих применений полипептидов и нуклеиновых кислот варианта PS4 являются их применение для получения пищевых продуктов, а в частности, в хлебопекарной промышленности и в производстве кормов, а также другие применения, подробно описанные ниже.
Полипептиды варианта PS4 могут содержать одну или несколько дополнительных мутаций помимо мутаций в положениях, представленных выше. Помимо уже имеющихся замен, могут присутствовать одна, две, три, четыре, пять, шесть, семь или более мутаций, предпочтительно, замен. Могут быть также внесены и другие мутации, такие как делеции, инсерции и замены на аминокислотном уровне, а также трансверсии, транзиции и инверсии на уровне нуклеиновых кислот и т.п. в одном или нескольких других положениях, описанных ниже. Кроме того, варианты PS4 не должны обязательно иметь все замены в перечисленных положениях. Действительно, у них могут отсутствовать одна, две, три, четыре или пять замен, то есть, в таких положениях могут присутствовать аминокислотные остатки дикого типа.
Другие мутации
Положения 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 и/или 334
В предпочтительных вариантах изобретения, полипептид варианта PS4 может содержать одну или несколько дополнительных мутаций в других сайтах или положениях его последовательности.
Так, например, полипептид варианта PS4 может также содержать одну или несколько мутаций, выбранных из группы, состоящей из положений: 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334. Остатками в этих положениях могут быть, предпочтительно, 33Y5 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K, 309P или 334P.
Следовательно, полипептид варианта PS4, помимо 307K/R/H, может содержать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или все 15 мутаций в положениях 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334. В указанных вариантах изобретения, остатком в положении 307 может быть гистидин (Н), а в частности, если такие дополнительные мутации присутствуют.
Следовательно, полипептид варианта PS4, помимо 307K/R/H, может содержать 1 дополнительную мутацию в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в "Приложении A: 1 мутация", т.е. 33Y; 34N; 70D; 121F; 134R; 141P; 146G; 157L; 161A; 178F; 179T; 223E; 229P; 309P; или 334P.
Другими словами, полипептид варианта PS4 может содержать любую из следующих мутаций: 33Y, 307K/R/H; 34N, 307K/R/H; 70D, 307K/R/H; 121F, 307K/R/H; 134R, 307K/R/H; 141P, 307K/R/H; 146G, 307K/R/H, 157L, 307K/R/H; 161 A, 307K/R/H; 178F, 307K/R/H; 179T, 307K/R/H; 223E, 307K/R/H; 229P, 307K/R7H; 309P, 307K/R/H; или 334P, 307K/R/H.
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 2 дополнительных мутации в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в "Приложении A: 2 мутации", т.е. 33Y,34N; 33Y,70D; 33Y,121F; 33Y,34R; 33Y,141P; 33Y,146G; 33Y,157L; 33Y,61A; 33Y,178F; 33Y,179T; 33Y,223E; 33Y,229P; 33Y,309P; 33Y,334P; 34N,70D; 34N,121F; 34N,134R; 34N,141P; 34N,146G; 34N,157L; 34N,161A; 34N,178F; 34N,179T; 34N,223E; 34N,229P; 34N,309P; 34N,334P; 70D,121F; 70D,134R; 70D,141P; 70D,146G; 70D,157L; 70D,161A; 70D,178F; 70D,179T; 70D,223E; 70D,229P; 70D,309P; 70D,334P; 121F,134R; 121F,141P; 121F,146G; 121F,157L; 121F,161A; 121F,178F; 121F,179T; 121F,223E; 121F,229P; 121F,309P; 121F,334P; 134R,141P; 134R,146G; 134R,157L; 134R,161A; 134R,178F; 134R,179T; 134R,223E; 134R,229P; 134R,309P; 134R,334P; 141P,146G; 141P,157L; 141P,161A; 141P,178F; 141P,179T; 141P,223E; 141P,229P; 141P,309P; 141P,334P; 146G,157L; 146G,161A; 146G,178F; 146G,179T; 146G,223E; 146G,229P; 146G,309P; 146G,334P; 157L,161A; 157L,178F; 157L,179T; 157L,223E; 157L,229P; 157L,309P; 157L,334P; 161A,178F; 161A,179T; 161A,223E; 161A,229P; 161A,309P; 161A,334P; 178F,179T; 178F,223E; 178F,229P; 178F,309P; 178F,334P; 179T,223E; 179T,229P; 179T,309P; 179T,334P; 223E,229P; 223E,309P; 223E,334P; 229P,309P; 229P,334P; или 309P,334P.
Другими словами, полипептид варианта PS4 может содержать любую из следующих мутаций: 33Y,34N,307K/R/H; 33Y,70D,307K/R/H; 33Y,121F,307K/R/H; 33Y,134R,307K/R/H; 33Y,141P,307K/R/H; 33Y,146G,307K/R/H; 33Y,157L,307K/R/H; 33Y,161A,307K/R/H; 33Y,178F,307K/R/H; 33Y,179T,307K/R/H; 33Y,223E,307K/R/H; 33Y,229P,307K/R/H; 33Y,309P,307K/R/H; 33Y,334P,307K/R/H; 34N,70D,307K/R/H; 34N,121F,307K/R/H; 34N,134R,307K/R/H; 34N,141P,307K/R/H; 34N,146G,307K/R/H; 34N,157L,307K/R/H; 34N,161A,307K/R/H; 34N,178F,307K/R/H; 34N,179T,307K/R/H; 34N,223E,307K/R/H; 34N,229P,307K/R/H; 34N,309P,307K/R/H; 34N,334P,307K/R/H; 70D,121F,307K/R/H; 70D,134R,307K/R/H; 70D,141P,307K/R/H; 70D,146G,307K/R/H; 70D,157L,307K/R/H; 70D,161A,307K/R/H; 70D,178F,307K/R/H; 70D,179T,307K/R/H; 70D,223E,307K/R/H; 70D,229P,307K/R/H; 70D,309P,307K/R/H; 70D,334P,307K/R/H; 121F,134R,307K/R/H; 121F,141P,307K/R/H; 121F,146G,307K/R/H; 121F,157L,307K/R/H; 121F,161A,307K/R/H; 121F,178F,307K/R/H; 121F,179T,307K/R/H; 121F,223E,307K/R/H; 121F,229P,307K/R/H; 121F,309P,307K/R/H; 121F,334P,307K/R/H; 134R,141P,307K/R/H; 134R,146G,307K/R/H; 134R,157L,307K/R/H; 134R,161A,307K/R/H; 134R,178F,307K/R/H; 134R,179T,307K/R/H; 134R,223E,307K/R/H; 134R,229P,307K/R/H; 134R,309P,307K/R/H; 134R,334P,307K/R/H; 141P,146G,307K/R/H; 141P,157L,307K/R/H; 141P,161A,307K/R/H; 141P,178F,307K/R/H; 141P,179T,307K/R/H; 141P,223E,307K/R/H; 141P,229P,307K/R/H; 141P,309P,307K/R/H; 141P,334P,307K/R/H; 146G,157L,307K/R7H; 146G,161A,307K/R/H; 146G,178F,307K/R/H; 146G,179T,307K/R/H; 146G,223E,307K/R/H; 146G,229P,307K/R/H; 146G,309P,307K/R/H; 146G,334P,307K/R/H; 157L,161A,307K/R/H; 157L,178F,307K/R/H; 157L,179T,307K/R/H; 157L,223E,307K/R/H; 157L,229P,307K/P/H; 157L,309P,307K/R/H; 157L,334P,307K/R/H; 161A,178F,307K/R/H; 161A,179T,307K/R/H; 161A,223E,307K/R/H; 161A,229P,307K/R/H; 161A,309P,307K/R/H; 161A,334P,307K/R/H; 178F,179T,307K/R/H; 178F,223E,307K/R/H; 178F,229P,307K/R/H; 178F,309P,307K/R/H; 178F,334P,307K/R/H; 179T,223E,307K/R/H; 179T,229P,307K/R/H; 179T,309P,307K/R/H; 179T,334P,307K/R/H; 223E,229P,307K/R/H; 223E,309P,307K/R/H; 223E,334P,307K/R/H; 229P,309P,307K/R/H; 229P,334P,307K/R/H; 309P,334P,307K/R/H.
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 3 дополнительных мутации в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в «Приложении A: 3 мутации».
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 4 дополнительных мутации в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в «Приложении A: 4 мутации».
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 5 дополнительных мутаций в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в «Приложении A: 5 мутаций».
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 6 дополнительных мутаций в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в «Приложении A: 6 мутаций».
Полипептид варианта PS4 может альтернативно содержать, помимо 307K/R/H, 7 дополнительных мутаций в любом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334, как указано в «Приложении A: 7 мутаций».
Полипептид варианта PS4 может содержать последовательность с 9 мутациями, а именно, в каждом из следующих остатков 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K/R/H, 309P, 334P, но не включает семь остатков, указанных в «Приложении A: 7 мутаций».
Полипептид варианта PS4 может содержать последовательность с 10 мутациями, а именно, в каждом из следующих остатков 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K/R/H, 309P, 334P, но не включает шесть остатков, указанных в «Приложении A: 6 мутаций».
Полипептид варианта PS4 может содержать последовательность с 11 мутациями, а именно, в каждом из следующих остатков 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K/R/H, 309P, 334P, но не включает пять остатков, указанных в «Приложении A: 5 мутаций».
Полипептид варианта PS4 может содержать последовательность с 12 мутациями, а именно, в каждом из следующих остатков 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K/R/H, 309P, 334P, но не включает четыре остатка, указанных в «Приложении A: 4 мутации».
Полипептид варианта PS4 может содержать последовательность с 13 мутациями, а именно, в каждом из следующих остатков 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K/R/H, 309P, 334P, но не включает три остатка, указанных в «Приложении A: 3 мутации».
Полипептид варианта PS4 может содержать последовательность с 14 мутациями, а именно, в каждом из следующих остатков 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K/R/H, 309P, 334P, но не включает два остатка, указанных в «Приложении A: 2 мутации».
Полипептид варианта PS4 может содержать последовательность с 15 мутациями, а именно, в каждом из следующих остатков 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K/R/H, 309P, 334P, но не включает один остаток, указанный в «Приложении A: 1 мутация».
Предпочтительные последовательности полипептида варианта PS4
Однако, предпочтительно, чтобы полипептид варианта PS4 дополнительно содержал мутации в каждом из этих положений.
Настоящее изобретение относится к полипептиду варианта PS4, происходящему от родительского полипептида, обладающего не-мальтогенной экзоамилазной активностью, где указанный полипептид варианта PS4 содержит мутацию в каждом из следующих положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 307, 309, 334, по сравнению с положениями последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1.
В предпочтительных вариантах изобретения, мутация в положении 307 содержит основный или положительно заряженный остаток. В некоторых вариантах изобретения, мутация в положении 307 содержит 307K или 307R. В другом предпочтительном варианте изобретения, остаток в положении 307 представляет собой H. Настоящее изобретение относится к полипептиду варианта PS4, происходящему от родительского полипептида, обладающего не-мальтогенной экзоамилазной активностью, где указанный полипептид варианта PS4 содержит мутацию в положении 307, а именно, замену на K или R, или где остаток в положении 307 представляет собой Н, а также мутации в каждом из положений 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 307, 309, 334.
Предпочтительно, остаток в положении 33 может представлять собой Y, предпочтительно 33 Y, более предпочтительно N33Y. Предпочтительно, остаток в положении 34 может представлять собой N, предпочтительно, 34N, более предпочтительно, D34N. Предпочтительно, остаток в положении 70 может представлять собой D, предпочтительно, 70D, более предпочтительно, G70D. Предпочтительно, остаток в положении 121 может представлять собой F, предпочтительно, 121F, более предпочтительно, Gl21F. Предпочтительно, остаток в положении 134 может представлять собой R, предпочтительно, 134R, более предпочтительно, G134R. Предпочтительно, остаток в положении 141 может представлять собой P, предпочтительно, 141P, более предпочтительно, A141P. Предпочтительно, остаток в положении 146 может представлять собой G, предпочтительно, 146G, более предпочтительно, Y146G. Предпочтительно, остаток в положении 157 может представлять собой L, предпочтительно, 157L, более предпочтительно, I157L. Предпочтительно, остаток в положении 161 может представлять собой A, предпочтительно, 161 A, более предпочтительно, S161 A. Предпочтительно, остаток в положении 178 может представлять собой F, предпочтительно, 178F, более предпочтительно, L178F. Предпочтительно, остаток в положении 179 может представлять собой T, предпочтительно, 179T, более предпочтительно, A179T. Предпочтительно, остаток в положении 223 представлять собой E, предпочтительно, 223E, более предпочтительно, G223E. Предпочтительно, остаток в положении 229 может представлять собой P, предпочтительно, 229P, более предпочтительно, S229P. Предпочтительно, остаток в положении 307 может представлять собой K, предпочтительно, 307K, более предпочтительно, H307K. Предпочтительно, остаток в положении 309 может представлять собой P, предпочтительно, 309P, более предпочтительно, A309P. Предпочтительно, остаток в положении 334 может представлять собой P, предпочтительно, 334P, более предпочтительно, S334P.
Как указывалось выше, в предпочтительных вариантах изобретения, мутация в положении 70 представляет собой 70D, предпочтительно, G70D. Поэтому, настоящее изобретение также относится к полипептиду варианта PS4, происходящему от родительского полипептида, обладающего не-мальтогенной экзоамилазной активностью, где указанный полипептид варианта PS4 содержит мутацию в положении 307, а именно, замену на K или R, или где остаток в положении 307 представляет собой H, и мутацию в положении 70, а именно, 70D, а также мутации в каждом из положений 33, 34, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 307, 309, 334.
В предпочтительных вариантах изобретения, остатком в положении 272 является остаток «дикого типа», то есть, немутированный остаток. Поэтому, предпочтительным остатком в положении 272 является гистидин (H). Следовательно, настоящее изобретение относится к полипептиду варианта PS4, происходящему от родительского полипептида, обладающего не-мальтогенной экзоамилазной активностью, где указанный полипептид варианта PS4 содержит мутацию в положении 307, а именно, замену на K или R, или где остаток в положении 307 представляет собой H, и мутацию в положении 70, а именно, 70D, где остатком в положении 272 является Н, а также мутации в каждом из положений 33, 34, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 307, 309, 334.
Аналогичным образом, остатком в положении 303 является остаток «дикого типа» или немутированный остаток, а в других предпочтительных вариантах изобретения, таким остатком предпочтительно является глицин (G). Следовательно, настоящее изобретение относится к полипептиду варианта PS4, происходящему от родительского полипептида, обладающего не-мальтогенной экзоамилазной активностью, где указанный полипептид варианта PS4 содержит мутацию в положении 307, а именно, замену на K или R, или где остаток в положении 307 представляет собой H, и мутацию в положении 70, а именно, 70D, где остатком в положении 303 является G, а также мутации в каждом из положений 33, 34, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 307, 309, 334.
В предпочтительных вариантах изобретения, в каждом из вышеуказанных вариантов полипептида варианта PS4, который содержит дополнительные мутации в положениях 33, 34, 70, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309, 334, остатком в положении 33 предпочтительно является Y, остатком в положении 34 предпочтительно является N, остатком в положении 70 предпочтительно является D, остатком в положении 121 предпочтительно является F, остатком в положении 134 предпочтительно является R, остатком в положении 141 предпочтительно является P, остатком в положении 146 предпочтительно является G, остатком в положении 157 предпочтительно является L, остатком в положении 161 предпочтительно является A, остатком в положении 178 предпочтительно является F, остатком в положении 179 предпочтительно является T, остатком в положении 223 предпочтительно является E, остатком в положении 229 предпочтительно является P, остатком в положении 309 предпочтительно является P, и остатком в положении 334 предпочтительно является P.
В особенно предпочтительных вариантах, настоящее изобретение относится к полипептиду варианта PS4, содержащему следующие остатки 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K/R/H, 309P, 334P. Полипептид варианта PS4 может содержать каждую из следующих мутаций N33Y, D34N, G70D, G121F, G134R, A141P, Y146G, I157L, S161A, L178F, A179T, G223E, S229P, H307K/R, A309P и S334P.
Настоящее изобретение, в частности, относится к полипептиду варианта PS4, содержащему следующие замены 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K, 309P, 334P, предпочтительно, N33Y, D34N, G70D, G121F, G134R, A141P, Y146G, I157L, S161A, L178F, A179T, G223E, S229P, H307K, A309P, S334P, по сравнению с последовательностью экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1. В этом варианте изобретения, указанный полипептид варианта PS4 может содержать последовательность SEQ ID NO: 21.
Настоящее изобретение также относится к полипептиду варианта PS4, содержащему следующие замены 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307R, 309P, 334P, предпочтительно, N33Y, D34N, G70D, G121F, G134R, A141P, Y146G, I157L, S161A, L178F, A179T, G223E, S229P, H307R, A309P, S334P по сравнению с последовательностью экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1. В этом варианте изобретения, указанный полипептид варианта PS4 может содержать последовательность SEQ ID NO: 23.
Кроме того, настоящее изобретение относится к полипептиду варианта PS4, происходящему от родительского полипептида, обладающего не-мальтогенной экзоамилазной активностью, где указанный полипептид варианта PS4 содержит следующие замены 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 309P, 334P, предпочтительно, N33Y, D34N, G70D, G121F, G134R, A141P, Y146G, I157L, S161A, L178F, A179T, G223E, S229P, A309P, S334P, по сравнению с последовательностью экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1. В этом варианте изобретения, указанный полипептид варианта PS4 может содержать последовательность SEQ ID NO: 25.
Дополнительные замены
В описанном в настоящей заявке полипептидном варианте PS4 могут также присутствовать одна или несколько других мутаций, представленных в следующей таблице.
Нуклеиновые кислоты варианта PS4
Авторами настоящего изобретения описаны также нуклеиновые кислоты PS4, имеющие последовательности, соответствующие изменениям или кодирующие эти изменения в последовательностях полипептида варианта PS4, где указанные нуклеиновые кислоты могут быть использованы для получения указанных полипептидов в описанных здесь целях. Таким образом, настоящее изобретение относится к нуклеиновым кислотам, способным кодировать любую полипептидную последовательность, представленную в настоящей заявке.
Специалисту в данной области известно, что существует взаимосвязь между последовательностью нуклеиновой кислоты и полипептидной последовательностью, в частности, между генетическим кодом и вырожденностью генетического кода, а поэтому сам специалист может без труда сконструировать указанные нуклеиновые кислоты PS4. Так, например, специалисту в данной области известно, что каждой аминокислотной замене в последовательности полипептида варианта PS4 могут соответствовать один или несколько кодонов, кодирующих замененную аминокислоту. В соответствии с этим, очевидно, что в зависимости от вырожденности генетического кода, соответствующего конкретному аминокислотному остатку, могут быть сконструированы одна или несколько нуклеотидных последовательностей PS4, соответствующих указанной последовательности полипептида варианта PS4. Кроме того, если Полипептид варианта PS4 содержит более чем одну замену, например, H307K/G70D, то соответствующие нуклеиновые кислоты PS4 могут содержать парные комбинации кодонов, кодирующих две аминокислотные замены, соответственно.
Последовательности нуклеиновой кислоты варианта PS4 могут происходить от родительских нуклеиновых кислот, кодирующих любой из описанных выше родительских полипептидов. В частности, родительские нуклеиновые кислоты могут содержать последовательности дикого типа, например, SEQ ID NO: 6 или SEQ ID NO: 12. Поэтому, нуклеотидные варианты PS4 могут содержать нуклеиновые кислоты, которые кодируют не-мальтогенные экзоамилазы дикого типа, но которые также кодируют другую аминокислоту в положении, соответствующем положению аминокислотного остатка дикого типа. Последовательности нуклеиновых кислот PS4 могут также содержать последовательности дикого типа с одной или несколькими мутациями, например, последовательности, кодирующие родительские полипептиды, описанные выше в разделе «Комбинации».
При этом следует отметить, что в описанных в настоящем описании способах и композициях также могут быть использованы последовательности нуклеиновых кислот, которые не являются идентичными конкретным последовательностям нуклеиновой кислоты варианта PS4, но являются родственными этим последовательностям, например, такие как вариант, гомолог, производное или фрагмент последовательности нуклеиновой кислоты варианта PS4, или комплементарная ему последовательность или последовательность, гибридизующаяся с ними. Если не указано иначе, то термин «нуклеиновая кислота варианта PS4» должен включать каждую из перечисленных выше молекул.
Мутации в аминокислотной последовательности и последовательности нуклеиновой кислоты могут быть внесены любыми различными методами, известными специалистам. Последовательности вариантов могут быть легко получены любыми известными методами мутагенеза, например, сайт-направленного мутагенеза, проводимого с помощью ПЦР с использованием соответствующих олигонуклеотидных праймеров; мутагенеза, осуществляемого путем присоединения к 5'-концу; мутагенеза с использованием несоответствующих праймеров и т.п. Альтернативно или дополнительно, последовательности нуклеиновой кислоты варианта могут быть сконструированы de novo.
В особенно предпочтительных вариантах изобретения, мутации вводят в родительские последовательности с помощью ПЦР (полимеразной цепной реакции), проводимой с использованием соответствующих праймеров, как описано в примерах. Следовательно, в полипептидную последовательность могут быть внесены модификации путем введения любых нужных аминокислотных замен в родительский полипептид, предпочтительно, обладающий не-мальтогенной экзоамилазной активностью, например, в последовательность экзоамилазы Pseudomonas saccharophilia или Pseudomonas stutzeri, на аминокислотном уровне или на уровне нуклеиновых кислот, как описано в настоящей заявке. Авторами настоящего изобретения был описан способ изменения последовательности не-мальтогенной экзоамилазы путем внесения изменений в последовательность нуклеиновой кислоты, кодирующую не-мальтогенную экзоамилазу.
Однако следует отметить, что фактически полипептид варианта PS4 необязательно должен быть получен из полипептида дикого типа или последовательности нуклеиновой кислоты, например, посредством постадийной мутации. Вместо этого, после идентификации последовательности полипептидного варианта PS4, специалист в данной области может легко сконструировать эту последовательность из последовательности дикого типа со всеми мутациями с применением известных методов, например, с использованием соответствующих олигонуклеотидных праймеров и с помощью ПЦР. Фактически, полипептид варианта PS4 может быть получен de novo cо всеми мутациями, например, методом пептидного синтеза.
Однако, в основном, полипептиды и/или нуклеиновые кислоты варианта PS4 происходят или могут происходить от последовательности-«предшественника». Используемый в настоящем описании термин «предшественник» означает фермент, являющийся предшественником фермента, который модифицируют описанными здесь методами, и их композиции. Поэтому, термин «предшественник» включает фермент, используемый для породуцирования модифицированного фермента. Таким образом, предшественником может быть фермент, модифицированный посредством мутагенеза, описанного в настоящей заявке. Аналогичным образом, предшественником может быть фермент дикого типа, вариант фермента дикого типа или уже мутированный фермент.
Полипептиды и нуклеиновые кислоты варианта PS4 могут быть получены любыми известными методами. В частности, они могут быть экспрессированы из природных экспрессионных систем in vitro или in vivo. В частности, авторами настоящего изобретения описаны плазмиды и экспрессионные векторы, содержащие последовательности нуклеиновой кислоты PS4, предпочтительно, обладающей способностью экспрессировать полипептиды варианта PS4. Также описаны клетки и клетки-хозяева, содержащие такие нуклеиновые кислоты, плазмиды и векторы PS4, предпочтительно, трансформированные ими, и совершенно очевидно, что такие клетки и клетки-хозяева также входят в объем настоящего изобретения.
Полипептиды варианта PS4 могут быть, например, получены методами сайт-направленного мутагенеза, проводимого с помощью ПЦР с использованием соответствующих олигонуклеотидных праймеров; мутагенеза, осуществляемого путем присоединения к 5'-концу; мутагенеза, проводимого с использованием несоответствующих праймеров и т.п., как описано в примере 4А. Для получения полипептидов варианта PS4 с мутациями в положении 307, например, могут быть получены последовательность нуклеиновой кислоты, соответствующая последовательности pSac-pMD229; нуклеотидная последовательность мальтотетрагидролазы Pseudomonas saccharophila с 17 заменами и делецией крахмал-связывающего домена (SEQ ID NO: 14), в которые затем вводят соответствующие модификации. Однако, для специалиста в данной области очевидно, что может быть использована любая подходящая исходная последовательность, и фактически, из последовательности экзоамилазы дикого типа может быть получен полипептид нужного варианта либо в одну стадию, либо посредством других промежуточных последовательностей.
В предпочтительных вариантах изобретения, полипептидную последовательность варианта PS4 используют в качестве пищевой добавки в выделенной форме. Термин «выделенный» означает, что последовательность, к которой он относится, по меньшей мере, в основном, не содержит по меньшей мере одного другого компонента, с которым эта последовательность обычно ассоциируется и обнаруживается в природе. В одном из аспектов изобретения, последовательность, предпочтительно, присутствует в очищенной форме. Термин «очищенный» означает, что указанная последовательность присутствует в относительно чистом виде, например, ее чистота составляет по меньшей мере примерно 90%, по меньшей мере примерно 95% или по меньшей мере примерно 98%.
В наиболее предпочтительных вариантах изобретения, последовательность нуклеиновой кислоты включает последовательности, представленные в SEQ ID NO: 22, 24 или 26.
Нумерация положений
Все положения, указанные в настоящей заявке, пронумерованы в соответствии с нумерацией эталонной последовательности экзоамилазы Pseudomonas saccharophilia, представленной ниже (SEQ ID NO: 1):
Эталонная последовательность происходит от последовательности Pseudomonas saccharophilia, имеющей регистрационный номер Р22963 в базе данных SWISS-PROT, но не включающей сигнальную последовательность MSHILRAAVLAAVLLPFPALA.
С-концевой крахмал-связывающий домен EGGLVNVNFR CDNGVTQMGD SVYAVGNVSQ LGNWSPASAV RLTDTSSYPT WKGSIALPDG QNVEWKCLIR NEADATLVRQ WQSGGNNQVQ AAAGASTSGS F может быть, но необязательно, делетирован, либо он может вообще отсутствовать. Альтернативно, он может быть включен в полипептидную последовательность варианта PS4.
В описании настоящего изобретения используется специфическая нумерация положений аминокислотных остатков в экзоамилазах PS4. В соответствии с этим, путем выравнивания аминокислотных последовательностей различных известных экзоамилаз можно однозначно определять конкретное положение для любого аминокислотного остатка экзоамилазы в любом экзоамилазном ферменте, аминокислотная последовательность которого является известной. С использованием этой системы нумерации, например, аминокислотной последовательности экзоамилазы, выделенной из Pseudomonas saccharophilia и сравниваемой путем выравнивания с аминокислотными последовательностями различных других известных экзоамилаз, можно однозначно указать положение аминокислотных остатков в экзоамилазе.
Поэтому, эта система нумерации, даже если в ней в качестве эталонной основы можно использовать конкретную последовательность, может быть применена ко всем релевантным гомологичным последовательностям. Так, например, такая нумерация положений может быть применена к гомологичным последовательностям других видов Pseudomonas, или гомологичным последовательностям других бактерий. Предпочтительно, такие гомологи на 60% или более, например, на 70% или более, на 80% или более, на 90% или более или на 95% или более гомологичны вышеуказанной эталонной последовательности SEQ ID NO: 1 или последовательностям, имеющим регистрационные номера P22963 или P13507 в базе данных SWISS-PROT, предпочтительно, гомологичны всем этим последовательностям. Гомология последовательностей белков может быть определена с помощью хорошо известных программ сопоставления последовательностей путем их выравнивания и методов гибридизации, описанных в настоящей заявке. Такие гомологичные последовательности, а также функциональные эквиваленты, описанные ниже, называются в настоящей заявке «семейством PS4».
Кроме того, как указывалось выше, в системе нумерации, используемой в настоящей заявке, за эталонную последовательность принимают последовательность SEQ ID NO: 1, которая происходит от последовательности Pseudomonas saccharophilia, имеющей регистрационный номер P22963 в SWISS-PROT, но не включающей сигнальную последовательность MSHILRAAVLAAVLLPFPALA. Эта сигнальная последовательность расположена со стороны N-конца от эталонной последовательности и состоит из 21 аминокислотного остатка. В соответствии с этим, необходимо просто идентифицировать конкретные остатки, мутированные или замененные в соответствующих последовательностях, содержащих сигнальную последовательность, или фактически, соответствующие последовательности, содержащие любые другие N- или C-концевые удлинения или делеции. Что касается N-концевых добавлений или делеций, то все, что требуется в данном случае, это выравнивать нумерацию положений по числу встроенных или делетированных остатков. Так, например, положение 1 в SEQ ID NO: 1 соответствует положению 22 в последовательности, содержащей сигнальную последовательность.
Родительский фермент/полипептид
Полипептиды варианта PS4 происходят от другой последовательности, известной как «родительский фермент», «родительский полипептид» или «родительская последовательность», или являются их вариантами.
Термин «родительский фермент», используемый в настоящей заявке, означает фермент, который имеет структуру, являющуюся родственной, предпочтительно, близкородственной химической структуре полученного варианта, то есть, полипептида или нуклеиновой кислоты варианта PS4. Родительским ферментом может быть фермент-предшественник (то есть, фермент, который фактически является мутированным), либо такой фермент может быть получен de novo. Родительским ферментом может быть фермент дикого типа, либо им может быть фермент дикого типа, содержащий одну или несколько мутаций.
Используемый в настоящем описании термин «предшественник» означает фермент, являющийся предшественником фермента, который модифицируют с получением зрелого фермента. Таким образом, предшественником может быть фермент, модифицированный посредством мутагенеза. Аналогичным образом, предшественником может быть фермент дикого типа, фермент варианта дикого типа или уже мутированный фермент.
Термин «дикого типа» понятен специалистам и означает фенотип, который характеризуется наибольшим числом видов, существующих в природе, и отличается от фенотипа мутанта. Так, например, в контексте настоящего описания, ферментом дикого типа является форма фермента, обычно присутствующего у большинства членов соответствующего вида. Обычно, релевантный фермент дикого типа по отношению к описанным здесь полипептидным вариантам является наиболее близкородственным соответствующему ферменту дикого типа с точки зрения гомологии последовательностей. Однако если для получения описанного в настоящем изобретении полипептида варианта PS4 в качестве основы используется конкретная последовательность дикого типа, то такой последовательностью может быть соответствующая последовательность дикого типа, независимо от присутствия или отсутствия другой последовательности дикого типа, которая является более близкородственной с точки зрения гомологии аминокислотных последовательностей.
Родительским ферментом или полипептидом может быть любой подходящий исходный полипептид. Он может, предпочтительно, обладать определенной ферментативной активностью. Такой ферментативной активностью, предпочтительно, является амилазная активность. Более предпочтительно, родительский полипептид обладает экзоамилазной активностью.
Родительским ферментом предпочтительно является полипептид, который, предпочтительно, обладает не-мальтогенной экзоамилазной активностью. Предпочтительно, указанный родительский фермент сам представляет собой не-мальтогенную экзоамилазу. Так, например, родительским ферментом может быть не-мальтогенная экзоамилаза Pseudomonas saccharophilia, такая, как полипептид, имеющий регистрационный номер P22963 в SWISS-PROT, или не-мальтогенная экзоамилаза Pseudomonas stutzeri, например, полипептид, имеющий регистрационный номер P13507 в SWISS-PROT.
В качестве родительских ферментов могут быть использованы другие члены семейства PS4; и такие «члены семейства PS4» могут быть, по существу, аналогичными, гомологичными или функционально эквивалентными любым из этих двух ферментов, и могут быть идентифицированы стандартными методами, такими как скрининг на гибридизацию подходящей библиотеки с использованием зондов, или анализ геномной последовательности.
В частности, функциональные эквиваленты любых из этих двух ферментов, а также другие члены «семейства PS4» могут быть также использованы в качестве исходных соединений или родительских полипептидов для получения описанных в настоящем описании полипептидов варианта PS4.
Термин «функциональный эквивалент» белка означает молекулу, которая обладает одной или несколькими, предпочтительно, по существу, всеми функциями этого белка. Предпочтительно, такими функциями являются биологические функции, более предпочтительно, ферментативные функции, такие как амилазная активность, предпочтительно, не-мальтогенная экзоамилазная активность. Такими функциями могут быть любые свойства белка, включая экзоспецифичность, термостабильность и улучшенные технологические свойства, такие как плотность, упругость, слипаемость, раскрашиваемость и сворачиваемость (как описано ниже).
Термин «функциональный эквивалент», относящийся к родительскому ферменту, предпочтительно, означает молекулу, функция которой аналогична или идентична функции родительской молекулы. Такой родительской молекулой может быть не-мальтогенная экзоамилаза Pseudomonas saccharophilia или не-мальтогенная экзоамилаза Pseudomonas stutzeri, или полипептид, полученный из других источников.
Термин «функциональный эквивалент», относящийся к родительскому ферменту, а именно к не-мальтогенной экзоамилазе Pseudomonas saccharophilia, такой как полипептид, имеющий регистрационный номер P22963 в SWISS-PROT, или к не-мальтогенной экзоамилазе Pseudomonas stutzeri, такой как полипептид, имеющий регистрационный номер P13507 в SWISS-PROT, означает, что указанный функциональный эквавалент может быть получен из других источников. Функционально эквивалентный фермент может иметь другую аминокислотную последовательность и обладать не-мальтогенной экзоамилазной активностью. Примеры анализов для определения функциональных свойств описаны в настоящей заявке и известны специалистам.
В наиболее предпочтительных вариантах изобретения, функциональный эквивалент имеет последовательность, гомологичную вышеупомянутым последовательностям любой из не-мальтогенных экзоамилаз Pseudomonas saccharophilia и Pseudomonas stutzeri, предпочтительно, последовательностям всех этих экзоамилаз. Функциональный эквивалент может также иметь последовательность, гомологичную любой из последовательностей, представленных в SEQ ID NO:1-14, предпочтительно, SEQ ID NO: 1 или SEQ ID NO: 7 или обеим последовательностям. Такие последовательности имеют гомологию, предпочтительно, по меньшей мере, 60%, предпочтительно, 65% или более, предпочтительно, 75% или более, предпочтительно, 80% или более, предпочтительно 85% или более, предпочтительно, 90% или более, и предпочтительно, 95% или более. Такая гомология последовательностей может быть установлена с помощью различных компьютерных программ, известных специалистам, например, BLAST или FASTA и т.п. Подходящей компьютерной программой для проведения такого сопоставления последовательностей является пакет программ GCG Wisconsin Bestfit (University of Wisconsin, U. S. A; Devereux et al, 1984, Nucleic Acids Research 805 12:387). Примерами других компьютерных программ, которые позволяют проводить сравнение последовательностей, являются, но не ограничивается ими, пакет программ BLAST (см. Ausubel et al., 1999 ibid, Chapter 18), FASTA (Atschul et al, 1990, J. Mol. Biol., 403-410) и программы сравнения GENEWORKS. Программы BLAST и FASTA являются доступными для поиска в автономных (off-line) и оперативных (on-line) режимах (см. Ausubel et al., 1999, ibid, pages 7-58 - 7-60). Однако предпочтительно использовать программу GCG Bestfit.
В других вариантах изобретения, функциональные эквиваленты обладают способностью специфически гибридизоваться с любой из описанных выше последовательностей. Методы определения способности одной последовательности гибридизоваться с другой последовательностью, известны специалистам, и описаны, например, в руководствах Sambrook и др. (см. выше) и Ausubel, F. M. и др. (см. выше). В особенно предпочтительных вариантах изобретения, функциональные эквиваленты обладают способностью гибридизоваться в жестких условиях, например, при 65°С и в 0,1×SSC {1×SSC = 0,15 M NaCl, 0,015 M Na3-цитрат, pH 7,0}.
Так, например, в качестве исходных ферментов могут быть использованы функциональные эквиваленты, последовательность которых гомологична последовательностям не-мальтогенных экзоамилаз Pseudomonas saccharophilia и Pseudomonas stutzeri. Такие последовательности могут отличаться от последовательности Pseudomonas saccharophilia в любом одном или нескольких положениях. Кроме того, в качестве родительского полипептида могут быть также использованы не-мальтогенные экзоамилазы, происходящие от других штаммов Pseudomonas spp., таких как ATCC 17686. Остатки полипептида варианта PS4 могут быть встроены в любую из этих родительских последовательностей с получением полипептидных последовательностей варианта PS4.
Следует отметить, что если желательно, чтобы полипептиды варианта PS4 дополнительно содержали одну или несколько мутаций, как описано выше, то в последовательности нуклеиновой кислоты функциональных эквивалентов не-мальтогенной экзоамилазы Pseudomonas spp., а также в другие члены «семейства PS4» могут быть внесены соответствующие мутации в таком порядке, чтобы они могли быть использованы в качестве исходных соединений или родительских полипептидов для получения описанных в настоящем описании полипептидов варианта PS4.
Термин «полипептиды варианта PS4» в частности, включают полипептиды, описанные в документах: US 60/485413, 60/485539 и 60/485616; PCT/US2004/021723 и PCT/US2004/021739; US 10/886905 и 10/866903; US 60/608919; US 60/612407; US 60/485539; PCT/IB2004/002487; US 10/886023; US 10/886505, US 10/886527 и US 10/886504; US 10/947612. Однако эти документы не должны рассматриваться как прототипы.
Такие полипептиды могут быть использованы в описанных здесь целях, в частности, в качестве пищевых добавок, для обработки крахмала, как описано в настоящей заявке, для приготовления пищевого продукта, для выпекания хлебобулочных изделий, для получения улучшенных композиций их комбинаций и т.п.
Модификация родительских последовательностей
Родительские ферменты могут быть модифицированы на аминокислотном уровне или на уровне нуклеиновых кислот с получением описанных в настоящем описании последовательностей варианта PS4. Поэтому, настоящее изобретение относится к получению полипептидов варианта PS4 путем введения одной или нескольких соответствующих замен в кодоны нуклеотидной последовательности, кодирующей полипептид не-мальтогенной экзоамилазы.
Нуклеиновые кислоты должны быть, предпочтительно, пронумерованы в соответствии с нумерацией положений нуклеотидной последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 6. Альтернативно или дополнительно, может быть проведено сравнение с последовательностью, имеющейся в GenBank под регистрационным номером X16732. В предпочтительных вариантах изобретения, нуклеиновые кислоты должны быть пронумерованы в соответствии с нумерацией нуклеотидной последовательности, представленной в SEQ ID NO: 6. Однако, что касается нумерации аминокислотных остатков, то нумерация остатков в этой последовательности приводится лишь в иллюстративных целях. В частности, следует отметить, что в любую из последовательностей нуклеиновой кислоты семейства PS4 могут быть введены указанные замены кодонов. Так, например, такие замены могут быть введены в последовательность нуклеиновой кислоты не-мальтогенной экзоамилазы Pseudomonas saccharophilia или Pseudomonas stutzeri (например, X16732, SEQ ID NO: 6 или M24516, SEQ ID NO: 12).
Родительский фермент может представлять собой «полноразмерный фермент», то есть, он может иметь полную длину, которую он обычно имеет в природе (либо он может быть мутированным), либо он может представлять собой усеченную форму. Вариант PS4, происходящий от такого фермента, может быть соответственно усеченным или «полноразмерным». Усечения могут присутствовать у N-конца или у С-конца, предпочтительно, у С-конца. Родительский фермент или вариант PS4 может не содержать одной или нескольких частей, таких как подпоследовательности, сигнальные последовательности, домены или группы, независимо от того, являются ли они активными или нет, и т.п. Так, например, родительский фермент или полипептид варианта PS4 может не содержать сигнальной последовательности, как описано выше. Альтернативно или дополнительно, родительский фермент или вариант PS4 может не содержать одного или нескольких каталитических или связывающих доменов.
В наиболее предпочтительных вариантах изобретения, родительский фермент или вариант PS4 может не содержать одного или нескольких доменов, присутствующих в не-мальтогенных экзоамилазах, таких как крахмал-связывающий домен. Так, например, полипептиды PS4 могут иметь только последовательность, расположенную до положения 429, в соответствии с нумерацией последовательности не-мальтогенной экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1. При этом следует отметить, что это относится к таким вариантам PS4, как pSac-pMS382, pSac-pMS382R и pSac-pMS382H.
В других вариантах изобретения, родительский фермент или вариант PS4 может содержать «полноразмерный фермент», то есть, фермент, имеющий длину, которую он обычно имеет в природе (или мутированный фермент), а также одну или несколько дополнительных аминокислотных последовательностей у N-конца или у С-конца. Так, например, родительский фермент или полипептид варианта PS4 может содержать один дополнительный аминокислотный остаток у С-конца или у N-конца, например, M, A, G и т.п. Предпочтительно, дополнительный аминокислотный остаток присутствует у N-конца. Если присутствуют один или несколько дополнительных остатков, то нумерацию положений выравнивают по длине добавленных остатков.
Амилаза
Полипептиды вариантов PS4 обычно обладают амилазной активностью.
Термин «амилаза» используется здесь в общепринятом смысле, например, этот термин означает фермент, который inter alia обладает способностью катализировать разложение крахмала. В частности, такими ферментами являются гидролазы, способные расщеплять α-D-(1→4)O-гликозидные связи в крахмале.
Амилазы представляют собой крахмал-разлагающие ферменты, классифицированные как гидролазы, которые расщепляют α-D-(1→4)O-гликозидные связи в крахмале. В основном, α-амилазы (E.C. 3.2.1.1, α-D-(1→4)O-глюкан-глюканогидролаза) определяют как эндоактивные ферменты, которые неспецифически расщепляют α-D-(1→4)O-гликозидные связи в молекуле крахмала. В противоположность этому, экзо-активные амилолитические ферменты, такие как β-амилазы (E.C. 3.2.1.2, α-D-(1→4)глюкан-мальтогидролаза) и некоторые продукт-специфические амилазы, такие как мальтогенная альфа-амилаза (E.C. 3.2.1.133), отщепляют молекулу крахмала от невосстанавливающего конца субстрата. β-амилазы, α-глюкозидазы (E.C. 3.2.1.20, α-D-глюкозид-глюкогидролаза), глюкоамилаза (E.C. 3.2.1.3, α-D-(1→4)-глюкан-глюкогидролаза) и продукт-специфические амилазы могут продуцировать из крахмала мальто-олигосахариды конкретной длины.
Не-мальтогенная экзоамилаза
Полипептиды варианта PS4, описанные в настоящей заявке, происходят от (или являются вариантами) полипептидов, которые предпочтительно, обладают не-мальтогенной экзоамилазной активностью. Предпочтительно, если эти родительские ферменты сами являются не-мальтогенными экзоамилазами. В наиболее предпочтительных вариантах изобретения, полипептиды варианта PS4 также сами обладают не-мальтогенной экзоамилазной активностью.
В наиболее предпочтительных вариантах изобретения, термин «не-мальтогенный экзоамилазный фермент», используемый в настоящей заявке, означает, что данный фермент, по своей природе, не разлагает крахмал с образованием значительного количества мальтозы, как было проанализировано в соответствии с процедурой тестирования продукта, описанной в настоящей заявке.
В наиболее предпочтительных вариантах изобретения, не-мальтогенная экзоамилаза содержит экзо-мальтотетрагидролазу. Обычно, экзо-мальтотетрагидролаза (E.C.3.2.1.60) является более известной как глюкан-1,4-альфа-мальтотетрагидролаза. Этот фермент гидролизует 1,4-альфа-D- глюкозидные связи в крахмальных полисахаридах, в результате чего происходит удаление избытка мальтотетраозных остатков из невосстанавливающих концов цепи.
Не-мальтогенные экзоамилазы подробно описаны в патенте США № 6667065, который включен в настоящее описание посредством ссылки.
Анализы на не-мальтогенную экзоамилазную активность
Нижеследующая система используется для характеризации полипептидов, обладающих не-мальтогенной экзоамилазной активностью, которая может быть использована в описанных здесь методах и композициях. Эта система может быть, например, использована для характеризации описанных здесь родительских полипептидов или полипептидов варианта PS4.
Для общего сведения, амилопектин восковидной кукурузы (получаемый как WAXILYS 200 от Roquette, France) представляет собой крахмал с очень высоким содержанием амилопектина (выше 90%). Для его получения, 20 мг/мл крахмала восковидной кукурузы кипятят в течение 3 минут в буфере, содержащем 50 мМ MES (2-(N-морфолино)этансульфоновой кислоты) и 2 мМ хлорида кальция, pH 6,0, а затем инкубируют при 50°С и используют в течение получаса.
Одну единицу не-мальтогенной экзоамилазы определяют как количество фермента, который высвобождает продукты гидролиза, эквивалентные 1 мкмоль восстанавливающего сахара в минуту при инкубировании при 50°С в тест-пробирке с 4 мл 10 мг/мл крахмала восковидной кукурузы в буфере 50 мМ MES, 2 мМ хлорида кальция, pH 6,0, полученном как описано выше. Уровень восстанавливающих сахаров определяют с использованием мальтозы в качестве стандарта и динитросалициловой кислоты методом, описанным Bernfeld, Methods Enzymol, (1954), I, 149-158 или другим методом определения количества восстанавливающих сахаров, известным специалистам.
Тип продукта гидролиза не-мальтогенной экзоамилазы определяют путем инкубирования 0,7 единиц не-мальтогенной экзоамилазы в течение 15 или 300 минут при 50°С в тест-пробирке с 4 мл 10 мг/мл крахмала восковидной кукурузы в буфере, полученном как описано выше. Реакцию прекращают путем погружения тест-пробирки на 3 минуты в баню с кипящей водой.
Продукты гидролиза анализируют и количественно оценивают с помощью анионообменной ВЭЖХ на колонке Dionex PA 100 с использованием ацетата натрия, гидроксида натрия и воды в качестве элюента методом импульсной амперометрической детекции с использованием известных линейных мальтоолигосахаридов от глюкозы до мальтогептаозы в качестве стандартов. Коэффициентом реактивности, используемым для сахаридов от мальтооктаозы до мальтодекаозы, является коэффициент реактивности, обнаруживаемый для мальтогептаозы.
Полипептиды варианта PS4, предпочтительно, обладают не-мальтогенной экзоамилазной активностью, при которой после инкубирования указанной не-мальтогенной экзоамилазы в количестве 0,7 единиц в течение 15 минут при температуре 50°С при pH 6,0 в 4 мл водного раствора 10 мг предварительно прокипяченного крахмала восковидной кукурузы на мл забуференного раствора, содержащего 50 мМ 2-(N-морфолино)этансульфоновой кислоты и 2 мМ хлорида кальция, указанный фермент будет давать продукт(ы) гидролиза, состоящий(ие) из одного или нескольких линейных мальтоолигосахаридов, имеющих от двух до десяти D-глюкопиранозильных звеньев и необязательно глюкозы, так, чтобы по меньшей мере 60% масс., предпочтительно, по меньшей мере 70% масс., более предпочтительно, по меньшей мере 80% масс. и наиболее предпочтительно, по меньшей мере 85% масс. указанных продуктов гидролиза состояли из линейных мальтоолигосахаридов, имеющих от трех до десяти D-глюкопиранозильных звеньев, предпочтительно, линейных мальтоолигосахаридов, имеющих от четырех до восьми D-глюкопиранозильных звеньев.
Для удобства ссылки и в целях настоящего изобретения, процедура инкубирования не-мальтогенной экзоамилазы в количестве 0,7 единиц в течение 15 минут при температуре 50°С, при рН 6,0 в 4 мл водного раствора 10 мг предварительно прокипяченного крахмала восковидной кукурузы на мл забуференного раствора, содержащего 50 мМ 2-(N-морфолино)этансульфоновой кислоты и 2 мМ хлорида кальция, может называться «тестом с инкубированием крахмала восковидной кукурузы».
Таким образом, альтернативно экспрессируемые предпочтительные полипептиды варианта PS4, которые являются не-мальтогенными экзоамилазами, характеризуются как полипептиды, которые в тесте с инкубированием крахмала восковидной кукурузы обладают способностью продуцировать продукт(ы) гидролиза, состоящий(ие) из одного или нескольких линейных мальтоолигосахаридов, содержащих от двух до десяти D-глюкопиранозильных звеньев и необязательно глюкозы, так, чтобы по меньшей мере 60% масс., предпочтительно, по меньшей мере 70% масс., более предпочтительно, по меньшей мере 80% масс. и наиболее предпочтительно, по меньшей мере 85% масс. указанных продуктов гидролиза состояли из линейных мальтоолигосахаридов, имеющих от трех до десяти D-глюкопиранозильных звеньев, предпочтительно, линейных мальтоолигосахаридов, имеющих от 4-8 D-глюкопиранозильных звеньев.
Продукты гидролиза в тесте с инкубированием крахмала восковидной кукурузы могут включать один или несколько линейных мальтоолигосахаридов, состоящих из 2-10 D-глюкопиранозильных звеньев и необязательно глюкозы. Продукты гидролиза в тесте с инкубированием крахмала восковидной кукурузы могут также включать другие продукты гидролиза. Тем не менее, процентное содержание (по массе) линейных мальтоолигосахаридов, состоящих из 3-10 D-глюкопиранозильных звеньев, определяют по количеству продукта гидролиза, состоящего из одного или нескольких линейных мальтоолигосахаридов, имеющих от 2 до 10 D-глюкопиранозильных звеньев и необязательно глюкозы. Другими словами, процентное содержание (по массе) линейных мальтоолигосахаридов, состоящих из 3-10 D-глюкопиранозильных звеньев, определяется не по количеству продуктов гидролиза, а по одному или нескольким линейным мальто-олигосахаридам, состоящим из 2-10 D-глюкопиранозильных звеньев и глюкозы.
Продукты гидролиза могут быть проанализированы любыми подходящими методами. Так, например, продукты гидролиза могут быть проанализированы с помощью анионообменной ВЭЖХ на колонке Dionex PA 100 методом импульсной амперометрической детекции и с использованием, например, известных линейных мальтоолигосахаридов от глюкозы до мальтогептаозы в качестве стандартов.
Для удобства ссылки и в целях настоящего изобретения, процедура анализа продукта(ов) гидролиза, проводимого с помощью анионообменной ВЭЖХ на колонке Dionex PA 100 методом импульсной амперометрической детекции и с использованием, например, известных линейных мальтоолигосахаридов от глюкозы до мальтогептаозы в качестве стандартов, может называться «анализом методом анионного обмена». Совершенно очевидно, и как было уже указано, могут быть применены и другие аналитические методы, а также другие конкретные методы анионного обмена.
Таким образом, альтернативно экспрессируемым предпочтительным полипептидом варианта PS4 является полипептид, который обладает не-мальтогенной экзоамилазной активностью, и который в тесте с инкубированием крахмала восковидной кукурузы обладает способностью продуцировать продукт(ы) гидролиза, состоящий(ие) из одного или нескольких линейных мальтоолигосахаридов, состоящих из 2-10 D-глюкопиранозильных звеньев и необязательно глюкозы, где указанные продукты гидролиза могут быть проанализированы методом анионного обмена, и где по меньшей мере 60% масс., предпочтительно, по меньшей мере 70% масс., более предпочтительно, по меньшей мере 80% масс. и наиболее предпочтительно, по меньшей мере 85% масс. указанных продуктов гидролиза состоят из линейных мальтоолигосахаридов, состоящих из 3-10 D-глюкопиранозильных звеньев, предпочтительно, линейных мальтоолигосахаридов, состоящих из 4-8 D-глюкопиранозильных звеньев.
Термин «линейный мальто-олигосахарид», используемый здесь в своем обычном значении, означает 2-10 единиц α-D-глюкопиранозы, соединенных α-(1→4)-связью.
В особенно предпочтительных вариантах изобретения, описанные здесь полипептиды PS4 обладают повышенной экзоамилазной активностью, предпочтительно, не-мальтогенной экзоамилазной активностью, по сравнению с родительским полипептидом, предпочтительно, при тестировании в одних и тех же условиях. В частности, в особенно предпочтительных вариантах изобретения, полипептиды варианта PS4 обладают 10% или более, предпочтительно, 20% или более, а более предпочтительно, 50% или более, экзоамиланой активностью по сравнению с активностью их родительских полипептидов, предпочтительно, при измерении в тесте с инкубированием крахмала восковидной кукурузы.
Продукты гидролиза могут быть проанализированы любыми подходящими методами. Так, например, продукты гидролиза могут быть проанализированы с помощью анионообменной ВЭЖХ на колонке Dionex PA 100 методом импульсной амперометрической детекции и с использованием, например, известных линейных мальтоолигосахаридов от глюкозы до мальтогептаозы в качестве стандартов.
Термин «линейный мальто-олигосахарид», используемый здесь в своем обычном значении, означает 2-20 единиц α-D-глюкопиранозы, соединенных α-(1→4)-связью.
Улучшенные технологические свойства
Описанные здесь варианты PS4, по сравнению с их родительскими ферментами, предпочтительно обладают улучшенными свойствами например, они обладают одним или несколькими из таких свойств, как повышенная термостабильность, повышенная стабильность к изменению рН или повышенная экзоспецифичность. Описанные здесь варианты PS4 также предпочтительно, обладают улучшенными технологическими свойствами, так, например, пищевой продукт, обработанный полипептидом варианта PS4, обладает любым одним или всеми из таких свойств, как пониженная плотность, повышенная упругость, повышенная слипаемость, пониженная раскрашиваемость или улучшенная сворачиваемость по сравнению с пищевым продуктом, который был обработан родительским полипептидом или полипептидом дикого типа.
Не ограничиваясь какой-либо конкретной теорией, авторы лишь отмечают, что мутации в конкретных положениях оказывают индивидуальное и кумулятивное действие на свойства полипептида, содержащего такие мутации.
Термостабильность и стабильность к изменению рH
Предпочтительно, полипептид варианта PS4 является термостабильным, а более предпочтительно, его термостабильность превышает термостабильность родительского фермента.
В пшенице и в других зерновых, внешние боковые цепи амилопектина имеют DP 12-19. Таким образом, ферментативный гидролиз боковых цепей амилопектина, например, под действием описанных здесь полипептидов варианта PS4, обладающих не-мальтогенной экзоамилазной активностью, могут значительно снижать их тенденцию к кристаллизации.
Крахмал пшеницы и других зерновых, используемых в хлебопекарном производстве, присутствует в форме крахмальных зерен, которые, по существу, обладают резистентностью к ферментативному воздействию амилаз. Так, например, модификация крахмала ограничивается, главным образом, разложением крахмала и происходит очень медленно в процессе обработки теста и начального выпекания до начала желатинизации примерно при 60°С. В результате, только амилазы с высокой степенью термостабильности обладают способностью эффективно модифицировать крахмал в процессе выпекания. Обычно, эффективность амилаз повышается с увеличением их термостабильности. То есть, поскольку более термостабильный фермент сохраняется в течение более длительного периода времени, то он может быть активным в процессе выпекания и тем самым может достигаться лучший эффект устойчивости к черствению.
В соответствии с этим, использование описанных здесь полипептидов варианта PS4 при их добавлении в крахмал на любой стадии его обработки с получением пищевого продукта, например, перед выпеканием или после выпекания хлеба, может приводить к замедлению или предотвращению, либо ослаблению ретроградации. Такое применение более подробно описано ниже.
Используемый здесь термин «термостабильный» относится к способности фермента сохранять активность после воздействия на него повышенных температур. При этом, предпочтительно, чтобы полипептид варианта PS4 обладал способностью разлагать крахмал при температурах примерно от 55°С до 80°С или более. В соответствии с этим, такой фермент сохраняет свою активность после воздействия на него температур примерно до 95°С.
Термостабильность фермента, такого как не-мальтогенная экзоамилаза, измеряют по времени ее полужизни. Так, например, описанные здесь полипептиды варианта PS4 имеют более длительное время полужизни, которое, предпочтительно, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% или более превышает время полужизни родительского фермента, предпочтительно, при повышенных температурах, составляющих от 55°С до примерно 95°С или более, предпочтительно, примерно 80°С.
Используемый здесь термин «время полужизни (t1/2)» означает время (в минутах), за которое половина ферментативной активности инактивируется в определенных условиях нагревания. В предпочтительных вариантах изобретения, время полужизни анализируют при 80°С. Предпочтительно, образец нагревают в течение 1-10 минут при 80°С или выше. Затем величину времени полужизни вычисляют путем измерения остаточной активности амилазы любыми описанными здесь методами. Предпочтительно, оценку времени полужизни проводят методами, более подробно описанными в примерах.
Предпочтительно, описанные здесь варианты PS4 являются активными в процессе выпекания и гидролиза крахмала и после желатинизации крахмальных гранул, которая начинается при температуре примерно 55°С. Чем более термостабильной является не-мальтогенная экзоамилаза, в течение более длительного времени она может быть активной и тем самым может достигаться лучший эффект устойчивости к черствению. Однако в процессе выпекания при температурах выше примерно 85°С может происходить инактивация фермента. Если это случается, то не-мальтогенная экзоамилаза может постепенно инактивироваться, и, по существу, она теряет свою активность после выпекания конечного продукта, а именно хлеба. Поэтому, при использовании не-мальтогенных экзоамилаз как описано выше, оптимальная температура преимущественно составляет выше 50°С и ниже 98°С.
Термостабильность описанных здесь вариантов PS4 может быть увеличена с использованием белка, сконструированного так, чтобы он был более термостабильным и был более подходящим для описанного здесь применения, а поэтому, авторы настоящего изобретения использовали варианты PS4, модифицированные путем конструирования белка так, чтобы они были более термостабильными.
Предпочтительно, полипептид варианта PS4 является стабильным к изменению pH, более предпочтительно, он обладает более высокой стабильностью к изменению рН, чем его когнатный родительский полипептид. Используемый здесь термин «стабильный к изменению рН» относится к способности фермента сохранять активность при широких интервалах значений рН. Предпочтительно, полипептид варианта PS4 обладает способностью разлагать крахмал при pH примерно от 5 до 10,5. В одном из вариантов изобретения, степень стабильности к изменению pH может быть проанализирована путем измерения времени полужизни фермента в конкретных условиях pH. В другом варианте изобретения, степень стабильности к изменению pH может быть проанализирована путем измерения активности или удельной активности фермента в конкретных условиях рН. Конкретными условиями рН могут быть любые значения рН от 5 до 10,5.
Таким образом, полипептид варианта PS4 может иметь более длительное время полужизни, или он может обладать более высокой активностью (в зависимости от анализа) по сравнению с родительским полипептидом в идентичных условиях. Полипептиды варианта PS4 могут иметь время полужизни, которое на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% или более превышает время полужизни родительских полипептидов в идентичных условиях рН. Альтернативно или дополнительно, они могут обладать более высокой активностью по сравнению с активностью родительского полипептида в идентичных условиях рН.
Экзоспецифичность
Известно, что некоторые не-мальногенные экзоамилазы могут обладать определенной степенью эндоамилазной активности. В некоторых случаях, активность такого типа необходимо снизить или элиминировать, поскольку эндоамилазная активность может негативно влиять на качество конечного хлебобулочного изделия в результате образования клейкого или вязкого мякиша вследствие аккумуляции разветвленных декстринов.
Экзоспецифичность может быть эффективно измерена путем определения отношения общей амилазной активности к общей эндоамилазной активности. В настоящей заявке, такое отношение называется «индексом экзоспецифичности». В предпочтительных вариантах изобретения, фермент называется экзоамилазой, если он имеет индекс экзоспецифичности 20 или более, то есть, если его общая амилазная активность (включая экзоамилазную активность) в 20 раз или более превышает его эндоамилазную активность. В наиболее предпочтительных вариантах изобретения, индекс экзоспецифичности экзоамилаз составляет 30 или более, 40 или более, 50 или более, 60 или более, 70 или более, 80 или более, 90 или более, или 100 или более. В особенно предпочтительных вариантах изобретения, индекс экзоспецифичности составляет 150 или более, 200 или более, 300 или более, 400 или более, 500 или более или 600 или более.
Общая амилазная активность и эндоамилазная активность могут быть измерены любыми методами, известными специалистам. Так, например, общая амилазная активность может быть измерена путем оценки общего числа восстанавливающих концов, высвобождаемых из субстрата крахмала. Альтернативно, проведение бетамилового анализа более подробно описано в примерах, а для удобства, амилазная активность, оцениваемая в примерах и представленная в таблицах, выражается в «бетамиловых единицах».
Эндоамилазная активность может быть проанализирована с помощью набора Phadebas (Pharmacia & Upjohn). В этом наборе используется меченный голубым красителем структурированный крахмал (меченный азо-красителем); причем, в молекуле крахмала, только внутренние, но не внешние, разрывы цепей высвобождают метку. Высвобождение красителя может быть оценено с помощью спектрофотометрии. В соответствии с этим, набор Phadebas позволяет измерять эндоамилазную активность, и для удобства, результаты такого анализа (описанного в примерах) называются в настоящей заявке «единицами Phadebas».
Поэтому, в особенно предпочтительном варианте изобретения, индекс экзоспецифичности выражают терминами «бетамиловые единицы»/единицы Phadebas», также обозначаемые «B/Phad».
Экзоспецифичность может быть также проанализирована методами, описанными в литературе, например, в публикации поданной авторами Международной патентной заявки № WO99/50399. Этот анализ позволяет измерять экзоспецифичность, выражаемую, как отношение эндоамилазной активности к экзоамилазной активности. Таким образом, в предпочтительном аспекте, описанные здесь варианты PS4 будут иметь активность менее, чем 0,5 эндоамиолазных единиц (EAU) на единицу экзоамилазной активности. Предпочтительно, не-мальтогенные экзоамилазы, которые являются подходящими для их применения в соответствии с настоящим изобретением, имеют активность менее, чем 0,05 EAU на единицу экзоамилазной активности, а более предпочтительно, менее, чем 0,01 EAU на единицу экзоамилазной активности.
Предпочтительно, описанные здесь варианты PS4 имеют экзоспецифичность, например, измеренную по индексу экзоспецифичности, как описано выше, что соответствует их экзоамилазной активности. Кроме того, эти варианты имеют более высокую или повышенную экзоспецифичность по сравнению с родительскими ферментами или полипептидами, от которых они происходят. Так, например, полипептиды варианта PS4 могут иметь индекс экзоспецифичности, который на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% или более превышает индекс экзоспецифичности их родительских полипептидов, предпочтительно, при идентичных условиях. Эти варианты имеют индекс экзоспецифичности, который в 1,5 раз или более, в 2 раза или более, в 5 раз или более, 10 раз или более, 50 раз или более, 100 раз или более превышают индекс экзоспецифичности их родительских полипептидов, предпочтительно, при идентичных условиях.
Улучшенные технологические свойства
Описанные здесь варианты PS4, по сравнению с родительским полипептидом или с полипептидом дикого типа, предпочтительно, обладают одним или несколькими улучшенными технологическими свойствами. В предпочтительных вариантах изобретения, такими улучшенными технологическими свойствами могут быть улучшенные хлебопекарные свойства.
Таким образом, вариантами PS4 являются такие полипептиды, которые при обработке ими пищевых продуктов, сообщают этим продуктам улучшенные технологические свойства или, предпочтительно, хлебопекарные свойства, по сравнению со свойствами пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа. Такие технологические или хлебопекарные свойства могут быть выбраны из группы, состоящей из плотности мякиша, упругости, слипаемости, раскрашиваемости и сворачиваемости хлебобулочного изделия.
Указанные технологические свойства могут быть проанализированы любыми методами, известными специалистам. Так, например, плотность мякиша, упругость и слипаемость могут быть определены путем оценки ломтиков хлеба с помощью анализа профиля консистенции, проводимого, например, на анализаторе консистенции, как описано в примерах.
Плотность
Описанными здесь вариантами PS4, предпочтительно, являются такие полипептиды, которые при обработке ими пищевых продуктов, по сравнению с обработкой родительским полипептидом или полипептидом дикого типа, сообщают этим пищевым продуктам пониженную плотность.
В предпочтительных вариантах изобретения, плотность обратно пропорциональна мягкости пищевого продукта, так, например, чем выше мягкость продукта, тем ниже его плотность, и наоборот.
Плотность, предпочтительно, измеряют в соответствии с «протоколом оценки плотности», описанным в примере 13.
Так, например, описанными здесь вариантами PS4, предпочтительно, являются такие полипептиды, которые при обработке ими пищевых продуктов, сообщают этим продуктам плотность, которая на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% или более ниже плотности пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа. Пищевой продукт, обработанный полипептидом варианта PS4, может иметь плотность, которая в 1,1 раз, 1,5 раз, в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или более ниже, чем плотность пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа.
Упругость
Описанными здесь вариантами PS4, предпочтительно, являются такие полипептиды варианта PS4, которые при обработке ими пищевых продуктов, по сравнению с обработкой родительским полипептидом или полипептидом дикого типа, сообщают этим пищевым продуктам повышенную упругость.
Упругость, предпочтительно, измеряют в соответствии с «протоколом оценки упругости», описанным в примере 14.
Так, например, описанными здесь вариантами PS4, предпочтительно, являются такие полипептиды варианта PS4, которые при обработке ими пищевых продуктов, сообщают этим продуктам упругость, которая на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% или более превышает упругость пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа. Пищевой продукт, обработанный полипептидом варианта PS4, может иметь упругость, которая в 1,1 раз, 1,5 раз, в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или более превышает упругость пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа.
Слипаемость
Описанными здесь вариантами PS4, предпочтительно, являются такие полипептиды варианта PS4, которые при обработке ими пищевых продуктов, по сравнению с обработкой родительским полипептидом или полипептидом дикого типа, сообщают этим пищевым продуктам повышенную слипаемость.
Слипаемость, предпочтительно, измеряют в соответствии с «протоколом оценки слипаемости», описанным в примере 15.
Так, например, описанными здесь вариантами PS4, предпочтительно, являются такие полипептиды варианта PS4, которые при обработке ими пищевых продуктов, сообщают этим продуктам слипаемость, которая на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% или более превышает слипаемость пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа. Пищевой продукт, обработанный полипептидом варианта PS4, может иметь слипаемость, которая в 1,1 раз, 1,5 раз, в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или более превышает слипаемость пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа.
Раскрашиваемость
Описанными здесь вариантами PS4, предпочтительно, являются такие полипептиды варианта PS4, которые при обработке ими пищевых продуктов, по сравнению с обработкой родительским полипептидом или полипептидом дикого типа, сообщают этим пищевым продуктам пониженную раскрашиваемость.
Раскрашиваемость, предпочтительно, измеряют в соответствии с «протоколом оценки раскрашиваемости», описанным в примере 16.
Так, например, описанными здесь вариантами PS4, предпочтительно, являются такие полипептиды варианта PS4, которые при обработке ими пищевых продуктов, сообщают этим продуктам раскрашиваемость, которая на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% или более ниже раскрашиваемости пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа. Пищевой продукт, обработанный полипептидом варианта PS4, может иметь раскрашиваемость, которая в 1,1 раз, 1,5 раз, в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или более ниже раскрашиваемости пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа.
Сворачиваемость
Описанными здесь вариантами PS4, предпочтительно, являются такие полипептиды варианта PS4, которые при обработке ими пищевых продуктов, по сравнению с обработкой родительским полипептидом или полипептидом дикого типа, сообщают этим пищевым продуктам повышенную сворачиваемость.
Сворачиваемость, предпочтительно, измеряют в соответствии с «протоколом оценки сворачиваемости», описанным в примере 17.
Так, например, описанными здесь вариантами PS4, предпочтительно, являются такие полипептиды варианта PS4, которые при обработке ими пищевых продуктов, сообщают этим продуктам сворачиваемость, которая на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% или более превышает сворачиваемость пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа. Пищевой продукт, обработанный полипептидом варианта PS4, может иметь сворачиваемость, которая в 1,1 раз, 1,5 раз, в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или более превышает сворачиваемость пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа.
Авторами настоящего изобретения было конкретно описано использование описанных здесь полипептидов варианта PS4 в комбинации с ксиланазой в целях улучшения сворачиваемости.
Применение полипептидов и нуклеиновых кислот варианта PS4
Полипептиды и нуклеиновые кислоты варианта PS4 и содержащие их клетки-хозяева, экспрессионные векторы и т.п. могут быть использованы в любых целях, для которых может быть использована амилаза. В частности, они могут быть использованы вместо любой не-мальтогенной экзоамилазы. Они могут быть также использованы в дополнение к амилазной или не-мальтогенной экзоамилазной активности, как отдельно, так и в комбинации с другими известными амилазами или не-мальтогенными экзоамилазами.
Описанные здесь последовательности варианта PS4 могут быть использованы в пищевой промышленности в различных целях, например, для выпекания хлебобулочных изделий и для приготовления напитков, и, кроме того, они могут быть использованы и в других целях, например, для получения фармацевтической композиции, или даже в химической промышленности. В частности, полипептиды и нуклеиновые кислоты варианта PS4 могут быть использованы для различных промышленных целей, включая хлебопекарное производство (как описано в WO 99/50399) и стандартизация муки (повышение объема или улучшение ее свойств). Они могут быть также использованы для получения мальтотетраозы из крахмала и других субстратов.
Поэтому, авторами настоящего изобретения был описан способ приготовления пищевого продукта, где указанный способ включает: (а) получение не-мальтогенной экзоамилазы; (b) введение мутации в любое одно или несколько положений не-мальтогенной экзоамилазы, как описано в настоящей заявке; и (с) смешивание полученного полипептида с пищевым ингредиентом.
Полипептиды варианта PS4 могут быть использованы для увеличения объема хлебобулочных изделий, таких как хлеб. Не ограничиваясь какой-либо конкретной теорией, авторы настоящего изобретения лишь отмечают, что такое увеличение вызвано снижением вязкости теста при нагревании (например, при выпекании) в результате экзоамилазного укорочения молекул амилозы. Это приводит к продуцированию двуокиси углерода посредством ферментации, что снижает затруднения в увеличении объема хлеба.
Таким образом, пищевые продукты, содержащие полипептиды варианта PS4, или обработанные такими полипептидами, имеют больший объем по сравнению с необработанными продуктами или продуктами, обработанными родительскими полипептидами. Другими словами, указанные пищевые продукты имеют больший объем воздуха на объем пищевого продукта. Альтернативно или дополнительно, пищевые продукты, обработанные полипептидами варианта PS4, имеют более низкую плотность или отношение веса (или массы) к объему. В особенно предпочтительных вариантах изобретения, полипептиды варианта PS4 используют для увеличения объема хлеба. Увеличение или расширение объема является предпочтительным, поскольку оно позволяет снижать клейкость или крахмалистость пищевых продуктов. Легкие пищевые продукты являются предпочтительными для потребителя, и спрос на эти продукты возрастает. В предпочтительных вариантах изобретения, использование полипептидов варианта PS4 позволяет увеличивать объем продукта на 10%, 20%, 30%, 40%, 50% или более.
Применение полипептидов варианта PS4, позволяющее увеличивать объем пищевых продуктов, подробно описано в примерах.
Использование пищевых продуктов
Описанные здесь полипептиды и нуклеиновые кислоты варианта PS4 могут быть использованы в качестве пищевого продукта или для приготовления пищевого продукта. В частности, они могут быть добавлены в пищу, то есть, могут быть использованы в качестве пищевой добавки. Термин «пищевой продукт» включает готовый пищевой продукт, а также пищевой ингредиент, такой как мука. В предпочтительном аспекте изобретения, пищевой продукт предназначен для его употребления человеком. Пищевой продукт может быть приготовлен в форме раствора или твердого вещества в зависимости от цели и/или способа применения и/или способа употребления.
Полипептиды и нуклеиновые кислоты варианта PS4 могут быть использованы в качестве пищевого ингредиента. Используемый здесь термин «пищевой ингредиент» включает композицию, которая представляет собой функциональные пищевые продукты или продукты питания или композицию, которая может быть добавлена в такие продукты, и этот термин также включает композиции, которые могут быть использованы в небольших количествах в продуктах широкого ряда, требующих, например, подкисления или эмульгирования. Пищевой ингредиент может быть приготовлен в форме раствора или твердого вещества, в зависимости от цели и/или способа его применения и/или способа введения.
Описанные здесь полипептиды и нуклеиновые кислоты варианта PS4 могут быть получены в виде пищевых добавок, либо они могут быть добавлены в эти пищевые добавки. Описанные здесь полипептиды и нуклеиновые кислоты варианта PS4 могут представлять собой функциональные пищевые продукты, либо они могут быть добавлены в эти функциональные пищевые продукты. Используемый здесь термин «функциональный пищевой продукт» означает пищевой продукт, обладающий не только питательными и/или вкусовыми свойствами, но также и другими свойствами, оказывающими благоприятное действие на потребителя. Хотя не существует юридического определения функционального пищевого продукта, однако большинство специалистов, работающих в этой области, согласны с тем, что эти продукты представлены на рынке как продукты, обладающие конкретными полезными для здоровья свойствами.
Полипептиды варианта PS4 могут быть также использованы в целях приготовления пищевых продуктов или продуктов питания. Типичными продуктами питания являются молочные продукты, мясные продукты, продукты из мяса домашней птицы, рыбные продукты и продукты из теста. Продуктами из теста могут быть любые обработанные продукты из теста, включая замороженное тесто, тесто глубокой заморозки, обжаренное тесто, выпеченное тесто, тесто, подвергнутое паровой сушке, и тесто, подвергнутое тепловой обработке, такие как паровой хлеб и рисовое печенье. В особенно предпочтительных вариантах изобретения, пищевым продуктом является хлебобулочный продукт.
Предпочтительным продуктом питания является хлебобулочный продукт. Типичными хлебобулочными продуктами (выпечкой) являются хлеб, такой как батоны, хлебцы, булочки, основы для пиццы и т.п., кондитерские изделия, крендели, лепешки, печенье, пирожные, бисквиты, крекеры и т.п.
Описанные здесь полипептиды варианта PS4, предпочтительно, сообщают пищевым продуктам одно или несколько улучшенных технологических или хлебопекарных свойств. Улучшенные технологические или хлебопекарные свойства могут быть выбраны из группы, состоящей из пониженной плотности, повышенной упругости, повышенной слипаемости, пониженной раскрашиваемости и повышенной сворачиваемости.
Поэтому авторами настоящего изобретения был описан способ модификации пищевой добавки, содержащей не-мальтогенную экзоамилазу, где указанный способ включает введение мутации в любое одно или несколько положений не-мальтогенной экзоамилазы, описанной в настоящей заявке. Тот же самый способ может быть применен для модификации пищевого ингредиента, пищевой добавки, пищевого продукта или продукты питания.
Ретроградация/черствение
Авторами настоящего изобретения описано применение белков варианта PS4, способных замедлять черствение крахмальных сред, таких как крахмальные гели. В частности, полипептиды варианта PS4 способны замедлять нежелательную ретроградацию крахмала.
Большинство крахмальных гранул состоит из смеси двух полимеров: в основном, линейной амилозы и в высокой степени разветвленного амилопектина. Амилопектин представляет собой очень крупную разветвленную молекулу, состоящую из цепей α-D-глюкопиранозильных звеньев, связанных 1-4-связями, где указанные цепи связаны друг с другом α-D-(1-6)-связями с образованием ветвей. Амилопектин присутствует во всех природных крахмалах, и у большинства часто встречающихся крахмалов, содержание амилопектина составляет примерно 75%. Амилоза, в основном, представляет собой линейную цепь, состоящую из (1-4)-связанных α-D-глюкопиранозильных звеньев, имеющих несколько α-D-(l-6)-ответвлений. Большинство крахмалов содержит примерно 25% амилозы.
Крахмальные зерна, нагретые в присутствии воды, подвергаются фазовому переходу типа «порядок-беспорядок», называемому желатинизацией, где жидкость поглощается набухающими зернами. Температура желатинизации у различных крахмалов варьируют. После охлаждения свежевыпеченного хлеба, амилозная фракция в течение нескольких часов подвергается ретроградации с обрабованием сетчатой структуры. Этот процесс является благоприятным, поскольку он приводит к образованию желаемой структуры мякиша с низкой степенью плотности и улучшенными свойствами, такими как нарезаемость ломтиками. В течение нескольких дней после выпекания, в желатинизированных крахмальных гранулах происходит более медленная кристаллизация амилопектина. В этом процессе, амилопектин, вероятно, усиливает амилозную сетчатую структуру, в которую внедряются крахмальные гранулы. Такое усиление приводит к повышению плотности хлебного мякиша. Такое усиление является одной из главных причин черствения хлеба.
Известно, что качество хлебобулочных изделий постепенно снижается во время хранения. В результате перекристаллизации крахмала (также называемой ретроградацией), способность мякиша сохраняться в воде нарушается, что значительно ухудшает органилептические и пищевые свойства продукта. Мякиш теряет мягкость и эластичность и становится твердым и раскрашеваемым. Увеличение плотности мякиша часто используется как мера черствения хлеба.
Скорость нежелательной ретроградации амилопектина зависит от длины боковых цепей амилопектина. Таким образом, ферментативный гидролиз боковых цепей амилопектина, например, под действием полипептидов варианта PS4, обладающих не-мальтогенной экзоамилазной активностью, может приводить к значительному снижению их тенденции к кристаллизации.
В соответствии с этим, применение описанных в настоящем описании полипептидов варианта PS4 при их добавлении в пищевой продукт на любой стадии его обработки, например, перед выпеканием или после выпекания хлеба, может приводить к замедлению или предотвращению, либо к снижению степени ретроградации. Такое применение более подробно описано ниже.
Авторами настоящего изобретения описан способ повышения способности не-мальтогенной экзоамилазы предотвращать черствение, предпочтительно, нежелательную ретроградацию продукта из теста, где указанный способ включает введение мутации в любое одно или несколько положений не-мальтогенной экзоамилазы, описанной в настоящей заявке.
Анализ для измерения ретроградации (включая черствение)
Для оценки действия описанных в настоящем описании полипептидов варианта PS4, обладающих не-мальтогенной экзоамилазной активностью, где указанное действие направлено на предотвращение черствения, плотность мякиша может быть измерена через 1, 3 и 7 дней после выпекания на универсальном анализаторе консистенции пищевых продуктов Instron 4301 или на аналогичном оборудовании, известном специалистам.
Другой метод, традиционно используемый в данной области и применяемый для оценки влияния полипептида варианта PS4, обладающего не-мальтогенной экзоамилазной активностью, на ретроградацию крахмала, основан на ДСК (дифференциальной сканирующей калориметрии). В этом методе измеряют энтальпию плавления амилопектина, подвергаемого ретроградации в хлебном мякише или в мякише, полученном от модельной системы теста, выпекаемого в присутствии или в отсутствии ферментов (контроль). Оборудованием для ДСК, применяемым в описанных примерах, является оборудование Mettler-Toledo DSC 820, работающее в градиенте температуры 20-95°С при шаге 10°С в минуту. Для получения образцов, 10-20 мг мякиша взвешивают и переносят в алюминиевые формы Mettler-Toledo, которые затем герметично закрывают.
Тесто модельной системы, используемое в описанных примерах, содержит стандартную пшеничную муку и оптимальное количество воды или буфера в присутствии или в отсутствии не-мальтогенной экзоамилазы варианта PS4. Эти образцы смешивают в 10-граммовых или 50-граммовых фаринографах Брабендера в течение 6 или 7 минут, соответственно. Образцы теста помещают в стеклянные тест-пробирки (15×0,8 см), снабженные крышкой. Содержимое этих тест-пробирок подвергают выпеканию в водяной бане, начиная с 30-минутного инкубирования при 33°С с последующим нагреванием с 33°С до 95°С в градиенте 1,1°С в минуту, и наконец с 5-минутным инкубированием при 95°С. Затем пробирки хранят в термостате при 20°С до проведения ДСК-анализа.
В предпочтительных вариантах изобретения, описанные здесь варианты PS4 имеют пониженную энтальпию плавления по сравнению с контролем. В наиболее предпочтительных вариантах изобретения, варианты PS4 имеют 10% или более низкую энтальпию плавления. Предпочтительно, они имеют на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более низкую энтальпию плавления по сравнению с контролем.
Получение продуктов из крахмала
Настоящее изобретение относится к применению полипептидов варианта PS4 для приготовления пищевых продуктов, а в частности, продуктов из крахмала. Этот способ включает получение продукта из крахмала путем добавления не-мальтогенного экзоамилазного фермента, такого как полипептид варианта PS4, в крахмальную среду. Если крахмальной средой является тесто, то такое тесто приготавливают путем смешивания муки, воды, не-мальтогенной экзоамилазы, которая представляет собой полипептид варианта PS4, и необязательно других возможных ингредиентов и добавок.
Термин «крахмал» означает крахмал per se или его компонент, в частности, амилопектин. Термин «крахмальная среда» означает любую подходящую среду, содержащую крахмал. Термин «продукт из крахмала» означает любой продукт, содержащий крахмал, либо продукт, полученный на основе крахмала или происходящий от крахмала. Продукт из крахмала, предпочтительно, содержит крахмал, полученный из пшеничной муки, либо его получают на основе такого крахмала, либо такой продукт происходит из крахмала, полученного из пшеничной муки. Используемый здесь термин «мука» является синонимом «пшеничной или другой зерновой муки тонкого помола». Однако, предпочтительно, этот термин означает муку, полученную из пшеницы per se, но не из другого зерна. Таким образом, если не указано иначе, используемый в настоящем описании термин «пшеничная мука», предпочтительно, означает пшеничную муку per se, а также пшеничную муку, присутствующую в среде, такой как тесто.
Предпочтительной мукой является пшеничная мука или ржаная мука или смеси пшеничной и ржаной муки. Однако в настоящем изобретении также рассматривается тесто, полученное из муки других зерновых, таких как, например, рис, кукуруза, ячмень и дурра (хлебное сорго). Предпочтительным продуктом из крахмала является хлебобулочное изделие. Более предпочтительным продуктом из крахмала является хлеб. Еще более предпочтительным продуктом из крахмала является выпеченное мучное хлебное изделие. Термин «выпеченное мучное хлебное изделие» означает любое хлебобулочное изделие, полученное из теста, приготавливаемого путем смешивания муки, воды и разрыхлителя в условиях образования теста. Совершенно очевидно, что в тестовую смесь могут быть добавлены и другие компоненты.
Таким образом, если продуктом из крахмала является выпеченное мучное хлебобулочное изделие, то процесс его приготовления включает смешивание, в любом подходящем порядке, муки, воды и разрыхлителя в условиях образования теста, и последующее добавление полипептида варианта PS4, необязательно в виде премикса. Разрыхлителем может быть химический разрыхлитель, такой как бикарбонат натрия или любой штамм Saccharomyces cerevisiae (пекарские дрожжи).
Не-мальтогенная экзоамилаза варианта PS4 может быть добавлена в тесто вместе с любым ингредиентом, включая воду или смесь тестовых ингредиентов, или вместе с любой добавкой или смесью добавок. Тесто может быть приготовлено любым стандартным методом приготовления теста, обычно применяемым в хлебопекарной промышленности или в любом другом производстве продуктов, выпекаемых из теста, полученного из муки.
Мучные хлебобулочные изделия, таких как, например, белый хлеб, хлеб, выпеченный из просеянной ржаной и пшеничной муки, хлебцы и т.п., обычно получают путем выпекания теста в печи при температуре в пределах от 180 до 250°С в течение примерно 15-60 минут. В процессе выпекания, на внешних слоях теста, где образуется корочка выпеченного продукта, в основном, происходит резкое снижение градиента температуры (200→120°С). Однако, из-за потребления тепла вследствие образования пара, температура мякиша, по окончании процесса выпекания, всего лишь близка к 100°С.
Авторами настоящего изобретения описан способ получения хлебобулочного изделия, включающий: (a) приготовление крахмальной среды; (b) добавление в крахмальную среду полипептида варианта PS4, описанного в настоящей заявке, и (c) подачу тепла к крахмальной среде во время или после стадии (b) с получением хлебобулочного изделия. Авторами настоящего изобретения также описан способ получения хлебобулочного изделия, включающий добавление в крахмальную среду описанного в настоящем описании полипептида варианта PS4.
Полипептид не-мальтогенной экзоамилазы варианта PS4 может быть добавлен в виде жидкого препарата или в виде сухой измельченной в порошок композиции, которая содержит фермент либо в форме отдельного активного компонента, либо в виде смеси с одним или несколькими дополнительными ингредиентами теста или добавками в тесто.
Улучшающая композиция
Авторами настоящего изобретения описаны улучшающие композиции, которые представляют собой композиции, улучшающие хлеб и композиции, улучшающие тесто. Такие композиции включают полипептид варианта PS4, необязательно вместе с другим ингредиентом, или с другим ферментом, или с тем и другим.
Настоящее изобретение также относится к применению таких композиций улучшающих хлеб и тесто, при выпекании. В другом аспекте, настоящее изобретение относится к хлебобулочному изделию или к тесту, полученным из композиции улучшающий хлеб или композиции, улучшающей тесто. В другом аспекте, настоящее изобретение относится к хлебобулочному изделию или тесту, полученному благодаря применению композиции улучшающий хлеб или композиции, улучшающий тесто.
Приготовление теста
Тесто может быть приготовлено путем смешивания муки, воды, композиции, улучшающей тесто, содержащей полипептид варианта PS4 (описанный выше), и необязательно, другие ингредиенты и добавки.
Композиция, улучшающая тесто, может быть добавлена вместе с любыми ингредиентами теста, включая муку, воду или другие необязательные ингредиенты или добавки. Композиция, улучшающая тесто, может быть добавлена перед добавлением муки или воды или других необязательных ингредиентов и добавок. Композиция, улучшающая тесто, может быть добавлена после добавления муки или воды или других необязательных ингредиентов и добавок. Тесто может быть приготовлено любым стандартным методом, обычно применяемым в хлебопекарной промышленности или в любой другой промышленности по изготовлению продуктов из теста.
Композиция, улучшающая тесто, может быть добавлена в форме жидкого препарата или в форме сухой порошкообразной композиции, содержащей либо один активный компонент, либо его смесь с одним или несколькими другими ингредиентами или добавками, входящими в состав теста.
Количество добавляемой не-мальтогенной экзоамилазы, а именно полипептида варианта PS4, обычно представляет собой количество, которое позволяет получить готовое тесто из 50-100000 единиц фермента на кг муки, предпочтительно, 100-50000 единиц фермента на кг муки. Предпочтительным является количество, составляющее 200-20000 единиц на кг муки. Альтернативно, количество добавляемой не-мальтогенной экзоамилазы, а именно полипептида варианта PS4 обычно представляет собой количество, которое позволяет получить готовое тесто, содержащее 0,02-50 м.д. фермента (0,02-50 мг фермента на кг муки), предпочтительно, 0,2-10 м.д.
В контексте настоящего описания, 1 единицу не-мальтогенной экзоамилазы определяют как количество фермента, которое высвобождает продукты гидролиза, эквивалентные 1 мкмоль восстанавливающего сахара в минуту при инкубировании при 50°С в тест-пробирке с 4 мл 10 мг/мл крахмала восковидной кукурузы в 50 мМ MES, 2 мМ хлорида кальция, pH 6,0 как описано ниже.
Описанное в настоящем описании тесто обычно содержит пшеничную муку грубого помола или пшеничную муку тонкого помола и/или муку другого типа, или крахмал, например, кукурузную муку, кукурузный крахмал, маисовую муку, рисовую муку, ржаную муку грубого помола, ржаную муку тонкого помола, овсяную муку тонкого помола, овсяную муку грубого помола, соевую муку, муку из сорго грубого помола, муку из сорго тонкого помола, муку из картофельных отходов, картофельную муку или картофельный крахмал. Тесто может быть свежим, замороженным или частично запеченным.
Тесто может содержать разрыхлитель, или оно может быть подвергнуто разрыхлению. Тесто может быть подвергнуто разрыхлению различными методами, такими как добавление химических разрыхлителей, например, бикарбоната натрия или дрожжевой закваски (для сбраживания теста), однако для разрыхления теста предпочтительно добавлять подходящую дрожжевую культуру, такую как Saccharomyces cerevisiae (пекарские дрожжи), например, коммерчески доступный штамм S. cerevisiae.
Тесто может содержать жир, такой как гранулированный жир или шортенинг. Тесто может также содержать и другой эмульгатор, такой как моно- или диглицериды, сложные эфиры сахаров и жирных кислот, сложные эфиры полиглицерина и жирных кислот, сложные эфиры молочной кислоты и моноглицеридов, сложные эфиры уксусной кислоты и моноглицеридов, стеараты полиоксиэтилена или лизолецитин.
Авторами настоящего изобретения также описан премикс, содержащий муку вместе с описанной в настоящем описании комбинацией. Такой премикс может содержать и другие добавки, улучшающие качество теста и/или хлеба, например, любые добавки, включая упомянутые в настоящем описании ферменты.
Дополнительные добавки или ингредиенты, вводимые в тесто
Для дополнительного улучшения свойств хлебобулочного изделия и придания этому изделию отличительных качеств, в тесто могут быть включены и другие ингредиенты и/или добавки. Другими такими добавляемыми компонентами могут быть ингредиенты, обычно добавляемые в тесто, а именно, соль, зерно, жир и масла, сахар или подсластитель, пищевые волокна, источники белка, такие как сухое молоко, глютен сои или яйца, и добавки к тесту, такие как эмульгаторы, другие ферменты, гидроколлоиды, ароматизаторы, окислители, минеральные вещества и витамины.
Эмульгаторы могут быть использованы в качестве улучшителей теста и размягчителей мякиша. Эмульгаторы, используемые в качестве улучшителей теста, могут сообщать ему устойчивость в состоянии покоя и тепловому стрессу во время расстойки. Кроме того, улучшители теста могут способствовать повышению устойчивости данного теста к изменениям времени сбраживания. Большинство улучшителей теста также ускоряют подъем теста в печи, что означает увеличение объема теста, начиная со времени расстойки и до выпекания продукта. И, наконец, улучшитель теста будет эмульгировать любые жиры, присутствующие в рецептурной композиции.
Подходящими эмульгаторами являются лецитин, полиоксиэтиленстеарат, моно- и диглицериды пищевых жирных кислот, сложные эфиры уксусной кислоты и моно- и диглицеридов пищевых жирных кислот, сложные эфиры молочной кислоты и моно- и диглицеридов пищевых жирных кислот, сложные эфиры лимонной кислоты и моно- и диглицеридов пищевых жирных кислот, сложные эфиры диацетилвинной кислоты и моно- и диглицеридов пищевых жирных кислот, сложные эфиры сахарозы и пищевых жирных кислот, стеароил-2-лактилат натрия и стеароил-2-лактилат кальция.
Дополнительные добавки или ингредиенты могут быть добавлены в тесто вместе с любым ингредиентом, добавляемым в тесто, включая муку, воду или другие необязательные ингредиенты или добавки, или с композицией улучшающей тесто. Дополнительные добавки или ингредиенты могут быть добавлены в тесто перед добавлением муки, воды, других необязательных ингредиентов и добавок или композиции улучшающей тесто. Дополнительные добавки или ингредиенты могут быть добавлены в тесто после добавления муки, воды, других необязательных ингредиентов и добавок или композиций улучшающих тесто.
Дополнительными добавками или ингредиентами, добавляемыми в тесто, обычно являются жидкие препараты. Однако дополнительными добавками или ингредиентами могут быть и сухие композиции.
Предпочтительно, дополнительные добавки или ингредиенты, добавляемые в тесто, составляют по меньшей мере 1% по массе муки, присутствующей в тесте. Более предпочтительно, другие добавки или ингредиенты, добавляемые в тесто, составляют по меньшей мере 2%, предпочтительно, по меньшей мере 3%, предпочтительно, по меньшей мере 4%, предпочтительно, по меньшей мере 5%, более предпочтительно, по меньшей мере 6%. Если такой добавкой является жир, то такой жир может составлять, в основном, 1-5%, обычно 1-3%, а чаще всего примерно 2%.
Другие ферменты
В комбинации с полипептидами варианта PS4 могут быть использованы один или несколько дополнительных ферментов. Такие комбинации могут быть, например, добавлены в состав пищевого продукта, препарата для приготовления теста, пищевого продукта или крахмала.
Такие дополнительные ферменты могут быть выбраны, например, из любых комбинаций, таких как: (a) Novamyl или его вариант, гомолог или мутант, обладающий мальтогенной альфа-амилазной активностью; (b) ксиланаза, такая как GRINDAMYLTM POWERBake 900 (Danisco A/S); (c) бактериальная α-амилаза, такая как Max-Life U4 (Danisco A/S); и (d) липаза, такая как GRINDAMYLTM POWERBake 4050 (Danisco A/S).
В одном из вариантов изобретения, полипептид варианта PS4 согласно изобретению используется в комбинации по меньшей мере с одним ферментом, выбранным из группы, состоящей из оксидоредуктаз, гидролаз, липаз, эстераз, гликозидаз, амилаз, пуллуланаз, ксиланаз, целлюлаз, гемицеллюлаз, крахмал-разлагающих ферментов, протеаз и липоксигеназ. В предпочтительном варианте изобретения, указанная композиция включает по меньшей мере один вариант PS4 и мальтогенную амилазу, происходящую от Bacillus, как описано в WO91/04669. Предпочтительный вариант включает вариант PS4 и муку.
В тесто могут быть добавлены и другие ферменты, включая оксидоредуктазы, гидролазы, такие как липазы и эстеразы, а также гликозидазы, такие как α-амилаза, пуллуланаза и ксиланаза. Оксидоредуктазы, такие как, например, глюкозо-оксидаза и гексозо-оксидаза, могут быть использованы для улучшения теста и для регуляции объема хлебобулочных изделий, а для улучшения технологических свойств теста, снижения плотности мякиша и увеличения объема хлеба могут быть добавлены ксиланазы и другие гемицеллюлазы. В качестве улучшителей теста и размягчителей мякиша могут быть использованы липазы, а для регуляции объема хлеба и дополнительного снижения плотности мякиша, в тесто могут быть включены α-амилазы и другие амилолитические ферменты.
Другие ферменты, которые могут быть использованы, могут быть выбраны из группы, состоящей из целлюлазы, гемицеллюлазы, крахмал-разлагающего фермента, протеазы, липоксигеназы.
Примерами подходящих оксидоредуктаз являются оксидазы, такие как фермент, окисляющий мальтозу, глюкозо-оксидаза (EC 1.1.3.4), углевод-расщепляющая оксидаза, глицерин-оксидаза, пиранозо-оксидаза, галактозо-оксидаза (EC 1.1.3.10) и гексозо-оксидаза (EC 1.1.3.5). Эти ферменты могут быть использованы для улучшения теста и для регуляции объема хлебобулочных изделий.
Среди крахмал-разлагающих ферментов, в качестве добавок, улучшающих тесто, особенно подходящими являются амилазы. α-Амилаза разлагает крахмал с образованием декстринов, которые затем разлагаются под действием β-амилазы с образованием мальтозы. Примерами подходящих амилаз являются мальтогенная альфа-амилаза, также называемая глюкан-1,4-α-мальтогидролазой (EC 3.2.1.133), происходящей от Bacillus stearothermophilus (например, NovamylTM (Novozymes)), α-амилаза (EC 3.2.1.1), происходящая от Bacillus amyloliqufaciens (например, Max Life U4 (Danisco AJS)), амилаза B. flavothermus (US 20050048611A1), варианты амилазы грибов с инсерциями альфа-амилазы (EC 3.2.1.133) от Bacillus stearothermophilus (WO2005019443), гибриды амилазы, описанные в US20060147581A1, и их варианты, гомологи и производные, обладающие мальтогенной альфа-амилазной активностью. В предпочтительном варианте изобретения, полипептид варианта PS4 может быть объединен с амилазами, в частности, с мальтогенными амилазами. Мальтогенная альфа-амилаза (глюкан-1,4-α-мальтогидролаза, E.C. 3.2.1.133) обладает способностью гидролизовать амилозу и амилопектин с образованием мальтозы в альфа-конфигурации. Другим подходящими крахмал-разлагающими ферментами, которые могут быть добавлены в тесто, являются глюкоамилазы и пуллуланазы.
Другим предпочтительным ферментом является по меньшей мере ксиланаза и/или по меньшей мере амилаза. Используемый в настоящем описании термин «ксиланаза» означает ксиланазы (EC 3.2.1.32), гидролизующие ксилозидные связи. Может быть также добавлена липаза. Примерами подходящих ксиланаз являются пекарские ксиланазы (EC 3.2.1.8), происходящие, например, от Bacillus sp., Aspergillus sp., Thermomyces sp. или Trichoderma sp. (такие как GRINDAMYLTM POWERBake 900 (Danisco AZS)) и ксиланазы, принадлежащие к семейству 10 или 11, и происходящие, например, от бактерии Thermomyces lanoginosus (ранее называемой Humicola insolens), Aspergillus aculeatus (WO 94/21785), Bacillus halodurans (WO 2005/059084), Bacillus sp (EP 0 720 649 Bl), B. agadeherens (US 5770424), и их варианты, гомологи и производные.
Используемый в настоящем описании термин «амилаза» означает амилазы, такие как α-амилазы (EC 3.2.1.1), β-амилазы (EC 3.2.1.2) и γ-амилазы (EC 3.2.1.3).
Другой фермент может быть добавлен вместе с любым ингредиентом теста, включая муку, воду или другие необязательные ингредиенты или добавки, или с композицией улучшающей тесто. Другой фермент может быть добавлен перед добавлением муки, воды и других необязательных ингредиентов и добавок, или композиции улучшающей тесто. Другой фермент может быть добавлен после добавления муки, воды и других необязательных ингредиентов и добавок, или композиции улучшающей тесто. Другой фермент может представлять собой, в основном, жидкий препарат. Однако такой препарат может быть получен, в основном, в форме сухой композиции.
Некоторые ферменты композиции улучшающей тесто обладают способностью взаимодействовать друг с другом в условиях приготовления теста так, что при таком взаимодействии, происходит улучшение реологических и/или технологических свойств теста из муки и/или качества продукта, приготовленного из теста под действием ферментов, при этом, эффект такого взаимодействия является не только аддитивным, но и синергическим.
Что касается улучшения качества продукта, приготовленного из теста (конечного продукта), то может оказаться, что такая комбинация дает значительный синергический эффект в отношении структуры мякиша. Кроме того, такой синергический эффект может наблюдаться в отношении конкретного объема хлебобулочного изделия.
Другим ферментом может быть липаза (EC 3.1.1), обладающая способностью гидролизовать связи из сложных эфиров карбоновых кислот с образованием карбоксилата. Примерами липаз являются, но не ограничивается ими, триацилглицерин-липаза (EC 3.1.1.3), галактолипаза (EC 3.1.1.26), фосфолипаза A1 (EC 3.1.1.32), фосфолипаза A2 (EC 3.1.1.4) и липопротеин-липаза A2 (EC 3.1.1.34). Более конкретно, подходящими липазами являются липазы, ппроисходящие от Mucor miehei, F. venenatun, H. lanuginosa, Rhizomucor miehei, Candida antarctica, F. oxysporum; гликолипаза, происходящая от Fusarium heterosporum (такая как GRINDAMYLTM POWERBake 4050 (Danisco A/S)), и их варианты, гомологи и производные.
Другие применения
Варианты PS4 являются подходящими для получения мальтозных сиропов и сиропов с высоким содержанием мальтозы. Такие продукты представляют особый интерес для приготовления некоторых кондитерских изделий, что обусловлено их низкой гигроскопичностью, низкой вязкостью, хорошей термостабильностью, а также умеренным, но не очень сладким вкусом мальтозы. Промышленный процесс получения мальтозных сиропов включает разжижение крахмала, а затем осахаривание ферментом, продуцирующим мальтозу, и необязательно, ферментом, расщепляющим точки ветвления 1,6-связей в амилопектине, например, альфа-1,6-амилоглюкозидазой.
Варианты PS4, описанные в настоящем описании, могут быть добавлены в моющую композицию, и таким образом, они становятся ее компонентом. Такая моющая композиция может быть, например, приготовлена в виде моющего средства для ручной или машинной стирки, включающего любую композицию с моющей добавкой, подходящей для предварительной обработки цветных тканей и композицию для умягчения тканей с добавлением ополаскивателя, или она может быть приготовлена в виде моющей композиции для очистки твердых поверхностей предметов домашнего обихода, либо для ручного или машинного мытья посуды. В своем конкретном аспекте, настоящее изобретение относится к моющей добавке, содержащей вариант PS4. Такая моющая добавка, а также моющая композиция могут содержать один или несколько других ферментов, таких как протеаза, липаза, кутиназа, амилаза, карбогидраза, целлюлаза, пектиназа, маннаназа, арабиназа, галактаназа, ксиланаза, оксидаза, например, лакказа и/или пероксидаза. Вообще говоря, свойства выбранного(ых) фермента(ов) должны быть совместимыми со свойствами выбранных детергентов (то есть, такой(ие) фермент(ы) должен(ны) иметь оптимальное значение pH и быть совместимым(и) с другими ферментативными и не-ферментативными ингредиентами и т.п.), и такой(ие) фермент(ы) должен(ны) присутствовать в эффективных количествах.
Вариант PS4 может быть также использован для получения лигноцеллюлозных материалов, таких как пульпа, бумага и картон, из армированных крахмалом бумажных отходов и картона, особенно в тех случаях, когда происходит роспуск бумажных отходов при pH выше 7 и когда амилазы могут облегчать дезинтеграцию отходов посредством разложения армирующего крахмала. Варианты PS4 могут быть особенно эффективными для получения бумажной массы из покрытой крахмалом запечатанной бумаги. Этот способ может быть осуществлен как описано в WO 95/14807, и может включать следующие стадии: a) дезинтеграцию бумаги с получением пульпы, b) обработку крахмал-разлагающим ферментом до, во время или после проведения стадии a), и c) отделение частиц краски от пульпы после проведения стадий a) и b). Вариант PS4 может быть также особенно эффективным для модификации крахмала, если ферментативно модифицированный крахмал используется для производства бумаги вместе со щелочными наполнителями, такими как карбонат кальция, каолин и глины. Описанные в настоящем описании варианты PS4 могут быть использованы для модификации крахмала в присутствии наполнителя, что упрощает этот трудоемкий процесс. Вариант PS4 может быть также с успехом использован в расшлихтовке ткани. В текстильной промышленности, амилазы обычно используются в качестве добавок в процессе расшлихтовки для облегчения удаления крахмал-содержащей шлихты, которая служит в качестве защитного покрытия на уточной пряже в процессе изготовления ткани. Полное удаление покрывающей шлихты после изготовления ткани является важным фактором, обеспечивающим оптимальные результаты последующих процессов, в которых осуществляется мойка, отбеливание и окрашивание ткани. Ферментативный гидролиз крахмала является предпочтительным, поскольку он не оказывает какого-либо негативного влияния на качество тканного материала. Вариант PS4 может быть использован отдельно или в комбинации с целлюлозой при расшлихтовке тканей или текстильных изделий, содержащих целлюлозу.
Вариант PS4 может также представлять собой амилазу, выбранную для получения подсластителей из крахмала. «Традиционный» способ превращения крахмала в фруктозные сиропы обычно состоит из трех последовательных ферментативных процессов, а именно, процесса разжижения, а затем осахаривания и изомеризации. В процессе разжижения, крахмал разлагается с образованием декстринов под действием амилазы при pH 5,5-6,2 и при температуре 95-160°С в течение приблизительно 2 часов. Для обеспечения оптимальной стабильности фермента в этих условиях добавляют 1 мМ кальция (40 м.д. без ионов кальция). После разжижения, декстрины превращают в декстрозу путем добавления глюкоамилазы и деветвящего фермента, такого как изоамилаза или пуллуланаза. Перед проведением этой стадии, pH снижают до величины ниже 4,5, смесь выдерживают при высокой температуре (выше 95°С), и активность разжижающей амилазы денатурируют. Затем температуру понижают до 60°С и добавляют глюкоамилазу и деветвящий фермент. Процесс осахаривания происходит в течение 24-72 часов.
Композиции моющих средств и их применение
Обсуждаемые в настоящем описании варианты α-амилазы могут быть получены в виде моющих композиций в целях их применения для мытья посуды или, например, в виде чистящих композиций. Такими композициями могут быть гели, порошки или жидкости. Указанные композиции могут содержать один вариант α-амилазы, другие амилолитические ферменты, другие очищающие ферменты и другие компоненты, обычно содержащиеся в чистящих композициях.
Таким образом, моющая композиция для мытья посуды может содержать поверхностно-активное вещество. Поверхностно-активным веществом может быть анионогенное, неионогенное, катионогенное, амфотерное поверхностно-активное вещество или их смеси любых типов. Моющее средство может содержать примерно 0%-90% масс. неионогенного поверхностно-активного вещества, такого как низкопенящиеся или непенящиеся этоксилированные-пропоксилированные спирты с прямой цепью.
При применении в качестве моющих средств, варианты α-амилазы обычно используются в жидкой композиции, содержащей пропиленгликоль. Вариант α-амилазы может быть солюбилизирован в пропиленгликоле, например, путем растворения в 25% об/об растворе пропиленгликоля, содержащем 10% хлорида кальция.
Композиция для мытья посуды может содержать детергент-модифицирующие неорганические и/или органические соли. Такие модификаторы детергентов могут быть подразделены на фосфор-содержащие и не содержащие фосфора соединения. Моющая композиция обычно содержит примерно 1-90% модификаторов детергентов. Примерами фосфор-содержащих неорганических щелочных модификаторов детергентов, если они присутствуют, являются водорастворимые соли, в частности, пирофосфаты, ортофосфаты и полифосфаты щелочных металлов. Примерами фосфор-содержащих органических щелочных модификаторов детергентов, если они присутствуют, являются водорастворимые соли фосфонатов. Примерами не содержащих фосфора неорганических модификаторов, если они присутствуют, являются водорастворимые карбонаты, бораты и силикаты щелочных металлов, а также различные типы нерастворимых в воде кристаллических или аморфных алюмосиликатов, из которых наиболее известными являются цеолиты.
Примерами подходящих органических модификаторов являются щелочные металлы; аммоний и замещенный аммоний; цитраты; сукцинаты; малонаты; сульфонаты жирных кислот; карбоксиметоксисукцинаты; полиацетаты аммония; карбоксилаты; поликарбоксилаты; аминополикарбоксилаты; полиацетилкарбоксилаты; и полигидроксисульфонаты.
Другими подходящими органическими модификаторами являются высокомолекулярные полимеры и сополимеры, которые, как известно, улучшают свойства продукта, например, соответствующие полиакриловая кислота, полималеиновая кислота и сополимеры полиакриловой/полималеиновой кислоты и их соли.
Чистящая композиция может содержать хлор-содержащие/бром-содержащие или кислород-содержащие отбеливатели. Примерами неорганических хлор-содержащих/бром-содержащих отбеливателей являются гипохлорит и гипобромит лития, натрия или кальция, а также хлорированный тринатрийфосфат. Примерами органических хлор-содержащих/бром-содержащих отбеливателей являются гетероциклические N-бром- и N-хлоримиды, такие как трихлоризоциануровая, трибромизоциануровая, дибромизоциануровая и дихлоризоциануровая кислоты и их соли водорастворимых катионов, таких как калий и натрий. Подходящими являются также гидантоиновые соединения.
Чистящая композиция может содержать кислородный отбеливатель, например, в форме неорганической персоли, необязательно, с предшественником отбеливателя, или в виде соединения пероксикислоты. Типичными примерами подходящих перокси-соединений, используемых в качестве отбеливателей, являются пербораты, тетрагидраты и моногидраты, а также перкарбонаты, персиликаты и перфосфаты щелочных металлов. Подходящими соединениями-активаторами являются тетраацетилэтилендиамин (TAED) и триацетат глицерина. Могут также присутствовать системы активации ферментативного отбеливателя, такие, как перборат или перкарбонат, триацетат глицерина и пергидролаза, описанные, например, в WO 2005/056783.
Чистящая композиция может быть стабилизирована с использованием стандартных агентов для стабилизации фермента(ов), например, полиола, такого как пропиленгликоль, сахар или спирт ряда сахаров, молочная кислота, борная кислота или производное борной кислоты (например, ароматический сложный эфир борной кислоты). Чистящая композиция может также содержать и другие стандартные ингредиенты моющих средств, например, дефлокулянт, наполнитель, пеногасители, противокоррозийные средства, грязеотталкивающие средства, секвестранты, средство, предотвращающее повторное осажение грязи, дегидратирующие средства, красители, бактерицидные средства, флуоресцентные агенты, загустители и отдушки.
И наконец, варианты α-амилазы могут быть использованы в стандартных средствах для мытья посуды, например, в любом моющем средстве, описанном в нижеследующих патентных публикациях, при условии, что описанные в настоящем описании варианты α-амилазы используются вместо или помимо любой α-амилазы, описанной в перечисленных ниже патентах и в опубликованных заявках: CA 2006687, GB 2200132, GB 2234980, GB 2228945, DE 3741617, DE 3727911, DE 4212166, DE 4137470, DE 3833047, DE 4205071, WO 93/25651, WO 93/18129, WO 93/04153, WO 92/06157, WO 92/08777, WO 93/21299, WO 93/17089, WO 93/03129, EP 481547, EP 530870, EP 533239, EP 554943, EP 429124, EP 346137, EP 561452, EP 318204, EP 318279, EP 271155, EP 271156, EP 346136, EP 518719, EP 518720, EP 518721, EP 516553, EP 561446, EP 516554, EP 516555, EP 530635, EP 414197, и в патентах США NN 5112518; 5141664 и 5240632.
В соответствии с одним из вариантов изобретения, типичными компонентами моющей композиции могут быть один или несколько вариантов α-амилазы. Так, например, такие варианты могут быть включены в моющую композицию в форме крупнозернистого гранулята, стабилизированной жидкости или защищенного фермента. Крупнозернистые грануляты могут быть получены, например, как описано в патентах США NN 4106991 и 4661452 и могут быть необязательно покрыты известными методами. Примерами материалов, используемых в качестве восков для покрытий, являются продукты полиэтиленоксида; полиэтиленгликоль (ПЭГ) со средней молярной массой 1000-20000; этоксилированные нонилфенолы, имеющие от 16 до 50 единиц этиленоксида; этоксилированные жирные спирты, где спирт содержит 12-20 атомов углерода, а содержание этиленоксида составляет 15-80 единиц; жирные спирты; жирные кислоты; и моно- и ди- и три-глицериды жирных кислот. Примеры пленкообразующих материалов для покрытий, подходящих для их применения в методах флюидизации, описаны, например, в патенте Великобритании No. 1483591. Жидкие ферментные препараты могут быть, например, стабилизированы путем добавления полиола, такого как пропиленгликоль, сахар или спирт ряда сахаров, молочная кислота или борная кислота, в соответствии со стандартными методами. Специалистам хорошо известны и другие стабилизаторы ферментов. Защищенные ферменты могут быть получены методом, описанным, например, в патенте США 5879920 (Genencor International, Inc.) или EP 238216. Полиолы давно известны как стабилизаторы белков, а также как средства, повышающие растворимость белков. См., например, публикацию Kaushik et al., "Why is trehalose an exceptional protein stabilizer? An analysis of the thermal stability of proteins in the presence of the compatible osmolyte trehalose" J. Biol. Chem. 278: 26458-65 (2003) и цитируемые там работы; и M. Conti et al., "Capillary isoelectric focusing: the problem of protein solubility," J Chromatography 757: 237-245 (1997).
Моющая композиция может быть получена в любой удобной форме, например, в виде гелей, порошков, гранул, паст или жидкостей. Жидким детергентом может быть водный детергент, обычно содержащий примерно до 70% воды и примерно 0-30% органического растворителя, и такой детергент может также присутствовать в форме компактного геля, содержащего только лишь примерно 30% воды.
Моющая композиция содержит одно или несколько поверхностно-активных веществ, каждое из которых может быть анионогенным, неионогенным, катионогенным или цвиттерионным. Это моющее средство обычно содержит примерно 0-50% анионогенного поверхностно-активного вещества, такого как алкилбензолсульфонат с прямой цепью (LAS); α-олефинсульфонат (AOS); алкилсульфат (сульфат жирного спирта)(AS); этоксисульфат спирта (AEOS или AES); вторичные алкансульфонаты (SAS); метиловые эфиры α-сульфожирных кислот; алкил- или алкенилянтарная кислота; или мыло. Такая композиция может также содержать примерно 0-40% неионогенного поверхностно-активного вещества, такого как этоксилат спирта (AEO или AE), карбоксилированные этоксилаты спиртов, этоксилат нонилфенола, алкилполигликозид, оксид алкилдиметиламина, этоксилированный моноэтаноламид жирной кислоты, моноэтаноламид жионой кислоты или полигидроксиалкиламид жирной кислоты, описанные, например, в WO 92/06154.
Моющая композиция может дополнительно содержать один или несколько других ферментов, таких как липаза, кутиназа, протеаза, целлюлаза, пероксидаза и/или лакказа в любой комбинации.
Моющее средство может содержать примерно 1-65% модификаторов детергентов или комплексообразующих агентов, таких как цеолит, дифосфат, трифосфат, фосфонат, цитрат, нитрилотриуксусная кислота (NTA), этилендиаминтетрауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота (DTMPA), алкил- или алкенилянтарная кислота, растворимые силикаты или слоистые силикаты (например, SKS-6 от Hoechst). Моющее средство может быть также немодифицированным, то есть, оно может, по существу, не содержать модификатора детергента. Ферменты могут быть использованы в любой композиции, не нарушающей стабильности фермента. Ферменты могут быть защищены, в основном, от вредных примесей известными методами инкапсулирования, например, гранлирования или секвестрации в гидрогелях. Ферменты, а, в частности, α-амилазы, содержащие или не содержащие крахмал-связывающие домены, применяются для стирки и мытья посуды и т.п., но могут быть также использованы в средствах для очистки поверхностей и для получения этанола из крахмала или биомассы.
Моющее средство может содержать один или несколько полимеров. Примерами являются карбоксиметилцеллюлоза (CMC), поливинилпирролидон (ПВП), полиэтиленгликоль (ПЭГ), поливиниловый спирт (ПВС), поликарбоксилаты, такие как полиакрилаты, сополимеры малеиновой/акриловой кислоты и сополимеры лаурилметакрилата/акриловой кислоты.
Моющее средство может содержать отбеливающую систему, которая может включать источник Н2О2, такой как перборат или перкарбонат, необязательно, объединенный с активатором отбеливателя, образующим перкислоту, таким как TAED или нонаноилоксибензолсульфонат (NOBS). Альтернативно, отбеливающая система может содержать пероксикислоты, например, амидного, имидного или сульфонового типа. Отбеливающей системой может быть также ферментативная отбеливающая система, в которой пергидролаза активирует пероксид, например, как описано в WO 2005/056783.
Ферменты моющей композиции могут быть стабилизированы с использованием стандартных стабилизаторов, например, полиола, такого как пропиленгликоль или глицерин; сахар или спирт ряда сахаров; молочная кислота, борная кислота, или производное борной кислоты, такое, как ароматический сложный эфир борной кислоты, где указанная композиция может быть получена, как описано, например, в WO 92/19709 и WO 92/19708.
Моющее средство может также содержать и другие стандартные ингредиенты моющих средств, такие как средство для кондиционирования тканей, включая, например, глины, усилители пенообразования, ингибиторы загрязнения, противокоррозийные средства, грязеотталкивающие средства; средства, предотвращающие повторное осаждение грязи, красители, бактерицидные средства, оптические отбеливатели или отдушки. pH (измеренный в водном растворе в используемой концентрации) обычно является нейтральным или щелочным, например, его значение может составлять приблизительно 7,0-11,0.
Вариант α-амилазы может быть включен в концентрациях, обычно используемых в моющих средствах. В моющей композиции, рассматриваемой в настоящем изобретении, вариант α-амилазы может быть добавлен в количестве, соответствующем 0,00001-1,0 мг (вычисленном как чистый ферментный белок) варианта α-амилазы на литр промывочного раствора. Могут быть получены конкретные формы моющих композиций, содержащих варианты α-амилазы, и такими формами являются:
(1) Моющая композиция, полученная в виде гранулята, имеющего объемную плотность по меньшей мере 600 г/л, и содержащего примерно 7-12% алкилбензолсульфоната с прямой цепью (вычисленного как кислота); примерно 1-4% этоксисульфата спирта (например, C12-18спирт, 1-2 этиленоксида (EO)) или алкилсульфата (например, C16-18); примерно 5-9% этоксилированного спирта (например, C14-15спирта, 7 EO); примерно 14-20% карбоната натрия (например, Na2CO3); примерно 2-6% растворимого силиката; примерно 15-22% цеолита (например, NaAlSiO4); примерно 0-6% сульфата натрия (Na2SO4); примерно 0-15% цитрата натрия/лимонной кислоты (например, C6H5Na3О7/C6H8O7); примерно 11-18% пербората натрия (например, NaBO3-H2O); примерно 2-6% TAED; примерно 0-2% карбоксиметилцеллюлозы (СМС); 0-3% полимеров (например, сополимера малеиновой кислоты/акриловой кислоты, ПВП, ПЭГ); 0,0001-0,1% ферментного белка (вычисленного как чистый фермент); и 0-5% вспомогательных ингредиентов (например, ингибиторов загрязнения, отдушек, оптических отбеливателей, фотоотбеливателей).
(2) Моющая композиция, полученная в виде гранулята, имеющего объемную плотность по меньшей мере 600 г/л, и содержащего примерно 6-11% алкилбензолсульфоната с прямой цепью (вычисленного как кислота); примерно 1-3% этоксисульфата спирта (например, C12-18спирта, 1-2 ЭО) или алкилсульфата (например, C16-18); примерно 5-9% этоксилированного спирта (например, C14-15спирта, 7 EO); примерно 15-21% карбоната натрия (например, Na2CO3); примерно 1-4% растворимого силиката; примерно 24-34% цеолита (например, NaAlSiO4); примерно 4-10% сульфата натрия (Na2SO4); примерно 0-15% цитрата натрия/лимонной кислоты (например, C6H5Na3О7/C6H8O7); примерно 0-2% карбоксиметилцеллюлозы (СМС); 1-6% полимеров (например, сополимера малеиновой кислоты/акриловой кислоты, ПВП, ПЭГ); 0,0001-0,1% ферментов (вычисленных как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, ингибиторов загрязнения, отдушек).
(3) Моющая композиция, полученная в виде гранулята, имеющего объемную плотность по меньшей мере 600 г/л, и содержащего примерно 5-9% алкилбензолсульфоната с прямой цепью (вычисленного как кислота); примерно 7-14% этоксилированного спирта (например, C12-15спирта, 7 EO); примерно 1-3% мыла в виде жирной кислоты (например, C16-22 жирной кислоты); примерно 10-17% карбоната натрия (например, Na2CO3); примерно 3-9% растворимого силиката; примерно 23-33% цеолита (например, NaAlSiO4); примерно 0-4% сульфата натрия (Na2SO4); примерно 8-16% пербората натрия (например, NaBO3·H2O); примерно 2-8% TAED; примерно 0-1% фосфоната (например, EDTMPA); примерно 0-2% карбоксиметилцеллюлозы (СМС); 0-3% полимеров (например, сополимера малеиновой кислоты/акриловой кислоты, ПВП, ПЭГ); 0,0001-0,1% ферментнов (вычисленных как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, ингибиторов загрязнения, отдушек, оптических отбеливателей).
(4) Моющая композиция, полученная в виде гранулята, имеющего объемную плотность по меньшей мере 600 г/л, и содержащего примерно 8-12% алкилбензолсульфоната с прямой цепью (вычисленного как кислота); примерно 10-25% этоксилированного спирта (например, C12-15спирта, 7 EO); примерно 14-22% карбоната натрия (например, Na2CO3); примерно 1-5% растворимого силиката; примерно 25-35% цеолита (например, NaAlSiO4); примерно 0-10% сульфата натрия (Na2SO4); примерно 0-2% карбоксиметилцеллюлозы (СМС); 1-3% полимеров (например, сополимера малеиновой кислоты/акриловой кислоты, ПВП, ПЭГ); 0,0001-0,1% ферментов (вычисленных как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, ингибиторов загрязнения, отдушек).
(5) Водная жидкая моющая композиция, содержащая примерно 15-21% алкилбензолсульфоната с прямой цепью (вычисленного как кислота); примерно 12-18% этоксилированного спирта (например, C12-15спирта, 7 EO или C12-15спирта, 5 EO); примерно 3-13% мыла в виде жирной кислоты (например, олеиновой кислоты); примерно 0-13% алкенилянтарной кислоты (С12-14); примерно 8-18% аминоэтанола; примерно 2-8% лимонной кислоты; примерно 0-3% фосфоната; примерно 0-3% полимеров (например, ПВП, ПЭГ); примерно 0-2% бората (например, В4О7); примерно 0-3% этанола; примерно 8-14% пропиленгликоля; 0,0001-0,1% ферментнов (вычисленных как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, диспергирующих агентов, ингибиторов загрязнения, отдушек, оптических отбеливателей).
(6) Водная структурированная жидкая моющая композиция, содержащая примерно 15-21% алкилбензолсульфоната с прямой цепью (вычисленного как кислота); 3-9% этоксилированного спирта (например, C12-15спирта, 7 EO или C12-15спирта, 5 EO); примерно 3-10% мыла в виде жирной кислоты (например, олеиновой кислоты); примерно 14-22% цеолита (например, NaAlSiO4); примерно 9-18% цитрата калия; примерно 0-2% бората (например, В4О7); примерно 0-2% карбоксиметилцеллюлозы (СМС); примерно 0-3% полимеров (например, ПЭГ, ПВП); примерно 0-3% заякоривающих полимеров (например, спосолимера лаурилметакрилата/акриловой кислоты, в молярном отношении 25:1, MW 3800); примерно 0-5% глицерина; 0,0001-0,1% ферментов (вычисленных как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, диспергирующих агентов, ингибиторов загрязнения, отдушек, оптических отбеливателей).
(7) Моющая композиция, полученная в виде гранулята, имеющего объемную плотность по меньшей мере 600 г/л, и содержащего примерно 5-10% сульфата жирного спирта; примерно 3-9% этоксилированного моноэтаноламида жирной кислоты; 0-3% мыла в виде жирной кислоты; примерно 5-10% карбоната натрия (например, Na2CO3); примерно 1-4% растворимого силиката; примерно 20-40% цеолита (например, NaAlSiO4); примерно 2-8% сульфата натрия (например, Na2SO4); примерно 12-18% пербората натрия (например, NaBO3·H2O); примерно 2-7% TAED; примерно 1-5% полимеров (например, сополимера малеиновой кислоты/акриловой кислоты, ПЭГ); 0,0001-0,1% ферментов (вычисленных как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, оптических отбеливателей, ингибиторов загрязнения, отдушек).
(8) Моющая композиция, полученная в виде гранулята, содержащего примерно 8-14% алкилбензолсульфоната с прямой цепью (вычисленного как кислота); примерно 5-11% этоксилированного моноэтаноламида жирной кислоты; 0-3% мыла в виде жирной кислоты; примерно 4-10% карбоната натрия (например, Na2CO3); примерно 1-4% растворимого силиката; примерно 30-50% цеолита (например, NaAlSiO4); примерно 3-11% сульфата натрия (Na2SO4); примерно 5-12% цитрата натрия (например, С6Н5Na3O7); примерно 1-5% полимеров (например, ПВП, сополимера малеиновой кислоты/акриловой кислоты, ПЭГ); 0,0001-0,1% ферментов (вычисленных как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, ингибиторов загрязнения, отдушек).
(9) Моющая композиция, полученная в виде гранулята, содержащего примерно 6-12% алкилбензолсульфоната с прямой цепью (вычисленного как кислота); примерно от 1-4% неионогенного поверхностно-активного вещества; примерно 2-6% мыла в виде жирной кислоты; примерно 14-22% карбоната натрия (например, Na2CO3); примерно 18-32% цеолита (например, NaAlSiO4); примерно 5-20% сульфата натрия (Na2SO4); примерно 3-8% цитрата натрия (например, C6H5Na3О7); примерно 4-9% пербората натрия (например, NaBO3·H2O); примерно 1-5% активатора отбеливателя (например, NOBS или TAED); примерно 0-2% карбоксиметилцеллюлозы (СМС); примерно 1-5% полимеров (например, поликарбоксилата или ПЭГ); 0,0001-0,1% ферментов (вычисленного как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, оптических отбеливателей, отдушек).
(10) Водная жидкая моющая композиция, содержащая примерно 15-23% алкилбензолсульфоната с прямой цепью (вычисленного как кислота); примерно 8-15% этоксисульфата спирта (например, C12-15спирта, 2-3 EO); примерно 3-9% этоксилированного спирта (например, C12-15спирта, 7ЕО или C12-15спирта, 5 EO); примерно 0-3% мыла в виде жирной кислоты (например, лауриновой кислоты); примерно 1-5% аминоэтанола; примерно 5-10% цитрата натрия; примерно 2-6% гидротропа (например, толуолсульфоната натрия); примерно 0-2% бората (например, В4О7); примерно 0-1% карбоксиметилцеллюлозы; примерно 1-3% этанола; примерно 2-5% пропиленгликоля; 0,0001-0,1% ферментов (вычисленных как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, полимеров, диспергирующих агентов, отдушек, оптических отбеливателей).
(11) Водная жидкая моющая композиция, содержащая примерно 20-32% алкилбензолсульфоната с прямой цепью (вычисленного как кислота); 6-12% этоксилированного спирта (например, C12-15спирта, 7ЕО или C12-15спирта, 5 EO); примерно 2-6% аминоэтанола; примерно 8-14% лимонной кислоты; примерно 1-3% бората (например, В4О7); примерно 0-3% полимеров (например, сополимера малеиновой/акриловой кислоты, заякоривающего полимера, такого как сополимер лаурилметакрилата/акриловой кислоты); примерно 3-8% глицерина; 0,0001-0,1% ферментов (вычисленных как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, гидротропов, диспергирующих агентов, отдушек, оптических отбеливателей).
(12) Моющая композиция, полученная в виде гранулята, имеющего объемную плотность по меньшей мере 600 г/л, и содержащего примерно 25-40% анионогенного поверхностно-активного вещества (алкилбензолсульфоната с прямой цепью, алкилсульфата, α-олефинсульфоната, метиловых эфиров α-сульфожирной кислоты, алкансульфонатов, мыла); примерно 1-10% неионогенного поверхностно-активного вещества (например, этоксилированного спирта); примерно 8-25% карбоната натрия (например, Na2CO3); примерно 5-15% растворимых силикатов; примерно 0-5% сульфата натрия (Na2SO4); примерно 15-28% цеолита (NaAlSiO4); примерно 0-20% пербората натрия (например, NaBO3·H2O); примерно 0-5% активатора отбеливателя (TAED или NOBS); примерно 0,0001-0,1% ферментов (вычисленных как чистый ферментный белок); и 0-3% вспомогательных ингредиентов (например, отдушек, оптических отбеливателей).
(13) Моющие композиции, описанные в пунктах 1)-12), см. выше, где весь алкилбензолсульфонат с прямой цепью или его часть заменены (C12-C18)алкилсульфатом.
(14) Моющая композиция, полученная в виде гранулята, имеющего объемную плотность по меньшей мере 600 г/л, и содержащего примерно 9-15% (С12-18)алкилсульфата; примерно 3-6% этоксилированного спирта; примерно 1-5% полигидроксиалкиламида жирной кислоты; примерно 10-20% цеолита (например, NaAlSiO4); примерно 10-20% слоистого дисиликата (например, SK56 от Hoechst); примерно 3-12% карбоната натрия (например, Na2CO3); примерно 0-6% растворимого силиката; примерно 4-8% цитрата натрия; примерно 13-22% перкарбоната натрия; примерно 3%-8% TAED; примерно 0-5% полимеров (например, поликарбоксилатов и ПВП); 0,0001-0,1% ферментов (вычисленных как чистый ферментный белок); и 0-5% вспомогательных ингредиентов (например, оптических отбеливателей, фотоотбеливателей, отдушек, ингибиторов загрязнения).
(15) Моющая композиция, полученная в виде гранулята, имеющего объемную плотность по меньшей мере 600 г/л, и содержащего примерно 4-8% (С12-18)алкилсульфата; примерно 11-15% этоксилированного спирта; примерно 1-4% мыла; примерно 35-45% цеолита МАР или цеолита А; примерно 2-8% карбоната натрия (например, Na2CO3); примерно 0-4% растворимого силиката; примерно 13-22% перкарбоната натрия; 1-8% TAED; примерно 0-3% карбоксиметилцеллюлозы (СМС); примерно 0-3% полимеров (например, поликарбоксилатов и ПВП); 0,0001-0,1% ферментов (вычисленных как чистый ферментный белок); и 0-3% вспомогательных ингредиентов (например, оптических отбеливателей, фосфонатов, отдушек).
(16) Моющие композиции, описанные выше в пунктах 1)-15), и содержащие стабилизированную или инкапсулированную перкислоту, либо в качестве дополнительного компонента, либо в качестве заменителя уже имеющихся конкретных отбеливающих систем.
(17) Моющие композиции, описанные выше в пунктах 1), 3), 7), 9) и 12), где перборат заменен перкарбонатом.
(18) Моющие композиции, описанные выше в пунктах 1), 3), 7), 9), 12), 14) и 15) и дополнительно содержащие марганцевый катализатор.
(19) Моющая композиция, приготовленная в виде безводной моющей жидкости, содержащей жидкое неионогенное поверхностно-активное вещество, такое как, например, алкоксилированный первичный спирт с прямой цепью, система модификаторов (например, фосфат), фермент(ы) и щелочь. Указанное моющее средство может также содержать анионогенное поверхностно-активное вещество и/или отбеливающую систему.
В другом варианте изобретения, в моющие композиции может быть включена 2,6-β-D-фруктан-гидролаза, которая может быть использована для удаления биопленки/очистки от биопленки, присутствующей на предметах домашнего обихода и/или готовых текстильных изделиях/белье.
Моющая композиция может быть, например, приготовлена в виде моющего средства для ручной или машинной стирки, включающего композицию с моющей добавкой, подходящую для предварительной обработки цветных тканей, и композицию для умягчения тканей с добавлением ополаскивателя, либо она может быть приготовлена в виде моющего средства для очистки твердых поверхностей предметов домашнего обихода, либо для ручного или машинного мытья посуды.
В конкретном аспекте изобретения, моющая композиция может включать 2,6-β-D-фруктан-гидролазу, один или несколько вариантов α-амилазы и один или несколько других очищающих ферментов, таких как протеаза, липаза, кутиназа, карбогидраза, целлюлаза, пектиназа, маннаназа, арабиназа, галактаназа, ксиланаза, оксидаза, лакказа и/или пероксидаза и/или их комбинации. Вообще говоря, свойства выбранного(ых) фермента(ов) должны быть совместимыми со свойством выбранных детергентов (то есть, такой(ие) фермент(ы) должен(ны) иметь оптимальное значение pH и быть совместимым(и) с другими ферментативными и не-ферментативными ингредиентами и т.п.), и такой(ие) фермент(ы) должен(ны) присутствовать в эффективных количествах.
Протеазы: подходящими протеазами являются протеазы животного, растительного или микробного происхождения. Могут быть также использованы химически модифицированные мутанты или мутанты, сконструированные на основе белка. Протеазами могут быть сериновая протеаза или металлопротеаза, например, микробная щелочная протеаза или трипсин-подобная протеаза. Примерами щелочных протеаз являются субтилизины, а в частности, субтилизины, происходящие от Bacillus sp., например, субтилизин Novo, субтилизин Carlsberg, субтилизин 309 (см., например, патент США № 6287841), субтилизин 147 и субтилизин 168 (см., например, WO 89/06279). Примерами трипсин-подобных протеаз являются трипсин (например, свиной или коровий) и протеазы Fusarium (см., например, WO 89/06270 и WO 94/25583). Примерами подходящих протеаз также являются, но не ограничивается ими, варианты, описанные в WO 92/19729 и WO 98/20115. Подходящими коммерчески доступными протеазами являются Alcalase®, Savinase®, Esperase®, и KannaseTM (Novozymes, прежнее название Novo Nordisk A/S); Maxatase®, MaxacalTM, MaxapemTM, ProperaseTM, Purafect®, Purafect OxPTM, FN2TM и FN3TM (Genencor International, Inc.).
Липазы: подходящими липазами являются липазы бактериального или грибкового происхождения. Могут быть также использованы химически модифицированные мутанты или мутанты, сконструированные на основе белка. Примерами подходящих липаз включают, но не ограничивается ими, липазы, происходящие от Humicola (синоним Thermomyces), например, H. lanuginosa (T. lanuginosa) (см., например, EP 258068 и EP 305216) и H. insolens (см., например, WO 96/13580); липаза Pseudomonas (например, от P. alcaligenes или P. pseudoalcaligenes; см., например, EP 218 272), P. cepacia {см. например, EP 331 376), P. stutzeri {см., например, GB 1372034), P. fluorescens, штамм SD 705 Pseudomonas sp. {см., например, WO 95/06720 и WO 96/27002), P. wisconsinensis {см., например, WO 96/12012); липаза Bacillus (например, от B. subtilis; см. например, Dartois et al. Biochemica Biophysica Acta, 1131: 253-360 (1993)), B. stearothermophilus {см. например, JP 64/744992), или B. pumilus {см. например, WO 91/16422). Дополнительными рассматриваемыми вариантами липаз, используемых в данных композициях, являются липазы, описанные, например, в WO 92/05249, WO 94/01541, WO 95/35381, WO 96/00292, WO 95/30744, WO 94/25578, WO 95/14783, WO 95/22615, WO 97/04079, WO 97/07202, EP 407225 и EP 260105. Некоторыми коммерчески доступными липазными ферментами являются Lipolase® и Lipolase® Ultra (Novozymes, прежнее название Novo Nordisk A/S).
Полиэстеразы: подходящие полиэстеразаы включают, но не ограничиваются ими, полиэстеразы, описанные в WO 01/34899 (Genencor International, Inc.) и WO 01/14629 (Genencor International, Inc.), и такие липазы могут быть включены в любую комбинацию с другими обсуждаемыми в настоящем описании ферментами.
Амилазы: композиции могут быть объединены с другими α-амилазами, такими как немодифицированная α-амилаза. Такими амилазами могут быть коммерчески доступные амилазы, которыми являются, но не ограничиваются ими, Duramyl®, TermamylTM, Fungamyl® и BANTM (Novozymes, прежнее название Novo Nordisk A/S), Rapidase® и Purastar® (Genencor International, Inc.).
Целлюлазы: в композиции могут быть добавлены целлюлазы. Подходящими целлюлазами являются целлюлазы бактериального или грибкового происхождения. Могут быть также использованы химически модифицированные мутанты или мутанты, сконструированные на основе белка. Подходящими целлюлазами являются целлюлазы, происходящие от бактерий рода Bacillus, Pseudomonas, Humicola, Fusarium, Thielavia, Acremonium, например, грибковые целлюлазы, происходящие от Humicola insolens, Myceliophthora thermophila и Fusarium oxysporum, и описанные, например, в патентах США NN 4435307; 5648263; 5691178; 5776757; и в WO 89/09259. Примерами рассматриваемых целлюлаз, которые могут быть использованы, являются целлюлазы, которые предохраняют текстильные изделия от нежелательной окраски. Примерами таких целлюлаз являются целлюлазы, описанные, например, в EP 0495257; EP 531 372; WO 99/25846 (Genencor International, Inc.), WO 96/34108 (Genencor International, Inc.), WO 96/11262; WO 96/29397; и WO 98/08940. Другими примерами являются варианты целлюлаз, например, варианты, описанные в WO 94/07998; WO 98/12307; WO 95/24471; PCT/DK98/00299; EP 531315; в патентах США №№ 5457046; 5686593 и 5763254. Коммерчески доступными целлюлазами являются Celluzyme® и Carezyme® (Novozymes, прежнее название Novo Nordisk A/S); ClazinaseTM и Puradax® HA (Genencor International, Inc.); и KAC-500(B)TM (Kao Corporation).
Пероксидазы/Оксидазы: подходящими рассматриваемыми пероксидазами/оксидазами, используемыми в данных композициях, являются пероксидазы/оксидазы растительного, бактериального или грибкового происхождения. Могут быть также использованы химически модифицированные мутанты или мутанты, сконструированные на основе белка. Примерами подходящих пероксидаз являются пероксидазы, происходящие от Coprinus, например, от C. cinereus, и их варианты, описанные в WO 93/24618, WO 95/10602 и WO 98/15257.
Фермент(ы), обладающий(ие) детергентными свойствами, может (могут) быть включен(ы) в моющую композицию в виде отдельных добавок, содержащих один или несколько ферментов, или в виде комбинированной добавки, содержащей все указанные ферменты. Детергентная добавка, то есть, отдельная добавка или комбинированная добавка может быть приготовлена в виде гранулята, жидкости, суспензии и т.п. Подходящие композиции, содержащие гранулированную детергентную добавку, включают крупнозернистые грануляты.
Крупнозернистые грануляты могут быть получены, например, как описано в патентах США №№ 4106991 и 4661452, и на них могут быть, но необязательно, нанесены покрытия методами, известными специалистам. Примерами материалов, используемых в качестве восков для покрытий, являются продукты полиэтиленоксида; например, полиэтиленгликоль (ПЭГ) со средней молярной массой 1000-20000; этоксилированные нонилфенолы, имеющие от 16 до 50 единиц этиленоксида; этоксилированные жирные спирты, где спирт содержит 12-20 атомов углерода, а содержание этиленоксида составляет 15-80 единиц; жирные спирты; жирные кислоты; и моно- и ди- и три-глицериды жирных кислот. Примеры пленкообразующих материалов для покрытий, подходящих для их применения в методах флюидизации, описаны, например, в патенте Великобритании No. 1483591. Жидкие ферментные препараты могут быть, например, стабилизированы путем добавления полиола, такого как пропиленгликоль, сахара или спирта ряда сахаров, молочной кислоты или борной кислоты, в соответствии со стандартными методами. Защищенные ферменты могут быть получены методом, описанным в EP 238216.
Моющая композиция может быть получена в любой подходящей форме, например, в виде брикета, таблеток, геля, порошка, гранул, пасты или жидкости. Жидкий детергент может представлять собой водный раствор, обычно содержащий примерно до 70% воды и примерно от 0 до 30% органического растворителя. Также рассматриваются компактные детергентные гели, содержащие 30% или менее воды. Моющая композиция содержит одно или несколько поверхностно-активных веществ, которые могут быть неионогенными, включая полуполярные поверхностно-активные вещества, а также анионогенными, катионогенными или цвиттерионными, или любые их комбинации. Поверхностно-активные вещества обычно присутствуют на уровне 0,1-60 масс.%.
Детергент, если он присутствует, обычно содержит примерно 1-40% анионогенного поверхностно-активного вещества, такого как алкилбензолсульфонат с прямой цепью, α-олефинсульфонат, алкилсульфат (сульфат жирного спирта), этоксисульфат спирта, вторичный алкансульфонат, метиловый эфир α-сульфо-жирной кислоты, алкил- или алкенилянтарная кислота или мыло.
Детергент, если он присутствует, обычно содержит примерно 0,2-40% неионогенного поверхностно-активного вещества, такого как этоксилированный спирт, этоксилированный нонилфенол, алкилполигликозид, оксид алкилдиметиламина, этоксилированный моноэтаноламид жирной кислоты, моноэтаноламид жирной кислоты, полигидроксиалкиламид жирной кислоты или N-ацил-N-алкиловые производные глюкозамина («глюкамиды»).
Детергент может содержать примерно 0%-65% модификатора детергента или комплексообразующего агента, такого как цеолит, дифосфат, трифосфат, фосфонат, карбонат, цитрат, нитрилотриуксусная кислота, этилендиаминтетрауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота, алкил- или алкенилянтарная кислота, растворимые силикаты или слоистые силикаты (например, SKS-6, Hoechst).
Детергент может содержать один или несколько полимеров. Примерами являются карбоксиметилцеллюлоза (CMC), поливинилпирролидон (ПВП), полиэтиленгликоль (ПЭГ), поливиниловый спирт (ПВС), поливинилпиридин-N-оксид, поливинилимидазол, поликарбоксилаты, например, полиакрилаты, сополимеры малеиновой/акриловой кислоты, и сополимеры лаурилметакрилата/акриловой кислоты.
Детергент может содержать отбеливающую систему, которая может включать источник Н2О2, такой как перборат или перкарбонат, которые могут быть объединены с образующим перкислоту активатором отбеливания (например, с тетраацетилэтилендиамином или нонаноилоксибензолсульфонатом). Альтернативно, отбеливающая система может включать пероксикислоты (например, пероксикислоты тапа амидов, имидов или сульфонов). Отбеливающей системой может быть также ферментативная отбеливающая система.
Фермент(ы) моющей композиции может(могут) быть стабилизирован(ы) с использованием стандартных стабилизирующих агентов, например, полиола (например, пропиленгликоля или глицерина), сахара или спирта ряда сахаров, молочной кислоты, борной кислоты, производного борной кислоты (например, ароматического сложного эфира борной кислоты) или производного фенилбороновой кислоты (например, 4-формилфенилбороновой кислоты). Указанная композиция может быть приготовлена, как описано в WO 92/19709 и WO 92/19708.
Детергент может также содержать и другие стандартные ингредиенты моющих средств, такие как средство для кондиционирования тканей, включая глины, усилители пенообразования, ингибиторы загрязнения, противокоррозийные средства, грязеотталкивающие средства, средства, предотвращающие повторное осажение грязи, красители, бактерицидные средства, оптические отбеливатели, гидротропы, ингибиторы окисления металлов или отдушки.
При этом, предусматривается, что в моющих композициях, варианты ферментов могут быть добавлены в количестве, соответствующем примерно 0,01-100 мг ферментного белка на литр промывочного раствора, в частности, примерно 0,05-5,0 мг ферментного белка на литр промывочного раствора, или более конкретно, примерно 0,1-1,0 мг ферментного белка на литр промывочного раствора.
Композиции для обработки крахмала и их применение
В другом аспекте настоящего изобретения, композиции, содержащие описанные в настоящем описании α-амилазные варианты, могут быть использованы для разжижения и/или осахаривания крахмала. Такая обработка крахмала может быть применена для получения подсластителей, продуцирования спирта в целях изготовления топлива или спиртных напитков (то есть, пищевого спирта), а также приготовления напитков, для производства сахара из сахарного тростника, или для получения нужных органических соединений, например, лимонной кислоты, итаконовой кислоты, молочной кислоты, глюконовой кислоты, кетонов, аминокислот, антибиотиков, ферментов, витаминов и гормонов. Превращение крахмала в фруктозные сиропы обычно состоит из трех последовательных ферментативных процессов: процесса разжижения, процесса осахаривания и процесса изомеризации. Во время разжижения, α-амилазный вариант разлагает крахмал с образованием декстринов при pH примерно 5,5-6,2 и при температурах примерно 95°С -160°С в течение приблизительно 2 часов. Для оптимизации стабильности фермента в этих условиях обычно добавляют примерно 1 мМ кальция (40 м.д., не содержащих ионов кальция). Для других α-амилазных вариантов могут потребоваться другие условия.
После разжижения, декстрины могут быть превращены в декстрозу путем добавления глюкоамилазы (например, AMGTM) и необязательно деветвящего фермента, такого как изоамилаза или пуллуланаза (например, Promozyme®). Перед проведением этой стадии, рН снижают до значения применрно ниже 4,5, поддерживая, при этом, высокую температуру (выше 95°С), и разжижающую активность α-амилазного варианта денатурируют. Затем температуру снижают до 60°С, после чего могут быть добавлены глюкоамилаза и деветвящий фермент. Процесс осахаривания обычно происходит в течение примерно 24-72 часов.
После осахаривания, рН повышают до значения примерно 6,0-8,0, например, 7,5, а затем кальций удаляют путем ионного обмена. После этого дектрозный сироп превращают в высококонцентрированный фруктозный сироп с использованием, например, иммобилизованной глюкозо-изомеразы (такой как Sweetzyme®).
α-Амилазный вариант может обладать по меньшей мере одним улучшенным ферментативным свойством, которое может быть использовано для осуществления процесса разжижения. Так, например, α-амилазный вариант может обладать более высокой активностью, либо он может иметь меньшую потребность в кальции. Добавление свободного кальция необходимо для обеспечения достаточно высокой стабильности α-амилазы, однако свободный кальций сильно ингибирует активность глюкозоизомеразы. В соответствии с этим, перед стадией изомеризации свободный кальций должен быть удален до уровня ниже 3-5 м.д. посредством проведения процедуры, требующей дорогостоящего оборудования, Если проведения этой процедуры можно избежать, то такого дорогостоящего оборудования не потребуется, и процесс разжижения можно было бы осуществить без добавления свободных ионов кальция. Таким образом, особенно предпочтительными являются α-амилазные варианты, которые не требуют присутствия ионов кальция, или которые имеют низкую потребность в кальции. Так, например, в указанных композициях и процедурах может быть использован α-амилазный вариант с меньшей зависимостью от кальция, где указанный вариант является стабильным и в высокой степени активным при низких концентрациях свободного кальция (<40 м.д.). Такой α-амилазный вариант должен иметь оптимальный рН в пределах примерно от 4,5 до 6,5, например, примерно от 4,5 до 5,5. α-амилазные варианты могут быть использованы отдельно для обеспечения специфического гидролиза, либо они могут быть объединены с другими амилазами с получением «коктейля», обладающего широким спектром активности.
Обрабатываемый крахмал может иметь высокую степень очистки, например, он может иметь чистоту по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 99,5%. Альтернативно, таким крахмалом может быть крахмал более грубой очистки, например, он может включать материал, содержащий размолотые цельные зерна, включая не-крахмальные фракции, такие как остатки семян и волокна. Неочищенный материал, такой как цельное зерно, размалывают до разрушения их структуры, а затем обрабатывают. Обычно применяют два способа помола: мокрый и сухой помол. Кроме того, могут быть использованы кукурузные крупы и размолотые кукурузные крупы. Сухое размолотое зерно, помимо крахмала, может содержать достаточное количество не-крахмальных углеводных соединений. Если такой гетерогенный материал обрабатывают в варочной камере распылительного типа, то в этих случаях, часто достигается только частичная желатинизация крахмала. В соответствии с этим, в процессе, предусматривающем разжижение и/или осахаривание сухого размолотого и крахмала, обработанного в варочной камере распылительного типа, предпочтительно использовать α-амилазные варианты, обладающие высокой активностью по отношению к нежелатинизированным крахмалам.
α-Амилазный вариант, обладающий превосходной гидролизующей активностью в процессе разжижения крахмала, имеет то преимущество, что он способствуют повышению эффективности стадии осахаривания {см. WO 98/22613) и требуют присутствия глюкоамилазы во время проведения стадии осахаривания. Глюкоамилаза преимущественно присутствует в количестве не более, чем или даже менее, чем 0,5 глюкоамилазных единиц активности (AGU)/г DS (то есть, единиц глюкоамилазной активности на грамм сухих твердых веществ). Глюкоамилаза может происходить от штаммов Aspergillus sp., Talaromyces sp., Pachykytospora sp., или Trametes sp., при этом, репрезентативными примерами являются Aspergillus niger, Talaromyces emersonii, Trametes cingulata или Pachykytospora papyracea. В одном из вариантов изобретения, указанный способ также включает использование углевод-связывающего домена, тип которого описан в WO 98/22613.
В еще одном аспекте изобретения, указанный способ может включать гидролиз суспензии желатинизированного или гранулированного крахмала, в частности, гидролиз гранулированного крахмала с образованием растворимого гидролизата крахмала при температуре ниже начальной температуры желатинизации гранулированного крахмала. Помимо контактирования с α-амилазным вариантом, крахмал может быть подвергнут контакту с одним или несколькими ферментами, выбранными из группы, состоящей из грибковой α-амилазы (EC 3.2.1.1), β-амилазы (EC 3.2.1.2), и глюкоамилазы (EC 3.2.1.3). В одном из вариантов изобретения, к α-амилазному варианту может быть добавлен еще один амилолитический фермент или деветвящий фермент, такой как изоамилаза (EC 3.2.1.68) или пуллуланазы (EC 3.2.1.41).
В одном из вариантов изобретения, указанный способ осуществляют при температуре ниже начальной температуры желатинизации. Такие процессы часто протекают по меньшей мере при 30°С, по меньшей мере при 31°С, по меньшей мере при 32°С, по меньшей мере при 33°С, по меньшей мере при 34°С, по меньшей мере при 35°С, по меньшей мере при 36°С, по меньшей мере при 37°С, по меньшей мере при 38°С, по меньшей мере при 39°С, по меньшей мере при 40°С, по меньшей мере при 41°С, по меньшей мере при 42°С, по меньшей мере при 43°С, по меньшей мере при 44°С, по меньшей мере при 45°С, по меньшей мере при 46°С, по меньшей мере при 47°С, по меньшей мере при 48°С, по меньшей мере при 49°С, по меньшей мере при 50°С, по меньшей мере при 51°С, по меньшей мере при 52°С, по меньшей мере при 53°С, по меньшей мере при 54°С, по меньшей мере при 55°С, по меньшей мере при 56°С, по меньшей мере при 57°С, по меньшей мере при 58°С, по меньшей мере при 59°С или по меньшей мере при 60°С. pH, при котором осуществляют такой процесс, может составлять примерно от 3,0 до 7,0, примерно от 3,5 до 6,0, или примерно от 4,0 до 5,0. В одном из аспектов изобретения рассматривается способ, включающий ферментацию под действием дрожжей, например, с получением этанола при температуре примерно 32°С, например, от 30°С до 35°С. В другом аспекте изобретения, указанный способ включает одновременное осахаривание и ферментацию под действием дрожжей с получением этанола, или под действием другого подходящего сбраживающего микроорганизма с получением нужного органического соединения, например, при температуре примерно от 30°С до 35°С, например, примерно при 32°С. В вышеупомянутых процессах ферментации, содержание этанола достигает по меньшей мере примерно 7%, по меньшей мере примерно 8%, по меньшей мере примерно 9%, по меньшей мере примерно 10%, по меньшей мере примерно 11%, по меньшей мере примерно 12%, по меньшей мере примерно 13%, по меньшей мере примерно 14%, по меньшей мере примерно 15%, или по меньшей мере примерно 16%.
Крахмальная суспензия, используемая в любом из вышеупомянутых аспектов изобретения, может содержать примерно 20%-55% сухого твердого гранулированного крахмала, примерно 25%-40% сухого твердого гранулированного крахмала, или примерно 30%-35% сухого твердого гранулированного крахмала. Такой вариант фермента превращает растворимый крахмал в растворимый гидролизат гранулированного крахмала в количестве по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91 %, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99%.
В другом варианте изобретения, α-амилазный вариант используют в способе разжижения или осахаривания желатинизированного крахмала, включая, но не ограничиваясь ими, желатинизация в варочной камере с распылением. Указанный способ может включать ферментацию с получением продукта ферментации, например, этанола. Такой способ получения этанола из крахмал-содержащего материала путем ферментации включает: (i) разжижение крахмал-содержащего материала под действием α-амилазного варианта; (ii) осахаривание полученной ожиженной массы; и (iii) ферментацию материала, полученного в стадии (ii), в присутствии сбраживающего микроорганизма. Кроме того, этот способ также включает, но необязательно, восстановление этанола. Процесс осахаривания и ферментации могут быть осуществлены как одновременная процедура осахаривания и ферментации (SSF). В процессе ферментации, содержание этанола достигает по меньшей мере примерно 7%, по меньшей мере примерно 8%, по меньшей мере примерно 9%, по меньшей мере примерно 10%, по меньшей мере примерно 11%, по меньшей мере примерно 12%, по меньшей мере примерно 13%, по меньшей мере примерно 14%, по меньшей мере примерно 15%, или по меньшей мере примерно 16%.
Крахмал, обработанный как описано в вышеупомянутых аспектах изобретения, может быть получен из клубней, корней, стеблей, бобов, зерна или цельного зерна. Более конкретно, гранулированный крахмал может быть получен из кукурузного зерна, кукурузных початков, пшеницы, ячменя, ржи, мило (разновидность сорго), саго, кассавы, тапиоки, сорго, риса, гороха, фасоли, бананов или картофеля. В частности, рассматривается использование восковидной и не-восковидной кукурузы и ячменя.
Используемый в настоящем описании термин «разжижение» или «разжижать» означает процесс, в результате которого крахмал превращается в менее вязкие декстрины, имеющие более короткие цепи. Обычно такой процесс включает желатинизацию крахмала, проводимую одновременно с добавлением или до добавления α-амилазного варианта. При этом, могут быть добавлены, но необязательно, дополнительные ферменты, индуцирующие разжижение. Используемый в настоящем описании термин «первичное разжижение» означает стадию разжижения, при которой температуру суспензии повышают до температуры желатинизации или доводят до температуры, близкой к температуре желатинизации. После повышения температуры, суспензию пропускают через теплообменник или сопло до достижения температуры примерно 90-150°С, например, 100-110°С. После достижения указанной температуры путем пропускания через теплообменник или сопло, указанную суспензию выдерживают при этой температуре в течение 3-10 минут. Эта стадия выдерживания суспензии при 90-150°С называется первичным разжижением.
Используемый в настоящем описании термин «вторичное разжижение» означает стадию разжижения, осуществляемую после первичного разжижения (при нагревании до 90-150°С), после чего эту суспензию оставляют для охлаждения до комнатной температуры. Такая стадия охлаждения может продолжаться от 30 минут до 180 минут, например, от 90 минут до 120 минут. Используемый в настоящем описании термин «минуты вторичного разжижения» означает время, прошедшее от начала процесса вторичного разжижения до момента измерения декстрозного эквивалента (ДЭ).
В другом аспекте изобретения рассматривается дополнительное использование β-амилазы в композиции, содержащей α-амилазный вариант. β-амилазы (EC 3.2.1.2) представляют собой экзоактивные мальтогенные амилазы, которые катализируют гидролиз 1,4-α-глюкозидных связей с образованием амилозы, амилопектина и родственных глюкозных полимеров, и с высвобождением мальтозы. β-Амилазы были выделены из различных растений и микроорганизмов (Fogarty et al., PROGRESS IN INDUSTRIAL MICROBIOLOGY, Vol. 15, pp. 112-115, 1979). Эти β-амилазы отличаются тем, что их оптимальные температуры составляют в пределах от 40°С до 65°С, а оптимальный рН составляет примерно от 4,5 до 7,0. Рассматриваемыми β-амилазами являются, но не ограничивается ими, β-амилазы, происходящие от ферментов ячменя Spezyme® BBA 1500, Spezyme® DBA, OptimaltTM ME, OptimaltTM BBA (Genencor International, Inc.); и NovozymTM WBA (Novozymes A/S).
Другим рассматриваемым ферментом, используемым в указанной композиции, является глюкоамилаза (EC 3.2.1.3). Глюкомилазы происходят от микроорганизма или растения. Так, например, глюкоамилазы могут иметь грибковое или бактериальное происхождение. Репрезентативными бактериальными глюкоамилазами являются глюкоамилазы Aspergillus, в частности, глюкоамилаза Gl или G2 A. niger (Boel et al. (1984), EMBO J. 3(5): 1097-1102), или их варианты, например, описанные в WO 92/00381 и WO 00/04136; глюкоамилаза A. awamori (WO 84/02921); глюкоамилаза A. oryzae (Agric. Biol. Chem. (1991), 55(4): 941-949), или их варианты или фрагменты.
Другими рассматриваемыми вариантами глюкоамилаз Aspergillus являются варианты, используемые для повышения термостабильности: G137A и G139A (Chen et al. (1996), Prot. Eng. 9: 499-505); D257E и D293E/Q (Chen et al. (1995), Prot. Eng. 8: 575-582); N 182 (Chen et al. (1994), Biochem. J. 301: 275-281); для образования дисульфидных связей, A246C (Fierobe et al. (1996), Biochemistry, 35: 8698-8704); и для введения остатков Pro в положения A435 и S436 (Li et al. (1997) Protein Eng. 10: 1199-1204). Другими рассматриваемыми глюкоамилазами являются глюкоамилазы Talaromyces, а в частности, глюкоамилазы, происходящие от T. emersonii (WO 99/28448), T. leycettanus (патент США No. RE 32153), T. duponti или T. thermophilus (патент США No. 4587215). Рассматриваемыми бактериальными глюкоамилазами являются глюкоамилазы, происходящие от рода Clostridium, в частности, C. thermoamylolyticum (EP 135138) и C. thermohydrosulfuricum (WO 86/01831). Подходящими глюкоамилазами являются глюкоамилазы, происходящие от Aspergillus oryzae, такие как глюкоамилаза, имеющая аминокислотную последовательность, которая на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, или даже на 90% гомологична аминокислотной последовательности, представленной в SEQ ID NO:2 в WO 00/04136. Подходящими также являются коммерчески доступные глюкоамилазы, такие как AMG 200L; AMG 300 L; SANTM SUPER и AMGTME (Novozymes); OPTIDEX® 300 (Genencor International, Inc.); AMIGASETM и AMIGASETM PLUS (от DSM); G-ZYME® G900 (Enzyme Bio-Systems); и G-ZYME® G990 ZR (глюкоамилаза A. niger с низким содержанием протеазы). Глюкоамилазы могут быть добавлены в количестве 0,02-2,0 AGU/г DS или 0,1-1,0 AGU/г DS, например, 0,2 AGU/г DS.
В композицию могут быть включены дополнительные варианты ферментов. Два или более α-амилазных варианта могут быть использованы отдельно или в комбинации с другими обсуждаемыми здесь ферментами. Так, например, третьим ферментом может быть другая α-амилаза, например, дрожжевая α-амилаза или другой α-амилазный вариант. Такими α-амилазами могут быть α-амилазы, происходящие от Bacillus, или α-амилазы, не происходящие от Bacillus.
Другим ферментом, который может быть добавлен, но необязательно, является деветвящий фермент, такой как изоамилаза (EC 3.2.1.68) или пуллуланазы (EC 3.2.1.41). Изоамилаза гидролизует связи α-1,6-D-глюкозидный ветвей в амилопектине и декстринах с ограниченным числом β-связей и в отличие от пуллуланаз может быть идентифицирована по своей неспособности взаимодействовать с пуллуланом и по своему ограниченному действию на декстрины с ограниченным числом α-связей. Деветвящие ферменты могут быть добавлены в эффективных количествах, хорошо известных специалистам.
Точный состав продуктов, используемых в данном процессе, зависит от комбинации используемых ферментов, а также от типа обработанного гранулированного крахмала. Растворимый гидролизат может представлять собой мальтозу, чистота которой составляет по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95,0%, по меньшей мере примерно 95,5%, по меньшей мере примерно 96,0%, по меньшей мере примерно 96,5%, по меньшей мере примерно 97,0%, по меньшей мере примерно 97,5%, по меньшей мере примерно 98,0%, по меньшей мере примерно 98,5%, по меньшей мере примерно 99,0% или по меньшей мере примерно 99,5%. Альтернативно, растворимым гидролизатом крахмала является глюкоза, либо гидролизат крахмала имеет ДЭ (процент глюкозы от общего содержания солюбилизированных сухих веществ) по меньшей мере 94,5%, по меньшей мере 95,0%, по меньшей мере 95,5%, по меньшей мере 96,0%, по меньшей мере 96,5%, по меньшей мере 97,0%, по меньшей мере 97,5%, по меньшей мере 98,0%, по меньшей мере 98,5%, по меньшей мере 99,0% или по меньшей мере 99,5%. В одном из вариантов изобретения, способ приготовления мороженного, пирожных, конфет и консервированных фруктов предусматривает использование особого сиропа, содержащего смесь глюкозы, мальтозы, DP3 и DPn.
Подходящими являются два способа помола: мокрый помол и сухой помол. При сухом помоле, перед использованием, цельное зерно измельчают. Мокрый помол позволяет эффективно отделять зародыш от муки (крахмальные зерна и белок) и обычно применяется в том случае, когда для приготовления сиропов используется гидролизат крахмала. Сухой и мокрый помол хорошо известны специалистам по обработке крахмала, и также рассматривается их применение в описанных композициях и способах. Такой способ может быть проведен в системе ультрафильтрации, где ретентат поддерживается при рециркуляции в присутствии ферментов, неочищенного крахмала и воды, и где пермеатом является растворимый гидролизат крахмала. Другим способом является процесс, проводимый в реакторе непрерывного действия с перегородками для ультрафильтрации, где ретентат поддерживается при рециркуляции в присутствии ферментов, неочищенного крахмала и воды, и где пермеатом является растворимый гидролизат крахмала. Также рассматривается процесс, проводимый в реакторе непрерывного действия с перегородками для микрофильтрации, где ретентат поддерживается при рециркуляции в присутствии ферментов, неочищенного крахмала и воды, и где пермеатом является растворимый гидролизат крахмала.
В одном из вариантов изобретения, растворимый гидролизат крахмала, используемый в таком процессе, превращают в крахмальный сироп с высоким содержанием фруктозы (HFSS), например, кукурузный сироп с высоким содержанием фруктозы (HFCS). Такое превращение может быть достигнуто с использованием глюкозо-изомеразы, а в частности, глюкозо-изомеразы, иммобилизованной на твердом носителе. Рассматриваемыми изомеразами являются коммерчески доступные продукты Sweetzyme®, IT (Novozymes A/S); G-zyme® IMGI, и G-zyme® G993, Ketomax®, G-zyme® G993, жидкий G-zyme® G993 и GenSweet® IGI.
В другом аспекте изобретения, из полученного растворимого гидролизата крахмала получают топливо или пищевой этанол. В способе согласно третьему аспекту изобретения, ферментация может быть осуществлена одновременно с гидролизом суспензии гранулированного крахмала или независимо от гидролиза или после такого гидролиза. Если ферментацию осуществляют одновременно с гидролизом, то температура может составлять 30°С-35°С, а в частности, 31°С-34°С. Такой процесс может быть проведен в системе ультрафильтрации, где ретентат поддерживают при рециркуляции в присутствии ферментов, неочищенного крахмала, дрожжей, дрожжевых питательных компонентов и воды, и где пермеатом является жидкость, содержащая этанол. Также рассматривается процесс, проводимый в реакторе непрерывного действия с перегородками для ультрафильтрации, где ретентат поддерживается при рециркуляции в присутствии ферментов, неочищенного крахмала, дрожжей, дрожжевых питательных компонентов и воды, и где пермеатом является жидкость, содержащая этанол.
Растворимый гидролизат крахмала, применяемый в данном процессе, может быть также использован для получения продукта ферментации, где указанный процесс включает ферментацию обработанного крахмала с образованием продукта ферментации, такого как лимонная кислота, моноглутамат натрия, глюконовая кислота, глюконат натрия, глюконат кальция, глюконат калия, глюконо-дельта-лактон или эриторбат натрия.
Амилолитическая активность α-амилазного варианта может быть определена с использованием картофельного крахмала в качестве субстрата. Такой способ основан на расщеплении модифицированного картофельного крахмала под действием фермента, а после проведения реакции, образцы раствора крахмала/фермента смешивают с раствором иода. Вначале образуется черновато-синяя окраска, но по мере расщепления крахмала, синяя окраска ослабевает и постепенно переходит в красновато-коричневую окраску, которую сравнивают со стандартно окрашенным стеклом.
Получение этанола
Полипептид варианта PS4 может быть использован, в основном, для превращения крахмала в сахара, которые затем могут быть обработаны с получением этанола или других условно чистых продуктов, таких как кукурузные подсластители с высоким содержанием фруктозы. Так, например, авторами настоящего изобретения было описано применение полипептидов варианта PS4 в целях получения этанола, а в частности, биоэтанола, которые в настоящей заявке должны рассматриваться как любой этанол, полученный путем ферментации биомассы.
Полученный таким образом этанол может быть использован в качестве топлива или напитков, либо он может быть использован в процессе ферментации для получения органических соединений, таких как лимонная кислота, аскорбиновая кислота, лизин, глутаминовая кислота. Эти соединения более подробно описаны ниже.
Этанол (или этиловый спирт) наиболее известен как основа для производства алкогольных напитков, таких как спирт, пиво и вино. Кроме того, этанол широко применяется для получения промышленных химических препаратов, фармацевтических средств и в качестве топлива для транспортных средств.
Этанол может быть получен почти из любого сырья, содержащего сахар или углеводы. Сам этанол может быть получен из биологических материалов широкого ряда. Для получения этанола используется исходная биомасса 3 главных типов, а именно, сахарные сельскохозяйственные культуры, такие как сахарный тростник; крахмал-содержащие культуры, включая пшеницу и кукурузу, и целлюлозные материалы, такие как послеуборочные растительные отходы (солома и т.п.) и отходы деревообрабатывающей промышленности. Производство этанола из легко доступных источников целлюлозы позволяет получать топливо из стабильного и неисчерпаемого источника.
Наиболее часто применяемой технологией производства этанола является сухой помол зерна. В этом способе, зерно сначала измельчают с получением муки крупнозернистой консистенции. Затем эту муку смешивают с водой и амилазой и пропускают через варочный аппарат, где крахмал зерна разжижается. При добавлении глюкоамилазы, разжиженный крахмал превращается в ферментируемые сахара. Затем к биомассе добавляют дрожжи для ферментации сахаров в этанол. После ферментации, биомассу подвергают перегонке и дегидратации, при которой из твердых веществ и воды выделяется спирт. На практике, примерно две трети от каждой тонны зерна превращается в этаноловое топливо. Оставшиеся побочные продукты, а именно, фильтрат барды и сырая дробина, являются кормом для скота с высоким содержанием белка, который является особенно подходящим для животных, таких как крупный рогатый скот или овцы.
Этанол может быть также получен из источников, содержащих целлюлозу, таких как древесная пульпа. Целлюлозное сырье состоит из сельскохозяйственных отходов, трав и древесины, а также другой низкокачественной биомассы, такой как городские отходы (например, бумажные отходы, дворовый мусор и т.п.). Этанол может быть получен путем ферментации любого из указанных источников целлюлозы. Однако сначала целлюлоза должна быть превращена в сахара, а затем, она может быть превращена в этанол путем обработки подходящим ферментом, таким как целлюлоза.
После выделения этанола на технологической установке, теоретически, он может быть использован в качестве автомобильного топлива в чистом виде, либо он может быть смешан с бензином в отношении 85:15 с образованием так называемого «чистого этанолового топлива». Однако, чаще всего, этанол смешивают с бензином в концентрациях 7-10% об. Этанол может быть использован в качестве добавки, повышающей октановое число бензина. Этанол, используемый в качестве источника топлива, является более экологически чистым, чем продукты, изготавливаемые из нефти. Известно, что применение этанола приводит к повышению чистоты воздуха и может снижать локальные уровни озона и смога. Кроме того, по сравнению с бензином, утилизация этанола может иметь стратегическое важное значение в предотвращении негативных последствий временных перебоев в поставке невозобновляемых источников энергии и нефтехимических продуктов.
Применение в пивоваренной промышленности
Этанол (или этиловый спирт) наиболее известен как основа алкогольных напитков, таких как спирты, пиво и вино. Так, например, описанные в настоящем описании полипептиды варианта PS4 могут быть использованы в пивоварении, а в частности, для производства пива. Все сорта пива варят способом, основанным на простом рецепте.
Процесс пивоварения предусматривает использование осоложенного зерна, и в зависимости от региона, таким зерном обычно является ячмень, пшеница, а иногда рожь. Солод получают путем проращивания зерна, которое затем сушат в печи, а иногда поджаривают. В процессе проращивания продуцируются различные ферменты, а именно α-амилазы и β-амилазы, которые используются для превращения крахмала зерна в сахар. В зависимости от степени обжаривания, солод может принимать темную окраску и значительно влияет на цвет и вкус пива.
Солод измельчают для разрушения сердцевины зерна, увеличения площади его поверхности и отделения более мелких кусочков от шелухи. Полученную солодовую крупку смешивают с подогретой водой в чане, называемом «заторным чаном», для проведения процедуры, известной под названием «затирание солода». Во время этой процедуры, природные ферменты в солоде превращают большую часть крахмала в сахара, которые играют главную роль в процессе ферментации. Процедура затирания солода занимает 1-2 часа, и в это время, остаток затора с различными температурами (время ожидания) активирует различные ферменты в зависимости от типа используемого солода, уровня его модификации и желаний пивовара. Активность этих ферментов направлена на превращение крахмала зерна в декстрины и в ферментируемые сахара, такие как мальтоза. Заторный чан обычно содержит «ложное днище» с прорезями или другую форму фильтрующей системы, которая действует как сетчатый фильтр, позволяющий отделять жидкость от зерна.
Остаток затора, при 120°F-130°F (49°С-55°С) активирует различные протеиназы, разрушающие белки, которые могут вызывать помутнение пива. Но при этом, следует соблюдать меры предосторожности, поскольку головная фракция пива также состоит, главным образом, из белков, которые имеют очень агрессивную природу, а поэтому такая белковая пауза может приводить к тому, что пиво не сможет сохранять головную фракцию. Эта пауза, в основном, используется только с недостаточно модифицированным солодом (то есть, недостаточно осоложенным зерном), который не очень популярен в Германии или в Чехии, или с неосоложенным зерном, таким как кукуруза и рис, которое широко используется в пивоварении в Северной Америке. Остаток затора при 60°С или 140°F активирует бета-глюканазу, которая разрушает смолообразные бета-глюканы в солодовой массе, что позволяет сахарам более свободно выходить при последующем прохождении этого процесса. В современном способе затирания солода, в качестве добавки может быть использована коммерчески доступная грибковая бета-глюканаза. И наконец, остаток затора при температуре 149°F-160°F (65-71°С) используется для превращения крахмалов солода в сахар, который затем утилизируется дрожжами в процессе пивоварения. Затор, находящийся дальше от легкого погона в данном аппарате, продуцирует низшие сахара, которые легче поддаются ферментации дрожжами. Это, в свою очередь, снижает экстрактивность пива и повышает содержание спирта. Затор, находящийся ближе к тяжелому погону в данном аппарате, образует большее количество высших сахаров, которые хуже поддаются ферментации дрожжами, а поэтому пиво приобретает большую экстрактивность и имеет меньшее содержание спирта.
После затирания солода, полученную жидкость выжимают из зерна способом, известным как фильтрация пивного сусла. Перед фильтрацией пивного сусла, температура затора солода может повышаться до 165°F-170°F (примерно 75°С) (этот процесс известен как брожение солода) с дезактивацией ферментов. Зерно может быть опрыскано дополнительным количеством воды для экстракции дополнительных сахаров (этот процесс известен как орошение пивной дробины).
Жидкость, образующаяся на этой стадии, называется суслом. Сусло переносят в большой чан, известный как «сусловарочный котел» или пивоваренный котел, где указанное сусло кипятят вместе с хмелем, а иногда и с другими ингредиентами, такими как травы или сахара. Процесс варки служит для прекращения ферментативных процессов, осаждения белков, изомеризации смол, содержащихся в хмеле, концентрирования и стерилизации сусла. Хмель добавляют в пиво для придания ему вкуса, аромата и горечи. По окончании варки, охмеленное сусло осаждают для его осветления в сосуде, называемом «гидроциклонный чан», а затем осветленное сусло охлаждают.
Затем сусло поступает в «сосуд для ферментации», в который были добавлены дрожжи, или в котором сусло было засеяно дрожжами. Дрожжи превращают сахара солода в спирт, двуокись углерода и другие компоненты по механизму, называемому гликолизом. По истечении 1-3 недель, свежее (или «зеленое») пиво выливают в кондиционирующие чаны. После кондиционирования в течение периода времени от одной недели до нескольких месяцев, пиво часто фильтруют для удаления дрожжей и крупных частиц. После этого «светлое пиво» становится готовым к употреблению или упаковке.
Поэтому, один или несколько полипептидов варианта PS4 могут быть добавлены на любой стадии варки пива для повышения природной амилазной активности.
Применение для изготовления кормов
В одном из вариантов изобретения, полипептид варианта PS4 обладает способностью разлагать резистентный к деградации крахмал.
Используемый в настоящем описании термин «деградация» относится к частичному или полному гидролизу или разложению резистентного к деградации крахмала с образованием глюкозы и/или олигосахаридов, таких как мальтоза и/или декстрины.
Полипептид варианта PS4 может разрушать остаточный резистентный к деградации крахмал, который не был полностью разрушен под действием амилазы животного происхождения. Так, например, полипептид варианта PS4 может быть использован в целях улучшения функции амилазы животного происхождения (например, панкреатической амилазы) для повышения уровня разложения резистентного к деградации крахмала. Панкреатическая α-амилаза секретируется в пищеварительную систему животных. Панкреатическая α-амилаза разлагает крахмал в корме. Однако часть крахмала, то есть, резистентного к деградации крахмала, полностью не разлагается под действием панкреатической α-амилазы, а поэтому она не абсорбируется в тонком кишечнике (см. определение резистентного к деградации крахмала). В некоторых вариантах изобретения, полипептид варианта PS4 стимулирует разложение крахмала панкреатической α-амилазой в пищеварительной системе, и тем самым, повышает уровень утилизации крахмала в организме животного.
Способность фермента разлагать резистентный к деградации крахмал может быть проанализирована, например, методом, разработанным и описанным в публикации Megazyme International Ireland Ltd. для определения уровня содержания резистентного к деградации крахмала, солюбилизированного крахмала и общего крахмала в образце (Процедура анализа резистентного к деградации крахмала, метод AOAC 2002.02, метод AACC 32-40).
В соответствии с этим, полипептиды варианта PS4 могут оказывать благоприятное действие при их проглатывании животным, а поэтому они могут быть введены в корма для животных.
Авторами настоящего изобретения было описано применение полипептида варианта PS4 в качестве компонента для крахмал-содержащих кормов или для улучшения состава корма, в котором полипептид варианта PS4 обладает способностью разлагать резистентный к деградации крахмал. Авторами настоящего изобретения также описан корм, содержащий крахмал и полипептид варианта PS4. Авторами настоящего изобретения также описан способ разложения резистентного к деградации крахмала в корме, где указанный способ включает контактирование указанного резистентного к деградации крахмала с полипептидом варианта PS4.
Авторами настоящего изобретения также описано применение полипептида варианта PS4 в целях приготовления крахмал-содержащего корма для разложения резистентного к деградации крахмала. Кроме того, авторами настоящего изобретения также описано применение полипептида варианта PS4 в целях приготовления корма для повышения его калорийности. Авторами настоящего изобретения описано применение фермента в целях приготовления корма для животного с улучшенными технологическими свойствами. В другом варианте изобретения, авторами настоящего изобретения описан способ приготовления корма, включающий смешивание крахмала с ферментом полипептида варианта PS4.
Так, например, применение компонента, содержащего полипептиды варианта PS4, способного разлагать резистентный к деградации крахмал, является предпочтительным, поскольку оно позволяет значительно повысить уровень разложения крахмала и/или продуктов разложения крахмала у животного. Кроме того, такое применение является предпочтительным, поскольку оно позволяет значительно повысить уровень разлагаемости крахмала и/или продуктов разложения крахмала у животного. Кроме того, такое применение является предпочтительным, поскольку оно позволяет повышать эффективность вырабатывания энергии организмом животного из данного корма. Кроме того, такое применение является предпочтительным, поскольку оно позволяет повышать биологическую доступность резистентного к деградации крахмала.
Корма для животных
Корма для животных, которые являются подходящими для включения в них полипептидов варианта PS4, могут быть изготовлены так, чтобы они удовлетворяли конкретным требованиям в питательных веществах для животных конкретных групп, и чтобы они содержали необходимые углеводы, жиры, белки и другие питательные элементы в форме, которая может подвергаться метаболизму в организме животного.
Предпочтительным кормом для животных является корм для свиней или домашней птицы.
Используемый в настоящем описании термин «свинья» означает нежвачное всеядное животное, такие как поросенок, боров или хряк. Обычно, корм для свиней включает примерно 50% углеводов, примерно 20% белка и примерно 5% жира. Примером высокоэнергетического корма для свиней является корм, полученный на основе кукурузы, который часто изготавливают в комбинации с кормовыми добавками, такими как, например, белок, микроэлементы, витамины и аминокислоты, такие как лизин и триптофан. Примерами кормов для свиней являются белковые продукты животного происхождения, морепродукты, молочные продукты, зерновые продукты и белковые продукты растительного происхождения, каждый из которых может также содержать природные ароматизаторы, искусственные ароматизаторы, микро- и макроэлементы, животные жиры, растительные жиры, витамины, консерванты или лекарственные препараты, такие как антибиотики.
При этом, следует отметить, что в настоящем описании, включая формулу изобретения, термин «корм для свиней» включает «рацион переходного периода откорма» или «рацион начального периода откорма» (используемый для поросят-отъемышей) и «рацион завершающего периода откорма» или «рацион, скармливаемый молодняку в период роста» (используемые для откорма свиней после переходной стадии до достижения ими возраста и/или размера, подходящего для продажи).
Используемый в настоящем описании термин «домашняя птица» означает любую птицу, такую как цыплята, бройлеры, куры, петухи, каплуны, индейки, утки, куры бойцовой породы, самки-молодки или молодые петушки. Корма для домашней птицы могут называться «полноценными» кормами, поскольку такие корма содержат все вещества, а именно, белки, источники энергии, витамины, микроэлементы и другие питательные вещества, необходимые для нужного роста, яйценоскости и здоровья птиц. Однако корма для домашней птицы могут также содержать витамины, микроэлементы или лекарственные препараты, такие как кокцидиостаты (например, монензин-натрий, лазалоцид, ампролий, салиномицин и сульфахиноксалин) и/или антибиотики (например, пенициллин, бацитрацин, хлортетрациклин и окситетрациклин).
Корм для цыплят или бройлеров, индеек и уток, откармливаемых на мясо, отличается от корма для молодок, содержащихся для несения яиц. Бройлеры, утки и индейки являются более крупной птицей и увеличение их массы происходит быстрее, чем у кур, содержащихся для несения яиц. Поэтому, кормовой рацион для таких птиц содержит большее количество белка и имеет большую энергетическую ценность.
Следует отметить, что в настоящем описании, включая формулу изобретения, термин «корм для домашней птицы» означает «рацион начального периода откорма» (используемый после выведения цыплят), «рацион завершающего периода откорма», «рацион, скармливаемый молодняку в период роста» или «рацион, скармливаемый ремонтному молодняку и подготавливающий его организм к периоду яйцекладки» (используемые для скармливания птицам в возрасте 6-8 недель до достижения ими размера, достаточного для убоя) и «рацион для несушек» (рацион, скармливаемый во время несения яиц).
Корма для животных могут быть изготовлены так, чтобы они удовлетворяли потребностям организма животного в питательных веществах, необходимых, например, для откармливания животного в целях получения мяса, молока и яиц, а также для воспроизводства и вырабатывания у животных реакции на стресс. Кроме того, указанные корма для животных приготавливают в целях улучшения качества удобрений из птичьего помета.
В предпочтительном аспекте изобретения, корм для животных содержит неочищенный материал, такой как бобы, например, горох или сою, или зерно, например, зерно пшеницы, кукурузы (маиса), ржи или ячменя. Подходящим неочищенным материалом может быть картофель.
Пищевые продукты
Полипептиды варианта PS4 могут быть включены в корма для животных путем прямого или опосредованного введения полипептидов варианта PS4 в корм, независимо от того, вводятся ли они отдельно или в комбинации с другими ингредиентами, такими как пищевые ингредиенты.
Типичными пищевыми ингредиентами могут быть любые одна или несколько добавок, таких как животный или растительный жир, природные или синтетические приправы, антиоксидант, модификатор вязкости, эфирные масла и/или отдушки, красители, и/или окрашивающие агенты, витамины, минеральные вещества, природные и/или не-природные аминокислоты, питательные вещества, дополнительные ферменты (включая генетически модифицированные ферменты), связывающий агент, такой как гуаровая камедь или ксантановая камедь, буферы, эмульгаторы, замасливатели, адъюванты, суспендирующие агенты, консерванты, агенты для нанесения покрытий или солюбилизирующие агенты и т.п.
Примерами способов применения являются, но не ограничивается ими, покрытие пищевого продукта материалом, содержащем полипептид варианта PS4, прямое нанесение путем смешивания полипептида варианта PS4 с пищевым продуктом, распыление полипептида варианта PS4 на поверхность пищевого продукта или погружение указанного пищевого продукта в препарат полипептида варианта PS4.
Полипептид варианта PS4, предпочтительно, наносят путем его смешивания с пищевым продуктом или путем распыления указанного полипептида на частицы пищевого продукта для животных. Альтернативно, полипептид варианта PS4 может быть включен в эмульсию пищевого продукта или он может быть введен вовнутрь твердых продуктов путем инжекции или перемешивания.
Полипептид варианта PS4 может быть нанесен на пищевой продукт путем его включения в пищевой продукт, нанесения покрытия на пищевой продукт и/или пропитки указанного пищевого продукта. Могут быть также использованы смеси с другими ингредиентами, и такие смеси могут быть нанесены отдельно, одновременно или последовательно. Аналогичным образом, в пищевой продукт одновременно (либо в виде смеси, либо отдельно) или последовательно могут быть введены хелатообразующие агенты, связывающие агенты, эмульгаторы и другие добавки, такие как макро- и микроэлементы, аминокислоты, витамины, животные жиры, растительные жиры, консерванты, ароматизаторы и красители.
Количество полипептида варианта PS4
Оптимальное количество используемого полипептида варианта PS4 зависит от типа обрабатываемого пищевого продукта и/или способа конатактирования пищевого продукта с полипептидом варианта PS4 и/или цели его применения. Количество полипептида варианта PS4 должно быть достаточным для эффективного разложения резистентного к деградации крахмала после и во время употребления данного продукта в пищу.
Предпочтительно, полипептид варианта PS4 должен оставаться эффективным после поедания пищевого продукта животным и во время расщепления данного пищевого продукта до его более полного гидролиза, то есть, данный полипептид способствует повышению калорийности полученного пищевого продукта.
Комбинации амилаз
Авторами настоящего изобретения были описаны конкретные комбинации полипептидов варианта PS4 с амилазами, в частности, с мальтогенными амилазами. Мальтогенная альфа-амилаза (глюкан-1,4-α-мальтогидролаза, E.C. 3.2.1.133) обладает способностью гидролизовать амилозу и амилопектин с образованием мальтозы в альфа-конфигурации.
Мальтогенная альфа-амилаза, происходящая от Bacillus (EP 120693), имеется в продаже под торговым знаком Novamyl (Novo Nordisk A/S, Denmark) и широко применяется в хлебопекарной промышленности в качестве агента, препятствующего черствению, что обусловлено его способностью снижать уровень ретроградации крахмала. Novamyl подробно описан в публикации Международной патентной заявки WO 91/04669. Мальтогенная альфа-амилаза Novamyl имеет несколько общих свойств, присущих циклодекстрин-глюканотрансферазам (ЦГТазам), включая гомологию их последовательностей (Henrissat B, Bairoch A; Biochem. J., 316, 695-696 (1996)) и образование продуктов трансгликозилирования (Christophersen, C, et al., 1997, Starch, vol. 50, No. 1, 39-45).
В наиболее предпочтительных вариантах изобретения, авторами настоящего изобретения были описаны комбинации, включающие полипептиды варианта PS4 вместе с Novamyl или с любыми его вариантами. Такие комбинации могут быть использованы для приготовления пищевых продуктов, таких как хлебобулочные изделия. Novamyl может, в частности, представлять собой Novamyl 1500 MG.
Другими документами, в которых описаны Novamyl и его применение, являются публикации Christophersen, C, Pedersen, S., and Christensen, T., (1993) Method for production of maltose an a limit dextrin, the limit dextrin, и use of the limit dextrin. Denmark, и WO 95/10627. Более подробное описание можно найти в патенте США No.4598048 и в патенте США No.4604355. Каждая из этих публикаций включена в настоящее описание посредством ссылки, и любой из описанных там полипептидов Novamyl может быть использован в комбинации с любыми из описанных в настоящем описании полипептидов варианта PS4.
Варианты, гомологи и мутанты Novamyl могут быть использованы в комбинациях, при условии, что они обладают альфа-амилазной активностью. Так, например, любые варианты Novamyl, описанные в патенте США № 6162628, полное содержание которого включено в настоящее описание посредством ссылки, могут быть использованы в комбинации с описанными в настоящем описании полипептидами варианта PS4. В частности, могут быть использованы любые полипептиды, описанные в этом документе, а именно, варианты SEQ ID NO:1, описанные в патенте США № 6162628, в любом одном или нескольких положениях, соответствующих Q13, I16, D17, N26, N28, P29, A30, S32, Y33, G34, L35, K40, M45, P73, V74, D76, N77, D79, N86, R95, N99, I100, H103, Ql19, N120, N131, S141, T142, A148, N152, A163, H169, N171, G172, I174, N176, N187, F188, A192, Q201, N203, H220, N234, G236, Q247, K249, D261, N266, L268, R272, N275, N276, V279, N280, V281, D285, N287, F297, Q299, N305, K316, N320, L321, N327, A341, N342, A348, Q365, N371, N375, M378, G397, A381, F389, N401, A403, K425, N436, S442, N454, N468, N474, S479, A483, A486, V487, S493, T494, S495, A496, S497, A498, Q500, N507, I510, N513, K520, Q526, A555, A564, S573, N575, Q581, S583, F586, K589, N595, G618, N621, Q624, A629, F636, K645, N664 и/или T681.
Аминокислотные последовательности
В настоящем изобретении описано применение нуклеиновой кислоты варианта PS4 и аминокислотных последовательностей, кодируемых такими нуклеиновыми кислотами варианта PS4, в описанных в настоящем описании способах и композициях.
Используемый в настоящем описании термин «аминокислотная последовательность» является синонимом термина «полипептид» и/или термина «белок». В некоторых случаях, термин «аминокислотная последовательность» является синонимом термину «пептид». В некоторых случаях, термин «аминокислотная последовательность» является синонимом термина «фермент».
Аминокислотная последовательность может быть получена/выделена из подходящего источника, либо она может быть синтезирована, либо она может быть получена с применением техники рекомбинантных ДНК.
Описанный в настоящем описании фермент варианта PS4 может быть использован в комбинации с другими ферментами. Так, например, авторами настоящего изобретения также описана комбинация ферментов, включающая описанный в настоящем описании фермент полипептида варианта PS4 и другой фермент, который сам может представлять собой другой фермент полипептида варианта PS4.
Нуклеотидная последовательность варианта PS4
Как указывалось выше, авторами настоящего изобретения были описаны нуклеотидные последовательности, кодирующие ферменты варианта PS4, обладающие описанными здесь конкретными свойствами.
Используемые в настоящем описании термины «нуклеотидная последовательность» или «последовательность нуклеиновой кислоты» означают олигонуклеотидную последовательность или полинуклеотидную последовательность, а также их варианты, гомологи, фрагменты и производные (например, их части). Нуклеотидная последовательность может быть геномной, синтетической или рекомбинантной, а также она может быть двухцепочечной или одноцепочечной, независимо от того, представляет ли она собой смысловую или антисмысловую цепь.
Используемый в настоящей заявке термин «нуклеотидная последовательность» включает геномную ДНК, кДНК, синтетическую ДНК и РНК. Предпочтительно, этот термин означает ДНК, более предпочтительно, последовательность кДНК, кодирующую полипептид варианта PS4.
Обычно, нуклеотидную последовательность варианта PS4 получают методами рекомбинантных ДНК (то есть, с использованием рекомбинантной ДНК). Однако, в альтернативном варианте изобретения, нуклеотидная последовательность может быть синтезирована, целиком или частично, химическими методами, хорошо известными специалистам (см. Caruthers MH et al., (1980) Nuc. Acids Res. Symp. Ser. 215-23 and Horn T. et al, (1980) Nuc. Acids Res. Symp. Ser. 225-232).
Получение последовательностей нуклеиновой кислоты
Нуклеотидная последовательность, кодирующая фермент, обладающий конкретными определенными в настоящем описании свойствами (например, полипептид варианта PS4) или фермент, который является подходящим для модификации, такой как родительский фермент, могут быть идентифицированы и/или выделены и/или очищены из любых клеток или микроорганизмов, продуцирующих указанный фермент. Различные методы идентификации и/или выделения и/или очистки нуклеотидных последовательностей хорошо известны специалистам. Так, например, после идентификации и/или выделения и/или очистки подходящей последовательности может быть получена дополнительная последовательность методами ПЦР-амплификации.
В другом примере, геномная ДНК и/или библиотека кДНК могут быть сконструированы с использованием хромосомной ДНК или информационной РНК из микроорганизма, продуцирующего фермент. Если аминокислотная последовательность указанного фермента или часть аминокислотной последовательности указанного фермента являются известными, то могут быть синтезированы меченные олигонуклеотидные зонды, которые могут быть использованы для идентификации фермент-кодирующих клонов из геномной библиотеки, выделенной из организма. Альтернативно, меченный олигонуклеотидный зонд, содержащий последовательности, гомологичные другому известному гену фермента, может быть использован для идентификации фермент-кодирующих клонов. В последнем случае используются гибридизация и условия промывки низкой жесткости.
Альтернативно, фермент-кодирующие клоны могут быть идентифицированы путем встраивания фрагментов геномной ДНК в экспрессионный вектор, такой как плазмида, трансформации негативных по ферменту бактерий полученной библиотекой геномных ДНК, а затем высевания трансформированных бактерий на агаровые пластины, содержащие субстрат для фермента (то есть, мальтозу), и тем самым, экспрессии идентифицируемого фермента клонами.
В еще одном альтернативном варианте, нуклеотидная последовательность, кодирующая указанный фермент, может быть получена хорошо разработанными стандартными методами синтеза, например, фосфорамидитным методом, описанным в публикации Beucage S.L. et al, (1981) Tetrahedron Letters 22, p 1859-1869, или методом, описанным в публикации Matthes et al, (1984) EMBO J. 3, p 801-805. С применением фосфорамидитного метода, олигонуклеотиды синтезируют, очищают, гибридизуют, лигируют и клонируют в соответствующих векторах, например, в автоматическом синтезаторе ДНК.
Нуклеотидная последовательность может представлять собой смесь геномной и синтетической последовательности, смесь синтетической последовательности и последовательности кДНК, или смесь геномной последовательности и последовательности кДНК, и может быть получена путем лигирования фрагментов синтетической последовательности, геномной последовательности или последовательности кДНК (если это необходимо) в соответствии со стандартными методами. Каждый лигированный фрагмент соответствует различным частям полноразмерной нуклеотидной последовательности. Последовательность ДНК может быть также получена с помощью полимеразной цепной реакции (ПЦР) с использованием специфических праймеров, например, как описано в патенте США 4683202 или в публикации Saiki R. K. et al., (Science (1988) 239, pp 487-491).
Варианты/гомологи/производные
Авторами настоящего изобретения также описано применение вариантов, гомологов и производных любой аминокислотной последовательности фермента или любой нуклеотидной последовательности, кодирующей указанный фермент, такой как полипептид варианта PS4 или нуклеиновая кислота варианта PS4. Термин «нуклеиновая кислота варианта PS4», если неи указано иначе, включает каждую из описанных ниже молекул нуклеиновой кислоты, а термин «полипептид варианта PS4» должен аналогичным образом включать каждую из описанных ниже молекул полипептида или аминокислоты.
Используемый в настоящем описании термин «гомолог» означает молекулу, имеющую определенную степень гомологии с рассматриваемыми аминокислотными последовательностями и рассматриваемыми нуклеотидными последовательностями. Используемый в настоящем описании термин «гомология» может быть синонимом термина «идентичность».
В контексте настоящего описания, гомологичной последовательностью считается аминокислотная последовательность, которая по меньшей мере на 75, 80, 85 или 90%, предпочтительно, по меньшей мере на 95, 96, 97, 98 или 99% идентична рассматриваемой последовательности. Обычно, гомологи содержат такие же активные сайты и т.п., как и рассматриваемая аминокислотная последовательность. Хотя термин «гомология» может быть также синонимом термина «сходство» (то есть, аминокислотные остатки, имеющие аналогичные химические свойства/функции), однако в контексте настоящего описания термин «гомология» предпочтительно, означает идентичность последовательностей.
В контексте настоящего описания, гомологичной последовательностью считается нуклеотидная последовательность, которая может быть по меньшей мере на 75, 80, 85 или 90%, предпочтительно, по меньшей мере на 95, 96, 97, 98 или 99% идентична нуклеотидной последовательности, кодирующей фермент полипептида варианта PS4 (такой как нуклеиновая кислота варианта РS4). Обычно, гомологи содержат такие же последовательности, кодирующие активные сайты, как и рассматриваемая последовательность. Хотя термин «гомология» может быть также синонимом термина «сходство» (то есть, аминокислотные остатки, имеющие аналогичные химические свойства/функции), однако в контексте настоящего описания термин «гомология» предпочтительно, означает идентичность последовательностей.
Гомологию определяют путем визуального сравнения последовательностей, а чаще всего с помощью легко доступных программ сравнения последовательностей. Эти коммерчески доступные компьютерные программы позволяют вычислять % гомологии между двумя или более последовательностями.
Процент гомологии может быть вычислен для непрерывных последовательностей, то есть, одну последовательность сопоставляют с другой последовательностью путем выравнивания, и каждую аминокислоту в одной последовательности непосредственно сравнивают с соответствующей аминокислотой в другой последовательности, по одному остатку за одно сравнение. Такое выравнивание называют «выравниванием без пробелов». Обычно такое выравнивание без пробелов осуществляют только для последовательностей с относительно небольшим числом остатков.
Хотя этот метод сравнения является очень простым и удобным, однако его недостаток заключается в том, что, например, в случае если пара последовательностей не является полностью идентичной, то есть, если присутствует одна инсерция или делеция, то она может приводить к нарушению хода сравнения последующих аминокислотных остатков, что может значительно снижать процент гомологии при общем сопоставлении последовательностей. Поэтому большинство методов сравнения последовательностей были разработаны так, чтобы они позволяли проводить оптимальное выравнивание с учетом возможных инсерций и делеций без излишнего введения «штрафов» в общую оценку гомологии. Это было достигнуто путем введения «пробелов» при выравнивании последовательностей для максимизации локальной гомологии.
Однако эти более сложные методы предусматривают присвоение каждому пробелу, введенному в последовательности при их выравнивании, «штрафа за пробел», так, чтобы, для одного и того же числа идентичных аминокислот, выравнивание последовательностей, по возможности, с небольшим числом пробелов, наилучшим образом отражало сходство между двумя сравниваемыми последовательностями, и чтобы при этом, достигалась более высокая оценка гомологии, чем оценка гомологии при проведении сравнения с многими пробелами. В этом случае, обычно используется «цена аффинности пробела», которая требует назначения относительно высокой цены на присутствие пробела и меньший штраф за каждый последующий остаток в данном пробеле. В таком методе чаще всего используется система оценки пробелов. Совершенно очевидно, что высокие штрафы за пробел позволяют оптимизировать выравнивание с меньшим числом пробелов. Большинство программ для сопоставления путем выравнивания позволяет изменять штрафы за пробел. Однако, если такая компьютерная программа применяется для сравнения последовательностей, то предпочтительно использовать параметры по умолчанию. Так, например, при использовании пакета программ GCG Wisconsin Bestfit, для аминокислотных последовательностей, по умолчанию, штраф за пробел составляет -12, а за каждое удлинение -4.
Поэтому для вычисления максимального процента гомологии сначала необходимо провести оптимальное выравнивание с учетом штрафов за пробел. Подходящей компьютерной программой для осуществления такого выравнивания является пакет программ GCG Wisconsin Bestfit (Devereux et al 1984 Nuc. Acids Research 12 p387). Примерами других компьютерных программ, с помощью которых может быть осуществлено сравнение последовательностей, являются, но не ограничиваются ими, пакеты программ для сравнения BLAST (см. Ausubel et al, 1999 Short Protocols in Molecular Biology, 4th Ed - Chapter 18), FASTA (Altschul et al, 1990 J. Mol. Biol. 403-410) и инструментальное средство GENEWORKS. Обе программы BLAST и FASTA являются доступными для поиска в автономном и оперативном режиме (см. Ausubel et al, 1999, Short Protocols in Molecular Biology, pages 7-58 to 7-60).
Однако для некоторых целей предпочтительно использовать программу GCG Bestfit. Это новое инструментальное средство, называемое BLAST 2 Sequences, также является доступным для сравнения белковых и нуклеотидных последовательностей (см. FEMS Microbiol Lett 1999 174(2): 247-50; FEMS Microbiol Lett 1999 177(1): 187-8 и tatiana@ncbi.nlm.nih.gov).
Хотя конечный процент гомологии может быть выражен термином «идентичность», однако сам процесс выравнивания обычно не основан на сравнении пар по типу «все или ничего». Вместо этого обычно используется матрица масштабированных оценок сходства, которая назначает оценки для каждого попарного сравнения, проводимого на основе химического сходства или эволюционной удаленности. Примером такой обычно используемой матрицы является матрица BLOSUM62 - матрица по умолчанию для пакета программ BLAST. В программах GCG Wisconsin обычно используются общедоступные величины по умолчанию или таблица специальных символов для сравнения, если она имеется (более подробно см. руководство для пользователей). Для некоторых целей предпочтительно использовать общедоступные величины по умолчанию для пакета программ GCG, или, в случае использования других программ, матрицу по умолчанию, такую как BLOSUM62.
Альтернативно, процент гомологии может быть вычислен с использованием множества параметров выравнивания, имеющихся в программе DNASISТМ (Hitachi Software), созданной на основе алгоритма, аналогичного алгоритму CLUSTAL (Higgins DG & Sharp PM (1988), Gene 73(1), 237-244).
После проведения оптимального выравнивания с помощью указанной компьютерной программы можно вычислить процент гомологии, предпочтительно, процент идентичности последовательностей. Такая компьютерная программа обычно позволяет осуществлять эту процедуру в процессе сравнения последовательностей и дает численный результат.
Эти последовательности могут также иметь делеции, инсерции или замены аминокислотных остатков, которые продуцируют «молчащие» мутации и приводят к получению функционально эквивалентного вещества. Специальные замены аминокислот могут быть сделаны на основе сходства свойств аминокислот (таких как полярность, заряд, растворимость, гидрофобность, гидрофильность и/или амфипатическая природа остатков), а поэтому аминокислоты могут быть подразделены на группы исходя из свойств их функциональных групп. Аминокислоты могут быть разделены на группы лишь по свойствам их боковых цепей. Однако также может оказаться полезным учитывать мутации. Так, например, определенная серия аминокислот может быть, вероятно, также консервативной по своим структурным признакам. Такие группы аминокислот могут быть описаны в виде диаграммы Венна (Livingstone CD. и Barton GJ. (1993) “Protein sequence alignments: a strategy for the hierarchical analysis of residue conservation» Comput.Appl Biosci. 9: 745-756)(Taylor W.R. (1986) "The classification of amino acid conservation" J. Theor.Biol. 119; 205-218). Консервативные замены могут быть сделаны, например, как показано в следующей таблице, где представлена общеизвестная классификация аминокислот по группам в виде диаграммы Венна.
Авторами настоящего изобретения также описаны последовательности, включающие гомологичную замену (используемые в настоящем описании термины замена и замещение означают замену существующего аминокислотного остатка альтернативным остатком), которая может представлять собой замену одного остатка подобным остатком, например, основного остатка основным остатком, кислотного остатка кислотным остатком, полярного остатка полярным остатком и т.п. Может также присутствовать негомологичная замена, то есть, замена остатка одного класса остатком другого класса или, альтернативно, такая замена включает присутствие неприродных аминокислот, таких как орнитин (далее обозначаемый Z), диаминомасляная кислота-орнитин (далее обозначаемый B), норлейцин-орнитин (далее обозначаемый O), пиридилаланин, тиенилаланин, нафтилаланин и фенилглицин.
Модифицированные аминокислотные последовательности могут включать подходящие спейсерные группы, которые могут быть встроены между любыми двумя аминокислотными остатками данной последовательности, включающие алкильные группы, такие как метильная, этильная или пропильная группа, а также аминокислотные спейсерные группы, такие как глициновые или β-аланиновые остатки. Специалистам также хорошо известна и другая форма модификации, включающая один или несколько аминокислотных остатков в пептоидной форме. Во избежание сомнений, следует отметить, что используемый в настоящем описании термин «пептоидная форма» означает варианты аминокислотных остатков, в которых α-углеродная группа-заместитель присутствует у атома азота, а не у α-углерода данного остатка. Способы получения пептидов в пептоидной форме известны специалистам, см., например, Simon RJ et al., PNAS (1992) 89(20), 9367-9371 и Horwell DC, Trends Biotechnol. (1995) 13(4), 132-134.
Описанные в настоящем описании нуклеотидные последовательности, которые могут быть использованы в описанных в настоящем описании способах и композициях (такие как нуклеиновые кислоты варианта PS4), могут находиться внутри синтетических или модифицированных нуклеотидов. Специалистам известны различные типы модификаций олигонуклеотидов. Такими модификациями являются метилфосфонатные и фосфортиоатные остовы и/или модификации, полученные в результате присоединения акридиновых или полилизиновых цепей у 3'- и/или 5'-концов данной молекулы. Следует отметить, что в целях настоящего изобретения, описанные в настоящем описании нуклеотидные последовательности могут быть модифицированы любым методом, известным специалистам. Такие модификации могут быть осуществлены для повышения in vivo активности или времени жизни нуклеотидных последовательностей.
Авторами настоящего изобретения также описано применение нуклеотидных последовательностей, комплементарных представленным в настоящем описании последовательностям, или любых их производных или фрагментов. Если указанная последовательность комплементарна ее фрагменту, то такая последовательность может быть использована в качестве зонда для идентификации аналогичных кодирующих последовательностей в других организмах и т.п.
Полинуклеотиды, которые не являются на 100% гомологичными последовательностям варианта PS4, могут быть получены различными методами. Другие варианты описанных в настоящем описании последовательностей могут быть получены, например, путем зондирования библиотек ДНК, выделенных у различных индивидуумов, например, индивидуумов различных популяций. Кроме того, могут быть получены и другие гомологи, и такие гомологи и их фрагменты, по существу, могут обладать способностью селективно гибридизоваться с последовательностями, представленными в имеющемся здесь списке последовательностей. Такие последовательности могут быть получены путем зондирования библиотек кДНК, происходящих от библиотек ДНК или библиотек геномных ДНК других видов, зондами, содержащими всю последовательность или часть любой одной из последовательностей, имеющихся в прилагаемом списке последовательностей, в условиях умеренной или высокой жесткости. Аналогичные методы могут быть применены для получения описанных в настоящем описании гомологов и аллельных вариантов полипептидных или нуклеотидных последовательностей конкретных видов.
Варианты и гомологи штаммов/видов могут быть также получены с помощью ПЦР, в которой используются вырожденные праймеры, специфичные к последовательностям-мишеням, присутствующим в вариантах и гомологах, кодирующих консервативные аминокислотные последовательности. Консервативные последовательности могут быть предсказаны, например, путем сравнения аминокислотных последовательностей для некоторых вариантов/гомологов посредством их выравнивания. Выравнивание последовательностей может быть осуществлено с помощью компьютерной программы, известной специалистам. Так, например, широко применяется программа GCG Wisconsin PileUp.
Вырожденные праймеры, используемые в ПЦР, содержат одно или несколько вырожденных положений и используются в менее жестких условиях по сравнению с условиями, используемыми для клонирования последовательностей, содержащих одиночные праймеры с известными последовательностями.
Альтернативно, полинуклеотиды могут быть получены посредством сайт-направленного мутагенеза охарактеризованных последовательностей. Этот метод может быть использован в случае, когда требуются замены в последовательности молчащего кодона для оптимизации предпочтительности кодонов для конкретной клетки-хозяина, в которой экспрессируются полинуклеотидные последовательности. Другие замены последовательности могут оказаться желательными для введения сайтов распознавания рестриктирующих ферментов или для изменения свойств или функций полипептидов, кодируемых полинуклеотидами.
Полинуклеотиды (нуклеотидные последовательности), такие как нуклеиновые кислоты варианта PS4, описанные в настоящей заявке, могут быть использованы для продуцирования праймера, например, ПЦР-праймера, праймера для альтернативной реакции амплификации, зонда, например, меченного обнаружимой меткой, стандартными методами с использованием радиоактивных или нерадиоактивных меток, либо полинуклеотиды могут быть клонированы в векторы. Такие праймеры, зонды и другие фрагменты могут иметь длину по меньшей мере 15, предпочтительно, по меньшей мере 20, например, по меньшей мере 25, 30 или 40 нуклеотидов, и также входят в объем термина «полинуклеотиды».
Полинуклеотиды, такие как ДНК-полинуклеотиды и зонды, могут быть получены рекомбинантными методами, методами синтеза или любыми методами, известными специалистам. Они могут быть также клонированы стандартными методами. Праймеры, в основном, получают методами синтеза, включающими постадийный синтез нужной последовательности нуклеиновой кислоты, присоединяя по одному нуклеотиду за один раз. Осуществление такого синтеза с применением автоматизированных методов хорошо известно специалистам.
Более длинные полинуклеотиды обычно получают рекомбинантными методами, например, методами клонирования с помощью ПЦР (полимеразной цепной реакции). Праймеры могут быть сконструированы так, чтобы они содержали подходящие сайты распознавания рестриктирующих ферментов, в результате чего амплифицированная ДНК может быть клонирована в подходящий клонирующий вектор. Предпочтительно, последовательности варианта и т.п. обладают по меньшей мере такой же биологической активностью, как и описанные в настоящем описании последовательности.
Используемый в настоящем описании термин «биологически активный» относится к последовательности, обладающей структурной функцией (но необязательно в той же самой степени) и/или регуляторной функцией (но необязательно в той же самой степени) и/или биохимической функцией (но необязательно в той же самой степени), которые аналогичны указанным функциям природной последовательности.
Гибридизация
Авторами настоящего изобретения также описаны последовательности, которые являются комплементарными последовательностям нуклеиновой кислоты вариантов PS4 или последовательностям, обладающим способностью гибридизоваться либо с последовательностями варианта PS4, либо с последовательностями, комплементарными этим последовательностям.
Используемый в настоящем описании термин «гибридизация» означает «процесс, посредством которого цепь нуклеиновой кислоты присоединяется к комплементарной цепи в результате спаривания оснований», а также процесс амплификации, осуществляемый методами с помощью полимеразной цепной реакции (ПЦР). Поэтому, авторами настоящего изобретения было описано применение нуклеотидных последовательностей, способных гибридизоваться с последовательностями, комплементарными описанным здесь последовательностям, или с любыми их производными или фрагментами.
Термин «вариант» также включает последовательности, комплементарные последовательностям, способным гибридизоваться с описанными в настоящем описании нуклеотидными последовательностями.
Предпочтительно, термин "вариант" включает последовательности, комплементарные последовательностям, способным гибридизоваться с описанными здесь нуклеотидными последовательностями в жестких условиях (например, при 50°С и в 0,2×SSC {1×SSC = 0,15 M NaCl, 0,015 M Na3-цитрата, pH 7,0}). Более предпочтительно, термин "вариант" включает последовательности, комплементарные последовательностям, способным гибридизоваться с описанными в настоящем описании нуклеотидными последовательностями в условиях высокой жесткости (например, при 65°С и в 0,1×SSC {1×SSC = 0,15 M NaCl, 0,015 M Na3-цитрата, pH 7,0}).
Авторами настоящего изобретения также описаны нуклеотидные последовательности, которые могут гибридизоваться с нуклеотидными последовательностями вариантов PS4 (включая последовательности, комплементарные представленным в настоящем описании последовательностям), а также нуклеотидные последовательности, комплементарные последовательностям, которые могут гибридизоваться с нуклеотидными последовательностями вариантов PS4 (включая последовательности, комплементарные представленным в настоящем описании последовательностям). Авторами настоящего изобретения также описаны полинуклеотидные последовательности, способные гибридизоваться с представленными в настоящем описании нуклеотидными последовательностями в условиях промежуточной или максимальной жесткости.
В предпочтительном аспекте изобретения, авторами настоящего изобретения описаны нуклеотидные последовательности, которые могут гибридизоваться с нуклеотидной последовательностью нуклеиновой кислоты варианта PS4 или ее комплемента в жестких условиях (например, при 50°С и в 0,2×SSC). Более предпочтительно, нуклеотидные последовательности могут гибридизоваться с нуклеотидной последовательностью варианта PS4 или ее комплементом в условиях высокой жесткости (например, при 65°С и в 0,1×SSC).
Сайт-направленный мутагенез
После выделения фермент-кодирующей нуклеотидной последовательности или идентификации предполагаемой фермент-кодирующей нуклеотидной последовательности может оказаться желательным введение мутации в данную последовательность с получением фермента. В соответствии с этим, последовательность варианта PS4 может быть получена из родительской последовательности. Мутации могут быть введены с использованием синтетических олигонуклеотидов. Эти олигонуклеотиды содержат нуклеотидные последовательности, фланкирующие нужные сайты мутации.
Подходящим методом является метод, описанный в публикации Morinaga et al, (Biotechnology (1984) 2, p646-649). Другой метод введения мутаций в фермент-кодирующие нуклеотидные последовательности описан Nelson и Long (Analytical Biochemistry (1989), 180, p 147-151). Другой метод описан Sarkar и Sommer (Biotechniques (1990), 8, p404-407 - "The megaprimer method of site directed mutagenesis").
В одном из аспектов изобретения, последовательностью, используемой в описанных в настоящем описании способах и композициях, является рекомбинантная последовательность, т.е. последовательность, которая была получена методами рекомбинантных ДНК. Такие методы рекомбинантных ДНК известны специалисту в данной области. Указанные методы описаны в литературе, например, в руководстве J. Sambrook, E. F. Fritsch, и T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press.
В одном из аспектов изобретения, последовательностью, используемой в описанных здесь способах и композициях, является синтетическая последовательность, то есть, последовательность, которая была получена in vitro методами химического или ферментативного синтеза. Такими последовательностями являются, но не ограничиваются ими, последовательности, имеющие оптимальную встречаемость кодонов для данного организма-хозяина, такого как метилотрофные дрожжи Pichia и Hansenula.
Нуклеотидная последовательность, используемая в описанных в настоящем описании способах и композициях, может быть введена в рекомбинантный реплицируемый вектор. Этот вектор может быть использован для репликации и экспрессии нуклеотидной последовательности, последовательности в ферментной форме, последовательности, присутствующей в совместимой клетке-хозяине, и/или последовательности, происходящей от совместимой клетки-хозяина. Экспрессия может регулироваться под контролем соответствующих последовательностей, например, регуляторных последовательностей. Фермент, продуцируемый рекомбинантной клеткой-хозяином в результате экспрессии нуклеотидной последовательности, может быть секретирован, либо он может содержаться внутри клеток в зависимости от используемой последовательности и/или от используемого вектора. Кодирующие последовательности могут быть сконструированы так, чтобы они содержали сигнальные последовательности, которые направляют секрецию последовательностей, кодирующих указанное вещество, через конкретную клеточную мембрану прокариотических или эукариотических клеток.
Экспрессия нуклеиновых кислот и полипептидов PS4
Полинуклеотидами и нуклеиновыми кислотами PS4 могут быть как синтезированные, так и природные ДНК и РНК, которые могут содержать модифицированные или немодифицированные дезокси- или дидезокси-нуклеотиды или рибонуклеотиды или их аналоги. Нуклеиновая кислота PS4 может присутствовать в виде одноцепочечной или двухцепочечной ДНК или РНК, РНК/ДНК-гетеродуплекса или сополимера РНК/ДНК, где термин «сополимер» означает одну цепь нуклеиновой кислоты, содержащую рибонуклеотиды и дезоксирибонуклеотиды. Нуклеиновая кислота PS4 может даже представлять собой кодон, оптимизированный для дополнительного повышения уровня экспрессии.
Используемый в настоящем описании термин «синтетический» относится к молекуле, продуцированной in vitro методом химического или ферментативного синтеза. Такими последовательностями являются, но не ограничиваются ими, нуклеиновые кислоты PS4, имеющие оптимальную встречаемость кодонов для данных организмов-хозяев, таких как метилотрофные дрожжи Pichia и Hansenula.
Полинуклеотиды, например, описанные в настоящем описании полинуклеотиды варианта PS4, могут быть введены в рекомбинантный реплицируемый вектор. Вектор может быть использован для репликации нуклеиновой кислоты в совместимой клетке-хозяине. Вектор, содержащий полинуклеотидную последовательность, может быть трансформирован в подходящую клетку-хозяина. Подходящими хозяевами могут быть клетки бактерий, дрожжей, насекомых и грибов.
Термин «трансформированная клетка» включает клетки, которые были трансформированы методами рекомбинантных ДНК. Трансформацию обычно осуществляют путем инсерции одной или нескольких нуклеотидных последовательностей в трансформируемую клетку. Встроенной нуклеотидной последовательностью может быть гетерологичная нуклеотидная последовательность (т.е. последовательность, которая в природе не присутствует в трансформируемой клетке). Кроме того, или альтернативно, встроенной нуклеотидной последовательностью может быть гомологичная нуклеотидная последовательность (т.е. последовательность, которая присутствует в природе в трансформируемой клетке), а поэтому, клетка приобретает одну или несколько дополнительных копий нуклеотидной последовательности, уже присутствующей в этой клетке.
Таким образом, в другом варианте изобретения, авторами настоящего изобретения был описан способ получения полипептидов и полинуклеотидов варианта PS4 путем введения полинуклеотида в реплицируемый вектор, введения вектора в совместимую клетку-хозяина и культивирования клетки-хозяина в условиях, стимулирующих репликацию указанного вектора. Такой вектор может быть выделен из клетки-хозяина.
Экспрессионные конструкции
Нуклеиновая кислота PS4 может быть функционально присоединена к элементам регуляции транскрипции и трансляции, которые являются активными в представляющей интерес клетке-хозяине. Нуклеиновая кислота PS4 может также кодировать гибридный белок, содержащий сигнальные последовательности, например, последовательности, происходящие от гена глюкоамилазы Schwanniomyces occidentalis, гена α-фактора, определяющего тип спаривания и происходящего от Saccharomyces cerevisiae, и гена TAKA-амилазы от Aspergillus oryzae. Альтернативно, нуклеиновая кислота PS4 может кодировать гибридный белок, содержащий мембраносвязывающий домен.
Экспрессионный вектор
Нуклеиновая кислота PS4 может быть эпрессирована на нужных уровнях в организме-хозяине с использованием экспрессионного вектора.
Экспрессионным вектором, содержащим нуклеиновую кислоту PS4, может быть любой вектор, способный экспрессировать ген, кодирующий нуклеиновую кислоту PS4, в выбранном организме-хозяине, и выбор такого вектора зависит от клетки-хозяина, в которую его вводят. Таким образом, вектором может быть автономно реплицирующийся вектор, то есть, вектор, присутствующий как эписомная молекула, репликация которой не зависит от хромосомной репликации, например, плазмида, бактериофаг или эписомный элемент, минихромосома или искусственная хромосома. Альтернативно, вектором может быть вектор, который, при его введении в клетку-хозяина, интегрируется в геном клетки-хозяина и реплицируется вместе с хромосомой.
Компоненты экспрессионного вектора
Экспрессионный вектор обычно включает компоненты клонирующего вектора, такие как, например, элемент, который позволяет вектору автономно реплицироваться в выбранном организме-хозяине, и один или несколько фенотипически детектируемых маркеров для отбора. Экспрессионный вектор обычно содержит регуляторны нуклеотидные последовательности, кодирующие промотор, оператор, сайт связывания с рибосомой, сигнал инициации трансляции и необязательно ген-репрессор или один или несколько генов-активаторов. Кроме того, экспрессионный вектор может включать последовательность, кодирующую аминокислотную последовательность, способную доставлять полипептид варианта PS4 в органеллу клетки-хозяина, такую как пероксисома, или в конкретный компартмент клетки-хозяина. Такая нацеливающая последовательность включает, но не ограничивается ею, последовательность SKL. В контексте настоящего описания, термин «сигнал экспрессии» включает любую из вышеуказанных регуляторных последовательностей, последовательностей-репрессоров или активаторов. Для экспрессии под контролем регуляторных последовательностей, последовательность нуклеиновой кислоты, кодирующая полипептид варианта PS4, функционально присоединяют к регуляторным последовательностям соответствующим образом.
Предпочтительно, полинуклеотид в векторе функционально присоединяют к регуляторной последовательности, способной обеспечивать экспрессию кодирующей последовательности в клетке-хозяине, то есть, таким вектором является экспрессионный вектор. Термин «функционально присоединенный» означает, что описанные компоненты находятся в определенной взаимосвязи, позволяющей им функционировать соответствующим образом. Регуляторную последовательность, «функционально присоединенную» к кодирующей последовательности, лигируют так, чтобы экспрессия кодирующей последовательности достигалась в условиях, совместимых с регуляторными последовательностями.
Регуляторные последовательности могут быть модифицированы, например, путем присоединения дополнительных элементов регуляции транскрипции до достижения уровня транскрипции, управляемой регуляторными последовательностями, которые являются более восприимчивыми к модуляторам транскрипции. Регуляторные последовательности, в частности, могут содержать промоторы.
Промотор
В векторе, последовательность нуклеиновой кислоты, кодирующую полипептид варианта PS4, функционально объединяют с подходящей промоторной последовательностью. Промотором может быть любая последовательность ДНК, обладающая транскрипционной активностью в выбранном организме-хозяине, и такой промотор может происходить от генов, которые являются гомологичными или гетерологичными для организма-хозяина.
Бактериальные промоторы
Примерами подходящих промоторов для регуляции транскрипции модифицированной нуклеотидной последовательности, такой как нуклеиновые кислоты PS4 в бактериальном хозяине, являются промотор оперона lac E.coli, промоторы гена dagA агаразы Streptomyces coelicolor, промоторы гена (amyL) α-амилазы Bacillus licheniformis, промоторы гена (amyM) мальтогенной амилазы Bacillus stearothermophilus, промоторы гена (amyQ) α-амилазы Bacillus amyloliquefaciens, промоторы генов xylA и xylB Bacillus subtilis, промотор гена aprE Bacillus subtilis и промотор, происходящий от промотора Lactococcus sp., включая промотор P170. Если ген, кодирующий полипептид варианта PS4, экспрессируется в бактериях, таких как E.coli, то подходящий промотор может быть выбран, например, из промотора бактериофага, включая промотор Т7, и промотора фага лямбда.
Грибковые промоторы
Примерами промоторов, подходящих для транскрипции в грибах, являются промоторы, происходящие от генов, кодирующих амилазу TAKA Aspergillus oryzae, аспарагиновая кислота-протеиназу Rhizomucor miehei, нейтральную α-амилазу Aspergillus niger, кислотоустойчивую α-амилазу A. niger, глюкоамилазу A. niger, липазу Rhizomucor miehei, щелочную протеазу Aspergillus oryzae, триозофосфат-изомеразу Aspergillus oryzae или ацетамидазу Aspergillus nidulans.
Дрожжевые промоторы
Примерами промоторов, подходящих для экспрессии в дрожжах, являются, но не ограничивается ими, промоторы Gal1 и Gal10 Saccharomyces cerevisiae и промоторы AOXl или AОX2 Pichia pastoris.
Организмы-хозяева
(I) Бактериальные организмы-хозяева
Примерами подходящих бактериальных организмов-хозяев являются грам-положительные бактерии, такие как Bacillaceae, включая Bacillus clausii, Bacillus subtilis, Bacillus licheniformis, Bacillus lentus, Bacillus brevis, Bacillus stearothermophilus, Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus coagulans, Bacillus lautus, Bacillus megaterium и Bacillus thuringiensis, Streptomyces sp., такие как Streptomyces murinus, молочнокислые бактерии, включая Lactococcus spp., такие как Lactococcus lactis, Lactobacillus spp., включая Lactobacillus reuteri, Leuconostoc spp., Pediococcus spp. и Streptococcus spp. Альтернативно, в качестве организма-хозяина могут быть выбраны штаммы грам-отрицательных бактерий, принадлежащих к Enterobacteriaceae, включая E. coli, или к Pseudomonadaceae.
(II) Дрожжевые организмы-хозяева
Подходящий дрожжевой организм-хозяин может быть выбран из биотехнологически релевантных дрожжей, таких как, но не ограничивающихся ими, дрожжи, например, Pichia sp., Hansenula sp или Kluyveromyces, Yarrowinia sp., или дрожжи Saccharomyces sp., включая Saccharomyces cerevisiae, или дрожжи, принадлежащие к виду Schizosaccharomyce, такие как, например, S. Pombe sp.
Предпочтительным штаммом, используемым в качестве организма-хозяина, является штамм метилотрофных дрожжей вида Pichia pastoris. Предпочтительным организмом-хозяином является микроорганизм Hansenula sp.
(III) Грибковые организмы-хозяева
Среди нитчатых грибов, подходящими организмами-хозяевами являются грибы вида Aspergillus, например, Aspergillus niger, Aspergillus oryzae, Aspergillus tubigensis, Aspergillus awamori или Aspergillus nidulans. Альтернативно, в качестве организма-хозяина могут быть использованы штаммы Fusarium sp., например, Fusarium oxysporum или штаммы вида Rhizomucor, такие как Rhizomucor miehei. Другими подходящими штаммами являются штаммы вида Thermomyces и Mucor.
Подходящими грибковыми организмами-хозяевами могут быть также Trichoderma spp. (а в частности, Trichoderma reesei, ранее называемый Trichoderma longibrachiatum и также известный как Hypocrea jecorina).
Экспрессия и очистка белка
Клетки-хозяева, содержащие полинуклеотиды, могут быть использованы для экспрессии полипептидов, таких как полипептиды варианта PS4, а также их фрагменты, гомологи, варианты или производные. Клетки-хозяева могут быть культивированы в условиях, подходящих для экспрессии белков. Экспрессия полипептидов может быть конститутивной, то есть, они могут продуцироваться непрерывно, либо индуцибельной, то есть, для инициации их экспрессии требуется стимулятор. В случае индуцибельной экспрессии, продуцирование белка может быть инициировано, если это необходимо, например, путем добавления в культуральную среду вещества-индуктора, например, дексаметазона или IPTG.
Полипептиды могут быть экстрагированы из клеток-хозяев различными методами, известными специалистам, включая ферментативный, химический и/или осмотический лизис, и физическую дизрупцию. Полипептиды могут быть также получены рекомбинантными методами в бесклеточной системе in vitro, такой как система кроличьих ретикулоцитов TnTTM (Promega).
ПРИМЕРЫ
Пример 1. Клонирование PS4
Pseudomonas sacharophila культивировали в течение ночи на среде LB и выделяли хромосомную ДНК стандартными методами (Sambrook J., 1989). 2190 п.н.-фрагмент, содержащий открытую рамку считывания PS4 (Zhou et al., 1989), амплифицировали из хромосомной ДНК P. sacharophila с помощью ПЦР с использованием праймеров Pl и P2 (см. таблицу 3). Полученный фрагмент использовали в качестве матрицы во вложенной ПЦР с применением праймеров P3 и P4 для амплификации открытой рамки считывания PS4 без его сигнальной последовательности и введения NcoI-сайта у 5'-конца гена и BamHI-сайта у 3'-конца. Вместе с NcoI-сайтом вводили кодон для N-концевого метионина, что позволяло осуществлять внутриклеточную экспрессию PS4. 1605 п.н.-фрагмент клонировали в вектор pCRBLUNT TOPO (Invitrogen) и проводили анализ на целостность конструкции путем секвенирования. Челночный вектор E.coli-Bacillus pDP66K (Penninga et al, 1996) модифицировали для осуществления экспрессии PS4 под контролем промотора P32 и сигнальной последовательности CTGазы. Полученную плазмиду pCSmta переносили в B. subtilis.
Была получена вторая экспрессионная конструкция, в которой отсутствовал крахмал-связывающий домен PS4. С помощью ПЦР, проводимой с использованием праймеров P3 и P6 (таблица 3) на pCSmta, получали усеченный вариант гена mta. Полноразмерный ген mta в pCSmta заменяли усеченным вариантом, в результате чего получали плазмиду pCSmta-SBD.
Пример 2. Сайт-направленный мутагенез PS4
Мутации вводили в ген mta 2 методами. Такую процедуру проводили либо с помощью 2-стадийной ПЦР, либо методом быстрого обмена (QE). Для удобства, ген mta разделяли на 3 части: PvuI-FspI-фрагмент, FspI-PstI-фрагмент и PstI-AspI-фрагмент, далее называемые фрагментами 1, 2 и 3, соответственно.
В ПЦР, проводимой 2-стадийным методом, мутации вводили с использованием ДНК-полимеразы Pfu (Stratagene). Первую ПЦР осуществляли с использованием праймера для мутагенеза (таблица 4) кодирующей цепи и прямого праймера на нижней цепи (либо 2R, либо 3R, таблица 3). Продукт реакции использовали в качестве праймера во второй ПЦР вместе с обратным праймером на кодирующей цепи. Продукт последней реакции клонировали в pCRBLUNT topo (Invitrogen), и после секвенирования, этот фрагмент заменяли соответствующим фрагментом в pCSmta.
С применением метода быстрого обмена (Stratagene), мутации вводили с помощью ПЦР на плазмиде, содержащей ген mta или часть гена mta, с использованием двух комплементарных праймеров.
Для удобства был сконструирован набор плазмид, содержащий 3 плазмиды SDM и 3 плазмиды pCSΔ. Каждая плазмида SDM содержала 1 из фрагментов вышеупомянутого гена mta, в который была введена нужная мутация методом быстрого обмена (QE). После подтверждания последовательности путем секвенирования, фрагменты клонировали в соответствующую реципиентную плазмиду pCSΔ. Плазмиды pCSΔ представляют собой неактивные производные pCSmta. Активность восстанавливали путем клонирования соответствующего фрагмента из плазмиды SDM, что позволяло легко осуществлять скрининг.
и стандартные праймеры, используемые для конструирования сайт-направленных мутантов с помощью 2-стадийной ПЦР.
в mta
кация
Пример 3. SDM с множественными мутациями
Были созданы варианты PS4 с использованием набора для сайт-направленного мутагенеза c множественными мутациями QuikChange® (Stratagene), проводимого в соответствии с протоколом производителей, в который были внесены некоторые описанные здесь изменения.
Стадия 1: Реакция синтеза мутантной цепи (ПЦР):
Инокулировали 3 мл среды LB (22 г/л минимального бульона Lennox L, Sigma) + антибиотики (0,05 мкг/мл канамицина, Sigma) в 10 мл-пробирке Falcon
- Инкубировали в течение ночи при 37°С, приб. При 200 об/мин.
- Клетки встряхивали путем центрифугирования (5000 об/мин/5 мин)
- Среду обедняли
- Получали дцДНК-матрицу в соответствии с протоколом минимальной очистки плазмиды QIAGEN
1. Реакцию синтеза мутантной цепи проводили в термоячейке следующим образом:
ПЦР-смесь:
2. Проводили цикл реакций с использованием следующих параметров:
Крышку ПЦР-устройства предварительно нагревали до 105°С, а пластину до 95°С, после чего в это устройство (термоячейку Эппендорфа) помещали ПЦР-пробирки.
Стадия 2: Гидролиз ферментом Dpn I
1. В каждую реакционную смесь для амплификации добавляли 2 мкл рестриктирующего фермента Dpn I (10 ед/мкл), затем смесь перемешивали путем пипетирования и центрифугировали.
2. Инкубировали при 37°С в течение ~3 часов.
Стадия 3: Трансформация ультракомпетентных клеток XL10-Gold®
1. Клетки XL10-GoId оттаивали на льду. В предварительно охлажденные пробирки Falcon вводили аликвоту 45 мкл клеток на реакционную смесь для мутагенеза.
2. Ставили водяную баню (42°С) и в эту баню помещали пробирки с бульоном NZY+ для предварительного нагревания.
3. В каждую пробирку добавляли 2 мкл смеси β-меркаптоэтанола. Пробирки встряхивали и слегка постукивали, а затем инкубировали в течение 10 минут на льду, встряхивая через каждые 2 минут.
4. В каждую аликвоту клеток добавляли 1,5 мкл DpnI-обработанной ДНК, а затем смесь встряхивали и инкубировали на льду в течение 30 минут.
5. Пробирки периодически помещали на 30 секунд в водяную баню при 42°С и на 2 минуты на лед.
6. В каждую пробирку добавляли 0,5 мл предварительно нагретого бульона NZY+ и инкубировали при 37°С в течение 1 часа со встряхиванием при 225-250 об/мин.
7. 200 мкл каждой реакционной смеси для трансформации наносили на LB-планшеты (33,6 г/л агара Lennox L, Sigma), содержащие 1% крахмала и 0,05 мкг/мл канамицина.
8. Планшеты для трансформации инкубировали в течение ночи при 37°С.
кация
кация
D34N
A179T
D343E
кация
Система векторов на основе pPD77
Система векторов, используемая для pPD77, была сконструирована на основе pCRbluntTOPOII (invitrogen). Кластер резистентности к зеоцину удаляли с помощью pmII, в результате чего был удален 393 п.н.-фрагмент. В указанный вектор встраивали экспрессионный кластер, происходящий от вектора pCC (P32-ssCGTase-PS4-tt).
Лигирование варианта PS4 в pCCMini
Плазмиду, содержащую релевантные мутации (созданные методом MSDM), разрезали рестриктирующим ферментом Nco 1 и Hind III (Biolabs): 3 мкг плазмидной ДНК, X мкл 10× буфера 2, 10 единиц Ncol, 20 единиц Hind III, инкубировали в течение 2 часов при 37°С.
Для оценки уровня гидролиза проводили электрофорез в 1% агарозном геле. Фрагменты размером 1293 п.н. (ген PS4) вырезали из геля и очищали с помощью набора для гель-очистки Qiagen.
Вектор pCCMini разрезали рестриктирующими ферментами Nco 1 и Hind III, а затем гидролиз оценивали с помощью электрофореза в 1% агарозном геле. Фрагмент размером 3569 п.н. вырезали из геля и очищали с помощью набора для гель-очистки Qiagen.
Лигирование: использовали набор для быстрого лигирования ДНК (Roche):
Было использовано двойное количество вставки по сравнению с количеством вектора, например,
Лигирование проводили в течение 5 минут при комнатной температуре.
Смесь для лигирования переносили в компетентные клетки One Shot TOPO в соответствии с протоколом производителей (Invitrogen). Было использовано 5 мкл смеси для лигирования на трансформацию.
50 мкл смеси для трансформации высевали на LB-планшеты (33,6 г/л агара Lennox L, Sigma), содержащие 1% крахмала и 0,05 мкг/мл канамицина. Векторы, содержащие вставку (варианты PS4), могут быть идентифицированы по образованию гало на крахмал-содержащих планшетах.
Пример 3A. Получение полипептида варианта PS4 с заменой
в положении 307
pSac-pMD229
Последовательность pSac-pMD229 (SEQ ID NO: 14), содержащую мутации в положениях N33Y, D34N, G121F, G134R, A141P, Y146G, I157L, S161A, L178F, A179T, G223E, S229P, H272Q, G303E, H307L, A309P, S334P по сравнению с не-мальтогенной экзоамилазой дикого типа, получали из последовательности дикого типа с помощью сайт-направленного мутагенеза (как описано выше в примере 2) или сайт-направленного мутагенеза с множественными мутациями (как описано выше в примере 3), проводимого с использованием праймеров, указанных в следующей таблице:
Праймеры для pMD229
D343E
D343E-
pSac-pMS382:
Последовательность pSac-pMS382 (SEQ ID NO:22), содержащую 307К, получали из pSac-pSac-pMD229 методом сайт-направленного мутагенеза с множественными мутациями (как описано выше в примере 3), проводимого с использованием праймеров, указанных в следующей таблице:
Праймеры для pMD229→pMS382
letic gene pMS230 which therefore also needed
iN
Полипептиды варианта PS4 с другими остатками в положении 307 получали с помощью сайт-направленного мутагенеза с множественными мутациями (как описано выше в примере 3), проводимого с использованием праймеров, указанных в следующей таблице:
кация
(синт)
(синт)
(синт)
(синт)
(синт)
(синт)
TGGCCGCTTCAAGATGGCC
(синт)
(синт)
(синт)
Праймер, используемый для сканирования сайтов в положении 307:
(синт)
Пример 4. Трансформация в Bacillus subtilis (Трансформация в протопластах)
Bacillus subtilis (штамм DB104A; Smith et al. 1988; Gene 70, 351-361) трансформировали мутированными плазмидами в соответствии со следующим протоколом:
А. Среда для культивирования и трансформации протопластов
B. Среда для посева/регенерации
Смесь для регенерации DM3: смешивали при 60°С (на водяной бане; в 500 мл-сосуде):
Добавляли соответствующие антибиотики: хлорамфеникол и тетрациклин, 5 мкг/мл; эритромицин, 1 мкг/мл. Отбор на резистентность к канамицину является проблематичным в среде DM3, поскольку для этого могут потребоваться концентрации 250 мкг/мл.
C. Получение протопластов
1. Во время всей процедуры использовали пластиковую или стеклянную посуду, не содержащую детергентов.
2. 10 мл 2×YT-среды инокулировали в 100 мл-колбу из одной колонии. Ночную культуру выращивали при 25-30°С в шейкере (200 об/мин).
3. Ночную культуру 20-кратно разводили 100 мл свежей 2×YT-среды (в 250 мл-колбе) и культивировали до OD600=0,4-0,5 (примерно 2 часа) при 37°С в шейкере (200-250 об/мин).
4. Клетки собирали путем центрифугирования (9000 g, 20 мин, 4°С).
5. Супернатант удаляли пипепткой, и клетки ресуспендировали в 5 мл SMMP + 5 мг лизоцима, и подвергали стерильной фильтрации.
6. Инкубировали при 37°С в шейкере с водяной баней (100 об/мин).
Через 30 минут, а затем с интервалами в 15 минут проводили оценку 25 мкл образцов под микроскопом. Затем их непрерывно инкубировали до тех пор, пока 99% клеток не становились протопластами (имели вид глобул). Протопласты собирали путем центрифугирования (4000 g, 20 мин, при комнатной температуре) и супернатант удаляли пипеткой. Осадок осторожно ресуспендировали в 1-2 мл SMMP.
Протопласты были уже готовы к применению (порции, например, 0,15 мл) могут быть заморожены при -80°С для последующего применения (добавления глицерина не требуется). Хотя эта процедура может приводить к определенному снижению уровня трансформируемости, однако с использованием замороженных протопластов может быть получено 106 трансформантов на мкг ДНК).
D. Трансформация
1. 450 мкл ПЭГ переносили к микропробирку.
2. 1-10 мкл ДНК (0,2 мкг) смешивали со 150 мкл протопластов, и эту смесь добавляли в микропробирку с ПЭГ. Смешивание проводили сразу, но осторожно.
3. Смесь оставляли на 2 минуты при комнатной температуре, а затем добавляли 1,5 мл SMMP и смешивали.
4. Протопласты собирали путем микроцентрифугирования (10 минут, 13000 об/мин (10-12000 g)) и супернатант выливали. Остаточные капельки удаляли тканью.
Затем добавляли 300 мкл SMMP (не встряхивая) и инкубировали в течение 60-90 минут при 37°С в шейкере с водяной баней (100 об/мин) для экспрессии маркеров резистентности к антибиотикам. (В результате встряхивания в водяной бане, протопласты становились в достаточной степени ресуспендированными). Затем проводили соответствующие разведения в 1×SSM и высевали в количестве 0,1 мл на планшеты с DM3.
Пример 5. Ферментация вариантов PS4 в шейкерных колбах
Субстрат для шейкерных колб получали следующим образом:
Субстрат доводили до pH 6,8 добавлением 4н серной кислоты или гидроксида натрия, а затем автоклавировали. 100 мл субстрата помещали в 500 мл-колбу с одной перегородкой и автоклавировали в течение 30 минут. Затем добавляли 6 мл стерильного декстрозного сиропа. Декстрозный сироп получали путем смешивания одного объема 50% масс/об декстрозы с одним объемом воды, и последующего автоклавирования в течение 20 минут.
Содержимое шейкерных колб инокулировали указанными вариантами и инкубировали в течение 24 часов при 35°С/180 об/мин в инкубаторе. После инкубирования, клетки отделяли от бульона путем центрифугирования (10000×g в течение 10 минут), и, наконец, супернатант очищали от клеток путем микрофильтрации при 0,2 мкм. Бесклеточный супернатант использовали для анализов и тестов на применение.
Пример 6. Анализы на амилазу
Бетамиловый анализ
Одну бетамиловую единицу определяют как активность, разлагающую 0,0351 ммоль за 1 минуту PNP-связанной мальтопентаозы, а именно, такую активность, при которой в аналитической смеси под действием избытка α-глюкозидазы за 1 минуту может высвобождаться 0,0351 ммоль PNP. Аналитическая смесь содержит 50 мкл 50 мМ Na-цитрата, 5 мМ CaC12, pH 6,5, 25 мкл образца фермента и 25 мкл бетамилового субстрата (Glc5-PNP и α-глюкозидаза) от Megazyme, Ireland (содержимое 1 сосуда растворяли в 10 мл воды). Аналитическую смесь инкубировали в течение 30 минут при 40°С, а затем реакцию прекращали путем добавления 150 мкл 4% триса. Оптическую плотность при 420 нм измерядли на ELISA-ридере, а бетамиловую активность вычисляли по формуле: активность = A420·d в бетамиловых единицах/мл анализируемого образца фермента.
Анализ на эндоамилазную активность
Анализ на эндоамилазную активность идентичен анализу Phadebas, проводимому как описано производителем (Pharmacia & Upjohn Diagnostics AB).
Экзо-специфичность
Отношение экзоамилазной активности к активности Phadebas использовали для оценки экзо-специфичности.
Пример 7. Определение времени полужизни
T1/2 определяли как время (в минутах), в течение которого, при определенных условиях нагревания, инактивируется половина ферментативной активности. Для определения времени полужизни фермента, образец нагревали в течение 1-40 минут при постоянной температуре 60°С-90°С. Время полужизни вычисляли с помощью анализа на остаточное содержание бетамила.
Процедура: В сосуде Эппендорфа, 1000 мкл буфера предварительно нагревали в течение по меньшей мере 10 минут при 60°С или выше. Термообработку образца начинали с добавления 100 мкл образца в предварительно нагретый буфер при непрерывном перемешивании (800 об/мин) содержимого сосуда Эппендорфа в термостате (в удобном термомиксере Эппендорфа). После инкубирования в течение 0, 2, 4, 6, 8 и 9 минут, обработку прекращали путем переноса 45 мкл образца в 1000 мкл буфера, уравновешенного при 20°С, и инкубирования в течение одной минуты при 1500 об/мин и при 20°С. Остаточную активность измеряли с помощью бетамилового анализа.
Вычисление: Вычисление t1/2 проводили исходя из наклона кривой (log 10, логарифм по основанию 10) зависимости остаточной бетамиловой активности от времени инкубирования. t1/2 вычисляли как тангенс угла наклона кривой/0,301=t1/2.
Пример 8. Пробная выпечка модельной системы
Тесто приготавливали в фаринографе при 30,0°С. 10,00 г реформированной муки взвешивали и добавляли в фаринограф, и через 1 минуту, через отверстия месильного чана стерильной пипеткой добавляли смесь эталона/образца (эталон = буфер или вода, образец = фермент + буфер или вода). Через 30 секунд, с краев соскабливали муку - также через отверстия месильного чана. Образец замешивали в течение 7 минут.
Тест с использованием буфера или воды осуществляли на фаринографе перед получением конечного эталонного продукта. Консистенцию теста расчитывали при постоянном эталонном значении ЕФ, равном 400, а если оно не достигалось, то такое значение должно быть скорректировано, например, добавлением определенного количества жидкости. Эталон/образец удаляли шпателем, а затем вручную (в одноразовых перчатках) заполняли данной смесью небольшие стеклянные пробирки (длиной приблизительно 4,5 см), которые помещали в ЯМР-пробирки и закрывали пробкой. Было приготовлено 7 пробирок с тестом.
Когда все образцы были получены, пробирки помещали на 25 минут в (программируемую) водяную баню при 33°С (без пробок), после чего водяную баню оставляли на 5 минут при 33°С, а затем нагревали до 98°С в течение 56 минут (на 1,1°С в минуту), и, наконец, снова оставляли на 5 минут при 96°С.
Пробирки хранили при 20,0°С в сушильном шкафу. Твердое содержимое мякиша измеряли с помощью протонного ЯМР с использованием ЯМР-анализатора Bruker NMS 120 Minispec на 1-й, 3-й и 7-й дни, как указано на фиг.2 для образцов мякиша, полученных с 0,05, 1 и 2 м.д. pSacD34. Меньшее увеличение содержания твердых веществ с течением времени означает снижение степени ретроградации амилопектина. После 7-дневного хранения при 20,0°С в сушильном шкафу, 10-20 мг образцов мякиша взвешивали помещали в алюминивые стандартные 40 мкл-капсулы для DSC и выдерживали при 20°С.
Эти капсулы использовали для проведения дифференциальной сканирующей калориметрии на устройстве Mettler Toledo DSC 820. Цикл нагревания 20→90°С проводили со скоростью 10°С в минуту, при потоке газа N2/80 мл в минуту. Результаты анализировали, и энтальпию плавления подвергаемого ретроградации амилопектина выражали в Дж/г.
Пример 9. Действие, направленное на предотвращение черствения
Модели хлебных мякишей были получены и оценены как описано в примере 8. Варианты PS4 обнаруживали значительное снижение уровня ретроградации амилопектина после выпекания данного продукта, как было измерено с помощью дифференциальной сканирующей калориметрии, по сравнению с контролем. Варианты PS4 обнаруживали явный дозозависимый эффект.
Пример 10. Рецепт пробной выпечки
Пробную выпечку осуществляли по стандартному рецепту приготовления белого хлеба из теста на опаре и бездрожжевого теста для тостов US. Тесто на опаре получали из 1400 г муки «Gold Medal» от General Mills, США, 800 г воды, 40 г масла из семян рапса, 7,5 г GRINDSTEDTM SSL P55 Veg, 10 г эмульгатора DIMOD ANTM PH200 и 60 г спрессованных дрожжей. Опару смешивали в течение 1 минуты при низкой скорости, а затем в течение 3 минут при скорости 2 на спиральном миксере Хобарта. Затем опару ферментировали в течение 3 часов при 25°С и при относительной влажности 85%.
Затем в опару добавляли 600 г муки «Gold Medal», 18 г спрессованных дрожжей, 5 г пропионата кальция, 160 г сахарозы, 5 г пропионата кальция, 432 г воды и аскорбиновую кислоту (до конечной концентрации 60 м.д.) и ADA (азодикарбонамид; до конечной концентрации 40 м.д.). Полученное тесто перемешивали в течение 1 минуты при низкой скорости, а затем в течение 2 минут на высокой скорости в миксере Diosna. Затем в тесто добавляли 30 г соли.
Это тесто оставляли на 5 минут при комнатной температуре, а затем отвешивали куски теста в 550 г, помещали в тестовальцовочную машину Glimek с установкой параметров 1:4, 2:4, 3:15, 4:12 и ширины 8 с обеих сторон и переносили в форму для выпечки хлеба. После 65-минутной расстойки при 43°С и при относительной влажности 95%, тесто выпекали в течение 26 минут при 200°С в микроволновой печи.
Пример 11. Регуляция объема датских булочек
Датские булочки выпекали из теста, приготовленного из 2000 г датской реформированной муки (от Cerealia), 120 г спрессованных дрожжей, 32 г соли и 32 г сахарозы. В тесто добавляли воду для оптимизации ее содержания.
Тесто смешивали на миксере Diosna (2 минуты при низкой скорости и 5 минут при высокой скорости). Температуру теста после смешивания поддерживали при 26°С. Затем отвешивали 1350 г теста и оставляли на 10 минут в нагревательной кабине при 30°С. Булочки формовали на формовочной машине Fortuna и оставляли на 45 минут для расстойки при 34°С и при относительной влажности 85%. Затем булочки выпекали в печи Bago 2 в течение 18 минут при 250°С при подачи пара в первые 13 секунд. После выпекания, булочки охлаждали в течение 25 минут, а затем взвешивали и измеряли объем.
Булочки анализировали на внешний вид корочки, однородность мякиша, консистенцию корочки, качество и конкретный объем (объем измеряли методом вытеснения рапсовых семян).
Исходя из этих критериев было установлено, что варианты PS4 способствуют повышению объема и улучшению качества датских булочек. Таким образом, варианты PS4 могут быть использованы для регуляции объема хлебобулочных изделий.
Пример 12. Протокол оценки плотности, упругости и слипаемости
Анализ профиля консистенции хлеба
Плотность, упругость и слипаемость определяли путем анализа профиля консистенции ломтиков хлеба на анализаторе консистенции Stable Micro Systems, UK. Определение плотности и упругости проводили на предварительно установленном стандартном оборудовании, поставляемом Stable Micro Systems, UK. В качестве зонда использовали алюминиевый 50 мм-круг.
Хлеб разрезали на ломтики шириной 12,5 мм. Эти ломтики формовали с получением круглых кусочков диаметром 45 мм и измеряли по отдельности.
При этом использовали следующие параметры:
Скорость до проведения анализа: 2 мм/с
Скорость при проведении анализа: 2 мм/с
Скорость после проведения анализа: 10 мм/с
Площадь в тесте на разрыв: 1%
Площадь: 40%
Сила: 0,098 Н
Время: 5,00 сек
Количество: 5
Загрузочная камера: 5 кг
Устройство триггерного типа: автоматизированное - 0,01 Н.
Способ сжатия представляет собой модификацию обычно применяемого стандартного способа AACC 74-09. Во время теста, образец подвергали сжатию два раза. На фиг.1 представлен пример кривой, полученной на анализаторе консистенции.
Пример 13. Протокол оценки плотности
Плотность определяли при 40% сжатии во время первого сжатия. На фигуре указана сила, необходимая для сжатия ломтика хлеба до снижения его толщины на 40% от общей толщины ломтика. Чем ниже величина этой силы, тем мягче хлеб. Плотность выражают в единицах давления, например, гПа.
Этот анализ может называться «Протоколом оценки плотности».
Пример 14. Протокол оценки упругости
Мерой работы, прилагаемой во время теста, является площадь под кривой. Площади под кривой во время сжатия (Al) и во время снятия нагрузки (A2) в процессе первого сжатия показаны на фиг.1.
Отношение между A1 и A2 определяют как упругость образца и выражают в единицах упругости. Материал с идеальной эластичностью дает симметричную кривую, поскольку сила, прилагаемая в первой части, равна силе, прилагаемой во второй части. Для хлеба и продукта, подобного хлебу, А2 обычно меньше, чем А1, что обусловлено нарушением структуры во время сжатия. Следовательно, показатель упругости всегда меньше 1.
Этот анализ может называться «Протоколом оценки упругости».
Пример 15. Протокол оценки слипаемости
Слипаемость определяют как отношение площади под кривой при втором сжатии к площади под кривой при первом сжатии (A3/A1+A2), и выражают в единицах слипаемости. Слипаемость является мерой порчи образца в процессе сжатия. Чем выше способность образца приобретать первоначальную форму после первого сжатия, тем ближе величина слипаемости к 1. Для хлеба и продукта, подобного хлебу, слипаемость всегда ниже 1.
Этот анализ может называться «Протоколом оценки слипаемости».
Пример 16. Протокол оценки раскрашиваемости (устойчивости к крошению хлеба)
Два ломтика хлеба помещали на лист бумаги. Каждый ломтик разделяли на 4 квадрата путем его разрыва на части сначала по вертикали, а затем по горизонтали.
Хлебный мякиш разрывали пальцами. Сначала ломтик разрывали с середины верхней части поверхности хлеба до середены нижней части поверхности хлеба. Затем каждую половину исходного ломтика разрывали в направлении от корочки до внутренней части. Небольшие кусочки мякиша, которые были разделены на 4 квадрата, удаляли путем встряхивания каждого кусочка после по меньшей мере 3-кратного разрывания вручную движениями руки вверх и вниз.
Массу разделенных маленьких кусочков мякиша определяют как показатель раскрашиваемости. Этот анализ может называться «Протоколом оценки раскрашиваемости».
Пример 17. Протокол оценки сворачиваемости
Хлебные тосты нарезали ломтиками на автоматической хлеборезке с получением серии ломтиков толщиной в 15 мм. Эти ломтики свертывали вручную сверху вниз с направлением загиба от одной стороны к другой.
Сворачиваемость визуально оценивали по следующей системе баллов:
Этот анализ может называться «Протоколом оценки сворачиваемости».
Пример 18. Улучшенная термостабильность полипептидов
варианта PS4
Термостабильность амилазы pSac-pMS382 определяли как описано выше и сравнивали с термостабильностью pSac-D34/pMD3 (SEQ ID NO: 2) и pSac-pMD229 (SEQ ID NO: 13).
Поскольку термоинактивация представляет собой реакцию 1-го порядка, то время полужизни, определяемое как время (в минутах), за которое происходит 50% инактивация, вычисляли исходя из остаточной активности с помощью бетамилового анализа после инкубирования в течение 1-40 минут при 75, 80 и 85°С (167, 176 и 185°F, соответственно) в 50 мМ цитрата натрия, 5 мМ хлорида кальция, рН 6,5.
Результаты представлены на фиг.2. На этой фигуре показано, что термостабильность (время полужизни) полипептидов варианта PS4, содержащих замену в положении 307, на основную или положительно заряженную аминокислоту, была выше, чем термостабильность полипептидов, не содержащих такой мутации.
Пример 19. Улучшенные технологические свойства пищевых продуктов, обработанных полипептидами варианта PS4: Плотность
Выпекали хлеб с различными количествами pSac-pMS382 (SEQ ID NO: 21), содержащей замену на основный или положительно заряженный остаток в положении 307, то есть, с 20000, 40000 и 60000 бетамиловых единиц/кг pSac-pMS382.
Плотность хлеба тестировали в соответствии с протоколом, описанным в примере 13, в различные периоды времени после выпекания. В качестве контроля также измеряли плотность хлеба, выпеченного без каких-либо ферментов.
На фиг.3 представлены результаты пробной выпечки, где тестировали плотность хлеба.
Пример 20. Улучшенные технологические свойства пищевых продуктов, обработанных полипептидами варианта PS4: Упругость
Выпекали хлеб с различными количествами pSac-pMS382 (SEQ ID NO: 21), содержащей замену на основный или положительно заряженный остаток в положении 307, то есть, с 20000, 40000 и 60000 бетамиловых единиц/кг pSac-pMS382.
Упругость хлеба тестировали в соответствии с протоколом, описанным в примере 14, в различные периоды времени после выпекания. В качестве контроля также измеряли упругость хлеба, выпеченного без каких-либо ферментов.
На фиг.4 представлены результаты пробной выпечки, где тестировали упругость хлеба.
Пример 21. Улучшенные технологические свойства пищевых продуктов, обработанных полипептидами варианта PS4: слипаемость
Выпекали хлеб с различными количествами pSac-pMS382 (SEQ ID NO: 21), содержащей замену на основный или положительно заряженный остаток в положении 307, то есть, с 20000, 40000 и 60000 бетамиловых единиц/кг pSac-pMS382.
Слипаемость хлеба тестировали в соответствии с протоколом, описанным в примере 15, в различные периоды времени после выпекания. В качестве контроля также измеряли плотность хлеба, выпеченного без каких-либо ферментов.
На фиг.5 представлены результаты пробной выпечки, где тестировали слипаемость хлеба.
Пример 22. Улучшенные технологические свойства пищевых продуктов, обработанных полипептидами варианта PS4: Плотность
Выпекали хлеб с 60000 бетамиловых единиц/кг pSac-pMS382 (SEQ ID NO:21), содержащих замену на основный или положительно заряженный остаток в положении 307, и плотность хлеба тестировали в соответствии с протоколом, описанным в примере 13, в различные периоды времени после выпекания.
Кроме того, выпекали хлеб с 60000 бетамиловых единиц/кг pSac-D34/pMD3 (SEQ ID NO:2) и 60000 бетамиловых единиц/кг pSac-pMD229 (SEQ ID NO:13), каждая из которых не содержала замену в положении 307, на основную или положительно заряженную аминокислоту. Было проведено тестирование плотности хлеба.
В качестве контроля также измеряли плотность хлеба, выпеченного без каких-либо ферментов.
На фиг.6 представлены результаты пробной выпечки, где тестировали плотность хлеба, обработанного полипептидом варианта PS4 в присутствии и отсутствии замены в положении 307.
Пример 23. Улучшенные технологические свойства пищевых продуктов, обработанных полипептидами варианта PS4: Плотность, упругость и слипаемость
Выпекали хлеб с 60000 бетамиловых единиц/кг pSac-pMS382 (SEQ ID NO:21), содержащих замену на основный или положительно заряженный остаток в положении 307, и упругость хлеба тестировали в соответствии с протоколом, описанным в примере 14, в различные периоды времени после выпекания.
Кроме того, выпекали хлеб с 60000 бетамиловых единиц/кг pSac-D34/pMD3 (SEQ ID NO:2) и 60000 бетамиловых единиц/кг pSac-pMD229 (SEQ ID NO:13), каждая из которых не содержала замену в положении 307 на основную или положительно заряженную аминокислоту. Было проведено тестирование упругости хлеба.
В качестве контроля также измеряли плотность хлеба, выпеченного без каких-либо ферментов.
На фиг.7 представлены результаты пробной выпечки, где тестировали упругость хлеба, обработанного полипептидом варианта PS4 в присутствии и отсутствии замены в положении 307.
Пример 24. Улучшенные технологические свойства пищевых продуктов, обработанных полипептидами варианта PS4: Слипаемость
Выпекали хлеб с 60000 бетамиловых единиц/кг pSac-pMS382 (SEQ ID NO:21), содержащих замену на основный или положительно заряженный остаток в положении 307, и слипаемость хлеба тестировали в соответствии с протоколом, описанным в примере 15, в различные периоды времени после выпекания.
Кроме того, выпекали хлеб с 60000 бетамиловых единиц/кг pSac-D34/pMD3 (SEQ ID NO:2) и 60000 бетамиловых единиц/кг pSac-pMD229 (SEQ ID NO:13), каждая из которых не содержала замену в положении 307 на основную или положительно заряженную аминокислоту. Было проведено тестирование слипаемости хлеба.
В качестве контроля также измеряли слипаемость хлеба, выпеченного без каких-либо ферментов.
На фиг.8 представлены результаты пробной выпечки, где тестировали слипемость хлеба, обработанного полипептидом варианта PS4 с заменой и без замены в положении 307.
Пример 25. Улучшенные технологические свойства пищевых продуктов, обработанных полипептидами варианта PS4: Сворачиваемость
Выпекали хлеб из теста на опаре и бездрожжевого теста в виде тостов, обработанный 4 м.д. pSac-pMS382 (SEQ ID NO:21, с заменой Н307К), и проводили тестирование и оценку сворачиваемости выпеченного хлеба.
В качестве контроля выпекали хлеб из теста на опаре и бездрожжевого теста в виде тостов, не обработанный ферментом, и проводили тестирование и оценку сворачиваемости такого хлеба.
Тесты проводили на трех ломтиках на 13-й день после выпекания.
Как указано выше в таблице и на фигурах, хлеб из теста на опаре и бездрожжевого теста в виде тостов, обработанный полипептидом варианта PS4, содержащим замену в положении 307 на основную или положительно заряженную аминокислоту, имел лучшую сворачиваемость по сравнению со сворачиваемостью необработанного хлеба в виде тостов.
Пример 26. Улучшенные технологические свойства пищевых продуктов, обработанных полипептидами варианта PS4: Сворачиваемость
Выпекали хлеб из теста на опаре и бездрожжевого теста в виде тостов, обработанный 4 м.д. pSac-pMS382 (SEQ ID NO:21, с заменой Н307К), и проводили тестирование и оценку сворачиваемости выпеченного хлеба, как описано выше.
В качестве контроля выпекали хлеб из теста на опаре и бездрожжевого теста в виде тостов, не обработанный ферментом, и проводили тестирование и оценку сворачиваемости такого хлеба. Также тестировали сворачиваемость хлеба из теста на опаре и бездрожжевого теста в виде тостов, обработанного другими ферментами, описанными ниже.
Фермент pSac-D34 (также известный как pMD3) содержит мутации N33Y, D34N, G121D, G134R, A141P, I157L, L178F, A179T, G223A, H307L, S334P, по сравнению с не-мальтогенной экзоамилазой дикого типа, и его последовательность представлена в SEQ ID NO:2.
Фермент pSac-pMD229 содержит мутации N33Y, D34N, G121F, G134R, A141P, Y146G, I157L, S161A, L178F, A179T, G223E, S229P, H272Q, G303E, H307L, A309P, S334P, по сравнению с не-мальтогенной экзоамилазой дикого типа, и его последовательность представлена в SEQ ID NO:13.
Тесты проводили на трех ломтиках на 8-й день после выпекания.
Как указано выше в таблице, хлеб из теста на опаре и бездрожжевого теста в виде тостов, обработанный полипептидом варианта PS4, содержащим замену в положении 307 на основную или положительно заряженную аминокислоту, имел лучшую сворачиваемость по сравнению со сворачиваемостью хлеба, обработанного ферментами, не содержащими такой замены.
Пример 27. Улучшенные технологические свойства пищевых продуктов, обработанных комбинациями полипептидов варианта PS4 и другими ферментами: Сворачиваемость
Выпекали хлеб из теста на опаре и бездрожжевого теста в виде тостов, обработанный 6 м.д. pSac-pMS382 (SEQ ID NO:21, с заменой 307К), взятым отдельно или в комбинации с другими ферментами, описанными ниже, и проводили тестирование и оценку сворачиваемости выпеченного хлеба, как описано выше.
Комбинация 1: 6 м.д. pSac-pMS382 + 50 м.д. GRINDAMYLТМ POWERBake 900 + 15 м.д. GRINDAMYLТМ Max-Life U4.
Комбинация 2: 6 м.д. pSac-pMS382 + 50 м.д. GRINDAMYLТМ POWERBake 900.
Комбинация 3: 6 м.д. pSac-pMS382 + 50 м.д. GRINDAMYLТМ POWERBake 900+150 м.д. GRINDAMYLТМ POWERBake 4050.
Продукт GRINDAMYLTMPOWERBake 900 представляет собой коммерчески доступную ксиланазу, поставляемую компанией Danisco A/S. Продукт GRINDAMYLТМ Max-Life U4 представляет собой коммерчески доступную бактериальную α-амилазу, поставляемую компанией Danisco A/S. Продукт GRINDAMYLТМ POWERBake 4050 представляет собой коммерчески доступную липазу, поставляемую компанией Danisco A/S.
В качестве контроля выпекали хлеб из теста на опаре и бездрожжевого теста в виде тостов, не обработанный ферментом, и проводили тестирование и оценку сворачиваемости такого хлеба.
Тесты проводили на трех ломтиках на 5-й день после выпекания.
Как указано выше в таблице, хлеб из теста на опаре и бездрожжевого теста, изготовленный в виде тостов и обработанный полипептидом варианта PS4, содержащим замену в положении 307 на основную или положительно заряженную аминокислоту, и взятым отдельно или в комбинации с другими ферментами, такими как бактериальная α-амилаза, липаза и ксиланаза, имел лучшую сворачиваемость по сравнению со сворачиваемостью необработанного хлеба.
Пример 28. Улучшенные технологические свойства пищевых продуктов, обработанных полипептидами варианта PS4: тесты на раскрашиваемость
Выпекали хлеб из теста на опаре и бездрожжевого теста в виде тостов, обработанный 4 м.д. pSac-pMS382 (SEQ ID NO:21, с заменой 307К), и проводили тестирование и оценку раскрашиваемости такого хлеба.
В качестве контроля выпекали хлеб из теста на опаре и бездрожжевого теста в виде тостов, не обработанный ферментом, и проводили тестирование и оценку сворачиваемости такого хлеба.
Тесты проводили на 13-й день после выпекания.
Как указано выше в таблице, через 13 дней, хлеб из теста на опаре и бездрожжевого теста в виде тостов, обработанный полипептидом варианта PS4, содержащим замену в положении 307 на основную или положительно заряженную аминокислоту, имел более низкую степень раскрашиваемости.
Пример 29. Улучшенные технологические свойства пищевых продуктов, обработанных полипептидами варианта PS4: тесты на раскрашиваемость
Выпекали хлеб из теста на опаре и бездрожжевого теста в виде тостов, обработанный 4 м.д. pSac-pMS382 (SEQ ID NO:21, с заменой 307К), и проводили тестирование и оценку раскрашиваемости такого хлеба, как описано выше.
В качестве контроля выпекали хлеб из теста на опаре и бездрожжевого теста в виде тостов, не обработанный ферментом, и проводили тестирование и оценку раскрашиваемости такого хлеба, как описано выше.
Тесты проводили на 15-й день после выпекания.
Как указано выше в таблице, через 15 дней, хлеб из теста на опаре и бездрожжевого теста в виде тостов, обработанный полипептидом варианта PS4, содержащим замену в положении 307 на основную или положительно заряженную аминокислоту, имел более низкую степень раскрашиваемости.
Пример 30. Полипептиды варианта PS4 с заменами в положении 307К.
Были получены следующие полипептиды с заменами на лизин в положении 307, и свойства таких полипептидов тестировали как описано выше. Последовательности полипептидов содержат последовательность SEQ ID NO:2 вместе с конкретными заменами.
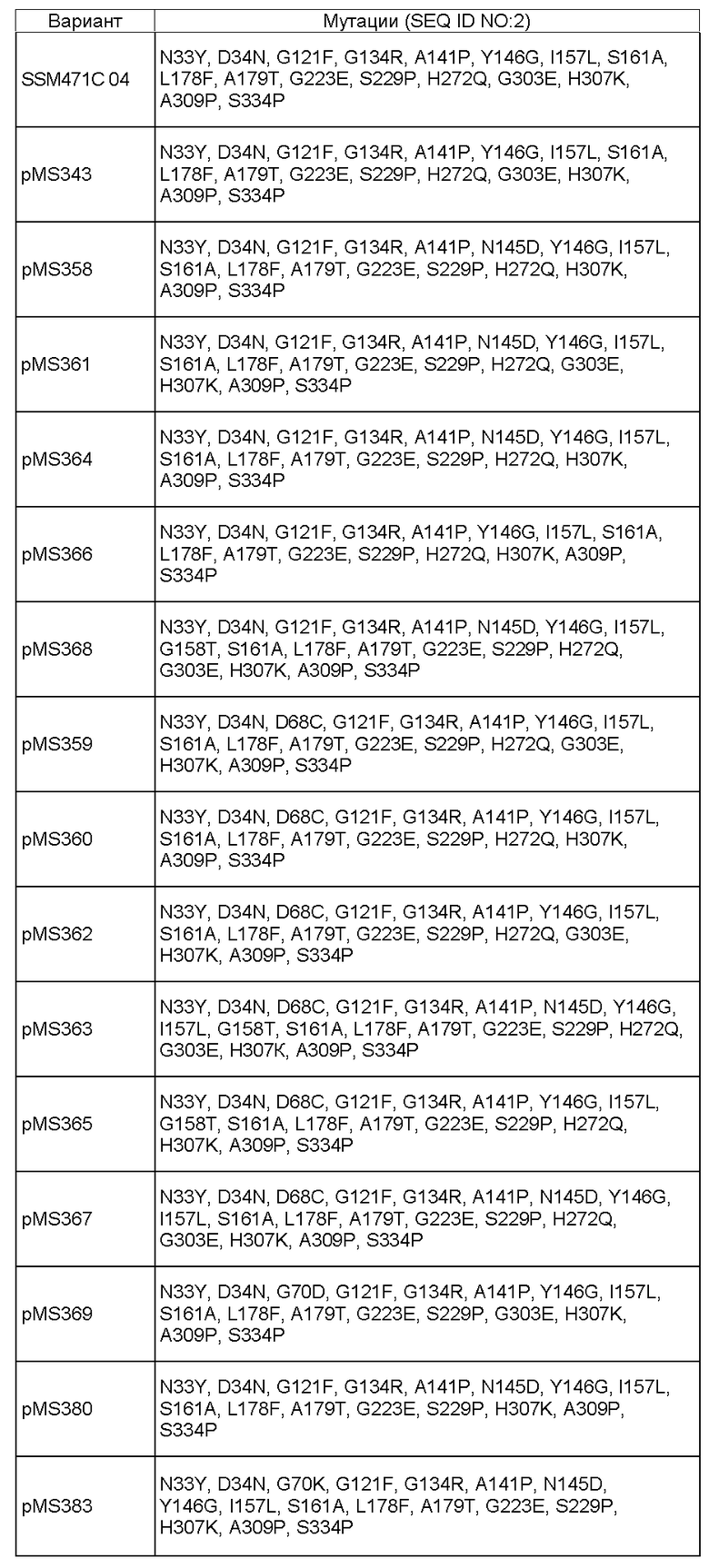
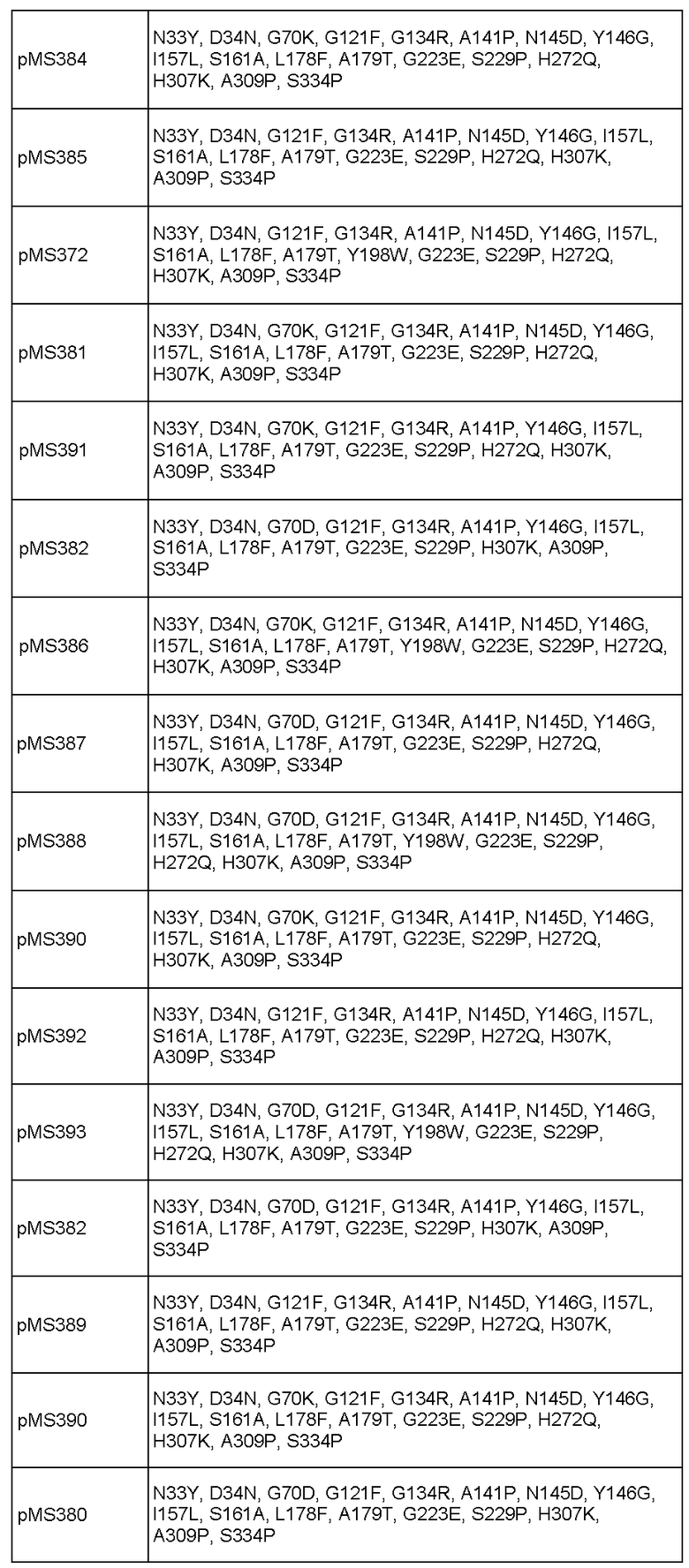
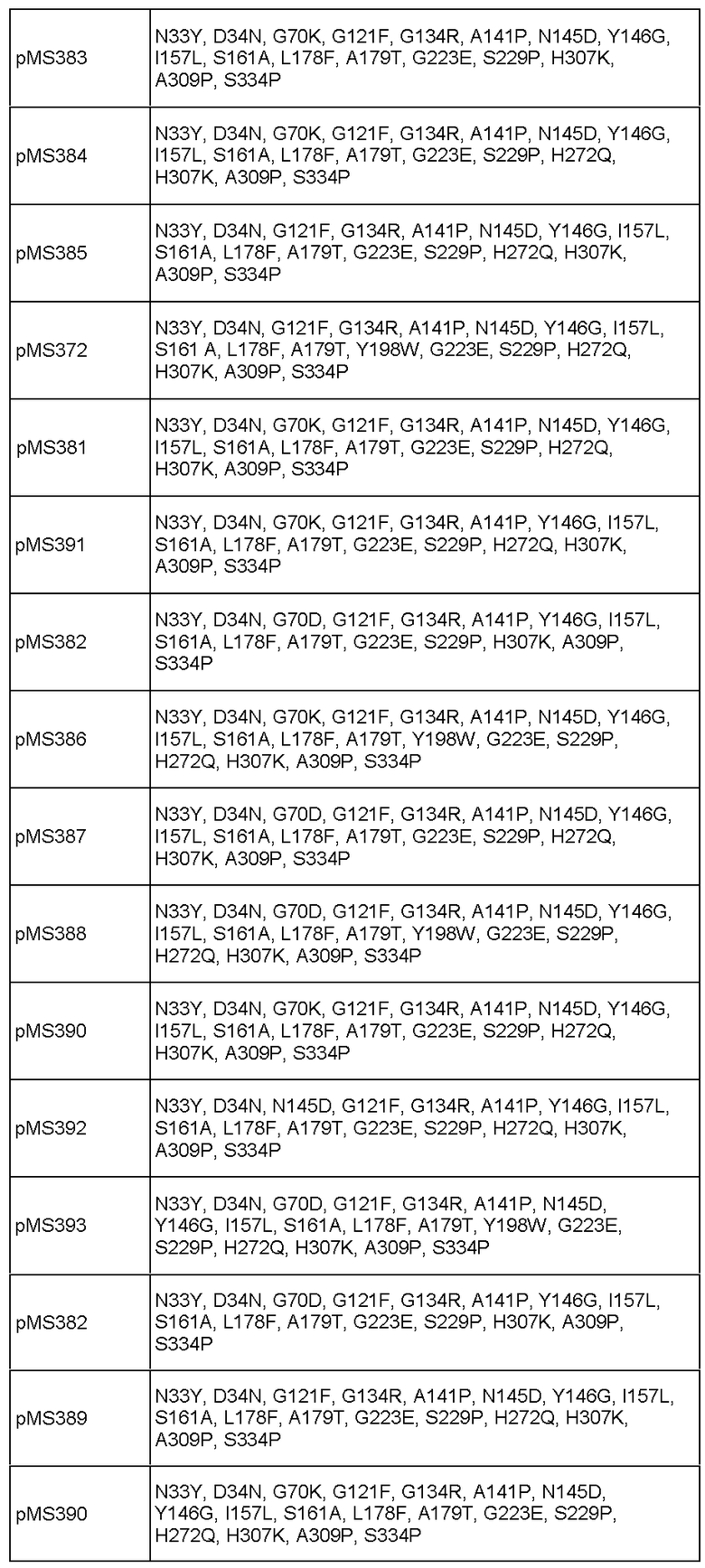
Пример 31. Полипептиды варианта PS4 с гистидином в положении 307Н.
Были получены следующие полипептиды с гистидином в положении 307, вместе с другими мутациями, и свойства таких полипептидов тестировали, как описано выше. Последовательности полипептидов содержат последовательность SEQ ID NO:2 вместе с конкретными заменами.
Пример 32. Получение полипептидов PS4 с мутациями в положениях L307R и L307K
SSM 471 B10 и SSM 471 C04 с другими остатками в положении 307 (L307R, L307K) получали с помощью сайт-направленного мутагенеза со множеством мутаций (как описано выше в примере 3), с использованием праймеров, указанных в следующей таблице:
Праймер, используемый для сканирования сайтов в положении 307:
(синт)
96 клонов из библиотеки Site Scan секвенировали, и идентифицировали два варианта SSM 471 B10 и SSM 471 C04, содержащие аминокислоты R и K, соответственно, в положении 307.
Аминокислотная последовательность SSM471 B10 представлена в SEQ ID NO: 27, а последовательность нуклеиновой кислоты SSM471 B10 представлена в SEQ ID NO: 28.
Аминокислотная последовательность SSM471 C04 представлена в SEQ ID NO: 29, а последовательность нуклеиновой кислоты SSM471 C04 представлена в SEQ ID NO: 30.
Аналогичным образом, другие полипептиды варианта PS4, происходящие от родительского полипептида и имеющие мутации L307R или L307K, получали с помощью сайт-направленного мутагенеза со множественными мутациями (как описано выше в примере 3), с использованием праймеров, указанных в следующей таблице:
Праймер, используемый для сканирования сайтов в положении 307:
(синт)
Для полипептидов с дополнительной мутацией в области 301- 306 или 308-313, дополнительную мутацию вводили с помощью сайт-направленного мутагенеза с множеством мутаций (в соответствии с методом, описанным в примере 3).
96 клонов из библиотеки Site Scan секвенировали, и идентифицировали варианты, содержащие аминокислоты R и K, соответственно, в положении 307.
Пример 33. Пробная выпечка лепешек
Лепешки выпекали по следующему рецепту:
Процедура:
Температура теста должна составлять 30°С. Все сухие ингредиенты помещали в миксер aK- Emper и медленно перемешивали в течение 1 минуты. Затем добавляли воду, и медленно перемешивали в течение 12 минут. Отвешивали 1350 г. Формовали в пресс-форме Glimek: время выпрессовывания 3,0 - время округления теста: 3,0. Тесто подвергали промежуточной расстойке 10 минут при 30°С. Комки теста пропускали через машину для выпекания лепешек CFO 40:
Параметры:
Прессование: Комки теста подвергали горячему прессованию:
Верхний ярус: 205°С; нижний ярус: 200°С
Конвейеры:
Верхний: 230°С; средний: 225°С; нижний: 160°С
Время выпечки: приблизительно 30 секунд
Охлаждение: 12 мин., 20°С, относительная влажность (RH) 80%
Упаковка: вакуумная с СО2
Параметры установки: вакуум: 40; СО2: 41; температрура 82°С
Пример 34. Результаты теста на сворачиваемость, проводимого на 8-й день после выпекания
Тест на сворачиваемость проводили на 8-й день после выпекания как описано в примере 17.
На фиг.9 представлены результаты теста на сворачиваемость, проводимого через 8 дней после выпекания лепешек с 400 м.д. NovamylTM 1500 и 50 BMK/кг pSac-pMS382 (SEQ ID NO:21). На фиг.10 представлены результаты теста на сворачиваемость, проводимого через 8 дней после выпекания лепешек с 400 м.д. NovamylTM 1500 и 50 BMK/кг pSac-pMS382 (SEQ ID NO: 21).
На фиг.9 и 10 показаны все трещины, образовавшиеся при сворачивании 10 лепешек, полученных с 400 м.д. NovamylTM 1500.
На фиг.9 и 10 проиллюстрировано отсутствие трещин при сворачивании 10 лепешек, полученных с 50 BMK/кг pSac-pMS382 (SEQ ID NO: 21).
Пример 35. Пробная выпечка с SSM 471 B10 (SEQ ID NO: 27, 307R) и SSM 471 C04 (SEQ ID NO: 29, 307K)
Тост US, полученный в соответствии с процедурой выпекания теста на опаре и бездрожжевого теста как описано в примере 10, использовали для тестирования вариантов SSM 471 B10 (SEQ ID NO: 27) с 307R и SSM 471 C04 (SEQ ID NO: 29) с 307K в дозе 40 BMK/кг.
Тост оценивали на плотность и упругость, как описано в примерах 12-14.
На фиг.11 представлены результаты теста на плотность тостов US, полученных с SSM 471 B10 (SEQ ID NO: 27) и SSM 471 C04 (SEQ ID NO: 29). На фиг.12 представлены результаты теста на упругость тостов US, полученных с SSM 471 B10 (SEQ ID NO: 27) и SSM 471 C04 (SEQ ID NO: 29).
Было показано, что оба варианта давали значительно более низкую плотность (фиг.11) и значительно более высокую упругость (фиг.12), что указывало на то, что варианты 307R и 307K обладают значительным действием, направленным на предотвращение черствения.
Пример 36. Пробная выпечка с PMS 370 (SEQ ID NO: 31, 307H) и SSM 471 C04 (SEQ ID NO: 29, 307K)
PMS 370 получали с помощью сайт-направленного мутагенеза с множеством мутаций, как описано выше в примере 3. Последовательность PMS 370 представлена в SEQ ID NO: 31.
Тост US получали в соответствии с процедурой выпекания теста на опаре и бездрожжевого теста как описано в примере 10. Этот тост использовали для тестирования вариантов PMS 370 с 307H и SSM 471 C04 с 307K в дозах 20, 40 и 60 BMK/кг.
Тост оценивали на упругость как описано в примерах 12 и 14.
На фиг.13 представлены результаты теста на упругость тостов US, полученных с pMS 370 (SEQ ID NO:31) и с SSM 471 С04 (SEQ ID NO: 29).
Было показано, что оба варианта давали значительно более высокую упругость (фиг.13) при увеличении дозы, что указывало на то, что варианты 307Н и 307K придавали данному продукту значительно более высокую дозозависимую упругость. Однако дозозависимый эффект варианта 307K был значительно выше, чем дозозависимый эффект соответствующего варианта 307H.
Пример 37. Анализ остающейся активности после теплового воздействия для вариантов с различными заменами в положении 307
Подвергали тепловому воздействию полипептиды-варианты, описанные ниже, после чего проводили анализ остающейся активности и сравнивали его с активностью контрольного полипептида '307H', не подвергавшегося тепловому воздействию, с получением отношений остающейся активности вариантов по сравнению с полипептида '307H', в котором присутствуют те же самые мутации, за исключением того, что в положении 307 у него находится гистидин из последовательности дикого типа. Нумерация положений относится к SEQ ID NO:1. Рассчитывали среднее, а также 95%-доверительный интервал.
Результаты, приведенные на Фиг.14, показывают, что остающаяся активность в случае мутаций H307K и H307R с 95%-доверительным интервалом выше, чем в случае H307L с 95%-доверительным интервалом, из чего можно сделать вывод, что мутации H307K и H307R обладают преимуществом по сравнению с H307L.
Три протестированных полипептида-варианта отличаются от SEQ ID NO:1 мутациями, приведенными ниже. У них также отсутствует связывающий крахмал домен (соответствующий аминокислотам после положения 429(относительно последовательности SEQ ID NO:1)).
Протестированные варианты представляют собой:
БИБЛИОГРАФИЯ
Penninga, D., van der Veen, B.A., Knegtel, R.M., van Hijum, S.A., Rozeboom, H. J., KaIk, K.H., Dijkstra, B. W., Dijkhuizen, L. (1996). The raw starch binding domain of cyclodextrin glycosyltransferase from Bacillus circмклans strain 251. J.Biol.Chem. 271, 32777-32784.
Sambrook J, F.E.M.T. (1989). Molecular Cloning: A Laboratory Manual, 2nd Edn. Cold Spring Harbor Laboratory, Cold Spring Harbor NY.
Zhou,J.H., Baba,T., Takano,T., Kobayashi,S., Arai,Y. (1989). Nucleotide sequence of the maltotetraohydrolase gene from Pseudomonas saccharophila. FEBS Lett. 255, 37-41.
Каждая из заявок и каждый из упомянутых патентов, упомянутых в настоящей заявке, и каждый документ, цитируемый или упомянутый в каждом из цитируемых выше заявок и патентов, включая рассматриваемые заявки («документы, цитируемые в заявке) и любые инструкции производителей, или каталоги любых продуктов, цитируемые и упоминаемые в каждой из указанных заявок и патентов и в любом документе, цитируемом в заявке, включены в настоящее описание посредством ссылки. Кроме того, все документы, цитируемые в настоящем описании и все документы, цитируемые или упоминаемые в документах, цитируемых в настоящем описании, и любые инструкции производителей, или каталоги любых продуктов, цитируемые или упоминаемые в данной заявке, включены в настоящее описание посредством ссылки.
Специалистам в данной области очевидно, что в описанные в настоящем описании способы и системы могут быть внесены различные модификации и изменения, не выходящие за рамки объема и существа изобретения. Хотя настоящее изобретение описано на конкретных предпочтительных вариантах его осуществления, однако следует отметить, что заявленное изобретение не должно ограничиваться такими конкретными вариантами его осуществления. Действительно, различные модификации описанных способов осуществления изобретения, которые являются очевидными для специалистов в области молекулярной биологии или в смежных областях, также входят в объем формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИПЕПТИД | 2005 |
|
RU2415939C2 |
| ВАРИАНТЫ ГЛЮКОАМИЛАЗЫ | 2006 |
|
RU2439153C2 |
| ВАРИАНТ МАЛЬТОГЕННОЙ α-АМИЛАЗЫ | 1999 |
|
RU2258739C2 |
| СПОСОБ ОБРАБОТКИ КРАХМАЛА | 2003 |
|
RU2315811C2 |
| Чистящие композиции, содержащие варианты амилазы в соответствии с перечнем последовательностей | 2012 |
|
RU2617954C2 |
| ЛИПОЛИТИЧЕСКИЙ ФЕРМЕНТ ДЛЯ ПРИМЕНЕНИЯ В ХЛЕБОПЕЧЕНИИ | 2018 |
|
RU2763469C2 |
| ВАРИАНТЫ СЕМЕЙСТВА, СОСТОЯЩЕГО ИЗ 44 КСИЛОГЛЮКАНАЗ | 2009 |
|
RU2545721C2 |
| ВАРИАНТЫ АЛЬФА-АМИЛАЗЫ С ИЗМЕНЕННЫМИ СВОЙСТВАМИ | 2008 |
|
RU2499044C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ, И ПОЛИНУКЛЕОТИДЫ, КОДИРУЮЩИЕ ИХ | 2006 |
|
RU2415150C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОВНОСТЬЮ, И ПОЛИНУКЛЕОТИДЫ, КОДИРУЮЩИЕ ИХ | 2006 |
|
RU2512525C2 |























































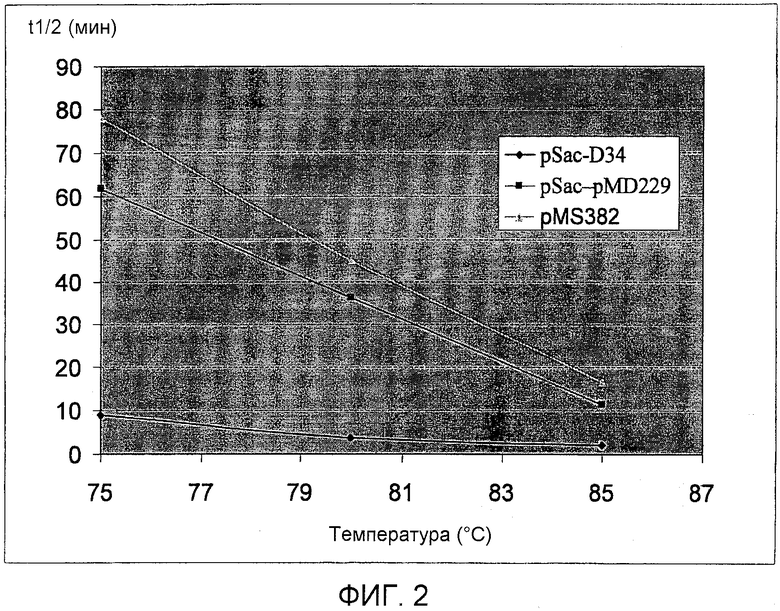
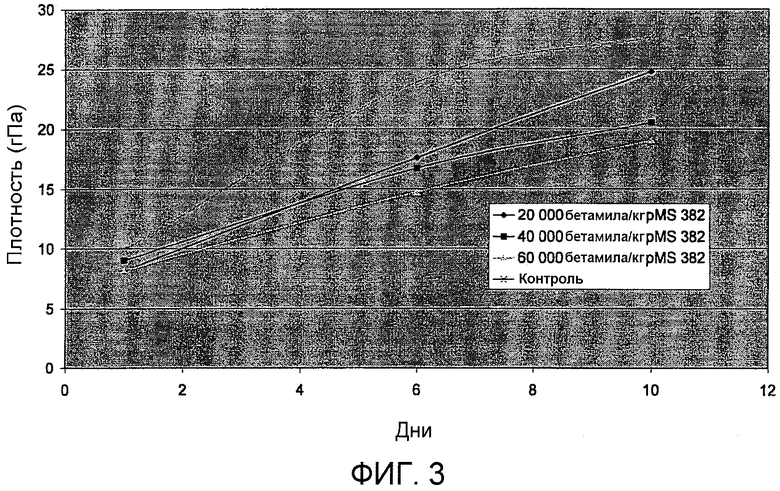
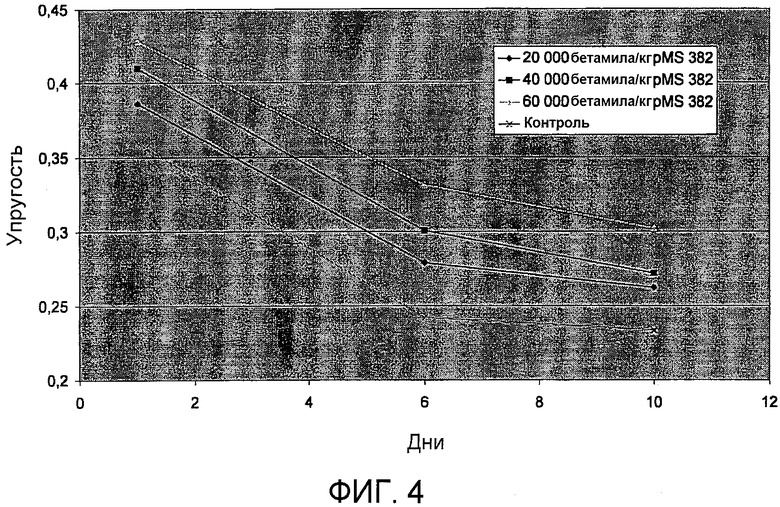
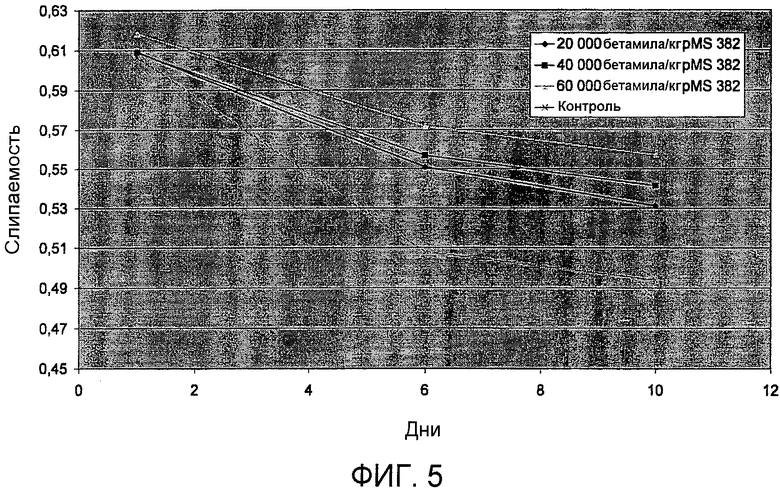
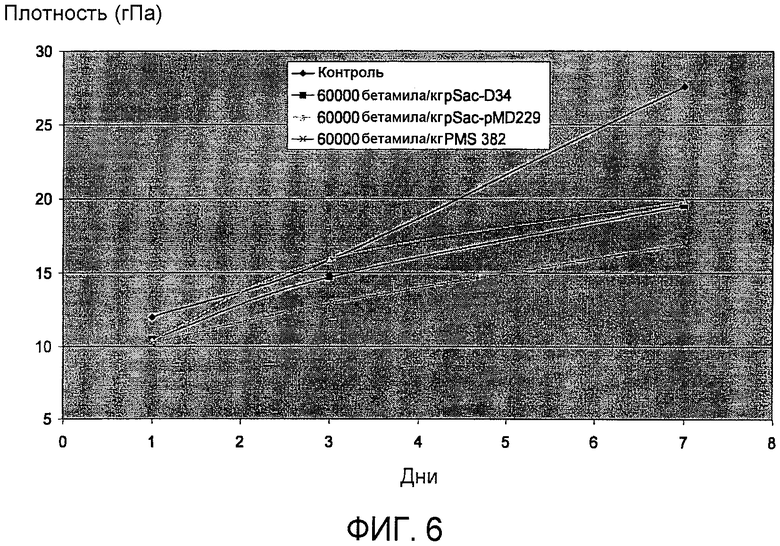
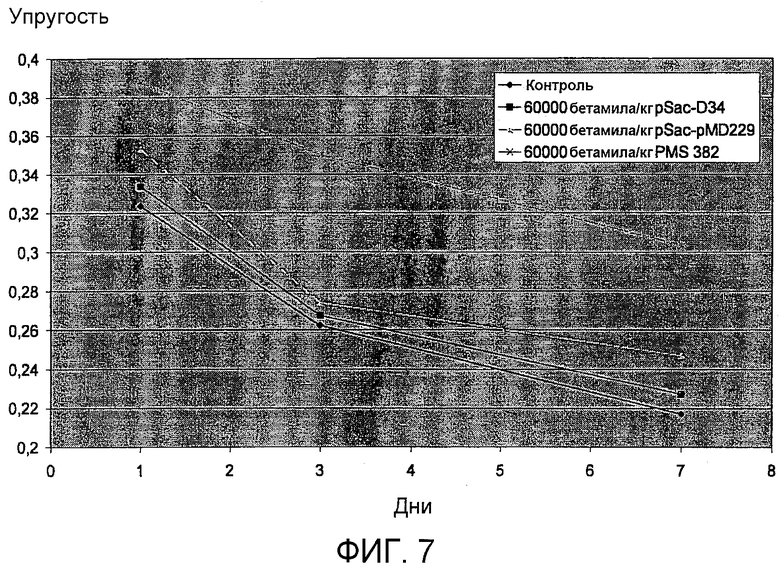


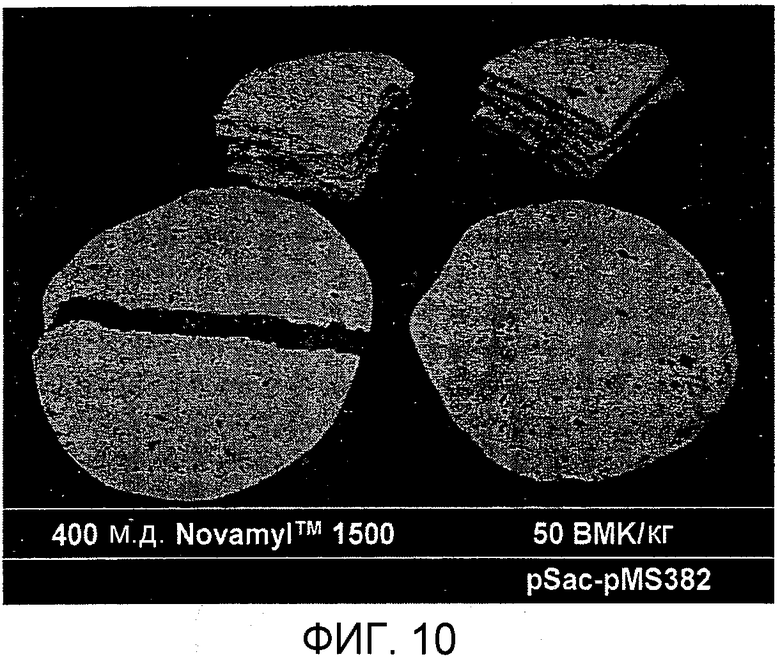
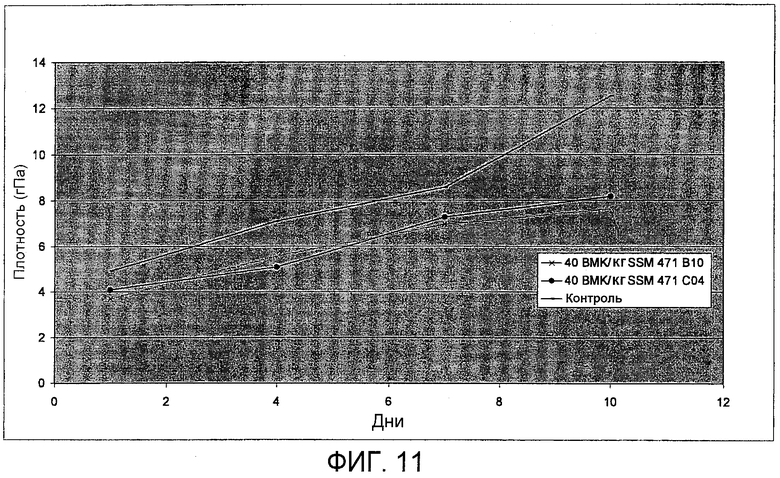
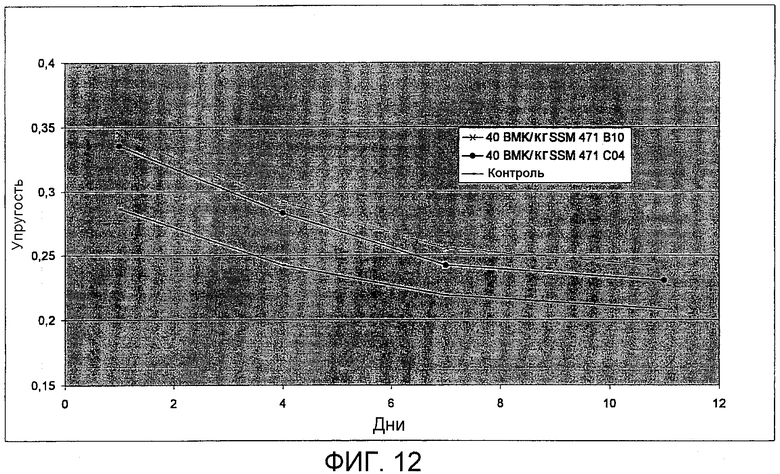

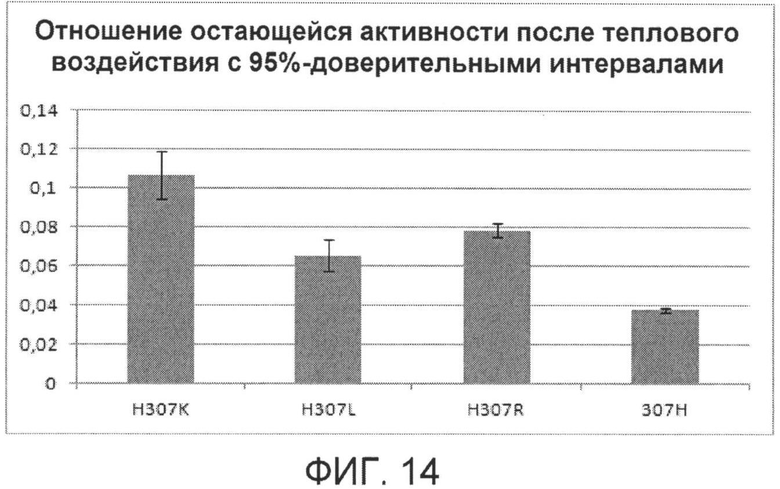
Изобретение относится к области биохимии, в частности к полипептиду, обладающему амилазной активностью, происходящему от родительского полипептида, являющегося не-мальтогенной экзоамилазой дикого типа, имеющей по меньшей мере 90% идентичность SEQ ID NO: 13. Указанный полипептид содержит аминокислотную замену в положении 307 на лизин (K) или аргинин (R), в соответствии с нумерацией положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1. Полипептид применяется в качестве пищевой или кормовой добавки, в способе обработки крахмала, для получения крахмал-содержащего пищевого или кормового продукта, в частности хлебобулочного изделия. Изобретение позволяет повысить термостабильность и экзоспецифичность не-мальтогенной экзоамилазы по сравнению с полипептидом дикого типа. 20 н. и 42 з. п. ф-лы, 14 ил., 25 табл., 37 пр.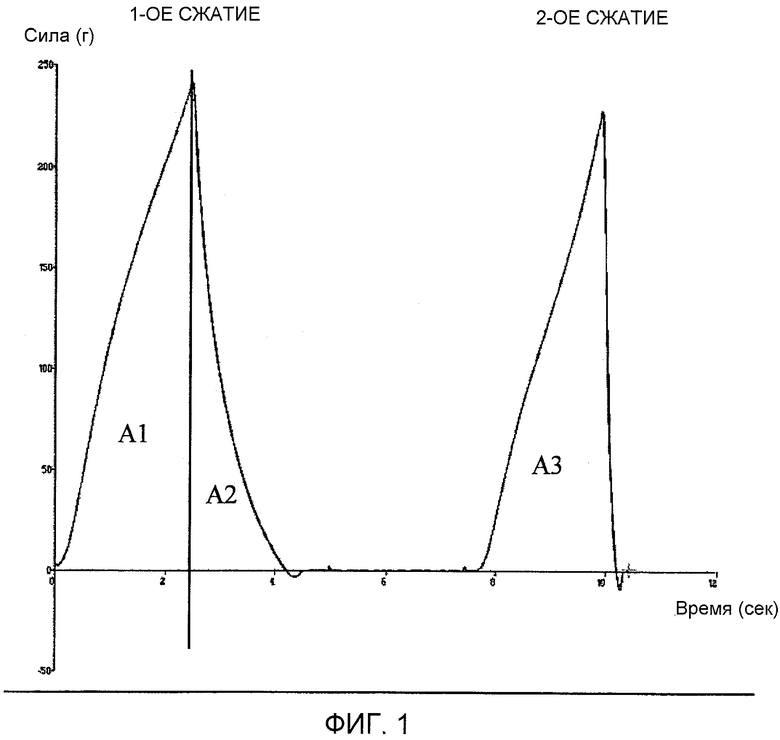
1. Вариантный полипептид, обладающий амилазной активностью, происходящий от родительского полипептида, являющегося не-мальтогенной амилазой дикого типа, имеющей амилазную активность, обладающей по меньшей мере 90% идентичностью SEQ ID NO: 13,
где указанный вариантный полипептид содержит аминокислотную замену в положении 307 на лизин (K) или аргинин (R), в соответствии с нумерацией положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1, и
где указанный вариантный полипептид обладает более высокой термостабильностью по сравнению с родительским полипептидом при их тестировании в одних и тех же условиях.
2. Вариантный полипептид по п.1, происходящий от родительского полипептида, обладающего экзоамилазной активностью, предпочтительно не-мальтогенной экзоамилазной активностью.
3. Вариантный полипептид по п.1 или 2, который включает аминокислотную замену в положении 70.
4. Вариантный полипептид по п.1 или 2, где аминокислотной заменой в положении 70 является замена на аспарагиновую кислоту (70D), предпочтительно G70D.
5. Вариантный полипептид по п.1 или 2, в котором аминокислота в положении 272 последовательности вариантного полипептида является гистидином (H).
6. Вариантный полипептид по п.1 или 2, в котором аминокислота в положении 303 последовательности вариантного полипептида является глицином (G).
7. Вариантный полипептид по п.1 или 2, который дополнительно включает одну или более мутаций, выбранных из группы, состоящей из положений: 33, 34, 121, 134, 141, 146, 157, 161, 178, 179, 223, 229, 309 или 334.
8. Вариантный полипептид по п.1 или 2, где дополнительная(ые) мутация(и) в вариантном полипептиде выбрана(ы) из группы, состоящей из: 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 223K, 229P, 309P, 334P, предпочтительно N33Y, D34N, G121F, G134R, A141P, Y146G, I157L, S161A, L178F, A179T, G223E, G223K, S229P, A309P и S334P.
9. Вариантный полипептид по п.1 или 2, где вариантный полипептид содержит следующие замены: 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307K, 309P, 334P, предпочтительно N33Y, D34N, G70D, G121F, G134R, A141P, Y146G, I157L, S161A, L178F, A179T, G223E, S229P, H307K, A309P, S334P, по сравнению с последовательностью экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1.
10. Вариантный полипептид по п.1 или 2, где вариантный полипептид содержит последовательность SEQ ID NO: 21 (pSac-pMS382).
11. Вариантный полипептид по п.1 или 2, где вариантный полипептид содержит следующие замены: 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 307R, 309P, 334P, предпочтительно N33Y, D34N, G70D, G121F, G134R, A141P, Y146G, I157L, S161A, L178F, A179T, G223E, S229P, H307R, A309P, S334P, по сравнению с последовательностью экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1.
12. Вариантный полипептид по п.1 или 2, где вариантный полипептид содержит последовательность SEQ ID NO: 23 (pSac-pMS382R).
13. Вариантный полипептид по п.1 или 2, происходящий от родительского полипептида, обладающего не-мальтогенной экзоамилазной активностью, где вариантный полипептид содержит следующие дополнительные замены 33Y, 34N, 70D, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 309P, 334P, предпочтительно N33Y, D34N, G70D, G121F, G134R, A141P, Y146G, I157L, S161A, L178F, A179T, G223E, S229P, A309P, S334P, по сравнению с последовательностью экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1.
14. Вариантный полипептид по п.1 или 2, где родительский полипептид содержит не-мальтогенную экзоамилазу, предпочтительно глюкан-1,4-альфа-мальтотетрагидролазу (EC 3.2.1.60).
15. Вариантный полипептид по п.1 или 2, где родительский полипептид представляет собой полипептид из видов Pseudomonas, предпочтительно Pseudomonas saccharophilia или Pseudomonas stutzeri, или происходит от этого полипептида.
16. Вариантный полипептид по п.1 или 2, имеющий аминокислотную последовательность, которая по меньшей мере на 75% идентична последовательности SEQ ID NO: 1 или SEQ ID NO: 5.
17. Вариантный полипептид по п.1 или 2, где родительским полипептидом является не-мальтогенная экзоамилаза из Pseudomonas stutzeri, имеющая последовательность, представленную в SEQ ID NO: 7 или SEQ ID NO: 11.
18. Вариантный полипептид по п.1 или 2, имеющий аминокислотную последовательность, которая по меньшей мере на 75% идентична последовательности SEQ ID NO: 7 или SEQ ID NO: 11.
19. Вариантный полипептид по п.1 или 2, который не содержит одного или более доменов, присутствующих в не-мальтогенных экзоамилазах.
20. Вариантный полипептид по п.1 или 2, который не содержит крахмал-связывающий домен, где крахмал-связывающий домен соответствует аминокислотам после положения 429, в соответствии с нумерацией положений последовательности Pseudomonas saccharophilia, представленной в SEQ ID NO: 1.
21. Вариантный полипептид по п.1 или 2, который содержит последовательность, выбранную из группы, состоящей из: SEQ ID NO: 21 (pSac-pMS382) и SEQ ID NO: 23 (pSac-pMS382R).
22. Вариантный полипептид по п.1 или 2, время полужизни которого (tl/2), предпочтительно при 60°С, на 15% или более, предпочтительно на 50% или более, наиболее предпочтительно на 100% или более превышает время полужизни родительского полипептида.
23. Вариантный полипептид по п.1 или 2, где пищевой продукт, обработанный вариантным полипептидом, имеет любое одно или более, предпочтительно все, из следующих свойств: (а) пониженная плотность; (b) повышенная упругость; (c) повышенная слипаемость; (d) пониженная раскрашиваемость; и (e) более высокая способность к сворачиваемости по сравнению с пищевым продуктом, обработанным родительским полипептидом.
24. Вариантный полипептид по п.23, где упругость, слипаемость или сворачиваемость пищевого продукта независимо друг от друга на 15% или более, предпочтительно на 50% или более, наиболее предпочтительно на 100% или более превышают указанные параметры пищевого продукта, обработанного родительским полипептидом.
25. Вариантный полипептид по п.23, где каждое из упругости, слипаемости и сворачиваемости пищевого продукта, обработанного вариантным полипептидом, является улучшенным по сравнению с указанным свойством пищевого продукта, обработанного родительским полипептидом.
26. Вариантный полипептид по п.23, где плотность или раскрашиваемость пищевого продукта независимо друг от друга на 15% или более, предпочтительно на 50% или более, наиболее предпочтительно на 100% или более ниже, чем указанные параметры пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа.
27. Вариантный полипептид по п.23, где каждый из плотности и раскрашиваемости пищевого продукта, обработанного вариантным полипептидом, ниже по сравнению с указанными свойствами пищевого продукта, обработанного родительским полипептидом или полипептидом дикого типа.
28. Применение вариантного полипептида по любому из предыдущих пунктов в качестве пищевой или кормовой добавки.
29. Способ обработки крахмала, включающий приведение крахмала в контакт с полипептидом по любому из пп.1-27 и получение из указанного крахмала одного или более линейных мальтоолигосахаридов под действием указанного полипептида.
30. Применение полипептида по любому из пп.1-27 для получения крахмал-содержащего пищевого или кормового продукта.
31. Применение по п.30, где пищевой продукт содержит тесто или продукт из теста, предпочтительно, обработанный продукт из теста.
32. Применение по любому из пп.30-31, где пищевой продукт является хлебобулочным изделием.
33. Применение по любому из пп.30-31, где пищевой продукт является лепешкой.
34. Способ получения крахмал-содержащего пищевого или кормового продукта, включающий смешивание полипептида по любому из пп.1-27 с крахмал-содержащим пищевым или кормовым ингредиентом.
35. Способ по п.34, где крахмал-содержащий пищевой продукт содержит тесто или продукт из теста, предпочтительно обработанный продукт из теста.
36. Способ по любому из пп.34-35, где крахмал-содержащий пищевой продукт является хлебобулочным изделием.
37. Способ по любому из пп.34-35, где крахмал-содержащий пищевой продукт является лепешкой.
38. Способ изготовления хлебобулочного изделия, включающий: (a) приготовление крахмальной среды; (b) добавление в крахмальную среду полипептида по любому из пп.1-27; и (c) подачу тепла к крахмальной среде во время или после стадии (b) с получением хлебобулочного изделия.
39. Способ по п.38, где полученное хлебобулочное изделие представляет собой лепешку.
40. Композиция для приготовления крахмал-содержащего пищевого продукта, содержащая муку и полипептид по любому из пп.1-27.
41. Применение вариантного полипептида по любому из пп.1-27 в продукте из теста для замедления или снижения черствения, предпочтительно нежелательной ретроградации продукта из теста.
42. Применение вариантного полипептида по любому из пп.1-27 в продукте из теста для улучшения любого одного или более свойств, таких как плотность, упругость, слипаемость, раскрашиваемость или сворачиваемость продукта из теста.
43. Композиция для применения в способе по любому из пп.29 и 34-39, содержащая вариантный полипептид по любому из пп.1-27 вместе с любым одним или более из следующего:
(a) мальтогенная альфа-амилаза, также называемая глюкан- 1,4-α-мальтогидролазой (EC 3.2.1.133) из Bacillus stearothermophilus, или ее вариант, гомолог или мутанты, обладающие мальтогенной альфа-амилазной активностью;
(b) пекарская ксиланаза (EC 3.2.1.8) из, например, Bacillus sp., Aspergillus sp., Thermomyces sp. или Trichoderma sp.;
(c) α-амилаза (EC 3.2.1.1) из Bacillus amyloliqufaciens или ее вариант, гомолог или мутанты, обладающие альфа-амилазной активностью; и
(d) липаза, такая как гликолипаза из Fusarium heterosporum.
44. Нуклеиновая кислота, кодирующая полипептид по любому из пп.1-27.
45. Нуклеиновая кислота по п.44, имеющая последовательность нуклеиновой кислоты, которая по меньшей мере на 75% идентична SEQ ID NO: 6 или SEQ ID NO: 12.
46. Нуклеиновая кислота, имеющая последовательность нуклеиновой кислоты, происходящую от родительской последовательности, способной кодировать не-мальтогенную экзоамилазу, обладающую по меньшей мере 90% идентичностью SEQ ID NO: 13, где указанная нуклеиновая кислота содержит замену в одном или более остатках, в результате чего такая нуклеиновая кислота кодирует остаток лизина (K) или аргинина (R) в положении 307, необязательно вместе с одной или более дополнительными мутациями, в результате чего такая нуклеиновая кислота кодирует один или более остатков, выбранных из группы, состоящей из: 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 309P, 334P, в соответствии с нумерацией положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO: 1, где указанная нуклеиновая кислота кодирует не-мальтогенную амилазу, обладающую повышенной термостабильностью по сравнению с указанным родительским полипептидом.
47. Нуклеиновая кислота по любому из пп.44-46, выбранная из группы, состоящей из: SEQ ID NO: 22 (pSac-pMS382), SEQ ID NO: 24 (pSac-pMS382R).
48. Плазмида для применения в трансформации клетки-хозяина, содержащая нуклеиновую кислоту по любому из пп.44-47.
49. Экспрессионный вектор, содержащий нуклеиновую кислоту по любому из пп.44-47 или способный экспрессировать полипептид по любому из пп.1-27.
50. Клетка-хозяин для экспрессии полипептида по любому из пп.1-27, содержащая плазмиду по п.48 или экспрессионный вектор по п.49, предпочтительно трансформированная указанной плазмидой или указанным экспрессионным вектором.
51. Клетка-хозяин по п.50, которая представляет собой бактериальную, грибковую или дрожжевую клетку.
52. Способ получения полипептида по любому из пп.1-27, включающий получение клетки-хозяина или клетки по п.50 или 51, и экспрессию полипептида из указанной клетки-хозяина, выделение указанного полипептида и, необязательно, очистку указанного полипептида.
53. Способ получения полипептида по любому из пп.1-27 путем введения аминокислотной замены в положение 307 на лизин (K) или аргинин (R) (в соответствии с нумерацией положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1), в родительский полипептид, обладающий не-мальтогенной экзоамилазной активностью и обладающий по меньшей мере 90% идентичностью SEQ ID NO: 13.
54. Способ по п.53, в котором в родительский полипептид, обладающий не-мальтогенной экзоамилазной активностью, введена аминокислотная замена в положении 70 на основный или положительно заряженный остаток (в соответствии с нумерацией положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1).
55. Способ по п.53 или 54, в котором в родительский полипептид, обладающий не-мальтогенной экзоамилазной активностью, введена одна или более дополнительных мутаций, выбранных из группы, состоящей из: 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272H, 303G, 309P, 334P (в соответствии с нумерацией положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1).
56. Способ по п.54 или 55, где основным или положительно заряженным остатком в положении 70 является лизин (K), аргинин (R) или гистидин (H).
57. Способ по любому из пп.53-55, где последовательность не-мальтогенной экзоамилазы изменяют путем изменения последовательности нуклеиновой кислоты, кодирующей не-мальтогенную экзоамилазу.
58. Способ получения варианта полипептида, включающий введение аминокислотной замены в родительский полипептид, обладающий не-мальтогенной экзоамилазной активностью и обладающий по меньшей мере 90% идентичностью SEQ ID NO: 13, где аминокислотная замена представляет собой замену в положении 307 на лизин (K) или аргинин (R), необязательно вместе с одной или более дополнительными аминокислотными заменами, выбранными из группы, состоящей из: 33Y, 34N, 70K/R/H, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272H, 303G, 309P, 334P, в соответствии с нумерацией положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1.
59. Способ по п.58, где указанную аминокислотную замену вводят посредством изменения последовательности нуклеиновой кислоты, кодирующей родительский полипептид.
60. Способ получения нуклеиновой кислоты, кодирующей полипептид по любому из пп.1-27, включающий введение в последовательность, кодирующую родительский полипептид, обладающий не-мальтогенной экзоамилазной активностью и обладающий по меньшей мере 90% идентичностью SEQ ID NO: 13, кодона, который кодирует аминокислотный остаток лизина (K) или аргинина (R) в положении 307, необязательно вместе с одним или более кодонами, кодирующими аминокислотный остаток, выбранный из группы, состоящей из: 33Y, 34N, 70K/R/H, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 229P, 272H, 303G, 309P, 334P, в соответствии с нумерацией положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной в SEQ ID NO:1.
61. Способ повышения термостабильности и экзоспецифичности полипептида не-мальтогенной амилазы дикого типа, включающий стадии по любому из пп.52-60.
62. Способ по п.52, в котором полипептид очищают.
| WO 2005007867 A2, 27.01.2005 | |||
| RU 2004121419 A, 10.01.2006 | |||
| US 2006008890 A1, 12.01.2006 |
Авторы
Даты
2015-01-27—Публикация
2007-06-19—Подача