Изобретение относится к производным нуклеозидов в качестве ингибиторов репликации РНК в составе репликона вируса гепатита С (HCV). В частности, изобретение относится к применению производных пуриновых и пиримидиновых нуклеозидов в качестве ингибиторов репликации субгеномной РНК вируса гепатита С (HCV) и к фармацевтическим композициям, содержащим такие соединения.
Вирус гепатита С во всем мире является главной причиной хронического заболевания печени. Больные, инфицированные вирусом гепатита С, подвержены риску развития цирроза печени и последующего печеночно-клеточного рака и поэтому HCV является главным показанием для пересадки печени. Только два апробированных вида терапии в настоящее время доступны для лечения инфицированных вирусом гепатита С (R.G. Gish, Sem. Liver. Dis., 1999, 19, 35). Это монотерапия интерфероном-α и применяемая совсем с недавнего времени комбинированная терапия аналогом нуклеозида, рибавирином (виразол), с интерфероном-α.
Многие из лекарственных средств, одобренных для лечения вирусных инфекций, являются нуклеозидами или аналогами нуклеозидов и большинство из этих, являющихся аналогами нуклеозидов, лекарственных средств ингибирует после превращения в соответствующие трифосфаты репликацию вирусов путем ингибирования вирусных полимераз. Это превращение в трифосфат обычно опосредуется клеточными киназами и поэтому прямую оценку нуклеозидов в качестве ингибиторов репликации HCV удобно проводить только применяя клеточный анализ. Для HCV не хватает наличия точного клеточного анализа вирусной репликации или модели инфицированного животного.
Вирус гепатита С относится к семейству Flaviridae. Это содержащий РНК вирус с РНК-геномом, кодирующим полипротеин большой длины, который после процессинга создает необходимый механизм репликации для обеспечения синтеза РНК потомства. Считают, что большинство неструктурированных протеинов, кодируемых РНК-геномом вируса гепатита С, вовлечено в репликацию РНК. Lohmann и др. [V. Lohmann и др., Science, 1999, 285, 110-113] описали конструкцию линии клеток гепатомы человека (Huh7), в которую вводили молекулы субгеномной РНК вируса гепатита С, и было показано, что репликация происходила с высокой эффективностью. Считают, что механизм репликации РНК в этих линиях клеток идентичен репликации полного РНК-генома вируса гепатита С в инфицированных гепатоцитах. Субгеномные клоны кДНК вируса гепатита С, используемые для выделения этих линий клеток, составляли основу для развития клеточного анализа для идентификации ингибиторов репликации HCV, являющихся аналогами нуклеозидов.
Было показано, что соединения формулы I являются ингибиторами субгеномной репликации вируса гепатита С в линии клеток гепатомы. Эти соединения могут потенциально рассматриваться эффективными в качестве противовирусных средств для лечения заражений вирусом гепатита С у людей.
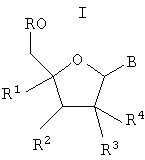
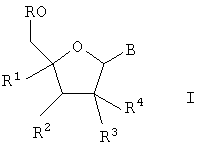
Изобретение относится к применению соединений формулы I,
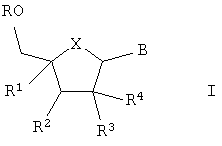
где
R означает водород или -[Р(O)(ОН)-O]nН и n является 1, 2 или 3;
R1 означает алкил, алкенил, алкинил, галоидалкил, алкилкарбонил, алкоксикарбонил, гидроксиалкил, алкоксиалкил, алкоксигруппу, цианогруппу, азидогруппу, гидроксииминометил, алкоксииминометил, галоген, алкилкарбониламиногруппу, алкиламинокарбонил, азидоалкил, аминометил, алкиламинометил, диалкиламинометил или гетероциклил;
R2 означает водород, гидроксил, аминогруппу, алкил, гидроксиалкил, алкоксигруппу, галоген, цианогруппу или азидогруппу;
R3 и R4 означают водород, гидроксил, алкоксигруппу, галоген или гидроксиалкил, при условии, что как минимум один из R3 и R4 означает водород; или
R3 и R4 вместе представляют =СН2 или =N-OH, или
R3 и R4 оба означают фтор;
Х означает О, S или СН2;
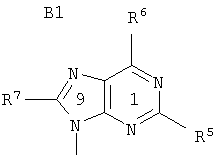
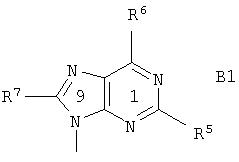
В является 9-пуринильным остатком В1 формулы
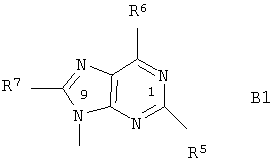
где
R5 означает водород, гидроксил, алкил, алкоксигруппу, алкилтиогруппу, NHR8, галоген или SH;
R6 означает гидроксил, NHR8, NHOR9, NHNR8, -NHC(O)OR9' или SH;
R7 означает водород, гидроксил, алкил, алкоксигруппу, алкилтиогруппу, NHR8, галоген, SH или цианогруппу;
R8 означает водород, алкил, гидроксиалкил, арилкарбонил или алкилкарбонил;
R9 означает водород или алкил;
R9' означает алкил; и
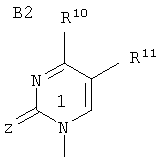
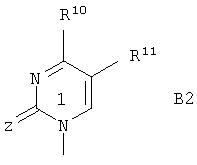
В является 1-пиримидильным остатком В2 формулы
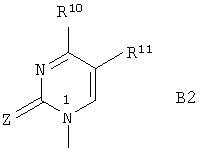
где Z означает О или S;
R10 означает гидроксил, NHR8, NHOR9, NHNR8, -NHC(O)OR9' или SH;
R10 означает водород, алкил, гидроксил, гидроксиалкил, алкоксиалкил, галоидалкил или галоген;
R8, R9 и R10 являются такими, как определено выше;
и их фармацевтически приемлемых солей
для лечения заболеваний, опосредствованных вирусом гепатита С (HCV), или
для приготовления лекарственных средств для такого лечения.
В соединениях, где R является фосфатной группой -[Р(O)(ОН)-O]nН, n является предпочтительно 1. Фосфатная группа может входить в состав представляющего монофосфат устойчивого пролекарства или может быть в виде другой фармацевтически приемлемой уходящей группы, которая при применении пролекарства способна in vivo обеспечить соединение, где R означает монофосфат. Такие "пронуклеотиды" могут улучшить свойства, например активность, биодоступность или устойчивость родственного нуклеотида.
Примеры замещающих групп, которые могут заместить один или несколько атомов водорода в фосфатном участке, описаны C.R. Wagner и др. в Medicinal Research Reviews, 2000, 20 (6), 417, или R. Jones и N. Bischofberger в Antiviral Research 1995, 27, 1. Подобные пронуклеотиды включают алкильные и арильные фосфодиэфиры, стероидные фосфодиэфиры, алкильные и арильные фосфотриэфиры, циклические алкильные фосфотриэфиры, циклосалигениловые (CycloSal) фосфотриэфиры, S-ацил-2-тиоэтилпроизводные (SATE), дитиоэтильные производные (DTE), пивалоил-оксиметильные фосфоэфиры, параацилоксибензильные (РАОВ) фосфоэфиры, глицеролипидные фосфодиэфиры, гликозиллипидные фосфотриэфиры, динуклеозидилфосфодиэфиры, динуклеозидные фосфотриэфиры, фосфодиамидаты, циклические фосфоамидаты, сложные моноэфиры фосфоамидатов и сложные диэфиры фосфоамидатов.
Изобретение также включает пролекарства или биопредшественники родственного нуклеозида, которые превращаются in vivo в соединения формулы I, где R означает водород и, как минимум, один из R2, R3 и R4 означает гидроксил. Предпочтительные пролекарственные производные включают сложные эфиры карбоновых кислот, в которых некарбонильный участок сложноэфирной группы выбирается из алкила с прямой или разветвленной цепью (например, метил, н-пропил, н-бутил или трет-бутил), алкоксиалкила (например, метоксиметил), аралкила (например, бензил), арилоксиалкила (например, феноксиметил), арила (например, фенил, необязательно замещенный галогеном, (С1-С4)алкилом или (С1-С4)алкоксилом, или аминогруппой); сложные эфиры сульфокислот, как, например, алкилсульфокислот или арилсульфокислот (например, метансульфокислоты); сложные эфиры аминокислот (например, L-валина или L-изолейцина) или их фармацевтически приемлемые соли. Получение осуществляют согласно известным в данной области способам, например способами из учебников по органической химии (например, J. March (1992), "Advanced Organic Chemistry: Reactions, Mechanisms and Structure", 4-oe издание, John Wiley & Sons).
Термин "алкил", как он используется в контексте, означает углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 12 атомов углерода. Предпочтительно термин "алкил" означает углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 7 атомов углерода. Наиболее предпочтительно это метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил или пентил. Алкил может быть незамещенным или замещенным. Заместители выбираются из одного или нескольких таких заместителей, как циклоалкил, нитро-, амино-, алкиламино-, диалкиламиногруппа, алкилкарбонил или циклоалкилкарбонил.
Термин "циклоалкил", как он используется в контексте, означает необязательно замещенную циклоалкильную группу, содержащую от 3 до 7 атомов углерода, например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Термин "алкоксигруппа", как он используется в контексте, означает необязательно замещенную алкилоксигруппу с прямой или разветвленной цепью, в которой алкильный остаток является таким, как определено выше, например метокси-, этокси-, н-пропилокси-, изопропилокси-, н-бутилокси-, изобутилокси-, трет-бутилокси-, пентилокси-, гексилокси-, гептилоксигруппу, включая их изомеры.
Термин "алкоксиалкил", как он используется в контексте, означает алкоксигруппу, как определено выше, которая связана с алкильной группой, как определено выше. Примерами являются метоксиметил, метоксиэтил, метоксипропил, этоксиметил, этоксиэтил, этоксипропил, пропилоксипропил, метоксибутил, этоксибутил, пропилоксибутил, бутилоксибутил, трет-бутилоксибутил, метоксипентил, этоксипентил, пропилоксипентил, включая их изомеры.
Термин "алкенил", как он используется в контексте, означает незамещенный или замещенный углеводородный радикал, содержащий в цепи от 2 до 7 атомов углерода, предпочтительно от 2 до 4 атомов углерода, имеющий одну или две олефиновые двойные связи, предпочтительно одну олефиновую двойную связь. Примерами являются винил, 1-пропенил, 2-пропенил (аллил) или 2-бутенил (кротил).
Термин "алкинил", как он используется в контексте, означает незамещенный или замещенный углеводородный радикал, содержащий в цепи от 2 до 7 атомов углерода, предпочтительно от 2 до 4 атомов углерода, с одной или, где возможно, двумя тройными связями, предпочтительно с одной тройной связью. Примерами служат этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил или 3-бутинил.
Термин "гидроксиалкил", как он используется в контексте, означает алкильную группу с прямой или разветвленной цепью, как определено выше, где 1, 2, 3 или более атомов водорода замещены гидроксильной группой. Примерами являются гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 1-гидроксипропил, 2-гидроксипропил, 3-гидроксипропил, гидроксиизопропил, гидроксибутил и им подобные.
Термин "галоидалкил", как он используется в контексте, означает алкильную группу с прямой или разветвленной цепью, как определено выше, где 1, 2, 3 или более атомов водорода замещены галогеном. Примерами являются 1-фторметил, 1-хлорметил, 1-бромметил, 1-иодметил, трифторметил, трихлорметил, трибромметил, трииодметил, 1-фторэтил, 1-хлорэтил, 1-бромэтил, 1-иодэтил, 2-фторэтил, 2-хлорэтил, 2-бромэтил, 2-иодэтил, 2,2-дихлорэтил, 3-бромпропил или 2,2,2-трифторэтил и им подобные.
Термин "алкилтиогруппа", как он используется в контексте, означает (алкил) S-группу с прямой или разветвленной цепью, где "алкил" является таким, как определено выше. Примерами являются метилтио-, этилтио-, н-пропилтио-, изопропилтио-, н-бутилтио-, изобутилтио- или трет-бутилтиогруппа.
Термин "арил", как он используется в контексте, означает необязательно замещенный фенил и нафтил (например, 1-нафтил, 2-нафтил или 3-нафтил). Подходящие заместители для арила могут быть выбраны из перечисленных для алкила, кроме этого, однако, галоген, гидроксил и необязательно замещенные алкил, галоидалкил, алкенил, алкинил и арилоксигруппа являются заместителями, которые могут быть добавлены к выбранным выше.
Термин "гетероциклил", как он используется в контексте, означает необязательно замещенные насыщенные, частично ненасыщенные или ароматические моноциклические, бициклические или трициклические гетероциклические системы, которые содержат один или несколько гетероатомов, выбранных из азота, кислорода и серы, которые также могут быть сконденсированы с необязательно замещенным насыщенным, частично ненасыщенным или ароматическим моноциклическим углеродным кольцом или гетероциклом.
Примерами подходящих гетероциклильных остатков являются оксазолил, изоксазолил, фурил, тетрагидрофурил, 1,3-диоксоланил, дигидропиранил, 2-тиенил, 3-тиенил, пиразинил, изотиазолил, дигидрооксазолил, пиримидинил, тетразолил, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, пирролидинонил, (N-оксид)-пиридинил, 1-пирролил, 2-пирролил, триазолил, например 1,2,3-триазолил или 1,2,4-триазолил, 1-пиразолил, 2-пиразолил, 4-пиразолил, пиперидинил, морфолинил (например, 4-морфолинил), тиоморфолинил (например, 4-тиоморфолинил), тиазолил, пиридинил, дигидротиазолил, имидазолидинил, пиразолинил, пиперазинил, 1-имидазолил, 2-имидазолил, 4-имидазолил, тиадиазолил, например 1,2,3-тиадиазолил, 4-метилпиперазинил, 4-гидроксипиперидин-1-ил.
Подходящие заместители для гетероциклила могут быть выбраны из таковых, упомянутых для алкила, кроме этого, однако, необязательно замещенный алкил, алкенил, алкинил, оксогруппа (=O) или аминосульфонил являются заместителями, которые могут быть добавлены к выбранным выше.
Термин "ацил" ("алкилкарбонил"), как он используется в контексте, означает группу формулы C(=O)R, где R означает водород, незамещенный или замещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 7 атомов углерода, или фенильную группу. Наиболее предпочтительно ацильные группы являются такими, где R означает водород, незамещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 4 углеродных атомов, или фенильную группу.
Термин галоген подразумевает фтор, хлор, бром или иод, предпочтительно фтор, хлор, бром.
В рамках изобретения термин "X" представляет О, S или СН2, предпочтительно О или СН2. Наиболее предпочтительно "X" означает О.
В рамках изобретения термин "Z" означает О или S, предпочтительно О.
При графическом изображении соединений, приведенных в этой заявке, утолщенная заостренная линия ( ) указывает заместитель, расположенный над плоскостью кольца, которому принадлежит асимметрический атом углерода, а пунктирная линия (
) указывает заместитель, расположенный над плоскостью кольца, которому принадлежит асимметрический атом углерода, а пунктирная линия ( ) указывает заместитель, который расположен под плоскостью кольца, которому принадлежит асимметрический атом углерода.
) указывает заместитель, который расположен под плоскостью кольца, которому принадлежит асимметрический атом углерода.
Соединения формулы I обнаруживают стереоизомерию. Эти соединения могут быть любым изомером соединения формулы I или смесью таких изомеров. Соединения и промежуточные соединения по настоящему изобретению, имеющие один или несколько асимметрических атомов углерода, могут быть получены в виде рацемических смесей стереоизомеров, которые могут быть разделены.
Соединения формулы I проявляют таутомерию, что означает, что соединения по данному изобретению могут существовать в виде двух или нескольких химических соединений, способных к легкому взаимному превращению. Во многих случаях это означает только обмен атомом водорода между двумя другими атомами, с любым из которых он образует ковалентную связь. Таутомерные соединения существуют в подвижном равновесии друг с другом, так что попытки получить отдельные соединения обычно приводят в результате к образованию смеси, которая характеризуется всеми химическими и физическими свойствами, ожидаемыми на основании структур компонентов.
Наиболее обычным видом таутомерии является таутомерия, включающая карбонильные или содержащие кетогруппу соединения и ненасыщенные гидроксилсодержащие соединения, или енолы. Структурное изменение означает смещение атома водорода между атомами углерода и кислорода с перегруппировкой связей. Например, во многих алифатических альдегидах и кетонах, как, например, ацетальдегид, кето-форма является преобладающей; в фенолах енольная форма является главным компонентом.
Соединения формулы I, являющиеся основными, могут образовывать фармацевтически приемлемые соли с неорганическими кислотами, как, например, галоидводородные кислоты (например, соляная кислота и бромисто-водородная кислота), серная кислота, азотная кислота и фосфорная кислота, и им подобные кислоты, и с органическими кислотами (например, с уксусной кислотой, винной кислотой, янтарной кислотой, фумаровой кислотой, малеиновой кислотой, яблочной кислотой, салициловой кислотой, лимонной кислотой, метансульфокислотой и п-толуолсульфокислотой и им подобными). Образование и выделение таких солей может быть осуществлено согласно способам, известным в данной области.
Предпочтительно применение соединений формулы I,
где R означает водород;
R1 означает алкил, алкенил, алкинил, галоидалкил, алкилкарбонил, алкоксигруппу, гидроксиметил, цианогруппу, азидогруппу, алкоксииминометил, алкилкарбониламиногруппу, алкиламинометил или диалкиламинометил;
R2 означает водород, гидроксил, алкоксигруппу или галоген;
R3 и R4 означают водород, гидроксил, алкоксигруппу, галоген или гидроксиалкил, при условии, что как минимум один из R3 и R4 означает водород; или
R3 и R4 представляют фтор;
Х означает О или СН2; и
В означает 9-пуринильный остаток В1 или 1-пиримидильный остаток В2, как определено выше.
Примеры предпочтительных соединений перечислены ниже:
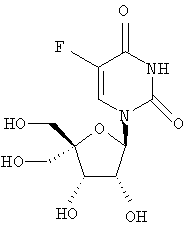
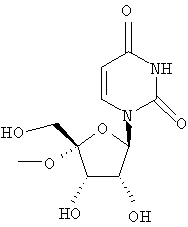
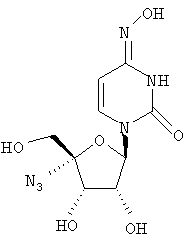
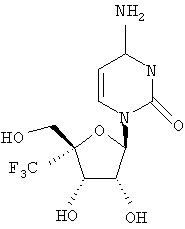
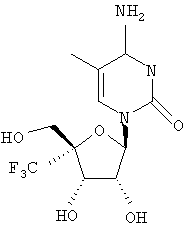
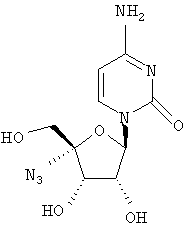
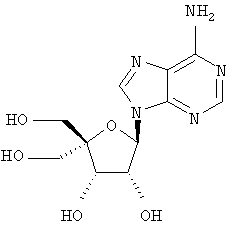
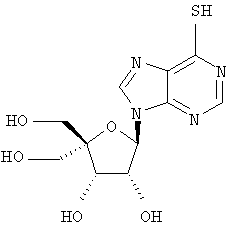
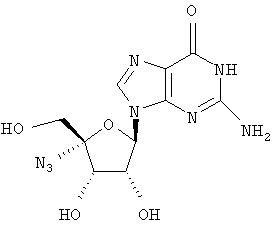
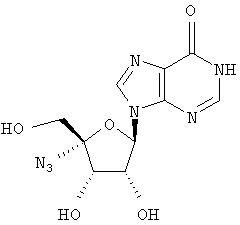
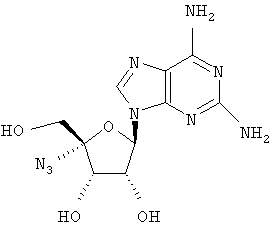
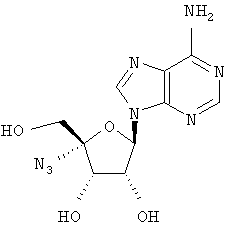
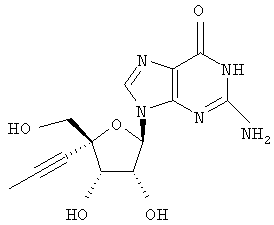
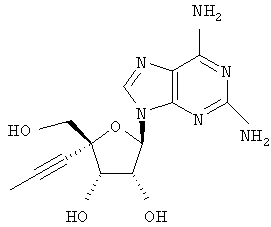
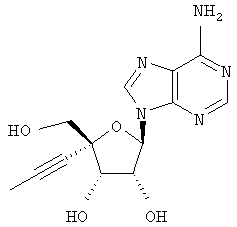
Особенно предпочтительной группой соединений для лечения HCV являются соединения формулы I-а,
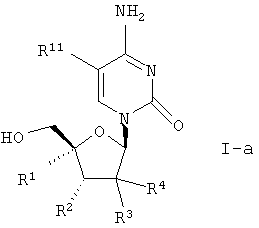
где
R1 означает алкил, алкенил, алкинил, галоидалкил, алкилкарбонил, алкоксигруппу, гидроксиметил, цианогруппу, азидогруппу, алкоксииминометил, алкилкарбрниламиногруппу, алкиламинометил
или диалкиламинометил;
R2 означает водород, гидроксил, алкоксигруппу или галоген;
R3 и R4 означают водород, гидроксил, алкоксигруппу, галоген или
гидроксиалкил, при условии, что как минимум один из R3 и R4 означает водород; или
R3 и R4 представляют фтор;
и фармацевтически приемлемые соли.
Примеры таких особенно предпочтительных соединений перечислены ниже:
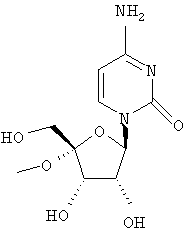
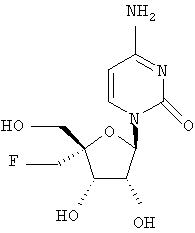
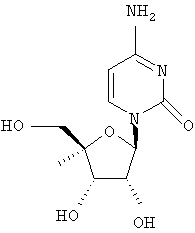
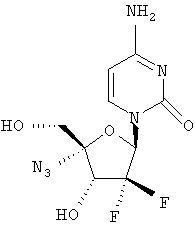
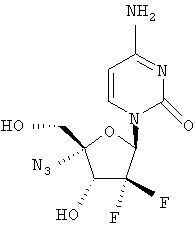
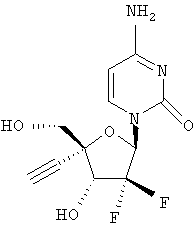
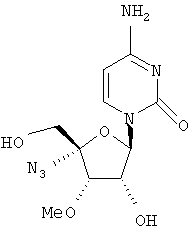
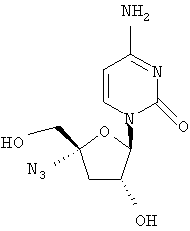
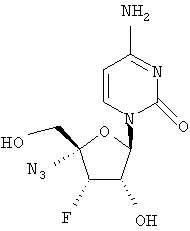
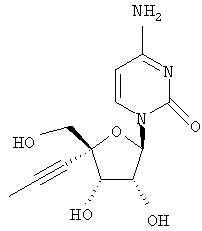
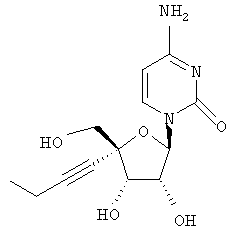
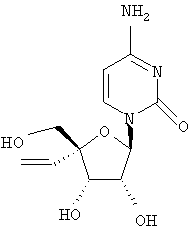
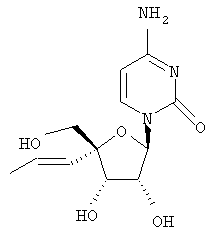
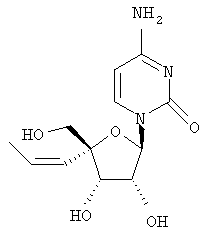
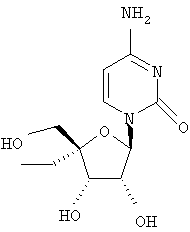
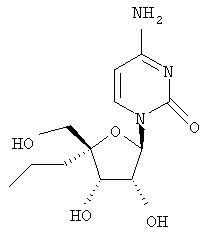
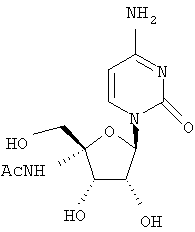
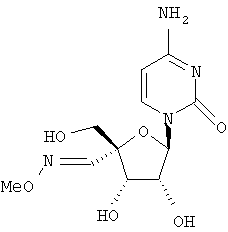

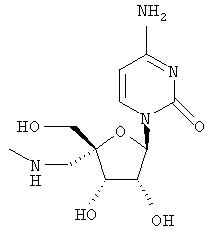
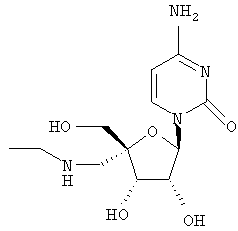
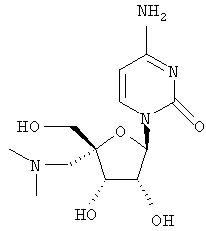
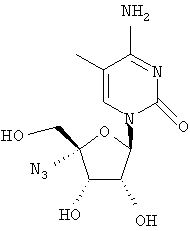

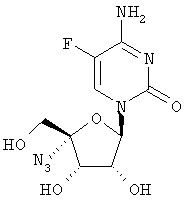
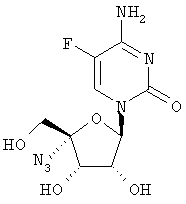
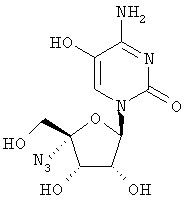
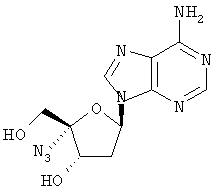
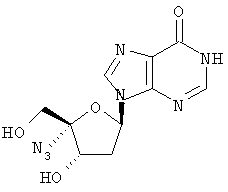
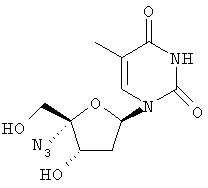
Наиболее предпочтительные соединения для лечения HCV приведены ниже:
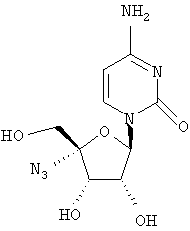
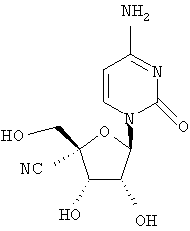
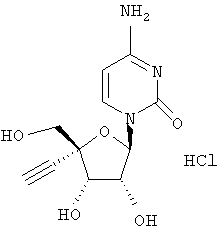
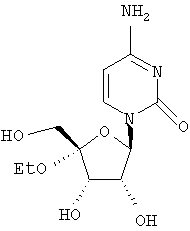
Соединения формулы I могут быть получены различными способами, известными обычно в области органической химии, и, в частности, для синтеза аналогов нуклеозидов. Исходные вещества для синтеза или легко коммерчески доступны, или известны, или их легко получить, следуя известным в данной области методикам. Общие обзоры, касающиеся получения аналогов нуклеозидов, включены в следующие публикации:
A.M. Michelson "The Chemistry of Nucleosides and Nucleotides", изд. Academic Press, Нью-Йорк, 1963.
L. Goodman "Basic Principles in Nucleic Acid Chemistry", изд. POP Ts'O, Academic Press, Нью-Йорк, 1974, том 1, глава 2.
"Synthetic Procedures in Nucleic acid Chemistry" ред. W.W. Zorbach и R.S. Tipson, изд. Wiley, Нью-Йорк, 1973, тома 1 и 2.
Синтез карбоциклических нуклеозидов рассмотрен в обзоре L. Agrofoglio и др., Tetrahedron, 1994, 50, 10611.
Подходы, полезные для синтеза соединенней формулы I, включают:
1) модификацию или взаимопревращение полученных нуклеозидов, или
2) построение гетероциклического основания после гликозилирования, или
3) конденсацию защищенного производного фуранозы, тиофуранозы или циклопентана с пиримидиновым (В2) или пуриновым (В1) основанием.
Эти способы будут обсуждены ниже:
1. Модификация или взаимопревращение предварительно полученных нуклеозидов.
Такие способы включают, с одной стороны, модификацию 9-пуринильного или 1-пиримидильного остатка или, с другой стороны, модификацию углеводной составляющей.
А. Модификация пуринильной или пиримидильной составляющей:
а) Дезаминирование аминопуриновых или аминопиримидиновых нуклеозидов, как описано J.R. Tittensor и R.T. Walker в European Polymer J., 1968, 4, 39, и Н. Hayatsu в "Progress in Nucleic Acid Research and Molecular Biology", 1976, том 16, стр. 75.
б) Превращение 4-гидроксильной группы в 4-гидроксипиримидиновых нуклеозидах в уходящую группу и замещение нуклеофильными реагентами. Такие уходящие группы включают галоген, как описано J. Brokes и J. Beranek, Col. Czech. Chem. Comm., 1974, 39, 3100, или 1,2,4-триазол, как описано К. J. Divakar и С. В. Reece, J. Chem. Soc. Perkin Trans. I, 1982, 1171.
в) Замещение по положению 5 пиримидиновых нуклеозидов достигалось при использовании замещенных металлами по положению 5 производных, например, замещенных двухвалентной ртутью или палладием, как описано D. Е. Bergstrom и J. L. Ruth, J. Amer. Chem. Soc., 1976, 98, 1587. Введение фтора в положение 5 пиримидиновых нуклеозидов может быть осуществлено с помощью реагентов, как, например, трифторметилгипофлюорит, как описано М. J. Robins, Ann New York Acad. Sci., 1975, 255, 104.
г) Модифицированные пуриновые нуклеозиды могут быть получены из соответствующих производных пуриновых нуклеозидов, где заместитель в положении 2, 6 или 8 является подходящей уходящей группой, как, например, галоген или сульфонат, или 1,3,4-триазол. 6-Замещенные пуриновые нуклеозиды могут быть получены при обработке соответствующих 6-галоидпуриновых или 6-(1,2,4-триазол-4-ил)пуриновых производных нуклеозидов соответствующим нуклеофильным реагентом, как описано V. Nair и А. J. Fassbender, Tetrahedron, 1993, 49, 2169, и V. Samano, R. W. Miles и M. J. Robins, J. Am. Chem. Soc., 1994, 116, 9331. Подобным же образом 8-замещенные пуриновые нуклеозиды могут быть получены при обработке соответствующего 8-галоидпуринового нуклеозида подходящим нуклеофильным реагентом, как описано L. Tai-Shun, С. Jia-Chong, I. Kimiko и А. С. SartoreUi, J. Med. Chem., 1985, 28, 1481; Nandanan и др., J. Med. Chem:, 1999, 42, 1625; J. Jansons, Y. Maurinsh и M. Lidaks, Nucleosides Nucleotides, 1995, 14, 1709. Введение цианогруппы в положение 8 может быть осуществлено путем замещения с помощью цианида металла, как описано L-L. Gundersen, Acta. Chem. Scand. 1996, 50, 58. Модифицированный по положению 2 пуриновый нуклеозид может быть получен способом, аналогичным описанному Т. Steinbrecher, С. Wamelung, F. Oesch и A. Seidi, Angew. Chem. Int. Ed. EngL, 1993,32, 404.
д) Когда заместитель в положении 2 или 8 пуринового нуклеозида связан углерод-углеродной связью, например алкил, тогда могут быть применены методики, использующие катализируемое металлом поперечное связывания, исходя из соответствующего 2- или 8-галоидзамещенного производного пуринового нуклеозида, как описано A. A. Van Aerschott, и др., J. Med. Chem., 1993, 36, 2938; V. Nair и G.. S. Buenger, J. Am. Chem. Soc., 1989, 111(22), 8502; С. Tu, С; Keane и В.Е. Eaton, Nucleosides Nucleotides, 1995, 14, 1631.
Б. Модификация углеводной составляющей:
Нижеследующее введение защитных групп, совместимых с дальнейшими химическими реакциями:
- Азид может быть введен в положение 4' путем обработки 4',5'-дидегидронуклеозида азидом иода, как подтверждают примером H. Maag и др., J. Med. Chem., 1992, 35, 1440. Алкоксид может быть введен в положение 4' при обработке 4',5'-дидегидронуклеозида иодом, затем спиртом и карбонатом свинца(2), как показано J. P. Verheyden и J.G. Moffatt, J. Am. Chem. Soc., 1975, 97(15), 4386. Фтор может быть введен в положение 4' при обработке 4',5'-дидегидронуклеозида иодом, затем фторидом серебра(1), как описано G. R. Owen и др., J. Org. Chem., 1976, 41(8), 3010, или A. Maguire и. др., J. Chem. Soc. Perkin Trans. I, 1993, 1(15), 1795. 4'-Формильная группа может быть введена и затем превращена в широкий ряд заместителей, включая, но не ограничивая этим, 4'-галоидалкил, 4'-этинил, 4'-оксииминометил и 4'-циан, как подтверждается М. Nomura и др., J. Med. Chem., 1999, 42, 2901.
- Возможна модификация либо 2'-гидрокси-, либо 3'-гидроксизаместителя в аналоге нуклеозида.
- Превращение гидроксильной группы в положении 3 в уходящую группу, например галоид, при реакции, например, с трифенилфосфином и тетрагалоидалканом, как описано, например, L. De Napoli и др., Nucleosides Nucleotides, 1993, 12, 981, с последующим восстановлением, что приводит к производным 3-дезоксисахаров, как описано D. G. Norman и С. В. Reese, Synthesis 1983, 304.
- Превращение гидроксильной группы в положении 3 в трифторметансульфонильную группу с последующим восстановлением при использовании боргидрида натрия, как описано S. A. Surzhykov и др., Nucleosides Nucleotides, 1994, 13(10), 2283. Прямое введение фторного заместителя может быть проведено с помощью фторирующих средств, как, например, трифторид диэтиламиносеры, как описано Р. Herdewijn, A. Van Aerschot и L. Kerremans, Nucleosides Nucleotides, 1989, 8, 65.
- Превращение гидроксильного заместителя в уходящую группу, например, галоид или сульфонат, также возможно при замещении с использованием нуклеофильных реагентов, как, например, фтористый тетрабутиламмоний, азид лития или цианиды металлов, как поясняют примерами Н. Hrebabecky, A. Holy и Е. de Clercq, Collect. Czech. Chem. Comm., 1990, 55, 1800; К.Е. В. Parkes и К. Taylor, Tet. Lett., 1988, 29, 2995; H. M. Pfundheller и др., Helv. Chim. Acta, 2000, 83, 128.
- Реакция 2'-кетонуклеозидов с фторирующими средствами, например трифторид диэтиламиносеры, может быть применен для получения 2',2'-дифторнуклеозидов, как описано D. Bergstrom, E. Romo и Р. Shum, Nucleosides Nucleotides, 1987, 6, 53.
2. Построение гетероциклического основания после гликозилирования:
а) способы, в которых, например, используют производные фуранозиламина, как описано N. J. Cusack, В. J. Hildick, D. H. Robinson, P. W. Rugg и G. Shaw, J. Chem. Soc. Perkin Trans., I 1973, 1720, или G. Shaw, R. N. Warrener, M. H. Maguire и R. К. Ralph, J. Chem. Soc., 1958, 2294.
б) способы, в которых используют, например, фуранозилмочевины для синтеза пиримидиновых нуклеозидов, как описано J. Smejkal, J. Farkas и F. Sorm, Coil. Czech. Chem. Comm., 1966, 31, 291.
в) получение пуриновых нуклеозидов из имидазольных нуклеозидов рассматривается в обзоре L. В. Townsend, Chem. Rev., 1967, 67, 533.
г) получение соединений формулы I, где Х означает СН2, может быть осуществлено из производных 1-гидроксиметил-4-аминоциклопентана, как описано Y. F. Shealy и J. D. Clayton, J. Am. Chem. Soc., 1969, 91, 3075; R. Vince и S. Daluge, J. Org. Chem., 1980, 45, 531; R. С. Cermak и R. Vmce, Tet. Lett., 1981, 2331; R. D. Elliott и др., J. Med. Chem., 1994, 37, 739.
3. Конденсация защищенного производного фуранозы, тиофуранозы или циклопентана с производным пурина или пиримидина.
Реакция конденсации защищенного производного фуранозы, тиофуранозы или циклопентана с соответствующим производным пурина или пиримидина может быть проведена с использованием стандартных способов, включая применения в качестве катализатора кислоты Льюиса, как, например, двубромистая ртуть или четыреххлористое олово, или триметилсилилтрифторметансульфонат, в растворителях, например в ацетонитриле, 1,2-дихлорэтане, дихлорметане, хлороформе или толуоле, при пониженной температуре, при температуре окружающей среды или при повышенной температуре. Примеры реакции конденсации защищенной фуранозы или тиофуранозы
- с производными тяжелых металлов производных пурина или пиримидина (например, с производными хлорртути) описываются J. Davoll и В. A. Lowry, J. Am. Chem. Soc., 1951, 73, 1650; J. J. Fox, N. Yung, J. Davoll и G. В. Brown, J. Am. Chem. Soc., 1956, 78, 2117.
- с алкоксипиримидинами описываются К. A. Watanabe, D. H. Hollenberg и J. J. Fox., Carbohydrates. Nucleosides and Nucleotides. 1974, 1, 1.
- с силильными производными пуринов или пиримидинов, как описано U. Niedballa и H. Vorbruggen, J. Org. Chem., 1976, 41, 2084; U. Niedballa и Н. Vorbruggen, J. Org. Chem., 1974, 39, 3672. A. J. Hubbard, A. S. Jones и R. Т. Walker, Nucleic Acids Res., 1984, 12, 6827.
Кроме того,
- конденсация перацилированных Сахаров с пуринами под вакуумом в присутствии п-толуолсульфокислоты была описана Т. Simadate, Y. Ishudo и Т. Sato, Chem. Abs., 1962, 56, 11692, и W. Pfleiderer, R. К. Robins, Chem. Ber. 1965, 98, 1511.
- реакции конденсации были описаны К. A. Watanabe, D. H. Hollenberg и J. J. Fox, Carbohydrates Nucleosides and Nucleotides, 1974, 1, 1.
Примеры реакции конденсации защищенного производного циклопентана с соответствующим производным пурина или пиримидина приведены H. Kapeller, H. Baumgartner и H. Griengi, Monattsh Chem., 1997, 128, 191, и Р. Wang и др., Tet. Lett., -1997, 38, 4207, или Т. Jenny и др., Helv. Chim. Acta, 1992, 25, 1944.
Такие способы часто приводят в результате к смесям аномерных производных нуклеозидов, которые могут быть разделены с помощью стандартных методик, известных в данной области, как, например, перекристаллизация, колоночная хроматография, высокоэффективная жидкостная хроматография или сверхкритическая флюидная хроматография.
Производные пуринов и пиримидинов для описанных выше реакций конденсации могут быть приобретены или могут быть получены с применением известных в данной области методик.
Получение производных пурина рассматривается G. Shaw в сборнике "Comprehensive Heterocyclic Chemistry", изд-во Pergamon Press, том 5, глава 4.09, стр. 499, и "Comprehensive Heterocyclic Chemistry II", изд-во Pergamon Press, том 7, глава 7. 11, стр. 397.
Получение производных пиримидина рассматривает D. J. Brown в книге "The Chemistry of Heterocyclic Compounds -The Pyrimidines", 1962, и в Приложении 1, 1970, изд-во John Wiley and Sons, Нью-Йорк, D. J. Brown в "Comprehensive Heterocyclic Chemistry", изд-во Pergamon Press, том 5, глава 4. 09, стр. 499, и К. Unheim и Т. Benneche в "Comprehensive Heterocyclic Chemistry II", изд-во Pergamon Press, том 6 глава 6. 02, стр. 93.
Производные фуранозы могут быть получены из коммерчески доступного углеводного сырья, как, например, D-формы рибозы, арабинозы, ксилозы или ликсозы, с последующим введением защитных групп, которые химически совместимы.
4-Замещенные фуранозы с заместителем, содержащим углеродный атом, присоединенный в положении 4 фуранозы, например алкилом, алкенилом, алкинилом, галоидалкилом, ацилом, алкоксикарбонилом, гидроксиалкилом, алкоксиалкилом, цианогруппой, оксииминометилом, алкоксииминометилом, алкиламинокарбонилом и ацилом, могут быть получены из соответствующей 4-формилфуранозы. Получение одной из таких 4-формилфураноз описывается H. Ohrui и др., J. Med. Chem., 2000, 43, 5416. 4-Галоидалкилфуранозы могут быть получены из соответствующих 4-гидроксиметилфураноз (например, К. Kitano и др., Tetrahedron, 1997, 53(39), 13315). 4-Метилфуранозы могут быть получены способом, описанным Т. Waga и др., Biosci. Biotech. Biochem., 1993, 19(7), 408.
Производные 2,2-дифторфуранозы могут быть получено из D-глюкозы или D-маннозы, как описано R. Fernandez, M. I. Mateu, R. Echarri и S. Castillon, Tetrahedron, 1998, 54, 3523. Производные тиофуранозы могут быть получены при использовании известных из литературы методик, как, например, описанных L.Bellon, J. L. Barascut, J. L. Imbach, Nucleosides and Nucleotides, 1992, 11, 1467, и модифицированных таким же образом, как и в случае аналогов фуранозы, описанных выше.
Производные циклопентана могут быть получены известными в данной области органической химии способами и способами, на которые ссылаются и которые включены в статью L. Agrofolio и др. Tetrahedron, 1994, 50, 10611.
Предварительно приготовленные производные нуклеозидов либо коммерчески доступны, либо их синтезируют согласно описанным выше способам.
Способы, обсуждаемые выше, более подробно описываются далее:
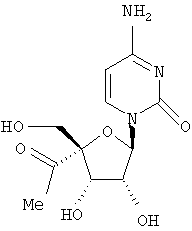
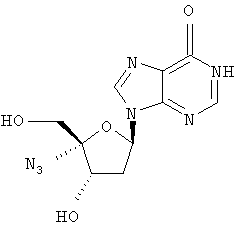
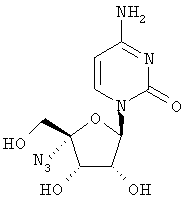
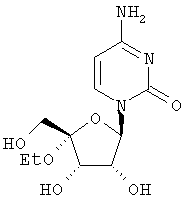
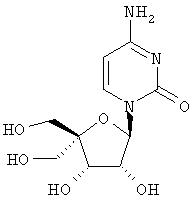
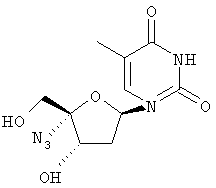
Соединения формулы I, где R1 означает N3, R2 и R3 являются гидроксильными группами и В означает В2, могут быть получены согласно реакционной схеме А:
Схема А
где Ас означает ацетил, Bz означает бензоил и R11 является таким, как описано выше.
Соединения формулы II могут быть иодированы при использовании смеси трифенилфосфина, иода и пиридина, как показано Н. Maag и др., J. Med. Chem., 1992, 35, 1440. Ацетонидная защитная группа может быть удалена при обработке кислотой, например уксусной кислотой, как описано J. Р. Verheyden и др., J. Org. Chem., 1970, 35(7), 2319, получают нуклеозиды формулы III. Последующая защита гидроксилов в положениях 2' и 3' с помощью уксусного ангидрида и удаление йодистого водорода с применением пиридина, например с помощью фторида серебра в пиридине, и удаление ацетильных защитных групп с помощью раствора аммиака в метаноле, как описано J. P. Verheyden и др., J. Org. Chem., 1974, 39(24), 3573, приводит к 4',5'-дидегидро-нуклеозидам формулы V.
Присоединение азида иода к двойной связи может быть осуществлено при обработке V смесью хлористого иода и азида натрия в N,N-диметилформамиде, как описано Н. Maag и др., J. Med. Chem., 1992, 35, 1440, получают нуклеозиды формулы VI. Защита гидроксильных групп в VI может быть проведена при обработке VI хлористым бензоилом в пиридине, получают нуклеозиды формулы VII, которые затем могут быть превращены в 5'-бензоилнуклеозиды формулы VIII при обработке мета-хлорнадбензойной кислотой в дихлорметане, в полученном соединении может быть затем удалена защита с помощью основания, например метилата натрия, в метиловом спирте для получения нуклеозидов формулы IX, как все это описано Н. Maag и др., J. Med. Chem., 1992, 35, 1440. В том случае, когда В2 в соединении формулы VIII является урацилом или 5'-замещенным урацилом, после защиты 3'-гидроксильной группы уксусным ангидридом и пиридином превращение в соответствующий цитидин формулы XII может быть осуществлено способом, описанным A. D. Borthwick и др., J. Med. Chem., 1990, 33(1), 179, в соответствии с которым нуклеозиды формулы Х могут быть обработаны 4-хлорфенилдихлорфосфатом и триазолом для получения 4-триазолилнуклеозидов формулы XI, последующая обработка нуклеозидов XI водным аммиаком приводит к 5-замещенным цитидинам формулы XII.
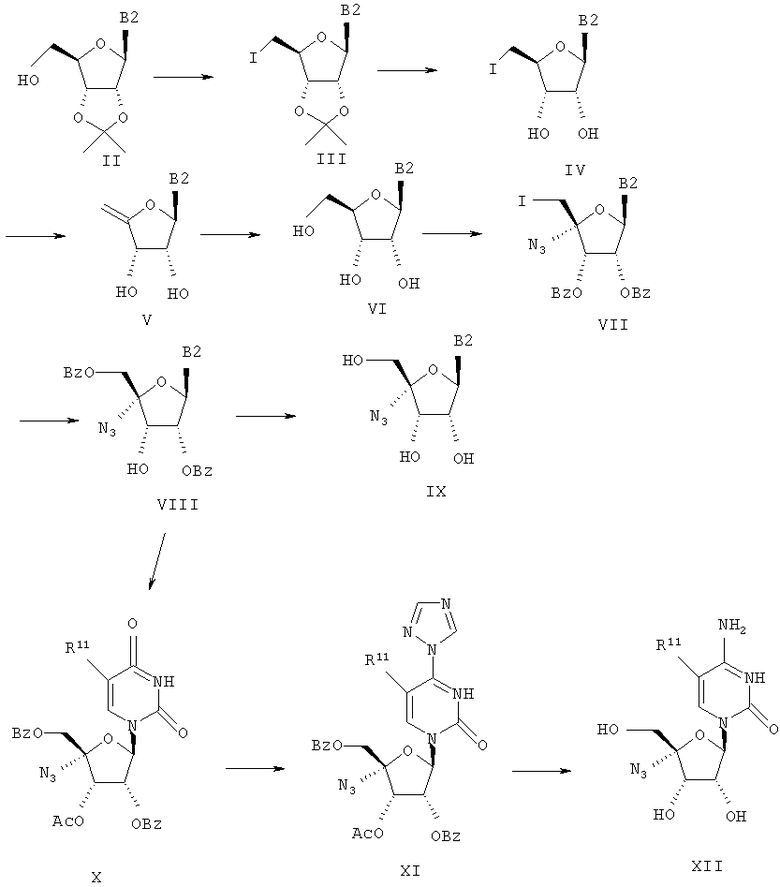
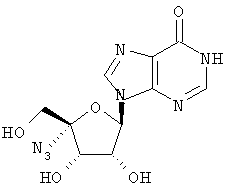
Соединения формулы I, где R является -C≡CH, -CH=CHCl, -CH=N-OH, -CN, R2 и R3 означают гидроксил и В является В1 или В2, могут быть получены согласно реакционной схеме Б.
Схема Б
Соединения формулы XIII могут быть просилилированы с помощью трет-бутилдиметилсилилхлорида (TBSCl) и имидазола, получают три-трет-бутилдиметил-силильные производные формулы XIV. Простой 5'-трет-бутилдиметилсилиловый эфир подвергают снятию защиты, применяя 80% уксусную кислоту, получают 5-гидрокси-нуклеозиды XV, которые затем могут быть окислены в 5'-формилнуклеозиды XVI, применяя смесь гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDAC) и диметилсульфоксида (DMSO) в подходящем растворителе, например в бензоле. Алкилирование XVI с помощью формальдегида и гидроокиси натрия приводит к 4'-гидроксиметильным соединениям формулы XVII, которые могут быть восстановлены в 4'-дигидроксиметильные соединения формулы XVIII.
Селективная защита гидроксиметильной группы с α-стороны нуклеозида тритилхлоридом в пиридине приводит к 4'-тритильным производным формулы XIX, последующая защита гидроксиметильной группы с β-стороны нуклеозида с применением трет-бутил-диметилсилилхлорида (TBSC1) и имидазола приводит к соединениям формулы XX. Удаление тритильной защиты с помощью бромкатехинборана приводит к 4'-гидроксиметильному производному XXI, которое может быть окислено с помощью ангидрида трифторметансульфокислоты и диметилсульфоксида в 4'-формилпроизводное формулы XXII.
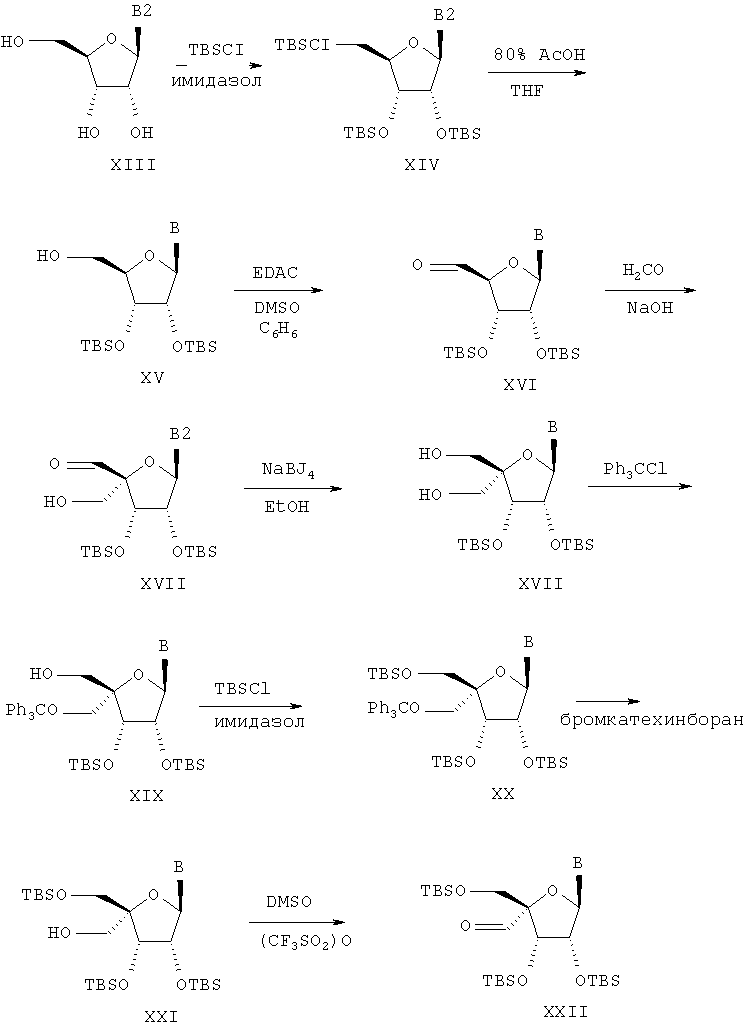
Альдегид формулы XXII может быть применен в качестве исходного сырья для получения широкого диапазона 4'-замещенных нуклеозидов, как показано на схеме В:
Схема В
Обработка альдегида XXII гидрохлоридом гидроксиламина и пиридином приводит к 4'-гидроксиимину формулы XXIII. Отщепление воды от соединения XXIII приводит к 4'-цианпроизводным формулы XXIV. Обработка 4'-формилпроизводных формулы XXII хлоридом хлорметилфосфония и бутиллитием приводит к 4'-(2-хлор-этенил)производным формулы XXVI. Обработка соединений XXVI бутиллитием приводит в результате к отщеплению хлористого водорода и образованию 4'-этенилпроизводных формулы XXVII. Удаление силильных защитных групп от защищенных по трем группам трет-бутилдиметилсилилхлоридом соединений XXIII, XXVII и XXIV может быть осуществлено с помощью фтористого соединения, как, например, фтористый аммоний в метаноле или фтористый тетрабутиламмоний, абсорбированный на двуокиси кремния в тетрагидрофуране, получают соответствующие 4'-замещенные нуклеозиды XXV, XXVIII и XXIX.
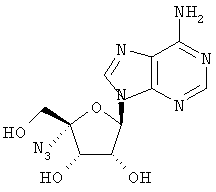
Подходящим образом защищенные 4'-замещенные уридины (например, XXIV и XXVII) могут быть превращены в соответствующие 4'-замещенные цитидины согласно реакционной схеме Г.
Схема Г
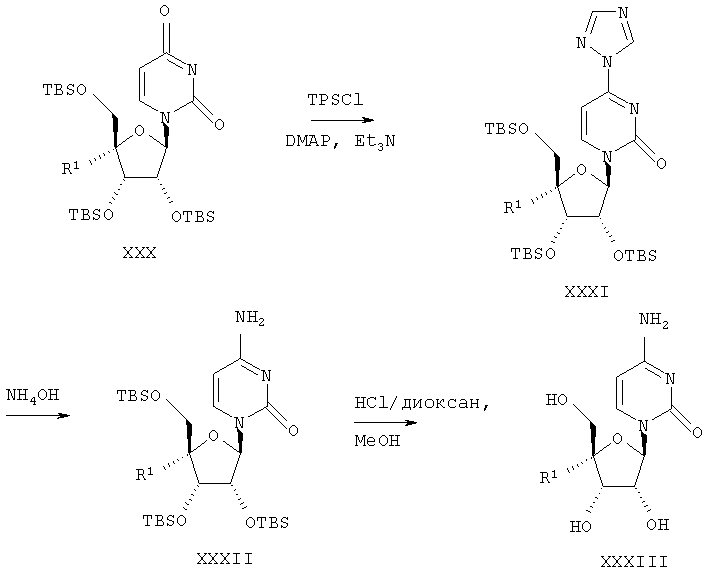
Защищенные тремя трет-бутилдиметилсилильными (TBS) группами уридины формулы XXX могут быть обработаны триизопропилбензолсульфонилхлоридом, триэтиламином и диметиламинопиридином для получения 4-триазолилнуклеозидов XXXI. 4-Триазолилпроизводные формулы XXXI могут быть превращены в 4-аминопроизводные формулы XXXII с помощью водного аммиака. Удаление защитных силильных групп с использованием смеси метанола и соляной кислоты в диоксане приводит к производным цитидина формулы XXXIII.
Соединения формулы I, где R1 означает алкоксигруппу, R2 и R3 являются гидроксилами и В является 9-пуринильным остатком В1 или 1-пиримидильным остатком В2, могут быть получены согласно методикам, описанным J. Р. Verheyden и др. в патенте США №3910885.
Соединения формулы I, в которых R1 означает трифторметил, метил или этинил, могут быть получено, как показано на реакционной схеме Д:
Схема Д
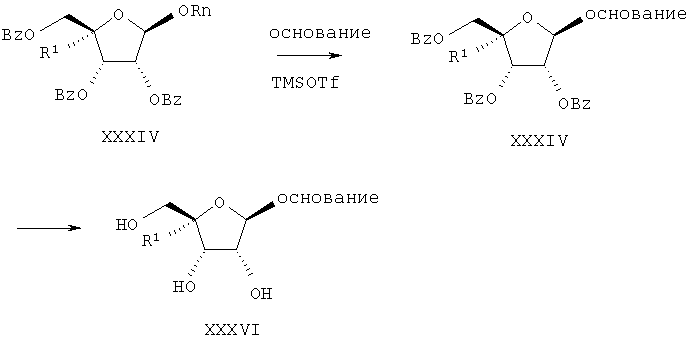
например, путем сочетания соответствующего защищенного 4'-замещенного рибофуранозида XXXIV с силилированным основанием в присутствии кислоты Льюиса, например триметилсилилтрифторметансульфоната (TMSOTf) или тетрахлорида олова, в подходящем растворителе, например ацетонитриле или 1,2-дихлорэтане, в результате получают соединение формулы XXXV. Защитные группы могут быть удалены при обработке XXXV основанием, например метилатом натрия, в подходящем растворителе, например в метаноле, получают соединения формулы XXXVI.
Способы монофосфорилирования органических соединений, включая нуклеозиды, рассмотрены L. A. Slotin, Synthesis, 1977, 737. В последнее время были описаны другие методики фосфорилирования нуклеозидов: М. Uchiyama и др., J. Org. Chem., 1993, 58, 373; R. Caputo и др., Synlett., 1997, 739, и М. Taktakishvili и V. Nair, Tet. Lett. 2000, 41, 7173. Другие методики монофосфорилирования, которые могут быть применены к нуклеозидам, описаны by С. Е. МсКеппа и J. Schmidhauser, J. Chem. Soc., Chem. Commun., 1979, 739, и J. К. Stowell и Т. S. Widlanski, Tet. Lett., 1995, 1825. Синтез ди- и трифосфатов рассмотрен в обзоре К. Н. Scheit, Nucleotide Analogues, 1980, изд-во Wiley Interscience, и К. Burgess и D. Cook, Chemical Reviews, 2000, 100, 2047.
Следующие примеры иллюстрируют способы получения соединений формулы I:
Пример 1
Получение соединения 1 согласно способу, представленному на схемах 1 и 1а
Схема 1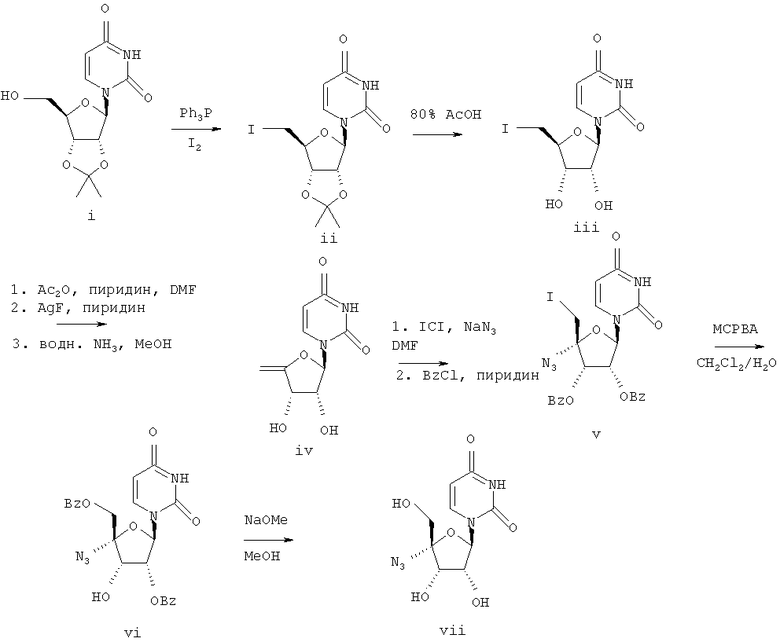
1.1. Соединение (i)
Соединение (i) приобретали в фирме Lancaster (№ по каталогу: 206-647-7, CAS 362-43-6).
1.2. Соединение (ii)
Трифенилфосфин (1,57 г, 6,0 ммолей) и иод (1,52 г, 6,0 ммолей) прибавляли к соединению (i) (1,14 г, 4,0 ммоля) в диоксане (20 мл), содержащем пиридин (0,65 ммоля, 8,0 ммолей). Смесь перемешивали в течение ночи и реакцию останавливали прибавлением метанола (1 мл). Растворитель выпаривали в вакууме. Остаток растворяли в этилацетате (200 мл), промывали водой (100 мл), 10%-ным водным тиосульфатом натрия (100 мл), соляным раствором (100 мл) и сушили над безводным сульфатом магния. Сульфат магния отделяли при фильтрации и фильтрат упаривали в вакууме. Остаток очищали с помощью колоночной флэш-хроматографии на силикагеле, элюируя этилацетатом/бензином 1:1, получали соединение (ii) в виде бесцветного масла, которое медленно затвердевало в бесцветное воскообразное твердое вещество (1,5 г), масс-спектр (химическая ионизация /CI/) m/z 395 [М+Н]+.
1.3. Соединение (iii)
Соединение (iii) получали из соединения (ii), как описано J. P. Verheyden и др., J. Org. Chem., 1970, 35(7), 2319.
1.4. Соединение (iv)
Соединение (iv) получали из соединения (iii), как описано J. P. Verheyden и др., J. Org. Chem., 1974, 39(24), 3573.
1.5. Соединение (v)
Соединение (v) получали из соединения (iv), как описано Н. Maag и др., J. Med. Chem., 1992, 35, 1440-1451.
1.6. Соединение (vi)
К раствору соединения (v) (482 мг, 0,80 ммоля) в дихлорметане, насыщенном водой, (10 мл) прибавляли 55%-ную мета-хлорнадбензойную кислоту (1,0 г, 4,95 ммоля). Смесь перемешивали 2 часа. Прибавляли дополнительно мета-хлорнадбензойную кислоту (0,50 г) и смесь перемешивали еще 3 часа. Прибавляли этилацетат (100 мл), и раствор промывали 10% раствором метабисульфита натрия (50 мл), затем насыщенным раствором бикарбоната натрия (50 мл). Этилацетат сушили над безводным сульфатом магния. Сульфат магния удаляли при фильтрации, и фильтрат упаривали в вакууме. Остаток подвергали флэш-хроматографии, элюируя этилацетатом/бензином 1:1, получали соединение (vi) в виде бесцветного стеклообразного вещества (200 мг); масс-спектр (ионизация электрораспылением /ESI/) m/z 535 [М+Н+СН3CN]+.
1.7. Соединение (vii)
К раствору соединения (vi) (170 мг, 0,35 ммоля) в метаноле (2 мл) прибавляли раствор метилата натрия в метаноле (0,5 М, 0,5 мл). Раствор перемешивали 2 часа при комнатной температуре. Раствор нейтрализовали с помощью ионообменной смолы (Амберлит IRC 50 (Н+), фирма Aldrich, № по каталогу 42,883-3) и перемешивали в течение 10 минут. Смолу удаляли при фильтрации. Фильтрат упаривали в вакууме, и остаток подвергали флэш-хроматографии, элюируя этилацетатом /ацетоном 1:1, получали бесцветное масло. После растирания с этилацетатом получали соединение (vii) в виде твердого бесцветного вещества (35 мг); масс-спектр (CI) m/z 286 [М+Н]+.
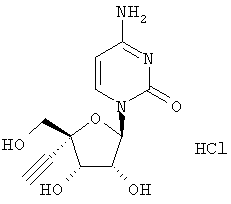
Превращение производного азидоуридина в соответствующее производное азидоцитидина (соединение 1) и его хлористо-водородную соль изображено на схеме 1а
Схема 1а
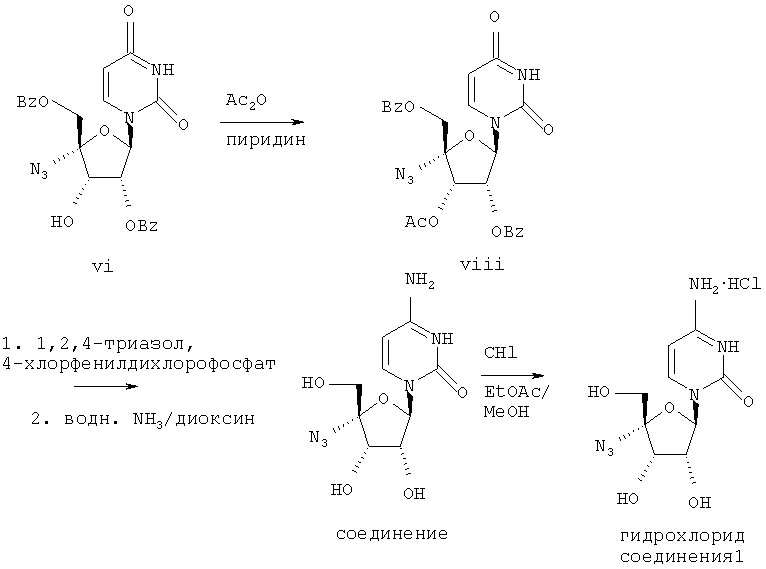
1.8. Соединение (viii)
К раствору соединения (vi) (460 мг, 0,93 ммоля) в пиридине (3 мл) прибавляли уксусный ангидрид (1 мл) и смесь перемешивали 4 часа. Прибавляли этилацетат (100 мл) и смесь промывали 2 н. соляной кислотой (50 мл), затем насыщенным раствором бикарбоната натрия (50 мл). Раствор сушили над безводным сульфатом магния. Сульфат магния удаляли при фильтрации, и фильтрат упаривали в вакууме. Остаток подвергали флэш-хроматографии, элюируя этилацетатом /бензином 1:1, получали вещество (viii) в виде бесцветной смолы (350 мг); масс-спектр (ESI) m/z 536 [М+Н]+.
1.9. Соединение 1
К раствору соединения (viii) (1,5 г, 2,8 ммоля) в пиридине (20 мл) прибавляли 1,2,4-триазол (0,97 г, 14 ммолей). Затем прибавляли по каплям при перемешивании 4-хлорфенилдихлорфосфат (1,36 мл, 8,4 ммоля). Смесь перемешивали 16 часов. Прибавляли этилацетат (300 мл), и смесь промывали насыщенным раствором бикарбоната натрия (200 мл). Раствор сушили над безводным сульфатом магния. Сульфат магния удаляли путем фильтрации, и фильтрат упаривали в вакууме. Остаток подвергали флэш-хроматографии, элюируя этилацетатом/бензином 2:1, получали пенообразное вещество желтого цвета (850 мг). Пенообразное вещество обрабатывали диоксаном (8 мл), затем водным раствором аммиака (16 мл) и перемешивали 16 часов. Фильтрат упаривали в вакууме и остаток подвергали флэш-хроматографии, элюируя дихлорметаном/метанолом/уксусной кислотой/водой 90:18:3:2, получали соединение 1 в виде светло-коричневого пенообразного вещества (350 мг); масс-спектр (бомбардировка быстрыми атомами /FAB/) m/z 285 [М+Н]+.
1.10. Гидрохлорид соединения 1
Соединение 1 (0,40 г) растворяли в метаноле и обрабатывали раствором хлористого водорода в этилацетате. Продукт отделялся в виде микрокристаллического твердого вещества, его собирали с помощью фильтрации и сушили в вакууме, получали хлористо-водородную соль соединения 1 (0,22 г); масс-спектр (ESI) m/z 285 [М+Н]+.
Пример 2
Получение соединения 2 согласно способу по схеме 2
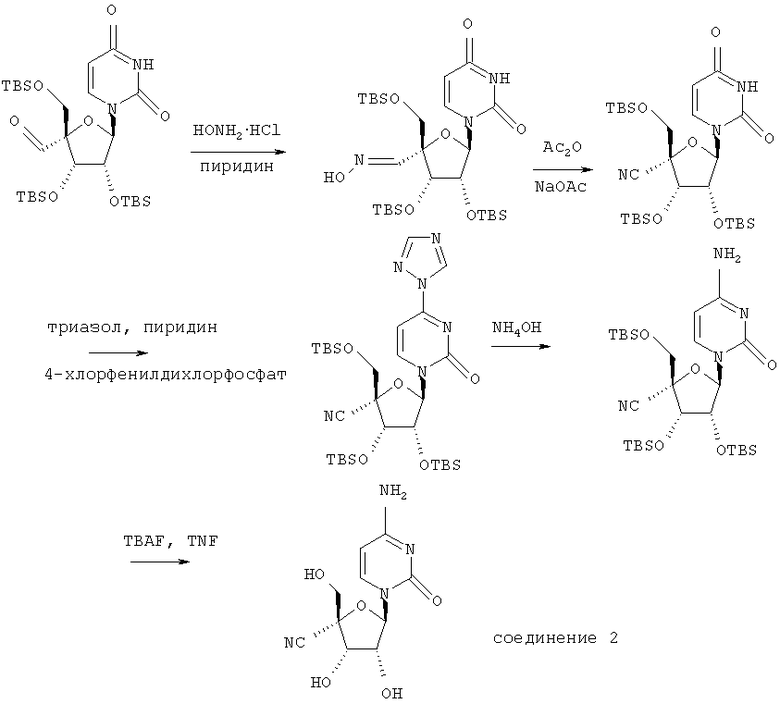
2.1. Соединение (ix)
Соединение (ix) получали из соединения (xiv), см. пример 3, как описано М. Nomura и др., J. Med. Chem., 1999, 42, 2901-2908.
2.2. Соединение (х)
Смесь (ix) (600 мг, 0,98 ммоля) и гидрохлорида гидроксиламина (140 мг, 1,95 ммоля) в пиридине перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь упаривали в вакууме, и остаток распределяли между этилацетатом (30 мл) и водой (30 мл). Этилацетатный слой отделяли и сушили над безводным сульфатом магния. Сульфат магния удаляли при фильтрации, и фильтрат упаривали в вакууме, получали соединение (х) в виде пенообразного вещества белого цвета (615 мг); масс-спектр (ESI) m/z 630 [М+Н]+.
2.3. Соединение (xi)
Смесь соединения (х) (550 мг, 0,87 ммоля) и ацетата натрия (720 мг, 5,25 ммоля) суспендировали в уксусном ангидриде, затем нагревали при 130°С в течение 3 часов. Реакционную смесь упаривали в вакууме, и остаток распределяли между этилацетатом (30 мл) и насыщенным раствором бикарбоната натрия (30 мл). Этилацетатный слой отделяли и сушили над безводным сульфатом магния. Сульфат магния удаляли при фильтрации, и фильтрат упаривали в вакууме. Остаток очищали с помощью колоночной флэш-хроматографии на силикагеле, элюируя диэтиловым эфиром/гексаном 1:2. Содержащие продукт фракции объединяли и упаривали в вакууме, получали соединение (xi) в виде бесцветного твердого вещества (285 мг). Масс-спектр (ESI) m/z 612 [M+H]+.
2.4. Соединение (xii)
4-Хлорфенилдихлорфосфат (160 мкл, 0,98 ммоля) прибавляли по каплям к раствору соединения (xi) (200 мг, 0,33 ммоля) и 1,2,4-триазола (115 мг, 1,63 ммоля) в безводном пиридине (5 мл), затем перемешивали при комнатной температуре 16 часов. Реакционную смесь упаривали в вакууме, и остаток распределяли между этилацетатом (30 мл) и 2 М соляной кислотой (30 мл). Этилацетатный слой отделяли, промывали насыщенным раствором бикарбоната натрия (30 мл) и сушили над безводным сульфатом магния. Сульфат магния удаляли при фильтрации, и фильтрат упаривали в вакууме. Остаток очищали с помощью колоночной флэш-хроматографии на силикагеле, элюируя диэтиловым эфиром/гексаном 1:1, затем диэтиловым эфиром/гексаном 2:1. Содержащие продукт фракции объединяли и упаривали в вакууме, получали соединение (xii) в виде твердого вещества кремового цвета (65 мг). Масс-спектр (ESI) m/z 663 [М+Н]+.
2.5. Соединение (xiii)
Раствор соединения (xii) (60 мг, 0,09 ммоля) и водного аммиака (2 мл) в ацетонитриле перемешивали при комнатной температуре 16 часов. Реакционную смесь упаривали в вакууме, и остаток распределяли между этилацетатом (10 мл) и 2 М соляной кислотой (10 мл). Этилацетатный слой отделяли и сушили над безводным сульфатом магния. Сульфат магния удаляли при фильтрации, и фильтрат упаривали в вакууме, получали соединение (xiii) в виде твердого вещества бледно-желтого цвета (45 мг); масс-спектр (ESI) m/z 611 [М+Н]+.
2.6. Соединение 2
Фтористый тетрабутиламмоний (1 М раствор в тетрагидрофуране, 0,3 мл) прибавляли к перемешиваемому раствору соединения (xiii) (40 мг, 0,06 ммоля) в безводном тетрагидрофуране (10 мл) и перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли путем выпаривания в вакууме. Остаток обрабатывали пиридином (1 мл), затем уксусным ангидридом (0,3 мл) и перемешивали 4 часа при комнатной температуре. Растворитель удаляли путем выпаривания в вакууме. Остаток обрабатывали этилацетатом (50 мл) и промывали разбавленной соляной кислотой (30 мл), затем 5% водным раствором бикарбоната натрия. Этилацетат сушили над безводным сульфатом магния. Сульфат магния удаляли при фильтрации, и фильтрат упаривали в вакууме. Остаток подвергали колоночной флэш-хроматографии, элюируя этилацетатом, получали маслообразное вещество. Масло растворяли в метаноле (1 мл) и обрабатывали метилатом натрия (0,5 М раствор в метаноле, 0,05 мл), выдерживали при комнатной температуре 3 часа. Смесь нейтрализовали ионообменной смолой (Амберлит IRC 50 (Н+)). Смолу удаляли при фильтрации, и фильтрат упаривали в вакууме. Остаток растворяли в воде и подвергали сушке при температуре ниже точки замерзания, получали соединение 2 в виде твердого аморфного вещества (7 мг).
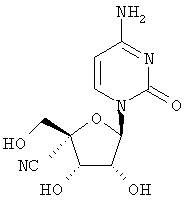
2.7. Соответствующий 4'-циануридин может быть получен при снятии защиты в соединении (xi).
Снятие защиты может быть проведено следующим образом:
Соединение (xi) (50 мг, 82 мкмоля) растворяли в тетрагидрофуране, обрабатывали фтористым тетрабутиламмонием на двуокиси кремния, затем перемешивали 16 часов при комнатной температуре. Реакционную смесь фильтровали через Гифло Супер Цел (фирмы Fluka, № по каталогу 56678), упаривали в вакууме, затем очищали с помощью колоночной флэш-хроматографии на силикагеле, элюируя дихлорметаном/метанолом/ уксусной кислотой/водой (240:24:3:2), а затем дихлорметаном/метанолом/уксусной кислотой/водой (90:18:3:2). Содержащие продукт фракции объединяли и упаривали. Остаток растворяли в метаноле/воде (5:1), обрабатывали ионообменной смолой Дуолит С225 (Н+-форма, BDH, № по каталогу 56678) и перемешивали 15 минут. Смолу удаляли при фильтрации и фильтрат упаривали в вакууме до небольшого объема. Продукт собирали при фильтрации и сушили в вакууме, получали 4'-циануридин в виде твердого кристаллического вещества белого цвета (15 мг); масс-спектр (ESI) m/z 270 [М+Н]+.
Пример 3
Получение соединения 3 согласно способу на схеме 3
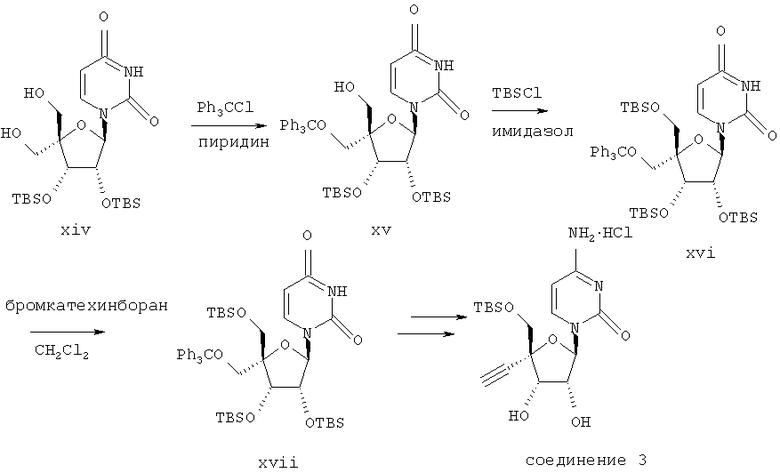
3.1. Соединение (xiv)
Данное соединение получали, как описано М. Nomura и др., J. Med. Chem., 1999, 42, 2901-2908.
3.2. Соединение (xv)
К раствору соединения (xiv) (3,0 г, 6,0 ммолей) в пиридине (20 мл) прибавляли трифенилхлорметан (3,2 г, 11,5 ммоля) и перемешивали при комнатной температуре в течение 16 часов. Растворитель выпаривали в вакууме, и остаток распределяли между этилацетатом (50 мл) и 2 М соляной кислотой (50 мл). Этилацетатный слой отделяли, промывали соляным раствором (50 мл) и сушили над безводным сульфатом магния. Сульфат магния удаляли с помощью фильтрации и фильтрат упаривали в вакууме. Технический продукт очищали с помощью колоночной флэш-хроматографии на силикагеле, элюируя диэтиловым эфиром/гексаном 2:1. Содержащие продукт фракции объединяли и упаривали в вакууме, получали соединение (xv) в виде твердого вещества белого цвета (2,75 г); масс-спектр (ESI) m/z 767 [М+Н]+.
3.3. Соединение (xvi)
Прибавляли трет-бутилдиметилсилилхлорид (0,67 г, 4, 4 ммоля) и имидазол (0,91 г, 13,3 ммоля) к перемешиваемому раствору соединения (xv) (2,75 г, 3,7 ммоля) в диметилформамиде (20 мл). Реакционную смесь нагревали при 45°С в течение 16 часов. Прибавляли дополнительно трет-бутилдиметилсилилхлорид (0,67 г, 4,4 ммоля) и имидазол (0,91 г, 13,3 ммоля), и смесь нагревали при 60°С в течение 4 часов. Растворитель удаляли при упаривании в вакууме и остаток распределяли между этилацетатом и соляным раствором. Этилацетат отделяли и промывали еще соляным раствором и сушили над безводным сульфатом магния. Сульфат магния удаляли при фильтрации, и фильтрат упаривали в вакууме. Оставшееся бесцветное пенообразное вещество очищали с помощью колоночной флэш-хроматографии на силикагеле, элюируя диэтиловым эфиром/гексаном 1:2. Содержащие продукт фракции объединяли и упаривали в вакууме, получали соединение (xvi) в виде твердого вещества белого цвета (3,1 г).
3.4. Соединение (xvii)
Прибавляли бромкатехинборан (355 мг, 1,77 ммоля) к перемешиваемому раствору соединения (xvi) (1,5 г, 1,77 ммоля) в безводном дихлорметане (50 мл) в атмосфере азота при 0°С. Реакционную смесь перемешивали 15 минут, разбавляли дихлорметаном (50 мл), затем промывали насыщенным раствором бикарбоната натрия (100 мл) и соляным раствором (100 мл). Дихлорметан сушили над безводным сульфатом магния. Сульфат магния удаляли при фильтрации, и фильтрат упаривали в вакууме. Остаток очищали с помощью колоночной флэш-хроматографии на силикагеле, элюируя диэтиловым эфиром/гексаном 1:1. Содержащие продукт фракции объединяли и упаривали в вакууме, получали соединение (xvii) в виде твердого вещества белого цвета (930 мг).
3.5. Соединение 3
Данное соединение получали из соединения (xvii), как описано М. Nomura и др., J. Med. Chem., 1999, 42, 2901-2908.
Другие соединения могут быть получены согласно способам, описанным в данной области, например:
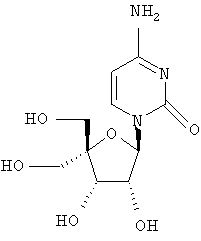
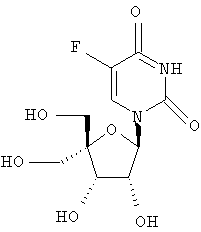
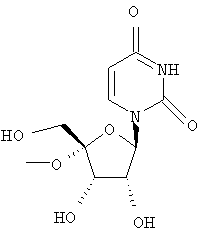
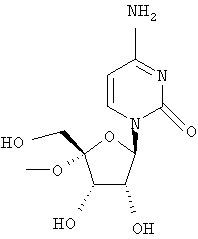
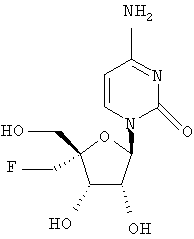
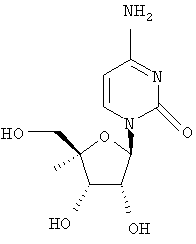
Дополнительные соединения формулы I, которые могут быть получены аналогично способам, описанным ранее, приведены ниже:
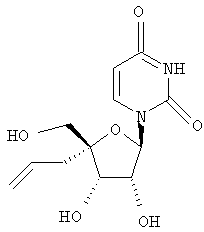


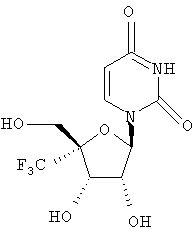
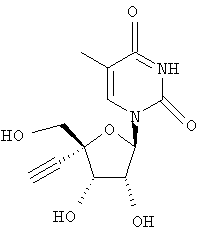
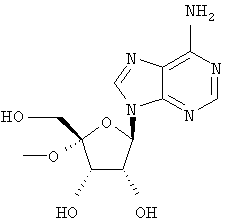
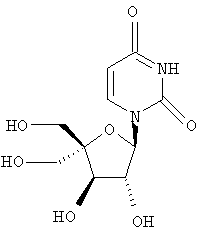
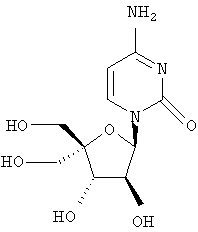
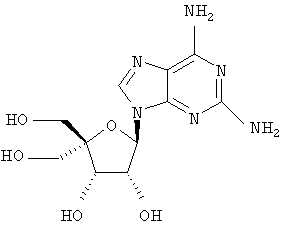
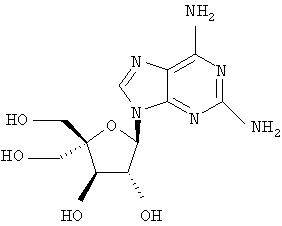
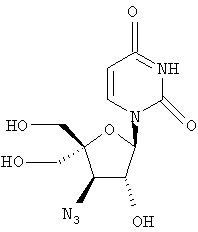
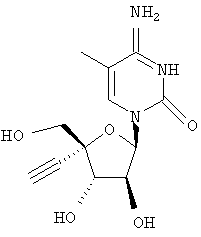
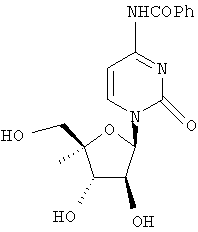
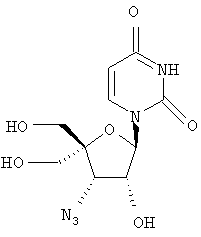
Следующий метод анализа демонстрирует способность соединений формулы I ингибировать репликацию РНК вируса гепатита С и, следовательно, возможность их потенциального применения для лечения заражений, вызванных HCV.
Анализ с участием Renilla-люциферазы
Анализ основывается на идее использования репортера в качестве простого считывателя внутриклеточного уровня РНК репликона HCV. Для этой цели ген Renilla-люциферазы вводили в первую открытую рамку считывания конструкции NK5.1 репликона (Krieger и др., J. Virol. 75:4614) сразу после внутренней последовательности рибосомного сайта вхождения (IRES) и проводили слияние с геном неомицин-фосфотрансферазы (NPTII) через саморасщепляющийся пептид 2А из вируса, вызывающего заболевания стоп и полости рта (Ryan & Drew, ЕМВО том 13: 928-933). После in vitro транскрипции РНК электропорировали в клетки человеческой гепатомы Huh7, выделяли G-418-устойчивые колонии и размножали. Было показано, что стабильно выбранная линия клеток 2209-23 содержала репликативную субгеномную РНК вируса гепатита С и активность Renilla-люциферазы, выраженная репликоном, отражает уровень ее РНК в клетках.
Для осуществления методики анализа клетки, содержащие Renilla-люциферазу с репликоном HCV (2209-23), которые культивировали в минимальной поддерживающей среде (MEM) Дюльбекко (GibcoBRL, № по каталогу 31966-021) с 5% околоплодной сывороткой теленка (FCS, GibcoBRL, № по каталогу 10106-169), помещали в 96-ячеечный планшет по 5000 клеток в ячейку и инкубировали в течение ночи. Еще через 24 часа к клеткам прибавляли химические соединения в среде для выращивания в различных разведениях, клетки далее инкубировали три дня при 37°С. Анализ проводили дублированно в двух планшетах, один анализ в непрозрачном белом и один в прозрачном, для того чтобы измерить активность и цитотоксичность химического соединения параллельно, убеждаясь, что наблюдаемая активность не является следствием снижения клеточной пролиферации.
В конце периода инкубирования собирали клетки в белых планшетах и активность люциферазы измеряли, используя сдвоенную репортерную систему анализа люциферазы (фирма Promega, № по каталогу Е1960). Все реагенты, описанные в следующем параграфе, были включены в наборы от производителей, и инструкции от производителей соблюдались для препаратов реагентов. Если кратко, клетки дважды промывали 200 мкл забуференного фосфатом физиологического раствора (рН 7,0) (ЗФР) на ячейку и лизировали с помощью 25 мкл 1х пассивного буфера для лизиса перед инкубированием при комнатной температуре в течение 20 минут. Прибавляли в каждую ячейку 100 мкл реагента для анализа люциферазы (LAR II). Планшет затем вставляли в люминометр для микропланшетов LB 96V (MicroLumatPlus, Berthold) и в каждую ячейку впрыскивали с помощью специального устройства 100 мкл реагента Stop & Glo, измеряли сигнал, используя 10-секундную программу измерения с 2-секундной задержкой. IC50, величина концентрации требующегося лекарственного препарата для уменьшения уровня репликона на 50% относительно контрольного значения для необработанных клеток, может быть рассчитана из графика зависимости процента снижения активности люциферазы против концентрации лекарственного средства. Результаты представлены ниже.
Для анализа цитотоксичности применяли реагент, представляющий водорастворимую мононатриевую соль 2-(4-иодфенил)-3-(4-нитрофенил)-5-(2,4-дисульфофенил)-2Н-тетразолия (реагент WST-1) от фирмы Roche Diagnostic (№ по каталогу 1644807). В каждую ячейку прибавляли 10 мкл реагента WST-1, включая ячейки, содержащие только среду, в качестве слепых опытов. Клетки затем инкубировали от 1 часа до 1,5 часа при 37°С и измеряли с помощью считывающего с 96-ячеечного планшета устройства оптическую плотность при 450 нм (фильтр сравнения при 650 нм). И снова СС50, величина концентрации лекарственного препарата, требуемая для уменьшения пролиферации клеток на 50% по отношению к контрольному значению для необработанных клеток, может быть рассчитана из кривой зависимости процента снижения величины WST-1 против концентрации лекарственного средства.
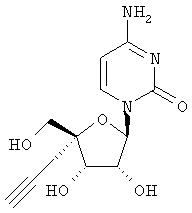
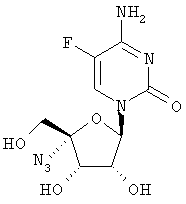
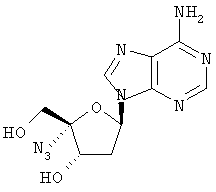
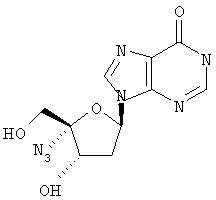
Как видно из таблицы, соединения формулы I обладают потенциальной возможностью быть эффективными в качестве противовирусных лекарственных средств при лечении вызванных вирусом гепатита С заражений у людей или эти соединения метаболизируются в соединение, обладающее подобной активностью.
В другом варианте осуществления изобретения активное соединение или его производное, или соль может быть применено в комбинации с другим противовирусным средством, как, например, противогепатитное средство, включая соединения формулы I. Когда активное соединение или его производное, или соль вводят в комбинации с другим противовирусным средством, активность может быть выше, чем у исходного соединения. Это легко может быть определено путем получения производного и изучения его активности против HCV согласно описанному здесь способу.
Введение активного соединения может охватывать варианты от непрерывного (капельное внутривенное вливание) до нескольких пероральных введений в день (например, в количестве, соответствующем получаемому при капельном внутривенном вливании) и может включать, среди различных способов введения, пероральное, местное, парентеральное, внутримышечное, внутривенное, подкожное, чрескожное введение (которое может включать применение средства, повышающего проникновение), введение трансбуккальное или в виде суппозиториев.
4'-Замещенные производные нуклеозидов, а также их применимые в фармацевтических целях соли могут применяться в качестве лекарственных средств в виде любой готовой фармацевтической формы. Фармацевтическая готовая форма может быть введена через тонкий кишечник, либо перорально, например, в виде таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий, сиропов или суспензий, либо через прямую кишку, например, в виде суппозиториев. Они также могут вводиться парентерально (внутримышечно, внутривенно, подкожно или с применением методик внутригрудинных инъекций или вливаний), например, в виде инъекционных растворов, через нос, например, в виде назальных распылителей, или с помощью ингаляционного аэрозоля, местно и т.д.
Для изготовления фармацевтических препаратов 4'-замещенные производные нуклеозидов, а также их фармацевтически применимые соли могут быть превращены в готовые лекарственные формы с помощью терапевтически инертного неорганического или органического наполнителя для производства таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий.
Соединения формулы I могут быть превращены в готовую лекарственную форму в смеси с фармацевтически приемлемым носителем. Например, соединения по настоящему изобретению могут вводиться перорально в виде фармакологически приемлемых солей. Поскольку соединения по настоящему изобретению большей частью растворимы в воде, их можно вводить внутривенно в физиологическом растворе (например, в забуференном до рН примерно 7,2-7,5). Для этой цели могут применяться обычные буферы, например фосфаты, бикарбонаты или цитраты. Конечно, обычный специалист в данной области может модифицировать готовые формы в рамках разработанных технических условий для обеспечения многочисленных готовых форм для определенного способа введения, не превращая композиции по данному изобретению в неустойчивые или не ухудшая их терапевтическую активность. В частности, модификация представленных соединений с целью придания им большей растворимости в воде или другом растворителе, например, может быть легко осуществлена с помощью незначительных модификаций (образование солей, получение сложных эфиров и т.д.), которые часто используются обычными специалистами в данной области. Также одобряется специалистами в данной области модификация способа введения и схем приема конкретного соединения с целью управления фармакинетикой данных соединений для достижения максимально полезного эффекта у больных.
Для парентеральных готовых лекарственных форм носитель обычно включает стерильную воду или водный раствор хлористого натрия, хотя могут быть включены и другие ингредиенты, включая способствующие диспергированию. Конечно, когда должна использоваться стерильная вода и поддерживаться стерильной, композиции и носители также должны быть стерилизованы. Также могут быть приготовлены инъецируемые суспензии, в этом случае могут быть использованы соответствующие жидкие носители, суспендирующие средства и им подобные вещества.
Подходящими наполнителями для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул являются, например, лактоза, кукурузный крахмал и их производные, тальк и стеариновая кислота или ее соли.
Если желательно, таблетки и капсулы могут быть покрыты энтеросолюбильной оболочкой или быть с поддерживаемым высвобождением, что достигается с помощью стандартных методик.
Подходящими наполнителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые или жидкие полиолы.
Подходящими наполнителями для инъекционных растворов являются, например, вода, физиологический раствор, спирты, полиолы, глицерин или растительные масла.
Подходящими наполнителями для суппозиториев являются, например, природные и отвержденные масла, воски, жиры, полужидкие или жидкие полиолы.
Подходящими наполнителями для растворов и сиропов для применения через кишечник являются, например, вода, полиолы, сахароза, инвертный сахар и глюкоза.
Фармацевтические препараты по настоящему изобретению могут также быть предоставлены в виде готовых лекарственных форм с поддерживаемым высвобождением или других подходящих готовых лекарственных форм.
Фармацевтические препараты могут также содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие средства, эмульгаторы, подсластители, красители, вкусовые вещества, соли для поддержания осмотического давления, буферы, маскирующие средства или антиоксиданты.
Фармацевтические препараты могут также содержать другие терапевтически активные средства, известные в данной области.
Дозировка может варьироваться в широких пределах и, конечно, подгоняется к индивидуальным требованиям в каждом конкретном случае. Для перорального введения дневная доза между примерно 0,01 и 100 мг/кг массы тела в день должна быть подходящей для монотерапии и/или в случае комбинированной терапии. Предпочтительная дневная доза составляет примерно от 0,1 до примерно 500 мг/кг массы тела, более предпочтительно от 0,1 до примерно 100 мг/кг массы тела и наиболее предпочтительно от 1,0 до примерно 100 мг/кг массы тела в день. Типичный препарат содержит примерно от 5% до примерно 95% активного вещества (масса/масса). Дневная доза может быть введена в виде одной дозы или отдельных доз, обычно от 1 до 5 доз в день.
В случае некоторых фармацевтических дозированных форм предпочтительны пролекарственные формы соединений, особенно включающие ацилированные (ацетилированные или другие) производные, сложные эфиры пиридина и различные формы в виде солей представленных соединений. Обычному специалисту в данной области понятно, как легко модифицировать настоящие соединения в пролекарственные формы для облегчения доставки активных соединений к целевому участку в организме-хозяине или у больного. Обычный специалист в данной области также воспользуется преимуществом подходящих фармакокинетических параметров пролекарственных форм, где это применимо, для доставки настоящих соединений к намеченному участку в организме-хозяине или у больного для максимизации предполагаемого эффекта соединения.
Производные нуклеозидов или приготовленные из них лекарственные препараты могут быть применены для монотерапии или комбинированной терапии, то есть лечение может проводиться в сочетании с введением одного или нескольких дополнительных терапевтически активных соединений, например модулятора иммунной системы, как, например, интерферон, интерлейкин, фактор некроза опухоли или колониестимулирующий фактор; противовирусного средства или противовоспалительного средства. Когда лечение представляет комбинированную терапию, применение лекарственных средств может быть одновременным или последовательным относительно терапии 4'-замещенными производными нуклеозидов. Одновременное введение, как это упоминается в контексте, включает, таким образом, введение средств в одно и то же время или в разное время.
Следует понять, что приведенные здесь ссылки на лечение относятся к профилактике, а также и к лечению существующих состояний, и что лечение животных включает лечение людей, как и других млекопитающих. Кроме того, лечение заражения вирусом гепатита С (HCV), как упоминается в контексте, также включает лечение или профилактику заболевания или состояния, связанного или опосредствованного заражением вирусом гепатита С, или его клинических симптомов.
В настоящей спецификации термин "включать" означает "охватывает или состоит из" и термин "включающий" означает "охватывающий или состоящий из".
Характерные особенности, раскрываемые в предшествующем описании, или следующие далее пункты формулы изобретения, или сопровождающие схемы, выраженные в специфической форме или в терминах средств для осуществления раскрываемой функции, или способ, или процесс для достижения раскрываемого результата в качестве подходящих могут по отдельности или в любой комбинации таких особенностей быть использованы для реализации изобретения в разнообразных его формах.
Изобретение относится к применению 4'-замещенных нуклеозидов формулы (I), в которой R водород; R1 - алкил, возможно замещенный гидроксилом, алкенил, алкинил, алкокси, циано или азидо; R2 - водород или гидроксил; R3 и R4 - водород, гидроксил, алкокси или галоген, при условии, что как минимум один из R3 и R4 означает водород; В является 9-пуринильным остатком формулы (В1), где R5 - водород; R6 - гидроксил или NHR8; R7 - водород; R8 - водород или фенилкарбонил; или В является 1-пиримидильным остатком формулы (В2), где Z означает О; R10 - гидроксил или NHR8; R11 - водород; R8 является таким, как определено выше; и их фармацевтически приемлемых солей, для приготовления лекарственного средства для лечения заболеваний, опосредствованных вирусом гепатита С (HCV). Изобретение относится также к фармацевтической композиции для приготовления лекарственного средства для лечения заболеваний, опосредованных вирусом гепатита С (HCV), и к применению данной фармацевтической композиции для приготовления лекарственного средства для лечения заболеваний, опосредованных вирусом гепатита С (HCV). 3 н. и 4 з.п. ф-лы.
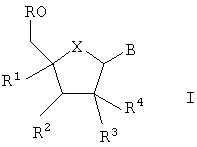
где R означает водород;
R1 означает C1-12 алкил с прямой или разветвленной цепью, возможно замещенный гидроксилом, C2-7 алкенил, C2-7 алкинил, C1-12 алкоксигруппу, цианогруппу или азидогруппу;
R2 означает водород или гидроксил;
R3 и R4 означают водород, гидроксил, C1-12 алкоксигруппу или галоген, при условии, что как минимум один из R3 и R4 означает водород;
В является 9-пуринильным остатком формулы В1
где R5 означает водород;
R6 означает гидроксил или NHR8;
R7 означает водород;
R8 означает водород или фенилкарбонил; или
В является 1-пиримидильным остатком формулы В2
 ,
,
где Z означает О;
R10 означает гидроксил или NHR8;
R11 означает водород;
R8 является таким, как определено выше;
и их фармацевтически приемлемых солей,
для приготовления лекарственного средства для лечения заболеваний, опосредованных вирусом гепатита С (HCV).
где R означает водород;
R1 означает C1-12 алкил, C2-7 алкенил, C2-7 алкинил, гидроксиметил, цианогруппу или азидогруппу;
R2 означает водород или гидроксил;
R3 и R4 означают водород, гидроксил, C1-12 алкоксигруппу или галоген, при условии, что как минимум один из R3 и R4 означает водород; и
В означает 9-пуринильный остаток формулы В1 или 1-пиримидильный остаток формулы В2, как определено в п.1.
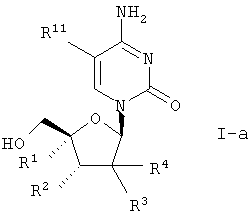
где R1 означает C1-12 алкил, C2-7 алкенил, C2-7 алкинил, гидроксиметил, цианогруппу или азидогруппу;
R2 означает водород или гидроксил;
R3 и R4 означают водород, гидроксил, C1-12 алкоксигруппу или галоген, при условии, что как минимум один из R3 и R4 означает водород;
R11 означает водород,
и их фармацевтически приемлемых солей.
| BIOSCIENCE, BIOTECHNOLOGY AND BIOCHEMISTRY (1999), 63 (6), 1146-1149 | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Прибор для вычерчивания конических сечений | 1922 |
|
SU457A1 |
| WO 00/69876, A1, 23.11.2000 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2008-04-27—Публикация
2002-06-07—Подача