Изобретение относится к области медицины, а именно к ортопедии и травматологии, и может быть использовано для лечения полнослойных дефектов хряща коленного сустава.
Длительно использующимся в клинической практике способом лечения локальных повреждений хряща коленного сустава, сопровождающихся обнажением субхондральной кости, является резекция нестабильных его участков и последующая туннелизация субхондральной кости (Ogilvie-Harris, Jackson, 1984). В последние годы все шире применяется так называемый «микрофрактуринг» - формирование микропереломов субхондральной кости, направленное на создание так называемого "суперсгустка" крови, стимуляцию мезенхимальных клеток с последующей трансформацией соединительной ткани в хрящеподобную (Steadmen et al., 2001). Основным недостатком этих способов является то, что они приводят к образованию в области деструкции рубцовой ткани или волокнистого хряща, значительно уступающих по своим функциональным свойствам гиалиновому, в результате чего развивается диффузное дегенеративно-дистрофическое поражение коленного сустава, которое приводит к тяжелому нарушению функции конечности.
Более перспективным методом хирургического лечения локальных глубоких повреждений хряща коленного сустава, позволяющим более оптимально восстановить гиалиновый хрящ по данным гистологического исследования, представляется пересадка культуры аутохондроцитов с периостальным лоскутом (Minas, Peterson, 1997). Этапами данного метода являются артроскопический забор хрящевой ткани из медиального или латерального мыщелков бедренной кости, ее культивирование в течение 3-4 недель для выращивания 10-12 миллионов жизнеспособных хондроцитов, имплантация культуры хондроцитов в область повреждения под периостальный лоскут, взятый из медиального мыщелка бедренной кости. Субпериостальная имплантация культуры аутогенных хондроцитов позволяет добиться хороших отдаленных результатов более чем у 85% пациентов в сроки до 12 лет после операции (Gillogly, 2002). Основными недостатками данного метода являются дополнительное повреждение хряща при заборе ткани, трудоемкость и высокая стоимость культивирования хондроцитов, двухэтапность хирургического лечения и соответственно необходимость повторной госпитализации пациента для выполнения второго этапа.
Разработанный нами, экспериментально подтвержденный способ лечения глубоких повреждений хряща коленного сустава позволяет оптимизировать формирование полноценного регенерата в области дефекта суставной поверхности, существенно замедлить развитие и прогрессирование дегенеративно-дистрофических изменений в суставе и избежать необходимости повторного оперативного вмешательства.
Результат изобретения достигается за счет того, что во время хирургического вмешательства после моделирования стенок и дна дефекта из ткани жирового тела коленного сустава выделяются и культивируются аутологичные мезенхимальные стволовые клетки, которые затем пункционно трехкратно вводятся в пораженный коленный сустав.
На фигурах изображено следующее.
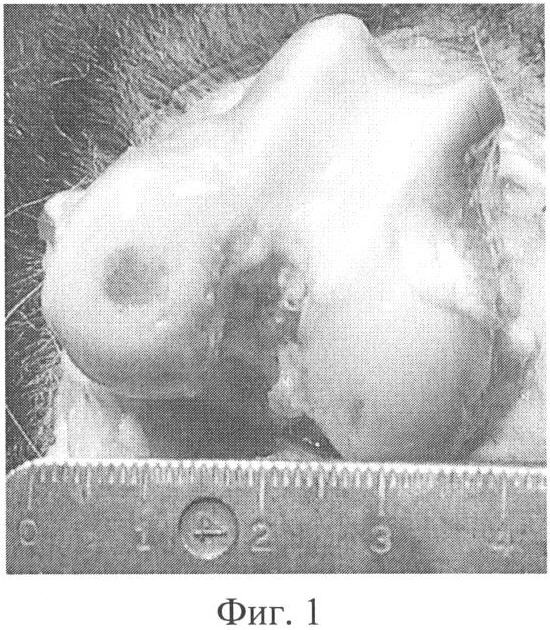
Фиг.1. Макроскопический препарат правого коленного сустава (основная группа) через год после операции, сохраняются контуры сформированного дефекта хряща, отсутствуют признаки гонартроза.
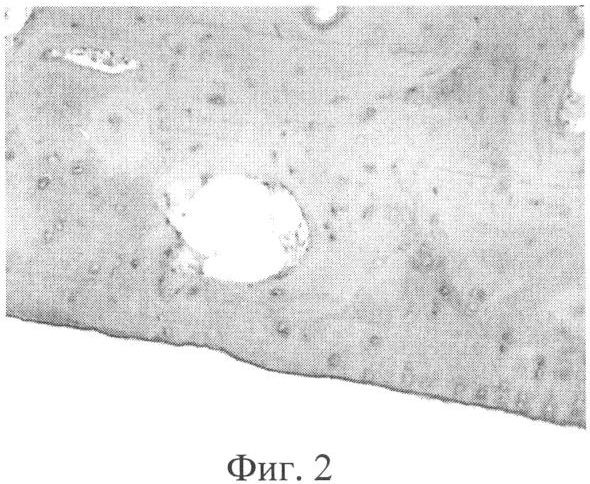
Фиг.2. Микроскопия дефекта хряща коленного сустава (основная группа), дно дефекта представлено базальным слоем суставного хряща, вне зоны дефекта хрящ обычного строения.
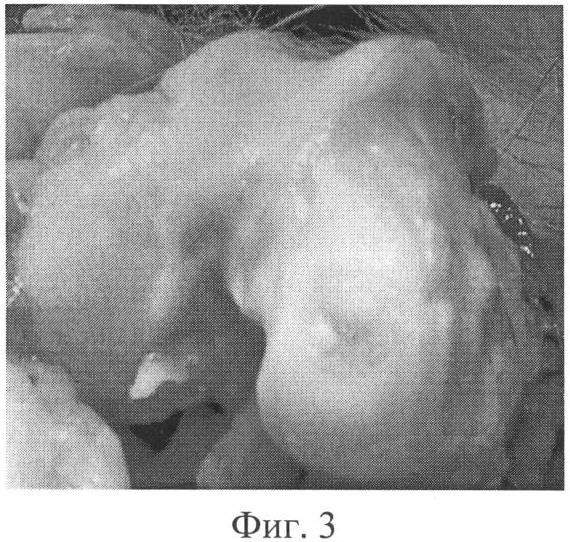
Фиг.3. Макроскопический препарат левого коленного сустава (контрольная группа) через год после операции, сохраняются контуры сформированного дефекта хряща, выраженные признаки гонартроза.
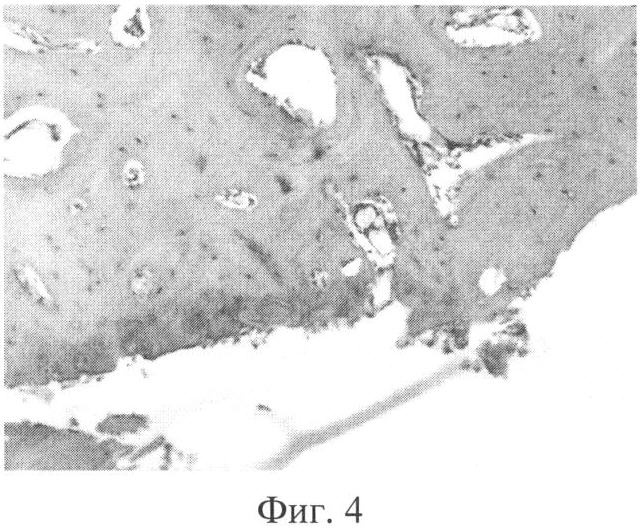
Фиг.4. Микроскопия дефекта хряща коленного сустава (контрольная группа), дно дефекта представлено склерозированной костной тканью - костными шлифами, в субхондральной костной пластинке костные кисты.
Способ осуществляется следующим образом. Для создания однотипных условий проведения эксперимента у всех животных использовали оригинальную методику формирования полнослойного локального дефекта круглой формы в нагружаемой зоне мыщелка бедренной кости только на толщину гиалинового хряща без повреждения подлежащей субхондральной кости. Под общим наркозом, после обработки и драпировки операционного поля, выполняли передневнутреннюю артротомию правого коленного сустава, надколенник вывихивали кнаружи, мобилизировали жировое тело, коленный сустав сгибали до острого угла для доступа к наиболее нагружаемым отделам мыщелков бедренной кости, после чего в одном из них полой фрезой диаметром 5 мм с ограничителем строго перпендикулярно суставной поверхности производили аккуратное удаление хряща на всю его толщину. Ограничитель, располагающийся внутри фрезы, препятствовал повреждению субхондральной кости. Резецировали 3-5 мм3 жирового тела коленного сустава и помещали его в пробирку с питательной средой. Затем рану промывали раствором антисептика, выполняли контроль гемостаза и далее послойный шов раны. Аналогичным способом формировали дефект суставной поверхности внутреннего мыщелка бедренной кости левого коленного сустава (контрольная группа). В послеоперационном периоде иммобилизацию суставов не применяли, дополнительных назначений медикаментов не требовалось, животные находились в клетках вивария.
Аутологичные мезенхимальные клетки из жирового тела получали путем измельчения ткани в диссоциирующем растворе, осаждения клеток центрифугированием, отмывки раствором DPBS без ионов Са2+ и Mg2+ и посева во флаконы в среде DMEM с 10% сыворотки эмбрионов коров. Клетки выращивали в течение 10-14 дней, после чего одну их часть вводили животным, а другую замораживали в жидком азоте для повторных введений собакам.
Через 4, 12 и 26 недель после операции под внутривенным наркозом с соблюдением асептики выполняли пункцию правого коленного сустава и внутрисуставно вводили взвесь аутологичных мезенхимальных стволовых клеток в количестве 5×106 клеток в 1 мл 0,9% раствора хлорида натрия. В левый коленный сустав внутрисуставно вводили 1 мл 0,9% раствора хлорида натрия.
Через год собак выводили из эксперимента. Осуществляли забор и препаровку макропрепаратов коленных суставов, визуально оценивали наличие признаков их дегенеративно-дистрофического поражения: цвет, толщина, плотность и равномерность хрящевого покрытия мыщелков бедренной и большеберцовой костей, наличие краевых костно-хрящевых разрастаний, состояние синовиальной оболочки.
После соответствующей обработки выполняли микроскопию срезов внутренних мыщелков бедренной кости в области сформированных ранее дефектов суставной поверхности.
Клинический пример.
У беспородной половозрелой собаки №1 в операционной под внутривенным наркозом из передневнутреннего доступа выполнили артротомию правого коленного сустава. В нагружаемой зоне внутреннего мыщелка бедренной кости полой фрезой диаметром 5 мм сформировали полнослойный дефект хряща до субхондральной кости без ее пенетрации. Резецировали часть жирового тела и поместили его в стерильную пробирку с питательной средой. Рану послойно ушили. Аналогичным способом после артротомии сформировали дефект суставной поверхности внутреннего мыщелка бедренной кости левого коленного сустава. В послеоперационном периоде иммобилизацию суставов не применяли, раны зажили первичным натяжением.
Аутологичные мезенхимальные клетки из жирового тела получали путем измельчения тела в диссоциирующем растворе, осаждения клеток центрифугированием, отмывки раствором DPBS без ионов Са2+ и Mg2+ и посева во флаконы в среде DMEM с 10% сыворотки эмбрионов коров. Клетки выращивали в течение 10-14 дней, после чего одну их часть вводили животным, а другую замораживали в жидком азоте для повторных введений собакам.
Через 4, 12 и 26 недель в операционной под внутривенным наркозом выполнили пункцию правого коленного сустава и внутрисуставно ввели взвесь аутологичных мезенхимальных стволовых клеток в количестве 5×106 клеток в 1 мл 0,9% раствора хлорида натрия.
Через год собаку вывели из эксперимента и осуществили забор и препаровку коленных суставов.
При визуальной оценке наличия и степени выраженности признаков дегенеративно-дистрофического поражения правого и левого коленных суставов отмечена существенная разница.
Хрящ правого коленного сустава имел нормальную окраску и плотность, сохранялись очертания дефекта суставной поверхности, однако он был неглубоким, заполненным тканью, напоминающей хрящевую, но более мягкую при пальпации. Костно-хрящевых разрастаний по краю суставной поверхности мыщелков бедренной и большеберцовой костей не было, в синовиальной оболочке отсутствовали признаки острого или хронического воспаления (фиг.1). При микроскопическом исследовании дефект сохранял округлую форму, дно его было представлено базальным слоем суставного хряща, покрытым тонкой прослойкой фиброзной ткани и фибрина. В подлежащей кости наблюдались явления склерозирования. Хрящ вне зоны дефекта имел обычное строение (фиг.2).
Хрящ левого коленного сустава был тусклым, размягченным, с очаговыми истончениями в наиболее нагружаемых отделах. Сохранялись четкие границы глубокого дефекта суставной поверхности внутреннего мыщелка бедра, дном которого была субхондральная кость. По краю суставной поверхности мыщелков бедренной и большеберцовой костей сформировались выраженные костно-хрящевые разрастания, в синовиальной оболочке отмечались умеренные признаки хронического воспаления (застойная гиперемия, гипертрофия ворсин, незначительный отек и уплотнение) (фиг.3). При микроскопическом исследовании дно дефекта было представлено склерозированной костной тканью - костными шлифами, по краям которых определялись костно-хрящевые разрастания. В субхондральной костной пластинке формировались кисты (фиг.4).
СПИСОК ЛИТЕРАТУРЫ
1. Gillogly S.D. Cartisel: indications, technique and results // Surgical treatment of complex knee ligament, patellofemoral and articular cartilage disorders. - Rosemont, 2002. - P.201-204.
2. Minas Т., Peterson L. Chondrocyte transplantation // Operative Techniques in Orthopaedics. - 1997. - V.7. - P.323-333.
3. Ogilvie-Harris D.J., Jackson R.W. The arthroscopic treatment of chondromalacia patellae // J. Bone Jt. Surgery. - 1984. - V.66-B, №5. - P.660-665.
4. Steadman J.R., Rodkey W.G., Rodrigo J.J. Microfracture: surgical technique and rehabilitation to treat chondral defects // Clin. Orthop. - 2001. - №391. - P.362-369.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ замещения дефектов хрящевой ткани | 2016 |
|
RU2637103C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ХРОНИЧЕСКОГО ПОЛНОСЛОЙНОГО ЛОКАЛЬНОГО ДЕФЕКТА ХРЯЩА КОЛЕННОГО СУСТАВА В ЭКСПЕРИМЕНТЕ НА СОБАКАХ | 2006 |
|
RU2307399C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ДЕФЕКТОВ ГИАЛИНОВОГО ХРЯЩА СУСТАВНЫХ ПОВЕРХНОСТЕЙ СУСТАВОВ КОНЕЧНОСТЕЙ | 2014 |
|
RU2559089C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ДЕФЕКТА И ПОВРЕЖДЕНИЯ СУСТАВНОГО ХРЯЩА | 2015 |
|
RU2578369C1 |
| Способ хирургического лечения костно-хрящевых дефектов мыщелков бедренной кости | 2019 |
|
RU2692228C1 |
| Способ лечения рассекающего остеохондрита коленного сустава | 2018 |
|
RU2675204C1 |
| СПОСОБ ЛЕЧЕНИЯ ХОНДРОМАЛЯЦИИ НАДКОЛЕННИКА | 1998 |
|
RU2171646C2 |
| РЕГЕНЕРАТИВНЫЙ СПОСОБ ЗАМЕЩЕНИЯ ДЕФЕКТА СУСТАВНОГО ХРЯЩА | 2019 |
|
RU2722452C1 |
| Способ аутохондропластики травматических дефектов суставного хряща опорной поверхности мыщелков бедренной кости | 2021 |
|
RU2779465C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ГИАЛИНОВОГО ХРЯЩА ПРИ ЛЕЧЕНИИ ВНУТРИСУСТАВНЫХ ПЕРЕЛОМОВ | 2008 |
|
RU2364360C1 |
Изобретение относится к области экспериментальной медицины и может быть применимо для моделирования лечения полнослойных дефектов хряща коленного сустава. Моделируют стенки и дно дефекта. Производят забор фрагмента ткани жирового тела для последующего выделения и культивирования аутологичных мезенхимальных стволовых клеток. Вводят куьтивированные клетки пункционно трехкратно в полость коленного сустава. Способ позволяет замедлить прогрессирование дегенеративно-дистрофических изменений, оптимизировать формирование регенерата в области дефекта. 4 ил.
Способ моделирования лечения полнослойных дефектов хряща коленного сустава, отличающийся тем, что после моделирования стенок и дна дефекта производят забор фрагмента ткани жирового тела для последующего выделения и культивирования аутологичных мезенхимальных стволовых клеток, которые затем пункционно трехкратно вводят в полость коленного сустава.
| ВИШНЕВСКИЙ В.А | |||
| Низкоинтенсивное лазерное излучение в лечении остеоартроза | |||
| - Вiсник морскоi медицини, 2000б №4(12), [ON-LINE], 12.06.2002, [найдено 12.06.2002], www.port.odessa.ua/medic/sea_med/0004/000431.htm | |||
| БЕССЫВОРОТОЧНАЯ СРЕДА ДЛЯ КУЛЬТУРЫ КЛЕТОК, ИСПОЛЬЗУЕМЫХ ДЛЯ РЕКОНСТРУКЦИИ КОСТНЫХ И ХРЯЩЕВЫХ СЕГМЕНТОВ (ВАРИАНТЫ) | 1999 |
|
RU2272839C2 |
| US 2006177387, 10.08.2006 | |||
| AUGELLO A | |||
| Cell therapy using allogeneic bone marrow mesenchymal stem cells prevents | |||
Авторы
Даты
2009-03-27—Публикация
2007-06-25—Подача