Изобретение относится к медицине, а именно к травматологии, и предназначено для замещения дефектов хрящевой ткани аутологичным хрящевым трансплантатом.
Патология крупных суставов среди населения неуклонно растет. Среди нее высок удельный вес посттравматических и дегенеративно-дистрофических поражений гиалинового хряща, а именно полнослойных хрящевых и костно-хрящевых дефектов суставной поверхности. Несмотря на высокий уровень специализированной медицинской помощи, в настоящее время продолжается постоянный поиск оптимальных способов восстановления гиалинового хряща.
В результате травм или заболеваний повреждается суставной хрящ, но обладает очень ограниченной способностью к регенерации. В этой зоне отсутствует васкуляризация и, как следствие, клетки крови и костного мозга, а также хондроциты не могут мигрировать в место дефекта. Поэтому в случае изолированного поражения хряща регенерация выражена слабо. При остеохондральных дефектах происходит повреждение суставного хряща и подлежащей субхондральной кости, вызывающее разрыв кровеносных сосудов и создающее сообщение дефекта с костным мозгом. В этом случае запускается процесс регенерации, начинающийся с образования гематомы, формирующейся из поврежденных кровеносных сосудов или костного мозга. Фибриновая сеть гематомы задерживает тромбоциты, выделяющие различные биоактивные факторы, стимулирующие в свою очередь сосудистую инвазию и миграцию недифференцированных мезенхимальных клеток в гематому, постепенно преобразующуюся в фибриновый сгусток. В течение нескольких дней после травмы мезенхимальные клетки размножаются и могут дифференцироваться в хондроциты, синтезирующие коллагеновый матрикс. Получающийся регенерат плохо организован и содержит преимущественно коллаген первого типа.
Независимо от генеза при отсутствии лечения поврежденного гиалинового хряща, обладающего ограниченной способностью к регенерации, в коленном суставе могут возникать распространенные дегенеративные изменения (Bert J.M.,1997; Buckwalter J.А., 2001; Стадников А.А. и др., 2008).
Множественные дискуссии и усилия хирургов в сфере восстановления суставного хряща приводят к внедрению широкого спектра хирургических вмешательств, среди них: мозаичная аутохондропластика, мембранная хондропластика, пересадка собственной культуры хондроцитов.
Установлено, что при артропластике в случае наличия дефектов суставных поверхностей воспалительного, травматического или дегенеративного происхождения необходимо их закрывать материалами, изолирующими обнаженную (лишенную хрящевого покрова) кость от полости сустава таким образом, чтобы были возможны свободные движения и скольжение сочленяющихся суставных концов, что лучше всего обеспечивается свойствами нативного гиалинового хряща или способствующими его восстановлению прокладками интерпозиционной артропластикой (М.Д. Михельман. Артродез и артропластика. М., 1968., J. Chapchal. Arthroplasty of the hip.Stuttgart, 1973). Предложено более 50 видов прокладок для интерпозиционной артропластики, но ни одна из них не дает искомого результата.
Из уровня техники известен способ применения при артропластике биосовместимых рассасывающихся полимеров (А.М. Кулиев, Л.В. Колпакова. Артропластика тазобедренного сустава с применением биосовместимых саморассасывающихся полимеров; экспериментальное исследование. Ортопедия, травматология и протезирование, 1989, N 3, с. 35-38). Установлено, однако, что полимерные пленки не играют прямой роли в образовании хряща, а выполняют лишь защитную роль как протекторы. Данный способ также практического применения не нашел.
Известен способ артропластики для замещения глубоких дефектов суставов с применением губчатого костного аутотрансплантата и аутотрансплантата суставного хряща на тонкой костной основе (Маракуша И.Г. Динамика перестройки и адаптации составных костно-хрящевых аутотрансплантатов, Вестник рентгенол. радиол., 1985, N 3, с. 37-41), включающий в себя взятие фрагмента подвздошной кости и участка суставного гиалинового хряща на тонкой костной основе с менее нагружаемой поверхности этого же или другого сустава. Пластика глубокого дефекта осуществлялась следующим образом: вначале подгонялся по размерам костный аутотрансплантат, который внедрялся в глубину дефекта, а затем сверху помещался аутотрансплантат хряща на тонкой костной основе вровень с окружающей нормальной суставной поверхностью. Недостатками данного способа являются сложность получения костно-хрящевого аутотрасплантата нужных размеров и необходимость замещения дефекта суставной поверхности, с которой был получен трансплантат хряща на тонкой костной основе.
Также известен способ артропластики с применением трансплантации свободного аутоперихондриума, осуществленный в эксперименте на животных (кролики) (Engkvist О. Е. et al, Formation of cartilage from rib perichondrium grefted to an articular defekt in the femur condyle of the rabbit, Scand. K. Past. Reconst. Surg., 1979, N 3, v. 13. p. 371-376), включающий в себя резекцию аутологичного хряща и снятие с него надхрящницы, образование в поперечном направлении дефекта в обоих мыщелках бедра до субхондральной кости диаметром 5 мм тотчас выше места прикрепления сухожилия разгибателя пальцев, внедрение в дефект трансплантата перихондриума и фиксацию его нерассасывающимися нитями через отверстия, высверленные в кости, наложением узловатых швов. Перихондриум поворачивали в сторону сустава поверхностью, прилежащей к хрящу. В связи с недостаточной надежностью фиксации трансплантата в ложе конечность иммобилизировали проволокой в полусогнутом положении на срок 1 неделю.
Недостатками данного способа являются ненадежная фиксация трансплантата в ложе, вследствие которой возможно его смещение, требует обязательной иммобилизации конечности в послеоперационном периоде, кроме того, на месте пересаженного перихондриума наблюдалась гиперпродукция новообразованного хряща вплоть до туморообразных разрастаний, которая ведет к нарушению конгруэнтности суставных поверхностей и сводит к минимуму результат восстановительной операции.
Из уровня техники известен способ артропластики для замещения глубоких дефектов (патент RU 2122366 С1 от 12.09.1995 г.). Сущность способа - плотно внедряют в дефект костный аутотрансплантат, хрящевой дефект заполняют лоскутом перихондриума, подогнанным по форме и размерам дефекта, фиксируют нерассасывающимися нитями с двух сторон одноузловым швом через 3 чрескостных отверстия в ложе с расположением узла вне трущихся суставных поверхностей, нити утапливают ниже уровня окружающего суставного хряща, что позволяет сформировать нормальную суставную поверхность с полноценным хрящом.
Недостатком данного метода являются необходимость забора костного трансплатанта, сложность в подгонке формы и размеров и техническая сложность в формировании чрескостных каналов.
Из уровня техники известен метод мозаичной хондропластики - метод замещения полнослойного хрящевого дефекта, при котором используются полнослойные костно-хрящевые «столбики». Забор таких «столбиков» осуществляется из ненагрузочной зоны суставной поверхности (Н.Н. Советников и др. Клеточные технологии и тканевая инженерия в лечении дефектов суставной поверхности. Клиническая практика №1, 2013 г., с. 56, кол. 1, абзац 4).
Недостатком такого метода является дополнительное повреждение суставного хряща.
Наиболее близким техническим решением к заявляемому способу является выбранный в качестве прототипа способ замещения дефектов хрящевой ткани, включающий имплантацию измельченного аутологичного хряща, смешанного с фибриновым клеем, в область дефекта (Н.Н. Советников и др., Клеточные технологии и тканевая инженерия в лечении дефектов суставной поверхности, Клиническая практика, №1, 2013 г., с. 56, кол. 1, абзац 5 - кол. 2, абзац 1). Хрящевую ткань забирают из неповрежденной области пораженного сустава. Измельченный хрящ смешивают с фибриновым клеем (DeNovo NT Natural Tissue Graft, Zimmer, Inc).
Недостатками данного способа являются необходимость дополнительной травматизации пораженного сустава при заборе трансплантируемого материала, ограниченный объем добытого трансплантата, не учтены пропорции компонентов замещающей смеси, что может существенно отразиться на состоянии замещенного дефекта хрящевой ткани не в лучшую сторону как в ближайший, так и в отдаленный послеоперационный период.
Таким образом существует потребность в способе замещения дефектов хрящевой ткани, позволяющем избежать вышеуказанных недостатков.
Техническим результатом настоящего изобретения является повышение эффективности лечения больных с деструктивно-дистрофическими и посттравматическими дефектами гиалинового хряща большого размерного диапазона за счет оптимального соотношения материалов, замещающих дефект, отсутствие дополнительной травматизации пораженного сустава и доступа к депо хрящевой ткани, обладающим высокими регенеративными способностями, - к хрящевой части ребер.
Этот технический результат достигается тем, что в предлагаемом способе замещения дефектов хрящевой ткани, включающем имплантацию измельченного аутологичного хряща, смешанного с фибриновым клеем, в область дефекта, забирают трансплантат с хрящевой части ребра, а пропорции смеси для замещения дефекта составляют 20-40% фибринового клея и 60-80% хрящевой крошки.
Способ осуществляют следующим образом.
На суставных поверхностях артроскопически визуализируют дефект, шейвером формируют границы дефекта, осуществляют дебриджмент и лаваж сустава. Следующим этапом выполняют забор реберного хряща. Для этого в реберной части на уровне 9 ребра продольным разрезом осуществляют доступ к перихондриуму, последний рассекается вдоль и распатором отводится в стороны. При помощи тонкого костного долота шириной 1 см производится забор хряща на всю толщину размером 2 см. Перихондриум ушивают без установки дренажей. Далее выполняют артротомию для открытого доступа к зоне дефекта хряща.
Полученный хрящ измельчают скальпелем в крошку до 0,1*0,1 мм. Заливают крошку фибриновым клеем Tissucol Kit по технологии и погружают полученную смесь в зону дефекта, плотно прижимают импактором и удерживают до полного застывания. Так как надежность фиксации аутотрансплантата в ложе не вызывает сомнений, послеоперационную иммобилизацию конечности не производят. Более того с первых дней начинают интенсивную пассивную, а затем и активную разработку оперированной конечности.
Для замещения дефекта необходима соответствующая консистенция клеево-хрящевой смеси, близкая по своим свойствам к пластилиновой массе. Для этого нами определены оптимально объемные соотношения фибринового клея и хрящевой крошки. Она составляет 20-40% объема клея и от 80-60% объема хрящевой крошки соответственно. Смесь с соотношением, меньшим 20% объема клея, является в конечном итоге непрочной структурой, так как частицы хрящевой крошки недостаточно связаны между собой, если объем клея составляет более 40%, смесь является слишком жидкой для замещения дефектов. Объем хрящевой крошки измеряют при помощи обычного шприца в миллилитрах путем засыпания в шприц после удаления поршня.
Известно, что гиалиновый хрящ, локализуясь в хрящах носа, гортани, трахеи и бронхов, в реберных хрящах имеет схожее строение и отличается лишь соотношением хондроцитов и коллагеновых волокон. Исходя из этого, мы предлагаем забирать хрящевой трансплантат из ребра в достаточном объеме.
Пример. Пациент X. (31 год) поступил с жалобами на боль, ощущение нестабильности в левом коленном суставе, ограничивающей повседневную активность.
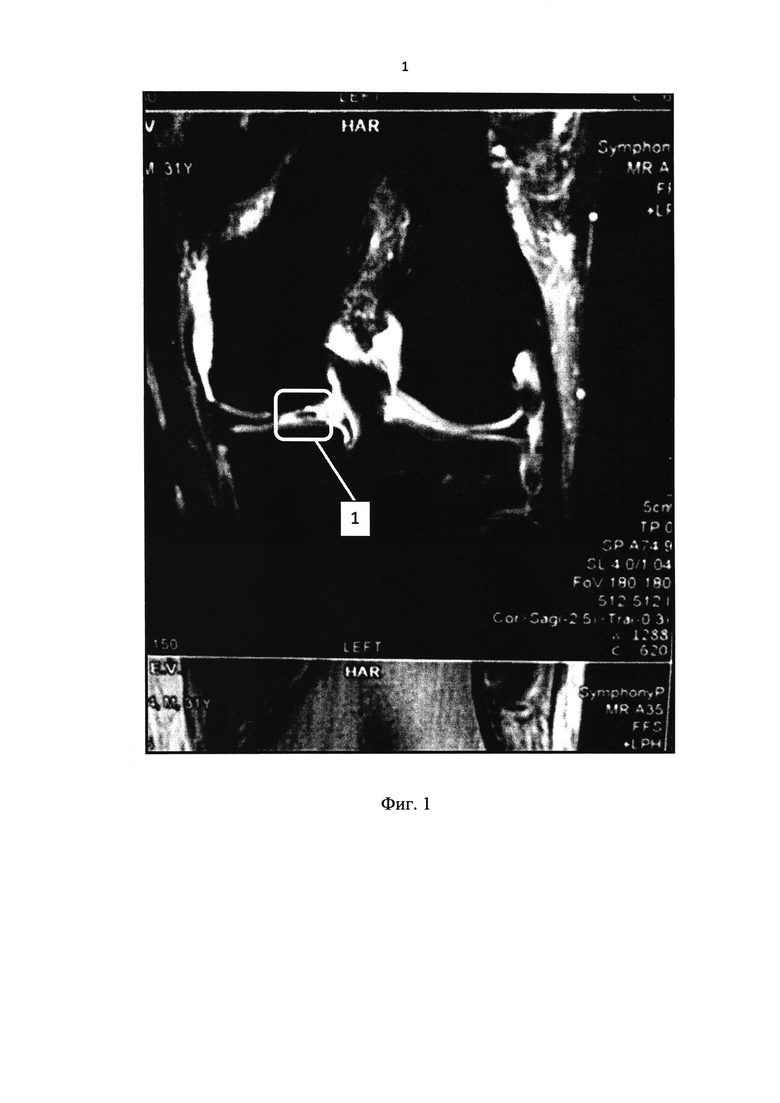
Anamnesis morbi: со слов пациента, производственная травма во время соревнований по пятиборью спасателей. Диагностирован разрыв передней крестообразной связки левого коленного сустава, повреждение хряща. Протокол МРТ: разрыв передней крестообразной связки левого коленного сустава. Травматическая отслойка (1) хряща суставной поверхности медиального мыщелка бедра. Большое количество жидкости в полости сустава (Фиг. 1).
Выполнена артроскопическая пластика передней крестообразной связки материалом из сухожилий изящной и полусухожильной мышц.
Осуществили с помощью предлагаемого способа замещение дефекта хряща медиального мыщелка бедренной кости измельченным аутохрящом ребра, смешанным с фибриновым клеем, пропорции смеси для замещения дефекта составили 35% фибринового клея и 65% хрящевой крошки.
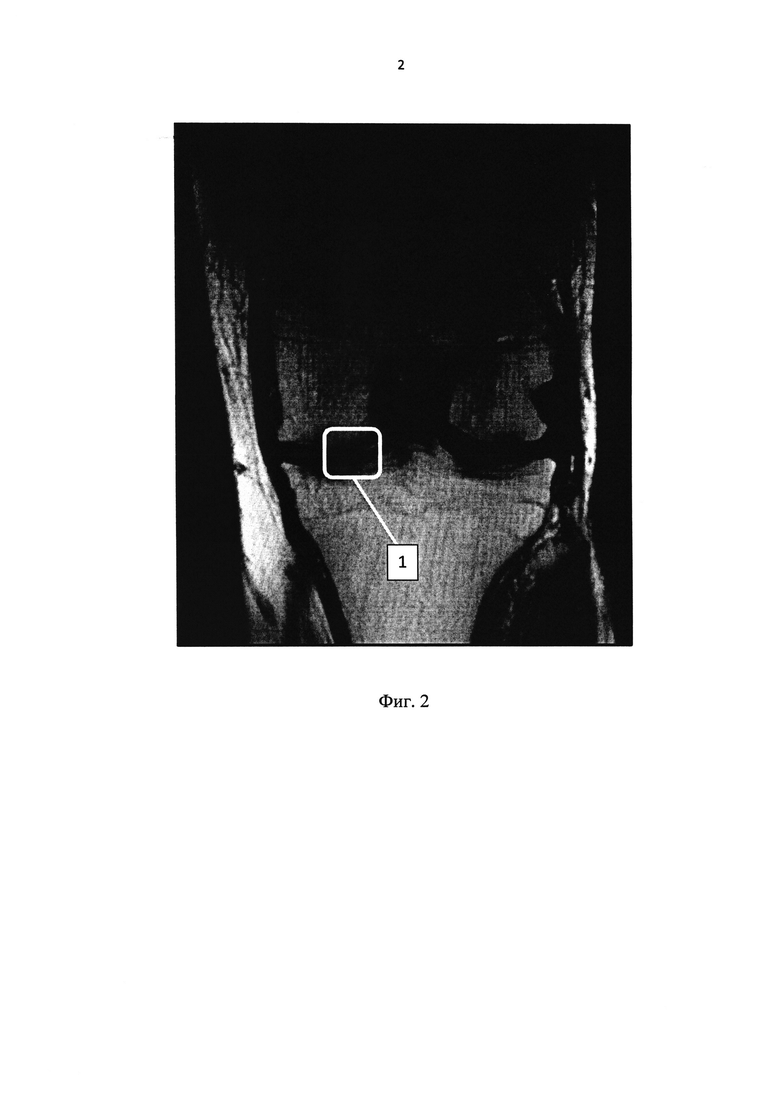
Через 4,5 месяца после операции - протокол МРТ: структура и интенсивность МР-сигнала от хрящевой поверхности, покрывающей суставную поверхность мыщелков, незначительно нарушена, равномерной толщины. Зона отслойки хряща (1) полностью восстановлена (Фиг. 2). Пациент передвигается с полной нагрузкой на оперированную конечность, объем движений в оперированном суставе полный, боли нет.
Предлагаемым способом было проведено замещение дефектов хрящевой ткани у 11 пациентов. Результаты наблюдения показали, что данный способ позволяет успешно и малотравматично восстанавливать поврежденную хрящевую ткань.
Таким образом, предлагаемый способ замещения дефектов хрящевой ткани позволяет повысить эффективность лечения больных с деструктивно-дистрофическими и посттравматическими дефектами гиалинового хряща большого размерного диапазона за счет оптимального соотношения материалов, замещающих дефект, отсутствие дополнительной травматизации пораженного сустава и доступа к депо хрящевой ткани, обладающим высокими регенеративными способностями, - к хрящевой части ребер.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ хирургического замещения полнослойных костно-хрящевых дефектов суставной поверхности таранной кости с хондропатией и асептическим некрозом | 2021 |
|
RU2766042C1 |
| Способ реконструкции остеохондральных дефектов суставов конечностей | 2024 |
|
RU2828762C1 |
| СПОСОБ АРТРОПЛАСТИКИ ДЛЯ ЗАМЕЩЕНИЯ ГЛУБОКИХ ДЕФЕКТОВ | 1995 |
|
RU2122366C1 |
| Способ хирургического лечения костно-хрящевых дефектов мыщелков бедренной кости | 2019 |
|
RU2692228C1 |
| РЕГЕНЕРАТИВНЫЙ СПОСОБ ЗАМЕЩЕНИЯ ДЕФЕКТА СУСТАВНОГО ХРЯЩА | 2019 |
|
RU2722452C1 |
| СПОСОБ АТРОПЛАСТИКИ | 1993 |
|
RU2071288C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ДЕФЕКТОВ ГИАЛИНОВОГО ХРЯЩА СУСТАВНЫХ ПОВЕРХНОСТЕЙ СУСТАВОВ КОНЕЧНОСТЕЙ | 2014 |
|
RU2559089C1 |
| Способ лечения рассекающего остеохондрита коленного сустава | 2018 |
|
RU2675204C1 |
| СПОСОБ ЛЕЧЕНИЯ ПОЛНОСЛОЙНЫХ ДЕФЕКТОВ ХРЯЩА КОЛЕННОГО СУСТАВА С ИСПОЛЬЗОВАНИЕМ КУЛЬТУРЫ АУТОЛОГИЧНЫХ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2007 |
|
RU2351020C1 |
| СПОСОБ АРТРОПЛАСТИКИ ДЕФЕКТОВ СУСТАВНОЙ ПОВЕРХНОСТИ МЫЩЕЛКОВ БЕДРЕННОЙ КОСТИ КОСТНО-ХРЯЩЕВЫМИ ТРАНСПЛАНТАТАМИ | 2002 |
|
RU2224476C2 |
Изобретение относится к медицине, а именно к травматологии, и может быть применимо для замещения дефектов хрящевой ткани. Имплантируют измельченный аутологичный хрящ, взятый с хрящевой части ребра, смешанного с фибриновым клеем, в область дефекта, пропорции смеси для замещения дефекта составляют 20-40% объема фибринового клея и 60-80% объема хрящевой крошки. Способ позволяет обеспечить высокий регенераторный потенциал имплантата, обеспечить замещение дефектов различных размеров. 2 ил., 1 пр.
Способ замещения дефектов хрящевой ткани, включающий имплантацию измельченного аутологичного хряща, взятого с хрящевой части ребра, смешанного с фибриновым клеем, в область дефекта, отличающийся тем, что пропорции смеси для замещения дефекта составляют 20-40% объема фибринового клея и 60-80% объема хрящевой крошки.
| СОВЕТНИКОВ Н.Н | |||
| и др | |||
| Клеточные технологии и тканевая инженерия в лечении дефектов суставной поверхности | |||
| Клиническая практика, 2013, N 1, c.52-66 | |||
| СПОСОБ ВОСПОЛНЕНИЯ ДЕФЕКТОВ СУСТАВНОГО ХРЯЩА | 2008 |
|
RU2383310C1 |
| RU 2011118071/15 А, 10.04.2015 | |||
| US 0009402709 B2, 02.08.2016 | |||
| GONZÁLEZ-OJEDA A | |||
| et al | |||
| Fibrin glue as adjuvant treatment for gastrocutaneous fistula after gastrostomy tube removal | |||
| Endoscopy | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2017-11-29—Публикация
2016-04-12—Подача