Все цитируемые здесь документы во всей полноте включены сюда в качестве ссылок.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Это изобретение находится в области иммуногенных композиций, более подробно композиций, включающих иммуногенные молекулы из Neisseria meningitidis серогрупп В и С (NmВ и NmC).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Штаммы серогрупп В и С Neisseria meningitidis (Nm) являются причиной большинства инвазивных заболеваний в Европе и Соединенных Штатах. В настоящее время доступны вакцины против индивидуальных серогрупп Nm. Вакцина NmB из Norwegian National Institute of Public Health является безопасной, вызывает штамм-специфичный иммунитет у детей и взрослых и эффективна в профилактике заболевания NmB у подростков. Эта вакцина обычно объединялась с полисахаридной вакциной менингококка С и давалась с квасцами. Однако простой полисахаридный компонент не эффективен у младенцев и маленьких детей. Конъюгированная (conj.) вакцина NmC фирмы Chiron также безопасна, вызывает высокие титры сывороточных бактерицидных антител у младенцев, привитых в возрасте двух и трех месяцев, и индуцирует иммунологическую память В-клеток к неконъюгированному полисахариду NmC.
Для представления комбинированной вакцины для NmВ и NmC, которая вызывает иммунный ответ на обе серогруппы, международная патентная заявка WO 99/61053 описывает иммуногенные композиции, которые включают (а) олигосахарид NmC, конъюгированный с носителем, в комбинации с (b) белком наружной мембраны NmB. Комбинированная вакцина вызывает иммунный ответ на обе серогруппы, который незначительно отличается от иммунного ответа, вызванного каждой серогруппой поодиночке. Целью настоящего изобретения является разработка их в композициях, которые вызывают иммунные ответы против более широкого ряда организмов.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соответственно, изобретение относится к иммуногенной композиции, включающей (а) олигосахарид NmC и (b) белок наружной мембраны NmB, характеризующееся тем, что композиция также включает (с) один или более компонентов из следующих:
- белки, описанные в WO 99/57280, или их иммуногенные фрагменты;
- белки, описанные в WO 99/36554, или их иммуногенные фрагменты;
- белки, описанные в WO 99/24578, или их иммуногенные фрагменты;
- белки, описанные в WO 97/28273, или их иммуногенные фрагменты;
- белки, описанные в WO 96/29412, или их иммуногенные фрагменты;
- белки, описанные в WO 95/03413, или их иммуногенные фрагменты;
- белки, описанные в WO 99/31132, или их иммуногенные фрагменты;
- протективный антиген против Neisseria meningitidis серогруппы А;
- протективный антиген против Neisseria meningitidis серогруппы Y;
- протективный антиген против Neisseria meningitidis серогрулпы W;
- протективный антиген против Haemophilus influenzae;
- протективный антиген против pneumococcus;
- противодифтерийный протективный антиген;
- противостолбнячный протективный антиген;
- противококлюшный протективный антиген;
- протективный антиген против Helicobacter pylori;
- протективный антиген против полиомиелита; и/или
- протективный антиген против вируса гепатита В.
Также, вызывая иммунный ответ и к N. meningitidis В, и к С, иммуногенные композиции по изобретению могут вызывать иммунный ответ против других организмов.
Компонент (а)
Олигосахарид компонента (а) предпочтительно является олигосахаридом фирмы Chiron, представляющим фрагменты полисахарида NmC предпочтительно из приблизительно от 12 до 22 повторяющихся единиц.
Олигосахарид NmC компонента (а) предпочтительно конъюгирован с носителем. Носителем предпочтительно является белок, но альтернативно может быть полисахаридом, полимолочной кислотой, полигликолевой кислотой, полимерными аминокислотами, сополимером аминокислоты, липидным агрегатом или неактивной вирусной частицей.
Наиболее предпочтительно, если носителем является белок. Самое предпочтительное, если носителем является CRM197, нетоксичный дифтерийный токсин. Каждая доза предпочтительно содержит 10 мкг олигосахарида на 12,5-33 мкг CRM197 (т.е. для поддержания соотношения олиго/белок на уровне от приблизительно 0,3 до приблизительно 0,8). Наиболее предпочтительно, может использоваться приблизительно 20 мкг CRM197.
Дозировка конъюгата NmC или полисахарида выражается в мкг сиаловой кислоты. Также может использоваться вакцина NmC, содержащая неконъюгированный полисахарид (называемая здесь как "полисахарид NmC" или "MеnС Ps"). MenC Ps является неочищенным изолятом, включающим полисахариды предпочтительно от приблизительно 60 до приблизительно 80 повторяющихся единиц.
Для других деталей по конъюгации NmC-CRM197 см. Costantino et al. (1992) Vaccine 10: 691-698.
Компонент (b)
Белок наружной мембраны NmB компонента (b) предпочтительно включает частично очищенные белки наружной мембраны из штамма 44/76 (В15:Р1.7, 16:L3, 7, 9).
Белок наружной мембраны предпочтительно присутствует в виде протеолипосомных везикул, полученных, например, как результат по способу экстракции с использованием деоксихолата.
Дозировка NmB выражается в мкг белка. Предпочтительно, компоненты иммунной композиции/вакцины NmB могут быть получены из National Institute of Public Health Норвегии. Вакцина NmB/квасцы включает 0,05 мг/мл белка NmB, 3,33 мг/мл Аl(ОН)3 (квасцы) и 0,10 мг/мл тиомерсала натрия.
Компонент (с)
Предпочтительно, компонент (с) включает один или более из следующих:


(или белок, включающий иммуногенный фрагмент из одного или более данных SEQ ID, или белок, включающий последовательность, обладающую идентичностью по последовательности (предпочтительно выше 50%, например 60%, 70%, 80%, 90%, 95%, 99% или более) с одним из данных SEQ ID);
- белок, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88 и 90, описанных в WO 99/36544 (или белок, включающий иммуногенный фрагмент из одного или более данных SEQ ID, или белок, включающий последовательность, обладающую идентичностью по последовательности (предпочтительно выше 50%, например 60%, 70%, 80%, 90%, 95%, 99% или более) с одним из данных SEQ ID);








- белок, описанный на фигуре 4 или фигуре 13 WO 97/28273;
- белок, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-8, описанных в WO 96/29412 (или белок, включающий иммуногенный фрагмент из одного или более данных SEQ ID, или белок, включающий последовательность, обладающую идентичностью по последовательности (предпочтительно выше 50%, например 60%, 70%, 80%, 90%, 95%, 99% или более) с одним из данных SEQ ID);
- белок, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-23, описанных в WO 95/03413 (или белок, включающий иммуногенный фрагмент из одного или более данных SEQ ID, или белок, включающий последовательность, обладающую идентичностью по последовательности (предпочтительно выше 50%, например 60%, 70%, 80%, 90%, 95%, 99% или более) с одним из данных SEQ ID);
- белок, включающий аминокислотную последовательность, состоящую из SEQ ID NO: 2, описанной в WO 99/31132 (или белок, включающий иммуногенный фрагмент из SEQ ID NO: 2, или белок, включающий последовательность, обладающую идентичностью по последовательности (предпочтительно выше 50%, например 60%, 70%, 80%, 90%, 95%, 99% или более) с SEQ ID NO:2);
- полисахаридный антиген против Neisseria meningitidis серогруппы А;
- полисахаридный антиген против Neisseria meningitidis серогруппы Y;
- полисахаридный антиген против Neisseria meningitidis серогруппы W;
- полисахаридный антиген против Haemophilus influenzae;
- полисахаридный антиген против pneumococcus;
- противодифтерийный протективный антиген, состоящий из дифтерийного токсоида, такого как мутант CRM197 [например, Del Guidice et al. (1998) Molecular Aspects of Medicine 19: 1-70].
- Противостолбнячный протективный антиген, состоящий из столбнячного токсоида [например, Wassilak & Orenstein, Chapter 4 of Vaccines (eds. Plotkin & Mortimer), 1988].
- Противококлюшный протективный антиген, включающий коклюшный холотоксин (РТ) и волокнистый гемагглютинин (FHA); необязательно дополнительно включающий пертактин и/или агглютиногены 2 и 3 [например, Gustafsson et al. (1996) N. Engl. J. Med. 334: 349-355; Rappuoli et al. (1991) TIBTECH 9: 232-238].
- Протективный антиген против Н.pylori, включающий один или более СаgА (например, WO 93/18150), VacA (например, WO 93/18150), NAP (например, WO 99/53310), НорХ (например, WO 98/04702), HopY (например, WO 98/04702), уреазу.
- Протективный антиген против вируса гепатита В, состоящий из поверхностного антигена HBV и/или корового антигена HBV.
Там, где компонент (с) включает противодифтерийный антиген, он предпочтительно включает также антигены против столбняка и полиомиелита. Там, где компонент (с) включает противостолбнячный антиген, он предпочтительно включает также антигены против дифтерии и полиомиелита. Там, где компонент (с) включает антиген против полиомиелита, он предпочтительно включает также антигены против дифтерии и столбняка.
Коклюшный токсин является токсичным белком, и при присутствии его в компоненте (с), он предпочтительно подвергается детоксикации. Детоксикация может проводиться химическими и/или генетическими средствами. Предпочтительным детоксицированным мутантом является двойной мутант 9K/129G [например, Rappuoli et al. (1997) Nature Medicine 3: 374-376].
Там, где компонент (с) включает белок, который существует в разных незрелых и зрелых формах, предпочтительно применяется зрелая форма белка. Например, при включении NspA (WO 96/29412; см. также Martin et al. (1997) J. Exp. Med. 185 1173-1183) предпочтительно применяется зрелая форма белка, не содержащая сигнального пептида.
Там, где компонент (с) включает полисахаридный антиген, полисахарид предпочтительно конъюгируется с белком-носителем.
Компонент (с) не должен уменьшать иммунные ответы, возникающие в ответ на компоненты (а) и (b).
Фармацевтически приемлемый носитель
Композиции по изобретению могут также включать фармацевтически приемлемый носитель.
Носитель может быть органическим, неорганическим или и тем и другим. Подходящие носители хорошо известны специалистам в данной области и включают без ограничений большие, медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, липидные агрегаты (такие как масляные капельки или липосомы) и неактивные вирусные частицы. Фармацевтически приемлемые соли также могут быть использованы, например, минеральные кислые соли, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и тому подобные; и соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и тому подобные. Подробное обсуждение фармацевтически приемлемых наполнителей описано в Remington Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991). Фармацевтически приемлемые носители в композиции могут содержать такие жидкости, как воду, солевой раствор, глицерин и этанол. Дополнительно в таких переносчиках могут присутствовать такие вспомогательные вещества, как увлажняющие агенты или эмульгаторы, рН буферы и тому подобные. Обычно терапевтические композиции приготавливаются как готовые к введению, либо как жидкие растворы, либо как суспензии; твердые формы, подходящие для разведения в растворе или в суспензии, перед инъекцией также могут быть приготовлены жидкие переносчики. Липосомы включены в определение фармацевтически приемлемого носителя.
Носитель может также функционировать в качестве иммуностимулирующего агента, например, адъюванта. Подходящие адъюванты хорошо известны специалистам в данной области.
Предпочтительными носителями являются гидроксид алюминия (квасцы) и MF59.
Квасцы могут быть получены в Superfos, Bedbaek, Denmark и являются 3% раствором. Если присутствуют, то используются от ~1 мг до ~1,67 мг квасцов на дозу.
Когда компонент (с) включает антиген гепатита В, гидроксид алюминия предпочтительно не используется в качестве носителя (например, ЕР-А-0642355). Точно так же, когда компонент (с) включает полисахаридный конъюгат Н. influenzae, гидроксид алюминия предпочтительно не используется в качестве носителя (например, ЕР-А-0833662.). Вместо этого может использоваться фосфат алюминия.
MF59 является микроожиженной эмульсией сквалена в воде, которая, как было показано, безопасна и увеличивает ответы сывороточных антител на различные вакцины. MF59 включает приблизительно 5% сквалена, 0,5% Tween 80 и приблизительно 0,5% Span 85. Адъювант MF59 описан в WO 90/14837. MF59 может быть получен согласно способу, описанному, например, у Ott et а1. в Vaccine Design: The Subunit And Adjuvant Approach (1995, Powell and Newman, Eds., Plenum Press, New York, p.277-296); Singh et al. (1998) Vaccine 16, 1822-1827; Ott et al. (1995) Vaccine 13, 1557-1562; Valensi et al. (1994) J. Immunol. 153, 4029-39.
Другие носители-адъюванты, которые могут использоваться, включают такие рецептуры эмульсии масла в воде (с или без других таких специфичных иммуностимулирующих агентов, как мурамиловые пептиды или компоненты стенок бактериальных клеток), как, например (а) MF59, как описано выше (необязательно содержащая различные количества МТР-РЕ, хотя это не требуется) (b) SAF, содержащий 10% сквалена, 0,4% Tween 80, 5% блокированный плюроном полимер L121, и thr-MDP (см. ниже) либо микроожиженный до субмикронной эмульсии, либо центрифугированный до получения эмульсии частиц больших размеров, и (с) адъювантной системы Ribi™ (RAS), (Ribi Immunochem, Hamilton, MT), содержащей 2% сквалена, 0,2% Tween 80, и один или более компонентов стенок бактериальных клеток из группы, состоящей из монофосфолипида A (MPL), димиколата трегалозы (TDM), и скелет клеточной стенки (CWS), предпочтительно MPL+CWS (Detox™); (3) могут использоваться сапониновые адъюванты, такие как Stimulon™ (Cambridge Bioscience, Worcester, MA) или производные от него частицы, типа ISCOM (иммуностимулирующие комплексы); (4) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (5) такие цитокины, как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 и т.д.), интерфероны (например, гамма-интерферон), колониестимулирующий фактор макрофагов (M-CSF), фактор некроза опухоли (TNF) и т.д.; и (6) другие вещества, которые действуют в качестве иммуностимулирующих агентов для усиления эффективности композиции.
Как упомянуто выше, мурамиловые пептиды включают в качестве неограничивающих примеров N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-[1'-2'-дипалмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (МТР-РЕ) и т.д.
Иммуногенность
При использовании здесь термин "иммуногенный" относится к веществу, которое при введении позвоночным, включая человека, индуцирует продуцирование антител.
Композиции по изобретению обычно задействуют иммунологически эффективное количество компонентов (а), (b) и (с). То есть включается количество компонента (а), (b) или (с), которое в сочетании с любым присутствующим адъювантом вызывает у субъекта продуцирование специфичного и достаточного иммунологического ответа, предпочтительно Т или В лимфоцитарного ответа таким образом, чтобы обеспечить защиту от последующего воздействия Neisseria у субъекта.
"Иммунологически эффективное количество" является эффективным либо в единичной дозе, либо как часть серии доз для индукции продуцирования антител для лечения или профилактики заболевания. Это количество изменяется в зависимости от различных факторов, включая физическое состояние субъекта, и может без труда определяться специалистом в данной области.
Для единичной дозы не может быть определено никакого обозначения, которое представит определенное руководство для любого и каждого антигена, который может быть использован в данном изобретении. Эффективное количество антигена является функцией от присущей ему активности и чистоты и эмпирически определяется обычными специалистами в данной области посредством рутинного экспериментирования.
Иммуногенные композиции по настоящему изобретению обычно включают иммуностимулирующее количество антигена Neisseria. Иммуностимулирующее количество это такое количество, которое является достаточным для того, чтобы вызвать измеряемый гуморальный или клеточный иммунный ответ. Например, иммуногенные композиции по настоящему изобретению включают приблизительно от 1 нанограмма до приблизительно 1000 микрограммов антигена или от приблизительно 10 нанограммов до приблизительно 800 микрограммов антигена. В некоторых предпочтительных осуществлениях иммунологические композиции содержат - от приблизительно 0,1 до приблизительно 500 микрограммов антигена. В некоторых предпочтительных осуществлениях иммунологические композиции содержат от приблизительно 1 до приблизительно 350 микрограммов антигена. В некоторых предпочтительных осуществлениях иммунологические композиции содержат от приблизительно 25 до приблизительно 250 микрограммов антигена. В некоторых предпочтительных осуществлениях иммунологические композиции содержат приблизительно 100 микрограммов антигена. Специалисты в данной области могут без труда составить иммуногенную композицию, включающую любое желательное количество антигена, которое может быть определено эмпирически обычным специалистом в данной области посредством рутинного экспериментирования. Иммуногенные композиции могут быть удобно введены в единичной дозировочной форме и могут приготавливаться любым из способов, хорошо известных в фармацевтике, например, как описано в (Mack Pub. Co., Easton, PA, 1980).
Вакцины
Настоящее изобретение также направлено на вакцины, включающие любую из иммуногенных композиций, описанных выше.
В качестве используемого здесь термин "вакцина" означает иммуногенную композицию, которая способна вызывать противомикробный иммунный ответ. Предпочтительно, вакцины по настоящему изобретению вызывают бактерицидный гуморальный ответ.
Вакцины по настоящему изобретению могут быть либо профилактическими (т.е. для предотвращения инфицирования), либо терапевтическими (то есть лечить заболевание после инфицирования).
Изобретение также относится к способу индукции иммунного ответа по крайней мере к NmB и NmС или вакцинирования, включающего введение иммунологически эффективного количества иммуногенной композиции по изобретению. Введение может осуществляться человеку и может быть с использованием любого способа, известного специалистам в данной области, включая парентеральный, ректальный, внутрибрюшинный, внутримышечный или подкожный пути. Непосредственная доставка в общем случае выполняется инъецированием либо подкожно, внутрибрюшинно, внутривенно либо внутримышечно, либо доставкой в интерстициальное пространство ткани. Композиции могут также вводиться в повреждение. Другие способы введения включают оральное и легочное введение, свечки и трансдермальное или чрескожное введение (например, WO 98/20734), иглы и генные "ружья" или безыгольный шприц. Режим дозировки может представлять собой однократную дозу или многократные дозы.
Изобретение также относится к композициям по изобретению для использования в качестве лекарств. Дополнительно оно относится к использованию композиции по изобретению в производстве лекарств для лечения или профилактики инфицирования бактериями Neisseria.
В качестве альтернативы основанным на белках вакцинам может быть задействована вакцинация нуклеиновыми кислотами [например, Robinson & Torres (1997) Seminars in Immunology 9: 271-283; Donnelly et al. (1997) Annu Rev Immunol 15: 617-648]. Один или более белковых компонентов композиций по изобретению могут таким образом замещаться нуклеиновыми кислотами (предпочтительно ДНК), которые кодируют белок.
Способ производства
Изобретение относится к способу производства композиции по изобретению, включающей смешивание компонентов (а), (b) и (с).
Общее
Для осуществления настоящего изобретения, кроме отмеченных иным образом случаев, будут задействованы общепринятые способы молекулярной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые лежат в пределах практического опыта в данной области. Такие способы полно объясняются в литературе, например, Sambrook Molecular Cloning; A Laboratory Manual, Second Edition (1989); DKA Cloning, Volumes I and ii (D.N Glover ed. 1985); Oligonucleotide Synthesis (M.J.Gait ed, 1984); Nucleic Acid Hybridization (B.D.Hamcs & S.J.Higgins eds. 1984); Transcription and Translation (B.D.Hames & S.J.Higgins eds. 1984); Animal Cell Culture (R.I.Freshney ed. 1986); Immobilized Cells and Enzymes (IRL Press, 1986); В.Perbal, A Practical Guide to Molecular Cloning (1984); the Methods in Enzymology series (Academic Press, Inc.), especially volumes 154 & 155; Gene Transfer Vectors for Mammalian Cells (J.H.Miller and M.P.Calos eds, 1987. Cold Spring Harbor Laboratory); Mayer and Walker, eds. (1987), Immunochemical Methods in Cell and Molecular Biology (Academic Press, London); Scopes, (1987) Protein Purification: Principles and Practice, Second Edition (Springer-Verlag, N.Y.), и Handbook of Experimental Immunology, Volumes I-IV (D.M.Weir and C.C.Blackwell eds 1986).
Определения
В данном описании используются стандартные аббревиатуры для нуклеотидов и аминокислот.
Термин "включающий" означает "содержащий", так же как и "состоящий из", например, композиция, "включающая" X, может состоять исключительно из Х или может содержать что-нибудь дополнительно к X, такое как X+Y.
Идентичность между белками предпочтительно определяется по алгоритму поиска гомологии Смита-Уотермана (Smith-Waterman) как это осуществлено в программе MPSRCH (Oxford Molecular) с использованием поиска родственных вставок с параметрами штрафа за открытие вставки =12 и штрафа за продолжение вставки =1.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На всех чертежах группа А представляет собой данные за 28 дней после 1 инъекции и группа В представляет собой данные за 18 дней после 2 инъекции.
На фигуре 1 показаны геометрические средние титров антител IgG (КЕ (КU)/мл) против (1А) OMV NmB и (1В) капсулы NmC, как было определено при помощи ТИФА. * указана (1А) Р≤0,03 для группы 5 к группам 2 и 3, (1В) Р≤0,02 для группы 5 к группам 1 и 4.
На фигуре 2 показаны титры сывороточных бактерицидных антител (1/геометрическое среднее титра) к (2А) NmB и (2В) NmC. * указана Р≤0,003 для группы 5 к группе 2.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Изобретение в дальнейшем иллюстрируется при помощи следующих примеров, которые предназначены разъяснить изобретение. Представленные примеры предназначены для иллюстрирования изобретения, а не для его ограничения. Специалисты в данной области смогут определить модификации, которые находятся в пределах возможностей и объема изобретения.
Пример 1: Результаты ТИФА
Группы морских свинок (n=15 животных) получали одну из вакцин, указанных далее в таблице 1:
Восемьдесят морских свинок были случайным образом распределены в ряды групп, указанных выше, и получали одну из шести комбинаций вакцин. Что касается данных, представленных в таблице 2, каждое животное получало две инъекции, в/м, разделенные 28 днями. Образцы сыворотки получали перед каждой инъекцией и через 18 дней после второй инъекции. Что касается данных, представленных на фиг.1А и 1В, каждое животное получало две иммунизации, разделенные шестью неделями. Каждая доза содержала две в/м инъекции по 0,25 мл. Образцы сыворотки были получены непосредственно перед каждой инъекцией и через 14 или 18 дней после второй инъекции.
Образцы сыворотки исследовались по концентрациям антикапсулярных антител IgG к NmC (таблица 2 и фиг.1А) и по концентрациям антител IgG против везикул наружной мембраны (OMV) к NmВ при помощи ТИФА (фиг.1В). Данные ТИФА были получены в репрезентативном исследовании индивидуальных сывороток животных (таблица 2), и также выражались как средние арифметические значения для множества исследований (фиг.1А и 1В). Поэтому суммарные данные ТИФА в таблице 2 выражены как геометрические средние.
Для ТИФА конъюгат MCPS-ADH (дигидразид полисахарид-адипиновой кислоты NmC) или компоненты OMV наслаивались на полистиреновые планшеты для микротитрования в течение ночи при 4°С, 1 мкг/мл, 100 мкл/ячейка. В каждом наслоенном планшете 100 мкл/ячейка каждого из стандарта сравнения (то есть объединенной сыворотки морской свинки), положительный контроль, отрицательный контроль и образцы сывороток периодически двукратно растворялись в буфере, содержащем 75 мкМ тиоцианата аммония, и в течение двух часов инкубировались при комнатной температуре. Конъюгированное с пероксидазой кроличье антитело IgG против морской свинки добавляли в ячейки (100 мкл/ячейка). Через 2 часа добавляли колориметрический субстрат 3, 3′, 5, 5′ тетраметилбензидин (ТМВ) (100 мкл/ячейка), и окрашивание проявлялось в течение 15 минут. Уровни антител для MCPS и для OMV, присутствующие в контролях и образцах, получали по стандартным кривым с использованием стандартов сравнения, которые имеют установленное значение 100 ТИФА единиц/мл. Результаты показаны в таблице 2 и на фигурах 1А и 1В.
Результаты, суммированные в таблице 2 и на фигурах 1А и 1В, показывают, что комбинированная вакцина была иммуногенной, что было измерено по титрам антител IgG NmB и NmC соответственно.
На фигуре 1А показано, что специфический гуморальный ответ против менингококка В был индуцирован комбинациями вакцин, включающих NmB. На фигуре 1В показано, что специфический гуморальный ответ против менингококка С был индуцирован комбинациями вакцин, включающих NmC. В частности, гуморальный ответ, индуцированный комбинацией конъюгата NmC и NmB в присутствии адъюванта MF59 (группа 5), был значительно выше, чем гуморальный ответ, индуцированный только конъюгатом NmC (группа 1), либо комбинацией конъюгата NmC и NmB в присутствии квасцов (группа 4). Когда присутствовал адъювант MF59, титр антитела для комбинированной вакцины увеличивался приблизительно в шесть раз.
Пример 2: Бактерицидные титры
Образцы сыворотки тестировались по комплемент-опосредованным титрам к штамму 60Е MenС и штамму 44/76 MenB. Бактерицидные титры исследовались на объединенной сыворотке из каждой группы. Бактерицидные данные были получены с использованием человеческого комплемента.
Компоненты по исследованию (то есть, буфер, антитело, комплемент и бактерия) добавлялись в стерильные в 96-луночные планшеты с крышками для культуры ткани (Nunc # 167008). Во время исследования планшеты хранились при комнатной температуре. В каждую ячейку последовательно добавляли 50 мкл буфера Джея (Gey) (Gibco), содержащего 1% RIA Grade BSA (Sigma), 25 мкл разбавленного тестового антитела, 25 мкл бактерий, разведенных в соотношении 1:8000 в буфере Джея (Gey)/1% BSA. Контрольные ячейки включали 1) буфер Джея (Gey)/1% BSA и только бактерию (для того, чтобы определить, жизнеспособны ли организмы только в растворителе); 2) контроль времени 0, содержащий 75 мкл буфера, 25 мкл инактивированного нагреванием (56°С, 30 минут) человеческого комплемента и 25 мкл бактерии; 3) контроль на токсичность, тестирующий комплемент при 20% и 40% буфере и бактерии, для того, чтобы проверить, что источник комплемента является нетоксичным для тестируемого штамма. Для того чтобы показать, что увеличение колониеобразующих единиц (KОЕ (cfu)) в присутствии антитела является зависимым от комплемента, все образцы антител (при самой высокой исследуемой концентрации) также тестировались с инактивированным нагреванием комплементом. После того, как все реагенты были добавлены, 22 мкл забиралось из каждой контрольной ячейки и помещалось на чашку с агаром Мюллера-Хинтон (Mueller-Hinton), позволяя образцу перетекать сверху донизу, чтобы определить KОЕ в ячейке при 0 минут. Планшеты для микротитрования затем накрывались и запечатывались парафином и аккуратно вращались в течение 1 часа при 37°С в инкубаторе с 4% CO2. Затем планшеты вынимались, и 22 мкл образца из каждой ячейки переносилось на агар Мюллера-Хинтон (Mueller-Hinton). Планшеты с культурой инкубировались приблизительно в течение 18 часов при 37°С с 4% СО2. Колонии пересчитывались, и % выживаемости определялся для каждой тестируемой ячейки: % выживаемости = ([KОЕ в ячейке с образцом за 60 минут]/[KОЕ в контрольной ячейке с инактивированным нагреванием комплементом при 0 минут])×100. Приводимые бактерицидные титры являются титрами, которые были получены при 50% выживаемости. Результаты одного эксперимента представлены в таблице 3. Результаты также представлены на фигурах 2А и 2В, причем на фигуре 2В представлены средние арифметические значения титров множества экспериментов.
Как показали результаты, суммированные в таблице 3, комбинированная вакцина вызывает высокие титры сывороточных бактерицидных антител как для NmВ, так и для NmC. Титр бактерицидного антитела NmC был немного выше для комбинированной вакцины, использующей MF59 в качестве носителя, но не было существенного влияния на бактерицидный титр NmB с использованием MF59. Интересно, что от двух до пяти раз более высокие бактерицидные титры NmB были получены для комбинированной вакцины, чем для одной вакцины NmB. На фигуре 2А продемонстрировано, что направленные на менингококк В антитела, индуцированные с использованием комбинаций вакцин, включающих NmB, были бактерицидными. На фигуре 2В продемонстрировано, что направленные на менингококк С антитела, индуцированные с использованием комбинаций вакцин, включающих конъюгат NmC, также были бактерицидными.
Пример 3: Сравнение квасцов и адъювантов MF59
Сравнивали сыворотки животных, описанных выше на фигурах 1А и 1В, и определяли гуморальные ответы МеnС и МеnВ, вызванные при использовании NmB/NmC conj. или с квасцами, или с адъювантом MF59, как описано выше в примерах 1 и 2. Результаты показаны в таблице 4.
Эти данные демонстрируют, что гуморальный ответ на менингококк С был приблизительно в шесть раз больше для вакцин, включающих адъювант MF59.
Пример 4: Сравнение ответов, вызванных при использовании комбинации к моновалентным вакцинам
Сравнивали сыворотки животных, описанных выше на фигурах 1А и 1В, и гуморальные ответы МеnС и МеnВ, вызванные при использовании NmB/NmC conj., сравнивали с гуморальными ответами, вызванными или только вакциной NmB, или только NmC conj. с квасцами, как описано выше в примерах 1 и 2. Результаты показаны в таблице 5:
Эти данные демонстрируют, что не существует значимого различия в гуморальных ответах на компоненты вакцины NmB/NmC conj. по сравнению с ответами, индуцированными при использовании моновалентных вакцин (или NmB, или NmC conj.).
Пример 5: Добавление дополнительных антигенов
Комбинация NmB/NmC conj. в дальнейшем расширялась при добавлении антигенов против других патогенных организмов (например, NspA, HBsAg). Хороший иммунный ответ наблюдался против NmB/NmC и против дополнительных антигенов.
Пример 6: Смеси антигенов NmВ и NmС
Для иммунизации мышей использовалась трехвалентная смесь белков штамма 2996 MenB "919" (например, фигура 23 из WO 99/57280 и SEQ ID NO: 3069-3074 отсюда), "287" (например, фигура 21 из WO 99/57280; также SEQ ID NO: 3103-3108 отсюда) и "ORF1" (например, пример 77 из WO 99/24578; см. также WO 99/55873). Данный экперимент повторялся с добавлением конъюгата NmC. Гидроксид алюминия был использован в качестве адъюванта.
Измеренные в бактерицидном исследовании титры против гомологичного штамма и также гетерологичного штамма МеnВ были следующими (табл.6):
Очевидно, что данное применение описывает изобретение только посредством примера и могут быть сделаны модификации, остающиеся пока в пределах возможностей и объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ АНТИГЕНЫ Neisseria meningitidis ИЗ СЕРОГРУПП В И С, И ДОПОЛНИТЕЛЬНЫЙ АНТИГЕН | 2000 |
|
RU2508122C2 |
| КОМПОЗИЦИИ МЕНИНГОКОККОВЫХ ВАКЦИН С АДЪЮВАНТАМИ | 2002 |
|
RU2360699C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТРАНСФЕРРИН-СВЯЗЫВАЮЩИЙ БЕЛОК И HSF ИЗ ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ | 2003 |
|
RU2359696C2 |
| МЕНИНГОКОККОВЫЕ ПОЛИПЕПТИДЫ fHBP | 2009 |
|
RU2475496C2 |
| МЕНИНГОКОККОВЫЕ ПОЛИПЕПТИДЫ fHBP | 2012 |
|
RU2567003C2 |
| ГИБРИДНАЯ И ТАНДЕМНАЯ ЭКСПРЕССИЯ БЕЛКОВ НЕЙССЕРИЙ | 2002 |
|
RU2475495C2 |
| УСОВЕРШЕНСТВОВАНИЯ, КАСАЮЩИЕСЯ ВЕЗИКУЛ ВНЕШНЕЙ МЕМБРАНЫ МЕНИНГОКОККОВ | 2005 |
|
RU2420312C2 |
| СПОСОБ ОЧИСТКИ БАКТЕРИАЛЬНОГО КАПСУЛЯРНОГО ПОЛИСАХАРИДА NEISSERIA MENINGITIDIS ИЛИ HAEMOPHILUS INFLUENZAE И СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ | 2002 |
|
RU2381814C2 |
| НАБОР ДЛЯ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ ПРОТИВ Neisseria meningitidis СЕРОЛОГИЧЕСКОЙ ГРУППЫ В | 2008 |
|
RU2498815C2 |
| КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2665841C2 |
Настоящее изобретение относится к области биотехнологии и иммунологии. Предложена композиция, обладающая иммуногенной активностью в отношении серогрупп В и С Neisseria meningitidis, содержащая иммуногенное количество олигосахарида Neisseria meningitidis серогруппы С, внешнемембранного белка наружной мембраны Neisseria meningitidis серогруппы B в виде протеолипосомных везикул и белка из Neisseria. Аминокислотная последовательность указанного белка приведена в описании. Использование изобретения обеспечивает высокие ELISA титры и бактерицидные титры сыворотки, что может найти применение в качестве протективной вакцины в отношении серогрупп В и С Neisseria meningitidis. 5 з.п. ф-лы, 4 ил., 6 табл.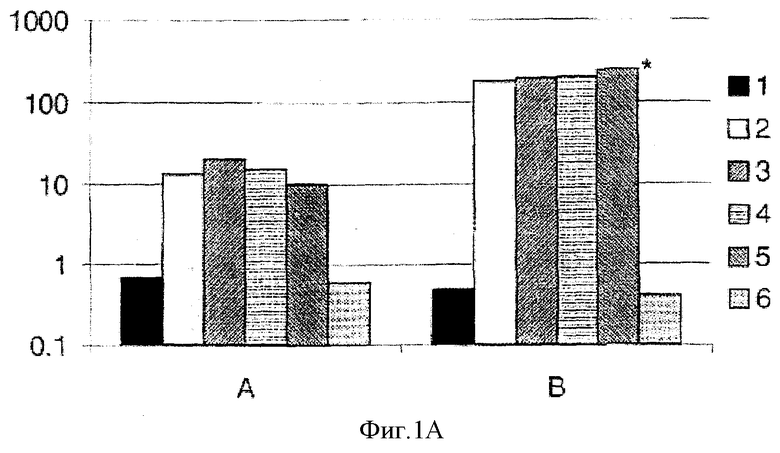
1. Композиция, обладающая иммуногенной активностью в отношении серогрупп В и С Neisseria meningitidis, содержащая иммуногеннное эффективное количество (а) олигосахарида NmC, (b) внешнемембранного белка NmB в виде протеолипосомных везикул; и (с) белка, содержащего (i) аминокислотную последовательность, выбранную из SEQ ID NO: 1200, 1202, или 1204, (ii) иммуногенный фрагмент указанной последовательности, или (iii) последовательность, которая на 80% идентична указанной последовательности SEQ ID NO: 1200, 1202, или 1204, и, необязательно, фармацевтически приемлемый носитель.
2. Композиция по п.1, где компонент (а) конъюгирован с носителем.
3. Композиция по п.2, где носителем является белок.
4. Композиция по п.3, где носителем является CRM197.
5. Композиция по любому предшествующему пункту, дополнительно содержащая гидроксид алюминия или MF59.
6. Композиция по любому из предшествующих пунктов для применения в качестве вакцины против серогрупп В и С Neisseria meningitidis.
| Granoff et al, "MF59 Adjuvant Enhances Antibody Responses of Infant Baboons Immunized with Haemophilius influenzae Type b and Neisseria meningitidis Group С Oligosaccharide-CRM197 conjugate Vaccine", Infect, and Immunity, 1997 May; 65 (5) pp.1710-1715 | |||
| Wedege et al., Immune Responses against Major Outer Membrane antigens of Neisseria meningitidis |
Авторы
Даты
2009-07-20—Публикация
2000-11-29—Подача