Настоящее изобретение относится к растворимым и стабилизированным тримерным формам гликопротеина оболочки HIV-1 gp41 и их применению в качестве вакцинного средства.
Вирус иммунодефицита человека типа 1 (HIV-1) кодирует предшественник гликопротеина оболочки массой 160 кДа (gp160), протеолитически расщепляемый на наружный (gp120) и трансмембранный (gp41) гликопротеины.
В зрелой гликопротеиновой оболочке гликопротеин gp120 остается ассоциированным с концевым доменом gp41 посредством нековалентного взаимодействия. Природные гликопротеины оболочки HIV-1 существуют в виде тримеров, содержащих три субъединицы gp120 и три - gp41 и заякорены в мембрану вируса или инфицированной клетки посредством трансмембранного участка gp41.
Показано, что связывание gp120 с рецептором CD4 индуцирует конформационные изменения, приводящие к последующему взаимодействию с одним из ряда рецепторов хемокинов (CXCR4, CCR5…). Эти события связывания запускают конформационные изменения gp41. В частности, исследования рентгеноструктурной кристаллографией и ядерно-магнитным резонансом показывают, что гликопротеин оболочки gp41 существует, по меньшей мере, в трех конформациях, нативной конформации (шипа), пре-сливающей неустойчивой конформации, которая переходит в термостабильную сливающую конформацию «тройной шпильки» после запускающего события, такого как связывание вирусной частицы HIV с мембраной клеток-мишеней.
Таким образом, связывание gp120 с клеточными корецепторами индуцирует переход gp41 из пре-сливающей формы в сливающую форму.
Линейная организация gp41 включает в себя пептид слияния, эктодомен (N-концевую суперспираль, участок связанной дисульфидными мостиками петли и C-концевой α-спиральный отрезок) и трансмембранный домен.
В сливающем 6-спиральном узле три N-концевых спирали формируют тримерную суперспираль и три C-концевых спирали упакованы в обратном направлении в три гидрофобные бороздки на поверхности суперспирали. Такая спирально-шпилечная структура соответствует конформации gp41 со сливающей активностью. Поскольку мембранный якорь и пептид слияния эктодомена gp41 внедрены в мембраны вируса и клетки-мишени соответственно, формирование сливающей шпилечной структуры приводит к колокализации двух мембран и таким образом преодолевает энергетический барьер для слияния мембран.
Гликопротеины оболочки представляют собой единственную реалистичную вирусную мишень для индуцированных вакциной ответов нейтрализующих антител, поскольку они способствуют слиянию вирусной мембраны посредством опосредованного рецептором конформационного изменения и они экспрессированы на поверхности как вириона, так и инфицированной клетки. Изначально главными кандидатами для вакцины считали мономерный gp120 HIV-1 и его производные. Однако gp120 HIV-1 является высоковариабельным и неоднократно показана его иммуногенная неэффективность для индукции нейтрализующих антител против клинических изолятов HIV-1. Немногие из антител, индуцированных мономерами gp120, эффективно связывают собранные тримеры гликопротеинов оболочки HIV-1.
Напротив, gp41 представляет собой чрезвычайно иммуногенный гликопротеин, индуцирующий антитела, по существу, у всех HIV-инфицированных индивидуумов.
Эктодомен gp41 является наиболее консервативным участком оболочки HIV-1, которая во всем остальном демонстрирует значительное генетическое разнообразие, даже между близкородственными изолятами.
Кроме того, gp41 играет критическую роль в поддержании структуры и инфекционности вириона HIV.
Антитела, направленные против структур шестиспирального пучка (сливающая форма) и пре-шпильки (пре-сливающая форма) в определенных условиях останавливают слияние. Антитела, имеющие доступ к конформациям пре-шпильки и шестиспирального пучка gp41, будут способны ингибировать gp41-опосредованное слияние. Кроме того, шестиспиральный пучок является чрезвычайно стабильной структурой.
Эти наблюдения позволяют считать шестичленную спираль gp41, в модифицированной форме или нет, привлекательной мишенью для развития лекарственных средств и вакцины.
В US 6455265 авторы изобретения показали, что некоторые производные gp41 могут являться особенно эффективными для получения вакцины для предупреждения патогенного эффекта, связанного с ретровирусной инфекцией, при условии, что соответствующие полипептиды имеют эпитопы с модифицированной антигенностью, так чтобы получать отличающийся иммунный ответ по отношению к вирусной оболочке и некоторым собственным белкам.
Более точно, они обнаружили, что консервативные и иммунодоминантные участки оболочки ретровируса могут отвечать за опасный феномен аутоиммунности, особенно в случае ретровирусной оболочки gp41. Авторы изобретения наблюдали, что определенные иммунодоминантные участки gp41 демонстрируют трехмерные структурные аналогии и/или перекрестную реактивность с определенными участками белка иммунной системы человека и, в особенности, IL-2.
Таким образом, они предложили модифицированные полипептиды, полученные модификацией антигенности интересующего эпитопа белка оболочки, чтобы получить отличающийся иммунный ответ по отношению к вирусному белку оболочки и этим белкам иммунной системы человека.
Как правило, gp41 можно получить в бакуловирусе или клетках млекопитающих, но выход ниже, чем в E. coli. Более того, гликозилирование в бакуловирусе или клетках млекопитающих отличается от гликозилирования в клетках человека и не является необходимым для иммуногенности белка. Gp41, в сущности, является очень иммуногенным без гликозилирования.
Однако рекомбинантный эктодомен gp41 HIV, полученный в Escherichia coli, при нейтральном pH формирует нерастворимые преципитаты (агрегаты тримерной формы gp41).
Настоящее изобретение более точно направлено на предложение стабилизированных водорастворимых форм белка gp41, в частности производных белка gp41, и еще более конкретно, производных, как раскрыто в US 6455265.
Авторы изобретения неожиданно обнаружили, что возможно значительно уменьшить гидрофобность петли, получив улучшение растворимости рекомбинантного эктодомена gp41 HIV, без изменения его иммуногенной реактивности.
Соответственно, в одном аспекте изобретения предоставлен модифицированный полипептид, содержащий, по меньшей мере, иммунодоминантный участок и соединяющую петлю между N- и C-концевыми спиралями эктодомена gp41 HIV-1, где соединяющая петля включает в себя, по меньшей мере, линкерный фрагмент, обладающий:
- размером, подходящим для поддержания нативной конформации взаимодействия между N- и C-концевыми спиралями, и
- гидрофильностью, достаточной для обеспечения растворимой и стабильной тримерной формы указанного модифицированного полипептида.
В значении по настоящему изобретению выражение «поддержание нативной конформации взаимодействия между N- и C-концевыми спиралями» понимают как означающее, что взаимодействие между N- и C-концевыми спиралями модифицированного полипептида gp41 функционально подобное или одинаковое с взаимодействием данных спиралей в полипептиде gp41 дикого типа.
В одном варианте осуществления по изобретению линкерный фрагмент включен в петлю взамен всего или части делетированного олигопептида дикого типа.
В другом варианте осуществления по изобретению делетированный олигопептид дикого типа локализован в области от 598 до 622, в частности в области от 603 до 615 белка gp41, в соответствии с нумерацией по SEQ ID NO: 1 (фиг.2A).
В другом варианте осуществления по изобретению делетированный олигопептид локализован в области от 525 до 549, в частности в области от 530 до 542, в соответствии с нумерацией по SEQ ID NO: 14 (фиг.3).
В дополнительном варианте осуществления по изобретению делетированный олигопептид дикого типа состоит из последовательности, по меньшей мере из 10, в частности из 13, и, более конкретно, из 25 аминокислотных остатков.
В другом варианте осуществления линкерный фрагмент представляет собой олигопептидный линкер, основанный преимущественно на гидрофильных аминокислотных остатках.
В еще одном варианте осуществления по изобретению олигопептидный линкер состоит из последовательности SGGRGGS, как изложено в SEQ ID NO: 2.
По второму аспекту изобретения предоставлен полинуклеотид, кодирующий модифицированный полипептид, как раскрыто выше.
По третьему аспекту изобретения предоставлен экспрессирующий вектор, содержащий следующие функционально связанные элементы: промотор транскрипта, фрагмент ДНК, кодирующий модифицированный полипептид, как раскрыто выше, и терминатор транскрипта.
По четвертому аспекту изобретения предоставлена вакцина для предотвращения патогенного эффекта, связанного с ретровирусной инфекцией, включающая в себя в качестве активного вещества, по меньшей мере, один модифицированный полипептид, как раскрыто выше.
Определения, данные выше, подразумевают, что применяемый полипептид содержит, по меньшей мере, часть иммунодоминантного участка белка оболочки вируса HIV-1 gp41.
Модифицированный полипептид по настоящему изобретению может представлять собой, например, целый белок оболочки HIV-1, модифицированный, как указано ниже. Модифицированный полипептид может являться также частью белка оболочки, модифицированного, как указано ниже, где указанная часть содержит, по меньшей мере, один иммунодоминантный фрагмент, как указано ниже. Модифицированный полипептид может также представлять собой химерный белок, содержащий, по меньшей мере, часть белка оболочки, где указанная часть белка оболочки является такой, как описано выше.
Пептидная последовательность участка 545-684 (SEQ ID NO: 1), воспроизведенная в прилагаемой фиг.2A, представляет собой консенсусную последовательность (штамм 32 HIV-1 в SWISS PROT).
Последовательность, представленная на фиг.3, SEQ ID NO: 14, получена из последовательности gp41 штамма HxB2 вируса HIV (SWISS PROT CODE: ENV HV 1 BR), где аминокислотные остатки цистеина в положениях 530 и 536 заменены на аминокислотные остатки серина. Иммунодоминантный участок относится к пептидной последовательности, индуцирующей в огромном большинстве случаев (например, по меньшей мере, примерно в 7 случаях из 10) гуморальный и/или клеточный ответ иммунной системы, направленный против указанного участка после иммунизации белком, содержащим указанную последовательность, или пептидом, по существу, состоящим из указанной последовательности.
В настоящей заявке, когда ссылаются на иммунный ответ без любой другой конкретной информации, он представляет собой иммунный ответ позвоночного после иммунизации in vivo.
Изобретение ссылается на клетки-мишени вируса, которые представляют собой клетки, в которые вирус способен проникать. Клетки-мишени ретровирусов широко известны. Вирусы обладают свойством связываться с клетками, которые они способны инфицировать. Таким образом, не обязательно, можно проверить клетки-мишени изучаемого вируса с применением общепринятых экспериментов in vitro.
Изобретение ссылается также на клетки хозяина, имеющие мембранный рецептор для белка хозяина. Клетки хозяина, имеющие рецептор для белка указанного хозяина, часто известны, и, в противном случае, возможно с применением общепринятых экспериментов определить, связывается ли данный белок с определенным типом клеток. Например, возможно применять меченный радиоактивным изотопом белок, чтобы определить, связывается ли он с указанным типом клеток. Возможно также проверить, связывается ли белок с данным мембранным рецептором, с применением линии клеток, трансфицированной геном, экспрессирующим указанный мембранный рецептор.
Белки хозяина, мембранным рецептором для которых обладают определенные клетки хозяина, в основном, являются белками, принадлежащими к ряду растворимых белковых медиаторов. Данный ряд включает в себя белки, называемые, в зависимости от случаев, гормонами, факторами роста или цитокинами, хотя не существует определенной границы между данными разными категориями медиаторов; смотри, например, CAVAILLON J. M. , Les Cytokines (Masson, Paris, 1966), часть 1, страницы 1-3 и предисловие.
Линкерный фрагмент, рассматриваемый по изобретению, обладает общим гидрофильным характером и является неиммуногенным или слабоиммуногенным и гибким.
Он является синтетическим линкером и, более конкретно, он является олигопептидным линкером.
Как применяют здесь, «гибкий» линкер представляет собой такой, у которого отсутствует, главным образом, стабильная высокоупорядоченная конформация в растворе. Следует избегать областей локального заряда. Как правило, предпочтительнее маленькие, полярные и гидрофильные остатки, а объемные и гидрофобные остатки нежелательны. Если линкерный полипептид включает в себя заряженные остатки, их обычно располагают так, чтобы получать результирующий нейтральный заряд внутри небольшого участка полипептида. Таким образом предпочтительнее располагать заряженный остаток рядом с остатком противоположного заряда.
Как правило, предпочтительные остатки для включения в линкерный полипептид включают в себя Gly, Ser, Ala, Thr, Asn и Gln; более предпочтительные остатки включают в себя Gly, Ser, Ala и Thr и наиболее предпочтительными остатками являются Gly и Ser. Как правило, следует избегать остатков Phe, Tyr, Trp, Cys, Pro, Leu, Ile, Lys и Arg, остатков Cys из-за их способности формировать нежелательные дисульфидные связи, остатков Pro из-за их гидрофобности и отсутствия гибкости и остатков Lys и Arg из-за риска возможной иммуногенности.
Подходящий линкер можно представить последовательностью SEQ ID NO:2, представленной на фиг.2С.
Данный линкерный фрагмент включен в петлю взамен остатков дикого типа.
Делегированный олигопептид дикого типа может обладать или нет такой же длиной, как и линкерный олигопептид.
В конкретном варианте осуществления делегированный олигопептид дикого типа короче, чем линкерный фрагменг.
В другом конкретном варианте осуществления делегированный олигопептид дикого типа длиннее, чем линкерный фрагмент.
В еще одном конкретном варианте осуществления они одинаковой длины.
Олигопептиды дикого типа, которые можно преимущественно заменять на линкер по настоящему изобретению, представлены на SEQ ID NO:15 и SEQ ID NO:16 (фиг.2D) и представляют собой соответственно последовательности между положениями 603 и 615 и между положениями 598 и 622 SEQ ID NO:1 и последовательности олигопептидов между положениями 530-542 и между положениями 525-149 SEQ ID NO:14.
В конкретном варианте осуществления модифицированный полипептид по настоящему изобретению включает в себя, кроме того, по меньшей мере, одну мутацию в иммунодоминантном участке.
Иммунодоминантные участки, антигенность которых желательно модифицировать по изобретению, можно выбирать из дающих in vitro перекрестную реакцию B-типа и/или T-типа с белком хозяина, в частности с IL-2.
В прилагаемой фиг.2B представлены пептидные последовательности четырех участков данной области gp41 555-577 (SEQ ID NO: 3), 572-601 (SEQ ID NO: 4), 590-620 (SEQ ID NO: 5) и 628-663 (SEQ ID NO:6), для которых отмечали структурные аналогии и/или перекрестные реакции с IL-2. Данные участки найдены по гомологии в SEQ ID NO: 14 и соотносятся, соответственно, с пептидными последовательностями, обнаруженными в положениях 482-504, 499-529, 517-547 и 555-590.
Таким образом, в другом аспекте по изобретению предоставлен модифицированный полипептид, как раскрыто здесь выше, включающий, кроме того, по меньшей мере, одну мутацию в иммунодоминантном участке для предотвращения перекрестной реакции B-типа и/или T-типа с белком хозяина, в частности с IL-2 человека.
Особенно интересны модифицированные полипептиды по изобретению, кроме того, включающие мутацию, по меньшей мере, в одном иммунодоминантном участке, представленном пептидной последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и/или SEQ ID NO: 6.
В настоящей заявке «мутация» относится к любой модификации участка (не обязательно, уменьшенного до одного аминокислотного остатка) полипептида физическими способами, химическими способами (ковалентной или нековалентной модификацией) и/или биологическими способами (мутациями посредством замены, делеции и/или вставки одной или нескольких аминокислот), приводящей к модификации функциональных возможностей составляющей аминокислоты (аминокислот) указанного участка, обозначенного «мутированный участок». В качестве примера, возможно вносить мутации, приводящие к уничтожению, приобретению и/или модификации свойств дисульфидных мостиков, водородных связей, электростатических взаимодействий и/или гидрофобных взаимодействий, модификации способности белка формировать гетерокомплекс или, в качестве альтернативы, в случае олигомерного белка, модификации состояния олигомеризации или стабильности олигомера.
Некоторые мутации, имеющие значение для воздействия на антигенность, раскрыты в US 6455265, идея которого полностью включена сюда в качестве ссылки.
Модифицированный полипептид по настоящему изобретению представлен, в частности, SEQ ID NO: 8 на фиг.1. Данный модифицированный полипептид получен из SEQ ID NO: 14, где последовательность олигопептида между положениями 531-542 заменена на линкер, соответствующий SEQ ID NO: 2 (фиг.2C), и последовательность олигопептида между положениями 597-607 заменена на His-таг. В данных последовательностях дополнительная мутация внесена в положении 528 (нумерация согласно SEQ ID NO:14), где остаток триптофана заменен на аминокислотный остаток аспартата.
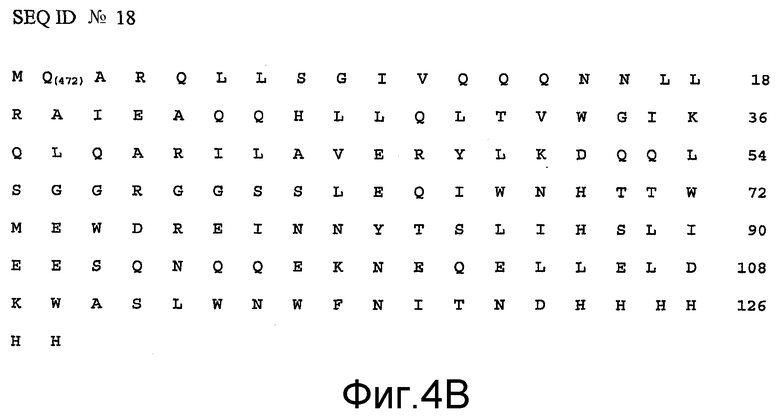
Другие полипептидные последовательности, иллюстрирующие настоящее изобретение, представлены на SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20 (фиг.4 и 5).
В другом конкретном варианте осуществления по настоящему изобретению модифицированный полипептид gp41 может также включать в себя модификацию, такую как усечение части аминокислотной последовательности на N- или C-концах.
В преимущественном варианте осуществления модифицированный полипептид gp41 усечен на N-конце.
Без намерения быть связанными какой-либо теорией, авторы изобретения выдвинули гипотезу, что такие модификации полипептида позволяют некоторым C-концевым пептидным последовательностям не являться, например, полностью или частично замаскированными, в частности, на C-конце, который, таким образом, является более доступным для антител.
Более конкретно, модифицированный полипептид gp41 представляет собой усеченный с N-конца олигопептид. Длина делеции имеет размер в пределах от 8 до 15 аминокислотных остатков, пронумерованых по SEQ ID NO: 1.
Более предпочтительно, модифицированный полипептид gp41 усечен, по меньшей мере, на 10, в частности, по меньшей мере, на 12 аминокислотных остатков в N-концевом положении.
Иллюстративная полипептидная последовательность, показывающая N-концевое усечение и замену олигонуклеотидной последовательности в последовательности петли на линкер (SED ID NO: 2) по настоящему изобретению, представлена, в частности, последовательностью SEQ ID NO: 21 (фиг.6).
В другом конкретном варианте осуществления по изобретению можно вносить, помимо модификаций в петле, выполненных для улучшения растворимости и модификаций для улучшения антигенности полипептида gp41, дополнительные модификации для улучшения растворимости.
В качестве конкретного варианта осуществления таких модификаций может быть указана мутация аминокислотного остатка, как, например, замена остатка триптофана в положении 528 (нумерация по SEQ ID NO: 14) более гидрофильным аминокислотным остатком, таким как аспартат.
Другие подобные мутации проиллюстрированы модифицированными полипептидами gp41, представленными на SEQ ID NO: 17 и SEQ ID NO: 19, где триптофан в положении 124 в SEQ ID NO: 17 и 130 в SEQ ID NO: 19, соответствующий триптофану в положении 685 SEQ ID NO: 1 (не представленному в данной последовательности), заменен на аспартат.
Такие мутации выполняют с целью замены гидрофобных аминокислотных остатков более гидрофильными аминокислотными остатками.
Другими модификациями, улучшающими растворимость модифицированного полипептида gp41, могут являться делеция или вставка аминокислотных остатков.
В качестве конкретного варианта осуществления таких модификаций можно указать делецию аминокислотных остатков, например делецию аминокислотных остатков триптофана и лейцина, соответственно, в положениях 122 и 123 SEQ ID NO: 17, и в положениях 128 и 129 SEQ ID NO: 19, дающих последовательности, соответственно, представленные на SEQ ID NO: 18 и SEQ ID NO: 20.
Кроме того, без отклонения от границ настоящего изобретения модифицированные полипептиды по настоящему изобретению могут содержать дополнительные модификации, полезные для лабораторных экспериментов, такие как слияние с His-тагом или флуоресцентным белком, как, например, зеленый флуоресцентный белок.
Иллюстративные модифицированные полипептиды gp41 по настоящему изобретению, несущие дополнительные модификации, такие как His-таг, представлены на SEQ ID NO: 8, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20 и SEQ ID NO: 21 (фиг.1, 4-6). His-таг добавляли к C-концу данных пептидов.
Для получения модифицированного полипептида по изобретению можно применять любые известные способы пептидного синтеза или способы генной инженерии, такие как описаны в Molecular cloning: a laboratory manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 2001.
Возможно выделить или получить полинуклеотидную последовательность, кодирующую, по меньшей мере, часть gp41 оболочек HIV-1, и, если желательно, на этой стадии возможно введение в нуклеотидную последовательность линкера и, не обязательно, мутаций, обеспечивающих возможность получения мутированного продукта трансляции, представляющего собой модифицированный полипептид.
Возможно также напрямую синтезировать модифицированную полинуклеотидную последовательность, содержащую одну или несколько мутаций, кодирующих модифицированный полипептид. Полученные таким образом полинуклеотидные последовательности вводят известным способом в подходящий вектор, предоставляющий возможность экспрессировать указанный полипептид, не обязательно, в модифицированной форме. Таким вектором является, например, вектор для E. Coli, бакуловирус или вектор для клетки млекопитающих. Возможно также вносить мутацию в немодифицированный полипептид, полученный по одному из предшествующих способов.
Таким образом, настоящее изобретение относится также к молекулам полинуклеотидов, включая молекулы ДНК и РНК, кодирующим модифицированные полипептиды, описанные выше.
Полинуклеотиды по настоящему изобретению включают в себя как одноцепочечные, так и двухцепочечные молекулы. Типичная последовательность ДНК представлена на SEQ ID NO: 7 на фиг.1.
Дополнительные последовательности ДНК, кодирующие модифицированные полипептиды, могут быть легко получены специалистами в данной области на основе генетического кода. Эквивалентные последовательности РНК можно получить посредством замены T на U. Специалистам в данной области абсолютно понятно, что ввиду вырожденности генетического кода возможна значительная изменчивость молекул полинуклеотидов, кодирующих модифицированные полипептиды.
Объектом изобретения является также применение модифицированного полипептида, как определено выше, в получении композиции вакцины для предупреждения патогенных воздействий, связанных с инфекцией хозяина ретровирусом HIV-1.
Таким образом, модифицированный полипептид, полученный по изобретению, может служить иммуногенным веществом, чтобы индуцировать посредством иммунизации формирование антител, которые можно применять, в частности, в лечении ретровирусных инфекций, таким образом, изобретение также относится к антителам, полученным в ответ на иммунизацию животных (включая человека) in vivo с помощью вакцинного средства, содержащего модифицированный полипептид, как описано выше.
Фармацевтические композиции, содержащие такие антитела, также составляют один из объектов изобретения.
Специалистам в данной области известно, что существуют различные штаммы вирусов HIV и, следовательно, различные гомологичные формы белков gp41.
Специалистам в данной области известно также, что, зная различные гомологичные последовательности данного пептида или белка, можно рассчитать консенсусные последовательности такого пептида или белка, демонстрирующие аминокислотные остатки, наиболее часто присутствующие в таком белке или пептиде.
Следовательно, не выходит за пределы настоящего изобретения осуществление подобного конструирования петли и других описанных модификаций посредством их адаптации для модификации конкретной изоформы белка gp41 или для модификации консенсусной последовательности.
Настоящее изобретение иллюстрируют следующими неограничивающими примерами.
Пример 1
Конструирование gp41 с модифицированной петлей по SEQ ID NO: 8 посредством молекулярной биологии
a) Конструирование олигонуклеотидных праймеров
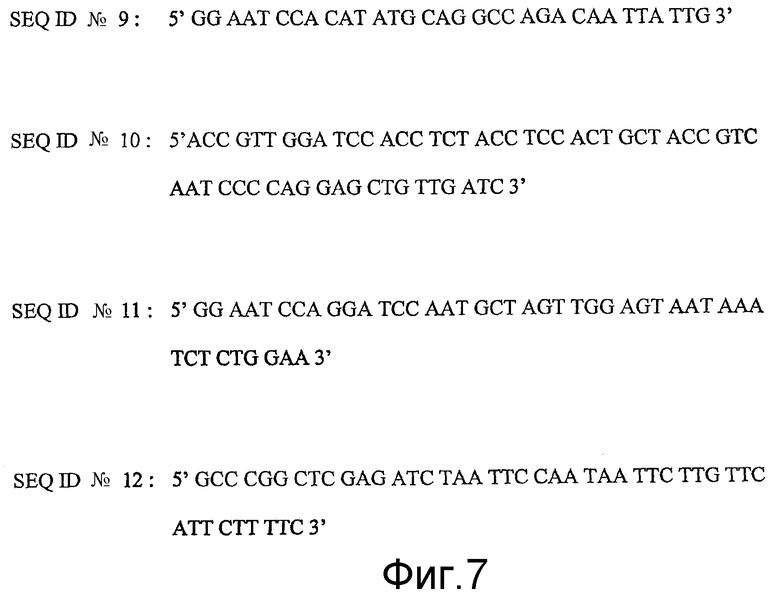
gp41 с модифицированной петлей конструировали посредством ПЦР. Амплификацию N-концевой спирали и введение гидрофильного линкера проводили с применением олигонуклеотидного праймера gp41-NdeI (SEQ ID NO: 9): 5'GG AAT CCA CAT ATG CAG GCC AGA CAA TTA TTG 3' и олигонуклеотидного праймера gp41-BamlIL (SEQ ID NO: 10): 5'ACC GTT GGA TCC ACC TCT ACC TCC ACT GCT ACC GTC AAT CCC CAG GAG CTG TTG ATC 3' (фиг.7).
Данные олигонуклеотидные праймеры сконструированы, чтобы соответственно вводить сайты рестрикционных ферментов NdeI и BamHI (дважды подчеркнуты в последовательностях олигонуклеотидных праймеров). Последовательности, гомологичные гену gp41, в обоих олигонуклеотидных праймерах даны наклонным шрифтом. Олигонуклеотидный праймер gp41-BamlIL сконструирован также, чтобы вводить олигопептидный линкер SGGRGGS (SEQ ID NO: 2) для замены делетированной части петли (соответствуют однократно и дважды подчеркнутым последовательностям) и вводить мутацию в положение 528 (нумерация белка по SEQ ID NO: 14), где триптофан заменен на аспарагиновую аминокислоту (полужирный триплет).
Амплификацию C-концевой спирали белка gp41 проводили посредством ПЦР с применением олигонуклеотидного праймера gp41-Bam2IL (SEQ ID NO: 11): 5'GG AAT CCA GGA TCC AAT GCT AGT TGG AGT AAT AAA TCT CTG GAA 3' и олигонуклеотидного праймера gp41-XhoI (SEQ ID NO: 12): 5'GCC CGG CTC GAG ATC TAA TTC CAA TAA TTC TTG TTC ATT CTT TTC 3' (фиг.7). Данные олигонуклеотидные праймеры сконструированы, чтобы соответственно вводить сайты рестрикции ферментами BamHI и XhoI (последовательности дважды подчеркнуты). Последовательности, гомологичные гену gp41, в обоих олигонуклеотидных праймерах даны наклонным шрифтом.
b) Условия ПЦР
Модифицированный полипептид gp41 амплифицировали с матрицы gp41 (SEQ ID NO: 13) посредством ПЦР с описанными выше олигонуклеотидными праймерами. Плазмиду применяли при 0,5 мкг/мкл, праймеры применяли по 10 мкМ каждый и dNTP
применяли по 10 мМ каждый. Амплификацию проводили с применением ДНК-полимеразы DyNazyme от Finnzymes. Амплификацию начинали стадией денатурации 5 минут при 94°C с последующими 30 циклами, каждый из которых содержал стадию одной минуты при 94°C (стадия денатурации), стадию одной минуты при 60°C (гибридизация) и стадию одной минуты при 72°C (удлинение), амплификацию завершали последней стадией 10 минут при 72°C.
Очищенные продукты ПЦР расщепляли NdeI-BamHI для амплификации N-концевой спирали и BamHI и XhoI для амплификации C-концевой спирали. Два очищенных фрагмента NdeI-BamHI и BamHI-XhoI лигировали по участкам NdeI-XhoI в вектор pET21b (Novagen®), получая pET21b-gp41 с модифицированной петлей.
Введение лигированного фрагмента по участку XhoI в плазмиду pET21b приводило к добавлению His-тага на C-конце модифицированных полипептидов gp41, предваряемому аминокислотными остатками глутамата и лейцина (смотри SEQ ID NO: 8). Продуктами pET21b-gp41 с модифицированной петлей трансформировали DH5α.
Полную нуклеотидную последовательность модифицированного полипептида (SEQ ID NO: 8) определяли в Genome Express (Grenoble). Мутаций не обнаружили.
Пример 2
Воспроизведение модифицированного полипептида в E. coli
a) Трансформация
Плазмидой pET21b-gp41 с модифицированной петлей трансформировали экспрессирующий штамм E. coli (BL21 (DE3)).
b) Проверки экспрессии
6 порций культуры штамма E. coli BL21 (DE3), несущего плазмиду pET21b-gp41 с модифицированной петлей, растили при 37°C в среде Лурия до достижения оптической плотности 0,6 при 600 нм (спектрофотометр Jasco V-530). Модифицированный полипептид индуцировали 1 мМ IPTG (изопропил-βD-тиогалактозид) и продолжали культивирование дополнительные 2 часа при 37°C. Белок gp41 с модифицированной петлей экспрессировался в E. coli как фракция белка размером 15 кДа.
Экспрессию белков контролировали посредством разделения в SDS-4-12% PAGE и иммуноблотинга с антителами к His-тагу.
c) Получение
1) Культура
Один литр культуры BL21 (DE3)/pET2lb-gp41 с модифицированной петлей растили при 37°C в среде Луриа до достижения оптической плотности 6,0. Экспрессию gp41 с модифицированной петлей индуцировали 1 мМ IPTG и продолжали культивирование дополнительные 2 часа при 37°C. Культуру центрифугировали (Центрифуга Beckman Coulter Avanti J20XP с ротором JLA 8-1000, 4000 x g, 30 мин, 4°C), осадок хранили при -80°C.
2) Выделение модифицированного полипептида gp41
Осадок ресуспендировали в буфере для обработки ультразвуком (40 мл Трис-HCl 50 мМ pH 8, NaCl 300 мМ). Бактерии разрушали на стадии обработки ультразвуком 15 мин во льду/этаноле (дезинтегратор UP200S, амплитуда 80%, коэфф. 0,5). Затем суспензию центрифугировали при 40000 x g 30 мин при 4°C для отделения растворимых белков (супернатанта) от нерастворимых белков (осадка) (Центрифуга Beckman Coulter Avanti J20XP с ротором JA20).
Модифицированный полипептид gp41 в основном (80%) растворен в супернатанте после обработки ультразвуком.
d) Очистка модифицированного полипептида gp41
Супернатант после обработки ультразвуком (# 50 мл) фильтровали через 0,2-мкм фильтр. Присутствие 6 His на C-конце позволяет очистку на колонках для аффинной хроматографии.
1) Аффинная хроматография
Аффинную хроматографию проводили с применением Akta FPLC (Fast Pressure Liquid Chromatography, Amersham-Biosciences)и колонки Chelating Sepharose Fast Flow (от Amersham-Pharmacia). Сначала колонку уравновешивали пропусканием уравновешивающего буфера A (Трис 50 мМ pH8, NaCl 300 мМ) (10-кратный объем колонки).
Затем через колонку пропускали 50 мл образца, содержащего белки gp41 с модифицированной петлей.
Примеси элюировали в четыре стадии пропусканием буфера A, содержащего увеличивающееся количество буфера B (Трис 50 мМ pH8, NaCl 300 мМ, имидазол 500 мМ), в объеме, соответствующем 10-кратному объему колонки, на каждой стадии (0, 20, 50 и 100 мМ имидазол). И, наконец, элюировали белок gp41 пропусканием 100% буфера B в объеме, соответствующем 10-кратному объему колонки.
Устанавливали скорость потока 8 мл/мин и объем собираемой фракции 2 мл.
Присутствие белков детектировали с применением УФ-лампы и измерением оптической плотности при 280 нм.
Первые четыре фракции собирали и смешивали (8 мл при 0,2 мг/мл).
2) Диализ
Белок gp41 с модифицированной петлей (8 мл в буфере B (Трис 50 мМ pH8, NaCl 300 мМ, имидазол 500 мМ) подвергали диализу три раза (два анализа в течение 1ч 30 и один в течение ночи) при 4°C против 300 мл Трис 50 мМ pH8, NaCl 200 мМ, имидазол 200 мМ. Полученный образец центрифугировали 30 мин при 30000 g, 4°C.
Из одного литра бактериальной культуры получали 10 мл очищенного белка gp41 с модифицированной петлей в Трис 50 мМ pH8, NaCl 200 мМ, имидазол 200 мМ при 0,2 мг/мл.
Для хранения при -80°C добавляли 5% глицерин и замораживали очищенный белок в жидком азоте. На данной стадии концентрация белка составляла приблизительно 0,2 мг/мл.
Пример 3:
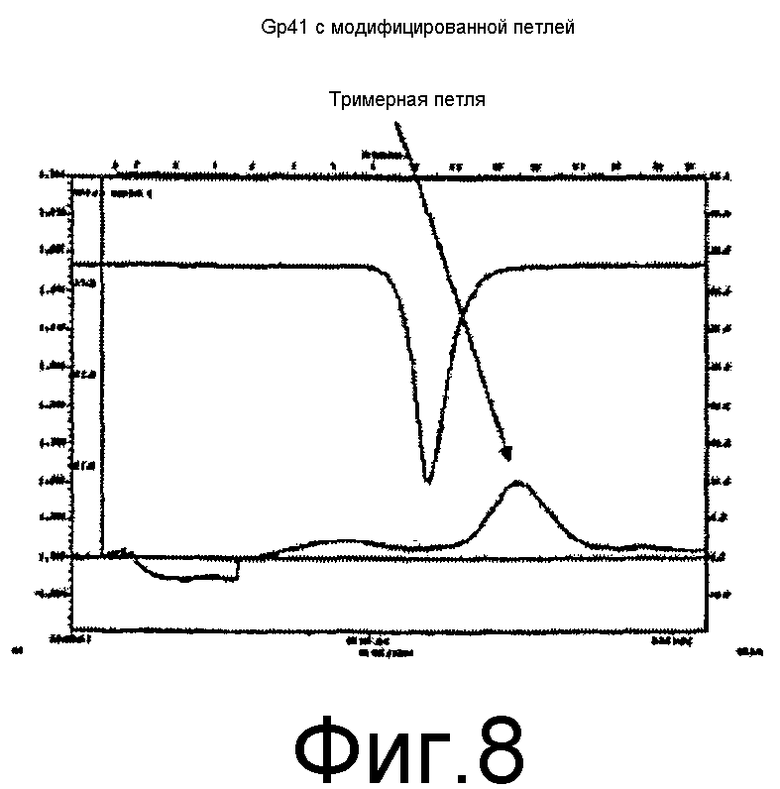
a) Определение олигомерного состояния
Для определения олигомерного состояния белка gp41 с модифицированной петлей проводили гель-фильтрацию с разделением между 3000 и 600000 Дальтон.
Определение олигомерного состояния проводили с применением Fast Performance Liquid Chromatography (System BioLogic, Bio-Rad) на колонке для аналитической хроматографии Superdex 200 HR 10/30 Amersham-pharmacia.
Колонку уравновешивали 50 мл буфера A (Трис 50 мМ pH8, NaCl 200 мМ), затем через колонку пропускали 250 мл образца, содержащего белок gp41 с модифицированной петлей (соответствующих 500 мкг белка gp41 с модифицированной петлей).
Таким образом элюировали белки с применением 30 мл буфера A при скорости потока 0,25 мл/мин. Собирали фракции объемом 2 мл. Белки детектировали с применением УФ-лампы и измерения оптической плотности при 280 нм.
Полученная хроматограмма (фиг.8) показывает, что конструкция белка gp41 с модифицированной петлей получена в растворимой и стабильной тримерной форме при 0,2 мг/мл.
Различия между консенсусной последовательностью эктодомена gp41 и gp41 с модифицированной петлей составили 13%. Среди 18 аминокислот, составляющих эктодомен, 6 были различными и 12 были удалены. Эктодомен белка gp41 представляет 71% полной последовательности gp41.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЛЬФАТЕЛА ДЛЯ ИНГИБИРОВАНИЯ ПРОНИКНОВЕНИЯ ВИЧ | 2010 |
|
RU2562165C2 |
| СПОСОБ БЫСТРОГО ОТБОРА ВАРИАНТОВ GP-120 ВИЧ | 2012 |
|
RU2603732C2 |
| Генетическая конструкция для экспрессии генов mNG_CD4-CXCR4, рекомбинантная плазмида rVSV_mNG_CD4-CXCR4 и рекомбинантный штамм вируса везикулярного стоматита rVSV_mNG_CD4-CXCR4, обеспечивающий таргетный виролизис клеток, экспонирующих на своей поверхности белки gp120/gp 41 ВИЧ-1 тропности X4 | 2021 |
|
RU2768032C1 |
| РОТАВИРУСНЫЕ ЧАСТИЦЫ С ХИМЕРНЫМИ ПОВЕРХНОСТНЫМИ БЕЛКАМИ | 2014 |
|
RU2698049C2 |
| Генетическая конструкция для экспрессии генов mNG_CD4-CCR5, рекомбинантная плазмида rVSV_mNG_CD4-CCR5 и рекомбинантный штамм вируса везикулярного стоматита rVSV_mNG_CD4-CCR5, обеспечивающий таргетный виролизис клеток, экспонирующих на своей поверхности белки gp120/gp41 ВИЧ-1 тропности R5 | 2021 |
|
RU2769125C1 |
| ПОЛУЧЕНИЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ В РАСТЕНИЯХ | 2011 |
|
RU2655431C2 |
| Производные слитого с Fc белка с высокой двойной активностью: противовирусной активностью в отношении ВИЧ и иммуномодулирующей активностью | 2018 |
|
RU2774782C2 |
| GP41-НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2624046C2 |
| ПОЛУЧЕНИЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ ВИРУСА ГРИППА В РАСТЕНИЯХ | 2014 |
|
RU2742607C1 |
| ПОЛУЧЕНИЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ ВИРУСА ГРИППА В РАСТЕНИЯХ | 2014 |
|
RU2705555C2 |
















Настоящее изобретение относится к области биотехнологии, а именно к модифицированному полипептиду гликопротеина оболочки HIV-1 gp41, полинуклеотиду, который кодирует данный модифицированный полипептид, и экспрессирующему вектору, который содержит кодирующий модифицированный полипептид гликопротеина оболочки HIV-1 gp41. Модифицированный полипептид гликопротеина оболочки HIV-1 gp41 содержит аминокислотную последовательность SEQ ID NO:1 или SEQ ID NO:14, где последовательность между положениями 603 и 615 или 598 и 622 SEQ ID NO:1 или последовательность между положениями 530 и 542 или 525 и 549 SEQ ID NO:14 заменена на линкерный фрагмент, представляющий собой олигопептид SEQ ID NO:2. Представленное изобретение позволяет получить улучшение растворимости модифицированного полипептида гликопротеина оболочки HIV-1 gp41 без изменения его иммуногенной реактивности. 3 н. и 7 з.п. ф-лы, 10 ил., 1 табл.
1. Модифицированный полипептид гликопротеина оболочки HIV-1 gp41, содержащий, аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO:14, где последовательность между положениями 603 и 615 или 598 и 622 SEQ ID NO:1 или последовательность между положениями 530 и 542 или 525 и 549 SEQ ID NO:14 заменена на линкерный фрагмент, представляющий собой олигопептид SEQ ID NO:2 и, где необязательно полипептид является усеченным с N-конца олигопептидом, где длина делеции имеет размер в пределах от 8 до 15 аминокислотных остатков и, где необязательно остаток триптофана в положении 528 SEQ ID NO:14 заменен на более гидрофильный аминокислотный остаток и, где необязательно к С-концу полипептида добавлен His-таг.
2. Модифицированный полипептид по п.1, где его выбирают из полипептидов SEQ ID NO:8, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19 и SEQ ID NO:20.
3. Модифицированный полипептид по п.2, где он представляет собой полипептид SEQ ID NO:8.
4. Модифицированный полипептид по п.1, являющийся, кроме того, усеченным с N-конца олигопептидом, где длина делеции имеет размер в пределах от 8 до 15 аминокислотных остатков.
5. Модифицированный полипептид по п.4, где он усечен, в частности, по меньшей мере, на 10 аминокислотных остатков и, более конкретно, по меньшей мере, на 12 аминокислотных остатков в N-концевом положении.
6. Модифицированный полипептид по п.4, где он представляет собой полипептид, как представлено на SEQ ID NO:21.
7. Полинуклеотид, кодирующий модифицированный полипептид по любому из пп.1-6.
8. Полинуклеотид по п.7, представляющий собой ДНК.
9. Полинуклеотид по п.7 или 8, где он представляет собой полинуклеотид SEQ ID NO:7.
10. Экспрессирующий вектор, содержащий, по меньшей мере, промотор транскрипции, фрагмент ДНК, кодирующий модифицированный полипептид по любому из пп.1-6 и терминатор транскрипции.
| LOUIS J.M | |||
| et al | |||
| Механический грохот | 1922 |
|
SU41A1 |
| - J | |||
| Biol Chem., 2001; v.276, n.31, p.29485-9 | |||
| ECKERT D.M | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2010-05-27—Публикация
2004-07-29—Подача