Изобретение относится к генетической конструкции для экспрессии генов mNG_CD4-CCR5, рекомбинантной плазмиде, кодирующей кДНК копию генома репликационно-дефектного вируса везикулярного стоматита, и рекомбинантному вирусу везикулярного стоматита, экспонирующему на своей поверхности рецепторы CD4 и CCR5 человека. Изобретение позволяет создать кандидатный препарат для виролизиса ВИЧ-инфицированных клеток, а также может являться компонентом модели для изучения таргетной виротерапии ВИЧ-инфекции.
Вирус способен специфически связываться с gp120 ВИЧ-1 и репродуцироваться в клетках, экспонирующих на своей поверхности указанные белки слияния ВИЧ-1 тропности R5 с последующим виролизисом таких клеток. Изобретение может быть использовано в молекулярной вирусологии, биотехнологии, молекулярной биологии, генетической инженерии и медицине.
В результате жизненного цикла ВИЧ-1, его гликопротеин gp161 (gp120+gp41) экспонируется на поверхности инфицированных клеток. Полученный рекомбинантный вирус может связываться с ВИЧ-1 инфицированными клетками посредством взаимодействия с экспонированным белком gp161 и проникать в цитоплазму за счет взаимодействия gp161 - корецептор (CCR5). Заражение ВИЧ-отрицательных клеток организма не происходит по причине отсутствия исходного белка слияния в полученном рекомбинантном вирусе.
Необходимость получения различных вирусов с разными корецепторами (CCR5 в данном случае, CXCR4 в альтернативных случаях) объясняется существованием двух мажоритарных вариантов ВИЧ-1, циркулирующих в популяции [1]. Связывание и слияние между мембраной вириона ВИЧ и плазматической мембраной клетки-мишени инициируется последовательным связыванием гликопротеина gp120 (субъединица gp 161) с CD4 на поверхности клетки, а затем со специфическим рецептором хемокинов CCR5 или CXCR4 [2]. Известно, что RS-тропные вирусы выявляются на ранних стадиях инфекции, тогда как варианты Х4 характерны для поздних стадий, как результат адаптации вируса к снижающемуся количеству клеток, имеющих на поверхности рецепторы CCR5.
На 2019 год количество ВИЧ-инфицированных людей в мире приблизилось к 38 миллионам человек, из которых 67% получали антиретровирусную терапию (АРВТ) [3]. Рекомендованная ВОЗ схема терапии значительно снижает вирусную нагрузку и вероятность передачи вируса, однако АРВТ имеет побочные эффекты и противопоказания, и может приводить к появлению лекарственно-устойчивых форм ВИЧ [4]. В связи с этим активно ведутся разработки дополнительных и альтернативных стратегий комплексной терапии ВИЧ-инфекции. Одним из перспективных подходов является разработка и применение рекомбинантных вирусов, таргетированных на ВИЧ-инфицированные клетки [9, 10, 15].
Вирус иммунодефицита человека (ВИЧ) относится к роду Lentivirus, семейству Retroviridae, подсемейству Orthoretrovirinae [5]. Зрелая частица ВИЧ имеет сферическую форму и диаметр 100-120 нм, имеет внешнюю липидную оболочку. Оболочка содержит 72 гликопротеиновых комплекса, состоящих из тримеров белков Env (gp161). Тримеры поверхностного белка gp120 прикреплены к мембране с помощью тримеров трансмембранного белка gp41.
На основе генетических характеристик и различий в вирусных антигенах ВИЧ классифицируется на два типа: ВИЧ-1 и ВИЧ-2. С момента появления, ВИЧ-1 распространился по всему миру, в то время как зона распространения ВИЧ-2 ограничена Западной Африкой, единичные случае зафиксированы в Европе, Индии и Соединенных Штатах Америки [6]. ВИЧ-2 инфицированные люди часто клинически не прогрессируют в долгосрочной перспективе, тогда как у большинства ВИЧ-1 инфицированных развитие инфекции приводит к приобретению СПИДа [7]. На данный момент более низкая эффективность передачи ВИЧ-2 по сравнению с ВИЧ-1 приводит к значительному снижению распространенности вируса 2 типа [8]. Таким образом, наиболее приоритетным направлением является разработка терапии ВИЧ-1 инфекции, в том числе и по причине того, что рецепторная специфичность и механизмы репликации ВИЧ-1 и ВИЧ-2 во многом сходны, а более актуальной проблемой является ВИЧ-1.
Известно решение по патенту US 9610346 B2, который описывает разработанный рекомбинантный вирус везикулярного стоматита, использующийся в качестве основы профилактического и терапевтического средства против ВИЧ-инфекции. Данное изобретение относится к векторам рекомбинантного вируса везикулярного стоматита (VSV), в которых ген, кодирующий поверхностный гликопротеин VSV G, заменен на Env ВИЧ или на модифицированную форму VSV G, которая несет эпитопы из проксимальной внешней области Env ВИЧ или на усеченную на N-конце форму VSV G, которая содержит цитоплазматический хвост и трансмембранные домены G, проксимальный внеклеточный полипептид, к которому присоединены эпитопы Env ВИЧ. Таким образом, в патенте получены рекомбинантные вирусы для потенциального использования в качестве вакцинных препаратов, в то время как наше изобретение подразумевает разработку терапевтического средства. Применение в качестве вектора вируса везикулярного стоматита указывает на целесообразность его применения в области разработки виротерапии. Используется аналогичный нашей работе вирусный вектор, однако принципиально подход другой - белок G в данном патенте заменяется на различные модификации Env ВИЧ-1, в то время как в нашей работе функциональная активность синтетического вируса обеспечивается рецепторами CD4 и CXCR4 на поверхности вирионов и их взаимодействием с ВИЧ-инфицированными клетками или с непосредственно вирусом ВИЧ-1.
В изобретении US 7736649 B2 предлагается способ подавления инфекции вируса иммунодефицита человека путем введения синергичных комбинаций моноклональных антител к CCR5, ингибиторов слияния и ингибиторов связывания CD4-gp120. Это является вариантом терапевтического подхода для сдерживания развития ВИЧ-1 инфекции, однако подразумевает принципиально другой путь, не включающий использование вирусных векторов и целенаправленных механизмов связывания с gp120 ВИЧ-1 на поверхности инфицированных клеток.
Изобретение JP 2005520482 А относится к вектору репликации, основу которого представляет геном ВИЧ-1, и применению этого вектора в профилактике и терапевтическом лечении вирусных инфекций (в частности ВИЧ-инфекций). Предполагаемый способ применения подразумевает использование генома «условно реплицирующегося» ВИЧ (conditionally replicating HIV-1 - crHIV) с селективными преимуществами для упаковки за счет обеспечения генома crHIV одним или несколькими рибозимами, способными расщеплять геном ВИЧ дикого типа. В данном изобретении используется модифицированный лентивирусный вектор, принципиально отличающийся от вектора на основе вируса везикулярного стоматита.
Наиболее близкие конструкции для нашего изобретения были описаны в международной заявке WO 1999002657 А1 и патенте США №7081243 В1. В данных документах опубликована обобщенная стратегия замены нативного белка слияния в вирусной платформе на клеточный рецептор, необходимый для связывания патогенного вируса с клеткой-мишенью. Таким образом обеспечивается связывание терапевтической конструкции с инфицированными клетками, экспонирующими на своей поверхности поверхностные белки патогенного вируса. В примерах предложены рекомбинантные вирусы везикулярного стоматита, несущие вместо нативного белка G VSV на поверхности вириона рецептор CD4 и корецептор CXCR4 для ВИЧ.
Наиболее близким аналогом (прототипом) являются компетентные к репликации рекомбинантные рабдовирусы (патент США №7081243, МПК A61K 39/21, опубл. 25.07.2006 г.), которые лишены функционального гена G и экспонируют на поверхности своих вирионов по меньшей мере один чужеродный полипептид, являющийся клеточным рецептором для другого вируса. Потенциально могут применяться в терапии вирусных инфекций. В одном варианте осуществления рекомбинантный вирус везикулярного стоматита (ВВС), лишенный своего гена гликопротеина слияния (G) и экспрессирующий вместо этого рецептор и корецептор ВИЧ, применяют для снижения титров ВИЧ в крови модельных объектов. Рекомбинантный вирус не может проникнуть в здоровые клетки, при этом способен контролировать ВИЧ-инфекцию в популяции Т-лимфоцитов путем специфичного инфицирования клеток, экспонирующих на поверхности белок слияния ВИЧ-1 тропности Х4, репликации и последующего лизиса указанных клеток.
Представленные данные в патенте демонстрируют, что rVSV специфически инфицирует клетки, которые временно экспрессируют гликопротеины оболочки ВИЧ-1 Х4, но не инфицирует непермиссивные культуры клеток. После того, как первичные культуры, инфицированные Х4 ВИЧ-1, были инокулированы G-комплементарным VSVΔG-CC4, rVSV значительно снизил количество ВИЧ-1 -инфицированных клеток, вероятно, за счет VSV-опосредованного цитолиза и/или через образование синцития или через зависимый от слияния клеток апоптоз и заметно ингибировал продукцию ВИЧ-1. Данные результаты показывают, что цитолитический rVSV, нацеленный на Х4 ВИЧ-1-инфицированные клетки, устраняет их и потенциально имеет терапевтическое значение для контроля инфекции Х4 ВИЧ-1, что было показано и позже в статьях [9].
Существенными отличиями от данного прототипа, обеспечивающими достижение технического результата, являются следующие пункты:
1. В структуру разработанной генетической конструкции, рекомбинантной плазмиды и полученного вируса входит ген рецептора CCR5, а не CXCR4, поскольку преимущественно циркулирующим вариантом в популяции является ВИЧ-1 с тропностью к рецептору CCR5 человека;
2. Сконструирована генетическая конструкция для экспрессии генов, включающая маркерный флуоресцентный белок и слитую с ним через Р2А пептид открытую рамку считывания гена CD4, и далее ген CCR5, что обеспечивает детекцию проникновения в клетку и репродукции рекомбинантных вирусов за счет флуоресценции белка mNeonGreen. Р2А-пептид в конструкции обеспечивает отщепление протеина mNG на этапе трансляции, с последующим независимым синтезом и фолдингом белков CD4 и CCR5;
3. В прототипе наработку продуцированного rVSV проводили в культуре клеток BHK-G, экспрессирующей протеин G. В нашем случае культивирование рекомбинантного вируса проводили на трансгенных клеточных культурах, стабильно экспрессирующих ген Env российских изолятов ВИЧ-1 тропности R5, что обеспечивает большую функциональную стабильность полученных вирусов. Также, это может быть необходимо для практического применения с циркулирующими эпидемиологически значимыми вариантами ВИЧ-1;
4. В патентах описывается получение вирусов на культурах клеток, предварительно инфицированных штаммом вируса осповакцины Western Reserve, который кодирует РНК-полимеразу бактериофага Т7. В нашем случае получение рекомбинантных вирусов происходило с использованием плазмидной конструкции, обеспечивающей экспрессию ДНК-зависимой РНК-полимеразы. Данный подход исключает контаминацию препарата осповакциной на первых циклах культивирования;
5. В нашем изобретении предусмотрена возможность замены гена флуоресцентного белка на открытые рамки считывания генов терапевтических антител или системы CRISPR/Cas9, нацеленной на геном ВИЧ-1.
Раскрытие изобретения
Техническим результатом заявляемого изобретения является расширение спектра генетических конструкций для экспрессии генов mNG_CD4-CCR5, рекомбинантных плазмид и рекомбинантных репликационно-дефектных вирусов, обеспечивающих виролизис клеток, экспонирующих на своей поверхности gp120/gp41 ВИЧ-1 тропности R5.
Указанный технический результат достигается получением генетической конструкции для экспрессии генов mNG_CD4 и CCR5, образованной последовательностями флуоресцентного белка mNeonGreen и слитого через Р2А-пептид рецептора CD4 и корецептора CCR5 человека и имеющего нуклеотидную последовательность (SEQ ID NO 1).
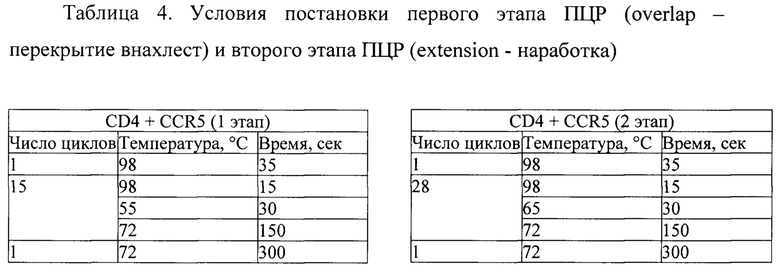
Указанный технический результат достигается также созданием рекомбинантной плазмиды rVSV_mNeonGreen [CD4-CCR5], кодирующей рецепторы CD4 и CCR5 человека в составе кДНК копии генома рекомбинантного вируса везикулярного стоматита (ВВС), имеющей размер 15259 п. н., содержащей в соответствии с физической и генетической картой, представленной на фиг.1, целевую генетическую конструкцию для экспрессии генов mNG_CD4-CCR5 по п. 1 и состоящей из следующих фрагментов:
• T7 promoter - нуклеотидная последовательность промотора бактериофага T7, необходимая для in vitro транскрипции антигеномной последовательности РНК рекомбинантного вируса везикулярного стоматита;
• N - открытая рамка считывания гена N, кодирующего нуклеопротеин;• P - открытая рамка считывания гена P, кодирующего фосфопротеин;
• M - открытая рамка считывания гена M, кодирующего матриксный белок;
• mNeonGreen - яркий мономерный желто-зеленый флуоресцентный белок, полученный из LanYFP и имеющий аминокислотную последовательность SEQ ID NO 2;
• P2A - 2A пептид из полипротеина тешовируса-1, обеспечивающий расщепление полипротеина на этапе трансляции;
• CD4 - ген, кодирующий гликопротеин CD4 и имеющий аминокислотную последовательность SEQ ID NO 3;
• CCR5 - ген, кодирующий C-C хемокиновый рецептор типа 5 и имеющий аминокислотную последовательность SEQ ID NO 4;
• L - открытая рамка считывания гена L, кодирующего РНК-зависимую РНК-полимеразу;
• T7 terminator - терминатор транскрипции РНК-полимеразы бактериофага Т7;
• Ген β-лактамазы под контролем промотора, генетический маркер, определяющий устойчивость к β-лактамным антибиотикам клеток бактерии E. coli;
• Точка начала репликации ori плазмидного вектора ColE1/pMB1/pBR322/pUC с высоким числом копий.
Указанный технический результат достигается получением рекомбинантного штамма вируса везикулярного стоматита rVSV_mNG_CD4-CCR5, полученного с использованием рекомбинантной плазмиды rVSV_mNeonGreen [CD4-CCR5] по п. 2. Вирус экспонирует на своей поверхности рецепторы CD4 и CCR5 человека, обеспечивает виролизис клеток, экспонирующих на своей поверхности gp120/gp41 ВИЧ-1 тропности R5. Штамм rVSV_mNG_CD4-CCR5 депонирован в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-1107.
В рекомбинантном вирусе везикулярного стоматита (ВВС) ген, кодирующий поверхностный гликопротеин ВВС G, заменен на искусственную генетическую конструкцию для экспрессии генов mNG_CD4-CCR5, включающую последовательности флуоресцентного белка mNeonGreen и слитый через Р2А пептид ген рецептора CD4 и одного из двух ключевых корецепторов ВИЧ-1 CCR5 в другой вирусной транскрипционной кассете (SEQ ID NO 1). При этом ген mNeonGreen является маркером. Р2А-пептид в данной конструкции обеспечивает отщепление протеина mNG на этапе трансляции, с последующим независимым синтезом и фолдингом белка CD4. Данная стратегия обеспечивает более высокую стабильность целевого трансгена за счет того, что возникновение любых мутаций, приводящих к сдвигу рамки считывания, исключает возможность синтеза необходимых для полноценного репродуктивного цикла вирусных белков, находящихся после Р2А-пептида. Расположение гена CCR5 в следующей от 3'-конца генома вирусной транскрипционной кассете, обеспечивает необходимый более низкий уровень экспрессии корецептора, по отношению к CD4.
Осуществление изобретения
Сущность заявленного изобретения поясняется следующими чертежами. Фиг. 1 - генетическая и физическая карта рекомбинантного плазмидного вектора rVSV_mNeonGreen [CD4-CCR5] для обратной генетики репликационно-дефектного вируса везикулярного стоматита.
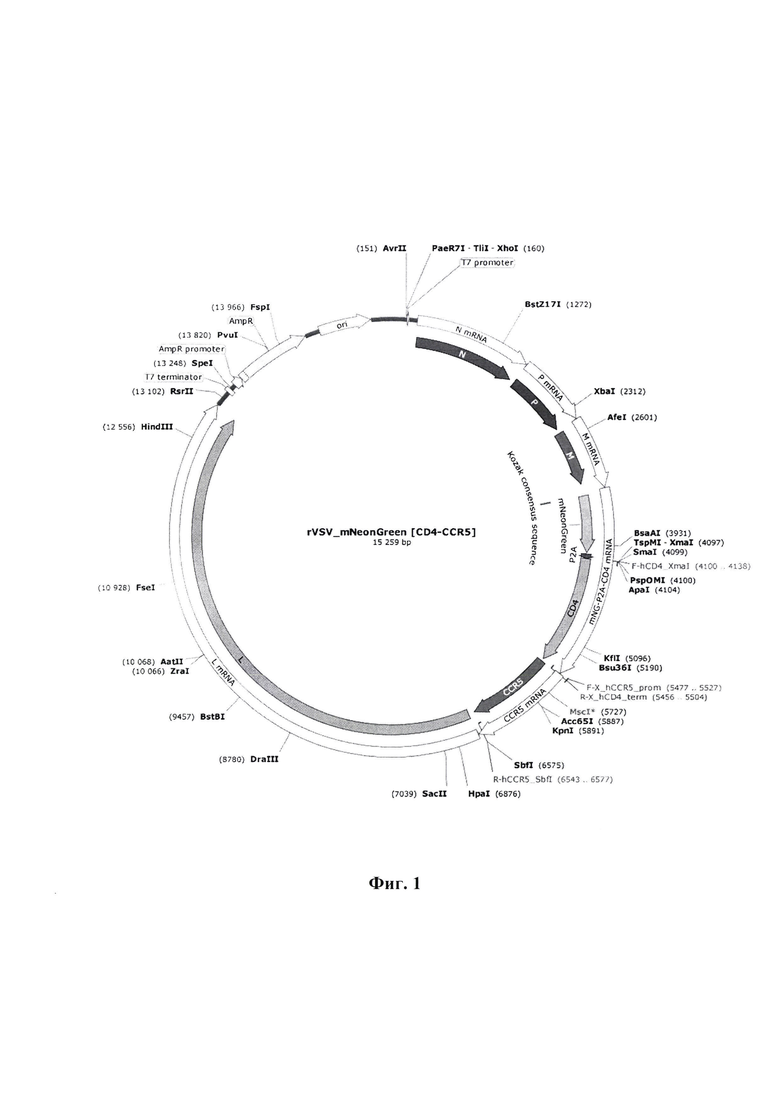
Фиг. 2 - схема получения продукта CD4-CCR5 с использованием праймеров, обеспечивающих перекрытие последовательностей фрагментов генов CD4 и CCR5, для последующей ПЦР с удлинением внахлест (overlap extension PCR на схеме).
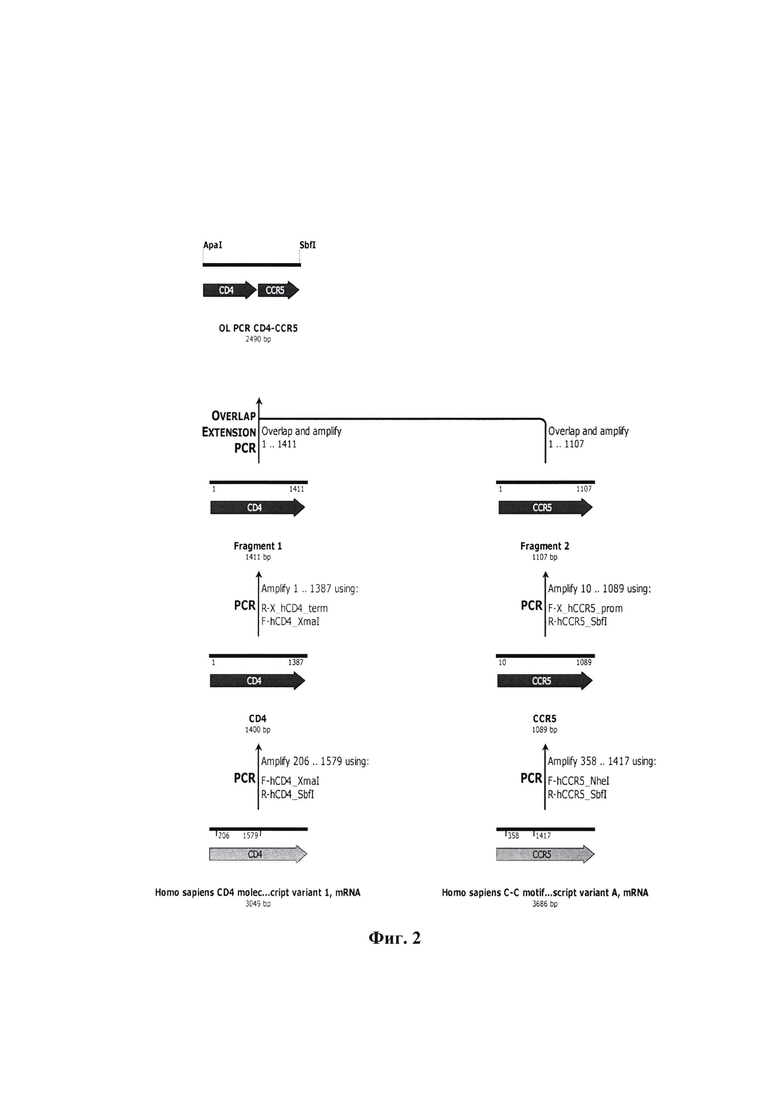
Фиг. 3 - схема клонирования продукта OL PCR CD4-CCR5 в целевой вектор для обратной генетики VSV pStem-rVSV-mNG.
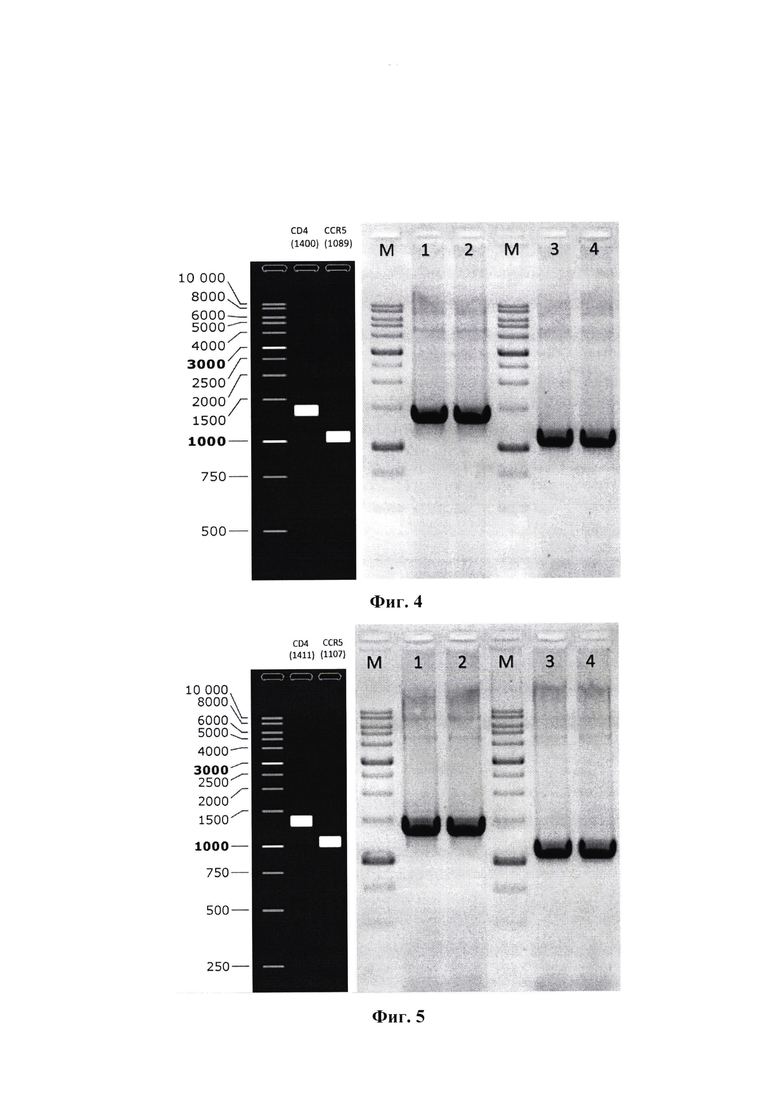
Фиг. 4 - ампликоны генов рецепторов CD4 и CCR5 человека (полосы 1, 2 - ген CD4, полосы 3, 4 - ген CCR5).
Фиг. 5 - ПЦР продукты, длиной 1411 п. н. (CD4) - полосы 1,2; 1107 п. н. (CCR5) - полосы 3,4, полученные амплификацией с плазмид pJET1.2_CD4 и pJET1.2_CCR5 с использованием праймеров, обеспечивающих частичное перекрытие в последовательностях CD4 и CCR5 с целью дальнейшей постановки ГТЦР с перекрывающимися праймерами.
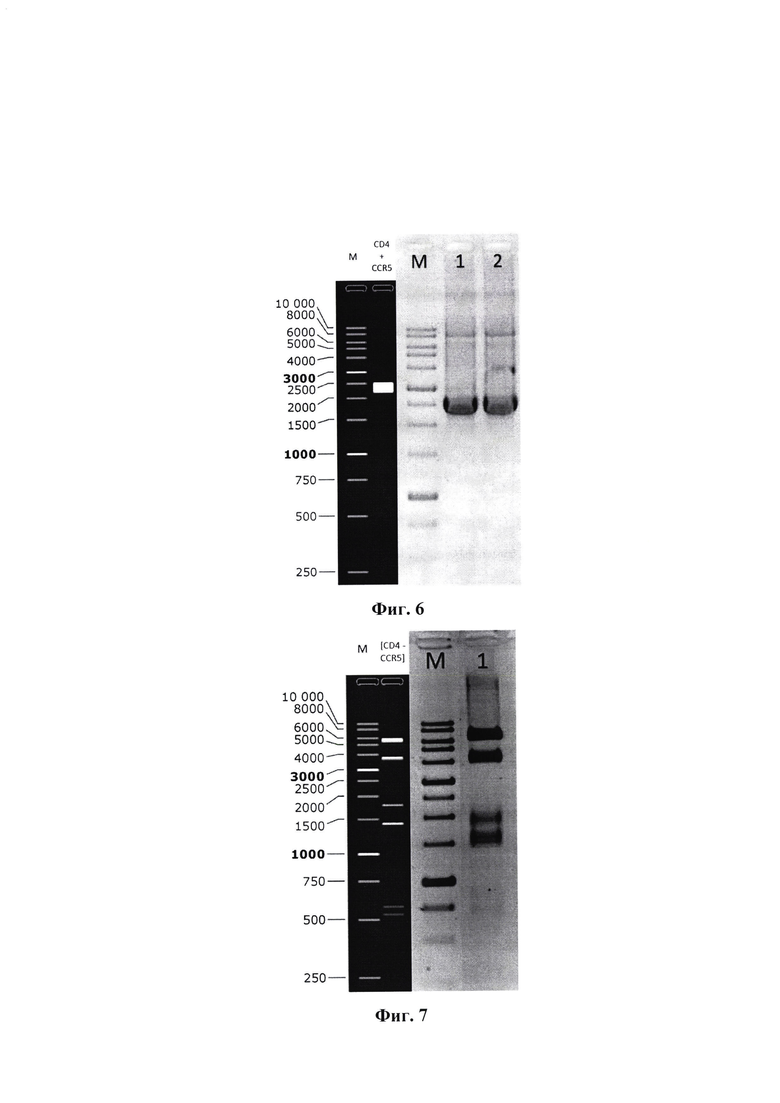
Фиг. 6 - объединение генов рецепторов CD4+CCR5 при помощи ГТЦР с перекрывающимися праймерами, размер продукта 2491 п. о.
Фиг. 7 - рестрикционный анализ рекомбинантной плазмиды rVSV_mNeonGreen [CD4-CCR5], М - маркер.
Фиг. 8 - (А, Б) 24 часа после заражения клеток HEK293_Env_R5 вирусом rVSV_mNG_CD4-CCR5; (В, Г) - 24 часа после заражения клеток HEK293_Env_X4 вирусом rVSV_mNG_CD4-CCR5. А, В - световая микроскопия, Б, Г - флуоресцентная микроскопия, размер масштабной шкалы - 300 мкм.
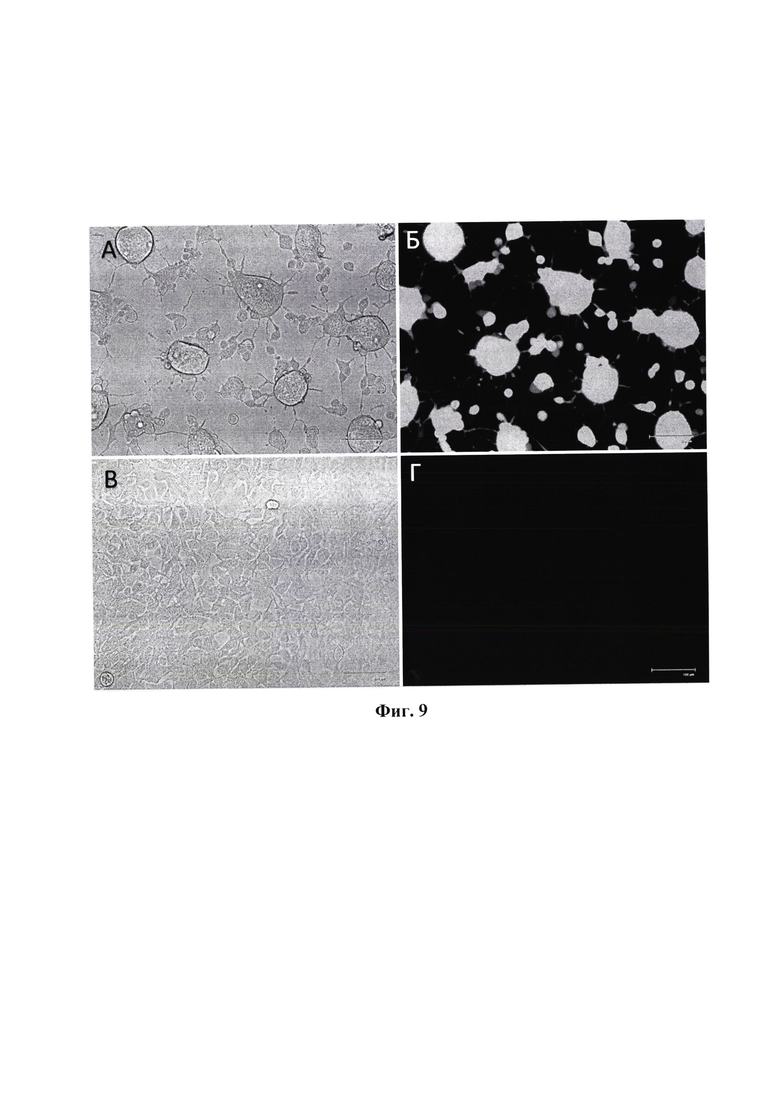
Фиг. 9 (А, Б) - 48 часов после заражения клеток HEK293_Env_R5 вирусом rVSV_mNG_CD4-CCR5; (В, Г) - 48 часов после заражения клеток НЕК293 вирусом rVSV_mNG_CD4-CCR5. А, В - световая микроскопия, Б, Г - флуоресцентная микроскопия, размер масштабной шкалы - 100 мкм.
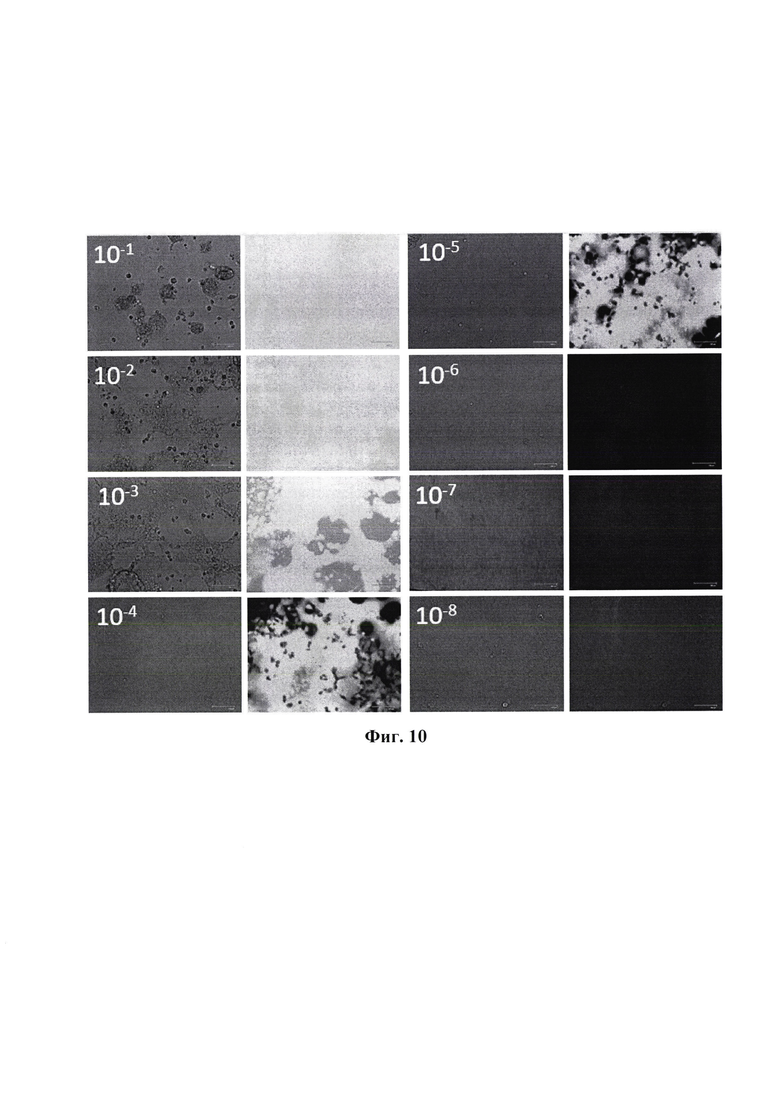
Фиг. 10 - определение титра репликационно-деффектного вируса rVSV_mNG_CD4-CCR5, 48 часов после заражения клеток HEK293_Env_R5 вирусом в разведениях от 10-1 до 10-8. Световая и флуоресцентная микроскопия, размер масштабной шкалы - 300 мкм.
Первоначально получены кДНК копии генов рецепторов CD4 и CCR5 человека и субклонированы в коммерческом векторе pJET1.2/blunt. Далее проведено объединение фрагментов генов рецепторов CD4 и CCR5, что стало возможным благодаря их амплификации с плазмид с использованием праймеров, обеспечивающих перекрытие последовательностей, для последующей ПЦР с перекрывающимися праймерами (overlap extension PCR на схеме).
Полученный продукт overlap extension PCR (OL PCR) рестрицирован эндонуклеазами рестрикции ApaI и SbfI и клонирован в вектор для обратной генетики ВВС pStem-rVSV-mNG по данным сайтам. В структуре получаемой рекомбинантной плазмиды rVSV_mNeonGreen [CD4-CCR5] на данном этапе собрана конструкция для экспрессии генов mNG_CD4 и CCR5.
Затем получен репликационно-дефектный вирус везикулярного стоматита rVSV_mNeonGreen [CD4-CCR5] путем трансфекции перевиваемой линии клеток 4647(коллекция культур клеток ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора) и/или трансгенной культуры клеток НЕК293 с использованием коммерческого реагента липофектамина 3000 (Thermo Scientific, США) в соответствии рекомендациями производителя. Трансфекция проводилась полученной генетической плазмидной конструкцией rVSV_mNeonGreen [CD4-CCR5] совместно с хелперными плазмидами pStem-vN, pStem-vP, pStem-vL, обеспечивающими экспрессию белковой репликативной машинерии вируса везикулярного стоматита (N, Р и L), а также ДНК-зависимой РНК-полимеразой бактериофага Т7.
Полученным вирусом проведено инфицирование трангенных моноклональных культур клеток HEK293_Env_R5 и HEK293_Env_X4, экспонирующих на своей поверхности gp160 ВИЧ-1 тропности R5 или Х4, соответственно. С использованием световой и флуоресцентной микроскопии функционально подтверждено слияние полученных синтетических вирусов с трансгенными культурами клеток, стабильно экспрессирующими на своей поверхности gp160 ВИЧ-1 тропности R5 и отсутствие взаимодействия вируса с культурой клеток HEK293_Env_X4.
Осуществление изобретения подтверждается следующими примерами.
Пример 1. Получение кДНК копий генов рецепторов CD4 и CCR5 человека
Первым этапом получения генетической конструкции для экспрессии генов mNG_CD4 и CCR5 и плазмидной конструкции для обратной генетики VSV, содержащих гены рецепторов CD4 и CCR5, являлась амплификация генов рецепторов CD4 и CCR5. ПЦР проводили с кДНК копии тотальной РНК, выделенной из лейкоцитарной фракции крови здорового донора.
Подбор праймеров (таблица 1) осуществляли с помощью ПО SnapGene v.3.2.1 и Oligo7, используя в качестве референса последовательности Homo sapiens CD4 molecule (CD4), transcript variant 1, mRNA (последовательность GenBank: NM_000616.4), Homo sapiens C-C motif chemokine receptor 5 (gene) (CCR5), transcript variant A, mRNA mRNA (последовательность GenBank: NM_000579.4). Олигонуклеотидные праймеры синтезированы биотехнологической компанией «Евроген» (г.Москва).

1.1. Выделение тотальной РНК из лейкоцитарной фракции крови здорового донора и постановка реакции обратной транскрипции
Выделение тотальной РНК проводили из лейкоцитарной фракции крови здорового донора, клетки ресуспендировали в лизирующем буфере AVL. Для выделения использовали коммерческий набор QIAamp Viral RNA Mini Kit (Qiagen, Германия) в соответствии рекомендациями производителя.
Элюат хранили при минус 20°С, в следующем этапе работы использовали его для постановки обратной транскрипции.
Для получения первой цепи ДНК на матрице вирусной геномной РНК использовали набор RNAscribe RT (Biolabmix, Россия). Для проведения реакции пробирку с смесью необходимых компонентов помещали в амплификатор Thermal Cycler С1000 (BioRad, США) и использовали рекомендуемый производителем температурно-временной профиль.
1.2. Амплификация методом ПЦР кДНК фрагментов, кодирующих гены рецепторов CD4 и CCR5 человека
Ген CD4 амплифицировали с помощью праймеров F-hCD4_XmaI и R-hCD4_SbfI, каждый из которых создавал дополнительные сайты рестрикции в ПЦР продукте, которые в дальнейшем использовали для направленного клонирования в целевой вектор для обратной генетики VSV. Температура отжига праймеров составляла 60°С. Длительность элонгации - 45 секунд. Число циклов - 25. ПЦР смесь разделяли в 1,5% агарозном геле. Продукт, длиной 1400 п. н. (фиг. 4 - полосы 1, 2), был вырезан из геля и элюирован с использованием набора набора QIAquick Gel Extraction Kit (Qiagen, Германия).
Ген CCR5 амплифицировали с помощью праймеров F-hCCR5_NheI и R-hCCR5_SbfI, каждый из которых создавал дополнительные сайты рестрикции в ПЦР продукте, которые в дальнейшем использовались для направленного клонирования в целевой вектор для обратной генетики VSV. Температура отжига праймеров составляла 60°С. Длительность элонгации - 30 секунд. Число циклов - 25. ПЦР смесь разделяли в 1,5% агарозном геле. Продукт, длиной 1089 п. н. (фиг. 4 - полосы 3,4), был вырезан из геля и элюирован с использованием набора набора QIAquick Gel Extraction Kit (Qiagen, Германия).
Пример 2. Субклонирование ПЦР продуктов CD4 и CCR5 в векторе pJET1.2/blunt
ПЦР продукты CD4 и CCR5 были субклонированы в векторе pJET1.2/blunt при помощи коммерческого набора CloneJET PCR Cloning Kit (Thermo Fisher Scientific, США) согласно инструкции производителя. Полученные реакционные смеси использовались для трансформации электрокомпетентных клеток Е. coli, штамм NEB Stable. Трансформанты высевали на чашки с агаризированной питательной средой, содержащей селективный антибиотик ампициллин в концентрации 50 мг/мл. Чашки Петри помещали в термостат при температуре 30°С на 18-24 часа. Затем с одиночных колоний были ссажены ночные культуры в объеме 3,5 мл среды LB. Жидкая среда LB содержала антибиотик ампициллин в концентрации 50 мг/мл.
Плазмиды выделяли из бактерий при помощи набора QIAprep Spin Miniprep Kit (Qiagen, Германия). Проводили рестрикционный анализ клонов векторов pJET1.2_CD4, pJET1.2_CCR5, на основании которого отбирали плазмиды, наблюдаемая рестрикционная картина которых совпадала с предполагаемой. Корректность нуклеотидных последовательностей данных конструкций подтверждена секвенированием по Сэнгеру с использованием праймеров, входящих в состав набора CloneJET PCR Cloning Kit (Thermo Fisher Scientific, США) для проверки на отсутствие значимых нуклеотидных замен, инсерций и делеций.

Пример 3. Амплификация методом ПЦР генов рецепторов CD4 и CCR5 из плазмид pJET1.2_CD4 и pJET1.2_CCR5
Проведена амплификация необходимых генов рецепторов с плазмид pJET1.2_CD4 и pJET1.2_CCR5 с использованием праймеров, обеспечивающих частичное перекрытие в последовательностях CD4 и CCR5 с целью дальнейшей постановки ПНР с перекрывающимися праймерами.

Для обоих ПЦР продуктов температура отжига праймеров составила 60°С. Длительность элонгации - от 60 до 90 секунд. Число циклов - 25. ПЦР смесь разделяли в 1,5% агарозном геле. Продукты, длиной 1411 п. н. (CD4), 1107 п. н. (CCR5) (фиг.5) вырезаны из геля и элюированы с использованием коммерческого набора QIAquick Gel Extraction Kit (Qiagen, Германия) согласно инструкции производителя.
Пример 4. Объединение генов рецепторов CD4+CCR5 при помощи ПЦР с удлинением внахлест
Концентрацию выделенных ДНК фрагментов измеряли при помощи NanoDrop One (Thermo Fisher Scientific, США). Затем фрагменты смешивали в эквимолярных количествах и осуществляли первый этап (overlap) синтеза кДНК копий, кодирующих открытые рамки считывания рецепторов CD4 и CCR5 с помощью полимеразы Phusion High-Fidelity (NEB, США), используя температурно-временной профиль, представленный в таблице 4. Второй этап (extension) осуществляли при помощи фланкирующих праймеров, содержащих сайты рестрикции XmaI и SbfI (таблица 1) с заданным температурно-временным профилем (таблица 4).
Очистку продуктов амплификации ДНК при помощи электрофореза в агарозном геле осуществляли способом, описанным ранее. После визуализации под УФ-излучением фрагменты ДНК необходимой длины, разделенные в агарозном геле (фиг. 6), вырезали и выделяли из геля с использованием набора QIAquick Gel Extraction kit (Qiagen, Германия).
Пример 5. Клонирование полученного ампликона рецепторов CD4+CCR5 в целевой вектор для обратной генетики VSV
На фиг. 3 представлена схема клонирования трансгенов, с формированием генетической конструкции для экспрессии генов mNG_CD4-CCR5 в структуре плазмиды rVSVjnNeonGreen [CD4-CCR5].
Продукт OL PCR CD4-CCR5 рестрицировали эндонуклеазами рестрикции ApaI и SbfI (NEB, США) и клонировали в вектор pStem-rVSV-mNG по данным сайтам (вектор получен ранее в лаборатории «Векторных систем на основе вирусных геномов» ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора). Для этого 2 мкг плазмидной ДНК pStem-rVSV-mNG гидролизовали эндонуклеазой рестрикции ApaI (NEB, США) в буфере CutSmart при 25°С 1 час, после чего вносили 10 е.а. рестриктазы SbfI (NEB, США) и инкубировали при 37°С 1 час, далее добавляли 2 е.а. рекомбинантной щелочной фосфатазы креветок (rSAP) (NEB, США), необходимой для предотвращения «самолигирования» вектора, инкубировали при 37°С 1 час. Продукты гидролиза разделяли методом электрофореза, фрагменты ДНК, соответствующие гидролизованному вектору (-12800 п. н.), выделяли из агарозного геля с использованием коммерческого набора QIAquick Gel Extraction Kit (Qiagen, Германия) согласно инструкции производителя. Нуклеотидные вставки, кодирующие целевые трансгены, подготавливали аналогичным образом, исключая из протокола добавление щелочной фосфотазы.
Смешивали 1 мкг гидролизованного вектора pStem-rVSV-mNG/Apal+Sbfl с гидролизованным по Apal и Sbfl фрагментом ДНК трансгена в эквимолярном соотношении, добавляли реакционный буфер и Т4 ДНК лигазу. После инкубации при 20°С в течение 60 минут, лигазную смесь использовали для трансформации компетентных клеток E.coli. Скрининг клонов-трансформантов проводили с использованием методов ПЦР и рестрикционного анализа рекомбинантных плазмид (фиг. 7). Корректность нуклеотидных последовательностей плазмидных конструкций подтверждена секвенированием по Сэнгеру.
Таким образом, в структуре полученной рекомбинантной плазмиды rVSV_mNeonGreen [CD4-CCR5] получена генетическая конструкция для экспрессии генов mNG_CD4-CCR5, образованная последовательностями флуоресцентного белка mNeonGreen и слитого через Р2А-пептид рецептора CD4 и корецептора CCR5 человека и имеющая нуклеотидную последовательность (SEQ ID NO 1).
Пример 6. Получение репликационно-дефектного вируса везикулярного стоматита rVSV_mNeonGreen [CD4-CCR5]
Получение репликационно-дефектного вируса везикулярного стоматита проводили путем трансфекции перевиваемой линии клеток НЕК293 (коллекция культур клеток ФБУН ГНЦ ВБ Вектор Роспотребнадзора). Монослой клеточной культуры (конфлюентность 90%) трансфецировали с использованием коммерческого набора липофектамина 3000 (Thermo Scientific, США) согласно инструкции производителя полученной генетической плазмидной конструкцией rVSV_mNeonGreen [CD4-CCR5] совместно с хелперными плазмидами pStem-vN, pStem-vP, pStem-vL обеспечивающими экспрессию белковой репликативной машинерии вируса везикулярного стоматита (N, Р и L), а также ДНК-зависимой РНК-полимеразой бактериофага Т7. Количество каждой из плазмидных конструкций составило: pStem-N - 0,25 мкг; pStem-P - 0,25 мкг; pStem-L - 1,0 мкг; pStem-T7 - 1,5 мкг; rVSV_mNeonGreen [CD4-CCR5] - 2 мкг.
За час до трансфекции в чашке Петри с культурой клеток НЕК293 (плотность монослоя 90-95%) удаляли ростовую среду ДМЕМ/Р-12 и вносили 10,0 мл бессывороточной среды OptiMEM. Готовили реакционную смесь, для этого 50 мкл липофектамина 3000 разводили в 500 мкл среды OptiMEM, инкубировали в течение 5 мин при температуре (22±2)°С и смешивали с 4 мкг общей плазмидной ДНК, также разведенной в 500 мкл OptiMEM с внесением рекомендуемого производителем количества Р3000 реагента. Полученную смесь инкубировали в течение 20 минут при температуре (22±2)°С.
После инкубации полученные комплексы вносили по каплям к клеткам НЕК293 равномерно по всей площади монослоя и культивировали при (37±1)°С. Через сутки производили смену питательной среды на поддерживающую (ДМЕМ/F-12 с 2% эмбриональной бычьей сыворотки), с последующим культивированием в CO2-инкубаторе при температуре (37±1)°С в атмосфере (5,0±0,5) % CO2 в течение 120-168 часов.
Вируссодержащую культуральную жидкость собирали в стерильную центрифужную пробирку объемом 15 мл, осветляли посредством низкоскоростного центрифугирования при 10 тысяч об/мин в течение 15 минут, аликвотировали и хранили до использования при минус 80°С.
Штамм идентифицирован в ФБУН ГШД ВБ Вектор» Роспотребнадзора в феврале 2019 г. и депонирован в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-1107.
Титр накопления в культуре клеток HEK293_Env_R5 рекомбинантного штамма вируса везикулярного стоматита rVSV_mNeonGreen [CD4-CCR5] составил - 5±0,33 lg ТЦЦ50/мл.
Пример 7. Инфицирование трангенных культур клеток НЕК293 Env_R5 и НЕК293 Env_X4, экспонирующих на своей поверхности gp161 ВИЧ-1 одного из двух типов тропностей
Полученным вирусом rVSV_mNG_CD4-CCR5 проведено инфицирование трангенных культур клеток HEK293_Env_R5 и HEK293_Env_X4, экспонирующих на своей поверхности gp161 ВИЧ-1 с тропностями к корецепторам CCR5 или CXCR4, соответственно.
Рекомбинантный вирус специфически связывается с гликопротеинами gp161 R5-тропности на поверхности клеток HEK293_Env_R5. Связывание с рецепторами на мембранах трансгенных клеток и проникновение вируса в клетку детектировалось благодаря флуоресценции белка mNeonGreen в случае репродукции вируса. Последующий специфический виролиз трансгенных HEK293_Env_R5 клеток проявлялся слиянием клеток и деструкцией монослоя. При этом в трансгенной культуре клеток HEK293_Env_X4 при инфицировании вирусом rVSV_mNG_CD4-CCR5 изменений в монослое не наблюдали. Результаты представлены на фигурах 8 и 9.
Фиг. 8 (А, Б) - 24 часа после заражения клеток HEK293_Env_R5 вирусом rVSV_mNeonGreen [CD4-CCR5]; (В, Г) - 24 часа после заражения клеток HEK293_Env_X4 вирусом rVSV_mNeonGreen [CD4-CCR5]. А, В -световая микроскопия, Б, Г - флуоресцентная микроскопия, размер масштабной шкалы - 300 мкм.
Фиг. 9 (А, Б) - 48 часов после заражения клеток HEK293_Env_R5 вирусом rVSV_mNeonGreen [CD4-CCR5]; (В, Г) - 48 часов после заражения клеток НЕК293 вирусом rVSV_mNeonGreen [CD4-CCR5]. А, В - световая микроскопия, Б, Г - флуоресцентная микроскопия, размер масштабной шкалы - 100 мкм.
Наличие и функциональная активность генов рецепторов CD4+CCR5 подтверждается эффективной репродукцией рекомбинантных вирусов в трансгенных клеточных линиях HEK293_Env_R5, имитирующих ВИЧ-1 инфицированные клетки тропности R5 (безопасная модель ВИЧ-инфицированных клеток).
При изучении культуральных свойств установлено, что полученный рекомбинантный вирус проявляет тропность в отношении gp161 ВИЧ-1 R5-3KcnpeccHpyioHj,HX клеток. Рекомбинантный вирус не способен связываться и репродуцироваться в эукариотических клетках, не экспонирующих на поверхности gp161 ВИЧ-1 R5 тропности. Характер цитопатического действия при репродукции - слияние клеток с образованием синцития, с последующей деструкцией монослоя. При внутриклеточной репродукции вируса rVSV_mNG_CD4-CCR5 детектируется флуоресценция mNeonGreen.
Пример 8. Определение титра накопления репликационно - дефектного вируса rVSV_mNG_CD4-CCR5
Инфекционную активность рекомбинантного вируса везикулярного стоматита оценивали при постановках классических вирусологических методов титрования в чувствительных культурах клеток HEK293_Env_R5 с выражением в 50% тканевых цитопатических дозах (ТЦЦ50).
Из вируссодержащего материала готовили последовательные десятикратные разведения на питательной среде ДМЕМ/F-12 с 10-1 до 10-8. Из 96-луночных планшетов (Corning Costar, США) с суточной культурой клеток трансгенных HEK293_Env_R5 удаляли ростовую питательную среду и каждое разведение вносили по 100 мкл в 8 лунок 96-луночного культурального планшета. В качестве контроля использовали интактную культуру клеток, в которую вносили поддерживающую среду (ДМЕМ/F-12 с 2% эмбриональной бычьей сыворотки). Планшеты с культурой клеток инкубировали в СО2-инкубаторе при температуре 37°С в атмосфере 5,0% СО2. По окончании культивирования в каждой лунке оценивали наличие или отсутствие репродукции вируса по наличию, либо отсутствию экспрессии флуоресцентного белка mNeonGreen. Учет результатов титрования проводили на 4 сутки после постановки реакции.
Расчет инфекционной активности вируса определяли как количество 50% тканевых цитопатических доз (ТЦД50) в 1 мл по методу Рида и Менча. Титр накопления в культуре клеток HEK293_Env_R5 рекомбинантного штамма вируса везикулярного стоматита rVSV_mNG_CD4-CCR5 составил 5±0,33 lg ТЦД50/МЛ.
Фиг. 10 - определение титра репликационно-деффектного вируса rVSVmNeonGreen [CD4-CCR5], 48 часов после заражения клеток HEK293_Env_R5 вирусом в разведениях от 10-1 до 10-8. Световая и флуоресцентная микроскопия, размер масштабной шкалы - 300 мкм.
Пример 9. Культивирование рекомбинантного вируса везикулярного стоматита rVSV_mNG_CD4-CCR5
Рекомбинантный вирус везикулярного стоматита rVSV_mNG_CD4-CCR5 культивировали в перевиваемой трансгенной клеточной линии HEK293_Env_R5. Из культуральных флаконов со сформировавшимся клеточным монослоем удаляли ростовую питательную среду, монослой клеток двукратно промывали раствором Хэнкса. Множественность заражения при инфицировании клеток составляла 0,1-0,00001 ТПД5 0/клетку. Вносили поддерживающую питательную среду (ДМЕМ/F-12 с 2% эмбриональной бычьей сыворотки) с последующим культивированием в СО2-инкубаторе при температуре 37°С в атмосфере 5,0 СО2 в течение 48-72 часов. Сбор вируссодержащей культуральной жидкости проводили при 75% деструкции монослоя клеток. Далее замораживали и хранили до использования при температуре -80°С.
Таким образом, заявляемый технический результат - расширение спектра генетических конструкций для экспрессии генов mNG_CD4-CCR5, рекомбинантных плазмид и рекомбинантных репликационно-дефектных вирусов, обеспечивающих виролизис клеток, экспонирующих на своей поверхности gp120/gp41 ВИЧ-1 тропности R5. Реализация подтверждается примерами 1-10, представленными в описании изобретения.
Источники патентной и научно-технической информации:
1. Zaitseva М.В. et al. CXCR4 and CCR5 on human thymocytes: biological function and role in HIV-1 infection // The Journal of Immunology. - 1998. - T. 161. - №. 6. - C. 3103-3113.
2. Moore J.P. et al. The CCR5 and CXCR4 coreceptors-central to understanding the transmission and pathogenesis of human immunodeficiency virus type 1 infection // AIDS research and human retroviruses. - 2004. - T. 20. - №. 1. - C. 111-126.
3. www.who.int (World Health Organization)
4. Kemnic T.R., Gulick P.G. HIV antiretroviral therapy // StatPearls [Internet]. - StatPearls Publishing, 2019.
5. Blood G.A.C. et al. Human immunodeficiency virus (HIV) // Transfusion Medicine and Hemotherapy. - 2016. - T. 43. - №. 3. - C. 203.
6. Visseaux B. et al. Hiv-2 molecular epidemiology // Infection, Genetics and Evolution. - 2016. - T. 46. - C. 233-240.
7. Nyamweya S. et al. Comparing HIV-1 and HIV-2 infection: Lessons for viral immunopathogenesis // Reviews in medical virology. - 2013. - T. 23. - №. 4. - C. 221-240.
8. Campbell-Yesufu О. ., Gandhi R.T. Update on human immunodeficiency virus (HIV)-2 infection // Clinical infectious diseases. - 2011. - T. 52. - №. 6. - C. 780-787.
9. Okuma К. et al. A recombinant vesicular stomatitis virus encoding CCR5-tropic HIV-1 receptors targets HIV-1-infected cells and controls HIV-1 infection // Microbes and infection. - 2017. - T. 19. - №.4-5. - C. 277-287.
10. Schnell M.J. et al. Construction of a novel virus that targets HIV-1-infected cells and controls HIV-1 infection // Cell. - 1997. - T. 90. - №. 5. - C. 849-857.
11. Liu Y. et al. Broadly neutralizing antibodies for HIV-1: efficacies, challenges and opportunities // Emerging microbes & infections. - 2020. - T. 9. - №. 1. - C. 194-206.
12. W. Hu, R. Kaminski, F. Yang et al., "RNA-directed gene editing specifically eradicates latent and prevents new HIV-1 infection," Proceedings of the National Academy of Sciences of the United States of America, vol. 111, no. 31, pp. 11461-11466, 2014.
13. Kaminski R. et al. Negative feedback regulation of HIV-1 by gene editing strategy // Scientific reports. - 2016.- T. 6. - №. 1. - C. 1-11.
14. Lebbink R.J. et al. A combinational CRISPR / Cas9 gene-editing approach can halt HIV replication and prevent viral escape // Scientific reports. - 2017. - T. 7. - №. l. - C. 1-10.
15. Jabbar M.A., Nayak D.P. Intracellular interaction of human immunodeficiency virus type 1 (ARV-2) envelope glycoprotein gp160 with CD4 blocks the movement and maturation of CD4 to the plasma membrane // Journal of virology. - 1990. - T. 64. - №. 12. - C. 6297-6304.
16. Патент США №9610346.
17. Патент США №7736649.
18. Заявка Японии №2005520482.
19. Международная заявка WO 1999002657.
20. Патент США №7081243, МПК A61K 39/21, опубл. 25.07.2006 г. (прототип).
--->
Перечень последовательностей
<110> Федеральное бюджетное учреждение науки «Государственный научный центр
вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере
защиты прав потребителей и благополучия человека (ФБУН ГНЦ ВБ «Вектор»
Роспотребнадзора)
<120> Генетическая конструкция для экспрессии генов mNG_CD4 CCR5,
рекомбинантная плазмида rVSV_mNG_CD4 CCR5 и рекомбинантный штамм вируса
везикулярного стоматита rVSV_mNG_CD4-CCR5, обеспечивающий таргетный
виролизис клеток, экспонирующих на своей поверхности белки gp120/gp41
ВИЧ-1 тропности R5.
<160> SEQ ID NO 4
<210> SEQ ID NO:1
<211> 3338
<212> PRT
<213> Artificial Sequence
<220>
<223> Нуклеотидная последовательность генетической конструкции для экспрессии
генов mNG_CD4-CCR5.
<400> 1
AACAGAGATCGATCTGTTTCCTTGACGCTAGCCGCCACCATGGTGAGCAAGGGCG 55
AGGAGGATAATATGGCCTCTCTCCCAGCGACACATGAGTTACACATCTTTGGCTC 110
CATCAACGGTGTGGACTTTGACATGGTGGGTCAGGGCACCGGCAATCCTAACGAC 165
GGTTATGAGGAGTTAAACCTGAAGTCCACCAAGGGTGACCTCCAGTTCTCCCCCT 220
GGATTCTGGTCCCTCATATCGGGTATGGCTTCCATCAGTACCTGCCCTACCCTGA 275
CGGGATGTCGCCTTTCCAGGCTGCTATGGTCGATGGCTCCGGATACCAAGTCCAT 330
CGCACAATGCAGTTTGAAGATGGTGCCTCCCTTACTGTCAACTACCGCTACACCT 385
ACGAGGGAAGCCACATCAAAGGAGAGGCCCAGGTGAAGGGGACTGGTTTCCCTGC 440
TGACGGTCCTGTGATGACCAACTCGCTGACCGCTGCGGACTGGTGCAGGTCGAAG 495
AAGACTTACCCCAACGACAAAACCATCATCAGTACCTTTAAGTGGAGTTACACCA 550
CTGGAAATGGCAAGCGGTACAGGAGCACTGCGCGGACCACCTACACCTTTGCCAA 605
GCCAATGGCGGCTAACTATCTGAAGAACCAGCCGATGTACGTGTTCCGTAAGACG 660
GAGCTGAAGCACTCCAAGACCGAGCTTAACTTCAAGGAGTGGCAAAAGGCATTCA 715
CCGATGTGATGGGCATGGACGAGCTGTACAAGGGATCCGGCTCCGGAGCTACTAA 770
CTTCAGCCTGCTGAAGCAGGCTGGAGACGTGGAGGAGAACCCCGGGCCCAACCGG 825
GGAGTCCCTTTTAGACACTTGCTTCTGGTGCTGCAACTGGCGCTCCTCCCAGCAG 880
CCACTCAGGGAAAGAAAGTGGTGCTGGGCAAAAAAGGGGATACAGTGGAACTGAC 935
CTGTACAGCTTCCCAGAAGAAGAGCATACAATTCCACTGGAAAAACTCCAACCAG 990
ATAAAGATTCTGGGAAATCAGGGCTCCTTCTTAACTAAAGGTCCATCCAAGCTGA 1045
ATGATCGCGCTGACTCAAGAAGAAGCCTTTGGGACCAAGGAAACTTTCCCCTGAT 1100
CATCAAGAATCTTAAGATAGAAGACTCAGATACTTACATCTGTGAAGTGGAGGAC 1155
CAGAAGGAGGAGGTGCAATTGCTAGTGTTCGGATTGACTGCCAACTCTGACACCC 1210
ACCTGCTTCAGGGGCAGAGCCTGACCCTGACCTTGGAGAGCCCCCCTGGTAGTAG 1265
CCCCTCAGTGCAATGTAGGAGTCCAAGGGGTAAAAACATACAGGGGGGGAAGACC 1320
CTCTCCGTGTCTCAGCTGGAGCTCCAGGATAGTGGCACCTGGACATGCACTGTCT 1375
TGCAGAACCAGAAGAAGGTGGAGTTCAAAATAGACATCGTGGTGCTAGCTTTCCA 1430
GAAGGCCTCCAGCATAGTCTATAAGAAAGAGGGGGAACAGGTGGAGTTCTCCTTC 1485
CCACTCGCCTTTACAGTTGAAAAGCTGACGGGCAGTGGCGAGCTGTGGTGGCAGG 1540
CGGAGAGGGCTTCCTCCTCCAAGTCTTGGATCACCTTTGACCTGAAGAACAAGGA 1595
AGTGTCTGTAAAACGGGTTACCCAGGACCCTAAGCTCCAGATGGGCAAGAAGCTC 1650
CCGCTCCACCTCACCCTGCCCCAGGCCTTGCCTCAGTATGCTGGCTCTGGAAACC 1705
TCACCCTGGCCCTTGAAGCGAAAACAGGAAAGTTGCATCAGGAAGTGAACCTGGT 1760
GGTGATGAGAGCCACTCAGCTCCAGAAAAATTTGACCTGTGAGGTGTGGGGACCC 1815
ACCTCCCCTAAGCTGATGCTGAGTTTGAAACTGGAGAACAAGGAGGCAAAGGTCT 1870
CGAAGCGGGAGAAGGCGGTGTGGGTGCTGAACCCTGAGGCGGGGATGTGGCAGTG 1925
TCTGCTGAGTGACTCGGGACAGGTCCTGCTGGAATCCAACATCAAGGTTCTGCCC 1980
ACATGGTCCACCCCGGTGCAGCCAATGGCCCTGATTGTGCTGGGGGGCGTCGCCG 2035
GCCTCCTGCTTTTCATTGGGCTAGGCATCTTCTTCTGTGTCAGGTGCCGGCACCG 2090
AAGGCGCCAAGCAGAGCGGATGTCTCAGATCAAGAGACTCCTCAGTGAGAAGAAG 2145
ACCTGCCAGTGTCCTCACCGGTTTCAGAAGACATGTAGCCCCATTTGACTATGAA 2200
AAAAACTAACAGTAATCAGCCACCATGGATTATCAAGTGTCAAGTCCAATCTATG 2255
ACATCAATTATTATACATCGGAGCCCTGCCAAAAAATCAATGTGAAGCAAATCGC 2310
AGCCCGCCTCCTGCCTCCGCTCTACTCACTGGTGTTCATCTTTGGTTTTGTGGGC 2365
AACATGCTGGTCATCCTCATCCTGATAAACTGCAAAAGGCTGAAGAGCATGACTG 2420
ACATCTACCTGCTCAACCTGGCCATCTCTGACCTGTTTTTCCTTCTTACTGTCCC 2475
CTTCTGGGCTCACTATGCTGCCGCCCAGTGGGACTTTGGAAATACAATGTGTCAA 2530
CTCTTGACAGGGCTCTATTTTATAGGCTTCTTCTCTGGAATCTTCTTCATCATCC 2585
TCCTGACAATCGATAGGTACCTGGCTGTCGTCCATGCTGTGTTTGCTTTAAAAGC 2640
CAGGACGGTCACCTTTGGGGTGGTGACAAGTGTGATCACTTGGGTGGTGGCTGTG 2695
TTTGCGTCTCTCCCAGGAATCATCTTTACCAGATCTCAAAAAGAAGGTCTTCATT 2750
ACACCTGCAGCTCTCATTTTCCATACAGTCAGTATCAATTCTGGAAGAATTTCCA 2805
GACATTAAAGATAGTCATCTTGGGGCTGGTCCTGCCGCTGCTTGTCATGGTCATC 2860
TGCTACTCGGGAATCCTAAAAACTCTGCTTCGGTGTCGAAATGAGAAGAAGAGGC 2915
ACAGGGCTGTGAGGCTTATCTTCACCATCATGATTGTTTATTTTCTCTTCTGGGC 2970
TCCCTACAACATTGTCCTTCTCCTGAACACCTTCCAGGAATTCTTTGGCCTGAAT 3025
AATTGCAGTAGCTCTAACAGGTTGGACCAAGCTATGCAGGTGACAGAGACTCTTG 3080
GGATGACGCACTGCTGCATCAACCCCATCATCTATGCCTTTGTCGGGGAGAAGTT 3135
CAGAAACTACCTCTTAGTCTTCTTCCAAAAGCACATTGCCAAACGCTTCTGCAAA 3190
TGCTGTTCTATTTTCCAGCAAGAGGCTCCCGAGCGAGCAAGCTCAGTTTACACCC 3245
GATCCACTGGGGAGCAGGAAATATCTGTGGGCTTGTGACCTGCAGGCCATGCTCA 3300
AAGAGGCCTCAATTATATTTGAGTTTTTAATTTTTATG 3338
<210> SEQ ID NO:2
<211> 236
<212> PRT
<213> Artificial Sequence
<220>
<223> Аминокислотная последовательность белка mNeonGreen
<400> 2
MVSKGEEDNMASLPATHELHIFGSINGVDFDMVGQGTGNPNDGYEELNLKSTKGD 55
LQFSPWILVPHIGYGFHQYLPYPDGMSPFQAAMVDGSGYQVHRTMQFEDGASLTV 110
NYRYTYEGSHIKGEAQVKGTGFPADGPVMTNSLTAADWCRSKKTYPNDKTIISTF 165
KWSYTTGNGKRYRSTARTTYTFAKPMAANYLKNQPMYVFRKTELKHSKTELNFKE 220
WQKAFTDVMGMDELYK 236
<210> SEQ ID NO:3
<211> 457
<212> PRT
<213> Artificial Sequence
<220>
<223> Аминокислотная последовательность белка CD4
<400> 3
NRGVPFRHLLLVLQLALLPAATQGKKVVLGKKGDTVELTCTASQKKSIQFHWKNS 55
NQIKILGNQGSFLTKGPSKLNDRADSRRSLWDQGNFPLIIKNLKIEDSDTYICEV 110
EDQKEEVQLLVFGLTANSDTHLLQGQSLTLTLESPPGSSPSVQCRSPRGKNIQGG 165
KTLSVSQLELQDSGTWTCTVLQNQKKVEFKIDIVVLAFQKASSIVYKKEGEQVEF 220
SFPLAFTVEKLTGSGELWWQAERASSSKSWITFDLKNKEVSVKRVTQDPKLQMGK 275
KLPLHLTLPQALPQYAGSGNLTLALEAKTGKLHQEVNLVVMRATQLQKNLTCEVW 330
GPTSPKLMLSLKLENKEAKVSKREKAVWVLNPEAGMWQCLLSDSGQVLLESNIKV 385
LPTWSTPVQPMALIVLGGVAGLLLFIGLGIFFCVRCRHRRRQAERMSQIKRLLSE 440
KKTCQCPHRFQKTCSPI* 457
<210> SEQ ID NO:4
<211> 352
<212> PRT
<213> Artificial Sequence
<220>
<223> Аминокислотная последовательность белка CCR5
<400> 4
MDYQVSSPIYDINYYTSEPCQKINVKQIAARLLPPLYSLVFIFGFVGNMLVILIL 55
INCKRLKSMTDIYLLNLAISDLFFLLTVPFWAHYAAAQWDFGNTMCQLLTGLYFI 110
GFFSGIFFIILLTIDRYLAVVHAVFALKARTVTFGVVTSVITWVVAVFASLPGII 165
FTRSQKEGLHYTCSSHFPYSQYQFWKNFQTLKIVILGLVLPLLVMVICYSGILKT 220
LLRCRNEKKRHRAVRLIFTIMIVYFLFWAPYNIVLLLNTFQEFFGLNNCSSSNRL 275
DQAMQVTETLGMTHCCINPIIYAFVGEKFRNYLLVFFQKHIAKRFCKCCSIFQQE 330
APERASSVYTRSTGEQEISVGL* 352
<---

Группа изобретений относится к генетической конструкции для экспрессии генов mNG_CD4-CCR5, рекомбинантной плазмиде и рекомбинантному вирусу везикулярного стоматита (ВВС), экспонирующему на своей поверхности рецепторы CD4 и CCR5 человека. Предложена генетическая конструкция для экспрессии генов mNG_CD4 и CCR5, образованная последовательностями флуоресцентного белка mNeonGreen и слитого через P2A-пептид рецептора CD4 и корецептора CCR5 человека и имеющего нуклеотидную последовательность SEQ ID NO: 1. Предложена рекомбинантная плазмида rVSV_mNeonGreen [CD4-CCR5], кодирующая рецепторы CD4 и CCR5 человека в составе кДНК копии генома рекомбинантного вируса везикулярного стоматита (ВВС), имеющая размер 15259 п.н. и содержащая вышеуказанную генетическую конструкцию. Также предложен рекомбинантный штамм ВВС rVSV_mNeonGreen [CD4-CCR5], содержащий вышеуказанную рекомбинантную плазмиду и обеспечивающий виролизис клеток, экспонирующих на своей поверхности белки gp120/gp41 ВИЧ-1 тропности R5. Штамм депонирован в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-1107. Группа изобретений обеспечивает расширение спектра генетических конструкций для экспрессии генов mNG_CD4-CCR5, рекомбинантных плазмид и штаммов вирусов, обеспечивающих виролизис клеток, экспонирующих на своей поверхности белки gp120/gp41 ВИЧ-1 тропности R5. 3 н. п. ф-лы, 10 ил., 4 табл., 9 пр.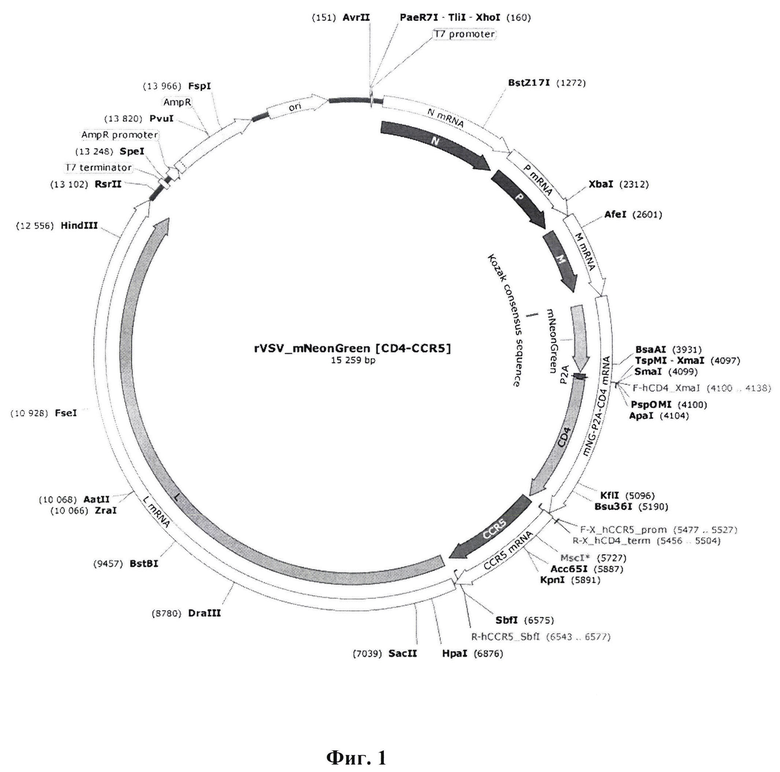
1. Генетическая конструкция для экспрессии генов mNG_CD4-CCR5, образованная последовательностями флуоресцентного белка mNeonGreen, слитого через P2A-пептид рецептора CD4 и корецептора CCR5 человека, и имеющая нуклеотидную последовательность SEQ ID NO: 1.
2. Рекомбинантная плазмида rVSV_mNeonGreen [CD4-CCR5], кодирующая рецепторы CD4 и CCR5 человека в составе кДНК копии генома рекомбинантного вируса везикулярного стоматита (ВВС), предназначенная для обеспечения виролизиса ВИЧ-инфицированных клеток, имеющая размер 15259 п.н., содержащая в соответствии с физической и генетической картой, представленной на фиг. 1, систему экспрессии генов по п. 1 и состоящая из следующих фрагментов:
• T7 promoter - нуклеотидная последовательность промотора бактериофага T7, необходимая для in vitro транскрипции антигеномной последовательности РНК рекомбинантного вируса везикулярного стоматита;
• N - открытая рамка считывания гена N, кодирующего нуклеопротеин;
• P - открытая рамка считывания гена P, кодирующего фосфопротеин;
• M - открытая рамка считывания гена M, кодирующего матриксный белок;
• mNeonGreen - яркий мономерный желто-зеленый флуоресцентный белок, полученный из LanYFP и имеющий аминокислотную последовательность SEQ ID NO: 2;
• P2A - 2A пептид из полипротеина тешовируса-1, обеспечивающий расщепление полипротеина на этапе трансляции;
• CD4 - ген, кодирующий гликопротеин CD4 и имеющий аминокислотную последовательность SEQ ID NO: 3;
• CCR5 - ген, кодирующий C-C хемокиновый рецептор типа 5 и имеющий аминокислотную последовательность SEQ ID NO: 4;
• L - открытая рамка считывания гена L, кодирующего РНК-зависимую РНК-полимеразу;
• T7 terminator - терминатор транскрипции РНК-полимеразы бактериофага Т7;
• Ген β-лактамазы под контролем промотора, генетический маркер, определяющий устойчивость к β-лактамным антибиотикам клеток бактерии E. coli;
• Точка начала репликации ori плазмидного вектора ColE1/pMB1/pBR322/pUC с высоким числом копий.
3. Рекомбинантный штамм вируса везикулярного стоматита rVSV_mNeonGreen [CD4-CCR5], содержащий рекомбинантную плазмиду rVSV_mNeonGreen [CD4-CCR5] по п. 2, экспонирующий на своей поверхности рецепторы CD4 и CCR5 человека, обеспечивающий таргетный виролизис клеток, экспонирующих на своей поверхности белки gp120/gp41 ВИЧ-1 тропности R5 и депонированный в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-1107.
| US 7081243 B1, 25.07.2006 | |||
| WO 1999002657 A1, 21.01.1999 | |||
| ДВОЙНОЙ ВЕКТОР ДЛЯ ПОДАВЛЕНИЯ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2010 |
|
RU2562868C2 |
| OKUMA K | |||
| et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Microbes Infect | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Найдено онлайн: | |||
Авторы
Даты
2022-03-28—Публикация
2021-09-02—Подача