Данное изобретение относится к новым замещенным 3-арилсульфонил-пиразоло[1,5-а]пиримидинам, антагонистам серотониновых 5-НТ6 рецепторов, лекарственным началам и фармацевтическим композициям, содержащим лекарственные начала в виде указанных соединений, а также к способу лечения и предупреждения развития различных заболеваний центральной нервной системы (ЦНС), когнитивных и нейродегенеративных заболеваний. В основе фармакологического эффекта новых лекарственных начал лежит их способность взаимодействовать с серотониновыми 5-НТ6 рецепторами, играющими важную роль в лечении заболеваний ЦНС, в частности болезни Альцгеймера (БА), болезни Паркинсона, болезни Гантингтона, шизофрении, других нейродегенеративных заболеваний, когнитивных расстройств, и ожирения.
Использование эффективных и селективных антагонистов серотониновых 5-НТ6 рецепторов для лечения заболеваний ЦНС, в частности шизофрении, БА и других нейродегенеративных заболеваний и когнитивных расстройств, научно обосновано и является чрезвычайно перспективным направлением в современной медицине [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X., Buschmann H. Medicinal chemistry strategies to 5-НТ6 receptor ligands as potential cognitive enhancers and antiobesity agents. Drug Disc. Today. 2006; 11:283-299]. Эти рецепторы у млекопитающих находятся исключительно в центральной нервной системе, причем главным образом в участках головного мозга, ответственных за обучение и память [Ge'rard С., Martres M.-P., Lefe'vre К., Miquel M.-C., Verge' D., Lanfumey L., Doucet E., Hamon M., El Mestikawy S. Immunо-localisation of serotonin 5-НТ6 receptor-like material in the rat central nervous system. Brain Research. 1997; 746:207-219]. Кроме того, показано [Dawson L.A., Nguyen H.Q., Li P. The 5-HT(6) receptor antagonist SB-271046 selectively enhances excitatory neurotransmission in the rat frontal cortex and hippocampus. Neuropsychopharmacology. 2001; 25:662-668], что 5-НТ6 рецепторы являются модуляторами нескольких нейромедиаторных систем, включая холинэргическую, норадренэргическую, глутаматэргическую и допаминэргическую. Учитывая фундаментальную роль этих систем в нормальных когнитивных процессах, а также их дисфункцию при нейродегенерации, становится очевидной исключительная роль 5-НТ6 рецепторов в формировании нормальной или «патологической» памяти. В большом числе современных работ показано, что блокирование 5-НТ6 рецепторов приводит к значительному усилению консолидации памяти в различных животных моделях обучения-запоминания-воспроизведения [Foley A.G., Murphy K.J., Hirst W.D., Gallagher H.C., Hagan J.J., Upton N., Walsh F.S., Regan C.M. The 5-HT(6) receptor antagonist SB-271046 reverses scopolamine-dismpted consolidation of a passive avoidance task and ameliorates spatial task deficits in aged rats. Neuropsychopharmacology. 2004; 29:93-100. Riemer С., Borroni E., Levet-Trafit В., Martin J.R., Poli S., Porter R.H., Bos M. Influence of the 5-HT6 receptor on acetylcholine release in the cortex: pharmacological characterization of 4-(2-bromo-6-pyrrolidin-l-ylpyridine-4-sulfonyl)phenylamine, a potent and selective 5-НТ6 receptor antagonist. J. Med. Chem. 2003; 46:1273-1276. King M.V., Woolley M.L., Topham I.A., Sleight A.J., Marsden C.A., Fone K.C. 5-HT6 receptor antagonists reverse delay-dependent deficits in novel object discrimination by enhancing consolidation e an effect sensitive to NMDA receptor antagonism. Neuropharmacology 2004; 47:195-204]. Также показано значительное улучшение когнитивных функций у старых крыс в модели водного лабиринта Моррисона при действии антагониста 5-НТ6 рецепторов [Foley A.G., Murphy K.J., Hirst W.D., Gallagher H.C., Hagan J.J., Upton N., Walsh F.S., Regan C.M. The 5-HT(6) receptor antagonist SB-271046 reverses scopolamine-disrupted consolidation of a passive avoidance task and ameliorates spatial task deficits in aged rats. Neuropsychopharmacology. 2004; 29:93-100]. В последнее время наряду с достижением более глубокого понимания роли 5-НТ6 рецепторов в когнитивных процессах сформировалось более четкое представление о возможных фармакофорных свойствах их антагонистов [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X., Buschmann H. Medicinal chemistry strategies to 5-НТ6 receptor ligands as potential cognitive enhancers and antiobesity agents. Drug Disc. Today. 2006; 11:283-299]. Результатом этого явилось создание высокоаффинных селективных лигандов («молекулярных инструментов»), а затем и клинических кандидатов. В настоящее время ряд антагонистов 5-НТ6 рецепторов находится на разных стадиях клинических испытаний в качестве лекарственных кандидатов для лечения БА, болезни Гантингтона, шизофрении (антипсихотики) и других нейродегенеративных и когнитивных заболеваний (таблица 1) [http://integrity.prous.com].
Лечение когнитивных заболеваний
Лечение когнитивных заболеваний
Еще одним привлекательным свойством антагонистов 5-НТ6 рецепторов является их способность подавлять аппетит, что может привести к созданию на их основе принципиально новых средств для понижения избыточного веса и ожирения [Vicker S.P., Dourish C.T. Serotonin receptor ligands and the treatment of obesity. Curr. Opin. Investig. Drugs. 2004; 5:377-388]. Этот эффект подтвержден во многих исследованиях [Holenz J., Pauwels P.J., Diaz J.L., Merce R., Codony X., Buschmann H. Medicinal chemistry strategies to 5-НТ6 receptor ligands as potential cognitive enhancers and antiobesity agents. Drug Disc. Today. 2006; 11:283-299. Davies S.L. Drug discovery targets: 5-НТ6 receptor. Drug Future. 2005; 30:479-495], его механизм основан на подавлении антагонистами 5-НТ6 рецепторов сигналинга гамма-аминомасляной кислоты и увеличении выброса альфа-меланоцитстимулирующего гормона, что в конечном итоге приводит к уменьшению потребности в пище [Woolley M.L. 5-HT6 receptors. Curr. Drug Targets CNS Neurol. Disord. 2004; 3:59-79]. В настоящее время два антагониста 5-НТ6 рецепторов находятся на первой стадии клинических испытаний в качестве лекарственных кандидатов для лечения избыточного веса (таблица 1) [http://integrity.prous.com].
В этой связи поиск селективных и эффективных антагонистов серотониновых 5-НТ6 рецепторов представляется оригинальным и перспективным подходом к созданию новых лекарственных средств для лечения широкого круга заболеваний ЦНС, в том числе неврологических и нейродегенеративных заболеваний и когнитивных расстройств.
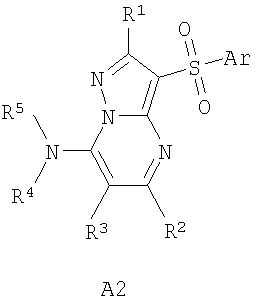
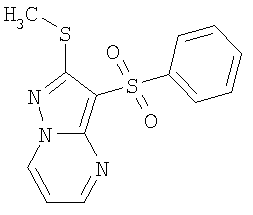
В литературе имеется значительное число публикаций, посвященных биологически активным сульфонилпроизводным азагетероциклических соединений, в том числе лигандам серотониновых рецепторов. Так, например, описаны замещенные 1-(2-аминоэтил)-4-арилсульфонил-пиразолы общей формулы А1 в качестве лигандов серотониновых 5-HT2с рецепторов [WO 2003057674 А1] и 7-амино-3-сульфонил-пиразоло[1,5-а]пиримидины А2 в качестве антагонистов серотониновых 5-HT6 рецепторов [ЕР 941994 А1, 1999]
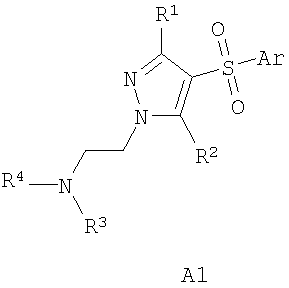
А1: Ar = алкил, арил; R1 и R2=Н, ОН, алкил, алкокси; R3 и R4=Н, алкил, арил.
А2: Ar = арил, гетероциклил; R1=Н, алкил, алкилтио; R2=Н, алкил, галоген; R3=Н, алкил, гидроксиалкил; R4 и R5=Н; NR4R5 = пиперазинил.
С целью разработки новых высокоэффективных лекарственных препаратов авторами данного изобретения выполнены широкие исследования в ряду замещенных 3-арилсульфонил-пиразоло[1,5-а]пиримидинов, в результате чего найдены новые лекарственные начала, представляющие собой антагонисты 5-НТ6 рецепторов.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Агонисты» означают лиганды, которые, связываясь с рецепторами данного типа, активно способствуют передаче этими рецепторами свойственного им специфического сигнала и тем самым вызывают биологический ответ клетки.
«Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько «низших алкильных» заместителей. Алкил может иметь один или несколько одинаковых или различных заместителей («алкильных заместителей»), включая галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или Rk aRk+1 аN-, Rk aRk+1 aNC(=O)-, Rk aRk+1 aNC(=S)-, Rk aRk+1 aNSO2-, где Rk a и Rk+1 a независимо друг от друга представляют собой «заместители аминогруппы», значение которых определено в данном разделе, например атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rk a и Rk+1 a вместе с атомом N, с которым они связаны, образуют через Rk a и Rk+1 a 4-7-членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, этил, пропил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил, метоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными «алкильными заместителями» являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или Rk aRk+1 aN-, Rk aRk+1 aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил.
«Алкилсульфанил» означает CnH2n+1S-группу, в которой алкильная группа определена в данном разделе.
«Алкилокси» означает CnH2n+1O- группу, в которой алкил определен в данном разделе. Предпочтительными алкилоксигруппами являются метокси, этокси, н-пропокси, изо-пропокси и н-бутокси.
«Алкилоксиалкил» означает CnH2n+1OCmH2m- группу, в которой алкил определен в данном разделе.
«Анксиолитик» или «Транквилизатор» означает лекарственное средство, предназначенное для лечения тревожных расстройств.
«Антагонисты» означают лиганды, которые связываются с рецепторами определенного типа и не вызывают активного клеточного ответа. Антагонисты препятствуют связыванию агонистов с рецепторами и тем самым блокируют передачу специфического рецепторного сигнала.
«Антидепрессант» означает лекарственное средство, предназначенное для лечения депрессии.
«Антипсихотик» означает лекарственное средство, предназначенное для лечения психотических заболеваний.
«Арил» означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимущественно от 6 до 10 атомов углерода. Арил может содержать один или более «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями арильных групп являются фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с неароматической циклической системой или гетероциклом.
«Арилсульфонил» означает арил-SO2- группу, в которой значение арил определено в данном разделе.
«Галоген» означает фтор, хлор, бром и йод. Предпочтительными яляются фтор, хлор и бром.
«Гидроксиалкил» означает HOCmH2m- группу, в которой алкил определен в данном разделе.
«Депрессия» означает большую депрессию; эпизодическую, хроническую и рецидивирующую формы большой депрессии; дистимическое расстройство (дистимию); циклотимию; аффективные расстройства; синдром сезонного аффективного расстройства; биполярные расстройства, включая биполярные расстройства I и II типа, а также другие депрессивные расстройства и состояния. Термин депрессия означает также депрессивные состояния, сопровождающие болезнь Альцгеймера, васкулярную деменцию; расстройства настроения, индуцированные алкоголем и веществами; шизоаффективные расстройства депрессивного типа; расстройства адаптации. Кроме того, депрессия включает депрессивные состояния онкологических больных; при болезни Паркинсона; депрессию после инфаркта миокарда; депрессию бесплодных женщин; педиатрическую депрессию; послеродовую депрессию, а также другие депрессивные состояния, сопровождающие соматические, неврологические и прочие заболевания.
«Заместитель» означает химический радикал, который присоединяется к скэффолду (фрагменту), например, «заместитель алкильный», «заместитель аминогруппы», «заместитель гидроксильный», «заместитель карбамоильный», «заместитель циклической системы», значения которых определены в данном разделе.
«Заместитель гидроксигруппы» означает заместитель, присоединенный к гидроксигруппе, включая алкил, арил, гетероарил, аралкил, гетероаралкил, гидроксиалкил, ацил, ароил, алкилоксиалкил, арилоксиалкил, гетероциклилоксиалкил и т.п.
«Когнитивные расстройства или нарушения когнитивных функций (cognitive disorder)» означают нарушение (ослабление) умственных возможностей, включающих внимание, память, мышление, познание, обучение, речевые, мыслительные, исполнительные и творческие способности, ориентацию во времени и пространстве, в частности, когнитивные расстройства, связанные с болезнями Альцгеймера, Паркинсона и Гантингтона; старческое слабоумие; возрастные расстройства памяти (age-associated memory impairment, AAMI); дисметаболические энцефалопатии; психогенные нарушения памяти; амнезия; амнестические расстройства; транзиторная глобальная амнезия; диссоциативная амнезия; васкулярная деменция; легкие (или умеренные) когнитивные нарушения (mild cognitive impairment, MCI); синдром нарушения внимания с гиперактивностью (attention deficit hyperactivity disorder, AD/HD); когнитивные нарушения, сопровождающие психотические заболевания, эпилепсию, делирий, аутизм, психозы, синдром Дауна, биполярные расстройства и депрессию; СПИД-ассоциированная деменция; деменция при гипотиреоидизме; деменция, индуцированная алкоголем, веществами, вызывающими зависимость, и нейротоксинами; деменция, сопровождающая нейродегенеративные заболевания, например мозжечковую дегенерацию и амиотрофический латеральный склероз; когнитивные расстройства, развивающиеся при инсульте, инфекционных и онкологических заболеваниях головного мозга, а также при черепно-мозговых травмах; нарушения когнитивных функций, ассоциированные с аутоиммунными и эндокринными заболеваниями, и прочие когнитивные расстройства.
«Лекарственное начало» (лекарственная субстанция, лекарственное вещество, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного средства (препарата).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Лиганды» (от латинского ligo - связывать) представляют собой химические вещества (малая молекула, неорганический ион, пептид, белок и прочее), способные взаимодействовать с рецепторами, которые трансформируют это взаимодействие в специфический сигнал.
«Нейродегенеративное заболевание (НЗ)» означает специфическое состояние или заболевание, характеризующиеся повреждением и первичной гибелью популяций нервных клеток в определенных областях центральной нервной системы. Нейродегенеративные заболевания включают, но не ограничивают, болезни Альцгеймера и Паркинсона; болезнь (хорею) Гантингтона; рассеянный склероз; мозжечковую дегенерацию; амиотрофический латеральный склероз; деменцию с тельцами Леви; спинальную мускульную атрофию; периферическую нейропатию; губчатый энцефалит («коровье бешенство», Creutzfeld-Jakob Disease); СПИД-ассоциированную деменцию; мультиинфарктную деменцию; лобно-височную деменцию; лейкоэнцефалопатию (болезнь исчезающего белого вещества); хронические нейродегенеративные заболевания; инсульт; ишемическое, реперфузионное и гипоксическое повреждение мозга; эпилепсию; церебральную ишемию; глаукому; черепно-мозговую травму; синдром Дауна; энцефаломиелит; менингит; энцефалит; нейробластому; шизофрению; депрессию. Кроме того, нейродегенеративные заболевания включают патологические состояния и расстройства, развивающиеся при гипоксии, злоупотреблении веществами, вызывающими зависимость, при воздействии нейротоксинов, инфекционных и онкологических заболеваниях головного мозга, а также нейрональные повреждения, ассоциированные с аутоиммунными и эндокринными заболеваниями, и прочие нейродегенеративные процессы.
«Низший алкил» означает линейный или разветвленный алкил с 1-4 атомами углерода.
«Ноотропы» или «ноотропики», они же нейрометаболические стимуляторы, - вещества, принимаемые для улучшения умственных способностей.
«Психические расстройства» (психические заболевания) - это болезни или болезненные состояния, связанные с нарушением и/или расстройством психики. Психические расстройства включают аффективные расстройства (биполярные аффективные расстройства, большая депрессия, гипомания, малая депрессия, маниакальный синдром, синдром Котара, циклотимия, шизоаффективное расстройство и др.); интеллектуально-мнестические расстройства, мании (гипомания, графомания, клептомания, магазиномания, мания преследования, мономания, порнографомания, эротомания и др.); расстройство множественной личности, аменцию, белую горячку, бред, бредовый синдром, галлюцинаторный синдром, галлюцинации, галлюциноз, гомицидоманию, делирий, иллюзию, кверулянтство, клиническую ликантропию, макропсию, манихейский бред, микропсию, наркоманию, нервную анорексию, онейроидный синдром, пароноид, паранойю, парафрению, псевдогаллюцинации, психоз, синдром Котара, шизоаффективное расстройство, шизотипическое расстройство, шизофрению, шизофреноподобное расстройство, шизофреноморфное расстройство, синдром Шребера, Даниэль Пауля); фобии (агарофобию, арахнофобию, аутофобию, верминофобию, гидрозофобию, гидрофобию, демофобию, зоофобию, канцерофобию, клаустрофобию, климакофобию, ксенофобию, мизофобию, радиофобию, светобоязнь, сколицефобию, скотофобию, социофобию, тетрафобию, трискаидефобию, эротофобию); алкогольные психозы, алкогольный палимпсест, аллотриофагию, афазию, графоманию, диссоциативные фуги, диссоциативные расстройства, дисфории, интернет-зависимости, ипохондрию, истерию, копрофемию, манию преследования, меланхолию, мизантропию, обсессию, панические атаки, синдром Аспергера, синдром Капгра, синдром Мюнхгаузена, синдром Ретта, синдром Фреголи, синдром дефицита внимания и гиперактивности, синдром навязчивых состояний, синдром последствий хронической наркотизации, синдром психического автоматизма, синдром раннего детского аутизма, сумашествие, тафофилию, тревожные состояния, синдром Хикикомори, эротографоманию и др.
«Психотические заболевания» это все виды шизофрении; шизофреноподобные заболевания; шизотипические расстройства; шизоаффективные расстройства, включая биполярный и депрессивный типы; бредовые расстройства, включая бред отношения, преследования, величия, ревности, эротомании, а также ипохондрический, соматический, смешанный и недифференцируемый бред; кратковременные психотические расстройства; индуцированные психотические расстройства; индуцированные веществами психотические расстройства, а также другие психотические расстройства.
«Рецепторы» (от латинского recipere - получать, узнавать) представляют собой биологические макромолекулы, расположенные на цитоплазматической мембране клетки или внутриклеточно, способные специфически взаимодействовать с ограниченным набором физиологически активных веществ (лигандов) и трансформировать сигнал об этом взаимодействии в определенный клеточный ответ.
«Сульфанильная группа» означает R-S- группу, в которой R представляет собой алкил, циклоалкил, арил, гетероарил, гетероциклил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, значения которых определены в данном разделе.
«Сульфинильная группа» означает R-SO- группу, в которой R представляет собой алкил, циклоалкил, арил, гетероарил, гетероциклил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, значения которых определены в данном разделе.
«Сульфонильная группа» означает R-SO2- группу, в которой R представляет собой алкил, циклоалкил, арил, гетероарил, гетероциклил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, значения которых определены в данном разделе.
«Терапевтический коктейль» представляет собой одновременно администрируемую комбинацию двух и более лекарственных препаратов, обладающих различным механизмом фармакологического действия и направленных на различные биомишени, участвующие в патогенезе заболевания.
«Тревожные расстройства» (anxiety) означают генерализованную (неконкретную) тревогу; острое неконтролируемое беспокойство; паническое заболевание; фобии, например агорафобию (сильная боязнь людных мест) или социальную фобию (сильную боязнь унижения перед другими людьми), или любую конкретную фобию (сильную боязнь конкретных предметов, животных или ситуаций, в виде боязни высоты, медицинских процедур, лифтов, открытого пространства и т.п.); навязчивые состояния (обсессивно-компульсивное расстройство); посттравматическое стрессовое расстройство и острое стрессовое расстройство. Кроме того, к тревожным расстройствам относятся тревожные состояния, индуцированные алкоголем или веществами; тревога при расстройствах адаптации, а также смешанные формы тревожных расстройств и депрессии.
«Шизофрения» означает все известные типы, формы и варианты заболевания, в том числе простую, гебефреническую, параноидную, гипертоксическую (фебрильную), кататоническую, шизоаффективную, остаточную или недифференцируемую шизофрению и/или формы шизофрении, определенные в классификации Американской психиатрической ассоциации (American Psychiatric Association; in: Diagnostic and Statistical Manual of Mental Disorders, IV Edition, Washington D.C. 2000) или в Международной классификации (International Statistical Classification of Diseases and Related Health Problems) или любые другие известные формы.
«Фармацевтическая композиция» означает композицию, включающую в себя соединение формулы I и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарата алюминия и желатина. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения. Фармацевтические композиции, как правило, получают с помощью стандартных процедур, предусматривающих смешение активного соединения с жидким или тонко измельченным твердым носителем.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные. (Подробное описание свойств таких солей дано в Berge S.M. et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее предпочтительными являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин.
Предметом настоящего изобретения являются новые замещенные 3-арилсульфонил-пиразоло[1,5-а]пиримидины общей формулы 1 и их фармацевтически приемлемые соли и/или гидраты
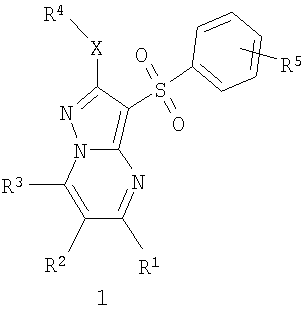
где R1 представляет собой атом водорода, C1-С3алкил, C1-С3-алкилоксиС1-С3алкил, гидроксиС1-С3алкил, пиридил;
R2 представляет собой атом водорода, атом галогена, C1-С3алкил, фенилокси или пиридилокси;
R3 представляет собой атом водорода, C1-С3алкил, C1-С3алкилокси, С1-С3алкилокси(С1-С3)алкил, гидрокси(С1-С3)алкил, пиридил;
R4 представляет собой C1-С3алкил,
R5 представляет собой атом водорода, один или два атома галогена, C1-С3алкил, C1-С3алкилокси или гидроксил;
Х представляет собой атом серы или сульфинильную группу (SO),
исключая соединения общей формулы 1, в которых R1 и R3 одновременно представляют собой метил, R2 представляет собой атом водорода, a R4-X представляет собой метилсульфанильную группу или этилсульфанильную группу.
Предпочтительными замещенными 3-арилсульфонил-пиразоло[1,5-а]пиримидинами общей формулы 1 являются соединения общей формулы 1.1 и их фармацевтически приемлемые соли и/или гидраты
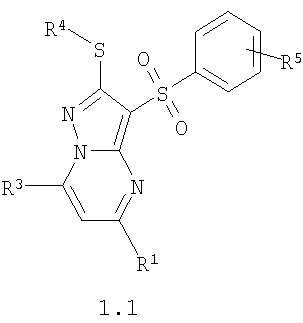
где R1, R3, R4 и R5 имеют вышеуказанное значение.
Более предпочтительными замещенными 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинами общей формулы 1 и 1.1 являются замещенные 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидины общей формулы 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10
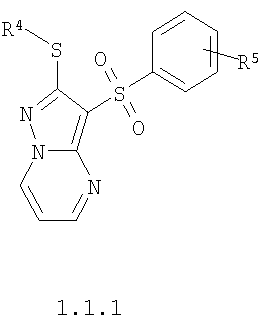
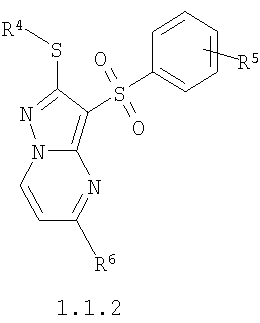
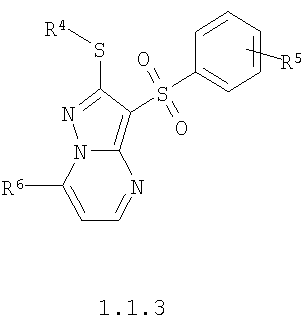
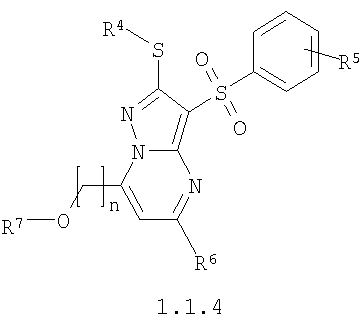
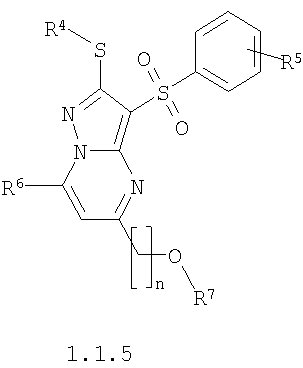
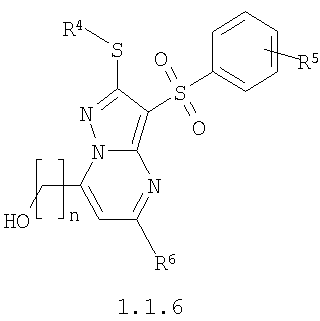
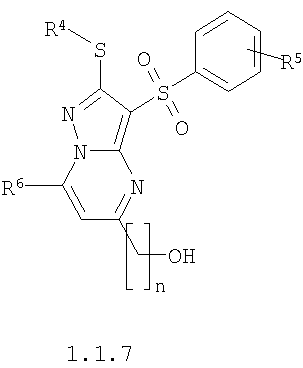
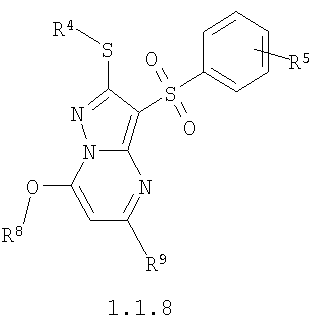
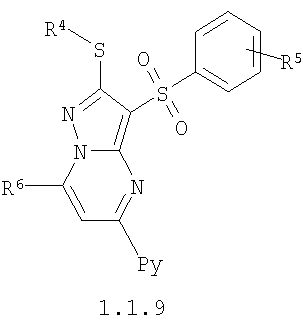
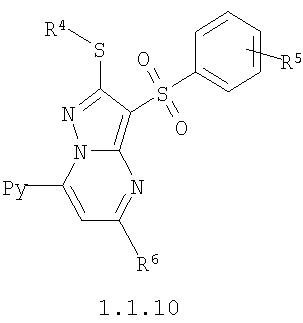
где R4 и R3 имеют вышеуказанное значение; R6 и R7 независимо друг от друга представляют собой водород или С1-С3алкил; R8 представляет собой водород или C1-С3алкил; R9 представляет собой С1-С3алкил или пиридил; Ру представляет собой пиридил, n принимает значения 1-3.
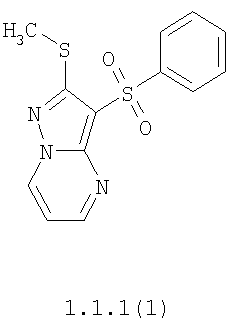
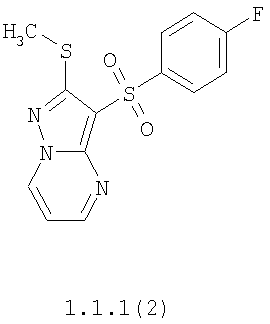
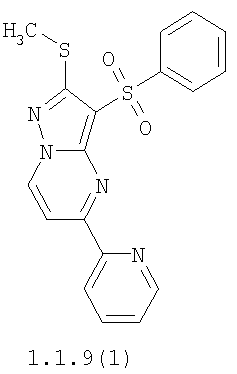
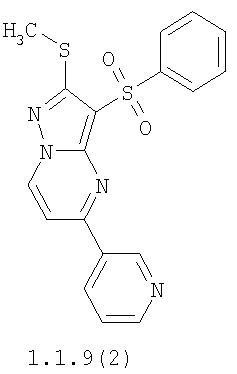
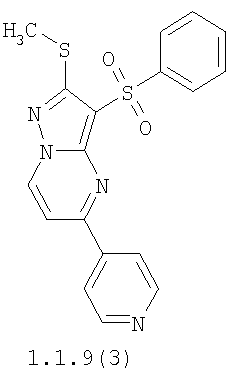
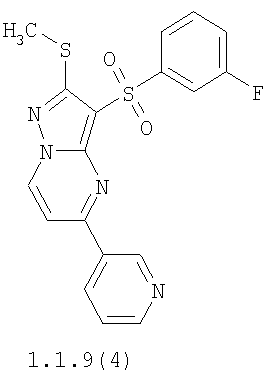
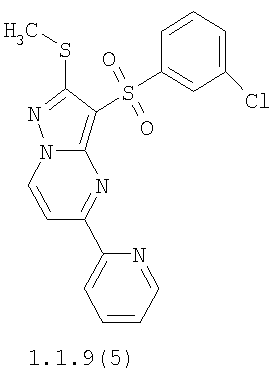
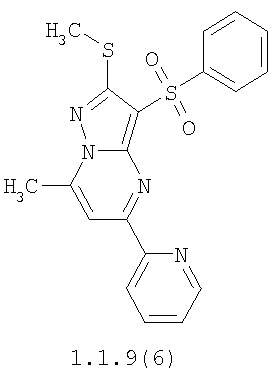
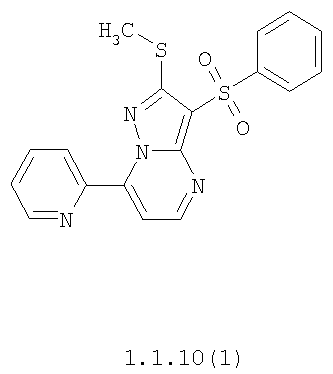
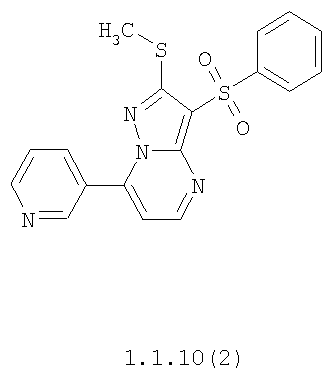
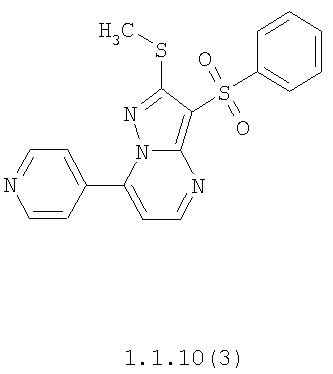
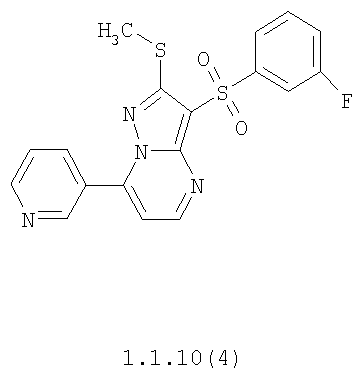
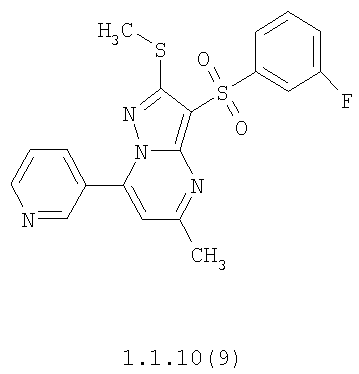
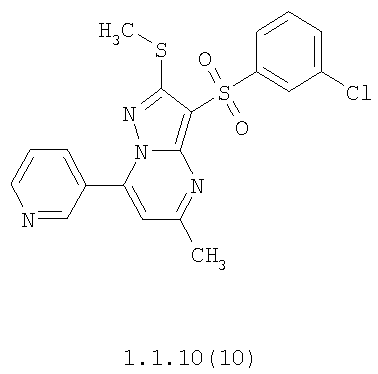
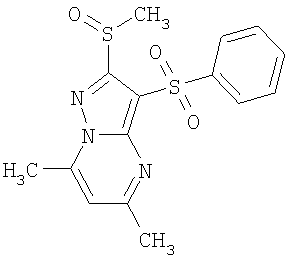
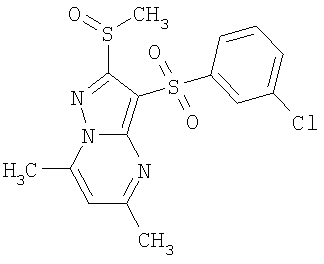
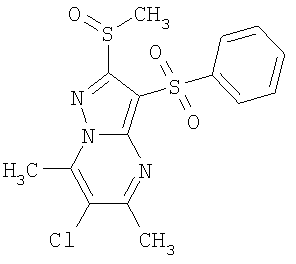
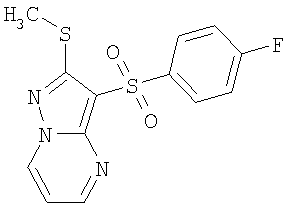
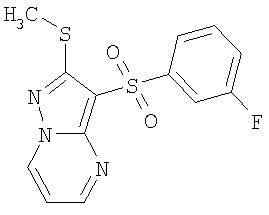
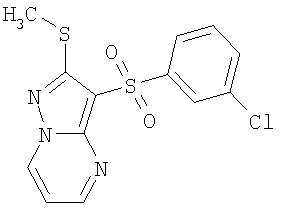
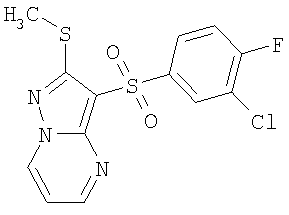
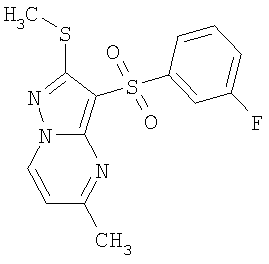
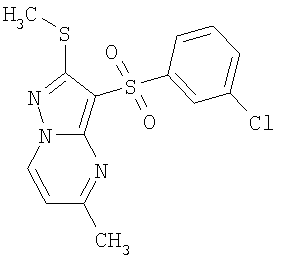
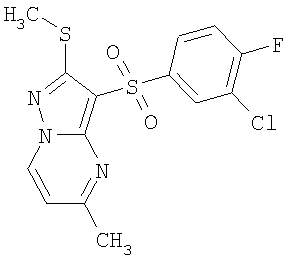
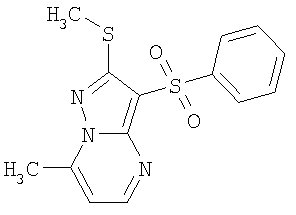
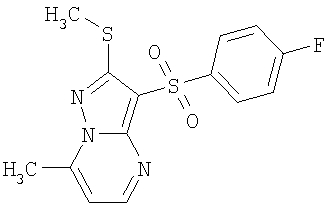
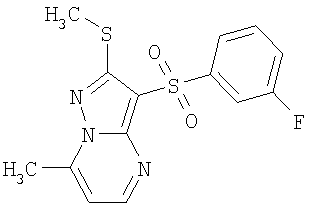
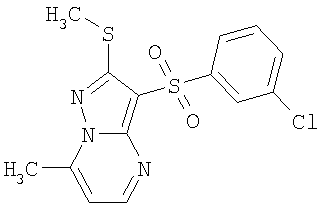
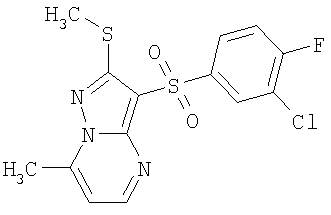
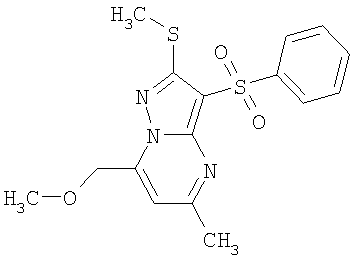
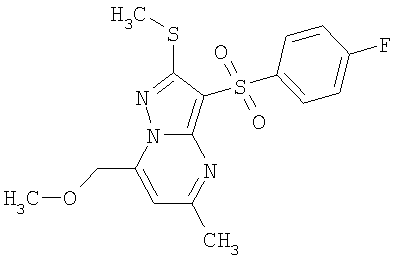
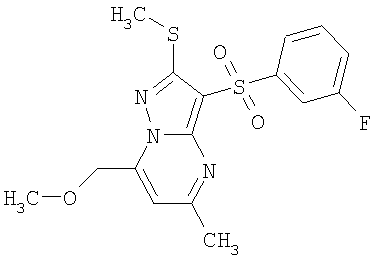
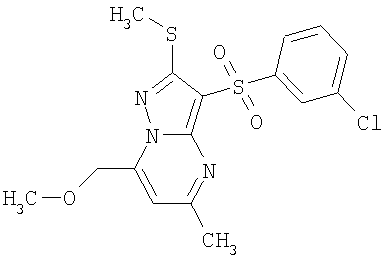
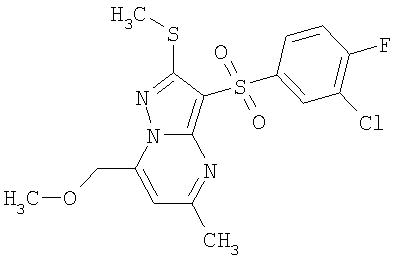
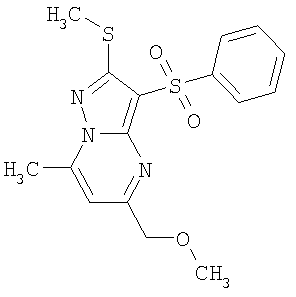
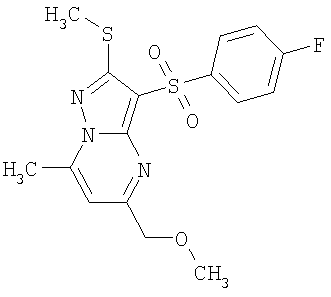
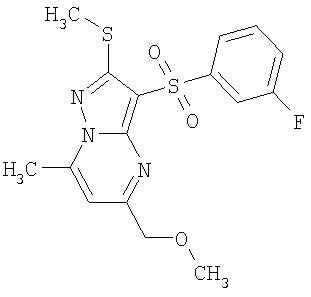
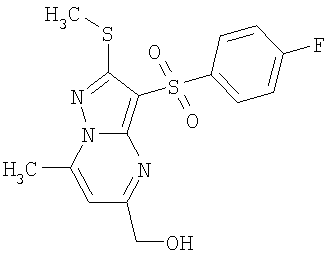
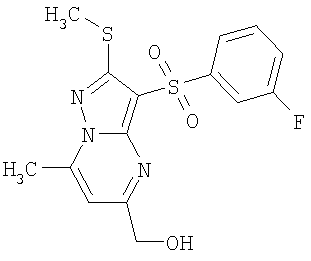
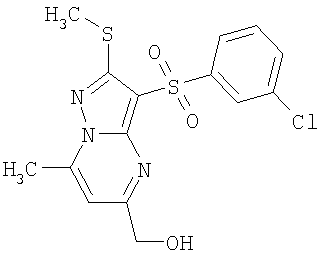
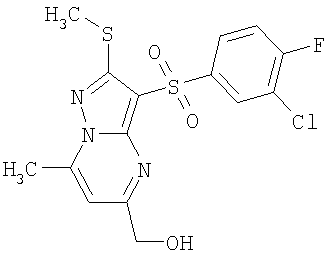
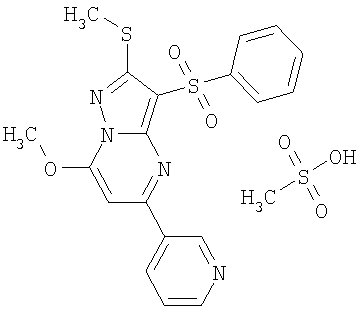
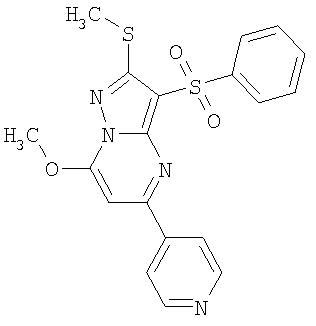
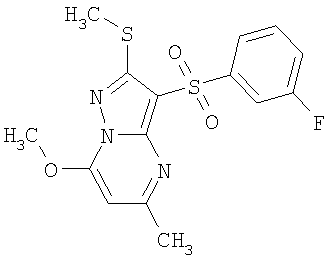
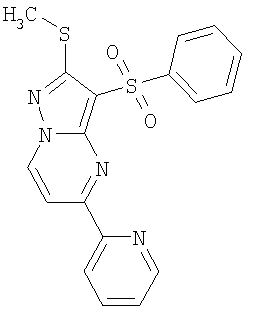
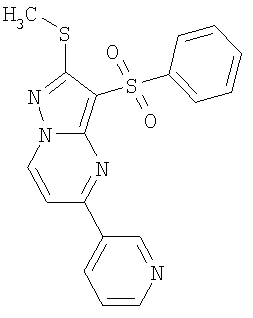
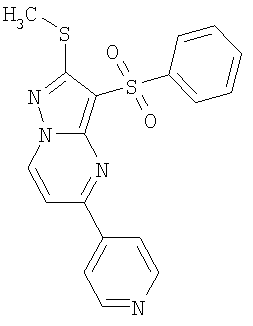
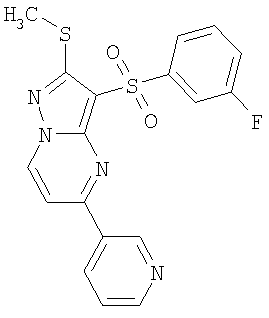
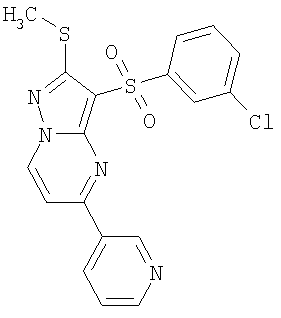
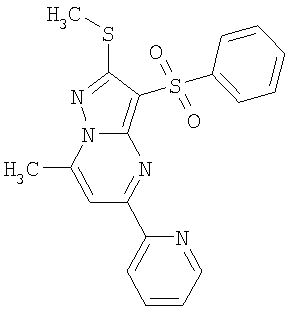
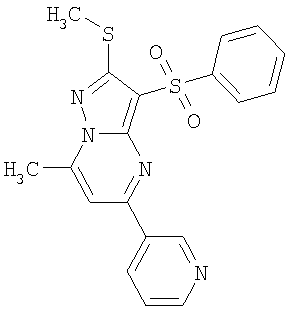
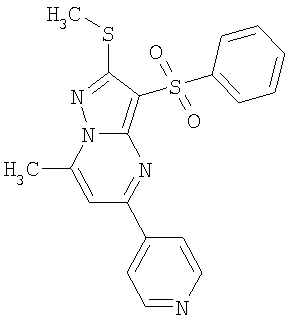
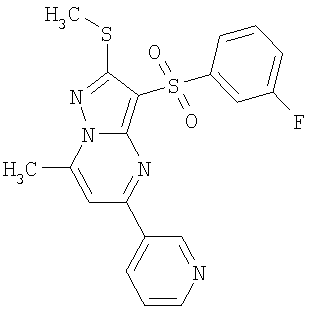
Более предпочтительными замещенными 2-метилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинами общей формулы 1 и 1.1 являются 2-метилсульфанил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(1), 2-метилсульфанил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(2), 2-метилсульфанил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(3), 2-метилсульфанил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(4), 2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(5), 5-метил-2-метилсульфанил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.2(1), 5-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.2(2), 5-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.2(3), 5-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.2(4), 5-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.2(5), 7-метил-2-метилсульфанил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.3(1), 7-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.3(2), 7-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.3(3), 7-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.3(4), 7-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.3(5), 5-метил-2-метилсульфанил-7-метоксиметил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.4(1), 5-метил-2-метилсульфанил-7-метоксиметил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.4(2), 5-метил-2-метилсульфанил-7-метоксиметил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.4(3), 5-метил-2-метилсульфанил-7-метоксиметил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.4(4), 5-метил-2-метилсульфанил-7-метоксиметил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.4(5), 7-метил-2-метилсульфанил-5-метоксиметил-3-фенилсульфонил-пиразоло[1,5-а] пиримидин 1.1.5(1), 7-метил-2-метилсульфанил-5-метоксиметил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.5(2), 7-метил-2-метилсульфанил-5-метоксиметил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.5(3), 7-метил-2-метилсульфанил-5-метоксиметил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.5(4), 7-метил-2-метилсульфанил-5-метоксиметил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.5(5), 7-гидроксиметил-5-метил-2-метилсульфанил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.6(1), 7-гидроксиметил-5-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а] пиримидин 1.1.6(2), 7-гидроксиметил-5-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а] пиримидин 1.1.6(3), 7-гидроксиметил-5-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.6(4), 7-гидроксиметил-5-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.6(5), 5-гидроксиметил-7-метил-2-метилсульфанил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.7(1), 5-гидроксиметил-7-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.7(2), 5-гидроксиметил-7-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.7(3), 5-гидроксиметил-7-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.7(4), 5-гидроксиметил-7-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.7(5), 5-метил-2-метилсульфанил-7-метокси-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.8(1), 2-метилсульфанил-7-метокси-5-(пиридин-2-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.8(2), 2-метилсульфанил-7-метокси-5-(пиридин-3-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.8(3), 2-метилсульфанил-7-метокси-5-(пиридин-4-ил)-3-фенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.8(4), 5-метил-2-метилсульфанил-7-метокси-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.8(5), 2-метилсульфанил-5-(пиридин-2-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(1), 2-метилсульфанил-5-(пиридин-3-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(2), 2-метилсульфанил-5-(пиридин-4-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(3), 2-метилсульфанил-5-(пиридин-3-ил)-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.9(4), 2-метилсульфанил-5-(пиридин-3-ил)-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.9(5), 7-метил-2-метилсульфанил-5-(пиридин-2-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(6), 7-метил-2-метилсульфанил-5-(пиридин-3-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(7), 7-метил-2-метилсульфанил-5-(пиридин-4-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(8), 7-метил-2-метилсульфанил-5-(пиридин-3-ил)-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.9(9), 7-метил-2-метилсульфанил-5-(пиридин-3-ил)-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.9(10), 2-метилсульфанил-7-(пиридин-2-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(1), 2-метилсульфанил-7-(пиридин-3-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(2), 2-метилсульфанил-7-(пиридин-4-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(3), 2-метилсульфанил-7-(пиридин-3-ил)-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.10(4), 2-метилсульфанил-7-(пиридин-3-ил)-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.10(5), 5-метил-2-метилсульфанил-7-(пиридин-2-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(6), 5-метил-2-метилсульфанил-7-(пиридин-3-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(7), 5-метил-2-метилсульфанил-7-(пиридин-4-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(8), 5-метил-2-метилсульфанил-7-(пиридин-3-ил)-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.10(9), 5-метил-2-метилсульфанил-7-(пиридин-3-ил)-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.10(10) и их фармацевтически приемлемые соли и/или гидраты
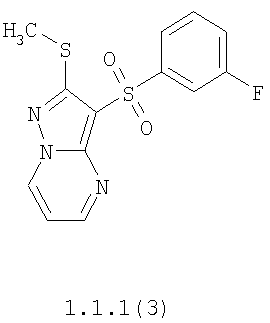
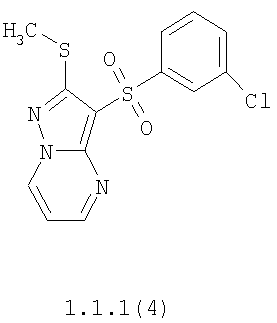
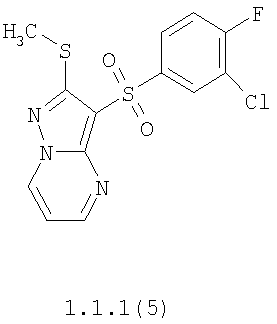
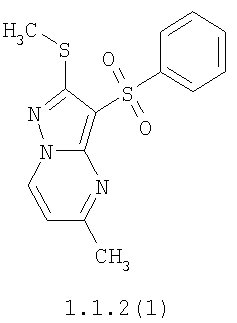
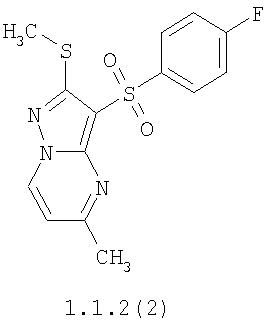
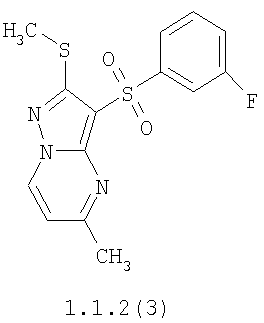
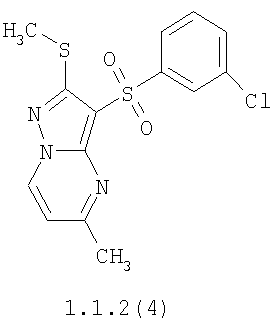
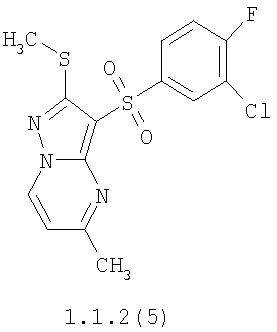
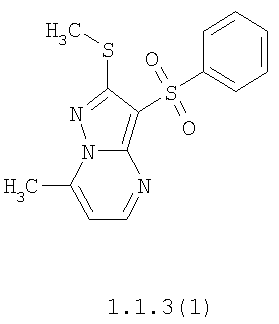
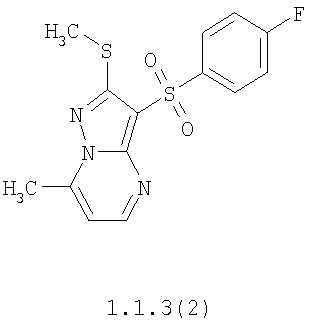
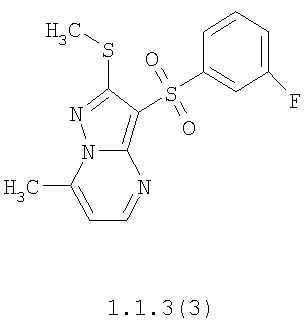
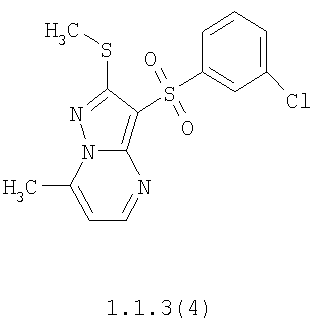
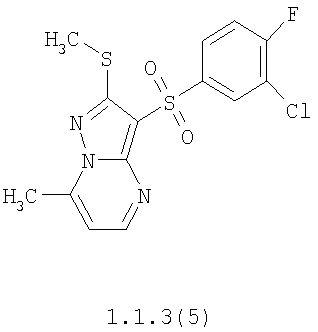
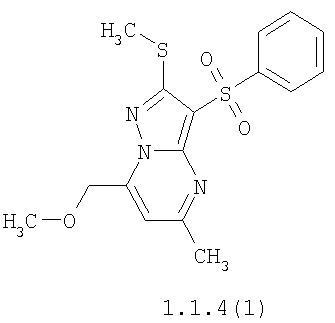
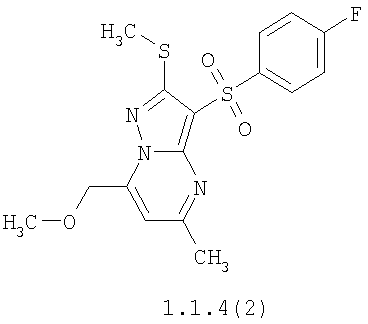
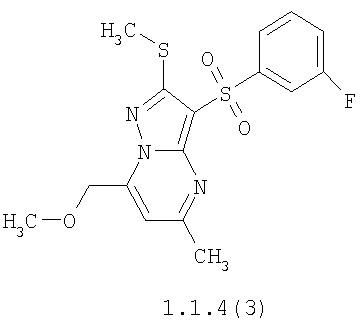
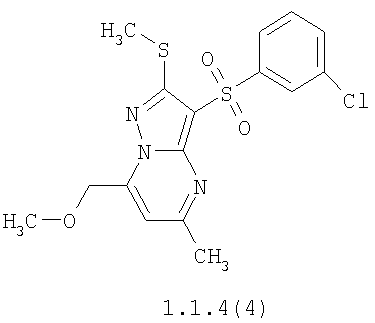
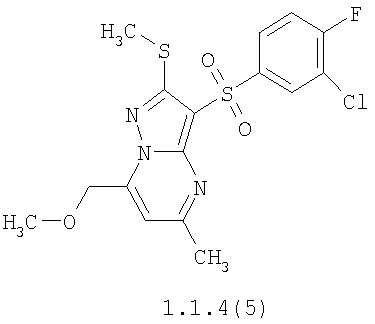
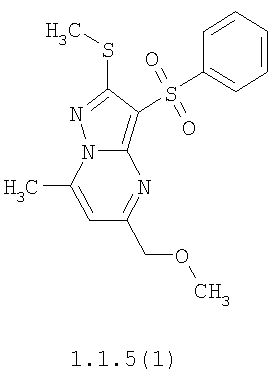
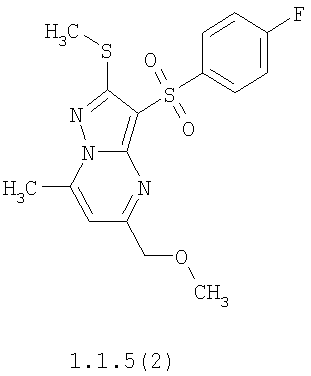
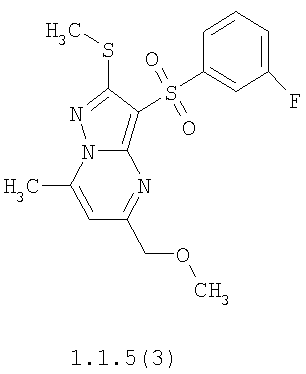
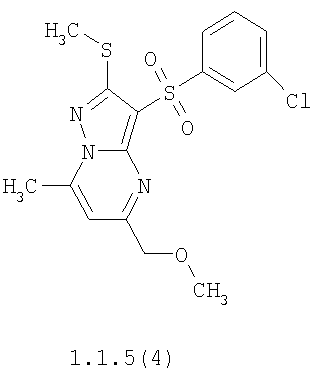
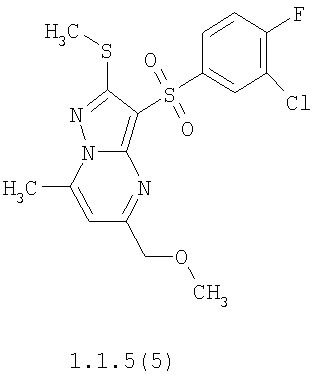
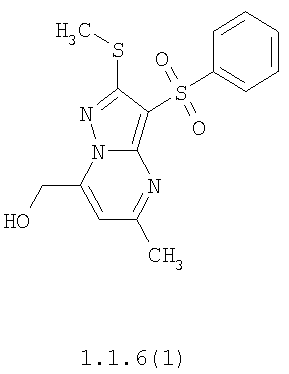
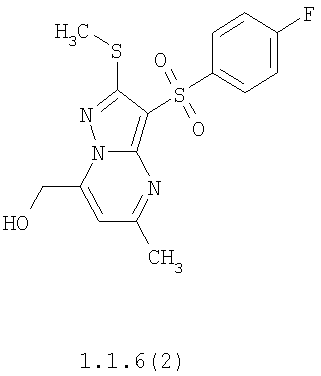
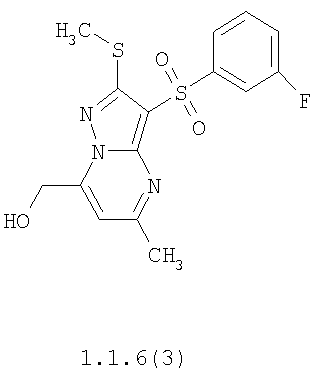
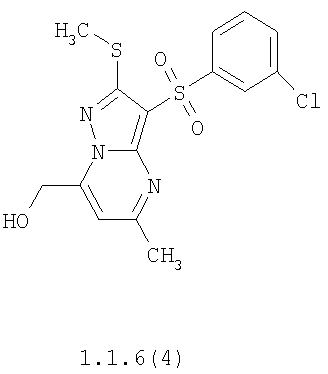
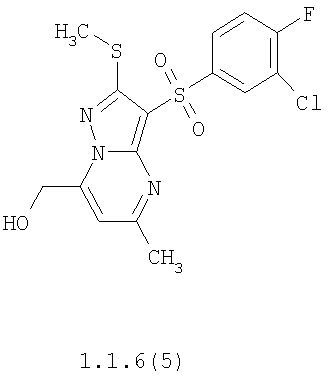
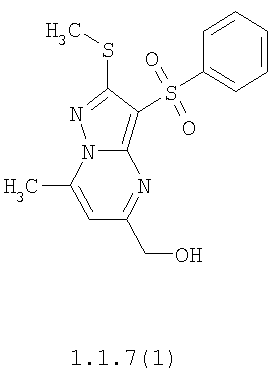
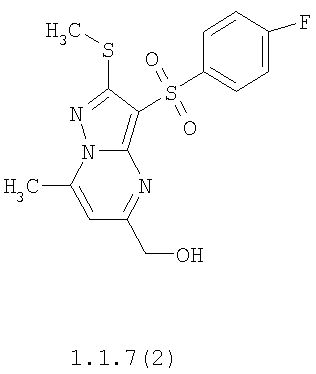
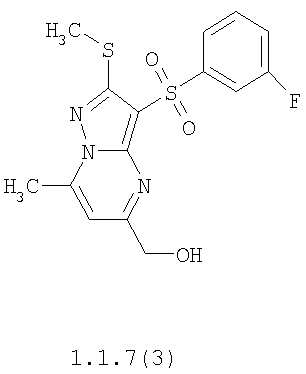
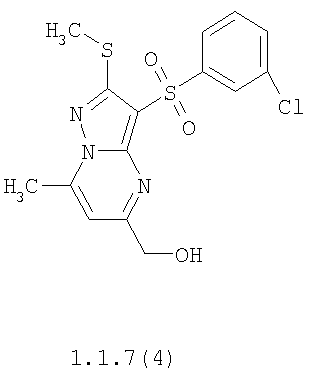
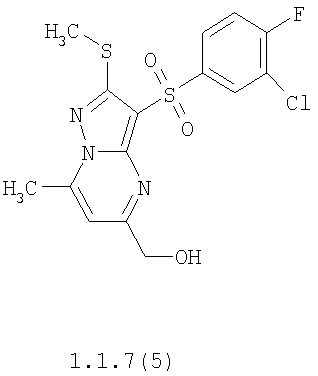
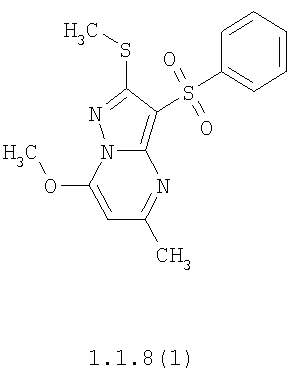
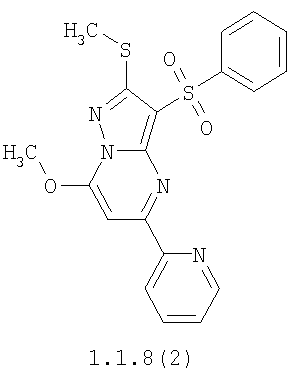
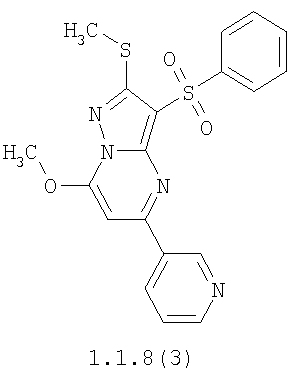
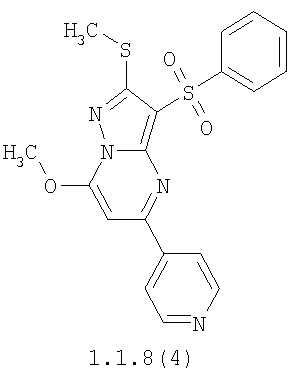
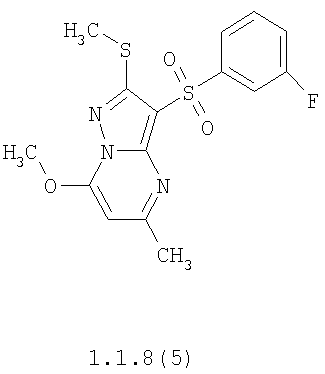
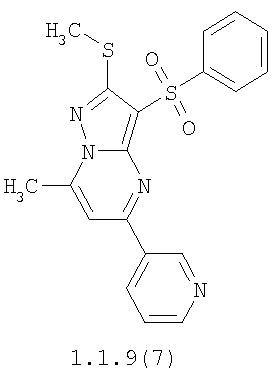
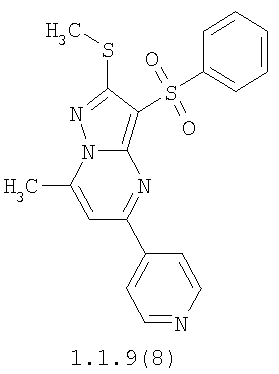
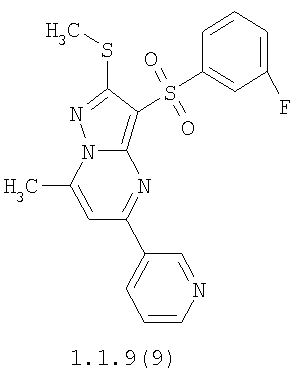
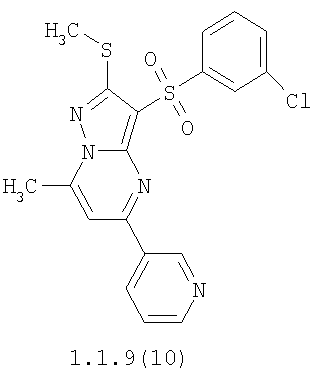
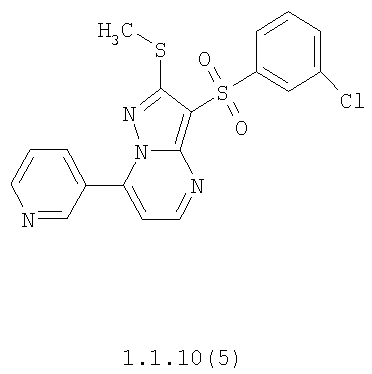
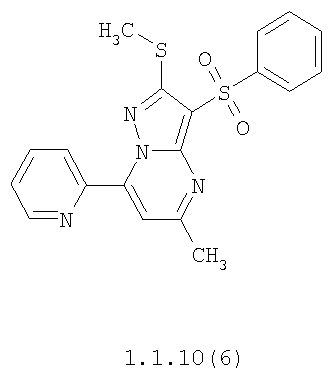
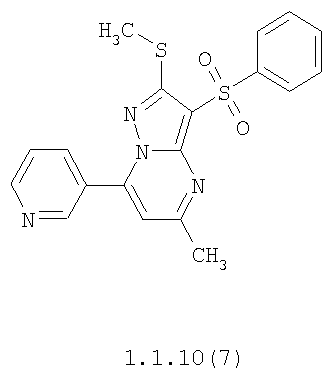
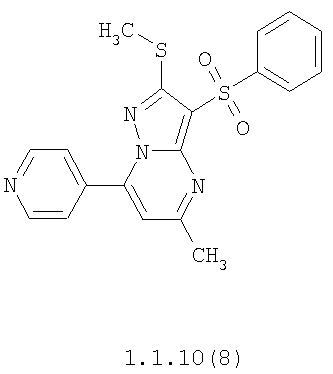
Предметом настоящего изобретения является способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1, в которых X=S, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.9, 1.1.10 и их фармацевтически приемлемых солей и/или гидратов взаимодействием 3-амино-4-сульфонил-2Н-пиразолов общей формулы 2 с соответствующими β-дикетонами общей формулы 3 или их ацеталями с последующим выделением или разделением продуктов реакции (А, В) по схеме, представленной ниже. Если используются симметрично замещенные β-дикетоны общей формулы 3, R1=R3, продуктом реакции является один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин (А=В). Если используются несимметрично замещенные β-дикетоны общей формулы 3, в которых R1≠R3, образуется смесь изомерных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов А и В, которую разделяют кристаллизацией или хроматографически.
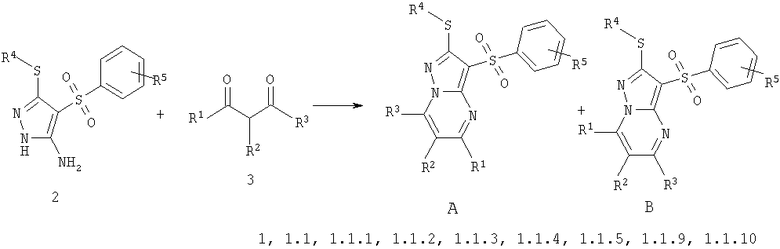
где: R1, R2, R3, R4 и R5 имеют вышеуказанное значение.
Предметом настоящего изобретения является способ получения замещенных 2-алкилсульфинил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1, в которых X=SO, окислением 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1, в которых X=S, по представленной ниже схеме.
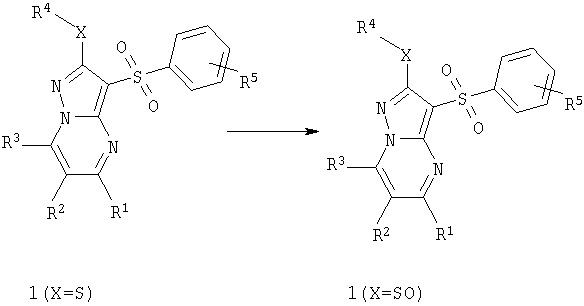
где R1, R2, R3, R4 и R5 имеют вышеуказанное значение.
Предметом настоящего изобретения является также способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.1 взаимодействием 3-амино-4-арилсульфонил-2Н-пиразолов общей формулы 2 с тетраацеталем малонового альдегида 3.1 по представленной ниже схеме.
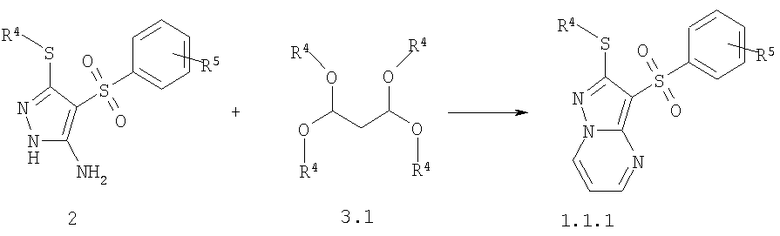
где R4 и R5 имеют вышеуказанное значение.
Предметом настоящего изобретения является также способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.2 восстановлением хлорзамещенных общей формулы 4
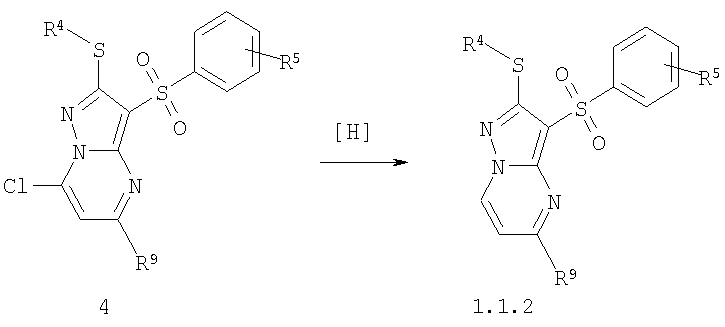
где R4, R5 и R9 имеют вышеуказанное значение.
Предметом настоящего изобретения является также способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.2 и 1.1.3 взаимодействием 3-амино-4-арилсульфонил-2Н-пиразолов общей формулы 2 с 1-замещенным 3,3-диалкилокси-пропаноном 3.2 с последующим выделением или разделением продуктов реакции по представленной ниже схеме.
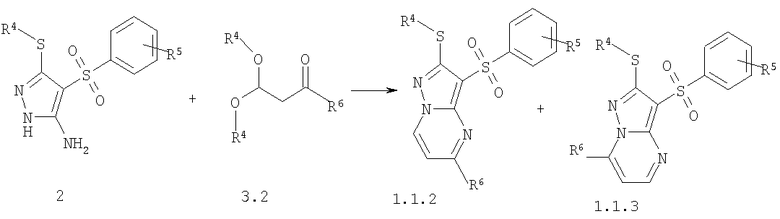
где R4, R5 и R6 имеют вышеуказанное значение.
Предметом настоящего изобретения является также способ получения акилоксизамещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.4 и 1.1.5 взаимодействием 3-амино-4-арилсульфонил-2Н-пиразолов общей формулы 2 с алкоксизамещенным дикетоном 3.3 с последующим выделением или разделением продуктов реакции по представленной ниже схеме.
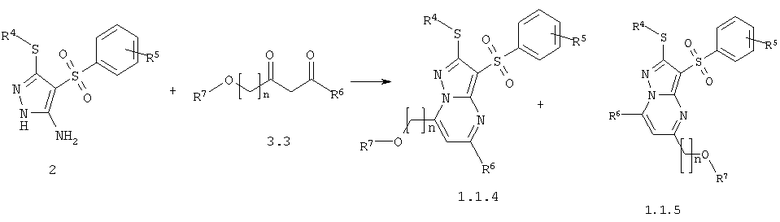
где R4, R5, R6, R7 и n имеют вышеуказанное значение.
Предметом настоящего изобретения является также способ получения замещенных 2-алкилсульфанил-7-(гидроксиалкил)-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.6 действием трехбромистого бора на 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидины общей формулы 1.1.4
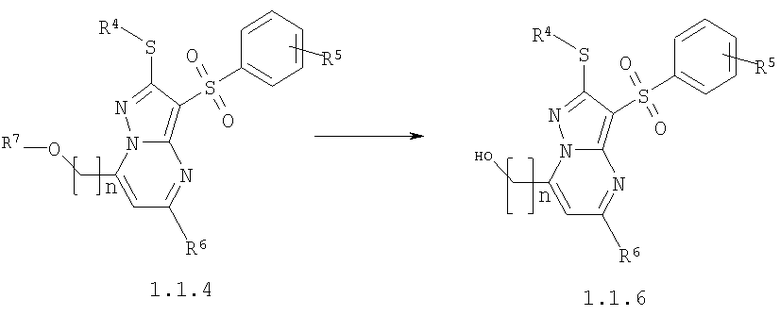
где R4, R5, R6 и R7 имеют вышеуказанное значение, n равно 1-3.
Предметом настоящего изобретения является также способ получения замещенных 2-алкилсульфанил-5-(гидроксиалкил)-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.7 действием трехбромистого бора на 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидины общей формулы 1.1.5
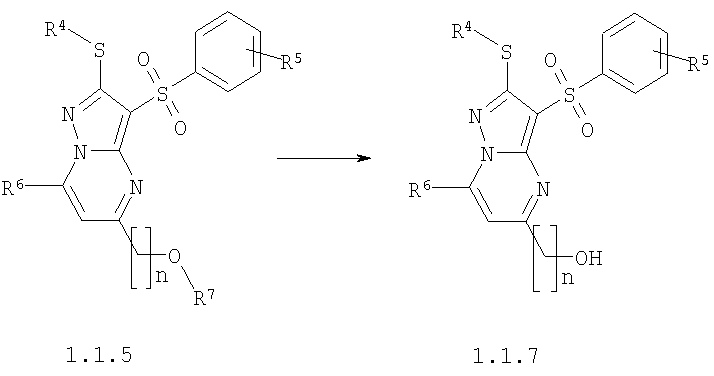
где R4, R5, R6 и R7 имеют вышеуказанное значение, n равно 1-3.
Предметом настоящего изобретения является также способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.8 взаимодействием хлорзамещенных общей формулы 4 с алкоголятами щелочных металлов общей формулы 6
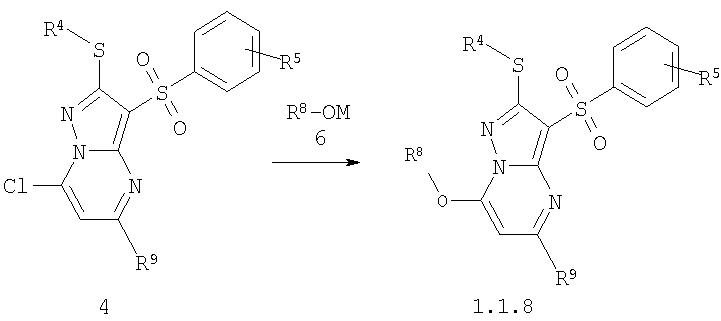
где R4, R5, R8 и R9 имеют вышеуказанное значение; М представляет собой катион щелочного металла.
Предметом настоящего изобретения является также способ получения пиридилзамещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.9 и 1.1.10 взаимодействием 3-амино-4-арилсульфонил-2Н-пиразолов общей формулы 2 с дикетоном 3.4 с последующим выделением или разделением продуктов реакции по представленной ниже схеме.
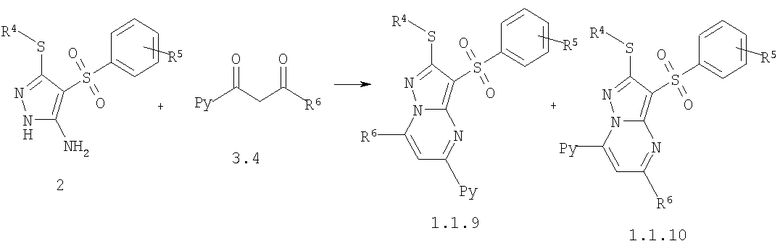
где R4, R5, R6 и Ру имеют вышеуказанное значение.
Предметом настоящего изобретения являются также антагонисты серотониновых 5-НТ6 рецепторов, представляющие собой 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидины общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 и их фармацевтически приемлемые соли и/или гидраты.
Цель настоящего изобретения заключается в создании новых «молекулярных инструментов», предназначенных для изучения особенностей ингибирования серотониновых 5-НТ6 рецепторов.
Поставленная цель достигается антагонистами серотониновых 5-НТ6 рецепторов, представляющими собой замещенные 3-арилсульфонил-пиразоло[1,5-а]пиримидины общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 и их фармацевтически приемлемые соли и/или гидраты.
Предметом данного изобретения является также лекарственное начало для фармацевтических композиций и лекарственных средств, представляющее собой, по крайней мере, один 3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат.
Предметом данного изобретения является также фармацевтическая композиция для лечения и предупреждения развития различных состояний и заболеваний ЦНС людей и теплокровных животных, содержащая фармацевтически эффективное количество нового лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат.
Фармацевтическая композиция может включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с лекарственным началом по настоящему изобретению может включать и другие активные ингредиенты при условии, что они не вызывают нежелательных эффектов, например аллергических реакций.
При необходимости использования фармацевтических композиций по настоящему изобретению в клинической практике они могут смешиваться для изготовления различных форм, при этом они могут включать в свой состав традиционные фармацевтические носители, например, пероральные формы (такие как таблетки, желатиновые капсулы, пилюли, растворы или суспензии); формы для инъекций (такие как растворы или суспензии для инъекций, или сухой порошок для инъекций, который требует лишь добавления воды для инъекций перед использованием); местные формы (такие как мази или растворы).
Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Предметом данного изобретения является также способ получения новой фармацевтической композиции смешиванием лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1,1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат с инертным наполнителем и/или растворителем.
Предметом данного изобретения является лекарственное средство в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, для профилактики и лечения заболеваний центральной нервной системы, патогенез которых связан с 5-НТ6 рецепторами, включающее фармацевтически эффективное количество лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат, или фармацевтической композиции, содержащей это лекарственное начало.
Более предпочтительным является лекарственное средство в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, для профилактики и лечения когнитивных расстройств и нейродегенеративных заболеваний, содержащее фармацевтически эффективное количество лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат, или фармацевтической композиции, содержащей это лекарственное начало.
Более предпочтительным является лекарственное средство в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, для профилактики и лечения болезни Альцгеймера, болезни Паркинсона, болезни Гантингтона, содержащее фармацевтически эффективное количество лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат, или фармацевтической композиции, содержащей это лекарственное начало.
Предметом данного изобретения является также лекарственное средство в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, для профилактики и лечения психических расстройств и шизофрении, содержащее фармацевтически эффективное количество лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/ил гидрат, или фармацевтической композиции, содержащей это лекарственное начало.
Более предпочтительным является лекарственное средство (анксиолитик или транквилизатор) для профилактики и лечения тревожных расстройств, содержащее фармацевтически эффективное количество лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат, или фармацевтической композиции, содержащей это лекарственное начало.
Более предпочтительным является лекарственное средство (ноотропик) для профилактики и лечения гиперкинетических расстройств, в частности для улучшения умственных способностей, содержащее фармацевтически эффективное количество лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат, или фармацевтической композиции, содержащей это лекарственное начало.
Предметом данного изобретения является также лекарственное средство в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, для профилактики и лечения ожирения, содержащее фармацевтически эффективное количество лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат, или фармацевтической композиции, содержащей это лекарственное начало.
Предметом данного изобретения является также терапевтический коктейль для профилактики и лечения различных заболеваний, патогенез которых связан с 5-НТ6 рецепторами у животных и людей, содержащий лекарственное средство в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, включающее фармацевтически эффективное количество лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат, или фармацевтической композиции, содержащей это лекарственное начало.
Предметом данного изобретения является также терапевтический коктейль для профилактики и лечения неврологических расстройств, нейродегенеративных и когнитивных заболеваний у животных и людей, в том числе для профилактики и лечения болезни Альцгеймера, болезни Паркинсона, болезни Гантингтона, психических расстройств и шизофрении, гипоксии-ишемии, гипогликемии, судорожных состояний, мозговых травм, латиризма, бокового амиотрофического склероза, ожирения и инсульта, содержащий фармацевтически эффективное количество нового лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат, или фармацевтической композиции, содержащей это лекарственное начало.
Терапевтические коктейли для профилактики и лечения неврологических расстройств, нейродегенеративных и когнитивных заболеваний у животных и людей, в том числе для профилактики и лечения болезни Альцгеймера, болезни Паркинсона, болезни Гантингтона, психических расстройств и шизофрении, гипоксии-ишемии, гипогликемии, судорожных состояний, мозговых травм, латиризма, бокового амиотрофического склероза, ожирения и инсульта, наряду с лекарственными средствами по данному изобретению, могут включать другие лекарственные средства, такие как нестероидные противовоспалительные препараты (Ортофен, Индометацин, Ибупрофен и т.п.); ингибиторы ацетилхолинэстеразы (Такрин, Амиридин, Физостигмин, Арисепт, Phenserine и т.п.); эстрогены (например, Эстрадиол); антагонисты NMDA-рецепторов (например, Мемантин, Neramexane); ноотропные препараты (например, Пирацетам, Фенибут и т.п.); модуляторы АМРА рецепторов (например, Ampalex); антагонисты каннабиноидных рецепторов СВ-1 (например, Rimonabant); ингибиторы моноаминооксидазы МАО-В и/или МАО-А (например, Rasagiline); антиамилоидогенные препараты (например, Tramiprosate); вещества, понижающие нейротоксичность бета-амилоида (например, Индол-3-пропионовая кислота); ингибиторы гамма- и/или бета-Секретазы; агонисты мускариновых рецепторов Ml (например, Cevimeline); хелаторы металлов (например, Clioquinol); антагонисты ГАМК(В) рецепторов (например, CGP-36742); моноклональные антитела (например, Bapineuzumab); антиоксиданты; нейротрофические агенты (например, Церебролизин); антидепрессанты (например, Имипрамин, Сертралин и т.п.) и прочие.
Терапевтический коктейль для понижения избыточного веса и лечения ожирения наряду с лекарственными средствами по данному изобретению включает другие лекарственные средства, такие как анорексические препараты (например, Фепранон, Дезопимон, Мазиндол), гормональные препараты (например Тиреоидин), гиполипидимические средства, такие как фибраты (например, Фенофибрат), статины (например, Ловастатин, Симвастатин, Правастатин и Пробукол), а также гипогликемические препараты (сульфонилмочевины, например Бутамид, Глибенкламид; бигуаниды, например Буформин, Метморфин) и препараты с другим механизмом действия, такие как антагонисты каннабиноидных СВ-1 рецепторов (Rimonabant), ингибиторы обратного захвата норэпинефрина и серотонина (Sibutramine), ингибиторы ферментов синтеза жирных кислот (Orlistat) и прочие, наряду с антиоксидантами, пищевыми добавками и т.д.
В соответствии с данным изобретением способ профилактики и лечения различных заболеваний центральной нервной системы, патогенез которых связан с 5-НТ6 рецепторами у животных и людей, заключается во введении лекарственного средства в форме таблеток, капсул или инъекций, содержащего в качестве активного ингредиента фармацевтически эффективное количество лекарственной начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1,1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат, или фармацевтической композиции, содержащей это лекарственное начало.
Лекарственные средства могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно). Клиническая дозировка лекарственного начала, фармацевтической композиции или лекарственного средства (препарата), включающего фармацевтически эффективное количество лекарственного начала, представляющего собой, по крайней мере, один 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидин общей формулы 1, 1.1, 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10 или его фармацевтически приемлемую соль и/или гидрат, или фармацевтической композиции, содержащей это лекарственное начало, у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10~500 мг, предпочтительно 50~300 мг. Поэтому во время приготовления фармацевтических композиций по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10~500 мг лекарственного начала, предпочтительно 50~300 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно от одного до шести раз).
Изобретение поясняется чертежами.
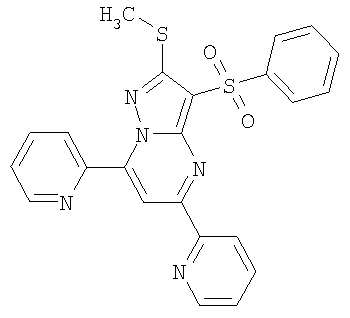
Фиг.1. Латентный период 1-го захода в темный отсек через 24 часа после обучения мышей избеганию темного отсека в челночной камере (средняя величина ± стандартная ошибка). Число в скобках - доза вещества в мг/кг. Изучавшиеся соединения 1(12) и 1.1.7(1) вводили внутрибрюшинно за 30 минут до опыта. Отличие от группы, получавшей скополамин: * - р<0,05; ** - р<0,01; *** - р<0,001.
Фиг.2. Продолжительность пребывания в светлом отсеке через 24 часа после обучения мышей избеганию темного отсека в челночной камере (средняя величина ± стандартная ошибка). Число в скобках - доза вещества в мг/кг. Изучавшиеся соединения 1(12) и 1.1.7(1) вводили внутрибрюшинно за 30 минут до опыта. Отличие от группы, получавшей скополамин: * - р<0,05; ** - р<0,01; *** - р<0,001.
Фиг.3. Число заходов в темный отсек через 24 часа после обучения мышей избеганию темного отсека в челночной камере (средняя величина ± стандартная ошибка). Число в скобках - доза вещества в мг/кг. Изучавшиеся соединения 1(12) и 1.1.7(1) вводили внутрибрюшинно за 30 минут до опыта. Отличие от группы, получавшей скополамин: * - р<0,05; ** - р<0,01; *** - р<0,001.
Фиг.4. Латентный период 1-го захода в темный отсек через 24 часа после обучения мышей избеганию темного отсека в челночной камере (средняя величина ± стандартная ошибка). Число в скобках - доза вещества в мг/кг. Изучавшиеся соединения 1(12) и 1.1.7(1) вводили внутрибрюшинно за 30 минут до опыта. Отличие от группы, получавшей МК-801: * - p<0,05; ** - p<0,01; *** - p<0,001.
Фиг.5. Продолжительность пребывания в светлом отсеке через 24 часа после обучения мышей избеганию темного отсека в челночной камере (средняя величина ± стандартная ошибка). Число в скобках - доза вещества в мг/кг. Изучавшиеся соединения 1(12) и 1.1.7(1) вводили внутрибрюшинно за 30 минут до опыта. Отличие от группы, получавшей МК-801: * - p<0,05; ** - p<0,01; *** - p<0,001.
Фиг.6. Число заходов в темный отсек через 24 часа после обучения мышей избеганию темного отсека в челночной камере (средняя величина ± стандартная ошибка). Число в скобках - доза вещества в мг/кг. Изучавшиеся соединения 1(12) и 1.1.7(1) вводили внутрибрюшинно за 30 минут до опыта. Отличие от группы, получавшей МК-801: * - p<0,05; ** - p<0,01; *** - p<0,001.
Фиг.7. Отношение времени, проведенного животными в открытых рукавах, к общему времени пребывания в открытых и закрытых рукавах (среднее ± стандартная ошибка). В скобках приведены дозы соединения 1(11) (в мг/кг). Отличие от групп, получавших плацебо: * - p<0,05; ** - p<0,01; *** - p<0,001.
Фиг.8. Отношение числа входов в открытые рукава к общему числу входов в рукава обоих типов (среднее ± стандартная ошибка). В скобках приведены дозы вещества 1(11) (в мг/кг). Отличие от групп, получавших плацебо: * - p<0,05; ** - p<0,01; *** - p<0,001.
Фиг.9. Число дефекаций в тесте «лабиринт-плюс» (среднее ± стандартная ошибка). В скобках приведены дозы вещества 1(11) (в мг/кг). Отличие от групп, получавших плацебо: * - p<0,05; ** - p<0,01; *** - p<0,001.
Представленные ниже примеры демонстрируют, но не ограничивают данное изобретение.
Пример 1. Общий способ получения замещенных 3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1 (X=S). Перемешивают 0.005 моль аминопиразола 2 и 0.0055 моль соответствующего дикарбонильного соединения 3 в 5 мл уксусной кислоты или другого подходящего растворителя в течение 4-12 часов при повышенной температуре. Выпавший осадок отфильтровывают, промывают метанолом и водой. При необходимости продукт подвергают перекристаллизации из подходящего растворителя, или хроматографической очистке, или хроматографическому разделению.
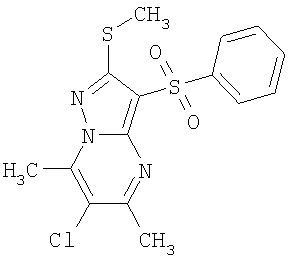
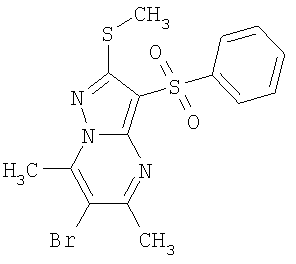
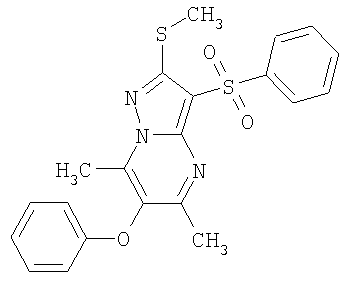
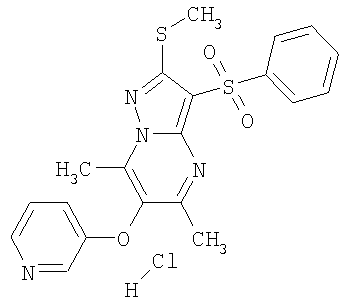
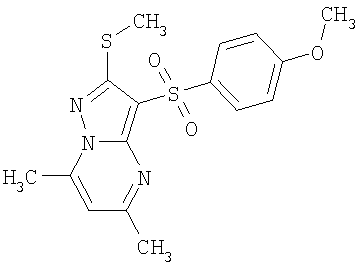
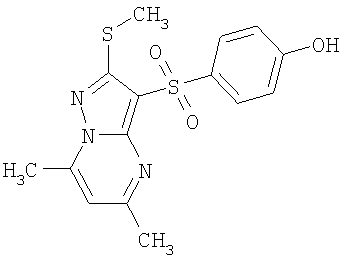
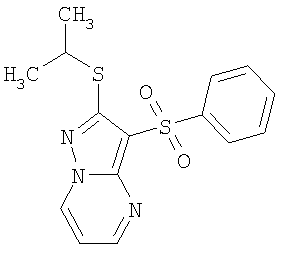
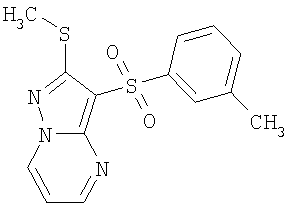
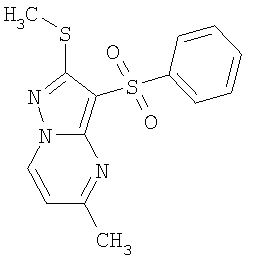
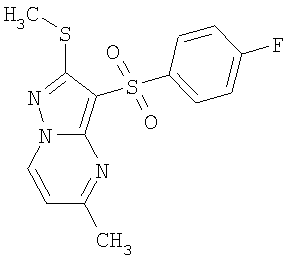
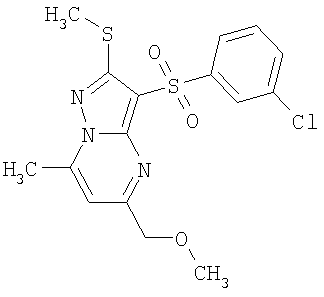
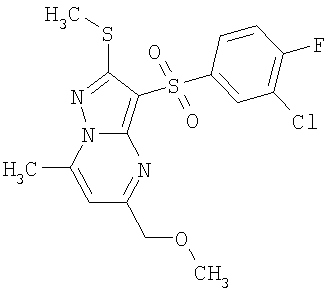
В таблице 2 представлены примеры новых 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1 (X=S), 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.9, 1.1.10 и их солей и данные LCMS-анализов и ЯМР-спектров.
Пример 2. Общий способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.1. Перемешивают 0.005 моль аминопиразола 2 и 0.0055 моль тетраацеталя малонового альдегида 3.1 в 5 мл уксусной кислоты в течение 12 часов при 80°С. Выпавший по охлаждении осадок отфильтровывают, промывают ацетонитрилом и сушат в вакууме. При необходимости продукт подвергают перекристаллизации из подходящего растворителя или хроматографической очистке. Получают соединения общей формулы 1.1.1. В таблице 2 представлены примеры новых 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.1 и их солей и данные их LCMS-анализов и ЯМР-спектров.
Пример 3. Общий способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.2 и 1.1.3. К раствору 0.001 М аминопиразола 2 в 1 мл уксусной кислоты при перемешивании и комнатной температуре добавляют 1 мл 6 М раствора НС1 в этаноле, через 2-3-минуты прикалывают раствор 0,002 М 1-замещенного 3,3-диалкилоксипропанона 3.2 в 3 мл уксусной кислоты. Полученную смесь оставляют на ночь при комнатной температуре и перемешивании. Упаривают досуха в вакууме, промывают метанолом, затем эфиром. При необходимости продукт подвергают перекристаллизации из подходящего растворителя, хроматографической очистке или хроматографическому разделению. Получают соединения общей формулы 1.1.2 и 1.1.3. В таблице 2 представлены некоторые примеры новых 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.2 и 1.1.3 и их солей; данные LCMS-анализов и ЯМР-спектров.
Пример 4. Общий способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.4 и 1.1.5. Перемешивают 0.005 моль аминопиразола 2 и 0.0075 моль натриевой соли 1-метоксипентан-2,4-диона 3.3 в 5 мл уксусной кислоты в течение 12 часов при кипении рекционной смеси. Выпавший по охлаждении осадок отфильтровывают, промывают ацетонитрилом и сушат в вакууме. Полученную смесь изомеров разделяют хроматографически на силикагеле. Получают соединения общей формулы 1.1.4 и 1.1.5. В таблице 2 представлены примеры новых 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.4, 1.1.5 и их солей и данные их LCMS-анализов и ЯМР-спектров.
Пример 5. Общий способ получения пиридилзамещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.9 и 1.1.10. К раствору 5 ммоль аминопиразола 2 в 5 мл уксусной кислоты добавляют 2 эквивалента дикетона 3.4; полученную смесь выдерживают при 80°С в течение 12 часов; охлаждают до комнатной температуры и упаривают в вакууме. К остатку добавляют 10% водный раствор NaOH, выпавший осадок отфильтровывают, промывают водой до нейтральной реакции, сушат. При необходимости продукт подвергают перекристаллизации из подходящего растворителя, хроматографической очистке или хроматографическому разделению. Получают соединения общей формулы 1.1.9 и 1.1.10. В таблице 2 представлены некоторые примеры новых пиридилзамещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.9 и 1.1.10 и их солей; данные LCMS-анализов и ЯМР-спектров.
Пример 6. Общий способ получения замещенных 2-алкилсульфинил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1 (X=SO). К раствору 1 ммоль 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидина общей формулы 1 (X=S) в 10 мл уксусной кислоты добавляют 88 мкл (1 ммоль, 35%) перекиси водорода и смесь перемешивают при 80°С в течение 7 ч. Смесь упаривают в вакууме и очищают продукт методом колоночной хроматографии на силикагеле (система хлороформ/этилацетат = 5:1). Выход 75-87%.
В таблице 2 представлены некоторые примеры новых 2-алкилсульфинил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1 и данные их LCMS-анализов и ЯМР-спектров.
Пример 7. Общий способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.2. Раствор 0.63 ммоль 2-алкилсульфанил-7-хлор-3-арилсульфонил-пиразоло[1,5-а]пиримидина общей формулы 1, в которых R3= Cl, в 9 мл МеОН и 3 мл бензола гидрируют над 30 мг 10% Pd/C при 1 атм в течение 12 ч. Выделение продукта проводят хроматографически на силикагеле. Получают соединения общей формулы 1.1.2. В таблице 2 представлены некоторые примеры новых замещенных 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.2 и их солей; данные LCMS-анализов и ЯМР-спектров.
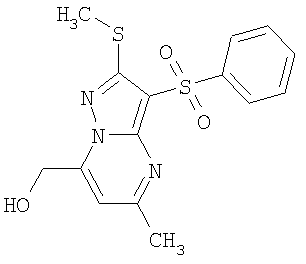
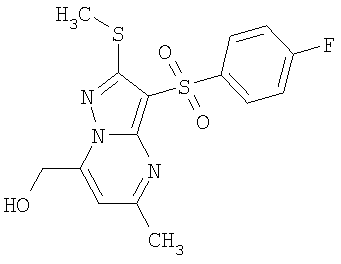
Пример 8. Общий способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-7-(гидроксиалкил)-пиразоло[1,5-а]пиримидинов общей формулы 1.1.6 и замещенных 2-алкилсульфанил-3-арилсульфонил-5-(гидроксиалкил)-пиразоло[1,5-а]пиримидинов общей формулы 1.1.7. Раствор 0.36 ммоль алкилоксиалкилпроизводного общей формулы 1.1.4 или 1.1.5 в 10 мл перегнанного хлористого метилена прикапывают при комнатной температуре к раствору 0.1 мл (0.27 мг) ВВr3 (3.0 эквивалента) в 10 мл перегнанного хлористого метилена. Реакционную смесь выдерживают при комнатной температуре в течение 12 часов, после чего при интенсивном перемешивании к ней добавляют 20 мл воды и оставляют перемешиваться в течение 30 минут. Органический слой отделяют, а водный слой экстрагируют два раза эфиром. Органические фазы объединяют, упаривают в вакууме, остаток хроматографируют. Получают соединения общей формулы 1.1.6, 1.1.7, примеры которых представлены в таблице 2.
Пример 9. Общий способ получения замещенных 2-алкилсульфанил-3-арилсульфонил-7-алкокси-пиразоло[1,5-а]пиримидинов общей формулы 1.1.8. К раствору 2,5 ммоль алкоголята натрия в 25 мл подходящего растворителя (спирт, диметилформамид и т.п.) добавляют 2-алкилсульфанил-3-арилсульфонил-7-хлор-пиразоло[1,5-а]пиримидин общей формулы 4. Реакционную массу выдерживают в микроволновом реакторе 2 часа при температуре 75°С, охладают, выпавший осадок отфильтровают, промывают метанолом, растворяют в хлористом метилене, пропустают через тонкий слой силикагеля и упаривают досуха. В случае необходимости полученный продукт 1.1.8 перекристаллизовывают из подходящего растворителя.
В таблице 2 представлены некоторые примеры новых замещенных 2-алкилсульфанил-3-арилсульфонил-7-алкокси-пиразоло[1,5-а]пиримидинов общей формулы 1.1.8 и данные LCMS-анализов и ЯМР-спектров.
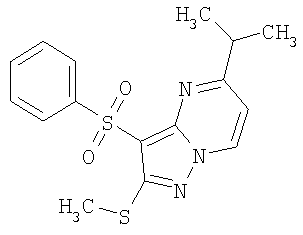
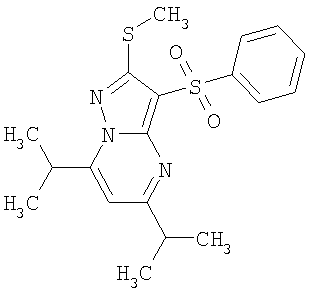
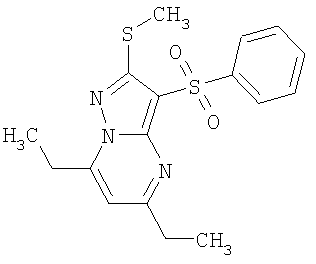
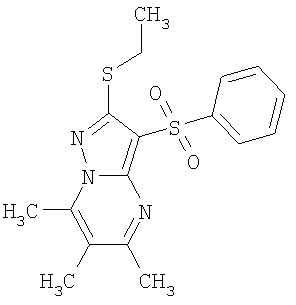
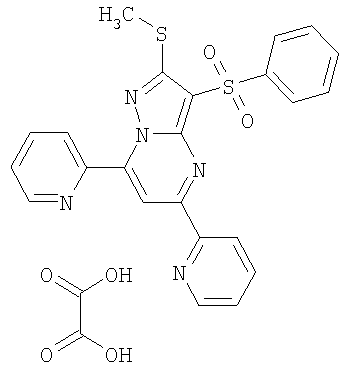
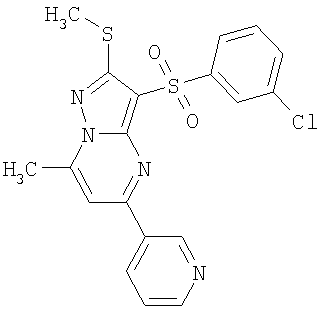
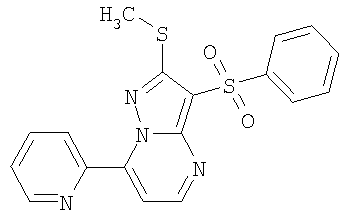
HCl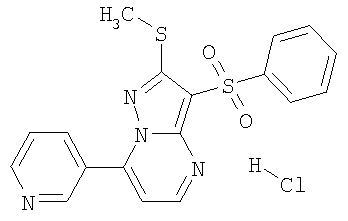
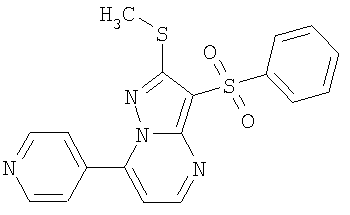
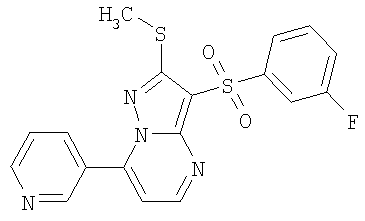
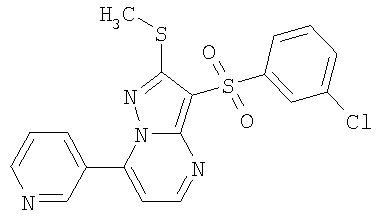
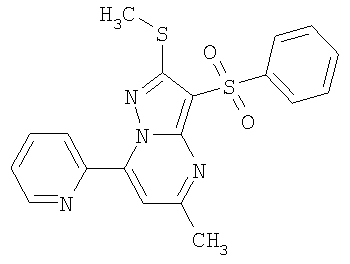
HCl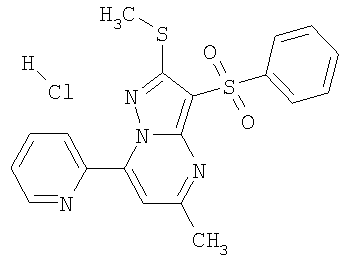
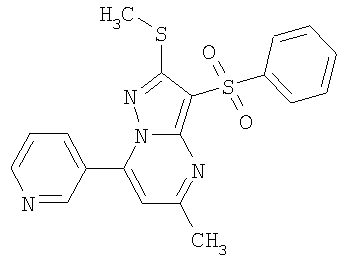
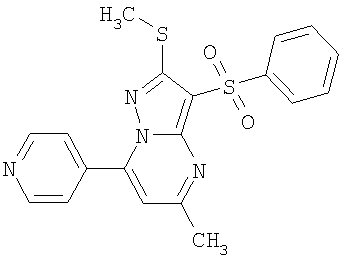
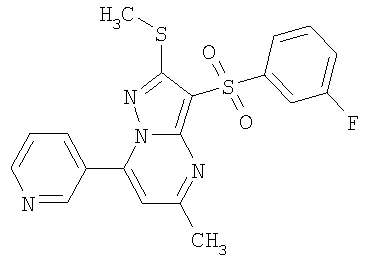
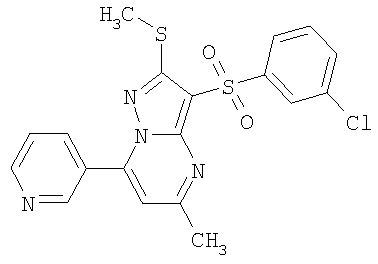
Пример 10. Определение антагонистической активности соединений общей формулы 1 по отношению к 5-НТ6 рецепторам. Соединения общей формулы 1 были испытаны на их способность препятствовать активации 5-НТ6 рецепторов серотонином. Использовали клетки НЕК 293 (клетки почки человеческого эмбриона) с искусственно экспрессированным рецептором 5-НТ6, активация которого серотонином приводит к повышению концентрации внутриклеточного цАМФ. Содержание внутриклеточного цАМФ определяли с помощью реагентного набора LANCE cAMP (PerkinElmer) по методике, описанной производителем набора [http://las.perkinelmer.com/content/Manuals/MAN_LANCEcAMP384KitUser.pdf].
Эффективность соединений оценивали по их способности снижать содержание внутриклеточного цАМФ, индуцированного серотонином.
В таблице 3 представлены значения IC50 антагонистов общей формулы 1 в условиях функционального эссея ингибирования серотониновых 5-НТ6 рецепторов, свидетельствующие об их умеренной или высокой антагонистической активности.
Пример 11. Определение активности антагонистов серотониновых 5-НТ6 рецепторов общей формулы 1 в условиях конкурентного связывания с серотониновыми 5-НТ6 рецепторами. Для проведения скрининга веществ на их потенциальную способность взаимодействовать с серотониновым рецептором 5-НТ6 использовали метод радиолигандного связывания. Для этого готовили мембранные препараты из клеток HeLa, экспрессирующих рекомбинантный человеческий 5-НТ6 рецептор, путем гомогенизирования рекомбинантных клеток в стеклянном гомогенизаторе с последующим отделением плазматических мембран от ядер, митохондрий и клеточных обломков путем дифференциального центрифугирования. Определение связывания изучаемых соединений с 5-НТ6 рецептором проводили в соответствии с методикой, описанной в Monsma FJ Jr, Shen Y, Ward RP, Hamblin MW and Sibley DR, Cloning and expression of a novel serotonin receptor with high affinity for tricyclic psychotropic drugs. Mol Pharmacol. 43:320-327, 1993. В предпочтительном исполнении мембранные препараты инкубировали с меченым лигандом (1.5 nM [3H] Lysergic acid diethylamide) без и в присутствии исследуемых соединений в течение 120 минут при 37°С в среде, состоящей из 50 mM Tris-HCl, рН 7.4, 150 мМ NaCl, 2 мМ Ascorbic Acid, 0.001% BSA. Образцы после инкубации фильтровали под вакуумом на стекло-микроволоконных фильтрах G/F (Millipor, USA), фильтры трижды промывали холодным раствором среды и радиоактивность измеряли с помощью сцинтилляционного счетчика MicroBeta 340 (PerkinElmer, USA). Неспецифическое связывание, которое составляло 30% от общего связывания, определяли инкубацией мембранных препаратов с радиолигандом в присутствии 5 µМ Serotonin (5-HT). В качестве положительного контроля использовали Methiothepin. Связывание тестируемых соединений с рецептором определялось по их способности вытеснять радиоактивный лиганд и выражалось в процентах вытеснения. Процент вытеснения определялся по следующей формуле:
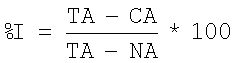 ,
,
где ТА - это общая радиоактивность в присутствии только радиоактивного лиганда, СА - радиоактивность в присутствии радиолиганда и тестируемого соединения и NA - радиоактивность в присутствии радиолиганда и серотонина (5 µM).
В таблице 4 представлены результаты испытаний некоторых антагонистов серотониновых 5-НТ6 рецепторов общей формулы 1 в условиях конкурентного связывания с серотониновыми 5-НТ6 рецепторами, свидетельствующие об их высокой активности по отношению к серотониновым 5-НТ6 рецепторам.
Представленные в таблицах 3 и 4 данные свидетельствуют о возможности использования соединений общей формулы 1 в качестве «молекулярных инструментов» для изучения особенностей физиологически активных соединений, обладающих свойством ингибировать серотониновые 5-НТ6 рецепторы, и в качестве лекарственных начал для фармацевтических композиций и лекарственных средств.
Пример 12. Получение лекарственного средства в форме таблеток. Смешивают 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и 1000 мг соединения 1.1.8(3)·HCl и спрессовывают в брусок. Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 560 мг каждая.
Пример 13. Получение лекарственного средства в форме капсул. Тщательно смешивают соединение 1.1.8(3)·HCl с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера.
Пример 14. Получение лекарственного средства в форме инъекционных композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивают 500 мг соединения 1.1.8(3)·HCl с 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают.
Пример 15. Антиамнестическая активность (ноотропное действие) соединений общей формулы 1. Улучшение памяти, нарушенной скополамином.
15.1. Ноотропное действие соединений общей формулы 1 в тесте «Пассивное избегание мышей в челночной камере».
Эксперименты проводились на взрослых самцах мышей линии BALB/c массой 20-25 г или самцах крыс линии Вистар массой 200-250 г.
В опытах использовали челночную камеру (Ugo Basile, Италия), которая состояла из двух отсеков. Все стенки одного из отсеков были непрозрачными, а второй отсек имел прозрачную крышку. Отсеки соединялись отверстием, которое могло автоматически закрываться вертикальной дверцей. Пол темного отсека состоял из поперечных металлических прутьев, на которые могли подаваться импульсы постоянного тока.
В первый день опыта за 30 минут до обучения животным внутрибрюшинно вводили скополамин, который вызывает нарушение памяти. Животным опытной группы дополнительно вводили соединение общей формулы 1, в частности соединения 1(12) и 1.1.7(1), в дозах 0,2 мг/кг. Животные контрольной группы получали инъекцию физиологического раствора. В каждой группе использовали 8 животных.
Животных помещали в светлый отсек и регистрировали латентный период первого захода в темную камеру. При этом дверцу между камерами закрывали, и животное в течение 3 секунд получало наказание током 0,6 мА. После этого животное возвращали в жилую клетку. Через 24 часа животное вновь помещали в светлый отсек челночной камеры и регистрировали латентный период первого захода в темную камеру, общее время пребывания в светлом отсеке и число заходов в темный отсек. Продолжительность наблюдения составляла 5 минут.
Животные контрольной группы, получившие наказание в темном отсеке, демонстрировали успешную обучаемость, которая выражалась в увеличении латентного периода захода в темный отсек, длительности пребывания в светлом отсеке и уменьшении числа заходов в темную камеру по сравнению с животными из группы, не получавшей наказания. Скополамин вызывал, так называемую антероградную амнезию, которая характеризуется нарушением фиксации в долгосрочной памяти новых событий. Это выражалось в виде статистически значимого увеличения латентного периода захода в темный отсек, уменьшения времени пребывания в светлом отсеке и увеличения числа заходов в темный отсек камеры.
Результаты эксперимента представлены на фиг.1, 2, 3, из которых следует, что соединение 1(12) обладает способностью уменьшать амнезию (улучшать память), вызванную скополамином.
15.2. Ноотропное действие соединений общей формулы 1 в тесте «Распознавание новых объектов».
Эксперимент проводили на взрослых самцах мышей линии SHK. В эксперименте использовали крестообразный плексигласовый лабиринт, который состоял из 4 тупиковых боковых камер (пронумерованных 1, 2, 3, 4), которые соединялись между собой пятой центральной камерой. Мышь помещали в центральную камеру и позволяли ей исследовать лабиринт. Пол очищался после каждого животного. Порядок посещения камер и время визитов регистрировались. Тест заканчивался, когда происходило 13 заходов в тупики. Критерием захода считалось наличие всех четырех лап животного внутри камеры.
Во время обучения животное помещали в лабиринт, в котором в каждой из четырех боковых камер находилось по одной одинаковой чашке. Во время теста (спустя 1 час после обучения) две противоположно стоящих чашки были заменены колбами, и животному было позволено исследовать лабиринт. В периоды обучения и тестирования регистрировали время, проведенное животным в каждой боковой камере. Рассчитывали индекс распознавания новых объектов как отношение времени, проведенного в боковых камерах с новыми объектами, к общему времени пребывания в боковых камерах. Появление нового объекта увеличивает время, проведенное животным в камере, по сравнению с фазой обучения (так называемый эффект распознавания новых объектов). Под действием скополамина в дозе 1 мг/кг, введенного внутрибрюшинно за 30 минут до начала обучения, распознавание новых объектов нарушалось, и индекс распознавания снижался.
Однако это влияние скополамина удавалось компенсировать внутрибрюшинным введением соединений общей формулы 1 в дозах 0,05 мг/кг и 0,2 мг/кг за 60 мин до начала обучения.
Пример 16. Ноотропное действие (улучшение памяти, нарушенной МК-801) соединений общей формулы 1 в тесте «Пассивное избегание мышей в челночной камере». Эксперимент проводили так же, как в примере 15.1. В первый день опыта за 30 минут до обучения мышам внутрибрюшинно вводили физиологический раствор МК-801 (0.1 мг/кг), вызывающий амнезию. Параллельно независимым группам мышей до обучения внутрибрюшинно вводили физиологический раствор МК-801 в сочетании с соединением общей формулы 1, например 1(12) и 1.1.7(1). Полученные результаты, представленные на фиг.4, 5 и 6, свидетельствуют о способности соединения 1(12) оказывать ноотропное действие.
Пример 17. Анксиолитическое (транквилизирующее) действие соединений общей формулы 1 в тесте «Поведение мышей в приподнятом крестообразном лабиринте». В эксперименте использовали самцов мышей линии BALB/c массой приблизительно 25 г. Животных содержали в клетках (по 5-7 мышей на клетку), обеспечивая свободный доступ к корму и воде. Ни одно животное прежде не было знакомо с экспериментальной установкой. Каждая экспериментальная группа включала 8 животных.
Использованный метод был описан Листером (Lister R.G. The use of a plus-maze to measure anxiety in the mouse. Psychopharmacology, 1987; 92:180-185). Плексигласовая установка состояла из двух открытых рукавов размером 30×5 см и двух закрытых рукавов размером 30×5×15 см. Боковые рукава были закрыты прозрачным плексигласом и соединялись с центральной площадкой размером 5×5 см. Открытые рукава, центральна платформа и пол были выполнены из черного плексигласа. Аппарат был смонтирован на металлическом основании, которое располагалось над уровнем пола на высоте 38,5 см.
Мышь помещали в центр лабиринта, в течение 5 минут регистрировали число заходов в открытые и закрытые рукава и время, проведенное животными в открытых и закрытых рукавах. Критерием захода считали нахождение всех четырех лап животного в рукаве. По этим данным рассчитывали индексы предпочтения открытых рукавов как отношение числа заходов в открытые рукава, а также времени пребывания в открытых рукавах, к общему числу заходов во все рукава и времени пребывания в них. Число фекальных болюсов, оставленных мышью, рассматривалось как дополнительный параметр, характеризующий состояние тревоги. В норме животные избегают открытые рукава (индекс их предпочтения составляет 0,2-0,3). Вещества с анксиолитической активностью (транквилизирующей активностью) увеличивают этот показатель до 0,5-0,6 и более, а также уменьшают число дефекаций, не изменяя общую двигательную активность (общее число заходов в рукава).
Животным вводили внутрибрюшинно плацебо, буспирон (5 мг/кг, за 30 минут до обучения), лоразепам (0,05 мг/кг, за 60 минут до обучения) или одно из тестируемых соединений общей формулы 1, например соединение 1(11), в дозе 0,05 мг/кг и 0,2 мг/кг. Буспирон и лоразепам вводили в максимальной эффективной дозе, при которой еще не наблюдалось побочное седативное действие, которое выражалось в виде общего снижения исследовательской активности (число визитов в рукава за время теста).
Результаты эксперимента представлены на фиг.7, 8 и 9, из которых следует, что стандарты (буспирон и лоразепам) оказывают выраженное анксиолитическое действие в тесте приподнятого крестообразного лабиринта, аналогичным действием обладает соединение 1(11).
Пример 18. Антипсихотическая активность соединений общей формулы 1 в тесте «Препульсное торможение вздрагивания у мышей». В экспериментах использовали самцов мышей линии SHK массой 24-30 г. Эксперименты проводили в светлое время суточного цикла животных. Апоморфина гидрохлорид растворяли в 0,1% растворе аскорбиновой кислоты, приготовленном на стерилизованной воде. Галоперидол растворяли в стерилизованной воде с использованием эмульгатора Твин 80. Исследуемое соединение общей формулы 1 растворяли в стерилизованной воде. Контрольным животным вводили 0,1% раствор аскорбиновой кислоты, приготовленный на стерилизованной воде с Твином 80. Галоперидол вводили за 60 минут, апоморфин - за 15 минут до теста. Объем вводимой жидкости составлял 10 мл/кг. Исследуемые вещества общей формулы 1 вводили подкожно в дозе 1 мг/кг за 60 минут до теста.
Аппарат состоял из камеры, выполненной из прозрачного плексигласа (производитель - компания Коламбус Инструментс, США), размещенной на платформе, которая находилась внутри звукоизолирующего кабинета. В 2 см от платформы находилась высокочастотная звуковая колонка, через которую передавались звуковые стимулы. При вздрагивании животного возникали колебания платформы, которые улавливались аналоговым преобразователем и регистрировались компьютером. Уровень фонового шума составлял 65 дБ. Животные получали по 4 предъявления одиночного тестирующего («пульсового») стимула длительностью 50 мс и громкостью 105 дБ или предваряющего («пре-пульсового») стимула длительностью 20 мс громкостью 85 дБ, за которым через 30 мс следовал пульсовой стимул длительностью 50 мс громкостью 105 дБ. Интервал между повторными предъявлениями пульсового или пре-пульсового в сочетании с пульсовым стимулов составлял 10 с. Ослабление вздрагивания в ответ на пульсовой стимул при наличии пре-пульсового стимула рассчитывали в процентах по отношению к амплитуде вздрагивания в ответ на изолированный пульсовой стимул. Введение апоморфина, который используется в экспериментах на животных для моделирования психотоподобных состояний, вызывало уменьшение препульсного торможения вздрагивания, что отражает снижение способности ЦНС фильтровать сенсорные стимулы. Галоперидол (1 мг/кг) и изучавшиеся соединения общей формулы 1 предупреждали нарушение препульсного торможения вздрагивания при введении апоморфина.
Пример 19. Антидепрессантная активность соединений общей формулы 1.
19.1. Поведение мышей в тесте «Вынужденное плавание Порсолта». Аппарат представлял собой пластмассовый сосуд (высота 300 мм, диаметр 480 мм), заполненный водой при температуре 20-22°С до высоты 18 см. В эксперименте использовались самцы мышей линии Balb/C массой 20-30 г. Мышей помещали в воду и в течение 15 минут регистрировали продолжительность неподвижного зависания в воде - так называемое поведение "отчаяния", считающегося мерой депрессивноподобного состояния. Через 3-5 мин активность плавания начинала снижаться и чередоваться фазами движения и неподвижности. В тесте использовали автоматизированное распознавание движений с помощью видеосистемы и программы Any-maze. После введения внутрибрюшинно соединения общей формулы 1 в дозе 5 мг/кг степень отчаяния животного снижается, что свидетельствует об уменьшении времени депрессивноподобного состояния.
19.2. Поведение мышей в тесте «Подвешивание за хвост». Тест подвешивания за хвост был описан Steri et al. (1985) как удобный способ изучения потенциальных антидепрессантов. Предполагается, что вынужденная неподвижность грызунов может служить моделью для исследования депрессивных расстройств у людей. Клинически эффективные антидепрессанты снижают неподвижность, которая наступает у мышей после безрезультатных попыток освободиться, когда их хвост зафиксирован.
В эксперименте использовались самцы мышей линии Balb/C массой 20-30 г. Животных подвешивали липкой лентой за хвост примерно на высоте 400 мм от поверхности стола на 3 мин. Животное считалось неподвижным, если оно не совершало никаких движений в течение 1,5 сек. Изучаемые соединения общей формулы 1 вводили внутрибрюшинно в дозе 5 мг/кг. Препараты сравнения (флуоксетин, дезипрамин) вводили внутрибрюшинно за 15 минут до начала теста. В данном тесте соединения общей формулы 1 проявляют антидепрессантную активность, сравнимую с применявшимися препаратами сравнения Флуоксетин и Дезипрамин.
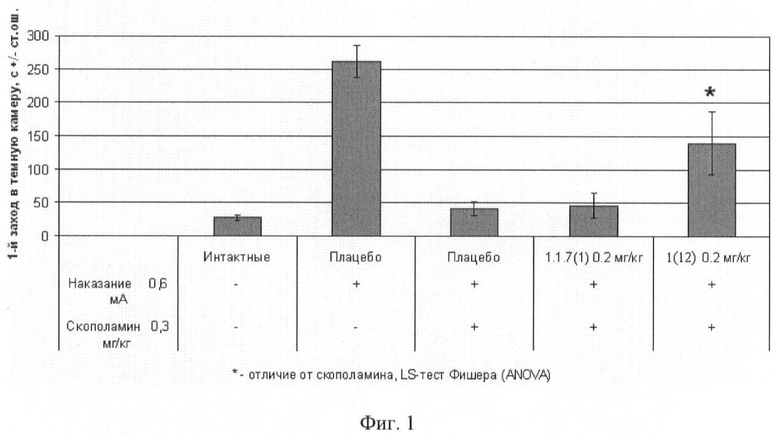
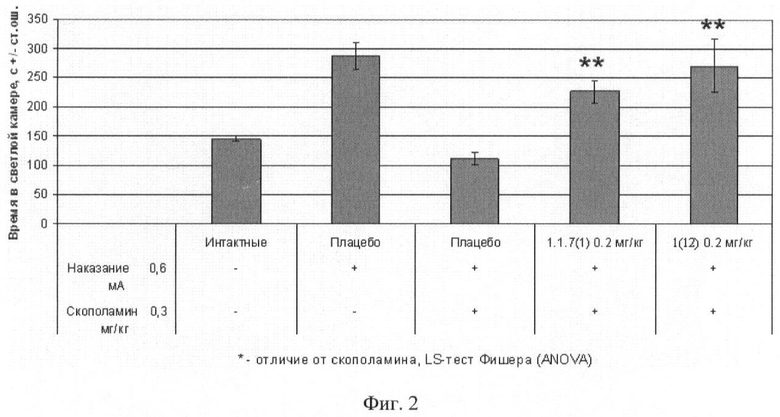
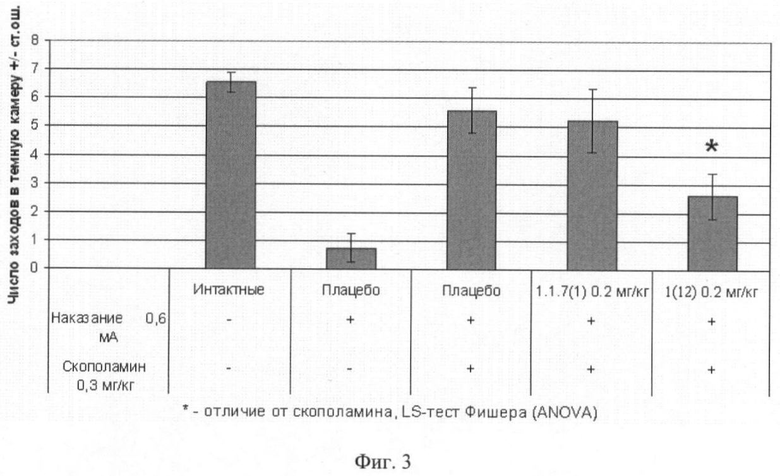
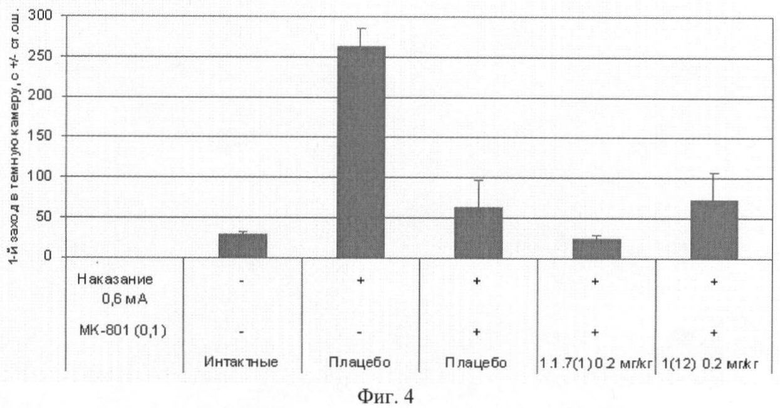
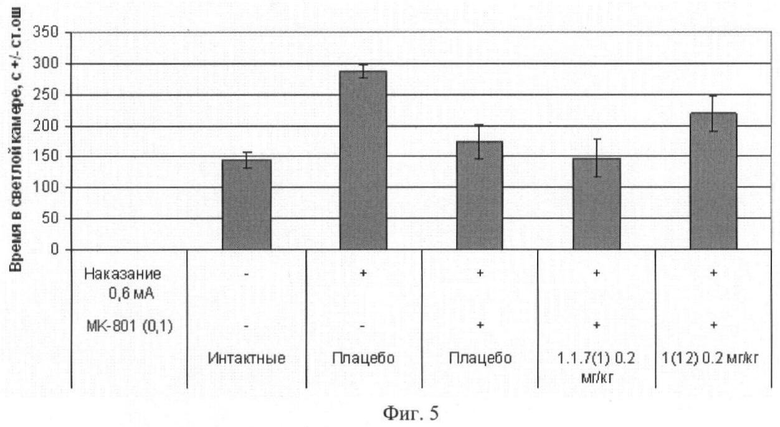
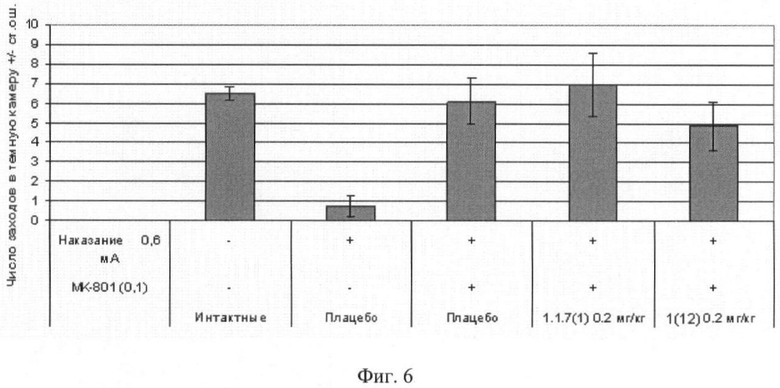
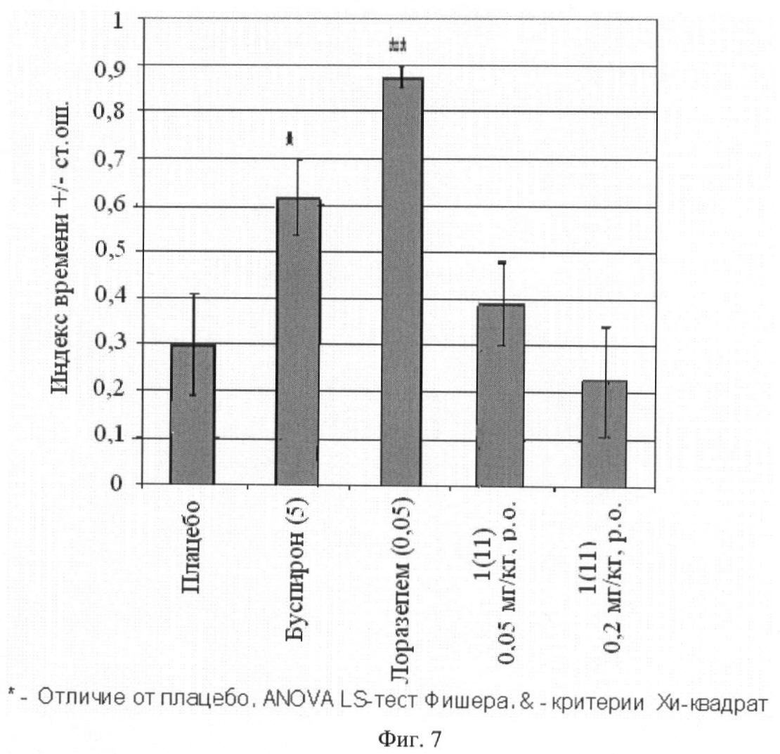
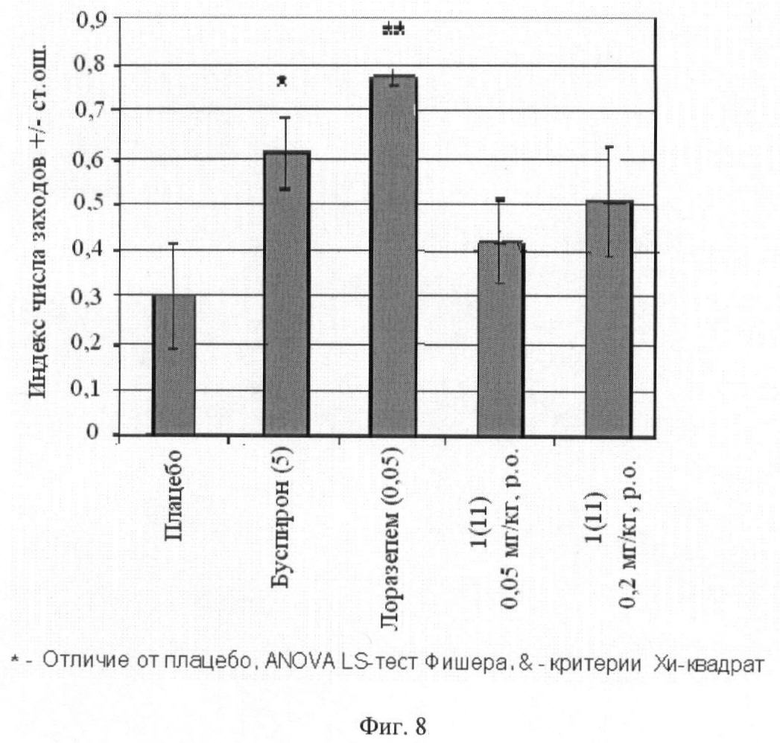
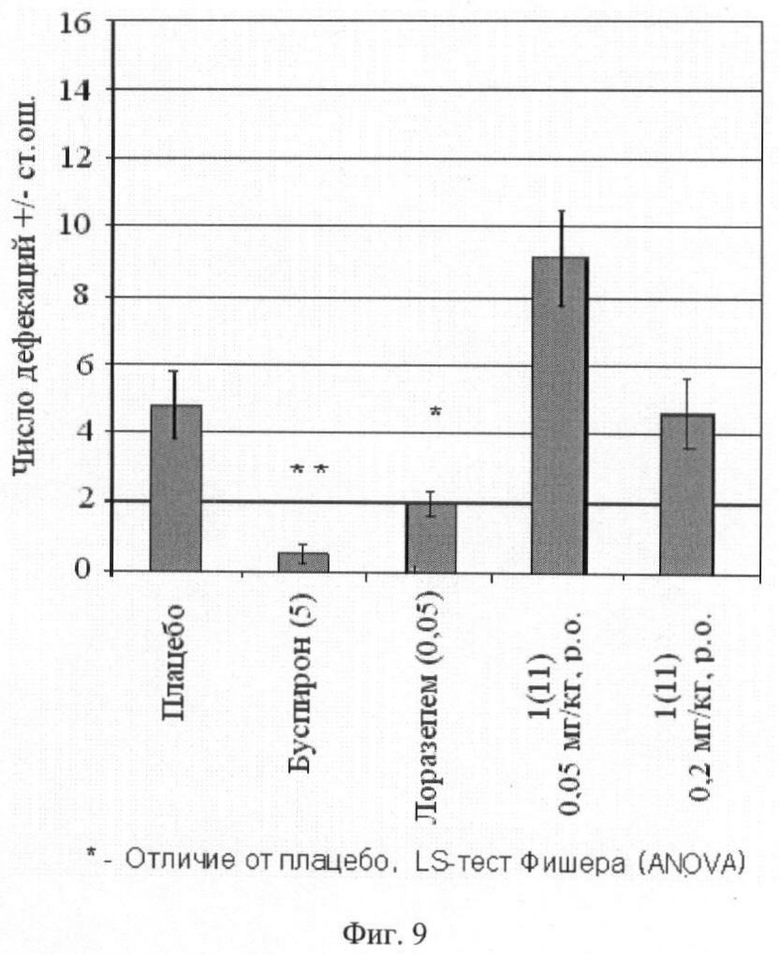
Данное изобретение относится к новым замещенным 3-арилсульфонил-пиразоло[1,5-а]пиримидинам общей формулы 1, их фармацевтически приемлемым солям и/или гидратам, обладающим свойствами антагонистов серотониновых 5-НТ6 рецепторов. Соединения могут быть использованы при лечении и предупреждении различных заболеваний центральной нервной системы (ЦНС), патогенез которых связан с 5-НТ6 рецепторами, в частности при когнитивных расстройствах и нейродегенеративных заболеваниях, психических расстройствах. Соединения обладают анксиолитическим и ноотропным действием и могут быть использованы также для профилактики и лечения тревожных расстройств и для улучшения умственных способностей. В формуле 1
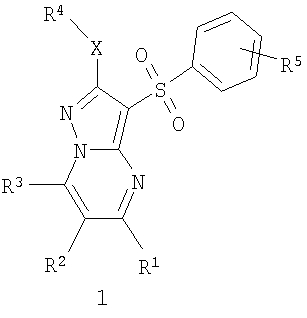
R1 представляет собой атом водорода, C1-С3алкил, (С1-С3)алкилокси(С1-С3)алкил, гидрокси(С1-С3)алкил, пиридил; R2 представляет собой атом водорода, атом галогена, C1-С3алкил, фенилокси или пиридилокси; R3 представляет собой атом водорода, C1-С3алкил, C1-С3алкилокси, (С1-С3)алкилокси(С1-С3)алкил, гидрокси(С1-С3)алкил, пиридил;
R4 представляет собой C1-С3алкил; R5 представляет собой атом водорода, один или два атома галогена, C1-С3алкил, C1-С3алкилокси или гидроксил; Х представляют собой атом серы или сульфинильную группу (SO). 13 н. и 11 з.п. ф-лы, 9 ил., 4 табл.
1. Замещенные 3-арилсульфонил-пиразоло[1,5-а]пиримидины общей формулы 1 и их фармацевтически приемлемые соли и/или гидраты
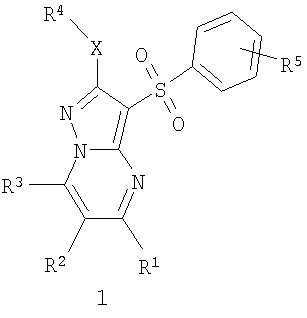
где R1 представляет собой атом водорода, C1-С3алкил, (С1-С3)алкилокси(С1-С3)алкил, гидрокси(С1-С3)алкил, пиридил;
R2 представляет собой атом водорода, атом галогена, C1-С3 алкил, фенилокси или пиридилокси;
R3 представляет собой атом водорода, C1-С3алкил, C1-С3алкилокси, (С1-С3)алкилокси(С1-С3)алкил, гидрокси(С1-С3)алкил, пиридил;
R4 представляет собой C1-С3алкил;
R5 представляет собой атом водорода, один или два атома галогена, C1-С3алкил, C1-С3алкилокси или гидроксил;
Х представляют собой атом серы или сульфинильную группу (SO);
исключая соединения общей формулы 1, в которых одновременно R1 и R3 представляют собой метил, R2 представляет собой атом водорода, a R4-X представляет собой метилсульфанильную группу и этилсульфанильную группу.
2. Соединения по п.1, представляющие собой замещенные 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидины общей формулы 1.1 и их фармацевтически приемлемые соли и/или гидраты
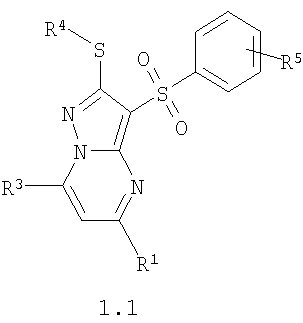
где R1, R3, R4 и R5 имеют вышеуказанное значение.
3. Соединения по п.2, представляющие собой замещенные 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидины общей формулы 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.6, 1.1.7, 1.1.8, 1.1.9, 1.1.10
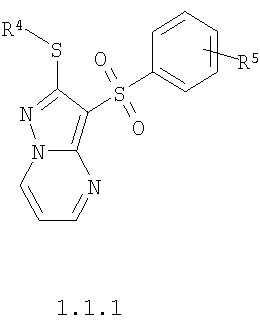
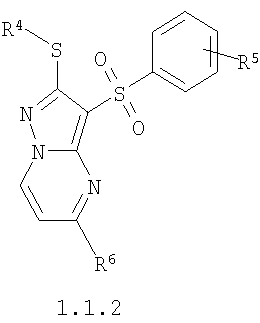
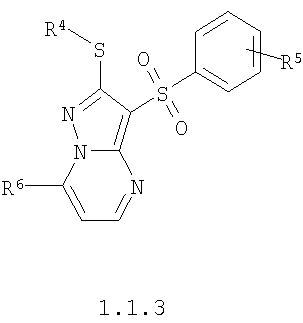
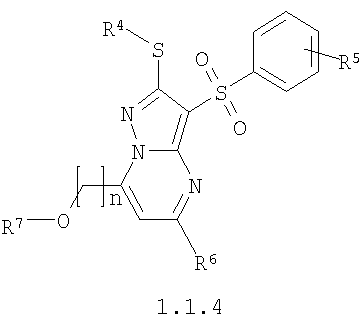
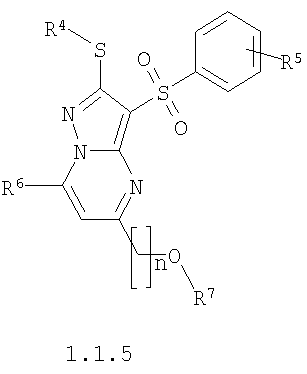
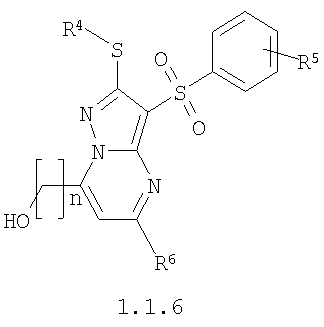
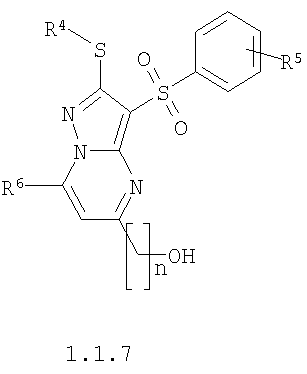
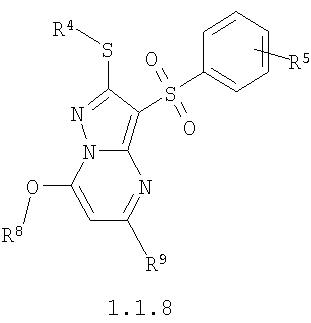
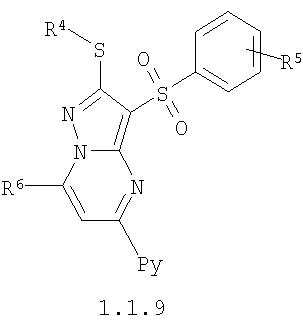
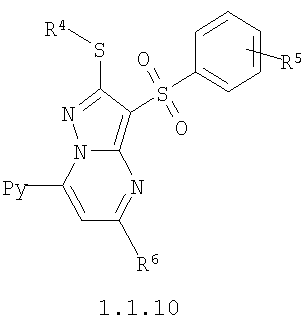
где R4 и R5 имеют вышеуказанное значение; R6 и R7 независимо друг от друга представляют собой водород или C1-С3 алкил; R8 представляет собой водород или C1-С3 алкил; R9 представляет собой C1-С3 алкил или пиридил; Ру представляет собой пиридил; n равно 1, 2, 3.
4. Соединения по п.3, представляющие собой 2-метилсульфанил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.1(1), 2-метилсульфанил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(2), 2-метилсульфанил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(3), 2-метилсульфанил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(4), 2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.1(5), 5-метил-2-метилсульфанил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.2(1), 5-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.2(2), 5-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.2(3), 5-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.2(4), 5-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.2(5), 7-метил-2-метилсульфанил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.3(1), 7-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.3(2), 7-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.3(3), 7-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.3(4), 7-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.3(5), 5-метил-2-метилсульфанил-7-метоксиметил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.4(1), 5-метил-2-метилсульфанил-7-метоксиметил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.4(2), 5-метил-2-метилсульфанил-7-метоксиметил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.4(3), 5-метил-2-метилсульфанил-7-метоксиметил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.4(4), 5-метил-2-метилсульфанил-7-метоксиметил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.4(5), 7-метил-2-метилсульфанил-5-метоксиметил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.5(1), 7-метил-2-метилсульфанил-5-метоксиметил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.5(2), 7-метил-2-метилсульфанил-5-метоксиметил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.5(3), 7-метил-2-метилсульфанил-5-метоксиметил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.5(4), 7-метил-2-метилсульфанил-5-метоксиметил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.5(5), 7-гидроксиметил-5-метил-2-метилсульфанил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.6(1), 7-гидроксиметил-5-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.6(2), 7-гидроксиметил-5-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.6(3), 7-гидроксиметил-5-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.6(4), 7-гидроксиметил-5-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.6(5), 5-гидроксиметил-7-метил-2-метилсульфанил-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.7(1), 5-гидроксиметил-7-метил-2-метилсульфанил-3-(4-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.7(2), 5-гидроксиметил-7-метил-2-метилсульфанил-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.7(3), 5-гидроксиметил-7-метил-2-метилсульфанил-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.7(4) и 5-гидроксиметил-7-метил-2-метилсульфанил-3-(4-фтор-3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.7(5), 5-метил-2-метилсульфанил-7-метокси-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.8(1), 2-метилсульфанил-7-метокси-5-(пиридин-2-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.8(2), 2-метилсульфанил-7-метокси-5-(пиридин-3-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.8(3), 2-метилсульфанил-7-метокси-5-(пиридин-4-ил)-3-фенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.8(4), 5-метил-2-метилсульфанил-7-метокси-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.8(5), 2-метилсульфанил-5-(пиридин-2-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(1), 2-метилсульфанил-5-(пиридин-3-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(2), 2-метилсульфанил-5-(пиридин-4-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(3), 2-метилсульфанил-5-(пиридин-3-ил)-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.9(4), 2-метилсульфанил-5-(пиридин-3-ил)-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.9(5), 7-метил-2-метилсульфанил-5-(пиридин-2-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(6), 7-метил-2-метилсульфанил-5-(пиридин-3-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.9(7), 7-метил-2-метилсульфанил-5-(пиридин-4-ил)-3-фенилсульфонил-пиразоло [1,5-а]пиримидин 1.1.9(8), 7-метил-2-метилсульфанил-5-(пиридин-3-ил)-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.9(9), 7-метил-2-метилсульфанил-5-(пиридин-3-ил)-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.9(10), 2-метилсульфанил-7-(пиридин-2-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(1), 2-метилсульфанил-7-(пиридин-3-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(2), 2-метилсульфанил-7-(пиридин-4-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(3), 2-метилсульфанил-7-(пиридин-3-ил)-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.10(4), 2-метилсульфанил-7-(пиридин-3-ил)-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.10(5), 5-метил-2-метилсульфанил-7-(пиридин-2-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(6), 5-метил-2-метилсульфанил-7-(пиридин-3-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(7), 5-метил-2-метилсульфанил-7-(пиридин-4-ил)-3-фенилсульфонил-пиразоло[1,5-а]пиримидин 1.1.10(8), 5-метил-2-метилсульфанил-7-(пиридин-3-ил)-3-(3-фторфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.10(9), 5-метил-2-метилсульфанил-7-(пиридин-3-ил)-3-(3-хлорфенилсульфонил)-пиразоло[1,5-а]пиримидин 1.1.10(10) и их фармацевтически приемлемые соли и/или гидраты
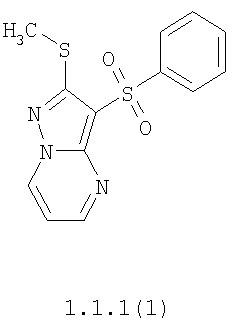
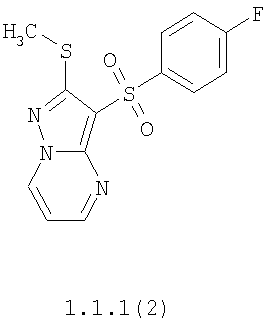
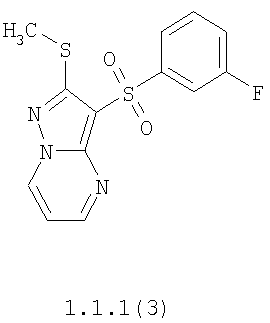
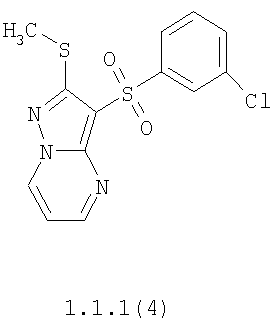
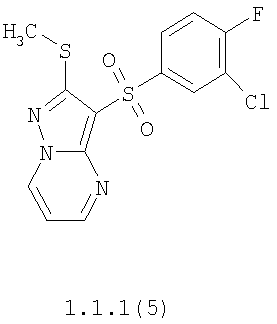
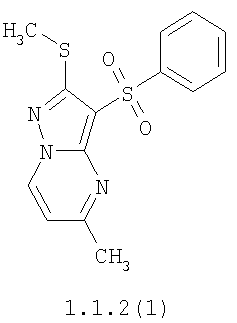
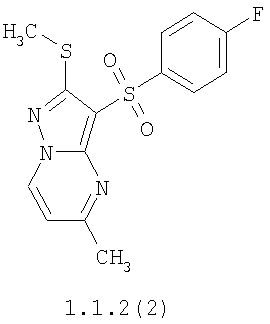
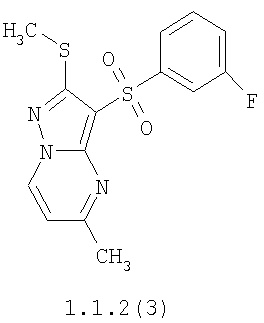
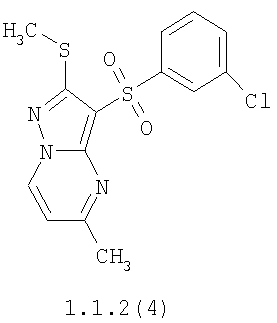
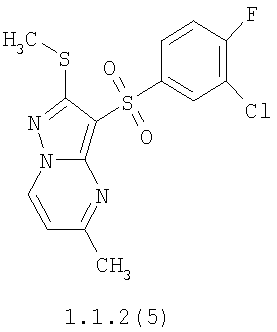
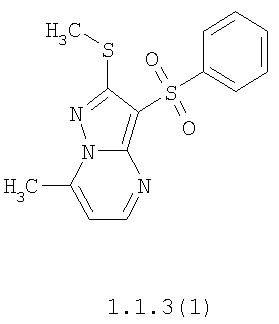
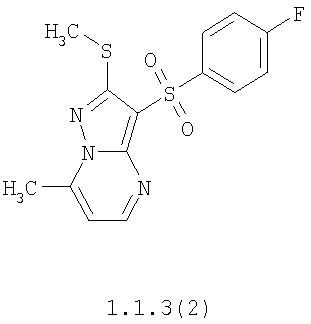
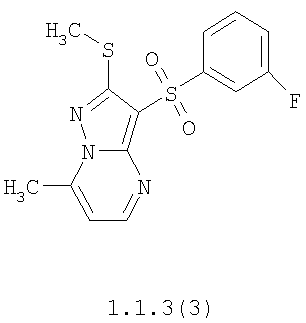
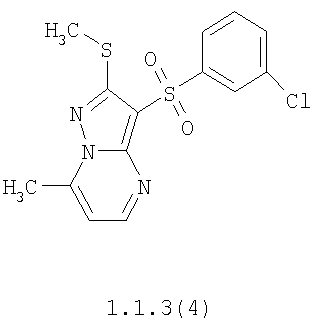
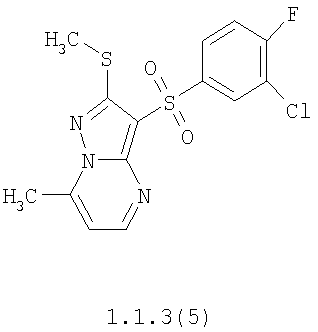
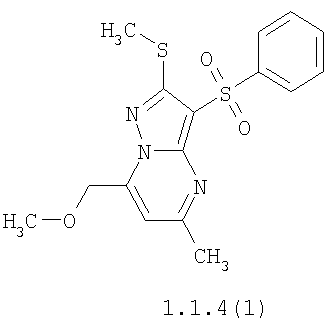
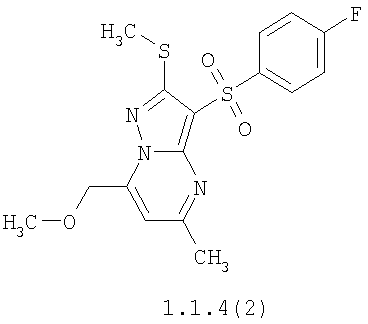
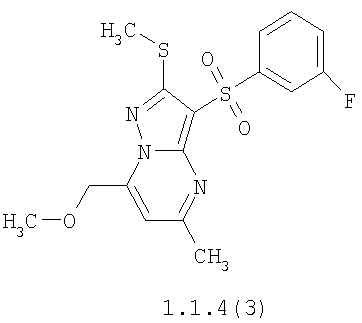
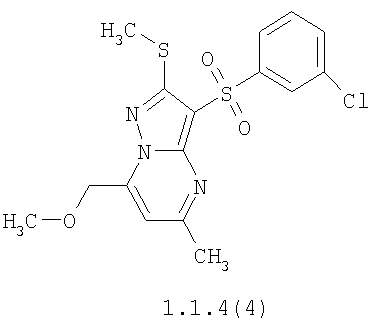
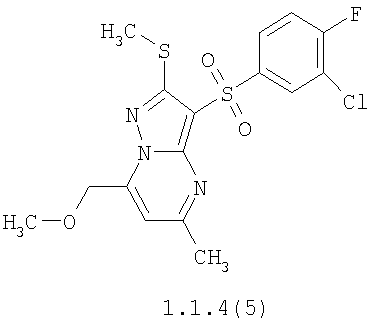
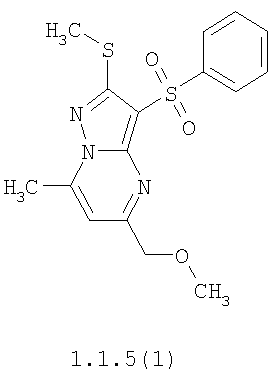
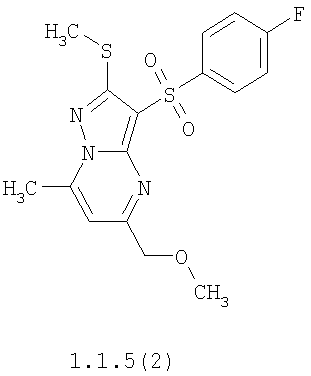
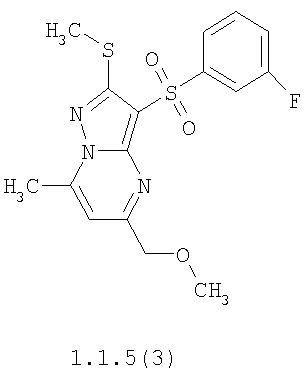
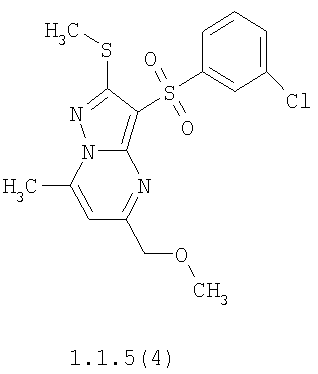
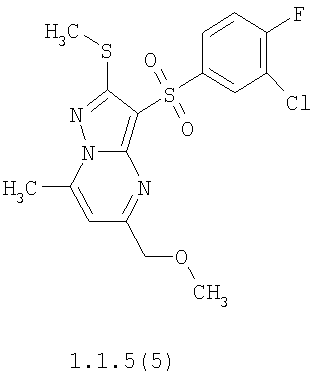
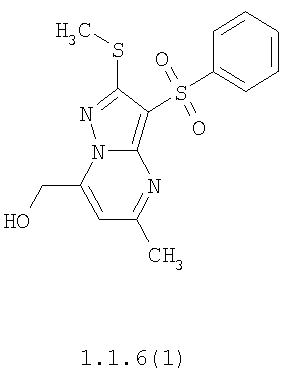
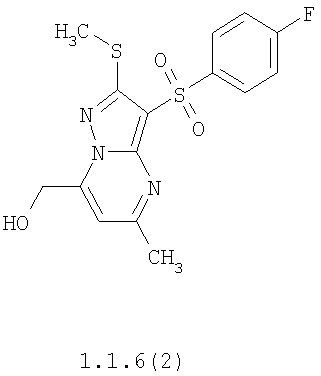
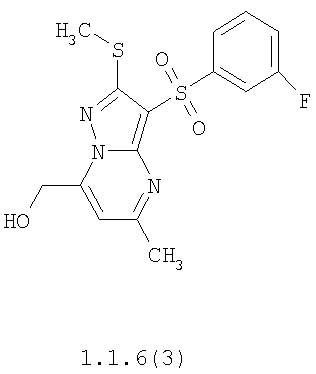
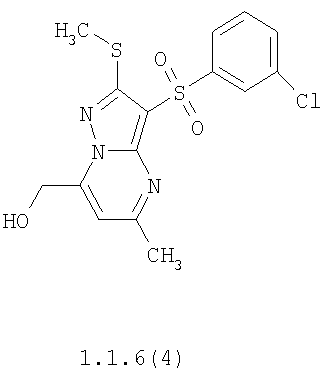
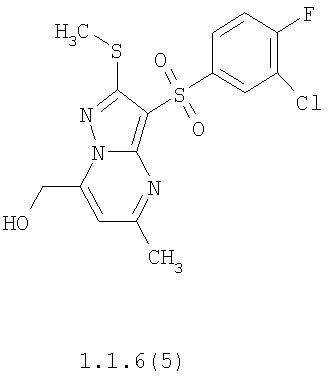
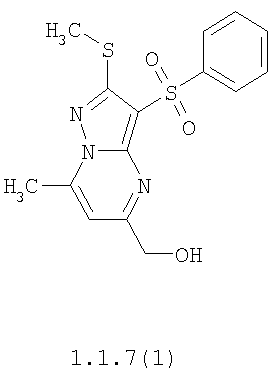
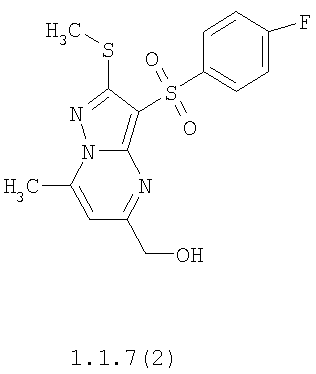
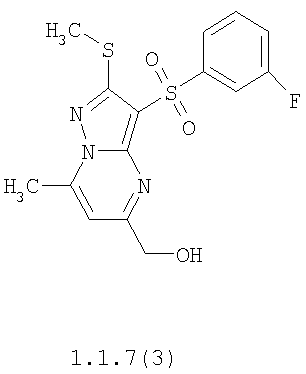
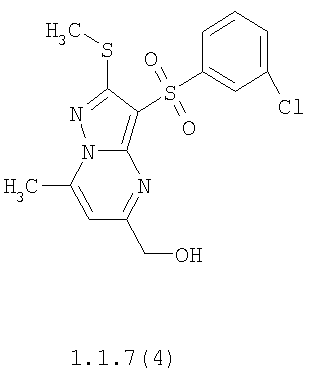
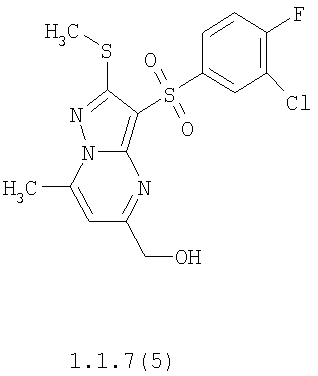
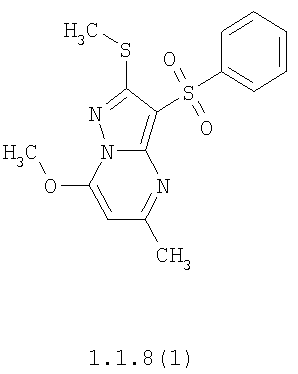
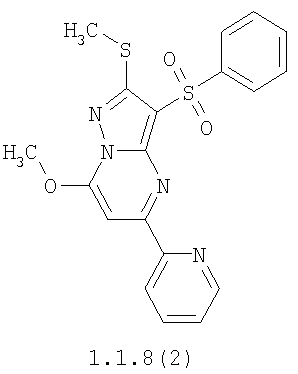
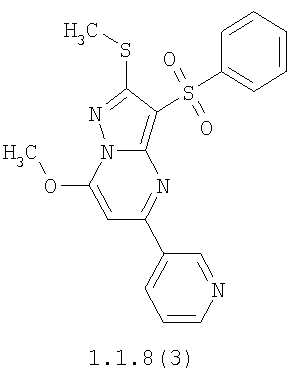
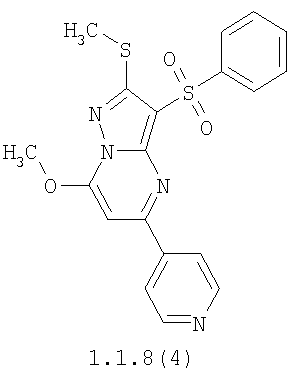
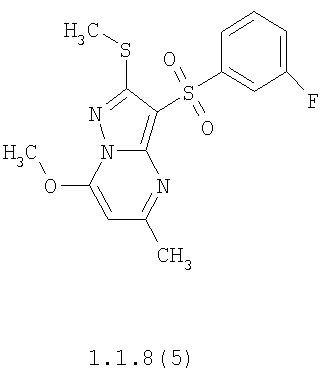
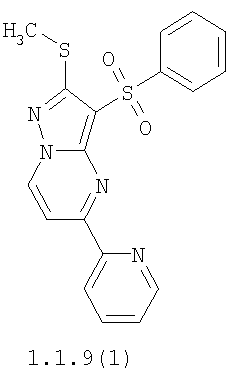
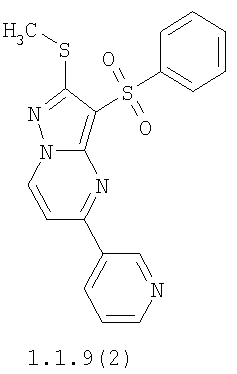
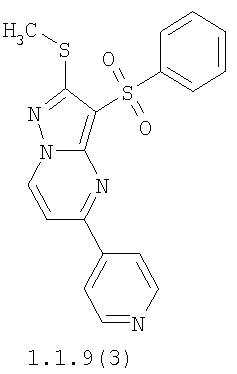
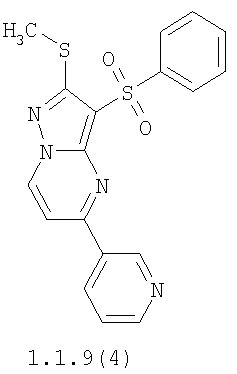
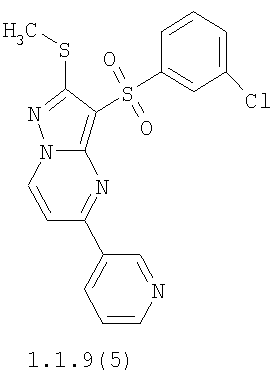
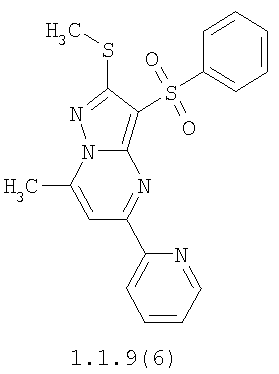
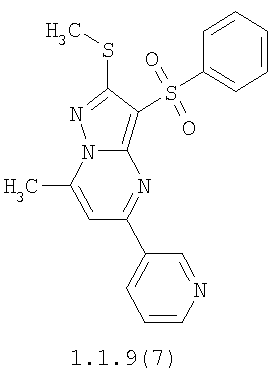
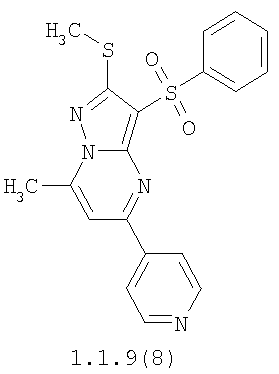
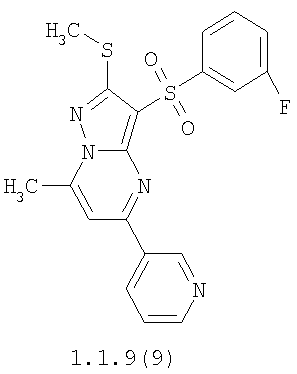
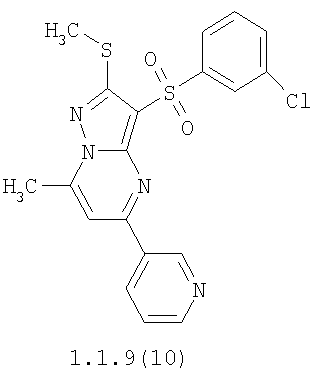
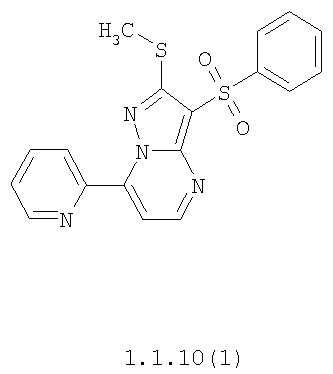
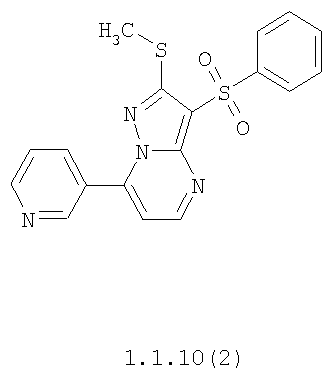
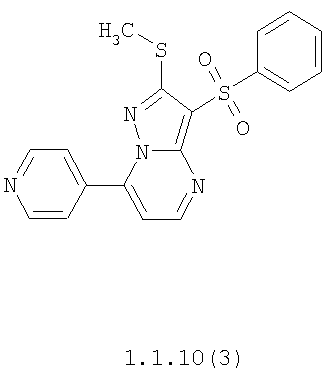
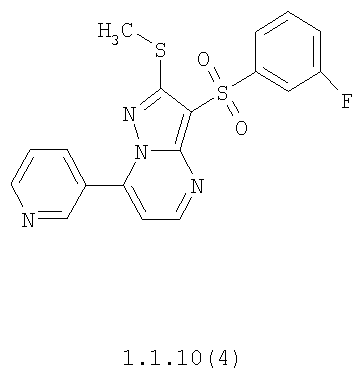
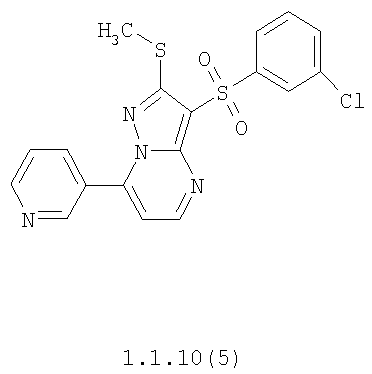
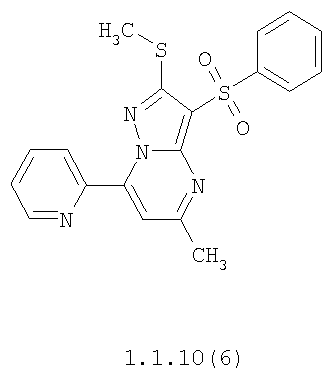
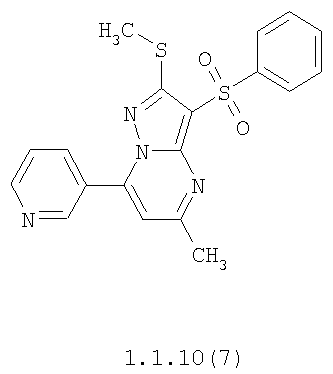
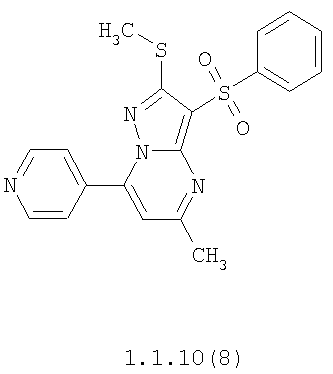
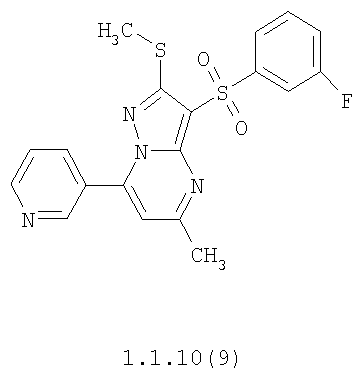
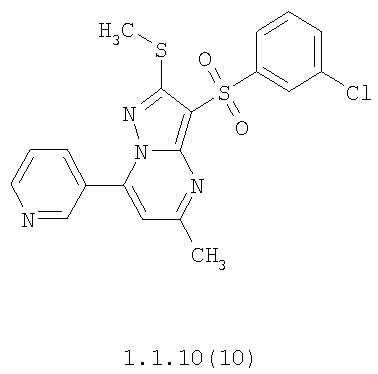
5. Способ получения соединений 1.1.1, 1.1.2, 1.1.3, 1.1.4, 1.1.5, 1.1.9, 1.1.10 по любому из пп.1-4 взаимодействием 3-амино-4-арилсульфонил-2Н-пиразолов общей формулы 2 с соответствующими β-дикарбонильными соединениями общей формулы 3 или их производными
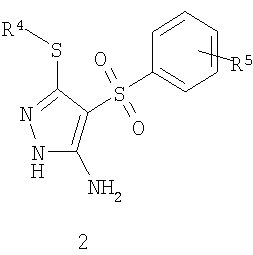
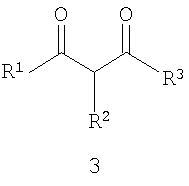
где R1, R2, R3, R4 и R5 имеют вышеуказанное значение.
6. Способ по п.5 получения соединений общей формулы 1.1.1 по любому из пп.3 и 4 взаимодействием 3-амино-4-сульфонил-2Н-пиразолов общей формулы 2 с тетраацеталем малонового альдегида 3.1

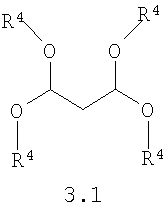
где R4 и R5 имеют вышеуказанное значение.
7. Способ по п.5 получения соединений общей формулы 1.1.2, 1.1.3 по любому из пп.3 и 4 взаимодействием 3-амино-4-сульфонил-2Н-пиразолов общей формулы 2 с 1-замещенным 3,3-диалкилокси-пропаноном 3.2 с последующим выделением или разделением продуктов реакции

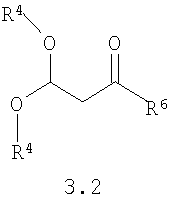
где R4, R5 и R6 имеют вышеуказанное значение.
8. Способ по п.5 получения соединений общей формулы 1.1.4, 1.1.5 по любому из пп.3 и 4 взаимодействием 3-амино-4-сульфонил-2Н-пиразолов общей формулы 2 с алкоксизамещенным дикетоном 3.3 с последующим выделением или разделением продуктов реакции

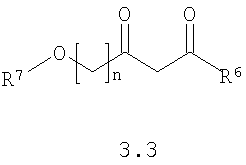
где R4, R5, R6, R7 и n имеют вышеуказанное значение.
9. Способ по п.5 получения соединений общей формулы 1.1.9, 1.1.10 по любому из пп.3 и 4 взаимодействием 3-амино-4-арилсульфонил-2Н-пиразолов общей формулы 2 с дикетоном 3.4 с последующим выделением или разделением продуктов реакции

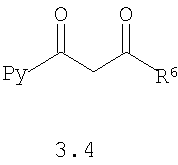
где R4, R5, R6 и Ру имеют вышеуказанное значение.
10. Способ получения соединений общей формулы 1(X=SO) по п.1 окислением 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1(X=S)
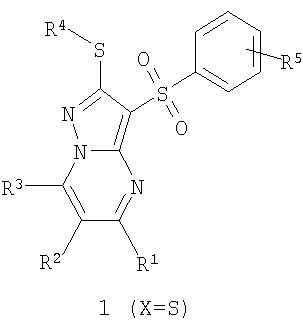
где R1, R2, R3, R4 и R5 имеют вышеуказанное значение.
11. Способ получения замещенных 2-сульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидинов общей формулы 1.1.2 по любому из пп.3 и 4 восстановлением хлорпроизводных общей формулы 4
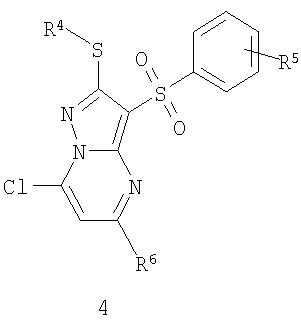
где R4, R5 и R6 имеют вышеуказанное значение.
12. Способ получения соединений общей формулы 1.1.6, 1.1.7 по любому из пп.3 и 4 действием трехбромистого бора на соответствующие алкилоксиалкилзамещенные соединения общей формулы 1.1.4 или 1.1.5.
13. Способ получения соединений общей формулы 1.1.8 по любому из пп.3 и 4 взаимодействием хлорзамещенных общей формулы 4 с алкоголятами щелочных металлов общей формулы 6

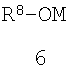
где R4, R5, R8 и R9 имеют вышеуказанное значение; М представляет собой катион щелочного металла.
14. Антагонисты серотониновых 5-НТ6 рецепторов, представляющие собой замещенные 2-алкилсульфанил-3-арилсульфонил-пиразоло[1,5-а]пиримидины общей формулы 1 по любому из пп.1-4.
15. Антагонисты серотониновых 5-НТ6 рецепторов по п.14, предназначенные для изучения избирательного ингибирования серотониновых 5-НТ6 рецепторов.
16. Замещенные 3-арилсульфонил-пиразоло[1,5-а]пиримидины по любому из пп.1-4, обладающие свойствами антагонистов серотониновых 5-НТ6 рецепторов в качестве лекарственного начала для фармацевтических композиций и лекарственных средств.
17. Фармацевтическая композиция, обладающая свойствами антагонистов серотониновых 5-НТ6 рецепторов, для лечения и предупреждения развития состояний и заболеваний центральной нервной системы, содержащая фармацевтически эффективное количество лекарственного начала по п.16.
18. Способ получения фармацевтической композиции по п.17 смешением лекарственного начала по п.16 с инертным наполнителем и/или растворителем.
19. Лекарственное средство в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, для профилактики и лечения заболеваний центральной нервной системы, патогенез которых связан с 5-НТ6 рецепторами, включающее фармацевтически эффективное количество лекарственного начала по п.16 или фармацевтической композиции по п.17.
20. Лекарственное средство по п.19 для профилактики и лечения когнитивных расстройств и нейродегенеративных заболеваний.
21. Лекарственное средство по п.19 для профилактики и лечения психических расстройств.
22. Лекарственное средство, обладающее анксиолитическим действием, по п.19 для профилактики и лечения тревожных расстройств.
23. Лекарственное средство, обладающее ноотропным действием, по п.19 для улучшения умственных способностей.
24. Способ профилактики и лечения заболеваний центральной нервной системы, патогенез которых связан с 5-НТ6 рецепторами, заключающийся во введении лекарственного начала по п.16, или фармацевтической композиции по п.17, или лекарственного средства по п.19 в эффективном количестве.
| Ячейка однородной структуры | 1980 |
|
SU941994A1 |
| KIM HYE JUNG et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| of Chemical Information and Modeling, 2008, 48(1), 197-206 | |||
| N-ПИРАЗОЛИЛ-1,2,4-ТРИАЗОЛО-[1,5-С]-ПИРИМИДИН-2-СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С НЕЖЕЛАТЕЛЬНОЙ РАСТИТЕЛЬНОСТЬЮ | 1992 |
|
RU2065861C1 |
| 1-N-АЛКИЛ-N-АРИЛПИРИМИДИНАМИНЫ, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2153494C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРИАЗОЛОВ, КОНЕЧНЫЕ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ СПОСОБА | 1996 |
|
RU2156760C2 |
Авторы
Даты
2010-06-27—Публикация
2008-10-06—Подача