Область техники, к которой относится изобретение
Настоящее изобретение преимущественно относится к аналитическому тестированию образцов тканей in vitro, точнее к выявлению генетических полиморфизмов, являющихся маркерами эффективности алискирена в качестве антигипертензивного агента.
Предпосылки создания изобретения
Ренин-ангиотензивная система (РАС) играет важную роль в регуляции кровяного давления и объема гомеостаза. Ренин секретируется почками в ответ на снижение объема циркулирующей крови и понижение кровяного давления и расщепляет субстрат ангиотензиноген с образованием неактивного декапептида ангиотензина I (Ang I). Ang I конвертируется в активный октапептид Ang II ангиотензин-конвертирующим ферментом (АКФ). Ang II взаимодействует с клеточными рецепторами, индуцируя сужение сосудов и высвобождение катехоламинов из мозгового вещества надпочечников и предсинаптических нервных окончаний. Он также индуцирует секрецию альдостерона и обратное всасывание натрия. Кроме того, Ang II ингибирует высвобождение ренина, тем самым, обеспечивая обратную связь с системой. Следовательно, Ang II действует на разных уровнях (например, на уровне сосудистой сети, симпатической нервной системы, коркового и мозгового вещества надпочечников) для увеличения сопротивления сосудов и повышения кровяного давления.
Ренин-ангиотензивная система (РАС) может быть заблокирована на разных уровнях. Поскольку ингибиторы ренина блокируют РАС на более высоком уровне, чем ингибиторы АКФ и антагонисты Ang II, они оказывают разное воздействие на компоненты РАС. После введения ингибитора ренина блокируется образование и Ang I, и Ang II. Несмотря на то что после подавления АСЕ блокируется только образование Ang II, уровни Ang I повышаются. Таким образом, Ang I все еще способен конвертироваться в Ang II и другие ангиотензивные пептиды по другим метаболическим путям, например, через химазную систему.
Алискирен (SPP100) является непептидным антигипертензивным агентом с низким молекулярным весом (609,8). См. Wood J.M. и др., Biochem. Biophys. Res. Commun. 308, 2003, с.698-705. Его механизм действия отличен от механизма действия других коммерческих антигипертензивных агентов. Алискирен блокирует ренин-ангиотензивную систему (РАС) на ее первой скорость-лимитирующей стадии. In vitro алискирен является мощным ингибитором ренина человека (IC50=0,6 нмолей). In vivo алискирен, введенный перорально (п.о.) или внутривенно (в.в.) в нескольких исследованиях на игрунковых обезьянах, истощенных по натрию, вызывал полное подавление активности ренина плазмы (АРП), устойчивое снижение среднего артериального давления (САД) и существенное повышение в плазме концентраций действующего и общего ренина. У людей концентрации алискирена в плазме быстро повышаются после введения, достигая пиковых уровней за 3-5 ч. Величины и Cmax, и AUC повышаются с увеличением дозы, но не линейно. Полувыведение алискирена занимает примерно 25 ч, а его биодоступность составляет примерно 2,7%.
Традиционные медицинские подходы к диагностике и лечению заболевания основываются только на клинических данных, или помимо них также на диагностическом тестировании. Такой общепринятый подход часто приводит к выбору способа лечения, оптимального для эффективности назначенной лекарственной терапии или для минимизации вероятности возникновения побочных эффектов для конкретного субъекта. Способ специфической терапевтической диагностики (также известный под названием тераностика) относится к расширяющейся области медицинской технологии, которая обеспечивает тесты, применимые для диагностики заболевания, выбор скорректированного режима лечения и мониторинг реакции субъекта на лечение. То есть тераностика применима для прогнозирования и оценки ответной реакции конкретного субъекта на лекарственное средство, т.е. является индивидуализированной медициной. Тесты тераностики также применимы для подбора субъектов для лечения, которые с высокой вероятностью получат лечебный эффект в результате лечения, или для выяснения раннего и объективного показания эффективности лечения у конкретных субъектов таким образом, что лечение может быть изменено с минимальным промедлением.
Прогресс в фармакогенетике, устанавливающий корреляции между ответами на конкретные лекарственные средства и генетическими профилями отдельных пациентов, основывается на развитии новых тераностических подходов. В связи с этим в данной области техники существует потребность в оценке у разных пациентов вариаций в генной последовательности и генной экспрессии. Общая форма генетического профиля основывается на идентификации вариаций последовательности ДНК, называемых одиночными нуклеотидными полиморфизмами (ОНП), которые являются одним из типов генетических мутаций, приводящих к вариациям у пациентов индивидуальных ответов на лекарственное средство. Из этого следует, что в данной области существует потребность в идентификации и описании генетических мутаций, например ОНП, которые могут использоваться для идентификации генотипов субъектов, связанной с ответами на лекарственные средства.
Краткое описание изобретения
Настоящее изобретение соответствует существующей в данной области техники потребности. Установлены важные корреляции между полиморфизмами в гене ангиотензин-конвертирующего фермента (АКФ), полиморфизмами в гене рецептора 2 ангиотензина II типа (AGTR2) и снижением клинических параметров средних значений диастолического и систолического значений кровяного давления с последующим лечением алискиреном, применяемым в качестве антигипертензивного агента. Эти эффекты не наблюдают при лечении ирбесартаном и плацебо, но они специфичны в отношении лечения алискиреном.
Таким образом, настоящее изобретение предусматривает применение алискирна для получения лекарственного средства для лечения гипертонии в группе определенным образом выбранных пациентов. Пациентов, предназначенных для лечения, отбирают в группу на основании генетических полиморфизмов в биомаркерных генах, имеющихся у пациентов. Биомаркерные гены являются геном ангиотензин-конвертирующего фермента (АКФ) и гена рецептора 2 ангиотензина II типа (AGTR2). Эти генетические полиморфизмы являются показателями эффективности алискирена в лечении гипертонии.
Настоящее изобретение также предусматривает диагностический способ определения ответной реакции индивидуумов с гипертонией на лечение алискиреном, основанный на установлении нуклеотидной пары в одном или нескольких полиморфных генетических локусах настоящего изобретения.
Настоящее изобретение также предусматривает тераностический способ лечения гипертонии у конкретного индивидуума. Антигипертензивный агент вводят индивидууму, если нуклеотидная пара в полиморфном генетическом локусе согласно настоящему изобретению показывает, что индивидуум отвечает на антигипертенивный агент. В одном из вариантов осуществления настоящего изобретения антигипертензивным агентом является алискирен. Другой вариант терапевтического лечения индивидуума применяют, если нуклеотидная пара в полиморфном генетическом локусе настоящего изобретения показывает, что индивидуум не отвечает на антигипертензивный агент.
Настоящее изобретение в целом предусматривает способ понижения диастолического кровяного давления на протяжении дневного времени (ДКДДВ) для амбулаторных больных. В конкретном варианте осуществления настоящего изобретения предусмотрен тераностический способ понижения среднего определенного диастолического кровяного давления (СОДКД).
Кроме того, настоящее изобретение предусматривает способ понижения систолического кровяного давления на протяжении дневного времени для амбулаторных больных (СКДДВ). В конкретном варианте осуществления настоящего изобретения предусмотрен тераностический способ понижения среднего определенного систолического кровяного давления (СОСКД).
Настоящее изобретение также предусматривает способ отбора индивидуума для включения в клиническое исследование для определения эффективности антигипертензивного агента для лечения гипертонии. Индивидуум может быть включен в исследование, если генотип индивидуума свидетельствует об эффективности антигипертензивного агента в лечении гипертонии данного индивидуума. Индивидуум может быть исключен из исследования, если генотип индивидуума не подтверждает эффективности антигипертензивного агента для лечения гипертонии у данного индивидуума.
Настоящее изобретение предусматривает наборы для практического осуществления способов настоящего изобретения. Настоящее изобретение также предусматривает способ применения продукта гена ангиотензин-конвертирующего фермента (АКФ) и продукта гена рецептора ангиотензина II, типа 2, (AGTR2) в качестве мишеней для поиска новых лекарственных средств.
Краткое описание чертежа
Чертеж представляет гистограммы, свидетельствующие о доле индивидуумов, отобранных по генотипу ОНП_4769, отвечающих на лечение (респондеров) во всех трех группах лечения тегасеродом вместе взятых, в группе с самой высокой дозой алискирена (600 мг), в группе лечения ирбесартаном и в группе плацебо. В подписях под гистограммами верхний ряд относится к аллелю СТ, а нижний ряд относится к аллелю ТТ.
Подробное описание изобретения
Ретроспективный фармакогенетический анализ был выполнен для оценки возможной связи между генетической вариацией и результатом клинического лечения. При проведении клинического лечения алискирен, вводимый в дозах 75, 150 или 300 мг один раз в сутки, проявил себя в качестве эффективного антигипертензивного агента при лечении пациентов с гипертонией, выраженной в степени от слабой до умеренной, что привело к статистически значимому снижению систолического кровяного давления в дневное время (СКДДВ). Все дозы активного лечении были статистически эффективнее плацебо, что выражалось в снижении среднего определенного диастолического кровяного давления (СОДКД) в конечной точке клинического лечения в группе пациентов, отобранных для этого лечения, через 8 недель, а также в группе лечения по протоколу к концу клинического исследования. Близкие результаты по снижению СДКД были достигнуты при применении алискирена в дозе 150 мг и ирбесартана в дозе 150 мг. См. ниже пример 1.
По параметру среднего определенного систолического кровяного давления (СОСКД) в конечной точке клинического исследования все дозы активного лечения были статистически эффективнее плацебо. Эффективность применения алискирена в дозах 300 и 600 мг статистически достоверно превышает результат применения плацебо и ирбесартана в конечной точке клинического исследования. Схожее понижение СОСКД было достигнуто при применении алискирна в дозе 150 мг и ирбесартана в дозе 150 мг. Дозы алискирена 300 и 600 мг вызывают самое сильное понижение кровяного давления. См. ниже пример 1.
При проведении фармакогенетического анализа исследовали 48 полиморфизмов в составе 12 генов системы ренин-ангиотензин-альдостерон (РАС) или генов, для которых ранее было установлено их участие в регулировании кровяного давления. Важные взаимосвязи наблюдали между одним полиморфизмом в гене ангиотензин-конвертирующего фермента (АКФ) (ОНП_4769, SEQ ID NO:1), двумя полиморфизмами в гене рецептора ангиотензина II, тип 2, (AGTR2) (ОНП_1445, SEQ ID NO:2 и ОНП_4795, SEQ ID NO:3) и клиническими параметрами снижения среднего диастолического и систолического кровяного давления. Эти эффекты не наблюдали при лечении ирбесартаном или плацебо в настоящем исследовании, предположительно они специфичные для алискирена.
Нуклеотидная последовательность ОНП_4769 (SEQ ID NO:1) следующая:
AGGACTTCCC AGCCTCCTCT TCCTGCTGCT CTGCTACGGG CACCCTCTGC TGGTCCCCAG CCAGGAGGCA/Y CCCAACAGGT GACAGTCACC CATGGGACAA GCAGCCAGGC AACAACCAGC AGCCAGACAA ССАСССАССА
ОНП_4769 является кодирующим ОНП, который изменяет аминокислотную последовательность с пролина на серин в кодоне 32 фермента АКФ.
Нуклеотидная последовательность ОНП_1445 (SEQ ID NO:1) следующая:
TGGAAACTTC ATTTTTTTTG TTTGAGATTT ATTTGAATGA GCTGTTATGA TTGGAGACAG TGAGAATTTC AGATTAATGT TTTGCAGACA AAAAAAAACC TCTCTGGAAA GCTGGCAAGG GTTCATAAGT CAGCCCTAGA ATTATGTAGG TTGAAGGCTC CCAGTGGACA GACCAAACAT ATAAGAAGGA AACCAGAGAT CTGGTGCTAT TACGTCCCAG CGTCTGAGAG AACGAGTAAG CACAGAATTC AAAGCATTCT GCAGCCTGAA TTTTGAAGGT AAGTATGAAC AATTTATATA TAATTTACTT GGAAAGTAGA ACATACATTA AATGAAAATA TTTTTTATGG ATGAACTTCT GTTTTTCCTG TGTTTTAACA CTGTATTTTG CAAAACTCCT/R AATTATTTAG CTGCTGTTTC TCTTACAGGA GTGTGTTTAG GCACTAAGCA AGCTGATTTA TGATAACTGC TTTAAACTTC AACAACCAGT AAGTCTTCAA GTGGAATTTA TTATTGATTC TTTTATGTTA ATTTGTTAGG TCAAAAGAAA AATCTTTAGA GCAAAATAAA AGTTTTGCTC TTTATTAGGA GGTTCTTTAG ATATTACACT TTTAATTGGG TAGCTTATTT GCATGTATTT TGAAACTATC TAAAGTAAAT AGTGTTTCCT TTGTATGCTT ATCTTTAGCT AATGTGTTTT TTTTTTTGGT TTTAAAATAA TGCTTCTAGT GAAAAAAATC ACAAAAACCT CAACACTGTA ACGTTTGAGA GCAACGGCTA TTCAGTTCGG TTAAACCGAA
ОНП_1445 является нетранслируемой областью иРНК гена AGTR2 (см. табл.2Б).
Нуклеотидная последовательность ОНП_4795 (SEQ ID NO:1) следующая:
ссаасасааа аgсасаgсаg ttgagaactg ggaaagcatc gcactacaac tgctactgcc attaaccaca ttgtcctgga tgcccaagag cttaagagcc cacttaccta cctggtacac tgctactaca actgacatct gagaaagcca cccaaaggaa caagaatttc cctgtctgga accaacagaa ttgtcactat/R ttctgtacca gatcccaagg atacacatgc ttagcttact attactacca ctgaaacttg caaaagaacc catcaagcat tccattcccc agcacaaatt catcagtttc tatcaataac ctcacaatgc cacacagagg aatagacaga tactactaag gctgtttata gccaatgaaa tcatacacag tcttcacca
ОНП_4795 присутствует в геномной области гена AGTR2 (см. табл.2Б). Определенные объекты, способы, осуществления, варианты и свойства настоящего изобретения описаны ниже с большей или меньшей степенью подробности для реального понимания настоящего изобретения. В общих чертах, такое описание предусматривает новое применение полинуклеотидных вариаций, ОНП, применимых для диагностики и лечения субъектов, нуждающихся в этом. Таким образом, различные объекты настоящего изобретения относятся к полинуклеотидам, кодирующим полинуклеотидные вариации настоящего изобретения генов АКФ и AGTR2. Различные объекты настоящего изобретения также относятся к диагностическим/тераностическим способам и наборам, в которых применяют полинуклеотидные вариации настоящего изобретения для идентификации индивидуумов, предрасположенных к заболеванию, или к классификации индивидуумов по способности отвечать на лекарственное средство, по побочным эффектам или по оптимальной лекарственной дозе. Кроме того, в настоящем изобретении предусмотрены способы оценки соединений и компьютерная система для накопления и анализа данных, связанных с полинуклеотидными вариациями настоящего изобретения. Ниже представлены различные конкретные варианты осуществления настоящего изобретения, которые иллюстрируют указанные выше объекты.
Определения. Ниже приведены определения некоторых терминов, используемых в настоящем изобретении. С определениями других терминов можно ознакомиться в словаре Департамента энергии США, отделе науки, проекте генома человека <http://www.ornl.gov/sci/techresources/Human_Genome/glossary/>. Медицинские термины представлены Chobanian и др. в Hypertension 42, 2003, сс.1206-1252. С определением гипертонии Ассоциации кардиологов США можно ознакомиться на сайте <http://www.americanheart.org/presenter.jhtml?identifier=4623>. Все ссылки на эти источники включены в настоящее изобретение.
В контексте настоящего изобретения понятие «аллель» означает определенную локализацию на хромосоме (в локусе) формы гена или последовательности ДНК.
В контексте настоящего изобретения понятие «антитело» включает, но не ограничивается ими, поликлональные антитела, моноклональные антитела, гуманизированные или химерные антитела и биологически функциональные фрагменты антител, достаточные для связывания фрагмента антитела с белком.
В контексте настоящего изобретения «клинический ответ» означает какое-либо одно или все из следующих понятий: количественное измерение ответа, ответа нет и вредный ответ (т.е. побочные эффекты).
В контексте настоящего изобретения понятие «клиническое исследование» означает какое-либо исследование, предпринятое для сбора клинических данных по ответам на конкретное лечение, и включает, но не ограничивается ими, этапы I, II и III клинических исследований. Используются стандартные методы для определения группы пациентов и включения в нее субъектов.
В контексте настоящего изобретения понятие «эффективное количество» означает количество соединения, достаточное для достижения желаемого терапевтического и/или профилактического эффекта, например количество, которое предупреждает появление симптомов, связанных с гипертонией, или понижает их проявление. В предпочтительном варианте осуществлении настоящего изобретения таким соединением является алискирен.
Количество соединения, вводимого субъекту, зависит от типа и тяжести заболевания и от состояния индивидуума, например от общего состояния здоровья, возраста, пола, массы тела и устойчивости к лекарственным средствам. Оно также может зависеть от степени, тяжести и типа заболевания. Специалист в данной области способен определить необходимые дозы, зависящие от этих и других факторов. Обычно эффективное количество соединений настоящего изобретения, достаточное для достижения терапевтического или профилактического эффекта, варьирует примерно от 0,000001 мг/кг массы тела в сутки до примерно 10,000 мг/кг массы тела в сутки. Предпочтительно дозы варьируют примерно от 0,0001 мг/кг массы тела в сутки до примерно 100 мг/кг массы тела в сутки. Соединения настоящего изобретения могут вводиться в комбинации друг с другом или с одним или несколькими дополнительными лекарственными соединениями. В предпочтительном варианте осуществления настоящего изобретения эффективное количество алискирена составляет 75, 150 или 300 мг при введении один раз в сутки.
В контексте настоящего изобретения понятие «экспрессия» означает одно или несколько из следующих понятий, но ими не ограничивается: транскрипцию гена и образование иРНК, сплайсинг и другой процессинг иРНК-предшественника для формирования зрелой иРНК, стабильность иРНК, трансляцию зрелой иРНК и образование белка (включая применение кодона и доступность тРНК) и гликозилирование и/или другие модификации продукта трансляции, если они необходимы для надлежащей экспрессии и функции.
В контексте настоящего изобретения понятие «ген» означает сегмент ДНК, содержащий всю информацию для регулируемого биосинтеза продукта РНК, включая промоторы, экзоны, интроны и другие нетранслируемые области, контролирующие экспрессию.
В контексте настоящего изобретения понятие «генотип» означает нефазовую 5'→3' последовательность нуклеотидных пар, обнаруженную в одном или нескольких полиморфных сайтах локуса пары гомологичных хромосом индивидуума. В контексте настоящего изобретения понятие «генотип» относится к полному генотипу или суб-генотипу.
В контексте настоящего изобретения понятие «локус» означает расположение на хромосоме или в молекуле ДНК, соответствующее гену или физическому, или фенотипическому свойству.
В контексте настоящего изобретения понятие «АКФ-модулирующий агент» или «AGTR2-модулирующий агент» означает какое-либо соединение, которое изменяет (т.е. повышает или понижает) уровень экспрессии или уровень биологической активности полипептида АКФ или полипептида AGTR2, соответственно, в отсутствие модулирующего агента. Модулирующим агентом может быть низкомолекулярное соединение, полипептид, углеводород, липид, нуклеотид или их комбинация. Модулирующим агентом может быть органическое соединение или неорганическое соединение.
В контексте настоящего изобретения понятие «мутант» означает какое-либо наследуемое изменение дикого типа, являющееся результатом мутации, например однонуклеотидный полиморфизм. В настоящем описании понятие «мутант» используется взаимозаменяемо с понятиями «маркер», «биомаркер» и «мишень».
В контексте настоящего изобретения понятие «медицинское состояние» означает, но ими не ограничивается, какое-либо состояние или заболевание, проявляемое в виде одного или нескольких физических и/или физиологических симптомов, для которого показано лечение, и включает ранее или вновь описанные заболевания и другие расстройства. В предпочтительном варианте осуществления настоящего изобретения медицинским состоянием является гипертония.
В контексте настоящего изобретения понятие «пара нуклеотидов» означает нуклеотиды, обнаруженные в полиморфном сайте двух копий хромосомы индивидуума.
В контексте настоящего изобретения понятие «полиморфный сайт» означает положение в локусе, по которому, по меньшей мере, две разные последовательности обнаруживаются в группе, причем его наибольшая частота встречаемости составляет не более 99%.
В контексте настоящего изобретения понятие «полиморфизм» означает какой-либо вариант последовательности, встречающийся в популяции с частотой >1%. Вариант последовательности может присутствовать с частотой, существенно превышающей 1%, например 5%, 10% или более. Кроме того, это понятие может применяться к варианту последовательности, обнаруживаемому у индивидуума в полиморфном сайте. К полиморфизмам относятся нуклеотидные замены, инсерции, делеции и микросателлиты, которые необязательно могут приводить к фиксируемым различиям генной экспрессии или функции белка.
В контексте настоящего изобретения понятие «полинуклеотид» означает какую-либо РНК или ДНК, которые могут быть немодифицированными или модифицированными РНК или ДНК. К полинуклеотидам относятся без каких-либо ограничений одно- и двунитевая ДНК, ДНК, представляющая смесь одно- и двунитевых областей, одно- и двунитевая РНК, РНК, представляющая смесь одно- и двунитевых областей, а также гибридные молекулы, ДНК и РНК, которые могут быть однонитевыми или, что чаще, двунитевыми, или смесью одно- и двунитевых областей. Кроме того, понятие «полинуклеотид» относится к трехнитевым областям, включающим РНК или ДНК, или и РНК, и ДНК. К понятию «полинуклеотид» также относятся молекулы ДНК или РНК, содержащие одну или несколько модификаций, основой которых являются молекулы ДНК или РНК, модифицированные с целью стабильности или по другим причинам.
В контексте настоящего изобретения понятие «полипептид» означает какой-либо полипептид, включающий две или несколько аминокислот, соединенных пептидными связями или модифицированными пептидными связями, т.е. пептидные изостеры. Понятие полипептид относится и к соединениям с короткой цепью, обычно называемым пептидами, гликопептидами или олигомерами, и к соединениям с длинной цепью, обычно называемыми белками. Полипептиды могут содержать аминокислоты, отличающиеся от 20 кодируемых генами аминокислот. К полипептидам относятся аминокислотные последовательности, модифицированные либо из-за естественных процессов, например, в результате пост-трансляционного процессинга, либо в результате химических модификаций, хорошо известных в данной области техники. Такие модификации подробно изложены в руководствах, более подробно - в монографиях, а также в огромном количестве научных публикаций.
В контексте настоящего изобретения понятие «нуклеиновая кислота с ОНП» означает последовательность нуклеиновой кислоты, в составе которой присутствует вариабельный нуклеотид, причем в других отношениях последовательность идентична последовательностям индивидуумов и групп индивидуумов, таким образом, она существует в виде аллелей. Такие нуклеиновые кислоты с ОНП содержат предпочтительно примерно от 15 до примерно 500 нуклеотидов в длину. Нуклеиновые кислоты с ОНП могут быть частью хромосомы, или они могут быть точной копией части хромосомы, например, за счет амплификации этой части хромосомы в результате ПЦР или клонирования. Нуклеиновые кислоты с ОНП в настоящем описании называются просто «ОНП». ОНП отражает вариабельность нуклеотида в одном положении генома, в котором два разных основания встречаются в человеческой популяции с ощутимой частотой (т.е. >1%). ОНП могут присутствовать в гене или в межгенных областях генома. Зонды ОНП согласно настоящему изобретению являются олигонуклеотидами, комплементарными нуклеиновой кислоте с ОНП.
В контексте настоящего изобретения понятие «субъект» предпочтительно означает млекопитающее, например человека, а также может означать животное, например домашнее животное (например, собак, кошек и других), сельскохозяйственное животное (например, коров, овец, свиней, лошадей и других) и лабораторное животное (например, обезьян, например, макак-крабоедов, крыс, мышей, морских свинок и других).
В контексте настоящего изобретения введение агента или лекарственного средства субъекту или пациенту означает введение, произведенное или самостоятельно, или другим лицом. Также следует учитывать, что различные способы лечения или предупреждения заболеваний носят характер «фундаментального», что означает общее, но не только общее, лечение или предупреждение, при котором достигаются некоторые биологические или медицинские значимые результаты.
Идентификация и описание вариации генной последовательности. В связи с преобладанием и широким распространением ОНП могут быть эффективными и важными инструментами для локализации генов, участвующих в болезненном состоянии человека. См., например, Wang и др., Science 280, 1998, сс.1077-1082. Совершенно очевидно, что риск развития многих обычных заболеваний и метаболизм лекарственных средств, используемых для лечения этих заболеваний, в значительной степени зависят от лежащих в основе геномных вариаций, хотя эффекты, вызываемые каким-либо из вариантов, могут быть незначительными.
ОНП называется «аллельным», поскольку в нем содержится полиморфизм, причем некоторые представители вида могут иметь последовательность без мутаций (т.е. природный аллель), а другие - последовательность с мутацией (т.е. вариант или мутантный аллель).
Ассоциация между наличием полиморфизма и определенным фенотипом не обязательно свидетельствует о том, что ОНП является причиной данного фенотипа. Ассоциация может существовать единственно из-за геномной близости ОНП и теми генетическими факторами, которые реально ответственны за данный фенотип, например, ОНП и указанные генетические факторы могут быть близко расположены. Таким образом, ОНП может быть в неравновесном сцеплении («НС») с «истинным» функциональным вариантом. НС (также называемое аллельной ассоциацией) наблюдается в тех случаях, когда аллели при двух различных локализациях генома ассоциированы в большей степени, чем предполагалось. Следовательно, ОНП могут служить в качестве маркера, который близко расположен к мутации, вызывающей определенный фенотип.
В описываемых полиморфных сайтах настоящего изобретения для удобства рассматривается смысловая цепь гена. Однако специалисту очевидно, что молекулы нуклеиновой кислоты, содержащие ген, могут быть комплементарны двунитевым молекулам и, следовательно, ссылка на определенный сайт смысловой цепи также относится к соответствующему сайту комплементарной антисмысловой цепи. Таким образом, ссылка может быть произведена к одному и тому же полиморфному сайту в любой из двух цепей и олигонуклеотид может быть разработан таким образом, чтобы гибридизировать конкретно любую из цепей по целевой области, содержащей полиморфный сайт. Следовательно, настоящее изобретение также включает однонитевые полинуклеотиды, которые комплементарны смысловой цепи геномных вариантов, описанных в настоящем изобретении.
Идентификация и описание ОНП. Может быть использовано много различных методов для идентификации и описания ОНП, включая анализ однонитевых конформационных полиморфизмов (ОНКП), гетеродуплексный анализ путем денатурирующей высокоэффективной жидкостной хроматографией (ДВЭЖХ), прямым секвенированием ДНК и вычислительными способами. Shi и др., Clin. Chem. 47, 2001, сс.164-172. Имеется огромная доступная информация о последовательностях, представленная в базах данных.
Наиболее распространенные современные методы типирования ОНП включают гибридизацию, протяжение праймеров и методы расщепления. Каждый из этих методов должен сочетаться с соответствующей ему системой детекции. К методам детекции относятся флуоресцентная поляризация (Chan и др., Genome Res. 9, 1999, сс.492-499), люминометрическая детекция высвобождения фосфата (пиросеквенирование) (Ahmadiian и др., Anal. Biochem. 280, 2000, сс.103-110), исследования расщепления, основанные на переносе энергии флуоресцентного резонанса, ДВЭЖХ и масс-спектрометрия (Shi, Clin. Chem. 47, 2001, сс.164-172, US 6300076 B1). Другие способы детекции и описания ОНП описаны в патентах US 6297018 и 6300063.
Полиморфизмы также могут быть выявлены с помощью коммерчески доступных продуктов, например технологии INVADER™ (фирма Third Wave Technologies Inc. Мэдисон, Висконсин, США). В этом исследовании специфический олигонуклеотидный расположенный выше по цепи «захватчик» и частично перекрывающийся расположенный ниже по цепи зонд вместе формируют специфическую структуру при связывании с комплементарной матрицей ДНК. Эта структура распознается и разрезается по специфическому сайту специфическими ферментами расщепления, в результате чего высвобождается 5'-фрагмент олигонуклеотидного зонда. Этот фрагмент затем выступает в роли олигонуклеотидного «захватчика» по отношению к синтетическим вторичным мишеням и вторичным флуоресцентно меченым сигнальным зондам, присутствующим в реакционной смеси. См. также Ryan D. и др., Molecular Diagnosis 4, 1999, сс.135-144, Lyamichev V. и др., Nature Biotechnology 17, 1999, сс.292-296, патенты US 5846717 и 6001567.
Идентичность полиморфизмов также может быть определена методом выявления ошибочных спариваний оснований, включая, но не ограничиваясь им, метод защиты от РНКазы с помощью рибозондов (Winter и др., Proc. Natl. Acad. Sci. USA 82. 1985, с.7575, Meyers и др., Science 230, 1985, с.1242) и белков, которые распознают ошибочные спаривания нуклеотидов, например белок mutS Е. coli (Modrich P., Ann Rev Genet 25, 1991, сс.229-253). В другом способе вариантные аллели могут быть идентифицированы с помощью анализа конформации однонитевого полиморфизма (КОП) (Orita и др., Genomics 5, 1989, сс.874-879, Humphries и др. в кн.: «Molecular Diagnosis of Genetic Diseases» под ред. Elles R., 1996, сс.321-340) или денатурирующим градиентным гель-электрофорезом (ДГГЭ) (Wartell и др., Nucl. Acids. Res. 18, 1990, сс.2699-2706, Sheffield и др., Proc. Natl. Acad. Sci. USA 86, 1989, сс.232-236). Полимераза-опосредованный праймер протяженный метод также может применяться для идентификации полиморфизмов. Несколько таких методов было описано в патентной и научной литературе, к ним относятся метод «генетического бит анализа» (WO 92/15712) и лигаза/полимераза-опосредованный метод генетического бит анализа (US 5679524). Близкие методы описаны в WO 91/02087, WO 90/09455, WO 95/17676 и US 5302509 и 5945283. Протяженные праймеры, содержащие полиморфизм, могут быть выявлены методом масс-спектрометрии (МСС) согласно описанному в US 5605798. Другим праймер протяженным методом является аллель-специфичная полимеразная цепная реакция (ПЦР) (Ruaflo и др., Nucl. Acids. Res. 17, 1989, с.8392), Ruafio и др., Nucl. Acids. Res. 19, 1991, сс.6877-6882), WO 93/22456, Turki и др., J. Clin. Invest. 95, 1995, сс.1635-1641). Кроме того, разные полиморфные сайты могут быть изучены одновременным амплифицированием разных областей нуклеиновой кислоты, используя набор аллель-специфичных праймеров, согласно описанному в опубликованной РСТ патентной заявке WO 89/10414.
Гаплотипирование и генотипирование олигонуклеотидов. В настоящем изобретении предусмотрены способы и композиции для гаплотипирования и/или генотипирования генов индивидуума. В контексте настоящего изобретения понятия «генотип» и «гаплотип» означают генотип или гаплотип, содержащий нуклеотидную пару или нуклеотид, соответственно, которые содержатся в одном или нескольких новых полиморфных сайтах, описанных в настоящем изобретении, и могут необязательно также включать нуклеотидную пару или нуклеотид, содержащийся в одном или нескольких дополнительных полиморфных сайтах гена. Дополнительные полиморфные сайты могут быть известными полиморфными сайтами или сайтами, обнаруженными впоследствии.
Композиции настоящего изобретения содержат нуклеотидные зонды и праймеры, разработанные для специфической гибридизации с одной или несколькими целевыми областями, содержащими полиморфный сайт или присоединенными к нему. Олигонуклеотидные композиции настоящего изобретения применимы в способах гаплотипирования и/или генотипирования генов индивидуума. Способы и композиции для установки генотипа или гаплотипа индивидуума по новым полиморфным сайтам, описанные в настоящем изобретении, применимы для изучения эффекта полиморфизмов на этиологию заболевания, связанного с экспрессией и функцией белка, изучения эффективности нацеливания лекарственных средств, прогнозирования чувствительности индивидуума к заболеванию, связанному с экспрессией и функцией белка, и прогнозирования реактивности индивидуума к лекарственным средствам, нацеленным на генный продукт.
Генотипируемые олигонуклеотиды настоящего изобретения могут быть иммобилизованы или синтезированы на твердой поверхности, например микрочипе, сферах или стеклянных пластинах. См., например, WO 98/20020 и WO 98/20019.
Генотипируемые олигонуклеотиды могут гибридизироваться с целевой областью, расположенной на расстоянии одного или нескольких нуклеотидов ниже по цепи одного или нескольких новых полиморфных сайтов, идентифицированных в настоящем изобретении. Такие нуклеотиды применимы в полимераза-опосредованных праймер протяженных способах обнаружения одного из новых полиморфизмов, обнаруженных в настоящем изобретении и, следовательно, такие генотипированные олигонуклеотиды рассматриваются в настоящем изобретении в качестве «праймер протяженных олигонуклеотидов».
Способ прямого генотипирования. описанный в настоящем изобретении. Способ генотипирования настоящего изобретения может включать выделение смеси молекул нуклеиновой кислоты индивидуума, включающей две копии исследуемого гена или его фрагмента, и определение идентичности нуклеиновой пары по одному или нескольким полиморфным сайтам в двух копиях. Специалисту в данной области очевидно, что две «копии» гена индивидуума могут быть одинаковыми аллелями или разными. В наиболее предпочтительном варианте осуществления настоящего изобретения способ генотипирования включает определение идентичности нуклеотидной пары в каждом полиморфном сайте. Обычно смесь молекул нуклеиновой кислоты выделяют из биологического образца индивидуума, например из образца крови или ткани. Пригодными образцами ткани являются цельная кровь, сперма, слюна, слезы, моча, фекальные массы, пот, защечный соскоб, кожа и волосы.
Ниже в примере 1 наборы зондов для исследований одиночных нуклеотидных полиморфизмов (ОНП) для способа генотипирования получают для платформы Assays-by-Design® фирмы ABI. Livak K.J., Marmaro J., Todd J.A., Nature Genetics 9, 1995, сс.341-342. Для проведения генотипирования согласно рекомендации производителя используют 10 нг геномной ДНК.
Способ прямого гаплотипирования, описанный в настоящем изобретении. Способ генотипирования по настоящему изобретению может включать выделение из образца индивидуума молекулы нуклеиновой кислоты, содержащей одну или две копии исследуемого гена или его фрагмента, и определение идентичности нуклеотида по одной или нескольким полиморфным сайтам в данной копии. Способы прямого генотипирования включают, например, технологию CLASPER System™ (US 5866404) или аллель-специфичную дальнего действия ПЦР (Michalotos-Beloin и др., Nucl. Acids. Res. 24, 1996, сс.4841-4843). Нуклеиновая кислота может быть выделена методом, позволяющим разделять две копии гена или фрагмента. Специалисту в данной области очевидно, что какой-либо отдельный клон может предоставить информацию только по гаплотипу одной из двух копий гена, имеющихся у индивидуума. В одном варианте осуществления настоящего изобретения гаплотипную пару индивидуума определяют идентификацией фазовой последовательности нуклеотидов по одному или нескольким полиморфным сайтам в каждой копии гена индивидуума. В предпочтительном варианте осуществления способ гаплотипирования включает идентификацию фазовой последовательности нуклеотидов в каждом полиморфном сайте каждой копии гена.
Идентификация нуклеотида (или нуклеотидной пары) в полиморфном сайте при использовании и метода генотипирования, и метода гаплотипирования может быть осуществлена амплификацией целевых областей, содержащих полиморфные сайты непосредственно из одной или двух копий гена или его фрагментов, и секвенированием амплифицированных областей традиционными способами. Генотип или гаплотип гена индивидуума также может быть определен гибридизацией образца нуклеиновой кислоты, содержащей одну или обе копии гена, с последовательностями и субпоследовательностями нуклеиновой кислоты, например, согласно описанному в WO 95/11995.
Способ непрямого генотипирования с применением полиморфных сайтов в неравновесном сцеплении с целевым полиморфизмом. Идентичность аллелей, присутствующих в каких-либо новых полиморфных сайтах настоящего изобретения, также может быть определена непрямым способом с помощью генотипирования других полиморфных сайтов, находящихся в неравновесном сцеплении с такими исследуемыми сайтами. Согласно описанному выше два сайта находятся в неравновесном сцеплении, если присутствие определенного варианта в одном сайте указывает на наличие другого варианта во втором сайте. Stevens JC, Mol. Diag. 4, 1999, сс.309-317. Полиморфные сайты в неравновесном сцеплении с полиморфными сайтами настоящего изобретения могут быть локализованы в областях того же гена, или в других геномных областях.
Амплификация области целевого гена. Целевые области могут быть амплифицированы с помощью какого-либо способа олигонуклеотид-направленной амплификации, включая, но не ограничиваясь ею, полимеразную цепную реакцию (ПЦР). (US 4965188), лигазную цепную реакцию (ЛЦР) (Ваrаnу и др., Proc.Natl. Acad. Sci. USA 88, 1991, сс.189-193, опубликованная РСТ патентная заявка WO 90/01069) и олигонуклеотидное лигирование (ОЛ) (Landegren и др., Science 241, 1988, сс.1077-1080). Олигонуклеотиды, используемые в таких способах в качестве праймеров или зондов, специфически гибридизируются с областью нуклеиновой кислоты, которая содержит или которая присоединена к полиморфному сайту. Обычно олигонуклеотиды содержат 10-35 нуклеотидов, предпочтительно 15-30 нуклеотидов. Наиболее предпочтительно длина нуклеотидов составляет 20-25 нуклеотидов. Точная длина олигонуклеотида зависит от многих факторов, которые оцениваются специалистом.
Другие известные способы амплификации нуклеиновой кислоты могут применяться для амплификации целевой области, включая системы амплификации на основе транскрипции (US 5130238, ЕР 329822, US 5169766, опубликованная РСТ патентная заявка WO 89/06700) и изотермальные способы (Walker и др., Proc. Natl. Acad. Sci. USA 89. 1992, сс.392-396).
Гибридизация аллель-специфичного олигонуклеотида с целевым геном. Полиморфизм целевой области может быть оценен до или после амплификации, используя один или несколько способов на основе гибридизации, известных в данной области техники. Обычно при осуществлении таких способов используют аллель-специфичные олигонуклеотиды. Аллель-специфичные олигонуклеотиды могут использоваться в качестве по-разному меченых зондовых пар, в которых один компонент в паре показывает полное сродство с одним вариантом целевой последовательности, а другой компонент показывает полное сродство с другим вариантом. В некоторых вариантах осуществления настоящего изобретения может быть обнаружено более одного полиморфного сайта, используя набор аллель-специфичных олигонуклеотидов или олигонуклеотидных пар. Предпочтительно составляющие такого набора имеют температуру плавления не более 5°С, более предпочтительно не более 2°С, при гибридизации к выявляемым полиморфным сайтам.
Гибридизация аллель-специфичного олигонуклеотида с целевым полинуклеотидом может быть осуществлена с обоими объектами в растворе, или такая гибридизация может быть осуществлена, если олигонуклеотид или целевой полинуклеотид ковалентно или нековалентно прикреплены к твердой подложке. Прикрепление может быть опосредовано, например, взаимодействиями антитела-антигена, поли-L-лизина, стрептавидина или авидин-биотина, солевыми мостиками, гидрофобными взаимодействиями, химическими связями, УФ перекрестным связыванием, отжигом и т.д. Аллель-специфичный олигонуклеотид может быть синтезирован прямым способом, или на твердой подложке, или прикреплен к твердой подложке после синтеза. К твердым подложкам, пригодным для применения в методах детекции настоящего изобретения, относятся силикон, стекло, пластик и др., которые могут быть разработаны, например, в виде лунок (96-луночных планшетов), слайдов, пластин, мембран, волокон, крошек, чашек и бусин. Твердая подложка может быть обработана, покрыта или может быть получено ее производное для того, чтобы облегчить иммобилизацию аллель-специфичного олигонуклеотида или целевой нуклеиновой кислоты.
Определение генотипов и гаплотипов в группе и их корреляция с определенным признаком. Настоящее изобретение предусматривает способ определения частоты генотипа или гаплотипа в группе. Способ включает определение генотипа или гаплотипа гена, присутствующего у каждого представителя группы, в которой генотип или гаплотип включает нуклеотидную пару или нуклеотид, выявляемый в одном или нескольких полиморфных сайтах гена, и подсчет частоты встречаемости генотипа или гаплотипа в группе. Группа может быть контрольной группой, семейной группой, группой по половому признаку, популяционной группой или группой с определенным признаком (например, группа индивидуумов с определенным исследуемым признаком, например медицинским состоянием или ответом на терапевтическое лечение).
Другой объект настоящего изобретения связан с данными по частоте встречаемости генотипов и/или гаплотипов в контрольной популяции, которые используют в способе идентификации ассоциации между признаком и гаплотипом или генотипом. Признак может быть каким-либо выявляемым фенотипом, включая, но не ограничиваясь ими, чувствительность заболевания или ответ на лечение. Способ включает получение данных по исследуемым ганотипам и гаплотипам в контрольной группе и сравнение этих данных с частотой встречаемости генотипов и гаплотипов в группе, обладающей определенным признаком. Частота данных по одной или двум группам (контрольной и исследуемой) может быть получена генотипированием или гаплотипированием каждого индивидуума в группах, осуществляемых способами, описанными выше. Гаплотипы исследуемой группы могут быть определены непосредственно или, в другом варианте, описанным выше способом прогнозирования генотипа по гаплотипу.
Данные по частоте встречаемости в контрольной и/или исследуемой группах получают путем оценки ранее полученных данных по частоте встречаемости, которые могут быть в письменном или в электронном виде. Например, данные по частоте встречаемости могут быть в виде компьютерной базы данных. После получения данных по частоте встречаемости сравнивают частоты встречаемости изучаемых гаплотипов или генотипов в контрольной группе и в группе с определенным признаком.
При анализе полиморфизмов подсчеты могут производить для ввода поправки на существенную ассоциативную связь, которая может быть выявлена случайно. Применимые в настоящем изобретении статистические методы описаны в кн.: «Statistical Methods in Biology», 3-е изд., Bailey NTJ, 1997, изд-во Cambridge Univ. Press, в кн.: Waterman M.S. «Introduction to Computational Biology», 2000, изд-во CRC Press и в кн.: «Bioinformatics» под ред. Baxevanis A.D., Ouellette B.F.F., 2001, изд-во John Wiley & Sons, Inc.
В другом варианте осуществления настоящего изобретения частоту встречаемости гаплотипа в разных группах определяют для того, чтобы определить, согласуются ли они с уравнением Харди-Вайнберга. См. кн.: Harti D.L. и др. «Principles of Population Genomics», 3-е изд., 1997, изд-во Sinauer Associates, Sunderland, Массачусетс.
В еще одном варианте осуществления настоящего изобретения статистический анализ проводят стандартными тестами ANOVA с коррекцией Бонферони или с помощью программы самозагрузки, которая многократно имитирует корреляцию генотипа с фенотипом и вычисляет уровень значимости. Тест ANOVA применяют для проверки предположения о том, связана ли ответная реакция с одним или несколькими признаками или переменными, поддающимися измерению, или коррелирует с ними. См. кн.: Fisher L.D. & vanBelle G. «Biostatistics: A Methodology for the Health Sciences», глава 10, 1993, изд-во Wiley-lnterscience, Нью-Йорк.
В другом варианте осуществления настоящего изобретения для прогнозирования гаплотипной пары анализ включает следующие стадии. Во-первых, каждая из возможных гаплотипных пар сопоставляется с гаплотипными парами в контрольной группе. Обычно только одна из гаплотипных пар в контрольной группе спаривается с возможной гаплотипной парой, причем эта пара присутствует у индивидуума. Иногда только один гаплотип, присутствующий в контрольных гаплотипных парах, совместим с возможной гаплотипной парой индивидуума, и в таких случаях индивидуум оценивается в качестве содержащего гаплотипную пару данного известного гаплотипа и новый гаплотип становится производным при вычитании известного гаплотипа от возможной гаплотипной пары.
В другом варианте осуществления настоящего изобретения выявляемый генотип или гаплотип, находящийся в неравновесном сцеплении с интересуемым гаплотипом или гаплотипом, может использоваться в качестве суррогатного маркера. Генотип, находящийся в неравновесном сцеплении с другим генотипом, выявляется, если конкретный генотип или гаплотип данного гена встречается чаще в группе, которая также показывает потенциальный суррогатный маркерный генотип, а не в контрольной популяции. Если частота статистически значима, маркерный генотип является индикатором такого генотипа или гаплотипа и может применяться в качестве суррогатного маркера.
В другом способе обнаружения корреляции между присутствием гаплотипа и клиническими ответами используют модели прогнозирования, основанные на алгоритмах оптимизации минимизации ошибок, один из них является генетическим алгоритмом. См. кн.: «Reviews in Computational Chemistry», под ред. Lipkowitz K.B., Boyd DB, глава 10, 1997, сс.1-73, изд-во VCH Publishers, Нью-Йорк. Могут применяться методы ложного отзыва (кн.: «The Art of Scientific Computing», глава 10, 1992, изд-во Cambridge University Press, Cambridge), невральные сети (кн.: Rich E., Knight K. «Artificial Intelligence», 2-е изд., глава 10, 1991, McGraw-Hill, Нью-Йорк), стандартные методы понижения градиента (см. выше Press и др., глава 10) или также могут быть применены другие глобальные или локальные подходы к оптимизации (см. выше обсуждение в работе Judson).
В приведенных ниже примерах исследования ассоциации генотипа-фенотипа и родственные анализы были выполнены в фирме SAS (Кэри, Северная Каролина, США), используя программное обеспечение Analyst®. В тестах по выявлению ассоциации используют четко установленные генотипы в качестве независимой переменной, без предположения о доминантности, и различные переменные эффективности в качестве зависимых переменных. Тесты непрерывных зависимых переменных, используемых в анализе ANCOVA, и логистическую регрессию применяют для определенных зависимых переменных. Ковариантными производными анализа ассоциации генотипа-фенотипа являются: лечение, исследуемая область и измерение базового уровня.
Ковариационный анализ (ANCOVA) повторяют на той же модели для каждой группы, в которой индивидуумы подвергаются лечению. Кроме того, процент респондеров анализируют с помощью модели логистической регрессии с такими факторами, как тип лечения и область, а также базового уровня в качестве ковариантной производной. Ассоциации с р<0,05 по всем данным в целом оцениваются в качестве значительных.
Корреляция генотипа или гаплотипа субъекта с ответной реакцией на лечение. В предпочтительных вариантах осуществления настоящего изобретения признаками являются чувствительность к заболеванию, тяжесть заболевания, стадия заболевания или ответная реакция на применение лекарственного средства. Такие способы применимы при разработке диагностических тестов и терапевтических схем лечения для всех фармакогенетических применений, если есть возможность связи генотипа и результатов лечения, включающих измерение эффективности, фармакогенетические измерения и измерения побочных эффектов.
В другом предпочтительном варианте осуществления настоящего изобретения интересуемый признак является клиническим ответом, проявляемым у пациента, при некоторых вариантах терапевтического лечения, например, ответ на нацеливание лекарственного средства или на терапевтическое лечение медицинского состояния.
Для обнаружения корреляции между клиническим ответом на лечение и генотипом или гаплотипом, данные по генотипу или гаплотипу получают на основании клинических ответов индивидуумов в группе лечения, которая в настоящем изобретении называется «клинической группой». Эти клинические данные могут быть получены путем анализа результатов клинического исследования, который уже был проведен, и/или разработкой и выполнением одного или нескольких новых клинических исследований.
Индивидуумы, включенные в клиническую группу, обычно разделяются по наличию изучаемого медицинского состояния. Такое разделение предполагаемых пациентов может основываться на результатах стандартных медицинских осмотров или на одном или нескольких лабораторных тестах. В другом варианте разделение пациентов может быть произведено на основании гаплотипирования для тех ситуаций, в которых есть строгая корреляция между гаплотипической парой и восприимчивость к заболеванию или тяжестью заболевания.
Исследуемое терапевтическое лечение проводят в отношении каждого индивидуума в исследуемой группе и ответ каждого индивидуума на лечение измеряют на основании одного или нескольких заранее выбранных критериев. Предполагают, что во многих случаях исследуемая группа может проявлять диапазон ответов и что исследователь может выбрать число респондерных групп (например, низкое, среднее, высокое), дающих разные варианты ответов. Кроме того, генотипируют и/или гаплотипируют ген каждого индивидуума в исследуемой популяции, что может быть осуществлено до или после лечения.
Полученные результаты затем анализируют для определения того, являются ли вариации клинических ответов между группами с полиморфизмами статистически значимыми. Применимые методы статистического анализа описаны Fisher L.D., vanBelle G. в кн.: «Biostatistics: A Methodology for the Health Sciences», изд-во Wiley-lnterscience, 1993, Нью-Йорк). Этот анализ также может включать регрессивное вычисление того, какие полиморфические сайты гена наиболее оказывают наиболее существенное значение на различия в фенотипе.
После получения клинических данных и данных по полиморфизмам выявляют корреляции между ответами индивидуумов на лечение и генотипом или гаплотипом. Корреляции могут быть получены несколькими способами. По одному способу индивидуумов группируют по генотипу или гаплотипу (или гаплотипной паре) (это также относится к полиморфической группе) и затем средние и стандартные отклонения клинических ответов, проявляемых представителями каждой полиморфической группе, подсчитываются.
Из описанных выше анализов следует, что специалист в данной области, прогнозирующий клинический ответ в виде функции имеющегося генотипа или гаплотипа, может легко сконструировать математическую модель. Идентификация ассоциации между клиническим ответом и генотипом или гаплотипом (или гаплотипной парой) гена может быть основой для разработки диагностического способа для определения тех индивидуумов, которые могут ответить или не ответить на лечение, или, в другом варианте, могут ответить на более низком уровне и, следовательно, может потребоваться более интенсивное лечение, т.е. увеличенная доза лекарственного средства. Способ диагностики может быть в одной или нескольких формах: например, прямое тестирование ДНК (т.е. генотипирование или гаплотипирование одного или нескольких полиморфных сайтов в гене), серологический тест или медицинский осмотр. Единственное требование заключается в том, что должна быть хорошая корреляция между результатами диагностического тестирования и генотипом или гаплотипом, лежащим в основе. В предпочтительном варианте осуществления настоящего изобретения в таком способе диагностики используют описанный выше способ прогнозированного генотипирования.
Оценка принадлежности субъекта к определенной генотипической группе. Специалисту в данной области очевидно, что может быть некоторая степень неточности при проведении данного определения принадлежности субъекта. Следовательно, стандартные отклонения от уровней контрольной группы могут быть применены для получения вероятностной детерминации и способы настоящего изобретения могут быть применены по отношению к широкому диапазону возможностей, основываясь на определениях генотипических групп. Таким образом, в качестве примера, но не для ограничения, в одном из вариантов настоящего изобретения отмечается, что если измеряемый уровень продукта генной экспрессии падает до величины 2,5 величины стандартных отклонений от средней величины какой-либо из контрольных групп, тогда конкретный индивидуум может быть отнесен к группе данного генотипа. В другом варианте осуществления настоящего изобретения, если измеряемый уровень генной экспрессии продукта падает в пределах 2,0 величины стандартных отклонений среднего значения какой-либо из контрольных групп, тогда конкретный индивидуум может быть отнесен к группе данного генотипа. В еще одном варианте осуществления настоящего изобретения, если измеряемый уровень генной экспрессии продукта падает в пределах 1,5 величины стандартных отклонений среднего значения какой-либо из контрольных групп, тогда конкретный индивидуум может быть отнесен к группе данного генотипа. В другом варианте осуществления настоящего изобретения, если измеряемый уровень генной экспрессии продукта составляет 1,0 или менее средних отклонений средних величин уровней какой-либо из контрольных групп, тогда конкретный индивидуум может быть отнесен к группе данного генотипа. Таким образом, настоящий способ позволяет определить, с различной степенью вероятности, в какую группу конкретного субъекта следует поместить и какая оценка принадлежности к генотипической группе, затем это может помочь определить категорию риска, к которой индивидуум может быть отнесен.
Корреляция между клиническим ответом и генотипом или гаплотипом. Для того чтобы установить корреляцию между клиническим ответом на лечение и генотипом или гаплотипом, необходимо получить данные по клиническим ответам, проявляемым представителями подвергавшейся лечению группы, которая называется ниже в настоящем изобретении «клинической группой». Клинические данные могут быть получены путем анализа результатов клинического исследования, которые уже были проведены, и/или клинические данные могут быть получены в результате разработки и проведения одного или нескольких новых клинических исследований.
Стандартные контрольные уровни продукта генной экспрессии, полученные описанным способом в разных контрольных группах, затем могут быть сопоставлены с измеряемым уровнем продукта генной экспрессии у конкретного пациента. Таким продуктом генной экспрессии может быть специфичная иРНК, связанная с такой конкретной генотипической группой, или продукт генной экспрессии - полипептид, характерный для данной генотипической группы. Затем пациент может быть классифицирован и отнесен к группе определенного генотипа, основываясь на том, насколько близки измеряемые уровни контрольным уровням данной группы.
Компьютерная система для хранения или отображения данных по полиморфизму. Настоящее изобретение также предусматривает компьютерную систему для хранения и отображения данных по полиморфизму, определенных для данного гена. Компьютерная система включает блок процессора, монитор и базу данных, содержащую данные по полиморфизму. Данные по полиморфизму включают полиморфизмы, генотипы и гаплотипы, идентифицированные для данного гена в контрольной группе. В предпочтительном варианте осуществления настоящего изобретения компьютерная система способна на экране отобразить гаплотипы, организованные согласно присущим им эволюционным взаимоотношениям. Компьютер может обеспечивать выполнение каких-либо или всех математических операций по методам настоящего изобретения. Кроме того, компьютер может выполнять программу, которая визуально отражает на экране (или на нескольких экранах) и над которой исследователь может работать для обзора и анализа больших объемов информации относительно гена и его геномных вариаций, включая хромосомную локализацию, генную структуру, генное семейство, данные по экспрессии гена, данные по полиморфизму, данные по генетической последовательности, а также клинические данные по группе (например, данные по этногеографическому происхождению, клинические ответы, генотипы и гаплотипы для одной или нескольких групп). Данные по полиморфизму, описанные в настоящем изобретении, могут храниться в качестве реляционной базы данных (например, базы данных Oracle или набора ASCII плоских файлов). Такие данные по полиморфизму могут храниться на жестком диске компьютера или, например, на CD-ROM, или одном или нескольких устройствах хранения информации, которые могут быть установлены на компьютере. Например, данные могут храниться в одной или нескольких устройствах по хранению информации, которые могут быть установлены на компьютере. Например, данные могут храниться в одной или нескольких базах данных, соединенных с компьютером через сеть.
Диагностика по нуклеиновым кислотам. Другой объект настоящего изобретения предусматривает зонды ОНП, применимые для классификации субъектов по типам генетических вариаций. Зонды ОНП согласно настоящему изобретению являются олигонуклеотидами, которые различают ОНП в традиционных исследованиях по различению аллелей. В некоторых предпочтительных вариантах осуществления настоящего изобретения олигонуклеотиды по данному объекту настоящего изобретения комплементарны одному аллелю ОНП нуклеиновой кислоты, но не какому-либо другому аллелю ОНП нуклеиновой кислоты. Олигонуклеотиды по данному варианту осуществления настоящего изобретения могут различать ОНП разными путями. Например, в жестких условиях гибридизации олигонуклеотид определенной длины может гибридизироваться только с одним ОНП, но не с другими. На олигонуклеотид может быть нанесена радиоактивная метка или метка в виде флуоресцирующей молекулы. В другом варианте олигонуклеотид определенной длины может использоваться в качестве праймера для ПЦР, при этом 3'-концевой нуклеотид комплементарен одному аллелю, содержащему ОНП, но не какому-либо другому аллелю. В данном варианте осуществления настоящего изобретения наличие или отсутствие амплификации с помощью ПЦР определяет гаплотип ОНП.
Геномные и кДНК фрагменты настоящего изобретения включают, по меньшей мере, один новый полиморфный сайт, идентифицированный в настоящем изобретении, длиной, по меньшей мере, 10 нуклеотидов, и могут достигать полной длины гена. Предпочтительно фрагмент по настоящему изобретению составляет от 100 до 3000 нуклеотидов в длину, более предпочтительно 200-2000 нуклеотидов в длину, и наиболее предпочтительно 500-1000 нуклеотидов в длину.
Наборы настоящего изобретения. Настоящее изобретение предусматривает наборы для идентификации нуклеиновых кислот и полипептидов, применимые для гаплотипирования и/или генотипирования гена индивидуума. Такие наборы применимы для классификации индивидуумов. Конкретно, настоящее изобретение охватывает наборы для выявления наличия полипептида или нуклеиновой кислоты соответствующих маркеру настоящего изобретения в биологическом образце, например, в какой-либо жидкости тела, включая, но не ограничиваясь ими, сыворотку, плазму, лимфу, желчь, мочу, фекальные массы, цереброспинальную жидкость, асцитную жидкость или кровь, а также в образцах для биопсии тканей. Например, образец может включать меченое соединение или агент, способный выявлять полипептид или иРНК, кодирующую полипептид, соответствующий маркеру настоящего изобретения в биологическом образце, и средства для определения количества полипептида или иРНК в образце, например антитело, которое связывает полипептидный или олигонуклеотидный зонд, который связывается с ДНК или иРНК, кодирующей полипептид. Наборы могут также включать инструкции для интерпретации результатов, полученных с помощью этого набора.
В другом варианте осуществления настоящего изобретения предусмотрен набор, включающий, по меньшей мере, два генотипируемых олигонуклеотида, упакованные в отдельные контейнеры. Набор также может содержать другие компоненты, например буфер для гибридизации (в котором олигонуклеотиды применяются в виде зондов), упакованный в отдельном контейнере. В другом варианте олигонуклеотиды используют для амплификации целевой области, и для этого набор может содержать в отдельных контейнерах полимеразу и буфер для проведения реакции, оптимизированный для праймер-протяженной полимеразной реакции, например, в случае ПЦР. В предпочтительном варианте осуществления настоящего изобретения такой набор может дополнительно включать средства отбора образца ДНК.
Наборы на основе антител могут включать, например, (1) первое антитело, например, прикрепленное к плотной подложке, которое связывается с полипептидом, соответствующим маркеру настоящего изобретения, и, необязательно, (2) второе антитело, которое связывается либо с полипептидом, либо с первым антителом и конъюгирует с выявляемой меткой.
Наборы на основе олигонуклеотидов могут включать, например, (1) олигонуклеотид, например выявляемый по метке олигонуклеотид, который гибридизируется с последовательностью нуклеиновой кислоты, кодирующей полипептид, соответствующий маркеру настоящего изобретению, или (2) пару праймеров, применимых для амплификации молекулы нуклеиновой кислоты, соответствующей маркеру настоящего изобретения.
Набор также может включать, например, буферный агент, консервант или белок-стабилизирующий агент. Набор может дополнительно включать компоненты, необходимые для обнаружения выявляемой метки, например фермента или субстрата. Набор также может включать контрольный образец или серии контрольных образцов, которые могут быть исследованы и сопоставлены с тестируемым образцом. Каждый компонент набора может быть помещен в отдельный контейнер и все варианты контейнеров могут быть упакованы в общую упаковку вместе с инструкциями по анализу результатов исследований, полученных с помощью данного набора.
Последовательности нуклеиновых кислот настоящего изобретения. Одним из объектов настоящего изобретения является один или несколько выделенных полинуклеотидов. Настоящее изобретение также включает их аллельные варианты, то есть иные природные формы выделенных полинуклеотидов, которые кодируют мутантные полипептиды, идентичные, гомологичные или родственные тем, которые кодируют полинуклеотиды. В другом варианте неприродные варианты могут быть получены методом мутагенеза или методами прямого синтеза, хорошо известными в данной области техники.
Следовательно, последовательности нуклеиновых кислот, способные гибридизироваться с меньшей жесткостью с какими-либо последовательностями нуклеиновой кислоты, кодирующей мутантный полипептид настоящего изобретения, относятся к области охвата настоящего изобретения. Стандартные условия жесткости подробно описаны в учебниках по стандартному биологическому молекулярному клонированию. См., например, кн.: Sambrook, Fritsch, Maniatis «Molecular Cloning A Laboratory Manual» 2-е изд., 1989, изд-во Cold Spring Harbor Laboratory Press, кн.: «DNA Cloning», тома I и II, под ред. Glover D.N., 1985, кн.: «Oligonucleotide Synthesis», под ред. Gait M.J., 1984, кн.: «Nucleic Acid Hybridization», под ред. Hames B.D., Higgins S.J., 1984.
Характеристика уровня генной экспрессии. Способы обнаружения и измерения уровней иРНК (т.е. уровней генной транскрипции) и уровней полипептидов - продуктов генной экспрессии (т.е. уровней трансляции гена) хорошо известны в данной области и включают использование нуклеотидных микроматриц и методов обнаружения полипептидов, включая масс-спектрометры и/или способы обнаружения и количественной оценки антител. См. также кн.: Strachan Т., Read A. «Human Molecular Genetics», 2-е изд., 1999, изд-во John Wiley and Sons, Inc. Publication, Нью-Йорк.
Определение транскрипции целевого гена. Определение уровня экспрессии генного продукта в биологическом образце, например ткани или жидкости тела индивидуума, может быть произведено разными способами. Понятие «биологический образец» подразумевает ткани, клетки, биологические жидкости, а также их составляющие, полученные от субъекта, а также ткани, клетки и жидкости, находящиеся в субъекте. Во многих способах выявления экспрессии используют выделенную РНК. Для методов in vitro какие-либо методы выделения РНК, которые не являются селективными в отношении выделения иРНК, могут быть использованы для очистки РНК из клеток. См., например, кн. «Curr. Prot. Mol. Biol.», под ред. Ausubel и др., 1987-1999, изд-во John Wiley & Sons, Нью-Йорк.
В одном из вариантов осуществления настоящего изобретения определяют уровень экспрессии продукта иРНК целевого гена. Способы измерения уровня специфической иРНК хорошо известны в данной области и включают нозерн-блоттинг, ПЦР обратной транскрипции или гибридизацию с олигонуклеотидной последовательностью или микропоследовательностью. В других более предпочтительных вариантах осуществления настоящего изобретения определение уровня экспрессии может быть выполнено путем определения уровня экспрессии генного продукта, белка или полипептида в образцах тканевой жидкости или ткани, включая, но, не ограничиваясь ими, кровь или сыворотку. Большое число образцов тканей может быть легко обработано с помощью методов, хорошо известных специалистам в данной области, например одноступенчатый способ выделения РНК, описанный в патенте US 4843155.
Выделенную иРНК можно использовать для гибридизации или амплификации, которые включают следующие методы, но ими не ограничиваются: саузерн-блоттинг или норзен-блоттинг, ПЦР и зондовые последовательности. Один предпочтительный способ диагностики для обнаружения уровней иРНК включает контакт выделенной иРНК с молекулой нуклеиновой кислоты (зондом), которая может гибридизироваться с иРНК, кодирующей исследуемый ген. Зондом нуклеиновой кислоты может быть, например, кДНК полной длины или ее часть, например олигонуклеотид, длина которого, по меньшей мере, 7, 15, 30, 50, 100, 250 или 500 нуклеотидов, и который достаточен для специфической гибридизации в жестких условиях с иРНК или геномной ДНК, кодирующих маркер настоящего изобретения. В настоящем изобретении описаны другие методы, пригодные для диагностики согласно настоящему изобретению. Гибридизация иРНК с зондом показывает, что данный маркер экспрессируется.
В одном формате зонды иммобилизованы на твердой поверхности и молекулы иРНК контактируют с зондами, например, это набор генных чипов Affymetrix (фирма Affymetrix, Калифорния, США). Специалист в данной области может легко адаптировать способы обнаружения иРНК для использования при выявлении уровня иРНК, кодируемой маркерами настоящего изобретения.
Другими способами определения уровня иРНК, соответствующей маркеру настоящего изобретения в образце, являются амплификация нуклеиновой кислоты, например, с помощью ПЦР реального времени (РВ-ПЦР) (варианты экспериментального осуществления описаны в патенте US 4683202), лигазная цепная реакция (Ваrаnу и др., Proc. Natl. Acad. Sci. USA 88, 1991, сс.189-193), самоподдерживающаяся репликация последовательности (Guatelli и др., Proc. Natl. Acad. Sci. USA 87, 1990, сс.1874-1878), система транскрипциональной амплификации, (Kwoh и др., Proc. Natl. Acad. Sci. USA 86, 1989, сс.1173-1177), Q-бета репликаза (Lizardi и др., Biol. Technology 6, 1988, с.1197), репликация по типу «катящегося кольца» (US 5854033) или какие-либо другие способы амплификации нуклеиновой кислоты с последующей детекцией амплифицированных молекул методами, известными специалистам в данной области. Такие схемы детекции особенно применимы для обнаружения молекул нуклеиновой кислоты, если эти молекулы присутствуют в низком числе копий. В контексте настоящего изобретения «праймерами амплификации» называют пару молекул нуклеиновой кислоты, которые могут отжигать 5' или 3' области гена (плюс и минус цепи, соответственно, или наоборот) и содержат короткую область между ними. Обычно праймеры амплификации составляют примерно 10-30 нуклеотидов в длину и фланкируют область длиной примерно 50-200 нуклеотидов.
Количественная полимеразная цепная реакция реального времени (РВ-ПЦР) является одним из способов оценки уровней генной экспрессии, например генов настоящего изобретения, например, содержащих ОНП и исследуемые полиморфизмы. В РВ-ПЦР используют РНК-обратную транскриптазу для катализа синтеза цепи ДНК на цепи РНК, в том числе цепи иРНК. Образуемая ДНК может быть специфически обнаружена и количественно определена, причем этот процесс может применяться для определения уровней специфических типов иРНК. Одним из таких способов является способ TAQMAN® (фирма РЕ Applied Biosystems, Foster City, Калифорния, США), в котором применяется 5'-нуклеазная активность ДНК-полимеразы AMPLITAQ GOLD™ для расщепления определенной формы зонда в ходе ПЦР. Это относится к зонду TAQMAN™. См. Luthra и др., Am. J. Pathol. 153, 1998, сс.63-68, Kuimelis и др., Nucl. Acids Symp.Ser. 37, 1997, сс.255-256, и Mullah и др., Nucl. Acids Res. 26, 1998, сс.1026-1031. В ходе реакции расщепление зонда разделяет репортерный краситель и краситель-глушитель, что приводит к повышению флуоресценции репортера. Накопление продуктов ПЦР выявляется непосредственно по появлению флуоресценции репортерного красителя. Held и др., Genome Res. 6, 1996, сс.986-994. Повышение числа стартовых копий мишеней нуклеиновой кислоты приводит к более быстрому значительному увеличению наблюдаемой флуоресценции. См. Gibson, Heid, Williams и др., Genome Res. 6, 1996, сс.995-1001.
Другие технологии измерения статуса транскрипции в клетке приводят к созданию пулов фрагментов рестрикции ограниченной сложности для анализа методом электрофореза, например, методами, сочетающими двойное рестриктазное расщепление с фазированием праймеров (см., например, ЕР 0534858 А1), или методами выбора фрагментов рестрикции с сайтами, плотно прилегающими к определенному концу иРНК (см., например, Prashar, Weissman, Proc. Natl. Acad. Sci. USA 93, 1996, сс.659-663).
Другие методы статистически отбирают пулы кДНК, например, секвенированием достаточного числа оснований, например 20-50 оснований, в каждой из множества молекул кДНК для идентификации каждой молекулы кДНК, или секвенированием коротких меток, например, длиной 9-10 оснований, которые образуются по известным положениям относительно определенной иРНК конца метаболического пути. См., например, Velculescu, Science 270, 1995, сс.484-487. Уровни кДНК в образцах подсчитывают и определяют для каждого типа кДНК среднее, среднеарифметическое и среднеквадратичное отклонение, используя стандартные методы статистики, известные специалистам. Norman T.J. Bailey в кн.: «Biology», 3-е изд., 1995, изд-во Cambridge University Press.
Выявление полипептидов. Методы иммунологического выявления. Экспрессия белка, кодируемого генами настоящего изобретения, может быть обнаружена с помощью зонда с нанесенной выявляемой меткой, или метка наносится впоследствии. Понятие «меченый» в отношении зонда или антитела относится к прямому нанесению метки за счет объединения с зондом или антителом, т.е. за счет физической связи, а также к непрямому нанесению метки на зонд или антитело за счет реакции с другим реагентом, меченным непосредственно. Примеры непрямого нанесения метки включают детекцию первичного антитела с помощью флуоресцентно меченного вторичного антитела и зонда ДНК, меченного с конца биотином, таким образом, что он может быть выявлен флуоресцентно меченным стрептавидином. Обычно зондом является антитело, которое распознает экспрессируемый белок. Разнообразные форматы могут быть применены для определения, содержат ли образцы целевой белок, который связывается с данным антителом. Методы иммуноисследования, применимые для выявления целевых полипептидов настоящего изобретения, включают, но ими не ограничиваются, дот-блоттинг, вестерн-блоттинг, белковые чипы, метод конкурентного и неконкурентного белкового связывания, фермент-связывающий иммуносорбентный анализ (ELISA - enzyme-linked immunoabsorbent assay),
методы иммуногистохимии, разделение флуоресцентно-активированных клеток (fluorescence activated cell sorting - FACS) и другие обычно применяемые и широко описанные в патентной и научной литературе методы, в том числе много коммерческих методов. Опытный специалист может легко адаптировать известные методы детекции белка/антитела для применения с целью определения, экспрессируют ли клетки маркер настоящего изобретения, и примерные концентрации конкретного экспрессируемого полипептидного продукта в крови или других тканях организма. Белки индивидуумов могут быть выделены методами, хорошо известными специалистам в данной области техники. Применяемыми способами выделения белка, например, могут быть методы, описанные в кн.: Harlow, Lane, «Antibodies: A Laboratory Manual», 1988, изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, Нью-Йорк.
Для получения антител к белку, кодируемому одним из описанных генов, возможна иммунизация животных-хозяев инъекцией полипептидом или его частью. К таким животным-хозяевам относятся, но ими не ограничиваются, кролики, мыши и крысы. Различные адъюванты могут быть применены для повышения иммунологического ответа, в зависимости от вида хозяина, к ним относятся, но ими не ограничиваются, адъювант Фрейнда (полный и неполный), минеральные гели, например гидроксид алюминия, поверхностно-активные вещества, например лизолецитин, плюроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин моллюска блюдечка и динитрофенол, а также потенциально применимых адъювантов человека, например вакцинный штамм палочки Кальметта-Герена (BCG) и Corynebacterium parvum.
Моноклональные антитела (мАнт) являются однородными популяциями антител к определенному антигену и могут быть получены методом, предусматривающим получение молекул антител с помощью культивируемых линий клеток. К таким методам относятся, но ими не ограничиваются, гибридомный метод Kohler и Milstein, Nature, 256, 1975, сс.495-497, патент US 4376110, метод гибридом В-клеток человека Kosbor и др., Immunol. Today 4, 1983, с.72, Cole и др., Proc. Natl. Acad. Sci. USA 80, 1983, сс.2026-2030 и EBV-гибридомный метод Cole и др. в кн.: «Monoclonal Antibodies and Cancer Therapy», 1985, фирма Alan R. Liss, Inc., cc.77-96.
Кроме того, могут применяться методы, разработанные для получения «химерных антител» (см. Morrison и др., Proc. Natl. Acad. Sci. USA 81, 1984, cc.6851-6855, Neuberger и др., Nature 312, 1984, cc.604-608 и Takeda и др., Nature 314, 1985, cc.452-454), основанные на сплайсинге генов молекулы мышиного антитела с определенной антигенной специфичностью с генами молекулы антитела человека с определенной биологической активностью. Химерным антителом является молекула, в которой разные ее части - производные молекул разных видов животных, например, имеющих вариабельный или супервариабельный фрагмент, полученный от мышиного мАнт, и стабильный фрагмент иммуноглобулина человека.
В другом варианте методы, описанные для получения одноцепочечных антител (US 4946778, Bird, Science 242, 1988, cc.423-426, Huston и др., Proc. Natl. Acad. Sci. USA 85, 1988, cc.5879-5883, Ward и др., Nature 334, 1989, cc.544-546), могут быть адаптированы для получения по-разному экспрессируемых генных одноцепочечных антител.
Методы, применимые для получения «гуманизированных антител», могут быть адаптированы для получения антител к белкам, их фрагментам или производным. Такие методы описаны в патентах US 5932448, 5693762, 5693761, 5585089, 5530101, 5569825, 5625126, 5633425, 5789650, 5661016 и 5770429.
Антитела или фрагменты антител могут использоваться в методах, например в вестерн-блоттинге или методах с применением иммунофлуоресценции, которые позволяют выявить экспрессию белков. В таких методах обычно желательно иммобилизовать либо антитело, либо белки на твердой основе. Приемлемыми твердыми основами или носителями являются какие-либо подложки, способные связывать антиген или антитело. К хорошо известным основам или носителям относятся: стекло, полистирол, полипропилен, полиэтилен, декстран, нейлон, амилазы, природные и модифицированные целлюлозы, полиакриламиды, габбро и магнетит.
Для упрощения обнаружения применим метод «ELISA-сэндвич», причем известно много его вариантов, каждый из которых может быть использован в настоящем изобретении. В контексте настоящего изобретения метод «сэндвича» относится ко всем вариантам метода, основанного на примении двух сторон. И иммунофлуоресцентные, и иммунометрические методы EIA широко применяются в данной области техники. Однако другие репортерные молекулы, например радиоизотопы, хемолюминесцентные или биолюминесцентные молекулы, также могут применяться. Специалисту очевидно, каким образом варьировать способ, приспосабливая его к конкретным условиям.
Мониторинг белков целого генома, т.е. «протеомика», может выполняться с помощью конструирования микроматрицы, в которой сайты связывания включают иммобилизованные, предпочтительно моноклональные антитела, специфичные в отношении множества белков, кодируемых клеточным геномом. Предпочтительно антитела имеются в отношении значительной фракции кодируемых белков, или, по меньшей мере, тех белков, которые значимы для тестирования или подкрепления исследуемой биологической сетевой модели. Выше отмечено, что способы получения моноклональных антител хорошо известны. См., например, Harlow, Lane в кн.: «Antibodies: A Laboratory Manual», изд-во Cold Spring Harbor Laboratory Press, 1988, Cold Spring Harbor, Нью-Йорк, США). В предпочтительном варианте осуществления настоящего изобретения моноклональные антитела образуются против фрагментов синтетического пептида, разработанных на основе геномной последовательности клетки. Белки клетки контактируют с таким множеством антител и их связывание измеряют с помощью методов, известных в данной области техники.
Выявление полипептидов. Двухмерный гель-электрофорез. Двухмерный гель-электрофорез хорошо известен в данной области и обычно включает изоэлектрическое фокусирование наряду с первым измерением, получаемым SDS-PAGE электрофорезом, наряду со вторым измерением. См., например, Hames и др. в кн.: «Gel Electrophoresis of Proteins: A Practical Approach», изд-во IRL Press, 1990, Нью-Йорк, США), Shevchenko и др., Proc. Natl. Acad. Sci. USA 93, 1996, сс.14440-14445, Sagliocco и др., Yeast 12, 1996, сс.1519-1533, Lander, Science 274, 1996, сс.536-539.
Выявление полипептидов. Масс-спектроскопия. Идентичность и уровень экспрессии целевого полипептида могут быть определены методом масс-спектроскопии. Методология на основе масс-спектроскопии применима для анализа выделенного целевого полипептида, а также для анализа целевого полипептида в биологическом образце. К методам масс-спектрометрии для анализа целевого полипептида относятся: методы ионизации, например, но этим методами список методов не ограничивается, метод ионизации лазерной десорбцией при содействии матрицы (matrix-assisted laser desorption/ionization - MALDI), непрерывная или пульсовая ионизация элекроспреем (electrospray ionization - ESI) и близкие методы, например ионоспрей или термоспрей, и массированный кластерный удар (massive cluster impact - MCI). Такие ионные источники могут подбираться методами детекции, к которым относятся метод линейного или нелинейного отражения измерения времени пролета ионов (time of flight - TOF), метод одиночного или множественного четырехполюсника, метод одиночного или множественного магнитного сектора, метод ионно-циклотронного резонанса с Фурье преобразованием сигнала (Fourier transform ion cyclotron resonance - FTICR), ионные ловушки и их комбинации, например ионная ловушка/TOF. Для ионизации могут быть применены различные комбинации матрицы/длины волн (например, MALDI) или комбинации растворителей (например, ESI).
Для применения масс-спектроскопии целевой полипептид может быть растворен в определенном растворе или системе реагентов. Выбор раствора или системы реагентов, например органического или неорганического растворителя, может зависеть от свойств целевого полипептида и метода масс-спектроскопии и основывается на методах, хорошо известных в данной области техники. См., например, описание метода MALDI в работе Vorm и др., Anal. Chem. 61, 1994, с.3281 (1994), а метода ESI в работе Valaskovic и др., Anal. Chem. 67, 1995, с.3802. Масс-спектроскопия пептидов также описана в международной заявке на изобретение РСТ 93/24834 и в патенте US 5792664. Растворитель выбирают таким образом, чтобы минимизировать риск разрушения целевого полипептида за счет энергии, возникающей при испарении. Снизить риск разрушения можно, например, погружением образца в матрицу. Для этого может быть применена матрица, являющаяся органическим соединением, например сахар, например пентоза или гексоза, или полисахарид, например целлюлоза. Такие соединения термолитически разрушаются до СО2 и Н2О таким образом, что не возникает остатков молекул, способных вступать в химические реакции. Матрикс также может быть неорганическим соединением, например нитратом аммония, который разрушается практически без остатка. Применение этих и других растворителей известно специалистам в данной области. См., например, патент US 5062935. Метод масс-спектроскопии был описан в J. Phys. Chem. 88, 1984, сс.4451-4459 и заявке РСТ WO 90/14148, а современные способы применения суммированы в обзорных статьях. См. Anal. Chem. 62, 1990, сс.882-889 и Spectroscopy 4, 1992, сс.10-18.
Масса целевого полипептида, определенная с помощью масс-спектроскопии, может быть сопоставлена с массой соответствующего известного полипептида. Например, если целевой пептид является мутантным белком, соответствующий известный полипептид может быть соответствующим немутантным белком, например белком дикого типа. С помощью ESI можно очень точно определить молекулярные массы образца, в котором они содержатся в фентомолярных количествах, благодаря присутствию множества ионных пиков, которые могут использоваться для определения массы. Субмолекулярные уровни белка выявляют, например, используя методы масс-спектроскопии ESI (Valaskovic и др., Science 273, 1996, сс.1199-1202) и MALDI (Li и др., J. Am. Chem. Soc. 118, 1996, сс.1662-1663).
Метод ионизации лазерной десорбцией при содействии матрицы (MALDI). Уровень целевого белка в биологическом образце, например жидкости тела или образце ткани, может быть измерен методами масс-спектроскопии, включая, но, не ограничиваясь ими, методы, известные в данной области: метод ионизации лазерной десорбцией при содействии матрицы (MALDI), метод измерения времени пролета (MALDI-TOF-MS), усиленная поверхностью времяпролетная лазерная масс-спектроскопия (Surface-enhanced laser desorption/ionization time-of-flight - SELDI-TOF), которые подробно описаны ниже. Методы осуществления MALDI хорошо известны специалистам в данной области. См. Juhasz и др., Analysis, Anal. Chem. 68, 1996, сс.941-946, а также патенты US 5777325, 5742049, 5654545, 5641959, 5654545 и 5760393 для описаний MALDI и протоколов замедленной экстракции. Также известны многочисленные способы повышения растворения. MALDI-TOF-MS были описаны Hillenkamp и др. в кн.: «Biological Mass Spectrometry», под ред. Burlingame, McCloskey, 1990, изд-во Elsevier Science PubL, Амстердам, сс.49-60.
Могут быть применены различные методы выявления маркера с применением масс-спектроскопии. См. кн.: «Bordeaux Mass Spectrometry Conference Report» под ред. Hillenkamp, 1988, сс.354-362, кн.: «Bordeaux Mass Spectrometry Conference Report» под ред. Karas, Hillenkamp, 1988, cc.416-417, Anal. Chem. 60, 1988, cc.2299-2301, Biomed. Environ. Mass Spectrum 18, 1989, cc.841-843. Показано применение лазерных лучей в TOF-MS, например, в патентах US 4694167, 4686366, 4295046 и 5045694, ссылки на которые включены в настоящее изобретение в их целостности. Другие методы масс-спектроскопии допускают успешное испарение биополимеров с большой молекулярной массой без их фрагментации и позволяют анализировать большое количество биологических макромолекул с помощью масс-спектрометрии.
Усиленная поверхностью времяпролетная лазерная масс-спектроскопия (SELDI). Другие методики, использующие новые композиции зондовых элементов масс-спектроскопии с поверхностями, которые позволяют зондовому элементу активно связываться в ловушке и накапливать специфические аналиты, описаны под названием аффинной масс-спектрометрии (Affinity Mass Spectrometry - AMS). См. патенты по методу SELDI: US 5719060, 5894063, 6020208, 6027942, 6124137 и публикации патентных заявок US 2003/0003465. Несколько типов новых масс-спектроскопических зондовых элементов было описано с усиленной поверхностью аффинной ловушкой (Surfaces Enhanced for Affinity Capture - SEAC). См. Rapid Commun. Mass Spectrom. 7, 1993, cc.576-580. Зондовые элементы SEAC успешно применяют для восстановления и привязки биополимеров разных классов, особенно белков, путем использования знаний о поверхностных белковых структурах и биоспецифического молекулярного распознавания. Устройства иммобилизованной аффинной ловушки на поверхности масс-спектрометрического элементного зонда, т.е. SEAC, определяют расположение и аффинность (специфичность) аналита к поверхности зонда, что повышает эффективность аналитической масс-спектрометрии.
В рамках метода SELDI имеется три разных методических варианта: (1) Усиленная поверхностью чистая десорбция (Surfaces Enhanced for Neat Desorption - SEND), в которой поверхности зондового элемента, т.е. презентирующие образец средства, разработаны таким образом, что содержат адсорбирующие энергию молекулы (Energy Absorbing Molecules - ЕАМ) вместо «матрицы» для облегчения десорбции/ионизации аналитов, добавленных непосредственно (чисто) к поверхности. (2) Вариант метода SEAC, в котором поверхности зондовых элементов, т.е. презентирующие образец средства, разработаны таким образом, что они содержат определенную химическую и/или определенную биологическую ловушку для облегчения либо специфического, либо неспецифического присоединения или адсорбции (стыковки или привязки) аналитов к поверхности зонда с помощью разных механизмов (преимущественно нековалентно). (3) Усиленная поверхностью для фотолабильного присоединения и высвобождения методика (Surfaces Enhanced for Photolabile Attachment and Release - SEPAR), в которой поверхности зондового элемента, т.е. презентирующие образец средства, разработаны таким образом, что содержат один или несколько типов химически определенных с поперечными сшивками молекул, которые служат ковалентно-связывающими средствами. Химические характеристики, определяющие тип и число точек присоединения фотолабильных молекул между SEPAR презентирующими средствами (т.е. поверхностью зондового элемента) и анализируемым соединением (например, белком) могут включать какое-либо или несколько из числа различных остатков или химических структур в анализируемом соединении (например, остатков His, Lys, Arg, Туr, Phe и Cys в случае белков и пептидов).
Другие объекты настоящего изобретения с биологической активностью. В различных вариантах осуществления настоящего изобретения объекты с биологическим действием или смеси объектов могут быть измерены для того, чтобы получить лекарственное средство и метаболические ответы. Активности белков, значимых для описания клеточной функции, могут быть измерены, причем варианты осуществления настоящего изобретения могут основываться на таких измерениях. Измерения активности могут быть выполнены с помощью каких-либо функциональных, биохимических или физических способов, применимых для конкретной описываемой активности. Если активностью является химическая трансформация, клеточный белок может контактировать с природными субстратами, а скорость трансформации измеряется. Если проявление активности включает ассоциацию многомерных единиц, например ассоциацию активированного ДНК-связывающего комплекса с ДНК, количество ассоциированного белка или вторичные последовательности ассоциации, например количество транскрибированной иРНК, может быть измерено. Кроме того, если известна только функциональная активность, например контроль клеточного цикла, проявление функции может регистрироваться. Если функция известна и поддается измерению, изменения активности белков формируют данные ответа, измеряемые способами настоящего изобретения. В других и неограничивающихся вариантах осуществления настоящего изобретения данные по ответу могут быть сформированы на основании оценки разных объектов биологического состояния клетки. Данные по ответу могут быть извлечены, например, из изменений больших количеств определенных белков и изменений активностей определенных белков.
Представленный ниже пример приводится для более полного описания предпочтительных вариантов осуществления настоящего изобретения. Этот пример не предназначен для ограничения области охвата настоящего изобретения, изложенной в формуле изобретения.
Пример 1. Сравнение алискирена с плацебо и ирбесартаном у пациентов с гипертонией, выраженной в степени от слабой до умеренной
Введение и краткое содержание. Ретроспективный фармакогенетический анализ проводят для оценки возможной связи между генетической вариацией и результатом клинического лечения. Конкретно 49 полиморфизмов исследуют в 12 генах ренин-ангиотензивной-альдестеронной системы (РАС) или в генах, для которых ранее было установлено, что они участвуют в регуляции кровяного давления. Существенные ассоциации наблюдают между одним полиморфизмом в гене ангиотензин-конвертирующего фермента (АКФ), двумя полиморфизмами в гене рецептора ангиотензина II, тип 2 (AGTR2), и клиническими параметрами снижения средних установленных диастолического и систолического кровяного давления. Эти эффекты не обнаруживают при введении ирбесартана и плацебо, в данном анализе они скорее специфичны для лечения алискиреном.
Клиническое исследование. Многоцентровое рандомизированное двойное слепое с параллельными группами клиническое исследование проводят для изучения эффективности и безопасности алискирена по сравнению с плацебо в группе пациентов с гипертонией, выраженной в состоянии от слабого до умеренного. Исследование проводят на протяжении восьми недель, т.е. конечная точка клинического исследования наступает через восемь недель данного конкретного исследования. Основная задача исследования заключается в определении действия алискирена в дозах 150 мг, 300 мг и 600 мг на снижение кровяного давления и сравнении этого действия с действием ирбесартана в дозе 150 мг и действием плацебо в группе пациентов с гипертонией, выраженной в состоянии от слабого до умеренного. Демографические показатели в целом сопоставляют по всем группам. Большинство пациентов относится к европеоидной расе, и возраст большинства пациентов не превышает 65 лет при среднем возрасте 50 лет. Распределение мужчин и женщин в исследовании примерно одинаковое.
Первым измеряемым показателем эффективности является изменение СОДКД (уменьшение величины СОДКД относительно базового уровня). Вторыми измеряемыми показателями эффективности являются изменение СОСКД (уменьшение величины СОСКД относительно базового уровня), доля респондеров, снижение активности ренина плазмы (АРП) и увеличение активного ренина плазмы (АКТР) относительно базового уровня.
По поводу первичной эффективности парные сопоставления показывают, что все дозы активного лечения были статистически выше по сравнению с плацебо касательно снижения среднего определенного диастолического кровяного давления (СОДКД) в конечной точке 8 недель в группе лечения и в контрольной точке контрольной группы. Сходные результаты по снижению СОДКД достигают при дозе алискирена 150 мг и ирберсартана 150 мг. Дозы алискирена 300 и 600 мг вызывают наибольшее снижение, но его величина не превышает величин снижения, наблюдавшихся при применении дозы 600 мг.
По поводу вторичной эффективности, касающейся среднего определенного систолического кровяного давления (СОСКД), все дозы активного лечения статистически выше по сравнению с плацебо в конечной точке исследования. Через 8 недель алискирен в дозе 300 и 600 мг статистически выше по сравнению с плацебо ирбесартаном в конечной точке. Сходные результаты по снижению СОСКД достигают при дозе алискирена 150 мг и ирберсартана 150 мг. Дозы алискирена 300 и 600 мг вызывают наибольшие снижения, но эти снижения не усиливались при дозе 600 мг.
Доля успешных респондеров (выраженная в виде уменьшения СОДКД < 90 мм Hg или ≥ 10 мм Hg относительно базового уровня или уменьшения СОСКД < 140 мм Hg или ≥ 20 мм Hg относительно базового уровня) показывает, что все эффективные схемы лечения в конечной точке исследования для групп лечения показывают результаты, которые статистически выше плацебо в конечной точке лечения. Результаты СОДКД в конечной точке лечения составляют 59-67% респондеров в группах лечения алискиреном против 56% при лечении ирбесартаном и 38% для плацебо. Результаты СОСКД в конечной точке лечения составляют 57-68% респондеров в группах лечения алискиреном против 59% для ирбесартана и 36% для плацебо. При лечении наблюдают дозозависимые увеличения активности ренина в группах алискирена (20,8, 29,9 и 93,6 ЕД/мл для доз алискирена 150, 300 и 600 мг, соответственно). Алискирен в дозе 150 мг приводит к большему среднему увеличению ренина по сравнению с ирбесартаном в дозе 150 мг (11,2 ЕД/мл). Это согласуется с механизмом действия ингибиторов ренина.
У пациентов, участвующих в клиническом исследовании, предварительно спрашивают согласие на участие в фармакогенетическом анализе. Образцы крови всех пациентов, давших согласие, собирают в разных местах исследования и затем направляют в фирму Covance (Индианаполис, Индиана, США). Геномную ДНК каждого пациента экстрагируют из крови методом фирмы Covance, используя набор для выделения ДНК PUREGENE™ DNA Isolation Kit (D-50K) (фирма Gentra, Миннеаполис, Миннесота, США). В конечном счете генотипировали 511 пациентов, которые примерно в равных долях для каждой группы.
Фармакогенетический анализ объектов и план исследований. Ретроспективный фармакогенетический анализ проводят на всех пациентах, которые согласились предоставить образцы для фармакогенетического исследования. Основная цель заключается в выявлении ассоциации между генетической вариацией и вариациями эффективности лечения алискиреном, которое оценивается первично по СОДКД и вторично по СОСКД и доле респондеров.
Методический подход с использованием генов-«кандидатов» применяют для отбора 48 полиморфизмов в 12 генах ренин-ангиотензивной системы (РАС) или в генах, ранее ассоциированных с регуляцией кровяного давления (табл.1). Все доступные образцы генотипируют для выявления каждого ОНП. Ассоциативную связь затем выявляют методом, описанным ниже.
Генотипирование. Исследования одиночных нуклеотидных полиморфизмов (ОНП) осуществляют с использованием информации из общественной базы данных dbSNP и патентованной базы данных Celera/ABI. Наборы зондов для проведения генотипирования получают для платформы Assays-by-Design® фирмы ABI. Livak KJ, Marmaro J, & Todd JA, Nature Genetics 9: 341-2 (1995). Генотипирование проводят с использованием 10 нг геномной ДНК согласно рекомендациям производителя.
Список полиморфизмов, генотипированных в настоящем анализе, включающий внутренний код локуса CPG, ген, метаболический путь, ссылки на базу данных и эффект, приводят в табл.2.
Статистический анализ. Исследования связи генотип-фенотип и другие близкие анализы проводят в SAS (Сагу, Северная Каролина, США), используя Analyst®.
В тестах по выявлению ассоциации используют четко установленные генотипы в качестве независимой переменной, без предположения о доминантности, и различные переменные эффективности в качестве зависимых переменных. Тесты непрерывных зависимых переменных, используемых в анализе ANCOVA, и логистическую регрессию применяют для определенных зависимых переменных. Ковариантными производными анализа ассоциации генотипа-фенотипа являются: лечение, исследуемая область и измерение базового уровня.
Ковариационный анализ (ANCOVA) повторяют на той же модели для каждой группы, в которой индивидуумы подвергаются лечению. Кроме того, процент респондеров анализируют с помощью модели логистической регрессии с такими факторами, как тип лечения и область, а также базового уровня в качестве ковариантной производной. Ассоциации с р<0,05 по всем данным в целом оцениваются в качестве значительных.
Ангиотензин-конвертирующий фермент (АКФ). Ангиотензин-конвертирующий фермент (АКФ) осуществляет конверсию Ang I в действующий октапептид Ang II. ОНП_4769 генотипируют у пациентов вместе с шестью другими полиморфизмами в ключевом ферменте РАС. Существенную ассоциацию наблюдают между ОНП_4769 и переменной первичной эффективности снижения СОДКД относительно базового уровня (р=0,0058) и вторичной переменной - долей респондеров (р=0,001). Для другой вторичной переменной - снижения СОСКД относительно базового уровня, не наблюдают существенной ассоциации, проявляется лишь тенденция (р=0,0745).
При повторении анализа ANCOVA для каждой группы лечения, ассоциативную связь наблюдают только для пациентов в группах лечения алискиреном, но не в группах лечения ирбесартаном или плацебо. Не выявляют существенной ассоциации между какими-либо ОНП и вторичными параметрами: активностью ренина плазмы (АРП) и активным ренином (АКТР).
Специфические эффекты алискирена показаны в табл.3.
ОНП_4769 является кодирующим ОНП, которая изменяет состав аминокислотной последовательности в кодоне 32, заменяя пролин на серин в ферменте АКФ. Полиморфизм АКФ I/D (наличие или отсутствие повторяющейся последовательности 287 п.н. полиморфизма Alu в интроне 16) ассоциируют с регуляцией уровня и активности АКФ и его разветвлений в элементе РАС. Rigat В. и др., J. Clin. Invest. 86, 1990, сс.1343-1346.
Рецептор ангиотензина II, тип 2 (AGTR2). AGTR2 кодирует рецептор ангиотензина II, тип 2. Рецептор ангиотензина II, тип 2, является мишенью нескольких антигипертензивных лекарственных средств. Сигналы Ang II через связывание с рецептором типа I индуцируют сжатие сосудов и повышение кровяного давления. Установлено, что рецептор II, тип 2, ингибирует активность АКФ и ослабляет действие через рецептор типа 1, вызывая расширение сосудов. Hunley Т.Е. и др., Kidney Int. 57, 2000, сс.570-577 (2000), Ichiki Т. и др., Nature 377, 1995, сс.748-750.
Существенную ассоциацию наблюдают между ОНП гена AGTR2 (ОНП_1445 и ОНП_4795) и переменной первичной эффективности снижения СОДКД относительно базового уровня (р=0,0078 и 0,0004, соответственно). ОНП_4795 также показывает существенную ассоциацию с вторичной переменной снижения СОСКД относительно базового уровня (р=0,0245), но не с другим вторичным параметром - долей респондеров. ОНП_1445 между тем не показывал существенной ассоциации со вторичными параметрами. Не было установлено существенной связи между какими-либо ОНП и вторичными параметрами, а именно активностью ренина плазмы (АРП) и активным ренином (АКТР).
При проведении анализа ANCOVA для каждой группы была установлена ассоциативная связь только в группах лечения алискиреном, но не в группах лечения ирбесартаном или плацебо. При повторении анализа ANCOVA для каждой группы лечения ассоциативную связь наблюдают только для пациентов в группах лечения алискиреном, но не в группах лечения ирбесартаном или плацебо. Эффект генотипа у пациентов, которых лечили алискиреном, показан выше в табл.3.
Два этих ОНП не являются кодирующими. ОНП_1445 находится в нетранслируемой области гена AGTR2, а ОНП_4795 находится в геномной области с неравновесным сцеплением с геном AGTR2.
Обсуждение. Вкратце, один вариант в гене АКФ и два варианта в гене AGTR2 показывают существенную ассоциацию с первичным параметром СОДКД. Вариант АКФ и один вариант AGTR2 также показывает существенную ассоциацию со вторичными параметрами - СОСКД и долей респондеров. Второй вариант AGTR2 не проявляет существенной ассоциации, а только показывает такую тенденцию по отношению к вторичным параметрам. Такой эффект генотипа наблюдают только в группах, в которых пациентов лечили алискиреном, но не в группах лечения иберсантаном или плацебо. Следовательно, описанный выше эффект является фармакогенетическим эффектом, специфичным для алискирена.
Эффект варианта АКФ является особенно интересным, поскольку различие между генотипами ТТ и СТ представляется весьма значительным (снижение СОДКД с 11,1 до 4,7 мм Hg, снижение СОСКД с 13,7 до 6,2 мм Hg, доля респондеров увеличивается с 14% до 69%).
Гомозиготный генотип СС отсутствует у пациентов, следовательно, частота встречаемости этого аллеля намного меньше частоты для ОНП согласно базам данных, равной 0,1.
При анализе ответа на лечение алискиреном в зависимости от генотипа, доля ответа на генотип ТТ возрастает примерно до 70%. Следовательно, такой вариант может помочь размещению алискирена на массовом рынке антигипертензивных препаратов, чему способствует распространение генотипа у основной части популяции (примерно 80% по аллельной частоте в базе данных ОНП, но даже может быть выше, что следует из данного анализа), обладая лучшим процентом респондеров (фиг.1). Это также может способствовать отбору возможных «более хороших» респондеров в дальнейших исследованиях.
Весьма вероятно, что два ОНП в гене AGTR2 находятся в неравновесном сцеплении.
Эти репортерные ОНП не показывают ассоциации с исходными значениями СОДКД и СОСКД, еще раз подтверждая, что генетический эффект - это алискирен-связанный фармакогенетический эффект.
Пример 2. Клинический фармакогенетический анализ клинического исследования А2203
Введение и краткое содержание. Ретроспективный фармакогенетический анализ проводят для оценки потенциальной связи между генетической вариацией и результатом клинического лечения. См. пример 1. Впоследствии результаты другого клинического исследования (А2203) оценивают для репликационного анализа. Конкретно исследовали 48 полиморфизмов в 12 генах ренин-ангиотензивной системы (РАС) или в генах, для которых было ранее установлено их участие в регуляции кровяного давления.
В примере 1 наблюдают существенную ассоциацию между одним полиморфизмом в гене ангиотензин-конвертирующего фермента (АКФ), двумя полиморфизмами в гене рецептора ангиотензина II, тип 2 (AGTR2), и клиническими параметрами снижения среднего определенного диастолического и систолического кровяного давления. Такие эффекты не обнаружены при лечении ирбесартаном и плацебо. Кроме того, обнаружено, что у бессмысленного варианта АКФ (Pro32Ser), ассоциированного с пониженным ответом, более высокая частота встречаемости аллеля С (Pro) среди представителей негроидной расы, по сравнению с представителями европеоидной расы (19/154 против 2/790).
В данном примере все четыре пациента с остатком серина (аллель С) относятся к негроидной расе. Из-за чрезвычайно малого числа пациентов с аллелем С нельзя провести исследование с даннам ОНП на той же модели, что и в примере 1. Кроме того, ассоциация двух ОНП в AGTR2, установленная в примере 1, не была воспроизведена.
Клиническое исследование в данном примере (А2203) рандомизируют и проводят двойным слепым многоцентровым многофакторным с плацебо контролем и применением параллельных групп методом для оценки эффективности и безопасности комбинаций алискирена и вальсартана по сравнению с монотерапией отдельными компонентами, а также комбинацией вальсартана и гидрохлортиазида (ГХТЗ), у пациентов с гипертонией.
Основными задачами настоящего примера являются оценка эффекта по снижению кровяного давления при использовании комбинации алискирена и вальсартана (75/80 мг, 150/160 мг и 300/320 мг) по сравнению с монотерапией отдельными компонентами, вводимыми на протяжении 6 недель пациентам с клиническим средним определенным диастолическим кровяным давлением ([СОДКД] ≥ 95 мм Hg и < 110 мм Hg), а также оценка эффекта по снижению кровяного давления при использовании только одного алискирена 75 мг, 150 мг и 300 мг по сравнению с плацебо, вводимыми на протяжении 6 недель пациентам с клиническим средним определенным диастолическим кровяным давлением ([СОДКД] ≥ 95 мм Hg и < 110 мм Hg). Группы лечения в основном сопоставляют с демографическими и базовыми параметрами, при среднем возрасте 56 лет, 56% мужчин и 6,8% представителей негроидной расы.
Первичная переменная эффективности, изменение относительно базового уровня СОДКД при терапии алискиреном по сравнению с плацебо, статистически значима в группе пациентов, получающих алискирен в дозе 300 мг. Средняя величина снижения кровяного давления для двух вариантов монотерапии такая же, что и в предыдущих исследованиях. Однако величина эффекта плацебо выше, чем предполагалось, и выше, чем в предыдущих исследованиях алискирена. Понижение кровяного давления с помощью комбинации алискирена и вальсартана было меньше, чем при применении гидрохлортиазида (ГХТЗ) 12,5 мг/вальсартана, а аддитивность была меньше при максимальной дозе алискирена 300 мг/вальсартан 320 мг, чем при менее жестких комбинациях.
Фармакогенетический анализ объектов. В ретроспективный фармакогенетический анализ включают всех пациентов, которые согласились предоставить образцы для фармакогенетического исследования. Основная задача заключается в выявлении ассоциаций между генетической вариацией и вариациями эффективности лечения алискиреном, которые оценивают преимущественно по СОДКД, а также по СОСКД и доле респондеров.
Подход с применением гена-«кандидата» используют для отбора 48 полиморфизмов в 12 генах РАС или в генах, для которых ранее была установлена связь с регуляцией кровяного давления (табл.4). Все доступные образцы генотипируют для каждого ОНП. Затем выполняют ассоциативные исследования согласно описанному в примере 1.
Образцы. У пациентов, участвующих в клиническом исследовании А2201 (см. пример 1) и клиническом исследовании А2203, отдельно спрашивают согласие на участие в проведении фармакогенетического анализа. Образцы крови пациентов, давших согласие на участие, собирают в отдельных местах исследования и затем отправляют в фирму Covance (Индианаполис, Индиана, США). Геномную ДНК каждого пациента экстрагируют из крови с помощью метода фирмы Covance, используя набор для выделения ДНК PUREGENE™ (D-50K) (фирма Gentra, Миннеаполис, Миннесота), и отправляют в NIBR для генотипирования. В конечном счете, 511 пациентов, участвующих в клиническом исследовании в примере 1 (A2201), генотипируют примерно в равных соотношениях для каждой из групп. Шестьсот восемьдесят четырех пациентов из А2203 генотипируют в соотношении 3:1 числа пациентов в группе плацебо и групп монотерапии алискиреном по отношению к другим группам лечения.
Первичными переменными эффективности являются изменения величин СОДКД (снижение величины СОДКД в конечной точке по сравнению с исходным уровнем). Вторичными переменными эффективности являются изменения величин СОСКД (снижение величины СОСКД в конечной точке по сравнению с исходным уровнем), доля респондеров, снижение активности ренина плазмы (АРП) и повышение активного ренина плазмы (АРП) относительно исходных величин.
Генотипирование. Исследования ОНП планируют, используя информацию общедоступной базы данных dbSNP и частной базы данных Celera/ABI. Разработанные наборы зондов для изучения гаплотипирования получают для платформы Assays-by-Design® фирмы ABI. Livak K.J. и др., Nat. Genet. 9, 1995, сс.341-342. Для генотипирования используют 10 нг геномной ДНК, что соответствует рекомендации производителя.
Генотипированные полиморфизмы. Список полиморфизмов, идентифицированных в настоящем исследовании, включающий код локуса, ген, ссылку на базу данных и эффект, приводят в табл.5.
Статистический анализ. Исследования ассоциации генотипа-фенотипа и родственные анализы проводят в фирме SAS (Кэри, Северная Каролина, США), используя программное обеспечение Analyst®.
Тесты выявления ассоциации используют четко определенные генотипы в качестве независимой переменной, без предположения о доминантности, и различные переменные эффективности в качестве зависимых переменных. Тесты непрерывных зависимых переменных, используемые в анализе ANCOVA, и логистическую регрессию используют для четко определенных зависимых переменных. Отмечают, что ни один из результатов не приспосабливают для тестирования по многим гипотезам. Порог р<0,05 используют для определения допустимых ассоциаций. Совпадением случайных величин при анализе ассоциации генотип-фенотип являются: (1) уровень дозы при лечении, (2) исследуемая область, обозначаемая STU1A в А2201 (см. пример 1) или обозначаемая REGION в А2203, (3) измерение исходных уровней СОДКД и СОСКД и (4) раса. Анализируют все образцы от всех трех групп, в которых пациентов лечили алискиреном. При наблюдении совпадения случайных величин тот же анализ проводят в группах пациентов, которых лечили ирбесартаном и плацебо.
АКФ. ОНП 4769 генотипируют у пациентов наряду с другими шестью полиморфизмами в данном принципиально важном ферменте для РАС. Существенную связь наблюдают между ОНП 4769 и первой переменной эффективности, снижением СОДКД относительно базового уровня (р=0,023), и со второй переменной, уровнем респондеров (р=0,0048). Для другой второй переменной, снижения величины СОКДДВ относительно исходного уровня, не отмечают значительной ассоциации, отмечают только тенденцию (р=0,14).
При повторении анализа ANCOVA с той же моделью для каждой из групп лечения ассоциацию выявляют только для групп лечения алискиреном, но не для группы лечения ирбесартаном или группы плацебо. Специфические эффекты алискирена показаны в табл.7. Незначительная связь установлена между ОНП и вторичными параметрами активности ренина плазмы (АРП) и активным ренином (АРП).
ОНП_4769 является кодирующим ОНП, который изменяет аминокислотную последовательность с пролина на серин по кодону 32 в изоформах 2 и 3 АКФ. Полиморфизм АСЕ I/D (присутствие или отсутствие 287 п.н. Alu повторяет последовательность в интроне 16) ассоциирует с уровнем регуляции АКФ и активностью и его рамификациями в РАС. Rigat В. и др., J. Clin. Invest. 86, 1990, сс.1343-1346. В данном случае тестируют АКФ I/D и наблюдают ассоциативные связи с ответом на алискирен. ОНП_47б9 располагается в 12-м интроне гена АКФ, кодирующего соматическую изоформу, и локализован в первом экзоне гена, кодирующего вторую и третью изоформы. АКФ I/D располагается в 16-м интроне, который находится в таком же неравновесном сцеплении, что и ОНП_4769, в группах европеоидов, афроамериканцев и китайцев (программа просмотра ОНП, фирма Applied Biosystems, Фостер-Сити, Калифорния, США).
AGTR2. Установлено, что рецептор ангиотензина II, тип 2, ингибирует активность АКФ и ослабляет действия, опосредованные рецептором, тип 1, вызывая в результате расширение сосудов. Ichiki Т и др., Nature 377, 1995, сс.748-750, Hunley ТЕ и др., Kidney Int. 57, 2000, сс.570-577.
Наблюдают существенную ассоциацию между ОНП 1445 и ОНП 4795 и первичной переменной эффективностью, снижением СОДКД относительно базового уровня (р=0,0071 и 0,0026, соответственно). ОНП 4795 также показывает существенную связь со второй переменной, снижением СОСКД относительно базового уровня (р=0,046), но не со вторым параметром, долей респондеров. Между тем, ОНП 1445 не показывает существенной связи со вторыми параметрами. Не обнаруживают существенной связи между ОНП и вторичными параметрами, АРП и АКТР.
При повторении анализа ANCOVA с той же моделью для каждой группы лечения ассоциативную связь обнаруживают только для групп лечения алискиреном, но не для группы лечения ирбесартаном или группы плацебо. Воздействия генотипа у пациентов, подвергшихся лечению алискиреном, представлены выше в табл.7.
При попытке повторить ассоциации, наблюдавшиеся с этими двумя ОНП в исследовании А2203 в группах лечения алискиреном, результаты не повторяются (р>0,05). Также не наблюдают проявления тенденции к ассоциации. На основании результатов предварительных клинических исследований из-за более высокого, чем наблюдалось ранее, ответа на плацебо (8,6 мм Hg), доза-ответ и величина плацебо-вычитаемых эффектов при лечении алискиреном ниже, чем предполагалось. Такое непостоянство может быть вызвано, по меньшей мере, частично, утратой копирования ассоциации AGTR2.
Оба этих ОНП не являются кодирующими. ОНП 1445 является нетранслируемой областью гена AGTR2, а ОНП_4795 находятся в геномной области в неравновесном сцеплении с геном AGTR2. По меньшей мере, у китайцев эти два ОНП находятся в том же блоке неравновесного сцепления (SNPbrowser, фирма Applied Biosystems, Foster City, Калифорния, США).
Обсуждение. Данный анализ выявляет существенные ассоциации между полиморфизмами в двух генах с переменными клинических результатов в исследовании А2201 (см. пример 1). Один вариант в гене АКФ и два варианта в гене AGTR2 показывают значительную ассоциацию с первичным параметром, СОДКД. Вариант АКФ и один из вариантов AGTR2 также показывают значительную ассоциацию со вторичными параметрами, СОСКД и долей респондеров. Второй вариант AGTR2 не показывает значительной ассоциации, а только проявляет такую же тенденцию по отношению ко вторичным параметрам. Такое действие генотипа наблюдают только в группах пациентов, которых лечили алискиреном, но не в группах лечения ирбесартаном или плацебо. Следовательно, описанный выше эффект означает, что фармакогенетический эффект специфичен для алискирена.
Действие Pro32Ser варианта АКФ представляет особый интерес, поскольку разница между генотипами ТТ и СТ представляется весьма значительной (снижение СОДКД 11,4 против 5,6 мм Hg, снижение СОСКД 11,7 против 5,9 мм Hg и соотношение респондеров 70% против 14%). Однако гомозиготный генотип СС отсутствует у всех пациентов. Следовательно, частота встречаемости этого аллеля намного меньше частоты для ОНП согласно базам данных, равной 0,1, и среднее число пациентов с генотипом СТ весьма незначительно. Установили, что частота встречаемости аллеля С намного выше у представителей негроидной расы по сравнению с представителями европеоидной расы (19/154 против 2/790). В эксперименте А2203 все 4 пациента с остатком серина (аллель С) относятся к негроидной расе. Из-за чрезвычайно малого числа пациентов с аллелем С анализ А2203 не может быть проведен с той же моделью.
Полиморфизмы АКФ и их влияние на концентрацию АКФ в плазме и кровяное давление выявляют преимущественно в группах африканцев и афроамериканцев. Bouzekri N. и др., Eur. J. Hum. Genet. 12, 2004, сс.460-468, Сох R. и др., Hum. Mol. Genet. 11, 2002, сс.2969-2677, Zhu X. и др., Am. J. Hum. Genet. 68, 2001, сс.1139-1148. Наблюдение более высокой аллельной частоты ОНП_4769 в гене АКФ у негроидных пациентов в двух исследованиях SPP100 подтверждает последующее исследование функционального воздействия данного полиморфизма на уровень АКФ или его активность. Кроме того, аминокислотное изменение в кодоне 32 предположительно является изоформой этого фермента в семенниках.
При анализе ответа на алискирен в зависимости от генотипа доля респондеров с генотипом ТТ возрастает примерно до 70%. Данный результат может способствовать размещению алискирена на массовом рынке антигипертензивных средств, поскольку значительная часть людского сообщества (примерно 80% согласно частоте встречаемости аллелей с ОНП по базам данных, и даже может быть больше по данным настоящего исследования) обладает генотипом ТТ, ассоциированным с большей долей респондеров (фиг.2). Это также может помочь в дальнейших исследованиях проводить отбор предположительно «лучших» респондеров, отвечающих на алискирен.
Весьма вероятно, что два ОНП гена AGTR2 находятся в неравновесном сцеплении, поскольку хромосомная область вокруг данного локуса находится в значительной степени в одном блоке неравновесного сцепления. Функция передачи сигнала Ang II через рецептор типа 2 изучена в меньшей степени по сравнению с рецептором типа 1. Это открытие также может означать участие AGTR2 в функции Ang II в виде регуляции кровяного давления ниже по цепи по отношению к ингибированию ренина.
Эти описываемые ОНП не показывают ассоциативной связи с измерениями исходных уровней СОДКД и СОСКД. Это означает, что генетический эффект является алискирен-связанным фармакогенетическим эффектом.
Эквиваленты
Детали одного или нескольких вариантов осуществления настоящего изобретения суммированы ниже в формуле изобретения и соответствуют приведенному выше описанию. Хотя какие-либо способы и материалы, сходные или эквивалентные описанным в настоящем изобретении, могут применяться для осуществления настоящего изобретения или для тестирования, предпочтительные способы и материалы описаны в настоящем описании. Другие свойства, объекты и преимущества настоящего изобретения можно почерпнуть из описания и формулы настоящего изобретения. В описании и прилагаемой формуле изобретения формы единственного числа включают ссылки на множественные объекты, несмотря на то что содержание, очевидно, указывает на обратное. Несмотря на очевидное противоречие, все методики и научные термины, используемые в настоящем изобретении, имеют то же назначение, которое обычно понимается специалистами в той области, к которой принадлежит настоящее изобретение. Все цитируемые в настоящем изобретении публикации, патенты и патентные заявки включены в него в виде ссылок на их сущность, и в полной мере для всех тех же целей, для которых каждая отдельная публикация, патент или патентная заявка были конкретно и отдельно показаны для включения в виде ссылки на их сущность.
Настоящее изобретение не ограничивается употреблением терминологии, приведенной в конкретных вариантах его осуществления, поскольку эта терминология приведена для пояснения отдельных объектов настоящего изобретения. Многие варианты и модификации настоящего изобретения могут быть получены без уклонения от духа и области охвата настоящего изобретения, что, безусловно, очевидно специалистам в данной области. Специалистам также очевидно, что перечисленные в настоящем изобретении методы и оборудование могут быть заменены на функционально эквивалентные, соответствующие области охвата настоящего изобретения. Такие модификации и варианты соответствуют формуле настоящего изобретения. Настоящее изобретение ограничивается терминами, приведенными в формуле изобретения, однако, наряду с ними в полной мере правомерно употребление их эквивалентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕНЕТИЧЕСКИЕ МАРКЕРЫ ДЛЯ ПРОГНОЗИРОВАНИЯ ОТВЕТА НА ТЕРАПИЮ ПОДНИМАЮЩИМИ УРОВЕНЬ HDL ИЛИ ИМИТИРУЮЩИМИ HDL АГЕНТАМИ | 2015 |
|
RU2703192C2 |
| Способ прогнозирования эффективности терапии больных сахарным диабетом 2 типа | 2015 |
|
RU2626670C2 |
| ПРОГНОЗ КИНЕТИКИ ВИРУСА ГЕПАТИТА С ПРИ ЛЕЧЕНИИ, ИСКЛЮЧАЮЩЕМ ИНТЕРФЕРОН | 2011 |
|
RU2590691C2 |
| Способ прогнозирования риска развития преэклампсии на основе генетического тестирования | 2021 |
|
RU2775434C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ВОЗНИКНОВЕНИЯ ТРОМБОТИЧЕСКИХ ОСЛОЖНЕНИЙ У ПАЦИЕНТОВ С СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИЕЙ | 2020 |
|
RU2746234C1 |
| ГЕНЕТИЧЕСКАЯ ПАНЕЛЬ И СПОСОБ ОПРЕДЕЛЕНИЯ ПРЕДРАСПОЛОЖЕННОСТИ ЧЕЛОВЕКА К РАЗЛИЧНЫМ ВИДАМ ФИЗИЧЕСКОЙ РАБОТОСПОСОБНОСТИ | 2006 |
|
RU2339701C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНЕТИЧЕСКОЙ ПРЕДРАСПОЛОЖЕННОСТИ К ЗАБОЛЕВАНИЮ ИНФЕКЦИОННЫМ ЭНДОКАРДИТОМ | 2016 |
|
RU2618459C1 |
| Способ прогнозирования развития коморбидной формы артериальной гипертензии и хронической обструктивной болезни легких | 2016 |
|
RU2620566C1 |
| Способ прогнозирования риска развития преэклампсии на основе молекулярно-генетического анализа | 2021 |
|
RU2775433C1 |
| ЛЕЧЕНИЕ БОЛЕЗНИ АЛЬЦГЕЙМЕРА ЦИТОКИНАМИ | 2003 |
|
RU2519651C2 |
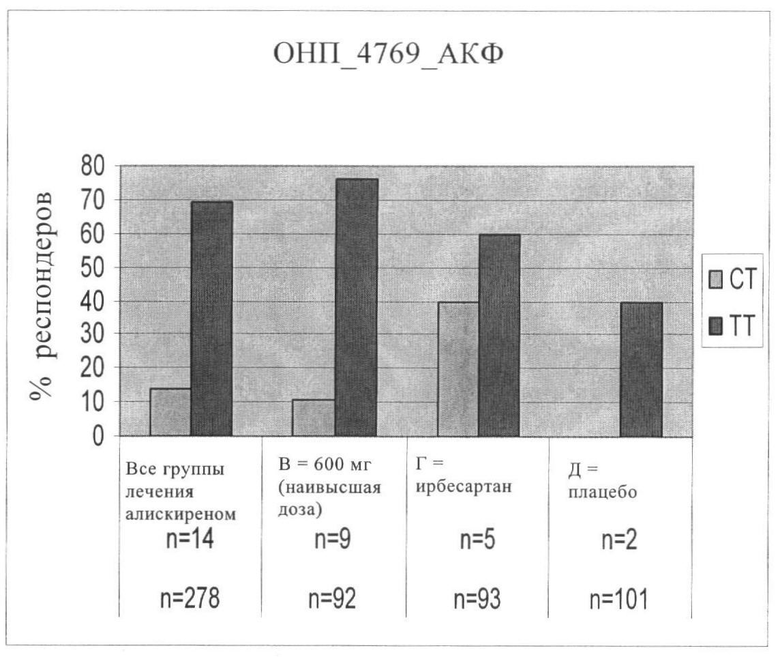
Изобретение относится к медицине, в частности к терапии и фармакологии, в частности к фармакогенетическому анализу, и касается выявления генетических полиморфизмов, являющихся маркерами эффективности алискирена в качестве антигипертензивного агента. Алискирен применяют для получения лекарственного средства для лечения гипертонии, для понижения среднего определяемого систолического кровяного давления и для понижения диастолического кровяного давления. Причем лечение алискиреном осуществляют в группе пациентов, которую выбирают на основании генетических полиморфизмов в биомаркерных генах, где показателями эффективности алискирена являются генетические полиморфизмы - ОНП_4769, как указано в SEQ ID NO: 1 в гене ангиотензин-конвертирующего фермента (АКФ), ОНП_1445, как указано в SEQ ID NO: 2 в гене рецептора ангиотензина II, тип 2 (AGTR2) и ОНП_4795, как указано в SEQ ID NO: 3 в гене AGTR2. Также изобретение обеспечивает способ определения чувствительности индивидуума с гипертонией к лечению алискиреном и применение генного продукта гена, выбранного из группы, включающей ген ангиотензин-конвертирующего фермента (АКФ) и ген рецептора ангиотензина II, тип 2 (AGTR2), в качестве мишени для действия лекарственного средства. 6 н.п. ф-лы, 1 ил., 7 табл.
1. Применение алискирена для получения лекарственного средства для лечения гипертонии в группе пациентов, выбранной на основании генетических полиморфизмов в биомаркерных генах, имеющихся у пациентов, причем генетические полиморфизмы являются показателями эффективности алискирена в лечении гипертонии и выбраны из группы, включающей: ОНП_4769, как указано в SEQ ID NO: 1 в гене ангиотензинконвертирующего фермента (АКФ), ОНП_1445, как указано в SEQ ID NO: 2 в гене рецептора ангиотензина II, тип 2 (AGTR2), ОНП_4795, как указано в SEQ ID NO: 3 в гене AGTR2, и их комбинации.
2. Способ определения чувствительности индивидуума с гипертонией к лечению алискиреном, включающий стадии:
(а) установления в двух копиях генов, имеющихся у индивидуума, идентичности нуклеотидных пар в одном или нескольких полиморфных генетических локусах, причем генетические локусы выбраны из группы, включающей ген ангиотензинконвертирующего фермента (АКФ), ген рецептора ангиотензина II, тип 2 (AGTR2), причем генетические полиморфизмы выбраны из группы, включающей: ОНП_4769, как указано в SEQ ID NO: 1 в гене ангиотензинконвертирующего фермента (АКФ), ОНП_1445, как указано в SEQ ID NO: 2 в гене рецептора ангиотензина II, тип 2 (AGTR2), ОНП_4795, как указано в SEQ ID NO: 3 в гене AGTR2, и их комбинации, и
(б) оценки принадлежности индивидуума к «высокореспондерной» группе, если нуклеотидные пары в полиморфных локусах указывают, что индивидуум отвечает на лечение алискиреном.
3. Применение алискирена для получения лекарственного средства для лечения гипертонии у индивидуума, включающее стадии:
(а) установления в двух копиях генов, имеющихся у индивидуума, идентичности нуклеотидных пар в одном или нескольких полиморфных генетических локусах, причем генетические локусы выбраны из группы, включающей ген ангиотензинконвертирующего фермента (АКФ), ген рецептора ангиотензина II, тип 2 (AGTR2), причем генетические полиморфизмы выбраны из группы, включающей: ОНП_4769, как указано в SEQ ID NO: 1 в гене ангиотензинконвертирующего фермента (АКФ), ОНП_1445, как указано в SEQ ID NO: 2 в гене рецептора ангиотензина II, тип 2 (AGTR2), ОНП_4795, как указано в SEQ ID NO: 3 в гене AGTR2, и их комбинации, и
(б) введения алискирена индивидууму, если нуклеотидная пара в полиморфном локусе указывает, что индивидуум отвечает на лечение алискиреном.
4. Применение алискирена для получения лекарственного средства для понижения среднего определяемого систолического кровяного давления (СОСКД) у индивидуума, включающее стадии:
(а) установления в двух копиях генов, имеющихся у индивидуума, идентичности нуклеотидных пар в ОНП_4795, как указано в SEQ ID NO: 3 в гене рецептора ангиотензина II, тип 2A(GTR2), и
(б) введения алискирена индивидууму, если нуклеотидная пара по ОНП_4795, как указано в SEQ ID NO: 3, указывает, что индивидуум отвечает на лечение алискиреном.
5. Применение алискирена для получения лекарственного средства для понижения диастолического кровяного давления у индивидуума, включающий стадии:
(а) установления в двух копиях генов, имеющихся у индивидуума, идентичности нуклеотидных пар в одном или нескольких полиморфных генетических локусах, причем генетические локусы выбраны из группы, включающей ген ангиотензинконвертирующего фермента (АКФ), ген рецептора ангиотензина II, тип 2 (AGTR2), причем генетические полиморфизмы выбраны из группы, включающей: ОНП_4769, как указано в SEQ ID NO: 1 в гене ангиотензинконвертирующего фермента (АКФ), ОНП_1445, как указано в SEQ ID NO: 2 в гене рецептора ангиотензина II, тип 2 (AGTR2), ОНП_4795, как указано в SEQ ID NO: 3 в гене AGTR2, и их комбинации, и
(б) введения алискирена индивидууму, если идентичность нуклеотидных пар в одном или нескольких полиморфных локусах свидетельствует о том, что индивидуум отвечает на лечение алискиреном.
6. Применение генного продукта гена, выбранного из группы, включающей ген ангиотензинконвертирующего фермента (АКФ) и ген рецептора ангиотензина II, тип 2 (AGTR2), в качестве мишени для действия лекарственного средства, которое включает следующие стадии:
(а) контакт лекарственного средства с первым генным продуктом, кодируемым полинуклеотидом с нуклеотидной парой в полиморфном сайте в области выбранного гена, свидетельствующей о высокой реактивности при лечении гипертонии алискиреном,
(б) идентификация действия лекарственного средства на указанный первый генный продукт,
(в) контакт лекарственного средство со вторым генным продуктом, кодируемым полинуклеотидом с нуклеотидной парой в полиморфном сайте в области выбранного гена, свидетельствующей о низкой реактивности при лечении гипертонии алискиреном,
(г) идентификация действия лекарственного средства на указанный второй генный продукт,
(д) идентификация сходных черт и различий между активностью, идентифицированной на стадии (б), и активностью, идентифицированной на стадии (г);
причем генетические полиморфизмы выбраны из группы, включающей: ОНП_4769, как указано в SEQ ID NO: 1 в гене ангиотензинконвертирующего фермента (АКФ), ОНП_1445, как указано в SEQ ID NO: 2 в гене рецептора ангиотензина II, тип 2 (AGTR2), ОНП_4795, как указано в SEQ ID NO: 3 в гене AGTR2, и их комбинации.
| ARNETT DK et al | |||
| Pharmacogenetic approaches to hypertension therapy: design and rationale for the Genetics of Hypertension Associated Treatment (GenHAT) study | |||
| Pharmacogenomics J., 2002 2(5), p.309-317, найдено в Интернет, найдено 25.02.2010 | |||
| STANTON A et al | |||
| Blood pressure lowering in essential hypertension with an oral renin inhibitor, aliskiren. |
Авторы
Даты
2011-01-10—Публикация
2006-03-20—Подача