Данная заявка испрашивает приоритет согласно предварительной патентной заявке США №60/523335, зарегистрированной 20 ноября 2003 г., и предварительной патентной заявке США №60/514018, зарегистрированной 27 октября 2003 г., содержание которых полностью включено в настоящее описание в виде ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам удаления агрегатов с высокой молекулярной массой из препаратов антител с помощью гидроксиапатитовой хроматографии. В определенных вариантах реализации настоящего изобретения содержание агрегатов с высокой молекулярной массой, присутствующих в конечном препарате, может быть существенно снижено, например, с 40% до менее чем 1%.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Изобретение направлено на создание таких способов очистки белков, которые бы не вызывали разрушения или существенного уменьшения биологической активности белка. Удаление загрязняющих веществ из препаратов антител необходимо для того, чтобы их можно было использовать в диагностических целях, терапевтических целях, для прикладной клеточной биологии и функциональных исследований. Так, например, препараты антител, полученные из линий клеток гибридомы, часто содержат нежелательные компоненты, в частности агрегаты с высокой молекулярной массой (high molecular weight aggregates, HMWA) антитела, полученного из линии клеток. Это образование агрегатов может отрицательно влиять на безопасность продукта, вызывая при введении активацию комплемента или анафилаксию. Кроме того, образование агрегатов может мешать процессу производства, вызывая уменьшение выхода продукта, расширение пика и потерю активности.
Наиболее общие способы очистки белка основаны на различиях размера, заряда и растворимости белка, подлежащего очистке, и загрязняющих веществ. Протоколы, основанные на этих параметрах, включают аффинную хроматографию, ионообменную хроматографию, эксклюзионную хроматографию и хроматографию гидрофобного взаимодействия. Однако эти хроматографические методы иногда вызывают технические трудности при разделении агрегированных или многомерных типов антител. Например, такие способы, как ионообменная хроматография и хроматография гидрофобного взаимодействия, могут вызывать образование агрегатов вследствие повышенной концентрации белка или необходимых изменений концентрации буфера и/или рН в процессе элюирования. Кроме того, в некоторых случаях антитела проявляют слишком малые отличия в изоэлектрических точках, чтобы обеспечить их разделение с помощью ионообменной хроматографии, Tarditi, J. Immunol. Methods 599:13-20 (1992). Эксклюзионная хроматография является трудоемким способом и приводит к существенному разбавлению продукта, что является препятствием для крупномасштабных производительных технологических процессов. Утечка лигандов, которая может происходить из колонок при аффинной хроматографии, вызывает нежелательное загрязнение элюированного продукта, Steindl, J. Immunol. Methods 235:61-69 (2000). Заявители попытались удалить HMWA из препарата анти-GDF-9-антитела с помощью анионообменной хроматографии, катионообменной хроматографии, а также хроматографии гидрофобного взаимодействия. Однако все эти способы оказались неспособными удалить HMWA из препарата анти-GDF-9- антитела в достаточной степени.
Гидроксиапатитовая хроматография представляет собой способ очистки белков, в котором используют нерастворимый гидроксилированный фосфат кальция [Са10(PO4)6(ОН)2], образующий матрицу и лиганд. Функциональные группы состоят из пар положительно заряженных ионов кальция (С-сайтов) и кластеров отрицательно заряженных фосфатных групп (Р-сайтов). Взаимодействия между гидроксиапатитом и белками являются сложными и многомодовыми. Однако в одном из типов взаимодействия положительно заряженные аминогруппы белков взаимодействуют с отрицательно заряженными Р-сайтами, а карбоксильные группы белков взаимодействуют с С-сайтами посредством координационного комплексообразования, см. Shepard, J. Chromatography 981:93-98 (2000).
Кристаллический гидроксиапатит представлял собой первый тип гидроксиапатита, который нашел применение в хроматографии, однако оно было ограничено вследствие структурных сложностей. Керамический гидроксиапатит (ceramic hydroxyapatite, cHA) разработали для преодоления некоторых трудностей, связанных с кристаллическим гидроксиапатитом, в частности с ограниченными скоростями потока. Керамический гидроксиапатит обладает высокой долговечностью, хорошей способностью связывать белки и может применяться при более высоких скоростях потока и давлениях, чем кристаллический гидроксиапатит, Vola et al., BioTechniques 14:650-655 (1993).
Гидроксиапатит используют для хроматографического разделения белков, нуклеиновых кислот, а также антител. В гидроксиапатитовой хроматографии колонку обычно уравновешивают и вводят образец в фосфатном буфере с низкой концентрацией, а затем элюируют адсорбированные белки в градиенте концентраций фосфатного буфера, Giovannini, Biotechnology and Bioengineering 73:522-529 (2000). Иногда для элюирования белков успешно применяют небольшие градиенты концентрации фосфата натрия, в то время как в других случаях с успехом используют градиенты концентраций до 400 мМ фосфата натрия. См., например, Stanker, J. Immunological Methods 76:157-159 (1985) (градиент фосфата натрия для элюирования от 10 мМ до 30 мМ); Shepard, J. Chromatograpy 891:93-98 (2000) (градиент фосфата натрия для элюирования от 10 мМ до 74 мМ); Tarditi, J. Chromatograpy 599:13-20 (1992) (градиент фосфата натрия для элюирования от 10 мМ до 350 мМ). Хотя соли, в частности NaCl, вводят в связующий буфер для очистки антитела с помощью гидроксиапатитовой хроматографии, Giovannini, Biotechnology and Bioengineering 73:522-529 (2000), влияние таких солей, как NaCl и (NH4)2SO4, на элюирование белков в гидроксиапатитовой хроматографии ранее не было известно Karlsson et al.. Ion Exchange Chromatography, в Protein Purification, VCH Publishers, Inc. (Janson and Ryden eds., 1989).
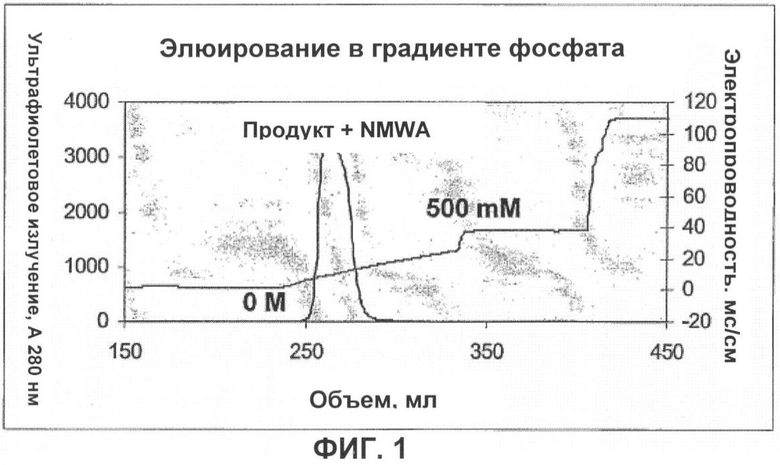
В некоторых случаях исследователям не удалось селективно элюировать антитела из гидроксиапатита или получить достаточно чистый продукт с помощью гидроксиапатитовой хроматографии, Junbauer, J. Chromatograpy 476:257-268 (1989); Giovannini, Biotechnology and Bioengineering 73:522-529 (2000). Заявители безуспешно пытались отделить агрегаты с высокой молекулярной массой от препарата антитела с помощью хроматографии с керамическим гидроксиапатитом и элюированием фосфатом натрия при помощи известных способов (фигура 1). Кроме того, как известно, жесткие условия элюирования, применяемые с целью разрушения плотного связывания белка с матрицей, нарушают биологическую активность белка. Поэтому существует потребность в эффективных способах удаления загрязнений, в частности, агрегатов с высокой молекулярной массой из препаратов антител, которые не нарушают биологическую активность антител.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
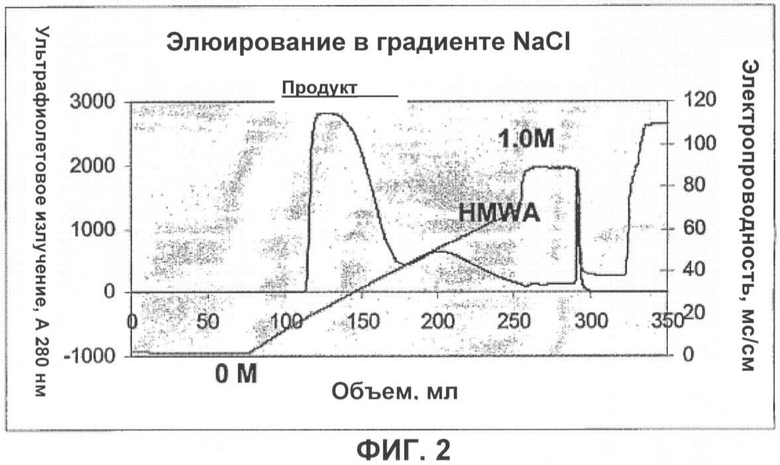
Заявители установили, что NaCl можно использовать в новом способе гидроксиапатитовой хроматографии для очистки иммуноглобулинов и удаления HMWA из различных неочищенных материалов (фигура 2). Таким образом, настоящее изобретение относится к способам удаления агрегатов с высокой молекулярной массой из препаратов антител путем контактирования указанного препарата с гидроксиапатитовой смолой и селективного элюирования антитела из смолы. В альтернативном способе препарат антитела можно ввести в уравновешивающий буфер с помощью буферного обмена, а затем пропустить через гидроксиапатитовую смолу. Для очистки препаратов антител можно использовать также комбинацию этих связывающих/проточных способов гидроксиапатитовой хроматографии.
Изобретение использует элюентный буфер или загрузочный буфер, который содержит от 1 до 20 мМ фосфата натрия и от 0,2 до 2,5 М NaCl, при этом элюентный буфер или загрузочный буфер имеет рН от 6,4 до 7,6.
При сочетании режима связывания/проточного режима изобретение использует уравновешивающий буфер и промывной буфер, который содержит от 1 до 20 мМ фосфата натрия, от 0,01 до 2,0 М NaCl, от 0 до 200 мМ аргинина и от 0 до 200 мМ HEPES (N-2-гидроксиэтилпиперазин-N2-этансульфоновой кислоты), при этом уравновешивающий буфер и промывной буфер имеют рН от 6,2 до 8,0.
В одном варианте реализации очищенное антитело содержит менее 5% агрегатов с высокой молекулярной массой.
В другом варианте реализации очищенное антитело содержит менее 1% агрегатов с высокой молекулярной массой.
В следующем варианте реализации препарат антитела содержит по меньшей мере одно антитело IgG. Более конкретно, препарат антитела содержит по меньшей мере одно антитело, выбранное из группы, включающей рецептор анти-IL-21, анти-GDF-8, анти-Abeta, анти-CD22, анти-Lewis Y, анти-IL-13 и анти-IL-22.
В сочетании с гидроксиапатитовой хроматографией согласно изобретению можно использовать по меньшей мере один способ очистки. Возможно использование различных способов очистки, в частности, но без ограничения, хроматографии с протеином А, аффинной хроматографии, хроматографии гидрофобного взаимодействия, аффинной хроматографии с иммобилизацией металла, эксклюзионной хроматографии, диафильтрации, ультрафильтрации, фильтрации для удаления вирусов, анионообменной хроматографии и/или катионообменной хроматографии.
В одном варианте реализации анионообменную хроматографию и хроматографию с протеином А используют в сочетании с хроматографией с применением керамического гидроксиапатита. Анионообменную хроматографию и хроматографию с протеином А можно использовать в комбинации, например, путем контактирования препарата антитела с подложкой из протеина А обеспечить адсорбцию антитела на подложке, промыть подложку и адсорбированное антитело по меньшей мере одним промывным буфером протеина А, элюировать адсорбированное антитело по меньшей мере одним элюентным буфером, обеспечить контакт препарата с ионообменной подложкой, пропустить антитело через подложку, промыть подложку по меньшей мере одним ионообменным промывным буфером, путем контактирования ионообменного потока с гидроксиапатитовой смолой обеспечить адсорбцию потока на смоле, промыть смолу по меньшей мере одним промывным буфером для промывки гидроксиапатита и элюировать очищенное антитело из смолы по меньшей мере одним элюентным буфером для гидроксиапатита.
В другом варианте реализации можно использовать комбинацию анионообменной хроматографии и хроматографии с применением протеина А, например, путем контактирования препарата с подложкой из протеина А обеспечить адсорбцию антитела на подложке из протеина А, промыть подложку из протеина А и адсорбированное антитело по меньшей мере одним промывным буфером протеина А, элюировать адсорбированное антитело по меньшей мере одним элюентным буфером для протеина А, обеспечить контакт элюата препарата А с ионообменной подложкой, пропустить антитело через ионообменную подложку, промыть ионообменную подложку по меньшей мере одним ионообменным промывным буфером, путем обмена ввести ионообменный поток в загрузочный буфер, содержащий от 1 до 20 мМ фосфата натрия и от 0,2 до 2,5 М NaCl, обеспечить контактирование ионообменного потока с гидроксиапатитовой смолой и промыть смолу по меньшей мере одним промывным буфером для гидроксиапатита.
В следующем варианте реализации используют анионообменную хроматографию и хроматографию с применением протеина А в комбинации с хроматографией с применением керамического гидроксиапатита. Анионообменную хроматографию и хроматографию с применением протеина А можно использовать в комбинации, например, путем контактирования препарата антитела с подложкой из протеина А обеспечить адсорбцию антитела на подложке, промыть подложку и адсорбированное антитело по меньшей мере одним промывным буфером для протеина А, элюировать адсорбированное антитело по меньшей мере одним элюентным буфером для протеина А, обеспечить контакт элюата препарата А с ионообменной подложкой, пропустить антитело через ионообменную подложку, промыть подложку по меньшей мере одним ионообменным промывным буфером, путем контактирования ионообменного потока с гидроксиапатитовой смолой обеспечить адсорбцию потока на смоле, обеспечить более плотное связывание HMWA, чем с мономером антитела, и по мере продолжения загрузки обеспечить вытеснение связанного мономера HMWA, промыть гидроксиапатитовую смолу по меньшей мере одним промывным буфером для гидроксиапатита и отобрать вытесненный мономер антитела.
Другие задачи и достоинства изобретения частично приведены в следующем разделе описания, а частично будут очевидными из описания или могут быть установлены при практической реализации изобретения. Задачи изобретения решаются, а достоинства реализуются с помощью элементов и комбинаций, указанных, в частности, в прилагаемой формуле изобретения.
Следует понимать, что предшествующее общее описание и приведенное ниже подробное описание являются только иллюстративными и пояснительными и не ограничивают изобретения, соответствующего прилагаемой формуле.
Прилагаемые фигуры, являющиеся частью настоящей заявки, совместно с описанием служат для пояснения принципов изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1 показывает невозможность известного способа элюирования с градиентом фосфата отделить HMWA от препарата анти-GDF-8-антитела.
Фигура 2 показывает, что применение элюирования с градиентом NaCl приводит к отделению большой части HMWA от препарата анти-GDF-8-антитела.
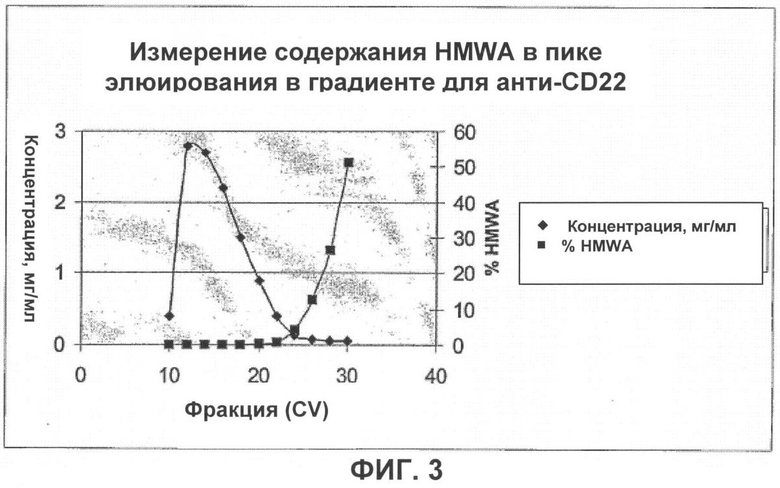
Фигура 3 показывает отделение HMWA от препарата анти-CD22-антитела при помощи хроматографии с сНА.
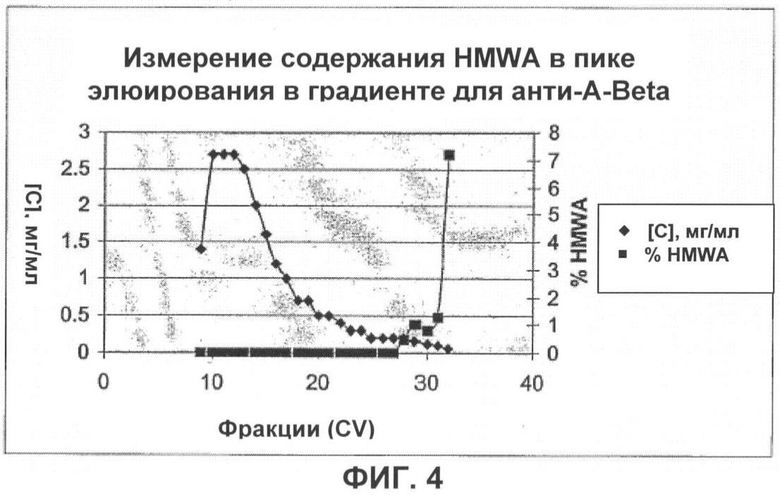
Фигура 4 показывает отделение HMWA от препарата анти-Abela-антитела при помощи хроматографии с сНА.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
А. Определения
Для облегчения понимания настоящего изобретения вначале необходимо определить некоторые термины. Дополнительные определения приведены далее при подробном описании.
Термин "антитело" относится к любому иммуноглобулину или его фрагменту и включает все полипептиды, содержащие антигенсвязывающий сайт. Термин включает, в частности, но без ограничения, поликлональные, моноклональные, моноспецифические, полиспецифические, неспецифические, гуманизированные, человеческие, одноцепочечные, химерные, синтетические, рекомбинантные, гибридные, мутированные, привитые и полученные in vitro антитела. Термин "антитело" включает также фрагменты антител, в частности Fab, F(ab′)2, Fv, scFv, Fd, dAb и другие фрагменты антител, которые сохраняют антигенсвязывающую функцию. Обычно такие фрагменты содержат антигенсвязывающий домен.
Антитела, которые можно очистить с помощью настоящего изобретения, включают также химически модифицированные формы, в частности, полученные в результате обработки полиэтиленгликолем, и слитые белки, содержащие иммуноглобулиновую группу. Антитело или его фрагмент можно выбрать из любых известных изотипов антител и их конформаций, например мономеры IgA, IgG, IgD, IgE, IgM, димеры IgA, тримеры IgA или пентамеры IgM.
Термин "препарат антитела" относится к составу, содержащему антитело и/или нежелательные компоненты, в частности агрегаты с высокой молекулярной массой указанного антитела.
Термин "керамический гидроксиапатит" или "сНА" относится к нерастворимому гидроксилированному фосфату кальция с формулой [Са10(PO4)6(ОН)2], который при спекании при высокой температуре принимает сферическую макропористую керамическую форму. Термин "сНА" включает, в частности, но без ограничения, керамический гидроксиапатит типа I и типа II. Если не указано иного, "сНА" относится к любому размеру частиц, включая, в частности, но без ограничения, 20, 40 и 80 мкм.
Термин "агрегаты с высокой молекулярной массой" или " HMWA" (high molecular weight aggregates) относится к соединению по меньшей мере двух антител. Соединение может быть образовано любым способом, включая, в частности, но без ограничения, ковалентные, не ковалентные, дисульфидные или нераспадающиеся поперечные связи. По меньшей мере два антитела могут связываться с одинаковыми или различными антигенами. По меньшей мере два антитела могут иметь форму антитела, фрагмента антитела или другие формы, описанные в приведенном выше определении термина "антитело".
Термин "проточный режим" относится к режиму отделения препарата антитела, при котором по меньшей мере одно антитело, содержащееся в препарате, пропускают через хроматографическую смолу или подложку, при этом по крайней мере одно потенциально загрязняющее вещество или примесь связывается с хроматографической смолой или подложкой. Проточный режим можно использовать, например, в гидроксиапатитовой хроматографии и в ионообменной хроматографии.
Термин "режим связывания" относится к способу отделения препарата антитела, при котором по меньшей мере одно антитело, содержащееся в препарате, связывается с хроматографической смолой или подложкой, при этом по крайней мере одно загрязняющее вещество или примесь проходит насквозь. Режим связывания можно использовать, например, в гидроксиапатитовой хроматографии и в ионообменной хроматографии.
Б. Описание способа
Настоящее изобретение обеспечивает способы удаления агрегатов с высокой молекулярной массой (HMWA) из препаратов антител с помощью гидроксиапатитовой хроматографии в режиме связывания, в проточном режиме или в их комбинации. Настоящее изобретение применяется в условиях крупномасштабной очистки препаратов антител.
В режиме связывания способ использует гидроксиапатитовую подложку, загруженную фосфатом с нейтральным рН и низкой ионной силой, чтобы связать антитело и HMWA. Затем колонку промывают фосфатным буфером, чтобы удалить слабосвязанные загрязнения. Далее антитело селективно вымывают с помощью фосфатного буфера с высокой ионной силой, содержащего от 0,2 до 2,5 М NaCl при рН от слабокислотного до слабощелочного. HMWA можно последовательно вымывать из смолы с помощью буфера с еще более высокой ионной силой и концентрацией фосфата при нейтральном рН. И, наконец, смолу можно регенерировать с помощью раствора гидроксида натрия и фосфата калия.
В проточном режиме препарат антитела с помощью буферного обмена переводят в загрузочный буфер, содержащий от 0,2 до 2,5 М NaCl при рН от слабокислотного до слабощелочного. Затем препарат антитела пропускают через колонку с гидроксиапатитом, при этом загрязнения, в частности HMWA, связываются в колонке. Колонку можно последовательно промывать, чтобы обеспечить дополнительное протекание очищенного антитела через колонку. И, наконец, можно произвести десорбирование колонки и регенерацию с помощью раствора гидроксида натрия и фосфата калия.
В одном варианте реализации изобретения очищенное антитело содержит менее 5% HMWA, в другом варианте - менее 3% HMWA, и в третьем варианте - менее 1% HMWA.
1. Антитела
Препараты антитела согласно изобретению можно выделить из нескольких источников, включая, в частности, но без ограничения, сыворотку иммунизированных животных, асцитную жидкость, надосадочную жидкость гибридомы или миеломы, кондиционированную среду, полученную в результате культивирования рекомбинантной клеточной линии, которая экспрессирует молекулу антитела, и все клеточные экстракты клеток, образующих антитела. В одном варианте реализации изобретения производят очистку антител от среды кондиционированной клеточной культуры множества рекомбинантных клеточных линий, образующих антитела. Исходя из данного описания, можно ожидать некоторых отличий для разных клеточных линий и различных продуктов антител, однако компетенции рядового специалиста в данной области техники вполне достаточно, чтобы адаптировать настоящее изобретение к конкретной комбинации белка антитела и продуктивной клеточной линии.
Исключительно в иллюстративных целях данное изобретение применили для очистки нескольких антител изотипа IgG с основным р1. Более конкретно, данное изобретение применили к моноклональным анти-GDF-8-антителам, описанным в предварительной патентной заявке США №60/419964 (именуемым далее "Муо-29"), к моноклональным антителам, специфически активным к антигену CD22, описанным в патентной заявке США №10/428894 (именуемым далее "анти-CD22"), и к моноклональным анти-Abeta-антигенантителам, описанным в международной патентной заявке PCT/US01/46587 (именуемым далее "анти-Abeta"). Структура рекомбинантных систем для получения антител Муо-29, CD22 и Abeta подробно описана в указанных заявках.
2. Гидроксиапатитовая смола
Серийно выпускаются различные гидроксиапатитовые смолы, при этом все доступные формы материала можно использовать для реализации настоящего изобретения. В одном из вариантов реализации изобретения используют гидроксиапатит в кристаллической форме. Гидроксиапатиты для применения согласно данному изобретению могут быть агломерированы для образования частиц и спечены при высоких температурах в стабильную пористую керамическую массу.
Размер частиц гидроксиапатита может изменяться в широких пределах, однако типичный размер частиц составляет от 1 мкм до 1000 мкм в диаметре и может быть равным от 10 мкм до 100 мкм. В одном варианте реализации изобретения размер частиц составляет 20 мкм. В другом варианте реализации изобретения размер частиц составляет 40 мкм. И, наконец, в еще одном варианте реализации изобретения размер частиц составляет 80 мкм.
Для получения колонок с сНА можно использовать ряд хроматографических подложек. Наиболее широко применяют гидроксиапатит типа I и типа II. Тип I имеет высокую способность связывания белка и лучшую способность для кислых белков. Тип II имеет более низкую способность связывания белка, однако лучшее разрешение для нуклеиновых кислот и некоторых белков. Материал типа II имеет также очень низкое сродство к альбумину и является особенно пригодным для очистки многих видов и классов иммуноглобулинов. Опытный специалист в данной области техники может оптимально выбрать конкретный тип гидроксиапатита.
Данное изобретение можно использовать с гидроксиапатитовой смолой, которая находится в свободной форме, загружена в колонку или содержится в хроматографе непрерывного годового действия. Опытный специалист может осуществить выбор размеров колонки. В одном из вариантов реализации изобретения для очистки в небольших объемах диаметр колонки может составлять по меньшей мере 0,5 см с высотой слоя около 20 см. В другом варианте реализации изобретения можно использовать диаметр колонки примерно от 35 см до примерно 60 см. И, наконец, в еще одном варианте реализации изобретения можно использовать диаметр колонки от 60 см до 85 см. В некоторых вариантах реализации для загрузки колонны при постоянной скорости потока примерно 4 см/мин или под действием силы тяжести можно использовать суспензию смолы керамического гидроксиапатита в растворе 200 мМ Na2HPO4 при рН 9,0.
2. (3?) Составы буферов и условия загрузки
Перед контактированием гидроксиапатитовой смолы с препаратом антитела может оказаться необходимым откорректировать такие параметры, как рН, ионная сила и температура, а в некоторых случаях добавить различные вещества. Так, например, возможной операцией является уравновешивание гидроксиапатитовой матрицы путем ее промывки определенным раствором (например, буфером для корректировки рН, ионной силы и т.п. или для введения детергента) с целью обеспечения необходимых характеристик для очистки препарата антитела.
При сочетании режима связывания/проточного режима гидроксиапатитовой хроматографии гидроксиапатитовую матрицу уравновешивают и промывают специальным раствором, обеспечивая необходимые характеристики для очистки препарата антитела. В одном из вариантов реализации настоящего изобретения матрицу можно уравновесить с помощью раствора, содержащего от 0,01 до 2,0 М NaCl при рН от слабощелочного до слабокислотного. Так, например, уравновешивающий буфер в различных вариантах реализации изобретения может иметь содержание фосфата натрия от 1 до 20 мМ, от 1 до 10 мм, от 2 до 5 мМ, 2 мМ и 5 мМ. Содержание NaCl в уравновешивающем буфере в различных вариантах реализации изобретения может составлять от 0,01 до 2,0 М, от 0,025 до 0,5 М, 0,05 М и 0,1 М. рН загрузочного буфера в одном варианте реализации может находиться в пределах от 6,2 до 8,0, в другом - от 6,6 до 7,0 и в третьем - может быть равным 7,3. Уравновешивающий буфер может иметь содержание аргинина в одном варианте реализации от 0 до 200 мМ, в другом - 120 мМ и в третьем - 100 мМ. Уравновешивающий буфер может иметь содержание HEPES в одном варианте реализации от 0 до 200 мМ, в другом - 20 мМ и в третьем - 100 мМ.
Можно также произвести буферный обмен препарата антитела для его введения в соответствующий буфер или в загрузочный буфер при подготовке к проточному режиму гидроксиапатитовой хроматографии. В одном варианте реализации изобретения препарат антитела с помощью буферного обмена может быть переведен в загрузочный буфер, содержащий от 0,2 до 2,5 М NaCl при рН от слабощелочного до слабокислотного. Так, например, загрузочный буфер может содержать от 1 до 20 мМ фосфата натрия, в другом варианте реализации он может содержать от 2 до 8 мМ фосфата натрия, в третьем - от 3 до 7 мМ и в четвертом - 5 мМ фосфата натрия. В одном варианте реализации загрузочный буфер может содержать от 0,2 до 2,5 М NaCl, в другом - от 0,3 до 1,0 М NaCl и в третьем - 350 мМ NaCl. рН загрузочного буфера может лежать в пределах от 6,4 до 7,6. В одном варианте реализации изобретения рН может составлять от 6,5 до 7,0, а в другом - 6,8.
Контактирование препарата антитела с гидроксиапатитовой смолой в режиме связывания, в проточном режиме или в их комбинации можно производить в колонке с фильтрующим слоем, в колонке с псевдоожиженным/расширяющимся слоем, содержащим матрицу из твердой фазы, и/или простым периодическим способом, когда матрицу из твердой фазы смешивают с раствором в течение определенного времени.
После контактирования гидроксиапатитовой смолы с препаратом антитела можно провести факультативную операцию промывки. Однако в некоторых случаях, когда очень высокая чистота иммуноглобулина не является критичной или не требуется дополнительного проточного пропускания антитела, процедуру промывки можно опустить в целях сокращения технологического процесса и экономии промывного раствора. Используемые промывные буферы зависят от природы гидроксиапатитовой смолы, применяемого режима гидроксиапатитовой хроматографии и, следовательно, могут быть определены рядовым специалистом в данной области техники. В проточном режиме и в сочетании режима связывания и проточного режима поток очищенного антитела, полученный после возможной промывки колонки, можно объединить с другими фракциями очищенного антитела.
В режиме связывания антитело можно элюировать из колонки после факультативной операции промывки. Для элюирования антитела из колонки согласно настоящему изобретению используют фосфатный буфер с высокой ионной силой, содержащий примерно от 0,2 до 2,5 М NaCl при рН от слабокислотного до слабощелочного. Так, например, буфер для элюирования может содержать от 1 до 20 мМ фосфата натрия, в другом варианте - от 2 до 8 мМ фосфата натрия, в третьем варианте - от 2 до 6 мМ, в четвертом варианте - 3 мМ и в пятом варианте - 5 мМ фосфата натрия. Буфер для элюирования может содержать от 0,2 до 2,5 М NaCl, в одном варианте - от 0,2 до 1,5 М NaCl, в другом варианте - от 0,3 до 1,1 М NaCl, в третьем варианте - 1,0 М NaCl и в четвертом варианте - 0,35 М NaCl. рН буфера для элюирования может составлять от 6,4 до 7,6. В одном варианте реализации рН может составлять от 6,5 до 7,3, в другом варианте реализации - 7,3, в третьем варианте реализации - 7,2 и в четвертом варианте реализации - 6,8. Для элюирования антитела из колонки буфер для элюирования может изменяться с непрерывным или ступенчатым градиентом.
В режиме связывания, в проточном режиме и в их сочетании матрицу из твердой фазы можно очистить, т.е подвергнуть десорбционной обработке, и регенерировать после элюирования или пропускания антитела. Эту процедуру обычно проводят регулярно, чтобы минимизировать накопление загрязнений на поверхности твердой фазы и/или стерилизовать матрицу во избежание загрязнения продукта микроорганизмами.
Компоненты буфера можно корректировать в соответствии со знаниями рядовых специалистов в данной области техники. Пределы содержания компонентов и рН в примерах буферов для режима связывания, проточного режима и их комбинации приведены в таблице 1, таблице 2 и таблице 3 соответственно. Не все буферы или операции являются обязательными, но указаны только в качестве иллюстрации. Так, например, может оказаться необязательным использовать две отдельные операции уравновешивания, а также может быть необязательным десорбировать, регенерировать или сохранять гидроксиапатитовую смолу. Высокопродуктивный скрининг, описанный в примере 11, можно использовать для эффективной оптимизации параметров буфера для колоночной хроматографии с применением сНА.
В одном варианте реализации изобретения загрузку в смолу сНА можно производить при уровне загрузки ≤ 20 мг/мл и исходном содержании агрегатов в загрузке ≤ 40% HMWA. В некоторых других вариантах реализации изобретения можно использовать уровень загрузки от 1,8 до 10,4 мг/мл с исходным содержанием агрегатов в загрузке около 15%.
В еще одном варианте реализации изобретения смолу сНА загружают при уровне загрузки по меньшей мере 20 мг/мл и исходном содержании агрегатов в загрузке ≤ 40% HMWA. В некоторых других вариантах реализации изобретения можно использовать уровень загрузки от 30 до 40 мг/мл с исходным содержанием агрегатов в загрузке около 27%.
3. (4?) Дополнительные возможные операции
Установлено, что для отделения мономерных IgG от агрегатов гидроксиапатитовую хроматографию можно использовать отдельно, однако, как указано выше, способ очистки согласно изобретению можно использовать в сочетании с другими способами очистки белков. В одном из вариантов реализации изобретения одна или несколько операций, предшествующих гидроксиапатитовой хроматографии, могут оказаться желательными для снижения уровня загрузки загрязняющих веществ или примесей. В другом варианте реализации изобретения одна или несколько операций очистки после гидроксиапатитовой хроматографии могут оказаться желательными для дополнительного удаления загрязнений или примесей.
Описанную процедуру очистки с помощью сНА можно комбинировать с другими способами очистки, включая, в частности, но без ограничения, хроматографию с протеином А, аффинную хроматографию, хроматографию гидрофобного взаимодействия, аффинную хроматографию с иммобилизацией металла, эксклюзионную хроматографию, диафильтрацию, ультрафильтрацию, фильтрацию для удаления вирусов и/или ионообменную хроматографию.
В одном из вариантов реализации перед очисткой с помощью сНА можно предварительно очистить собранную среду, используя хроматографию с протеином А. Так, например, можно успешно применять PROSEP-A™ (Millipore, U.K.), который состоит из протеина А, ковалентно связанного со стеклом, имеющим контролируемую пористость. Другие полезные составы протеина А включают сефарозу протеина A FAST FLOW™ (Amersham Biosciences, Piscataway, NJ), TOYOPEARL™ 650M Protein A (TosoHaas Co., Philadelphia, PA) и колонки MABSELECT™ (Amersham Biosciences, Piscataway, NJ).
Перед очисткой с помощью сНА можно предварительно использовать ионообменную хроматографию. Для этого к матрице могут быть присоединены различные анионные или катионные заместители с целью получения анионных или катионных подложек для хроматографии. Анионные обменные заместители включают диэтиламиноэтил (DEAE), триэтиламиноэтилакриламид (ТМАЕ), четвертичный аминоэтил (QAE) и четвертичные аминные группы (Q). Катионные обменные заместители включают карбоксиметил (СМ), сульфоэтил (SE), сульфопропил (SP), фосфат (Р) и сульфонат (S). Whatman Ltd. Maidstone, Kent, U.K. поставляет целлюлозные ионообменные смолы, в частности DE23, DE32, DE52, СМ-23, СМ-32 и СМ-52. Известны также ионообменные соединения на основе сефандекса с поперечными связями. Так, например, DEAE-, QAE-, CM- и SP-сефандекс, DEAE-, QAE-, CM- и SP-сефарозу и сефарозу поставляет Amersham Biosciences, Piscataway, NJ. Кроме того, TosoHaas Co., Philadelphia, PA, поставляет производный DEAE и CM сополимер этиленгликоля и метакрилата, в частности TOYOPEARL™ DEAE-650S или М и TOYOPEARL™ CM-650S или М.
В одном варианте реализации изобретения ионообменную хроматографию можно использовать в режиме связывания или в проточном режиме.
В некоторых вариантах реализации изобретения сначала проводят хроматографию с протеином А, затем - ионообменную хроматографию и после этого хроматографию с сНА.
4. (5?) Удаление других загрязнений
Кроме удаления HMWA хроматография с применением сНА является полезной для удаления других загрязнений из препаратов антител. Другие загрязнения, которые могут быть удалены способами хроматографии с сНА согласно изобретению, включают, в частности, но без ограничения, ДНК, белок клетки-хозяина, адвентициальные вирусы и загрязнения протеина А, оставшиеся с предыдущих операций очистки.
В одном варианте реализации изобретение обеспечивает удаление протеина А из препарата антитела. В некоторых вариантах реализации настоящего изобретения содержание протеина А в конечном препарате можно существенно уменьшить, в частности, от 300 промилей до менее чем 1 промиль.
С. Примеры
Следующие примеры приведены исключительно в иллюстративных целях.
Пример 1: очистка анти-GDF-8 антитела
Способ очистки, описанный ниже, был разработан для моноклонального анти-GDF-8-антитела (называемого далее "Муо-29"). Антитело Муо-29 представляет собой антитело подтипа IgG1 и имеет pH примерно 8,1. Способ очистки включал три хроматографических операции (аффинная с протеином А, анионообменная и гидроксиапатитовая), операцию вирусной дезактивации и операцию ультрафильтрации/диафильтрации, обеспечивающую концентрирование и обменное введение продукта в конечный буфер. Все операции проводили при 18-25°С, за исключение хроматографии с протеином А, которая проходила при 2-8°С.
Процесс очистки можно нормализовать для любого масштаба. Указанные линейные скорости потока не зависят от диаметра колонки, а соотношения загрузки приведены в единицах массы на единицу объема. Хроматографию с протеином А можно циклически повторять несколько раз при одной загрузке, чтобы адаптировать различные величины титра клеточной культуры в биореакторе. Каждый цикл рассматривали как отдельную операцию и объединенный элюент сохраняли для следующего этапа очистки. Емкость хроматографии с протеином А составляла около 35 г Муо-29 на литр MabSelect. Последующие этапы процесса очистки (например, анионообменную хроматографию и хроматографию с керамическим гидроксиапатитом) адаптировали примерно для 15 г Муо-29 на литр анионообменной смолы и около 10 г Муо-29 на литр смолы с керамическим гидроксиапатитом.
1. Удаление клеток из культуры
Антитело Муо-29 выделили из клеток яичника китайского хомячка (Chinese Hamster Ovary, CHO) и вырастили при перемешивании в корпусном биореакторе объемом 2500 л. Для отбора жидкой культуры клетки удалили с помощью устройства для микрофильтрации Prostak (Millpore, Billerica, MA). Осветленную кондиционированную среду (clarified conditioning media, CCM) отобрали для первой хроматографической операции - хроматографии с протеином А.
2. Операция очистки с помощью аффинной хроматографии с протеином А
Колонку MabSelect объемом 17,7 л (диаметр 30 см, высота 25 см) со смолой рекомбинантного протеина A (Amersham Biosciences, Piscataway, NJ) уравновесили 5 объемами колонки уравновешивающего буфера (10 мМ трис-гидроксиметиламинометан, 100 мМ NaCl, рН 7,5). CCM ввели в колонку при скорости потока 2,5 см/мин и уровне загрузки 35 г Муо-29 на литр смолы. После загрузки колонки ее промыли 5 объемами колонки промывочного буфера с высоким содержанием соли (20 мМ трис, 1 М NaCl, рН 7,5), а затем 10 объемами колонки промывочного буфера с низким содержанием соли (10 мМ трис, 100 мМ NaCl, рН 7,5). Муо-29 элюировали введением 6 объемов колонки элюентного буфера (100 мМ аргинина, 50 мМ NaCl, рН 3,0). Затем выдержали объединенный элюат при рН 3,6±0,5 в течение 1,5±0,5 часа в качестве профилактической меры, способствующей дезактивации потенциальных адвентициальных вирусных загрязнений. После этого нейтрализовали объединенный элюат до рН 7,3 с помощью 2М буфера HEPES с рН 8,0, чтобы предотвратить разложение неустойчивых в кислой среде групп Муо-29.
Потоки, вытекающие из колонки, контролировали по нескольким параметрам, включая визуальный контроль поглощения ультрафиолетового излучения и хроматографических профилей электропроводности, а также извлечение продукта с помощью высокоэффективной жидкостной хроматографии с протеином А для титра загрузки и коэффициент поглощения при 280 нм для концентрации объединенного элюата.
Колонку десорбировали с помощью 6 М солянокислого гуанидина, а затем промыли десорбирующим промывным буфером (10 мМ трис, 100 мМ NaCl, pH 7,5). Колонку хранили в 16% этаноле.
3. Операция очистки с помощью анионообменной хроматографии
Элюат из колонки с протеином А подвергли дальнейшей очистке с помощью анионообменной хроматографии в 75-литровой колонке (диаметр 80 см × длина 15 см) со смолой Q SEPHAROSE FF (Amersham Biosciences, Piscataway, NJ). Колонку уравновесили 5 объемами колонки первого уравновешивающего буфера (20 мМ HEPES, 1000 мМ NaCl, pH 7,3), а затем 5 объемами колонки второго уравновешивающего буфера (100 мМ аргинина, 50 мМ NaCl, 100 мМ HEPES, pH 7,3). Элюат колонки с протеином А ввели в уравновешенную колонку при скорости потока 2,5 см/мин и отношении загрузки 15 г Муо-29 на литр смолы. После загрузки колонку промыли 5 объемами колонки второго уравновешивающего буфера. Отобрали поток из анионообменной колонки.
Отобранный поток из анионообменной колонки контролировали по нескольким параметрам, включая визуальный контроль поглощения ультрафиолетового излучения и хроматографических профилей электропроводности, а также извлечение продукта, используя поглощение излучения при 280 нм.
Анионообменную колонку десорбировали десорбционным буфером (20 мМ HEPES, 1 М NaCl, pH 7,3) и регенерировали регенерационным буфером (500 мМ NaOH, 1 М NaCl, pH 13,3). Колонку хранили в 0,01 М NaOH.
4. Отделение вирусов фильтрацией
Задача данной факультативной операции состоит в удалении ретровирусоподобных частиц, которые могут присутствовать в культуре клеток СНО, и обеспечении дополнительной надежности за счет удаления потенциальных адвентициальных вирусных загрязнений. Поток из анионообменной колонки отобрали и пропустили через одноразовый фильтр 35 нм Planova (Asahi-Kasel Corp., New York, NY). Оставшийся в модуле продукт извлекли путем пропускания через устройство промывочного буфера (100 мМ аргинина, 50 мМ NaCl, 100 мМ HEPES, рН 7,3) из анионообменной колонки.
Извлечение продукта после отделения вирусов фильтрацией оценили с помощью поглощения излучения при 280 нм и анализа объединенного фильтрата Planova методом электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) по сравнению с историческими данными указанных параметров.
5. Операция очистки способом хроматографии с применением сНА
После отделения вирусов с помощью фильтрации раствор подвергли дальнейшей очистке в гидроксиапатитовой колонке (60 см × 20 см), загруженной смолой сНА типа II с размером частиц 40 мкм (BioRad, Hercules, CA). Колонку уравновесили 3 объемами колонки уравновешивающего буфера 1 (0,3 М фосфата натрия, 1,0 М NaCl, рН 6,8). Второй этап уравновешивания провели с 4 объемами колонки уравновешивающего буфера 2 (5 мМ фосфата натрия, 50 мМ NaCl, рН 7,2). Частично очищенную среду загрузили в смолу в загрузочном буфере (10 мМ фосфата натрия, рН 7,2) в отношении 1:1 (по объему) при скорости потока 2,5 см/мин. Колонку с сНА промыли 3 объемами колонки промывного буфера (5 мМ фосфата натрия, рН 7,2). Антитело Муо-29 элюировали из смолы сНА с помощью 6 объемов колонки элюентного буфера (5 мМ фосфата натрия, 350 мМ NaCl, рН 6,8).
Операцию очистки с помощью сНА контролировали визуально по поглощению ультрафиолетового излучения и по хроматографическим профилям электропроводности, извлечение продукта - по поглощению излучения при 280 нм, удаление HMWA - по анализу способом эксклюзионной хроматографии (size exclusion chromatography, SEC), а удаление протеина А - с помощью конкурентного иммуноферментного твердофазного анализа (enzyme linked immunosorbent assay, ELISA).
Колонку с сНА десорбировали десорбционным буфером (0,3 М фосфата натрия, 1,0 М NaCl, pH 6,8) и регенерировали регенерационным буфером (0,5 М фосфата калия, 1,0 М NaOH, pH 13,3). Хранение колонки осуществляли в 0,02 М NaOH. Как показано в таблице 4, хроматография с применением сНА эффективно удаляет загрязнения HMWA из препаратов антител. Кроме того, хроматография с сНА способна удалять другие загрязнения, в частности протеин А.
6. Ультрафильтрация/диафильтрация и окончательная фильтрация
Объединенный продукт из колонки с сНА пропустили через тангенциальную проточную систему ультрафильтрации с использованием 2 кассет PLCTK Pellicon (Millipore, Billerica, MA), содержащих композитную мембрану из регенерированной целлюлозы с номинальным пределом молекулярной массы 30000. Задачи этой операции состояли в том, чтобы сконцентрировать и произвести буферный обмен объединенного продукта из колонки с сНА в препаративный буфер. Объединенный продукт из колонки с сНА ввели в 50% раствор сахарозы (масса/объем), чтобы довести концентрацию сахарозы до 2%. Антитело Муо-29 сконцентрировали примерно до 20 гл-1, а затем подвергли диафильтрации с использованием примерно ≥ 9 промывных объемов препаративного буфера (0,1 М L-гистидина, 2% сахарозы, pH 6,0). После окончания диафильтрации продукт дополнительно сконцентрировали примерно до 60 гл-1, извлекли из аппарата самотеком с обдувом воздуха, а затем промыли каналы подачи ультраконцентрата препаративным буфером. Необходимая концентрация Муо-29 в лекарственных веществах ≥ 25 г/л.
Лекарственное вещество Муо-29 окончательно профильтровали через фильтр 0,22 микрона, уравновесили препаративным буфером (0,1 М L-гистидина, 2% сахарозы, рН 6,0), отобрали аликвоты в бутыли и хранили при -80°С.
Пример 2: очистка с сНА препарата анти-GDF-8-антитела при помощи смолы типа I
Антитело Муо-29 также успешно очистили с помощью смолы сНА типа I с размером частиц 40 мкм, загруженной в колонку объемом 3,1 л. Колонку уравновесили 3 объемами колонки уравновешивающего буфера 1 (0,3 М фосфата натрия, 1,0 М NaCl, рН 6,8). Второй этап уравновешивания провели с 4 объемами колонки уравновешивающего буфера 2 (5 мМ фосфата натрия, 50 мМ NaCl, рН 7,2). Частично очищенную среду с операции анионообменной очистки загрузили в смолу при уровне загрузки 35 мг/мл и скорости потока 1,5 см/мин. Колонку сНА промыли 3 объемами колонки промывного буфера (5 мМ фосфата натрия, 50 мМ NaCl, рН 7,2). Антитело Муо-29 элюировали из смолы сНА с помощью 6 объемов колонки элюентного буфера (3 мМ фосфата натрия, 1,0 М NaCl, рН 7,2).
Колонку с сНА десорбировали десорбционным буфером (0,3 М фосфата натрия, 1,0 М NaCl, рН 6,8) и регенерировали регенерационным буфером (0,5 М фосфата калия, 1,0 М NaOH, рН 13,3). Хранение колонки осуществляли в 0,02 М NaOH.
Операцию очистки с сНА контролировали визуально по поглощению ультрафиолетового излучения и по хроматографическим профилям электропроводности, извлечение продукта - по поглощению излучения при 280 нм, удаление HMWA - по анализу способом эксклюзионной хроматографии (size exclusion chromatography, SEC), а удаление протеина А - с помощью конкурентного иммуноферментного твердофазного анализа (enzyme linked immunosorbent assay, ELISA). Как показано в таблице 5, очистка с сНА с помощью смолы типа I позволяет уменьшить процентное содержание HMWA с 27% до 9% в первом цикле и далее уменьшить процентное содержание HMWA до 0,6% во втором цикле. Кроме того, смола типа I приспособлена для более высокого уровня загрузки, чем смола типа II, и обеспечивает при этом достаточный выход мономера. И, наконец, очистка с сНА с помощью смолы типа I позволяет уменьшить содержание загрязнения протеина А.
Пример 3: очистка с сНА препарата анти-CD22-антитела и препарата анти-Abeta-антитела при помощи смолы типа I
Способ очистки с сНА, описанный в примере 2, позволяет также эффективно удалять HMWA из препаратов анти-CD22-антитела и анти-Abeta-антитела. Применявшийся способ аналогичен описанному в примере 2, с тем исключением, что очищенный мономер антитела элюировали с градиентом 15 объемами колонки элюентного буфера (3 мМ фосфата натрия, 1,5 М NaCl, pH 7,2).
Как показано в таблице 6, очистка с помощью смолы сНА типа I позволяет уменьшить процентное содержание HMWA в препарате анти-CD22-антитела до 0,5%, а в препарате анти-Abeta-антитела - ниже предела обнаружения. Кроме того, очистка с применением сНА позволяет удалить загрязнения протеина А из препарата антитела.
Пример 4: Очистка анти-GDF-8-антитела с помощью сНА в проточном режиме
Антитело Муо-29 также успешно очистили, используя протокол очистки с помощью сНА в проточном режиме. В колонку Vantage 1,6 × 20 см (Millipore, Billerica, MA) загрузили 200 мМ двухосновного фосфата натрия, рН 9,0 с использованием керамической гидроксиапатитовой смолы Macro-Prep, тип II (BioRad, Hercules, СА) с размером частиц 40 мкм. Колонку уравновесили 3 объемами колонки уравновешивающего буфера 1 (300 мМ фосфата натрия, 1,0 М NaCl, рН 6,8) и 3 объемами колонки уравновешивающего буфера 2 (350 мМ NaCl, 5 мМ фосфата натрия, рН 6,8).** Препарат антитела Муо-29 в результате буферного обмена ввели в загрузочный буфер, содержащий 350 мМ NaCl, 5 мМ фосфата натрия, рН 6,8, а затем загрузили в колонку с сНА. Колонку промыли промывным буфером (350 мМ NaCl, 5 мМ фосфата натрия, рН 6,8), десорбировали десорбционным буфером (300 фосфата натрия, 1,0 М NaCl, рН 6,8) и регенерировали регенерационным буфером (500 мМ фосфата калия, 1,0 М NaOH, рН 13,3). Все скорости потоков поддерживали на уровне 2,5-3 см/мин. Выходные потоки из колонки анализировали способом эксклюзионной хроматографии, используя систему высокоэффективной жидкостной хроматографии.
Обобщенные результаты извлечения Муо-29 и удаления HMWA из препарата антитела представлены в таблице 7. В исходном состоянии препарат содержал 14,4% HMWA (загрузка). С помощью способа очистки с применением сНА согласно изобретению содержание HMWA снизили до 0,2% (проток).
Пример 5: Очистка анти-GDF-6-антитела с сНА с помощью смолы типа I в проточном режиме
В колонку Vantage 1,1×21 см (Millipore, Billerica, MA) с керамической гидроксиапатитовой смолой Macro-Prep, тип I (BioRad, Hercules, CA) с размером частиц 40 мкм загрузили 200 мМ двухосновного фосфата натрия, рН 9,0. Колонку уравновесили 3 объемами колонки уравновешивающего буфера 1 (300 мМ фосфата натрия, 1,0 М NaCl, рН 6,8) и 3 объемами колонки уравновешивающего буфера 2 (1,0 М NaCl, 3 мМ фосфата натрия, рН 7,2). Препарат антитела Муо-29 с помощью буферного обмена ввели в загрузочный буфер, содержащий 1,0 мМ NaCl, 3 мМ фосфата натрия, рН 7,2, а затем загрузили в колонку с сНА при уровне загрузки 26 мг/мл. Колонку промыли промывным буфером (1,0 М NaCl, 3 мМ фосфата натрия, рН 7,2), десорбировали десорбционным буфером (300 мМ фосфата натрия, 1,0 М NaCl, рН 6,8), а затем регенерировали 5 объемами колонки регенерационного буфера (500 мМ фосфата калия, 1,0 М NaOH, рН 13,3). Скорости потоков поддерживали на уровне менее 90 см/час для загрузки и промывки и менее 240 см/час для остального процесса очистки. Выходные потоки анализировали способом эксклюзионной хроматографии, используя систему высокоэффективной жидкостной хроматографии.
В исходном состоянии препарат содержал 27,2% HMWA (загрузка), эту величину снизили до 6,1% (проток). Извлечение мономера антитела составило 72%.
Пример 6: очистка препарата анти-CD22-антитела с помощью сНА
Способ хроматографической очистки с помощью керамического гидроксиапатита также оказался полезным для очистки препарата анти-CD22-антитела. В колонку Vantage 1,6×20 см (Millipore, Billerica, MA) с керамической гидроксиапатитовой смолой Macro-Prep, тип II (BioRad, Hercules, CA) с размером частиц 40 мкм загрузили 200 мМ двухосновного фосфата натрия, рН 9,0. Колонку уравновесили 3 объемами колонки уравновешивающего буфера 1 (300 мМ фосфата натрия, 1,0 М NaCl, pH 6,8) и 3 объемами колонки уравновешивающего буфера 2 (50 мМ NaCl, 5 мМ фосфата натрия, рН 6,8). Препарат анти-CD22-антитела в результате буферного обмена ввели в 50 мМ NaCl, 5 мМ фосфата натрия, рН 6,8 и загрузили в колонку с сНА. Колонку промыли 3 объемами колонки промывного буфера (50 мМ NaCl, 5 мМ фосфата натрия, рН 6,8), а затем элюировали с градиентом 15 объемами колонки состава, содержащего 5 мМ фосфата натрия, 1,0 М NaCl, рН 6,8. После этого колонку десорбировали десорбционным буфером (300 фосфата натрия, 1,0 М NaCl, рН 6,8) и регенерировали регенерационным буфером (500 мМ фосфата калия, 1,0 М NaOH). Все скорости потоков поддерживали на уровне 2,5-3 см/мин. Выходные потоки из колонки анализировали способом эксклюзионной хроматографии, используя систему высокоэффективной жидкостной хроматографии.
Как показано на фигуре 3, очистка с помощью сНА успешно удаляет HMWA из препарата анти-CD22-антитела. Содержание HMWA в загрузке составляло 1,7%, а в элюате сНА 0,0%.
Пример 7: очистка препарата анти-Abeta-антитела с помощью сНА
Способ хроматографической очистки с помощью керамического гидроксиапатита также оказался полезным для очистки препарата анти-Abeta-антитела. В колонку Vantage 1,6×20 см (Millipore) с керамической гидроксиапатитовой смолой Macro-Prep, тип II (BioRad, Hercules, CA) с размером частиц 40 мкм загрузили 200 мМ двухосновного фосфата натрия, рН 9,0. Колонку уравновесили 3 объемами колонки уравновешивающего буфера 1 (300 мМ фосфата натрия, 1,0 М NaCl, рН 6,8) и 5 объемами колонки уравновешивающего буфера 2 (50 мМ NaCl, 5 мМ фосфата натрия, рН 6,8). Препарат анти-Abeta-антитела с помощью буферного обмена ввели в 50 мМ NaCl, 5 мМ фосфата натрия, рН 6,8 и загрузили в колонку. Колонку промыли 5 объемами колонки промывного буфера (50 мМ NaCl, 5 мМ фосфата натрия, рН 6,8), а затем элюировали с градиентом 15 объемами колонки состава, содержащего 5 мМ фосфата натрия, 1,0 М NaCl, рН 6,8. После этого колонку десорбировали десорбционным буфером (300 мМ фосфата натрия, 1,0 М NaCl, рН 6,8) и регенерировали регенерационным буфером (500 мМ фосфата калия, 1,0 М NaOH). Все скорости потоков поддерживали на уровне 2,5-3 см/мин. Выходные потоки из колонки анализировали способом эксклюзионной хроматографии, используя систему высокоэффективной жидкостной хроматографии.
Как показано на фигуре 4, очистка с помощью сНА успешно удаляет HMWA из препарата анти-Abeta-антитела. Содержание HMWA в загрузке составляло 2,6%, а в элюате сНА 0,0%.
Пример 8: определение активности очищенного антитела Муо-29
Связующую активность Муо-29, анти-GDF-8-антитела, очищенного способом, описанным в примере 1, анализировали с помощью конкурентного иммуноферментного твердофазного анализа (enzyme linked immunosorbent assay, ELISA). Конкурентный ELISA можно также адаптировать для определения связующей активности других очищенных антител. См., например, Antibodies: A Laboratory Manual, Harlowand Land (eds.), 1988, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y. Рецептор GDF-8 ActRIIβ.Fc (2 мкг/мл) адсорбировали на микротировальный планшет с 96 лунками в объеме 100 мкл/лунка. Затем планшет инкубировали в течение ночи при температуре 2-8°С. После этого планшет дважды промыли промывным буфером (50 мМ трис-HCl, рН 8,0, 0,05 Tween 20) и заблокировали 4% раствором альбумина сыворотки крупного рогатого скота (bovine serum albumin, BSA), чтобы минимизировать неспецифическое связывание. Затем планшет инкубировали при комнатной температуре в течение 1,5-3,0 часов и дважды промыли промывным буфером (50 мМ трис-HCl, рН 8,0, 0,05% Tween 20).
Путем последовательного 4-кратного разбавления стандартного образца антитела Муо-29 аналитическим разбавителем (0,5% BSA, 137 мМ NaCl, 2,7 мМ KCl) получили 8 стандартных точек. Контрольные образцы, содержащие фракции антитела Муо-29, очистили с помощью хроматографии с протеином А, а фракции очистили с помощью дополнительной операции очистки с сНА. Эти контрольные образцы также последовательно двукратно разбавили аналитическим разбавителем, получив 8 точек, которые лежали в диапазоне стандартной кривой. Стандарты и контрольные образцы добавили в соответствующие аналитические лунки в количестве 50 мкл/лунка. Затем в каждую лунку добавили по 50 мкл биотинилированного конкурента - GDF-8, меченного биотином (50 нг/мл). Планшет инкубировали в течение ночи на встряхивающем устройстве при комнатной температуре.
Четыре раза промыли планшет промывным буфером (50 мМ трис-HCl, рН 8,0, 0,05% Tween 20) и определили связанный, меченный биотином GDF-8 с помощью добавления 100 мкл/лунка пероксидазы хрена конъюгированной со стрептавидином (1:5000; Southern Biotech, Birmingham, Alabama). Планшет инкубировали в течение 50-70 минут на встряхивающем устройстве при комнатной температуре, а затем проявили добавлением 100 мкл/лунка 3,3'5,5'-тетраметилбензидина (BioFX, Owings Mills, MD). Оптическую плотность в каждой лунке определяли при 450 нм с помощью планшет-ридера для ELISA (Molecular Devices, Sunnyvale, CA). Содержание активного Муо-29 в контрольном образце косвенно пропорционально сигналу, вырабатываемому при анализе. Реакцию останавливали добавлением 100 мкл/лунка 0,18 М H2SO4.
Концентрацию Муо-29, способную связывать биотинилированный GDF-8 в контрольных образцах, интерполировали со стандартной кривой, которую построили с помощью логистического уравнения с 4-мя параметрами. Затем рассчитали величину биоактивности (% активного белка) контрольного образца путем деления концентрации активного белка (определенной способом ELISA) на общую концентрацию белка (определенную по А280) и умножения полученной величины на 100. Если один и тот же образец подвергали очистке в отдельных загрузках, то рассчитывали среднюю величину биологической активности. Результаты определения величины биоактивности представлены в таблице 8.
Как показано в таблице 8, Муо-29 сохраняет способность связывать GDF-8 после очистки способом, описанным в примере 1. Связующая активность очищенного Муо-29 несколько ниже в пиковых фракциях элюента при очистке с протеином А. Однако после операции дополнительной очистки с помощью сНА, описанной в примере 1, связующая активность становится большей, чем в случае стандартного образца антитела Муо-29.
Пример 9: сочетание режима связывания и проточного режима очистки анти-GDF-8-антитела
Способ хроматографической очистки с помощью керамического гидроксиапатита в сочетании режима связывания и проточного режима также оказался полезным для очистки препарата анти-GDF-8-антитела. Описанный ниже эксперимент проводили с помощью системы ÄКТА FPLC (General Electric). В колонку Vantage 1,1×21 см (Millipore) с керамической гидроксиапатитовой смолой Macro-Prep, тип II (BioRad, Hercules, СА) с размером частиц 40 мкм загрузили 200 мМ двухосновного фосфата натрия, рН 9,0. Колонку уравновесили 3 объемами колонки уравновешивающего буфера 1 (300 мМ фосфата натрия, 1,0 М NaCl, pH 6,8) и 5 объемами колонки уравновешивающего буфера 2 (50 мМ NaCl, 2,0 мМ фосфата натрия, 100 мМ аргинина, 100 мМ HEPES, рН 7,3). Препарат анти-GDF-8-антитела загрузили в колонку при уровне загрузки 20 мг/мл. Колонку промыли уравновешивающим буфером 2, десорбировали десорбционным буфером (300 мМ фосфата натрия, 1,0 М NaCl, рН 6,8) и регенерировали регенерационным буфером (500 мМ фосфата калия, 1,0 М NaOH, рН 13,3). Скорость потока при загрузке и промывке составляла 1,5 см/мин. Остальные скорости потоков в процессе очистки поддерживали на уровне 2,5-3,0 см/мин. Выходные потоки из колонки анализировали способом SEC, используя систему высокоэффективной жидкостной хроматографии.
Результаты показали, что применение смолы сНА типа II при сочетании режима связывания и проточного режима является эффективным для удаления HMWA из препаратов антитела. В исходном состоянии препарат содержал 27% HMWA (загрузка), с помощью способа очистки с применением сНА согласно изобретению эту величину снизили до 1,1% (проток).
Пример 10: сочетание режима связывания и проточного режима очистки с сНА анти-GDF-8-антитела с применением смолы типа I
Процедуру, описанную в примере 9, повторили с применением смолы типа I вместо смолы типа II. Буферы были идентичными описанным в примере 9, за исключением уравновешивающего буфера 2, который состоял из 5,0 мМ фосфата натрия, 100 мМ NaCl, 120 мМ аргинина, 20 мМ HEPES при рН 7,3.
Как показано в таблице 9, применение смолы сНА типа I при сочетании режима связывания и проточного режима является эффективным для удаления HMWA из препаратов антитела при сохранении выходов мономера антитела. Кроме того, сочетание режима связывания и проточного режима эффективно для удаления загрязнений протеина А. И, наконец, смола сНА типа I позволяет увеличивать уровень загрузки до 55 мг/мл.
Пример 11: высокопродуктивный скрининг буферов, применяемых с сНА
Провели высокопродуктивный скрининг для оптимизации буферов, применяемых совместно со смолой сНА типа I для очистки препарата антитела Муо-29. При скрининге изменяли содержание фосфата натрия, хлорида натрия, аргинина и Муо-29 на смоле сНА типа I и контролировали степень связывания Муо-29 и агрегата с высокой молекулярной массой (HMWA) со смолой.
Смолу сНА типа I добавили во все 96 лунок фильтровального планшета. Каждую лунку, обозначенную в таблицах 10-12 как А1, А2… Н1, Н12, уравновесили уравновешивающим буфером, содержащим 20 мМ HEPES с рН 7.2 и индивидуальную комбинацию фосфата (таблица 10), хлорида натрия (таблица 11) и аргинина (таблица 12).
После добавления индивидуального уравновешивающего буфера в каждую лунку добавили также смесь Муо-29 и агрегата. Содержание агрегата в загрузке составляло 25%. Содержание компонентов буфера поддерживали на том же уровне, что и во время уравновешивания. Материал встряхивали в течение 20 минут, чтобы обеспечить уравновешивание. Удалили надосадочный слой из каждой лунки фильтровального планшета. Добавили вторую порцию препарата антитела, встряхивали планшет и удалили надосадочный слой. Повторили эту операцию для семи порций. Анализировали белок, который не был связан в каждой порции, чтобы определить общую концентрацию белка (по поглощению излучения при А280 нм). Содержание мономера и агрегата измеряли с помощью эксклюзионной ВЭЖХ. Уменьшение содержания агрегата указывало на состояние, благоприятное для очистки. В таблицах 13 и 14 показано процентное содержание агрегата и мономера в одной лунке для объединенных первых четырех порций.
Высокопродуктивный скрининг позволяет качественно прогнозировать извлечение мономера и удаление HMWA в системе очистки с помощью колонки. Так, например, испытали состав из лунки С8 (20 мМ HEPES, 1 мМ фосфата, 1750 мМ NaCl и 12 мМ аргинина, рН 7,2) в колонке, загруженной смолой сНА типа I. После очистки в колонке содержание агрегатов снизилось до 2,5%, а выход мономера составил 72%. Состав лунки D5 (20 мМ HEPES, 5 мМ фосфата, 100 мМ NaCl и 120 мМ аргинина, рН 7,2) также испытали в колонке, загруженной смолой сНА-1. После очистки в колонке содержание агрегатов снизилось до 0,7%, а выход мономера составил 73%. И, наконец, состав, эквивалентный лунке С3 (100 мМ HEPES, 1 мМ фосфата, 120 мМ NaCl и 200 мМ аргинина, рН 7,2, где высокое содержание HEPES вносит ионную силу аналогично NaCl) испытали в колонке, загруженной смолой сНА-1. После очистки в колонке содержание агрегатов снизилось до 4%, а выход мономера составил 69%. Эти результаты показывают, что высокопродуктивный скрининг дает заниженные результаты эффективности очистки в колонке по извлечению мономера и удалению HMWA. Однако высокопродуктивный скрининг позволяет качественно прогнозировать как выход, так и чистоту продукта.
Все упоминаемые здесь ссылки включены в данное описание в такой же степени и во всех целях, как если бы для отдельной публикации, патента или патентной заявки было специально и отдельно указано, что они полностью включаются в это описание в качестве ссылки в любых целях. Если публикации, патенты или патентные заявки, включенные в качестве ссылки, противоречат содержанию данного описания, то описание имеет приоритет или предпочтение перед любыми указанными материалами.
Все числа, выражающие количества ингредиентов, условий реакции и т.п., приведенные в описании и формуле изобретения, следует понимать как модифицируемые во всех случаях термином "примерно". В соответствии с этим, если не указано иного, числовые параметры, указанные в описании и прилагаемой формуле изобретения, представляют собой аппроксимации, которые могут изменяться в зависимости от желаемых результатов реализации изобретения. В самой меньшей степени, но без ограничения области распространения формулы изобретения, каждый числовой параметр следует истолковывать в свете числа, состоящего из значимых цифр с обычными правилами округления.
Для специалистов в данной области техники очевидно множество модификаций и вариаций, которые можно реализовать без отклонения от сути и области распространения изобретения. Конкретные варианты реализации, указанные в данном описании, приведены только в качестве примеров и не являются ограничением изобретения в какой-либо степени. Предполагается, что данное описание и примеры подлежат рассмотрению только в иллюстративных целях, в то время как истинная область распространения и суть изобретения указаны в прилагаемой формуле.
| название | год | авторы | номер документа |
|---|---|---|---|
| УДАЛЕНИЕ АГРЕГАТОВ С ВЫСОКОЙ МОЛЕКУЛЯРНОЙ МАССОЙ ПУТЕМ ХРОМАТОГРАФИИ НА ГИДРОКСИАПАТИТАХ | 2010 |
|
RU2573910C2 |
| СПОСОБЫ ОЧИСТКИ ОДНОДОМЕННЫХ АНТИГЕНСВЯЗЫВАЮЩИХ МОЛЕКУЛ | 2009 |
|
RU2553214C2 |
| СПОСОБЫ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ЭТАПОВ ОЧИСТКИ БЕЛКА, НАХОДЯЩИХСЯ НИЖЕ ПО ПОТОКУ, С ИСПОЛЬЗОВАНИЕМ МЕМБРАННОЙ ИОНООБМЕННОЙ ХРОМАТОГРАФИИ | 2012 |
|
RU2648999C2 |
| ОЧИСТКА АНТИТЕЛ С ПОМОЩЬЮ КАТИОНООБМЕННОЙ ХРОМАТОГРАФИИ | 2008 |
|
RU2498991C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ОЧИЩЕННЫЕ РЕКОМБИНАНТНЫЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2671481C2 |
| ПРЕПАРАТ АНТИТЕЛА, ОБОГАЩЕННОГО ИЗОФОРМАМИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2586515C2 |
| СПОСОБ ХРОМАТОГРАФИИ В РЕЖИМЕ СЛАБОГО РАСПРЕДЕЛЕНИЯ | 2006 |
|
RU2457214C2 |
| СПОСОБ ОЧИСТКИ ВИТАМИН К-ЗАВИСИМЫХ БЕЛКОВ, ТАКИХ КАК КОАГУЛЯЦИОННЫЙ ФАКТОР IX | 2011 |
|
RU2590726C2 |
| СПОСОБ ОЧИСТКИ ВИТАМИН К-ЗАВИСИМЫХ БЕЛКОВ, ТАКИХ КАК КОАГУЛЯЦИОННЫЙ ФАКТОР VII | 2011 |
|
RU2731720C2 |
| КОМПОЗИЦИИ И СПОСОБЫ НА ОСНОВЕ DAC HYP | 2012 |
|
RU2661764C2 |
Изобретение относится к области биотехнологии. Способ выделения мономерного антитела из состава, содержащего агрегаты антител с высокой молекулярной массой, предусматривает контактирование состава с гидроксиапатитовой смолой и элюирование очищенного антитела из смолы. Раскрыты также варианты такого способа, предусматривающие проведение для состава аффинной хроматографии с белком А, ионообменной хроматографии и гидроксиапатитовой хроматографии. Способы позволяют получать состав, в котором содержание агрегатов антител с высокой молекуляной массой снижено до 1%. 6 н. и 17 з.п. ф-лы, 4 ил., 14 табл.
1. Способ выделения по меньшей мере одного мономерного антитела из состава, содержащего агрегаты антител с высокой молекулярной массой, включающий
а) контактирование указанного состава с гидроксиапатитовой смолой и элюирование очищенного антитела из смолы по меньшей мере одним элюентным буфером, содержащим от 1 до 20 мМ фосфата высокой ионной силы и от 0,2 до 2,5 М NaCl.
2. Способ выделения по меньшей мере одного мономерного антитела из состава, содержащего агрегаты антител с высокой молекулярной массой, включающий проведение для состава (а) аффинной хроматографии с белком А, (б) ионообменной хроматографии и (в) гидроксиапатитовой хроматографии,
при этом на этапе (в) мономерное антитело элюируют из гидроксиапатитовой смолы с помощью элюентного буфера, содержащего от 1 до 20 мМ фосфата высокой ионной силы и от 0,2 до 2,5 М NaCl.
3. Способ по п.2, отличающийся тем, что афинную хроматографию с белком А производят вначале, а гидроксиапатитовую хроматографию - в конце.
4. Способ выделения по меньшей мере одного мономерного антитела из состава, содержащего агрегаты антител с высокой молекулярной массой, включающий
а) контактирование состава с подложкой из белка А,
б) адсорбцию антитела на подложке из белка А,
в) промывание подложки из белка А и адсорбированного антитела по меньшей мере одним промывным буфером для белка А,
г) элюирование адсорбированного антитела по меньшей мере одним элюентным буфером для белка А,
д) контактирование элюата белка А с ионообменной подложкой,
е) пропускание антитела через ионообменную подложку,
ж) промывание ионообменной подложки по меньшей мере одним
ионообменным промывным буфером,
з) контактирование ионообменного смыва с гидроксиапатитовой смолой,
и) адсорбцию антитела на смоле,
к) промывание смолы по меньшей мере одним промывным буфером для гидроксиапатита,
л) элюирование очищенного антитела из смолы по меньшей мере одним элюентным буфером для гидроксиапатита, содержащим от 1 до 20 мМ фосфата высокой ионной силы и от 0,2 до 2,5 М NaCl.
5. Способ выделения по меньшей мере одного мономерного антитела из состава антитела, содержащего агрегаты антител с высокой молекулярной массой, включающий
а) уравновешивание гидроксиапатитовой смолы по меньшей мере одним уравновешивающим буфером, содержащим от 1 до 20 мМ фосфата высокой ионной силы и от 0,01 до 2,0 М NaCl,
б) контактирование состава с указанной гидроксиапатитовой смолой в условиях, при которых возможно связывание как мономерных антител так и агрегатов антител с высокой молекулярной массой,
в) обеспечение более прочного связывания агрегатов с высокой молекулярной массой, чем мономерных антител и по мере продолжения загрузки обеспечение вытеснения связанных мономерных антител агрегатами антител с высокой молекулярной массой, и
г) сбор указанного вытесненного мономерного антитела.
6. Способ по п.5, отличающийся тем, что загрузочный буфер имеет рН в диапазоне от 6,4 до 7,6, предпочтительно рН от 6,8 до 7,2.
7. Способ выделения по меньшей мере одного мономерного антитела из состава, содержащего агрегаты антител с высокой молекулярной массой, включающий проведение для состава (а) аффинной хроматографии с белком А, (б) ионообменной хроматографии и (в) гидроксиапатитовой хроматографии, согласно которому
1) уравновешивают гидроксиапатитовую смолу с помощью по меньшей мере одного уравновешивающего буфера, содержащего от 1 до 20 мМ фосфата высокой ионной силы и от 0,01 до 2,0 М NaCl,
2) осуществляют контакт состава с указанной гидроксиапатитовой смолой в условиях, в которых происходит связывание как мономерных антител так и агрегатов антител с высокой молекулярной массой,
3) обеспечивают более прочное связывание агрегатов с высокой молекулярной массой, чем мономерных антител и по мере продолжения загрузки обеспечивают вытеснение связанного мономерного антитела агрегатами с высокой молекулярной массой, и
4) сбор указанные вытесненные мономерных антител.
8. Способ выделения по меньшей мере одного мономерного антитела из состава, содержащего агрегаты антител с высокой молекулярной массой, включающий
а) контактирование состава с подложкой из белка А,
б) адсорбцию антитела на подложке из белка А,
в) промывку подложки из белка А и адсорбированного антитела по меньшей мере одним промывным буфером для белка А,
г) элюирование адсорбированного антитела по меньшей мере одним элюентным буфером для белка А,
д) контактирование элюата белка А с ионообменной подложкой, е) пропускание антитела через ионообменную подложку,
ж) промывку ионообменной подложки по меньшей мере одним ионообменным промывным буфером,
з) уравновешивание гидроксиапатитовой смолы по меньшей мере одним уравновешивающим буфером, содержащим 1 до 20 мМ фосфата высокой ионной силы и от 0,01 до 2,0 М NaCl,
и) контактирование ионообменного смыва с указанной гидроксиапатитовой смолой в условиях, в которых происходит связывание как мономерного антитела, так и агрегатов антител с высокой молекулярной массой,
к) обеспечение более прочного связывания агрегатов с высокой молекулярной массой, чем мономерных антител и по мере продолжения загрузки обеспечение вытеснения связанного мономерного антитела агрегатами с высокой молекулярной массой,
л) промывание смолы по меньшей мере одним промывным буфером для гидроксиапатита,
м) сбор указанного вытесненного мономерного антитела.
9. Способ по любому из пп.1-8, отличающийся тем, что элюентный буфер или загрузочный буфер имеют рН от 6,4 до 7,6, предпочтительно рН от 6,8 до 7,2.
10. Способ по любому из пп.1-8, отличающийся тем, что элюентный буфер содержит 3 мМ или 5 мМ фосфата высокой ионной силы.
11. Способ по любому из пп.1-8, отличающийся тем, что элюентный буфер содержит 1 М или 0,35 М NaCl.
12. Способ по любому из пп.1-8, отличающийся тем, что антитело представляет собой антитело IgG, IgA, IgD, IgE или IgM.
13. Способ по любому из пп.1-8, отличающийся тем, что антитело является моноклональным, поликлональным, химерным, гуманизированным или их фрагментом.
14. Способ по любому из пп.1-8, отличающийся тем, что антитело представляет собой рецетор анти-IL-21, анти-GDF-8, анти-Abeta, анти-CD-22, анти-Lewis Y, анти-IL-13 или анти-IL-22-антитело.
15. Способ по любому из пп.1-8, отличающийся тем, что антитело имеет основной рI.
16. Способ по любому из пп.1-8, отличающийся тем, что смола представляет собой керамический гидроксиапатит типа I или типа II.
17. Способ по любому из пп.2, 3, 7 и 8, отличающийся тем, что ионообменная хроматография представляет собой анионообменную хроматографию.
18. Способ по любому из пп.4 или 8, отличающийся тем, что включает дополнительно фильтрацию ионообменного смыва перед нанесением на гидроксиапатитовую смолу, что снижает содержание вирусных загрязнителей.
19. Способ по любому из пп.4 или 8, отличающийся тем, что включает дополнительно по меньшей мере одну ультрафильтрацию или диафильтрацию смыва, пропущенного через гидроксиапатит.
20. Способ по любому из пп.7-8, отличающийся тем, что уравновешивающий буфер имеет рН от 6,2 до 8,0, предпочтительно рН 7,3.
21. Способ по любому из пп.7-8, отличающийся тем, что уравновешивающий буфер содержит 3 мМ или 5 мМ фосфата высокой ионной силой.
22. Способ по любому из пп.7-8, отличающийся тем, что уравновешивающий буфер содержит 50 мМ или 100 мМ хлорида натрия.
23. Способ по любому из пп.7-8, отличающийся тем, что уравновешивающий буфер дополнительно содержит 200 мМ аргинина или HEPES, предпочтительно уравновешивающий буфер дополнительно содержит 100 мМ или 120 мМ аргинина и 100 мМ или 20 мМ HEPES.
| GIOVANNINI R | |||
| et al., "Comparison of different types of ceramic hydroxyapatite for the chromatographic separation ofplasmid DNA and a recombinant anti-rhesus D antibody", Bioseparation | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| GIOVANNINI R | |||
| et al., "Isolation of a recombinant antibody from cell culture supernatant: continuous annular versus batch and expanded-bed chromatography", Biotechnol Bioeng | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2011-01-20—Публикация
2004-10-06—Подача