Изобретение относится к области биологии и медицины и может быть использовано при проведении клеточной трансплантации на открытом сердце во время кардиохирургических операций.
В практике использования клеточной терапии и исследований протекторных эффектов признается необходимость адресного использования клеточного материала. При изучении возможности коррекции постинфарктного ремоделирования сердечной мышцы и лечения сердечной недостаточности считается перспективным использование интрамиокардиальной трансплантации клеток и в частности мезенхимальных стволовых клеток [1]. При решении вопроса об адресной доставке клеток при их трансплантации возникает новая проблема. Трансплантируемые клетки из оптимальных условий, поддерживаемых при их культивировании, попадают в условия заведомо патологически измененного миокарда. Этот факт в немалой степени служит причиной низкой выживаемости клеток после их трансплантации.
Таким образом, создание способа подготовки патологически измененного миокарда к интрамиокардиальной трансплантации клеточного материала, в частности мезенхимальных стволовых клеток, является весьма актуальным.
Адекватного прототипа изученной патентной и научно-медицинской литературе не обнаружено.
Задачей изобретения является создание условий, обеспечивающих наиболее полную реализацию регенераторных возможностей трансплантируемых клеток в патологически измененном миокарде.
Поставленную задачу решают следующим образом:
На открытом сердце, руководствуясь результатами инструментального обследования или визуального осмотра, выбирают участки миокарда для интрамиокардиальной трансплантации мезенхимальных стволовых клеток. На эти участки воздействуют импульсами радиочастотного излучения длительностью 98 мс и мощностью 3 Вт. В подготовленные участки миокарда интрамиокардиально, с помощью шприца, выполняют инъекции мезенхимальных: стволовых клеток [2, 3].
Новым в предлагаемом способе является предварительная подготовка патологически измененного миокарда к проведению интрамиокардиальной трансплантации мезенхимальных стволовых клеток, путем воздействия импульсами радиочастотного излучения длительностью 98 мс и мощностью 3 Вт.
Известно, что постинфарктное ремоделирование сводится не только к изменению геометрии сердца как органа в результате формирования рубца в зоне некроза, но и сопровождается значительными структурными изменениями сердечной мышцы. При этом разрастание соединительной тканной происходит как в зоне некроза, так и в прилегающих участках миокарда, что увеличивает жесткость межклеточного матрикса. В этих условиях трансплантируемые клетки могут не только погибнуть от ишемии, но и получить импульс к дифференцировке в нежелательном направлении. С другой стороны известно, что во время воспалительных реакций происходит разрушение межклеточного матрикса, а так же выделение эндогенных биологически активных веществ, способствующих регенерации [4]. Это обстоятельство, несомненно, служит позитивным моментом для клеточной терапии и учитывается при определении сроков проведения клеточной трансплантации при первично развившемся инфаркте миокарда.
Однако на поздних стадиях постинфарктного ремоделирования активность эндогенных репаративных механизмов затухает, тогда как процесс разрастания межклеточного матрикса и замещение одного типа калагеновых волокон другим, продолжается в процессе всего ремоделирования. Показано, что локальную гибель клеток миокарда можно вызвать воздействуя на сердечную мышцу излучением - радиочастотном диапазоне. Этот принцип использован при создании специальных приборов - радиочастотных деструкторов. Локальное разрушение клеток в эктопических очагах возбуждения миокарда применяется при коррекции нарушений сердечного ритма. Можно предположить, что после локального воздействия на патологически измененный миокард радиочастотным излучением произойдет активация эндогенных регенераторных процессов, при этом мезенхимальные стволовые клетки, интрамиокардиально трансплантируемые в эти участки, смогут более полно реализовать свой регенераторный потенциал. Трансплантируемые мезенхимальные
стволовые клетки будут оказывать не только локальное влияние, но смогут определять состояние и более удаленных участков миокарда.
Существенные признаки проявили в заявленной совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области и неочевидные для специалиста.
Идентичная совокупность признаков не обнаружена в патентной и научно-медицинской литературе.
Способ может быть использован на практике для подготовки патологически измененного миокарда к процедуре интрамиокардиальной трансплантации мезенхимальных стволовых клеток.
Исходя из вышеизложенного, следует считать предлагаемый способ соответствующим условиям патентоспособности: «Новизна», «Изобретательский уровень», «Промышленная применимость».
Изобретения будет понятно из следующего описания и приложенных к нему чертежей.
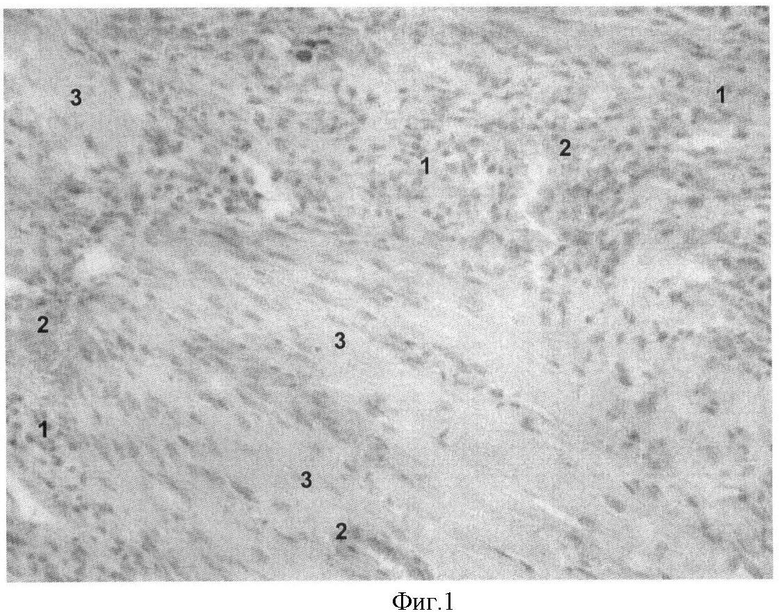
На фиг.1 представлена морфологическая картина миокард крысы с развившимся ПИКС, радиочастотным воздействием и интрамиокардиальной трансплантации мезенхимальных стволовых клеток (окраска гематоксилином и эозином, увеличение ×200). Видно, что через 15 суток после радиочастотного воздействия и последующей трансплантации мезенхимальных стволовых клеток в миокарде, прилежащем к зоне постинфарктного рубца, отмечалась выраженная мононуклеарная инфильтрация (1) и полнокровие сосудов (2). Эти особенности были более выражены, чем в контрольных группах, тогда как гипертрофия кардиомиоцитов была выражена незначительно (3).
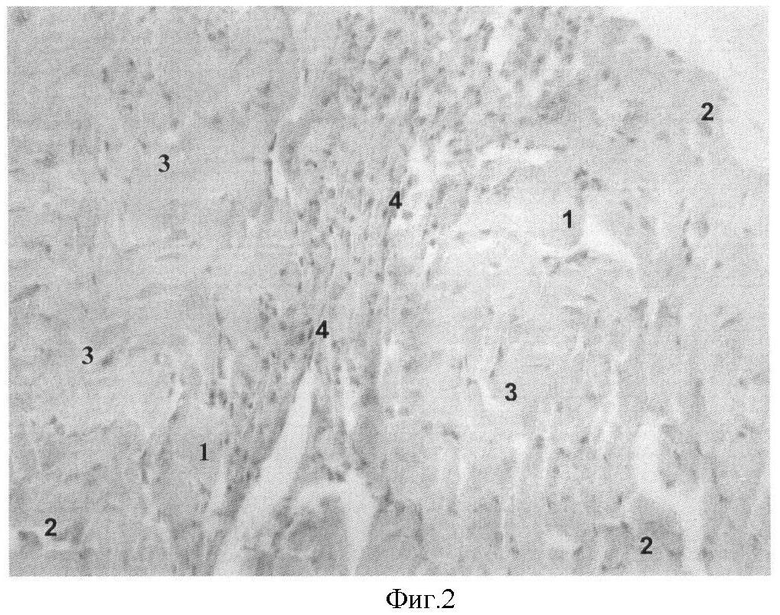
На фиг.2 представлена морфологическая картина миокарда крысы с развившимся ПИКС и интрамиокардиальной трансплантации мезенхимальных стволовых клеток (окраска гематоксилином и эозином, увеличение ×200). Видно, что через 15 суток после оказанных воздействий в миокарде, прилежащем к зоне постинфарктного рубца (4), отмечалась гипертрофия мышечных волокон (1), наблюдалось набухание цитоплазмы кардиомиоцитов и полнокровие капилляров (2), присутствовал извитой ход мышечных волокон (3) и слабо выраженная клеточная инфильтрация, полностью отсутствующая в соединительнотканных тяжах.
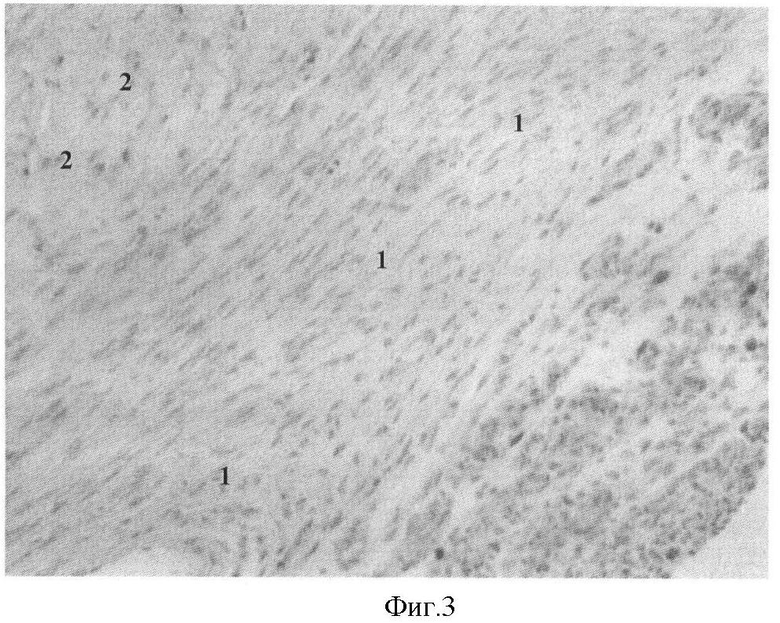
На фиг.3 представлена морфологическая картина миокард крысы с развившимся ПИКС и радиочастотным воздействием (окраска гематоксилином и эозином, увеличение ×200). Через 15 суток после радиочастотного воздействия исследуемый участок миокарда содержит молодую соединительную ткань (1), преобладающими клеточными элементами которой являются фибробласты, а также видны единичные мононуклеары, наблюдается гипертрофия мышечных волокон (2) и вакуолизация цитоплазмы кардиомиоцитов.
Животное с развившимся экспериментальным постинфарктным кардиосклерозом наркотизируют, фиксируют на операционном столе и вскрывают грудную клетку. На поверхности миокарда, прилегающем к границе постинфарктного рубца, определяют область, в которую будут трансплантировать мезенхимальные стволовые клетки.
На поверхность выбранного участка радиочастотным деструктором наносят разряды (длительностью 98 мс и мощностью 3 Вт.) добиваясь полного покрытия поверхности участка. После такой обработки проводят интрамиокардиальную трансплантацию мезенхимальных стволовых клеток. Затем операционную рану послойно ушивают. Все манипуляции выполняют в стерильных условиях и стерильными инструментами.
Пример.
В группе из 10 крыс линии Вистар был смоделирован инфаркт миокарда [5], после чего они в течение 45 суток содержались в условиях вивария. Затем животным повторно вскрывали грудную клетку и на участке миокарда вдоль границы зоны рубца произвели 5 разрядов радиочастотным деструктором по предлагаемому способу с последующей интрамиокардиальной трансплантацией мезенхимальных стволовых клеток. Для определения эффективности предлагаемого способа проведен сравнительный анализ гистологических препаратов сердечной мышцы опытной и двух контрольных групп. В 1-й контрольной группе (10 животных) после радиочастотного воздействия в миокард был введен эквивалентный объем без клеточной культуральной среды. Животным 2-й контрольной группе (10 крыс) МСК были трансплантированы без предварительной подготовки участка миокарда. Во всех группах операционную рану ушивали, после чего животных содержали в условиях вивария. Через 15 дней животные были умерщвлены. Фрагменты левого желудочка, подвергавшегося воздействиям, были иссечены и фиксировались в нейтральном 10% формалине. Выполнялась стандартная проводка образцов в спиртах с приготовлением парафиновых блоков и гистологических препаратов.
Образцы миокарда после радиочастотной деструкции и последующей интрамиокардиальной трансплантации мезенхимальных стволовых клеток (фиг.1) характеризовались наличием обильной инфильтрированностью клетками, вт.ч. мононуклеарами. В образцах присутствует грануляционная ткань с сохранившимися или дистрофичными кардиомиоцитами и участками молодой соединительной ткани. В большом количестве представлены предсуществующие и новообразованные сосуды. В исследуемых образцах гипертрофия кардиомиоцитов была выражена незначительно и присутствовали выраженные признаки воспаления.
Морфологическая картина миокарда животных контрольных групп существенно отличалась. Так для 1 контрольной группы (трансплантацией мезенхимальных стволовых клеток на фоне развившегося ПИКС) была характерна слабая клеточная инфильтрация, представленная одинаковым соотношением мононуклеаров и фибробластов. Можно было наблюдать гипертрофию мышечных волокон, набухание цитоплазмы кардиомиоцитов и умеренное полнокровие капилляров. Отличительной чертой образцов этой группы являлся извитой ход мышечных волокон и отсутствие клеточной инфильтрации в соединительнотканных прослойках (фиг.2).
Во 2 контрольной группе (радиочастотная деструкция на фоне ПИКС), зона деструкции была представлена молодой соединительной тканью (1), преобладающими клеточными элементами которой являются фибробласты, мононуклеары представлены единичными включениями. По периферии постинфарктного рубца отмечалась гипертрофия мышечных волокон и вакуолизация цитоплазмы кардиомиоцитов. Стенки артерий в зоне деструкции и прилежащем к ней миокарде умеренно утолщены за счет склероза (фиг.3).
Полученные результаты свидетельствуют, что в опытной группе животных регенераторные процессы протекают значительно более благоприятно и не сопровождаются склерозированием ткани, что свидетельствует об эффективности предложенного способа и возможности его использования для более полной реализации регенераторных возможностей клеточной трансплантации.
Цитируемая литература
1. Бузиашвили Ю.И., Мацкеплишвили С.Т., Алекян Б.Г., и др. Острый коронарный синдром и клеточные технологии. // Вестник Российской АМН, 2005, №4, с.65-69.
2. Онищенко Н.А., Потапов И.В., Башкина Л.В., и др. Восстановление сократительной функции криоповрежденного миокарда крысы после трансплантации фетальных кардиомиоцитов и преддифиренцированных стромальных клеток костного мозга. // Бюлл. эксперим. биол. и мед., 2004, №10, с.403-407.
3. Афанасьев С.А., Свиридов И.Н., Шахов В.П. и др. Влияние интрамиокардиальной трансплантации мононуклеарных клеток костного мозга на элетромеханическое сопряжение кардиомиоцитов крым после криодеструкции миокарда. // Вестник аритмологии, 2007, №47, с.38-41.
4. Pountos I., Giannoudis P.V. Biology of mesenchymal stem cells. // Injury. 2005, v.36, Suppl 3, p.8-12.
5. Кондратьева Д.С., Афанасьев С.А., Фалалеева Л.П., Шахов В.П. Особенности функционального состояния саркоплазматического ретикулума кардиомиоцитов миокарда крыс с постинфарктным кардиосклерозом. // Бюллетень экспериментальной биологии и медицины. 2005, т.130, №6, с.613-616.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ УВЕЛИЧЕНИЯ ПУЛА СТВОЛОВЫХ КЛЕТОК В МИОКАРДЕ | 2007 |
|
RU2347577C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ | 2006 |
|
RU2325934C1 |
| СПОСОБ ЛЕЧЕНИЯ ИНФАРКТА МИОКАРДА | 2006 |
|
RU2355325C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ РАЗЛИЧНОЙ ЭТИОЛОГИИ И ТРАВМ РАЗЛИЧНЫХ ОРГАНОВ | 2005 |
|
RU2301667C1 |
| БИОТРАНСПЛАНТАТ И СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ (ВАРИАНТЫ) | 2005 |
|
RU2299073C1 |
| СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ КАРДИОМИОЦИТОВ И ИХ ВНУТРИКЛЕТОЧНЫХ СТРУКТУР И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2008 |
|
RU2367451C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СЕРДЦА ИШЕМИЧЕСКОГО ГЕНЕЗА | 2005 |
|
RU2361529C2 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2004 |
|
RU2268061C1 |
| СПОСОБ ТЕРАПИИ ИНФАРКТА МИОКАРДА | 2005 |
|
RU2294206C2 |
| СПОСОБ ВЫДЕЛЕНИЯ СТВОЛОВЫХ КЛЕТОК ИЗ КОСТНОГО МОЗГА ДЛЯ ВНУТРИСОСУДИСТОГО ВВЕДЕНИЯ | 2012 |
|
RU2496871C1 |
Изобретение относится к области медицины, экспериментальной кардиологии. В эксперименте на патологически измененный миокард вдоль границы зоны рубца воздействуют импульсами радиочастотного излучения длительностью 98 мс и мощностью 3 Вт. Радиочастотное воздействие осуществляют непосредственно перед интрамиокардиальной трансплантацией мезенхимальных стволовых клеток. Последующую интрамиокардиальную трансплантацию клеточного материала осуществляют инъекционно в подготовленные участки миокарда. Способ позволяет добиться лучшей приживаемости трансплантируемых клеток за счет создания условий, обеспечивающих наиболее полную реализацию регенераторных возможностей трансплантируемых клеток в патологически измененном миокарде. 3 ил.
Способ подготовки постинфарктно ремоделированной сердечной мышцы к проведению интрамиокардиальной трансплантации клеточного материала в эксперименте, характеризующийся тем, что непосредственно перед интрамиокардиальной трансплантацией мезенхимальных стволовых клеток участки патологически измененного миокарда вдоль границы зоны рубца подвергают однократному воздействию радиочастотного излучения с импульсами длительностью 98 мс и мощностью 3 Вт, затем в подготовленные участки миокарда с помощью шприцевых инъекций проводят интрамиокардиальную трансплантацию мезенхимальных стволовых клеток.
| RU 2007128510 А, 27.01.2009 | |||
| БИОТРАНСПЛАНТАТ, СОДЕРЖАЩИЙ ЯДРОСОДЕРЖАЩИЕ КЛЕТКИ КОСТНОГО МОЗГА, В ТОМ ЧИСЛЕ ПРЕДДИФФЕРЕНЦИРОВАННЫЕ В ЭНДОТЕЛИАЛЬНОМ И КАРДИОМИОЦИТАРНОМ НАПРАВЛЕНИИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ (ВАРИАНТЫ) | 2006 |
|
RU2314816C2 |
| СПОСОБ ИМПЛАНТАЦИИ СТВОЛОВЫХ КЛЕТОК В МИОКАРД В ЭКСПЕРИМЕНТЕ | 2002 |
|
RU2237440C2 |
| US 7419482, 02.09.2008 | |||
| СПОСОБ ИМПЛАНТАЦИИ СТВОЛОВЫХ КЛЕТОК В МИОКАРД В ЭКСПЕРИМЕНТЕ | 2002 |
|
RU2237440C2 |
| СПОСОБ ЛЕЧЕНИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ ВО ВРЕМЯ ОПЕРАЦИЙ С ИСКУССТВЕННЫМ КРОВООБРАЩЕНИЕМ БЕЗ ВСКРЫТИЯ ЛЕВЫХ ОТДЕЛОВ СЕРДЦА | 2005 |
|
RU2294155C2 |
| WO 2008125279 А2, 23.10.2008 | |||
| БОКЕРИЯ Л | |||
| А | |||
| Клеточно-генные технологии при эндоваскулярном и хирургическом лечении заболеваний сердца и сосудов | |||
| Российские медицинские вести, 2004, | |||
Авторы
Даты
2011-02-27—Публикация
2009-04-20—Подача