Способ выделения из пуповинной крови лейкоцитарного концентрата, содержащего гемопоэтические стволовые клетки, относится к области медицины - к трансфузиологии.
Клеточная терапия - это современный метод лечения самых разнообразных заболеваний. Применение в клинической практике инновационных клеточных технологий направлено на улучшение качества жизни и увеличении продолжительности жизни населения. Применение новых клеточных технологий в здравоохранении разрешено Росздравнадзором лицензией № 99-1-001458 от 12.05.2005 г. Стволовые клетки - это универсальные предшественники клеток всех органов человека, а также клеток крови. Они способны делиться при определенных условиях и превращаться в любой вид ткани. Это свойство используется, когда необходимы, например, замена и восстановление функций кроветворной ткани. Выделяют два основных типа стволовых клеток: гемопоэтические и мезенхимальные. Гемопоэтические стволовые клетки (ГСК) превращаются во взрослые клетки крови, переносят кислород и питательные вещества к тканям и отвечают за иммунитет и невосприимчивость к различным заболеваниям. Мезенхимальные стволовые клетки дают начало всем «высокоспециализированным» клеткам органов человеческого организма. В настоящее время существуют методы выделения стволовых клеток из костного мозга, периферической крови, пуповинной крови, жировой ткани, пульпы зуба. В течение всей жизни человек стареет и подвергается неблагоприятным воздействиям внешней среды и экологии. Такие факторы, как радиация, концерогенные вещества, воздействуют на весь организм и все его клетки. Стволовые клетки, полученные из пуповинной крови, намного моложе однотипных клеток из костного мозга, т.к. они сохранены в самом начале жизни и более защищены от вредных воздействий, количество делений клеток ограничено. Стволовые клетки пуповинной крови собирают на одном из ранних этапов жизни человека, поэтому способность этих клеток делиться и превращаться в нужные организму клетки, а также их пролиферативная способность выше. Пуповинная кровь собирается легко и быстро. Сам по себе процесс сбора пуповинной крови прост, занимает не более 10 минут, не вызывает дискомфорта и безопасен как для матери, так и для ребенка, т.к. при этом с ними нет контакта.
Пуповинную кровь собирает акушерка после отсечения пуповины, ее можно собирать как после самостоятельных родов, так и после кесарева сечения. Когда ребенок родится, акушерка пережимает и перерезает пуповину, затем вводят в нее иглу от системы, куда поступает кровь. Собранную кровь помещают в контейнер для транспортировки. В нем кровь защищена от ударов, вибрации, резких перепадов температуры и в полной сохранности вместе с сопроводительной документацией доставляется в хранилище. Доставка осуществляется в течение 24 часов, что позволяет провести сбор крови практически в любом городе РФ. Перед помещением в хранилище пуповинная кровь ребенка должна быть обработана. Кровь взвешивают, подсчитывают количество стволовых клеток. Затем стволовые клетки выделяют из пуповинной крови и добавляют к ним криопротектор - раствор, который предохраняет клетки от разрушения при размораживании. Выделенные стволовые клетки помещают в мешки, разработанные специально для долгосрочного хранения при низких температурах, и три криопробирки - «спутника». Каждому образцу присваивают уникальный индентификационный номер. Используемая маркировка гарантирует неприкосновенность стволовых клеток ребенка. Стволовые клетки ребенка будут храниться в запаянном стерильном и герметичном мешке в условиях глубокого холода, см. «Клиническая гематология. Справочник. Спутник врача» под ред. Абдулкадырова К.М., СПб., «ПИТЕР», 2006 г., стр.365-398.
Недостатками указанного выше способа выделения гемопоэтических стволовых клеток из пуповинной крови являются: способ технологически неэффективен, отсутствуют действия по определению качества пуповинной крови выделенных стволовых клеток, отсутствуют проверки на определение возможных или их отсутствие биологических загрязнений и инфицированности, отсутствуют действия и количественные значения, позволяющие осуществить технологический процесс получения гемопоэтических стволовых клеток.
В трансфузиологии известна методика выделения гемопоэтических стволовых клеток из пуповинной крови, см. http://www.gemabank, ru/pub/nl.htmal-cma, авторов: К.М.Абдулкадыров, Н.А.Романенко, Н.Н.Старков, А.В.Сельцер «Актуальные вопросы гематологии и трансфузиологии». Заготовка и хранение пуповинной крови. Материалы научно-практической конференции, Санкт-Петербург, 2000 г. Сбор пуповинной крови производят при физиологических родах после рождения ребенка и отделения его от последа. После этого производят пункцию вены пуповинного канатика. Процедура сбора пуповинной крови длится не более 10 минут. После сбора крови контейнер с пуповинной кровью взвешивают для определения массы собранной крови. Перерасчет массы крови на объем осуществляют делением массы на плотность пуповинной крови с раствором антикоагулянта («глюгицир» - раствор гидроцитрата натрия), которая составляет 104-105 г в 100 мл. Далее в крови определяют содержание лейкоцитов, эритроцитов, тромбоцитов, гемоглобина, а также осуществляют бактериологический посев на стерильность. Выделения эритроцитов и лейкоцитов осуществляют посредством седементации в 10% растворе гидроксиэтилкрахмала в соотношении его с пуповинной кровью 1:4, отмывании от гидроксиэтилкрахмала и сепарации со скоростью 1500 об/мин в течение 10 минут. Получение ядросодержащих клеток осуществляют в градиенте плотности фиколла посредством сепарации и раствора гидроксиэтилкрахмала.
Недостатками такого способа выделения гемопоэтических стволовых клеток из пуповинной крови являются: недостаточное качество, количество и надежность проверок пуповинной крови, т.к. отсутствуют проверки на наличие HLA - типирования гистосовместимости пуповинной крови, отсутствует тест на выявление антител T.pallidum в плазме пуповинной крови, отсутствуют контрольные действия и проверки с плазмой пуповинной крови и отсутствует проверка на гемотрансмиссивные инфекции; полученные фракции ядросодержащих клеток в градиенте плотности фиколла могут нанести вред здоровью человека, приведенное соотношение седементирующегго средства - гидроксиэтилкрахмала 1:4 недостаточно эффективно, супернатант отбирают пипеткой, открытая система может привести к инфекции, технология способа выявления гемопоэтических стволовых клеток практически и промышленно не отработана и неэффективна.
Техническим результатом предлагаемого способа выделения гемопоэтических клеток из пуповинной крови является: повышение качества и надежности от различной инфекционности и биологических загрязнений, собранных и выделенных из пуповинной крови стволовых клеток, содержащихся в лейкоцитарном концентрате, повышении технологичности получения гемопоэтических стволовых клеток CD34+CD45 dim.
Этот результат достигается тем, что в способе выделения из пуповинной крови лейкоцитарного концентрата, содержащего гемопоэтические стволовые клетки, заключающемся в сборе крови из пуповины в контейнер, взвешивании массы собранной крови с подсчетом ее объема, учитывая массу антикоагулянта, проведении анализа пуповинной крови на бактериологический посев, осуществлении сепарации посредством центрифугирования, разделяя пуповинную кровь на эритроцитарную массу и лейкоцитарный концентрат с гемопоэтическми стволовыми клетками посредством седементирующего средства раствором гидроксиэтилкрахмала, после взвешивания контейнера, выполненного в виде пакета, с пуповинной кровью в ламинарном боксе, предварительно облученном ультрафиолетовым излучением, отбирают из пакета 1,5 мл пуповинной крови для обследования ее на гемоанализаторе, определяя тип человеческого лейкоцитарного антигена для сопоставления гистосовместимости, на отсутствие или наличие инфицирования, вновь взвешивают массу пуповинной крови в пакете и определяют ее объем по формуле V1=((Mпk-Mak)/Pcp)+Vak, где Мпк - масса пуповинной крови, г, с пакетом, в котором она размещена, Мак - масса антикоагулянта, г, с пакетом, в котором он размещен, Pcp - среднее значение плотности крови, г/мл, Vak - объем антикоагулянта, мл, причем антикоагулянт взят в виде цитрат-фосфат-декстроза-аденин с массой, равной 54,4 г, вместе с пакетом, в котором он размещен, среднее значение плотности крови взято равным 1,05 г/мл, а объем антикоагулянта - 35 мл, после перемешивания пуповинной крови с антикоагулянтом, внесенным в пакет с пуповинной кровью, в последний вводят седементирующее средство в виде 6% раствора гидроксиэтилкрахмала в объеме, рассчитанном по формуле V2=0,2V1, помещают пакет со смесью пуповинной крови, антикоагулянтом и гидроксиэтилкрахмалом на площадку шейкера, осуществляют орбитальное механическое перемешивание содержимого пакета со скоростью 30 об/мин, наклоняя площадку шейкера в разных плоскостях к горизонту, и проводят инкубацию смеси с пуповинной кровью в течение 10 минут при комнатной температуре, отделяя эритроцитарную массу седементированием в пакете смеси с пуповинной кровью, затем помещают центрифужную камеру в сепаратор, подсоединяют к ней по вертикальной оси симметрии магистральный трубопровод, подсоединяя последний через оптический сенсор к распределительному узлу, от которого подводят трубопроводы к мешкам для сбора компонентов крови и к пакету со смесью, наполняют камеру смесью пуповинной крови, антикоагулянта и гидроксиэтилкрахмала из пакета и осуществляют сепарацию размещенных в центрифужной камере смеси с пуповинной кровью антикоагулянтом и гидроксиэтилкрахмалом центрифугированием со скоростью от 1700 до 8000 об/мин в течение времени от 10 до 40 минут, разделяя содержимое пакета с пуповинной кровью на эритроцитарную массу, плазму и лейкоцитарный концентрат и распределяя их посредством оптического сенсора через трубопроводы к своим мешкам, после окончания сепарации отбирают 0,5 мл фракции лейкоцитарного концентрата для определения жизнеспособности и количества гемопоэтических стволовых клеток CD34+CD45 dim на проточном цитофлуориметре, из мешков с плазмой и эритроцитарной массой отбирают по 2,5 мл, смешивают эти дозы в пробирке и проверяют эту смесь на бактериальный посев, для выявления антител T.pallidum в плазме отбирают 0,1 мл плазмы, также отбирают из мешка с плазмой 1 мл плазмы в пробирку с маркировкой «плазма ребенка» для исследования на гемотрансмиссивные инфекции, а из мешка с эритроцитарной массой отбирают 1 мл для определения группы крови и резус-фактора.
Сущность изобретения заключается в совокупности существенных признаков, достаточной для достижения обеспечиваемого изобретением технического результата.
Существенными признаками предложенного способа, совпадающими с известными признаками, являются: А - сбор крови из пуповины в контейнер; Б - взвешивание массы собранной крови с подсчетом ее объема, учитывая массу антикоагулянта; В - проведение анализа на бактериологический посев; Г - осуществление сепарации посредством центрифугирования, разделяя пуповинную кровь на эритроцитарную массу и лейкоцитарный концентрат с гемопоэтическими стволовыми клетками посредством седементирующего средства раствором гидроксиэтилкрахмала.
Существенными отличительными признаками способа выделения из пуповинной крови лейкоцитарного концентрата, содержащего гемопоэтические стволовые клетки, являются: Д - после взвешивания контейнера, выполненного в виде пакета, с пуповинной кровью в ламинарном боксе, предварительно облученном ультрафиолетовым излучением, отбирают из пакета 1,5 мл пуповинной крови для обследования ее на гемоанализаторе, определяя тип человеческого лейкоцитарного антигена для сопоставления гистосовместимости, на отсутствие или наличия инфицирования; Е - вновь взвешивают массу пуповинной крови в пакете и определяют ее объем по формуле V1=((Mnk-Mak)/Pcp)+Vak, где Мпк - масса пуповинной крови, г, с пакетом, в котором она размещена, Мак - масса антикоагулянта, г, с пакетом, в котором он размещен, Pcp - среднее значение плотности крови, г/мл, Vак - объем антикоагулянта, мл, причем антикоагулянт взят в виде цитрат-фосфат-декстроза-аденин с массой, равной 54,4 г вместе с пакетом, в котором он размещен, среднее значение плотности крови равно 1,05 г/мл, а объем антикоагулянта - 35 мл; Ж - после перемешивания пуповинной крови с антикоагулянтом, внесенным в пакет с пуповинной кровью, в последний вводят седементирующее средство в виде 6% раствора гидроксиэтилкрахмала в объеме, рассчитанным по формуле V2=0,2V1; И - помещают пакет со смесью пуповинной крови, антикоагулянтом и гидроксиэтилкрахмалом на площадку шейкера, осуществляют орбитальное механическое перемешивание содержимого пакета со скоростью 30 об/мин, наклоняя площадку шейкера в разных плоскостях к горизонту; К - проводят инкубацию смеси с пуповинной кровью в течение 10 минут при комнатной температуре, отделяя эритроцитарную массу седементированием в пакете смеси с пуповинной кровью; Л - помещают центрифужную камеру в сепаратор, подсоединяют к ней по вертикальной оси симметрии магистральный трубопровод, подсоединяя последний через оптический сенсор к распределительному узлу, от которого подводят трубопроводы к мешкам для сбора компонентов крови и к пакету со смесью, наполняют камеру смесью пуповинной крови, антикоагулянта и гидроксиэтилкрахмала из пакета; М - осуществляют сепарацию размещенных в центрифужной камере смеси с пуповинной кровью со скоростью от 1700 до 8000 об/мин в течение времени от 10 до 40 минут, разделяя пуповинную кровь на эритроцитарную массу, плазму и лейкоцитарный концентрат и распределяя их посредством оптического сенсора через трубопроводы к своим мешкам; Н - после окончания сепарации отбирают 0,5 мл фракции лейкоцитарного концентрата для определения жизнеспособности и количества гемопоэтических стволовых клеток CD34+CD45dim на проточном цитофлуориметре; О - из мешков с плазмой и эритроцитарной массой отбирают по 2,5 мл, смешивают эти дозы в пробирке и проверяют эту смесь на биологический посев; П - для выявления антител T.pallidum в плазме отбирают 1 мл плазмы; Р - из мешка с плазмой отбирают 1 мл плазмы в пробирку с маркировкой «плазма ребенка» для исследования на гемотрасмиссивные инфекции; С - из мешка с эритроцитарной массой отбирают 1 мл для определения группы крови и резус-фактора.
Способ выделения из пуповинной крови лейкоцитарного концентрата, содержащего гемопоэтические стволовые клетки, осуществляется следующим образом. Из пуповины ребенка, отделенной при физиологических родах из ее вены пункцией шприцем осуществляют сбор пуповинной крови в стерильный специальный контейнер, имеющий входной и выходной порты, выполненный из пластического материала, предназначенный для хранения пуповинной крови. Записывают все данные матери и ребенка в протокол индентификации образца пуповинной крови. Все дальнейшие действия производят в ламинарном боксе (“Termo Scientific" Hera Safe KS Heraeus, США), представляющем закрытый шкаф с прозрачными стенками и отверстиями в одной стенке для того, чтобы можно было бы просунуть руки в перчатках, с использованием ультрафиолетового излучения лампой 15 Вт фирмы «OSRAM» для обеззараживания внутреннего объема. Салфеткой, смоченной 70% этиловьм спиртом, протирают пакет с пуповинной кровью и пакет с антикоагулянтом. Антикоагулянт выбран в виде цитрат-фосфат-декстроза-аденин с массой, равной 54,4 г, вместе с пакетом, в котором он размещен. Взвешивают пакет с пуповинной кровью на прецизионных электронных весах «ACCULAR» VIC 120d3 интерфейс RS-232 - VICON США. После перемешивания пуповинной крови в пакете (ручным действием) отбирают из пакета через его порт 1,5 мл пуповинной крови для исследования ее на гемоанализаторе и HLA типирования, определяя тип человеческого лейкоцитарного антигена для сопоставления гистосовместимости, на отсутствие или наличие инфицирования. Вновь взвешивают пакет с массой пуповинной крови и рассчитывают объем V1 собранной пуповинной крови по формуле V1=((Mпk-Mak)/Pcp)+Vak, где Мпк - масса пуповинной крови, г, с пакетом, в котором она размещена, Мак - масса антикоагулянта, г, с пакетом, в котором он размещен, равная 54,4 г, Ркр - среднее значение плотности крови, г/мл, и равное 1,05 г/мл, Vak - объем антикоагулянта, мл, равный 35 мл. После определения объема V2 6% гидроксиэтилкрахмала - седементирующего средства, с помощью которого оседает эритроцитарная масса, по формуле V2=0,2V1 вводят его в пакет с пуповинной кровью. Осторожно покачивая руками, перемешивают пакет с пуповинной кровью и раствором гидроксиэтилкрахмала и помещают этот пакет на площадку шейкера (мешалка) (Multi Bio 3D (Biosan, Швейцария)). С помощью последнего осуществляют механическое орбитальное перемешивание содержимого пакета с пуповинной кровью, антикоагулянтом и гидроксиэтилкрахмалом со скоростью 30 об/мин, наклоняя площадку шейкера в разных плоскостях к горизонту, угол наклона равен 7°, равномерно покачивая площадку шейкера вокруг координатных осей - (3 степени свободы). Инкубируют пакет с содержимым в течение 10 минут при комнатной температуре (+18-20°С). С помощью гидроксиэтилкрахмала в пакете оседают эритроциты. Центрифужную камеру 1 устанавливают в сепаратор 2 (Sepax, Швейцария), подсоединяют к ней по вертикальной оси симметрии магистральный трубопровод 3, подсоединяя последний через оптический сенсор 4 к распределительному узлу 5, от которого подводят трубопроводы 6 к мешкам 7, 8 для сбора компонентов крови и к пакету 9 со смесью 10. Наполняют центрифужную камеру 1 из пакета 9 смесью 10 пуповинной крови, антикоагулянта и гидроксиэтилкрахмала. Закрывают центрифужную камеру 1 и осуществляют сепарацию размещенных в центрифужной камере 1 смеси с пуповинной кровью, антикоагулянтом и гидроксиэтилкрахмалом, центрифугированием, т.е. вращением камеры вокруг вертикальной оси со скоростью вращения 1700-8000 об/мин в течение времени от 10 до 40 минут, разделяя пуповинную кровь на плазму, эритроцитарную массу и лейкоцитарный концентрат. Скорость и время вращения можно варьировать в зависимости от веса пакета с пуповинной кровью. По магистральному трубопроводу 3, через оптический сенсор 4 и распределительное устройство 5 плазму, эритроцитарную массу и лейкоцитарный концентрат распределяют по своим мешкам 7, 8, 9. Эритроцитарной массой наполняют опустевший от смеси пакет-мешок 9. После окончания сепарации отсоединяют каждый мешок от своих трубопроводов и запаивают отверстия их трубопроводов. В ламинарном боксе отбирают шприцем 0,5 мл лейкоцитарного концентрата в маркированную микропробирку для подсчета жизнеспособности и количества гемопоэтических стволовых клеток CD34+CD45dim на проточном цитофлуориметре. Из мешка с плазмой отбирают для проведения исследований 5 мл плазмы в стерильную маркированную пробирку. Из этого количества берут 2,5 мл плазмы и из другого мешка - 2,5 мл эритроцитарной массы, смешивают эти дозы и проверяют эту смесь на бактериальный посев. Для проведения теста на выявление антител T.pallidum в плазме отбирают в пробирку Эппендорфф 0,1 мл плазмы. В маркированную пробирку «плазма ребенка» отбирают 1 мл плазмы для проверки на гемотрансмиссивную инфекцию. Из мешка с эритроцитарной массой отбирают 1 мл для определения группы крови и резус-фактора.
Следовательно, перед хранением гемопоэтических стволовых клеток в лейкоцитарном концентрате, полученных из пуповинной крови, их подвергают бактериологическому и вирусологическому контролю на наличие грибкового инфицирующего материала. Полученный в результате обработки пуповинной крови материал (плазму, эритроцитарную массу и лейкоцитарный концентрат) исследуют на определение группы крови и резус-фактора, проверяют на стерильность, жизнеспособность, выявление ряда инфекций: ВИЧ, гепатит В и С, сифилис, определение количества гемопоэтических стволовых клеток - CD34+CD45dim.
Использование технического решения «Способ выделения из пуповинной крови лейкоцитарного концентрата», содержащего гемопоэтические стволовые клетки по сравнению с прототипом, позволяет повысить качество и надежность от инфицированности и биозагрязнений в выявленных и собранных в лейкоцитарном концентрате гемопоэтических стволовых клеток, благодаря тому, что пуповинную кровь проверяют на определение типа человеческого лейкоцитарного антигена для определения гистосовместимости, на отсутствие или наличия инфицирования плазмы, выделенной из пуповинной крови, определения теста антитела T.pallidum, определения на гемотрансмиссивные инфекции, проверки на вирусологический контроль. Выделение гемопоэтических стволовых клеток проводят на высококачественном эффективном сертифицированном оборудовании производителей различных стран: Швейцария, США, Дания, Германия и т.д. Технологический процесс выделения гемопоэтических стволовых клеток осуществляют коммерческой организацией «ООО Покровский банк стволовых клеток», имеющей лицензии №78-01-000356 от 10.10.2008 г. и № ФС-99-01-005911 от 20.01.2009 г. на базе государственной Покровской больницы г.Санкт-Петербург. Все технологии, используемые в этой организации, отвечают международным требованиям и стандартам, предъявляемыми к банкам стволовых клеток, полученных из пуповинной крови. В настоящее время около 80 разных болезней, включая онкологические заболевания, лейкозы, лимфомы и специфические нарушения иммунной системы, дают положительный ответ на лечение стволовыми клетками.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КРИОКОНСЕРВИРОВАНИЯ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК ПУПОВИННОЙ КРОВИ | 2009 |
|
RU2416197C1 |
| СПОСОБ КРИОКОНСЕРВИРОВАНИЯ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК ПУПОВИННОЙ КРОВИ | 2012 |
|
RU2554405C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУСПЕНЗИИ ЯДРОСОДЕРЖАЩИХ КЛЕТОК ИЗ ПУПОВИННОЙ КРОВИ СО СТАНДАРТИЗИРОВАННОЙ КОНЦЕНТРАЦИЕЙ | 2014 |
|
RU2590688C2 |
| СПОСОБ ИЗМЕРЕНИЯ ДЛИНЫ ТЕЛОМЕР КЛЕТОК ЛЕЙКОКОНЦЕНТРАТА ПУПОВИННОЙ КРОВИ | 2010 |
|
RU2434940C1 |
| СПОСОБ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЙ АХИЛЛОВА СУХОЖИЛИЯ | 2009 |
|
RU2423089C1 |
| Способ изготовления средства для клеточно-опосредованной генной терапии и средство для клеточно-опосредованной генной терапии | 2019 |
|
RU2716013C2 |
| СПОСОБ КРИОКОНСЕРВИРОВАНИЯ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК ПУПОВИННОЙ КРОВИ | 2013 |
|
RU2547426C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЯДРОСОДЕРЖАЩИХ КЛЕТОК ИЗ ПУПОВИННОЙ КРОВИ | 2007 |
|
RU2343928C1 |
| СПОСОБ ВЫДЕЛЕНИЯ СТВОЛОВЫХ КЛЕТОК ИЗ КОСТНОГО МОЗГА ДЛЯ ВНУТРИСОСУДИСТОГО ВВЕДЕНИЯ | 2012 |
|
RU2496871C1 |
| КОМБИНИРОВАННЫЙ КРИОПРОТЕКТОР "ДИМЕТИЛСУЛЬФОКСИД/РЕОПОЛИГЛЮКИН" ДЛЯ КРИОКОНСЕРВАЦИИ СТВОЛОВЫХ КЛЕТОК И СПОСОБ ИХ КРИОКОНСЕРВАЦИИ ДЛЯ КЛИНИЧЕСКОГО ПРИМЕНЕНИЯ | 2014 |
|
RU2563117C1 |
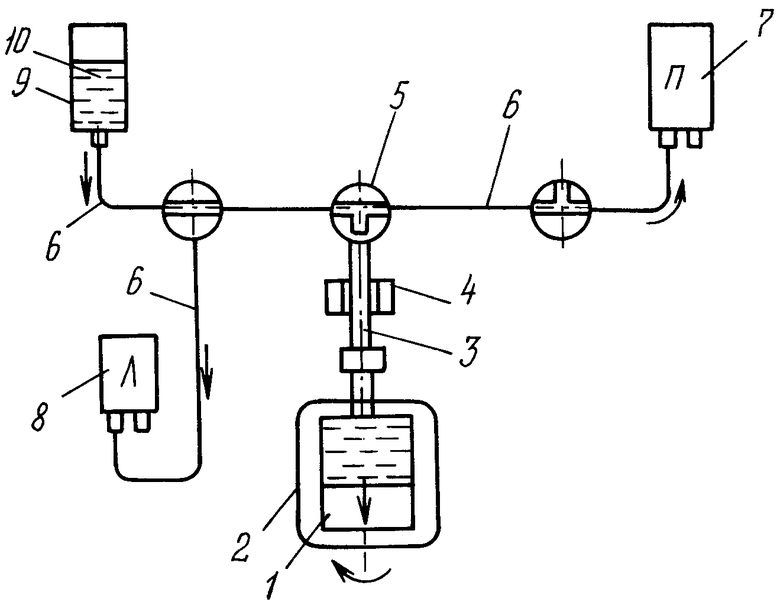
Способ относится к области медицины, а именно к трансфузиологии. Способ включает сбор пуповинной крови (ПК) в контейнер, взвешивание ее массы с подсчетом ее объема, определение типа человеческого лейкоцитарного антигена для сопоставления гипосовместимости, на отсутствие или наличие инфицирования, внесение в пакет с ПК, антикоагулянт и гидроксиэтилкрахмал, механическое перемешивание содержимого пакета в разных плоскостях, инкубирование после перемешивания при комнатной температуре, отделяя эритроцитарную массу (ЭМ) седементированием, размещение центрифужной камеры в сепаратор, подсоединение к ней по оси симметрии магистрального трубопровода, подсоединяя последний через распределительный узел через трубопроводы к мешкам для сбора компонентов крови и к пакету со смесью ПК, антикоагулянта и гидроксиэтилкрахмала. Затем наполняют камеру содержимым пакета и проводят сепарацию смеси, разделяя ее на ЭМ, плазму и лейкоцитарный концентрат и распределяя их по своим мешкам и в опустевший пакет. После сепарации определяют жизнеспособность и количество СК, проверяют их на биологический посев образца смеси плазмы и ЭМ, исследуют дозу плазмы на выявление антител, на гемотрансмиссивные инфекции, а дозу ЭМ - на определение группы крови и резус-фактора. Использование способа позволяет повысить качество и надежность определения СМ от различных биологических загрязнений. 1 ил.
Способ выделения из пуповинной крови лейкоцитарного концентрата, содержащего гемопоэтические стволовые клетки, заключающийся в сборе крови из пуповины в контейнер, взвешивании массы собранной крови с подсчетом ее объема, учитывая массу антикоагулянта, проведении анализа пуповинной крови на бактериологический посев, осуществлении сепарации посредством центрифугирования, разделяя пуповинную кровь на эритроцитарную массу и лейкоцитарный концентрат с гемопоэтическими стволовыми клетками посредством седементирующего средства раствором гидроксиэтилкрахмала, отличающийся тем, что после взвешивания контейнера, выполненного виде пакета, с пуповинной кровью в ламинарном боксе, предварительно облученном ультрафиолетовым излучением, отбирают из пакета 1,5 мл пуповинной крови для обследовании ее на гемоанализаторе, определяя тип человеческого лейкоцитарного антигена для сопоставления гистосовместимости на отсутствие или наличие инфицирования, вновь взвешивают массу пуповинной крови в пакете и определяют ее объем по формуле V1=((Mпк-Maк)/Pcp)+Vaк, где, Мпк - масса пуповинной крови, г, с пакетом, в котором она размещена, Мак - масса антикоагулянта, г, с пакетом, в котором он размещен, Pсp - среднее значение плотности крови, г/мл, Vaк - объем антикоагулянта, мл, причем антикоагулянт взят в виде цитрат-фосфат-декстроза-аденин с массой, равной 54,4 г вместе с пакетом, в котором он размещен, среднее значение плотности крови равно 1,05 г/мл, а объем антикоагулянта - 35 мл, после перемешивания пуповинной крови с антикоагулянтом, внесенным в пакет с пуповинной кровью, в последний вводят седементирующее средство в виде 6%-ного раствора гидроксиэтилкрахмала в объеме, рассчитанным по формуле V2=0,2V1, помещают пакет со смесью пуповинной крови, антикоагулянтом и гидроксиэтилкрахмалом на площадку шейкера, осуществляют орбитальное механическое перемешивание содержимого пакета со скоростью 30 об/мин, наклоняя площадку шейкера в разных плоскостях к горизонту, и проводят инкубацию смеси с пуповинной кровью в течение 10 мин при комнатной температуре, отделяя эритроцитарную массу седементированием в пакете смеси с пуповинной кровью, затем помещают центрифужную камеру в сепаратор, подсоединяют к ней по вертикальной оси симметрии магистральный трубопровод, подсоединяя последний через оптический сенсор к распределительному узлу, от которого подводят трубопроводы к мешкам для сбора компонентов крови и к пакету со смесью, наполняют камеру смесью пуповинной крови, антикоагулянта и гидроксиэтилкрахмала из пакета и осуществляют сепарацию размещенных в центрифужной камере смеси с пуповинной кровью, антикоагулянтом и гидроксиэтилкрахмалом центрифугированием со скоростью от 1700 до 8000 об/мин в течение времени от 10 до 40 мин, разделяя пуповинную кровь на эритроцитарную массу, плазму и лейкоцитарный концентрат и распределяя их посредством оптического сенсора через трубопроводы к своим мешкам, после окончания сепарации отбирают 0,5 мл фракции лейкоцитарного концентрата для определения жизнеспособности и количества гемопоэтических стволовых клеток CD34+CD45 dim, на проточном цитофлуориметре из мешков с плазмой и эритроцитарной массой отбирают по 2,5 мл, смешивают эти дозы в пробирке и проверяют эту смесь на бактериальный посев, для выявления антител T.pallidum в плазме отбирают 0,1 мл плазмы, также отбирают из мешка с плазмой 1 мл плазмы в пробирку с маркировкой «плазма ребенка» для исследования на гемотрансмиссивные инфекции, а из мешка с эритроцитарной массой отбирают 1 мл для определения группы крови и резус-фактора.
| АБДУЛКАДЫРОВ К.М | |||
| и др | |||
| Актуальные вопросы гематологии и трансфузиологии | |||
| Материалы научно-практической конференции | |||
| - СПб., 2000, с.23-27 | |||
| СПОСОБ ПОЛУЧЕНИЯ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ИЗ КОСТНОГО МОЗГА МЛЕКОПИТАЮЩИХ И ПОПУЛЯЦИЯ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК, ПОЛУЧЕННАЯ ЭТИМ СПОСОБОМ | 2006 |
|
RU2303632C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОЧНОЙ КУЛЬТУРЫ ДЛЯ ЛЕЧЕНИЯ СОСУДИСТЫХ И ДЕМИЕЛИНИЗИРУЮЩИХ ЗАБОЛЕВАНИЙ НЕРВНОЙ СИСТЕМЫ И КЛЕТОЧНАЯ КУЛЬТУРА, ПОЛУЧЕННАЯ ЭТИМ СПОСОБОМ (ВАРИАНТЫ) | 2007 |
|
RU2347579C1 |
| YANG H et al | |||
| Damage and protection of UC blood cells during cryopreservation | |||
| Cytotherapy, 2001, 3(5), p.377-86, PMID: 11953017, найдено в PubMed, найдено 15.06.2010. | |||
Авторы
Даты
2011-02-27—Публикация
2009-10-07—Подача