Настоящее изобретение принадлежит к области медицинской химии, а именно относится к соединениям и их фармацевтическим композициям, которые ингибируют каспазы, опосредующие апоптоз клеток и воспаление. Изобретение также относится к способам получения этих соединений. Изобретение также относится к способам применения этих соединений и фармацевтических композиций настоящего изобретения при лечении заболеваний, в развитии которых участвует активность каспаз.
Уровень техники
Апоптоз, или запрограммированная клеточная смерть, является основным механизмом, посредством которого организмы удаляют нежелательные клетки. Нарушение регуляции апоптоза, как избыточный апоптоз, так и невозможность подвергнуться апоптозу, лежит в основе ряда заболеваний, таких как рак, острые воспалительные и аутоиммунные заболевания, ишемические болезни и некоторые нейродегенеративные расстройства (см., главным образом, Science, 1998, 281, 1283-1312; Ellis et al., Ann. Rev. Cell. Biol., 1991, 7, 663).
Каспазы являются семейством ферментов цистеинпротеиназ, которые являются ключевыми медиаторами в сигнальных путях апоптоза и фрагментации клеток (Thornberry, Chem. Biol., 1998, 5, R97-R103). Эти сигнальные пути различаются в зависимости от типа клеток и стимулов, но все пути апоптоза, как создается впечатление, сходятся на общем эффекторном пути, ведущем к протеолизу ключевых белков. Каспазы участвуют и в эффекторной фазе сигнального пути, и на более раннем этапе в момент ее инициации. Вышерасположенные по каскаду реакций каспазы, участвующие в инициирующих событиях, активируются и, в свою очередь, активируют другие каспазы, которые задействованы на более поздних фазах апоптоза.
Каспаза-1, первая идентифицированная каспаза, известна также как интерлейкин-конвертирующий фермент или "ICE". Каспаза-1 превращает предшественник интерлейкина-1β ("pIL-1β") в активную провоспалительную форму путем специфичного расщепления pIL-1β между аминокислотными остатками Asp-116 и Ala-117. Кроме каспазы-1 существует также одиннадцать других каспаз человека, каждая из которых обеспечивает специфичное расщепление по аспартиловому остатку. Также отмечается строгая необходимость в присутствии, по меньшей мере, 4 аминокислотных остатков на N-концевом участке сайта расщепления.
Каспазы разделяют на три группы в зависимости от аминокислотной последовательности, которая является предпочтительной или распознается в первую очередь. В группе каспаз, которая включает каспазы 1, 4, 5 и 13, как было показано, преимущественно гидрофобные ароматические аминокислотные остатки находятся в позиции 4 на N-концевом участке сайта расщепления. В другой группе, включающей каспазы 2, 3 и 7, обнаруживаются аспартильные остатки в позициях 1 и 4 N-концевого участка сайта расщепления и предпочтительно последовательность типа Asp-Glu-X-Asp. В третьей группе, которая включает каспазы 6, 8, 9 и 10, допускается много аминокислот в первично распознаваемой последовательности, но, как кажется, предпочтительны остатки с разветвленными, алифатическими боковыми цепочками, такими как валин и лейцин в позиции 4.
Каспазы также группируют в соответствии с их функцией. Первое подсемейство состоит из каспаз-1 (ICE), 4, 5 и 13. Эти каспазы, как было показано, вовлечены в процессинг провоспалительных цитокинов, и, таким образом, играют важную роль в воспалении. Каспаза-1, самый изученный фермент этого класса, активирует предшественник IL-1β путем протеолитического расщепления. Этот фермент тем самым играет ключевую роль в воспалительном ответе. Каспаза-1 также участвует в процессинге фактора, индуцирующего интерферон-γ (IGIF, также известный как IL-18), который стимулирует продукцию интерферона-гамма, ключевого иммунорегулятора, который опосредует презентацию антигенов, активацию Т-клеток и клеточную адгезию.
Остальные каспазы составляют второе и третье подсемейство. Эти ферменты играют центральную роль во внутриклеточных сигнальных путях, ведущих к апоптозу. Одно подсемейство состоит из ферментов, вовлеченных в инициирующие события апоптотического пути, включая трансдукцию сигналов с плазматической мембраны. Представители этого подсемейства включают каспазы-2, 8, 9 и 10. Другое подсемейство, состоящее из эффекторных каспаз 3, 6 и 7, вовлечено в конечные в каскаде события расщепления, которые приводят к системному распаду и гибели клетки путем апоптоза. Каспазы, участвующие в сигнальной трансдукции выше по каскаду, активируют нижерасположенные по каскаду реакций каспазы, которые затем выводят из строя механизмы репарации ДНК, фрагментируют ДНК, разбирают клеточный цитоскелет и в конечном счете фрагментируют клетку.
Данные о последовательности четырех аминокислот, первично распознаваемой каспазами, используются для создания ингибиторов каспаз. Полученные обратимые тетрапептидные ингибиторы имеют структуру CH3CO-[P4]-[P3]-[P2]-CH(R)CH2CO2H, где P2 и P4 представляют собой оптимальную аминокислотную распознаваемую последовательность, а R является альдегидом, нитрилом или кетоном, способным к связыванию с цистеинсульфгидрилом каспазы. Rano and Thornberry, Chem. Biol. 4, 149-155 (1997); Mjalli et al., Bioorg. Med. Chem. Lett. 3, 2689-2692 (1993); Nicholson et al., Nature 376, 37-43 (1995). Получены необратимые ингибиторы, основанные на аналогичной тетрапептидной распознаваемой последовательности.
Применение ингибиторов каспаз в лечении множества болезненных состояний млекопитающих, связанных с усилением клеточного апоптоза, было продемонстрировано с помощью пептидных ингибиторов каспаз. Например, в моделях на грызунах ингибиторы каспаз демонстрируют уменьшение размера инфаркта и подавление апоптоза кардиомиоцитов после инфаркта миокарда, уменьшение объема повреждения и неврологического дефицита в результате инсульта, уменьшение посттравматического апоптоза и неврологического дефицита при черепно-мозговой травме, а также эффективность в лечении фульминантной деструкции печени и повышение выживаемости после эндотоксического шока. Yaoita et al., Circulation, 97, 276 (1998); Endres et al., J Cerebral Blood Flow and Metabolism, 18, 238, (1998); Cheng et al. , J. Clin. Invest., 101, 1992 (1998); Yakovlev et al., J Neuroscience, 17, 7415 (1997); Rodriquez et al., J. Exp. Med., 184, 2067 (1996); Grobmyer et al., Mol. Med., 5, 585 (1999).
В общем случае пептидные ингибиторы, описанные выше, обладают весьма мощным действием в отношении некоторых каспаз. Тем не менее, их эффективность не всегда отражается в клеточных моделях апоптоза. Кроме того, пептидные ингибиторы обычно характеризуются нежелательными фармакологическими свойствами, такими как слабая абсорбция при пероральном приеме, низкая стабильность и быстрый метаболизм. Plattner и Norbeck, в Drug Discovery Technologies, Clark and Moos, Eds. (Ellis Horwood, Chichester, England, 1990).
Учитывая необходимость в улучшении фармакологических свойств пептидных ингибиторов каспаз, появились сообщения о пептидомиметических ингибиторах. Среди них сообщается об ингибиторах, в которых P3 аминокислота замещена производными 3-аминопиридин-2-онов и 5-аминопиридин-4-онов (Патент США 5,756,466 (Bemis et al.); PCT WO 95/35308 (Bemis et al.); Dolle et al. J. Med. Chem. 39, 2438, (1996); Golec et al. Bioorg. Med. Chem. Lett. 7, 2181, (1997); Semple et al, Biorg. Med. Chem. Lett. 7, 1337, (1997)).
Из-за характерных недостатков пептидных ингибиторов сохраняется необходимость в малых молекулах, непептидных ингибиторах каспаз, которые являются мощными, стабильными и проникают через мембраны, обеспечивая эффективное ингибирование апоптоза in vivo. Такие соединения будут исключительно полезны в лечении вышеперечисленных заболеваний, в которых каспазы играют существенную роль.
Сущность изобретения
Настоящее изобретение обеспечивает соединение формулы I:
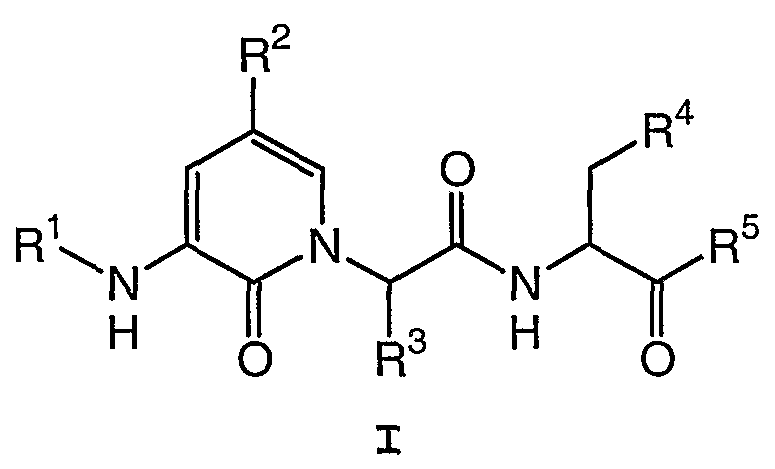
где: R1, R2, R3, R4 и R5 имеют значения, определенные в настоящем описании.
Настоящее изобретение также обеспечивает фармацевтические композиции, содержащие соединение формулы I и способы применения таких соединений и композиций для лечения опосредованных каспазой заболеваний. Настоящее изобретение также обеспечивает способы получения соединений формулы I.
Подробное описание изобретения
Настоящее изобретение обеспечивает соединение формулы I:
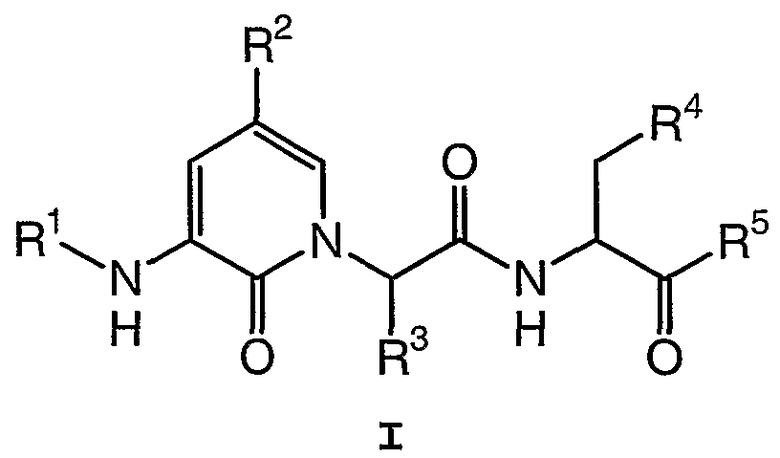
где:
R1 представляет собой R6C(O)-, HC(O)-, R6SO2-, R6OC(O)-, (R6)2NC(O)-, (R6)(H)NC(O)-, R6C(O)C(O)-, (R6)2NC(O)C(O)-, (R6)(H)NC(O)C(O)- или R6OC(O)C(O)-;
R2 представляет собой водород, -CF3, галоген, -OR7, -NO2, -OCF3, -CN или R8;
R3 представляет собой -T-R9;
R4 представляет собой -COOH или -COOR8;
R5 представляет собой -CH2F или -CH2О-2,3,5,6-тетрафторфенил;
R6 представляет собой R6a или R6b; две R6 группы вместе с тем же атомом, к которому они присоединены, необязательно образуют 3-10-членное ароматическое или неароматическое кольцо; где кольцо необязательно конденсировано с (C6-C10)арилом, (C5-C10)гетероарилом, (C3-C10)циклоалкилом или (C3-C10)гетероциклилом; где до 3 алифатических атомов углерода могут быть замещены группой, выбранной из O, N, N(R7), S, SO и SO2; и где каждый R6 независимо замещен до 6 заместителями, независимо выбранными из R;
R6a и R6b каждый независимо представляет собой (C1-C3)-алифатическую группу, (C4-C12)-алифатическую группу, (C3-C10)-циклоалифатическую группу, (C6-C10)-арил-, (C3-C10)-гетероциклил-, (C5-C10)-гетероарил-, (C3-C10)-циклоалифатик-(C1-C12)-алифатическую группу, (C6-C10)-арил-(C1-C12)-алифатическую группу, (C3-C10)-гетероциклил-(C1-C12)-алифатическую группу, (C5-C10)-гетероарил(C1-C12)-алифатическую группу;
R представляет собой галоген, -OR7, -OC(O)N(R7)2, -NO2, -CN, -CF3, -OCF3, -R7, оксо, тиоксо, =NR7, =N(OR7), 1,2-метилендиокси, 1,2-этилендиокси, -N(R7)2, -SR7, -SOR7, -SO2R7, -SO2N(R7)2, -SO3R7, -C(O)R7, -C(O)C(O)R7, -C(O)C(O)OR7, -C(O)C(O)N(R7)2, -C(O)CH2C(O)R7, -C(S)R7, -C(S)OR7, -C(O)OR7, -OC(O)R7, -C(O)N(R7)2, -OC(О)N(R7)2, -C(S)N(R7)2, -(CH2)0-2NHC(O)R7, -N(R7)N(R7)COR7, -N(R7)N(R7)C(О)OR7, -N(R7)N(R7)CON(R7)2, -N(R7)SО2R7, -N(R7)SO2N(R7)2, -N(R7)C(O)OR7, -N(R7)C(O)R7, -N(R7)C(S)R7, -N(R7)C(О)N(R7)2, -N(R7)C(S)N(R7)2, -N(COR7)COR7, -N(OR7)R7, -C(=NR7)N(R7)2, -C(O)N(OR7)R7, -C(=NOR7)R7, -OP(O)(OR7)2, -P(O)(R7)2, -P(О)(OR7)2 или -P(O)(H)(OR7);
две R7 группы вместе с атомами, к которым они присоединены, необязательно образуют 3-10-членное ароматическое или неароматическое кольцо, имеющее до 3 гетероатомов, независимо выбранных из N, N(R7), O, S, SO или SO2, где кольцо необязательно конденсировано с (C6-C10)арилом, (C5-C10)гетероарилом, (C3-C10)циклоалкилом или (C3-C10)гетероциклилом и где любое кольцо имеет до 3 заместителей, независимо выбранных из J2; или
каждый R7 независимо выбран из:
водорода,
(C1-C12)-алифатической группы,
(C3-C10)-циклоалифатической группы,
(C3-C10)-циклоалифатик-(C1-C12)-алифатической группы,
(C6-C10)-арила,
(C6-C10)-арил-(C1-C12)алифатической группы,
(C3-C10)-гетероциклила,
(C6-C10)-гетероциклил-(C1-C12)алифатической группы,
(C5-C10)-гетероарила или
(C5-C10)-гетероарил-(C1-C12)-алифатической группы; где R7 имеет до 3 заместителей, независимо выбранных из J2; и
J2 представляет собой галоген, -OR7, -OC(O)N(R7)2, -NO2, -CN, -CF3, -OCF3, -R7, оксо, тиоксо, =NR7, =NOR7, 1,2-метилендиокси, 1,2-этилендиокси, -N(R7)2, -SR7, -SOR7, -SO2R7, -SO2N(R7)2, -SO3R7, -C(O)R7, -C(O)C(O)R7, -C(O)C(O)OR7, -C(O)C(O)N(R7)2, -C(O)CH2C(O)R7, -C(S)R7, -C(S)OR7, -C(O)OR7, -OC(O)R7, -C(O)N(R7)2, -OC(О)N(R7)2, -C(S)N(R7)2, -(CH2)0-2NHC(O)R7, -N(R7)N(R7)COR7, -N(R7)N(R7)C(O)OR7, -N(R7)N(R7)CON(R7)2, -N(R7)SO2R7, -N(R7)SO2N(R7)2, -N(R7)C(O)OR7, -N(R7)C(O)R7, -N(R7)C(S)R7, -N(R7)C(О)N(R7)2, -N(R7)C(S)N(R7)2, -N(COR7)COR7, -N(OR7)R7, -CN, -C(=NR7)N(R7)2, -C(O)N(OR7)R7, -C(=NOR7)R7, -OP(O)(OR7)2, -P(O)(R7)2, -P(O)(OR7)2 или -P(O)(H)(OR7); и
R8 представляет собой
(C1-C12)-алифатическую группу,
(C3-C10)-циклоалифатическую группу,
(C6-C10)-арил-,
(C3-C10)-гетероциклил-,
(C5-C10)-гетероарил-,
(C3-C10)-циклоалифатик-(C1-C12)-алифатическую группу,
(C6-C10)-арил-(C1-C12)-алифатическую группу,
(C3-C10)-гетероциклил-(C1-C12)-алифатическую группу или
(C5-C10)-гетероарил-(C1-C12)-алифатическую группу, где до 3 алифатических атомов углерода могут быть замещены группой, выбранной из O, N, N(R7), S, SO и SO2, и где R8 необязательно замещен до 6 заместителями, независимо выбранными из R.
T представляет собой прямую связь или (C1-C6)алифатическую группу, где до 2 алифатических атомов углерода в T могут быть необязательно замещены S, -SO-, SO2, O, N(R7) или N в химически стабильном положении; где каждый T может быть необязательно замещен до 3 R заместителями;
R9 является необязательно замещенным (C6-C10)-арилом или (C5-C10)-гетероарилом.
В соответствии с первым воплощением настоящего изобретения R1 представляет собой R6C(O)-, (R6)2NC(O)-, R6C(O)C(O)-, (R6)2NC(O)C(O)-, (R6)(H)NC(O)C(O)- или R6OC(O)C(O)-. В некоторых воплощениях R6 представляет собой R6a. В других воплощениях R6 представляет собой R6b.
В соответствии с другим воплощением R1 представляет собой HC(O)-, R6SO2-, R6OC(O)- или (R6)(H)NC(O)-. В некоторых воплощениях R6 представляет собой R6a. В других воплощениях R6 представляет собой R6b.
В соответствии с другим воплощением R1 представляет собой R6C(O)- или R6SO2-. В другом воплощении R1 представляет собой R6C(O)-. В другом воплощении R1 представляет собой R6SO2-.
В соответствии с еще одним воплощением настоящего изобретения R1 представляет собой (R6)2NC(О)-, (R6)(H)NC(O)- или (R6)OC(О)-. В предпочтительном воплощении R1 представляет собой (R6)2NC(O)-. В еще одним предпочтительном воплощении R1 представляет собой (R6)(H)NC(O)-. В еще другом предпочтительном воплощении R1 представляет собой (R6)OC(O)-.
В соответствии с одним воплощением настоящего изобретения R6 представляет собой R6a. В соответствии с другим воплощением R6 представляет собой R6b. В соответствии с третьим воплощением R6 представляет собой R6a или R6b.
В одном воплощении настоящего изобретения
R6а представляет собой
(C4-C12)-алифатическую группу,
(C3-C10)-циклоалифатическую группу,
(C6-C10)-арил-,
(C3-C10)-гетероциклил-,
(C5-C10)-гетероарил-,
(C3-C10)-циклоалифатик-(C1-C12)-алифатическую группу,
(C6-C10)-арил-(C1-C12)-алифатическую группу,
(C3-C10)-гетероциклил-(C1-C12)-алифатическую группу,
(C5-C10)-гетероарил(C1-C12)-алифатическую группу, или две R6a группы, вместе с атомом, к которому они присоединены, необязательно образуют 3-10-членное ароматическое или неароматическое кольцо; где кольцо необязательно конденсировано с (C6-C10)арилом, (C5-C10)гетероарилом, (C3-C10)циклоалкилом или (C3-C10)гетероциклилом; где до 3 алифатических атомов углерода могут быть замещены группой, выбранной из O, N, N(R7), S, SO и SО2; и где R6a замещен до 6 заместителями, независимо выбранными из R;
R6b представляет собой R6a или (С1-С3)-алифатическую группу.
В еще одном воплощении настоящего изобретения R6а представляет собой
(C1-C4)-алифатическую группу,
(C3-C10)-циклоалифатическую группу,
(C3-C10)-гетероциклил,
(C5-C10)-гетероарил,
(C6-C10)-арил- или
(C6-C10)-арил-(C1-C12)-алифатическую группу (понятно, что необязательно до 3 алифатических атомов углерода могут быть замещены группой, выбранной из O, N, N(R7), S, SO и SO2; и где R6a необязательно замещен до 6 заместителями, независимо выбранными из R; или R6a замещен, как раскрыто в любом из воплощений в настоящем описании).
В другом воплощении каждый R6a независимо представляет собой
(C4)-алифатическую группу,
(C3-C10)-циклоалифатическую группу,
(C3-C10)-гетероциклил,
(C5-C10)-гетероарил,
(C6-C10)-арил- или
(C6-C10)-арил-(C1-C12)-алифатическую группу (понятно, что необязательно до 3 алифатических атомов углерода могут быть замещены группой, выбранной из O, N, N(R7), S, SO и SO2; и где R6a необязательно замещен до 6 заместителями, независимо выбранными из R; или R6a замещен, как раскрыто в любом из воплощений в настоящем описании).
В одном воплощении каждый R6a независимо представляет собой (C4)-алифатическую группу, (C3-C7)-циклоалифатическую группу, (C6-C10)-арил- или (C5-C10)-гетероарил; где гетероарил и арил являются независимыми и необязательно замещенными, или каждый R6 вместе с N-атомом, к которому он присоединен, представляет собой (C3-C7)-циклоалифатическую группу.
В соответствии с другим воплощением каждый R6a независимо представляет собой (C3-C7)-циклоалифатическую группу, (C6-C10)-арил- или (C5-C10)-гетероарил, где гетероарил и арил являются независимыми и необязательно замещенными, или каждый R6 вместе с N-атомом, к которому он присоединен, представляет собой (C3-C7)-циклоалифатическую группу.
В другом воплощении каждый R6a независимо представляет собой (C4)-алифатическую группу, (C5-C10)-гетероарил- или (C6-C10)-арил-; где гетероарил или арил является необязательно замещенным, или где две R6a группы вместе с N-атомом, к которому они присоединены, образуют (C3-C7)-циклоалифатическую группу; в предпочтительном воплощении каждый R6a независимо представляет собой (C5-C10)-гетероарил- или (C6-C10)-арил-.
В другом воплощении каждый R6a независимо представляет собой H, (C4)-алифатическую группу или (C6-C10)-арил-. В предпочтительном воплощении каждый R6а представляет собой (C6-C10)-арил- или каждый R6a вместе с N-атомом, к которому он присоединен, представляет собой (C3-C7)-циклоалифатическую группу.
В другом воплощении каждый R6a независимо представляет собой (C4)-алифатическую группу или (C6-C10)-арил-, где арил является необязательно замещенным, или где две R6 группы вместе с N-атомом, к которому они присоединены, образуют (C3-C7)-циклоалифатическую группу. В другом воплощении каждый R6a независимо представляет собой (C6-C10)-арил-.
В соответствии с определенными воплощениями каждый R6b независимо представляет собой R6a или (C1-C3)-алифатическую группу.
В соответствии с одним воплощением настоящего изобретения R2 представляет собой водород, C1-, C2-, C3- или C4-алкил-, -CF3, -Cl, -OR7, -NO2, -OCF3 или -CN. Более предпочтительно, R2 представляет собой водород, C1-алкил-, C2-алкил- или CF3. Более предпочтительно, R2 представляет собой водород или CF3.
В соответствии с одним воплощением T представляет собой (C1-C4) алифатическую группу, где до одного алифатического атома углерода могут быть замещены группой, выбранной из O, N, N(R7) и S.
В соответствии с другим воплощением T представляет собой (C1-C4)алифатическую группу, где ноль алифатических атомов углерода замещены группой, выбранной из O, N, N(R7) и S.
В еще другом воплощении T представляет собой прямую связь, -CH2-, -CH(Me)-, -CH2-CH2-, -CH2-O-CH2-, -CH(Me)-O-CH2- или -CH2-CH2-O-CH2-.
В первом воплощении T представляет собой -CH2- или -CH2-CH2-; в другом воплощении T представляет собой -CH2-.
В соответствии с другим воплощением R9 является необязательно замещенным C6-арилом или C5-гетероарилом.
В соответствии с одним воплощением R9 представляет собой замещенный фенил. Примеры предпочтительных фенильных заместителей для R9 включают галоген, -OR7, -NO2, -CF3, -OCF3, -R7, -О-бензил, -О-фенил, 1,2-метилендиокси, 1,2-этилендиокси, -N(R7)2, -C(O)R7, -COOR7 и -CON(R7)2, где R7 определен, как указано выше.
В соответствии с другим воплощением R9 представляет собой незамещенный фенил.
В соответствии с одним воплощением R5 представляет собой -CH2О-2,3,5,6-тетрафторфенил.
В соответствии с другим воплощением R5 представляет собой -CH2F.
В соответствии с другим воплощением R8 представляет собой (C1-C12)-алкил. Более предпочтительно, R8 представляет собой (C1-C4)-алкил.
В соответствии с предпочтительным воплощением каждый R и J2 являются независимо галогеном, -OR7, -OC(O)N(R7)2, -NO2, -CN, -CF3, -OCF3, -R7, оксо, 1,2-метилендиокси, 1,2-этилендиокси, -N(R7)2, -C(O)R7, -C(O)C(O)R7, -C(O)OR7, -OC(O)R7, -C(О)N(R7)2 или -OC(O)N(R7)2.
Как используют в настоящем описании, обозначения атома углерода могут быть представлены целым числом и любым промежуточным числом. Например, число атомов углерода в (C1-C4)-алкильной группе равно 1, 2, 3 или 4. Должно быть понятно, что это обозначение имеет отношение к общему числу атомов в соответствующей группе. Например, в (C3-C10)-гетероциклиле общее число атомов углерода и гетероатомов равно 3 (как в азиридине), 4, 5, 6 (как в морфолине), 7, 8, 9 или 10.
Как используют в настоящем описании, алифатическая группа включает группы с прямой цепью и разветвленной цепью, имеющие конкретное число атомов. Если число атомов не определено конкретно, алифатическая группа имеет от 1 дo 12 атомов углерода. Как должно быть понятно, алкенил и/или алкинильные алифатические группы имеют минимально 2 атома углерода. Предпочтительно, алифатические группы представляют собой алкильные группы (предпочтительно, имеющие от 1 дo 6 атомов).
Таким образом, если иное не указано, предпочтительными алифатическими группами настоящего изобретения являются алкильные группы, и они имеют 1, 2, 3, 4, 5 или 6 атомов углерода. Более предпочтительные алкильные группы имеют 1, 2, 3 или 4 атомов углерода. Предпочтительные алкенильные и алкинильные группы настоящего изобретения имеют 2, 3, 4, 5 или 6 атомов углерода, и более предпочтительные - от 2, 3 или 4 атомов углерода.
Циклоалкильные и циклоалкенильные группы имеют от 3 до 10 атомов углерода и являются моноциклическими или бициклическими, включая линейно конденсированные, мостиковые или спироциклические. Циклоалифатическая группа предпочтительно является циклоалкилом или циклоалкенилом. Более предпочтительные циклоалифатические группы представляют собой 3-, 4-, 5-, 6- или 7-членные кольца, которые более предпочтительно представляют собой циклоалкильные кольца.
Как используют в настоящем описании, термин "ароматическая группа" или "арил" относится к 6-10-членной кольцевой системе, которая содержит, по крайней мере, одно ароматическое кольцо. Пример ароматических колец включает фенил и нафтил.
Как используют в настоящем описании, термин "гетероарил" относится к кольцевой системе, имеющей 5-10 членов и 1, 2 или 3 гетероатома, независимо выбранных из N, N(R7), O, S, SO и SО2, где, по крайней мере, одно кольцо является гетероароматическим (например, пиридил, тиофен или тиазол). Предпочтительные гетероарильные группы представляют собой 5- или 6-членные кольца, имеющее 1 или 2 гетероатома. В определенных воплощениях настоящего изобретения, более предпочтительно, гетероарильные группы представляют собой те, которые содержат "=N" группу.
Примеры гетероарильных колец включают 2-фуранил, 3-фуранил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, бензимидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, N-пирролил, 2-пирролил, 3-пирролил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, пиридазинил (например, 3-пиридазинил), 2-тиазолил, 4-тиазолил, 5-тиазолил, тетразолил (например, 5-тетразолил), триазолил (например, 2-триазолил и 5-триазолил), 2-тиенил, 3-тиенил, бензoфурил, бензoтиофенил, индолил (например, 2-индолил), пиразолил (например, 2-пиразолил), изотиазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, 1,2,4-оксадиазолил, 1,2,3-триазолил, 1,2,3-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, пуринил, пиразинил, 1,3,5-триазинил, хинолинил (например, 2-хинолинил, 3-хинолинил, 4-хинолинил) и изохинолинил (например, 1-изохинолинил, 3-изохинолинил или 4-изохинолинил).
Как используют в настоящем описании, "гетероцикл" относится к кольцевой системе, имеющей 3-10 членов и 1, 2 или 3 гетероатома, независимо выбранных из N, N(R7), O, S, SO и SО2, где ни одно кольцо не является ароматическим (например, пиперидин и морфолин). Предпочтительные гетероциклильные группы представляют собой 5- или 6-членные кольца, имеющие 1 или 2 гетероатома.
Примеры гетероциклических колец включают 3-1H-бензимидазол-2-oн, 3-(1-алкил)-бензимидазол-2-oн, 2-тетрагидрофуранил, 3-тетрагидрофуранил, 2-тетрагидротиофенил, 3-тетрагидротиофенил, 2-морфолино, 3-морфолино, 4-морфолино, 2-тиоморфолино, 3-тиоморфолино, 4-тиоморфолино, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, 1-тетрагидропиперазинил, 2-тетрагидропиперазинил, 3-тетрагидропиперазинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 1-пиразолинил, 3-пиразолинил, 4-пиразолинил, 5-пиразолинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил, 2-тиазолидинил, 3-тиазолидинил, 4-тиазолидинил, 1-имидазолидинил, 2-имидазолидинил, 4-имидазолидинил, 5-имидазолидинил, индолинил, тетрагидрохинолинил, тетрагидроизохинолинил, бензотиолан, бензодитиан и 1,3-дигидро-имидазол-2-oн.
Любая из этих циклоалифатических, гетероциклических и гетероарильных групп является необязательно конденсированной с 5- или 6-членным арильным или гетероарильным кольцом. Кроме того, каждая из любой алифатической, арильной, циклоалифатической, гетероарильной и гетероциклильной групп может содержать соответствующие заместители (предпочтительно до 5, более предпочтительно до 3 и даже более предпочтительно, 0 или 1), независимо выбранных из, например, карбонила и R. Предпочтительные заместители (включая R и J2) представляют собой галоген, -OR7, -NO2, -CF3, -OCF3, -R7, оксо, -OR7, -О-бензил, -О-фенил, 1,2-метилендиокси, 1,2-этилендиокси, -N(R7)2, -C(O)R7, -COOR7 или -CON(R7)2, где R7 определен в настоящем описании (и предпочтительно представляет собой H, (C1-C6)-алкил или (C2-C6)-алкенил и алкинил), с (C1-C6)-алкилом, являющимся более предпочтительным). Должно быть понятно, что это определение должно включать перфторированную алкильную группу.
В воплощениях настоящего изобретения там, где R представляет собой заместитель на атоме азота, предпочтительно R группы выбраны из группы, состоящей из -R7, -SOR7, -SO2R7, -SO2N(R7)2, -SO3R7, -C(O)R7, -C(O)C(O)R7, -C(O)C(O)OR7, -C(О)C(О)N(R7)2, -C(O)CH2C(O)R7, -C(S)R7, -C(S)OR7, -C(O)OR7, -C(О)N(R7)2, -C(S)N(R7)2, -(CH2)0-2NHC(О)R7, -N(R7)N(R7)COR7, -N(R7)N(R7)C(О)OR7, -N(R7)N(R7)CON(R7)2, -N(R7)SО2R7, -N(R7)SO2N(R7)2, -N(R7)C(О)OR7, -N(R7)C(O)R7, -N(R7)C(S)R7, -N(R7)C(О)N(R7)2, -N(R7)C(S)N(R7)2, -N(COR7)COR7, -N(OR7)R7, -C(=NR7)N(R7)2, -C(О)N(OR7)R7, -C(=NOR7)R7, -OP(O)(OR7)2, -P(O)(R7)2, -P(O)(OR7)2 и -P(O)(H)(OR7), где R7 определен в настоящем описании (и предпочтительно представляет собой H, (C1-C6)-алкил или (C2-C6)-алкенил и алкинил), с (C1-C6)-алкилом, являющимся более предпочтительным). Более предпочтительно такие R группы выбраны из группы, состоящей из -R7 и -C(O)R7.
Должно быть понятно, что в качестве небольших молекул, непептидных ингибиторов каспазы, соединения настоящего изобретения должны иметь приемлемое число заместителей, особенно в изменяемых группах, которые сами являются заместителями. Таким образом, если первая R7 группа содержит заместитель J2, который содержит вторую R7 группу, вторая R7 группа не должна предпочтительно быть замещенной с помощью еще одной группы J2.
В предпочтительных соединениях настоящего изобретения стереохимия является той, как изображено ниже:
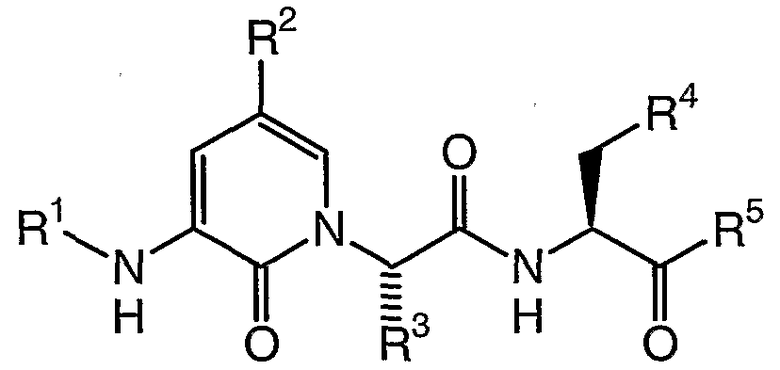
Любые из воплощений, раскрытых в настоящем описании, могут быть объединены, чтобы обеспечить альтернативные воплощения настоящего изобретения. Конкретные воплощения настоящего изобретения могут быть выбраны из заместителей соединений, представленных в Таблице 1.
Соединения по настоящему изобретению представляют собой широкий круг ингибиторов каспазы и имеют улучшенную способность по сравнению с известными соединениями с точки зрения ингибирования апоптоза.
В соответствии с одним воплощением настоящее изобретение обеспечивает соединение формулы Ia или Ib:
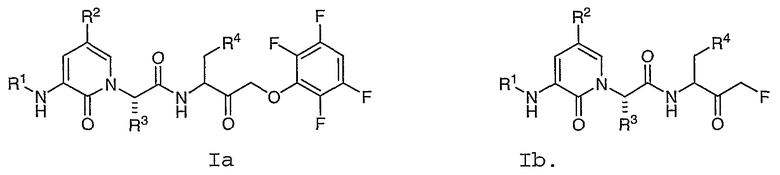
В соответствии с другим воплощением настоящее изобретение обеспечивает соединение формулы Ic или Id:
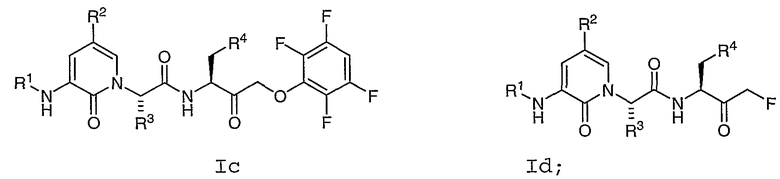
где R1, R2, R3 и R4 имеют значения, определенные в любом из воплощений в настоящем описании.
В соответствии с более предпочтительным воплощением настоящее изобретение обеспечивает соединение формулы II, выбранное из представленных в Таблице 1, приведенной ниже:
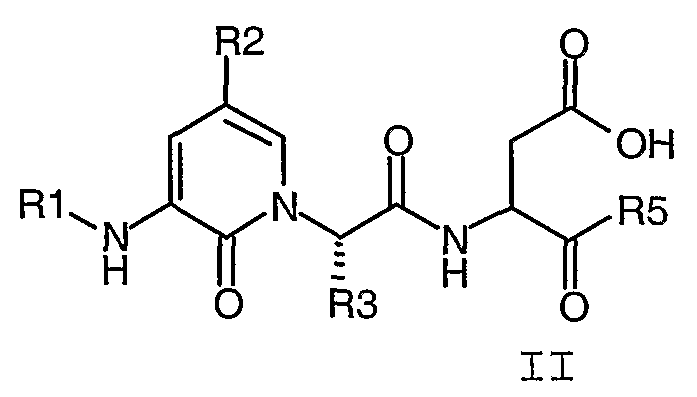
В Таблице 1, представленной ниже, используют следующие определения: "Ph" представляет собой фенил, "Bn" представляет собой бензил [-CH2-Ph], "Et" представляет собой этил [-CH2-CH3] и "iso-Pr" представляет собой изопропил [-CH(CH3)2].
Соединения по изобретению
В соответствии с другим воплощением настоящее изобретение обеспечивает фармацевтическую композицию, содержащую:
а) соединение формулы I, как определено в настоящем описании, или его фармацевтически приемлемую соль и
b) фармацевтически приемлемый носитель, адъювант или наполнитель.
Специалисту в данной области очевидно, что определенные соединения по настоящему изобретению могут существовать в таутомерных формах или гидратных формах, все такие формы соединений находятся в рамках настоящего изобретения. Если иное не установлено, структуры, изображенные в настоящем описании, также определены как структуры, включающие все стереохимические формы; то есть R- и S-конфигурации для каждого асимметричного центра. Следовательно, единственные стереохимические изомеры, так же как энантиомерные и диастереомерные смеси данных соединений, находятся в рамках настоящего изобретения. Если иное не установлено, структуры, изображенные в настоящем описании, также предназначены для включения соединений, которые отличаются только присутствием одного или большего числа изотопно обогащенных атомов. Например, соединения, имеющие данные структуры, за исключением замещения водорода на дейтерий или тритий, или замещение атома углерода на обогащенный атом углерода 13C- или 14C-, находятся в рамках настоящего изобретения.
Соединения настоящего изобретения могут быть получены, как правило, с помощью общих способов, известных специалисту в данной области для аналогичных соединений и с помощью последующих препаративных примеров. См., например, WO 2004/106304, которая включена в настоящее описание в качестве ссылки. Для иллюстративных целей представлены следующие Схемы I-III синтеза соединений по настоящему изобретению. Должно быть понятно, что любая защитная группа, изображенная на схемах, может быть различна, как подходящая, принимая во внимание совместимость с другими заместителями
Различные защитные группы могут быть применены в способах настоящего изобретения (см., например, T.W. Greene & P.G.M Wutz, "Protective Grups in Organic Synthesis", 3rd Edition, John Wiley & Sons, Inc. (1999) и ранние публикации этой книги). Типичными функциональными группами, которые должны быть защищены, являются амины. Любые амины и другие функциональные группы могут быть защищены в соответствии со способами, известными специалисту в данной области. Соединения, содержащие амины, могут быть применены с или без выделения из реакционной смеси.
Схема I

Схема I (а) EDC/DMAP/HOBt/ТГФ; (b) периодинан Десс-Мартина (Dess-Martin periodinane); (c) TFA/DCM
На Схеме I, представленной выше, используют следующие сокращения: EDC представляет собой 1-(3-диметиламинопропил)-3-этилкарбодиимид; HOBt представляет собой 1-гидроксибензoтриазол; ТГФ представляет собой тетрагидрофуран; TFА представляет собой трифторуксусную кислоту; DCM представляет собой дихлорметан; DMAP представляет собой 4-диметиламинопиридин. Кислоту 1 связывают с аминоспиртом 2. Связывание проводят, как изображено в описании, используя EDC/DMAP/HOBt/ТГФ, тем не менее, также могут быть использованы другие подходящие условия. В зависимости от основного свойства R4 и R5 может быть применен аминокетон вместо аминоспирта, таким образом исключается последующая стадия окисления. В случае фторметилкетонов, где R5 представляет собой CH2F, аминоспирт 2 может быть получен в соответствии со способом от Revesz et al., Tetrahedron Lett. 1994, 35, 9693. В случае тетрафторфеноксикетонов, где R5 представляет собой -CH2О-2,3,5,6-тетрафторфенил, аминоспирт 2 может быть получен с помощью способов, аналогичных тем, которые описаны у Semple et al., Bioorganic and Medicinal Chemistry Letters, 1997, 7, 1337 (Схема II).
Наконец, гидроксигруппа в соединении 3 является окисленной (например, с периодинаном Десс-Мартина), и полученное соединение обрабатывают подходящим образом в соответствии с природой R4. Например, в продукте I, если R4 продставляет собой карбоновую кислоту, тогда R4 в соединении 3 предпочтительно представляет сложный эфир, который гидролизуют на конечной стадии схемы. Если этот сложный эфир представляет собой трет-бутиловый эфир (то есть если R4 представляет собой CO2tBu), обработка трифторуксусной кислотой будет давать кислоту. Сложный эфир предпочтительно представляет собой трет-бутиловый эфир, когда другие заместители в продукте I являются совместимыми с кислотными условиями.
Если R4 в продукте I представляет собой сложный эфир, желаемый эфир может быть получен путем этерификации соответствующей кислоты или при наличии требуемой сложноэфирной группы, уже присутствующей в соединении 2.
Схема II
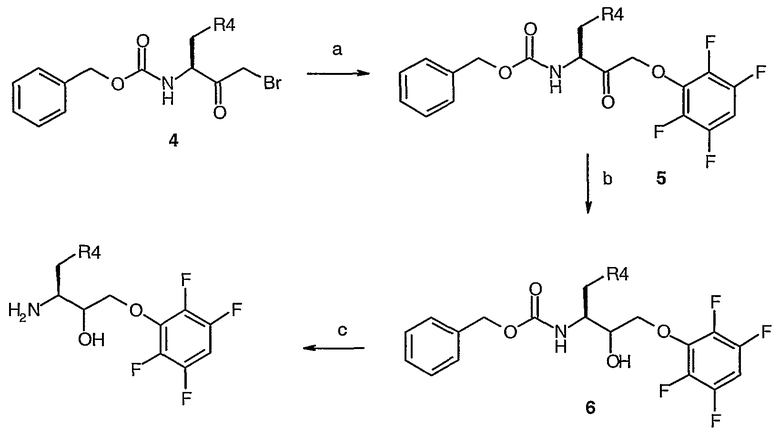
Схема II (а)KF/ДМФА/ArOH; (b) NaBH4/ТГФ; (c) H2/Pd/C/MeOH
На схеме II, указанной выше, используют следующие сокращения: KF представляет собой фторид калия; ДМФА представляет собой N,N-диметилформамид; ArOH представляет собой 2,3,5,6-тетрафторфенол; ТГФ представляет собой тетрагидрофуран; MeOH представляет собой метанол. Коммерчески доступный бромкетон 4 (R4=CО2tBu) взаимодействует с 2,3,5,6-тетрафторфенолом и фторидом калия, что дает феноксикетон 5. Кетон затем восстанавливают с помощью подходящего агента восстановления, например боргидрида натрия, что дает спирт 6, который гидрируют, используя газообразный водород и подходящий катализатор, например палладий на угле, что дает аминоспирт 2 (R4= CО2tBu, R5= CH2О-2,3,5,6-тетрафторфенил).
Схема III
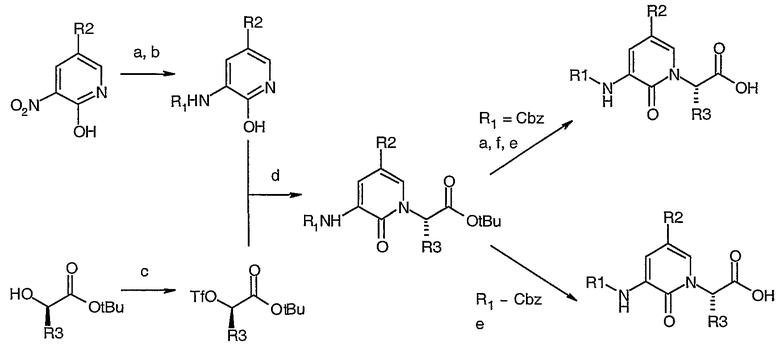
Схема III (а) H2 Pd/C MeOH; (b) R1-Cl, Na2CO3, H2О/ТГФ; (c) (CF3SO2)2О, 2,6-Литидин, DCM; (d) NaH, ТГФ; (e) TFA/DCM; (f) R1-Cl, Et3N, DMAP, DCM.
На Схеме III используют следующие сокращения: Cbz представляет собой бензилоксикарбонильную защитную группу; MeOH представляет собой метанол; DCM представляет собой дихлорметан; TFА представляет собой трифторуксусную кислоту; DMAP представляет собой 4-диметиламинопиридин; ТГФ представляет собой тетрагидрофуран. Производные 1 пиридоновой кислоты могут быть получены в хиральной форме, используя синтетическую последовательность, показанную на Схеме III. Коммерчески доступный нитропиридон восстанавливают дo амина с помощью водорода и смеси палладий/уголь. Аминогруппу затем заменяют на другую функциональную группу соответствующим электрофилом: в случае R1=Cbz получают бензилоксикарбонил, защищающий амин, используя методику, аналогичную методике, описанной у Warner et al. J. Med. Chem. 1994, 37(19), 3090-3099. В других случаях амин превращают в производные, используя обычные способы. Сложный (R)-трет-бутил-2-гидроксиэфир обрабатывают трифторметансульфоновым ангидридом и 2,6-литидином в DCM, что дает соответствующий трифлат. Реакция трифлата с анионом функционализированного 2-гидроксипиридина (полученного путем депротонирования гидридом натрия в ТГФ) дает N-алкилированный пиридон. Когда R1 представляет собой бензилоксикарбонильную защитную группу, он может быть удален на этой стадии, используя водород и палладий на угле, что дает амин; указанный амин затем взаимодействует с соответствующим электрофилом, триэтиламином и DMAP в DCM. Например, если требуется, чтобы R1 имел значение R6C=O (амид), тогда может быть применен соответственно замещенный хлорангидрид. Если требуется, чтобы R1 имел значение R6S(=О)2 (сульфонамид), тогда может быть применен соответственно замещенный сульфонилхлорид. Если R1 представляет собой (R6)2N(C=O) (мочевина), тогда может быть применен соответственно замещенный карбамоилхлорид или изоцинат. Другие R1 группы могут быть получены таким же образом. Кислоту 1 затем получают путем снятия защиты со сложного эфира, например, используя трифторуксусную кислоту. Кислоту затем связывают с аминоспиртом 2 (Схема 1).
Схема IV
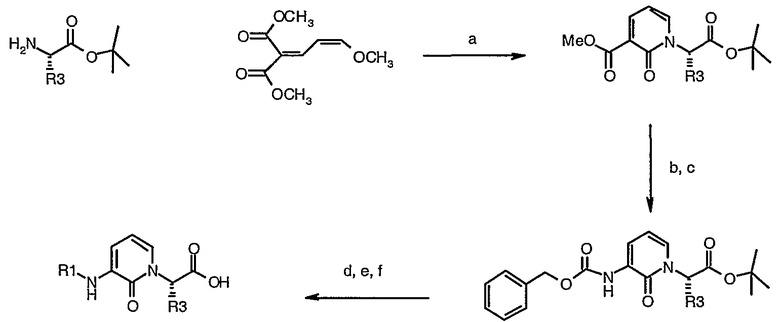
Схема IV (а) NaOMe, MeOH; (b) LiOH/H2О/диоксан; (c) DPPA, TEA, BnOH, диоксан; (d) H2 Pd/C MeOH; (e) R1-Cl, Et3N, DMAP, DCM; (f) TFA/DCM;
На Схеме IV используют следующие сокращения: MeOH представляет собой метанол; DPPA представляет собой дифенилфосфорилазид; BnOH представляет собой бензиловый спирт; TEА представляет собой триэтиламин; DCM представляет собой дихлорметан; TFА представляет собой трифторуксусную кислоту; ТГФ представляет собой тетрагидрофуран. Производные пиридоновых кислот 1 могут быть получены в хиральной форме, используя альтернативный путь, изображенный на Схеме IV. Реакция диметилового эфира 2-(3-метоксиаллилиден)малоновой кислоты и трет-бутиловых эфиров аминокислоты в присутствии метилата дает циклизованный пиридоновый продукт. Гидролиз метилового эфира в кислоту с последующей обработкой кислотой в условиях перегруппировки по Куртису в присутствии бензилового спирта дает защищенный бензилоксикарбонилом аминопиридон. Бензилоксикарбонильную защитную группу удаляют в условиях гидрогенолиза, и полученный амин затем взаимодействует с соответствующим электрофилом, триэтиламином и DMAP в DCM. Например, если требуется, чтобы R1 имел значение R6C=O (амид), тогда может быть применен соответственно замещенный хлорангидрид. Если требуется, чтобы R1 имел значение R6S(=О)2 (сульфонамид), тогда может быть применен соответственно замещенный сульфонилхлорид. Если R1 представляет собой (R6)2N(C=O) (мочевина), тогда может быть применен соответственно замещенный карбамоилхлорид или изоцинат. Другие R1 группы могут быть получены таким же образом. Кислоту 1 затем получают путем снятия защиты со сложного эфира с помощью, например, использования трифторуксусной кислоты. Кислоту затем связывают с аминоспиртом 2 (Схема 1).
Следовательно, еще одно воплощение настоящего изобретения обеспечивает способ получения соединения формулы I:
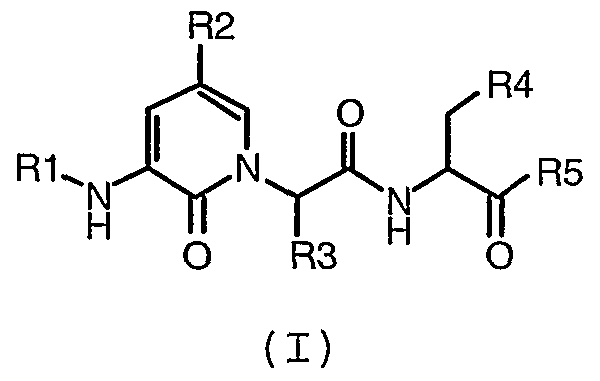
где R1, R2, R3, R4 и R5 имеют значения, определенные в любом из воплощений настоящего описания, включающий:
(а) взаимодействие соединения формулы (III):
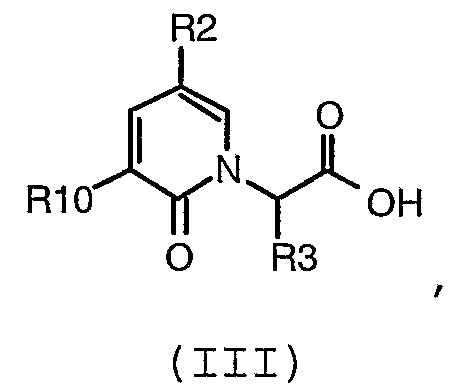
где:
R10 представляет собой -NO2, -C(O)OR11, R6C(O)N(H)-, R6SO2N(H)-, R6OC(O)N(H)-, (R6)2NC(O)N(H)-, R6C(O)C(O)N(H)-, (R6)2NC(О)C(О)N(H)- или R6OC(O)C(O)N(H)-;
R11 независимо представляет собой водород, (C1-C12)-алифатическую группу, (C3-C10)-циклоалифатическую группу, (C6-C10)-арил-, (C3-C10)-гетероциклил-, (C5-C10)-гетероарил-, (C3-C10)-циклоалифатик-(C1-C12)-алифатическую группу, (C6-C10)-арил-(C1-C12)-алифатическую группу, (C3-C10)-гетероциклил-(C1-C12)-алифатическую группу, (C5-C10)-гетероарил(C1-C12)-алифатическую группу, где до 3 алифатических атомов углерода могут быть замещены группой, выбранной из O, N(H), N(R7), S, SO и SO2, и где R11 необязательно замещен до 6 заместителями, независимо выбранными из R; и
R, R2, R3 и R6 имеют значения, определенные в любом из воплощений формулы (I) в настоящем описании;
с соединением формулы (IV):
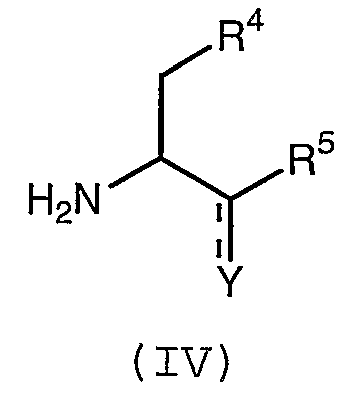
где Y представляет собой или карбонильную группу, или OH-группу и R4 и R5 имеют значения, как определенные в любом из воплощений формулы (I) в настоящем описании;
при наличии агентов пептидного связывания и растворителя;
при условии, что если Y представляет собой OH-группу, тогда способ дополнительно включает
b) окисление OH-группы, чтобы получить соединение формулы (I); и
при условии, что, если R10 представляет собой -NO2, -C(O)OR11 или -CN, способ дополнительно включает стадию превращения -NO2, -C(O)OR11 или -CN в R6C(O)N(H)-, R6SO2N(H)-, R6OC(O)N(H)-, (R6)2NC(О)N(H)-, R6C(O)C(O)N(H)-, (R6)2NC(О)C(О)N(H)- или R6OC(O)C(O)N(H)-.
Условия связывания могут быть известны любому практикующему специалисту в данной области для образования пептидильных связей. Предпочтительные условия связывания представляют собой EDC/DMAP/HOBt. Предпочтительный растворитель в указанных выше воплощениях представляет собой ТГФ.
В предпочтительном воплощении соединение формулы (III):
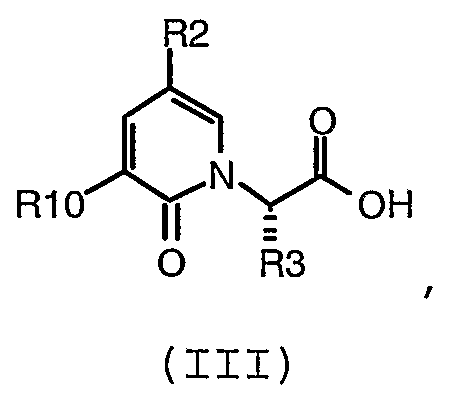
где R2, R3 и R9 имеют значения, определенные в настоящем описании; получают с помощью способа, включающего:
(c) взаимодействие соединения формулы (V):
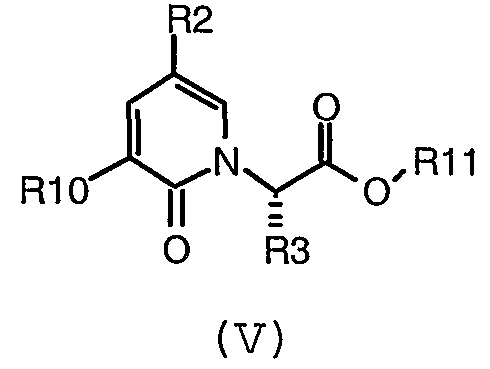
где R, R2, R3 и R10 имеют значения, определенные в настоящем описании; в растворителе при наличии условий снятия защиты.
Условия снятия защиты зависят от конкретной защитной группы (то есть R11). Например, если R11 представляет собой трет-бутил, тогда предпочтительные условия снятия защиты должны включать гидролиз кислоты. Предпочтительная кислота представляет собой TFA. Предпочтительный растворитель представляет DCM. Более предпочтительно, растворитель и условия гидролизации включают TFA и DCM. Если R11 представляет собой метил или этил, тогда предпочтительные условия снятия защиты должны быть основными (например, водный раствор NaOH). Если R11 представляет собой бензил, тогда бензильная группа должна быть удалена путем гидрогенолиза.
В предпочтительном воплощении соединение формулы (V):
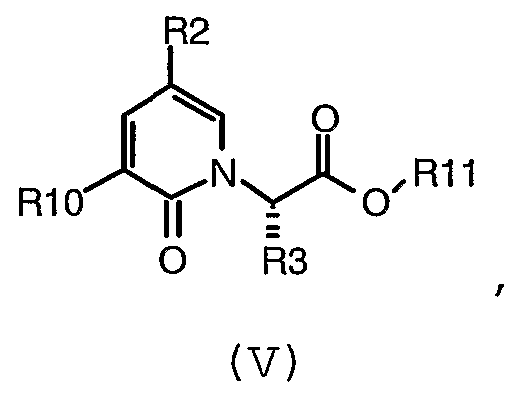
где R2, R3, R10 и R11 имеют значения, определенные в настоящем описании;
получают с помощью способа, включающего:
(d) взаимодействие соединения формулы (VI):
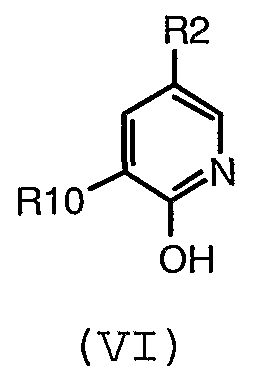
где R2 и R10 имеют значения, определенные в настоящем описании;
с соединением формулы (VII):
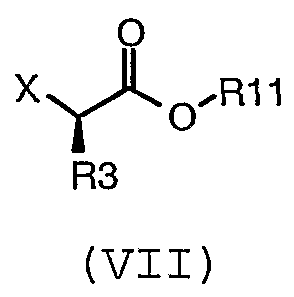
где X представляет собой подходящую уходящую группу; и
R3 и R11 имеют значения, определенные в настоящем описании;
в присутствии растворителя и основания.
Предпочтительно, X представляет собой -I, -Br, -Cl, -OH, алкилсульфонат или арилсульфонат. Когда X представляет собой -OH, соответствующая уходящая группа может быть образована in situ (например, как в реакции по Митсунобу). Предпочтительные сульфонаты включают -O-трифторметансульфонат, -O-метансульфонат, -O-бензолсульфонат, -O-п-толуолсульфонат, -О-м-нитробензолсульфонат и -О-п-нитробензолсульфонат. Подходящие уходящие группы, используемые в способах настоящего изобретения, хорошо известны специалисту в данной области. См., например, "March's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M.B. и March, J., John Wiley & Sons, New York (2001).
Может быть применен любой растворитель, который является совместимым с получением анионов. Предпочтительные растворители включают ДМФА, толуол и ТГФ.
Подходящие основания включают любые, которые могут удалить протон с гидроксигруппы в соединении формулы (V). Такие основания включают BuLi, LDA, LHMDS и NaH. Предпочтительное основание представляет собой NaH.
Еще одно воплощение настоящего изобретения обеспечивает способ получения соединения формулы (VIII):
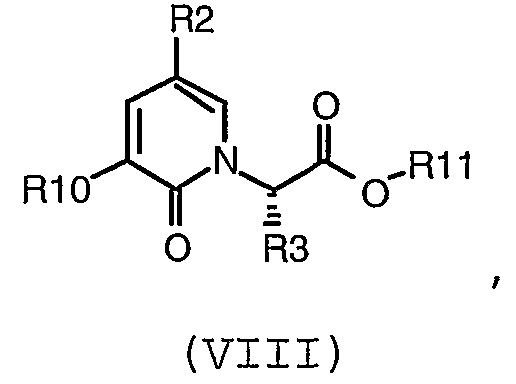
где:
R2 представляет собой -CF3, -Cl, -OR7, -NO2, -OCF3, -CN или R8; и
R3, R8, R10 и R11 имеют значения, определенные в настоящем описании;
включая стадию (e) взаимодействия соединения формулы (IX):
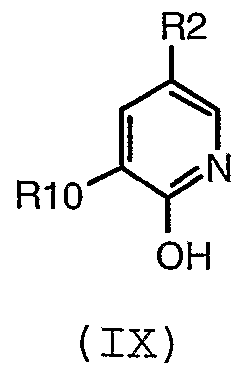
где R2 и R10 имеют значения, определенные в настоящем описании;
с соединением формулы (VII):
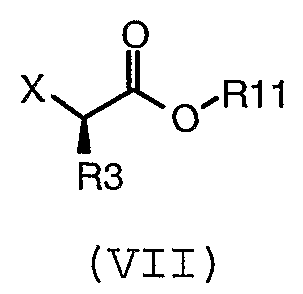
где R3 и R11 имеют значения, определенные в настоящем описании; и X представляет собой подходящую уходящую группу;
в присутствии растворителя и основания.
Предпочтительно, X представляет собой -I, -Br, -Cl, -OH, алкилсульфонат или арилсульфонат. Когда X представляет собой -OH, соответствующая уходящая группа может быть образована in situ (например, как в реакци по Митсунобу). Предпочтительно сульфонаты включают -О-трифторметансульфонат, -O-метансульфонат, -О-бензолсульфонат, -O-п-толуолсульфонат, -О-м-нитробензолсульфонат и -O-п-нитробензолсульфонат.
Может быть применен любой растворитель, являющийся совместимым с получением анионов. Такие растворители включают ДМФА, толуол и ТГФ. Предпочтительный растворитель представляет собой ТГФ.
Подходящие основания включают любые, которые могут удалить протон с гидроксигруппы в соединении формулы (V). Такие основания включают BuLi, LDA, LHMDS и NaH. Предпочтительное основание представляет собой NaH.
Еще одно воплощение настоящего изобретения обеспечивает способ получения соединения формулы (I):
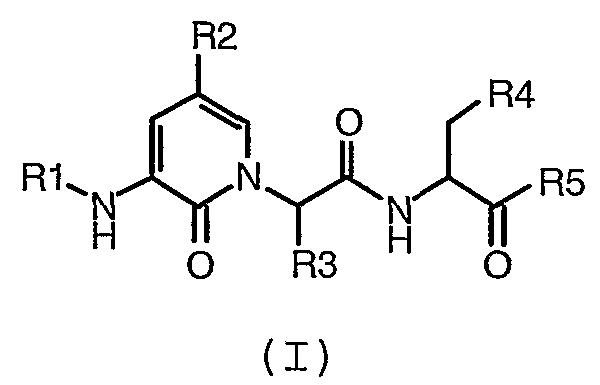
где R1, R2, R3, R4 и R5 имеют значения, определенные в любом из воплощений настоящего описания, включающий:
(а) взаимодействие соединения формулы (VI или IX):
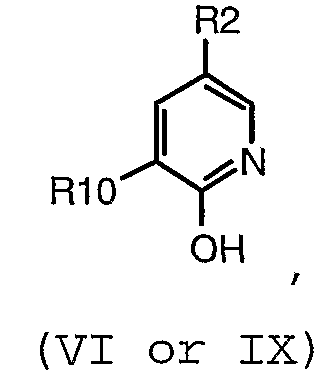
(VI или IX)
где:
R10 представляет собой -NO2, -C(O)OR11, -CN, R6C(O)N(H)-, R6SO2N(H)-, R6OC(O)N(H)-, (R6)2NC(O)N(H)-, R6C(O)C(O)N(H)-, (R6)2NC(O)C(O)N(H)- или R6OC(O)C(O)N(H)-; и
R2, R3 и R6 имеют значения, определенные в настоящем описании;
с соединением формулы (X):
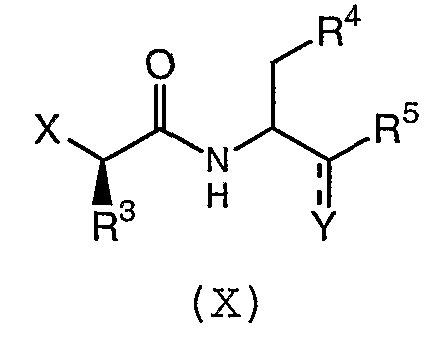
где Y представляет собой или карбонильную группу или OH-группу; и R4 и R5 имеют значения, определенные в настоящем описании;
в присутствии любого из условий связывания, определенных в настоящем описании, и растворителя;
при условии, что если Y представляет собой OH-группу, тогда способ дополнительно включает (b) окисление OH-группы, чтобы получить соединение формулы (I); и
при условии, что если R10 представляет собой -NO2, -C(O)OR11 или -CN, тогда способ дополнительно включает стадию превращения -NO2, -C(O)OR11 или -CN в R6bC(O)N(H)-, R6аSO2N(H)-, R6bOC(О)N(H)-, (R6b)2NC(О)N(H)-, R6bC(O)C(O)N(H)-, (R6b)2NC(О)C(О)N(H)- или R6bOC(O)C(O)N(H)-.
Если фармацевтически приемлемые соли соединений настоящего изобретения используют в данных композициях, то соли предпочтительно представляют собой производные от неорганических или органических кислот и оснований. Включенными в указанные кислотные соли являются следующие: ацетат, адипат, алигинат, аспартат, бензoaт, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Основные соли включают соли аммония, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-D-глюкамина, и соли с аминокислотами, такие как аргинин, лизин и так далее.
Также основные азотсодержащие группы могут быть кватернизованы такими агентами, как низшие алкилгалоиды, такие как метил, этил, пропил и бутилхлорид, бромиды и иодиды; диалкилсульфаты, такие как диметил, диэтил, дибутил и диамилсульфаты, галоиды с длинной цепью, такие как децил, лаурил, миристил и стеарилхлориды, бромиды и иодиды, аралкилгалоиды, такие как бензил и фенэтилбромиды и другие. Таким образом полученными являются водные или маслорастворимые или диспергированные продукты.
Соединения настоящего изобретения могут также быть модифицированы путем присоединения соответствующих функциональных групп для усиления селективных биологических свойств. Такие модификации известны специалисту в данной области и включают те, которые увеличивают биологическое проникновение в исходную биологическую систему (например, кровь, лимфатическую систему, центральную нервную систему), увеличивают оральную доступность, увеличивают растворимость, чтобы позволить ввести инъекцию, изменить метаболизм и изменить интенсивность выделения.
Например, группа карбоновой кислоты в соединении настоящего изобретения может быть модифицирована, например, в виде сложного эфира. Предпочтительные сложные эфиры будут те, которые являются производными от:
C1-6-алкила с прямой или разветвленной цепью, алкенила или алкинила, где алкил, алкенил или алкинил необязательно замещен с помощью арила, CF3, Cl, F, OMe, OEt, OCF3, CN, или NMe2;
C1-6-циклоалкила, где 1-2 атома углерода в циклоалкиле являются необязательно замещенными -O- или -NR9-.
Соединения по настоящему изобретению, имеющие карбонильную группу, могут быть также модифицированы, например, через ацеталь, кеталь, оксим (=NOR9), гидразин C=NN(R9)2), тиоацеталь или тиокеталь.
Соответствующие производные аминов известны специалисту в данной области и также включены в рамки настоящего изобретения.
Некоторые из приведенных выше производных включают защитные группы, известные специалисту в данной области (см., например, T.W. Greene & P.G.M Wutz, "Protective Groups in Organic Synthesis", 3rd Edition, John Wiley & Sons, Inc. (1999)). Типичными функциональными группами, которые должны быть защищены, являются амины. Любые амины и другие функциональные группы могут быть защищены в соответствии со способами, известными специалисту в данной области. Соединения, включая амины, могут быть применены с или без выделения из реакционной смеси. Как должно быть очевидно специалисту в данной области, эти защитные группы также могут быть применены в способах настоящего изобретения.
Без связи с теорией, заявленные циклические ацетальные соединения являются пролекарствами. Это означает то, что ацетальную часть расщепляют in vivo, чтобы обеспечить соответствующее кислотно-альдегидное соединение. Как должно быть очевидно специалисту в данной области, химические соединения могут быть метаболизированы in vivo, например, в месте, другом, чем место расщепления пролекарства. Любые такие метаболиты включены в рамки настоящего изобретения.
Соединения настоящего изобретения могут быть тестируемы на их способность ингибировать апоптоз, высвобождать IL-IP или непосредственную активность каспазы. Тесты для каждой из активностей известны специалисту в данной области. Тем не менее, как должно быть очевидно специалисту в данной области, пролекарственное соединение настоящего изобретения должно быть активным только в тестах, где пролекарственный остаток должен быть расщеплен, как правило, в тестах in vivo. Выбранные тесты описаны ниже.
Фармацевтически приемлемые носители, которые могут быть применены в таких композициях, включают, но без ограничения, ионообменники, окись алюминия, стеарат алюминия, лецитин, серопротеин, такой как альбумин человеческой сыворотки, буферные субстанции, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, частичные глицеридовые смеси насыщаемых растительных жирных кислот, воды, соли или электролитов, такие как сульфат протамина, динатриевый гидрофосфат, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный кварц, трисиликатный магний, поливинил пирролидона, субстанции на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлозы натрия, многоакрилаты, воски, полиэтилен-полиоксипропилeн-блок-полимеры, полиэтиленгликоль и ланолин.
Согласно предпочтительному воплощению композиции настоящего изобретения получают для фармацевтического введения млекопитающему, предпочтительно человеку.
Такие фармацевтические композиции настоящего изобретения могут быть введены перорально, парентерально, посредством ингаляционного спрея, местно, ректально, интраназально, защечно, вагинально или через имплантированный резервуар. Термин «парентеральный», используемый в настоящем описании, включает подкожные, внутривенные, внутримышечные, внутрисуставные, внутрисиновиальные, внутригрудинные, интратекальные, внутрипеченочные, введение в очаг пораженной ткани и внутричерепные инъекции и инфузии. Предпочтительно композиции вводят перорально или внутривенно.
Стерильные формы композиций для инъекций настоящего изобретения могут быть водными или масляными суспензиями. Эти суспензии могут быть приготовлены в соответствии с методиками, известными специалистам в данной области, с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекций может также быть стерильным раствором для инъекций или суспензией в нетоксичном подходящем для парентерального применения разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Среди подходящих носителей и растворителей, которые могут применяться, используется вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные, нелетучие масла традиционно используются в качестве растворителя или среды суспензии. С этой целью любое мягкое нелетучее масло может быть использовано, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, пригодны для получения препаратов для инъекций, как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в полиоксиэтилированной форме. Эти масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой растворитель или диспергирующее вещество, такое как карбоксиметилцеллюлоза или сходные диспергирующие агенты, которые обычно используются для приготовления фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Другие обычно используемые поверхностно-активные вещества, такие как Tweens, Spans и другие эмульгаторы или средства, улучшающие биодоступность, которые обычно применяются в производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм, могут также быть использованы для получения препаратов.
Фармацевтические композиции настоящего изобретения могут вводиться перорально в любой подходящей для перорального введения лекарственной форме, включая, без ограничения, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для приема внутрь носители, которые обычно применяются, включают лактозу и кукурузный крахмал. Смазывающие агенты, такие как магния стеарат, также обычно добавляют. Для перорального введения в форме капсул приемлемые разбавители включают лактозу и сухой кукурузный крахмал. В случае необходимости в водных суспензиях для перорального применения активный ингредиент комбинируют с эмульгаторами или суспендирующими агентами. При необходимости также могут быть добавлены некоторые подсластители, ароматизаторы или красители.
Альтернативно, фармацевтические композиции настоящего изобретения могут быть введены в форме суппозиториев для ректального введения. Они могут быть изготовлены путем смешивания агента с подходящим нераздражающим наполнителем, который имеет твердую консистенцию при комнатной температуре, но становится жидким при ректальной температуре и, таким образом, расплавляется в прямой кишке, высвобождая лекарство. Такие вещества включают масло какао, пчелиный воск и полиэтиленгликоли.
Фармацевтические композиции настоящего изобретения могут также быть введены местно, особенно когда мишень терапии включает области и органы, легко доступные для местного применения, включая заболевания глаз, кожи или дистальные отделы кишечного тракта. Подходящие препараты для местного применения легко могут быть изготовлены для каждого из этих областей или органов.
Местное применение для дистальных отделов кишечного тракта может быть эффективно в форме ректальных суппозиториев (см. выше) или в подходящих препаратах в виде клизм. Также могут применяться пластыри для местного чрескожного введения.
Для местного применения фармацевтические композиции могут быть изготовлены в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или более носителях. Носители для местного применения соединений настоящего изобретения включают, без ограничения, минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль, полиоксиэтилен, соединение полиоксипропилена, эмульгирующий воск и воду. Альтернативно, фармацевтические композиции могут быть приготовлены в подходящем лосьоне или креме, содержащем активные компоненты, суспендированные или растворенные в одном или более фармацевтически приемлемых носителях. Подходящие носители включают, без ограничения, минеральное масло, сорбитанмоностеарат, полисорбат 60, сложные цетиловые эфиры воска, цетиариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
Для применения в офтальмологии фармацевтические композиции могут быть приготовлены в виде тонкоизмельченных суспензий в изотоническом, стерильном солевом растворе с подобранным pH или, предпочтительно, в виде растворов в изотоническом солевом растворе с подобранным pH с добавлением или без добавления консерванта, такого как бензалкония хлорид. Альтернативно, для применения в офтальмологии фармацевтические композиции могут быть приготовлены на основе мази, такой как вазелин.
Фармацевтические композиции настоящего изобретения могут также быть введены посредством интраназального аэрозоля или ингаляции. Такие композиции получают согласно методикам, хорошо известным в области приготовления фармацевтических препаратов, и могут быть приготовлены в виде растворов в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов, промоторов абсорбции для улучшения биодоступности, фторуглеводородов и/или других традиционных повышающих растворимость или диспергирующих агентов.
Вышеописанные композиции особенно пригодны в терапевтических ситуациях, относящихся к опосредованному IL-1 заболеванию, апоптоз-опосредованному заболеванию, воспалительному заболеванию, аутоиммунному заболеванию, деструктивному заболеванию костей, пролиферативному нарушению, инфекционному заболеванию, дегенеративному заболеванию, заболеванию, связанному с клеточной гибелью, или различным формам заболеваний печени. Эти заболевания включают относящиеся к ревматологическим и аутоиммунным заболеваниям, таким как ревматоидный артрит, остеоартроз, остеопороз, системная красная волчанка, склеродермия, хронический тиреоидит, болезнь Грейвса, миастения, аутоиммунная нейтропения, аутоиммунная гемолитическая анемия, тромбоцитопения, ювенильный ревматоидный артрит, подагра, синдром Бехчета, синдром Стилла, синдром макрофагальной активации и саркоидоз; к аутовоспалительным синдромам, таким как криопиринзависимые периодические синдромы (иногда обозначаемые как аутовоспалительные лихорадочные синдромы), включая синдром Макла-Уэллса, семейную холодовую крапивницу (также известную как семейный холодовой аутовоспалительный синдром), хронический младенческий неврологический кожно-суставной синдром (также известный как младенческое периодическое системное воспалительное заболевание), семейная средиземноморская лихорадка, TNFR1-ассоциированный периодический синдром (TRAPS), гипер-IgD периодический лихорадочный синдром (HIDS) и синдром Блау, а также системный ювенильный идиопатический артрит (также известный как болезнь Стилла) и синдром макрофагальной активации; к дерматологическим болезням, таким как псориаз, атопический дерматит, рубец, алопеция, обыкновенные угри и пемфигус, а также токсический эпидермальный некролиз; к дыхательным расстройствам, таким как астма, респираторный дистресс-синдром взрослых, муковисцидоз, эмфизема, хронический бронхит, хроническая обструктивная болезнь легких и идиопатический фиброз легких; к внутренним болезням, таким как перитонит, воспалительные заболевания кишечника, болезнь Крона, язвенный колит, аутоиммунный гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, ассоциированная с H.pylori, диабет, панкреатит, гломерулонефрит, хронический активный гепатит, болезнь злоупотребления алкоголем, почечные заболевания, болезнь поликистозных почек, ожоги, апоптоз органа после ожогового поражения, геморрагический шок, органная недостаточность (например, печеночная недостаточность, острая почечная недостаточность и острая дыхательная недостаточность) и эндометриоз; к расстройствам трансплантации, таким как болезнь «трансплантат против хозяина» (GVHD) и отторжение пересаженного органа; к онкологическим заболеваниям, таким как лейкемии и сходные расстройства, миелодиспластический синдром, заболевание костей, связанное с множественной миеломой, острый миелолейкоз, хронический миелолейкоз, метастатическая меланома, саркома Капоши и множественная миелома; к сердечно-сосудистым заболеваниям, таким как хроническое заболевание сердца, острое сердечное заболевание, инфаркт миокарда, ишемия миокарда, застойная сердечная недостаточность, атеросклероз, проведение аорто-коронарного шунтирования (АКШ), острый коронарный синдром; к заболеваниям центральной и периферической нервной системы, таким как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, болезнь Кеннеди, прионная болезнь, ишемия головного мозга, эпилепсия, спинальная мышечная атрофия, боковой амиотрофический склероз, рассеянный склероз, ВИЧ-обусловленный энцефалит, черепно-мозговая травма, травма спинного мозга, неврологическое нарушение, обусловленное инсультом, диабетическая нейропатия, острая и хроническая боль, а также судороги, судорожные расстройства и конвульсии; к офтальмологическим заболеваниям, таким как увеит, нарушения сетчатки, диабетическая ретинопатия, глаукома и кератит, а также инфекционные заболевания глаз, травмы, аллергия, химическое раздражение, ожоги, ксерофтальм, синдром Шегрена и старение глаз (см., например, WO 2005/053665, которая включена в качестве ссылки); к инфекционным заболеваниям, таким как вирус-опосредованные заболевания, сепсис, септический шок, шигеллез, гепатит B, гепатит C, гепатит G, желтая лихорадка, лихорадка денге, японский энцефалит, ВИЧ-инфекция, туберкулез, менингит, псевдомонадная инфекция и ацинетобактерная инфекция, а также другие бактериальные, вирусные, паразитические и грибковые инфекции, в особенности инфекции глаз; и к другим заболеваниям, таким как старение. Соединения и композиции также применимы в лечении осложнений, связанных с коронарным шунтированием. Количество соединения, присутствующего в вышеописанных композициях, должно быть достаточным, чтобы вызвать снижение тяжести заболевания или активности каспаз и/или апоптоза клеток, определяемое при помощи какого-либо теста, известного в данной области.
Согласно другому воплощению композиции настоящего изобретения могут также содержать другой терапевтический агент. Такие агенты включают, без ограничения, тромболитические агенты, такие как активаторы тканевого плазминогена и стрептокиназа. При использовании второго агента этот второй агент может быть введен или в отдельной лекарственной форме, или в виде единичной лекарственной формы с соединениями или композициями настоящего изобретения. Соответственно, комбинированный препарат для одновременного, раздельного или последовательного применения включен в настоящее изобретение.
Уровни дозирования ингибиторов протеаз, приведенных в настоящем описании, в пределах между около 0,01 и около 100 мг/кг массы тела в день, предпочтительно между около 0,5 и около 75 мг/кг массы тела в день, применимы в виде монотерапии для профилактики и лечения заболеваний, связанных с активностью каспаз и/или апоптозом.
Обычно фармацевтические композиции настоящего изобретения вводят от 1 до 5 раз в день или альтернативно в виде длительной инфузии. Такое введение может быть использовано в качестве длительной или интенсивной терапии. Количество активного ингредиента, который может быть комбинирован с носителями для получения единичной лекарственной формы, будет варьировать в зависимости от заболевания, которое подвержено лечению, и конкретного способа введения. Типичный препарат будет содержать от около 5% до около 95% активного соединения (по объему). Предпочтительно, такие препараты содержат от около 20% до около 80% активного соединения.
В случае когда композиции настоящего изобретения содержат комбинацию соединения формулы I и один или более дополнительных терапевтических или профилактических агентов, и соединение, и дополнительный агент будут представлены в дозах от около 10 до 100% и более предпочтительно от около 10 до 80% от дозы, обычно применяемой в режиме монотерапии.
Необходимо понимать, что конкретная дозировка и режим лечения для каждого конкретного пациента будет зависеть от множества факторов, включая активность конкретного применяемого соединения, возраста, массы тела, общего состояния, пола, диеты, времени введения лекарства, скорости экскреции, лекарственных взаимодействий и решения лечащего врача, а также тяжести конкретного заболевания, по поводу которого проводится лечение. Количество активных ингредиентов будет также зависеть от конкретного соединения и другого терапевтического агента, если он присутствует в композиции.
В предпочтительном воплощении изобретение охватывает способ лечения млекопитающего, страдающего от одного из вышеупомянутых заболеваний, который включает введение этому млекопитающему фармацевтически приемлемой композиции, описанной выше. В этом воплощении, если пациенту также вводят другой терапевтический агент или ингибитор каспазы, он может быть введен вместе с соединением данного изобретения в единичной лекарственной форме или в виде отдельной лекарственной формы. При введении в отдельной лекарственной форме другой ингибитор каспазы или агент может быть введен до, одновременно или последовательно с введением фармацевтически приемлемой композиции, содержащей соединение настоящего изобретения.
Для того чтобы настоящее изобретение было раскрыто полностью, представлены следующие примеры получения и тестирования. Эти примеры служат только для иллюстративных целей и не могут быть истолкованы как ограничивающие область изобретния в любом направлении. 1H-ЯМР спектр регистрируют при 400 МГц, используя аппарат Bruker DPX 400. Масс-спектр, тесты анализируют на масс-спектрометре MicroMass Quattro Micro, функционирующем в одинарной МС-методике с электроспрейной ионизацией.
Пример II.1
3(R,S)-[2(S)-(3-Бензоиламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропиониламино]-5-фтор-4-оксопентановая кислота
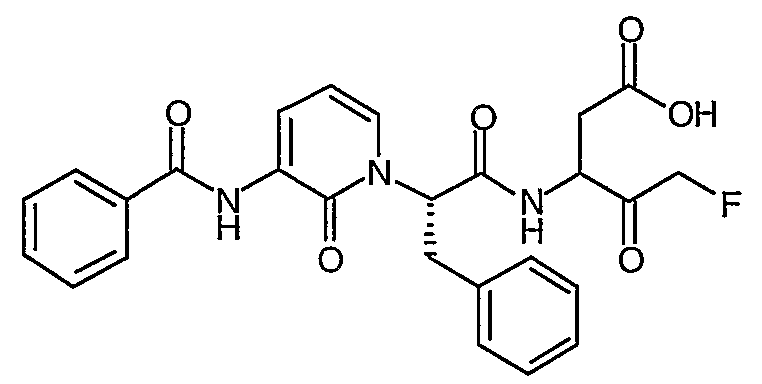
Способ A:
трет-Бутиловый эфир (S)-2-(3-бензилоксикарбониламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропионовой кислоты
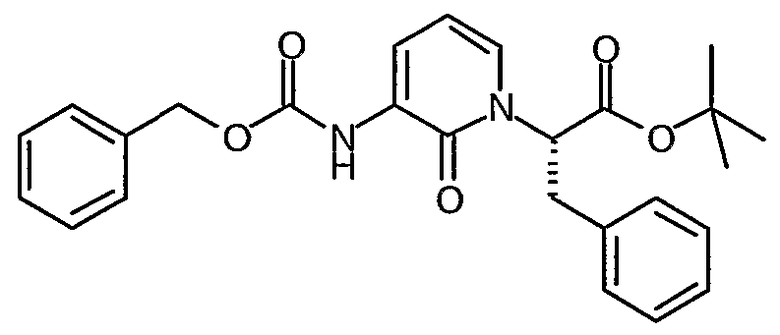
В холодный (0°C) раствор трет-бутилового эфира (R)-2-гидрокси-3-фенилпропионовой кислоты (2,50 г, 15,6 ммоль) в дихлорметане (50 мл), медленно добавляют 2,6-литидин (3,3 г, 30,8 ммоль) и затем трифторметансульфоновый ангидрид (8,25 г, 29,2 ммоль). Полученную смесь перемешивают при температуре 0°C в течение 1 часа, затем распределяют между трет-бутилметиловым эфиром (200 мл) и водным раствором 1 M HCl (60 мл). Органический слой промывают рассолом (60 мл), сушат (сульфат натрия), фильтруют и концентрируют, что дает трифлат в виде масла светло-коричневого цвета.
В раствор бензилового эфира (2-оксо-1,2-дигидропиридин-3-ил)карбаминовой кислоты (P. Warner et al., J. Med. Chem., 37, 19, 1994, 3090-3099) (4,34 г, 17,8 ммоль) в сухом ТГФ (100 мл) добавляют гидрид натрия (60% дисперсия, 711 мг, 17,8 ммоль), и раствор перемешивают при комнатной температуре в течение 45 минут. Реакционную смесь затем медленно переносят с помощью канюли в раствор трифлата, полученного выше, в ТГФ (30 мл). Реакционную смесь перемешивают при комнатной температуре в течение 90 минут и гасят водным раствором хлорида аммония (20 мл). Большую часть растворителя выпаривают и остаток распределяют между EtOAc и насыщенным водным раствором NH4Cl. Органический слой промывают рассолом (30 мл), сушат (MgSО4), фильтруют и выпаривают. Остаток очищают с помощью флеш-хроматографии (10% смесь этилацетат/гексан), что дает указанное в заголовке соединение в виде бесцветного масла (5,1 г, 76%); 1H ЯМР (400 МГц, CDCl3) δ 1,48 (9H, с), 3,35 (1Н, дд), 3,65 (1Н, дд), 5,23 (2H, с), 5,53 (1Н, м), 6,18 (1Н, т), 6,85 (1Н, д), 7,12 (2H, м), 7,20-7,48 (8H, м), 7,82 (1Н, с), 7,98 (1Н, м).
Способ B:
трет-Бутиловый эфир (S)-2-(3-амино-2-оксо-2H-пиридин-1-ил)-3-фенилпропионовой кислоты
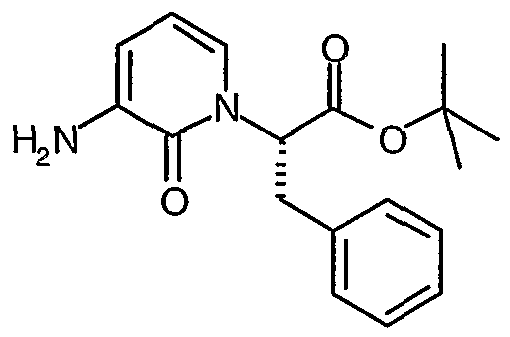
К раствору трет-бутилового эфира (S)-2-(3-бензилоксикарбониламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропионовой кислоты (4 г, 8,92 ммоль) в смеси растворителей MeOH (40 мл) и EtOAc (10 мл) добавляют 10% Pd/C (500 мг). Смесь дегазируют и перемешивают при комнатной температуре в течение 4 часов в атмосфере водорода (давление в баллоне). Реакционную смесь фильтруют через короткую подушку из целита, которую затем промывают MeOH. Объединенные фильтраты выпаривают при пониженном давлении, что дает указанное в заголовке соединение в виде твердого вещества белого цвета (2,6 г, 92%); 1H ЯМР (400 МГц, CDCl3) δ 1,48 (9H, с), 3,32 (1Н, дд), 3,52 (1Н, дд), 3,95 (2H, уширенный с), 5,55 (1Н, дд), 6,00 (1Н, т), 6,55 (1Н, д), 6,72 (1Н, д), 7,18-7,35 (5H, м).
Способ C:
трет-Бутиловый эфир (S)-2-(3-бензоиламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропионовой кислоты
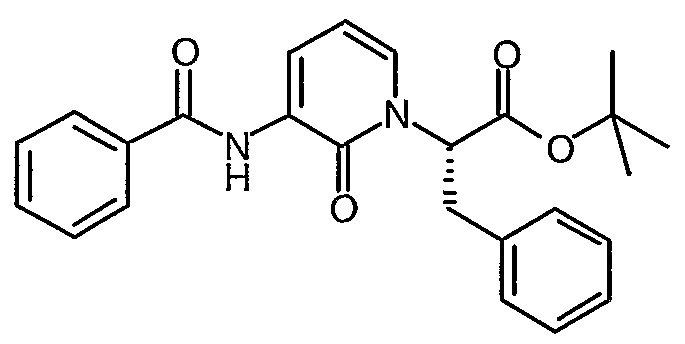
В холодный (0°C) раствор трет-бутилового эфира (S)-2-(3-амино-2-оксо-2H-пиридин-1-ил)-3-фенилпропионовой кислоты (2,6 г, 8,26 ммоль) в дихлорметане (50 мл) добавляют триэтиламин (918 мг, 9,09 ммоль) и DMAP (20 мг) с последующим добавлением по каплям бензоилхлорида (1,27 г, 9,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 12 часов и затем распределяют между EtOAc и насыщенным водным раствором NH4Cl. Органический слой промывают водой (30 мл), рассолом (30 мл), сушат (MgSO4), фильтруют и выпаривают. Остаток очищают с помощью флеш-хроматографии (10-25% смесь этилацетат/петролейный эфир), что дает указанное в заголовке соединение в виде бесцветного масла (2,07 г, 60%); 1H ЯМР (400 МГц, CDCl3) δ 1,48 (9H, с), 3,35 (1Н, дд), 3,55 (1Н, дд), 5,5 (1Н, м), 6,26 (1Н, т), 6,90 (1Н, д), 7,15 (2H, м), 7,28 (3H, м), 7,52 (3H, м), 7,95 (2H, м), 8,52 (1Н, д), 9,22 (1Н, уширенный с).
Способ D:
(S)-2-(3-Бензоиламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропионовая кислота
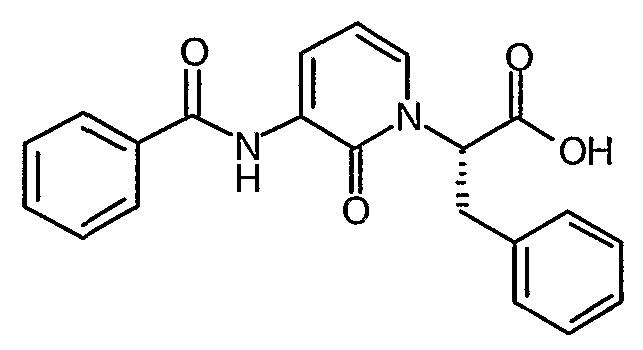
Раствор трет-бутилового эфира (S)-2-(3-бензоиламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропионовой кислоты (2,07 г, 4,95 ммоль) в дихлорметане (25 мл) охлаждают до температуры 0°C. Добавляют трифторуксусную кислоту (25 мл) и полученной смеси дают возможность нагреться до комнатной температуры и при этом продолжают перемешивание в течение 5 часов. Смесь затем концентрируют при пониженном давлении и остаток повторно растворяют в дихлорметане. Этот процесс повторяют несколько раз для того, чтобы удалить избыток трифторуксусной кислоты. Полученное твердое вещество суспендируют в диэтиловом эфире, фильтруют и промывают обильно диэтиловым эфиром. Твердое вещество затем сушат до постоянного веса в вакууме. Это дает указанный в заголовке продукт в виде твердого вещества белого цвета (1,61 г, 90%); 1H ЯМР (400 МГц, CDCl3) δ 3,48 (1Н, дд), 3,65 (1Н, дд), 5,32 (1Н, м), 6,35 (1Н, т), 6,80 (1Н, м), 7,08 (2H, д), 7,27-7,35 (3H, м), 7,56-7,65 (3H, м), 7,92 (2H, д), 8,65 (1Н, д), 9,18 (1Н, уширенный с).
Способ E:
трет-Бутиловый эфир 3(R,S)-[2(S)-(3-бензоиламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропиониламино]-5-фтор-4(R,S)-гидроксипентановой кислоты

Перемешиваемую смесь (S)-2-(3-бензоиламино-2-оксо-2Н-пиридин-1-ил)-3-фенилпропионовой кислоты (2,20 г, 6,07 ммоль), трет-бутилового эфира 3(R,S)-амино-5-фтор-4(R,S)-гидроксипентановой кислоты (1,39 г, 6,68 ммоль), HOBt (902 мг, 6,68 ммоль), DMAP (853 мг, 6,98 ммоль) и ТГФ (20 мл) охлаждают до температуры 0°C, затем добавляют EDC (1,28 мг, 6,68 ммоль). Смеси дают возможность нагреться до комнатной температуры в течение 16 часов, затем ее концентрируют при пониженном давлении. Остаток очищают с помощью флеш-хроматографии (от 30-70% дo 55-45% смесь этилацетат/гексан), что дает указанное в заголовке соединение в виде пены белого цвета (1,23 г, 32%); 1H ЯМР (400 МГц, CDCl3) δ 0,88-0,93 (3H, м), 1,35-1,42 (9H, 2с), 2,50-2,65 (2H, м), 3,20-3,35 (2H, м), 3,60 (1Н, м), 3,98 (1Н, м), 4,10-4,32 (3H, м), 5,62-5,70 (1Н, м), 6,44 (1Н, м), 6,80-6,98 (1Н, м), 7,21-7,41 (5H, м), 7,55-7,62 (3H, м), 7,95 (2H, м), 8,58 (1Н, т), 9,18 (1Н, уширенный с).
Способ F:
трет-Бутиловый эфир 3(R,S)-[2(S)-(3-бензоиламино-2-оксо-2Н-пиридин-1-ил)-3-фенилпропиониламино]-5-фтор-4-оксопентановой кислоты
Перемешиваемый раствор трет-бутилового эфира 3(R,S)-[2(S)-(3-бензоиламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропиониламино]-5-фтор-4(R,S)-гидроксипентановой кислоты (1,23 г, 2,23 ммоль) в безводном DCM (25 мл) обрабатывают 1,1,1-триацeтокси-1,1-дигидро-1,2-бензиодоксол-3(1Н)-oном (периодинан Десс-Мартина) (1,13 г, 2,67 ммоль) при температуре 0°C. Полученную смесь оставляют при температуре 0°C в течение 2 часов, разбавляют этилацетатом, затем выливают в смесь 1:1 насыщенного водного раствора гидрокарбонaта натрия и насыщенного водного раствора тиосульфата натрия. Органический слой удаляют и водный слой повторно экстрагируют этилацетатом. Объединенные органические экстракты сушат (сульфат магния) и концентрируют. Остаток очищают с помощью флеш-хроматографии (40-60% смесь этилацетат/петролейный эфир), что дает указанное в заголовке соединение в виде смолы красного цвета (776 мг, 64%); 1H ЯМР (400 МГц, CDCl3) δ 1,32-1,40 (3H, с), 2,60 (1Н, м), 2,92 (1Н, м), 3,27 (1Н, м), 3,61 (1Н, м), 4,78-4,88 (1Н, м), 4,97-5,05 (2H, м), 5,77 (1Н, м), 6,43 (1Н, м), 7,22-7,38 (7H, м), 7,54-7,65 (3H, м), 7,95 (2H, м), 8,62 (1Н, м), 9,22 (1Н, м).
Способ G:
3(R,S)-[2(S)-(3-Бензоиламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропиониламино]-5-фтор-4-оксопентановая кислота
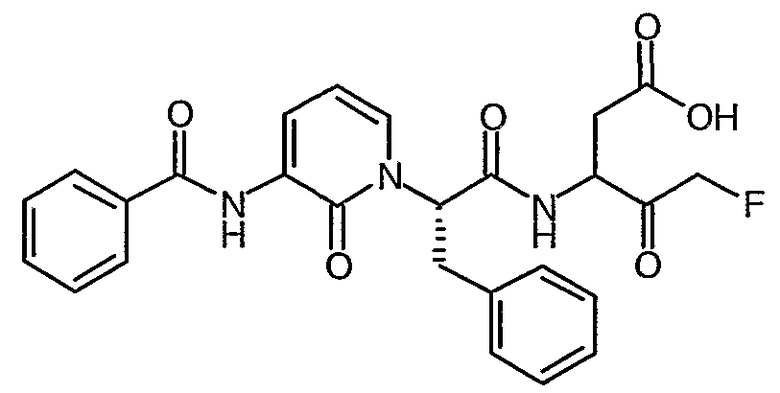
Раствор трет-бутилового эфира 3(R,S)-[2(S)-(3-бензоиламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропиониламино]-5-фтор-4-оксопентановой кислоты (776 мг, 1,41 ммоль) в дихлорметане (6 мл) охлаждают до температуры 0°C. Добавляют трифторуксусную кислоту (2 мл) и полученной смеси дают возможность нагреться до комнатной температуры, после чего перемешивание продолжают в течение 3 часов. Смесь затем концентрируют при пониженном давлении и остаток повторно растворяют в дихлорметане. Этот процесс повторяют несколько раз для того, чтобы удалить избыток трифторуксусной кислоты. Твердое вещество затем сушат до постоянного веса в вакууме. Получают названный продукт в виде твердого вещества розового цвета (627 мг, 90%); 1H ЯМР (400 МГц, d6-ДМСО) δ 2,59-2,95 (2H, м), 3,34-3,47 (2H, м), 4,30-4,81 (2H, м), 5,15-5,33 (2H, м), 5,87-6,09 (1Н, м), 6,38 (1Н, т), 7,15-7,32 (5H, м), 7,60-7,78 (4H, м), 7,92 (2H, д), 8,17-8,21 (1Н, м), 9,01-9,11 (1Н, м), 9,28 (1Н, м), 12,51 (1Н, уширенный с); 19F ЯМР (376 МГц, d6-ДМСО, несвязанный протон) δ -226,8, 232,6; M+H 494,4, M-H 492,4.
Пример II.2
3(R,S)-[2(S)-(3-Бензоиламино-2-оксо-2Н-пиридин-1-ил)-4-фенилбутириламино]-5-фтор-4-оксопентановая кислота
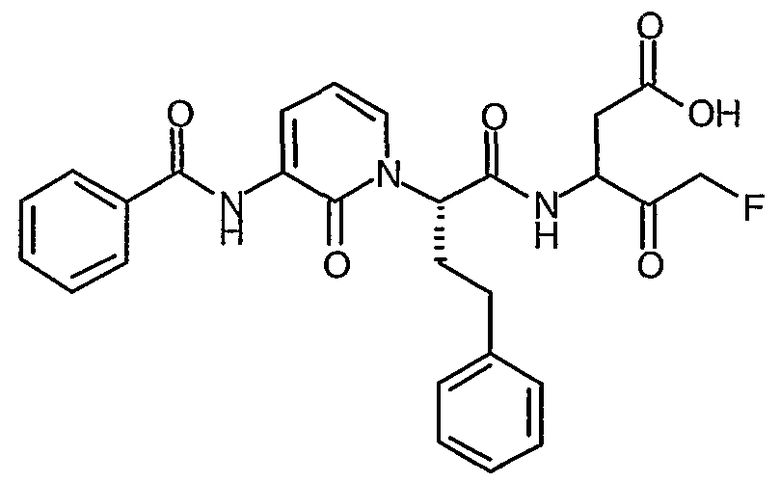
Получают в соответствии со способами, аналогичными способам A и D-G, используя N-(2-Оксо-1,2-дигидропиридин-3-ил)бензамид и трет-бутиловый эфир (R)-2-гидрокси-4-фенилмасляной кислоты (получают, используя способ, аналогичный способу, представленному у Lei et al., J. Carbohydrate Chemistry, 15, 4, 1996, 485-500) в способе A; твердое вещество белого цвета; ИК (твердое вещество) 1643, 1578, 1521, 1490, 1213, 753 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 2,3-2,9 (6H, м), 3,5-3,7 (2H, м), 4,3-4,7 (3H, м), 5,1-5,35 (1,5H, м), 5,6-5,8 (1Н, м), 6,4-6,45 (1Н, м), 7,2-7,35 (5H, м), 7,6-7,8 (4H, м), 7,9-8,0 (2H, м), 8,3-8,35 (1Н, м), 8,9-9,0 (1Н, м), 9,35-9,4 (1Н, м); M+H 508,4, M-H 506,4.
Пример II.3
3(R,S)-[2(S)-(3-Бензоиламино-5-метил-2-оксо-2H-пиридин-1-ил)-3-фенилпропиониламино]-5-фтор-4-оксопентановая кислота
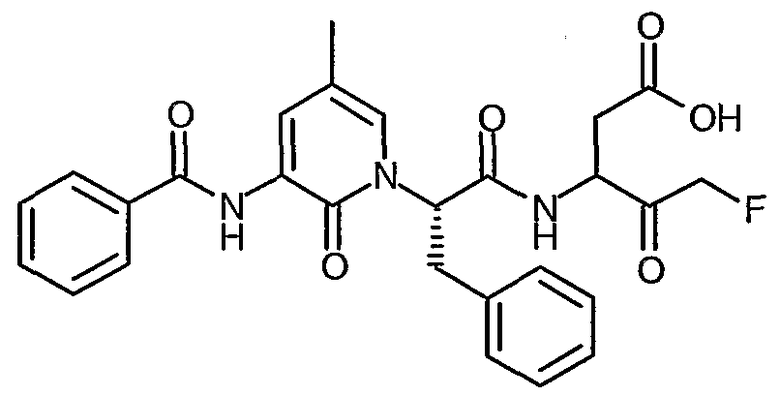
Получают в соответствии со способами, аналогичными способам A и D-G, используя N-(5-метил-2-оксо-1,2-дигидропиридин-3-ил)бензамид и трет-бутиловый эфир (R)-2-гидрокси-3-фенилпропионовой кислоты на стадии A; твердое вещество белого цвета; ИК (твердое вещество) 1650, 1516, 1224, 692 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 0,83-0,86 (3H, м), 2,30-2,67 (4H, м), 4,32-4,95 (2H, м), 5,12-5,24 (1Н, м), 5,83-6,04 (1Н, м), 7,15-7,61 (9H, м), 7,86-7,88 (2H, м), 8,11-8,12 (1Н, м), 8,70-9,02 (1Н, м), 9,21 (1Н, д), 12,41 (1Н, уширенный с); M+H 508,4, M-H 506,4.
Пример II.4
3(R,S)-{2(S)-[3-(2,6-Диметилбензоиламино)-2-оксо-2H-пиридин-1-ил]-3-фенилпропиониламино}-5-фтор-4-оксопентановая кислота
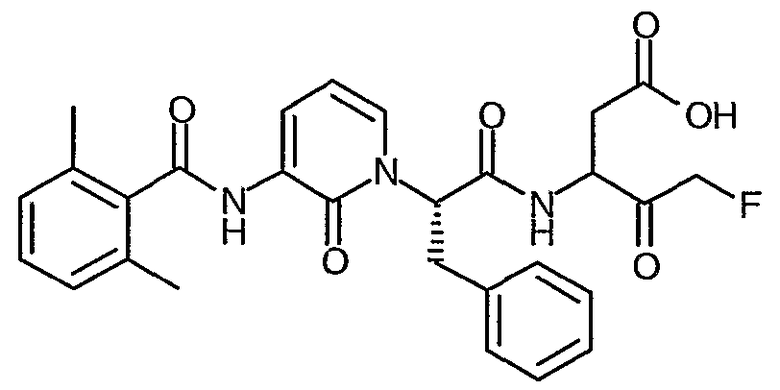
Получают в соответствии со способами, аналогичными способам A-G, используя 2,6-диметилбензоилхлорид в способе C; твердое вещество грязно-белого цвета; 1H ЯМР (400 МГц, d6-ДМСО) δ 2,50 (6H, с), 2,51-2,98 (2H, м), 3,15-3,45 (2H, м), 4,15-3,30 (3H, м), 5,61-6,00 (1Н, м), 6,25 (1Н, м), 7,00-7,25 (8H, м), 7,45-7,70 (1Н, м), 8,12 (1Н, м), 8,65-9,10 (2H, м); 19F (376 МГц, d6-ДМСО, несвязанный протон) δ -226,8, -226,8, -227,5, -230,8, -231,8, -232,7, -232,8, -232,8, -232,9, -233,4; M+H 522,5, M-H 520,5.
Пример II.5
3(R,S)-{2(S)-[3-(2,6-Дихлорбензоиламино)-2-оксо-2H-пиридин-1-ил]-3-фенилпропиониламино}-5-фтор-4-оксопентановая кислота
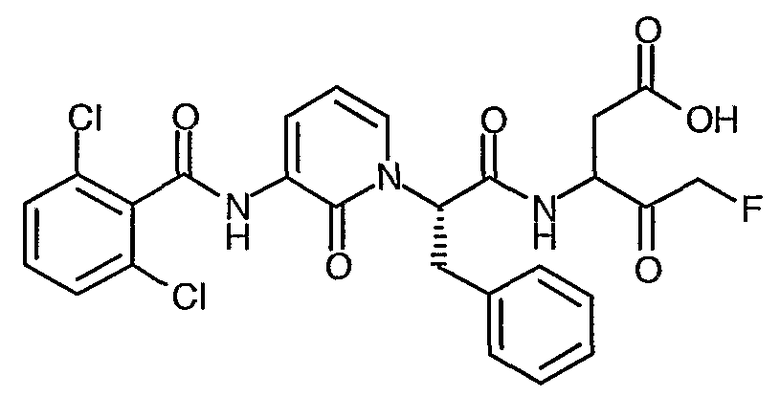
Получают в соответствии со способами, аналогичными способам A-G, используя 2,6-дихлорбензоилхлорид в способе C; 1H ЯМР (400 МГц, d6-ДМСО) δ 2,35-2,99 (2H, м), 3,05-3,50 (2H, м), 4,15-5,35 (3H, м), 5,66-6,05 (1Н, м), 6,29 (1Н, м), 7,10-7,30 (5H, м), 7,37-7,52 (3H, м), 7,51-7,70 (1Н, м), 8,25 (1Н, м), 8,70-9,11 (1Н, м), 10,00-10,15 (1Н, м); 13F (376 МГц, d6-ДМСО, несвязанный протон) δ -226,7, -226,8, -230,7, -231,4, -232,6, -232,7, -232,9; M+H 562,28, M-H 560,28.
Пример II.6
3(R,S)-{2(S)-[3-(3,3-Диэтилуреидо)-2-оксо-2H-пиридин-1-ил]-3-фенилпропиониламино}-5-фтор-4-оксопентановая кислота
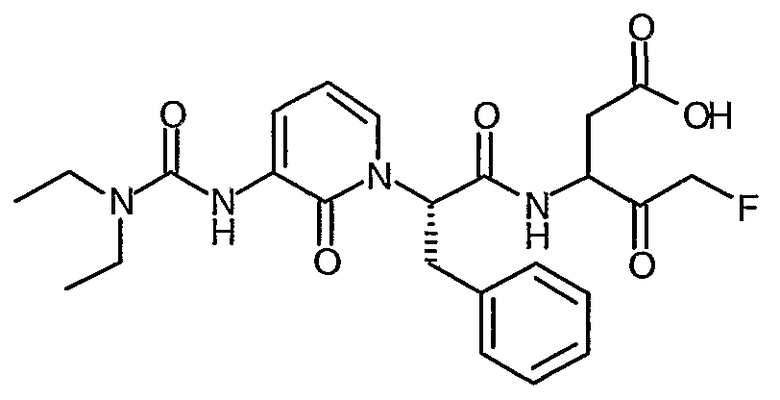
Способ H:
трет-Бутиловый эфир (S)-2-[3-(3,3-Диэтилуреидо)-2-оксо-2H-пиридин-1-ил]-3-фенилпропионовой кислоты
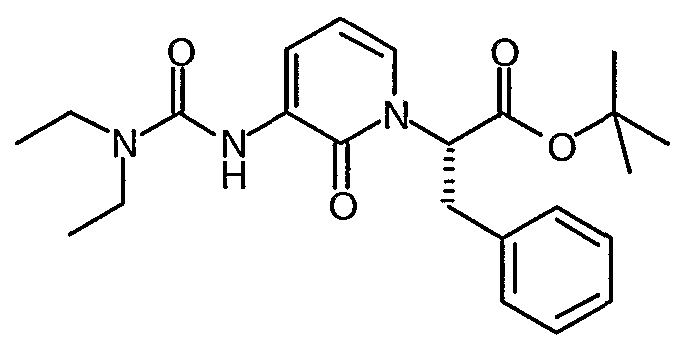
В холодный (0°C) раствор трет-бутилового эфира (S)-2-(3-амино-2-оксо-2H-пиридин-1-ил)-3-фенилпропионовой кислоты (500 мг, 1,59 ммоль) в дихлорэтане (3 мл) добавляют триэтиламин (0,254 мл, 1,82 ммоль). Этот раствор добавляют по каплям в раствор дифосгена (0,11 мл, 0,91 ммоль) в дихлорэтане (7 мл) при температуре 0°C в течение 10 минут. Реакционную смесь перемешивают при комнатной температуре в течение 90 минут и затем распределяют между EtOAc и водным раствором 1 M HCl. Органический слой промывают рассолом, сушат (MgSО4), фильтруют и выпаривают, что дает изоцинат в виде масла коричневого цвета.
В холодный (0°C) раствор изоцината, полученный выше, (541 мг, 1,59 ммоль) в дихлорэтане (8 мл) добавляют триэтиламин (0,24 мл, 1,75 ммоль), а затем диэтиламин (0,16 мл, 1,59 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и затем распределяют между EtOAc и водным раствором 1 M HCl. Органический слой промывают рассолом, сушат (MgSО4), фильтруют и выпаривают, что дает маслянистый остаток коричневого цвета, который очищают с помощью флеш-хроматографии на колонке (25-75% смесь этилацетат/гексан), что дает диэтилмочевину в виде масла светло-розового цвета. 1H ЯМР (400 МГц, CDCl3) δ 1,48 (9H, с), 3,35 (1Н, дд), 3,55 (1Н, дд), 5,5 (1Н, м), 6,26 (1Н, т), 6,90 (1Н, д), 7,15 (2H, м), 7,28 (3H, м), 7,52 (3H, м), 7,95 (2H, м), 8,52 (1Н, д), 9,22 (1Н, уширенный с).
Это промежуточное соединение участвует в последовательности стадий процесса, описанного в способах D-G, что дает соединение по примеру II.6 в виде твердого вещества бледно-розового цвета; ИК (твердое вещество) 1794, 1737, 1664, 1640, 1588, 1515, 1458, 1414, 1382, 1353, 1220, 1066 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 1,08-1,12 (6H, м), 2,50-2,90 (2H, м), 3,20-3,55 (6H, м), 4,30-5,30 (3H, м), 5,85 (1Н, м), 6,19 (1Н, м), 7,15-7,37 (6H, м), 7,64 (1Н, м), 7,86 (1Н, м), 9,00 (1Н, м); 19F (376 МГц, d6-ДМСО, несвязанный протон) δ -226,8, -226,8, -230,8, -231,6, -232,9, -233,0; M+H 489,4, M-H 487,4.
Пример II.7
5-Фтор-4-оксо-3(R,S)-[2(S)-(2-оксо-3-фенилацетиламино-2H-пиридин-1-ил)-3-фенилпропиониламинопентановая кислота
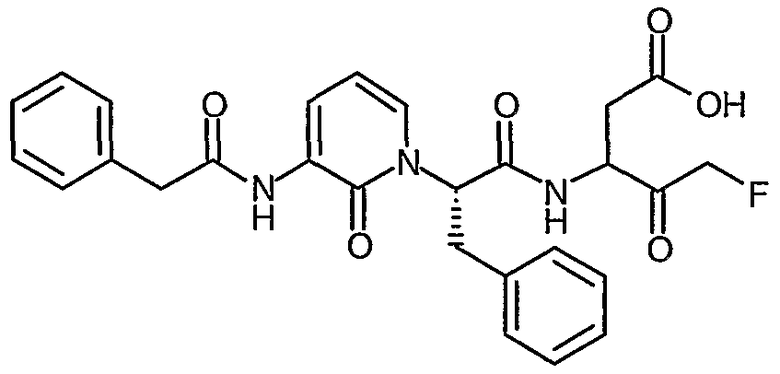
Получают в соответствии со способами, аналогичными способам A-G, используя фенилацетилхлорид в способе C; твердое вещество бледно-розового цвета; ИК (твердое вещество) 1789, 1742, 1685, 1643, 1587, 1516, 1451 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 2,50-2,90 (2H, м), 3,27-3,41 (2H, м), 3,76 (2H, с), 4,30-5,30 (3H, м), 5,90 (1Н, м), 6,17 (1Н, м), 7,15-7,31 (10H, м), 7,50 (1Н, м), 8,00 (1Н, м), 8,85 (1Н, м), 9,25 (1Н, м); 19F (376 МГц, d6-ДМСО, несвязанный протон) δ -222,0, -222,1, -226,0, -226,5, -227,9, -228,0; M+H 508,5, M-H 506,5.
Пример II.8
3(S)-{2(S)-[3-(2,6-Дихлорбензоиламино)-2-оксо-2H-пиридин-1-ил]-3-фенилпропиониламино}-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентановая кислота
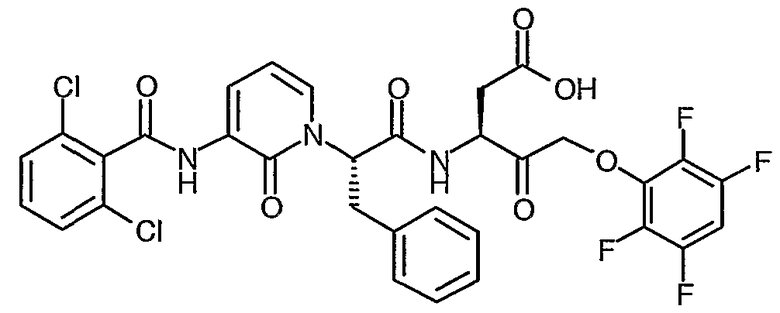
Получают в соответствии со способами, аналогичными способам A-G, используя 2,6-дихлорбензоилхлорид в способе C и трет-бутиловый эфир 3(S)-амино-4(R,S)-гидрокси-5-(2,3,5,6-тетрафторфенокси)пентановой кислоты на стадии E; твердое вещество розового цвета; ИК (твердое вещество) 1675, 1634, 1511, 1429 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 2,61-2,80 (2H, м), 3,29-3,52 (2H, м), 4,67-4,73 (1Н, м), 5,22 (2H, дд), 5,87-5,93 (1Н, м), 6,26-6,31 (1Н, м), 7,12-7,28 (5H, м), 7,41-7,72 (5H, м), 8,26 (1Н, д), 9,12 (1Н, д), 10,05 (1Н, с); 19F (376 МГц, d6-ДМСО, несвязанный протон) δ -140,5, -140,6, -140,6, -140,6, -141,0, -141,0, -141,0, -141,1, -156,9, -156,9, -156,9, -156,9, -157,0; M+H 708,1 M-H 706,0.
Пример II.9
5-Фтор-4-оксо-3(R,S)-{2(S)-[2-оксо-3-(3-фенилуреидо)-2H-пиридин-1-ил]-3-фенилпропиониламино}пентановая кислота
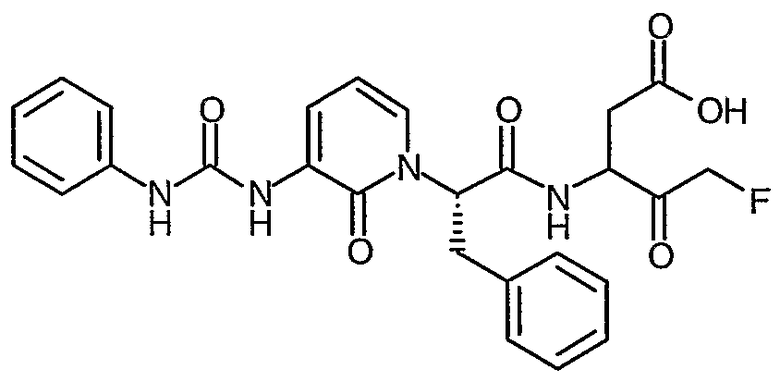
Получают в соответствии со способами, аналогичными способам A-G, используя фенилизоцинат в способе C; твердое вещество грязно-белого цвета; ИК (твердое вещество) 1780, 1737, 1671, 1638, 1601, 1544, 1498 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 2,50-2,90 (2H, м), 3,20-3,55 (2H, м), 4,30-5,30 (3H, м), 5,90 (1Н, м), 6,20 (1Н, м), 6,85 (1Н, м), 7,10-7,45 (11H, м), 8,00 (1Н, м), 8,50 (1Н, м), 9,00(1Н, м), 9,50 (1Н, м), 12,50 (1Н, уширенный с); 19F (376 МГц, d6-ДМСО, несвязанный протон) δ -226,8, -226,8, -227,5, -230,9, -231,3, -232,7, -232,8, -233,4; M+H 509,5, M-H 507,45.
Пример II.10
3(R,S)-[2(S)-(3-Бензоиламино-2-оксо-5-трифторметил-2H-пиридин-1-ил)-3-фенилпропиониламино]-5-фтор-4-оксопентановая кислота
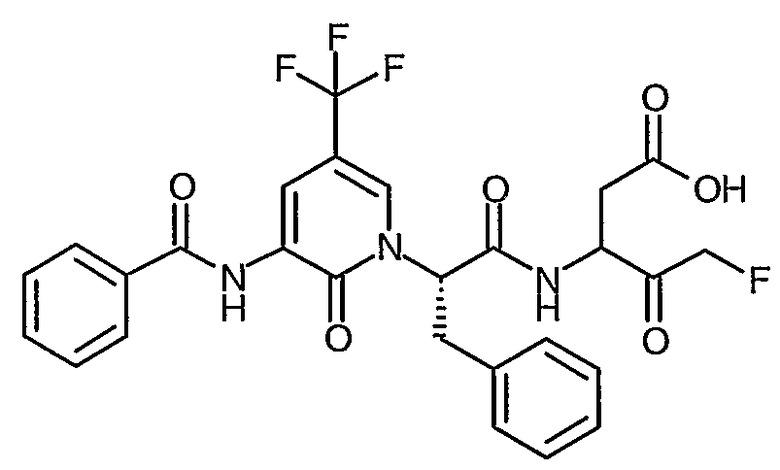
Получают из бензилового эфира N-(2-оксо-5-трифторметил-1,2-дигидропиридин-3-ил)карбаминовой кислоты в соответствии со способами A-G; ИК твердого вещества 1655, 1521, 1450, 1322, 1173, 1127 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 2,60-2,91 (2H, м), 3,45-3,64 (2H, м), 4,65 (1Н, м), 5,18-5,37 (2H, м), 5,81-5,97 (1Н, м), 7,16-7,25 (5H, м), 7,52-7,63 (3H, м), 7,89-7,91 (2H, м), 8,02-8,14 (1Н, м), 8,35 (1Н, с), 9,10-9,19 (1Н, м), 9,41 (1Н, уширенный с), 12,69 (1Н, уширенный с); 19F (376 МГц, d6-ДМСО, несвязанный протон) δ -61,3, -61,3, -226,7, -226,9, -232,6, -232,7; M+H 562,4, M-H 560,4.
Пример II.11
5-Фтор-3(R,S)-[2(S)-(3-изобутириламино-2-оксо-2H-пиридин-1-ил)-3-фенилпропиониламино]-4-оксопентановая кислота
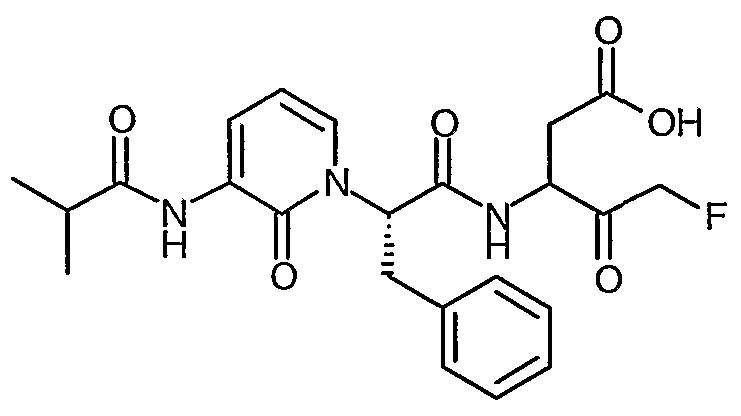
Получают в соответствии со способами, аналогичными способам A-G, используя изобутирилхлорид в способе C; твердое вещество грязно-белого цвета; 1H ЯМР (400 МГц, d6-ДМСО) δ 1,05 (6H, м), 2,50-2,99 (3H, м), 3,11-3,50 (2H, м), 4,20-5,35 (3H, м), 5,70-6,10 (1Н, м), 6,21 (1Н, м), 7,07-7,28 (5H, м), 7,40-7,60 (1Н, м), 7,85-8,15 (1Н, м), 8,65-9,10 (2H, м); 19F (376 МГц, d6-ДМСО, несвязанный протон) δ -226,7, -226,8, -230,7, -231,3, -232,7, -232,7; M+H 460,2, M-H 458,2.
Пример II.12
3(R,S)-[2(S)-(3-Бензоиламино-2-оксо-2H-пиридин-1-ил)-3-тиофен-3-илпропиониламино]-5-фтор-4-оксопентановая кислота
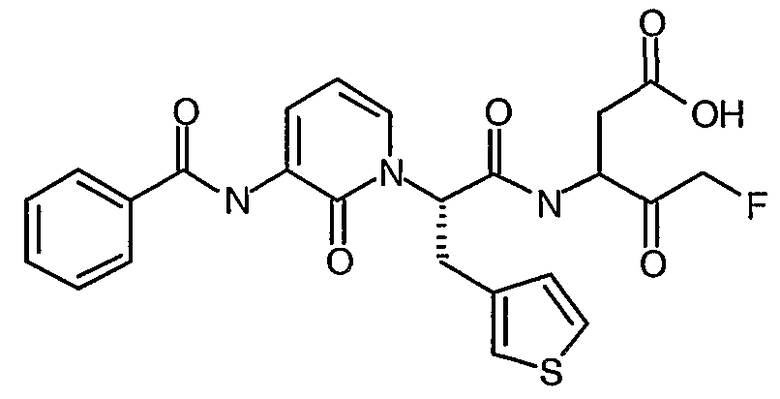
Получают в соответствии со способами, аналогичными способам A и D-G, используя N-(2-оксо-1,2-дигидропиридин-3-ил)бензамид и трет-бутиловый эфир 2-гидрокси-3-тиофен-3-илпропионовой кислоты (получают, используя способ, аналогичный способу, представленному у Lei et al., J. Carbohydrate Chemistry, 15, 4, 1996, 485-500) в способе A; ИК (твердое вещество) 1675, 1644, 1578, 1521, 705 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 2,6-2,9 (2H, м), 3,5-3,7 (2H, м), 4,3-4,7 (3H, м), 5,1-5,35 (2H, м), 5,7-5,9 (1Н, м), 6,3-6,4 (1Н, м), 6,8-6,9 (2H, м), 7,15-7,2 (1Н, м), 7,3-7,35 (1Н, м), 7,4-7,6 (4H, м), 7,9-7,9 (2H, м), 8,2-8,25 (1Н, м), 9,0-9,1 (1Н, м), 9,25-9,3 (1Н, м); M+H 500,4, M-H 498,4.
Пример II.13
5-Фтор-4-оксо-3(R,S)-[2(S)-(2-оксо-3-пропиониламино-2Н-пиридин-1-ил)-3-фенилпропиониламино]пентановая кислота
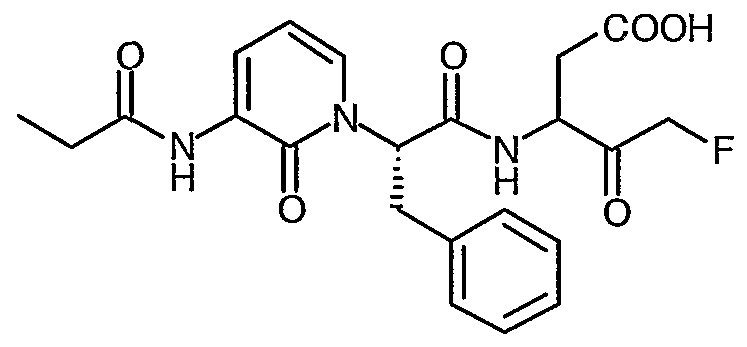
Получают в соответствии со способами, аналогичными способам A-G, используя пропионилхлорид в способе C; твердое вещество бежевого цвета; 1H ЯМР (400 МГц, d6-ДМСО) δ 0,99-1,02 (3H, м), 2,36-2,42 (2H, м), 2,53-2,94 (2H, м), 3,21-3,45 (3H, м), 4,33-5,29 (3H, м), 5,80-6,02 (1Н, м), 6,16-6,21 (1Н, м), 7,11-7,23 (5H, м), 7,43-7,53 (1Н, м), 8,08-8,13 (1Н, м), 8,68-9,05 (2H, м), 12,50 (1Н, уширенный с); M+H 446,4, M-H 444,4.
Пример II.14
3(R,S)-[2(S)-(3-Бензоиламино-2-оксо-2H-пиридин-1-ил)-3-тиофен-2-ил-пропиониламино]-5-фтор-4-оксопентановая кислота
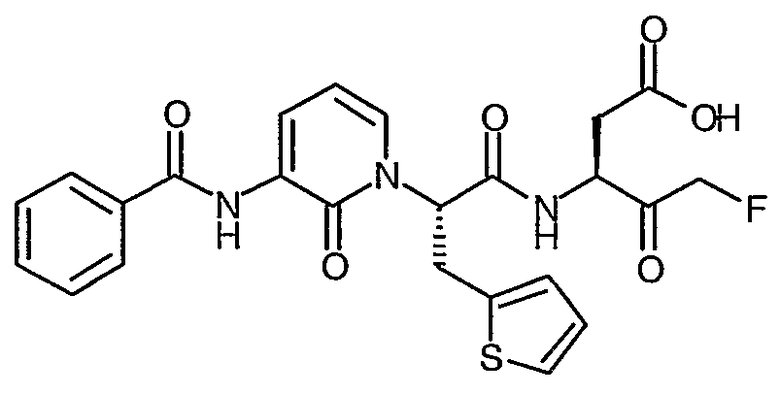
Получают в соответствии со способами, аналогичными способам A и D-G, используя N-(2-оксо-1,2-дигидропиридин-3-ил)бензамид и трет-бутиловый эфир 2-гидрокси-3-тиофен-2-илпропионовой кислоты (получают, используя способ, аналогичный способу, представленному у Lei et al., J. Carbohydrate Chemistry, 15, 4, 1996, 485-500) в способе A; ИК (твердое вещество) 1644, 1521, 705 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 2,6-2,9 (2H, м), 3,5-3,7 (2H, м), 4,3-4,7 (3H, м), 5,1-5,35 (1,5H, м), 5,7-5,9 (1H, м), 6,3-6,4 (1Н, м), 6,8-6,9 (2H, м), 7,3-7,35 (1Н, м), 7,4-7,7 (4H, м), 7,9-8,0 (3H, м), 8,2-8,25 (1Н, м), 9,0-9,1 (1Н, м), 9,25-9,3 (1Н, м); M+H 500,4, M-H 498,4.
Пример II.15
3(R,S)-[2(S)-(3-Бензоиламино-2-оксо-2H-пиридин-1-ил)-3-(1H-индол -3-ил)пропиониламино]-5-фтор-4-оксопентановая кислота
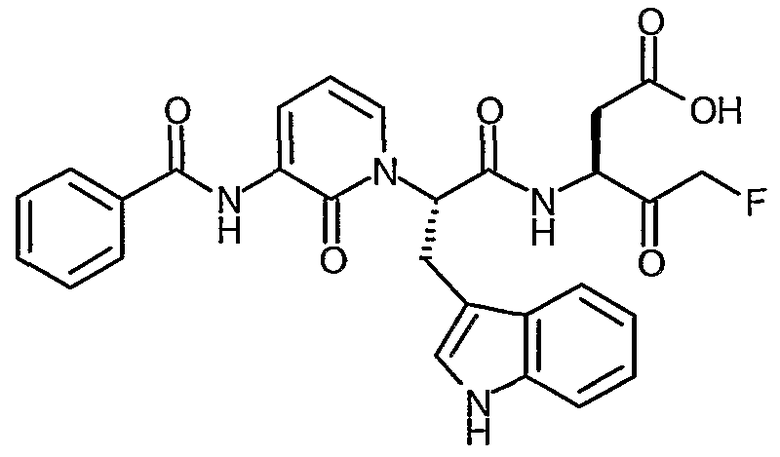
Способ I
трет-Бутиловый эфир (S)-3-[2-трет-бутоксикарбонил-2-(3-метоксикарбонил-2-оксо-2H-пиридин-1-ил)этил]индол-1-карбоновой кислоты
В раствор трет-бутилового эфира (S)-3-(2-амино-2-трет-бутоксикарбонилэтил)индол-1-карбоновой кислоты (2,5 г, 7 ммоль) в метаноле (15 мл) добавляют диметиловый эфир 2-(3-метоксиаллилиден)малоновой кислоты (1,5 г, 7 ммоль) и перемешивание продолжают в течение ночи при комнатной температуре. Добавляют метилат натрия (78 мг, 1,4 ммоль) и перемешивают в течение трех часов при комнатной температуре. Реакционную смесь разбавляют водой (50 мл) и экстрагируют этилaцетатом (60 мл). Органический слой промывают рассолом, сушат (MgSO4), фильтруют и выпаривают, что дает сырой продукт, который очищают с помощью флеш-хроматографии (30-70% смесь этилaцетат/петролейный эфир), что дает указанное в заголовке соединение в виде твердого вещества белого цвета (2,3 г, 57%); 1H ЯМР (400 МГц, CDCl3) δ 1,43 (9H, с), 1,72 (9H, с), 3,50 (2H, м), 3,91 (3H, м), 5,68 (1Н, уширенный с), 6,08 (1Н, т), 7,2-7,5 (5H, м), 8,15 (2H, м); M+H 497,5, M-H 495,5.
Способ J
трет-Бутиловый эфир (S)-3-[2-трет-бутоксикарбонил-2-(3-карбокси-2-оксо-2H-пиридин-1-ил)этил]индол-1-карбоновой кислоты
В раствор трет-бутилового эфира (S)-3-[2-трет-бутоксикарбонил-2-(3-метоксикарбонил-2-оксо-2H-пиридин-1-ил)этил]индол-1-карбоновой кислоты (2,3 г, 4,7 ммоль) в диоксане (60 мл) добавляют гидроксид лития (115 мг, 4,7 ммоль) в воде (30 мл). Смесь перемешивают в течение ночи при комнатной температуре. Затем ее разбавляют водой, подкисляют до значения рН, равного 3, с помощью 1 M HCl и экстрагируют этилaцетатом. Органический слой промывают рассолом, сушат (MgSО4), фильтруют и выпаривают, что дает сырой продукт в виде твердого вещества белого цвета, который используют в следующей стадии без дополнительной очистки (1,9 г, 85%); 1H ЯМР (400 МГц, CDCl3) δ 1,45 (9H, с), 1,74 (9H, с), 3,50 (2H, м), 5,65 (1Н, уширенный с), 6,08 (1Н, т), 7,2-7,5 (5H, м), 8,15 (2H, м).
Способ K
трет-Бутиловый эфир 3-[2-(3-бензилоксикарбониламино-2-оксо-2Н-пиридин-1-ил)-2-трет-бутоксикарбонилэтил]индол-1-карбоновой кислоты
В перемешиваемый раствор трет-бутилового эфира (S)-3-[2-трет-бутоксикарбонил-2-(3-карбокси-2-оксо-2H-пиридин-1-ил)этил]индол-1-карбоновой кислоты (1,8 г, 3,7 ммоль) в диоксане добавляют триэтиламин (580 мг, 5,9 ммоль), дифенилфосфорилазид (91,5 г, 5,6 ммоль) и бензиловый спирт (680 мг, 6,3 ммоль) и смесь нагревают при температуре кипения с обратным холодильником 100°C в течение 18 часов. Смесь концентрируют и распределяют между этилaцетатом и насыщенным раствором гидрокарбоната. Органический слой промывают рассолом, сушат (MgSО4), фильтруют и выпаривают, что дает сырой продукт, который очищают с помощью флеш-хроматографии (30-70% смесь этилaцетат/петролейный эфир), что дает указанное в заголовке соединение в виде твердого вещества белого цвета (1,3 г, 59%); 1H ЯМР (400 МГц, CDCl3) δ l,48 (9H, с), 1,73 (9H, с), 3,45 (1Н, м), 3,65 (1Н, м), 5,2-5,25 (2H, м), 5,60 (1Н, м), 6,15 (1Н, т), 6,85 (1Н, м), 7,25-7,55 (9H, м), 7,95 (1Н, м), 8,02-8,18 (2H, м).
Продукт из способа K участвует в последовательности реакций B-G, что дает указанное в заголовке соединение в виде твердого вещества грязно-белого цвета; ИК (твердое вещество) 1669, 1643, 1578, 1522, 1490, 1212 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 2,5-2,8 (2H, м), 3,4-3,6 (2H, м), 4,35-4,6 (1Н, м), 4,65-4,8 (1Н, м), 5,15-5,3 (1Н, м), 5,85-6,0 (1Н, м), 6,3-6,35 (1Н, м), 6,9-7,1 (3H, м), 7,25-7,3 (1Н, м), 7,5-7,9 (8H, м), 8,2-8,25 (1Н, м), 9,1-9,3 (2H, м), 10,8-10,9 (1Н, уширенный с); 7,40-7,60 (1Н, м), 7,85-8,15 (1Н, м), 8,65-9,10 (2H, м); 19F (376 МГц, d6-ДМСО, несвязанный протон) δ -226,3, 226,7, -232,5, -232,6; M+H 533,0, M-H 530,9.
Пример II.16
3(R,S)-[2(S)-(3-Этансульфониламино-2-оксо-2Н-пиридин-1-ил)-3-фенилпропиониламино]-5-фтор-4-оксопентановая кислота
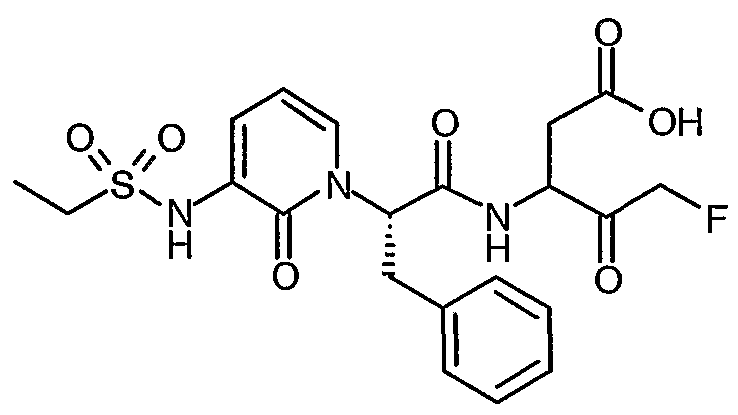
Получают в соответствии со способами, аналогичными способам A-G, используя этансульфонилхлорид в способе C; твердое вещество бледно-голубого цвета; ИК (твердое вещество) 1787, 1742, 1685, 1643, 1590, 1551, 1456 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 1,03-1,14 (3H, м), 2,51-2,94 (4H, м), 3,30-3,41 (2H, м), 4,30-5,30 (3H, м), 5,90 (1Н, м), 6,20 (1Н, м), 7,14-7,26 (7H, м), 7,58 (1Н, м), 8,80 (1Н, м); 19F (376 МГц, d6-ДМСО, (несвязанный протон) δ -226,8, -230,8, -232,8, -232,9; M+H 482,4, M-H 480,4.
Пример II.17
3(R,S)-[4-Бензилoкси-2(S)-(2-оксо-3-пропиониламино-2H-пиридин-1-ил)бутириламино]-5-фтор-4-оксопентановая кислота
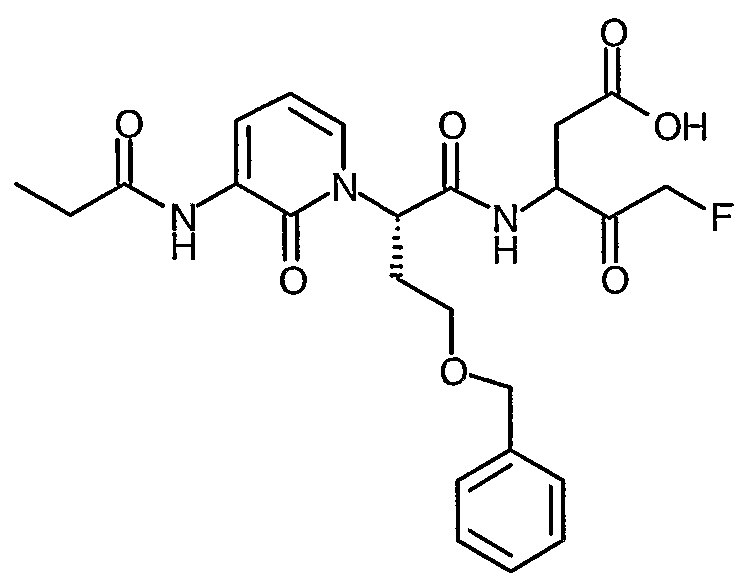
Получают в соответствии со способами, аналогичными способам A и D-G, используя трет-бутиловый эфир (R)-4-бензилoкси-2-гидроксимасляной кислоты (получают, используя способ, аналогичный способу, представленному у Lei et al., J. Carbohydrate Chemistry, 15, 4, 1996, 485-500) в способе A; твердое вещество бледно-розового цвета; ИК (твердое вещество) 1784, 1740, 1675, 1589, 1515, 1451, 1368 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 1,23-1,27 (3H, т), 2,20 (1Н, м), 2,46-2,48 (2H, м), 2,50 (1Н, м), 2,75-3,09 (2H, м), 3,39 (1Н, м), 3,55 (1Н, м), 4,42-4,50 (3H, м), 4,70-5,01 (2H, м), 5,47-5,87 (1Н, м), 6,40 (1Н, м), 6,98 (1H, м), 7,02-7,06 (5H, м), 7,68 (1Н, м), 8,26 (1Н, м), 8,48 (1Н, м); 19F (376 МГц, CDCl3, несвязанный протон) δ -230,2, -230,46, -231,9, -232,4; M+H 490,4, M-H 488,4.
Пример II.18
3(R,S)-[3(S)-Бензилoкси-2(S)-(2-оксо-3-пропиониламино-2H-пиридин-1-ил)бутириламино]-5-фтор-4-оксопентановая кислота
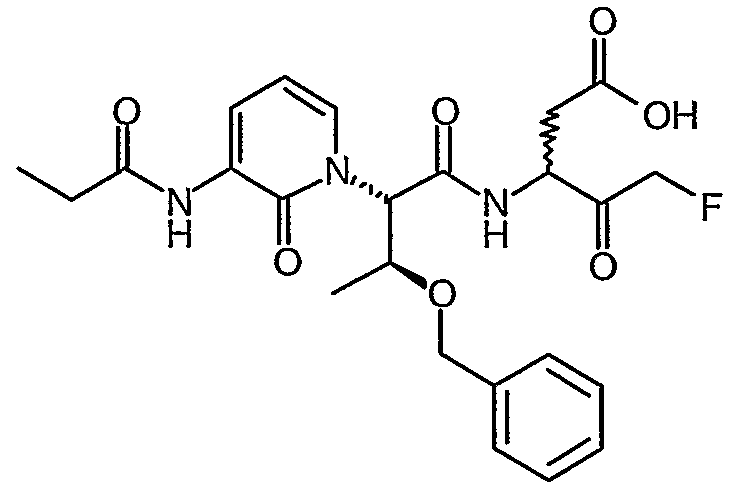
Получают в соответствии со способами, аналогичными способам A и D-G, используя трет-бутиловый эфир 3(S)-бензилoкси-2-(R)-гидроксимасляной кислоты (получают, используя способ, аналогичный способу, представленному у Lei et al., J. Carbohydrate Chemistry, 15, 4, 1996, 485-500) в способе A; ИК (твердое вещество) 1738, 1644, 1518, 1371, 1205 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 1,13-1,25 (3H, м), 1,25-1,35 (3H, м), 2,40-2,5 (2H, м), 2,7-3,2 (2H, м), 4,3-5,2 (6H, м), 6,40-6,5 (1Н, м), 7,3-7,55 (5H, м), 7,68 (1Н, м), 8,3-8,4 (1Н, м), 8,5-8,6 (1Н, м); M+H 490,4, M-H 488,4.
Пример II.19
5-Фтор-4-оксо-3(R,S)-[2(R,S)-(2-оксо-3-пропиониламино-2Н-пиридин-1-ил)-2-фенилацетиламино]пентановая кислота
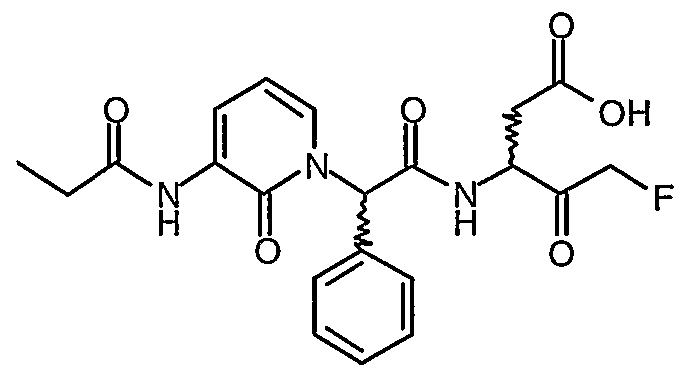
Получают в соответствии со способами, аналогичными способам A и D-G, используя метиловый эфир бромфенилуксусной кислоты на стадии A; ИК (твердое вещество) 1671, 1643, 1581, 1520 cм-1; 1H ЯМР (400 МГц, d6-ДМСО) δ 1,0-1,08 (3H, м), 2,4-2,5 (2H, м), 2,6-2,9 (2H, м), 4,3-4,8 (2H, м), 5,2-5,4 (2H, м), 6,15-6,25 (1Н, м), 6,7-6,8 (1Н, м), 7,3-7,4 (2H, м), 7,4-7,5 (3H, м), 8,2-8,25 (1Н, м), 9,1-9,3 (1Н, м); M+H 432,4, M-H 430,4.
Пример II.20
3(R,S)-[3-Бензилoкси-2(S)-(2-оксо-3-пропиониламино-2H-пиридин-1-ил)пропиониламино]-5-фтор-4-оксопентановая кислота
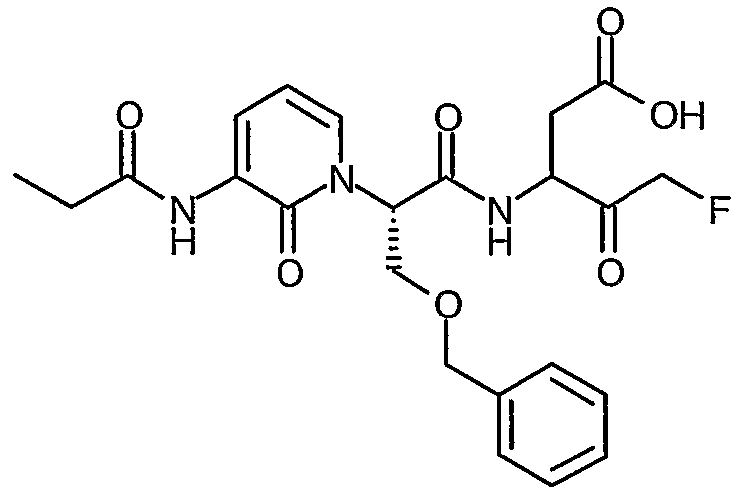
Получают в соответствии со способами, аналогичными способам A и D-G, используя трет-бутиловый эфир (R)-3-бензилoкси-2-гидроксипропионовой кислоты (получают, используя способ, аналогичный способу, представленному у Lei et al., J. Carbohydrate Chemistry, 15, 4, 1996, 485-500) в способе A; твердое вещество грязно-белого цвета; 1H ЯМР (400 МГц, d6-ДМСО) δ 1,05 (3H, т), 2,30-2,90 (4H, м), 3,95-4,15 (2H, м), 4,20-4,80 (4H, м), 5,05-5,40 (2H, м), 5,70 (1Н, м), 6,35 (1Н, м), 7,30 (5H, м), 7,40-7,55 (1Н, м), 8,25 (1Н, м), 8,95 (1Н, м), 9,15 (1Н, м); 19F (376 МГц, CDCl3, несвязанный протон) δ -226,9, -232,9; M+H 476,3.
Пример II.21
Ферментные исследования
Исследования ингибирования каспаз основаны на расщеплении флуорогенного субстрата очищенными человеческими каспазами -1, -3 или -8. Эти исследования проводят по существу таким же образом, как это описано Garcia-Calvo с соавт. (J. Biol. Chem. 273 (1998), 32608-32613), с использованием субстрата, специфического для каждого фермента. Субстратом для каспазы-1 является Ацетил-Tyr-Val-Ala-Asp-амино-4-метилкумарин. Субстратом для каспаз-3 и -8 является Ацетил-Asp-Glu-Val-Asp-амино-4-метилкумарин. Оба субстрата известны специалистам в данной области.
Наблюдаемый уровень инактивации фермента при конкретной концентрации ингибитора, kobs подсчитывают путем прямой подстановки данных в уравнение, полученное Thornberry et al. (Biochemistry 33 (1994), 3943-3939) с использованием компьютерной программы нелинейного анализа методом наименьших квадратов (PRISM 2,0; GraphPad software). Для получения константы скорости второго порядка, kinact, значения kobs наносят напротив их относительных концентраций ингибиторов и уровни kinact последовательно высчитывают с помощью компьютерной линейной регрессии.
Ингибирование активности каспаз-1, -3 и -8 для выбранных соединений настоящего изобретения определяют вышеописанным способом. Соединения II.1-II.20 ингибируют каспазу-1 с показателем kinact > 60000 M-1с-1, каспазу-3 со значениями от 0 до 300000 M-1с-1, а каспазу-8 со значениями > 35000 M-1с-1.
Пример II.22
Клеточное исследование с мононуклеарами периферической крови (PMBC)
Исследование IL-1β со смешанной популяцией мононуклеаров периферической крови или обогащенными прилипшими мононуклеарами
Преобразование пре-IL-1β посредством ICE может быть измерено в клеточной культуре, используя клетки из разнообразных источников. Клетки PBMC человека, полученные от здоровых доноров, формируют смешанную популяцию подтипов лимфоцитов и мононуклеарных клеток, которые продуцируют широкий спектр интерлейкинов и цитокинов в ответ на физиологические раздражители многих видов. Прилипшие мононуклеары из PBMC формируют обогащенный источник нормальных моноцитов для селективных исследований продукции цитокинов активированными клетками.
Методика эксперимента:
Готовят серию начальных разведений тестируемого соединения в ДМСО или этаноле с последующим разбавлением в среде FBS RPMI-10% (содержащей 2 мМ L-глутамина, 10 мМ HEPES, 50 U и 50 мг/мл pen/strep) соответственно конечным препаратам в концентрации, в 4 раза превышающей конечную тестируемую концентрацию, содержащей 0,4% ДМСО или 0,4% этанола. Конечная концентрация ДМСО составляет 0,1% для всех разведений препаратов. Титрование концентрации, которое определяет рамки показателя Ki для тестируемого соединения, определенного в исследовании ингибирования ICE, обычно используют для первичного скрининга соединения.
Обычно 5-6 разведений соединения тестируют и клеточный этап исследования выполняют дважды с двойным проведением ELISA в каждой надосадочной фракции клеточной культуры.
Выделение PBMC и исследование IL-1:
Клетки лейкоцитарной пленки, выделенные из пинты крови человека (получают 40-45 мл конечного объема плазмы и клеток), разбавляют средой до 80 мл, затем в каждую пробирку с разделительным гелем LeukoPREP (Becton Dickinson) добавляют 10 мл клеточной суспензии. Через 15 минут центрифугирования при 1500-1800×g слой плазма/среда аспирируют и затем слой мононуклеаров собирают с помощью пастеровской пипетки и переносят в коническую центрифужную пробирку объемом 15 мл (Corning). Среду добавляют до объема 15 мл, аккуратно смешивают клетки путем переворачивания и центрифугируют при 300×g в течение 15 мин. Фракцию PBMC ресуспендируют в малом объеме среды, клетки подсчитывают и доводят до концентрации 6×106 клеток/мл.
Для клеточного исследования в каждую лунку 24-луночного плоскодонного планшета для тканевых культур (Corning) добавляют 1 мл клеточной суспензии, 0,5 мл разведения тестируемого соединения и 0,5 мл раствора LPS (Sigma #L-3012; 20 нг/мл раствор, приготовленный в полной среде RPMI; конечная концентрация LPS 5 нг/мл). Добавленных 0,5 мл тестируемого соединения и LPS обычно достаточно для смешивания содержимого лунок. Три контрольных смешивания проводят в каждом опыте, либо только с LPS, либо с растворителем и/или дополнительной средой, чтобы довести объем конечной культуры до 20 мл. Клеточные культуры инкубируют в течение 16-18 ч при 37°С в присутствии 5% CO2.
В конце периода инкубации клетки отбирают и переносят в 15 мл конические центрифужные пробирки. После центрифугирования в течение 10 минут при 200×g, отбирают надосадочную жидкость и переносят в 1,5 мл пробирки Эппендорфа. Следует отметить, что клеточный осадок может быть использован для определения содержания пре-IL-1β и/или зрелого IL-1β в цитозольном экстракте методом Western blotting или ELISA со специфическими пре-IL-lβ антителами.
Выделение прилипших мононуклеарных клеток:
PBMC выделяют и готовят, как описано выше. Сначала в лунки добавляют среду (1,0 мл), затем 0,5 мл суспензии PBMC. После часа инкубации планшеты осторожно встряхивают, а неприлипшие клетки аспирируют из каждой лунки. Затем лунки аккуратно трижды отмывают 1 мл среды и в конечном итоге ресуспендируют в 1 мл среды. Обогащение прилипшими клетками обычно дает 2,5-3,0×105 клеток на лунку. Добавление тестируемых соединений, LPS, процессы инкубации клеток и обработку надосадочной жидкости производят, как описано выше.
ELISA:
Наборы «Quantikine» (R&D Systems) могут быть использованы для измерения содержания зрелого IL-1β. Исследования осуществляют в соответствии с инструкциями производителя. Концентрации зрелого IL-1β около 1-3 нг/мл отмечены и в PBMC и в позитивных контролях прилипших мононуклеарных клеток. ELISA исследования проводят с разведенной 1:5, 1:10 и 1:20 надосадочной жидкостью, полученной из LPS-позитивных контролей, для выбора оптимального разведения надосадочной жидкости в тестируемом ряду.
Ингибиторная способность соединений может быть представлена в виде IC50, который представляет собой концентрацию ингибитора, при которой в надосадочной жидкости определяется 50% зрелого IL-1β по сравнению с позитивным контролем.
Квалифицированный специалист в данной области должен понимать, что результаты, полученные в клеточных исследованиях, могут зависеть от множества факторов. Полученные значения не обязательно являются количественно точными.
Выбранные соединения данного изобретения тестированы на предмет ингибирования высвобождения IL-1β из PBMC со значениями IC50 от 300 нМ до 10 мкМ.
Исследование апоптоза, индуцированного антителами к Fas
Программированная клеточная гибель может быть индуцирована путем связывания Fas-лиганда (FasL) с его рецептором, CD95 (Fas). CD95 является представителем семейства родственных рецепторов, известных как «рецепторы смерти», которые могут запускать апоптоз в клетках путем активации каспазного ферментного каскада. Процесс инициируется при связывании адаптивной молекулы FADD/MORT-1 с цитоплазматическим доменом комплекса CD-95 рецептор-лиганд. Каспаза-8 затем связывает FADD и активируется, запуская каскад событий, который включает активацию нижележащих каспаз и последующую клеточную гибель. Апоптоз также может быть индуцирован в клетках, экспрессирующих CD95, например, в клеточной линии Т-клеточной лимфомы Jurkat E6.1, используя скорее антитела, нежели FasL, для взаимодействия с расположенным на клеточной поверхности CD95. Анти-Fas-индуцированный апоптоз также индуцируется путем активации каспазы-8. Это обеспечивает основу для клеточных исследований с целью скрининга способности соединений ингибировать путь апоптоза, опосредованный каспазой-8.
Методика эксперимента:
Клетки Jurkat E6.1 культивируют в полной среде, которая состоит из RPMI-1640 (Sigma No) + 10% сыворотки коровьего эмбриона (Gibco BRL No.10099-141) + 2 мM L-глутамина (Sigma No. G-7513). Клетки отбирают во время лог-фазы роста. 100 мл клеток в концентрации 5-8×105 клеток/мл переносят в стерильные 50 мл центрифужные пробирки Фалькона и центрифугируют в течение 5 минут при 100×g при комнатной температуре. Удаляют надосадочную жидкость, а клеточный осадок ресуспендируют в 25 мл полной среды. Клетки подсчитывают и доводят плотность до 2×106 клеток/мл с помощью полной среды.
Тестируемое соединение растворяют в диметилсульфоксиде (ДМСО) (Sigma No. D-2650) до получения 100 мM базового раствора. Его разводят до 400 мкМ в полной среде, затем последовательно разводят в 96-луночном планшете до добавления в клеточный планшет исследования.
100 мкл клеточной суспензии (2×106 клеток) добавляют в каждую лунку стерильного 96-луночного круглодонного кластерного планшета (Costar No. 3790). 50 мкл раствора соединения в приемлемом разведении и 50 мкл анти-Fas антител, клон CH-1l (Upstate, Cat No. 1544 675) в конечной концентрации 10 нг/мл добавляют в лунки. Контрольные лунки не содержат ни антител, ни соединения, но содержат серийные разведения ДМСО в качестве контроля растворителя. Планшеты инкубируют в течение 16-18 часов при температуре 37°C, 5% CО2 и 95% влажности.
Апоптоз клеток измеряют путем регистрации фрагментации ДНК, используя «Анализ обнаружения клеточной гибели», Roche diagnostics, No. 1544 675. После инкубирования в течение 16-18 часов планшеты исследования центрифугируют при 100×g при комнатной температуре в течение 5 минут. 150 мкл надосадочной жидкости удаляют и замещают 150 мкл свежей полной среды. Затем отбирают клетки и добавляют 200 мкл буфера лизиса, входящего в набор исследования, в каждую лунку. Клетки гомогенизируют до достижения полного разрушения и инкубируют в течение 30 минут при 4°C. Планшеты затем центрифугируют при 1900×g в течение 10 минут и разводят надосадочную жидкость 1:20 в буфере инкубации. 100 мкл данного раствора затем исследуют в соответствии с инструкциями производителя, приложенными к набору. Оптическую плотность при 405 нм измеряют через 20 минут после добавления конечного субстрата при помощи планшетного считывающего устройства SPECTRAmax Plus (Molecular Devices). Оптическую плотность при 405 нм отмечают напротив концентрации соединения, а уровни IC50 соединений высчитывают с использованием программы построения кривой SOFTmax Pro (Molecular Devices), применяя четырехпараметрический анализ. Выбранные соединения протестированы в данном исследовании, для них продемонстрирована способность ингибировать Fas-индуцированный апоптоз клеток Jurkat с уровнем IC50 от 0,013 мкМ до 8 мкМ.
В то время как имеется описанное число воплощений настоящего изобретения, это означает, что основные примеры изобретения могут быть альтернативными, чтобы обеспечить другие воплощения, которые используют соединения и способы настоящего изобретения. Следовательно, будет оценено, что рамки настоящего изобретения предпочтительнее определены с помощью прилагаемой формулы изобретения, чем с помощью конкретных воплощений, которые представлены через указанные выше примеры.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ КАСПАЗ И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2372335C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПУРИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1997 |
|
RU2228335C2 |
| НОВЫЕ ЦИКЛОАЛКИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕЗОРБЦИИ КОСТИ И АНТАГОНИСТОВ РЕЦЕПТОРА ВИТРОНЕКТИНА | 1997 |
|
RU2180331C2 |
| ИНГИБИТОРЫ СЕРИНОВЫХ ПРОТЕАЗ, В ЧАСТНОСТИ НС3-НС4А ПРОТЕАЗЫ | 2004 |
|
RU2412198C2 |
| ЗАМЕЩЕННЫЕ 2-ОКСО- И 2- ТИОКСО- ДИГИДРОХИНОЛИН-3-КАРБОКСАМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ KCNQ2/3 | 2011 |
|
RU2581362C2 |
| КЛАСС КОНДЕНСИРОВАННЫХ КОЛЬЦЕВЫХ СОЕДИНЕНИЙ И ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2021 |
|
RU2831125C1 |
| ЗАМЕЩЕННЫЕ ИЗОХИНОЛИНОВЫЕ И ИЗОХИНОЛИНОНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ Rho-КИНАЗЫ | 2007 |
|
RU2455302C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2005 |
|
RU2433127C2 |
| ПРОЛЕКАРСТВА ИНГИБИТОРА КАСПАЗЫ | 2006 |
|
RU2427582C2 |
| PPAR-ПОДДЕРЖИВАЮЩИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2687490C2 |
Настоящее изобретение относится к соединению формулы I:

где: R1 представляет собой R6C(O)-, R6SO2-, (R6)2NC(O)-; R2 представляет собой водород, -CF3 или R8; R3 представляет собой -T-R9; R4 представляет собой -СООН или -COOR8; R5 представляет собой -CH2F или -CH2O-2,3,5,6-тетрафторфенил; R6 представляет собой R6a или R6b; две R6 группы вместе с тем же атомом, к которому они присоединены, необязательно образуют 3-10-членное ароматическое или неароматическое кольцо; и где каждый R6 независимо замещен 6 заместителями, независимо выбранными из R; R6a и R6b каждый независимо представляет собой (С1-С3)-алифатическую группу, (С6-С10)-арил-, (С6-С10)-арил-(С1-С12)алифатическую группу; R представляет собой галоген, -OR7, -R7; каждый R7 независимо выбран из: водорода, (С1-С12)-алифатической группы, (С6-С10)-арила; R8 представляет собой (С1-С12)-алифатическую группу; Т представляет собой прямую связь или (C1-С6)алифатическую группу, где до 2 алифатических атомов углерода в Т могут быть необязательно замещены O; R9 является необязательно замещенным (С6-С10)-арилом или (С5-С10)-гетероарилом, изобретение также относится к фармацевтической композиции, к способам лечения, ингибирования опосредованных каспазами процессов, к способу консервирования клеток с использованием соединений формулы I применения таких композиций для лечения опосредованных каспазой заболеваний и к способам получения соединений I. Технический результат: получены и описаны новые соединения, которые могут быть полезны в лечении опосредованных каспазой заболеваний 10 н. и 28 з.п. ф-лы, 1 табл.
1. Соединение формулы I:
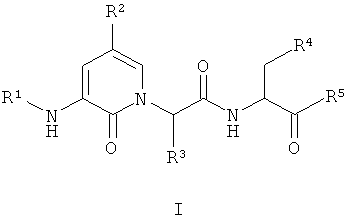
где
R1 представляет собой R6C(O)-, R6SO2-, (R6)2NC(O)-;
R2 представляет собой водород, -CF3 или R8;
R3 представляет собой -T-R9;
R4 представляет собой -СООН или -COOR8;
R5 представляет собой -CH2F или -CH2O-2,3,5,6-тетрафторфенил;
R6 представляет собой R6a или R6b; две R6 группы вместе с тем же атомом, к которому они присоединены, необязательно образуют 3-10-членное ароматическое или неароматическое кольцо; и где каждый R6 независимо замещен 6 заместителями, независимо выбранными из R;
R6a и R6b каждый независимо представляет собой
(С1-С3)-алифатическую группу,
(С6-С10)-арил-,
(С6-С10)-арил-(С1-С12)-алифатическую группу;
R представляет собой галоген, -OR7, -R7;
каждый R7 независимо выбран из:
водорода,
(С1-С12)-алифатической группы,
(С6-С10)-арила;
R8 представляет собой
(С1-С12)-алифатическую группу;
Т представляет собой прямую связь или (С1-С6)алифатическую группу, где до 2 алифатических атомов углерода в Т могут быть необязательно замещены О;
R9 является необязательно замещенным (С6-С10)-арилом или (С5-С10)-гетероарилом.
2. Соединение по п.1, где R5 представляет собой -CH2O-2, 3, 5, 6 - тетрафторфенил.
3. Соединение по п.1, где R5 представляет собой -CH2F.
4. Соединение по п.1, где R1 представляет собой R6C(O)-, (R6)2NC(O)-, где R6 представляет собой R6b.
5. Соединение по п.1, где R1 представляет собой R6SO2-, где R6 представляет собой R6a.
6. Соединение по п.4, где R1 представляет собой R6C(O)-.
7. Соединение по п.5, где R1 представляет собой R6SO2-.
8. Соединение по п.4, где R1 представляет собой (R6)2NC(O)-.
9. Соединение по п.4 или 5, где R6a представляет собой
(С6-С10)-арил-,
(С6-С10)-арил-(С1-С12)-алифатическую группу,
или две R6a группы вместе с атомом, к которому они присоединены, необязательно образуют 3-10-членное ароматическое или неароматическое кольцо; и где R6a замещен 6 заместителями, независимо выбранными из R;
R6b представляет собой R6a или (С1-С3)-алифатическую группу.
10. Соединение по п.9, где R6a представляет собой
(С6-С10)-арил- или
(С6-С10)-арил-(С1-С12)-алкил-.
11. Соединение по п.10, где R6a представляет собой (С6-С10)-арил-.
12. Соединение по любому одному из пп.10 и 11, где каждый R6b представляет собой R6a или (С1-С3)-алифатическую группу.
13. Соединение по п.9, где R2 представляет собой водород, CF3 или CH3.
14. Соединение по п.13, где R2 представляет собой водород или CF3.
15. Соединение по п.13, где Т представляет собой связь или (С1-С4) алифатическую группу, где до одного алифатического атома углерода может быть замещено О.
16. Соединение по п.15, где Т представляет собой прямую связь, -СН2-, -СН(Ме)-, -СН2-СН2-, -СН2-O-СН2-, -СН(Ме)-O-СН2- или -СН2-СН2-O-СН2-.
17. Соединение по п.15, где Т представляет собой (С1-С4)алифатическую группу, где ноль атома углерода замещено с помощью О.
18. Соединение по п.17, где Т представляет собой -СН2- или -СН2-СН2-.
19. Соединение по п.18, где Т представляет собой -СН2-.
20. Соединение по п.15, где R9 является необязательно замещенным С6-арилом или С5-гетероарилом.
21. Соединение по п.20, где R9 является необязательно замещенным фенилом.
22. Соединение по п.21, где R9 представляет собой незамещенный фенил.
23. Соединение по п.1, представленное формулой II:
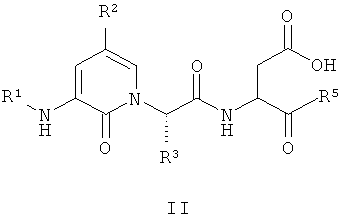
где R1, R2, R3 и R5 имеют значения, определенные ниже
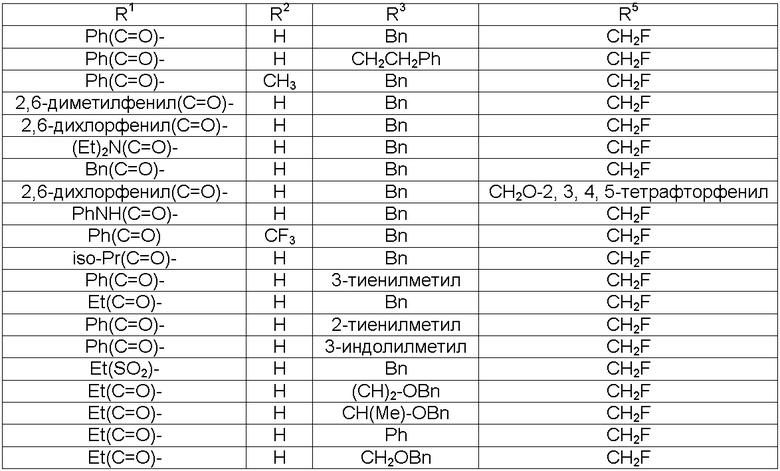
24. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении каспазы, содержащая:
a) соединение по п.1 и
b) фармацевтически приемлемый носитель, адъювант или наполнитель.
25. Способ лечения заболевания, опосредованного IL-1, заболевания, опосредованного апоптозом, воспалительного заболевания, аутоиммунного заболевания, деструктивной болезни костей, пролиферативного расстройства, инфекционного заболевания, дегенеративного заболевания, заболевания, связанного с клеточной гибелью, вирус-опосредованного заболевания или заболевания печени у пациента, включающий введение пациенту терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.24.
26. Способ лечения остеоартрита, ревматоидного артрита, системной красной волчанки, псориаза, респираторного дистресс-синдрома взрослых, воспалительных заболеваний кишечника, болезни Крона, панкреатита, хронического активного гепатита, почечных заболеваний, болезни «трансплантат против хозяина», отторжения пересаженного органа, инфаркта миокарда, ишемии миокарда, атеросклероза, осложнения, ассоциированного с аортокоронарным шунтированием, ишемии головного мозга, бокового амиотрофического склероза, рассеянного склероза, травмы спинного мозга, неврологического нарушения, обусловленного инсультом, сепсиса, септического шока, гепатита В, гепатита С, гепатита G у пациента, включающий введение этому пациенту терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.24.
27. Способ по п.26, отличающийся тем, что заболевание является остеоартритом, панкреатитом, респираторным дистресс-синдромом у взрослых, ревматоидным артритом, системной красной волчанкой, хроническим активным гепатитом, воспалительным заболеванием кишечника, болезнью Крона, псориазом, болезнью «трансплантат против хозяина», сепсисом, септическим шоком, ишемией головного мозга, ишемией миокарда или неврологическим нарушением, обусловленным инсультом.
28. Способ по п.26, отличающийся тем, что указанное заболевание является осложнением, связанным с аортокоронарным шунтированием.
29. Способ ингибирования опосредованных каспазами процессов у пациента, включающий введение пациенту терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.24.
30. Способ снижения продукции IGIF или IFN-y у пациента, включающий введение фармацевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.24.
31. Способ консервирования клеток, включающий стадию хранения клеток в растворе соединения по п.1.
32. Способ по п.31, где указанные клетки являются:
a) клетками органа, предназначенного для трансплантации; или
b) клетками препаратов крови.
33. Способ по любому из пп.25-30, отличающийся тем, что способ включает введение дополнительного терапевтического агента.
34. Способ получения соединения формулы
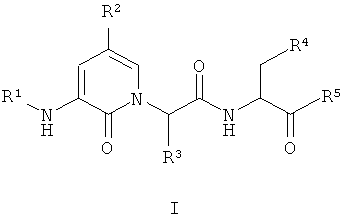
где R1 представляет собой R6C(O)-, R6SO2-, (R6)2NC(O)-;
R2 представляет собой водород, -CF3 или R8;
R3 представляет собой -T-R9;
R4 представляет собой -СООН или -COOR8;
R5 представляет собой -CH2F или -CH2O-2, 3, 5, 6-тетрафторфенил;
R6 представляет собой R6a или R6b; две R6 группы вместе с тем же атомом, к которому они присоединены, необязательно образуют 3-10-членное ароматическое или неароматическое кольцо; и где каждый R6 независимо замещен 6 заместителями, независимо выбранными из R;
R6a и R6b каждый независимо представляет собой
(С1-С3)-алифатическую группу,
(С6-С10)-арил-,
(С6-С10)-арил-(С1-С12)-алифатическую группу;
R представляет собой галоген, -OR7, -R7;
каждый R7 независимо выбран из: водорода,
(С1-С12)-алифатической группы,
(С6-С10)-арила;
R8 представляет собой (С1-С12)-алифатическую группу;
Т представляет собой прямую связь или (С1-С6) алифатическую группу, где до 2 алифатических атомов углерода в Т могут быть необязательно замещены О;
R9 является необязательно замещенным (С6-С10)-арилом или (С5-С10)-гетероарилом;
включающий:
(а) взаимодействие соединения формулы (III):
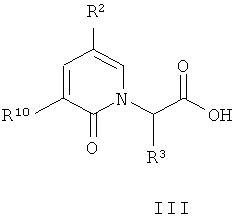
где R10 представляет собой -NO2, -C(O)OR11, -CN, R6C(O)N(H)-; R6SO2N(H)-, R6OC(O)N(H)-, (R6)2NC(O)N(H)-, R6C(O)C(O)N(H)-, (R6)2NC(O)C(O)N(H) - или R6OC(O)C(O)N(H)-;
R11 независимо представляет собой водород, (С1-С12)-алифатическую группу, (С3-С10)-циклоалифатическую группу, (С6-С10)-арил-, (С3-С10)-гетероциклил-, (С5-С10)-гетероарил-, (С3-С10)-циклоалифатик-(С1-С12)-алифатическую группу, (C6-C10)-арил-(C1-C12) -алифатическую группу, (С3-С10)-гетероциклил-(С1-С12)-алифатическую группу, (С5-С10)-гетероарил (C1-C12)-алифатическую группу, где до 3 алифатических атомов углерода могут быть замещены группой, выбранной из О, N, N(R7), S, SO и SO2;
и где R11 необязательно замещен до 6 заместителями, независимо выбранными из R; и
R, R2, R3 и R6 имеют значения, определенные выше; с соединением формулы (IV):
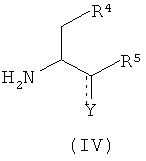
где Y представляет собой или карбонильную группу, или ОН группу; и R4 и R5 имеют значения, определенные выше; в присутствии агентов связывания и растворителя;
при условии, что если Y представляет собой ОН группу, тогда способ дополнительно включает (b) окисление ОН группы, чтобы обеспечить соединение формулы (I); и
при условии, что если R10 представляет собой -NO2, -С(О)OR11 или -CN, способ дополнительно включает стадию превращения -NO2, -C(O)OR11 или -CN в R6C(O)N(H)-, R6SO2N(H)-, R6OC(O)N(H)-, (R6)2NC(O)N(H)-, R6C(O)C(O)N(H)-, (R6)2NC(O)C(O)N(H)- или R6OC(O)C(O)N(H)-.
35. Способ по п.34, отличающийся тем, что соединение формулы (III):
где R2 представляет собой водород, -CF3 или R8;
R3 представляет собой -T-R9;
R10 представляет собой -NO2, -C(O)OR11, -CN, R6C(O)N(H)-, R6SO2N(H)-, R6OC(O)N(H)-, (R6)2NC(O)N(H)-, R6C(O)C(O)N(H)-, (R6)2NC(O)C(O)N(H)- или R6OC(O)C(O)N(H)-;
R6 представляет собой R6a или R6b;
две R6 группы вместе с атомом, с которым они связаны, необязательно образуют 3-10-членное ароматическое или неароматическое кольцо; и где каждый R6 независимо замещен 6 заместителями, независимо выбранными из R;
R6a и R6b каждый независимо представляет собой
(С1-С3)-алифатическую группу, (С6-С10)-арил-,
(С6-С10)-арил-(С1-С12)-алифатическую группу;
R представляет собой галоген, -OR7, -R7;
каждый R7 независимо выбран из:
водорода,
(С1-С12)-алифатической группы,
(С6-С10)-арила;
R8 представляет собой (С1-С12)-алифатическую группу;
Т представляет собой прямую связь, (С1-С6)алифатическую группу, где до 2 алифатических атомов углерода в Т могут быть необязательно замещены О;
R9 является необязательно замещенным (С6-С10)-арилом или (С5-С10)-гетероарилом;
получают с помощью способа, включающего:
(с) взаимодействие соединения формулы (V):
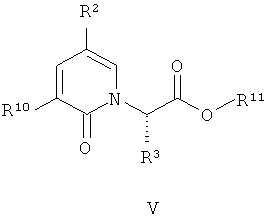
где R11 независимо представляет собой водород,
(С1-С12)-алифатик-(С3-С10)-циклоалифатическую группу,
(С6-С10)-арил-,
(С3-С10)-гетероциклил-,
(С5-С10)-гетероарил-,
(С3-С10)-циклоалифатик-(С1-С12)-алифатическую группу,
(С6-С10)-арил-(С1-С12)-алифатическую группу,
(С3-С10)-гетероциклил-(С1-С12)-алифатической группы,
(С5-С10)-гетероарил-(С1-С12)-алифатическую группу, где до 3 алифатических атомов углерода могут быть замещены группой, выбранной из О, N, N(R7), S, SO и SO2; и
R, R2, R3, R7 и R10 имеют значения, определенные выше; в растворителе при наличии условий снятия защиты.
36. Способ по п.35, где соединение формулы (V):
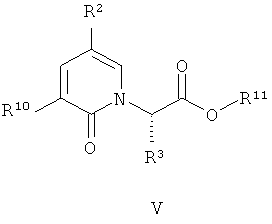
где R2, R3, R10 и R11 имеют значения, определенные в п.35; получают с помощью способа, включающего:
(d) взаимодействие соединения формулы (VI):
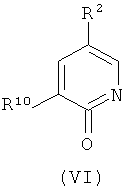
где R2 и R10 имеют значения, определенные в п.35; с соединением формулы (VII):
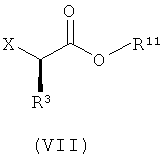
где X представляет собой подходящую уходящую группу; и R3 и R11 имеют значения, определенные выше;
в присутствии растворителя и основания.
37. Способ получения соединения формулы (VIII):
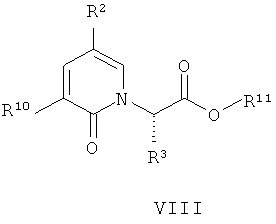
где R2 представляет собой -CF3 или R8;
R3 представляет собой -T-R9;
R10 представляет собой -NO2, -C(O)OR11, -CN, R6C(O)N(H)-, R6SO2N(H)-, R6OC(O)N(H)-, (R6)2NC(O)N(H)-, R6C(O)C(O)N(H)-, (R6)2NC(O)C(O)N(H)- или R6OC(O)C(O)N(H)-;
R11 независимо представляет собой водород,
(С1-С12)-алифатическую группу,
(С3-С10)-циклоалифатическую группу,
(С6-С10)-арил-,
(С3-С10)-гетероциклил-,
(С5-С10)-гетероарил-,
(С3-С10)-циклоалифатик-(С1-С12)-алифатическую группу,
(С6-С10)-арил-(С1-С12)-алифатическую группу,
(С3-С10)-гетероциклил-(С1-С12)-алифатическую группу,
(С5-С10)-гетероарил (С1-С12-алифатическую группу, где до 3 алифатических атомов углерода могут быть замещены группой, выбранной из О, N(H), N(R), S, SO и SO2; и где R11 необязательно замещен до 6 заместителями, независимо выбранными из R;
R6 представляет собой R6a или R6b; две R6 группы вместе с атомом, с которым они связаны, необязательно образуют 3-10-членное ароматическое или неароматическое кольцо; и где каждый R6 независимо замещен 6 заместителями, независимо выбранными из R;
R6a и R6b каждый независимо представляет собой
(С1-С3)-алифатическую группу,
(С6-С10)-арил-,
(С6-С10)-арил-(С1-С12)-алифатическую группу;
R представляет собой галоген, -OR7, -R7; каждый R7 независимо выбран из:
водорода,
(С1-С12)-алифатической группы,
(С6-С10)-арила;
R8 представляет собой
(С1-C12)-алифатическую группу;
Т представляет собой прямую связь или (С1-С6)алифатическую группу, где до 2 алифатических атомов углерода в Т могут быть необязательно замещены О;
R9 является необязательно замещенным (С6-С10)-арилом или (C5-C10)-гетероарилом;
включающий стадию (е) взаимодействия соединения формулы (IX):
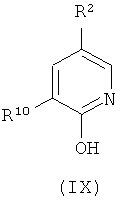
где R2 и R10 имеют значения, определенные выше; с соединением формулы (VII)
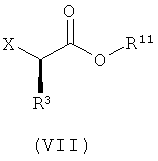
где
R3 и R11 имеют значения, определенные выше; и X представляет собой подходящую уходящую группу;
в присутствии растворителя и основания.
38. Способ получения соединения формулы (I):
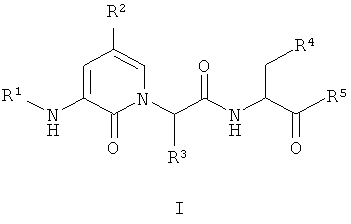
где
R1 представляет собой R6C(O)-, R6SO2-, (R6)2NC(O)-;
R2 представляет собой водород, -CF3 или R8;
R3 представляет собой -T-R9;
R4 представляет собой -СООН или -COOR8;
R5 представляет собой -CH2F или -CH2O-2, 3, 5, 6-тетрафторфенил;
R6 представляет собой R6a или R6b; две R6 группы вместе с тем же атомом, к которому они присоединены, необязательно образуют 3-10-членное ароматическое или неароматическое кольцо; и где каждый R6 независимо замещен 6 заместителями, независимо выбранными из R;
R6a и R6b каждый независимо представляет собой
(С1-С3)-алифатическую группу,
(С6-С10)-арил-,
(C6-C10)-арил-(С1-С12)-алифатическую группу;
R представляет собой галоген, -OR7, -R7;
каждый R7 независимо выбран из:
водорода,
(С1-С12)-алифатической группы,
(С6-С10)-арила;
R8 представляет собой (С1-С12)-алифатическую группу;
Т представляет собой прямую связь или (C1-C6) алифатическую группу, где до 2 алифатических атомов углерода в Т могут быть необязательно замещены О;
R9 является необязательно замещенным (С6-С10)-арилом или (С5-С10)-гетероарилом; включающий:
(а) взаимодействие соединения формулы (III):
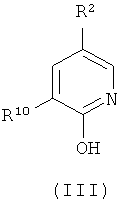
где R10 представляет собой -NO2, -C(O)OR11, -CN, R6C(O)N(H)-, R6SO2N(H)-, R6OC(O)N(H)-, (R6)2NC(O)N(H)-, R6C(O)C(O)N(H)-, (R6)2NC(O)C(O)N(H)- или R6OC(O)C(O)N(H)-; и
R2, R6 и R11 имеют значения, определенные выше; с соединением формулы (X):
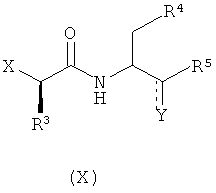
где Y представляет собой или карбонильную группу, или ОН группу; и R3, R4 и R5 имеют значения, определенные выше;
в присутствии агентов связывания и растворителя;
при условии, что если Y представляет собой ОН группу, тогда способ дополнительно включает (b) окисление ОН группы, чтобы получить соединение формулы (I); и
при условии, что если R10 представляет собой -NO2, -C(O)OR11 или -CN, способ дополнительно включает стадию превращения -NO2, -C(O)OR11 или -CN в R6C(O)N(H)-, R6SO2N(H)-, R6OC(O)N(H)-, (R6)2NC(O)N(H)-, R6C(O)C(O)N(H)-, (R6)2NC(O)C(O)N(H)- или R6OC(O)C(O)N(H)-.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| RU 94015282 A1, 20.12.1995. | |||
Авторы
Даты
2011-02-27—Публикация
2005-11-21—Подача