Изобретение относится к молекулярной биологии и биотехнологии и связано с анализом молекул нуклеиновых кислот путем амплификации их специфичных фрагментов. Оно может быть использовано при проведении ДНК-диагностики, в том числе в полевых условиях, в медицине, ветеринарии, санитарно-эпидемиологических исследованиях для обнаружения возбудителей опасных инфекций, включая возможные биотеррористические атаки, в криминалистике для идентификации преступников, в пищевой промышленности при выявлении продуктов питания из генетически модифицированных организмов, определении качества сырья и т.д.
Существующие способы ДНК-диагностики основаны преимущественно на амплификации специфичных фрагментов ДНК или РНК с помощью полимеразной цепной реакции (ПЦР) и ее модификаций. В последние годы, помимо обычной ПЦР по конечной точке, требующей электрофоретического разделения продуктов реакции (или их анализа каким-нибудь другим методом), все более широкое применение находит так называемая ПЦР в реальном времени (ПЦР-РВ), когда детекция целевого продукта ведется прямо в ходе амплификации с помощью специальных ДНК-термоциклеров, оснащенных оптическим модулем.
После своего появления в середине 80-х годов двадцатого столетия ПЦР, по крайней мере, по масштабу применимости довольно быстро стала фактически методом №1 в медико-биологических науках и в диагностике. Тем не менее, вслед за ПЦР большей частью на рубеже 90-х гг.появился целый ряд других реакций амплификации и способов высокочувствительной детекции специфичных фрагментов ДНК или РНК. Однако ни один из тех методов, ни появившихся позже в силу ряда причин так до сих пор и не смогли составить серьезной конкуренции ПЦР.
Для своего осуществления ПЦР требует циклического изменения температур, поскольку для того, чтобы начался новый цикл, должна произойти денатурация ампликонов (обычно при температуре около 95°С) с последующим отжигом праймеров (чаще всего при температурах от 50 до 60°С) и их удлинением (наиболее часто используются температуры 72-75°С). Но ввиду того, что температурные переходы в реакционном блоке и соответственно в реакционной смеси не происходят мгновенно, то значительное время тратится на то, чтобы нагреть и охладить сам блок и затем содержимое пробирок до нужных значений температур, на что часто уходит свыше 80% общего времени реакции. Для ускорения смены температур в самой реакционной смеси в ПЦР предложено использовать специальные тонкостенные полипропиленовые пробирки, поставляемые в настоящее время многими фирмами. Тем не менее, практически сразу после появления метода ПЦР стали разрабатываться всевозможные способы быстрого изменения температур в реакционных пробирках. Так, в первых коммерческих моделях термоциклеров, нагрев реакционных блоков осуществлялся за счет электрических тэнов, а охлаждение было или воздушным, или водяным. В настоящее время, подавляющее большинство термоциклеров основаны на элементах Пельтье, позволяющих достаточно легко и быстро менять температуру в реакционном блоке. Скорости смены температур для основанных на элементах Пельтье разных моделей термоциклеров разных фирм варьируют в среднем от 2 до 6°С в секунду. При этом реакционные блоки некоторых скоростных термоциклеров изготовлены не из обычно используемого алюминия, а из позолоченного серебра, которое гораздо лучше проводит тепло, но заметно дороже. Как правило, амплификация фрагментов ДНК размером до 1 тысячи пар нуклеотидов в течение 25-30 циклов в термоциклерах такого типа занимает от 30 минут до 2 часов.
Альтернативой термоциклерам на базе элементов Пельтье служат приборы, где очень быстрый нагрев (до 15°С/сек) осуществляется мощной инфракрасной лампой, а охлаждение - мощным вентилятором [Wittwer et al., 1990; 1995]. В этом случае как таковой реакционный блок отсутствует и вместо него имеется воздушная камера, что исключает инерционность смены температур, поскольку воздух одной температуры очень быстро заменяется другим, благодаря чему типичные 30 циклов в таких приборах завершаются за 15 минут. Однако некоторым недостатком таких приборов является то, что реакция, как правило, ведется в специальных стеклянных капиллярах, а не в стандартных полипропиленовых пробирках, которые заметно дешевле и удобнее.
Более быстрая смена температур в реакционном блоке достигается путем попеременной подачи под давлением горячего и холодного газов, что, впрочем, заметно усложняет всю конструкцию. Так, один из самых быстрых ДНК-термоциклеров по конечной точке, работающий за счет действия газов, получил название PCRJet. Сообщается, что с его помощью 35 циклов укладываются в 8 минут [Ebmeier et al., 2004]. В выданном патенте США на термоциклер, основанный на том же принципе говорится о смене температур со скоростью 17°С в секунду [Quintanar, Nelson, 2002]. Дополнительными недостатками этих моделей помимо необходимости применения газов под давлением является использование вместо удобных стандартных пробирок специальных кювет.
Другое решение относительно быстрой смены температур реализовано в приборах Robocycler фирмы Stratagene, в которых имеется 4 блока, постоянно поддерживающих каждый свою температуру (или градиент температур в некоторых моделях), между которыми с помощью манипулятора происходит механическое перемещение реакционных планшет, на которое также требуется время, и поэтому продолжительность одного только цикла составляет около 3 минут.
Все эти вышеописанные способы быстрой смены температур предусматривают еще и то, что внутри воздушной камеры или металлического термоблока будет обеспечена униформная температура, отличающаяся для расположенных в разных местах пробирок на десятые доли градуса.
Принципиально иным подходом являлся способ проведения ПЦР в термоциклере оригинальной конструкции (Nakano et al., 1994). Главной особенностью этого прибора было то, что полимеразная цепная реакция протекала не как обычно в пробирке, а в потоке жидкости, с помощью специального пневматического насоса постоянно движущейся по тефлоновому капилляру, отдельные отрезки которого были помещены в зоны с соответствующими температурами денатурации ДНК, отжига праймеров и построения новых цепей. Таким образом, определенные части общей реакционной смеси в этом случае находятся одновременно в разных температурных условиях, что кардинально отличает данный режим от классических подходов и несет некоторые преимущества, благодаря чему эта идея впоследствии получила заметное развитие при разработке ПЦР в микрожидкостных устройствах.
Постоянно меняющаяся неоднородная температура в реакционной смеси характерна и для случаев проведения ПЦР с использованием эффекта термоконвекции. В одном варианте конвекционной ПЦР смена температур внутри реакционной смеси происходит за счет градиента силы поверхностного натяжения, вызванного температурными различиями, и такая конвекционная ячейка носит название ячейки Марангони. На ее основе предложен способ проведения ПЦР, рассчитанный на проведение амплификации не в пробирках, а в проточном микрожидкостном устройстве [Lee et al., 2006]. Его недостатком является невысокая скорость протекания реакции и плохая масштабируемость.
Другой механизм перемещения слоев жидкости, лежащий в основе так называемой конвекционной ячейки Бенара-Рэлея, приводится в действие силой плавучести, являющейся разницей между архимедовой силой и силой тяжести. На этом принципе была предложена конвекционная ячейка для проведения ПЦР, представляющая собой вертикальный канал глубиной 1,5 см и объемом 35 мкл в кубике из оргстекла [Krishnan et al., 2002]. Снизу производился нагрев кубика до 97°С, а сверху он был термостатирован при температуре 61°С. В результате за 1,5 часа реакции наработался специфичный ПЦР-продукт, количество которого оказалось достаточным, чтобы его увидеть с помощью агарозного гель-электрофореза.
Позднее этими же авторами [Krishnan et al., 2004] конвекционная ПЦР-система была несколько улучшена, но сохранила основные недостатки в виде малой скорости реакции и трудности заполнения реакционных сосудов. Так, вместо одноканального кубика был изготовлен специальный многоколодцевый картридж из оргстекла, который сверху и снизу нагревался до нужных температур алюминиевыми пластинами. Однако серьезная проблема исключения образования вверху полости воздушных пузырьков, способных кардинально изменить устанавливаемый температурный режим, можно сказать, была не решена, поскольку предлагалось слегка переполнять полость жидкостью, не допуская при этом перекрестного загрязнения образцов, что сразу свидетельствует об абсолютной нетехнологичности данного способа амплификации. Отбор жидкости из данных вертикальных весьма узких каналов после завершения реакции затруднителен или, по крайней мере, довольно длителен. Другим вариантом реакционных сосудов, также предложенных в этой работе, были 9-сантиметровые отрезки полимерной трубки, вмещающие в себя 15 мкл жидкости. Как и в случае с картриджем с колодцами, здесь также рекомендовался некоторый перелив при заполнении, которое необходимо производить, изогнув трубку в форме буквы U. Хотя в этом случае наличие небольшого воздушного пузырька и не столь опасно для прохождения реакции. Замыкание трубки в кольцо после ее заполнения производится маленьким отрезком другой трубки подходящего диаметра, после чего такому реакционному сосуду можно придавать разные формы, обеспечивая подвод к соответствующим участкам трубки нужных температур, для возникновения конвекционных ячеек и потоков жидкости. Сообщается, что в такой конвекционной ПЦР приблизительно 40 минут инкубации требуется для наработки целевого продукта, сравнимого по количеству с таковым при проведении обычной ПЦР [Krishnan et al., 2004]. Способ проведения ПЦР в отрезке трубки получил в дальнейшем свое развитие, что позволило этим же авторам [Agrawal, Ugaz, 2007; Agrawal et al., 2007] создать карманный конвекционный термоциклер, питающийся от батареек типа АА. Но при этом такой портативный способ амплификации с помощью конвекционной ПЦР сохранил все недостатки своих более крупногабаритных предшественников.
Еще один тип конвекционной ячейки для проведения ПЦР был предложен другими авторами [Braun et al., 2003]. Несмотря на то, что им удалось добиться относительно высокой скорости амплификации, завершающейся приблизительно за 10 минут, благодаря тому, что время, затрачиваемое на один стандартный цикл (денатурация, отжиг, элонгация), составляло всего около 15 секунд, их реакционный сосуд представлял собой тонкий слой жидкости между покровными стеклами для микроскопических исследований, герметизированных силиконом, и никак не мог быть рекомендован для массовых экспериментов и тем более для ДНК-диагностики.
Еще более сложноустроенная ячейка с вертикальным градиентом температур, в которой должна возникать конвекция и происходить ПЦР, предложена в патенте США №6586233 [Bennet et al., 2003]. Однако массовость применения этого способа конвекционной ПЦР ввиду сложности и явной дороговизны самой рабочей камеры, где происходит амплификация, крайне сомнительна. В работе других авторов [Hwang et al., 2004] реакционным сосудом служила открытая с верхней стороны толстостенная стеклянная трубка. Ее высота составляла 55-60 мм, внутренний диаметр - 2 мм, внешний диаметр - 8 мм, запаянный нижний конец имел толщину стенок 3 мм. Она помещалась в полнотелый реакционный блок, разделенный изолятором на верхнюю и нижнюю части, где для каждого задавалась своя температура. Целевой продукт на электрофорезе появлялся лишь после часовой инкубации, причем в ходе конвекционной ПЦР реакционный сосуд находился под давлением азота в 1,2 атм. Все эти сложности также ставят под сомнение массовое применение подобной конвекционной ПЦР.
Таким образом, ни один из предложенных в настоящее время способов конвекционной ПЦР не обеспечивает действительно быстрой смены температур и не рассчитан на широкомасштабное применение.
Ближайшими прототипами предлагаемому нами способу амплификации нуклеиновых кислот с помощью конвекционной ПЦР служат способы, основанные на конвекционных ячейках Бенара-Рэлея, поскольку вклад сил поверхностного натяжения, характерных для ячейки Марангони, в нашем случае несущественен.
Цель изобретения состоит в значительном ускорении с помощью конвекции, основанной на силе плавучести, протекания ПЦР и упрощении ее проведения с сохранением высокой специфичности реакции.
Сущность изобретения заключается в том, что быстрая амплификация целевых продуктов ПЦР ведется в специальном ДНК термоциклере, оснащенном особым реакционным термоблоком, обеспечивающем в реакционных сосудах, которыми служат стандартные полипропиленовые пробирки, наклонный градиент температуры, ориентированный под углом к направлению действия силы тяжести.
Реакционный блок в конвекционном ДНК-термоциклере представляет собой две алюминиевые (или из другого подходящего металла) полоски со специальными выборками (для нижней) и искривлениями (для верхней или боковой полоски), обеспечивающими максимально плотный контакт с нужными местами реакционных полипропиленовых 0.2 мл пробирок, содержащих обычно 30 мкл реакционной смеси (фиг.1). Поддержание требуемой температуры металлических полосок осуществляется с помощью элементов Пельтье и управляется процессором. Ввиду короткого времени протекания реакции (1-5 минут) не требуется предотвращения испарения ни с помощью горячей крышки, ни наслаиванием минерального масла.
В другом варианте нижняя температура (температура денатурации) вместо алюминиевой полоски поддерживается с помощью металлической (алюминиевой) пластины с соответствующими многочисленными выборками, количество которых совпадает с числом используемых пробирок и представляет собой вместимость термоциклера. Форма выборок повторяет профиль околодонной части пробирки с таким расчетом, что плотный контакт обеспечивается только с одной стороны дна и сбоку. Ввиду стандартного квадратно-гнездового расположения пробирок этот реакционной блок не требует переделки стандартных оптических модулей для регистрации протекания реакции в режиме реального времени.
После приложения заданных температур к реакционным пробиркам внутри них очень быстро создается наклонный градиент температур, запускающий механизм конвекции, основанный на силе плавучести. Причем благодаря наклонному градиенту температур возникает направленное движение слоев жидкости, в массе своей не разбивающееся на многочисленные ячейки Бенара, как это часто происходит в случае приложения вертикального градиента температур. С помощью специальных пробных частиц была оценена скорость вращения жидкости по эллипсоподобному пути, составившая от 2 до 3 секунд на оборот, благодаря чему за это время жидкость из зоны с высокой температурой (зона денатурации) проходит зону средней температуры (нерабочая зона), попадает в зону низкой температуры (зона отжига), вновь попадает в зону средней температуры (зона элонгации) и затем опять в зону высокой температуры и т.д. Таким образом, один цикл занимает около 2-3 секунд и за 1-2 минуты их происходит от 20 до 60. Ввиду того, что жидкость в средней части пробирки описывает меньший эллипс, то молекулы ДНК, находящиеся в ней, не оказываются в зоне высокой температуры, где могла бы произойти денатурация ампликонов и соответственно затем отжиг праймеров, сопровождающийся их удлинением. Однако, благодаря имеющей место диффузии и флуктуациям потоков, слои жидкости из центральной части смещаются и оказываются также вовлеченными в этот температурный круговорот. При этом абсолютно неважно, что все ампликоны одновременно не ведут себя одинаково. Главное, чтобы успело размножиться молекул столько, что это можно будет регистрировать или по конечной точке электрофорезом, или в реальном времени по свечению соответствующего красителя(ей).
Что касается малого времени пребывания молекул ДНК в каждой из температурных зон, то следует заметить, что главное предназначение конвекционной ПЦР это не наработка протяженных фрагментов ДНК для их последующего клонирования или секвенирования, а она рассчитана на проведение массовых анализов, где размер ампликонов обычно не бывает большим, а нужна лишь большая пропускная способность метода при проведении диагностических тестов. Так, для проведения специфичной ПЦР вполне достаточно детектировать фрагмент размером около 40 пар нуклеотидов с помощью праймеров, отжигающихся встык (на разных цепях) или даже с условным перекрытием в 1 нуклеотид. При этом специфичность амплификации при правильном подборе праймеров будет обеспечена, поскольку число всех вариантов перебора азотистых оснований во фрагменте длиной 40 нуклеотидов составит гигантскую величину в 440, что приблизительно равно гептиллиону (1024) комбинаций и случайное нахождение таких участков нуклеотидной последовательности возможно с вероятностью 8x10-25, и поскольку геномов с такими размерами не существует, то, следовательно, такое событие можно считать крайне маловероятным.
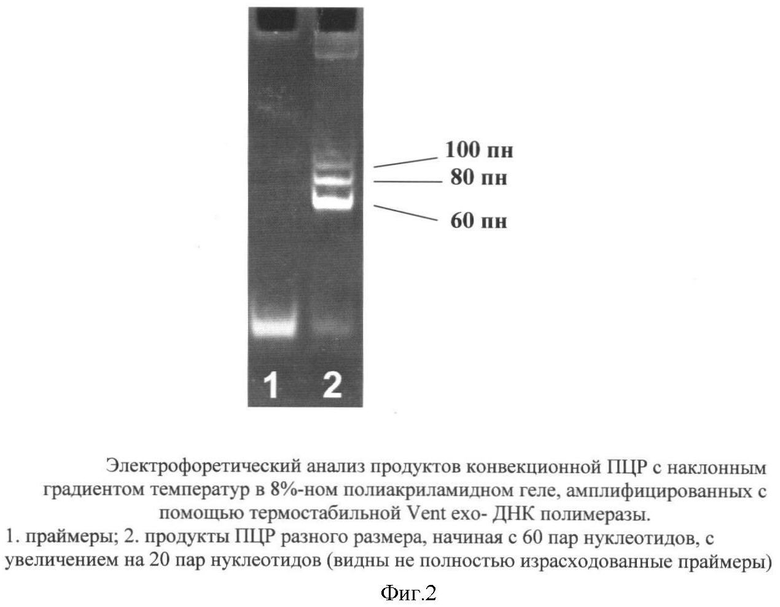
Скорость работы многих термостабильных ДНК полимераз весьма высока, и за те мгновения (менее секунды), что ампликон с отожженым праймером находится в зоне, оптимальной для элонгации цепи ДНК, фермент вполне успевает построить 20 и более нуклеотидов. Как можно видеть из фиг.2, с помощью конвекционной ПЦР с наклонным градиентом температур вполне удается уверенно амплифицировать фрагменты ДНК длиной, по крайней мере, до 100 пар нуклеотидов. Время отжига праймеров и денатурации ДНК в виде образования и разрушения водородных связей, по разным оценкам измеряемое от пикосекунд до миллисекунд, также не является лимитирующим.
Предлагаемый способ амплификации специфичных фрагментов ДНК или РНК с помощью полимеразной цепной реакции, управляемой термоконвекцией, иллюстрируется нижеследующими примерами.
Пример 1. Проведение конвекционной ПЦР.
ПЦР проводили в 30 мкл реакционной смеси, содержащей буфер (40 мМ Трис-НСl рН8.0, 2.5 мМ MgCl2, 25 мМ КСl); 1 ед. акт. Taq ДНК полимеразы; по 0.5 пмоль каждого из 2 праймеров и соответствующее количество дистиллированной воды. ПЦР проводили в экспериментальном образце конвекционного ДНК-амплификатора, где в нижней части пробирки поддерживалась температура 95°С, а в месте, расположенном наискосок от первого, задавалась температура, оптимальная для отжига выбранных праймеров. Приложение к указанным местам (фиг.1) температур денатурации и отжига обеспечивало формирование наклонного градиента температур и возникновение конвекции. Время инкубации варьировало от 1 минуты до 5 минут.
Пример 2. Электрофоретический анализ продуктов ПЦР.
Электрофоретическое разделение продуктов ПЦР проводили в 8%-ном полиакриламидном геле в трис-ацетатном буфере рН 7.8 в неденатурирующих условиях при градиенте напряжения 4V на см длины геля в приборе вертикального типа в течение 4 часов. По завершении электрофореза гель после окрашивания бромистым этидием фотографировали в фотодокументационной системе Gel Camera System (UVP, Inc.).
Литература
Agrawal N., Hassan Y.A., Ugaz V.M. A Pocket-Sized Convective PCR Thermocycler // Angew. Chem. Int. Ed. Engl. 2007. V.46. P.4316-4319.
Agrawal N., Ugaz V.M. A buoyancy-driven compact thermocycler for rapid PCR // Clin. Lab. Med. 2007. V.27. P.215-223.
Bennet W.J., Richards J.B., Milanovich F.P. Convectively driven PCR thermal-cycling // US Patent No 6586233 B2. Jul. 1, 2003.
Braun D., Goddard N.L., Libchaber A. Exponential DNA replication by laminar convection // Phys. Rev. Lett. 2003. V.91. 158103.
Ebmeier R., Whitney S., Alugupally S., Nelson M., Padhye N., Gogos G., Viljoen H.J. Ranque -Hilsch vortex tube thermocycler for DNA amplification // Instrum. Sci. Technol. 2004. V.32. P.567-570.
Hwang H.J., Kim J.H., Jeong K. Method and apparatus for amplification of nucleic acid sequences by using thermal convection // US Patent Application Publication No 2004/0152122 Al. Aug. 5,2004.
Krishnan M., Agrawal N., Burns M.A., Ugaz V.M. Reactions and fluidics in miniaturized natural convection systems // Anal. Chem. 2004. V.76. P.6254-6265.
Krishnan M., Ugaz V.M., Burns M.A. PCR in a Rayleigh-Benard convection cell // Science. 2002. V.298. P.793.
Lee Y-S., Kuk K., Oh Y-S., Shih S-H., Kim M-S. Polymer chain reaction apparatus using Marangoni covection and polymer chain reaction method using the same // US Patent Application Publication No 2006/0216725 Al. Sep.28, 2006.
Nakano H., Matsuda K., Yohda M., Nagamune Т., Endo I., Yamane T. High speed polymerase chain reaction in constant flow // Biosci. Biotech. Biochem. 1994. V.58. P.349-352.
Quintanar A., Nelson R.M. High speed process and apparatus for amplifying DNA // US Patent No. 6472186 Bl. Oct. 29,2002.
Wittwer C.T., Fillmore G.C., Garling D.J. Minimizing the time required for DNA amplification by efficient heat transfer to small samples // Anal. Biochem. 1990. V.186. P.328-331.
Wittwer C.T., Hillyard D.R., Ririe K.M. Rapid thermal cycling device // US Patent No 5455175. Oct. 3, 1995.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ АМПЛИФИКАЦИИ СПЕЦИФИЧНЫХ ФРАГМЕНТОВ НУКЛЕИНОВЫХ КИСЛОТ С ПОМОЩЬЮ РЕКУРРЕНТНОЙ ЦЕПНОЙ РЕАКЦИИ | 2007 |
|
RU2414510C2 |
| СПОСОБ СТАНДАРТИЗАЦИИ ДАННЫХ КОНВЕКЦИОННОЙ ПОЛИМЕРНОЙ ЦЕПНОЙ РЕАКЦИИ С РЕГИСТРАЦИЕЙ НАКОПЛЕНИЯ ПРОДУКТОВ РЕАКЦИЙ ПО ФЛУОРЕСЦЕНЦИИ НЕПОСРЕДСТВЕННО ВО ВРЕМЯ РЕАКЦИИ | 2010 |
|
RU2423685C1 |
| Способ диагностики энзоотической пневмонии свиней методом полимеразной цепной реакции | 2018 |
|
RU2702170C1 |
| СПОСОБ И НАБОР ДЛЯ ОБНАРУЖЕНИЯ БАКТЕРИЙ РОДА CAMPYLOBACTER У БОЛЬНЫХ С ВОСПАЛИТЕЛЬНЫМИ ЗАБОЛЕВАНИЯМИ КИШЕЧНИКА | 2019 |
|
RU2732923C1 |
| СПОСОБ ДЕТЕКЦИИ И ОПРЕДЕЛЕНИЯ БИОТИПА, СЕРОГРУППЫ И ТОКСИГЕННОСТИ ВОЗБУДИТЕЛЯ ХОЛЕРЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2007 |
|
RU2360972C1 |
| Способ диагностики мутации 35delG (rs80338939) гена GJB2 | 2020 |
|
RU2739889C1 |
| Способ диагностики мутации 167delT (rs80338942) гена GJB2 | 2020 |
|
RU2739943C1 |
| Способ диагностики мутации c.-23+1G>A (rs80338940) гена GJB2 | 2020 |
|
RU2746055C1 |
| ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ, ФЛУОРЕСЦЕНТНЫЙ ЗОНД И СПОСОБ ДЛЯ ВЫЯВЛЕНИЯ РНК ВИРУСА БОЛЕЗНИ ИБАРАКИ МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2013 |
|
RU2540142C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФИКСИРОВАННОГО ВИРУСА БЕШЕНСТВА ШТАММА "МОСКВА 3253" | 2012 |
|
RU2511440C2 |
Изобретение относится к области биотехнологии, в частности к способу амплификации специфичных фрагментов нуклеиновых кислот с помощью полимеразной цепной реакции в конвекционной ячейке Бенара-Рэлея. Амплификация целевых продуктов ведется в специальном ДНК термоциклере, оснащенном особым реакционным термоблоком. Данный термоциклер обеспечивает в реакционных сосудах, которыми служат стандартные полипропиленовые пробирки, градиент температуры, ориентированный под углом к направлению действия силы тяжести. Время такой амплификации составляет 1-5 минут. Предложенное изобретение позволяет значительно ускорить с помощью конвекции ПЦР, а также упростить ее проведение с сохранением высокой специфичности. 3 з.п. ф-лы, 2 ил.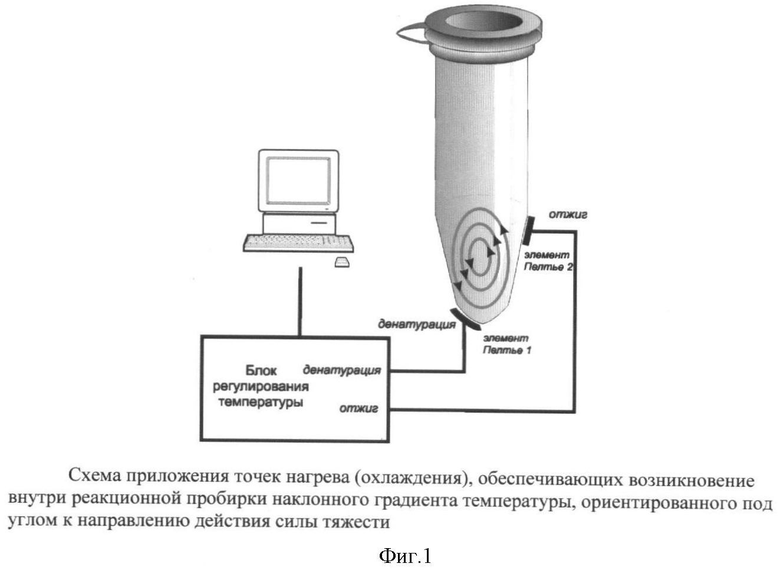
1. Способ амплификации специфичных фрагментов нуклеиновых кислот с помощью полимеразной цепной реакции в конвекционной ячейке Бенара-Рэлея, отличающийся тем, что в реакционном сосуде обеспечивается градиент температуры, ориентированный под углом к направлению действия силы тяжести.
2. Способ по п.1, отличающийся тем, что используют реакционный сосуд, представляющий собой стандартную полипропиленовую пробирку.
3. Способ по п.1, отличающийся тем, что регистрацию процесса амплификации нуклеиновых кислот ведут в режиме реального времени.
4. Способ по п.1, отличающийся тем, что приложение одинаковых температур к соответствующим частям реакционного сосуда и их синхронная смена вместо возникновения градиента температур обеспечивает достаточную однородность температуры для всей жидкости и при необходимости позволяет проводить обычную ПЦР.
| US 2004152122 A1, 05.08.2004 | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| US 2006216725 A1, 28.09.2006. | |||
Авторы
Даты
2011-03-10—Публикация
2007-06-14—Подача