Изобретение относится к способу анализа пробы крови, а также к устройству и реагенту для его реализации. Более конкретно настоящее изобретение относится к области автоматического анализа проб крови.
При анализе образца крови обычно стремятся определить:
- общее количество лейкоцитов;
- более конкретно количество лейкоцитов по субпопуляциям (базофилы, эозинофилы, нейтрофилы, моноциты и лимфоциты);
- количество эритроцитов и тромбоцитов; и
- уровень гемоглобина.
Известно несколько методик анализа, в частности:
- оценку гемоглобина проводят после лизиса эритроцитов, т.е. разрушения мембран клеток эритроцитов и путем измерения гемоглобина, выделившегося в среду спектрофотометрическими методами; оценка гемоглобина также требует стабилизации гемоглобина в сложной форме (оксигемоглобин и цианметгемоглобин) для измерения спектральной способности поглощения одного соединения на соответствующей длине волны;
- в образце крови проводят общий подсчет лейкоцитов по резистивности, проводя специфический лизис эритроцитов и защищая лейкоциты;
- дифференцируют лейкоциты и подсчитывают их количество по субпопуляции:
- либо измеряя волюметрическую резистивность после конкретного лизиса эритроцитов, защиты лейкоцитов и регулировки рН; однако такой способ не позволяет дифференцировать все субпопуляции в одном анализе;
- или оптическим способом, в частности, методом проточной цитометрии, после специфического лизиса и защиты лейкоцитов, измеряя различные параметры (в частности, дифракцию, флуоресценцию, поглощательную способность) в потоке лейкоцитов по оси узкого, среднего и широкого углов и, опционально, после добавления метящего агента (например, хлоразол черный, или пигменты для маркирования ДНК и РНК, или флуоресцентные пигменты), и путем измерения на разных длинах волн; такая методика позволяет дифференцировать субпопуляции лейкоцитов;
- подсчет эритроцитов и тромбоцитов проводят в разведенном образце путем измерения резистивности без добавления конкретного реагента.
Существует много автоматических анализаторов клеток крови, в которых используются эти методики для проведения как можно более полного анализа образца крови.
В таких автоматических анализаторах традиционно сосуществуют два разных контура анализа:
- первый контур, выполненный с возможностью измерения гемоглобина и/или проведения подсчета общего числа лейкоцитов; и
- второй контур, выполненный с возможностью проведения дифференциации образца крови и/или подсчитывать лейкоциты методом проточной цитометрии.
Каждый контур характеризуется степенью разбавления образца крови в соответствии с используемым измерительным средством, добавлением одного или более реагента и соответствующим средством для проведения измерений.
Так, для измерения гемоглобина и подсчета лейкоцитов контур типично содержит так называемую счетную камеру, в которой разбавляют образец крови, реагент, содержащий, в частности, соединение для лизиса эритроцитов, стабилизирующее соединение для комплекса, сформированного из гемоглобина, к нему добавляют соединение лейкопротектора и непосредственно в ней измеряют гемоглобин спектрофотометрическим методом и количество лейкоцитов по резистивности. Степень разбавления выбрана такой, чтобы аналитический раствор был идеально гомогенен и чтобы устройство обнаружения не переполнялось. Степень разбавления составляет от 1/100 до 1/500, обычно от 1/160 до 1/180.
Для дифференциации лейкоцитов путем проточной цитометрии в контуре используется сосуд для разбавления образца крови, к которому добавляют один или более реагентов, содержащих агент для лизиса эритроцитов, факультативно дифференцирующий агент (например, флуоресцентный пигмент для ДНК или РНК лейкоцитов), затем часть этого раствора отбирают для инъекции в проточную оптическую камеру проточного цитометра. Здесь используется степень разбавления менее 1/100, что обеспечивает оптимальное время анализа в имеющихся в настоящее время на рынке цитометрах (гидрофокусного типа).
Следовательно, обычно для двух контуров анализа приходится использовать по меньшей мере два разных реагента и в этих двух контурах анализа приходится применять две разные степени разбавления.
Главной целью производителей является упрощение существующих автоматических устройств за счет уменьшения количества компонентов и реагентов, что позволяет снизить расходы на производство и обслуживание, уменьшить габариты автоматических устройств, без уменьшения, однако, времени на полный анализ образца крови.
Настоящее изобретение направлено на достижение этих целей.
В международной публикации WO 2004/003517 для этой цели предлагаются способ и оборудование, в котором два контура анализа имеют общие средства. Принцип заключается в проведении первого разбавления образца крови в единственном разбавляющем сосуде и в последовательном переносе частей этого раствора, имеющих выбранный объем, в блок измерения или подсчета, чтобы каждый раз измерять или подсчитывать разные элементы, содержащиеся в образце крови. Для проведения полного анализа, а именно подсчета эритроцитов и тромбоцитов, подсчета лейкоцитов, измерения гемоглобина и дифференциации лейкоцитов, в документе описано следующее решение: используют первый перенос для подсчета эритроцитов и тромбоцитов, в разбавляющий сосуд добавляют лизирующий агент, затем выполняют второй перенос для подсчета лейкоцитов, осуществляют третий перенос лизированного раствора для измерения уровня гемоглобина, добавляют реагент для дифференциации лейкоцитов и выполняют четвертый перенос для проведения дифференциации лейкоцитов в блоке измерения.
Этот принцип может позволить использовать единственный так называемый разбавляющий сосуд, но не позволяет сократить время анализа, поскольку измерения или подсчеты выполняются последовательно после каждого переноса части раствора. Более того, он требует точного управления объемом последовательно добавляемых реагентов и разбавителей, переносимых в блок измерения. Кроме того, он также требует применения нескольких шприцов и лизирующих реагентов.
Целью настоящего изобретения является также устранение указанных недостатков.
Согласно первому объекту настоящее изобретение относится к способу автоматического анализа образца крови и к устройству для реализации этого способа.
Способ по настоящему изобретению отличается тем, что в едином сосуде для разбавления и анализа формируют аналитический раствор, содержащий пробу крови, разбавитель и по меньшей мере одно соединение для лизиса эритроцитов, по меньшей мере одно соединение для стабилизации гемоглобина в форме хромогенного комплекса, в этом аналитическом растворе в сосуде после лизиса эритроцитов методом спектрофотометрии измеряют уровень гемоглобина из этого сосуда и отбирают соответствующее количество аналитического раствора, на котором оптическими средствами проводят дифференциацию лейкоцитов.
Способ согласно изобретению отличается тем, что аналитический раствор также содержит по меньшей мере одно соединение для защиты лейкоцитов, позволяя выделить по меньшей мере пять основных субпопуляций лейкоцитов.
Подсчет лейкоцитов может проводиться совместно в сосуде для анализа и/или оптическими средствами.
Подсчет эритроцитов и опционально тромбоцитов может проводиться, например, на предыдущем этапе способа, на пробе, находящейся в едином сосуде для разведения анализа.
Таким образом, настоящее изобретение основано на концепции единственного аналитического раствора, используемого в том виде, в котором он существует для двух типов анализа, которые обычно проводят в двух отдельных контурах, а именно, с одной стороны, для измерения гемоглобина и опционально подсчета лейкоцитов, и, с другой стороны, для дифференциации лейкоцитов оптическими средствами, при этом в аналитическом растворе объединены соединения реагентов, способные выполнить эти виды анализа, благодаря их природе и их количеству. Эти введенные соединения реагентов выбирают так, чтобы они были химически совместимы друг с другом и в количествах, подходящих для нужного анализа. Их можно выбирать из соединений, типично применяемых в предшествующем уровне техники. Можно также использовать коммерческие составы, которые обычно используются для дифференциации лейкоцитов, т.е. содержащие соединение для лизирования эритроцитов и соединение лейкопротектора, и добавить к нему третье соединение реагента, предназначенное для стабилизации гемоглобина в форме хромогенного комплекса.
Благодаря такому единственному аналитическому раствору настоящее изобретение, в частности, дает следующие преимущества:
- автоматическое устройство может содержать единственный сосуд для подготовки аналитического раствора;
- измерение гемоглобина можно проводить непосредственно в этом сосуде, наряду с глобальным подсчетом лейкоцитов измерением резистивности аналитического раствора;
- можно использовать монореагент, объединяющий все соединения "реагентов", необходимые для измерения гемоглобина и для дифференциации лейкоцитов оптическими средствами; это особенно позволяет упростить гидравлические контуры, как будет показано ниже;
- монораствор образца крови можно переносить непосредственно в единственный раствор и аналитический сосуд, при этом степень разбавления определяется как функция измерения и использованного средства обнаружения. Монореагент может служить разбавителем для получения этого монораствора. Предпочтительно степень разбавления выбирают от 1/100 до 1/500 в соответствии со степенью разбавления, необходимой для измерения уровня гемоглобина, предпочтительно, также выбирают степень разбавления 1/175 (1/173 в описанном ниже варианте).
Возможность использования монораствора и монореагента позволяет, благодаря первому объекту настоящего изобретения, значительно упростить аналитическое оборудование, тем не менее, давая возможность проводить полный анализ образца крови.
Согласно настоящему изобретению также предлагается средство для оптических измерений, позволяющее проводить анализ лейкоцитов (подсчет и дифференциацию по субпопуляциям) при степени разбавления выше 1/100, которое определено и описано ниже.
Монореагент, используемый в способе по настоящему изобретению, позволяет измерять концентрацию гемоглобина в пробе крови методом спектрофотометрии и проводить дифференциацию лейкоцитов оптическими средствами. Он также позволяет проводить резистивный и/или оптический подсчет лейкоцитов. Предпочтительно он выбирается так, чтобы обеспечивать дифференциацию по меньшей мере пять субпопуляций. Предпочтительно, он выбирается так, чтобы не содержать цианидов.
Согласно настоящему изобретению соединение для лизиса эритроцитов предпочтительно образовано по меньшей мере одним катионным поверхностно-активным веществом. В известной предпочтительной форме оно выбрано для образования комплекса оксигенированного гемоглобина (поскольку он не токсичен по сравнению с цианметгемоглобиновым комплексом, в котором имеются ионы цианида). Катионное поверхностно-активное вещество, таким образом, также выбирается так, чтобы формировать только комплекс оксигенированного гемоглобина. Количество катионного поверхностно-активного вещества, таким образом, выбирается так, чтобы эффективно гемолизировать эритроциты и окислять высвобожденный гемоглобин. Он предпочтительно выбран из ряда, содержащего:
- четвертичные аммониевые соли, предпочтительно алкилтриметиламмониевые соли, и еще более конкретно, цетил- додецил- тетрадецил- и гексадецилтриметиламмониевые бромиды и хлориды;
- пиридиновые соли;
- длинноцепочечные этоксилированные амины; и
- алкиловые сульфаты (SDS).
Соединение-лейкопротектор по настоящему изобретению - это соединение, которое задерживает или предотвращает разрушение лейкоцитов. Предпочтительно это неионное или амфотерное поверхностно-активное вещество, предпочтительно выбранное из ряда, содержащего:
- этоксилированные спирты, в частности 2-феноксиэтанол, полиокисэтиленалкилфениловые эфиры, такие как коммерческие продукты IPEGAL990®, TRITON®, X100 или X114, plurafac® A38 или Brij35®;
- бетаины и сульфобетаины четвертичных аммониевых солей, в частности лаурамидопропилбетаин (LAB) и додецилдиметил-3-аммоний-1-пропансульфонат (DDAPS) или тетрадецилдиметил-3-аммоний-1-пропансульфонат (TDAPS);
- третичные аминовые оксиды, такие как N,N-диметиллауриламин-N-оксид (LDAO) или 3-[(холамидопропил)-диметиламино-]-1-пропан сульфонат (CHAPS или CHAPSO);
- соединения гликозидного типа и, более конкретно, тритерпеновый сапонин;
- соединения глюцидного типа (маннитол, D-глюкоза, трегалоза, декстран сульфат).
Соединение, которое стабилизирует гемоглобин в форме хромогенного комплекса, предпочтительно выбрано из ряда, содержащего:
- моно- или полидентатные хелаты, имеющие атомы лигандов (несвязывающие пары O, N, S и карбоксильных групп СОО- и пр.), в частности:
этилендиаминтетрауксусная кислота (EDTA) или этиленгликоль-бис-(3-аминоэтленэфир)N-N'-тетрауксусная кислота (EGTA) и, в частности, их натриевые или дикалиевые соли,
оксалат калия K2OxOx=C2O4 2,
гидроксиламиновые соли (предпочтительно, гидрохлориты),
органические кислоты (в частности, муравьиная или уксусная);
- ароматические соединения (моно- или полидентатные хелаты), имеющие атомы лигандов (не связывающие пары O, N, S и п.д.), в частности:
Tiron®,
8-гидроксихинолин и его производные,
пиридин или бипиридин и их производные,
1,10-фенантролин и его производные,
соединения фенола (моно или бис и их производные),
пиразол и/или пиразолоны и их производные,
имидазол и его производные,
сульфосалициловая кислота,
- сапонины, третичные оксиды амина, бетаины и сульфобетаины четвертичных аммониев (такие, как DDAPS, TDAPS, LAB).
В дополнение к этим трем соединениям, определенным настоящим изобретением, можно добавлять (моно)реагент(ы):
- по меньшей мере один пигмент (или смесь), специфически помечающий определенные лейкоциты и, более конкретно, эозинофилы (или базофилы) для обеспечения возможности выделения по меньшей мере пяти основных субпопуляций, выбранный из ряда, содержащего:
цианины;
Oxazine 750;
реагенты Райта и Романовского;
DAPI;
хлоразол черный Е;
толуидиновый синий;
астра синий;
триазоловый оранжевый G или синий;
другие флуоресцентные реагенты,
- по меньшей мере один фиксирующий агент, позволяющий укреплять мембрану лейкоцитов, которым предпочтительно является альдегид и, более конкретно, глутаральдегид или формальдегид;
- по меньшей мере один смачивающий агент для оптимизации струйной техники и предотвращения формирования пузырьков, который также действует как солюбилизатор для остатков органических веществ, выбранный из ряда, содержащего:
спирты (метанол, этанол или пропан-2-ол);
гликоли (этилен- или пропиленгликоль);
этоксилированные гликоли (в частности, Triton® X100 или Brij35®);
гликозидные соединения (TWEEN80® или TWEEN20®);
при этом концентрация фиксирующего агента и солюбилизатора строго ограничена, поскольку их избыток может воспрепятствовать лизису эритроцитов и изменить оптические свойства лейкоцитов; и
- буферную систему для задания водородного показателя рН между 5,0 и 10,0 и предпочтительно между 6,0 и 8,0 и, оптимально, близко к нейтральному (7,0±0,4). Выбор такого рН обусловлен стремлением учесть естественные условия клетки. Более того, такой рН обеспечивает лучшее растворение составляющих, используемых по настоящему изобретению. Такой буфер образован парой солей (неорганических или органических), приведенных к такому рН соляной кислотой или содой (4-6N), выбранную из ряда, содержащего:
дигидрофосфат/гидрофосфат натрия или калия Н2РО4 -/НРО4 2-
гидрокарбонат/карбонат натрия NaHCO3/Na2CO3;
буфер из лимонной кислоты/цитрата натрия (III);
TRIS-HCI;
триэтаноламинат (TEA);
имидазол,
- кислоту, выбранную из ряда, содержащего:
органические кислоты: фталевую, сульфосалициловую или муравьиную, которые также участвуют в формировании и стабилизации хромогенного комплекса гемоглобина; и
минеральные кислоты: HCl, H3PO4 и т.д.,
- фоновую соль, обеспечивающую проводимость порядка 10-50 мс/см, необходимую для измерения резистивности, и осмотическую концентрацию раствора порядка 120-500 мОсм, и, предпочтительно, близкую к изотоничности (290±5 мОсм), выбранную из ряда содержащего:
хлорид натрия (NaCl);
хлорид калия (KCl);
хлорид магния (MgCl2);
хлорид кальция (CaCl2) ;
безводный сульфат натрия (Na2SO4);
при этом эта фоновая соль может быть включена в буферную систему,
- по меньшей мере один консервант, обладающий свойствами ингибитора окисления и/или антибиотика, выбранный из ряда, содержащего:
2-феноксиэтанол;
парабены;
BHT;
изотиазолоны (Proclin® 150 или 300);
имидазол или производные мочевины;
антибиотики;
- натуральный антибиотик, проникающий в клетки (ионофор), который также облегчает проникновение пигмента или пигментов, выбранный из ряда, содержащего:
ионофор I для NH4 + (нонатин);
ионофор III для Са2+ (кальцимицин);
ионофор для Cl-;
ионофор I для К+ (валиномицин).
Составляющие по настоящему изобретению, а также диапазоны их концентрация сведены в нижеприведенную таблицу:
Согласно настоящему изобретению также предлагается устройство для реализации способа по настоящему изобретению, отличающееся тем, что:
- содержит аналитический сосуд, выполненный с возможностью принимать указанный аналитический раствор;
- содержит средство для измерения уровня гемоглобина, присутствующего в указанном аналитическом растворе методом спектрофотометрии в указанном сосуде;
- содержит средства для отбора проб указанного аналитического раствора;
- содержит средство для оптического измерения пробы для проведения анализа лейкоцитов.
Согласно второму объекту настоящее изобретение относится к оптическому устройству для автоматического устройства для проведения автоматического анализа пробы крови, которое особенно полезно для реализации способа по первому объекту настоящего изобретения.
Как указано выше, определенные субпопуляции лейкоцитов можно дифференцировать только оптическими измерениями, например измерением дифракции, создаваемой клеткой под одним углом или более, или измерением поглощающей способности клетки. Оптические системы для определения параметров клетки крови имеют общее основание, на котором расположен источник света, излучающий световой луч, оптический сосуд, в котором клетки крови пересекают световой луч, система для регулировки светового луча в соответствии с потоком клеток и средство для измерения света, исходящего из оптического сосуда после того, как он будет перекрыт клетками. В частности, для определения параметров лейкоцитов, лейкоциты движутся в потоке в этом сосуде. Они освещаются световым лучом, сфокусированным на потоке, который обозначен как "поток пробы".
Такие устройства дороги: в частности лазеры, которые используются в качестве источника света, которые громоздки и обычно требуют системы отвода теплоты; лазерные диоды, как и лазеры, которые требуют дорогих систем юстировки. Световые лучи, излучаемые такими источниками света, имеют приблизительно гауссово поперечное распределение света. Поэтому интенсивность является постоянной лишь приблизительно и максимальна в узкой и центральной части луча. Юстировочные системы позволяют выравнивать центральную часть [луча] с потоком пробы. Более того, ширина потока пробы не должна превышать ширину этой центральной части [луча] и чем меньше разница между этими двумя ширинами, тем выше должна быть точность юстировочной системы. В результате необходимо как можно больше уменьшить ширину потока пробы.
Поток пробы, содержащий подсчитываемые и/или дифференцируемые клетки крови должен быть тем уже, чем больше сфокусирован свет. Поэтому используется поток с шириной в сечении менее 50 мкм, который должен пересекать сфокусированный узкий световой луч, сечение которого превышает сечение потока пробы. Это требует особо точной и поэтому дорогой системы для инжектирования потока в оптический сосуд. Согласно предшествующему уровню техники такой результат достигается путем использования системы гидрофокусного типа (сокращение от английского выражения "гидродинамическое фокусирование"). Поток пробы окружен потоком-оболочкой. Инжектор потока пробы погружен в центр изолирующего потока. Созданный таким образом поток пробы при движении от инжектора к зоне, освещенной световым лучом, расширяется или фокусируется так, чтобы в этой точке он имел требуемый диаметр, приблизительно от 5 до 50 мкм. Для достижения этой цели требуется одинарный, а иногда двойной изолирующий поток.
Кроме того, как указано выше, учитывая требуемый уровень точности для того, чтобы поток клеток совпадал со световым лучом, существенную роль играет юстировочная система. В этом случае можно использовать два подхода: можно перемещать поток клеток или световой луч. Если перемещается поток клеток крови, нужно перемещать весь узел оптического сосуда. В этом случае сосуд устанавливается на подвижном столике, который обеспечивает точное и равномерное перемещение по двум осям, поскольку установлен на шариковых подшипниках. Такой прецизионный механический узел весьма дорог. Можно также перемещать световой луч, чтобы он совпадал с потоком клеток крови. Обычно это достигается с помощью нескольких регулируемых призм. Это решение, в котором соединены оптические элементы и прецизионная механика, также требует больших затрат.
Кроме того, что касается светового луча, клетки крови могут отклонять траекторию световых лучей. Интенсивность и угол отклоненных световых лучей дают информацию о типе клеток. Обычно используют два диапазона углов: узкие углы менее 10° относительно оптической оси, и широкие углы, приблизительно перпендикулярные оптической оси. В диапазоне узких углов полезны два вида информации: потери по оси и дифракция. Перпендикулярно оптической оси обычно измеряют диффузию и флуоресценцию. Следовательно, для этих двух диапазонов углов свет следует распределить по двум разным каналам. Это обычно достигается с помощью дихроичных зеркал или интерференционными фильтрами. Оптические компоненты обоих этих типов изготавливаются путем нанесения тонких пленок на стеклянную подложку. Они имеют высокую эффективность, но между разными экземплярами фильтра имеется значительное рассогласование и срок их службы невелик. Поэтому их приходится регулярно заменять.
Все эти обычно громоздкие устройства также достаточно непрочны и требуют обслуживания, которое также обходится очень дорого. Поэтому применение таких устройств ограничено аналитическими лабораториями, достаточно большими, чтобы иметь возможность приобретать такие автоматические устройства.
Целью настоящего изобретения является создание устройства для дифференциации лейкоцитов и/или подсчета лейкоцитов, более простого и более экономичного как в производстве, так и в обслуживании, позволяющего использовать автоматические устройства, которые оснащены таким устройством, небольшими лабораториями, сохраняя при этом адекватное качество измерений.
Согласно второму объекту настоящего изобретения предлагается оптическое устройство для подсчета и/или дифференциации лейкоцитов в автоматическом анализаторе крови, отличающееся тем, что содержит источник света относящийся к типу электролюминесцентного диода для освещения пробы крови, циркулирующей в оптическом сосуде по оси инжектирования, используя луч от источника света. Такой диод позволяет получить световой луч, который более однороден по ширине его сечения и, следовательно, имеет увеличенную и более однородную зону считывания.
Предпочтительно диод излучает свет, длина волны которого составляет менее 600 нм и, еще более предпочтительно, менее 500 нм. Такая длина волны обеспечивает повышенную эффективность дифракции и, следовательно, повышенную точность измерений, в которых используется дифракция.
Кроме того, ширина луча, излучаемого оптическим устройством, т.е. исходного луча, который освещает поток пробы, предпочтительно составляет от 50 до 200 мкм рядом с осью инжектирования, что позволяет освещать более широкий поток пробы, в то же время обеспечивая адекватную точность проводимого измерения. Еще более преимущественно эта ширина составляет от 90 до 120 мкм. Такую ширину потока, в частности, позволяет использовать применение электролюминесцентных диодов.
Предпочтительно исходный световой луч излучается приблизительно в направлении сосуда, приблизительно поперечно направлению потока пробы. Прозрачная призма, выполненная так, чтобы исходный луч проходил сквозь нее между двумя противолежащими поверхностями, которая установлена и расположена с возможностью вращения между диодом и сосудом, может позволить перемещать световой луч в поперечном направлении, благодаря двойному преломлению луча, когда он проходит сквозь пластину. Поворот пластины позволяет менять угол падения луча на пластину и, таким образом, регулировать величину поперечного сдвига. Предпочтительно прозрачная пластина установлена с возможностью поворота вокруг оси, проходящей приблизительно параллельно движению образца крови в сосуде.
За оптическим сосудом преимущественно используется средство для разделения по потерям на отражение результирующего светового луча, исходящего от источника света, которое разделяет этот луч на осевой луч и по меньшей мере один луч, полученный в результате потерь на отражение во время прохождения через разделяющее средство. Разделяющее средство содержит по меньшей мере одну разделяющую поверхность, которая является поверхностью в прозрачном разделяющем материале, при этом осевой луч проходит сквозь прозрачный материал, а луч, полученный в результате потерь на отражение, отражается разделяющей поверхностью, которая наклонена относительно светового луча за сосудом. Разделяющим средством может быть единственная недорогая стеклянная пластина. Кроме того, она имеет по существу неограниченный и не требующий обслуживания срок службы, в отличие от дихроичных зеркал или интерференционных фильтров.
Устройство также может содержать устройство для измерения света осевого луча и по меньшей мере одно другое устройство для измерения света по меньшей мере одного луча, полученного в результате потерь на отражение. Эти измерительные устройства могут содержать, в частности, средства для измерения флуоресценции, либо световых потерь рядом с осью, либо дифракции рядом с осью. Оно также может содержать средство для измерения дифракции светового луча на широких углах под воздействием пробы в сосуде. Например, эти широкие углы могут быть углами в диапазоне от 60 до 150°.
Устройство также может содержать на пути луча, перед сосудом, по меньшей мере одну диафрагму, блокирующую паразитный свет.
Настоящее изобретение также относится к гематологическому устройству, в частности к автоматическому анализатору крови, оснащенному таким устройством.
Согласно третьему объекту настоящее изобретение также относится к проточному оптическому сосуду для оптического устройства, предназначенного для подсчета и дифференциации лейкоцитов, например проточного цитометра, а также к аналитическому устройству, оснащенному таким сосудом. Целью настоящего изобретения является создание более простого и более экономичного в производстве и обслуживании сосуда, позволяющего использовать автоматические устройства, оснащенные таким сосудом в небольших лабораториях, сохраняя адекватное качество измерений.
Согласно настоящему изобретению проточный сосуд для оптического устройства для подсчета и дифференциации лейкоцитов в автоматическом анализаторе крови отличается тем, что в аналитической зоне сосуда сечение сосуда имеет по меньшей мере один поперечный размер, составляющий от 1 до 5 мм. Это сечение может быть приблизительно прямоугольным, и поперечное направление может измеряться по одной и/или по другой стороне прямоугольника.
Таким образом, такой сосуд может производиться, по меньшей мере частично из пластмассы, методом литья под давлением. Такой способ изготовления сосуда является особенно преимущественным по сравнению с известными сосудами, которые обычно изготавливают из кварцевых стенок, соединенных склеиванием.
Сосуд также может содержать по меньшей мере одну линзу, отлитую заодно с сосудом. Эта по меньшей мере одна линза может содержать линзу, выполненную с возможностью расположения сбоку относительно оптической оси. Она может содержать полусферическую линзу.
Сосуд может содержать расположенное вдоль его оптической оси окно для подачи светового луча и окно для выхода светового луча. По меньшей мере одно окно может быть отлито заодно с сосудом и/или быть выполнено в виде вставки в прозрачный материал, например, из кварца или стекла.
Сосуд может преимущественно содержать инжектор для потока пробы и средство для формирования потока-оболочки вокруг впрыснутого потока. Инжектор может содержать выходное отверстие, диаметр которого составляет от 20 до 150 мкм, позволяющее получить поток пробы, который значительно больше, чем потоки по предшествующему уровню техники. В отличие от устройств по предшествующему уровню техники ширина потока пробы определяется не потоком-оболочкой, который растягивает его, а формой и сечением выходного отверстия инжектора. Поток-оболочка, таким образом, играет не активную, а просто пассивную роль, в частности, например, центрируя поток пробы в широком сосуде.
Согласно первому варианту этот инжектор может быть сформирован как одна деталь из более или менее жесткого материала. Этим материалом может быть, например, нержавеющая сталь, керамика, синтетический рубин или пластмасса, или несколько из этих материалов.
Согласно второму варианту такой инжектор может содержать жесткую структурную трубку, например, выполненную из металла, например, из нержавеющей стали, и расположенную внутри металлической трубки пластмассовую вставную трубку, заканчивающуюся соплом, сформированным заодно с вставной трубкой. Пластмассой инжектора может быть политетрафторэтилен, который позволяет пробе легче циркулировать по трубке и уменьшает риск загрязнения.
Настоящее изобретение также относится к инжектору для сосуда по настоящему изобретению, выполненному по одному из этих вариантов.
Настоящее изобретение также относится к гематологическому устройству, в частности к автоматическому анализатору крови, оснащенному сосудом по настоящему изобретению.
Согласно четвертому объекту настоящее изобретение также относится к гидравлическому устройству для гематологического аналитического устройства, которое проще и экономичнее и в производстве, и в обслуживании, и которое позволяет использовать автоматическое устройство, оснащенное таким устройством, в небольших лабораториях, сохраняя адекватное качество измерений. Настоящее изобретение также относится к способу анализа, пригодному для такого устройства.
Согласно настоящему изобретению предлагается гидравлическое устройство для анализа крови, в частности автоматического устройства, содержащего средство для инжектирования под давлением потока пробы в проточный оптический сосуд и для создания потока-оболочки обволакивающей жидкости вокруг потока пробы, отличающемуся тем, что содержит средство для регулировки расхода потока пробы относительно расхода потока обволакивающей жидкости. Такая регулировка может позволить поддерживать гомогенные и приблизительно нетурбулентные потоки в сосуде.
Средство для инжектирования может содержать шприцы, гидравлический контур и электромагнитные клапаны. Эти средства могут содержать средства для инжектирования пробы под давлением относительно потока-оболочки.
Такое устройство может преимущественно содержать средство для формирования поршня из вытесняющей жидкости для впрыскиваемой пробы. Такая вытесняющая жидкость позволяет использовать лишь небольшие пробы, достаточные для анализа, а остальная жидкость, необходимая для инжектирования, является жидкостью, имеющейся в аналитическом устройстве и не являющейся имеющей большую ценность пробой.
Поток-оболочка особенно полезна при использовании сосуда с широким сечением, позволяя поддерживать малое сечение потока пробы. Как одно из средств регулирования потока пробы относительно потока-оболочки, устройство может преимущественно содержать средство для регулирования расхода вытесняющей жидкости относительно расхода обволакивающей жидкости. Регулировочное средство может содержать средство для создания падения давления в шунтирующей цепи для вытесняющей жидкости и/или средство для создания падения давления в шунтирующей цепи для обволакивающей жидкости. Например, средство для создания падения давления может быть выбрано из известного ряда, содержащего калиброванную трубку, фиксированное гидравлическое сопротивление и переменное гидравлическое сопротивление.
Гидравлическое устройство может содержать только один привод, например единственный электродвигатель, для одновременного генерирования потока пробы и потока-оболочки. Кроме того, оно может содержать по меньшей мере два шприца для генерирования потока пробы и потока-оболочки, при этом поршни шприцов прочно прикреплены друг к другу. Таким образом, они совершают общее перемещение, и поток пробы, и поток-оболочка генерируются действительно одновременно.
В частности, в описанной выше цепи по настоящему изобретению можно использовать гидрофокусный сосуд по предшествующему уровню техники и впрыск (инжектирование) пробы в такой сосуд может осуществляться без давления относительно потока-оболочки.
Согласно настоящему изобретению также предлагается способ анализа пробы крови и проточном цитометре, отличающийся тем, что инжектируют пробу крови, опционально под давлением, в проточный сосуд цитометра, при этом проба образует в нем поток пробы, и вокруг потока пробы создают окружающий его поток обволакивающей жидкости, отличающийся тем, что расход потока пробы регулируют относительно расхода потока-оболочки из обволакивающей жидкости.
В частности, можно вводить пробу в инжекторную ветвь гидравлического контура и выше по потоку от пробы можно вводить в инжекторную ветвь вытесняющую жидкость, при этом вытесняющая жидкость служит для выталкивания пробы при ее впрыске в сосуд. Такая вытесняющая жидкость может быть выбрана из ряда, содержащего реагент и разбавитель, предпочтительно реагент. Таким образом, нет необходимости использовать жидкости, кроме строго необходимых для приготовления пробы для анализа или анализов.
Вокруг потока пробы в сосуде также можно создать поток-оболочку из обволакивающей жидкости. Обволакивающую жидкость можно выбрать из ряда, содержащего реагент и разбавитель, предпочтительно разбавитель. В этом случае также нет необходимости использовать жидкости, кроме строго необходимых для приготовления пробы для анализа или анализов.
Если используется метод гидрофокусировки или сосуд согласно третьему объекту настоящего изобретения, преимущества дает регулировка расхода вытесняющей жидкости относительно расхода обволакивающей жидкости, например, путем создания падения давления в шунтирующей ветви для вытесняющей жидкости и/или средством падения давления в шунтирующей ветви для обволакивающей жидкости.
В способе согласно настоящему изобретению, в частности для сосуда, согласно третьему объекту настоящего изобретения легко предусмотреть степень разбавления пробы крови по меньшей мере 1/100. В действительности в таком способе пробу можно вводить в сосуд под давлением относительно обволакивающей жидкости со скоростью, превышающей скорость по предшествующему уровню техники и при большей ширине сечения потока пробы в сосуде. Поэтому, не увеличивая время анализа, для дифференциации и подсчета лейкоцитов можно использовать степень разбавления, идентичную обычно применяемой для измерения гемоглобина, в частности от 1/100 до 1/500, и, более конкретно, от 1/160 до 1/180.
Настоящее изобретение также относится к гематологическому устройству, в частности к автоматическому устройству для анализа крови, отличающемуся тем, что содержит гидравлическое устройство согласно настоящему изобретению.
Настоящее изобретение будет более понятным и другие преимущества станут более очевидными в контексте описания предпочтительных вариантов осуществления изобретения со ссылками на прилагаемые чертежи:
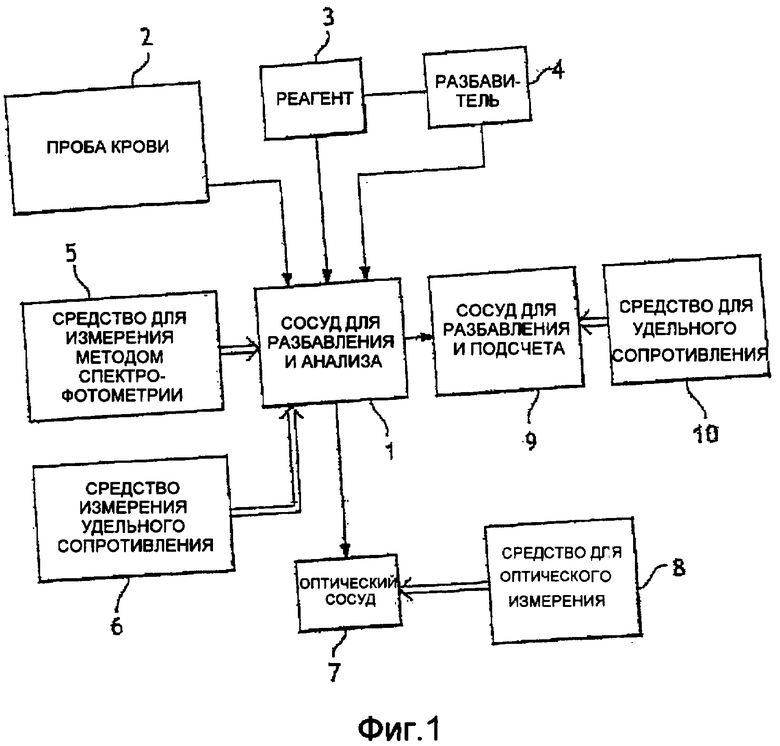
Фиг. 1 - схематический пример оборудования по первому объекту настоящего изобретения;
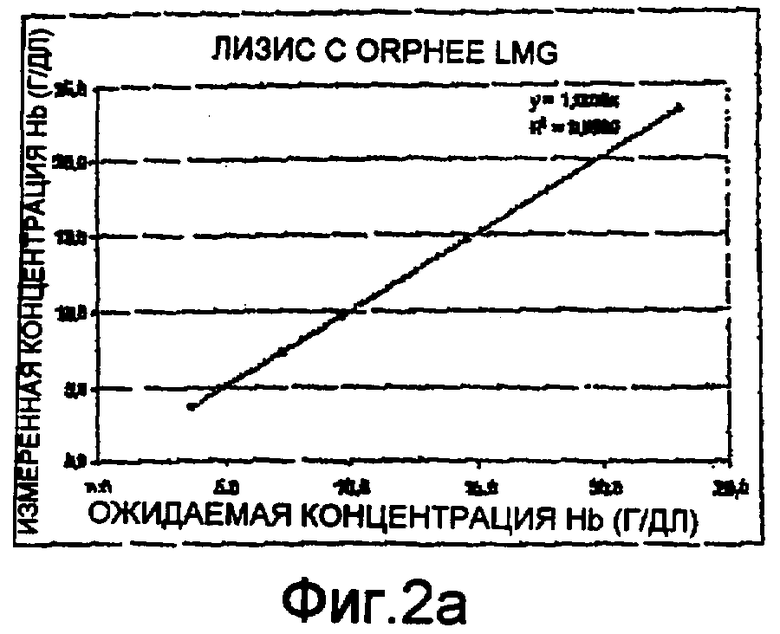
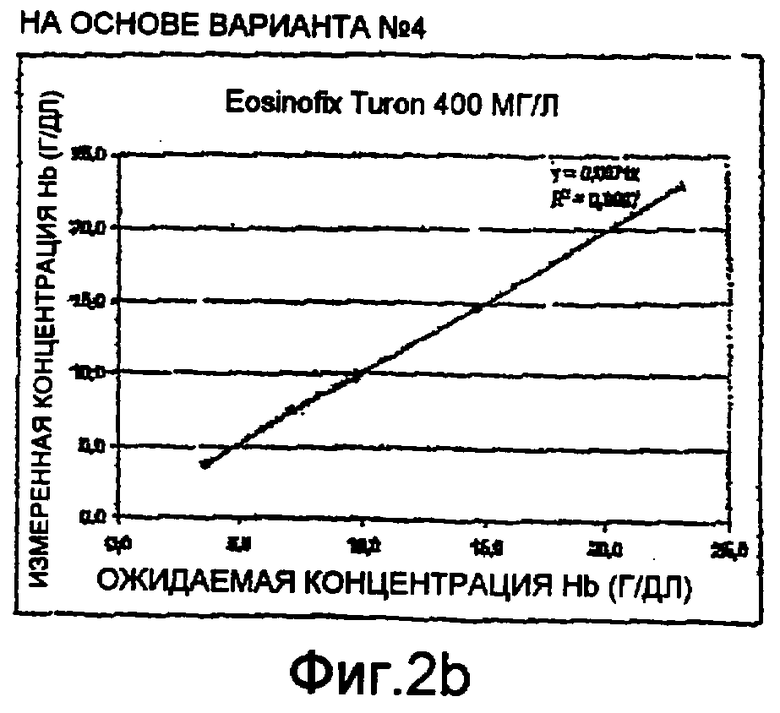
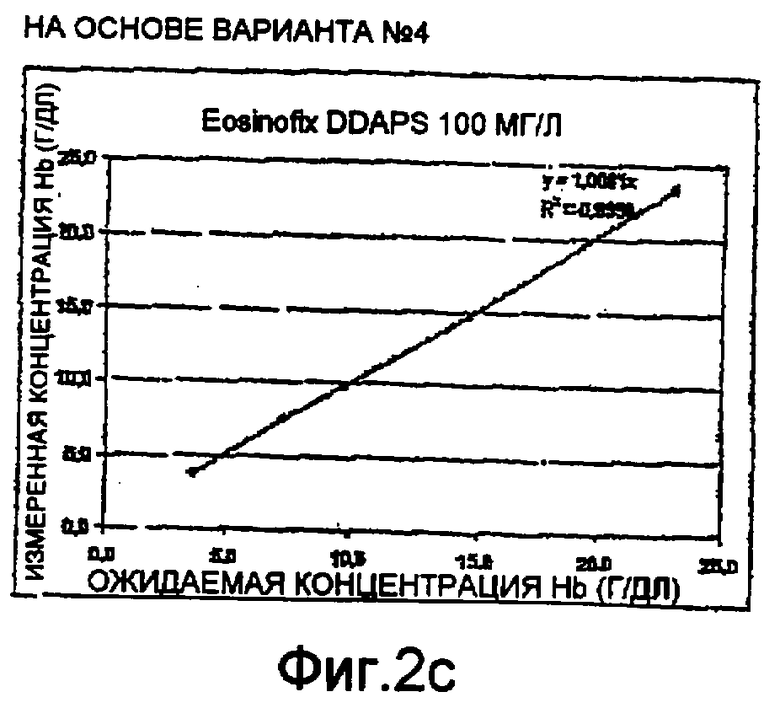
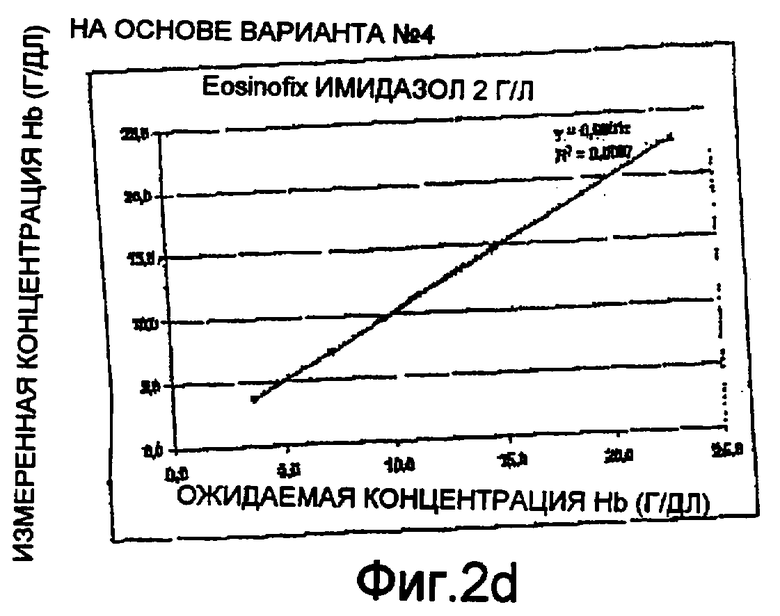
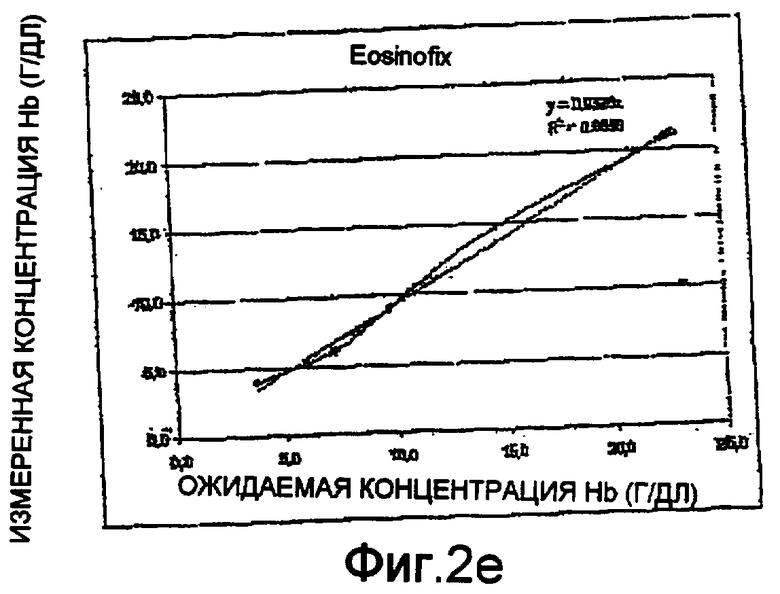
Фиг. 2а-2е - диаграммы линейных тестов измерений гемоглобина методом спектрофотометрии способом по настоящему изобретению;
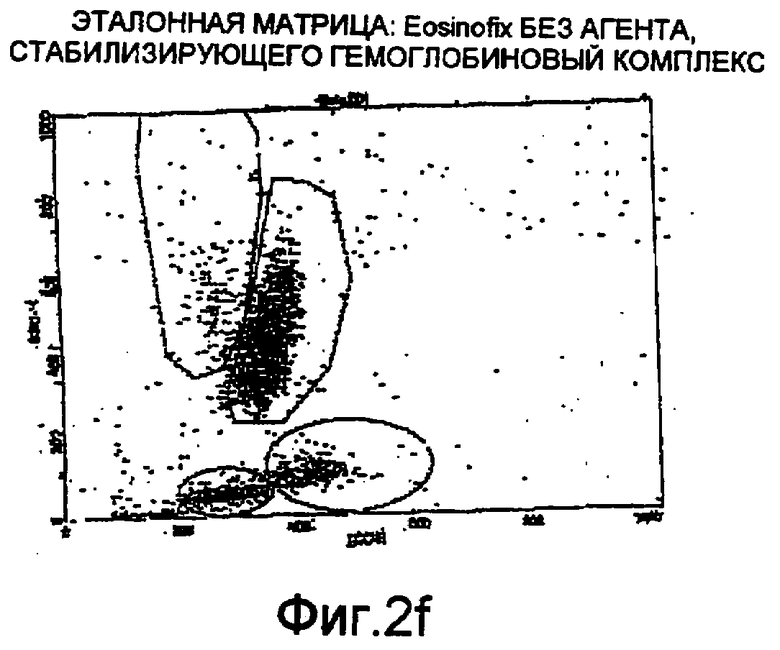
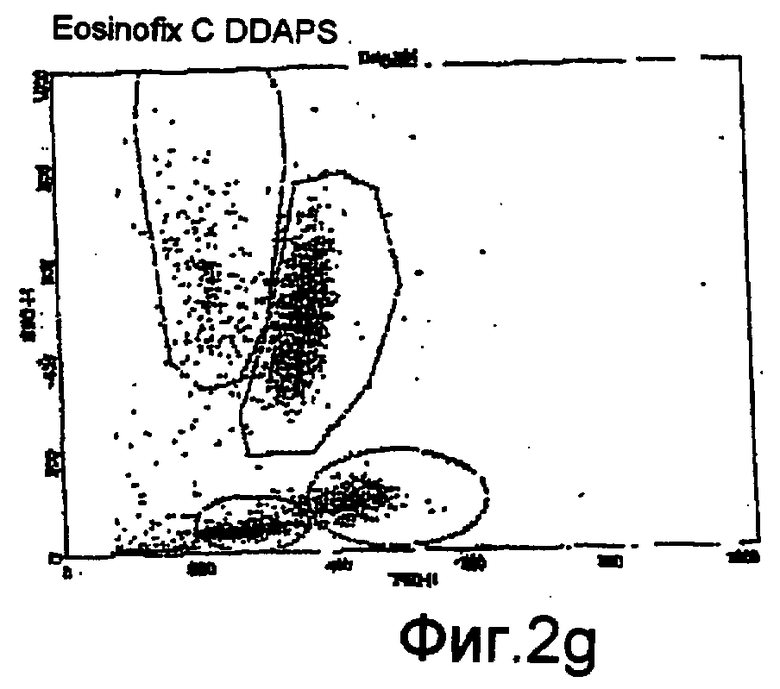
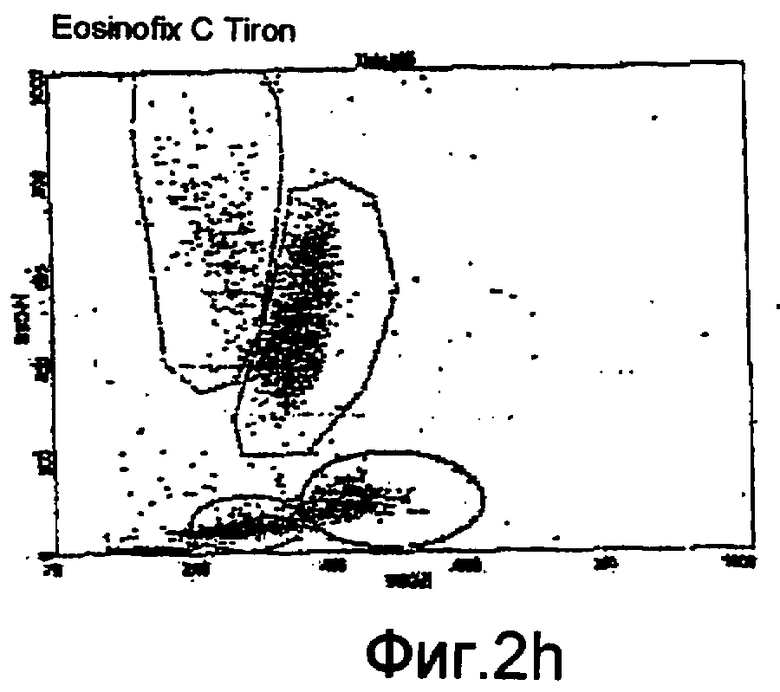
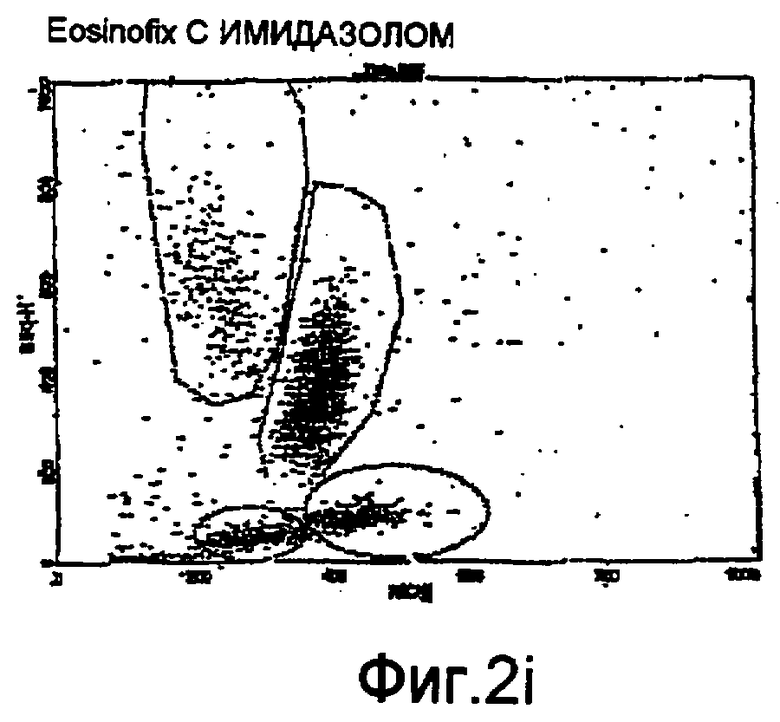
Фиг. 2f-2i - соответствующие цитограммы;
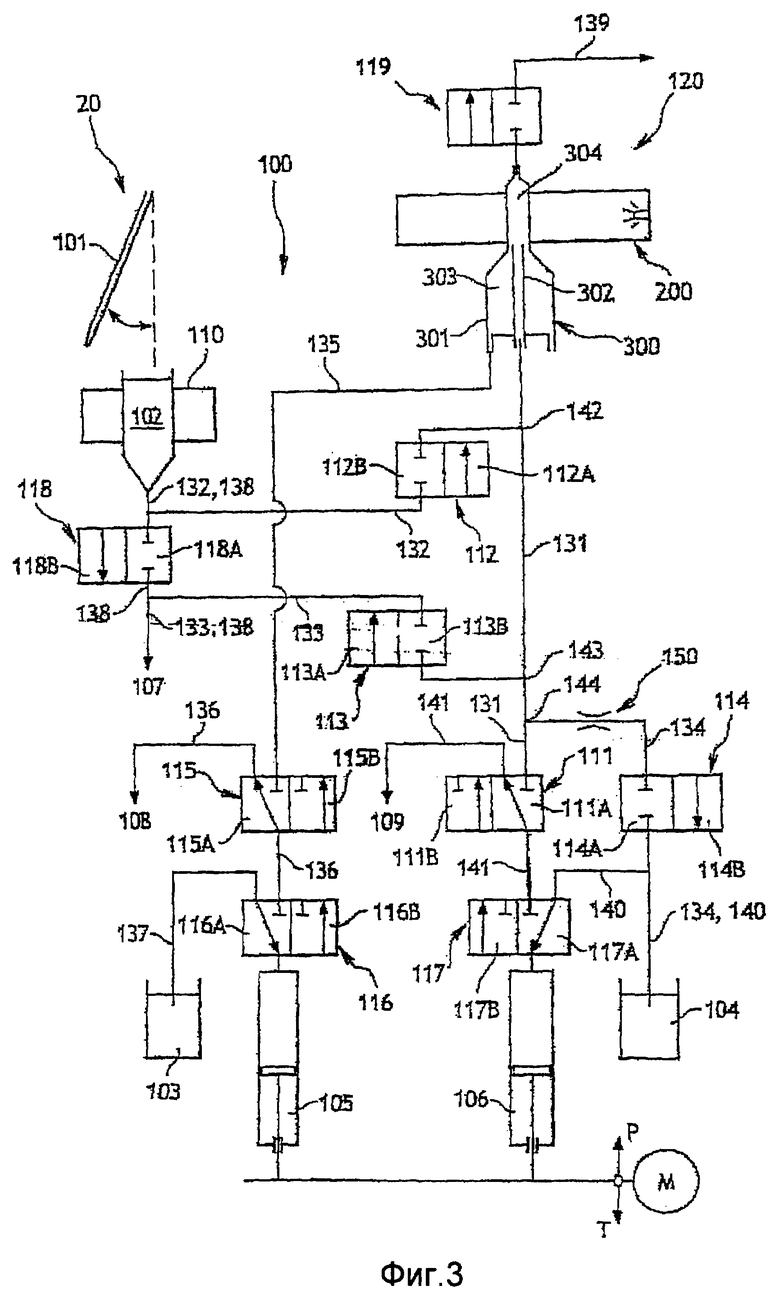
Фиг. 3 - схематический вид автоматического устройства для анализа пробы крови с использованием гидравлического устройства согласно четвертому объекту настоящего изобретения;
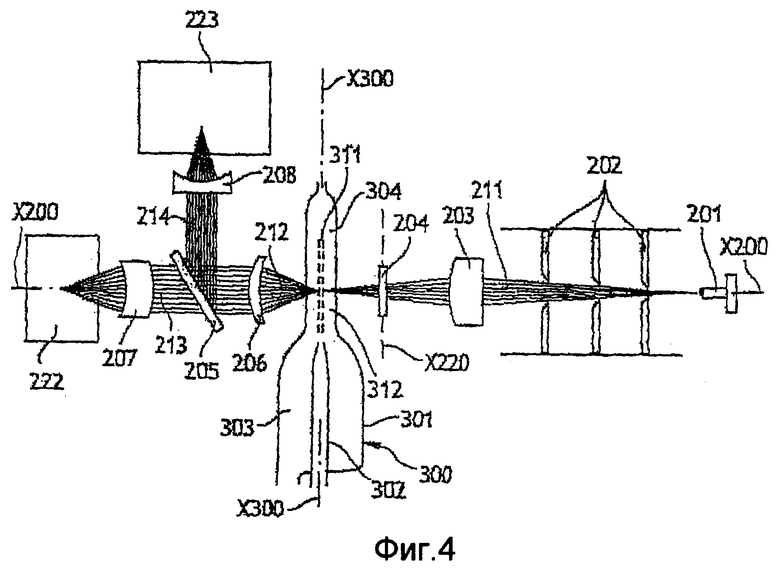
Фиг 4 - схематический продольный вид оптического устройства согласно второму объекту настоящего изобретения;
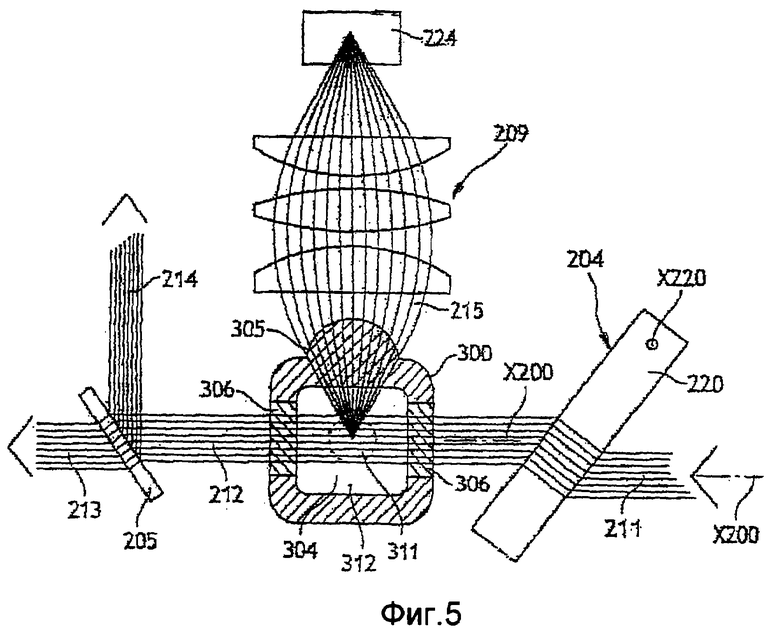
Фиг. 5 - более детальный схематический продольный вид оптического устройства по фиг.4 в плоскости, перпендикулярной плоскости фиг. 4;
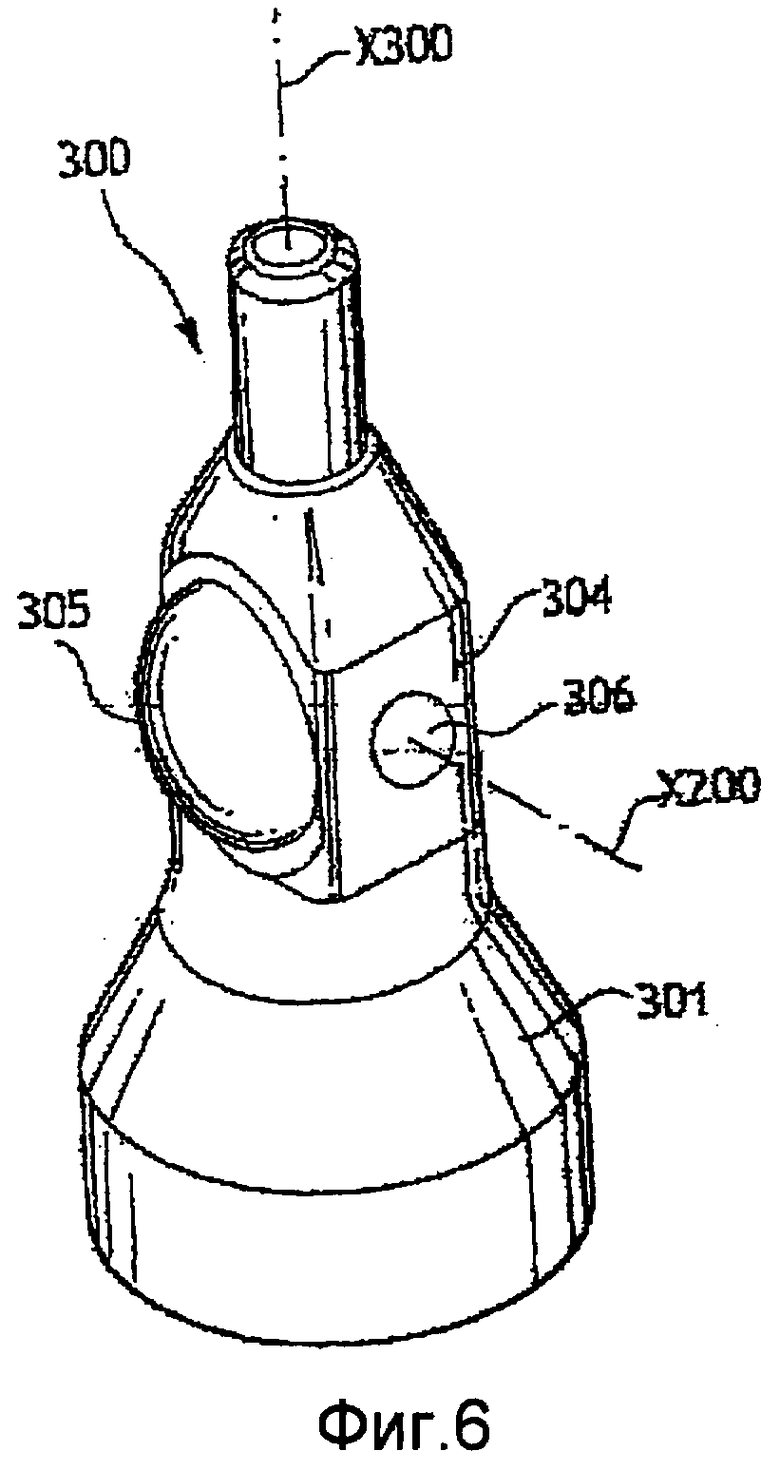
Фиг. 6 - вид в перспективе оптического сосуда согласно третьему объекту настоящего изобретения;
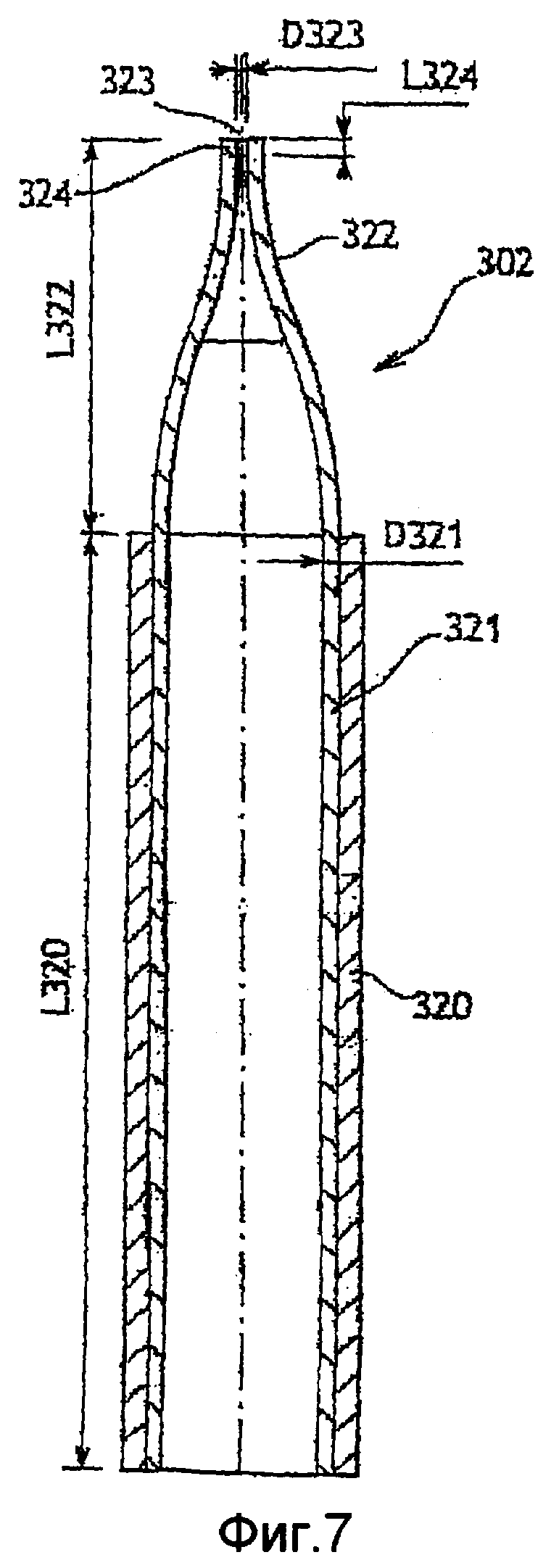
Фиг. 7 - продольное сечение первого варианта инжектора для оптического сосуда по настоящему изобретению;
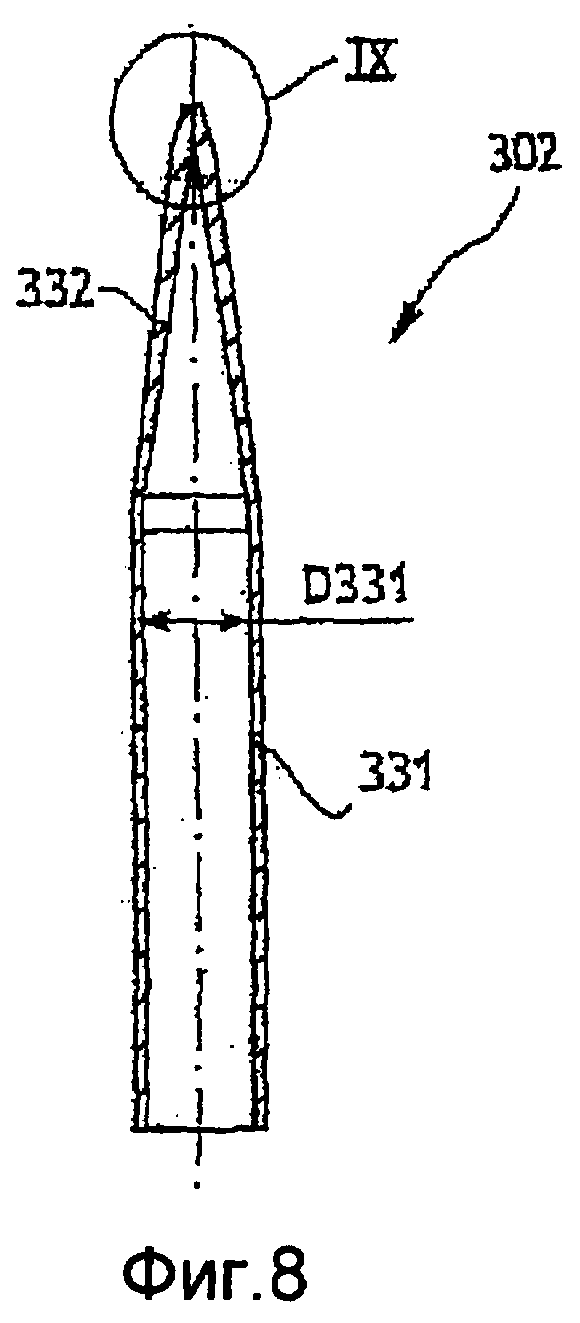
Фиг. 8 - продольное сечение второго варианта инжектора для оптического сосуда по настоящему изобретению;
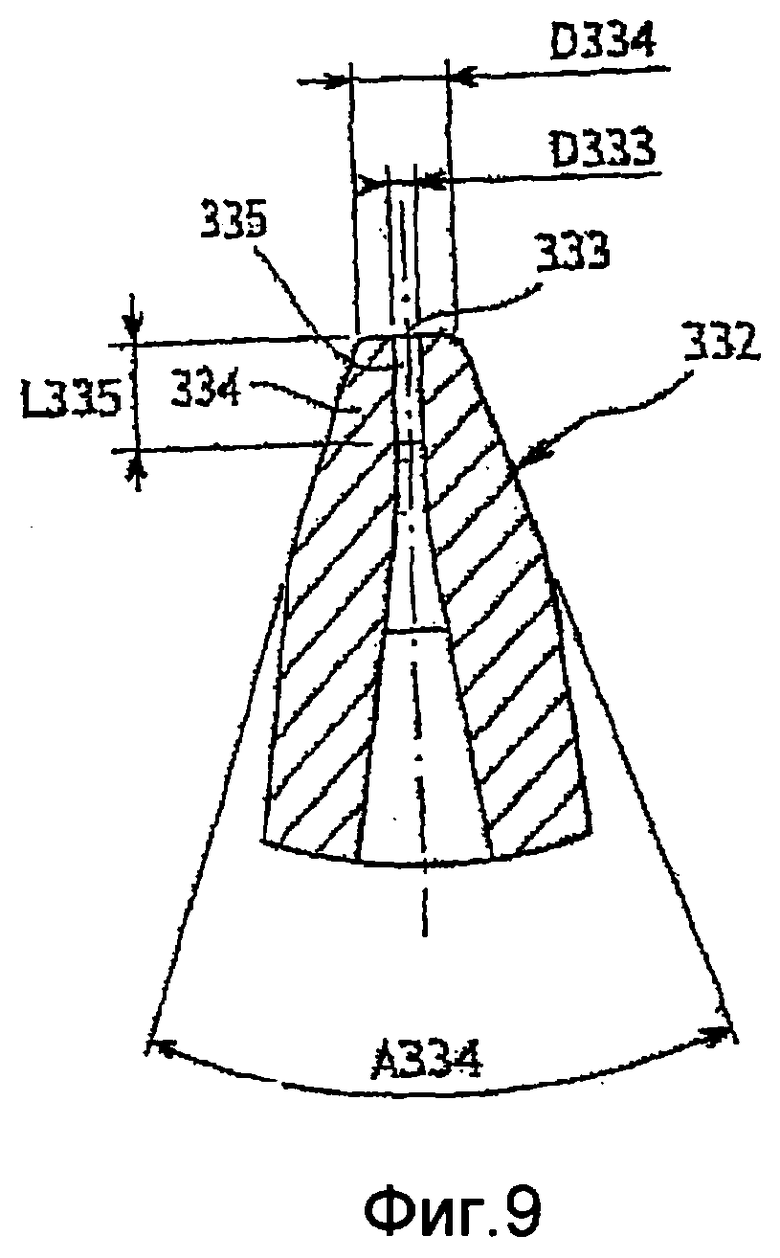
Фиг. 9 - продольное сечение одного конца инжектора по фиг. 8;
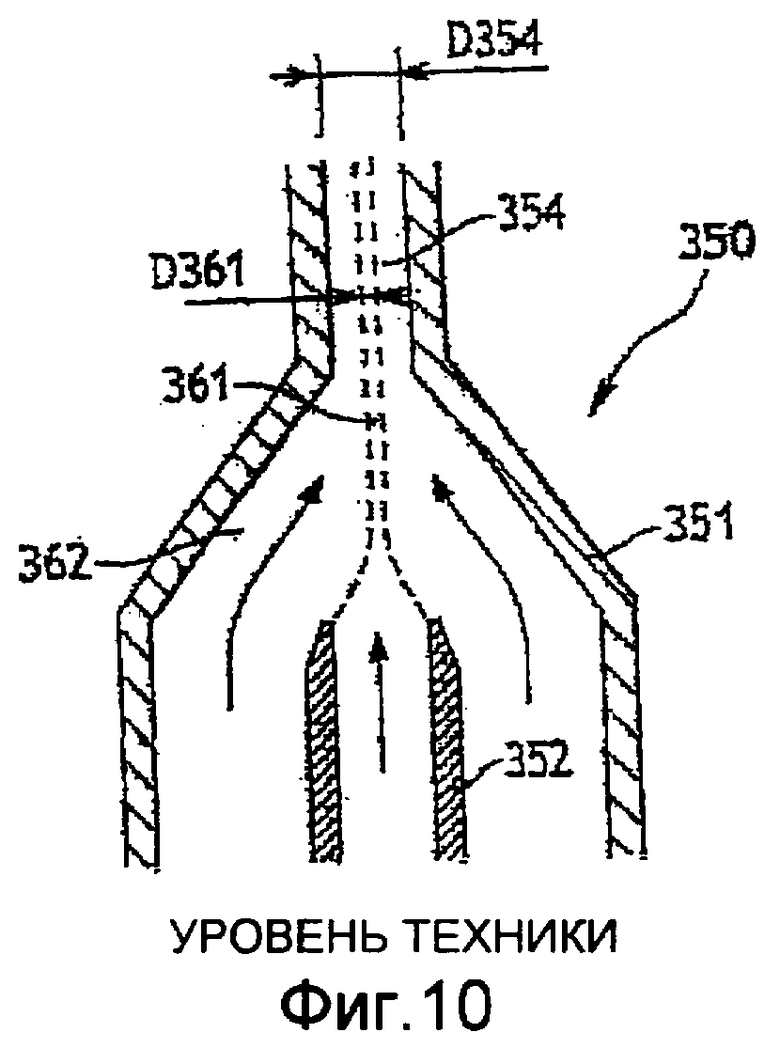
Фиг. 10 - продольное сечение сосуда, иллюстрирующее способ инжектирования в сосуд пробы крови по предшествующему уровню техники; и
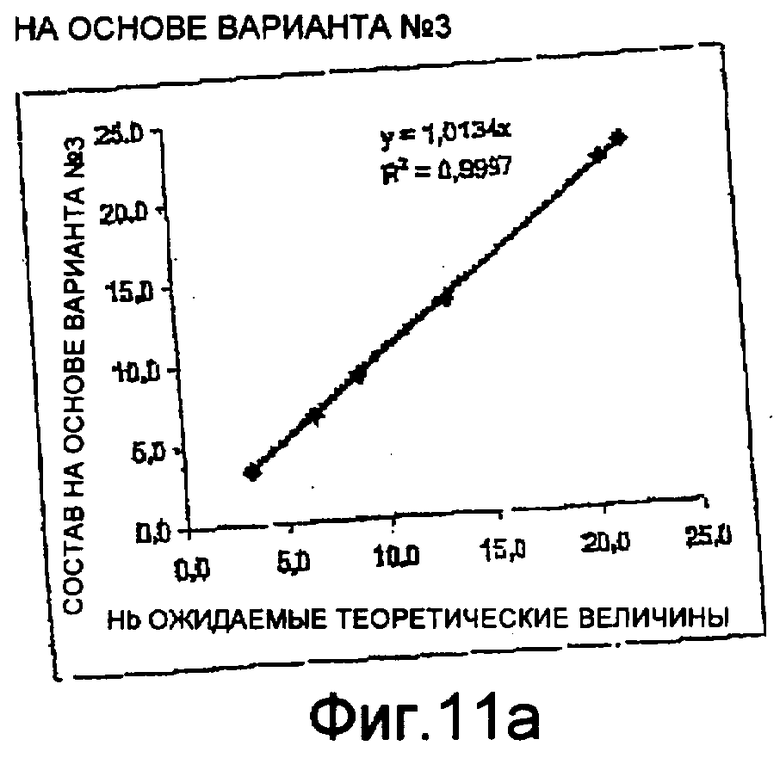
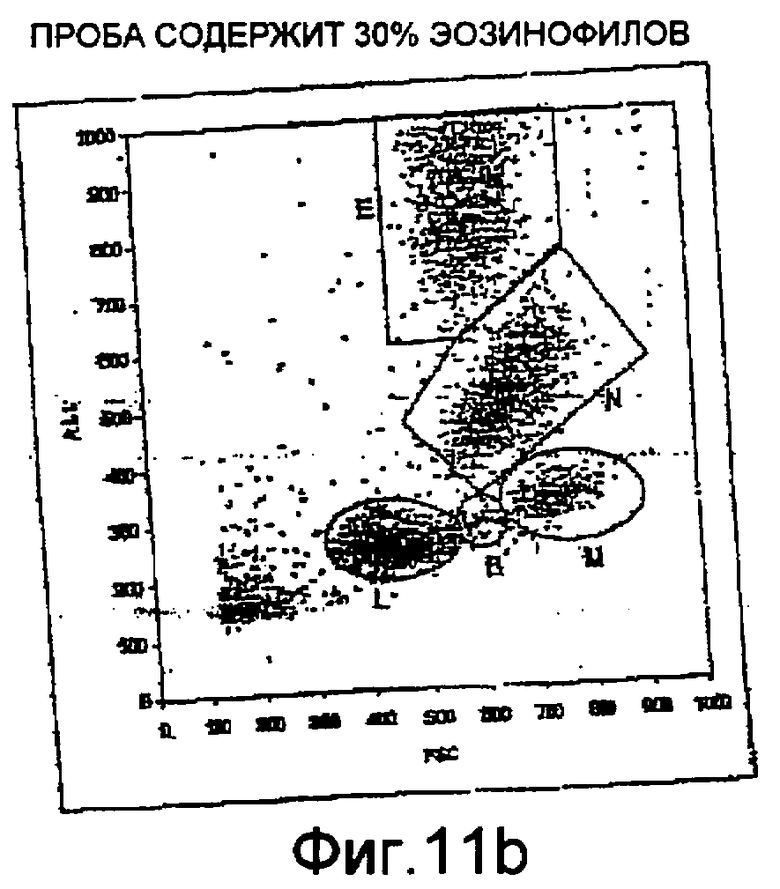
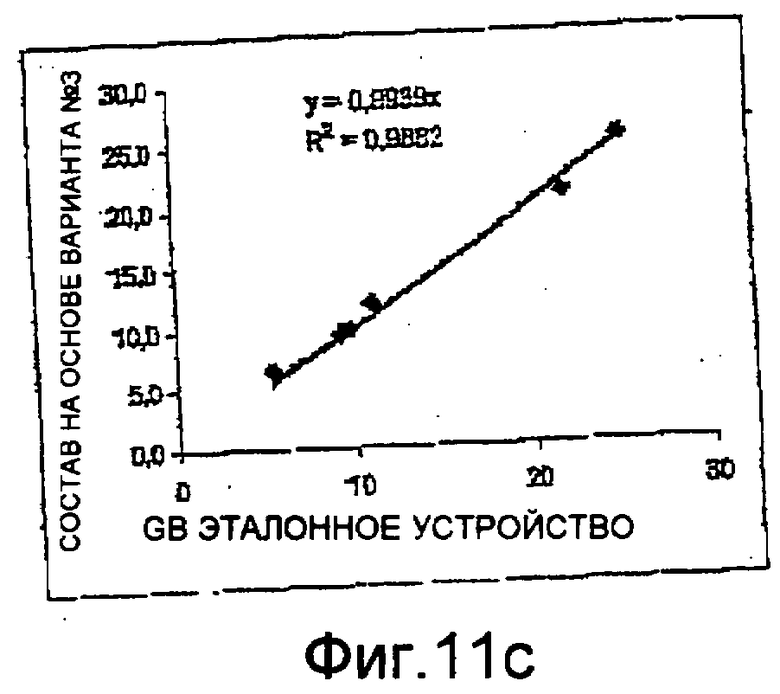
Фиг. 11а-11с - диаграммы, иллюстрирующие результаты, полученные на автоматическом устройстве с использованием способа и цитографа с оптическим устройством и сосудом по настоящему изобретению.
На фиг. 1 схематически показан единственный сосуд 1 для разбавления и анализа, в который можно совместно подать пробу 2 крови, подлежащую анализу, разбавитель 3 и реагент 4 для формирования аналитического раствора. Этот сосуд 1 оснащен средством 5 для измерения методом спектрофотометрии уровня гемоглобина в аналитическом растворе и средством 6 для измерения удельного сопротивления аналитического раствора для подсчета общего числа лейкоцитов. По существу имеются средства для отбора части аналитического раствора из аналитического сосуда 1 и для инжектирования его в оптический сосуд 7, оснащенный оптическим измерительным средством 8 (например, проточным цитометром) для анализа лейкоцитов. Согласно выбранному примеру также имеется средство для отбора части предварительного раствора, образованного пробой крови и разбавителем, и введения ее в сосуд 9 для подсчета и разбавления, оснащенный средством 10 для измерения удельного сопротивления этой части предварительного раствора для подсчета эритроцитов и тромбоцитов. Установка обычно оснащается нагревательным средством для поддержания постоянной температуры, равной приблизительно 35°С. Эта температура дает оптимальное время реакции лизиса и качество эритроцитов.
Установка работает следующим образом:
- одну аликвоту крови (15,6 мкл) впрыскивают в аналитический сосуд 1 и разбавляют 2 мл разбавителя так, чтобы сформировать аналитический предварительный раствор; степень разбавления составляет 1/130;
- очень небольшую часть (приблизительно 20 мкл) аналитического предварительного раствора отбирают и помещают в сосуд 9 для подсчета эритроцитов и тромбоцитов;
- затем к остающемуся в аналитическом сосуде 1 предварительному раствору добавляют 0,7 мл реагента: лизис длится приблизительно 10 с (для разрушения эритроцитов, формирования и стабилизации оксигемоглобинового комплекса), и таким образом сформированный аналитический раствор имеет окончательную степень разбавления приблизительно 1/173; часть этого аналитического раствора отбирают и впрыскивают (инжектируют) в оптический сосуд 7, где проводится анализ лейкоцитов (подсчет и/или дифференциация лейкоцитов по субпопуляциям); одновременно в аналитическом сосуде 1 подсчитываются лейкоциты путем измерения удельного сопротивления, и измеряется уровень гемоглобина путем измерения способности поглощения на длине волны сформированного оксигемоглобинового комплекса.
Далее следует описание оптического устройства по настоящему изобретению, особенно пригодного для анализа лейкоцитов в аналитическом растворе, имеющем степень разбавления ниже 1/100 и более конкретно от 1/160 до 1/180. Обычно степень разбавления 1/160 считается ниже, чем степень разбавления 1/100.
Разумеется, описанные выше способ и установка могут иметь разные варианты:
- для установки: можно предусмотреть средство для раздельного введения в аналитический сосуд 1 соединения для лизиса, лейкопротекторного соединения и соединения, стабилизирующего сформированный гемоглобиновый комплекс и, следовательно, скорее в форме монореагента; средство 6 для измерения удельного сопротивления аналитического раствора является факультативным; общее количество лейкоцитов можно определить оптическим анализом аналитического раствора; аналогично сосуд 9 для подсчета и средство 10 для измерения удельного сопротивления в этом сосуде можно применять только, если нужно получить полный анализ пробы крови;
подобным образом и для способа: введение реакционных соединений можно выполнить раздельным или совместным вместо монореагента; вводить соединения можно одновременно или последовательно; предшествующий этап подсчета эритроцитов и тромбоцитов и этап глобального подсчета лейкоцитов можно опустить; кроме того, можно проводить два последовательных разбавления пробы крови: первое разбавление, которое особенно пригодно для дифференциации лейкоцитов (приблизительно до 1/80), происходит, как в известном стандартном гидрофокусном цитометре, затем во второй момент времени производят второе разбавление, пригодное для измерения гемоглобина (от 1/100 до 1/500), как в известных спектрометрах.
Согласно еще одному варианту осуществления изобретения сосуд 1 во второй момент времени может служить для подсчета эритроцитов и тромбоцитов после очистки путем заполнения сосуда пробой, ожидающей в шприце.
Далее следует описание полученных результатов со ссылками на конкретный пример (моно)реагента по настоящему изобретению.
Монореагент был приготовлен с использованием состава Eosinofix®, выпускаемого компанией ABX, выпускаемого на рынок для определения лейкоцитов в проточной цитометрии и содержащего для этой цели соединение для лизиса эритроцитов и лейкопротекторное соединение (см. патент EP 0430750 компании ABX). Согласно настоящему изобретению было добавлено соединение, стабилизирующее гемоглобиновый комплекс.
Измерение гемоглобина методом спектрофотометрии
Были проведены тесты на линейность с использованием спектрофотометра на длине волны 542 нм. Диаграммы приведены на фиг. 2а-2е. Они представляют измеренные концентрации гемоглобина относительно ожидаемых концентраций. Более конкретно:
- Фиг. 2а соответствует эталонному лизису для измерения гемоглобина методом спектрофотометрии (LMG®, продается компанией ORPHEE);
- Фиг. 2b-2d соответствуют монореагенту по варианту №4 с использованием, соответственно, Tiron, DDAPS и имидазола в качестве стабилизирующего агента для гемоглобинового комплекса; и
- Фиг. 2е соответствует способу по настоящему изобретению, реализованному с применением одного только монореагента Eosinofix®, т.е. не содержащего стабилизирующего агента гемоглобинового комплекса по настоящему изобретению.
Три теста на линейность, проведенные согласно настоящему изобретению, дали положительные результаты с коэффициентом корреляции R2=1±10-4(как показано на чертежах). Этот результат соответствует полученному в эталонном тесте на лизис по фиг. 2а. Это значит, что способ по настоящему изобретению действительно позволяет измерять реальный уровень гемоглобина в пробе крови.
Наоборот, как показано на фиг. 2е, при наличии реагента (Eosinofix) без стабилизатора гемоглобина линейное соотношение не было получено. Это значит, что один только этот реагент не может использоваться для измерения уровня гемоглобина.
Дифференциация лейкоцитов проточной цитометрией
На фиг. 2f-2i показаны цитограммы, полученные с использованием проточного цитометра BD FAСScan®, соответствующие применению одного реагента Eosinofix, и реагента Eosinofix с добавлением DDAPS, Tiron и имидазола соответственно. На этих чертежах видно, что дифференциация субпопуляций достигнута и сравнима с результатом, полученным при использовании стандартного реагента для дифференциации лейкоцитов (матрица, полученная с применением Eosinofix на фиг. 2f).
Можно также упомянуть цитограмму по фиг. 11b (описываемую ниже), в частности полученную цитометром по настоящему изобретению.
Далее следует описание гидравлического устройства по четвертому объекту настоящего изобретения.
На фиг. 3 частично представлена диаграмма гидравлической системы 100 и части оборудования автоматического анализатора 20 крови в той степени, в которой это способствует пониманию устройства гидравлической системы по настоящему изобретению.
Автоматическое устройство, показанное на фиг. 3, в частности, содержит иглу 101 для отбора пробы анализируемой крови в трубку, которая используется для ее хранения и транспортировки в автоматическое устройство. Отобранная кровь заливается иглой в форме пробы в сосуд 102. Сосуд 102 предназначен, в частности, для разбавления пробы крови и/или лизиса эритроцитов в пробе крови. Вся проба или ее часть перед разбавлением или после разбавления может быть отобрана для анализа в другой части автоматического устройства, например в устройстве 120, которое будет описано ниже. Устройство 110 для анализа гемоглобина (например, спектрофотометр) расположено рядом с сосудом 102. Хранилище 103 для разбавленного продукта и хранилище 104 для реагента, в частности реагента для лизиса, соединены с сосудом 102 через гидравлический контур 100.
Другое аналитическое устройство 120 более конкретно предназначено для подсчета и дифференциации лейкоцитов, например, во всей или в части пробы, отобранной из сосуда 102. Устройство 120 для анализа лейкоцитов, в частности, содержит оптическое устройство 200 и оптический сосуд 300. Оптический сосуд соединен с сосудом 102 гидравлическим контуром.
Набор шприцов позволяет перемещать жидкости по гидравлическому контуру. Из этих шприцов для понимания настоящего изобретения представлены шприц 105, предназначенный для разбавителя, и шприц 106, предназначенный для реагента. В устройстве могут быть использованы и другие шприцы, которые не представлены, поскольку они не являются необходимыми для понимания настоящего изобретения.
Помимо трубок для циркуляции жидкостей гидравлический контур содержит электромагнитные клапаны для переключения различных контуров в гидравлическом контуре 100 в соответствии с его использованием в данный момент анализа. На фиг. 3 показаны восемь электромагнитных клапанов 111-119 из используемых в гидравлическом контуре 100. Каждый электромагнитный клапан имеет два положения, обозначенные соответственно буквой А или В.
Конструкция гидравлического контура, которая будет описана ниже, позволяет использовать только один привод М для показанных шприцов. Этот же привод может использоваться и для других шприцов. Таким образом, движение шприцов происходит одновременно, либо в направлении Р выталкивания, когда они входят в соответствующий цилиндр каждого шприца, либо в направлении Т втягивания, когда они выдвигаются из цилиндров.
Далее следует описание конструкции и работы гидравлики в автоматическом устройстве.
Сосуд 300 содержит внешний корпус 301 и инжектор 302, расположенный внутри корпуса 301, при этом между корпусом и инжектором сформирован обволакивающий объем 303.
Гидравлический контур 100 содержит:
- инжекторную ветвь 131, которая проходит выше по потоку от инжектора, между инжектором и клапаном 111;
- ветвь 132 пробы, которая соединена в точке 142 отбора пробы с инжекторной ветвью и проходит до сосуда 102;
- всасывающую ветвь 133, которая соединена в точке 143 отвода всасывания с инжекторной ветвью выше по потоку от точки 142 отбора пробы через клапан 113 и доходит до источника 107 разряжения, например шприца или перистальтического насоса;
- выпускную ветвь 134, которая соединена в точке 144 отвода выпуска с инжекторной ветвью выше по потоку от точки 143 отвода всасывания и доходит до хранилища 104 реагента;
- обволакивающую ветвь 135, которая проходит выше по потоку от корпуса 301 и соединяет обволакивающий объем и клапан 115;
- разбавляющую ветвь 136, которая проходит между клапаном 116 и сливом 108 для разбавителя через клапан 115;
- ветвь 137 разбавителя, которая проходит между хранилищем 103 для разбавителя и клапаном 117;
- ветвь 140 реагента, которая проходит между клапаном 117 и сливом 109 для реагента через клапан 111;
- дренажную ветвь 138 для сосуда 102, которая проходит между сосудом 102 и источником 107 разрежения через клапан 118, при этом ветвь 132 пробы соединена с дренажной ветвью между сосудом 102 и клапаном 118, и ветвь всасывания соединена с выпускной ветвью 132 за клапаном 118 относительно сосуда; и
- выпускную ветвь 139, которая соединяется ниже по потоку от сосуда 300, через клапан 119, со сборником отходов, например, при атмосферном давлении или через источник разрежения, шприц или перистальтический насос.
В первом положении 116А клапана 116 шприц 105 разбавления находится в сообщении с хранилищем разбавителя, поэтому вытягивающее движение Т позволяет заполнить шприц 105 разбавителем.
В первом случае шприц разбавления, содержащий разбавитель, когда клапан 116 находится во втором положении 116В, которое соединяет шприц 105 с ветвью 136 разбавления, и клапан 115 находится в первом положении 115А, которое соединяет ветвь разбавления со сливом 108 для разбавителя, при движении Р перемещает разбавитель к этому сливу 108, например, в сосуде 102, например, для разбавления всей пробы.
Во втором случае, когда клапан 116 находится во втором положении 116В, а клапан 115 находится во втором положении 115В, которое соединяет ветвь разбавления с обволакивающей ветвью 135, толкающее движение Р позволяет разбавителю переместиться в оптический сосуд 300 для формирования в нем потока-оболочки. Полезность потока-оболочки в контексте настоящего изобретения будет проанализирована ниже при описании сосуда 300.
Когда клапан 117 находится в первом положении 117А, при котором шприц с реагентом сообщается с хранилищем 104 для реагента, а клапан 114 находится в первом положении 114А, которое отсекает выпускную ветвь 134, вытягивающее движение Т позволяет заполнить шприц 106 реагентом.
В первом случае шприц реагента, содержащий реагент, когда клапан 117 находится во втором положении 117В, при котором шприц 104 с реагентом сообщается с ветвью 141 реагента, и когда клапан 111 находится в первом положении 111А, при котором ветвь реагента сообщается со сливом 109 реагента, при выталкивающем движении Р перемещает реагент к сливу 109, например, в сосуде 102, например, для лизиса во всей пробе.
Во втором случае, когда клапан 117 находится во втором положении 117В и клапан 111 находится во втором положении 111В, при котором ветвь 141 сообщается с инжекторной ветвью 131, шприц 106 с реагентом непосредственно соединен с инжектором 302.
Когда клапан 118 находится в первом положении 118А, при котором всасывающая ветвь 133 изолирована от ветви 132 пробы через дренажную ветвь, и клапан 112 находится в первом положении 112А, в котором верхняя по потоку часть ветви 132 пробы сообщается с нижней ее частью, а клапан 113 находится в первом положении 113А, соединяя нижнюю по потоку часть всасывающий ветви 133 с нижней ее частью, и, следовательно, с источником 107 разрежения, подлежащая анализу проба всасывается в инжекторную ветвь 131 между точкой 142 отвода пробы и точкой 143 отвода всасывания.
Выпускная ветвь 134 содержит переменное или калиброванное гидравлическое сопротивление 150.
Когда шприц 105 для разбавителя содержит разбавитель, шприц 106 для реагента содержит реагент и проба крови, подлежащая анализу, находится в инжекторной ветви 131, и когда, кроме того, клапаны 112 и 113 находятся во втором положении 112В, 113В, при котором верхняя часть и нижняя часть изолированы от их соответствующих рукавов, и когда клапаны 115 и 116 находятся во втором положении 115В и 116В, при котором шприц 105 с разбавителем сообщается с обволакивающим объемом 303, наконец, когда клапаны 111 и 117 находятся во втором положении 111В, 117В, при котором шприц 106 с реагентом сообщается с инжектором 302 и когда клапан 114 находится во втором положении 114В, единое толкающее движение Р, генерируемое приводом М шприцов, позволяет переместить разбавитель, реагент и пробу крови в направлении сосуда 300 и сквозь него, при этом часть реагента в результате действия гидравлического сопротивления 150 возвращается в хранилище 104 для реагента.
Сопротивление 150, в частности, позволяет регулировать расход обволакивающей и вытесняющей жидкостей относительно друг друга. Это позволяет адаптировать эти расходы к разным функциям этих жидкостей. В частности, это позволяет получить одинаковые скорости для оболочки и для пробы в зоне 304 анализа при использовании стандартного гидрофокусного сосуда.
В частности, выпускная ветвь 134 и конструкции, описанные выше, позволяют использовать единственный привод и, следовательно, в частности, уменьшить стоимость автоматического аналитического устройства и его габариты.
Разбавитель в зоне 304 анализа сосуда 300 образует поток, обволакивающий пробу (см., в частности, фиг. 4 и 5). Реагент, расположенный выше по потоку от пробы в инжекторной ветви 131, служит вытесняющей жидкостью, т.е. он позволяет передать движение поршня шприца с реагентом на пробу. Поэтому нет необходимости заполнять шприц с реагентом пробой, чтобы иметь возможность проведения ее анализа. Таким образом, можно анализировать даже пробу небольшого объема и всю эту пробу можно впрыснуть и проанализировать так, чтобы какая-либо ее часть не оставалась в инжекторной ветви 131 или в шприце 106.
Разумеется, гидравлический контур 100 может содержать и другие шприцы, клапаны и ветви, не представленные на фиг. 3 и предназначенные для полноты и качества работы автоматического аналитического устройства 20.
Далее следует описание оптического устройства 200 по настоящему изобретению со ссылками на фиг. 4 и 5.
Оптическое устройство содержит приблизительно монохроматический источник 201 света. Этот источник света является электролюминесцентным диодом. Свет излучается главным образом вдоль оси Х200. Оптическая ось Х200 проходит приблизительно перпендикулярно оси Х300 инжектирования, вдоль которой движется проба в оптическом сосуде 300. Эти две оси Х200 и Х300 совместно определяют оптическую плоскость.
Чтобы предотвратить паразитные засветки исходящего луча 311, созданного источником 201, имеется набор из трех диафрагм, каждая из которых проходит перпендикулярно лучу. В диафрагмах 202 проколото отверстие, диаметр которого приблизительно равен диаметру луча и постепенно увеличивается в каждой диафрагме, чтобы адаптироваться к диаметру измерительного луча, поскольку этот диаметр увеличивается по мере удаления от источника 201. Затем луч проходит через фокусирующее устройство 203, образованное одной или более линзой.
За фокусирующим устройством луч попадает на регулировочное устройство, которое позволяет смещать оптическую ось в плоскости, перпендикулярной оси Х300 впрыска, т.е. в поперечном направлении относительно движения пробы в сосуде. Боковое смещение луча может привести к частичному освещению или к отсутствию освещения пробы, что имеет прямое влияние на результаты анализа.
В контексте описанного примера регулировочное устройство образовано прозрачной пластиной 220, установленной на оси Х220 с возможностью поворота. Ось Х220 проходит по существу параллельно оси Х300 инжектирования. Если призма расположена перпендикулярно оптической оси Х200, луч проходит сквозь нее без отклонения. Наоборот, если пластина расположена под углом к оптической оси, двойное преломление на входе и на выходе из пластины приводит к смещению луча в плоскости, перпендикулярной регулировочной оси Х220. Регулировочная ось Х220 проходит приблизительно параллельно оси Х300 инжектирования, поэтому преломление в пластине генерирует только поперечное смещение. Чем больше толщина и/или коэффициент преломления пластины и чем больше пластина наклонена относительно оптической оси, тем большим является сдвиг. Поэтому для пластины с данной толщиной и коэффициентом преломления достаточно повернуть пластину 220 вокруг оси Х220, чтобы отрегулировать положение луча относительно пробы, которая движется в зоне 304 анализа в оптическом сосуде 300. Такое регулировочное устройство является особенно экономичным по сравнению с устройствами по предшествующему уровню техники, особенно учитывая то, что, используя средства точной механики, прецизионное вращение по существу получить легче, чем прецизионное линейное перемещение.
Попав в сосуд и пройдя сквозь пробу, исходящий луч 211 по меньшей мере частично становится результирующим осевым лучом 212, который выходит из сосуда приблизительно вдоль оптической оси. Этот осевой результирующий луч 212 несет информацию о пробе, сквозь которую он прошел.
Чтобы обеспечить возможность одновременного измерения нескольких параметров этой информации, необходимо иметь возможность анализировать луч несколькими измерительными устройствами 222, 223. В частности, оптический анализ основан на обнаружении света, дифрагированного в соответствии с двумя диапазонами углов: узких углов и широких углов. Таким образом, необходимо распределить свет по двум разным каналам для каждого диапазона. Следовательно, используется средство 205 для разделения результирующего луча 212 на два результирующих луча 213 и 214. Это разделяющее средство состоит в основном из светоделителя 205. Светоделитель - это прозрачная стеклянная призма. Она расположена под углом 45о к оптической оси. Таким образом, создается вторичный результирующий осевой луч 213, сформированный светом, прошедшим сквозь светоделитель, и луч 214, сформированный потерями на отражение, т.е. светом, отраженным светоделителем. Такой светоделитель очень дешев по сравнению с разделяющим средством, используемым по предшествующему уровню техники в оптических аналитических устройствах такого типа. В частности, поскольку оно не содержит каких-либо дополнительных отражающих покрытий, оно практически не стареет и не требует обслуживания. С учетом многократных переотражений внутри пластины и поляризации падающего излучения результирующего осевого луча от 5 до 15% энергии отражается, а остальная передается в форме вторичного результирующего осевого луча.
Между сосудом и светоделителем результирующий осевой луч 212 переводится в параллельное направление соответствующим средством 206. За светоделителем результирующие лучи 212, 213 вновь фокусируются соответствующими подходящими средствами 207, 208 для их анализа соответствующими измерительными устройствами 222, 223.
В описанном примере измерительное устройство 222, которое анализирует вторичный результирующий осевой луч 213, является устройством для измерения дифракции рядом с оптической осью, создаваемой клетками крови (которое именуется "измерение FSC"). В описанном примере измерительное устройство 223, которое анализирует луч 214, образованный потерями на отражение, является устройством для измерения потерь света на оси (которое именуется измерение ALL), т.е. перекрытие света клетками пробы.
На фиг. 5 схематически показано сечение сосуда в плоскости, перпендикулярной оси Х300 инжектирования и содержащей оптическую ось Х200. Как частично показано на этом чертеже, свет, отведенный пробой вбок в виде бокового результирующего луча, фокусируется за сосудом и также анализируется измерительным устройством 224.
Далее со ссылками, в частности, на фиг. 6, следует описание оптического сосуда по настоящему изобретению, в частности предназначенного для использования в гидравлическом контуре, например, в таком, который описан выше. Работу этого сосуда можно сравнить с работой гидрофокусных сосудов по предшествующему уровню техники, которые весьма схематично показаны на фиг. 10.
Сосуд 350 по фиг. 10 содержит корпус 351, инжектор 302 и зону 354 анализа. Внутренний поперечный размер D354 сосуда составляет приблизительно 250 мкм. Этот размер может быть диаметром, если сосуд имеет круглое сечение, или одной стороной, если он имеет квадратное или прямоугольное сечение. Как показано штриховыми линиями, поток-оболочка 362 используется, в частности, для уменьшения диаметра потока 361 пробы, поэтому в зоне 354 согласно предшествующему уровню техники поток пробы имеет диаметр D361 менее 50 мкм.
Сосуд 300 по настоящему изобретению, показанный на фиг. 4-6, содержит корпус 301 и инжектор 302, расположенные приблизительно соосно вдоль оси Х300 инжектирования. Зона 304 анализа расположена ниже по потоку от инжектора.
Корпус выполнен из материала, отлитого под давлением, предпочтительно из пластмассы. Такой способ изготовления позволяет получить сложные формы. В частности, на корпусе отлита линза 305. Эта линза позволяет собирать свет перекрытый, дифрагированный или рассеянный клетками крови.
Эта линза должна иметь такие размеры, в частности диаметр, чтобы локальные неоднородности во введенном материале по сравнению с этим размером были пренебрежимо малы. В показанном примере диаметр линзы 305 составляет 3 мм. Такая отлитая под давлением линза является линзой 305, сквозь которую проходит боковой результирующий луч 315. Кроме того, эта боковая линза должна обеспечивать возможность собирания света в максимально возможном количестве направлений, т.е. должна иметь максимально большое поле направлений. Поэтому, чем ближе линза расположена к пробе, тем больше будет поле направлений. В показанном примере линза является полусферической, которую именуют 90о линзой. Кроме того, поскольку линза является частью стенки сосуда, она находится в прямом контакте с жидкостью в сосуде, т.е. между пробой и линзой отсутствует воздушное пространство, имеющее низкий коэффициент преломления. Это улучшает измерения.
Для устранения недостатков, связанных с неоднородностью, используется стекло, которое особенно фокусирует свет, например стекло типа ВК7. Это, в частности, относится к осевым окнам 306, через которые исходный луч 211 проникает в сосуд и через которые выходит результирующий осевой луч 212.
Чтобы получить литую линзу такого размера, сосуд 300 в зоне 304 анализа должен иметь по меньшей мере сравнимые размеры. Кроме того, такие большие размеры позволяют интегрировать в пластиковые стенки стеклянные окна, тогда как сосуды по предшествующему уровню техники, имеющие малые размеры, выполнены с целиком стеклянными или кварцевыми стенками. В примере, показанном, в частности, на фиг. 5 и 6, нижняя часть сосуда в сечении имеет 4,5 мм вдоль оптической оси на 3 мм в перпендикулярном направлении. Такое прямоугольное сечение больших размеров в сочетании с малым объемом пробы, которая транспортирует анализируемые клетки крови, требует использования гидродинамического обволакивания пробы. Для сравнения, сосуд по предшествующему уровню техники имеет внутренний поперечный размер D354 зоны анализа, близкий к 250 мкм.
Выше по потоку от зоны 304 анализа корпус 301 окружает инжектор 302 и образует вокруг инжектора обволакивающий объем 303. Стенки инжектора разделяют поток 311, образованный пробой внутри инжектора, от потока-оболочки 312 в обволакивающем объеме. Поток пробы исходит из инжекторной ветви 131 гидравлического контура 100. Поток-оболочка исходит из обволакивающей ветви 135 этого гидравлического контура. В зоне анализа эти два потока контактируют, оставаясь соосными, и одновременно текут в сосуде.
Для уменьшения производственных издержек на автоматическое устройство может быть преимущественным уменьшить точность при изготовлении деталей. Как указано выше, такая цель может быть достигнута путем создания потока пробы большего сечения.
Однако если используется технология по предшествующему уровню техники, где проток пробы растягивается потоком-оболочкой, то поток пробы большего сечения будет турбулентным, что, в частности, отрицательно влияет на точность измерений. Кроме того, сечение потока пробы будет постепенно уменьшаться, что противоречит желаемому эффекту получения потока пробы большого сечения. Эта цель достигается путем использования гидравлического контура 100 по настоящему изобретению, описанного выше со ссылками на фиг. 1. Такой контур позволяет получить независимо выбранные скорости для потока-оболочки и для потока пробы, чтобы в потоке пробы турбулентность была незначительной и не оказывала заметного влияния на результат анализа. Эти два потока могут быть приблизительно равномерными, факультативно ламинарными в определенных соответствующих диапазонах скоростей.
Кроме того, инжектор 302, как показано на фиг. 7 или 8, также позволяет ограничить турбулентность потока пробы. Более того, он обеспечивает высокую скорость впрыска пробы в оптический сосуд, сохраняя приблизительную равномерность потока.
Инжектор по фиг. 7 содержит структурную трубку 320, например, выполненную из нержавеющей стали, обеспечивающую жесткость инжектора. Структурная трубка изнутри выложена вставной пластмассовой трубкой 321, выполненной, например, из политетрафторэтилена (PTFE). В показанном примере структурная и вставная трубки выполнены цилиндрическими. Вставная трубка образует выступающее из нижнего по потоку конца структурной трубки сопло, выполненное из той же пластмассы. Разделение структурной функции структурной трубки и инжекторной функции сопла наряду с применением пластмассы позволяет с небольшими затратами получить прецизионные формы.
Сопло имеет сечение, которое постепенно сужается от внутреннего диаметра D321 вставной трубки до внутреннего диаметра D323 выходного отверстия 323 на нижнем по потоку конце 324 сопла 322. В описываемом примере нижний по потоку конец 324 представляет собой цилиндр длиной L324. Стенка сопла сначала является вогнутой внутрь, а затем изгибается так, чтобы стать выпуклой, при этом сечение сопла постепенно сужается от верхнего по потоку конца к нижнему по потоку концу от диаметра D321 до диаметра D324. Вогнутая поверхность проходит тангенциально относительно внутренней поверхности цилиндрической вставной трубки. Выпуклая поверхность проходит тангенциально относительно внутренней поверхности цилиндрического конца 324. В описываемом примере диаметр D323 отверстия 323 составляет приблизительно 60 мкм, внутренний диаметр D321 вставной трубки составляет приблизительно 1 мм, длина L322 сопла составляет приблизительно 2,5 мм, длина L320 структурной трубки составляет приблизительно 6 мм, а длина цилиндрического конца L324 составляет приблизительно 200 мкм.
Инжектор 302, такой как показан на фиг. 8 и 9, выполнен как одна деталь и изготовлен из одного достаточно жесткого материала. Этим материалом могут быть, например, нержавеющая сталь, керамика, синтетический рубин или пластмасса. Пластмассой преимущественно может быть политетрафторэтилен. Инжектор содержит приблизительно цилиндрическую трубку 331, которая заканчивается на нижнем по потоку конце соплом 332.
Сопло постепенно сужается внутрь от внутреннего диаметра D331 трубки 331 до внутреннего диаметра D333 выпускного отверстия 333 для пробы на нижнем по потоку конце 334 сопла 332. В показанном примере сужение происходит в форме усеченного конуса, открытого под углом приблизительно 9-10°. За усеченным конусом и до выпускного отверстия 333 диаметр цилиндрической части остается постоянным, и эта цилиндрическая часть имеет длину L335 и диаметр D333.
С внешней стороны сопла его внешний диаметр постепенно увеличивается в форме усеченного конуса, открытого под углом приблизительно 8-9°, затем на значительно уменьшенном конце усеченного конуса открывается под углом А334, составляющим 35-45°, до внешнего диаметра D334 вокруг выпускного отверстия 333. D334 приблизительно в 3-4 раза больше чем D333.
Для примера, D333=60 мкм, D334=200 мкм, А334=40°.
Благодаря различным вышеописанным конструкциям можно добиться высокой скорости инжектирования. Так, в описанном примере можно впрыскивать (инжектировать) пробу объемом более 200 мкл за менее чем 10 с. В частности, такая скорость инжектирования позволяет использовать высокую степень разбавления, не увеличивая продолжительность анализа по сравнению с автоматическими устройствами по предшествующему уровню техники. В частности, можно использовать одинаковую степень разбавления, например, 1/160 для анализа гемоглобина устройством 110 (см. фиг. 3) и для анализа лейкоцитов оптическим устройством 120, вместо степени 1/80, обычно используемой для анализа лейкоцитов.
На фиг. 11а-11с показаны результаты, полученные с использованием способа и оборудования по первому объекту настоящего изобретения, где использовался оптический сосуд 7 по третьему объекту изобретения и оптический сосуд 8 по второму объекту настоящего изобретения. На фиг. 11а показан положительный тест на линейность при измерении гемоглобина и, следовательно, он демонстрирует возможность и надежность измерения уровня гемоглобина в пробе крови по настоящему изобретению. На фиг. 11b показана оптическая матрица, полученная по тестовой пробе крови с 30% эозинофилов, к которым добавлен состав по настоящему изобретению. На этой матрице присутствуют и дифференцированы пять субпопуляций (группы, обозначенные на цитограмме: Е - эозинофилы, N - нейтрофилы, М - моноциты, В - базофилы, L - лимфоциты). На фиг. 11с показан положительный результат теста на линейность при измерении уровня лейкоцитов по резистивности.
Эти диаграммы показывают, что благодаря настоящему изобретению можно проводить анализ по меньшей мере уровня гемоглобина и уровня лейкоцитов и дифференциацию лейкоцитов, используя состав по настоящему изобретению, в частности в форме монореагента.
Разумеется, настоящее изобретение не ограничено описанными примерами и в эти примеры могут быть внесены многочисленные изменения, не выходящие из объема настоящего изобретения.
Например, для формирования потока-оболочки и жидкого поршня можно использовать другие продукты, помимо разбавителя или реагента, в частности, если такие продукты присутствуют в автоматическом устройстве для других целей.
Кроме того, гидравлическое сопротивление можно установить не в инжекционном контуре, а в обволакивающем контуре или в обоих этих контурах одновременно. Это может произойти как функция данного максимального расхода через вытесняющее средство для жидкостей, предназначенных, соответственно для вытеснения или обволакивания.
Некоторые или все линзы оптического сосуда и/или оптического устройства могут быть изготовлены литьем под давлением вместе с корпусом сосуда, а не по одной, как показано выше. В частности, можно отливать стеклянные окна. В частности, если неоднородности во впрыскиваемом материале более или менее малы относительно точности измерений.
Регулировочное устройство и/или разделяющее средство, описанные выше, могут использоваться независимо друг от друга и опционально с другим источником света, а не с электролюминесцентным диодом.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРАВЛИЧЕСКОЕ УСТРОЙСТВО ДЛЯ УСТРОЙСТВА ДЛЯ АНАЛИЗА КРОВИ, СПОСОБ, СВЯЗАННЫЙ С УКАЗАННЫМ УСТРОЙСТВОМ, И АНАЛИЗАТОР, ОСНАЩЕННЫЙ ТАКИМ УСТРОЙСТВОМ | 2006 |
|
RU2408004C2 |
| СОСУД ДЛЯ ОПТИЧЕСКОГО УСТРОЙСТВА ДЛЯ АНАЛИЗА КРОВИ, АНАЛИЗАТОР, ОСНАЩЕННЫЙ ТАКИМ СОСУДОМ | 2006 |
|
RU2419777C2 |
| ОПТИЧЕСКОЕ УСТРОЙСТВО ДЛЯ АНАЛИЗА КРОВИ, АНАЛИЗАТОР, ОСНАЩЕННЫЙ ТАКИМ УСТРОЙСТВОМ | 2006 |
|
RU2414694C2 |
| МИКРОЖИДКОСТНАЯ РЕЗИСТЕНТНАЯ СЕТЬ И МИКРОЖИДКОСТНОЕ УСТРОЙСТВО | 2012 |
|
RU2599657C2 |
| СПОСОБ ПРОВЕДЕНИЯ АНАЛИЗОВ КРОВИ И АНАЛИЗАТОР КРОВИ | 2007 |
|
RU2347224C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ПРОТОЧНОЙ ЦИТОМЕТРИИ БЕЗ ОБЖИМАЮЩЕЙ ТЕКУЧЕЙ СРЕДЫ | 2009 |
|
RU2511065C2 |
| ПРОБООТБОРНИК КРОВИ С ГЕПАРИНОВОЙ ОСНОВОЙ БЕЗ АКТИВАЦИИ ТРОМБОЦИТОВ | 2018 |
|
RU2772466C2 |
| СИСТЕМЫ И МЕТОДЫ ОПТИМИЗАЦИИ ИСПОЛЬЗОВАНИЯ ОБРАЗЦА | 2012 |
|
RU2620922C2 |
| ИЗМЕРИТЕЛЬНЫЙ КРИСТАЛЛ, МИКРОФЛЮИДНОЕ УСТРОЙСТВО И СПОСОБ | 2012 |
|
RU2604622C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ГЛЮКОЗЫ В КЛЕТКЕ КРОВИ | 2009 |
|
RU2438130C2 |
Изобретение относится к гематологии. Для анализа пробы крови осуществляют следующие этапы: формируют в едином так называемом сосуде для разбавления и анализа аналитический раствор, содержащий эту пробу крови, разбавитель и, по меньшей мере, одно соединение для лизиса красных кровяных телец; по меньшей мере, одно соединение для стабилизации гемоглобина в форме хромогенного комплекса. После лизиса красных кровяных телец в этом аналитическом растворе проводят спектрофотометрические измерения уровня гемоглобина и отбирают соответствующее количество аналитического раствора в сосуде, на котором оптическим средством проводят дифференциацию лейкоцитов. Изобретение характеризуется тем, что аналитический раствор дополнительно содержит, по меньшей мере, одно соединение для защиты белых кровяных телец, позволяя выделить, по меньшей мере, пять основных субпопуляций лейкоцитов. Использование способа позволяет упростить процесс анализа пробы крови с определением гемоглобина в форме оксигемоглобина и, по меньшей мере, пяти субпопуляций лейкоцитов, а также сократить время анализа. 14 з.п. ф-лы, 21 ил., 1 табл.
1. Способ автоматического анализа пробы крови, при котором в едином сосуде для разбавления и анализа формируют аналитический раствор, при этом указанный аналитический раствор содержит:
пробу крови, разбавитель и монореагент, включающий по меньшей мере одно соединение для лизиса эритроцитов; по меньшей мере одно соединение для стабилизации гемоглобина в форме оксигемоглобина; и по меньшей мере одно соединение для защиты лейкоцитов, позволяя выделить по меньшей мере пять основных суб-популяций лейкоцитов, причем указанный лейкопротекторный состав выбирается из ряда, содержащего: бетаины и сульфобетаины четвертичных аммониев, третичные оксиды амина, соединения гликозидного типа и соединения глюцидного типа,
при этом в этом аналитическом растворе в сосуде после лизиса эритроцитов методом спектрофотометрии измеряют уровень гемоглобина;
из этого сосуда отбирают соответствующее количество аналитического раствора, на котором оптическим средством проводят дифференциацию лейкоцитов, по меньшей мере пяти основных суб-популяций.
2. Способ по п.1, отличающийся тем, что в аналитический раствор также добавляют пигмент или смесь пигментов, конкретно помечающих по меньшей мере одну суб-популяцию лейкоцитов.
3. Способ по п.1, отличающийся тем, что монореагент выполнен с возможностью выполнять функции разбавителя для получения монораствора пробы крови.
4. Способ по одному из пп.1-3, отличающийся тем, что аналитический раствор имеет степень разбавления пробы крови, пригодную для измерения гемоглобина методом спектрофотометрии.
5. Способ по п.4, отличающийся тем, что аналитический раствор имеет степень разбавления от 1/100 до 1/500, предпочтительно от 1/160 до 1/180.
6. Способ по п.1, отличающийся тем, что отбор соответствующего количества аналитического раствора для проведения дифференциации лейкоцитов проводят до измерения гемоглобина в этом сосуде, при этом степень разбавления отобранного аналитического раствора подходит для такого измерения оптическими средствами, и тем, что разбавитель добавляют в оставшийся аналитический раствор так, чтобы увеличить степень разбавления в сосуде для получения раствора, пригодного для измерения гемоглобина методом спектрофотометрии.
7. Способ по п.1, отличающийся тем, что оптическим средством является проточный цитометр гидрофокусного типа и степень разбавления отобранного аналитического раствора для цитометрических измерений составляет менее 1/100.
8. Способ по п.1, отличающийся тем, что оптическим средством является цитометр с пассивным обволакиванием, и степень разбавления отобранного аналитического раствора для цитометрических измерений составляет более 1/100.
9. Способ по п.7 или 8, отличающийся тем, что степень разбавления аналитического раствора для измерения гемоглобина методом спектрофотометрии составляет от 1/100 до 1/500.
10. Способ по п.1, отличающийся тем, что на этапе перед добавлением указанных соединений отбирают часть предварительного раствора, образованного пробой крови и разбавителем, на которой проводят подсчет эритроцитов и/или тромбоцитов методом измерения резистивности.
11. Способ по п.1, отличающийся тем, что лизирующим соединением является ионное поверхностно-активное вещество, выбранное из ряда, содержащего:
четвертичные аммониевые соли, предпочтительно алкилтриметиламмониевые соли, и еще более конкретно цетил-додецил-тетрадецил- и гексадецилтриметиламмониевые бромиды и хлориды;
пиридиновые соли;
длинноцепочеченые этоксилированные амины; и
алкиловые сульфаты (SDS).
12. Способ по п.1, отличающийся тем, что состав, который стабилизирует гемоглобин в форме оксигемоглобинного комплекса, предпочтительно выбирают из ряда, содержащего:
моно- или полидентатные хелаты, имеющие атомы лигандов (не связывающие пары О, N, S и карбоксильных групп СОО- и подобное),
ароматические соединения (моно- или полидентатные хелаты), имеющие атомы лигандов (не связывающие пары О, N, S и подобное), и
сапонины, третичные оксиды амина, бетаины и сульфобетаины четвертичных аммониев.
13. Способ по п.1, отличающийся тем, что в аналитический раствор также добавляют фиксирующий агент для мембран лейкоцитов.
14. Способ по п.1, отличающийся тем, что в аналитический раствор также добавляют буффер кислотности (рН), способный задать рН аналитического раствора в диапазоне от 5,0 до 8,0, предпочтительно 7,0.
15. Способ по п.1, отличающийся тем, что в аналитический раствор добавляют фоновую соль, обеспечивающую его проводимость.
| US 5958781, 28.09.1999 | |||
| US 5786224, 28.07.1998 | |||
| US 4529705, 16.07.1985 | |||
| US 4502786, 05.03.1985 | |||
| СПОСОБ КОНТРОЛЯ ОКОНЧАНИЯ ПЛАВКИ ГОЛОЛЕДА | 1997 |
|
RU2122267C1 |
| Способ определения резистентности эритроцитов | 1987 |
|
SU1469464A1 |
Авторы
Даты
2011-04-27—Публикация
2006-03-22—Подача