Область техники, к которой относится изобретение
Настоящее изобретение направлено на способы стимуляции двигательной функции желудочно-кишечного тракта у пациента, которые предусматривают введение пептидильного аналога, обладающего агонистической активностью в отношении грелина, его пролекарства или фармацевтически приемлемой соли указанного аналога или указанного пролекарства.
Уровень техники
Двигательная функция желудочно-кишечного тракта (ЖКТ) представляет собой координированный нейромышечный процесс, обеспечивающий транспорт питательных веществ через пищеварительную систему (Scarpignato, C, Dig. Dis., (1997), 15:112), нарушение которого может приводить к развитию различных заболеваний, включающих гастроэзофагеальную рефлюксную болезнь (GERD), парез желудка (например, диабетический и после хирургической операции), синдром раздраженной кишки (IBS), констипацию (например, связанную с фазой гипокинезии IBS), рвоту (например, вызываемую противораковыми химиотерапевтическими средствами), непроходимость кишечника и псевдонепроходимость толстой кишки (патент США № 6548501; патентная заявка США № 20040266989). Указанные осложнения при нарушении двигательной функции ЖКТ относятся к серьезным проблемам здравоохранения промышленно развитых государств (патент США № 6548501; Feighner, S.D. et al., Science, (1999), 284:2184-8).
Термин "непроходимость кишечника" относится к закупорке кишки или пищеварительного канала, особенно толстой кишки (см., например, Dorland's Illustrated Medical Dictionary, p. 816, 27th ed. (W.B. Saunders Company, Philadelphia 1988)). Как правило, любая травма кишечника, сопровождающаяся высвобождением медиаторов воспаления для активации рефлексов нервного торможения, приводит к развитию непроходимости кишечника. Непроходимость кишечника можно диагностировать по нарушению нормальных согласованных движений кишечника, обеспечивающих продвижение его содержимого (Resnick, J., Am. J. of Gastroentero., (1997), 92:751; Resnick, J., Am. J. of Gastroentero., (1997), 92:934). Непроходимость кишечника следует отличать от констипации, которая характеризуется редкими или затрудненными испражнениями (см., например, Dorland's Illustrated Medical Dictionary, p. 375, 27th ed. (W.B. Saunders Company, Philadelphia 1988)).
Непроходимость кишечника может быть обусловлена разными причинами, такими как родовая деятельность; ишемия кишечника; ретроперитонеальная гематома; сепсис брюшной полости; воспаление брюшной полости, например, острый аппендицит, холецистит, панкреатит; переломы позвоночника; мочеточниковая колика; торакальные повреждения; базальная пневмония; переломы ребер; инфаркт миокарда; и нарушения метаболизма. Непроходимость кишечника является распространенной проблемой для женщин в послеродовой период, считается, что она обусловлена колебаниями уровней природных опиоидов в результате стресса, полученного при родах. Пациенты, подвергшиеся таким процедурам, как большая хирургическая операция брюшной полости, включая лапаротомию абдоминального абсцесса или трансплантацию тонкой кишки (SITx), хирургическая операция грудной клетки, таза или ортопедическая хирургия, часто страдают от временного ухудшения функции кишечника, называемого послеоперационная непроходимость кишечника (далее обозначаемая как POI).
POI обычно наблюдается в течение 24-72 часов после хирургической операции. В некоторых случаях дисфункция кишечника может стать очень тяжелой и может длиться более недели и поражать несколько участков ЖКТ (Livingston, E.H. et al., Digest. Dis. and Sei., (1990), 35:121). Обычно самое тяжелое нарушение моторики желудочно-кишечного тракта, связанное с POI, наблюдается в толстой кишке. POI характеризуется абдоминальной тошнотой, вздутием живота, рвотой, обстипацией, неспособностью есть и спазмами. POI не только замедляет нормальное возобновление потребления пищи после хирургической операции, но и приводит к развитию послеоперационных осложнений, особенно аспирационной пневмонии.
Введение опиоидных обезболивающих средств после хирургической операции зачастую может вносить вклад в развитие дисфункции кишечника у пациента или усиливать уже существующую дисфункцию кишечника, и, следовательно, замедлять восстановление нормальной функции кишечника. Поскольку практически все пациенты получают опиоидные обезболивающие средства, например морфин или другие наркотические средства, для облегчения боли после хирургической операции, особенно полостной операции, существующие в настоящее время способы лечения послеоперационной боли могут существенно замедлять восстановление нормальной функции кишечника и задерживать выписку из больницы, увеличивая стоимость медицинского обслуживания.
Средства, влияющие на двигательную функцию желудочно-кишечного тракта, также могут оказывать благоприятное действие на пациентов, страдающих от рвоты. Рвоте или тошноте часто предшествуют позывы к рвоте, которые могут сопровождаться сухими рвотными движениями. Рвоту могут вызывать нарушения в пищеварительном тракте, такие как непроходимость кишечника, диспепсия или воспаление стенки желудка, или нарушения в сенсорной системе мозга, такие как укачивание, мигрень или опухоли. Рвота может возникать самопроизвольно, например, при анорексии или булимии, она также может происходить в ответ на тяжелую боль, эмоциональные реакции (например, на неприятные образы или запахи) или беременность. Рвота является распространенным осложнением после введения многих лекарственных средств, особенно противораковых средств, таких как химиотерапевтические средства. Продолжительные приступы повторяющейся рвоты могут приводить к различным повреждениям организма, включая обезвоживание и электролитный дисбаланс (Quigley, E.M. et al., Gastroentero., (2001), 120:263-86).
Средства, влияющие на двигательную функцию желудочно-кишечного тракта, также могут оказывать благоприятное действие на пациентов, страдающих от пареза желудка. Парез желудка, также называемый замедленным опорожнением желудка, представляет собой заболевание, при котором нервы, связанные с желудком, повреждаются или прекращают функционировать, и в результате опорожнение желудка занимает слишком много времени. Например, после повреждения блуждающего нерва, который контролирует движение пищи через пищеварительный тракт, мышцы желудка и кишечника перестают работать нормально и движение пищи замедляется или останавливается. Высокий уровень глюкозы в крови вызывает химические изменения в нервах и повреждения кровеносных сосудов, которые несут кислород и питательные вещества к нервам. Если уровень глюкозы остается высоким в течение длительного времени, как это обычно бывает при диабете, может произойти повреждение блуждающего нерва; парез желудка часто встречается у людей с диабетом типа 1 или типа 2 (Murray, C. D. et al., Gut, (2005), 54:1693-8).
Традиционные способы лечения нарушений двигательной функции ЖКТ, таких как кишечная непроходимость, парез желудка и рвота, считаются неэффективными. Существующие в настоящее время способы лечения кишечной непроходимости предусматривают функциональную стимуляцию кишечника, применение средств, разжижающих стул, слабительных, таких как Dulcolax®, смазывающих средств, внутривенную гидратацию, назогастральную аспирацию, применение прокинетических средств, раннее энтеральное питание и назогастральную декомпрессию. Кроме того, для лечения кишечной непроходимости часто используют назогастральную интубацию с целью декомпрессии желудка.
Традиционные фармацевтические средства, используемые для лечения нарушений двигательной функции ЖКТ, таких как кишечная непроходимость, включают лекарственные средства, усиливающие двигательную функцию толстой кишки, такие как Leu13-мотилин и простагландин F2α, а также прокинетические средства, такие как Cisapride®. PROPULSID®, содержащий моногидрат Cisapride®, представляет собой пероральное желудочно-кишечное средство (патент США № 4962115), которое назначают для симптоматического лечения взрослых пациентов с ночной изжогой, как следствием гастроэзофагеальной рефлюксной болезни. Другие прокинетические средства включают, например, метоклопрамид, домперидон, ондансетрон, трописетрон, мосаприд и итоприд. Другие способы лечения предусматривают введение пиразолопиридиновых соединений в качестве антагонистов аденозина (патент США № 6214843); антагониста рецептора гипофизарного аденилатциклаза-активирующего пептида (PACAP) в сочетании с антагонистом рецептора вазоактивного пептида кишечника (VIP) (патент США № 6911430); федотозина (патент США № 5362756); нейропептидов (патент США № 5929035) и антагонистов активируемого протеинкиназой рецептора-2 (патент США № 5929035). В крайних случаях кишечную непроходимость лечат путем хирургического вмешательства для разблокирования толстой кишки.
Однако перечисленные способы лечения имеют многочисленные недостатки. Например, PROPULSID® недавно изъяли из продажи, поскольку он может вызывать сердечную аритмию (патент США № 6548501). Adolor Corporation в настоящее время проводит клинические испытания, фаза III, способа лечения послеоперационной кишечной непроходимости с использованием Alvimopan (Entereg®). Однако в способе лечения Adolor используются антагонисты опиоидных рецепторов, которые только блокируют побочные эффекты опиатных обезболивающих средств, не облегчая реально состояние кишечной непроходимости. Фаза III испытаний показывает, что указанный способ лечения кишечной непроходимости, в частности послеоперационной кишечной непроходимости, обладают низкой эффективностью и минимальной применимостью.
Кроме того, существующие на известном уровне техники способы лечения нарушений двигательной функции ЖКТ не обладают специфичностью в отношении различных типов нарушений, например послеоперационной кишечной непроходимости или послеродовой кишечной непроходимости. Существующие на известном уровне техники способы также не обеспечивают профилактики нарушений двигательной функции ЖКТ, таких как кишечная непроходимость, парез желудка и рвота. Если бы нарушения двигательной функции ЖКТ, такие как кишечная непроходимость, парез желудка и рвота, можно было предотвращать или более эффективно лечить, время пребывания в стационаре, время восстановления и стоимость медицинского обслуживания можно было значительно снизить при дополнительной минимизации дискомфорта пациента.
Лекарственные средства, обладающие селективностью в отношении двигательной функции пищеварительного тракта и способные корректировать дисфункцию желудочно-кишечного тракта, вызванную послеоперационной кишечной непроходимостью, могут быть идеальными кандидатами для профилактики и/или лечения послеоперационной или послеродовой кишечной непроходимости. Такие лекарственные средства также могут быть превосходными кандидатами для лечения пареза желудка и/или рвоты, особенно рвоты, связанной с дисфункцией желудочно-кишечного тракта, вызванной химиотерапевтическими или другими лекарственными средствами. Среди указанных лекарственных средств особенно полезными являются такие, которые не препятствуют действию опиоидных обезболивающих, поскольку их можно вводить одновременно со средствами для лечения боли при ограниченных побочных эффектах.
В настоящее время считают, что пептиды, влияющие на высвобождение гормона роста (GH), оказывают гастрокинетические или "прокинетические" эффекты (патент США № 6548501; Peeters, T.L., J Physiol. Pharmacol., (2003), 54 (supp 4):95-103, а также приведенные в данном патенте ссылки; Trudel, L. et al, J. Physiol. Gastrointest. Liver Physiol., (2002), 282:G948-52). Такие пептиды, высвобождающие гормон роста, или GHRP, также называют стимуляторами секреции гормона роста (GHS). Примеры пептидов, высвобождающих гормон роста (GHRP) и предположительно обладающих прокинетическими эффектами, включают GHRP-I, GHRP-2 и грелин.
Грелин, недавно открытый гормон возбуждения аппетита, продуцируется в виде препрогормона, который после протеолитического процессинга превращается в пептид, имеющий следующую последовательность: H-Gly-Ser-Ser-Phe-Leu-Ser-Pro-Glu-His-Gln-Arg-Val-Gln-Gln-Arg-Lys-Glu-Ser-Lys-Lys-Pro-Pro-Ala-Lys-Leu-Gln-Pro-Arg-NH2 (Kojima, M. et al., Nature, (1999), 402(6762):656-60). Грелин продуцируется эпителиальными клетками, выстилающими дно желудка, его функция заключается в стимуляции аппетита; уровень грелина повышается перед едой и уменьшается после приема пищи.
Грелин эффективно стимулирует секрецию GH из передней доли гипофиза, в основном, на уровне гипоталамуса, через взаимодействие с рецептором стимулятора секреции гормона роста (GHS-R), как у животных, так и у людей (Ukkola, O. et al., Ann. Med., (2002), 34:102-8; (Kojima, M. et al., Nature, (1999), 402(6762):656-60).
Известны природные структуры грелина из нескольких видов млекопитающих и отличных от млекопитающих видов (Kaiya, H. et al., J. of Biol. Chem., (2001), 276:40441-8 и Международная патентная заявка РСТ/JР00/04907 [WO 01/07475]). Центральный участок грелина отвечает за наблюдаемую активность рецептора GHS. Центральный участок содержит четыре N-концевые аминокислоты, причем серин в положении три обычно модифицирован н-октановой кислотой. Помимо ацилирования н-октановой кислотой нативный грелин может быть ацилирован н-декановой кислотой (Kaiya, H. et al., J. of Biol. Chem., (2001), 276:40441-8).
До открытия того факта, что грелин является природным лигандом рецептора GHS, было известно, что GHRP контролируют высвобождение гормона роста из гипофизарных соматотропных клеток. Обнаружено, что у некоторых видов, включая человека, гексапептид His-D-Trp-Ala-Trp-D-Phe-Lys-амид (GHRP-6) высвобождает гормон роста из соматотропных клеток в зависимости от дозы (Bowers, C.Y. et al., Endocrinology, (1984), 114(5):1537-45). Последующие химические исследования GHRP-6 привели к идентификации других активных синтетических GHS, таких как GHRP-I, GHRP-2 и гексарелин (Cheng, K. et al., Endocrinology, (1989), 124(6):2791-8; Bowers, C.Y., Novel GH-Releasing Peptides. Molecular and Clinical Advances in Pituitary Disorders, Ed: Melmed, S., Endocrine Research and Education, Inc., Los Angeles, CA, USA, (1993), 153-7; и Deghenghi, R. et al., Life Sei., (1994), 54(18):1321-8). Данные соединения имеют следующие структуры:
GHRP-I Ala-His-D-(2')-Nal-Ala-Trp-D-Phe-Lys-NH2;
GHRP-2 D-Ala-D-(2')-Nal-Ala-Trp-D-Nal-Lys-NH2 и
Гексарелин His-D-2-MeTrp-Ala-Trp-D-Phe-Lys-NH2.
GHRP-I, GHRP-2, GHRP-6 и гексарелин относятся к классу синтетических GHS.
Проведенные в последнее время исследования показали, что GHS, такие как грелин, GHRP-6 и другие, можно использовать для стимуляции двигательной активности кишечного тракта и для лечения таких состояний, как кишечная непроходимость и рвота. Например, было показано, что грелин и GHRP-6 ускоряют опорожнение желудка у крыс и мышей (Peeters, T. L., J Physiol. Pharmacol., (2003), 54 (supp 4):95-103). Обнаружено, что грелин уменьшает замедление опорожнения желудка на крысиной модели послеоперационной кишечной непроходимости (Peeters, T.L., J Physiol. Pharmacol., (2003), 54 (supp 4):95-103; Trudel, L. et al., J. Physiol. Gastrointest. Liver Physiol., (2002), 282(6):G948-52) и у собак после лапарэктомии, показано, что грелин улучшает POI у обработанных животных (Trudel, L. et al, Peptides, (2003), 24:531-4). У септических мышей грелин и GHRP-6 ускоряют опорожнение желудка, но мало влияют на повышение скорости передачи пищевой массы в тонкий кишечник (De Winter, B. Y. et al., Neurogastroenterol. Motil., (2004), 16:439-46).
В экспериментах по имитированию условий госпитализации для пациентов-людей, страдающих от POI, крысам после лапарэктомии вводят опиаты и аналог грелина RC-1139 (Poitras, P. et al., Peptides, (2005), 26:1598-601). Анализ с измерением опорожнения желудка показал, что RC-1139 уменьшает POI у контрольных крыс и крыс после лапарэктомии в присутствии морфина. Следовательно, можно предположить, что грелин оказывает гастрокинетическое действие, не влияя на активность опиатов.
У хорьков, получающих цитотоксическое противораковое средство цисплатин, после церебровентрикулярного введения грелина гораздо реже наблюдаются позывы к рвоте и рвота (Rudd, J.A. et al., Neurosci. Lett, (2006), 392:79-83), что подтверждает способность грелина уменьшать рвоту в соответствии с ролью, которую он играет в модуляции функций желудочно-кишечного тракта. Полагают, что роль грелина в модуляции двигательной функции желудка зависит от активации секреции GH и может опосредоваться вагально-холинергическим мускариновым путем (патентная заявка США № 20060025566).
Кроме того, показано, что грелин ускоряет опорожнение желудка у пациентов с диабетическим парезом желудка (Murray, C. D. et al., Gut, (2005), 54:1693-8).
Следует отметить, что в приведенных выше исследованиях грелин или аналог грелина вводят путем внутрибрюшинной (в.б.), внутривенной (в.в.) или интрацеребровентрикулярной (и.ц.в.) инъекции. В других работах (патент США № 6548501; патентная заявка США № 20020042419; патентная заявка США № 20050187237; патентная заявка США № 20060025566) описано пероральное введение GHS для лечения нарушений двигательной функции желудочно-кишечного тракта.
В данной области известно очень мало соединений, которые можно использовать для лечения двигательной функции ЖКТ, следовательно, существует настоятельная потребность в увеличении количества соединений, оказывающих влияние, такое как стимуляция, на моторику желудочно-кишечного тракта. Соединения, оказывающие влияние на двигательную функцию желудочно-кишечного тракта, можно использовать для лечения нарушений нормальных функций ЖКТ, таких как кишечная непроходимость и рвота.
Раскрытие изобретения
Настоящее изобретение относится к способу стимуляции двигательной функции желудочно-кишечного тракта у пациента (например, у млекопитающего, такого как человек). Данный способ предусматривает стадию введения терапевтически эффективного количества пептидильного аналога грелина указанному пациенту, страдающему от нарушения моторики желудочно-кишечного тракта или имеющему риск такого нарушения.
В одном аспекте настоящее изобретение предлагает способ лечения состояний с нарушением двигательной функции желудочно-кишечного тракта путем введения терапевтически эффективного количества пептидильного аналога грелина или его пролекарства, подходящих для облегчения таких состояний желудочно-кишечного тракта, где аналог или его пролекарство включает соединение формулы (I), формулы (II) или формулы (III), или его фармацевтически приемлемую соль. Способ данного изобретения можно использовать для стимуляции двигательной функции желудка и желудочно-кишечного тракта у пациента (например, у млекопитающего, такого как человек) и, как таковой, его можно использовать для лечения состояний, на которые благоприятное действие оказывает улучшение двигательной функции желудка и желудочно-кишечного тракта, таких как гастроэзофагеальная рефлюксная болезнь (GERD), IBS, констипация, кишечная непроходимость, рвота, парез желудка, псевдонепроходимость толстой кишки и т.п.
В другом аспекте данное изобретение предлагает способ лечения кишечной непроходимости, пареза желудка или рвоты путем введения терапевтически эффективного количества пептидильного аналога грелина, подходящего для облегчения кишечной непроходимости, рвоты или пареза желудка. В следующем аспекте состояние, подлежащее лечению с помощью способа данного изобретения, представляет собой кишечную непроходимость, например послеоперационную кишечную непроходимость, после хирургической операции на желудочно-кишечном тракте. В следующем аспекте данного изобретения состояние, подлежащее лечению с помощью способа данного изобретения, представляет собой рвоту, например рвоту, связанную с введением противоракового химиотерапевтического средства или вызванную введением такого средства. В следующем аспекте состояние, подлежащее лечению с помощью способа данного изобретения, представляет собой парез желудка, например диабетический парез желудка. Диабет может представлять собой диабет типа I или типа II.
В одном аспекте изобретение предлагает способ лечения желудочно-кишечных состояний, таких как GERD, IBS, констипация, кишечная непроходимость, рвота, парез желудка, псевдонепроходимость толстой кишки и т.п., путем введения терапевтически эффективного количества пептидильного аналога грелина формулы (I):
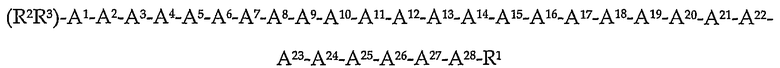
где
A1 обозначает Gly, Aib, Ala, β-Ala или Асc;
A2 обозначает Ser, Aib, Act, Ala, Acc, Abu, Ava, Thr или Val;
A3 обозначает Ser, Ser(C(О)-R4), Asp(О-R8), Asp(NH-R9), Cys(S-R14), Dap(S(O)2-R10), Dab(S(О)2-R11), Glu(O-R6), Glu(NH-R7), Thr, Thr(C(O)-R5) или HN-CH((CH2)n-N(R12R13))-C(O);
A4 обозначает Phe, Acc, Aic, Cha, 2-Fua, 1-Nal, 2-Nal, 2-Pal, 3-Pal, 4-Pal, hPhe, (X1,X2,X3,X4,X5)Phe, Taz, 2-Thi, 3-Thi, Trp или Tyr;
A5 обозначает Leu, Abu, Acс, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle или Val;
A6 обозначает Ser, Abu, Acc, Act, Aib, Ala, Gly, Thr или Val;
A7 обозначает Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или исключен;
A8 обозначает Glu, Acс, Aib, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
A9 обозначает His, Apc, Aib, Acc, 2-Fua, 2-Pal, 3-Pal, 4-Pal, Taz, 2-Thi, 3-Thi, (X1,X2,X3,X4,X5)Phe или исключен;
A10 обозначает Gln, Acc, Aib, Asn, Asp, Glu или исключен;
A11 обозначает Arg, Apс, hArg, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
A12 обозначает Val, Abu, Acс, Aib, Ala, Cha, Nva, Gly, Ile, Leu, Nle, Tle или исключен;
A13 обозначает Gln, Acc, Aib, Asn, Asp, Glu или исключен;
A14 обозначает Gln, Acc, Aib, Asn, Asp, Glu или исключен;
A15 обозначает Arg, hArg, Acc, Aib, Apc, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
A16 обозначает Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
A17 обозначает Glu, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
A18 обозначает Ser, Abu, Acc, Act, Aib, Ala, Thr, Val или исключен;
A19 обозначает Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
A20 обозначает Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
A21 обозначает Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или исключен;
A22 is Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или исключен;
A23 обозначает Abu, Acc, Act, Aib, Ala, Apc, Gly, Nva, Val или исключен;
A24 обозначает Lys, Acс, Aib, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
A25 обозначает Leu, Abu, Acс, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle, Val или исключен;
A26 обозначает Gln, Aib, Asn, Asp, Glu или исключен;
A27 обозначает Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или исключен;
A28 обозначает Acc, Aib, Apc, Arg, hArg, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
R1 представляет собой -OH, -NH2, -(С1-С30)алкокси или NH-X6-CH2-Z0, где X6 представляет собой (C1-C12)алкил, (C2-C12)алкенил, и Z0 представляет собой -H, -OH, -CO2H или -C(O)-NH2;
R2 и R3, каждый независимо, в каждом случае представляет собой H, (C1-C20)алкил или (C1-C20)ацил;
R4, R5, R6, R7, R8, R9, R10, R11 и R14, каждый независимо, в каждом случае представляет собой (C1-C40)алкил, (C2-C40)алкенил, замещенный (C1-C40)алкил, замещенный (C2-C40)алкенил, алкиларил, замещенный алкиларил, арил или замещенный арил;
R12 и R13, каждый независимо, в каждом случае представляет собой H, (C1-C40)алкил, (C1-C40)ацил, (C1-C30)алкилсульфонил или -C(NH)-NH2, где, если R12 представляет собой (C1-C40)ацил, (C1-C30)алкилсульфонил или -C(NH)-NH2, то R13 представляет собой H или (C1-C40)алкил;
n в каждом случае независимо равен 1, 2, 3, 4 или 5;
X1, X2, X3, X4 и X5, каждый независимо, в каждом случае представляет собой H, F, Cl, Br, I, (C1-C10)алкил, замещенный (C1-C10)алкил, арил, замещенный арил, OH, NH2, NO2 или CN;
при условии, что пептид содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из:
A2, который обозначает Aib, Acс или Act;
A3, который обозначает Dap(S(O)2-R10), Dab(S(O)2-R11), Glu(NH-гексил) или Cys(S-децил);
A5, который обозначает Abu, Acс, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle или Val;
A6, который обозначает Abu, Acс, Act, Aib, Ala, Gly, Thr или Val;
A7, который обозначает Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz или Tic;
A8, который обозначает Acс, Aib, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn или HN-CH((CH2)n-N(R12R13))-C(O);
A9, который обозначает Aib, Acс, Apс, 2-Fua, 2-Pal, 3-Pal, 4-Pal, Taz, 2-Thi, 3-Thi или (X1,X2,X3,X4,X5-)Phe; и
A10, который обозначает Acс, Aib, Asn, Asp или Glu;
и при дополнительном условии, что пептид не является (Lys8)hгрелин(1-8)-NH2 или (Arg8)hгрелин(1-8)-NH2; или его фармацевтически приемлемой соли.
В другом аспекте данное изобретение предлагает группу предпочтительных соединений формулы (I), где:
A1 обозначает Gly или Aib;
A2 обозначает Ser, Aib, A5c, Act или Ava;
A3 обозначает Ser(C(O)-R4), Glu(O-R6), Glu(NH-R7), Dap(S(O)2-R10) или Dab(S(O)2-R11);
A4 обозначает Phe;
A5 обозначает Leu, Acс, Aib, Cha или hLeu;
A6 обозначает Ser, Abu, Act, Aib или Thr;
A7 обозначает Pro, Dhp, Dmt, 4-Hyp, Ktp, Pip, Tic или Thz;
A8 обозначает Glu или Aib;
A9 обозначает His, Aib, Apc, 2-Fua, 2-Pal, 3-Pal, 4-Pal, Taz или 2-Thi;
A10 обозначает Gln или Aib;
A11 обозначает Arg;
A12 обозначает Aib, Val или Ace;
A13 обозначает Gln;
A14 обозначает Gln;
A15 обозначает Arg или Orn;
A16 обозначает Lys или Apс;
A17 обозначает Glu;
A18 обозначает Ser;
A19 обозначает Lys;
A20 обозначает Lys;
A21 обозначает Pro;
A22 обозначает Pro;
A23 обозначает Ala;
A24 обозначает Lys;
A25 обозначает Leu;
A26 обозначает Gln;
A27 обозначает Pro; и
A28 обозначает Arg, или их фармацевтически приемлемые соли.
В следующем аспекте данное изобретение предлагает группу предпочтительных соединений формулы (I), где:
R2 и R3, каждый независимо, представляет собой H, ацил, н-бутирил, изобутирил или н-октаноил;
R4 представляет собой октил;
R6 представляет собой гексил;
R7 представляет собой гексил;
R10 представляет собой октил; и
R11 представляет собой октил, или их фармацевтически приемлемые соли, где Acс в каждом случае независимо обозначает A5c или A6c.
В следующем аспекте данное изобретение предлагает группу предпочтительных соединений формулы (I), включающую следующие соединения:
(Dap3(октансульфонил))hгрелин(1-28)-NH2; Пример 75
(Aib2, A6c5)hгрелин(1-28)-NH2; Пример 96
(A6c5)hгрелин(1-28)-NH2;
(Aib2,6)hгрелин(1-28)-NH2; Пример 108
(Aib2, A5c12)hгрелин(1-28)-NH2;
(Aib2, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Act6)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9)hгрелин(1-28)-NH2; Пример 29
(Aib2, Dmt7)hгрелин(1-28)-NH2;
(Aib2, Thz7)hгрелин(1-28)-NH2;
(A5c2)hгрелин(1-28)-NH2; Пример 52
(Act2)hгрелин(1-28)-NH2; Пример 94
(Aib2, A5c5)hгрелин(1-28)-NH2;
(Aib2, A6c5)hгрелин(1-28)-NH2;
(Aib2,5)hгрелин(1-28)-NH2;
(Aib2, hLeu5)hгрелин(1-28)-NH2;
(Aib2, Cha5)hгрелин(1-28)-NH2;
(Aib2,6)hгрелин(1-28)-NH2;
(Aib2, Act6)hгрелин(1-28)-NH2; Пример 114
(Aib2, Thr6)hгрелин (1-28)-NH2;
(Aib2, Abu6)hгрелин(1-28)-NH2; Пример 88
(Aib2, 4-Hyp7)hгрелин (1-28)-NH2; Пример 36
(Aib2, Thz7)hгрелин(1-28)-NH2; Пример 54
(Aib2, Pip7)hгрелин(1-28)-NH2; Пример 65
(Aib2, Dhp7)hгрелин (1-28)-NH2; Пример 44
(Aib2, Ktp7)hгрелин(1-28)-NH2;
(Aib2,8)hгрелин(1-28)-NH2; Пример 49
(Aib2, 2-Pal9)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, 4-Pal9)hгрелин(1-28)-NH2; Пример 55
(Aib2, Taz9)hгрелин(1-28)-NH2; Пример 27
(Aib2, 2-Thi9)hгрелин(1-28)-NH2;
(Aib2, 2-Fua9)hгрелин(1-28)-NH2;
(Aib2, Apc9)hгрелин(1-28)-NH2;
(Aib2,9)hгрелин(1-28)-NH2;
(Aib2,10)hгрелин(1-28)-NH2; Пример 48
(Aib2, Tic7)hгрелин(1-28)-NH2; Пример 53
(Aib6)hгрелин(1-28)-NH2;
(A5c5)hгрелин(1-28)-NH2;
(A6c5)hгрелин(1-28)-NH2; Пример 102
(Act6)hгрелин(1-28)-NH2;
(3-Pal9)hгрелин(1-28)-NH2; Пример 32
(Dmt7)hгрелин(1-28)-NH2;
(Thz7)hгрелин(1-28)-NH2;
(Aib5)hгрелин(1-28)-NH2;
(hLeu5)hгрелин(1-28)-NH2;
(Cha5)hгрелин(1-28)-NH2;
(Thr6)hгрелин(1-28)-NH2;
(Abu6)hгрелин(1-28)-NH2;
(4-Hyp7)hгрелин(1-28)-NH2;
(Pip7)hгрелин(1-28)-NH2;
(Dhp7)hгрелин(1-28)-NH2;
(Ktp7)hгрелин(1-28)-NH2;
(Aib8)hгрелин(1-28)-NH2; Пример 10
(2-Pal9)hгрелин(1-28)-NH2;
(3-Pal9)hгрелин(1-28)-NH2;
(4-Pal9)hгрелин(1-28)-NH2;
(Taz9)hгрелин(1-28)-NH2;
(2-Thi9)hгрелин(1-28)-NH2; Пример 26
(2-Fua9)hгрелин(1-28)-NH2;
(Apc9)hгрелин(1-28)-NH2;
(Aib9)hгрелин(1-28)-NH2;
(Aib10)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), A6c5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A6c5)hгрелин(1-28)-NH2;
(Aib2,6, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), A5c12)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Act6)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Dmt7)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Thz7)hгрелин(1-28)-NH2;
(A5c2, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Act2, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), A5c5)hгрелин(1-28)-NH2;
(Aib2,5, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), hLeu5)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Cha5)hгрелин(1-28)-NH2;
(Aib2,6, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Thr6)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Abu6)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 4-Hyp7)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Pip7)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Dhp7)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Ktp7)hгрелин(1-28)-NH2;
(Aib2,8, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 2-Pal9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 3-Pal9)hгрелин(1-28)-NH2
(Aib2, Dap3(октансульфонил), 4-Pal9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Taz9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 2-Thi9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 2-Fua9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Apc9)hгрелин(1-28)-NH2;
(Aib2,9, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2,10, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A6c5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Aib6)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c12)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Act6)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 3-Pal9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Dmt7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Thz7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Aib5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), hLeu5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Cha5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Thr6)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Abu6)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 4-Hyp7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Pip7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Dhp7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Ktp7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Aib8)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 2-Pal9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 3-Pal9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 4-Pal9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Taz9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 2-Thi9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 2-Fua9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Apc9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Aib9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Aib10)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Dab3(октансульфонил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, A6c5, A5c12, Orn15)hгрелин(1-28)-NH2;
(А6с5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Act6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Dmt7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Thz7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, A5c5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, hLeu5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Cha5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Thr6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Abu6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 4Hyp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Pip7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Dhp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Ktp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,8, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 2-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 4-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Taz9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 2-Thi9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 2-Fua9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Apc9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,10, A5c12, Orn15)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Dab3(октансульфонил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, А6с5, A5c12, Apc16)hгрелин(1-28)-NH2;
(А6с5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Act6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Dmt7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Thz7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, A5c5,12, Apc16)hгрелин(1-28)-NH2;
(Aib2,5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, hLeu5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Cha5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Thr6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Abu6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 4-Hyp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Pip7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Dhp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Ktp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,8, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 2-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 4-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Taz9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 2-Thi9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 2-Fua9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Apc9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,10, A5c12, Apc16)hгрелин(1-28)-NH2;
(A6c5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Act6, A5c12, Orn15)hгрелин(1-28)-NH2;
(3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Dmt7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Thz7, A5c12, Orn15)hгрелин(1-28)-NH2;
(A5c5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib5, A5c12, Orn15)hгрелин(1-28)-NH2;
(hLeu5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Cha5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Thr6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Abu6, A5c12, Orn15)hгрелин(1-28)-NH2;
(4Hyp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Pip7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Dhp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Ktp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib8, A5c12, Orn15)hгрелин(1-28)-NH2;
(2-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(4-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Taz9, A5c12, Orn15)hгрелин(1-28)-NH2;
(2-Thi9, A5c12, Orn15)hгрелин(1-28)-NH2;
(2-Fua9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Apc9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib10, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib6, A5c12, Apc16)hгрелин(1-28)-NH2;
(А5С5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Act6, A5c12, Apc16)hгрелин(1-28)-NH2;
(3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Dmt7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Thz7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib5, A5c12, Apc16)hгрелин(1-28)-NH2;
(hLeu5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Cha5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Thr6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Abu6, A5c12, Apc16)hгрелин(1-28)-NH2;
(4-Hyp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Pip7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Dhp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Ktp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib8, A5c12, Apc16)hгрелин(1-28)-NH2;
(2-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(4-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Taz9, A5c12, Apc16)hгрелин(1-28)-NH2;
(2-Thi9, A5c12, Apc16)hгрелин(1-28)-NH2;
(2-Fua9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Apc9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib10, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A6c5)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), A6c5)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Act6)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dmt7)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thz7)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A5c5)hгрелин(1-28)-NH2;
(Aib2,5, Glu3(NH-гексил))hгрелин(l -28)-NH2;
(Aib2, Glu3(NH-гексил), hLeu5)hгрелин(1-28)-NH2;
(Aib2, Cha5)hгрелин(1-28)-NH2; Пример 81
(Aib2,6, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thr6)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Abu6)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4Hyp7)hгрелин(1-28)-NH2; Пример 79
(Aib2, Glu3(NH-гексил), Pip7)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dhp7)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Ktp7)hгрелин(1-28)-NH2;
(Aib2,8, Glu3(NH-гексил))hгрелин(1-28)-NH2; Пример 56
(Aib2, Glu3(NH-гексил), 2-Pal9)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9)hгрелин(1-28)-NH2; Пример 80
(Aib2, Glu3(NH-гексил), 4-Pal9)hгрелин(1-28)-NH2; Пример 85
(Aib2, Glu3(NH-гексил), Taz9)hгрелин(1-28)-NH2; Пример 43
(Aib2, Glu3(NH-гексил), 2-Thi9)hгрелин(1-28)-NH2; Пример 51
(Aib2, Glu3(NH-гексил), 2-Fua9)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Apc9)hгрелин(1-28)-NH2;
(Aib2,9, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Aib2,10, Glu3(NH-гексил))hгрелин(1-28)-NH2; Пример 59
(Glu3(NH-гексил), Aib6)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), A5c5)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Act6)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 3-Pal9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Dmt7)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Thz7)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Aib5)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), hLeu5)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Cha5)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Thr6)hгрелин (1-28)-NH2;
(Glu3(NH-гексил), Abu6)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 4-Hyp7)hгрелин(1-28)-NH2; Пример 82
(Glu3(NH-гексил), Pip7)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Dhp7)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Ktp7)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Aib8)hгрелин(1-28)-NH2; Пример 35
(Glu3(NH-гексил), 2-Pal9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 3-Pal9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 4-Pal9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Taz9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 2-Thi9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 2-Fua9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Apc9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Aib9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Aib10)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A6c5, A5c12, Orn15)hгрелин(1-28)-NH2;
(A6c5, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Act6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dmt7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thz7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A5c5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,5, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, hLeu5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Cha5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thr6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Abu6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4-Hyp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Pip7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dhp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Ktp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,8, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Taz9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Thi9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Fua9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Apc9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,9, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,12, Glu3(NH-гексил), 4-Pal9, Orn15)hгрелин(1-28)-NH2; Пример 89
(Aib2,10, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A6c5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), A6c5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Act6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dmt7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thz7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A5c5,12, Apc16)hгрелин(1-28)-NH2;
(Aib2,5, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), hLeu5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Cha5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thr6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Abu6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4-Hyp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Pip7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dhp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Ktp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,8, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Taz9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Thi9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Fua9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Apc9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,9, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,10, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Glu3(O-гексил))hгрелин(1-28)-NH2; Пример 21
(Aib2)hгрелин(1-28)-NH2; Пример 25
(Glu3(NH-гексил))hгрелин(1-28)-NH2; Пример 76
(Aib2, Glu3(O-гексил))hгрелин(1-28)-NH2;
(Aib1, Glu3(O-гексил))hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил))hгрелин(1-28)-NH2; Пример 8
(Dap3(1-октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(1-октансульфонил))hгрелин(1-28)-NH2;
(Aib1, Dap3(1-октансульфонил))hгрелин(1-28)-NH2;
(Ava2, Dap3(1-октансульфонил))hгрелин(2-28)-NH2;
(Ac-Gly1)hгрелин(1-5)-NH2;
(Ac-Gly1)hгрелин(1-6)-NH2;
(Ac-Gly1)hгрелин(1-7)-NH2;
(Ac-Gly1, Aib2)hгрелин(1-28)-NH2; Пример 63
(Ac-Gly1, Aib2, Glu3(NH-гексил))hгрелин(1-5)-NH2;
(Ac-Gly1, Aib2, Glu3(NH-гексил))hгрелин(1-6)-NH2;
(Ac-Gly1, Aib2, Glu3(NH-гексил))hгрелин(1-7)-NH2;
(Ac-Gly1, Aib2, Glu3(NH-гексил), Arg8)hгрелин(1-8)-NH2;
(Ac-Gly1, Aib2, Glu3(NH-гексил), Lys8)hгрелин(1-8)-NH2;
(н-бутирил-Glu1)hгрелин(1-28)-NH2; Пример 95
(изобутирил-Glu1)hгрелин(1-28)-NH2; Пример 99
(н-октаноил-Gly1)hгрелин(1-28)-NH2, Пример 92
Cys3(S(CH2)9CH3)hгрелин(1-28)-NH2; Пример 61
(Lys5)hгрелин(1-28)-NH2. Пример 42
(Aib2, Ser3)hгрелин(1-28)-NH2;
(Aib2,6, Ser3)hгрелин(1-28)-NH2
(Aib2, Ser3, 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Ser3, Thz7)hгрелин(1-28)-NH2;
(Aib2, Ser3, Cha5)hгрелин(1-28)-NH2;
(Aib2, Ser3, Abu6)hгрелин(1-28)-NH2;
(Aib2, Ser3, 4-Hyp7)hгрелин(1-28)-NH2;
(Aib2, Ser3, Taz9)hгрелин(1-28)-NH2;
(Aib2, Ser3, Dhp7)hгрелин(1-28)-NH2;
(Aib2,8, Ser3)hгрелин(1-28)-NH2;
(Aib2, Ser3, Pip7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Ser3)hгрелин(1-28)-NH2;
(Aib2,10, Ser3)hгрелин(1-28)-NH2;
(н-бутирил-Gly1, Aib2, Ser3)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Ser3)hгрелин(1-28)-NH2;
(Aib2, Ser3, Tic7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Ser3, Arg8)hгрелин(1-28)-NH2;
(Ser3, Aib8)hгрелин(1-28)-NH2;
(Ser3, Taz9)hгрелин(1-28)-NH2;
(Ser3, 3-Pal9)hгрелин(1-28)-NH2;
(Ser3, 4-Pal9)hгрелин(1-28)-NH2;
(Aib2, Ser3, 2-Thi9)hгрелин(1-28)-NH2;
(Ser3, 2-Thi9)hгрелин(1-28)-NH2;
(Ser3, 4-Hyp7)hгрелин(1-28)-NH2;
(Aib2, Ser3, Tic7)hгрелин(1-28)-NH2;
(Aib2, Thr3)hгрелин(1-28)-NH2;
(Aib2,6, Thr3)hгрелин(1-28)-NH2;
(A5c5, Thr3)hгрелин(1-28)-NH2;
(Aib2, Thr3, 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Thr3, Thz7)hгрелин(1-28)-NH2;
(Aib2, Thr3, Cha5)hгрелин(1-28)-NH2;
(Aib2, Thr3, Abu6)hгрелин(1-28)-NH2;
(Aib2, Thr3, 4-Hyp7)hгрелин(1-28)-NH2;
(Aib2, Thr3, Taz9)hгрелин(1-28)-NH2;
(Aib2, Thr3, Dhp7)hгрелин(1-28)-NH2;
(Aib2,8, Thr3)hгрелин(1-28)-NH2;
(Aib2, Thr3, Pip7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Thr3)hгрелин(1-28)-NH2;
(Aib2,10, Thr3)hгрелин(1-28)-NH2;
(н-бутирил-Gly1, Aib2, Thr3)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Thr3)hгрелин(1-28)-NH2;
(Aib2, Thr3, Tic7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Thr3, Arg8)hгрелин(1-28)-NH2;
(Thr3, Aib8)hгрелин(1-28)-NH2;
(Thr3, Taz9)hгрелин(1-28)-NH2;
(Thr3, 3-Pal9)hгрелин(1-28)-NH2;
(Thr3, 4-Pal9)hгрелин(1-28)-NH2;
(Aib2, Thr3, 2-Thi9)hгрелин(1-28)-NH2;
(Thr3, 2-Thi9)hгрелин(1-28)-NH2;
(Thr3, 4-Hyp7)hгрелин(1-28)-NH2;
(Aib2, Thr3, Tic7)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu3(NH-гексил))hгрелин(1-28)-NH2; или
их фармацевтически приемлемые соли.
В одном аспекте данное изобретение предлагает способ лечения таких состояний желудочно-кишечного тракта, как гастроэзофагеальная рефлюксная болезнь, IBS, констипация, кишечная непроходимость, рвота, парез желудка, псевдонепроходимость толстой кишки и т.п., путем введения терапевтически эффективного количества пептидильного аналога грелина, имеющего приведенную ниже формулу (II):
R 1 -A 1 -A 2 -A 3 -A 4 -A 5 -R 2
где:
A1 обозначает Aib, Apc или Inp;
A2 обозначает D-Bal, D-Bip, D-Bpa, D-Dip, D-1-Nal, D-2-Nal, D-Ser(Bzl) или D-Trp;
A3 обозначает D-Bal, D-Bip, D-Bpa, D-Dip, D-1-Nal, D-2-Nal, D-Ser(Bzl) или D-Trp;
A4 обозначает 2-Fua, Orn, 2-Pal, 3-Pal, 4-Pal, Pff, Phe, Pim, Taz, 2-Thi, 3-Thi, Thr(Bzl);
A5 обозначает Apc, Dab, Dap, Lys, Orn или исключен;
R1 представляет собой водород, (C1-6)алкил, (C5-14)арил, (C1-6)алкил(C5-14)арил, (С3-8)циклоалкил или (C2-10)ацил; и
R2 представляет собой OH или NH2;
при условии, что, если A5 обозначает Dab, Dap, Lys или Orn, то:
A2 обозначает D-Bip, D-Bpa, D-Dip или D-Bal; или
A3 обозначает D-Bip, D-Bpa, D-Dip или D-Bal; или
A4 обозначает 2-Thi, 3-Thi, Taz, 2-Fua, 2-Pal, 3-Pal, 4-Pal, Orn, Thr(Bzl) или Pff;
если A5 исключен, то:
A3 обозначает D-Bip, D-Bpa или D-Dip; или
A4 обозначает 2-Fua, Pff, Taz или Thr(Bzl); или
A1 обозначает Apc, если
A2 обозначает D-Bip, D-Bpa, D-Dip или D-Bal; или
A3 обозначает D-Bip, D-Bpa, D-Dip или D-Bal; или
A4 обозначает 2-Thi, 3-Thi, Orn, 2-Pal, 3-Pal или 4-Pal;
или его фармацевтически приемлемой соли.
В следующем аспекте данное изобретение предлагает предпочтительное соединение формулы (II), где:
A1 обозначает Aib, Apc или H-Inp;
A2 обозначает D-Bal, D-Bip, D-Bpa, D-Dip, D-1-Nal, D-2-Nal, D-Ser(Bzl) или D-Trp;
A3 обозначает D-Bal, D-Bpa, D-Dip, D-1-Nal, D-2-Nal или D-Trp;
A4 обозначает Orn, 3-Pal, 4-Pal, Pff, Phe, Pim, Taz, 2-Thi или Thr(Bzl); и
A5 обозначает Apc, Lys или исключен;
или его фармацевтически приемлемую соль.
В следующем аспекте, связанном с предыдущей группой соединений, данное изобретение предлагает предпочтительное соединение формулы (II), где:
A1 обозначает Apc или H-Inp;
A2 обозначает D-Bal, D-Bip, D-1-Nal или D-2-Nal;
A3 обозначает D-Bal, D-1-Nal, D-2-Nal или D-Trp;
A4 обозначает 3-Pal, 4-Pal, Pff, Phe, Pim, Taz, 2-Thi или Thr(Bzl);
или его фармацевтически приемлемую соль.
В следующем аспекте данное изобретение предлагает группу предпочтительных соединений формулы (I), включающую:
Inp-D-2-Nal-D-Trp-Phe-Lys-NH2; Пример 2
H-Inp-D-1-Nal-D-Trp-3-Pal-Lys-NH2; Пример 50
H-Inp-D-2-Nal-D-Trp-4-Pal-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Orn-Lys-NH2; Пример 116
H-Inp-D-Bip-D-Trp-Phe-Lys-NH2; Пример 66
H-Inp-D-2-Nal-D-Trp-Thr(Bzl)-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-Lys-NH2; Пример 100
H-Inp-D-2-Nal-D-Trp-2-Thi-Lys-NH2; Пример 15
H-Inp-D-2-Nal-D-Trp-Taz-Lys-NH2; Пример 37
H-Inp-D-Dip-D-Trp-Phe-Lys-NH2; Пример 105
H-Inp-D-Bpa-D-Trp-Phe-Lys-NH2; Пример 109
H-Inp-D-2-Nal-D-Bpa-Phe-Lys-NH2; Пример 118
H-Inp-D-2-Nal-D-Trp-3-Pal-NH2; Пример 93
H-Inp-D-2-Nal-D-Trp-4-Pal-NH2; Пример 112
H-Inp-D-1-Nal-D-Trp-3-Pal-NH2; Пример 97
H-Inp-D-Bip-D-Trp-Phe-NH2; Пример 98
H-Inp-D-2-Nal-D-Trp-Thr(Bzl)-NH2; Пример 87
H-Inp-D-2-Nal-D-Trp-Pff-NH2; Пример 103
H-Inp-D-2-Nal-D-Trp-2-Thi-NH2; Пример 84
H-Inp-D-2-Nal-D-Trp-Taz-NH2; Пример 90
H-Inp-D-Dip-D-Trp-Phe-NH2; Пример 111
H-Inp-D-2-Nal-D-Dip-Phe-NH2; Пример 110
H-Inp-D-Bal-D-Trp-Phe-NH2; Пример 78
H-Inp-D-2-Nal-D-Bal-Phe-NH2; Пример 101
H-Inp-D-2-Nal-D-Trp-3-Pal-Lys-NH2; Пример 71
H-Inp-D-Trp-D-2-Nal(Ψ)-Pim; Пример 115
H-Inp-D-Bal-D-Trp-2-Thi-Lys-NH2; Пример 12
H-Inp-D-Bal-D-Trp-Phe-Lys-NH2; Пример 5
H-Inp-D-1-Nal-D-Trp-2-Thi-Lys-NH2; Пример 3
H-Inp-D-2-Nal-D-Trp-Phe-Apc-NH2; Пример 28
H-Inp-D-1-Nal-D-Trp-Phe-Apc-NH2; Пример 6
H-Inp-D-Bal-D-Trp-Phe-Apc-NH2; Пример 19
H-Apc-D-2-Nal-D-Trp-Phe-Lys-NH2; Пример 11
H-Apc-D-1-Nal-D-Trp-2-Thi-Lys-NH2; Пример 1
H-Inp-D-1-Nal-D-Trp-2-Thi-NH2; Пример 39
H-Apc-D-1-Nal-D-Trp-Phe-NH2; Пример 31
H-Inp-D-2-Nal-D-Trp(Ψ)-Pim; Пример 113
H-Inp-D-1-Nal-D-Trp(Ψ)-Pim; Пример 107
H-Inp-D-Bal-D-Trp(Ψ)-Pim; Пример 106
H-Aib-D-Ser(Bzl)-D-Trp(Ψ)-Pim; Пример 119
H-Inp-D-1-Nal-D-Trp-Taz-Lys-NH2; Пример 57
H-Inp-D-Bal-D-Trp-Taz-Lys-NH2; Пример 23
H-Apc-D-1-Nal-D-Trp-Taz-Lys-NH2; Пример 14
H-Apc-D-Bal-D-Trp-Taz-Lys-NH2; Пример 20
H-Apc-D-Bal-D-Trp-2-Thi-Lys-NH2; Пример 7
H-Apc-D-Bal-D-Trp-Phe-Lys-NH2; Пример 4
H-Apc-D-lNal-D-Trp-Phe-Apc-NH2; Пример 18
H-Apc-D-Bal-D-Trp-Phe-Apc-NH2; Пример 33
H-Apc-D-1-Nal-D-1-Nal-Phe-Apc-NH2; Пример 74
H-Apc-D-1-Nal-D-2-Nal-Phe-Apc-NH2; Пример 73
H-Apc-D-1-Nal-D-1-Nal-Phe-Lys-NH2; Пример 64
H-Apc-D-Bal-D-1-Nal-Phe-Apc-NH2; Пример 83
H-Apc-D-Bal-D-2-Nal-Phe-Apc-NH2; Пример 69
H-Apc-D-Bal-D-1-Nal-Phe-Lys-NH2;
H-Apc-D-Bal-D-2-Nal-Phe-Lys-NH2; Пример 30
H-Apc-D-1-Nal-D-Trp-2-Thi-NH2; Пример 34
H-Apc-D-Bal-D-Trp-Phe-NH2; Пример 41
H-Apc-D-1-Nal-D-Trp-Taz-NH2; Пример 67
H-Apc-D-Bal-D-Trp-2-Thi-NH2; Пример 47
H-Apc-D-Bal-D-Trp-Taz-NH2; Пример 72
H-Apc-D-2-Nal-D-Trp-2-Thi-NH2; Пример 45
H-Apc-D-2-Nal-D-Trp-Taz-NH2; Пример 77
H-Inp-D-1-Nal-D-Trp-Taz-Apc-NH2; Пример 60
H-Inp-D-Bal-D-Trp-Taz-Apc-NH2; Пример 38
H-Apc-D-1-Nal-D-Trp-Taz-Apc-NH2; Пример 46
H-Apc-D-Bal-D-Trp-Taz-Apc-NH2; Пример 58
H-Apc-D-1-Nal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-NH2;
H-Apc-D-1-Nal-D-Trp-2-Pal-NH2;
H-Apc-D-1-Nal-D-Trp-3-Pal-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-NH2;
H-Apc-D-1-Nal-D-Trp-4-Pal-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-NH2;
H-Apc-D-2-Nal-D-Trp-2-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-3-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-NH2;
H-Apc-D-2-Nal-D-Trp-4-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-Lys-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-Apc-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-Lys-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-NH2;
H-Apc-D-Bal-D-Bal-2-Pal-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-Apc-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-Lys-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-NH2;
H-Apc-D-Bal-D-Bal-3-Pal-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-Apc-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-Lys-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-NH2;
H-Apc-D-Bal-D-Bal-4-Pal-NH2;
H-Apc-D-Bal-D-Bal-Pff-Apc-NH2;
H-Apc-D-Bal-D-Bal-Pff-Lys-NH2;
H-Apc-D-Bal-D-Bal-Pff-NH2;
H-Apc-D-Bal-D-Bal-Phe-Apc-NH2;
H-Apc-D-Bal-D-Bal-Phe-Lys-NH2;
H-Apc-D-Bal-D-Bal-Phe-NH2;
H-Apc-D-Bal-D-Bal-Taz-Apc-NH2;
H-Apc-D-Bal-D-Bal-Taz-Lys-NH2;
H-Apc-D-Bal-D-Bal-Taz-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-NH2;
H-Apc-D-Bal-D-Trp-2-Pal-NH2;
H-Apc-D-Bal-D-Trp-3-Pal-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-NH2;
H-Apc-D-Bal-D-Trp-4-Pal-NH2;
H-Apc-D-Bal-D-Trp-Pff-Apc-NH2;
H-Apc-D-Bal-D-Trp-Pff-Lys-NH2;
H-Apc-D-Bal-D-Trp-Pff-NH2;
H-Inp-D-1-Nal-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-2-Fua-NH2;
H-Inp-D-1-Nal-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Pff-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Pff-NH2;
H-Inp-D-l~Nal-D-Bal-Phe-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Taz-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Taz-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-NH2;
H-Inp-D-1-Nal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-NH2;
H-Inp-D-1-Nal-D-Trp-Taz-NH2;
H-Inp-D-2-Nal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-2-Fua-NH2;
H-Inp-D-2-Nal-D-Trp-2-Thi-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-3-Thi-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-NH2;
H-Inp-D-Bal-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-Bal-D-Bal-2-Fua-NH2;
H-Inp-D-Bal-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-Bal-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-Bal-D-Bal-Pff-Lys-NH2;
H-Inp-D-Bal-D-Bal-Pff-NH2;
H-Inp-D-Bal-D-Bal-Phe-Lys-NH2;
H-Inp-D-Bal-D-Bal-Taz-Lys-NH2;
H-Inp-D-Bal-D-Bal-Taz-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-NH2;
H-Inp-D-Bal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-Bal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-Bal-D-Trp-Pff-Apc-NH2;
H-Inp-D-Bal-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bal-D-Trp-Pff-NH2;
H-Inp-D-Bal-D-Trp-Taz-NH2;
H-Inp-D-Bip-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-Bip-D-Bal-2-Fua-NH2;
H-Inp-D-Bip-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-Bip-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-Bip-D-Bal-Pff-Lys-NH2;
H-Inp-D-Bip-D-Bal-Pff-NH2; или
H-Inp-D-Bip-D-Bal-Taz-Lys-NH2;
H-Inp-D-Bip-D-Bal-Taz-NH2;
H-Inp-D-Bip-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-Bip-D-Trp-2-Fua-NH2;
H-Inp-D-Bip-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-Bip-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-Bip-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bip-D-Trp-Pff-NH2;
H-Inp-D-Bip-D-Trp-Taz-Lys-NH2; или
H-Inp-D-Bip-D-Trp-Taz-NH2;
H-Inp-D-1-Nal-D-Trp-3-Pal-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-4-Pal-Lys-NH2; Пример 91
H-Inp-D-2-Nal-D-Trp-Orn-Lys-NH2;
H-Inp-D-Bip-D-Trp-Phe-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Thr(Bzl)-Lys-NH2; Пример 70
H-Inp-D-2-Nal-D-Trp-Pff-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-Lys-NH2;
H-Inp-D-Dip-D-Trp-Phe-Lys-NH2;
H-Inp-D-Bpa-D-Trp-Phe-Lys-NH2;
H-Inp-D-2-Nal-D-Bpa-Phe-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Thr(Bzl)-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-NH2;
H-Inp-D-2-Nal-D-Dip-Phe-NH2;
H-Inp-D-2-Nal-D-Trp-3-Pal-Lys-NH2;
H-Inp-D-Trp-D-2-Nal(Ψ)-Pim;
H-Inp-D-Bal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-Bal-D-Trp-Phe-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-2-TM-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Phe-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-Phe-Apc-NH2;
H-Inp-D-Bal-D-Trp-Phe-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Phe-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-2-Nal-D-Trp(Ψ)-Pim;
H-Inp-D-1-Nal-D-Trp(ΨW)-Pim;
H-Inp-D-Bal-D-Trp(Ψ)-Pim;
H-Aib-D-Ser(Bzl)-D-Trp(Ψ)-Pim;
H-Inp-D-1-Nal-D-Trp-Taz-Lys-NH2;
H-Inp-D-Bal-D-Trp-Taz-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-Taz-Lys-NH2;
H-Apc-D-Bal-D-Trp-Taz-Lys-NH2;
H-Apc-D-Bal-D-Trp-2-Thi-Lys-NH2;
H-Apc-D-Bal-D-Trp-Phe-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-Phe-Apc-NH2;
H-Apc-D-Bal-D-Trp-Phe-Apc-NH2;
H-Apc-D-1-Nal-D-1-Nal-Phe-Apc-NH2;
H-Apc-D-1-Nal-D-2-Nal-Phe-Apc-NH2;
H-Apc-D-1-Nal-D-1-Nal-Phe-Lys-NH2;
H-Apc-D-Bal-D-1-Nal-Phe-Apc-NH2;
H-Apc-D-Bal-D-2-Nal-Phe-Apc-NH2;
H-Apc-D-Bal-D-1-Nal-Phe-Lys-NH2;
H-Apc-D-Bal-D-2-Nal-Phe-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-2-Thi-NH2;
H-Apc-D-Bal-D-Trp-Phe-NH2;
H-Apc-D-1-Nal-D-Trp-Taz-NH2;
H-Apc-D-Bal-D-Trp-2-Thi-NH2;
H-Apc-D-Bal-D-Trp-Taz-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-NH2;
H-Inp-D-1-Nal-D-Trp-Taz-Apc-NH2;
H-Inp-D-Bal-D-Trp-Taz-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-Taz-Apc-NH2;
H-Apc-D-Bal-D-Trp-Taz-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-Bal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-Bal-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-Bal-D-Trp-Pff-Apc-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-Bal-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bal-D-Bal-Phe-Lys-NH2;
H-Inp-D-Bal-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-Bal-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-Bal-D-Bal-Taz-Lys-NH2;
H-Inp-D-Bal-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-Bal-D-Bal-Pff-Lys-NH2;
H-Apc-D-Bal-D-Bal-Phe-Lys-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-Lys-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-Lys-NH2;
H-Apc-D-Bal-D-Bal-Taz-Lys-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-Lys-NH2;
H-Apc-D-Bal-D-Bal-Pff-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Phe-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Taz-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Pff-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-2-Thi-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bip-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-Bip-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-Bip-D-Trp-Taz-Lys-NH2;
H-Inp-D-Bip-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-Bip-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bip-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-Bip-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-Bip-D-Bal-Taz-Lys-NH2;
H-Inp-D-Bip-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-Bip-D-Bal-Pff-Lys-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-Bal-D-Trp-Pff-Apc-NH2;
H-Apc-D-Bal-D-Bal-Phe-Apc-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-Apc-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-Apc-NH2;
H-Apc-D-Bal-D-Bal-Taz-Apc-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-Apc-NH2;
H-Apc-D-Bal-D-Bal-Pff-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-Apc-NH2;
H-Inp-D-Bal-D-Trp-Taz-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-NH2;
H-Inp-D-Bal-D-Trp-Pff-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-NH2;
H-Apc-D-Bal-D-Trp-Pff-NH2;
H-Apc-D-Bal-D-Trp-4-Pal-NH2;
H-Apc-D-Bal-D-Trp-3-Pal-NH2;
H-Apc-D-Bal-D-Trp-2-Pal-NH2;
H-Inp-D-Bal-D-Bal-Taz-NH2;
H-Inp-D-Bal-D-Bal-2-Fua-NH2;
H-Inp-D-Bal-D-Bal-Pff-NH2;
H-Apc-D-Bal-D-Bal-Phe-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-NH2;
H-Apc-D-Bal-D-Bal-Taz-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-NH2;
H-Apc-D-Bal-D-Bal-Pff-NH2;
H-Apc-D-Bal-D-Bal-4-Pal-NH2;
H-Apc-D-Bal-D-Bal-3-Pal-NH2;
H-Apc-D-Bal-D-Bal-2-Pal-NH2;
H-Inp-D-1-Nal-D-Trp-Taz-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-NH2;
H-Inp-D-1-Nal-D-Bal-Taz-NH2;
H-Inp-D-1-Nal-D-Bal-2-Fua-NH2;
H-Inp-D-1-Nal-D-Bal-Pff-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-NH2;
H-Inp-D-2-Nal-D-Trp-2-Fua-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-NH2;
H-Apc-D-1-Nal-D-Trp-4-Pal-NH2;
H-Apc-D-1-Nal-D-Trp-3-Pal-NH2;
H-Apc-D-1-Nal-D-Trp-2-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-NH2;
H-Apc-D-2-Nal-D-Trp-4-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-3-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-2-Pal-NH2;
H-Inp-D-Bip-D-Trp-Taz-NH2;
H-Inp-D-Bip-D-Trp-2-Fua-NH2;
H-Inp-D-Bip-D-Trp-Pff-NH2;
H-Inp-D-Bip-D-Bal-Taz-NH2;
H-Inp-D-Bip-D-Bal-2-Fua-NH2; или
H-Inp-D-Bip-D-Bal-Pff-NH2;
H-Inp-D-1-Nal-D-Trp-2-Thi-Apc-NH2; Пример 24
H-Inp-D-Bal-D-Trp-2-Thi-Apc-NH2; Пример 9
H-Apc-D-1-Nal-D-Trp-2-Thi-Apc-NH2; Пример 17
H-Apc-D-Bal-D-Trp-2-Thi-Apc-NH2; Пример 22 или
H-Apc-D-1-Nal-D-Trp-Phe-Lys-NH2; Пример 13,
или их фармацевтически приемлемые соли.
В следующем аспекте данное изобретение предлагает способ лечения желудочно-кишечных состояний, таких как гастроэзофагеальная рефлюксная болезнь, IBS, констипация, кишечная непроходимость, рвота, парез желудка, псевдонепроходимость толстой кишки и т.п., путем введения терапевтически эффективного количества пептидильного аналога грелина формулы (III):
где
A1 обозначает Gly, Aib, Ala, β-Ala, Acc или Gly(миристил);
A2 обозначает Ser, Aib, Ala, Acc, Abu, Act, Ava, Thr или Val;
A3 обозначает Ser, Ser(C(O)-R4), Asp(О-R8), Asp(NH-R9), Cys(S-R14), Dap(S(O)2-R10), Dab(S(O)2-R11), Glu(O-R6), Glu(NH-R7), Thr(C(O)-R5) или HN-CH((CH2)n-N(R12R13))-C(O);
A4 обозначает Phe, Acc, Aic, Cha, 2-Fua, 1-Nal, 2-Nal, 2-Pal, 3-Pal, 4-Pal, hPhe, (X1,X2,X3,X4,X5)Phe, Taz, 2-Thi, 3-Thi, Trp или Tyr;
A5 обозначает Leu, Abu, Acс, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle или Val;
A6 обозначает Ser, Abu, Acc, Act, Aib, Ala, Gly, Thr или Val;
A7 обозначает Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz или Tic;
A8 обозначает Glu, Acс, Aib, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn или HN-CH((CH2)n-N(R12R13))-C(O);
A9 обозначает His, Apc, Aib, Acc, 2-Fua, 2-Pal, 3-Pal, 4-Pal, Taz, 2-Thi, 3-Thi или (X1,X2,X3,X4,X5)Phe;
A10 обозначает Gln, Acс, Aib, Asn, Asp или Glu;
A11 обозначает Arg, Apc, hArg, Dab, Dap, Lys, Orn или HN-CH((CH2)n-N(R12R13))-C(O);
A12 обозначает Val, Abu, Acс, Aib, Ala, Cha, Nva, Gly, Ile, Leu, Nle, Tle или Cha;
A13 обозначает Gln, Acс, Aib, Asn, Asp или Glu;
A14 обозначает Gln, Acс, Aib, Asn, Asp или Glu;
A15 обозначает Arg, hArg, Acс, Aib, Apc, Dab, Dap, Lys, Orn, Ser(C(O)-R4), Thr(C(O)-R5), Glu(O-R6), Glu(NH-R7), Asp(О-R8), Asp(NH-R9), Dap(S(O)2-R10), Dab(S(O)2-R11), HN-CH((CH2)n-N(R12R13))-C(O), Cys(S-R14), Cys(R15), hCys(S-R16) или hCys(R17);
A16 обозначает Lys, Acс, Aib, Apc, Arg, hArg, Dab, Dap, Orn, Ser(C(O)-R4), Thr(C(O)-R5), Glu(O-R6), Glu(NH-R7), Asp(O-R8), Asp(NH-R9), Dap(S(O)2-R10), Dab(S(O)2-R11), HN-CH((CH2)n-N(R12R13))-C(O), Cys(S-R14), Cys(R15), hCys(S-R16), hCys(R17) или исключен;
A17 обозначает Glu, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn, Ser(C(O)-R4), Thr(C(O)-R5), Glu(O-R6), Glu(NH-R7), Asp(O-R8), Asp(NH-R9), Dap(S(O)2-R10), Dab(S(O)2-R11), HN-CH((CH2)n-N(R12R13))-C(O), Cys(S-R14), Cys(R15), hCys(S-R16), hCys(R17), Lys(биотинил) или исключен;
A18 обозначает Ser, Abu, Acc, Act, Aib, Ala, Thr, Val, Ser(C(O)-R4), Thr(C(O)-R5), Glu(O-R6), Glu(NH-R7), Asp(О-R8), Asp(NH-R9), Dap(S(O)2-R10), Dab(S(O)2-R11), HN-CH((CH2)n-N(R12R13))-C(O), Cys(S-R14), Cys(R15), hCys(S-R16), hCys(R17) или исключен;
A19 обозначает Lys, Acс, Aib, Apc, Arg, hArg, Dab, Dap, Orn, Ser(C(O)-R4), Thr(C(O)-R5), Glu(O-R6), Glu(NH-R7), Asp(О-R8), Asp(NH-R9), Dap(S(O)2-R10), Dab(S(O)2-R11), HN-CH((CH2)n-N(R12R13))-C(O), Cys(S-R14), Cys(R15), hCys(S-R16), hCys(R17) или исключен;
A20 обозначает Lys, Acс, Aib, Apc, Arg, hArg, Dab, Dap, Orn, Ser(C(O)-R4), Thr(C(O)-R5), Glu(O-R6), Glu(NH-R7), Asp(О-R8), Asp(NH-R9), Dap(S(O)2-R10), Dab(S(O)2-R11), HN-CH((CH2)n-N(R12R13))-C(O), Cys(S-R14), Cys(R15), hCys(S-R16), hCys(R17) или исключен;
A21 обозначает Pro, Dhp, Dmt, Inc, 3-Hyp, 4-Hyp, Ktp, Oic, Pip, Thz, Tic или исключен;
A22 обозначает Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или исключен;
A23 обозначает Abu, Acc, Act, Aib, Ala, Apc, Gly, Nva, Val или исключен;
A24 обозначает Lys, Acс, Aib, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
A25 обозначает Leu, Abu, Acс, Aib, Ala, Cha, lie, hLeu, Nle, Nva, Phe, Tle, Val или исключен;
A26 обозначает Gln, Aib, Asn, Asp, Glu или исключен;
A27 обозначает Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или исключен;
A28 обозначает Acс, Aib, Apc, Arg, hArg, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или исключен;
R1 представляет собой -OH, -NH2, -(C1-C30)алкокси или NH-X6-CH2-Z0, где X6 представляет собой (C1-C12)алкил, (C2-C12)алкенил, и Z0 представляет собой -H, -OH, -CO2H или -C(O)-NH2;
R2 и R3 в каждом случае независимо выбраны из группы, состоящей из H, (C1-C30)алкила, (C1-C30)гетероалкила, (C1-C30)ацила, (С2-С30)алкенила, (C2-C30)алкинила, арил(C1-C30)алкила, арил(C1-C30)ацила, замещенного (C1-C30)алкила, замещенного (C1-C30)гетероалкила, замещенного (C1-C30)ацила, замещенного (C2-C30)алкенила, замещенного арил(C1-C30)алкила и замещенного арил(C1-C30)ацила;
R4, R5, R6, R7, R8, R9, R10, R11, R14, R15, R16 и R17 в каждом случае независимо выбраны из группы, состоящей из (C1-C40)алкила, (С2-С40)алкенила, замещенного (C1-C40)алкила, замещенного (C2-C40)алкенила, алкиларила, замещенного алкиларила, арила и замещенного арила;
R12 и R13 в каждом случае независимо выбраны из группы, состоящей из H, (C1-C40)алкила, (C1-C40)ацила, (C1-C30)алкилсульфонила, биотинила и -C(NH)-NH2,
X1, X2, X3, X4 и X5 в каждом случае независимо выбраны из группы, состоящей из H, F, Cl, Br, I, (C1-C10)алкила, замещенного (C1-C10)алкила, арила, замещенного арила, OH, NH2, NO2 и CN; и
n в каждом случае независимо равен 1, 2, 3, 4 или 5;
при условии, что:
(I) если R2 представляет собой (C1-C30)ацил, арил(C1-C30)ацил, замещенный (C1-C30)ацил или замещенный арил(C1-C30)ацил, то R3 представляет собой H, (C1-C30)алкил, (C1-C30)гетероалкил, (C2-C30)алкенил, арил(C1-C30)алкил, замещенный (C1-C30)алкил, замещенный (C1-C30)гетероалкил, замещенный (C2-C30)алкенил или замещенный арил(C1-C30)алкил;
(II) если R12 представляет собой (C1-C40)ацил, (C1-C30)алкилсульфонил, биотинил или -C(NH)-NH2, то R13 представляет собой H или (C1-C40)алкил;
(III) по меньшей мере, один из A15, A16, A17, A18, A19 или A20 должен быть выбран из группы, состоящей из Ser(C(O)-R4), Thr(C(O)-R5), Glu(O-R6), Glu(NH-R7), Asp(О-R8), Asp(NH-R9), Dap(S(O)2-R10), Dab(S(O)2-R11), HN-CH((CH2)n-N(R12R13))-C(O), Cys(S-R14), Cys(R15), hCys(S-R16) и hCys(R17); и
(IV) если любой член группы, состоящей из A15, A16, A17, A18, A19 и A20, обозначает HN-CH((CH2)n-N(R12R13))-C(O), то R12 должен представлять собой биотинил;
или его фармацевтически приемлемой соли.
В следующем аспекте данное изобретение предлагает группу предпочтительных соединений формулы (III), где:
R2 и R3, каждый независимо, в каждом случае выбран из группы, состоящей из H, ацила, н-бутирила, изобутирила и н-октаноила;
R4 представляет собой гептил;
R6 представляет собой гексил;
R7 представляет собой гексил;
R10 представляет собой октил;
R11 представляет собой гептил; и
при условии, что, если Acс замещен одним из природных остатков, он в каждом случае независимо обозначает A3c, A4c, A5c или A6c;
или их фармацевтически приемлемые соли.
В следующем аспекте данное изобретение предлагает группу предпочтительных соединений формулы (III), включающую:
(Ser(н-октаноил)15)hгрелин(1-28)-NH2;
(Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)15)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Ser(н-октаноил)16)hгрелин(1-28)-NH2;
(Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)16)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Aib2,10 Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Dap(октансульфонил)17)hгрелин(1-28)-NH2;
(Dap(октансульфонил)3,17)hгрелин(1-28)-NH2;
(Dap(октансульфонил)3, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Dap(октансульфонил)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Dap(октансульфонил)17)hгрелин(1-28)-NH2;
(Cys(S-(CH2)9CH3)17)hгрелин(1-28)-NH2;
(Cys(S-(CH2)9CH3)3,17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Cys(S-(CH2)9CH3)17)hгрелин(1-28)-NH2;
(Cys(S-(CH2)9CH3)3, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Cys(S-(CH2)9CH3)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Aib2, Thz7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, 4-Hyp7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Dhp7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Pip7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Tic7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, Thz7)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, 4-Hyp7)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, Dhp7)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, Pip7)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, Tic7)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2; Пример 16
(Aib2, 3-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, 4-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Taz9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, 2-Thi9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, 4-Pal9)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, Taz9)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, 2-Thi9)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Aib8, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Taz9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(3-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(4-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(2-Thi9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17, Aib8)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17, Taz9)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17, 3-Pal9)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17, 4-Pal9)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17, 2-Thi9)hгрелин(1-28)-NH2;
(Aib1,2,10, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib1,2,10, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(A5c2, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(A5c2, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Glu(1-гептанол)3,17)hгрелин(1-28)-NH2;
(Asp(1-гептанол)3,17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Asp(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Lys(биотинил)17)hгрелин(1-28)-NH2;
(Ser(н-октаноил)18)hгрелин(1-28)-NH2;
(Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)18)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Ser(н-октаноил)19)hгрелин(1-28)-NH2;
(Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)19)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Ser(н-октаноил)20)hгрелин(1-28)-NH2;
(Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)20)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Dap(октансульфонил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Dap(октансульфонил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Dap(октансульфонил)3, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Dap(октансульфонил)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Dap(октансульфонил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Cys(S-(CH2)9CH3)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Cys(S-(CH2)9CH3)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Cys(S-(CH2)9CH3)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Cys(S-(CH2)9CH3)3, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Cys(S-(CH2)9CH3)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Thz7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, 4-Hyp7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Dhp7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Pip7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Tic7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, Thz7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, 4-Hyp7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, Dhp7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, Pip7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, Tic7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, 3-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, 4-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Taz9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, 2-Thi9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, 3-Pal9)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, 4-Pal9)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, Taz9)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, 2-Thi9)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib8, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Taz9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, 3-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, 4-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, 2-Thi9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17, Aib8)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17, Taz9)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17, 3-Pal9)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17, 4-Pal9)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17, 2-Thi9)hгрелин(1-28)-NH2;
(Ac-Aib1, Aib2,10, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Aib1, Aib2,10, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, A5c2, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, A5c2, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(1-гептанол)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Asp(1-гептанол)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Asp(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3, Lys(биотинил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
или их фармацевтически приемлемые соли.
В следующем аспекте данное изобретение предлагает способ лечения желудочно-кишечных состояний, таких как гастроэзофагеальная рефлюксная болезнь, IBS, констипация, кишечная непроходимость, рвота, парез желудка, псевдонепроходимость толстой кишки и т.п., путем введения терапевтически эффективного количества указанных ниже пептидильных аналогов грелина, которые не соответствуют формулам (I), (II) или (III):
(Asp3(NH-гептил))hгрелин(1-28)-NH2 Пример 86
(des-Ser2)hгрелин(1-28)-NH2; Пример 104
(des-Gly1, Des-Ser2)hгрелин(1-28)-NH2; Пример 117
(Aib1)hгрелин(1-28)-NH2; Пример 6
(Asp3(О-гексил))hгрелин(1-28)-NH2; Пример 40
(Aib1, Ser3)hгрелин(1-28)-NH2;
(А5c5, Ser3)hгрелин(1-28)-NH2;
(Aib2,4, Ser3, 4-Pal9)hгрелин(1-28)-NH2;
(н-октаноил-Gly1, Ser3)hгрелин(1-28)-NH2;
(изобутирил-Gly1, Ser3)hгрелин(1-28)-NH2;
(н-бутирил-Gly1, Ser3)hгрелин(1-28)-NH2;
(Aib1, Thr3)hгрелин(1-28)-NH2;
(Aib2,4, Thr3, 4-Pal9)hгрелин(1-28)-NH2;
(н-октаноил-Gly1, Thr3)hгрелин(1-28)-NH2;
(изобутирил-Gly1, Thr3)hгрелин(1-28)-NH2;
(н-бутирил-Gly1, Thr3)hгрелин(1-28)-NH2;
(Ac-Gly1)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser3)hгрелин(1-28)-NH2,
Aib2, Lys(миристил)17)hгрелин-(1-28)-NH2 или
Gly(миристил)1-(Aib2, Lys(миристил)17]hгрелин-(1-28)-NH2;
или их фармацевтически приемлемых солей.
Пептидильный аналог грелина или его пролекарство можно вводить парентерально, например путем внутривенного или подкожного введения, или путем имплантации композиции с замедленным высвобождением. Пептидильный аналог грелина также можно вводить путем интрацеребровентрикулярной (icv) инъекции. В другом варианте осуществления пептидильный аналог грелина вводят перорально. Особенно предпочтительными пептидильными аналогами грелина являются соединения формулы (I), (II) или (III), а также указанные выше соединения, которые не соответствуют данным формулам, и соединения, отдельно перечисленные в данном разделе и в разделе Примеры настоящего описания, или их фармацевтически приемлемые соли.
Соответственно, в одном аспекте данное изобретение включает способ лечения кишечной непроходимости у пациента, который предусматривает диагностирование пациента, страдающего от кишечной непроходимости или имеющего риск кишечной непроходимости, и введение пациенту фармацевтической композиции, содержащей эффективное количество пептидильного аналога грелина. Особенно предпочтительными пептидильными аналогами грелина являются соединения формулы (I), (II) или (III), а также указанные выше соединения, которые не соответствуют данным формулам, и соединения, отдельно перечисленные в данном разделе и в разделе Примеры настоящего описания, или их фармацевтически приемлемые соли.
В другом аспекте данное изобретение включает способ лечения послеоперационной кишечной непроходимости у пациента. Данный способ предусматривает диагностирование пациента, страдающего от послеоперационной кишечной непроходимости, и введение пациенту фармацевтической композиции, содержащей пептидильный аналог грелина в количестве, эффективном для лечения кишечной непроходимости у пациента. Кишечная непроходимость может быть связана с любым участком желудочно-кишечного тракта, например с желудком, тонким кишечником и/или толстым кишечником (например, с ободочной кишкой). Фармацевтическую композицию можно вводить с помощью любого описанного в данном описании способа, например путем ингаляции (газообразных композиций); перорально и/или путем непосредственного введения в брюшную полость пациента. Особенно предпочтительными пептидильными аналогами грелина являются соединения формулы (I), (II) или (III), а также указанные выше соединения, которые не соответствуют данным формулам, и соединения, отдельно перечисленные в данном разделе и в разделе Примеры настоящего описания, или их фармацевтически приемлемые соли.
Данное изобретение также включает способ лечения кишечной непроходимости у пациента, страдающего от кишечной непроходимости или имеющего риск кишечной непроходимости, не связанной с хирургией брюшной полости, например кишечной непроходимости, вызванной любым из описанных в данном описании факторов, отличных от хирургии брюшной полости. Данный способ предусматривает диагностирование пациента, страдающего от послеоперационной кишечной непроходимости или имеющего риск кишечной непроходимости, не связанной с хирургией брюшной полости, и введение пациенту фармацевтической композиции, содержащей пептидильный аналог грелина в количестве, эффективном для лечения кишечной непроходимости у пациента. Особенно предпочтительными пептидильными аналогами грелина являются соединения формулы (I), (II) или (III), а также указанные выше соединения, которые не соответствуют данным формулам, и соединения, отдельно перечисленные в данном разделе и в разделе Примеры настоящего описания, или их фармацевтически приемлемые соли.
В следующем аспекте данное изобретение предлагает способ проведения хирургической операции у пациента. Данный способ предусматривает диагностирование пациента, нуждающегося в хирургической операции, и введение пациенту до, в процессе и/или после хирургической операции эффективного количества пептидильного аналога грелина, достаточного для лечения кишечной непроходимости у пациента. Хирургическая операция представляет собой любую хирургическую операцию, вызывающую у пациента кишечную непроходимость и/или состояние риска кишечной непроходимости. Например, хирургическая операция может представлять собой манипулирование (например, контактирование (прямо или косвенно)) с желудочно-кишечным трактом, например с желудком и/или кишечником, например тонким или толстым кишечником (например, с ободочной кишкой), и хирургию, включающую или не включающую лапаротомию (например, хирургические операции с использованием лапароскопии). В некоторых вариантах осуществления хирургическая операция может представлять собой трансплантационную или нетрансплантационную операцию, например, хирургическую операцию на каких-либо органе (органах) или ткани (тканях) брюшной полости, например хирургию мочеполовой системы (например, почек, мочеточника и/или мочевого пузыря; и репродуктивных органов (например, матки, яичников и/или фаллопиевых труб)); пищеварительной системы (например, желудка, тонкого кишечника, толстого кишечника (например, ободочной кишки), аппендикса, желчного пузыря, печени, селезенки и/или поджелудочной железы); лимфатической системы; дыхательной системы (например, легких); диафрагмы; хирургия с целью лечения рака какого-либо органа или ткани брюшной полости; хирургия эндометрия; и ортопедическая хирургия, например хирургия тазобедренного сустава. Особенно предпочтительными пептидильными аналогами грелина являются соединения формулы (I), (II) или (III), а также указанные выше соединения, которые не соответствуют данным формулам, и соединения, отдельно перечисленные в данном разделе и в разделе Примеры настоящего описания, или их фармацевтически приемлемые соли.
В следующем аспекте данное изобретение предлагает способ лечения кишечной непроходимости у пациента, который предусматривает диагностирование пациента, страдающего от кишечной непроходимости или имеющего риск кишечной непроходимости, и введение пациенту количества пептидильного аналога грелина, эффективного для лечения или профилактики кишечной непроходимости. Особенно предпочтительными пептидильными аналогами грелина являются соединения формулы (I), (II) или (III), а также указанные выше соединения, которые не соответствуют данным формулам, и соединения, отдельно перечисленные в данном разделе и в разделе Примеры настоящего описания, или их фармацевтически приемлемые соли.
В другом аспекте данное изобретение включает способ лечения рвоты у пациента, который предусматривает диагностирование пациента, страдающего от рвоты или имеющего риск рвоты, и введение пациенту фармацевтической композиции, содержащей эффективное количество пептидильного аналога грелина. Особенно предпочтительными пептидильными аналогами грелина являются соединения формулы (I), (II) или (III), а также указанные выше соединения, которые не соответствуют данным формулам, и соединения, отдельно перечисленные в данном разделе и в разделе Примеры настоящего описания, или их фармацевтически приемлемые соли.
В следующем аспекте настоящее изобретение включает способ лечения у пациента рвоты, вызванной введением противораковых химиотерапевтических средств или связанной с введением таких средств, который предусматривает диагностирование пациента, страдающего от рвоты, вызванной введением противораковых химиотерапевтических средств или связанной с введением таких средств, или имеющего риск такой рвоты, и введение пациенту фармацевтической композиции, содержащей терапевтически эффективное количество пептидильного аналога грелина. Особенно предпочтительными пептидильными аналогами грелина являются соединения формулы (I), (II) или (III), а также указанные выше соединения, которые не соответствуют данным формулам, и соединения, отдельно перечисленные в данном разделе и в разделе Примеры настоящего описания, или их фармацевтически приемлемые соли.
В другом аспекте настоящее изобретение включает способ лечения пареза желудка у пациента, который предусматривает диагностирование пациента, страдающего от пареза желудка или имеющего риск пареза желудка, и введение пациенту фармацевтической композиции, содержащей эффективное количество пептидильного аналога грелина. Особенно предпочтительными пептидильными аналогами грелина являются соединения формулы (I), (II) или (III), а также указанные выше соединения, которые не соответствуют данным формулам, и соединения, отдельно перечисленные в данном разделе и в разделе Примеры настоящего описания, или их фармацевтически приемлемые соли.
В следующем аспекте настоящее изобретение включает способ лечения у пациента пареза желудка, вызванного диабетом, который предусматривает диагностирование пациента, страдающего от диабетического пареза желудка или имеющего риск диабетического пареза желудка, и введение пациенту фармацевтической композиции, содержащей эффективное количество пептидильного аналога грелина. Диабет может представлять собой диабет типа I или диабет типа II. Особенно предпочтительными пептидильными аналогами грелина являются соединения формулы (I), (II) или (III), а также указанные выше соединения, которые не соответствуют данным формулам, и соединения, отдельно перечисленные в данном разделе и в разделе Примеры настоящего описания, или их фармацевтически приемлемые соли.
В другом аспекте настоящее изобретение предлагает применение терапевтически эффективного количества пептидильных аналогов грелина формул (I), (II) или (III), как определено выше, а также указанных выше соединений, которые не соответствуют данным формулам, и соединений, отдельно перечисленных в данном разделе настоящего описания и ниже, или их фармацевтически приемлемых солей, для производства лекарственного средства, которое можно использовать для лечения таких состояний желудочно-кишечного тракта, как гастроэзофагеальная рефлюксная болезнь, IBS, констипация, кишечная непроходимость, рвота, парез желудка, псевдонепроходимость толстой кишки и т.п. В следующем варианте осуществления подлежащие лечению состояния желудочно-кишечного тракта включают кишечную непроходимость, рвоту и парез желудка. В другом варианте осуществления кишечная непроходимость представляет собой послеоперационную кишечную непроходимость, рвота связана с введением противораковых химиотерапевтических средств, и парез желудка является следствием диабета.
В следующем аспекте настоящее изобретение предлагает способ индуцирования агонистического или антагонистического эффекта в отношении рецептора грелина у субъекта, нуждающегося в таком индуцировании, который предусматривает введение указанному субъекту эффективного количества соединений формул (I), (II) или (III), как определено выше, а также указанных выше соединений, которые не соответствуют данным формулам, и соединений, отдельно перечисленных в данном разделе настоящего описания и ниже, или их фармацевтически приемлемых солей.
Краткое описание чертежей
Фиг.1: схематическое изображение способов, используемых для анализа опорожнения желудка на крысиной модели;
Фиг.2: влияние нативного грелина и соединения примера 19 на опорожнение желудка у нормальных крыс;
Фиг.3: относительное уменьшение опорожнения желудка вследствие послеоперационной кишечной непроходимости в отсутствин лекарственных препаратов и на фоне приема морфина; и
Фиг.4: влияние нативного грелина и соединения примера 19 на опорожнение желудка на крысиной модели послеоперационной кишечной непроходимости;
Фиг.5: влияние нативного грелина и соединения примера 19 на опорожнение желудка на крысиной модели послеоперационной кишечной непроходимости, получающей морфин;
Фиг.6: влияние соединений примеров 9, 19, 28 и 38 на опорожнение желудка на крысиной модели послеоперационной кишечной непроходимости, получающей морфин.
Подробное описание изобретения
Если не указано иное, все технические и научные термины, используемые в данном описании, имеют значения, традиционно используемые специалистами в области, к которой относится данное изобретение. Подходящие способы и вещества описаны ниже, хотя при осуществлении или тестировании настоящего изобретения можно использовать способы и материалы, подобные или эквивалентные описанным в данном описании. Все указанные публикации, патентные заявки, патенты и другие ссылки включены в данное описание в качестве ссылки во всей полноте. В случае конфликта, настоящее описание, включая определения, будет иметь преимущественную силу. Материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Другие признаки и преимущества данного изобретения станут ясны из нижеследующего описания предпочтительных вариантов осуществления и формулы изобретения. В соединениях данного изобретения могут присутствовать следующие аминокислоты:
Номенклатура и сокращения
 р
р

Если на С-конце соединения данного изобретения присутствует имидазольный фрагмент, не являющийся аминокислотой (например, определенный выше Pim), само собой разумеется, что имидазольный фрагмент присоединен к соседней аминокислоте посредством псевдопептидной связи (Ψ), образованной атомом углерода в положении 2 имидазольного кольца и альфа-атомом углерода аминокислоты. Например, если соседняя аминокислота представляет собой D-триптофан (D-Trp), и имидазольный фрагмент представляет собой Pim, C-концевой фрагмент пептида имеет следующую структуру:

В данном описании Acc представляет собой аминокислоту, выбранную из группы, состоящей из
1-амино-1-циклопропанкарбоновой кислоты (A3c);
1-амино-1-циклобутанкарбоновой кислоты (A4c);
1-амино-1-циклопентанкарбоновой кислоты (A5c);
1-амино-1-циклогексанкарбоновой кислоты (A6c);
1-амино-1-циклогептанкарбоновой кислоты (A7c);
1-амино-1-циклооктанкарбоновой кислоты (A8c) и
1-амино-1-циклононанкарбоновой кислоты (A9c).
В данном описании термин "пептидильный аналог грелина" охватывает аналоги грелина и их пептидильные аналоги, которые могут использоваться в терапевтическом способе настоящего изобретения и включают, но без ограничения, следующие соединения:
(Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, A6c5)hгрелин(1-28)-NH2;
(A6c5)hгрелин(1-28)-NH2;
(Aib2,6)hгрелин(1-28)-NH2;
(Aib2, A5c12)hгрелин(1-28)-NH2;
(Aib2, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Act6)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Dmt7)hгрелин(1-28)-NH2;
(Aib2, Thz7)hгрелин(1-28)-NH2;
(A5c2)hгрелин(1-28)-NH2;
(Act2)hгрелин(1-28)-NH2;
(Aib2, A5c5)hгрелин(1-28)-NH2;
(Aib2, A6c5)hгрелин(1-28)-NH2;
(Aib2,5)hгрелин(1-28)-NH2;
(Aib2, hLeu5)hгрелин(1-28)-NH2;
(Aib2, Cha5)hгрелин(1-28)-NH2;
(Aib2,6)hгрелин(1-28)-NH2;
(Aib2, Act6)hгрелин(1-28)-NH2;
(Aib2, Thr6)hгрелин(1-28)-NH2;
(Aib2, Abu6)hгрелин(1-28)-NH2;
(Aib2, 4Hyp7)hгрелин(1-28)-NH2;
(Aib2, Thz7)hгрелин(1-28)-NH2;
(Aib2, Pip7)hгрелин(1-28)-NH2;
(Aib2, Dhp7)hгрелин(1-28)-NH2;
(Aib2, Ktp7)hгрелин(1-28)-NH2;
(Aib2,8)hгрелин(1-28)-NH2;
(Aib2, 2-Pal9)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, 4-Pal9)hгрелин(1-28)-NH2;
(Aib2, Taz9)hгрелин(1-28)-NH2;
(Aib2, 2-Thi9)hгрелин(1-28J-NH2;
(Aib2, 2-Fua9)hгрелин(1-28)-NH2;
(Aib2, Apc9)hгрелин(1-28)-NH2;
(Aib2,9)hгрелин(1-28)-NH2;
(Aib2,10)hгрелин(1-28)-NH2;
(Aib2, Tic7)hгрелин(1-28)-NH2;
(Aib6)hгрелин(1-28)-NH2;
(A5c5)hгрелин(1-28)-NH2;
(A6c5)hгрелин(1-28)-NH2;
(Act6)hгрелин(1-28)-NH2;
(3-Pal9)hгрелин(1-28)-NH2;
(Dmt7)hгрелин(1-28)-NH2;
(Thz7)hгрелин(1-28)-NH2;
(Aib5)hгрелин(1-28)-NH2;
(hLeu5)hгрелин(1-28)-NH2;
(Cha5)hгрелин(1-28)-NH2;
(Thr6)hгрелин(1-28)-NH2;
(Abu6)hгрелин(1-28)-NH2;
(4Hyp7)hгрелин(1-28)-NH2;
(Pip7)hгрелин(1-28)-NH2;
(Dhp7)hгрелин(1-28)-NH2;
(Ktp7)hгрелин(1-28)-NH2;
(Aib8)hгрелин(1-28)-NH2;
(2-Pal9)hгрелин(1-28)-NH2;
(4-Pal9)hгрелин(1-28)-NH2;
(Taz9)hгрелин(1-28)-NH2;
(2-Thi9)hгрелин(1-28)-NH2;
(2-Fua9)hгрелин(1-28)-NH2;
(Apc9)hгрелин(1-28)-NH2;
(Aib9)hгрелин(1-28)-NH2;
(Aib10)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), A6c5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A6c5)hгрелин(1-28)-NH2;
(Aib2,6, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), A5c12)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Acr6)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Dmt7)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Thz7)hгрелин(1-28)-NH2;
(A5c2, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Act2, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), A5c5)hгрелин(1-28)-NH2;
(Aib2,5, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), hLeu5)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Cha5)hгрелин(1-28)-NH2;
(Aib2,6, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Thr6)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Abu6)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 4Hyp7)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Pip7)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Dhp7)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Ktp7)hгрелин(1-28)-NH2;
(Aib2,8, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 2-Pal9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 4-Pal9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Taz9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 2-Thi9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), 2-Fua9)hгрелин(1-28)-NH2;
(Aib2, Dap3(октансульфонил), Apc9)hгрелин(1-28)-NH2;
(Aib2,9, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Aib2,10, Dap3(октансульфонил))hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A6c5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Aib6)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c12)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Act6)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 3-Pal9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Dmt7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Thz7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Aib5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), hLeu5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Cha5)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Thr6)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Abu6)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 4Hyp7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Pip7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Dhp7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Ktp7)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Aib8)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 2-Pal9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 3-Pal9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 4-Pal9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Taz9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 2-Thi9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), 2-Fua9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Apc9)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), Aib9)hгрелин(1-28)-NH2
(Dap3(октансульфонил), Aib10)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Dab3(октансульфонил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, A6c5, A5c12, Orn15)hгрелин(1-28)-NH2;
(А6с5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Act6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Dmt7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Thz7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, A5C5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, hLeu5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Cha5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Thr6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Abu6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 4Hyp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Pip7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Dhp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Ktp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,8, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 2-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 4-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Taz9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 2-Thi9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, 2-Fua9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Apc9, A5c12, Orn15)hгрелин(1-28)-NH2
(Aib2,9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,10, A5c12, Orn15)hгрелин(1-28)-NH2;
(Dap3(октансульфонил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Dab3(октансульфонил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, А6с5, A5c12, Apc16)hгрелин(1-28)-NH2;
(А6с5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Act6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Dmt7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Thz7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, А5c5,12, Apc16)hгрелин(1-28)-NH2;
(Aib2,5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, hLeu5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Cha5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Thr6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Abu6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 4Hyp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Pip7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Dhp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Ktp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,8, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 2-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 4-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Taz9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 2-Thi9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, 2-Fua9, A5c12, Apc16)hгрелин(1-28)-NH2
(Aib2, Apc9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,10, A5c12, Apc16)hгрелин(1-28)-NH2;
(А6с5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Act6, A5c12, Orn15)hгрелин(1-28)-NH2;
(3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Dmt7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Thz7, A5c12, Orn15)hгрелин(1-28)-NH2;
(A5c5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib5, A5c12, Orn15)hгрелин(1-28)-NH2;
(hLeu5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Cha5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Thr6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Abu6, A5c12, Orn15)hгрелин(1-28)-NH2;
(4Hyp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Pip7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Dhp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Ktp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib8, A5c12, Orn15)hгрелин(1-28)-NH2;
(2-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(4-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Taz9, A5c12, Orn15)hгрелин(1-28)-NH2;
(2-Thi9, A5c12, Orn15)hгрелин(1-28)-NH2;
(2-Fua9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Apc9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib10, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib6, A5c12, Apc16)hгрелин(1-28)-NH2;
(А5c5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Act6, A5c12, Apc16)hгрелин(1-28)-NH2;
(3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Dmt7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Thz7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib5, A5c12, Apc16)hгрелин(1-28)-NH2;
(hLeu5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Cha5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Thr6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Abu6, A5c12, Apc16)hгрелин(1-28)-NH2;
(4Hyp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Pip7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Dhp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Ktp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib8, A5c12, Apc16)hгрелин(1-28)-NH2;
(2-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(4-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Taz9, A5c12, Apc16)hгрелин(1-28)-NH2;
(2-Thi9, A5c12, Apc16)hгрелин(1-28)-NH2;
(2-Fua9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Apc9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib10, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A6c5)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), A6c5)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Act6)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dmt7)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thz7)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A5c5)hгрелин(1-28)-NH2;
(Aib2,5, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), hLeu5)hгрелин(1-28)-NH2;
(Aib2, Cha5)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thr6)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Abu6)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4-Hyp7)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Pip7)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dhp7)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Ktp7)hгрелин(1-28)-NH2;
(Aib2,8, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Pal9)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4-Pal9)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Taz9)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Thi9)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Fua9)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Apc9)hгрелин(1-28)-NH2;
(Aib2,9, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Aib2,10, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Aib6)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), A5c5)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Act6)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 3-Pal9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Dmt7)hгрелин(1-28)-NH2
(Glu3(NH-гексил), Thz7)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Aib5)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), hLeu5)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Cha5)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Thr6)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Abu6)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 4Hyp7)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Pip7)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Dhp7)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Ktp7)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Aib8)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 2-Pal9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 3-Pal9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 4-Pal9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Taz9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 2-Thi9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), 2-Fua9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Apc9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Aib9)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), Aib10)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A6c5, A5c12, Orn15)hгрелин(1-28)-NH2;
(A6c5, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Act6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dmt7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thz7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A5C5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,5, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, hLeu5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Cha5, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thr6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Abu6, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4Hyp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Pip7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dhp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Ktp7, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,8, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4-Pal9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Taz9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Thi9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Fua9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Apc9, A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,9, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2,12, Glu3(NH-гексил), 4-Pal9, Orn15)hгрелин(1-28)-NH2;
(Aib2,10, Glu3(NH-гексил), A5c12, Orn15)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A6c5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Glu3(NH-гексил), A6c5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Act6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dmt7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thz7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), A5c5,12, Apc16)hгрелин(1-28)-NH2;
(Aib2,5, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), hLeu5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Cha5, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,6, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Thr6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Abu6, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4Hyp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Pip7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Dhp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Ktp7, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,8, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 3-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 4-Pal9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Taz9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Thi9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), 2-Fua9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил), Apc9, A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,9, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Aib2,10, Glu3(NH-гексил), A5c12, Apc16)hгрелин(1-28)-NH2;
(Glu3(О-гексил))hгрелин(1-28)-NH2;
(Aib2)hгрелин(1-28)-NH2;
(Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Aib2, Glu3(О-гексил))hгрелин(1-28)-NH2;
(Aib1, Glu3(О-гексил))hгрелин(1-28)-NH2;
(Aib2, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Dap3(1-Октансульфонил))hгрелин(1-28)-NH2;
(Aib2, Dap3(1-октансульфонил))hгрелин(1-28)-NH2;
(Aib1, Dap3(1-октансульфонил))hгрелин(1-28)-NH2;
(Ava2, Dap3(1-октансульфонил))hгрелин(2-28)-NH2;
(Ac-Gly1)hгрелин(1-5)-NH2;
(Ac-Gly1)hгрелин(1-6)-NH2;
(Ac-Gly1)hгрелин(1-7)-NH2;
(Ac-Gly1, Aib2)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu3(NH-гексил))hгрелин(1-5)-NH2;
(Ac-Gly1, Aib2, Glu3(NH-гексил))hгрелин(1-6)-NH2;
(Ac-Gly1, Aib2, Glu3(NH-гексил))hгрелин(1-7)-NH2;
(Ac-Gly1, Aib2, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu3(NH-гексил), Arg8)hгрелин(1-8)-NH2;
(Ac-Gly1, Aib2, Glu3(NH-гексил), Lys8)hгрелин(1-8)-NH2;
(н-бутирил-Gly1)hгрелин(1-28)-NH2;
(н-бутирил-Gly1, Aib2, Glu3(NH-гексил))hгрелин(1-28)-NH2;
(изобутирил-Gly1)hгрелин(1-28)-NH2 или
(н-октаноил-Gly1)hгрелин(1-28)-NH2,
или его фармацевтически приемлемую соль.
Cys3(S(CH2)9CH3)hгрелин(1-28)-NH2;
(Aib2, Ser3)hгрелин(1-28)-NH2;
(Aib2,6, Ser3)hгрелин(1-28)-NH2
(Aib2, Ser3, 3Pal9)hгрелин(1-28)-NH2;
(Aib2, Ser3, Thz7)hгрелин(1-28)-NH2;
(Aib2, Ser3, Cha5)hгрелин(1-28)-NH2;
(Aib2, Ser3, Abu6)hгрелин(1-28)-NH2;
(Aib2, Ser3, 4Hyp7)hгрелин(1-28)-NH2;
(Aib2, Ser3, Taz9)hгрелин(1-28)-NH2;
(Aib2, Ser3, Dhp7)hгрелин(1-28)-NH2;
(Aib2,8, Ser3)hгрелин(1-28)-NH2;
(Aib2, Ser3, Pip7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Ser3)hгрелин(1-28)-NH2;
(Aib2,10, Ser3)hгрелин(1-28)-NH2;
(н-бутирил-Gly1, Aib2, Ser3)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Ser3)hгрелин(1-28)-NH2;
(Aib2, Ser3, Tiс7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Ser3, Arg8)hгрелин(1-28)-NH2;
(Ser3, Aib8)hгрелин(1-28)-NH2;
(Ser3, Taz9)hгрелин(1-28)-NH2;
(Ser3, 3Pal9)hгрелин(1-28)-NH2;
(Ser3, 4Pal9)hгрелин(1-28)-NH2;
(Aib2, Ser3, 2Thi9)hгрелин(1-28)-NH2;
(Ser3, 2Thi9)hгрелин(1-28)-NH2;
(Ser3, 4Hyp7)hгрелин(1-28)-NH2;
(Aib2, Ser3, Tic7)hгрелин(1-28)-NH2;
(Aib2, Thr3)hгрелин(1-28)-NH2;
(Aib2,6, Thr3)hгрелин(1-28)-NH2;
(A5C5, Thr3)hгрелин(1-28)-NH2;
(Aib2, Thr3, 3Pal9)hгрелин(1-28)-NH2;
(Aib2, Thr3, Thz7)hгрелин(1-28)-NH2;
(Aib2, Thr3, Cha5)hгрелин(1-28)-NH2;
(Aib2, Thr3, Abu6)hгрелин(1-28)-NH2;
(Aib2, Thr3, 4Hyp7)hгрелин(1-28)-NH2;
(Aib2, Thr3, Taz9)hгрелин(1-28)-NH2;
(Aib2, Thr3, Dhp7)hгрелин(1-28)-NH2;
(Aib2,8, Thr3)hгрелин(1-28)-NH2;
(Aib2, Thr3, Pip7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Thr3)hгрелин(1-28)-NH2;
(Aib2,10, Thr3)hгрелин(1-28)-NH2;
(н-бутирил-Gly1, Aib2, Thr3)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Thr3)hгрелин(1-28)-NH2;
(Aib2, Thr3, Tic7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Thr3, Arg8)hгрелин(1-28)-NH2;
(Thr3, Aib8)hгрелин(1-28)-NH2;
(Thr3, Taz9)hгрелин(1-28)-NH2;
(Thr3, 3Pal9)hгрелин(1-28)-NH2;
(Thr3, 4Pal9)hгрелин(1-28)-NH2;
(Aib2, Thr3, 2Thi9)hгрелин(1-28)-NH2;
(Thr3, 2Thi9)hгрелин(1-28)-NH2;
(Thr3, 4Hyp7)hгрелин(1-28)-NH2;
(Aib2, Thr3, Tic7)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu3(NH-гексил))hгрелин(1-28)-NH2 или
H-Inp-D-1-Nal-D-Trp-3-Pal-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-4-Pal-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Orn-Lys-NH2;
H-Inp-D-Bip-D-Trp-Phe-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Thr(Bzl)-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-Lys-NH2;
H-Inp-D-Dip-D-Trp-Phe-Lys-NH2;
H-Inp-D-Bpa-D-Trp-Phe-Lys-NH2;
H-Inp-D-2-Nal-D-Bpa-Phe-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-3-Pal-NH2;
H-Inp-D-2-Nal-D-Trp-4-Pal-NH2;
H-Inp-D-1-Nal-D-Trp-3-Pal-NH2;
H-Inp-D-Bip-D-Trp-Phe-NH2;
H-Inp-D-2-Nal-D-Trp-Thr(Bzl)-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-NH2;
H-Inp-D-2-Nal-D-Trp-2-Thi-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-NH2;
H-Inp-D-Dip-D-Trp-Phe-NH2;
H-Inp-D-2-Nal-D-Dip-Phe-NH2;
H-Inp-D-Bal-D-Trp-Phe-NH2;
H-Inp-D-2-Nal-D-Bal-Phe-NH2;
H-Inp-D-2-Nal-D-Trp-3-Pal-Lys-NH2;
H-Inp-D-Trp-D-2-Nal(ψ)-Pim;
H-Inp-D-Bal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-Bal-D-Trp-Phe-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Phe-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-Phe-Apc-NH2;
H-Inp-D-Bal-D-Trp-Phe-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Phe-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-2-Thi-NH2;
H-Apc-D-1-Nal-D-Trp-Phe-NH2;
H-Inp-D-2-Nal-D-Trp(ψ)-Pim;
H-Inp-D-1-Nal-D-Trp(ψ)-Pim;
H-Inp-D-Bal-D-Trp(ψ)-Pim;
H-Aib-D-Ser(Bzl)-D-Trp(ψ)-Pim;
H-Inp-D-1-Nal-D-Trp-Taz-Lys-NH2;
H-Inp-D-Bal-D-Trp-Taz-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-Taz-Lys-NH2;
H-Apc-D-Bal-D-Trp-Taz-Lys-NH2;
H-Apc-D-Bal-D-Trp-2-Thi-Lys-NH2;
H-Apc-D-Bal-D-Trp-Phe-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-Phe-Apc-NH2;
H-Apc-D-Bal-D-Trp-Phe-Apc-NH2;
H-Apc-D-1-Nal-D-1-Nal-Phe-Apc-NH2;
H-Apc-D-1-Nal-D-2-Nal-Phe-Apc-NH2;
H-Apc-D-1-Nal-D-1-Nal-Phe-Lys-NH2;
H-Apc-D-Bal-D-1-Nal-Phe-Apc-NH2;
H-Apc-D-Bal-D-2-Nal-Phe-Apc-NH2;
H-Apc-D-Bal-D-1-Nal-Phe-Lys-NH2;
H-Apc-D-Bal-D-2-Nal-Phe-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-2-Thi-NH2;
H-Apc-D-Bal-D-Trp-Phe-NH2;
H-Apc-D-1-Nal-D-Trp-Taz-NH2;
H-Apc-D-Bal-D-Trp-2-Thi-NH2;
H-Apc-D-Bal-D-Trp-Taz-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-NH2;
H-Inp-D-1-Nal-D-Trp-Taz-Apc-NH2;
H-Inp-D-Bal-D-Trp-Taz-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-Taz-Apc-NH2;
H-Apc-D-Bal-D-Trp-Taz-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-NH2;
H-Apc-D-1-Nal-D-Trp-2-Pal-NH2;
H-Apc-D-1-Nal-D-Trp-3-Pal-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-NH2;
H-Apc-D-1-Nal-D-Trp-4-Pal-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-NH2;
H-Apc-D-2-Nal-D-Trp-2-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-3-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-NH2;
H-Apc-D-2-Nal-D-Trp-4-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-Lys-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-Apc-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-Lys-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-NH2;
H-Apc-D-Bal-D-Bal-2-Pal-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-Apc-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-Lys-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-NH2;
H-Apc-D-Bal-D-Bal-3-Pal-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-Apc-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-Lys-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-NH2;
H-Apc-D-Bal-D-Bal-4-Pal-NH2;
H-Apc-D-Bal-D-Bal-Pff-Apc-NH2;
H-Apc-D-Bal-D-Bal-Pff-Lys-NH2;
H-Apc-D-Bal-D-Bal-Pff-NH2;
H-Apc-D-Bal-D-Bal-Phe-Apc-NH2;
H-Apc-D-Bal-D-Bal-Phe-Lys-NH2;
H-Apc-D-Bal-D-Bal-Phe-NH2;
H-Apc-D-Bal-D-Bal-Taz-Apc-NH2;
H-Apc-D-Bal-D-Bal-Taz-Lys-NH2;
H-Apc-D-Bal-D-Bal-Taz-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-NH2;
H-Apc-D-Bal-D-Trp-2-Pal-NH2;
H-Apc-D-Bal-D-Trp-3-Pal-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-NH2;
H-Apc-D-Bal-D-Trp-4-Pal-NH2;
H-Apc-D-Bal-D-Trp-Pff-Apc-NH2;
H-Apc-D-Bal-D-Trp-Pff-Lys-NH2;
H-Apc-D-Bal-D-Trp-Pff-NH2;
H-Inp-D-1-Nal-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-2-Fua-NH2;
H-Inp-D-1-Nal-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Pff-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Pff-NH2;
H-Inp-D-1-Nal-D-Bal-Phe-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Taz-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Taz-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-NH2;
H-Inp-D-1-Nal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-NH2;
H-Inp-D-1-Nal-D-Trp-Taz-NH2;
H-Inp-D-2-Nal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-2-Fua-NH2;
H-Inp-D-2-Nal-D-Trp-2-Thi-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-3-Thi-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-NH2;
H-Inp-D-Bal-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-Bal-D-Bal-2-Fua-NH2;
H-Inp-D-Bal-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-Bal-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-Bal-D-Bal-Pff-Lys-NH2;
H-Inp-D-Bal-D-Bal-Pff-NH2;
H-Inp-D-Bal-D-Bal-Phe-Lys-NH2;
H-Inp-D-Bal-D-Bal-Taz-Lys-NH2;
H-Inp-D-Bal-D-Bal-Taz-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-NH2;
H-Inp-D-Bal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-Bal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-Bal-D-Trp-Pff-Apc-NH2;
H-Inp-D-Bal-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bal-D-Trp-Pff-NH2;
H-Inp-D-Bal-D-Trp-Taz-NH2;
H-Inp-D-Bip-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-Bip-D-Bal-2-Fua-NH2;
H-Inp-D-Bip-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-Bip-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-Bip-D-Bal-Pff-Lys-NH2;
H-Inp-D-Bip-D-Bal-Pff-NH2;
H-Inp-D-Bip-D-Bal-Taz-Lys-NH2;
H-Inp-D-Bip-D-Bal-Taz-NH2;
H-Inp-D-Bip-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-Bip-D-Trp-2-Fua-NH2;
H-Inp-D-Bip-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-Bip-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-Bip-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bip-D-Trp-Pff-NH2;
H-Inp-D-Bip-D-Trp-Taz-Lys-NH2;
H-Inp-D-Bip-D-Trp-Taz-NH2;
H-Inp-D-1-Nal-D-Trp-3-Pal-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-4-Pal-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Orn-Lys-NH2;
H-Inp-D-Bip-D-Trp-Phe-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Thr(Bzl)-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-Lys-NH2;
H-Inp-D-Dip-D-Trp-Phe-Lys-NH2;
H-Inp-D-Bpa-D-Trp-Phe-Lys-NH2;
H-Inp-D-2-Nal-D-Bpa-Phe-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Thr(Bzl)-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-NH2;
H-Inp-D-2-Nal-D-Dip-Phe-NH2;
H-Inp-D-2-Nal-D-Trp-3-Pal-Lys-NH2;
H-Inp-D-Trp-D-2-Nal(ψ)-Pim;
H-Inp-D-Bal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-Bal-D-Trp-Phe-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-Phe-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-Phe-Apc-NH2;
H-Inp-D-Bal-D-Trp-Phe-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Phe-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-2-Nal-D-Trp(ψ)-Pim;
H-Inp-D-1-Nal-D-Trp(ψ)-Pim;
H-Inp-D-Bal-D-Trp(ψ)-Pim;
H-Aib-D-Ser(Bzl)-D-Trp(ψ)-Pim;
H-Inp-D-1-Nal-D-Trp-Taz-Lys-NH2;
H-Inp-D-Bal-D-Trp-Taz-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-Taz-Lys-NH2;
H-Apc-D-Bal-D-Trp-Taz-Lys-NH2;
H-Apc-D-Bal-D-Trp-2-Thi-Lys-NH2;
H-Apc-D-Bal-D-Trp-Phe-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-Phe-Apc-NH2;
H-Apc-D-Bal-D-Trp-Phe-Apc-NH2;
H-Apc-D-1-Nal-D-1-Nal-Phe-Apc-NH2;
H-Apc-D-1-Nal-D-2-Nal-Phe-Apc-NH2;
H-Apc-D-1-Nal-D-1-Nal-Phe-Lys-NH2;
H-Apc-D-Bal-D-1-Nal-Phe-Apc-NH2;
H-Apc-D-Bal-D-2-Nal-Phe-Apc-NH2;
H-Apc-D-Bal-D-1-Nal-Phe-Lys-NH2;
H-Apc-D-Bal-D-2-Nal-Phe-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-2-Thi-NH2;
H-Apc-D-Bal-D-Trp-Phe-NH2
H-Apc-D-1-Nal-D-Trp-Taz-NH2;
H-Apc-D-Bal-D-Trp-2-Thi-NH2;
H-Apc-D-Bal-D-Trp-Taz-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-NH2;
H-Inp-D-1-Nal-D-Trp-Taz-Apc-NH2;
H-Inp-D-Bal-D-Trp-Taz-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-Taz-Apc-NH2;
H-Apc-D-Bal-D-Trp-Taz-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-Bal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-Bal-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-Bal-D-Trp-Pff-Apc-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-Bal-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bal-D-Bal-Phe-Lys-NH2;
H-Inp-D-Bal-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-Bal-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-Bal-D-Bal-Taz-Lys-NH2;
H-Inp-D-Bal-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-Bal-D-Bal-Pff-Lys-NH2;
H-Apc-D-Bal-D-Bal-Phe-Lys-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-Lys-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-Lys-NH2;
H-Apc-D-Bal-D-Bal-Taz-Lys-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-Lys-NH2;
H-Apc-D-Bal-D-Bal-Pff-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Phe-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Taz-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-1-Nal-D-Bal-Pff-Lys-NH2;
H-Inp-D-2-Nal-D-Trp-2-Thi-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-3-Thi-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-Apc-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-Lys-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bip-D-Trp-2-Thi-Lys-NH2;
H-Inp-D-Bip-D-Trp-3-Thi-Lys-NH2;
H-Inp-D-Bip-D-Trp-Taz-Lys-NH2;
H-Inp-D-Bip-D-Trp-2-Fua-Lys-NH2;
H-Inp-D-Bip-D-Trp-Pff-Lys-NH2;
H-Inp-D-Bip-D-Bal-2-Thi-Lys-NH2;
H-Inp-D-Bip-D-Bal-3-Thi-Lys-NH2;
H-Inp-D-Bip-D-Bal-Taz-Lys-NH2;
H-Inp-D-Bip-D-Bal-2-Fua-Lys-NH2;
H-Inp-D-Bip-D-Bal-Pff-Lys-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-Bal-D-Trp-Pff-Apc-NH2;
H-Apc-D-Bal-D-Bal-Phe-Apc-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-Apc-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-Apc-NH2;
H-Apc-D-Bal-D-Bal-Taz-Apc-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-Apc-NH2;
H-Apc-D-Bal-D-Bal-Pff-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-2-Thi-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Taz-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-Apc-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-Apc-NH2;
H-Inp-D-Bal-D-Trp-Taz-NH2;
H-Inp-D-Bal-D-Trp-2-Fua-NH2;
H-Inp-D-Bal-D-Trp-Pff-NH2;
H-Apc-D-Bal-D-Trp-3-Thi-NH2;
H-Apc-D-Bal-D-Trp-2-Fua-NH2;
H-Apc-D-Bal-D-Trp-Pff-NH2;
H-Apc-D-Bal-D-Trp-4-Pal-NH2;
H-Apc-D-Bal-D-Trp-3-Pal-NH2;
H-Apc-D-Bal-D-Trp-2-Pal-NH2;
H-Inp-D-Bal-D-Bal-Taz-NH2;
H-Inp-D-Bal-D-Bal-2-Fua-NH2;
H-Inp-D-Bal-D-Bal-Pff-NH2;
H-Apc-D-Bal-D-Bal-Phe-NH2;
H-Apc-D-Bal-D-Bal-2-Thi-NH2;
H-Apc-D-Bal-D-Bal-3-Thi-NH2;
H-Apc-D-Bal-D-Bal-Taz-NH2;
H-Apc-D-Bal-D-Bal-2-Fua-NH2;
H-Apc-D-Bal-D-Bal-Pff-NH2;
H-Apc-D-Bal-D-Bal-4-Pal-NH2;
H-Apc-D-Bal-D-Bal-3-Pal-NH2;
H-Apc-D-Bal-D-Bal-2-Pal-NH2;
H-Inp-D-1-Nal-D-Trp-Taz-NH2;
H-Inp-D-1-Nal-D-Trp-2-Fua-NH2;
H-Inp-D-1-Nal-D-Trp-Pff-NH2;
H-Inp-D-1-Nal-D-Bal-Taz-NH2;
H-Inp-D-1-Nal-D-Bal-2-Fua-NH2;
H-Inp-D-1-Nal-D-Bal-Pff-NH2;
H-Inp-D-2-Nal-D-Trp-Taz-NH2;
H-Inp-D-2-Nal-D-Trp-2-Fua-NH2;
H-Inp-D-2-Nal-D-Trp-Pff-NH2;
H-Apc-D-1-Nal-D-Trp-3-Thi-NH2;
H-Apc-D-1-Nal-D-Trp-2-Fua-NH2;
H-Apc-D-1-Nal-D-Trp-Pff-NH2;
H-Apc-D-1-Nal-D-Trp-4-Pal-NH2;
H-Apc-D-1-Nal-D-Trp-3-Pal-NH2;
H-Apc-D-1-Nal-D-Trp-2-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-3-Thi-NH2;
H-Apc-D-2-Nal-D-Trp-2-Fua-NH2;
H-Apc-D-2-Nal-D-Trp-Pff-NH2;
H-Apc-D-2-Nal-D-Trp-4-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-3-Pal-NH2;
H-Apc-D-2-Nal-D-Trp-2-Pal-NH2;
H-Inp-D-Bip-D-Trp-Taz-NH2;
H-Inp-D-Bip-D-Trp-2-Fua-NH2;
H-Inp-D-Bip-D-Trp-Pff-NH2;
H-Inp-D-Bip-D-Bal-Taz-NH2;
H-Inp-D-Bip-D-Bal-2-Fua-NH2 или
H-Inp-D-Bip-D-Bal-Pff-NH2;
H-Inp-D-1-Nal-D-Trp-2-Thi-Apc-NH2;
H-Inp-D-Bal-D-Trp-2-Thi-Apc-NH2;
H-Apc-D-1-Nal-D-Trp-2-Thi-Apc-NH2;
H-Apc-D-Bal-D-Trp-2-Thi-Apc-NH2;или
H-Apc-D-1-Nal-D-Trp-Phe-Lys-NH2;
(Ser(н-октаноил)15)hгрелин(1-28)-NH2;
(Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)15)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Ser(н-октаноил)16)hгрелин(1-28)-NH2;
(Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)16)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Dap(октансульфонил)17)hгрелин(1-28)-NH2;
(Dap(октансульфонил)3,17)hгрелин(1-28)-NH2;
(Dap(октансульфонил)3, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Dap(октансульфонил)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Dap(октансульфонил)17)hгрелин(1-28)-NH2;
(Cys(S-(CH2)9CH3)17)hгрелин(1-28)-NH2;
(Cys(S-(CH2)9CH3)3,17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Cys(S-(CH2)9CH3)17)hгрелин(1-28)-NH2;
(Cys(S-(CH2)9CH3)3, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Cys(S-(CH2)9CH3)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Aib2, Thz7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, 4-Hyp7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Dhp7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Pip7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Tic7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, Thz7)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, 4-Hyp7)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, Dhp7)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, Pip7)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, Tic7)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Aib2, 3-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, 4-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Taz9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, 2-Thi9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, 3-Pal9)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, 4-Pal9)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, Taz9)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17, 2-Thi9)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Aib8, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Taz9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(3-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(4-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(2-Thi9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17, Aib8)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17, Taz9)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17, 3-Pal9)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17, 4-Pal9)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17, 2-Thi9)hгрелин(1-28)-NH2;
(Aib1,2,10, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Aib1,2,10, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(A5c2, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(A5c2, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Glu(1-гептанол)3,17)hгрелин(1-28)-NH2;
(Asp(1-гептанол)3,17)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Asp(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Lys(биотинил)17)hгрелин(1-28)-NH2;
(Ser(н-октаноил)18)hгрелин(1-28)-NH2;
(Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)18)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Ser(н-октаноил)19)hгрелин(1-28)-NH2;
(Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)19)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Ser(н-октаноил)20)hгрелин(1-28)-NH2;
(Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Glu(NH-гексил)3, Ser(н-октаноил)20)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Aib2, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Aib2,8, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Aib2,10, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Dap(октансульфонил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Dap(октансульфонил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Dap(октансульфонил)3, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Dap(октансульфонил)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Dap(октансульфонил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Cys(S-(CH2)9CH3)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Cys(S-(CH2)9CH3)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Cys(S-(CH2)9CH3)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Cys(S-(CH2)9CH3)3, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Cys(S-(CH2)9CH3)3, Ser(н-октаноил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Thz7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, 4-Hyp7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Dhp7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Pip7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Tic7, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, Thz7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, 4-Hyp7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, Dhp7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, Pip7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, Tic7)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, 3-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, 4-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Taz9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, 2-Thi9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, 3-Pal9)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, 4-Pal9)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, Taz9)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,17, 2-Thi9)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib8, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Taz9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, 3-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, 4-Pal9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, 2-Thi9, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17, Aib8)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17, Taz9)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17, 3-Pal9)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17, 4-Pal9)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17, 2-Thi9)hгрелин(1-28)-NH2;
(Ac-Aib1, Aib2,10, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Aib1, Aib2,10, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, A5c2, Glu(NH-гексил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, A5c2, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(1-гептанол)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Asp(1-гептанол)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Asp(NH-гексил)3,17)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3, Lys(биотинил)17)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2 , Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)15)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,15)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)16)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,16)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)18)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,18)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)19)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,19)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser(н-октаноил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Ac-Gly1, Glu(NH-гексил)3, Ser(н-октаноил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,8, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)20)hгрелин(1-28)-NH2;
(Ac-Gly1, Aib2,10, Glu(NH-гексил)3,20)hгрелин(1-28)-NH2;
(Asp3(NH-гептил))hгрелин(1-28)-NH2; Пример 86
(des-Ser2)hгрелин(1-28)-NH2; Пример 104
(des-Gly1, Des-Ser2)hгрелин(1-28)-NH2; Пример 117
(Aib1)hгрелин(1-28)-NH2; Пример 6
(Asp3(O-гексил))hгрелин(1-28)-NH2; Пример 40
(Aib1, Ser3)hгрелин(1-28)-NH2;
(A5C5, Ser3)hгрелин(1-28)-NH2;
(Aib2, 4, Ser3, 4-Pal9)hгрелин(1-28)-NH2;
(н-октаноил-Gly1, Ser3)hгрелин(1-28)-NH2;
(изобутирил-Gly1, Ser3)hгрелин(1-28)-NH2;
(н-бутирил-Gly1, Ser3)hгрелин(1-28)-NH2;
(Aib1, Thr3)hгрелин(1-28)-NH2;
(Aib2,4, Thr3, 4-Pal9)hгрелин(1-28)-NH2;
(н-октаноил-Gly1, Thr3)hгрелин(1-28)-NH2;
(изобутирил-Gly1, Thr3)hгрелин(1-28)-NH2;
(н-бутирил-Gly1, Thr3)hгрелин(1-28)-NH2;
(Ac-Gly1)hгрелин(1-28)-NH2;
(Ac-Gly1, Ser3)hгрелин(1-28)-NH2;
Aib2, Lys(миристил)17)hгрелин-(1-28)-NH2 или
Gly(миристил)1-(Aib2, Lys(миристил)17]hгрелин-(1-28)-NH2.
Настоящее изобретение охватывает диастереомеры, а также рацемические смеси и выделенные энантиомерно чистые формы указанных соединений. Аналоги грелина могут содержать D-аминокислоты, L-аминокислоты или их комбинация. Предпочтительно аминокислоты, входящие в состав аналога грелина, представляют собой L-энантиомеры.
Предпочтительные производные аналогов данного изобретения содержат D-аминокислоты, N-алкиламинокислоты, β-аминокислоты и/или одну или несколько меченых аминокислот (включающих меченные D-аминокислоты, N-алкиламинокислоты или β-аминокислоты). Меченое производное представляет собой модификацию аминокислоты или аминокислотного производного посредством введения детектируемой метки. Примеры детектируемых меток включают люминесцентные, ферментативные и радиоактивные метки. Как тип, так и положение метки может влиять на активность аналога. Метки следует выбирать и располагать таким образом, чтобы они по существу не изменяли активность аналога грелина в отношении рецептора GHS. Влияние типа и положения метки на активность грелина можно определить с помощью анализов активности и/или связывания грелина.
Терапевтически эффективное количество зависит от состояния, подлежащего лечению, выбранного способа введения и конкретной активности используемого соединения, в конечном счете, его определяет лечащий врач или ветеринар (например, от 5 г/день до 5 мг/день). В одном варианте осуществления пептидильный аналог грелина вводят пациенту до ослабления или исчезновения наблюдаемых симптомов, связанных с нарушением двигательной функции желудочно-кишечного тракта, например абдоминальной тошноты, вздутия живота, рвоты, обстипации, неспособности есть и спазмов, зачастую обусловленных послеоперационной кишечной непроходимостью.
С помощью способа по данному изобретению можно лечить кишечную непроходимость, связанную с нарушением в любом участке желудочно-кишечного тракта, например в желудке, тонком кишечнике и/или толстом кишечнике. Причиной кишечной непроходимости может быть любой фактор, вызывающий кишечную непроходимость, а именно хирургическая операция, например хирургия брюшной полости, такая как трансплантационная хирургия (например, трансплантация тонкого кишечника (SITx)) или хирургия брюшной полости, отличная от трансплантационной хирургии (например, хирургия брюшной полости с использованием лапаротомии или без использования лапаротомии, например лапароскопические процедуры); ортопедическая хирургия (например, хирургия тазобедренного сустава); роды; ишемия кишечника; забрюшинная гематома; внутрибрюшной сепсис; внутрибрюшное воспаление, например острый аппендицит, холецистит, панкреатит; перелом спинного мозга; мочеточниковая колика; торакальные повреждения; базальная пневмония; переломы ребер; инфаркт миокарда; нарушения метаболизма; или любое сочетание указанных факторов.
Пептидильный аналог грелина можно вводить парентерально, например внутривенно, в кровоток субъекта, подлежащего лечению, однако специалистам в данной области хорошо известно, что способ введения, такой как внутривенный, подкожный, внутримышечный, внутрибрюшинный, кишечный, чрезкожный, через слизистую оболочку, с использованием полимерных композиций с замедленным высвобождением (например, микрочастиц или имплантатов, содержащих полимер или сополимер молочной кислоты), насыщающее введение, назальный, пероральный и др., зависит от состояния, подлежащего лечению, а также от активности и биодоступности используемого пептидильного аналога грелина.
Хотя пептидильный аналог грелина можно вводить в виде чистого или практически чистого соединения, он также может входить в состав фармацевтической композиции или фармацевтического препарата. Композиции, используемые в настоящем изобретении для введения людям и животным, содержат любой из описанных ниже пептидильных аналогов грелина вместе с одним или несколькими фармацевтически приемлемыми носителями и, необязательно, другими терапевтическими ингредиентами.
Носитель должен быть "приемлемым", то есть он должен быть совместимым с активным ингредиентом (активными ингредиентами) композиции (например, способным стабилизировать пептиды) и не оказывать вредного воздействия на субъекта, подлежащего лечению. Желательно, чтобы композиция не содержала окисляющих агентов или других веществ, которые заведомо не совместимы с пептидами. Высокоокислительные условия могут приводить к образованию сульфоксида цистеина и к окислению триптофана. Следовательно, большое значение имеет правильный выбор эксципиента.
Фармацевтическую композицию можно вводить пациенту с помощью любого способа, пригодного для введения пациентам газов, жидкостей и/или твердых веществ, например путем ингаляции, инсуффляции, инфузии, инъекции и/или проглатывания. Например, в одном варианте осуществления настоящего изобретения фармацевтическую композицию вводят пациенту путем ингаляции. В другом варианте осуществления фармацевтическую композицию вводят пациенту перорально. В следующем варианте осуществления фармацевтическую композицию вводят непосредственно в брюшную полость пациента.
Композиции обычно получают в виде единичных дозированных форм с помощью хорошо известных в области фармацевтики способов. Все способы предусматривают стадию смешивания активного ингредиента (ингредиентов) с носителем, который включает один или несколько вспомогательных ингредиентов.
Как правило, композиции таблеток или порошков получают путем однородного и равномерного смешивания активного ингредиента с тонкоизмельченными твердыми носителями и затем, при необходимости, как в случае таблеток, формования продукта, с получением желаемой формы и размера.
С другой стороны, композиции, подходящие для парентерального (например, внутривенного) введения, обычно содержат стерильные водные растворы активного ингредиента (ингредиентов). Предпочтительно растворы являются изотоническими по отношению к крови субъекта, подлежащего лечению. Такие композиции обычно получают путем растворения твердого активного ингредиента (ингредиентов) в воде с последующей стерилизацией полученного водного раствора. Композиция может находиться в контейнерах, вмещающих одну или несколько доз, например в герметически закрытых ампулах или флаконах.
В данной области также известны композиции с замедленным высвобождением, подходящие для парентерального введения (например, композиции на основе биоразрушаемых полимеров, таких как сложные полиэфиры, содержащие остатки молочной или гликолевой кислот) (см., например, патенты США №№ 3773919 и 4767628 и публикацию PCT WO 94/15587).
В дополнение к лечению послеоперационной кишечной непроходимости способ настоящего изобретения у пациентов, страдающих от кишечной непроходимости, оказывает и другие терапевтические эффекты, свойственные грелину, такие как возбуждение аппетита, ингибирование воспалительных цитокинов, стимуляция медленного сна и укрепление иммунитета.
Примеры
A. Синтез аналогов грелина
Аналоги грелина и соединения данного изобретения можно получить с помощью способов, раскрытых в примерах настоящего описания, а также с помощью способов, хорошо известных в данной области. Например, полипептидный участок аналога грелина можно синтезировать и модифицировать химическими или биохимическими способами. Примеры способов биохимического синтеза, предусматривающих введение нуклеиновой кислоты в клетку и экспрессию нуклеиновых кислот, описаны в Ausubel, Current Protocols in Molecular Biology, John Wiley, 1987-1998 и Sambrook et al., in Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory Press, 1989. Способы химического синтеза полипептидов также хорошо известны в данной области (см., например, Vincent in Peptide and Protein Drug Delivery, New York, N.Y., Dekker, 1990). Например, пептиды данного изобретения можно получить с помощью стандартного твердофазного пептидного синтеза (см., например, Stewart, J.M., et al., Solid Phase Synthesis, Pierce Chemical Co., 2d ed. 1984).
Заместители R2 и R3 указанной выше общей формулы можно присоединить к свободному амину N-концевой аминокислоты с помощью стандартных способов, известных в данной области. Например, алкильные группы, такие как (C1-C30)алкил, можно присоединить путем восстановительного алкилирования. Гидроксиалкильные группы, такие как (C1-C30)гидроксиалкил, также можно присоединить путем восстановительного алкилирования, где свободная гидроксильная группа защищена трет-бутиловым сложным эфиром. Ацильные группы, например COE1, можно присоединить путем взаимодействия свободной кислоты, такой как E1COOH, со свободной аминогруппой N-концевой аминокислоты, например, путем смешивания готовой смолы с 3 мольными эквивалентами свободной кислоты и диизопропилкарбодиимида в метиленхлориде в течение 1 часа. Если свободная кислота содержит свободную гидроксильную группу, например п-гидроксифенилпропионовая кислота, то сочетание следует проводить в присутствии дополнительно 3 молярных эквивалентов HOBT.
Если R1 представляет собой NH-X2-CH2-CONH2, (т.е., Z0=CONH2), синтез пептида начинают с Fmoc-HN-X2-CH2-COOH, присоединенной к смоле Rink Amide-MBHA (амид-4-метилбензилгидриламин, поставляемый Novabiochem®, San Diego, CA). Если R1 представляет собой NH-X2-CH2-COOH (т.е., Z0-COOH), синтез пептида начинают с Fmoc-HN-X2-CH2-COOH, присоединенной к смоле Wang.
В синтезе аналога грелина данного изобретения, содержащего A5c, A6c и/или Aib, время сочетания составляет 2 часа для указанных остатков и остатка, следующего сразу за ними.
Защитная группа, присоединенная к C-концевой карбоксильной группе, уменьшает реакционноспособность карбоксильного конца in vivo. Защитную группу карбоксильного конца предпочтительно присоединяют к α-карбонильной группе последней аминокислоты. Предпочтительные защитные группы карбоксильного конца включают амид, метиламид и этиламид.
Приведенные ниже примеры предназначены для дополнительной иллюстрации различных признаков настоящего изобретения. Примеры также иллюстрируют методики, используемые для осуществления изобретения. Указанные примеры не ограничивают изобретение согласно формуле изобретения.
Синтез коротких аминокислотных последовательностей хорошо известен в области химии пептидов. Например, синтез соединений формулы I, таких как (Glu3(О-гексил))hгрелин(1-28)-NH2, (Aib2)hгрелин(1-28)-NH2, (Glu3(NH-гексил))hгрелин(1-28)-NH2 и (Cys3(S-децил))hгрелин(1-28)-NH2, описанные выше, можно провести, следуя методике, описанной в международной патентной публикации WO04/009616 на страницах 46-56, следующим образом:
Пример 1: (Glu 3 (О-гексил))hгрелин(1-28)-NH 2
Указанный в заголовке пептид синтезируют на пептидном синтезаторе Applied Biosystems (Foster City, CA), модель 433A. Используют смолу 4-(2',4'-диметоксифенил-Fmoc-аминометил)феноксиацетамидо-норлейцил-MBHA (смола Rink Amide MBHA, Novabiochem, San Diego, CA) с замещением 0,72 ммоль/г. Используют следующие Fmoc-защищенные по боковым цепям аминокислоты (AnaSpec, San Jose, CA): Fmoc-Arg(Pbf)-OH, Fmoc-Pro-OH, Fmoc-Gln-OH, Fmoc-Leu-OH, Fmoc-Lys(Boc)-OH, Fmoc-Ala-OH, Fmoc-Ser(tBu)-OH, Fmoc-Glu(OtBu)-OH, Fmoc-Val-OH, Fmoc-His(Trt)-OH, Fmoc-Phe-OH и Fmoc-Asp(OtBu)-OH. В положении 1 используют Boc-Gly-OH (Midwest Bio-Tech, Fishers, IN). В положении 3 используют γ-4-{N-(1-(4,4-диметил-2,6-диоксоциклогексилиден)-3-метилбутил)амино}бензиловый эфир N-α-Fmoc-L-глутаминовой кислоты (Fmoc-Glu(ODmab)-OH) (Chem-Inpex International, Wood Dale, IL). Синтез проводят в масштабе 0,25 ммоль. Группы Fmoc удаляют обработкой 20% раствором пиперидина в N-метилпирролидоне (NMP) в течение 30 мин. На каждой стадии сочетания Fmoc-аминокислоту (1 ммоль) предварительно активируют HBTU (0,9 ммоль) и HOBt (0,9 ммоль) в ДМФА и затем добавляют к смоле. Пептидный синтезатор ABI 433A программируют таким образом, чтобы он выполнял следующий цикл реакций: (1) промывание NMP, (2) удаление защитной группы Fmoc 20% раствором пиперидина в NMP в течение 30 мин, (3) промывание NMP, (4) сочетание предварительно активированной Fmoc-аминокислоты в течение 1 ч.
По окончании сборки пептидной цепи на пептидном синтезаторе Applied Biosystems (ABI) 433A смолу переносят в реакционный сосуд на шейкере и проводят ручной синтез. Защитную группу Dmab с боковой цепи остатка Glu удаляют 2% раствором гидразина в ДМФА в течение 2 ч. После промывания ДМФА смолу обрабатывают 2,5 ммоль гексафторфосфата тетраметилфторфорамидиния (TFFH) (Perseptive Biosystems, Warrington, UK) в дихлорметане (DCM) в течение 25 мин, для преобразования свободной функциональной карбоксильной группы боковой цепи остатка Glu во фторангидрид. К смеси добавляют 5,0 ммоль гексанола, 2,5 ммоль гексафторфосфата О-(7-азабензотриазол-1-ил-1,1,3,3-тетраметилурония (HOAT) (Anaspec, San Jose, CA), 5,0 ммоль диизопропилэтиламина (DIEA) (Aidrich, Milwaukee, WI) и каталитическое количество 4-(диметиламино)пиридина (DMAP)(Aldrich, Milwaukee, WI). Смесь встряхивают при комнатной температуре в течение 2 ч. Смолу промывают ДМФА и DCM и обрабатывают в течение ночи 2,5 ммоль N,N-диизопропилкарбодиимида (DIC) (Chem-Impex International, Wood Dale, IL), 2,5 ммоль 1-гексанола, 2,5 ммоль HOBt и 0,025 ммоль DMAP. После промывания и сушки пептид отщепляют от смолы, используя смесь ТФУК (9,5 мл), H2O (0,85 мл) и триизопропилсилана (TIS) (0,65 мл) в течение 2 ч. Смолу отфильтровывают и фильтрат выливают в 70 мл эфира. Полученный осадок отфильтровывают и тщательно промывают эфиром. Полученный неочищенный продукт растворяют в 5% уксусной кислоте и очищают препаративной ВЭЖХ на обращенной фазе, используя колонку (4×43 см) С18 DYNAMAX-100A0 (Varian, Walnut Creek, CA). Колонку элюируют с линейным градиентом от 75% A и 25% B до 55% A и 45% B в течение часа, где A представляет собой 0,1% раствор ТФУК в воде, и B представляет собой 0,1% раствор ТФУК в ацетонитриле. Фракции проверяют аналитической ВЭЖХ. Фракции, содержащие чистый продукт, объединяют и лиофилизируют досуха. Чистота соединения составляет 92,8%. Выход составляет 6,6%. Анализ масс-спектрометрии с ионизацией электрораспылением (ESI MС) показывает, что молекулярная масса продукта составляет 3369,4 (что находится в соответствии с рассчитанной молекулярной массой 3369,9).
Пример 2: (Aib 2 )hгрелин(1-28)-NH 2
Указанный в заголовке пептид синтезируют в соответствии с методикой примера 1, используемому для синтеза (Glu3(О-гексил))hгрелин(1-28)-NH2, за исключением того, что: в положении 3 используют Fmoc-Ser-OH, в положении 2 используют Fmoc-Aib-OH и в положении 1 используют Boc-Gly-OH. После сборки пептидной цепи пептид на смоле обрабатывают 25% раствором пиперидина в ДМФА 3×2 ч. Смолу промывают ДМФА и обрабатывают октановой кислотой (2,5 ммоль, 10-кратный избыток), HBTU (2,2 ммоль), HOBt (2,2 ммоль) и DIEA (7,5 ммоль) в ДМФА в течение 2 ч. Смолу промывают ДМФА и затем обрабатывают октановой кислотой (2,5 ммоль), DIC (2,5 ммоль), HOBt (2,5 ммоль) и DMAP (0,025 ммоль) в ДМФА в течение 2 ч. Конечное отщепление и очистку проводят аналогично методике, используемой в примере 1. По данным аналитической ВЭЖХ продукт является гомогенным и имеет чистоту 99% при выходе 18,5%. Анализ масс-спектрометрии с ионизацией электрораспылением (ESI MS) показывает, что молекулярная масса продукта составляет 3367,6 (что находится в соответствии с рассчитанной молекулярной массой 3367,0).
Пример 3: (Glu 3 (NH-гексил))hгрелин(1-28)-NH 2
Указанный в заголовке пептид синтезируют на пептидном синтезаторе Applied Biosystems (Foster City, CA), модель 430A, модифицированном с целью ускорения твердофазного пептидного синтеза с использованием Boc-химии. См. Schnolzer, et al, Int. J. Peptide Protein Res., 40:180 (1992). Используют 4-метилбензгидриламиновую (MBHA) смолу (Peninsula, Belmont, CA) с замещением 0,91 ммоль/г. Используют следующие Boc-защищенные по боковым цепям аминокислоты (Midwest Bio-Tech, Fishers, IN; Novabiochem., San Diego, CA): Boc-Ala-OH, Boc-Arg(Tos)-OH, Boc-His(DNP)-OH, Boc-Val-OH, Boc-Leu-OH, Boc-Gly-OH, Boc-Gln-OH, Boc-Lys(2ClZ)-OH, Boc-Ser(Bzl)-OH, Boc-Phe-OH, Boc-Glu(OcHex)-OH и Boc-Pro-OH. В положении 3 последовательности используют Fmoc-Glu(OtBu)-OH (Novabiochem., San Diego, CA). Синтез проводят в масштабе 0,25 ммоль. Группы Boc удаляют обработкой 100% раствором ТФУК 2×1 мин. Boc-аминокислоты (2,5 ммоль) предварительно активируют HBTU (2,0 ммоль) и DIEA (1,0 мл) в 4 мл ДМФА и подвергают сочетанию без предварительной нейтрализации ТФУК-соли пептида на смоле. Время сочетания составляет 5 мин.
После сборки первых 25 остатков на пептидном синтезаторе ABI 430A и перед сочетанием Fmoc-Glu(OtBu)-OH защищенный пептид на смоле переносят в реакционный сосуд на шейкере и проводят ручной синтез. После удаления защитной группы Boc обработкой 100% ТФУК 2×1 мин с промыванием ДМФА, смолу смешивают с Fmoc-Glu(OtBu)-OH (2,5 ммоль), которую предварительно активируют HBTU (2,0 ммоль), HOBt (2,0 ммоль) и DIEA (1,0 мл) в 4 мл ДМФА. Смесь встряхивают в течение 2 ч. Описанную стадию реакции сочетания повторяют. После промывания ДМФА смолу обрабатывают раствором ТФУК, содержащим 5% воды и 5% TIS, в течение 2 ч, для удаления защитной группы tBu с боковой цепи остатка Glu. Смолу нейтрализуют 10% раствором DIEA в ДМФА и промывают ДМФА и DCM. Затем смолу обрабатывают гексиламином (2,0 ммоль), DIC (2,0 ммоль), HOBt (2,0 ммоль) в 5 мл DCM в течение 2×2 ч. Смолу промывают ДМФА и обрабатывают 25% раствором пиперидина в ДМФА в течение 30 мин, для удаления защитной группы Fmoc. После промывания ДМФА и DCM смолу переносят в реакционный сосуд пептидного синтезатора ABI 430A для сборки двух оставшихся остатков.
По окончании сборки всей пептидной цепи смолу обрабатывают раствором 20% меркаптоэтанол/10% DIEA в ДМФА в течение 2×30 мин, для удаления группы DNP с боковой цепи His. Затем удаляют N-концевую группу Boc обработкой 100% ТФУК в течение 2×2 мин. Пептид на смоле промывают ДМФА и DCM и сушат при пониженном давлении. Конечное отщепление осуществляют путем перемешивания пептида на смоле в 10 мл HF, содержащего 1 мл анизола и дитиотреитола (50 мг), при 0°C в течение 75 мин. HF удаляют в токе азота. Остаток промывают эфиром (6×10 мл) и экстрагируют 4N HOAc (6×10 мл). Неочищенный продукт очищают препаративной ВЭЖХ на обращенной фазе с использованием колонки (4×43 см) C18 DYNAMAX-100A°(Varian, Walnut Creek, CA). Колонку элюируют с линейным градиентом от 75% A и 25% B до 55% A и 45% B при скорости потока 10 мл/мин в течение часа, где A представляет собой 0,1% раствор ТФУК в воде, и B представляет собой 0,1% раствор ТФУК в ацетонитриле. Фракции собирают и проверяют методом аналитической ВЭЖХ. Фракции, содержащие чистый продукт объединяют и лиофилизируют досуха. Получают 31,8 мг белого твердого вещества. По данным аналитической ВЭЖХ чистота составляет 89%. Анализ масс-спектрометрии с ионизацией электрораспылением (ESI MS) показывает, что молекулярная масса продукта составляет 3368,4 (что находится в соответствии с рассчитанной молекулярной массой 3368,9).
Пример 4: (Cys 3 (S-децил))hгрелин(1-28)-NH 2
Указанный в заголовке пептид синтезируют в соответствии с методикой примера 3, используемому для синтеза (Glu3(NH-гексил))hгрелин(1-28)-NH2, со следующими модификациями: Первые 25 остатков собирают с помощью Boc-технологии, и последние 3 остатка присоединяют, используя Fmoc-химию. Используют следующие 3 Fmoc-аминокислоты: N-α-Fmoc-S-(п-метокситритил)-L-цистеин (Fmoc-Cys(Mmt)-OH), Fmoc-Ser(Bzl)-OH и Fmoc-Gly-OH, полученные от Novabiochem (San Diego, CA). Fmoc-аминокислоту (1 ммоль) предварительно активируют HBTU (0,9 ммоль) и HOBt (0,9 ммоль) в ДМФА и затем подвергают сочетанию пептидов на смоле. Цикл сочетания Fmoc-аминокислоты включает: (1) промывание NMP, (2) удаление защитной группы Fmoc с использованием 20% раствора пиперидина в NMP в течение 30 мин, (3) промывание NMP и (4) сочетание предварительно активированной Fmoc-аминокислоты в течение 1 ч.
(ii) По окончании сборки всей пептидной цепи защищенный пептид на смоле обрабатывают раствором, содержащим 20% меркаптоэтанола и 10% DIEA в ДМФА, в течение 2×30 мин, для удаления группы DNP с боковой цепи остатка His. Затем удаляют защитную группу Mmt с боковой цепи остатка Cys обработкой раствором, содержащим 1% ТФУК и 5% TIS в DCM, в течение 30 минут, затем пептид на смоле промывают ДМФА.
(iii) 1-(2-пиридилдитио)декан получают путем перемешивания 2,2'-дипиридилдисульфида (1,06 г, 4,8 ммоль), 1-декантиола (0,83 мл, 4 ммоль) и триэтиламина (2 мл) в смеси пропанола и ацетонитрила (1/9, об/об) при комнатной температуре в течение приблизительно 3 часов (см. Carlsson et al, Biochem. J.,1978, 173, 723-737). Неочищенный 1-(2-пиридилдитио)декан очищают флэш-хроматографией, элюируя системой смешанных растворителей DCM/MeOH (10:0,4).
(iv) Полученный на стадии (ii) пептид на смоле обрабатывают 1-(2-пиридилдитио)деканом, полученным на стадии (iii) и DIEA (3 экв., 0,75 ммоль) в течение ночи в системе смешанных растворителей ДМФА/1-пропанол (7:3). Затем смолу промывают ДМФА и N-концевую защитную группу Fmoc удаляют обработкой 25% раствором пиперидина в ДМФА в течение 30 мин. Затем пептид на смоле промывают ДМФА и DCM и сушат при пониженном давлении.
(v) Конечное отщепление проводят путем перемешивания пептида на смоле в 10 мл HF, содержащего 1 мл анизола приблизительно при 0°С в течение приблизительно 70 мин. Очистку проводят, следуя методу примера 3. Аналитической ВЭЖХ определяют, что чистота целевого продукта (выход 10,2%) составляет 99,9%. Анализ масс-спектрометрии с ионизацией электрораспылением (ESI-MS) показывает, что молекулярная масса продукта составляет 3432,1 (что находится в соответствии с рассчитанной молекулярной массой 3432,1).
Другие пептиды настоящего изобретения специалист в данной области сможет получить, следуя методикам синтеза, аналогично раскрытым в общих чертах в данном описании выше в соответствии с описанными в международной патентной публикации WO04/009616. Другие пептиды настоящего изобретения специалист в данной области сможет получить, используя методики синтеза, аналогично раскрытым в общих чертах в данном описании выше.
Синтез пептидильных аналогов формулы II, таких как H-Inp-D-Bal-D-Trp-Phe-Apc-NH2, H-Inp-D-2-Nal-D-Trp(Ψ)-Pim и H-Inp-D-Trp-D-2-Nal(Ψ)-Pim, можно проводить, следуя методике, описанной в международной патентной публикации WO04/014415 на страницах 33-44, следующим образом:
Пример 1: H-Apc-D-1-Nal-D-1-Nal-Phe-Apc-NH 2
Каждая реакционная лунка содержит 0,0675 ммоль смолы Rink Amide MBHA (замещение=0,72 ммоль/г, Novabiochem, San Diego, CA). Используют следующие Fmoc-аминокислоты (Novabiochem, San Diego, CA; Chem-Impex International, Wood Dale, IL; SyntheTech, Albany, OR; Pharma Core, High Point, NC): Fmoc-Lys(Boc)-OH, Fmoc-Phe-OH, Fmoc-H-Inp-OH, Fmoc-D-1Nal-OH, Fmoc-D-2Nal-OH, Fmoc-D-Trp(Boc)-OH, Fmoc-3Pal-OH, Fmoc-4Pal-OH, Fmoc-Orn(Boc)-OH, Fmoc-D-Bip-OH, Fmoc-Thr(Bzl)-OH, Fmoc-Pff-OH, Fmoc-2Thi-OH, Fmoc-Taz-OH, Fmoc-D-Dip-OH, Fmoc-D-Bpa-OH, Fmoc-D-Bal-OH и Fmoc-Apc(Boc)-OH.
Каждую Fmoc-аминокислоту растворяют в 0,3н. растворе HOBt в ДМФА с получением конечной концентрации Fmoc-аминокислоты 0,3н. Для каждой реакции сочетания используют четырехкратный избыток (0,27 ммоль, 0,9 мл 0,3н. раствора) Fmoc-аминокислоты. В каждой реакции сочетания в качестве агента сочетания используют DIC (0,27 ммоль, 0,6 мл 0,45н. раствор DIC в ДМФА). Защитные группы удаляют обработкой 20% раствором пиперидина в ДМФА (2×1,5 мл на остаток).
Пептиды отделяют от смолы обработкой пептида на смоле 8% раствором триизопропилсилана (TIP) в трифторуксусной кислоте (ТФУК) (1,5 мл на реакционную лунку) при комнатной температуре в течение 2 ч. Смолу удаляют фильтрованием. Каждый фильтрат разбавляют до 25 мл эфиром в центрифужной пробирке. Полученный осадок в каждой пробирке осаждают центрифугированием и растворители декантируют. Затем осадок в каждой пробирке растворяют в метаноле (3 мл) и разбавляют водой (1 мл). Продукты очищают препаративной ВЭЖХ на обращенной фазе, используя колонку (100×21,20 мм, 5 мкм) LUNA 5 мкм C8(2) (Phenomenex, Torrance, CA). Все пептиды элюируют на колонке с линейным градиентом от 85% A и 15% B до 25% A и 75% B в течение 15 мин со скоростью потока 25 мл/мин. A представляет собой 0,1% раствор ТФУК в воде, и B представляет собой 0,1% раствор ТФУК в смеси ацетонитрил/вода (80/20, об/об). Фракции, содержащие чистый продукт по данным аналитической ВЭЖХ, объединяют и лиофилизируют досуха.
Выход составляет от 13% до 71%, и чистота каждого из соединений примеров 1-65 превышает 94% по данным анализа аналитической ВЭЖХ. Значения молекулярной массы, полученные масс-спектрометрией с ионизацией электрораспылением (ES-MС) соответствуют рассчитанным значениям молекулярной массы. Результаты приведены в таблице I, ниже.
Пример 2: H-Inp-D-2-Nal-D-Trp(Ψ)-Pim
1.a. BOC-(D)-Trp-OH (4,0 г, 13,1 ммоль) (Novabiochem San Diego, Calif.) в метаноле (36 мл) и Cs2CO3 (2,14 г, 6,57 ммоль) в воде (10 мл) объединяют, затем смесь энергично перемешивают до получения гомогенной смеси. Растворители удаляют в вакууме и осадок растворяют в ДМФА (45 мл). К раствору добавляют 2-бромацетофенон (2,61 г, 13,1 ммоль) в ДМФА (9 мл) и перемешивают 30 мин при комнатной температуре. Бромид цезия удаляют фильтрованием и фильтрат концентрируют в вакууме. Полученный концентрат растворяют в ксилолах (45 мл), добавляют NH4OAc (17,1 г) и раствор нагревают при кипячении с обратным холодильником в течение 1 ч. Охлажденный раствор промывают два раза насыщенным раствором NaHСО3 (45 мл) и затем насыщенным раствором NaCl. Полученный органический слой очищают флэш-хроматографией, получая 4,1 г (77%) промежуточного соединения 1A, изображенного на схеме 1A ("соединение 1A").
Схема 1A
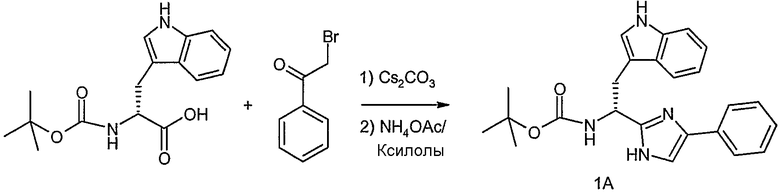
1b. Соединение 1A (403 мг) деблокируют смесью трифторуксусной кислоты (ТФУК) (8 мл), дихлорметана (DCM) (8 мл) и триизопропилсилана (TIPS) (1,4 мл). После перемешивания в течение одного часа раствор концентрируют в токе азота. Остаток растворяют в DCM (40 мл), промывают два раза насыщенным раствором NaHCO3 (40 мл) и затем сушат над Na2SO4, получая раствор промежуточного продукта 1B, изображенного на схеме 1B, ниже.
Схема 1В
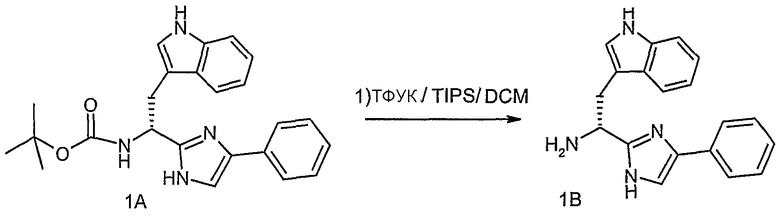
1c.-f. Полученный раствор промежуточного продукта 1B делят на четыре равные части и подвергают сочетанию с предварительно активированными HOBT сложными эфирами FMOC-защищенных аминокислот, как показано на приведенных ниже схемах реакций 1С, 1D, 1E и 1F. Используют аминокислоту FMOC-D-2Nal-OH (130 мг, 0,30 ммоль) (Synthetech Albany, Oregon). Каждую из указанных выше аминокислот предварительно активируют HOBT (46 мг, 0,30 ммоль) и DIC (38 мг, 0,30 ммоль) в DCM (5 мл) в течение десяти минут, затем добавляют к одной из четырех порций полученного выше раствора промежуточного продукта 1B. Затем реакции сочетания дают возможность протекать в течение 30 минут при комнатной температуре.
Схема 1С
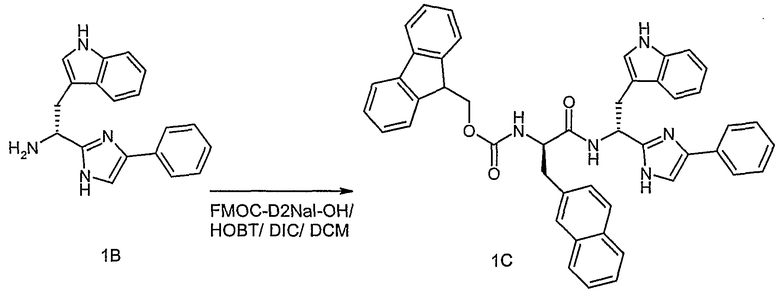
Схема 1D

Схема 1Е
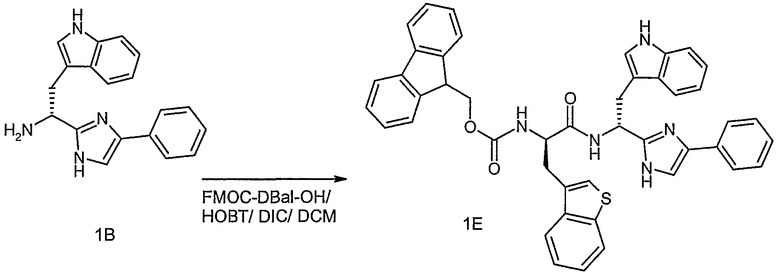
Схема 1F
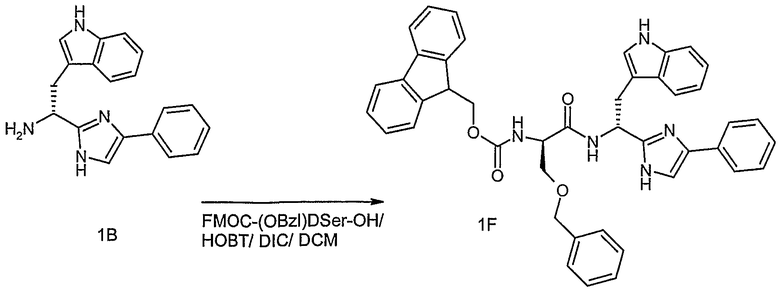
1g.-j. Группу FMOC удаляют со всех полученных соединений 1С, 1D, 1E и 1F путем добавления трис(2-аминоэтил)амина (0,9 мл) к соответствующим реакционным смесям, полученным на предыдущей стадии, с последующим перемешиванием в течение 30 минут при комнатной температуре. Затем реакционные смеси, содержащие деблокированные соединения, промывают три раза 10% фосфатным буфером, pH 5,5 (10 мл).
Полученные растворы свободных аминов подвергают реакции сочетания с FMOC-Inp-OH (105 мг, 0,30 ммоль) (Chem Impex Wood Dale, IL), которую предварительно активируют HOBT (46 мг, 0,30 ммоль) и DIC (38 мг, 0,30 ммоль) в DCM (5 мл) в течение 10 минут, затем добавляют к соответствующим образом защищенному амину. Затем реакции сочетания дают возможность протекать в течение одного часа при комнатной температуре.
Группу FMOC удаляют с полученного FMOC-защищенного соединения путем добавления трис(2-аминоэтил)амина (0,9 мл) и перемешивания в течение 30 минут. Деблокированные соединения промывают три раза 10% фосфатным буфером, pH 5,5 (10 мл), и неочищенные продукты собирают в виде осадка.
BOC-защищенные соединения очищают флэш-хроматографией и затем деблокируют в течение одного часа с помощью TIPS (0,50 мл) и ТФУК (0,50 мл) в DCM (2,75 мл). Затем неочищенные продукты концентрируют и сушат в вакууме.
Приведенные выше стадии удаления защитных групп, сочетания и удаления защитных групп изображены на представленных ниже схемах 1G, 1H, 1I и 1J
Схема 1G
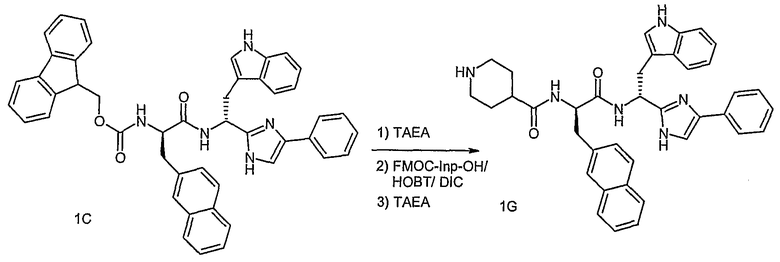
Схема 1H

Схема 1I

Схема 1J
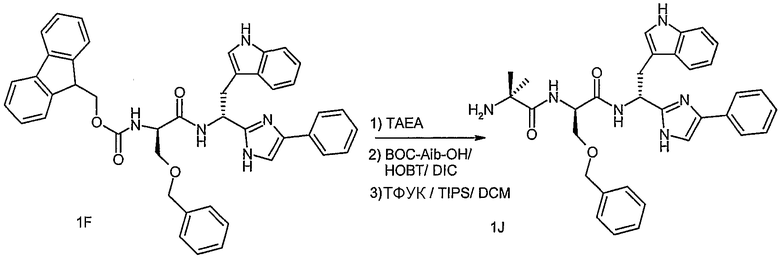
Пример 3: H-Inp-D-Trp-D-2-Nal(Ψ)-Pim
2.a.1 и 2.a.2.: Соединение 2A получают по методике аналогично получению соединения 1A, используя в качестве исходных веществ BOC-D-2Nal-OH и 2-бромацетофенон.
Стадии 2.a.1. и 2.a.2. показаны на приведенной ниже схеме 2A.
Схема 2A
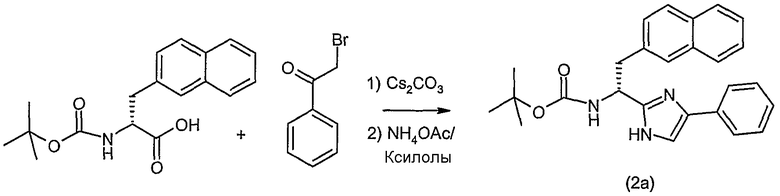
2.b.1. Соединение 2A (100 мг, 0,242 ммоль) деблокируют с помощью ТФУК (2 мл) и DCM (2 мл) в течение одного часа. Летучие вещества удаляют в токе азота и остаток растворяют в DCM (10 мл). Полученный раствор промывают три раза насыщенным раствором NaHCO3 (10 мл), получая раствор соединения 2A в виде свободного амина.
2.b.2. Активированный эфир FMOC-D-Trp-(BOC)-OH (153 мг, 0,290 ммоль) получают заранее взаимодействием с N-гидроксисукцинимидом (HOSu; 33 мг, 0,290 ммоль) и DIC (37 мг, 0,290 ммоль) в DCM (1,5 мл). Через час диизопропилмочевину удаляют фильтрованием и фильтрат добавляют к раствору соединения 2A (свободный амин). Полученный раствор разбавляют DCM до 4 мл и реакции сочетания дают возможность протекать в течение 30 минут.
Стадии 2.b.1. и 2.b.2. изображены ниже на схеме 2B.
Схема 2B

2.c.1 Соединение 2B деблокируют путем добавления трис(2-аминоэтил)амина (TAEA) (0,9 мл) к только что полученному на предшествующей стадии сочетания реакционному раствору и последующего перемешивания в течение 30 минут при комнатной температуре. Затем реакционный раствор промывают три раза насыщенным раствором NaCl (10 мл) и затем три раза 10% фосфатным буфером, pH 5,5 (10 мл), получая раствор соединения 2B в виде свободного амина.
2.c.2. Активированный эфир BOC-Inp-OH (66,5 мг, 0,290 ммоль) получают заранее взаимодействием с HOSu (33 мг, 0,290 ммоль) и DIC (37 мг, 0,290 ммоль) в DCM (1,5 мл). Через час диизопропилмочевину удаляют фильтрованием и фильтрат добавляют к раствору соединения 2B (свободный амин). Полученный раствор разбавляют DCM до 4 мл, затем реакции сочетания дают возможность протекать в течение 12 часов.
Реакционную смесь затем промывают три раза 10% фосфатным буфером, pH 5,5 (10 мл), и сушат над Na2SO4. Растворитель удаляют в вакууме и концентрат очищают флэш-хроматографией.
2.c.3. Промежуточное соединение деблокируют, используя ТФУК (2,75 мл) и TIPS (0,5 мл) в DCM (2,75 мл) в течение 30 минут. Летучие вещества удаляют из реакционной смеси в токе азота, затем остаток растирают с эфиром (15 мл). После центрифугирования эфир декантируют и полученное твердое вещество подвергают ВЭЖХ, получая очищенное соединение 70 с выходом 39%.
Стадии 2.c.1., 2.c2. и 2.c.3. изображены ниже на схеме 2C.
Схема 2C
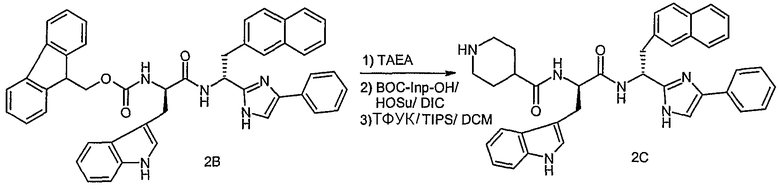
Другие примеры синтеза соединений формулы III приведены ниже для дополнительной иллюстрации различных признаков настоящего изобретения. Данные примеры также иллюстрируют методику, которую можно использовать для осуществления изобретения. Указанные примеры не ограничивают изобретение, согласно формуле изобретения.
(Ac-Aib 1 , Aib 2,10 , Glu(NH-гексил) 3,17 )hГрелин(1-28)-NH 2
Указанный в заголовке пептид синтезируют на пептидном синтезаторе Applied Biosystems®, модель 433A (полученном от Applied Biosystems®, Foster City, CA, U.S.A.), с использованием химии флуоренилметилоксикарбонила (Fmoc). Используют смолу Rink амид-4-метилбензилгидриламин (MBHA) (поставляемую Novabiochem®, San Diego, CA) с замещением 0,64 ммоль/г. Используют следующие Fmoc-аминокислоты (поставляемые AnaSpec®, San Jose, CA, U.S.A.): Fmoc-Ala-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Aib-OH, Fmoc-Gln(Trt)-OH, Fmoc-Glu(tBu)-OH, Fmoc-His(Trt)-OH, Fmoc-Leu-OH, Fmoc-Lys(Boc)-OH, Fmoc-Phe-OH, Fmoc-Pro-OH, Fmoc-Ser(tBu)-OH и Fmoc-Val-OH. Кроме того, используют в качестве аминокислоты Fmoc-Glu(О-2-PhiPr)-OH (поставляемую Novabiochem®, San Diego, CA) в положениях 3 и 17. Синтез проводят в масштабе 0,1 ммоль. Группы Fmoc удаляют обработкой смолы 20% раствором пиперидина в N-метилпирролидоне (NMP) в течение приблизительно 30 минут. На каждой стадии конденсации Fmoc-аминокислоту (3 экв, 0,3 ммоль) предварительно активируют 2 мл раствора 0,45M гексафторфосфат 2-(1-H-бензотриазол-1-ил)-1,1,2,3-тетраметилурония/1-гидроксибензотриазола (HBTU/HOBT) в NMP. Раствор, содержащий активированный эфир аминокислоты вместе с 1 мл диизопропилэтиламина (DIEA) и 1 мл NMP, добавляют к смоле. Пептидный синтезатор ABI 433A® программируют для выполнения следующего реакционного цикла:
(1) промывание NMP;
(2) удаление защитной группы Fmoc с помощью 20% раствора пиперидина в NMP в течение 30 минут;
(3) промывание NMP; и
(4) сочетание предварительно активированной Fmoc-аминокислоты в течение приблизительно 1 или 3 часов.
Смолу последовательно подвергают реакциям сочетания в соответствии с последовательностью указанного в заголовке пептида. После сборки пептидной цепи смолу целиком промывают N,N-диметилформамидом (ДМФА) и дихлорметаном (DCM).
По окончании сборки пептидной цепи на пептидном синтезаторе ABI 433A® (без остатка Fmoc-Aib в A1), пептид на смоле переносят в реакционный сосуд на шейкере и удаляют Fmoc с помощью 25% раствора пиперидина в ДМФА в течение 30 минут. Затем смолу промывают ДМФА. Fmoc-Aib-OH (0,4 ммоль) подвергают реакции сочетания, используя TFFH (гексафторфосфат тетраметилфторформамидиния) (полученный от Perceptive Biosystems®, Warrington, U.K.) (0,4 ммоль), HOAt (0,4 ммоль), DMAP (диметиламинопиридин) (0,1 г) и DIEA (1,2 ммоль), один раз в течение 4 часов и затем в течение ночи.
Группу Fmoc удаляют, как описано выше, и пептид кэпируют, используя Ac2O (уксусный ангидрид) (5 ммоль) и DIEA (5 ммоль) в ДМФА в течение приблизительно 30 минут. Группу PhiPr (γ-2-фенилизопропиловый эфир) удаляют с остатков глутамина в A3 и A17 путем двукратного промывания 3% раствором ТФУК в DCM в течение 10 минут каждый раз. Boc, частично удаленный с боковой цепи лизина, заменяют, используя Вос2О (0,8 ммоль) и DIEA (0,8 ммоль) в DCM в течение ночи. Смолу обрабатывают PyAOP (гексафторфосфат 7-азабензотриазол-1-илокситрис(пирролидино)фосфония) (полученным от Applied Biosystems®, Foster City, CA, U.S.A.) (0,6 ммоль), HOAt (0,6 ммоль), DMAP (0,1 г) и DIEA (1,8 ммоль) в течение 10 минут. Затем к раствору смолы добавляют гексил-NH2 (гексиламин) (полученный от Sigma-Aldrich Chemicals®, St. Louis, MO, U.S.A.) (2,0 ммоль), встряхивают и оставляют стоять в течение ночи.
Чтобы отсоединить указанный в заголовке пептид от смолы, пептид на смоле обрабатывают смесью ТФУК, Н2О и триизопропилсилана (TIS) (9,5 мл/0,85 мл/0,8 мл, соответственно) в течение приблизительно 4 часов. Отсоединенную смолу отфильтровывают и оставшийся фильтрат выливают в 200 мл эфира. Полученный осадок собирают фильтрованием. Неочищенный продукт растворяют в смеси ацетонитрила и воды и затем очищают препаративной ВЭЖХ на обращенной фазе с использованием колонки (4×43 см) С18 DYNAMAX-100 A0® (полученной от Varian®, Walnut Creek, CA, U.S.A.). Колонку элюируют в течение приблизительно 1 часа, используя линейный градиент от 85% A:15% B до 60% A:40% B, где A представляет собой 0,1% раствор ТФУК в воде, и B представляет собой 0,1% раствор ТФУК в ацетонитриле. Фракции, содержащие по данным ВЭЖХ чистый продукт, объединяют и лиофилизируют досуха. Получают приблизительно 27,1 мг (6,3%) белого твердого вещества, чистота которого по данным ВЭЖХ составляет приблизительно 97,5%. Анализ масс-спектрометрии с ионизацией электрораспылением (ESI MS) показывает, что молекулярная масса продукта составляет 3477,4 (что находится в соответствии с рассчитанной молекулярной массой 3477,19).
(Aib 1,2,10 , Glu(NH-гексил) 3,17 )hгрелин(1-28)NH 2
Указанный в заголовке пептид синтезируют в соответствие с методикой, описанной для получения соединения примера 158, т.е. (Ac-Aib1, Aib2,10, Glu(NH-гексил)3,17)hгрелин(1-28)-NH2), за исключением того, что: после сочетания последней Fmoc-Aib-OH в положении 1 на шейкере защитные группы PhiPr удаляют с остатков глутамина в A3 и A17 двукратным промыванием 3% раствором ТФУК в DCM в течение интервалов времени, составляющих приблизительно 10 минут. Boc, частично удаленные с боковых цепей лизина, заменяют, используя раствор BОC2O (0,8 ммоль) и DIEA (0,8 ммоль) в DCM. Смолу встряхивают, оставляют стоять в течение ночи и затем обрабатывают раствором PyAOP (гексафторфосфат 7-азабензотриазол-1-илокситрис(пирролидино)фосфония) (полученным от Applied Biosystems®, Foster City, CA, U.S.A.) (0,6 ммоль), HOAt (0,6 ммоль), DMAP (0,1 г) и DIEA (1,8 ммоль) в течение 10 минут, затем к раствору добавляют гексил-NH2 (гексиламин) (полученный от Sigma-Aldrich, St. Louis, MO, U.S.A.) (2,0 ммоль), встряхивают и оставляют стоять в течение ночи. Затем защитную группу Fmoc удаляют с помощью 25% раствора пиперидина в ДМФА. Пептид отсоединяют от смолы и очищают ВЭЖХ, как подробно описано выше для синтеза соединения примера 158.
По данным ВЭЖХ чистота полученного продукта составляет приблизительно 96,5%. С помощью метода масс-спектрометрии с ионизацией электрораспылением (ESI MС) определяют молекулярную массу продукта, которая составляет 3435,00, что находится в соответствии с рассчитанной молекулярной массой 3369,9.
B. Биологические анализы
Активность соединений данного изобретения в отношении рецептора GHS можно определить, например, с помощью методов, описанных в приведенных ниже примерах. В различных вариантах осуществления функциональная активность аналога грелина составляет по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 98% или более, от активности грелина по результатам одного или нескольких из приведенных ниже анализов на функциональную активность; и/или IC50 аналога грелина составляет более чем приблизительно 1000 нМ, более чем приблизительно 100 нM или более чем приблизительно 50 нM, по данным описанного ниже анализа связывания рецептора. Показатель IC50 связан с эффективностью и, следовательно, чем больше его значение, тем меньше требуется соединения для достижения ингибирования связывания.
В анализах, измеряющих способность соединения связываться с рецептором GHS, используют рецептор GHS, фрагмент данного рецептора, содержащий участок связывания грелина, полипептид, содержащий такой фрагмент, или производное такого полипептида. Предпочтительно в анализе используют рецептор GHS или его фрагмент.
Полипептид, содержащий грелин-связывающий фрагмент рецептора GHS, также может содержать один или несколько полипептидных участков, не обнаруженных в рецепторе GHS. Производное такого полипептида содержит грелин-связывающий фрагмент рецептора GHS вместе с одним или несколькими непептидными компонентами.
Аминокислотную последовательность рецептора GHS, участвующую в связывании грелина, может быть легко идентифицирована, используя меченый грелин или меченые аналоги грелина, и различные фрагменты рецептора. Фрагменты, подлежащие тестированию с целью сужения участка связывания, можно выбрать с помощью различных стратегий. Примеры таких стратегий предусматривают тестирование последовательных фрагментов, составляющих приблизительно 15 аминокислот в длину, начиная с N-конца, и тестирование более длинных фрагментов. При тестировании более длинных фрагментов грелин-связывающий фрагмент можно разделить на более мелкие участки, чтобы дополнительно локализовать участок связывания грелина. Фрагменты, используемые в анализах связывания, можно получить с применением рекомбинантных нуклеиновых кислот.
Анализы связывания можно проводить с использованием индивидуальных соединений или препаратов, содержащих разное число соединений. Препарат, содержащий разное число соединений, обладающих способностью связываться с рецептором GHS, можно подразделить на более мелкие группы соединений, которые можно тестировать для идентификации соединения (соединений), связывающегося с рецептором GHS. В одном варианте осуществления настоящего изобретения в анализе связывания используют препарат, содержащий по меньшей мере 10 соединений.
Анализы связывания можно проводить с использованием полученных рекомбинантными методами полипептидов рецептора GHS, присутствующих в различных средах. Такие среды включают, например, клеточные экстракты и очищенные клеточные экстракты, содержащие полипептид рецептора GHS, кодируемый рекомбинантной нуклеиновой кислотой или природной нуклеиновой кислотой; кроме того, они включают, например, применение очищенного полипептида рецептора GHS, полученного с использованием рекомбинантной нуклеиновой кислоты или природной нуклеиновой кислоты, который вводят в другую среду.
B.1 Скрининг соединений, активных в отношении рецептора GHS
Скрининг соединений, активных в отношении рецептора GHS, проще проводить с использованием рецептора, полученного рекомбинантными методами. Применение рекомбинантного рецептора GHS имеет ряд преимуществ, например, возможность экспрессировать рецептор в определенной клеточной системе таким образом, чтобы дать возможность более легкого установления различий между ответом на соединение, опосредованным рецептором GHS, и ответами, опосредованными другими рецепторами. Например, рецептор GHS можно экспрессировать в клеточной линии, такой как HEK 293, COS 7 или CHO, которая обычно не экспрессирует данный рецептор, путем введения вектора экспрессии, и такую же клеточную линию, не содержащую вектора экспрессии, можно использовать в качестве контроля.
Скрининг соединений, уменьшающих активность рецептора GHS, предпочтительно проводят с использованием аналога грелина. Аналог грелина обеспечивает активность рецептора GHS в скрининге. Путем измерения влияния тестируемого соединения на такую активность можно идентифицировать, например, аллостерические модуляторы и антагонисты.
Активность рецептора GHS можно измерять, используя различные методы, такие как детекция изменений во внутриклеточной конформации рецептора GHS, в активности, связанной с G-белком, и/или во внутриклеточных месседжерах. Предпочтительно активность рецептора GHS определяют, используя такие методы, как измерение внутриклеточного Ca2+. Примеры хорошо известных в данной области методов измерения Ca2+ включают применение красителей, таких как Fura-2, и использование Ca2+-биолюминесцентных чувствительных репортерных белков, таких как экворин. Примером клеточной линии, с использованием экворина для измерения активности G-белка, является HEK293/aeq17 (Button, D. et al, Cell Calcium, (1993), 14(9):663-71; и Feighner, S. D. et al, Science, (1999), 284(5423):2184-8).
Для измерения активности рецептора GHS также можно использовать химерные рецепторы, содержащие грелин-связывающий участок, функционально связанный с другим G-белком. Химерный рецептор GHS содержит N-концевой внеклеточный домен; трансмембранный домен, состоящий из трансмембранных участков, участки внеклеточной петли и участки внутриклеточной петли; и внеклеточный карбокси-конец. Способы получения химерных рецепторов и измерения ответов, опосредованных G-белком, описаны, например, в Международной заявке WO 97/05252 и патенте США № 5264565, которые включены в данное описание в качестве ссылки.
Аналоги грелина можно использовать для стимуляции активности рецептора GHS. Такую стимуляцию можно использовать, например, для исследования эффекта модуляции рецептора GHS, секреции гормона роста, поиска или анализа антагонистов грелина, или для улучшения состояния субъекта. Полагают, что аналоги грелина настоящего изобретения можно использовать для стимуляции двигательной функции желудочно-кишечного тракта.
B.1.a. Получение клеток CHO-K1, экспрессирующих рекомбинантный рецептор GHS человека
кДНК рецептора фактора, усиливающего секрецию человеческого гормона роста (hGHS-R, или рецептора грелина), клонируют методом полимеразной цепной реакции (ПЦР), используя в качестве матрицы РНК мозга человека (Clontech, Palo Alto, CA), ген-специфичные праймеры, фланкирующие полноразмерную кодирующую последовательность hGHS-R (S: 5'-ATGTGGAACGCGACGCCCAGCGAAGAG-3' и AS: 5'-TCATGTATTAATACTAGATTCTGTCCA-3'), и набор для ПЦР Advantage 2 (Clontech, Palo Alto, CA). Продукт ПЦР клонируют в векторе pCR2.1®, используя набор для клонирования OriGlnal TA® (Invitrogen, Carlsbad, CA). Полноразмерный GHS-R человека субклонируют в векторе экспрессии млекопитающих pcDNA 3.1® (Invitrogen, Carlsbad, CA). Плазмиду трансфицируют в линию клеток яичников китайского хомячка CHO-K1 (Американская коллекция типовых культур, Rockville, MD) кальций-фосфатным методом (Wigler, M. et al, Cell, (1977), 11(1):223-32). Клоны одиночных клеток, стабильно экспрессирующие hGHS-R, получают путем селекции трансфицированных клеток, выращенных в клонзапирающих кольцах в среде RPMI 1640, дополненной 10% фетальной телячьей сывороткой и 1 мM пируватом натрия и содержащей 0,8 мг/мл G418 (Gibco®, Grand Island, NY, U.S.A.).
B.1.b Анализ связывания рецептора GHS:
Мембраны для анализа связывания можно получить путем гомогенизации указанных выше клеток CHO-K1, экспрессирующих рекомбинантный рецептор GHS человека. Клетки гомогенизируют в 20 мл охлажденного на льду 50 мM Tris-HCl с использованием Brinkman Polytron® (Westbury, NY; setting 6, 15 sec). Гомогенаты промывают дважды центрифугированием (39000 g/10 мин) и конечные осадки ресуспендируют в 50 мM Tris-HCl, содержащем 2,5 мM MgCl2 и 0,1% бычьего сывороточного альбумина (BSA). Чтобы провести данный анализ аликвоты объемом 0,4 мл инкубируют с 0,05 нM (125I)грелин (~2000 Ки/ммоль, Perkin Elmer Life Sciences, Boston, MA) в присутствии или в отсутствии 0,05 мл немеченого конкурирующего тестируемого пептида. После инкубации в течение 60 мин при 4°C связанный (125I)грелин отделяют от свободного (125I)грелина быстрым фильтрованием через фильтры GF/C (Brandel, Gaithersburg, MD), которые предварительно пропитывают 0,5% полиэтиленимином/0,1% BSA. Затем фильтры промывают три раза 5-мл аликвотами охлажденного на льду 50 мM Tris-HCl и 0,1% BSA, и связанную радиоактивность на фильтрах считают методом гамма-спектрометрии (Wallac LKB, Gaithersburg, MD). Специфическое связывание определяют как общее количество связанного (125I)грелина минус количество, связанное в присутствии 1000 нM грелина (Bachern, Torrence, CA).
Выбранные предпочтительные варианты осуществления тестировали с использованием описанного выше анализа связывания рецептора, результаты приведены ниже в таблице 1.
Значения Ki связывания рецептора для выбранных соединений
B.2. Анализ функциональной активности GHS-R
B.2.a. Мобилизация внутриклеточного iCa 2+ in vitro, опосредуемая рецептором GSH
Упомянутые выше клетки CHO-K1, экспрессирующие рецептор GSH человека, собирают путем инкубации в 0,3% EDTA/забуференном фосфатом физиологическом растворе (25°C) и промывают дважды центрифугированием. Промытые клетки ресуспендируют в физиологическом растворе, забуференном раствором Хэнкса (HBSS), и нагружают флуоресцентным индикатором Ca2+ Fura-2AM. Клеточные суспензии с концентрацией приблизительно 106 клеток/мл инкубируют с 2 мкM Fura-2AM в течение 30 мин приблизительно при 25°C. Незагруженный Fura-2AM удаляют двойным центрифугированием в HBBS, затем полученные суспензии переносят в спектрофотометр (Hitachi F-2000), оборудованный магнитной мешалкой и держателем кювет с регулируемой температурой. После уравновешивания при 37°C добавляют аналоги грелина и измеряют мобилизацию внутриклеточного Ca2+. Длины волн возбуждения и испускания составляют 340 и 510 нм, соответственно.
B.2.b. Высвобождение/супрессия GH in vivo
Как известно в данной области, соединения можно тестировать на способность стимулировать или подавлять высвобождение гормона роста (GH) in vivo (Deghenghi, R. et al, Life Sciences, (1994), 54(18): 1321-8; and International Patent Application No. PCT/EP01/07929 [WO 02/0B250]). Так, например, чтобы определить способность соединения стимулировать высвобождение GH in vivo, соединение можно ввести крысам возрастом 10 дней подкожно в дозе, например, 300 мг/кг. Уровень GH в крови можно определить, например, через 15 минут после введения и сравнить его с уровнем GH у крыс, получавших контрольный растворитель.
B.3. Влияние на двигательную функцию желудочно-кишечного тракта
Было показано, что у субъектов, страдающих от пареза желудка, грелин усиливает двигательную функцию желудка и улучшает его опорожнение. Выбранные соединения данного изобретения можно тестировать на способность влиять на опорожнение желудка и прохождение содержимого через кишечник.
В.3.а. Анализ влияния грелина на прохождение содержимого через кишечник in vivo
Проводят анализ влияния нативного грелина и пептидильного аналога грелина, H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (пример 19), на прохождение содержимого через кишечник. В данном исследовании группы из восьми крыс держат на голодной диете со свободным доступом к воде в течение приблизительно 24 часов. 25 тестируемым субъектам под наркозом вводят нативный грелин, выбранный аналог и атропин в качестве контроля. Примерно через пять минут после начального введения грелина, выбранного аналога или атропина субъектам через желудочный зонд вводят 2 мл угольной муки. Еще примерно через 25 минут тестируемых субъектов умерщвляют путем разрыва шейных позвонков и удаляют тонкий кишечник. Расстояние, на которое переместился уголь, измеряют от пилоруса. Как грелин, так и тестируемый пептидильный аналог грелина (H-Inp-D-Bal-D-Trp-Phe-Apc-NH2) ускоряют прохождение содержимого через желудочно-кишечный тракт.
В.3.b. Анализ влияния грелина на опорожнение желудка in vivo
Выбранные соединения данного изобретения можно тестировать на способность влиять на опорожнение желудка. Анализируют влияние нативного грелина и пептидильного аналога грелина, H-Inp-D-Bal-D-Trp-Phe-Apc-NH2, на опорожнение желудка. В данном исследовании группы из восьми самцов крыс Sprague Dawley (массой 200-250 г) держат на голодной диете со свободным доступом к воде в течение приблизительно 24 часов. Тестируемым субъектам под наркозом внутривенно вводят нативный грелин, выбранный аналог грелина и метоклопрамид в качестве контрольного соединения. Приблизительно через пять минут после начального введения нативного грелина, выбранного аналога грелина или контрольного соединения, каждому тестируемому субъекту через желудочный зонд вводят 1,5 мл муки, меченной феноловым красным (0,5 мг/мл фенолового красного и 1,5% метилцеллюлозы в цельном молоке). Еще приблизительно через 20 минут тестируемых субъектов умерщвляют путем разрыва шейных позвонков, желудки удаляют и отдельно измельчают. Остаток фенолового красного экстрагируют из желудка тестируемых субъектов и измеряют спектрофотометрически при длине волны 560 нм. Как грелин, так и тестируемый пептидильный аналог грелина (H-Inp-D-Bal-D-Trp-Phe-Apc-NH2) ускоряют опорожнение желудка.
В других экспериментах группы из восьми самцов крыс Sprague Dawley (массой 200-250 г) держат на голодной диете со свободным доступом к воде в течение приблизительно 24 часов. Животным вводят под кожу либо среду, либо разные дозы нативного грелина или выбранного аналога грелина. Примерно через 15 минут крысам перорально вводят 1,5 мл питательной муки, меченной феноловым красным (0,5 мг/мл фенолового красного и 1,5% метилцеллюлозы в цельном молоке). Еще приблизительно через 15 минут субъектов умерщвляют путем разрыва шейных позвонков и, после зажима пилоруса и кардии, удаляют желудок. Остаток фенолового красного экстрагируют из желудка и измеряют спектрофотометрическими методами при длине волны 560 нм. Как грелин, так и тестируемый пептидильный аналог грелина (H-Inp-D-Bal-D-Trp-Phe-Apc-NH2) ускоряют опорожнение желудка (см. фигуры).
B.3.c. Влияние на POI у крыс
У самцов крыс Sprague Dawley (массой 200-250 г) индуцируют желудочно-кишечную непроходимость путем 3-сантиметровой лапаротомии под анестезией изофлураном. Мышцы живота и кожу зашивают и животных оставляют восстанавливаться в течение приблизительно двух часов сорока пяти минут. В это время животным, перенесшим лапаротомию, подкожно вводят среду или выбранный аналог грелина. Приблизительно через 15 минут после введения соединения или среды животным вводят муку, меченную феноловым красным (см. выше). Еще приблизительно через 15 минут тестируемых субъектов умерщвляют путем разрыва шейных позвонков и измеряют опорожнение желудка, как описано выше. Как грелин, так и тестируемый пептидильный аналог грелина (H-Inp-D-Bal-D-Trp-Phe-Apc-NH2) значительно ускоряют опорожнение желудка в условиях послеоперационной кишечной непроходимости.
B.3.d. Влияние на POI у крыс в присутствии морфина
У самцов крыс Sprague Dawley (массой 200-250 г) индуцируют желудочно-кишечную непроходимость путем 3-сантиметровой лапаротомии под анестезией изофлураном. Мышцы живота и кожу зашивают и животных оставляют восстанавливаться в течение приблизительно 2,5 часов, в это время животным, перенесшим лапаротомию, подкожно вводят 4 мг/кг морфина. Приблизительно через 15 минут животным, перенесшим лапаротомию, подкожно вводят среду или выбранный аналог грелина. Приблизительно через 15 минут после введения соединения или среды животным вводят муку, меченную феноловым красным (см. выше). Еще приблизительно через 15 минут тестируемых субъектов умерщвляют путем разрыва шейных позвонков и измеряют опорожнение желудка, как описано выше. Как можно видеть из фигур, грелин и его аналог значительно ускоряют опорожнение желудка в присутствии морфина в условиях послеоперационной кишечной непроходимости.
Специалистам в данной области известно, что для определения влияния аналога грелина на опорожнение желудка и прохождение содержимого через кишечник можно использовать анализы, подобно описанным выше.
Введение
Аналоги грелина могут быть получены и введены субъекту с использованием приведенных в данном описании руководств, согласно методикам, хорошо известным в данной области. Предпочтительный путь введения обеспечивает доставку эффективного количества соединения к мишени. Общие руководства по введению фармацевтических средств приведены, например, в Remington's Pharmaceutical Sciences 18th Edition, Ed. Gennaro, Mack Publishing, 1990, и Modem Pharmaceutics 2nd Edition, Eds. Banker and Rhodes, Marcel Dekker, Inc., 1990, которые включены в данное описание в качестве ссылки.
Аналоги грелина могут быть получены в виде кислых или основных солей. Фармацевтически приемлемые соли (в виде растворимых или диспергируемых в воде или масле продуктов) включают традиционные нетоксичные соли или соли четвертичного аммония, полученные, например, из неорганических или органических кислот или оснований. Примеры таких солей включают кислотно-аддитивные соли, такие как ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат; и основные соли, такие как соли аммония, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли органических оснований, такие как соли дициклогексиламина, N-метил-D-глюкамина, а также соли аминокислот, таких как аргинин и лизин.
Аналоги грелина можно вводить различными путями, включая пероральный, назальный, путем инъекции, чрезкожно и через слизистую оболочку. Суспензию для перорального введения, содержащую активные ингредиенты, можно получить с помощью методов, хорошо известных в области фармацевтики, такая суспензия может содержать микрокристаллическую целлюлозу для придания массы, альгиновую кислоту или альгинат натрия в качестве суспендирующего средства, метилцеллюлозу в качестве средства, повышающего вязкость, а также подсластители/ароматизаторы. Композиции в виде таблеток с быстрым высвобождением могут содержать микрокристаллическую целлюлозу, дикальций фосфат, крахмал, стеарат магния и лактозу и/или другие наполнители, связующие средства, расширители, дезинтегрирующие средства, разбавители и лубриканты.
Композиции в виде назального аэрозоля или для ингаляции можно получить, например, в виде растворов в физиологическом растворе, с использованием бензилового спирта или других подходящих консервантов, стимуляторов абсорбции для увеличения биодоступности, фторуглеродов и/или других солюбилизирующих или диспергирующих средств.
Аналоги грелина также можно вводить в виде форм для внутривенного (как болюсного, так и путем инфузии), внутрибрюшинного, подкожного, местного в открытом или закрытом виде или внутримышечного введения. В случае введения путем инъекции раствор или суспензию для инъекции можно получить с использованием подходящих, нетоксичных, парентерально приемлемых разбавителей или растворителей, таких как раствор Рингера или изотонический раствор хлорида натрия или подходящих диспергирующих или увлажняющих и суспендирующих средств, таких как стерильные, легкие, жирные масла, включающие синтетические моно- или диглицериды и жирные кислоты, например олеиновую кислоту.
Подходящие режимы дозирования предпочтительно определяют с учетом хорошо известных в данной области факторов, которые включают тип субъекта, получающего дозу; возраст, массу, пол и состояние здоровья субъекта; способ введения; функционирование почек и печени субъекта; желаемый эффект; и вид конкретного используемого соединения.
Оптимальная точность при получении концентраций в интервале, обеспечивающем эффективность в отсутствие токсичности, зависит от кинетики, характеризующей способность лекарственного средства достигать участки-мишени. Такая кинетика включает распределение, равновесные концентрации и выведение лекарственного средства. Суточная доза для субъекта предположительно составляет от 0,01 до 1000 мг в день.
Аналоги грелина могут быть предоставлены в наборе. Такой набор обычно содержит активное соединение в составе дозированной формы, предназначенной для введения. Дозированная форма содержит количество активного соединения, достаточное для достижения желаемого эффекта при введении субъекту с регулярными интервалами, например от 1 до 6 раз в день, в течение 1 или нескольких дней. Предпочтительно набор содержит инструкции, описывающие способ применения дозированной формы, обеспечивающий желаемый эффект, и количество дозированной формы, которое следует принимать в течение указанного периода времени.
Данное изобретение описано в иллюстративной манере и следует понимать, что используемая терминология предназначена скорее для описания, чем для ограничения. Очевидно, что на основе приведенных выше разъяснений можно осуществить многочисленные модификации и вариации настоящего изобретения. Таким образом, следует понимать, что в пределах объема прилагаемой формулы осуществление изобретения может отличаться от приведенного в описании.
Патентная и научная информация, приведенная в данном описании, содержит информацию, доступную для специалистов в данной области. Все патенты, патентные и другие публикации, указанные в данном описании, включены в него в качестве ссылки во всей полноте.
Другие варианты осуществления
Приведенное выше описание ограничено конкретными вариантами осуществления данного изобретения. Однако будет очевидно, что могут быть осуществлены вариации и модификации данного изобретения с сохранением некоторых или всех преимуществ данного изобретения. Такие варианты осуществления также входят в объем следующей ниже формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ СТИМУЛЯЦИИ ДВИГАТЕЛЬНОЙ ФУНКЦИИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2006 |
|
RU2566708C2 |
| АНАЛОГИ ГРЕЛИНА | 2003 |
|
RU2315059C2 |
| АНАЛОГИ ГРЕЛИНА | 2003 |
|
RU2373220C2 |
| АНАЛОГИ ГРЕЛИНА | 2006 |
|
RU2427587C2 |
| АНАЛОГИ ГРЕЛИНА С ЗАМЕЩЕНИЕМ НА N-КОНЦЕ | 2007 |
|
RU2459831C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ЛИГАНДОВ РЕЦЕПТОРОВ СЕКРЕТАГОГОВ ГОРМОНА РОСТА | 2011 |
|
RU2523566C2 |
| РИЛИЗИНГ-ПЕПТИДЫ РОСТОВОГО ГОРМОНА | 2003 |
|
RU2323941C2 |
| СПОСОБ СИНТЕЗА ТЕРАПЕВТИЧЕСКИХ ПЕПТИДОВ | 2012 |
|
RU2625793C2 |
| ПРИМЕНЕНИЕ МЕЛАНОКОРТИНОВ ДЛЯ ЛЕЧЕНИЯ ЧУВСТВИТЕЛЬНОСТИ К ИНСУЛИНУ | 2008 |
|
RU2453328C2 |
| СПОСОБ ЛЕЧЕНИЯ НАРУШЕНИЙ, АССОЦИИРОВАННЫХ С ПУТЕМ РЕЦЕПТОРА МЕЛАНОКОРТИНА 4 | 2016 |
|
RU2785889C1 |































































































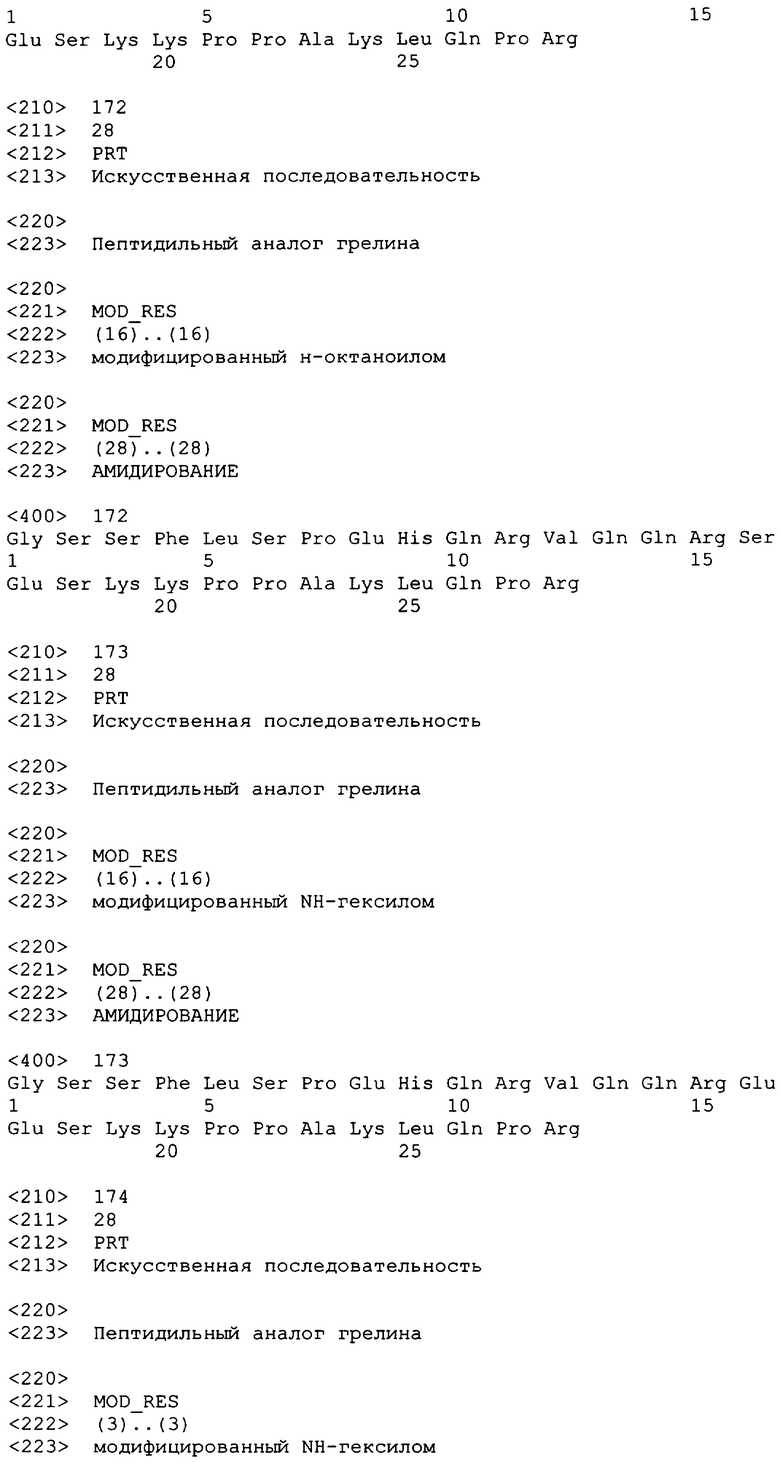








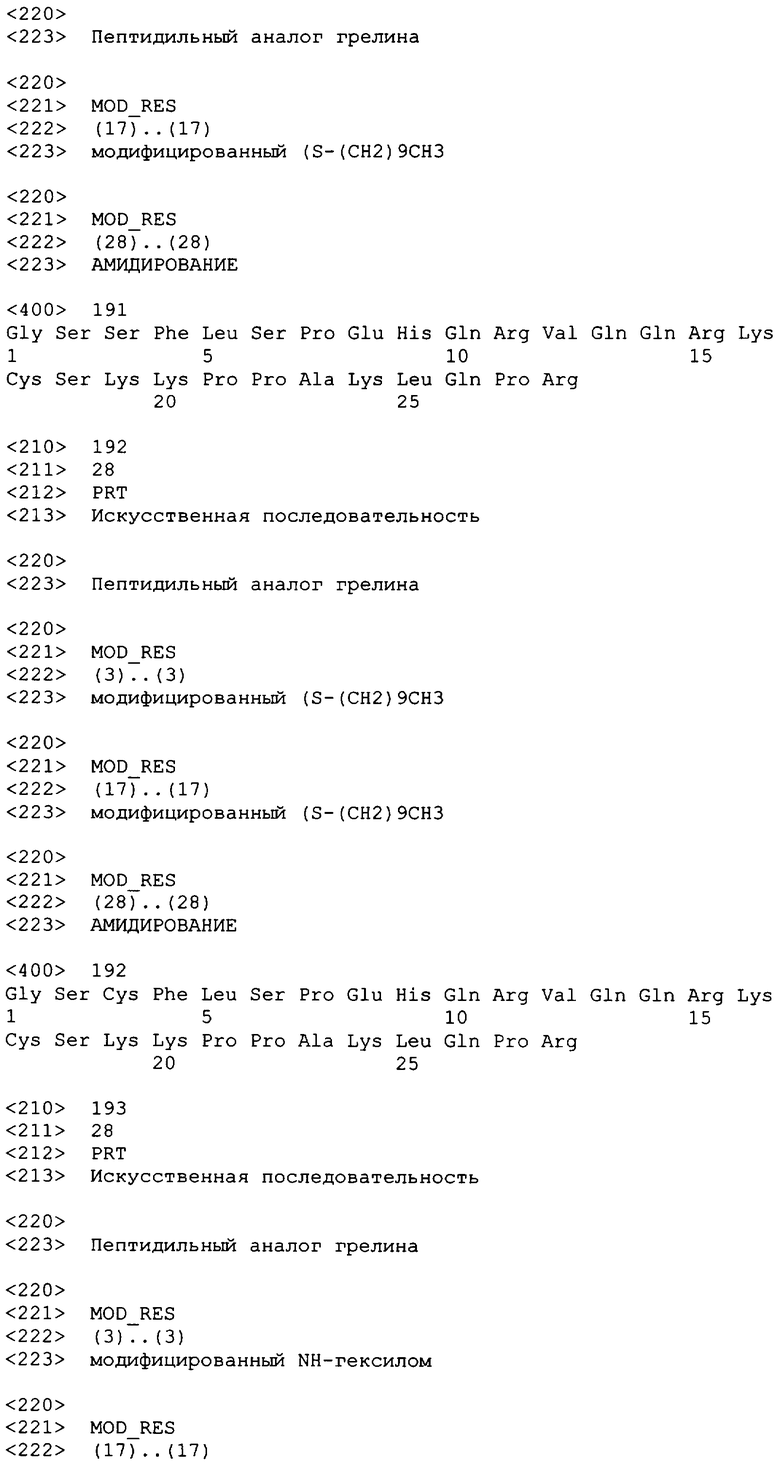











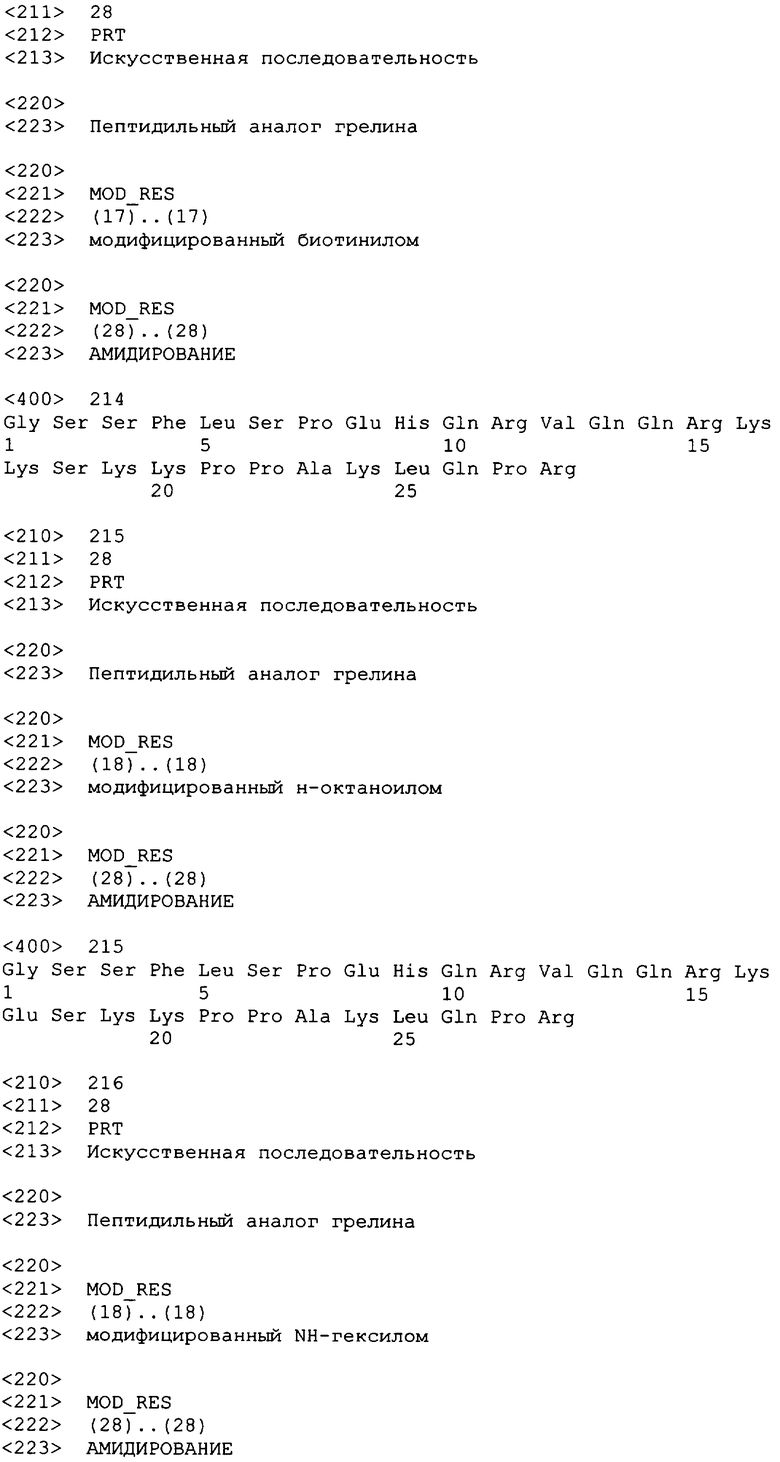




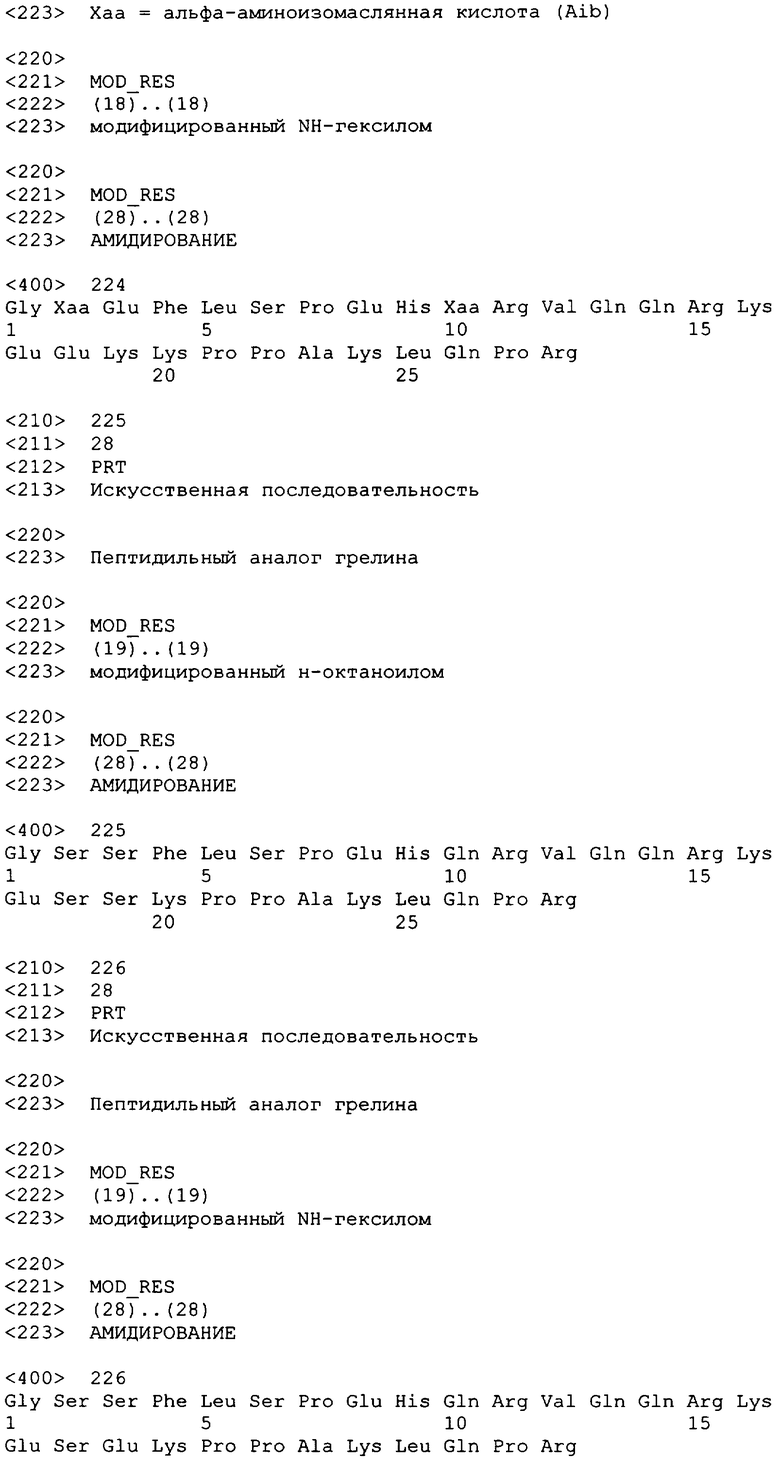


























































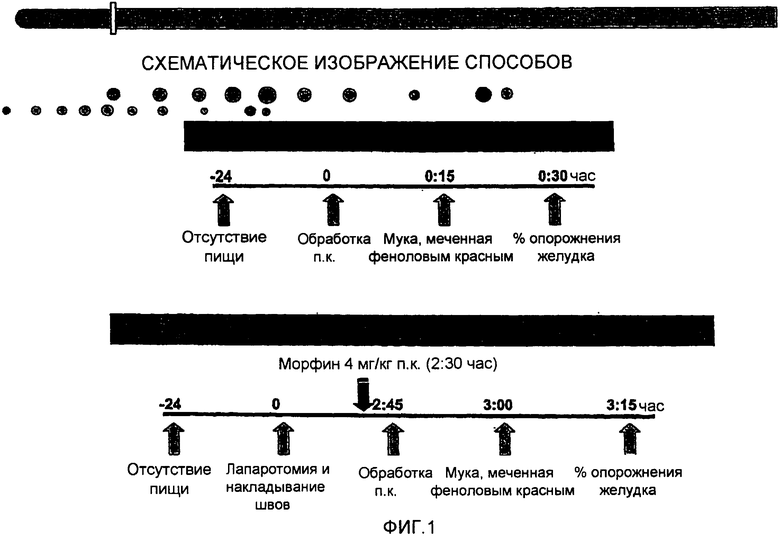
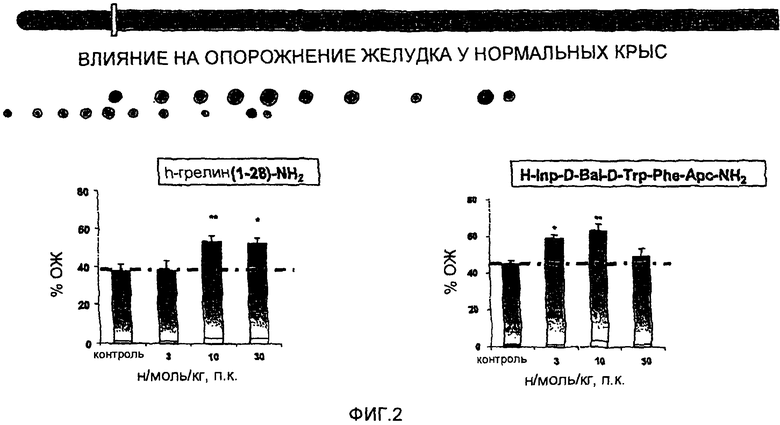
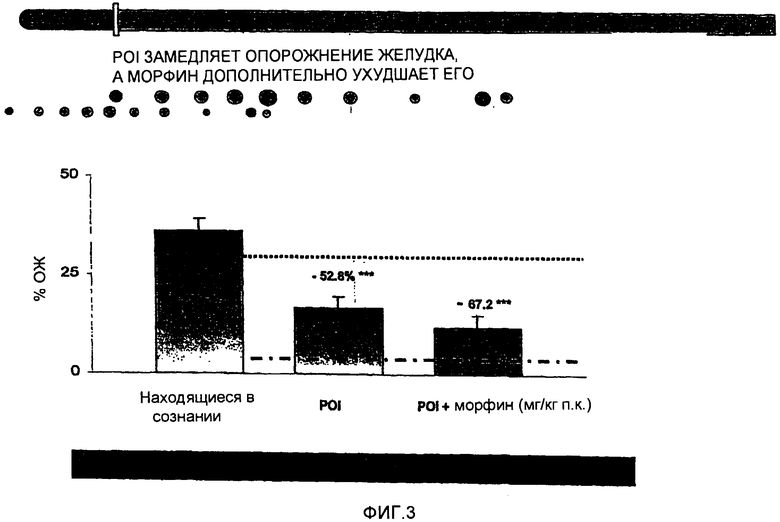


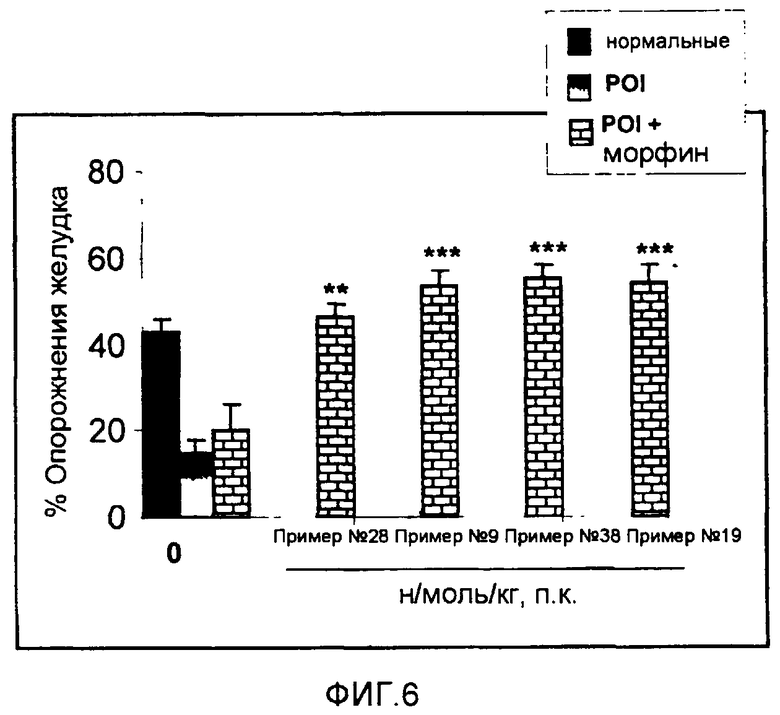
Группа изобретений относится к медицине, а именно к гастроэнтерологии и может быть использована для стимуляции двигательной функции желудочно-кишечного тракта. Изобретения предполагают введение терапевтически эффективного количества пептидильного аналога грелина, имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (BIM-28131), его фармацевтически приемлемой соли или в составе фармацевтических композиций. Для этого предлагают способы, характеризующие различные пути введения указанных средств при разных состояниях, сопровождающихся такими нарушениями. Изобретения позволяют обеспечить наиболее эффективную стимуляцию двигательной активности желудочно-кишечного тракта при различных типах нарушений, за счет выбранного аналога грелина, который обладает на порядок большей эффективностью и продолжительностью действия по сравнению с грелином. 7 н. и 23 з.п. ф-лы, 6 ил., 1 табл.
1. Способ стимуляции двигательной функции желудочно-кишечного тракта у пациента, предусматривающий введение аналога грелина, имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (SEQ ID NO:122), или его фармацевтически приемлемой соли.
2. Способ по п.1, где указанный пациент страдает от послеоперационной кишечной непроходимости после операции на желудочно-кишечном тракте.
3. Способ по п.1, где указанному пациенту одновременно или заранее вводят опиоидные обезболивающие средства.
4. Способ по п.2, где указанному пациенту одновременно или заранее вводят опиоидные обезболивающие средства.
5. Способ лечения у пациента дисфункции кишечника, связанной с введением опиоидных лекарственных средств, предусматривающий введение аналога грелина имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (SEQ ID NO:122), или его фармацевтически приемлемой соли.
6. Способ по любому из пп.1-5, где указанным пациентом является человек.
7. Способ по любому из пп.1-5, где указанный пациент, нуждающийся в стимуляции функции желудочно-кишечного тракта, страдает от гастроэзофагеальной рефлюксной болезни, кишечной непроходимости, рвоты, пареза желудка, IBS, констипации или псевдонепроходимости толстой кишки.
8. Способ по п.7, где указанная кишечная непроходимость представляет собой послеоперационную кишечную непроходимость.
9. Способ по п.8, где указанная послеоперационная кишечная непроходимость возникает после хирургии брюшной полости.
10. Способ по п.9, где указанная кишечная непроходимость связана с желудком, тонким кишечником или толстым кишечником.
11. Способ по п.7, где указанная кишечная непроходимость вызвана фактором, отличным от хирургии брюшной полости.
12. Способ по п.11, где указанная кишечная непроходимость связана с желудком, тонким кишечником или толстым кишечником.
13. Способ по п.7, где указанный пациент страдает от рвоты, связанной с введением противоракового химиотерапевтического средства, беременностью, булимией или анорексией.
14. Способ по п.7, где указанный парез желудка связан с диабетом.
15. Способ по п.14, где указанный диабет представляет собой диабет типа I.
16. Способ по п.15, где указанный диабет представляет собой диабет типа II.
17. Способ по любому из пп.1-5 и 8-16, где указанное терапевтически эффективное количество аналога грелина, имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (SEQ ID NO:122), или его фармацевтически приемлемой соли, и фармацевтически приемлемого носителя или разбавителя, вводят внутривенно, подкожно, перорально или путем имплантации композиции с замедленным высвобождением.
18. Способ по п.6, где указанное терапевтически эффективное количество аналога грелина, имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (SEQ ID NO:122), или его фармацевтически приемлемой соли, и фармацевтически приемлемого носителя или разбавителя, вводят внутривенно, подкожно, перорально или путем имплантации композиции с замедленным высвобождением.
19. Способ по п.7, где указанное терапевтически эффективное количество аналога грелина, имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (SEQ ID NO:122), или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или разбавителя, вводят внутривенно, подкожно, перорально или путем имплантации композиции с замедленным высвобождением.
20. Способ стимуляции двигательной функции желудочно-кишечной системы у пациента, где указанный способ предусматривает диагностирование пациента, страдающего от или имеющего риск гастроэзофагеальной рефлюксной болезни, кишечной непроходимости, рвоты, пареза желудка, IBS, констипации или псевдонепроходимости толстой кишки, и введение указанному пациенту терапевтически эффективного количества фармацевтической композиции, содержащей аналог грелина, имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (SEQ ID NO:122), или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или разбавителя.
21. Способ проведения хирургической операции у пациента, предусматривающий введение указанному пациенту терапевтически эффективного количества аналога грелина, имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (SEQ ID NO:122), или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или разбавителя.
22. Способ по п.21, где указанная хирургическая операция выбрана из группы, состоящей из прямой манипуляции с желудочно-кишечным трактом, косвенной манипуляции с желудочно-кишечным трактом, лапаротомии, трансплантационной хирургии, хирургии мочеполовой системы, хирургии лимфатической системы, хирургии дыхательной системы и хирургического лечения рака какого-либо органа или какой-либо ткани брюшной полости.
23. Способ по п.21, где указанное введение осуществляют до, во время или после указанной хирургической операции, или в комбинированном режиме.
24. Способ профилактики послеоперационной кишечной непроходимости у пациента, нуждающегося в такой профилактике, где указанный способ предусматривает введение указанному пациенту терапевтически эффективного количества аналога грелина, имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (SEQ ID NO:122), или его фармацевтически приемлемой соли, и фармацевтически приемлемого носителя или разбавителя, до, во время или после указанной хирургической операции, или в комбинированном режиме.
25. Способ профилактики гастроэзофагеальной рефлюксной болезни, рвоты, пареза желудка, IBS, констипации или псевдонепроходимости толстой кишки у пациента, нуждающегося в такой профилактике, где указанный способ предусматривает введение указанному пациенту терапевтически эффективного количества аналога грелина, имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (SEQ ID NO:122), или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или разбавителя.
26. Способ по п.25, где указанная рвота связана с введением противоракового химиотерапевтического средства, беременностью, булимией или анорексией.
27. Способ по п.25, где указанный парез желудка связан с диабетом.
28. Способ по п.27, где указанный диабет представляет собой диабет типа I.
29. Способ по п.27, где указанный диабет представляет собой диабет типа II.
30. Способ профилактики послеоперационной кишечной непроходимости, гастроэзофагеальной рефлюксной болезни, рвоты, пареза желудка, IBS, констипации или псевдонепроходимость толстой кишки у пациента, нуждающегося в такой профилактике, предусматривающий введение указанному пациенту терапевтически эффективного количества аналога грелина, имеющего последовательность H-Inp-D-Bal-D-Trp-Phe-Apc-NH2 (SEQ ID NO:122), или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или разбавителя, вводят внутривенно, подкожно, перорально или путем имплантации композиции с замедленным высвобождением.
| MASUDA Y | |||
| et al | |||
| Ghrelin stimulates gastric acid and motility in rats, Biochemical and biophysical research communications, 2000, v | |||
| СПОСОБ СОСТАВЛЕНИЯ ЗВУКОВОЙ ЗАПИСИ | 1921 |
|
SU276A1 |
| АНАЛОГИ ГРЕЛИНА | 2003 |
|
RU2315059C2 |
| WO 2003051389, 26.06.2003 | |||
| US 20020042419 A1, 11.04.2002 | |||
| PIERRE POITRAS et al | |||
| СПОСОБ ПОЛУЧЕНИЯ СПЛАВЛЕННОГО ГЛИНОЗЕМА ИЛИ ДРУГИХ ТУГОПЛАВКИХ ОКИСЛОВ | 1924 |
|
SU1139A1 |
Авторы
Даты
2011-06-10—Публикация
2006-09-28—Подача