Область изобретения
Настоящее изобретение относится к твердым лекарственным препаративным формам, включающим гранулированные материалы, содержащие оспемифен или близко родственные соединения.
Уровень техники
Публикации и другие материалы, используемые в настоящем описании для освещения предпосылок изобретения, и, в частности, описание дополнительных деталей в практическом отношении включены в качестве ссылки.
“СМЭР” (селективные модуляторы эстрогеновых рецепторов) обладают как эстрогеноподобными, так и антиэстрогенными свойствами (Kauffman & Bryant, 1995). Их эффекты могут быть специфичными для тканей, как в случае тамоксифена и торемифена, которые оказывают эстрогеноподобные эффекты в костях, частичный эстрогеноподобный эффект в матке и печени и чисто антиэстрогенный эффект при раке молочной железы. Ралоксифен и дролоксифен аналогичны тамоксифену и торемифену за исключением того, что их антиэстрогенные свойства доминируют. На основании опубликованных сведений более вероятно, что многие СМЭР скорее вызовут симптомы менопаузы, чем предотвратят их. Однако они имеют другие важные преимущества у пожилых женщин: они снижают уровень общего холестерина и холестерина LDL (липопротеида низкой плотности), снижая, таким образом, риск сердечно-сосудистых заболеваний, и они могут предотвратить остеопороз и ингибировать рост рака молочных желез у женщин в постменопаузе. В настоящее время также разрабатываются почти чистые антиэстрогены.
Оспемифен представляет собой Z-изомер соединения формулы (I)
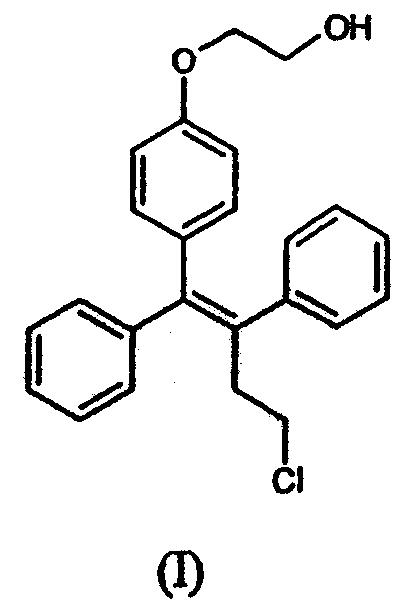
и он представляет собой один из основных метаболитов торемифена, который известен как агонист и антагонист эстрогенов (Kangas, 1990; международные патентные публикации WO 96/07402 и WO 97/32574). Соединение также называется (деаминоксигидрокси)торемифеном, и оно также известно под кодом FC-1271a. Оспемифен оказывает относительно слабые эстрогенные и антиэстрогенные эффекты в классических гормональных тестах (Kangas, 1990). Он обладает противоостепорозным действием и снижает уровни общего холестерина и холестерина LDL и на экспериментальных моделях, и у людей-добровольцев (международные патентные публикации WO 96/07402 и WO 97/32574). Он также обладает противоопухолевой активностью на ранней стадии развития рака молочной железы на модели рака молочной железы у животных. Оспемифен также представляет собой первый СМЭР, который, как было показано, оказывает благоприятные эффекты при климактерических симптомах у здоровых женщин. Применение оспемифена для лечения определенных климактерических расстройств у женщин в постменопаузе, а именно сухости влагалища и половой дисфункции, раскрыто в WO 02/07718. В опубликованной патентной заявке WO 03/103649 описано применение оспемифена для ингибирования атрофии и для лечения или профилактики связанных с атрофией заболеваний или расстройств у женщин, в частности у женщин во время или после менопаузы.
Задача и раскрытие изобретения
Задачей настоящего изобретения является предоставление усовершенствованной твердой лекарственной препаративной формы, содержащей оспемифен, где существенно увеличено растворение препарата.
Таким образом, изобретение относится к твердой лекарственной препаративной форме, включающей гранулированные материалы, содержащие терапевтически активное соединение формулы (I)

или его геометрический изомер, стереоизомер, фармацевтически приемлемую соль, сложный эфир или метаболит, в комбинации с одним или более внутригранулярными эксципиентами.
Краткое описание чертежей
На чертеже показано растворение во времени оспемифена из таблеток, изготовленных прямым прессованием ингредиентов (ромбики), и из таблеток, изготовленных из гранул, включающих лекарственное средство (квадраты).
Подробное описание изобретения
Гранулирование
Гранулирование представляет собой способ, где первичные частицы порошка изготовлены для прилипания с формированием более крупных структурных элементов, состоящих из множества частиц, называемых гранулами. Фармацевтические гранулы типично имеют размер в диапазоне от 0,2 до 4,0 нм, в зависимости от их последующего применения. В большинстве случаев при изготовлении таблеток или капсул гранулы будут изготавливаться в виде промежуточного продукта и будут иметь типичный диапазон размера от 0,2 до 0,5 мм.
Основными причинами, обусловливающими необходимость гранулирования, являются:
- Предотвращение сегрегации ингредиентов порошковой смеси:
Сегрегация или распад на составные части в первую очередь вызвана различиями размера или плотности компонентов смеси, причем более мелкие и/или более плотные частицы концентрируются в основании контейнера с более крупными и/или менее плотными частицами, располагающимися над ними. Идеальный гранулированный материал будет содержать все ингредиенты смеси в правильной пропорции в каждой грануле, и сегрегация ингредиентов не произойдет.
- Улучшение свойств текучести смеси:
Многие порошки, ввиду маленького размера их частиц, неправильной формы или поверхностных характеристик, подвергаются межмолекулярному сцеплению и не обладают достаточной текучестью. Плохая текучесть приведет к широкой вариабельности массы внутри конечного продукта, ввиду меняющегося наполнения головок экструдеров таблетировочных машин и т.д.
- Улучшение характеристик прессования смеси:
Некоторые порошки трудно прессовать даже при включении в смесь легко прессуемого клеящего материала, но гранулы той же препаративной формы часто легче прессуются и продуцируют более прочные таблетки.
Можно также упомянуть другие причины: уменьшение пыли при манипулировании с порошками, устранение прилипания слегка гигроскопичных материалов при хранении.
Способы гранулирования можно разделить на 2 типа: влажное гранулирование и сухое гранулирование. В подходящей препаративной форме понадобится ряд различных эксципиентов, в дополнение к лекарственному средству. Обычными типами являются разбавители для получения массы стандартной дозы подходящего размера и разрыхляющие агенты, которые добавляют для содействия разрушению гранулы, когда она достигает жидкой среды, например, после приема внутрь пациентом. Можно также добавить адгезионные вещества в форме сухого порошка, особенно если используется сухое гранулирование. Эти ингредиенты следует смешивать перед гранулированием.
Эксципиенты в гранулах также называются внутригранулярными эксципиентами. Когда гранулированные материалы включаются в конечные препаративные формы, то следует добавлять эксципиенты. Эксципиенты вне гранулированных материалов называются внегранулярными эксципиентами.
В способах сухого гранулирования первичные частицы порошка агрегируются под высоким давлением. Существуют 2 основных способа: изготавливается или крупная таблетка (брусок) в предназначенном для работы в тяжелых условиях таблетировочном прессе, или порошок выдавливается между двумя роликами для изготовления листового материала (роликовая прессовка). Эти промежуточные продукты разрушаются подходящей методикой помола. Сухое гранулирование используют для препаратов, которые чувствительны к влаге.
Влажное гранулирование включает перемешивание смеси сухих первичных частиц порошка с использованием гранулирующей жидкости. Жидкость содержит растворитель, который должен быть нетоксичным и летучим с тем, чтобы его можно было удалить сушкой. Типичные жидкости включают воду, этанол и изопропанол, или отдельно, или в комбинации. Грануляционную жидкость можно использовать отдельно или обычнее в виде растворителя, содержащего растворенное адгезивное вещество (связывающий агент), которое используется для обеспечения адгезии частиц, когда гранула сухая. Влажную массу продавливают через сито для получения влажных гранул, которые затем сушат. Последующая стадия скрининга разрушает агломераты и удаляет мелкий материал.
Испытание растворения
Испытание растворения in vitro служит в качестве важного инструмента для характеристики биофармацевтического качества продукта на различных стадиях его цикла существования. На ранней стадии разработки препарата свойства растворения in vitro подтверждают выбор между различными альтернативными кандидатами препаративных форм для дальнейшей разработки и для оценки активных ингредиентов/лекарственных веществ. Более того, данные растворения in vitro должны быть очень важны при оценке изменений в месте производства, способе изготовления или препаративной форме и содействовать принятию решения, касающегося необходимости исследований биологической доступности.
Всасывание препарата из твердой лекарственной формы после орального введения зависит от высвобождения лекарственного вещества из лекарственного продукта, растворения или солюбилизации препарата в физиологических условиях и проницаемости через желудочно-кишечный тракт. Ввиду решающей природы первых двух из этих стадий, растворение in vitro может быть релевантным для прогноза работы in vivo. На основании этих общих рассуждений тесты растворения in vitro для твердых оральных лекарственных форм немедленного высвобождения, таких как таблетки и капсулы, используются для а) оценки качества лекарственного продукта от лота к лоту; b) руководства разработкой новых препаративных форм и с) обеспечения продолжающегося качества и работы продукта после определенных изменений, таких как изменения препаративной формы, процесса изготовления, места производства и увеличения масштаба способа изготовления.
Сравнения профиля растворения
Профили растворения можно считать одинаковыми на основании 1) аналогии общего профиля и 2) аналогии в каждой точке времени взятия образца для оценки растворения. Сравнения профиля растворения можно проводить, используя независимые от модели и зависимые от модели способы.
Фактор сходства f2 представляет собой логарифмическую обратную квадратно-корневую трансформацию суммы квадратной ошибки и представляет собой меру подобия растворения в процентах (%) между двумя кривыми. Фактор подобия рассчитывают в соответствии со следующей формулой
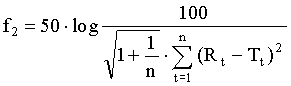
где n представляет собой число точек времени взятия проб; Rt представляет собой количество препарата, высвободившегося из эталонной партии, во время t, и Tt представляет собой количество препарата, высвободившегося из испытуемой партии, во время t. Для кривых, которые должны считаться сходными, f2 должен быть близким к 100. В целом, величины f2 более чем 50 гарантируют сходство или эквивалентность двух кривых, т.е. сходство работы эталонного продукта и испытуемого продукта.
В лекарственной препаративной форме в соответствии с настоящим изобретением внутригранулярный эксципиент может состоять из одного или более ингредиентов, которые могут относиться к одним и тем же или различным категориям эксципиентов. По меньшей мере, один внутригранулярный эксципиент представляет собой разрыхлитель или смесь нескольких разрыхлителей; разбавитель или смесь нескольких разбавителей или связывающий агент или смесь нескольких связывающих агентов. Внутригранулярный эксципиент может также представлять собой комбинацию, по меньшей мере, одного разбавителя и, по меньшей мере, одного связывающего агента; комбинацию, по меньшей мере, одного разбавителя и, по меньшей мере, одного разрыхлителя; комбинацию, по меньшей мере, одного разбавителя, по меньшей мере, одного разрыхлителя и, по меньшей мере, одного связывающего агента.
В качестве типичных неограничивающих примеров подходящих разрыхлителей можно упомянуть повидон, кросповидон, карбоксиметилцеллюлозу, метилцеллюлозу, альгиновую кислоту, кроскармеллозу натрия, гликоляткрахмал натрия, крахмал, формальдегид-казеин или их комбинации.
В качестве типичных неограничивающих примеров подходящих разбавителей можно упомянуть мальтозу, мальтодекстрин, лактозу, фруктозу, декстрин, микрокристаллическую целлюлозу, предварительно желатинизированный крахмал, сорбит, сазарозу, соединенную с кремнием микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраты, маннит, фосфат кальция или их комбинации.
В качестве типичных неограничивающих примеров подходящих связывающих агентов можно упомянуть акацию, декстрин, крахмал, повидон, карбоксиметилцеллюлозу, кизельгур, глюкозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, полиметакрилаты, мальтодекстрин, гидроксиэтилцеллюлозу или их комбинации.
Гранулированные материалы можно изготовить или сухим гранулированием, или влажным гранулированием в соответствии с известной технологией. Подходящими растворителями при влажном гранулировании являются, например, вода или этанол.
Конечная твердая лекарственная препаративная форма может представлять собой любую твердую препаративную форму, такую как таблетки, капсулы, гранулированные материалы как таковые или гранулированные материалы, упакованные в подходящие стандартные лекарственные формы, овальные таблетки, лепешки и им подобные. Термин «таблетка» следует понимать как охватывающий любой вид таблеток, таких как непокрытые таблетки, покрытые таблетки, таблетки с пленочным покрытием, таблетки, интенсивно выделяющие газ при растворении, оральные лиофилизаты, таблетки, диспергируемые в ротовой полости, таблетки, устойчивые к желудочной среде, таблетки пролонгированного высвобождения, таблетки модифицированного высвобождения, жевательные таблетки, оральные смолы и пилюли. Гранулированные материалы следует понимать как охватывающие также гранулированные материалы, интенсивно выделяющие газ при растворении, устойчивые к желудочной среде, пролонгированного высвобождения и модифицированного высвобождения. Капсулы следует понимать как охватывающие также капсулы, устойчивые к желудочной среде, пролонгированного высвобождения и модифицированного высвобождения.
Препаративная форма может, например, представлять собой капсулу, включающую гранулированные материалы, инкапсулированные в оболочку, изготовленную из желатина или подобного материала. Препаративная форма может в дополнение к гранулированным материалам включать внегранулярный смазывающий агент. Типичный смазывающий агент представляет собой, например, стеарат кальция, стеарат магния, стериновую кислоту, тальк, растительное масло, полоксамер, минеральное масло, лаурилсульфат натрия, стеарилфумарат натрия, стеарат цинка или их комбинации. Препаративная форма может также содержать другие внегранулярные эксципиенты, например, разбавители.
Лекарственная препаративная форма может альтернативно представлять собой таблетку, включающую гранулированные материалы, в комбинации с одним или более внегранулярными наполнителями. Внегранулярный наполнитель может представлять собой один или более разрыхлителей, один или более разбавителей, один или более связывающих агентов, один или более смазывающих агентов или их комбинации. Внегранулярный разрыхлитель может представлять собой один из разрыхлителей, указанных выше, или их комбинации. Аналогичным образом, внегранулярные разбавители, связывающие агенты и смазывающие агенты можно выбрать из указанных выше веществ.
Таблетки могут также включать другие внегранулярные ингредиенты, такие как ароматизирующие агенты, красящие вещества, консерванты, средства, содействующие суспендированию, и наполнители.
Гранулированные материалы включают предпочтительно один или более разрыхлителей в диапазоне от 0,1 до 10 предпочтительно, от 0,1 до 4 мас.% гранул и один или более разбавителей в диапазоне от 20 до 80 мас.% гранул.
Если гранулы перерабатываются в таблетки, то такие таблетки могут содержать, например, внегранулярные разрыхлители в диапазоне от 0,1 до 25%, смазывающие агенты от 0,1 до 2%, содержащие препарат гранулированные материалы в диапазоне от 20 до 80%, и остальную часть могут составлять разбавители необязательно в комбинации с другими ингредиентами, такими как связывающие агенты, ароматизирующие агенты, красящие агенты, консерванты, средства, содействующие суспендированию, наполнители и им подобные. Все процентные доли представляют собой мас.% таблетки.
Усовершенствованная лекарственная препаративная форма в соответствии с настоящим изобретением особенно полезна при лечении женщин во время или после менопаузы. Однако способ в соответствии с настоящим изобретением не ограничивается женщинами этой возрастной группы.
Термин «метаболит» следует понимать как охватывающий любой уже обнаруженный или подлежащий обнаружению метаболит оспемифена или (деаминогидрокси)торемифена. В качестве примеров таких метаболитов термин «метаболит» следует понимать как охватывающий любой уже обнаруженный или подлежащий обнаружению метаболит оспемифена или (деаминогидрокси)торемифена. В качестве примеров таких метаболитов можно упомянуть метаболиты окисления, упомянутые в публикации Kangas (1990) на стр.9 (TORE VI, TORE VII, TORE VIII, TORE XIII), в частности TORE VI и TORE VIII, и другие метаболиты соединения. Самый важный метаболит оспемифена, 4-гидроксиоспемифен, имеет формулу
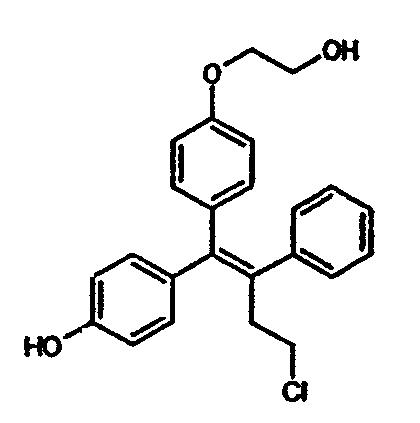
Применение смесей изомеров соединения (I) также должно быть включено в настоящее изобретение.
Соединение (I) представляет собой предпочтительно оспемифен.
Размер частиц оспемифена в гранулированных материалах важен для получения хорошего растворения. Предпочтительно, по меньшей мере, 90% лекарственного вещества должно иметь размер частиц менее чем 250 мкм. Предпочтительнее, 90% лекарственного вещества должно иметь размер частиц менее чем 150 мкм и 50% лекарственного вещества должно иметь размер частиц менее чем 25 мкм. Особенно предпочтительно 90% лекарственного вещества должно иметь размер частиц менее чем 50 мкм и 50% лекарственного вещества должно иметь размер частиц менее чем 15 мкм.
Термин «размер частиц» относится к диаметру частиц или в случае, когда частицы являются несферическими, к самому большому протяжению в одном направлении частицы.
Усовершенствованная лекарственная препаративная форма в соответствии с настоящим изобретением полезна при любом применении оспемифена, особенно, когда соединение используется для лечения или профилактики остеопороза или для лечения или профилактики симптомов, связанных с атрофией кожи или атрофией эпителия или слизистых оболочек.
Особая форма атрофии, которую можно ингибировать введением оспемифена, является мочеполовая атрофия. Симптомы, связанные с мочеполовой атрофией, можно разделить на 2 подгруппы: мочевые симптомы и влагалищные симптомы. В качестве примеров мочевых симптомов можно упомянуть расстройства мочеиспускания, дизурию, гематурию, частое мочеиспускание, ощущение императивных позывов на мочеиспускание, инфекции мочевых путей, воспаление мочевых путей, никтурию, недержание мочи, недержание мочи с императивными позывами на мочеиспускание и непроизвольное истечение мочи. В качестве примеров влагалищных симптомов можно упомянуть раздражение, зуд, жжение, выделения с неприятным запахом, инфекцию, лейкоррею, зуд вульвы, ощущение давления и кровотечение после полового акта.
В соответствии с предыдущими данными ожидается, что оптимальная клиническая доза оспемифена составляет выше чем 25 мг/сут и ниже чем 100 мг/сут. Особенно предпочтительная суточная доза предлагалась в диапазоне от 30 до 90 мг. При более высоких дозах (100 и 200 мг/сут) оспемифен проявляет свойства, больше похожие на свойства тамоксифена и торемифена. Вследствие повышенной биологической доступности в соответствии со способом настоящего изобретения можно прогнозировать, что такой же терапевтический эффект можно достичь дозами, более низкими, чем ранее рекомендовавшиеся дозы.
Изобретение будет более подробно описано в следующем неограничивающем экспериментальном разделе.
Экспериментальный раздел
Были изготовлены 2 различные таблетки оспемифена. Одну из них изготовили из гранулированного материала оспемифена, которая была изготовлена влажным способом, а другую таблетку изготовили прямым прессованием ингредиентов.
Состав двух таблеток представлен ниже:
Таблетки повергли тестированию растворением в соответствии с лопастным способом по 24-й Фармакопее США, используя ручное взятие проб. Одну таблетку помещали в каждый из 12 сосудов, содержащих 900 мл 2% додецилсульфата натрия. рН был 9,8. Через 5, 15, 30, 60, 120, 180 и 240 мин из сосудов, где происходило растворение, вручную удаляли 10 мл. Пробы сразу фильтровали и анализировали спектрофотометрически, используя 2-мм проточную ячейку, в компьютеризированном спектрофотометре. Концентрацию оспемифена в растворе пробы определяли сравнением спектральной поглощательной способности при 238 нм со спектральной поглощательной способностью стандартного раствора. Результаты показаны на чертеже. Рассчитанный фактор сходства f2 составил 36, что означает, что профили растворения для двух таблеток очень отличаются.
На чертеже показано, что таблетка, содержащая гранулированные материалы, значительно улучшает растворение оспемифена по сравнению с таблетками, изготовленными прямым прессованием.
Следует понимать, что способы по настоящему изобретению можно реализовать в разнообразных формах осуществления, лишь некоторые из которых раскрыты в настоящем описании. Для специалиста в данной области будет очевидно, что существуют другие варианты осуществления, и они не отходят от сущности изобретения. Таким образом, описанные варианты осуществления являются иллюстративными и их не следует рассматривать как ограничивающие.
Источники информации
Kangas L. Biochemical and pharmacological effects of toremifene metabolites. Cancer Chemother Pharmacol, 27:8-12, 1990.
Kauffmen R.F., Bryant H.U. Selective estrogen receptor modulators. Drug News Perspect, 8: 531-539, 1995.

Изобретение относится к области медицины и химико-фармацевтической промышленности, в частности к твердой лекарственной препаративной форме, включающей гранулированные материалы, содержащие в качестве терапевтически активного соединения оспемифен, так же известный, как (деаминогидрокси)торемифен или его геометрический изомер, стереоизомер, фармацевтически приемлемую соль, сложный эфир или метаболит, в комбинации с одним или более внутригранулярными эксципиентами. 1 з.п. ф-лы, 1 ил., 1 табл.
1. Твердая лекарственная препаративная форма, включающая гранулированные материалы, содержащие следующие ингредиенты
где по меньшей мере 80% препаративной формы растворяется в течение 30 мин после начала тестирования указанной препаративной формы растворением при рН 9,8 в соответствии с лопастным способом по 24-й Фармакопее США.
2. Лекарственная препаративная форма по п.21, где гранулированные материалы изготовлены влажным гранулированием.
| US 6245819 В1, 12.06.2001 | |||
| Технология лекарств | |||
| / Под ред | |||
| проф | |||
| В.И.Чуешова, УкрФа, 1999, с.353-355 | |||
| US 6245352 В1, 12.06.2001 | |||
| US 6525084 В2, 25.02.2003. |
Авторы
Даты
2011-07-10—Публикация
2005-01-19—Подача