Область техники
Настоящее изобретение касается композиции для профилактики или лечения рака, которая содержит в качестве активного ингредиента линию клеток, полученную (то есть ведущую свое происхождение) из камбия или прокамбия растения рода Taxus (тисс), лизат этой линии клеток; экстракт этой линии клеток или культуральную среду этой линии клеток.
Уровень техники
Апоптоз представляет собой активный процесс гибели клеток, который осуществляется путем регуляции в клетках экспрессии разных генов и активности ряда белков в соответствии с запрограммированными сигналами. Образуемые в ходе этого процесса апоптосомы удаляются под действием фагоцитов, таких как окружающие клетки или как макрофаги, так что они не приводят к развитию воспаления. Такой апоптоз часто наблюдается в ходе различных нормальных физиологических процессов в живых организмах, и, как известно, глубоко вовлечен в процесс развития различных заболеваний, а именно развитие ненормального апоптоза может привести к нейродегенеративным заболеваниям, иммунным заболеваниям и сердечно-сосудистым заболеваниям, а ненормальное ингибирование апоптоза может вызывать рак.
Более специфические примеры заболеваний, которые вызываются ненормальным протеканием апоптоза и ингибированием апоптоза, включают разные виды рака, индуцируемые ненормальной экспрессией некоторых генов, таких как р53, р16 и Bcl-2, инфицированием вирусами ВИЧ, герпеса и гриппа, и аутоиммунные заболевания, такие как диабет 1 типа, ревматоидный артрит, рассеянный склероз и миастения гравис (тяжелая псевдопаралитическая миастения). Апоптоз клеток у индивидуума представляет собой общий механизм удаления ненормальных клеток, например непоправимо генетически поврежденных клеток у индивидуума для того, чтобы предотвратить развитие опухолей, вызываемое либо такими генетическими поврежденными клетками, либо индукцией ненормальной дифференцировки под действием вызывающих дифференцировку стимулов. Эта концепция подтверждается тем фактом, что обычные противораковые агенты вызывают гибель раковых клеток через процесс апоптоза, ассоциированный с ингибированием пролиферации раковых клеток (Barry M.A. et al., Biochem Pharmacol., 40:2353, 1990; Hickman J.A., Cancer Metastasis Rev., 11:121, 1992).
В соответствии с этим нарушение процесса апоптоза приводит к выживанию поврежденных клеток и клеток, в которых начался процесс повреждения, и к росту этих клеток, то есть, ингибирование апоптоза играет важную роль в процессе канцерогенеза. Кроме того, сообщалось, что вещества, обладающие защитным действием в отношении рака, индуцируют апоптоз таких ненормальных клеток, а индукция апоптоза этими веществами ассоциирована, по меньшей мере, с их защитной активностью в отношении рака (Fesus L., J. Cell Biochem., 22:151,1995; Reddy B.S., Cancer Res., 57:420,1997).
В изучение механизма развития рака и способов его лечения по-прежнему вкладываются огромные средства, однако рак все еще остается неизлечимым заболеванием, а различные способы лечения рака вызывают побочные эффекты (Goodman et al., Cancer Res., 9:2295, 1987). В связи с этим предпринимаются многочисленные попытки в области исследования и разработки новых лекарств и композиций для подавления рака, в частности, большой интерес вызывают исследования, направленные на разработку противораковых веществ из природных материалов, которые имеют незначительные побочные эффекты.
Некоторые из авторов настоящего изобретения разработали способ для получения клеточных линий из камбия и прокамбия, в которых не возникает проблем с разнородностью клеток, связанных с процессом дифференцировки, которые могут стабильно пролиферировать и обладают высокой генетической стабильностью, и обнаружили, что при культивировании таких клеточных линий, полученных из растений рода Taxus, в отличие от клеточных линий другого происхождения, наблюдается высокий выход паклитаксела (paclitaxel) (PCT/KR 2006/001544). Однако о противораковом действии самих по себе клеточных линий, полученных из камбия и прокамбия Taxus, до настоящего времени ничего не сообщалось.
В соответствии с этим авторы настоящего изобретения проделали большую работу по получению противораковой композиции из натурального природного материала, которая имеет минимизированные побочные эффекты по сравнению с обычными противораковыми агентами и обладает прекрасной противораковой активностью, и в результате проделанной работы обнаружили, что гомогенные клеточные линии, полученные из камбия и прокамбия Taxus, лизат этих линий, экстракт этих линий или культуральная среда этих линий обладают активностью, убивающей раковые клетки, что и является предметом настоящего изобретения.
Раскрытие изобретения
Целью настоящего изобретения является предоставление композиции, полученной из природного материала, которая имеет минимизированные побочные эффекты по сравнению с известными в данной области техники противораковыми агентами и обладает активностью в отношении профилактики (предотвращения развития) и лечения рака.
Для достижения указанной выше цели, в одном из своих аспектов настоящее изобретение предоставляет фармацевтическую композицию для профилактики или лечения рака, которая содержит любой один или более компонентов, выбираемых из группы, состоящей из клеточной линии, полученной (то есть ведущей свое происхождение) из камбия или прокамбия Taxus и обладающей приведенными ниже характеристиками, лизата этой клеточной линии, экстракта этой клеточной линии и культуральной среды этой клеточной линии:
(а) клетки этой линии морфологически характеризуются наличием большого количества вакуолей;
(б) клетки этой линии находятся в характерном для них изначально недифференцированном состоянии; и
(в) линия представляет собой гомогенную клеточную линию.
В другом аспекте настоящее изобретение предоставляет функциональный пищевой продукт для профилактики или улучшения состояния при раке, которое содержит один или более компонентов, выбираемых из группы, состоящей из названной клеточной линии, названного лизата, названного экстракта и названной культуральной среды.
В еще одном своем аспекте настоящее изобретение предоставляет применение любого из перечисленного: названной клеточной линии, названного лизата, названного экстракта и названной культуральной среды для профилактики или лечения рака.
В еще одном своем аспекте настоящее изобретение предоставляет способ для профилактики или лечения рака, способ, который включает применение одного или более компонентов, выбираемых из группы, состоящей из названной клеточной линии, названного лизата, названного экстракта и названной культуральной среды.
Другие особенности и аспекты настоящего изобретения станут очевидными из приведенного ниже раскрытия изобретения и прилагаемой формулы изобретения.
Краткое описание чертежей
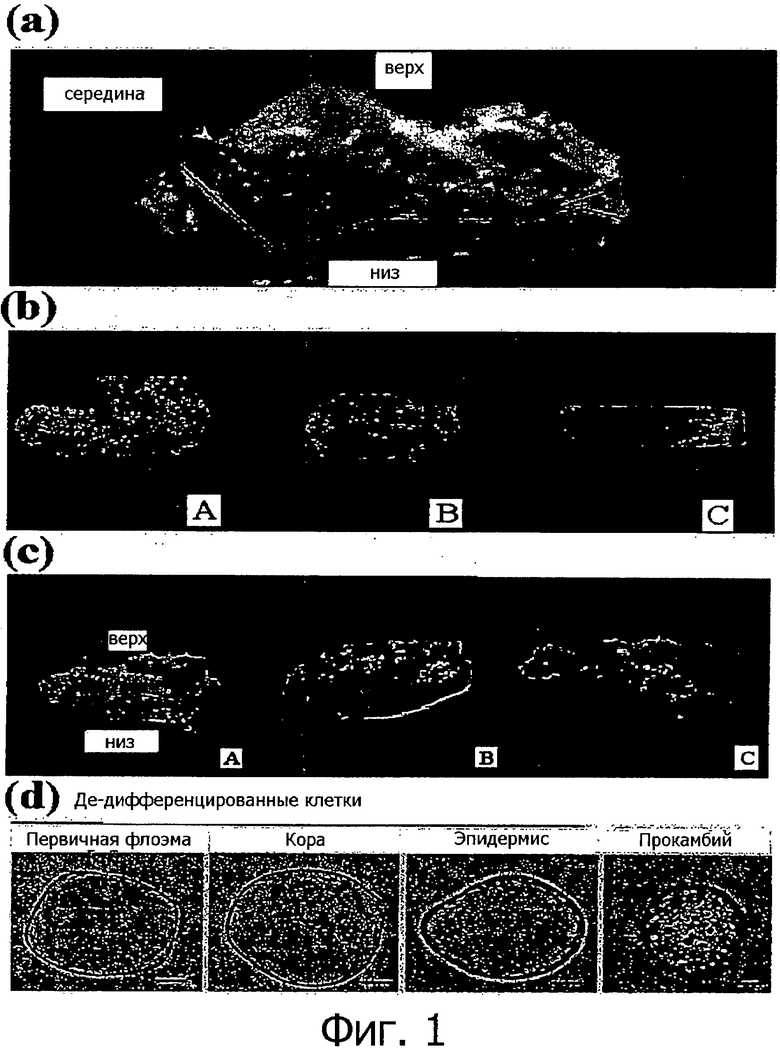
Фигура 1 представляет собой фотографии, показывающие способ индукции клеточной линии согласно настоящему изобретению, изображение изолированного прокамбия и камбия и сравнение между дедифференцированными клетками и клетками, полученными из прокамбия Taxus.
Фигура 2 представляет собой сравнительные графики количества Активных Форм Кислорода (АФК) и фотографии флуоресценции DCFH, которые показывают антиоксидантную активность экстрактов клеточных линий согласно настоящему изобретению, когда старение диплоидных фибробластов кожи человека (human skin diploid fibroblasts, HDFs) индуцируется обработкой H2O2. Обозначения на Фигуре 2: p-WE - экстракт прокамбия в дистиллированной воде; и C-WE - экстракт камбия в дистиллированной воде.
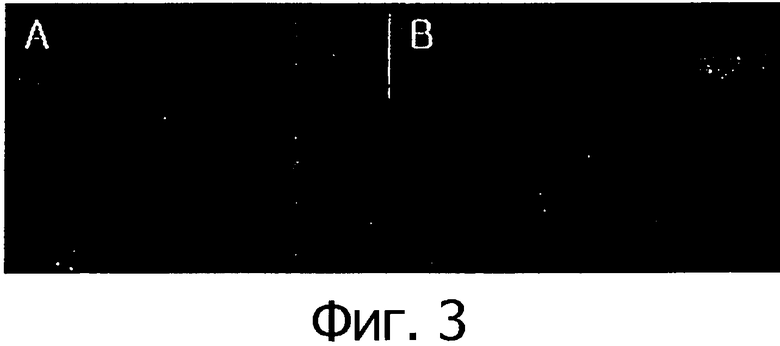
Фигура 3 представляет собой фотографии, показывающие сравнение размера раковой ткани между контрольной группой и группой, которой вводилась клеточная линия, через 2 недели после введения клеточной линии согласно настоящему изобретению.
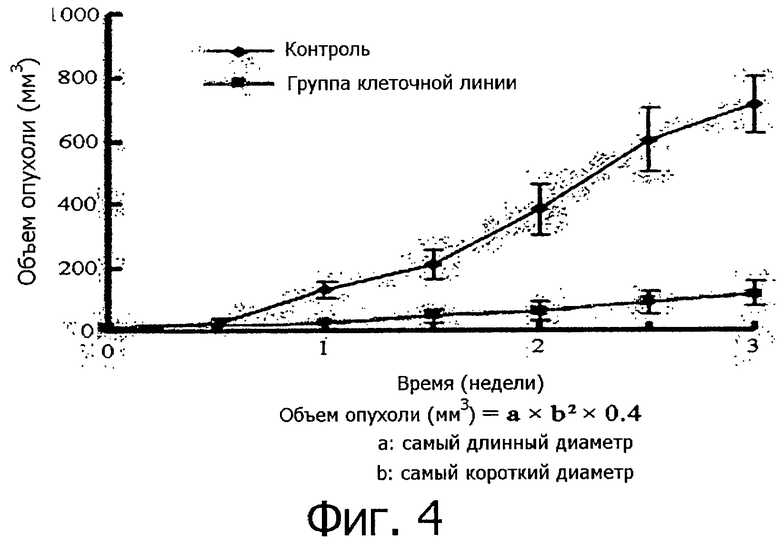
Фигура 4 представляет собой графическую диаграмму, показывающую размеры (объем) опухоли в контрольной группе и в группе, которой вводилась клеточная линия, в течение 3 недель после введения клеточной линии согласно настоящему изобретению.
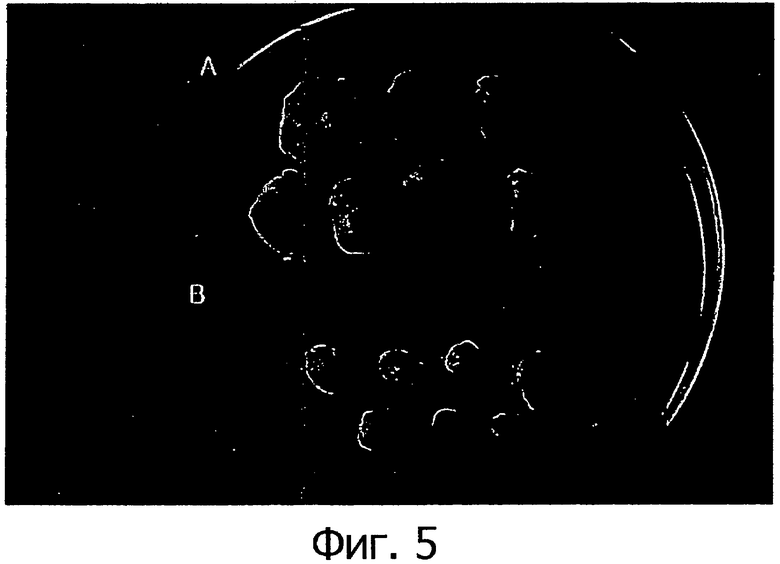
Фигура 5 представляет собой фотографии раковых тканей, вырезанных из мышей из контрольной группы и из группы, которой вводилась клеточная линия, через 3 недели после введения клеточной линии согласно настоящему изобретению.
Фигура 6 представляет собой фотографию внутреннего строения вырезанной раковой ткани через 3 недели после введения клеточной линии согласно настоящему изобретению.
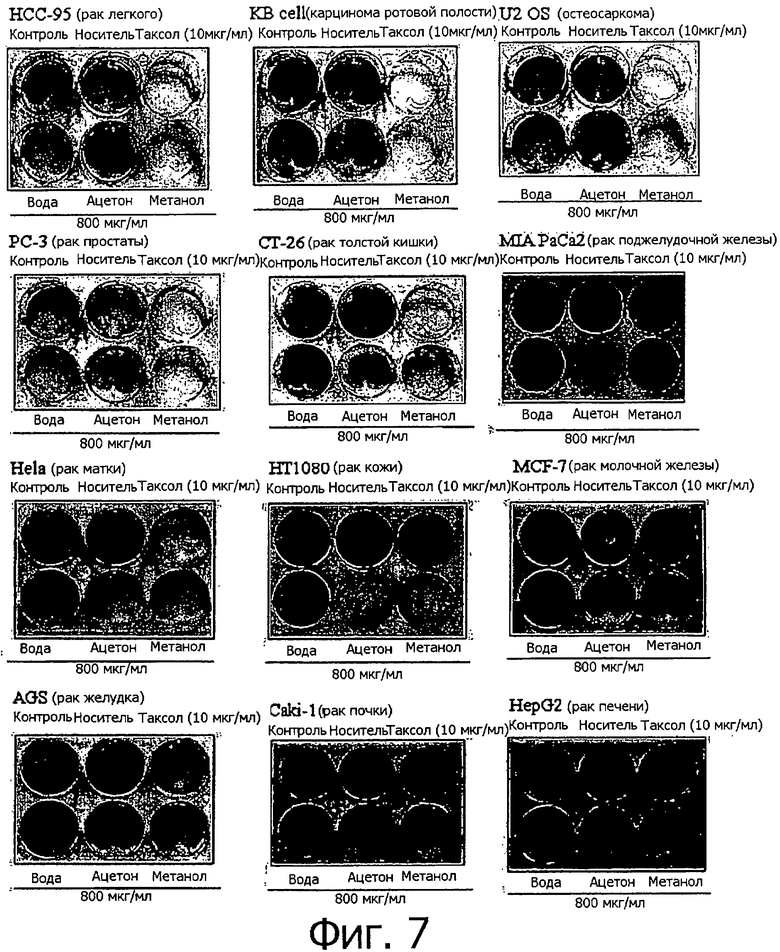
Фигура 7 представляет собой фотографии, показывающие степень гибели клеток после обработки нескольких линий раковых клеток экстрактом клеточной линии согласно настоящему изобретению.
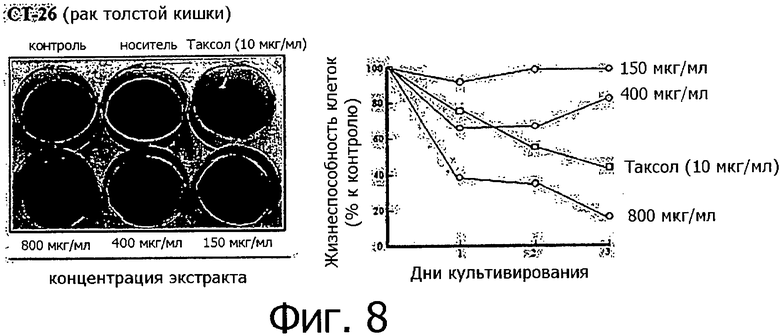
Фигура 8 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака толстой кишки разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
Фигура 9 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака легкого разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
Фигура 10 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака простаты разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
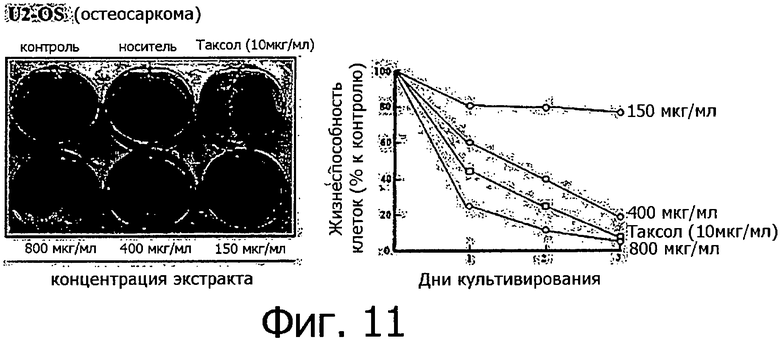
Фигура 11 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток остеосаркомы разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
Фигура 12 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток карциномы ротовой полости разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
Фигура 13 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака кожи разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
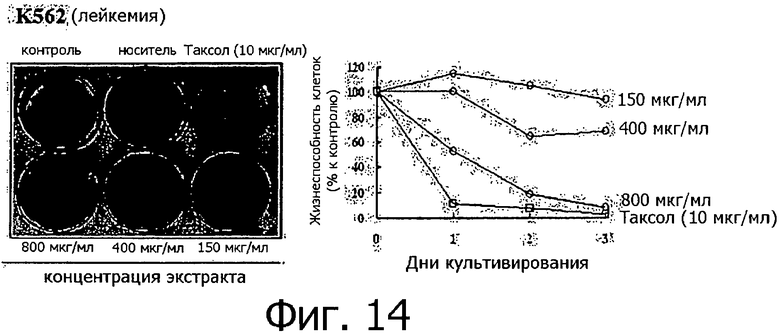
Фигура 14 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток лейкемии разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
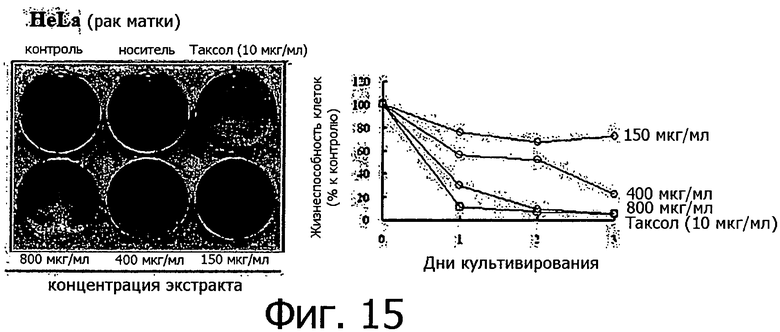
Фигура 15 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака матки разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
Фигура 16 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака кожи (человека) разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
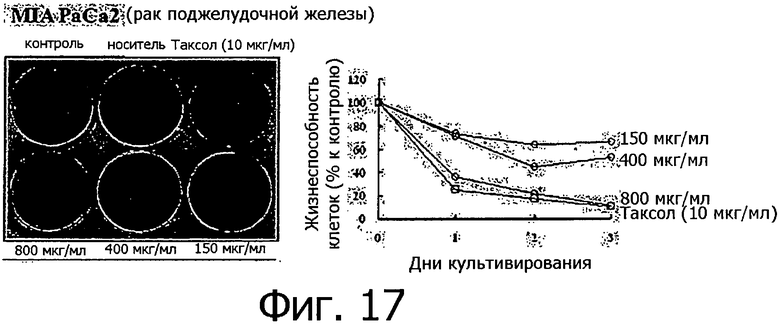
Фигура 17 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака поджелудочной железы разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
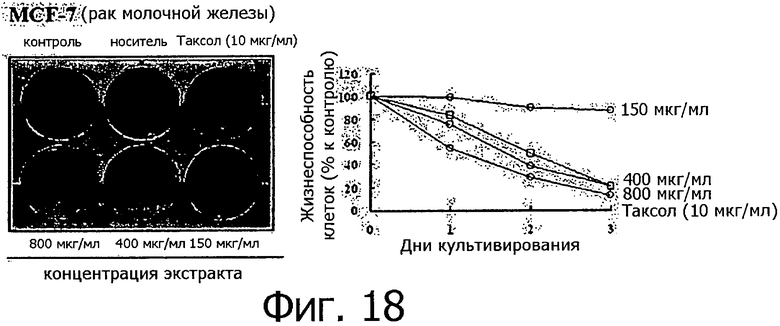
Фигура 18 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака молочной железы разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
Фигура 19 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака желудка разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
Фигура 20 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака почки разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
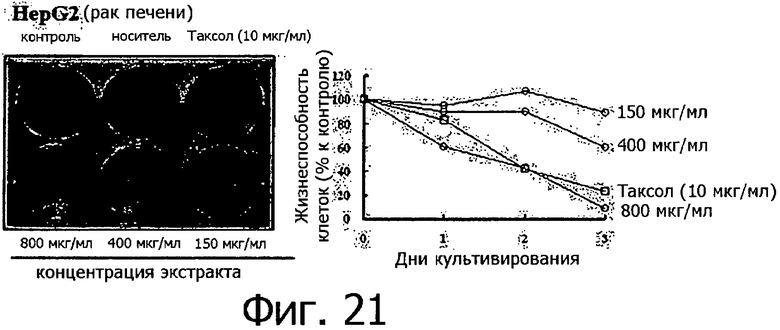
Фигура 21 представляет собой фотографию, показывающую степень гибели клеток после обработки линии клеток рака печени разными концентрациями метанольного экстракта клеточной линии согласно настоящему изобретению.
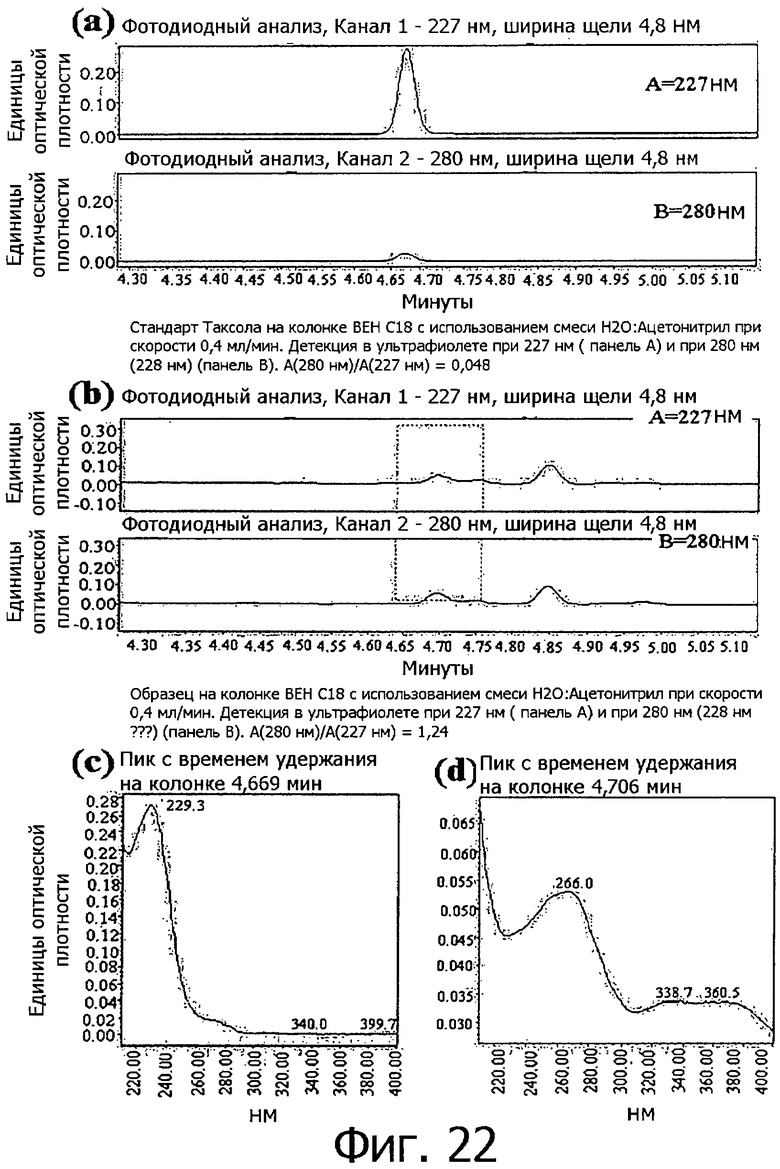
Фигура 22 графически представляет результаты анализа присутствия паклитаксела в клеточной линии согласно настоящему изобретению.
Раскрытие изобретения и предпочтительные воплощения
Если не определено иначе, все технические и научные термины, употребляемые в настоящем изобретении, имеют то же самое значение, которое обычно понимается специалистом среднего уровня квалификации в данной области техники. В целом определения различных терминов, употребляемых в настоящем изобретении, хорошо известны и обычно используются в данной области техники.
Определения основных терминов, употребляемых в раскрытии изобретения, являются следующими. В используемом здесь значении термин «камбий» относится к ткани, которая обеспечивает рост стебля и корня в толщину и позволяет растению увеличивать свой объем. Сообщалось, что когда камбий - меристема, в которой происходит наиболее активное деление клеток, используется в качестве экспланта для получения культуры растительной ткани, можно получить быструю и массовую продукцию клеток (Korean Patent 10-0533120).
В используемом здесь значении термин «прокамбий» относится к первичной меристеме, ведущей свое происхождение от группы первичных клеток, а камбий представляет собой первичную меристему, которая образуется из прокамбия без формирования постоянной ткани.
В используемом здесь значении термин «лизат» относится к клеточному лизату, полученному путем разрушения клеток посредством химического метода, например с помощью обработки детергентом, или с помощью физического метода. Термин «экстракт» клеточной линии относится к субстанции, полученной путем растворения клеток в растворителе и последующего удаления клеток, после этого экстракт может быть сконцентрирован посредством возгонки или выпаривания.
В используемом здесь значении термин «изначально недифференцированные» означает, что клетки не находятся в недифференцированном состоянии в результате процесса дедифференцировки, но исходно находятся в характерном для них преддифференцированном состоянии.
В одном своем аспекте настоящее изобретение касается фармацевтической композиции для профилактики или лечения рака, которая содержит любой один или более из компонентов, выбираемых из группы, состоящей из клеточной линии, полученной из камбия или прокамбия Taxus, лизата этой клеточной линии, экстракта этой клеточной линии и культуральной среды этой клеточной линии.
Клеточная линия, полученная из камбия или прокамбия Taxus согласно настоящему изобретению, обладает следующими характеристиками:
(а) клетки этой линии морфологически характеризуются наличием большого количества вакуолей;
(б) клетки этой линии находятся в характерном для них изначально недифференцированном состоянии; и
(в) линия представляет собой гомогенную клеточную линию.
Клеточная линия, полученная из камбия или прокамбия Taxus согласно настоящему изобретению, дополнительно характеризуется тем, что: (а) она присутствует в виде одиночных клеток при культивировании в суспензии; (б) она обладает более высокой скоростью роста по сравнению с теми клеточными линиями, которые получены из других тканей, а не из камбия или прокамбия Taxus, и она стабильно культивируется; и (в) она обладает низкой чувствительностью к стрессу, вызываемому угловым сдвигом в биореакторе, по сравнению с теми клеточными линиями, которые получены из других тканей, а не из камбия или прокамбия Taxus.
Клеточная линия согласно настоящему изобретению предпочтительно получается способом выделения клеток, включающим следующие стадии:
(а) выделение ткани Taxus, содержащей камбий или прокамбий;
(б) индукцию образования слоя камбия или прокамбия, который пролиферирует из клеток камбия или прокамбия, и аморфного слоя каллуса, который пролиферирует из тканей, не являющихся камбием или прокамбием, путем культивирования полученной ткани Taxus, содержащей камбий или прокамбий; и
(в) сбор клеточной линии из слоя камбия или прокамбия.
В предлагаемом способе выделения стадия (в) предпочтительно проводится путем пролиферации клеток в среде, которая содержит 3-5% (по весу) нерафинированного сахара или сахара и, по меньшей мере, одно из веществ, выбираемых из группы, состоящей из метилжасмоната, грибного экстракта, бактериального экстракта, дрожжевого экстракта, хитозана, глюкоманнана, глюкана, фенилаланина, бензойной кислоты, салициловой кислоты, арахоновой кислоты, STS, мевалоналонат-N-бензолилглицина, АВА, SNP, IPP, ВНТ, ССС, этефона, гиппуевой кислоты, нитрата аммония и церия, AgNO3, ванадилсульфата, р-аминобензойной кислоты, брассиностероидов, альгината натрия и ацетата натрия, и последующего сбора пролиферированной клеточной линии. Предпочтительно, чтобы в среде содержался метилжасмонат в концентрации 10-100 мкМ.
Среда, применяемая в настоящем изобретении, представляет собой обычную среду для культуры растительной ткани, и примеры таких сред включают, но ими не ограничиваются, среду N6, среду SH, среду MS, среду АА, среду LS, среду В5, среду WPM, среду LP, среду White, среду GD, среду DKW, среду DCR и т.д.
В настоящем изобретении экстракт предпочтительно получают с применением растворителя, выбираемого из группы, включающей дистиллированную воду, спирт, ацетон, ДМСО (диметилсульфоксид) и смесь этих растворителей.
В одном примере настоящего изобретения было обнаружено, что клеточная линия, полученная из камбия Taxus, и клеточная линия, полученная из прокамбия Taxus, согласно настоящему изобретению обладают способностью ингибировать активные формы кислорода, индуцируемые H2O2, что позволяет считать, что они обладают антиоксидантным эффектом. Поскольку продуцируемые in vivo активные формы кислорода (АФК) вызывают мутации при связывании с клеточными молекулами, такими как внутриклеточная ДНК, белки и липиды, и вовлечены в образование раковой ткани за счет ингибирования нормального функционирования клеток, можно видеть, что клеточные линии настоящего изобретения обладают способностью предотвращать рак.
В другом примере настоящего изобретения клеточная линия, полученная из камбия Taxus, и клеточная линия, полученная из прокамбия Taxus, согласно настоящему изобретению вводились мышам, после чего анализировалась раковая ткань, извлеченная из мышей. В результате было показано, что клеточная линия, полученная из камбия Taxus, и клеточная линия, полученная из прокамбия Taxus, согласно настоящему изобретению ингибируют рост раковой ткани, ингибируют ангиогенез (рост кровеносных сосудов), что является одним из противораковых механизмов, и усиливают инфильтрацию иммунных клеток в раковую ткань.
В еще одном примере настоящего изобретения клеточные линии рака толстой кишки, карциномы ротовой полости, рака легкого, рака простаты, остеосаркомы, лейкемии, рака матки, рака кожи, рака поджелудочной железы, рака молочной железы, рака желудка, рака почки и рака печени обрабатывались каждая по отдельности водным экстрактом (в дистиллированной воде), метанольным экстрактом и ацетоновым экстрактом для того, чтобы определить влияние этих экстрактов на гибель раковых клеток. В результате было показано, что экстракты клеточных линий согласно настоящему изобретению являются эффективными для профилактики и лечения, но этими видами рака не ограничиваясь, рака толстой кишки, карциномы ротовой полости, рака легкого, рака простаты, остеосаркомы, лейкемии, рака матки, рака кожи, рака поджелудочной железы, рака молочной железы, рака желудка, рака почки и рака печени.
Таким образом, было обнаружено, как это описано выше, что клеточные линии и их экстракты обладают активностью в плане профилактики и лечения рака. Следовательно, хотя это и не продемонстрировано в настоящем изобретении и отсутствует специфический пример, показывающий, что композиция, включающая лизат или культуральную среду клеточной линии, демонстрирует активность по предотвращению и лечению рака, это должно быть очевидным для любого специалиста в данной области техники, что композиция, включающая лизат или культуральную среду клеточной линии согласно настоящему изобретению, может также обладать активностью по предотвращению и лечению рака.
В еще одном примере настоящего изобретения было проанализировано наличие паклитаксела в клеточной линии настоящего изобретения. Когда клеточная линия согласно настоящему изобретению культивируется в среде, содержащей стимулятор, она может продуцировать паклитаксел в высокой концентрации. Клеточная линия настоящего изобретения, которая не культивировалась в условиях, обеспечивающих продукцию паклитаксела, или была обработана в специальных условиях таким образом, чтобы она не продуцировала паклитаксел, была протестирована с целью выяснения, содержит ли она паклитаксел, для чего анализировались данные жидкостной хроматографии (LC). В результате было показано, что клеточная линия не содержит паклитаксел. Таким образом, можно думать, что противораковая активность клеточной линии настоящего изобретения не является результатом действия паклитаксела, который как известно продуцируется растениями рода Taxus, но является противораковой активностью клеточной линии самой по себе. Кроме того, поскольку клеточная линия согласно настоящему изобретению демонстрирует противораковые эффекты даже когда она вводится перорально, можно полагать, что противораковая активность клеточной линии настоящего изобретения не связана с действием паклитаксела, который применяется в виде раствора для инъекций, поскольку паклитаксел не эффективен при пероральном введении.
Композиция для профилактики или лечения рака, содержащая любой один или более из компонентов, выбираемых из клеточной линии согласно настоящему изобретению, лизата этой клеточной линии, экстракта этой клеточной линии, и культуральной среды этой клеточной линии, может быть предоставлена в виде фармацевтической композиции, содержащей любой один или более компонент, выбираемый из группы, состоящей из клеточной линии, лизата этой клеточной линии, экстракта этой клеточной линии, и культуральной среды этой клеточной линии самих по себе или в комбинации, по меньшей мере, с одним фармацевтически приемлемым носителем, наполнителем или растворителем. Клеточная линия, лизат, экстракт или культуральная среда этой клеточной линии могут быть включены в фармацевтическую композицию в фармацевтически эффективном количестве в зависимости от заболевания и его тяжести, возраста, веса, состояния здоровья и пола пациента, способа введения и длительности периода лечения.
В используемом здесь значении термин «фармацевтически приемлемая композиция» означает композицию, которая является физиологически приемлемой и не вызывает при введении человеку расстройства желудка, аллергических реакций, таких как головокружение или подобных реакций.
Примеры названных носителей, наполнителей или растворителей могут включать лактозу, декстрозу, сахарозу, сорбитол, маннитол, ксилитол, эритритол, мальтитол, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидрокси-бензоат, тальк, стеарат магния и минеральные масла.
Фармацевтическая композиция может дополнительно содержать наполнители, анти-агрегирующие агенты, смазывающие вещества (любриканты), увлажняющие агенты, ароматизаторы, эмульгаторы и консерванты. Кроме того, фармацевтическая композиция согласно настоящему изобретению может быть получена с применением методов, хорошо известных в данной области техники, таких, которые обеспечивали бы быстрое, замедленное или отложенное высвобождение активного ингредиента после введения млекопитающим. Композиция может быть приготовлена в виде порошков, гранул, таблеток, эмульсий, сиропов, аэрозолей, мягких или твердых желатиновых капсул, стерильных растворов для инъекций, стерильных порошков и т.д.
В другом аспекте настоящее изобретение предоставляет функциональный пищевой продукт для профилактики или улучшения состояния при раке, которое содержит любой один или более из компонентов, выбираемых из группы, состоящей из названной клеточной линии, названного лизата, названного экстракта и названной культуральной среды, получаемых из камбия или прокамбия Taxus.
В используемом здесь значении термин «функциональный пищевой продукт» относится к продуктам питания, функциональность которых была улучшена путем добавления к ним клеточной линии согласно настоящему изобретению, лизата, экстракта или культуральной среды клеточной линии. Например, противораковый эффект клеточной линии настоящего изобретения или экстракта клеточной линии могут применяться для приготовления функционального пищевого продукта для профилактики и облегчения рака.
Функциональный пищевой продукт настоящего изобретения может содержать различные питательные вещества, витамины, минеральные компоненты (электролиты), ароматизирующие агенты, такие как синтетические ароматизирующие агенты и натуральные ароматизирующие агенты, красители, наполнители, пищеварительную кислоту (peptic acid) и ее соль, альгиновую кислоту и ее соль, органические кислоты, защитные коллоидные загустители, агенты, регулирующие кислотность (рН), стабилизаторы, консерванты, глицерин, спирт, карбонизирующие агенты, которые применяются при карбонизировании напитков.
Примеры
Далее настоящее изобретение будет описано более детально с помощью примеров. Для любого специалиста в данной области техники должно быть очевидным, что данные примеры приводятся исключительно с целью иллюстрации настоящего изобретения и никак не ограничивают рамок настоящего изобретения, поскольку эти примеры могут быть изменены в различные другие варианты.
В частности, хотя в приведенных ниже примерах подтверждаются эффекты по предотвращению рака и эффекты по ингибированию рака клеточной линией и экстрактом клеточной линии, полученной из камбия или прокамбия Taxus, специалисту в данной области техники должно быть очевидным, что применение лизата или культуральной среды указанной клеточной линии может обеспечить такие же результаты, как те, которые получены с применением клеточной линии или экстракта этой клеточной линии.
Пример 1. Получение клеточной линии, происходящей из камбия или прокамбия Taxus
1-1. Получение растительного материала
Собирали по отдельности ветви и стебли Taxus spp., после чего их сразу замачивали в растворе L-аскорбиновой кислоты (DUCHEFA, The Netherlands) в концентрации 100 мг/л, используемой в качестве антиоксиданта. После этого материал транспортировали и хранили.
После этого растения предварительно обрабатывали смешанным раствором 1% беномила (Dongbu Hannong Chemical, Korea), 1% даконила (Dongbu Hannong Chemical, Korea), 1% стрептомицинсульфата (DUCHEFA, The Netherlands) и 0,1% цефотаксима натрия (DUCHEFA, The Netherlands) в течение 24 часов, после чего промывали проточной водой в течение 30 минут для удаления фенольных соединений и оставшихся химикатов. Затем поверхность растений стерилизовали 70% этанолом (DC Chemical, Korea) в течение 1 минуты, 30% перекисью водорода (LG Chemical, Korea) в течение 15 минут, 1% раствором CLOROX в течение 15 минут и 3% раствором CLOROX в течение 5 минут, после чего 3-4 раза промывали водой.
1-2. Выделение тканей прокамбия и камбия из веток и стеблей
Наружные ткани веток и стеблей, которые прошли процесс стерилизации, сразу удаляли путем отрывания их в продольном направлении. Очищенные ткани состояли из ксилемы, прокамбия (ветки) или камбия (стебли), флоэмы, коры и эпидермиса, и эти ткани культивировали таким способом, чтобы самая глубокая ткань из числа имеющихся в материале, например ксилема, находилась в контакте со средой.
1-3. Индукция клеточных линий, происходящих из прокамбия и камбия Taxus
На 4-7 день первичной культуры визуально наблюдалось деление клеток прокамбия и камбия, а после 15 дней культивирования формировался аморфный каллус за счет начала дедифференцировки клеток в слое, состоящем из флоэмы, коры и эпидермиса. Однако деления клеток в ксилеме не происходило во время всего периода культивирования, в результате чего слой камбия естественным образом был отделен от ксилемы. Через 30 дней культивирования ткань начинала разделяться на слой камбия и содержащий флоэму верхний слой, который представлял собой аморфный слой каллуса (фигура 1(а)), после чего ткань естественным образом полностью разделялась на два слоя и эти слои по отдельности культивировались в разных чашках Петри (фигура 1(b)). На фигуре 1(а) надпись «верх» указывает на ткань, содержащую флоэму, кору и эпидермис, надпись «середина» указывает на камбий, надпись «низ» указывает на ксилему, а наконечник стрелки указывает на зону разделения между слоем камбия и тканью, содержащей флоэму, кору и эпидермис. На фигуре 1(b) «А» указывает на клеточную линию, образованную тканью, содержащей флоэму/кору/эпидермис, которая пролиферирует нерегулярно из-за разницы в скорости деления у разных клеток, «В» указывает на клеточную линию, происходящую из камбия, которая пролиферирует с образованием однородного слоя клеток в результате регулярного деления клеток, а «С» указывает на ксилему, в которой деления клеток не происходит. Фигура 1(с) показывает, что происходит индукция клеточной линии, происходящей из прокамбия. На фигуре 1(с) «А» показывает фрагмент ветки через 30 дней культивирования и представляет собой фотографию, демонстрирующую, что прокамбий («низ») отделяется от клеток каллуса, происходящих из ткани, состоящей из первичной флоэмы, коры и эпидермиса, «В» представляет собой фотографию через 35 дней культивирования и показывает, что происходящий из прокамбия слой был изолирован и культивировался, а «С» представляет собой фотографию через 40 дней культивирования и показывает, что каллус, происходящий из ткани, состоящей из первичной флоэмы, коры и эпидермиса, пролиферирует после отделения слоя прокамбия.
После того как ткань была изолирована, как это описано выше, белая и рыхлая часть этой ткани, обладающая хорошей скоростью роста, была субкультивирована (пересеяна) в такой же свежей среде, как среда индукции, с интервалом в 21 день. Состав среды, применявшейся для индукции только клеточных линий, происходящих из прокамбия и камбия, показан ниже в таблице 1.
В среду был добавлен регулятор роста ауксин в концентрации 1-3 мг/л. Культивирование проводилось в темной комнате при контролируемой температуре 25±1°С.
Для сравнения зародыши и эксплантаты иголок Taxus были простерилизованы и культивировались в среде, приведенной в таблице 1. В результате можно видеть, что зародыши и эксплантаты иголок формируют каллусы за счет процесса дедифференцировки. Каллусы, образующиеся из зародышей и эксплантатов иголок, имеют неправильную форму из-за разницы в скорости деления между разными клетками, как это наблюдается в случае ткани, содержащей флоэму, демонстрируют нестабильную скорость роста и быстро приобретают коричневую окраску. Агрегированные каллусы коричневого цвета, индуцированные из зародышей и эксплантатов иголок, демонстрируют медленный рост, вследствие секреции ими фенольных соединений и неизбежно погибают, а именно через 6 месяцев культивирования каллусы, образованные из зародышей и эксплантатов иголок, было трудно поддерживать в культуре. Однако клетки, ведущие свое происхождение от прокамбия и камбия, стабильно поддерживались без изменения скорости их роста, характера роста и агрегации, когда они культивировались в течение длительного времени, превышающего 20 месяцев, что говорит о возможности создания крупномасштабной клеточной культуры.
1-4. Анализ роста и характеристики выделенных клеточных линий
Клеточные линии, полученные из прокамбия и камбия, помещались в колбы, содержащие жидкую среду, состав которой приведен ниже в таблице 2. После этого клеточные линии в колбах культивировались во вращающемся шейкере (качалке) при 100 оборотах в минуту при 25±1°С. Субкультура поддерживалась в течение 2 недель так, чтобы культивируемые клетки всегда сохраняли высокую жизнеспособность и находились в экспоненциальной фазе роста.
Клетки каллусов, полученных из зародышей и иголок, также культивировали в среде 2, приведенной в таблице 2, и сравнивались с клеточными линиями настоящего изобретения, полученными из прокамбия и камбия.
Степень агрегации клеток оценивали с помощью микроскопа для биологических исследований СХ31 (Olympus, Japan). В результате, как показано ниже в таблице 3, можно видеть, что более чем 90% клеток в клеточных линиях согласно настоящему изобретению присутствуют в виде одиночных клеток при культивировании в виде суспензии. Как показано на фигуре 1(d), можно видеть, что клеточные линии согласно настоящему изобретению морфологически характеризуются наличием большого количества вакуолей и находятся в недифференцированном состоянии. Стрелка на фигуре 1(d) указывает на вакуоли в клетках, происходящих из прокамбия Taxus.
Средние клеточные агрегаты 1×103 мкм;
Мелкие клеточные агрегаты 4×102 мкм < размер < 1×103 мкм
В то же время для определения возможности крупномасштабного культивирования клеток, каллусы, полученные из зародышей и иголок, и клеточные линии, полученные из прокамбия и камбия, культивировались в воздушном биореакторе (Sung-Won Cytec, Korea) с внутренним объемом 3 л. Культивирование проводилось в жидкой среде, состав которой представлен в таблице 2, в темноте при температуре 25±1°С.
В результате, как это показано в приведенной ниже таблице 4, можно видеть, что время удвоения клеточных культур, полученных из прокамбия и камбия Taxus согласно настоящему изобретению, составило в биореакторе 4-5 дней, что не отличалось от времени удвоения культур в колбах или было меньше по сравнению с временем удвоения культур в колбах, тогда как время удвоения гетерогенных клеточных линий, которые представляют собой культуры клеток, полученные из зародышей/иголок, составило 12 дней в колбах и 21 день в биореакторе. Другими словами, можно видеть, что при культивировании в колбах клеточные линии согласно настоящему изобретению демонстрировали примерно в 2-3 раза более высокую скорость роста по сравнению с клеточными линиями, полученными из тканей, не являющихся прокамбием или камбием Taxus, а при культивировании в биореакторе клеточные линии согласно настоящему изобретению демонстрировали примерно в 5-6 раз более высокую скорость роста по сравнению с клеточными линиями, полученными из тканей, не являющихся прокамбием или камбием. Можно предполагать, что это происходит вследствие быстрого снижения жизнеспособности клеток в результате образования кольца роста в биореакторе, агрегации растительных клеток в процессе культивирования и чувствительности твердых клеточных стенок к угловым напряжениям сдвига.
Клеточные линии, полученные из прокамбия и камбия согласно настоящему изобретению, формируют очень маленькую площадь кольца роста в биореакторе и это кольцо, формируемое на внутренней стенке биореактора, легко удаляется, когда простая стимуляция прикладывается к инкубатору для встряхивания среды. Кроме того, было обнаружено, что клеточные линии настоящего изобретения характеризуются слабой агрегацией и содержат большое количество вакуолей, в результате чего обладают низкой чувствительностью к напряжению углового сдвига, так что жизнеспособность клеток не уменьшается. Другими словами, было обнаружено, что клеточные линии согласно настоящему изобретению имею низкую чувствительность к напряжению углового сдвига, возникающему при встряхивании в биореакторе при массовом выращивании клеток, вследствие чего могут быть быстро получены в биореакторе в больших количествах. Принимая во внимание различия в скорости роста клеточных линий при культивировании в колбах и в биореакторе, можно видеть, что клеточные линии, полученные из прокамбия или камбия Taxus согласно настоящему изобретению, обладают в 2-3 раза меньшей чувствительностью к напряжению углового сдвига по сравнению с клеточными линиями, полученными из тканей, не являющихся прокамбием или камбием Taxus.
1-5: Обработка сахаром и метилжасмонатом
Клеточные линии, которые культивировались в виде суспензии в течение 14 дней, как это описано в Примере 1-4, далее культивировались в среде (содержащей стерильную воду, 3-5% (по весу) нерафинированного сахара и 100 мкМ метилжасмоната) в течение 10 дней в темноте, после чего клетки собирались и использовались в дальнейших экспериментах.
Пример 2. Приготовление экстракта клеточной линии, полученной из прокамбия или камбия Taxus
Из клеточной линии, полученной в примере 1, были последовательно экстрагированы активные ингредиенты, как указано ниже:
(i) 500 г клеточной линии, из которой была удалена культуральная среда, растворяли (экстрагировали) в 500 мл дистиллированной воды при 50°С в течение 6 часов при постоянном перемешивании;
(ii) после завершения экстрагирования раствор клеток центрифугировали при 3000×g в течение 10 минут, собирали супернатант, получая, таким образом, субстанцию, растворимую в дистиллированной воде;
(iii) после получения субстанции, растворимой в дистиллированной воде, оставшаяся нерастворимая в дистиллированной воде субстанция экстрагировалась в 500 мл метанола при комнатной температуре в течение 6 часов при постоянном перемешивании;
(iv) после завершения экстрагирования раствор центрифугировали при 3000×g в течение 10 минут, собирали супернатант, получая, таким образом, субстанцию, растворимую в метаноле;
(v) после получения субстанции, растворимой в метаноле, оставшаяся нерастворимая в метаноле субстанция экстрагировалась в 500 мл ацетона при комнатной температуре в течение 6 часов при постоянном перемешивании;
(vi) после завершения экстрагирования раствор центрифугировали при 3000xg в течение 10 минут, собирали супернатант, получая, таким образом, субстанцию, растворимую в ацетоне;
(vii) полученные как описано выше субстанции, растворимые в дистиллированной воде, метаноле и ацетоне, были сконцентрированы с помощью вакуумного роторного испарителя;
(viii) сконцентрированные образцы были высушены с помощью лиофильной сушки и растворены в дистиллированной воде, метаноле и ацетоне, в результате чего были получены водный экстракт (в дистиллированной воде), метанольный экстракт и ацетоновый экстракт клеточной культуры настоящего изобретения соответственно.
Пример 3. Измерение антиоксидантной активности экстракта клеточных линий, полученных из камбия или прокамбия Taxus
Поскольку известно о наличии корреляции между антиоксидантным действием и предотвращением рака, были проведены следующие тесты для того, чтобы выяснить, обладает ли клеточная линия согласно настоящему изобретению эффектом по предотвращению рака.
3-1: Культура диплоидных фибробластов человека (human diploid fibroblasts, HDF)
Клетки HDF выделяли из эмбриональной крайней плоти и культивировали. Культуральная среда была приготовлена путем добавления 10% фетальной сыворотки теленка (FBS, Hyclone, Logan, Utah, USA), инактивированной нагреванием при 56°С в течение 30 минут, 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина и 300 мкг/мл глутамина к среде DMEM (Invitroge Gibco life tech. Vienna, Austria). Клетки культивировали в описанной выше среде в инкубаторе с 5% СО2 при температуре 37°С и влажности 95% и субкультивировали (пересевали) с интервалом в 3-4 дня, непосредственно перед тем, как клетки сливались друг с другом. Субкультивируемые клетки были разделены на группы в соответствии с числом пересевов (пассажей) на молодые клетки, культивируемые с числом пассажей менее 20, промежуточные клетки, культивируемые с числом пассажей 21-49, и старые клетки, культивируемые с числом пассажей более 50.
3-2: Измерение активных форм кислорода, индуцируемых Н2О2
Для оценки того, ингибируется ли образование активных форм кислорода, индуцируемых H2O2, когда диплоидные фибробласты кожи (клетки HDF) обрабатываются водным экстрактом (в дистиллированной воде) - одним из экстрактов, которые были получены в примере 2, было проведено измерение активных форм кислорода (АФК).
Измерение внутриклеточных активных форм кислорода проводили с помощью анализа Facscan с использованием флуоресцентного красителя DCFDA (2',7'-дихлорфлуоресцеин диацетат, Fluka Cat 35847 Molecular Probes, USA), чувствительного к активным формам кислорода. Клетки HDF выращивались согласно каждому протоколу в 100-миллиметровых чашках, после чего инкубировались в присутствии 5 мкМ DCFDA в темноте при 37°С в течение 30 минут. После этого клетки дважды промывали фосфатным буфером (PBS) и собирали с помощью обработки трипсином и ЭДТА. После этого собранные клетки осаждали центрифугированием при 900 об/мин в течение 4 минут и измеряли активные формы кислорода в расчете на 10000 клеток (фигуры 2(а) и 2(b)).
Клетки в количестве 5×105 помещали в 6-луночный планшет и обрабатывали либо только H2O2, либо H2O2 в комбинации с экстрактом, полученным в Примере 2. Из полученных в Примере 2 экстрактов применялся экстракт в дистиллированной воде в концентрации 10-100 мкг/мл, предпочтительно в концентрации 50 мкг/мл. После этого клетки промывали 2-3 раза раствором HBSS (сбалансированный солевой раствор Хенкса) и стабилизировали в растворе HBSS в течение примерно 30 минут. Затем клетки окрашивали 10 мкМ раствором DCFDA (Molecular Probes USA) в темноте при 37°С в течение 1 часа, промывали три раза раствором HBSS, после чего анализировали с помощью флуоресцентного микроскопа (фигура 2(с)).
Как описано выше, клетки HDF были обработаны 200 мкМ раствором H2O2 и экстрактом в дистиллированной воде в концентрации 10-100 мкг/мл (предпочтительно 50 мкг/мл), полученном в примере 2, после чего визуально анализировали вариации в морфологии клеток.
Через 24 часа после обработки клеток H2O2, клетки HDF генерируют активные формы кислорода (АФК) в результате окислительного стресса. Поскольку DCFDA, не обладающий флуоресценцией, окисляется активными формами кислорода с образованием продукта DCF, обладающего интенсивной флуоресценцией, можно измерить количество активных форм кислорода. В данном примере для измерения использовался прибор FACS Calibur (Becton Dickinson Analytic Flow Cytometer, USA).
В результате было установлено, как показано на фигуре 2, что экстракт клеточной линии, полученной из камбия Taxus, и экстракт клеточной линии, полученной из прокамбия Taxus, оба ингибируют продукцию активных форм кислорода (АФК). На фигуре 2 P-WE обозначает экстракт в дистиллированной воде клеток прокамбия, a C-WE - экстракт в дистиллированной воде клеток камбия. Таким образом, можно видеть, что экстракты двух клеточных линий оба ингибируют продукцию активных форм кислорода.
Вещества, обладающие высокой антиоксидантной активностью, являются активными веществами, которые ингибируют повреждение клеток, вызываемое клеточным окислением, поскольку активные формы кислорода (АФК), продуцируемые in vivo, связываются с клеточными молекулами, такими как внутриклеточная ДНК, белки и липиды, что приводит к мутациям клеток, и этот процесс участвует в образовании раковой ткани за счет ингибирования нормального функционирования клеток.
Таким образом, поскольку в описанном выше эксперименте было установлено, что клеточная линия, полученная из камбия Taxus, и клеточная линия, полученная из прокамбия Taxus, настоящего изобретения обладают антиоксидантным действием, следовательно, клеточная линия, полученная из камбия Taxus, и клеточная линия, полученная из прокамбия Taxus, настоящего изобретения обладают способностью предотвращать рак.
Пример 4. Противораковая активность при введении клеточных линий, полученных из камбия и прокамбия Taxus
(1) В этом эксперименте мыши Balb/C были куплены у Damool Science (Daejeon, Korea) и содержались в соответствии с общими правилами содержания лабораторных животных, а именно мыши возрастом 6 недель были приобретены и адаптированы в течение примерно 5 дней. После этого клетки рака толстой кишки СТ-26 (Korean Cell Line Bank KCLB80009) в количестве 1×106 были введены мышам подкожно в правую часть спины (правое бедро).
Примерно через 3 дня после инъекции раковых клеток наблюдался рост раковой опухоли до размера, примерно равного размеру зерна проса. Начиная с 3 дня, после инъекции раковых клеток мышам, обеспечивали свободный доступ к пище, содержащей клеточные линии, полученные из камбия и прокамбия в примере 1. Контрольная группа получала стандартный корм для лабораторных мышей, а введение в корм клеточных линий производили путем тонкого измельчения стандартного корма для мышей, добавления в него одной из клеточных линий в соотношении 1:1, приготовлением гранул корма, имеющих ту же форму, что и гранулы стандартного корма, и обеспечивали мышам свободный доступ к приготовленному корму. Таким образом, средняя дневная дозировка каждой из клеточных линий составила 2-3 г сырого веса клеток/мышь. Все другие условия содержания животных были одинаковыми для контрольной группы и тестируемой группы, а за размером раковой опухоли наблюдали в течение 3 недель. В эксперименте каждая группа из контрольной группы и группы, получавшей корм с клеточной линией, состояла из 15 животных (7 мышей, получавших клеточную линию их камбия, и 8 мышей, получавших клеточную линию из прокамбия), и эксперимент повторялся 3 раза.
(2) Результаты анализа размера раковой опухоли после введения клеточной линии в течение трех недель.
Через 2 недели после введения клеточной линии согласно настоящему изобретению определяли размер раковой ткани у мышей в контрольной и опытной группах. В результате было установлено, как это видно на фигуре 3, что рост раковой ткани в группе, которой вводилась клеточная линия, полученная из камбия, и клеточная линия, полученная из прокамбия, был заингибирован по сравнению с контрольной группой.
Кроме того, как показано на фигуре 4, через 3 недели после введения клеточной линии объем раковой ткани в группе, получавшей клеточные линии, составлял примерно 100 мм2, тогда как в контрольной группе объем раковой ткани был более чем в 6 раз больше по сравнению с группами, получавшими клеточные линии. Кроме того, раковая ткань была вырезана и сфотографирована и, как показано на фигуре 5, наблюдалось значительное различие в объеме опухоли между контрольной группой и группой, получавшей клеточные линии. Вырезанная раковая ткань была взвешена, в результате чего было установлено, что средний вес раковой ткани в контрольной группе составил 2,16 г, тогда как средний вес раковой ткани в группе, получавшей клеточные линии составил 0,21 г, что соответствует примерно 1/10 от веса ткани в контрольной группе. Таким образом, можно заключить, что клеточные линии согласно настоящему изобретению в целом ингибируют рост раковых клеток, что позволяет предполагать, что эти клеточные линии обладают активностью, направленной на предотвращение и лечение рака.
(3) Одновременно с этим раковая ткань была вырезана у мышей контрольной группы и группы, получавшей клеточные линии, после чего при разных увеличениях было проведено исследование внутреннего строения этой ткани. Полученные результаты показаны на фигуре 6.
В результате наблюдений было установлено, что в контрольной группе не обнаруживается участков ткани, характеризующихся гибелью клеток по пути апоптоза, что ткань во всех участках опухоли была плотная, и что делящиеся клетки (фракция, отмеченная буквой «b» на фигуре 6(а)) были крупными. Тот факт, что делящиеся клетки были крупными, означает, что раковая ткань в контрольной группе продолжает расти и распространяться.
Однако в группе, получавшей клеточные линии, ткань была не плотной, а большинство клеток демонстрировало конденсацию ядер с формированием структур, называемых апоптотическими тельцами (фракция, отмеченная буквой «с» на фигуре 6(b)), или демонстрировало деление в различные ткани. Такие апоптотические тельца в контрольной группе в значительных количествах не наблюдались.
Кроме того, важным характеристическим признаком является окрашивание эритроцитов (фракция, отмеченная буквой «а» на фигуре 6(а)), которое показывает наличие кровеносных сосудов в ткани. В контрольной группе было обнаружено множество кровеносных сосудов, тогда как в группе, получавшей клеточные линии, кровеносных сосудов обнаружено не было. В группе, получавшей клеточные линии, в значительных количествах присутствовали клетки с круглым ядром, которые можно считать иммунными клетками (фракция, отмеченная буквой «d» на фигуре 6(b), но в контрольной группе такие клетки в значительном количестве обнаружены не были.
Таким образом, можно видеть, что клеточные линии настоящего изобретения, полученные из камбия или прокамбия Taxus, прямо участвуют в развитии рака и вызывают гибель раковых клеток, что позволяет предполагать, что они обладают активностью в плане профилактики и лечения рака за счет ингибирования общего роста раковой ткани. Кроме того, можно видеть, что эти линии ингибируют ангиогенез, сопровождающий процесс канцерогенеза, и увеличивают инфильтрацию иммунных клеток в раковую ткань, что индуцирует сильную иммунную активность, то есть демонстрируют сильную противораковую активность.
Пример 5. Получение и направленная на гибель раковых клеток активность экстракта клеточной линии, полученной из камбия или прокамбия Taxus
(1) Культура раковых клеток
- Клеточные линии рака человека: клеточная линия карциномы ротовой полости (KB cell, Korean Cell Line Bank KCLB10017), клеточная линия рака легкого (НСС95, Korean Cell Line Bank KCLB70095), клеточная линия рака простаты (PC-3, Korean Cell Line Bank KCLB21435), клеточная линия остеосаркомы (U2-OS, Korean Cell Line Bank KCLB30096), клеточная линия лейкемии (К-562, Korean Cell Line Bank KCLB10243), клеточная линия рака матки (HeLa, Korean Cell Line Bank KCLB10002), клеточная линия рака кожи (НТ1080, Korean Cell Line Bank KCLB10121), клеточная линия рака поджелудочной железы (MIA CaPa-2, Korean Cell Line Bank KCLB21420), клеточная линия рака молочной железы (MCF-7, Korean Cell Line Bank KCLB30022), клеточная линия рака желудка (AGS, Korean Cell Line Bank KCLB21739), клеточная линия рака почки (Caki-1, Korean Cell Line Bank KCLB30046) и клеточная линия рака печени (HepG2, Korean Cell Line Bank KCLB88065).
- Клеточные линии рака мыши: клеточная линия рака кожи (B16F10, Korean Cell Line Bank KCLB8008) и клеточная линия рака толстой кишки (СТ-26, Korean Cell Line Bank KCLB80009).
- Культивирование клеток: каждая из клеточных линий культивировалась в среде RPMI или DMEM в зависимости от типа клеток. К среде добавляли 10% фетальной сыворотки теленка (FBS), инактивированной нагреванием при 56°С в течение 30 минут, пенициллин (100 единиц/мл), стрептомицин (100 мкг/мл) и 300 мг/мл глутамина. Каждая из клеточных линий культивировалась в соответствующей среде в 5% CO2 инкубаторе при 37°С и влажности 95% и субкультивировалась (пересевалась) с интервалом в 3-4 дня непосредственно перед тем, как клетки начинали сливаться друг с другом. В экспериментах использовались только те клетки, которые пересевались в целом 30 раз или менее.
- Обработка экстрактом и измерение активности, приводящей к гибели клеток:
клетки в количестве 1×105 высевали в 6-луночный планшет и через 6 часов, когда клетки полностью прикреплялись к стенкам 6-луночного планшета, клетки обрабатывали либо экстрактом в дистиллированной воде, либо метанольным, либо ацетоновым экстрактами (150, 400, 800 мкг/мл культуры). После этого степень гибели клеток измеряли в течение 3 дней после обработки экстрактами. Пролиферацию клеток измеряли согласно методу измерения МТТ (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолийбромид). Степень подавления роста клеток в группе, обработанной экстрактом, сравнивалась с контрольной группой, которая ничем не обрабатывалась, с группой, получавшей носитель, к которой добавляли метанол или ацетон, и с группой положительного контроля, которую обрабатывали полученным из растений рода Taxus паклитакселем (Sigma) в качестве противоракового агента. Клетки дважды промывали культуральной средой, подогретой до 37°С в течение заданного времени, после чего к ним добавляли 1 мл раствора МТТ (5 мг/мл, без фенолового красного). После этого клетки снова культивировали в течение 4 часов. Супернатант удаляли, а образовавшийся осадок формазана растворяли в 1 мл ДМСО и измеряли оптическую плотность при 570 нм. Число выживших клеток определяли путем фиксирования клеток 50% метанолом через 3 дня после обработки экстрактом и окрашивания прикрепленных выживших клеток кристаллическим фиолетовым (кристалл-виолетом).
(2) Результаты экспериментов, полученные при обработке экстрактами
- Выжившие клетки через 3 дня после того, как клетки были обработаны каждым из экстрактов в дистиллированной воде, метаноле и ацетоне (800 мкг/мл)
Каждая из клеточных линий, полученных из Taxus, из которой была удалена культуральная среда, последовательно растворялась в дистиллированной воде, метаноле и ацетоне для получения экстрактов клеточной линии, а затем клетки обрабатывались каждым из этих экстрактов. В результате было установлено, что метанольный экстракт обладает самой сильной апоптотической активностью на большую часть протестированных клеток, и что эта апоптотическая активность близка к апоптотической активности в группе положительного контроля (Taxol (паклитаксел) на фигуре 7), обработанной 10 мкг/мл паклитаксела.
Водный и ацетоновый экстракты также демонстрировали апоптотические эффекты, однако наблюдаемая апоптотическая активность была в целом более низкой, чем активность метанольного экстракта. Однако контроль с носителем (носитель на фигуре 7) показал, что метанол и ацетон не оказывают влияния на апоптоз. Это позволяет предполагать, что экстракты клеточных линий содержат соединения, обладающие активностью, приводящей к гибели раковых клеток. На следующей стадии экспериментов клетки обрабатывались разными концентрациями метанольного экстракта, и проводилась оценка степени апоптоза клеток.
- Апоптотическая активность при обработке разными концентрациями метанольного экстракта
Метанольный экстракт растворяли в метаноле в концентрации 200 мг/мл и добавляли к 1 мл каждой культуральной среды тестируемых клеточных линий в концентрации 150, 400 и 800 мкг/мл. Рост клеток определяли методом МТТ ежедневно с 1 по 3 день после добавления метанольного экстракта, а через 3 дня после добавления метанольного экстракта выжившие клетки фиксировали метанолом, после чего окрашивали кристаллическим фиолетовым. Результаты измерений для 14 линий раковых клеток показаны на фигурах с 8 по 21.
Как видно из приведенных выше результатов, метанольный экстракт клеточных линий согласно настоящему изобретению, полученных из камбия и прокамбия Taxus, продемонстрировал апоптическую активность в отношении 14 линий раковых клеток концентрационно-зависимым способом. Метанольный экстракт в концентрации 800 мкг/мл демонстрировал сильную апоптотическую активность в отношении всех клеточных линий, и эта апоптотическая активность была такой же, как апоптотическая активность паклитаксела (10 мкг/мл), который применялся в группе положительного контроля. Однако в случае линий клеток СТ-26 (фигура 8) и B16F10 (фигура 13), метанольный экстракт в концентрации 800 мкг/мл продемонстрировал более высокую апоптотическую активность по сравнению с группой положительного контроля. Количественное различие между паклитакселем, применяемым в качестве положительного контроля, и метанольным экстрактом клеточных линий согласно настоящему изобретению можно объяснить тем фактом, что паклитаксел представляет собой высокоочищенное вещество, тогда как экстракт клеточной линии представляет собой смесь большого количества соединений. Таким образом, можно предполагать, что апоптотическая активность клеточной линии согласно настоящему изобретению может быть дополнительно улучшена с помощью очистки.
Пример 6. Исследование присутствия паклитаксела в клеточных линиях. полученных из камбия и прокамбия Taxus
Одновременно с этим, для доказательства того, что противораковая активность клеточной линии согласно настоящему изобретению не является противораковой активностью паклитаксела, наличие паклитаксела в клеточной линии настоящего изобретения было исследовано следующим образом.
Паклитаксел (Taxol), применяемый в данном примере в качестве стандарта, приобретали у фирмы Sigma, а применяемые в ВЭЖХ воду (J.T.Baker), ацетонитрил и метанол фильтровали через фильтр с диаметром пор 0,2 мкм и использовали в качестве подвижной фазы.
Клеточную линию, полученную в примере 1, в количестве 0,2 г встряхивали на Вортексе в 0,4 мл метанола в течение 5 минут и экстрагировали при комнатной температуре в течение 1 часа. Экстракт центрифугировали при 13000 об/мин в течение 5 минут и фильтровали через фильтр с размером пор 0,2 мкм, после чего фильтрат количественно анализировали методом ВЭЖХ (ultra performance liquid chromatography, UPLC).
При анализе методом UPLC (Waters, MA, USA) экстракт количественно анализировали, сравнивая его со стандартом, при разделении на колонке UPLC ВЕН С18 (100 мм × 2,1 мм i.d. (внутренний диаметр) × 1,7 мкм). В качестве подвижной фазы применялись вода и ацетонитрил, скорость тока при градиентной элюции составляла 0,4 мл/мин, определение оптической плотности в ультрафиолете проводили при длине волны 227 нм.
Стандарт таксола анализировали методом UPLC по поглощению при 227 нм и 280 нм. В результате, как показано на фигуре 22(а), время удержания составило 4,67 минуты. Кроме того, сообщалось, что паклитаксел должен демонстрировать соотношение поглощения в ультрафиолете (227 нм/280 нм), равное примерно 0,05 (Castor & Tyler 1993), а для анализируемого в этом примере стандарта паклитаксела измеренное соотношение поглощения в ультрафиолете А (280 нм)/А (227 нм) составило 0,048.
Одновременно с этим клеточная линия (тестируемый образец) согласно настоящему изобретению был проанализирован методом UPLC по поглощению при 227 нм и 280 нм. В результате анализа было установлено, как показано на фигуре 22(b), что время удержания составило 4,70 мин. Кроме того, анализ поглощения экстракта клеточной линии (тестируемого образца) в ультрафиолете показал, что соотношение поглощения при 227 нм и 280 нм А (280 нм)/А (227 нм) составило 1,24, что позволяет считать, что экстракт клеточной линии не содержит паклитаксела.
Дополнительно были проанализированы PDA-спектры (спектры поглощения пиков после фотодиодного анализа при ВЭЖХ) стандарта паклитаксела и экстракта клеточной линии согласно настоящему изобретению. Как показано на фигуре 22(с) и фигуре 22(d), результаты анализа позволяют заключить, что клеточная линия согласно настоящему изобретению не содержит паклитаксела.
Пример 7. Изготовление фармацевтических композиций
Композиция 1: Изготовление таблеток
Экстракт клеточной линии, полученный в примере 1, в количестве 100 мг смешивался со 100 мг кукурузного крахмала, 100 мг лактозы и 2 мг стеарата магния, после чего смесь прессовали для получения таблеток согласно стандартному способу таблетирования.
Композиция 2: Изготовление композиции в виде капсул
Экстракт клеточной линии, полученный в примере 1, в количестве 500 мг помещали в мягкие желатиновые капсулы для получения композиции в виде капсул.
Композиция 3: Изготовление композиции в виде сиропа
Клеточная линия, полученная в примере 1, в количестве 1 г смешивалась с 10 г изомеризованного сахара, 5 г маннитола и подходящим количеством очищенной воды, после чего объем смеси доводили до 100 мл для получения композиции в виде сиропа с помощью стандартного способа.
Композиция 4: Изготовление раствора для инъекций
Экстракт клеточной линии, полученный в примере 1, в количестве 200 мг нагревали и растворяли в 200 мг физиологического раствора, содержащего гидрогенизированное полиоксиэтиленом касторовое масло, для получения раствора для инъекций, содержащего смешанный экстракт в концентрации 0,1%.
Пример 8. Изготовление функциональных продуктов питания: изготовление функционального напитка
Рецепт изготовления 1. Клеточная линия, полученная в примере 1, в количестве 200 мг растворялась в 96 мл воды, после чего к полученному раствору были добавлены 500 мг витамина С в качестве дополнения, по 1 г каждого лимонной кислоты и олигосахаридов в качестве усилителей вкуса и 0,05 г бензоата натрия в качестве консерванта. После этого добавлялась очищенная вода для получения 100 мл функционального напитка.
Рецепт изготовления 2. Экстракт клеточной линии, полученный в примере 1, в количестве 200 мг растворялась в 96 мл воды, после чего к полученному раствору были добавлены 500 мг витамина С в качестве дополнения, по 1 г каждого лимонной кислоты и олигосахаридов в качестве усилителей вкуса и 0,05 г бензоата натрия в качестве консерванта. После этого добавлялась очищенная вода для получения 100 мл функционального напитка.
Промышленная применимость
Как описано выше, клеточная линия согласно настоящему изобретению и лизат экстракт и культуральная среда этой клеточной линии выделяются из природного (натурального) материала, имеют минимизированные побочные эффекты по сравнению с ранее известными терапевтическими средствами, являются безопасными для человека, прямо вовлекаются в развитие рака и индуцируют гибель раковых клеток и демонстрируют противораковую активность за счет ингибирования ангиогенеза, происходящего в процессе канцерогенеза. Таким образом, они являются пригодными для профилактики, лечения и облегчения симптомов рака.
Хотя настоящее изобретение описано в деталях только в отношении некоторых специфических характеристик, специалисту в данной области техники должно быть понятно, что данное раскрытие изобретения приводится только для предпочтительного воплощения изобретения и не ограничивает рамок настоящего изобретения. Таким образом, основные рамки настоящего изобретения будут определены в прилагаемой формуле изобретения и в эквивалентах приведенных пунктов формулы изобретения.









Изобретение относится к фармацевтической промышленности, в частности к композиции для профилактики или лечения рака. Фармацевтическая композиция для профилактики или лечения рака, которая содержит один или более компонентов, выбираемых из группы, состоящей из клеточной линии, полученной из камбия или прокамбия Taxus с определенными характеристиками. Функциональный пищевой продукт для профилактики или улучшения состояния при раке, который содержит один или более компонентов, выбираемых из группы, состоящей из клеточной линии, которая получена из камбия или прокамбия Taxus с определенными характеристиками. Вышеописанные композиция и продукт эффективно индуцируют гибель раковых клеток, имеют минимальные побочные эффекты. 2 н. и 9 з.п. ф-лы, 22 ил., 4 табл.
1. Фармацевтическая композиция для профилактики или лечения рака, которая содержит любой один или более компонентов, выбираемых из группы, состоящей из клеточной линии, полученной из камбия или прокамбия Taxus и обладающей приведенными ниже характеристиками, лизата этой клеточной линии, экстракта этой клеточной линии, и культуральной среды этой клеточной линии:
(a) клетки этой линии находятся в изначально недифференцированном состоянии без прохождения дедифференциации; и
(b) линия представляет собой гомогенную клеточную линию.
2. Фармацевтическая композиция по п.1, где клеточная линия дополнительно характеризуется тем, что
(i) формирует агрегаты меньшего размера, чем агрегаты, полученные из дедифференцированного каллуса;
(ii) обладает более высокой скоростью роста по сравнению с теми клеточными линиями, которые получены из других тканей, а не из камбия или прокамбия Taxus, и она стабильно культивируется;
(iii) обладает низкой чувствительностью к стрессу, вызываемому угловым сдвигом в биореакторе, по сравнению с теми клеточными линиями, которые получены из других тканей, а не из камбия или прокамбия Taxus и
(iv) клетки этой линии морфологически характеризуются наличием большого количества вакуолей.
3. Фармацевтическая композиция по п.1, где клеточная линия получена способом, включающим следующие стадии:
(a) выделение ткани Taxus, содержащей камбий или прокамбий;
(b) индукцию образования слоя камбия или прокамбия, который пролиферирует из клеток камбия или прокамбия, путем культивирования полученной ткани Taxus, содержащей камбий или прокамбий; и
(c) сбор клеточной линии из слоя камбия или прокамбия.
4. Фармацевтическая композиция по п.3, где стадия (с) проводится путем пролиферации клеточной линии в среде, которая содержит 3-5% (по весу) нерафинированного сахара или сахара и, по меньшей мере, одно из веществ, выбираемых из группы, состоящей из метилжасмоната, грибного экстракта, бактериального экстракта, дрожжевого экстракта, хитозана, глюкоманнана, глюкана, фенилаланина, бензойной кислоты, салициловой кислоты, арахоновой кислоты, STS, мевалоналонат-N-бензолилглицина, АВА, SNP, IPP, ВНТ, ССС, этефона, гиппуевой кислоты, нитрата аммония и церия, AgNO3, ванадилсульфата, n-аминобензойной кислоты, брассиностероидов, альгината натрия и ацетата натрия, и последующего сбора пролиферированной клеточной линии.
5. Фармацевтическая композиция по п.1, где экстракт получают с применением растворителя, выбираемого из группы, состоящей из дистиллированной воды, спирта, ацетона, ДМСО (диметилсульфоксида) и смеси этих растворителей.
6. Фармацевтическая композиция по любому из пп.1-5, где рак выбирается из группы, состоящей из рака толстой кишки, карциномы ротовой полости, рака легкого, рака простаты, остеосаркомы, лейкемии, рака матки, рака кожи, рака поджелудочной железы, рака молочной железы, рака желудка, рака почки и рака печени.
7. Фармацевтическая композиция по п.1, где указанная клеточная линия, ее лизат, экстракт и ее культуральная среда являются свободными от паклитакселя.
8. Функциональный пищевой продукт для профилактики или улучшения состояния при раке, который содержит любой один или более компонентов, выбираемых из группы, состоящей из клеточной линии, которая получена из камбия или прокамбия Taxus и обладает приведенными ниже характеристиками, лизата этой клеточной линии, экстракта этой клеточной линии и культуральной среды этой клеточной линии:
(a) клетки этой линии находятся в изначально недифференцированном состоянии без прохождения дедифференциации; и
(b) линия представляет собой гомогенную клеточную линию.
9. Функциональный пищевой продукт по п.8, где клеточная линия дополнительно характеризуется тем, что (i) она присутствует в виде одиночных клеток при культивировании в суспензии; (ii) она обладает более высокой скоростью роста по сравнению с теми клеточными линиями, которые получены из других тканей, а не из камбия или прокамбия Taxus, и она стабильно культивируется; и (iii) она обладает низкой чувствительностью к стрессу, вызываемому угловым сдвигом в биореакторе, по сравнению с теми клеточными линиями, которые получены из других тканей, а не из камбия или прокамбия Taxus и (iv) клетки этой линии морфологически характеризуются наличием большого количества вакуолей.
10. Функциональный пищевой продукт по п.8, где клеточная линия получена способом, включающим следующие стадии:
(a) выделение ткани Taxus, содержащей камбий или прокамбий;
(b) индукцию образования слоя камбия или прокамбия, который пролиферирует из клеток камбия или прокамбия, путем культивирования полученной ткани Taxus, содержащей камбий или прокамбий; и
(c) сбор клеточной линии из слоя камбия или прокамбия.
11. Функциональный пищевой продукт по п.8, где указанная клеточная линия, ее лизат, экстракт и ее культуральная среда являются свободными от паклитакселя.
| СПОСОБ ЛЕЧЕНИЯ РАКА | 2002 |
|
RU2284184C2 |
| US 5850032 А, 15.12.1998 | |||
| KR 101995005081 B1, 18.05.1995 | |||
| US 5407816 A, 18.04.1995. | |||
Авторы
Даты
2012-01-27—Публикация
2008-10-10—Подача