Настоящее изобретение относится к способам и композициям, предназначенным для терапевтического и диагностического применения при лечении заболеваний и нарушений, которые вызываются или ассоциированы с амилоидом или амилоидоподобными белками, включая амилоидоз, группу нарушений и патологий, ассоциированных с амилоидным белком, таких как болезнь Альцгеймера.
Амилоидоз представляет собой не отдельное заболевание, а скорее группу разнообразных прогрессирующих болезненных процессов, которые характеризуются внеклеточными отложениями в ткани воскообразного крахмалоподобного белка, называемого амилоидом, который накапливается в одном или нескольких органах или системах организма. После образования амилоидных отложений они начинают препятствовать нормальному функционированию органа или системы организма. Существует по меньшей мере 15 различных типов амилоидоза. Основными формами являются первичный амилоидоз, не имеющий известных предвестников (состояний-предшественников) заболевания, вторичный амилоидоз, возникающий после определенного другого состояния, и наследственный амилоидоз.
Вторичный амилоидоз возникает у людей, страдающих хроническим инфекционным или воспалительным заболеванием, таким как туберкулез, бактериальная инфекция, которую называют семейной средиземноморской лихорадкой, костными инфекционные заболевания (остеомиелит), ревматоидный артрит, воспаление тонкого кишечника (гранулематозный илеит), болезнь Ходжкина и проказа.
Амилоидные отложения, как правило, включают три компонента. Амилоидные белковые фибриллы, на долю которых приходится примерно 90% амилоидного материала, состоят из одного или нескольких различных типов белков. Фибриллы этих белков обладают способностью принимать так называемую «бета-складчатую конформацию», представляющую собой уникальную конфигурацию белка, которая обладает сайтами связывания с красителем конго красным, что обусловливает уникальную способность амилоидного белка к окрашиванию. Кроме того, амилоидные отложения тесно ассоциированы с компонентом, представляющим собой амилоид Р (пентагональный) (АР), гликопротеин, родственный обычному сывороточному амилоиду Р (амилоидному белку) (SAP), и сульфатированными гликозаминогликанами (GAG), сложными углеводами, присутствующими в соединительной ткани.
Многие связанные с возрастом заболевания обусловлены или ассоциированы с амилоидоподобными белками и характеризуются, в частности, образованием внеклеточных отложений амилоида или амилоидоподобного материала, которые участвуют в патогенезе, а также в развитии заболевания. Такие заболевания включают (но не ограничиваясь ими) неврологические нарушения, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона, другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна.
Хотя патогенез этих заболеваний может быть различным, характерные для них отложения часто содержат многие сходные молекулярные компоненты. В значительной степени это может относиться к местной активации провоспалительных путей, приводя тем самым к конкурентному отложению компонентов активированного комплемента, реактантов острой фазы, иммуномодуляторов и других воспалительных медиаторов (McGeer и др., 1994).
Болезнь Альцгеймера (AD) представляет собой неврологическое нарушение, которое, как предполагается, вызывается прежде всего амилоидными бляшками, накоплением патологических отложений белков в головном мозге. Наиболее часто встречающийся тип амилоида, выявленный в головном мозге пораженных заболеванием индивидуумов, в основном состоит из Aβ-фибрилл. Научно доказано, что увеличение производства и накопления бета-амилоидного белка в бляшках приводит к гибели нервных клеток, что способствует возникновению и развитию болезни Альцгеймера. В свою очередь, утрата нервных клеток в стратегически важных областях головного мозга приводит к уменьшению уровня нейромедиаторов и ухудшению памяти. К белкам, которые в первую очередь ответственны за образование бляшки, относятся амилоидный белок-предшественник (АРР) и два пресенилина (пресенилин I и пресенилин II). Последовательное расщепление амилоидного белка-предшественника (АРР), который конститутивно экспрессируется и катаболизируется в большинстве клеток, ферментами β- и γ-секретазами приводит к высвобождению состоящего из 39-43 аминокислот Aβ-пептида. Расщепление АРР, по-видимому, приводит к повышению их способности к агрегации с образованием бляшек. Aβ(1-42)-фрагмент обладает прежде всего наиболее высокой способностью образовывать агрегаты благодаря наличию двух высокогидрофобных аминокислотных остатков на его С-конце. Поэтому предполагается, что прежде всего Aβ(1-42)-фрагмент участвует и ответственен за инициацию образования нейритной бляшки при болезни Альцгеймера, и следовательно, обладает высоким патологическим потенциалом. Таким образом, существует необходимость в создании специфических антител, которые могут направленно воздействовать на образование амилоидных бляшек и разрушать их.
Симптомы болезни Альцгеймера проявляются медленно, и первым симптомом может быть лишь слабая забывчивость. На этой стадии индивидуумы могут забывать последние события, действия, имена знакомых людей или названия вещей и могут быть не в состоянии решить простые математические задачи. По мере прогрессирования болезни симптомы становятся более заметными и настолько серьезными, что вынуждают людей, пораженных болезнью Альцгеймера, или членов их семьи прибегать к медицинской помощи. Симптомы, характерные для средней стадии болезни Альцгеймера, включают забывание того, как выполнять простые функции, такие как приводить себя в порядок, при этом возникают проблемы с речью, пониманием, чтением или письмом. Пациенты на поздней стадии болезни Альцгеймера могут становиться боязливыми или агрессивными, могут уходить далеко от дома и, в конце концов, нуждаться в полном уходе.
В настоящее время единственным надежным путем диагностики болезни Альцгеймера является идентификация бляшек и сплетений в ткани головного мозга при вскрытии после смерти индивидуума. Таким образом, пока индивидуум еще жив, доктора могут ставить только диагноз «возможна» или «вероятна» болезнь Альцгеймера. С помощью современных методов лечащие врачи могут правильно диагностировать вплоть до 90 процентов случаев болезни Альцгеймера с помощью ряда средств, позволяющих диагностировать «возможную» болезнь Альцгеймера. Лечащие врачи задают вопросы об общем состоянии здоровья индивидуума, медицинских проблемах, имевших место в прошлом, и истории каких-либо затруднений у индивидуума при выполнении повседневных действий. Поведенческие тесты на память, решение задач, внимание, счет и речь позволяют получать информацию о когнитивной дегенерации, а медицинские анализы, такие как анализы крови, мочи или спинномозговой жидкости, и сканирование головного мозга могут дать некоторую дополнительную информацию.
Борьба с болезнью Альцгеймера заключается в осуществлении лечения, основанного на применении лекарственных средств, и лечения без использования лекарственных средств (немедикаментозного лечения). Лечение с целью изменения основного течения болезни (замедления или реверсирования развития) до сих пор были по большей части безуспешными. Было продемонстрировано, что лекарственные средства, которые восстанавливают дефицит (дефект) или недостаточную функцию химических медиаторов нервных клеток (нейромедиаторов), такие как ингибиторы холинэстеразы (ChEI), позволяют улучшать симптомы. Лекарственные средства могут также воздействовать на психиатрические проявления болезни Альцгеймера.
В настоящее время ингибиторы холинэстеразы, такие как такрин и ривастигмин, являются единственным классом агентов, которые разрешены FDA для лечения болезни Альцгеймера. Эти агенты представляют собой лекарственные средства, которые восстанавливают дефект или недостаточную функцию химических нейромедиаторов в головном мозге. ChEI задерживают ферментативное расщепление нейромедиаторов, повышая тем самым количество химических медиаторов, пригодных для передачи нервных сигналов в головном мозге.
Для некоторых людей на ранней и средней стадиях заболевания такие лекарственные средства, как такрин (COGNEX®, Моррис-Плейнс, шт.Нью-Джерси), донепезил (ARICEPT®, Токио, Япония), ривастигмин (EXELON®, Ист-Хановер, шт.Нью-Джерси) или галантамин (REMINYL®, Нью-Брансуик, шт.Нью-Джерси), могут предупреждать ухудшение некоторых симптомов в течение ограниченного периода времени. Другое лекарственное средство, мемантин (NAMENDA®, Нью-Йорк, шт.Нью-Йорк), разрешено для лечения болезни Альцгеймера от средней до тяжелой. Некоторые лекарственные средства могут помогать также контролировать поведенческие симптомы болезни Альцгеймера, такие как бессонница, возбуждение, блуждание, тревога и депрессия. Лечение этих симптомов часто делает жизнь пациентов более комфортной и облегчает обслуживающему персоналу уход за ними. К сожалению, несмотря на значительные успехи лечения, демонстрирующие, что этот класс агентов существенно превосходит по эффективности плацебо, болезнь продолжает прогрессировать, а влияние на умственные функции в среднем является очень ограниченным. ChEI обладают также побочными действиями, которые включают желудочно-кишечные нарушения, токсичность для печени и потерю веса.
Успехи в понимании патологий, связанных с головным мозгом, которые имеют место при болезни Альцгеймера, могут явиться основой для выявления новых мишеней для лечения, которые в большей степени сфокусированы на изменении протекания и развития болезни. В настоящее время проводятся интенсивные исследования многих соединений, включая противовоспалительные агенты. Проводятся также клинические опыты с использованием специфических ингибиторов циклооксигеназы (СОХ-2), таких как рофекоксиб и целекоксиб.
К другим заболеваниям, которые обусловлены или ассоциированы с накоплением и отложением амилоидоподобного белка, относятся умеренное когнитивное нарушение, деменция, связанная с тельцами Леви (LBD), амиотрофический боковой склероз (ALS), миозит, вызываемый тельцами включения (IBM), и дегенерация желтого пятна, прежде всего связанная с возрастом дегенерация желтого пятна (AMD).
Умеренное когнитивное нарушение (MCI) является общим понятием, которое включает наиболее часто встречающиеся небольшие, но заметные нарушения памяти. Индивидуум, страдающий MCI, испытывает больше затруднений, связанных с памятью, чем это можно ожидать в связи с возрастом, однако не имеет других симптомов деменции, таких как нарушение рассудительности и логического хода мысли. MCI представляет собой состояние, которое часто является свидетельством преклинической стадии AD.
По-видимому, отложение β-амилоида в энторинальной области коры головного мозга (ЕС) играет основную роль в развитии умеренного когнитивного нарушения (MCI) в престарелом возрасте. Это согласуется с данными о том, что уровни Aβ(1-42) в CSF (спинномозговая жидкость)-А существенно снижаются, когда клинические признаки AD становятся явными. В отличие от CSF-A, уровни Aβ(1-42) в CSF-tau существенно повышаются на стадии MCI, и эти уровни продолжают оставаться повышенными в дальнейшем, это свидетельствует о том, что повышенные уровни в CSF-tau можно использовать для обнаружения индивидуумов с MCI, которые предрасположены к развитию AD.
Деменция, связанная с тельцами Леви (LBD), представляет собой нейродегенеративное нарушение, которое может возникать у индивидуумов старше 65 лет, как правило, вызывающее симптомы когнитивного (мыслительного) нарушения и патологические изменения поведения. Симптомы могут включать когнитивное нарушение, неврологические признаки, нарушение сна и неспособность к самостоятельным действиям. Когнитивное нарушение в большинстве случаев является характерной особенностью LBD. У пациентов происходят повторяющиеся случаи замешательства, которые прогрессивно усугубляются. Флуктуации когнитивной способности часто ассоциированы со сдвигом уровня внимания и бдительности. Когнитивное нарушение и флуктуации мыслительной способности могут варьироваться в течение минут, часов или дней.
Тельца Леви образуются из фосфорилированных и нефосфорилированных нейрофиламентных белков; они содержат синаптический белок альфа-синуклеин, а также убикитин, который участвует в элиминации поврежденных или аномальных белков. Помимо телец Леви могут присутствовать также нейриты Леви, представляющие собой тельца включения, участвующие в клеточных процессах в нервных клетках. Амилоидные бляшки могут образовываться в головном мозге пациентов, пораженных LBD, однако, как правило, в меньшем количестве, чем у пациентов, страдающих болезнью Альцгеймера. Наличие нейрофибриллярных сплетений, представляющих собой еще один микропатологический признак AD, не является главной отличительной особенностью LBD, но они часто присутствуют в дополнение к амилоидным бляшкам.
Амиотрофический боковой склероз (ALS) характеризуется дегенерацией верхних и нижних двигательных нейронов. У некоторых пациентов с ALS может иметь место деменция или афазия (ALS-D). Деменция наиболее часто представляет собой лобно-височную деменцию (FTD), и во многих таких случаях имеются убикитин-положительные, тау-(tau)-отрицательные включения в нейронах зубчатой извилины медиальной и нижней поверхности полушария головного мозга и поверхностных слоях лобной и височной долей головного мозга.
Миозит, связанный с тельцами включения (IBM), представляет собой калечащее заболевание, как правило, обнаруживаемое у людей старше 50 лет, при котором возникает воспаление мышечных волокон, и они начинают атрофироваться, но при этом головной мозг не нарушается, и пациенты полностью сохраняют свой интеллект. Обнаружено, что уровень двух ферментов, участвующих в производстве белка амилоида-β, повышен в мышечных клетках пациентов, страдающих этим часто встречающимся у пожилых людей прогрессирующим мышечным заболеванием, при этом повышается также уровень амилоида-β.
Еще одним заболеванием, обусловленным или ассоциированным с накоплением и отложением амилоидоподобного белка, является дегенерация желтого пятна.
Дегенерация желтого пятна представляет собой обычное заболевание глаза, которое вызывает деградацию желтого пятна, т.е. центральной области сетчатки (тонкий слой ткани на задней части глаза, откуда светочувствительные клетки посылают зрительные сигналы в головной мозг). Желтое пятно опосредует острое, четкое, «неискаженное» зрение. Повреждение желтого пятна приводит к развитию слепых пятен и затуманенному или нарушенному зрению. Связанная с возрастом дегенерация желтого пятна (AMD) является основной причиной ухудшения зрения в Соединенных Штатах, и у людей старше 65 лет она представляет собой основную причину медицински подтвержденной слепоты среди лиц кавказской расы. Примерно 1,8 миллионов американцев в возрасте 40 лет и старше имеют развитую AMD, а еще у 7,3 миллионов людей с умеренной AMD имеется значительный риск потери зрения. По оценкам правительства к 2020 г. 2,9 миллиона людей будут иметь развитую AMD. Жертвы AMD часто бывают удивлены и расстроены, когда узнают, как мало известно о причинах и методах лечения этого состояния слепоты.
Существует две формы дегенерации желтого пятна: сухая дегенерация желтого пятна и влажная дегенерация желтого пятна. Сухая форма, при которой клетки желтого пятна медленно начинают разрушаться, диагностирована в 85 процентов случаев дегенерации желтого пятна. Как правило, сухая AMD поражает оба глаза, хотя при этом один глаз может потерять зрение, а второй глаз оставаться непораженным. Обычно ранними признаками сухой AMD являются друзы, которые представляют собой отложения желтого тела под сетчаткой. Риск возникновения развитой сухой AMD или влажной AMD повышается с увеличением количества или размера друз. Сухая AMD может прогрессировать и вызывать потерю зрения, не превращаясь во влажную форму заболевания; однако на ранней стадии сухая AMD может внезапно переходить во влажную форму.
Хотя на долю влажной формы приходится только 15 процентов случаев, она в 90 процентах приводит к слепоте, и ее рассматривают как развитую AMD (не существует ранней или промежуточной стадии влажной AMD). Влажной AMD всегда предшествует сухая форма заболевания. При прогрессировании сухой формы у некоторых людей начинается патологический рост кровеносных сосудов позади желтого пятна. Эти сосуды являются очень хрупкими, и из них просачивается жидкость и кровь (отсюда название «влажная» дегенерация желтого пятна), приводя к быстрому повреждению желтого пятна.
Сухая форма AMD первоначально часто вызывает слегка затуманенное зрение. Затем прежде всего центральная часть зрительного поля может становиться затуманенной, и эта область увеличивается в размерах по мере прогрессирования заболевания. Если поражен только один глаз, то симптомы могут оставаться незамеченными. В случае влажной AMD прямые линии могут представляться волнистыми и при этом может быстро наступать потеря центрального зрения.
Для установления диагноза дегенерации желтого пятна, как правило, проводят исследование расширенного глаза (зрачка), тест на остроту зрения и обследование задней стенки глаза с использованием процедуры, называемой фундоскопией, помогающей установлению диагноза AMD, и, если имеется предположение о наличии влажной AMD, то может быть проведена ангиография с использованием флуоресцеина. В настоящее время отсутствуют средства лечения, позволяющие предупреждать потерю зрения, если сухая AMD достигла развитой стадии. Однако применение определенной композиции, содержащей высокую дозу антиоксидантов и цинка, может замедлять или предупреждать прогрессирование промежуточной стадии AMD, приводящее к переходу в развитую стадию. Macugen® (инъекция пегаптаниба натрия), лазерное фотокоагулирование и фотодинамическая терапия позволяют контролировать патологический рост кровеносных сосудов и кровоизлияние в желтом пятне, что является полезным для определенной группы людей с влажной AMD; однако зрение, если оно уже почти потеряно, не может быть восстановлено с помощью таких методов. Если зрение почти потеряно, то существуют средства для слабого зрения, которые могут помочь улучшить качество жизни.
Одним из самых ранних признаков связанной с возрастом дегенерации желтого пятна (AMD) является накопление внеклеточных отложений, известных как друзы, в области, находящейся между базальным слоем пигментированного эпителия сетчатки (RPE) и базальной оболочкой Бруха (ВМ). Результаты современных исследований, проведенных Anderson с соавторами, подтвердили, что друзы содержат амилоид-бета (Experimental Eye Research 78, 2004, cc.243-256).
В настоящее время проводятся исследования, в которых изучают факторы окружающей среды, генетические и связанные с питанием факторы, которые могут влиять на AMD. Исследуют также новые стратегии лечения, включая применение трансплантатов клеток сетчатки, лекарственных средств, которые должны предупреждать или замедлять прогрессирование заболевания, лучевой терапии, генной терапии, компьютерного чипа, имплантированного в сетчатку, который может стимулировать зрение, и агентов, которые должны предупреждать рост новых кровеносных сосудов под желтым пятном.
Таким образом, необходима разработка композиций терапевтических вакцин и методов, направленных на борьбу с осложнениями, ассоциированными с амилоидозом, группой заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона, а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна. В частности, существует необходимость в разработке специализированных и высокоэффективных терапевтических вакцин и композиций, содержащих такие вакцины, которые позволяют противодействовать физиологическим проявлениям заболевания, таким как образование бляшек, ассоциированное с агрегацией волокон амилоида или амилоидоподобного пептида.
В настоящем изобретении предложены новые способы и композиции, предназначенные для получения высокоспецифичного и высокоэффективного иммунного ответа в организме, прежде всего в организме животного, прежде всего млекопитающего или человека, способного предупреждать или ослаблять амилоидоз или симптомы, ассоциированные с амилоидозом, группой заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона, а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна.
Настоящее изобретение относится, прежде всего к новым способам и композициям, предназначенным для сохранения или улучшения, и прежде всего восстановления, более предпочтительно полного восстановления когнитивной способности к запоминанию у млекопитающего, имеющего ассоциированное с амилоидом заболевание или состояние.
Целью настоящего изобретения являются разработка композиции терапевтической вакцины и способа получения такой композиции, предназначенной для лечения заболеваний и нарушений, ассоциированных с амилоидом или амилоидоподобными белками, включая амилоидоз, группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), прежде всего заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), которая содержит пептидный фрагмент из N-концевой области Aβ-пептида, прежде всего фрагмент Aβ-пептида, состоящего из встречающегося один раз или повторяющегося несколько раз участка, включающего от 13 до 15 смежных аминокислотных остатков из N-концевой области Aβ-пептида, и прежде всего фрагмент Aβ-пептида, состоящий из аминокислотных остатков, выбранных из группы, включающей остатки 1-15, 1-14 и 1-13 из N-концевой части Aβ-пептида, более предпочтительно остатки 1-15, представленные в SEQ ID NO:1, включая функционально эквивалентные фрагменты, и прежде всего указанный выше в настоящем описании фрагмент Aβ-пептида, который присоединен, встроен или реконструирован в частице-носителе/адъюванте, такой, например, как липосома.
Указанный участок, состоящий из 13-15 смежных аминокислотных остатков, можно получать из N-концевого фрагмента, включающего 1-16-, 1-17-, 1-18- или 1-20-фрагменты Aβ-пептида, и прежде всего из N-концевого 1-16- или 1-17-фрагмента Aβ-пептида, представленные в SEQ ID NO:2 и SEQ ID NO:5 соответственно, которые можно прерывать путем делеции от одного до трех аминокислотных остатков, в результате чего получают участок, содержащий от 13 до 15 аминокислотных остатков, где удаленные в результате делеции аминокислотные остатки могут представлять собой смежные аминокислотные остатки или остатки, отделенные друг от друга по меньшей мере одним аминокислотным остатком, но предпочтительно представляют собой аминокислотные остатки, которые не являются отрицательно заряженными остатками, если требуется, чтобы общий чистый заряд молекулы антигенного пептида был отрицательным, или аминокислотные остатки, которые не являются положительно заряженными остатками, если требуется, чтобы общий чистый заряд молекулы антигенного пептида был положительным. Такой участок, состоящий из 13-15 смежных аминокислотных остатков, может повторяться в антигенной конструкции, предлагаемой в изобретении, от 2 до 50 раз, предпочтительно от 2 до 30 раз, более предпочтительно от 2 до 20 раз, еще более предпочтительно от 2 до 16 раз, и наиболее предпочтительно от 2 до 10 раз.
В конкретном варианте осуществления изобретения применяют участок, состоящий из 13-15 смежных аминокислотных остатков, в форме полимера, выбранного из группы, включающей 2-мер, 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер, 10-мер, 11-мер, 12-мер, 13-мер, 14-мер, 15-мер, 16-мер, 20-мер, 30-мер и 50-мер.
Следующий вариант осуществления изобретения относится к композиции терапевтической вакцины и способу получения такой композиции, предназначенной для лечения заболеваний и нарушений, вызываемых или ассоциированных с амилоидами или амилоидоподобными белками, включая амилоидоз, группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), прежде всего заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), как это более конкретно описано ниже, с использованием фрагмента Aβ-пептида из N-концевой области Aβ-пептида, но предпочтительно фрагмента Aβ-пептида, состоящего из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 1-15(Δ13), 1-15(Δ14), более конкретно фрагмента Aβ-пептида, состоящего из аминокислотных остатков 1-15, представленных в SEQ ID NO:1, и 1-16(Δ14), представленных в SEQ ID NO:3.
Под объем настоящего изобретения подпадает также пептидный фрагмент, который практически идентичен указанным выше фрагментам и обладает практически такой же биологической активностью, что и указанные фрагменты, но предпочтительно пептидный фрагмент, который представляет собой консервативно модифицированный вариант указанных фрагментов, в котором изменения заключаются в замене одной или нескольких аминокислот, предпочтительно от одной до 10 аминокислот, более предпочтительно от одной до 6 аминокислот, более предпочтительно от одной до 4 аминокислот, еще более предпочтительно от одной до 3 аминокислот, на химически сходные аминокислоты. Таблицы консервативных замен, в которых представлены функционально сходные аминокислоты, хорошо известны в данной области и приведены ниже в настоящем описании. Консервативные замены предпочтительно следует осуществлять таким образом, чтобы общий чистый заряд пептида, а также распределение заряда по молекуле пептида, оставались практически прежними.
В конкретном варианте осуществления изобретения по меньшей мере один, предпочтительно 2, более предпочтительно 3 или даже все отрицательно заряженные аминокислотные остатки 1, 3, 7, 11 можно заменять на химически сходные отрицательно заряженные аминокислоты. В частности, Asp в положении 1 и 7 соответственно можно заменять на Glu, a Glu в положении 9 и 11 соответственно можно заменять на Asp.
Конкретный вариант осуществления изобретения относится к композиции терапевтической вакцины и способу получения такой композиции, которая содержит фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего фрагмент Aβ-пептида, содержащий аминокислотные остатки, выбранные из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), антиген, представляющий собой Aβ1-16(Δ15)-пептид (антигенный Aβ1-16(Δ15)-пептид), более предпочтительно антиген, представляющий собой Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой Aβ1-14-пептид, конкретно антиген, представляющий собой Aβ1-15-пептид, но прежде всего фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, которая предназначена для лечения заболеваний и нарушений, вызываемых или ассоциированных с амилоидом или амилоидоподобными белками, включая амилоидоз, т.е. группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), прежде всего заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI).
Конкретным вариантом осуществления изобретения является композиция терапевтической вакцины и способ получения композиции терапевтической вакцины, предназначенной для сохранения или улучшения, и прежде всего полного восстановления когнитивной способности к запоминанию у млекопитающего или человека, страдающего ухудшением памяти, с использованием фрагмента Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего фрагмента Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антигена, представляющего собой Aβ1-16(Δ15)-пептид, более предпочтительно антигена, представляющего собой Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антигена, представляющего собой Aβ1-14-пептид, конкретно антигена, представляющего собой Aβ1-15-пептид, и прежде всего фрагмента Aβ-пептида, содержащего аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3.
Объектом изобретения является также способ лечения заболеваний и нарушений, которые вызываются или ассоциированы с амилоидными или амилоидоподобными белками, включая амилоидоз, группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, в том числе вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), заключающийся в том, что животному, в частности млекопитающему или человеку, вводят предлагаемую в изобретении композицию вакцины, которая представлена в настоящем описании.
Конкретным вариантом осуществления изобретения является способ сохранения или улучшения когнитивной способности к запоминанию, но прежде всего полного восстановления когнитивной способности к запоминанию у животного, в частности млекопитающего или человека, который страдает нарушением памяти, заключающийся в том, что вводят животному, прежде всего млекопитающему или человеку, предлагаемую в изобретении композицию вакцины, которая представлена в настоящем описании.
Следующим объектом изобретения являются композиция терапевтической вакцины и способ получения указанной композиции, а также способ лечения заболеваний и нарушений, которые вызываются или ассоциированы с амилоидными или амилоидоподобными белками, включая амилоидоз, группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, в том числе вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), в частности заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), с использованием предлагаемого в изобретении антигена, представляющего собой Aβ-пептид, как он описан выше, но прежде всего фрагмента Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего фрагмента Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антигена, представляющего собой Aβ1-16(Δ15)-пептид, более предпочтительно антигена, представляющего собой Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антигена, представляющего собой Aβ1-14-пептид, конкретно антигена, представляющего собой Aβ1-15-пептид, и прежде всего фрагмента Aβ-пептида, содержащего аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, где антиген, представляющий собой Aβ-пептид, модифицируют таким образом, чтобы он обладал способностью поддерживать и стабилизировать определенную конформацию, отличающуюся сбалансированным соотношением участков α-спиралей, и/или β-складок, и/или произвольных спиралей, и индуцирующую высокоспецифический иммунный ответ у обработанного животного.
Предлагаемая в изобретении и описанная выше композиция вакцины при введении животному, прежде всего млекопитающему, но наиболее предпочтительно человеку, приводит главным образом к выработке антител невоспалительных Тп2-подтипов, таких, например, как изотип IgG1 и IgG2b, и/или антител независимого от Т-клеток подкласса IgG, такого, например, как IgG3, и/или не приводят к существенному повышению уровня маркеров воспаления в головном мозге, прежде всего маркеров воспаления, выбранных из группы, включающей IL-1β, IL-6, IFN-γ и TNF-α.
Согласно еще одному варианту осуществления изобретения предлагаемая в настоящем изобретении и описанная выше вакцина при введении животному, прежде всего млекопитающему, но наиболее предпочтительно человеку, приводит к существенному повышению уровня нерастворимых связанных с бляшками Aβ1-40 и Aβ1-42 в головном мозге.
Согласно еще одному варианту осуществления изобретения предлагаемая в настоящем изобретении и описанная выше вакцина при введении животному, прежде всего млекопитающему, но наиболее предпочтительно человеку, приводит к существенному снижению уровня растворимого Aβ1-42 в головном мозге.
Кроме того, предлагаемая в изобретении и описанная выше вакцина при введении животному, прежде всего млекопитающему или человеку, страдающему ассоциированным с амилоидом состоянием, которое характеризуется утратой когнитивной способности к запоминанию, приводит к повышению сохранения когнитивной способности к запоминанию.
Изобретение относится также к предлагаемой в настоящем изобретении и описанной выше вакцине, которая при введении животному, прежде всего млекопитающему или человеку, страдающему ассоциированным с амилоидом состоянием, которое характеризуется утратой когнитивной способности к запоминанию, приводит к полному восстановлению когнитивной способности к запоминанию.
В частности, предлагаемый в изобретении и описанный выше антиген, представляющий собой Aβ-пептид, в частности фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антиген, представляющий собой Aβ1-16(Δ15)-пептид, более предпочтительно антиген, представляющий собой Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой Aβ1-14-пептид, конкретно антиген, представляющий собой Aβ1-15-пептид, и прежде всего фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, презентуют в виде антигена, присоединенного, встроенного или реконструированного в носителе, таком, например, как пузырек, состоящее из частиц тельце или молекула, но прежде всего липосома.
Иммуногенные композиции, предлагаемые в настоящем изобретении, могут содержать липосомы, созданные путем реконструкции (восстановления) липосом в присутствии очищенных или частично очищенных или модифицированных антигенных пептидов, предлагаемых в изобретении. Кроме того, в липосомах можно реконструировать (восстанавливать) пептидные фрагменты. Настоящее изобретение относится также к фрагментам антигенных пептидов, модифицированных с целью повышения их антигенности. Например, антигенные остатки и адъюванты можно присоединять или смешивать с пептидом. Примерами антигенных остатков и адъювантов являются (но не ограничиваясь ими) такие адъюванты, как липофильные мурамильные дипептидные производные, неионные блоксополимеры, гидроксид алюминия или фосфат алюминия и их смеси.
В другом варианте осуществления изобретения предлагаемый в изобретении и описанный выше антиген, представляющий собой Aβ-пептид, в частности фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антиген, представляющий собой Aβ1-16(Δ15)-пептид, более предпочтительно антиген, представляющий собой Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой Aβ1-14-пептид, конкретно антиген, представляющий собой Aβ1-15-пептид, и прежде всего фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, модифицируют с помощью липофильного или гидрофобного фрагмента, который облегчает встраивание в липидный бислой липосомы-носителя/иммунного адъюванта, прежде всего с помощью липофильного или гидрофобного фрагмента, который функционирует в качестве «якоря», служащего для закрепления пептида в бислое липосомы, и имеет размер, который обеспечивает положение пептида в непосредственной близости от поверхности липосомы и стабилизирует его в таком положении.
В следующем варианте осуществления изобретения липофильный или гидрофобный фрагмент представляет собой жирную кислоту, триглицерид или фосфолипид, но особенно предпочтительно жирную кислоту, триглицерид или фосфолипид, где углеродный каркас жирной кислоты содержит по меньшей мере 10 атомов углерода. В частности, липофильный или гидрофобный фрагмент представляет собой жирную кислоту, углеродный каркас которой содержит по меньшей мере примерно 14 атомов углерода и вплоть до примерно 24 атомов углерода, при этом под объем настоящего изобретения подпадает вариант с каждым индивидуальным количеством атомов углерода в указанном диапазоне. Более конкретно липофильный или гидрофобный фрагмент имеет углеродный каркас, состоящий по меньшей мере из 14 атомов углерода, но более предпочтительно из 16 атомов углерода. Примерами гидрофобных фрагментов являются (но не ограничиваясь ими) пальмитиновая кислота, стеариновая кислота, миристиновая кислота, лауриновая кислота, олеиновая кислота, линолевая кислота и линоленовая кислота. В конкретном варианте осуществления настоящего изобретения липофильный или гидрофобный фрагмент представляет собой пальмитиновую кислоту.
В еще одном варианте осуществления изобретения липофильный или гидрофобный фрагмент представляет собой пальмитиновую кислоту, и препарат липосомы может содержать также адъювант, такой, например, как липид А, квасцы, фосфат кальция, интерлейкин 1, и/или микрокапсулы из полисахаридов и белков, но предпочтительно детоксифицированный липид А, такой как монофосфорильный или дифосфорильный липид А, или квасцы.
Еще одним объектом изобретения является композиция терапевтической вакцины и способ получения такой композиции с использованием иммуногенного антигенного пептида, предлагаемого в изобретении и описанного выше, для лечения заболеваний и нарушений, которые вызываются или ассоциированы с амилоидными или амилоидоподобными белками, включая амилоидоз, группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, в том числе вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), прежде всего для сохранения, улучшения или восстановления когнитивной способности к запоминанию у животного, в частности у млекопитающего или человека, страдающего нарушением памяти, а также способ лечения амилоидоза, когда антигенный β-амилоидный пептид представляет собой пальмитоилированный антигенный Aβ-пептид, предлагаемый в изобретении и описанный выше, до реконструкции в липосому, прежде всего пальмитоилированный фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего пальмитоилированный фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антиген, представляющий собой пальмитоилированный Aβ1-16(Δ15)-пептид, более предпочтительно антиген, представляющий собой пальмитоилированный Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой пальмитоилированный Aβ1-14-пептид, конкретно антиген, представляющий собой пальмитоилированный Aβ1-15-пептид, но прежде всего пальмитоилированный фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, модифицированный путем присоединения с помощью ковалентной связи пальмитоильных остатков, в частности от 2 до 4 пальмитоильных остатков, более конкретно 4 пальмитоильных остатка, сшитых с каждым концом антигенного пептида посредством одного или нескольких, но прежде всего посредством одного или двух приемлемых аминокислотных остатков, таких как остатки лизина, глутаминовой кислоты или цистеина, или любого другого аминокислотного остатка, который можно применять для сочетания пальмитоильного остатка с антигенным пептидом.
В конкретном варианте осуществления изобретения 2 или большее количество молекул антигенного пальмитоилированного Aβ-пептида, модифицированных путем ковалентного присоединения пальмитоильных остатков на каждом конце пептида, реконструируют в одной липосоме.
Настоящее изобретение относится к новым способам и иммуногенным композициям, содержащим иммуногенный антигенный пептид, который при введении животному, в частности млекопитающему или человеку, страдающему ассоциированным с амилоидом состоянием, прежде всего состоянием, которое характеризуется утратой когнитивной способности к запоминанию, таким, например, как умеренное ухудшение когнитивной способности (MCI), индуцирует иммунный ответ у животного или человека. Лечение терапевтической вакциной, предлагаемой в изобретении, приводит к сохранению или улучшению когнитивной способности к запоминанию, но прежде всего к полному восстановлению когнитивной способности к запоминанию.
Следующим объектом изобретения являются композиция терапевтической вакцины и способ получения такой композиции с использованием иммуногенного антигенного пептида, предназначенной для индукции иммунного ответа у животного, в частности у млекопитающего или человека, а также способ вызывания иммунного ответа у животного, в частности у млекопитающего или человека, где животное или человек страдает ассоциированным с амилоидом состоянием, которое характеризуется утратой когнитивной способности к запоминанию, таким, например, как умеренное ухудшение когнитивной способности (MCI), заключающийся в том, что животному или человеку вводят композицию терапевтической вакцины, которая содержит антигенный Aβ-пептид, предлагаемый в изобретении и описанный выше, но прежде всего пальмитоилированный фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего пальмитоилированный фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антиген, представляющий собой пальмитоилированный Aβ1-16(Δ15)-пептид, более предпочтительно антиген, представляющий собой пальмитоилированный Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой пальмитоилированный Aβ1-14-пептид, конкретно антиген, представляющий собой пальмитоилированный Aβ1-15-пептид, но прежде всего пальмитоилированный фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, в результате чего когнитивная способность к запоминанию обработанного животного или человека сохраняется или повышается, но прежде всего полностью восстанавливается.
Антигенный пептид, описанный выше, но конкретно фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антиген, представляющий собой Aβ1-16(Δ15)-пептид, более предпочтительно антиген, представляющий собой Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой Aβ1-14-пептид, конкретно антиген, представляющий собой Aβ1-15-пептид, и прежде всего фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, также представляет собой часть настоящего изобретения.
Также частью изобретения является пальмитоилированный антигенный Аβ-пептид, предлагаемый в изобретении и описанный выше, прежде всего пальмитоилированный фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего пальмитоилированный фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антиген, представляющий собой пальмитоилированный Aβ1-16(Δ15)-пептид, более предпочтительно антиген, представляющий собой пальмитоилированный Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой пальмитоилированный Aβ1-14-пептид, конкретно антиген, представляющий собой пальмитоилированный Aβ1-15-пептид, но прежде всего пальмитоилированный фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, модифицированный путем присоединения с помощью ковалентной связи пальмитоильных остатков, в частности от 2 до 4 пальмитоильных остатков, более конкретно 4 пальмитоильных остатков, сшитых с каждым концом антигенного пептида посредством одного или нескольких, но прежде всего посредством одного или двух приемлемых аминокислотных остатков, таких как остатки лизина, глутаминовой кислоты или цистеина, или любого другого аминокислотного остатка, который можно применять для сочетания пальмитоильного остатка с антигенным пептидом.
В конкретном варианте осуществления изобретения 2 или большее количество антигенных молекул пальмитоилированного Aβ-пептида, модифицированных путем ковалентного присоединения пальмитоильных остатков на каждой конце пептида, реконструируют в одной липосоме.
Под объем изобретения подпадает также антигенный пептид, который презентуют в виде антигенного пептида, прикрепленного или встроенного или реконструированного в носителе, таком, например, как пузырек, состоящее из частиц тельце или молекула, но прежде всего липосома, как описано выше, но прежде всего фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антиген, представляющий собой Aβ1-16(Δ15)-пептид, более предпочтительно антиген, представляющий собой Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой Aβ1-14-пептид, конкретно антиген, представляющий собой Aβ1-15-пептид, и прежде всего фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, который презентуют в виде антигена, прикрепленного или встроенного или реконструированного в носителе, таком, например, как пузырек, состоящее из частиц тельце или молекула, но прежде всего липосома, как описано выше.
Не рассматривая какую-либо конкретную гипотезу, можно предположить, что иммунный ответ, индуцируемый композиций терапевтической вакцины, предлагаемой в изобретении, может вызывать у животного или человека стимуляцию Т-клеток и других реактивных иммунных клеток, направленных против иммуногенного агента, но прежде всего создание высокоспецифических и высокоэффективных антител, которые обладают способностью специфически распознавать и связываться со специфическими эпитопами из набора β-амилоидных антигенов, это антитело при связывании с антигеном опосредует и/или индуцирует заметное сохранение, улучшение, но прежде всего полное восстановление когнитивной способности к запоминанию у обработанного животного или человека.
Настоящее изобретение относится также к композиции вакцины, которая при введении животному, прежде всего млекопитающему или человеку, индуцирует производство антитела в организме обработанного животного или человека, которое непосредственно и специфически связывается с β-амилоидными волокнами, такими, например, как волокна, состоящие из мономерных Aβ-пептидов 1-39; 1-40, 1-41, 1-42 или 1-43, но прежде всего с волокнами, состоящими из мономерных Aβ1-42-пептидов, и/или обладает способностью индуцировать стабилизацию ранее образовавшихся высокомолекулярных полимерных амилодных фибрилл или филаментов, сформировавшихся в результате агрегации амилоидных мономерных пептидов, прежде всего β-амилоидных мономерных пептидов, таких, например, как мономерные Aβ-пептиды 1-39; 1-40, 1-41, 1-42 или 1-43, но прежде всего мономерные Aβ1-42-пептиды, путем направленного и специфического связывания с эпитопом в эпитопной области β-амилоидного белка, прежде всего в эпитопной области Aβ-полипептида, ограниченной аминокислотными остатками акn-акm, где n обозначает целое число от 2 до 15, прежде всего от 5 до 15, более предпочтительно от 8 до 15, еще более предпочтительно от 10 до 15, a m обозначает целое число от 3 до 17, прежде всего от 6 до 17, более предпочтительно от 9 до 17, еще более предпочтительно от 11 до 17, где n и m не могут иметь идентичные значения и n всегда должно иметь значение более низкое, чем значение m, при этом различие между n и m должно быть ≥2.
В конкретном варианте осуществления изобретения антитело связывается с эпитопом в эпитопной области β-амилоидного белка, содержащего аминокислотные остатки 1-10, но прежде всего аминокислотные остатки 1-9.
Указанное антитело, кроме того, специфически связывается с растворимыми мономерными или олигомерными амилоидными пептидами, прежде всего мономерными или олигомерными β-амилоидными пептидами, выбранными из группы, включающей Aβ-пептиды 1-39; 1-40, 1-41, 1-42 или 1-43, но прежде всего Aβ1-42, и ингибирует агрегацию мономеров или олигомеров Aβ, приводящую к образованию высокомолекулярных полимерных фибрилл.
Следующим вариантом осуществления изобретения является антитело, прежде всего моноклональное антитело, включая любой функциональный эквивалент антитела или его функциональные фрагменты, где антитело обладает по меньшей мере одним из свойств, выбранных из группы, включающей ингибирование агрегации, нарушение агрегации (разрушение агрегатов), индукцию конфирмационного перехода, распознавание и непосредственное связывание с эпитопом в 4-16-области, в частности в 1-9 области, но прежде всего комбинацию двух или большего количества указанных свойств. Более конкретно, предложено антитело, прежде всего моноклональное антитело, включая любой функциональный эквивалент антитела или его функциональные фрагменты, где антитело обладает комбинированной реактивностью против 1-16- и 29-40-области, более конкретно против 1-16 и 22-35-области, в которой оно может распознавать и связываться с обеими указанными областями, 1-16-29-40-областью и 1-16- и 22-35-областью соответственно, и обладает по меньшей мере одним из указанных выше свойств, таких как ингибирование агрегации, нарушение агрегации, индукция конформационного перехода, прежде всего комбинацией двух или большего количества указанных свойств.
Антитела, которые индуцируются композиций вакцины, предлагаемой в изобретении, и которые можно получать иммунизацией животного или с помощью линии клеток гибридомы, также являются частью настоящего изобретения.
Конкретным вариантом осуществления изобретения является антитело, включая любое функционально эквивалентное антитело или его функциональные фрагменты, прежде всего моноклональное антитело, включая любое функционально эквивалентное антитело или его функциональные фрагменты, которые можно получать путем иммунизации приемлемого животного композиций вакцины, предлагаемой в изобретении и описанной выше, прежде всего композицией вакцины, которая содержит антиген, представляющий собой пептид Aβ1-16(Δ15), более предпочтительно антиген, представляющий собой пептид Aβ1-16(Δ14) или Aβ1-16(Δ13), еще более предпочтительно антиген, представляющий собой пептид Aβ1-14, но наиболее предпочтительно антиген, представляющий собой пептид Aβ1-15, где антитело представляет собой бифункциональное антитело, и при инкубации с амилоидными мономерными пептидами, прежде всего с β-амилоидными мономерными пептидами, такими, например, как мономерные Aβ-пептиды 1-38, 1-39; 1-40, 1-41, 1-42 или 1-43, но предпочтительно мономерные Aβ1-42-пептиды, ингибирует агрегацию Aβ-мономеров с образованием высокомолекулярных полимерных фибрилл и, кроме того, при инкубации с ранее образовавшимися высокомолекулярными полимерными амилоидными фибриллами или филаментами, сформированными в результате агрегации амилоидных мономерных пептидов, прежде всего β-амилоидных мономерных пептидов, таких, например, как мономерные Aβ-пептиды 1-38, 1-39; 1-40, 1-41, 1-42 или 1-43, но прежде всего мономерные Aβ1-42-пептиды, обладает способностью нарушать агрегацию ранее образовавшихся полимерных фибрилл или филаментов.
Конкретным вариантам осуществления изобретения является антитело, прежде всего бифункциональное антитело, но прежде всего моноклональное антитело, в частности бифункциональное моноклональное антитело, включая любое функционально эквивалентное антитело или его функциональные фрагменты, которое обладает высокой специфичностью в отношении мономерных Aβ1-42-пептидов, но практически не обладает или обладает лишь незначительной перекрестной реактивностью на мономерные пептиды Aβ1-38, Aβ1-39, Aβ1-40 и/или Aβ1-41, прежде всего антитело, но особенно предпочтительно моноклональное антитело, включая любое функционально эквивалентное антитело или его функциональные фрагменты, где чувствительность антитела к амилоидному Aβ1-42-пептиду превышает его чувствительность к Aβ1-38, Aβ1-39, Aβ1-40, Aβ1-41 вплоть до 100 раз, предпочтительно от 50 до 100 раз, более предпочтительно от 80 до 100 раз, но наиболее предпочтительно в 100 раз, и чувствительность антитела к амилоидному Aβ1-42-пептиду превышает его чувствительность к Aβ1-38 вплоть до раз 1000 раз, предпочтительно от 500 до 1000 раз, более предпочтительно от 800 до 1000 раз, но особенно предпочтительно в 1000, и в результате обладает способностью ингибировать in vitro и in vivo агрегацию амилоидогенных мономерных пептидов, но прежде всего амилоидного Aβ1-42-пептида.
Следующим вариантом осуществления изобретения является антитело, прежде всего бифункциональное антитело, но особенно предпочтительно моноклональное антитело, включая любое функционально эквивалентное антитело или его функциональные фрагменты, которое обладает высокой чувствительностью к амилоидному Aβ1-42-пептиду и обладает способностью выявлять волокна Aβ1-42 в концентрации, пониженной вплоть до по меньшей мере 0,001 мкг, но прежде всего в концентрации, составляющей от 0,5 и 0,001 мкг, более предпочтительно от 0,1 до 0,001 мкг, но наиболее предпочтительно в концентрации 0,001 мкг.
Одним из наиболее предпочтительных конкретных вариантов осуществления изобретения является антитело, прежде всего моноклональное антитело, включая любое функционально эквивалентное антитело или его функциональные фрагменты, где антитело обладает способностью выявлять волокна Aβ1-42 в концентрации, пониженной вплоть до минимальной концентрации, составляющей 0,001 мкг, волокна Aβ1-40 в концентрации, пониженной вплоть до минимальной концентрации, составляющей 0,1 мкг, а волокна Aβ1-38 в концентрации, пониженной вплоть до минимальной концентрации волокон, составляющей 1 мкг.
Связывание антител, предлагаемых в изобретении и описанных выше, с амилоидогенными мономерными пептидами, но прежде всего с амилоидной формой (1-42), приводит к ингибированию агрегации мономерных амилоидогенных пептидов с образованием высокомолекулярных фибрилл или филаментов. Вследствие ингибирования агрегации амилоидогенных мономерных пептидов антитела, предлагаемые в настоящем изобретении, обладают способностью предупреждать или замедлять образование амилоидных бляшек, прежде всего амилоидной формы (1-42), которая, как известно, становится нерастворимой в результате изменения конформации и представляет собой основную часть амилоидных бляшек в головном мозге больных животных или людей.
Конкретным вариантом осуществления настоящего изобретения является моноклональное антитело, включая любое функционально эквивалентное антитело или его функциональные фрагменты, где антитело обладает характерными свойствами антитела, продуцируемого клетками гибридомы линии EJ 7H3, которая депонирована 8 декабря 2005 г. как DSM ACC2756.
Более конкретно, изобретение относится к моноклональному антителу, включая любое функционально эквивалентное антитело или его функциональные фрагменты, продуцируемому клетками гибридомы линии EJ 7H3, которая депонирована 8 декабря 2005 г. как DSM ACC2756.
Объектом изобретения является также способ предупреждения, лечения или облегчения воздействия амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, но прежде всего заболевания или состояния, характеризующегося утратой когнитивной способности к запоминанию, такого, например, как умеренное ухудшение когнитивной способности (MCI), путем введения надмолекулярной антигенной конструкции, предлагаемой в настоящем изобретении, но прежде всего композиции вакцины, содержащей надмолекулярные антигенные конструкции, предлагаемые в изобретении, животному, прежде всего млекопитающему или человеку, который поражен указанным нарушением и нуждается в таком лечении.
Следующим вариантом осуществления настоящего изобретения является способ получения композиции вакцины, предназначенной для индукции иммунного ответа в организме, прежде всего в организме животного или человека, который поражен указанным нарушением, заболеванием или состоянием и в результате нуждается в таком лечении или облегчении воздействия амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, но прежде всего заболевания или состояния, характеризующегося утратой когнитивной способности к запоминанию, такого, например, как умеренное ухудшение когнитивной способности (MCI).
Еще одним вариантом осуществления настоящего изобретения является способ получения композиции терапевтической вакцины, предназначенной для предупреждения, лечения или облегчения воздействия амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, но прежде всего заболевания или состояния, характеризующегося утратой когнитивной способности к запоминанию, такого, например, как умеренное ухудшение когнитивной способности (MCI), заключающемуся в том, что приготавливают антитело, предлагаемое в изобретении, в фармацевтически приемлемой форме.
Конкретным вариантом осуществления настоящего изобретения является применение презентации антигена, что приводит к более эффективной доступности и стабилизации предпочтительной конформации антигена, что в конце концов приводит к получению более специфического иммунного ответа и приводит к образованию антител с уникальными свойствами.
Одним из вариантов осуществления настоящего изобретения являются иммуногенные композиции, содержащие надмолекулярную антигенную конструкцию, которая имеет антигенный β-амилоидный пептид, предлагаемый в изобретении и описанный выше, который представлен N-концевой областью β-амилоидного пептида, где антигенный пептид модифицируют так, чтобы он обладал способностью поддерживать и стабилизировать определенную конформацию антигена, прежде всего конформацию, которая отличается сбалансированным соотношением участков произвольных спиралей, α-спиралей и β-складок. Указанная конформация приводит к индукции сильного и высокоспецифического иммунного ответа при интродукции животному или человеку.
Согласно следующему варианту осуществления изобретения композиция вакцины, предлагаемая в изобретении, может содержать помимо антигенного Aβ-пептида, прежде всего антигенного Aβ-пептида, предлагаемого в изобретении и описанного выше, ингибитор активации комплемента. Таким образом, изобретение относится к композиции вакцины и способу получения указанной композиции, предназначенной для лечения заболеваний и нарушений, которые вызываются или ассоциированы с амилоидным или амилоидоподобными белками, включая амилоидоз, группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), прежде всего заболевание или состояние, характеризующиеся утратой когнитивной способности к запоминанию, такое, например, как умеренное ухудшение когнитивной способности (MCI), которая содержит пептидный фрагмент из N-концевой области Aβ-пептида, прежде всего фрагмент Aβ-пептида, состоящий из встречающегося один раз или повторяющегося несколько раз участка, который содержит от 7 до 16 смежных аминокислотных остатков, прежде всего от 13 до 16 смежных аминокислотных остатков, предпочтительно из N-концевой области Aβ-пептида, но особенно предпочтительно фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей остатки 1-16, 1-15, 1-14 и 1-13 из N-концевой области Aβ-пептида, более предпочтительно остатки 1-15, представленные в SEQ ID NO:1, включая их функционально эквивалентные фрагменты, но прежде всего указанные выше фрагменты Aβ-пептида, присоединенные, или встроенные, или реконструированные в частице носителя/адъюванте, такого, например, как липосома, в сочетании с ингибитором системы комплемента, прежде всего ингибитором пути комплемента, выбранным из группы, включающей растворимые версии мембранных регуляторных белков, гуманизированные антитела к белкам комплемента, низкомолекулярные ингибиторы, которые действуют на различных стадиях пути комплемента, и регуляторы человеческого комплемента, которые экспрессируются в трансгенных животных.
Указанный участок, состоящий из 13-15 смежных аминокислотных остатков, может повторяться в конструкции, предлагаемой в изобретении, от 2 до 50 раз, предпочтительно от 2 до 30 раз, более предпочтительно от 2 до 20 раз, еще более предпочтительно от 2 до 16 раз, но наиболее предпочтительно от 2 до 10 раз.
В конкретном варианте осуществления изобретения упомянутый выше ингибитор активации комплемента, представляющий собой компонент композиции терапевтической вакцины, является соединением, выбранным из группы, включающей растворимый рецептор 1 человеческого комплемента, антитело к белку С5 человеческого комплимента, такое, например, как гуманизированное моноклональное антитело к С5 или одноцепочечный фрагмент гуманизированного моноклонального антитела, ингибитор-N С1-эстеразы и встречающийся в естественных условиях ингибитор человеческого С1.
Настоящее изобретение относится также к указанной выше композиции вакцины, предлагаемой в изобретении, которая помимо фрагмента Aβ-пептида, прежде всего фрагмента Aβ-пептида, предлагаемого в изобретении, содержит аллостерический эффектор гемоглобина, который в эритроцитах индуцирует снижение аффинности O2/гемоглобина, в результате чего кислород высвобождается затем регулируемым образом в тканях.
Таким образом, изобретение относится к композиции вакцины и способу получения такой композиции, предназначенной для лечения заболеваний и нарушений, которые вызываются или ассоциированы с амилоидом или амилоидоподобными белками, включая амилоидоз, группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), прежде всего заболевание или состояние, характеризующиеся утратой когнитивной способности к запоминанию, такое, например, как умеренное ухудшение когнитивной способности (MCI), которая содержит пептидный фрагмент из N-концевой области Aβ-пептида, прежде всего фрагмент Aβ-пептида, состоящий из встречающегося один раз или повторяющегося несколько раз участка, который содержит от 7 до 16 смежных аминокислотных остатков, прежде всего от 13 до 16 смежных аминокислотных остатков, предпочтительно из N-концевой области Aβ-пептида, но особенно предпочтительно фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей остатки 1-16, 1-15, 1-14 и 1-13 из N-концевой области Aβ-пептида, более предпочтительно остатки 1-15, представленные в SEQ ID NO:1, включая их функционально эквивалентные фрагменты, но прежде всего указанный выше фрагмент Aβ-пептида, который модифицируют путем присоединения с помощью ковалентной связи пальмитоильных остатков на каждый конец пептида, что приводит к тому, что от 2 до 4 пальмитоильных остатков, более конкретно 4 пальмитоильных остатка, но прежде всего указанный выше фрагмент Aβ-пептида, присоединяется, или встраивается, или реконструируется в частице носителя/адъюванта, такого, например, как липосома, в сочетании с соединением, которое индуцирует снижение аффинности O2/гемоглобина, в результате чего кислород высвобождается затем регулируемым образом в тканях.
Указанный участок, состоящий из 13-15 смежных аминокислотных остатков, может повторяться в конструкции, предлагаемой в изобретении, от 2 до 50 раз, предпочтительно от 2 до 30 раз, более предпочтительно от 2 до 20 раз, еще более предпочтительно от 2 до 16 раз, но наиболее предпочтительно от 2 до 10 раз.
Соединения, которые можно применять в композиции, предлагаемой в изобретении, представляют собой, в частности, соединения, выбранные из группы, включающей антилипидемическое лекарственное средство, такое, например, как клофибриновая кислота или производные безафибрата LR16 и L35, производные мочевины, такие, например, как [2-[4[[(ариламино)карбонил]амино]фенокси]-2-метилпропионовая кислота, аллостерический эффектор гемоглобина.
Соединение, модулирующее аффинность O2/гемоглобина, может представлять собой также соединение, содержащее анионный лиганд аллостерического сайта гемоглобина, где анионный лиганд содержит внутреннее пирофосфатное кольцо, необязательно в сочетании с нетоксичным катионом, таким, например, как Ca2+ и Na2+.
Более конкретно изобретение относится к предлагаемой в изобретении указанной выше композиции терапевтической вакцины, которая содержит помимо фрагмента Aβ-пептида, предлагаемого в изобретении, производные инозитгексакисфосфатат (IHP), которые содержат внутренне пирофосфтатное кольцо, необязательно в сочетании с нетоксичным катионом, таким, например, как Са2+ и Na+.
Еще одним вариантом осуществления изобретения является предлагаемая в изобретении и указанная выше композиция вакцины, которая содержит помимо фрагмента Aβ-пептида, прежде всего фрагмента Aβ-пептида, предлагаемого в изобретении, комбинацию ингибитора системы активации комплемента, прежде всего ингибитор пути комплемента, выбранный из группы, включающей растворимые версии мембранных регуляторных белков, гуманизированные антитела к белкам комплемента, низкомолекулярные ингибиторы, которые действуют на различных стадиях пути комплемента, и человеческие регуляторы комплемента, экспрессируемые в трансгенных животных, и аллостерический эффектор гемоглобина, который в эритроцитах снижает аффинность O2/гемоглобина, в результате чего большее количество кислорода высвобождается затем регулируемым образом в тканях.
Таким образом, изобретение относится также к композиции вакцины и способу получения такой композиции для лечения заболеваний и нарушений, которые вызываются или ассоциированы с амилоидом или амилоидоподобными белками, включая амилоидоз, группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), прежде всего заболевание или состояние, характеризующиеся утратой когнитивной способности к запоминанию, такое, например, как умеренное ухудшение когнитивной способности (MCI), которая содержит пептидный фрагмент из N-концевой области Aβ-пептида, прежде всего фрагмент Aβ-пептида, состоящий из встречающегося один раз или повторяющегося несколько раз участка, который содержит от 7 до 16 смежных аминокислотных остатков, прежде всего от 13 до 16 смежных аминокислотных остатков, предпочтительно из N-концевой области Aβ-пептида, но особенно предпочтительно фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей остатки 1-16, 1-15, 1-14 и 1-13 из N-концевой части Aβ-пептида, более предпочтительно остатки 1-15, представленные в SEQ ID NO:1, включая их функционально эквивалентные фрагменты, но прежде всего указанный выше фрагмент Aβ-пептида, который модифицируют путем присоединения с помощью ковалентной связи пальмитоильных остатков на каждый конец пептида, что приводит к тому, что от 2 до 4 пальмитоильных остатков, более конкретно 4 пальмитоильных остатка, но прежде всего указанный выше фрагмент Aβ-пептида, присоединяется, или включается, или реконструируется в частице носителя/адъюванта, такого, например, как липосома, в сочетании с ингибитором системы активации комплемента, прежде всего ингибитором пути комплемента, выбранным из группы, включающей растворимые версии мембранных регуляторных белков, гуманизированные антитела к белкам комплемента, низкомолекулярные ингибиторы, которые действуют на различных стадиях пути комплемента, и человеческие регуляторы комплемента, экспрессируемые в трансгенных животных, и соединение, прежде всего аллостерический эффектор гемоглобина, который снижает аффинность O2/гемоглобина, в результате чего больше кислорода высвобождается затем регулируемым образом в тканях.
Указанный участок, состоящий из 13-15 смежных аминокислотных остатков, может повторяться в конструкции, предлагаемой в изобретении, от 2 до 50 раз, предпочтительно от 2 до 30 раз, более предпочтительно от 2 до 20 раз, еще более предпочтительно от 2 до 16 раз, но наиболее предпочтительно от 2 до 10 раз.
Еще одним вариантом осуществления изобретения является способ лечения ассоциированного с амилоидом заболевания или состояния, заключающийся в том, что вводят животному, прежде всего млекопитающему, но предпочтительно человеку, который страдает указанным заболеванием или состоянием, композиции терапевтической вакцины, предлагаемой в изобретении и описанной выше, прежде всего композиции вакцины, которая содержит антиген, представляющий собой Aβ1-15-пептид, более предпочтительно антиген, представляющий собой палимитоилированный Aβ1-15-пептид.
В конкретном варианте осуществления изобретения композиция вакцины приводит главным образом к продуцированию антител невоспалительных подтипов, прежде всего невоспалительного Th2-подтипа, такого, например, как изотип IgG1 и IgG2b.
Согласно следующему конкретному варианту осуществления изобретения введение композиции вакцины приводит главным образом к продуцированию независимых от Т-клеток антител подкласса IgG, прежде всего изотипа IgG3.
Согласно еще одному варианту осуществления изобретения введение указанной композиции вакцины не приводит к существенному повышению уровня маркеров воспаления в головном мозге, прежде всего маркеров воспаления, выбранных из группы, включающей IL-1β, IL-6, IFN-γ и TNF-α.
Согласно еще одному варианту осуществления изобретения введение указанной композиции вакцины приводит к существенному снижению уровня нерастворимых, связанных с бляшками Aβ1-40 и Aβ1-42 в головном мозге.
Согласно еще одному варианту осуществления изобретения введение указанной композиции вакцины приводит к существенному снижению уровня растворимого Aβ1-42 в головном мозге.
В частности, ассоциированное с амилоидом заболевание или состояние выбирают из группы, включающей заболевания, которые включают (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна.
Более предпочтительно ассоциированное с амилоидом заболевание или состояние представляет собой болезнь Альцгеймера.
Согласно еще одному конкретному варианту осуществления изобретения способ лечения ассоциированного с амилоидом заболевания или состояния, предлагаемый в изобретении и описанный выше, при котором вводят композицию вакцины млекопитающему или человеку, страдающему ассоциированным с амилоидом состоянием, которое характеризуется утратой когнитивной способности к запоминанию, что приводит к улучшению, прежде всего полному восстановлению когнитивной способности к запоминанию.
Еще одним конкретным вариантом осуществления изобретения является способ лечения ассоциированного с амилоидом заболевания или состояния, заключающийся в том, что вводят животному, в частности млекопитающему, но особенно предпочтительно человеку, страдающему указанным заболеванием или состоянием, композиции терапевтической вакцины, которая содержит антигенную конструкцию, предлагаемую в изобретении и описанную выше, и ингибитор системы комплемента, где композицию вакцины прежде всего вводят так, чтобы ингибитор комплемента и антигенную конструкцию вводить одновременно, поочередно или последовательно.
В конкретном варианте осуществления изобретения ингибитор комплемента вводят до вакцинации антигенной конструкцией, в частности в пределах временного окна, начинающегося вплоть до 20 ч до вакцинации и заканчивающегося непосредственно перед вакцинацией.
В другом конкретном варианте осуществления изобретения ингибитор комплемента вводят после вакцинации антигенной конструкцией в пределах временного окна, начинающегося непосредственно после вакцинации и заканчивающегося через 1 день после применения вакцины.
Следующим вариантом осуществления изобретения является способ приготовления лекарственного средства, предназначенного для лечения ассоциированного с амилоидом заболевания или состояния, заключающийся в применении композиции вакцины, предлагаемой в изобретении и описанной выше.
Эти и другие объекты, отличительные признаки и преимущества настоящего изобретения станут очевидными после ознакомления с приведенным ниже подробным описанием вариантов осуществления изобретения и прилагаемой формулой изобретения.
Понятия «полипептид», «пептид» и «белок» в контексте настоящего описания используют взаимозаменяемо, и они обозначают биологическую молекулу, состоящую из аминокислот, сцепленных пептидной связью.
Понятие «пептиды» означает цепи аминокислот (как правило, L-аминокислот), альфа-атомы углерода которых сцеплены через пептидные связи, образованные в результате реакции конденсации между карбоксильной группой альфа-углерода одной аминокислоты и аминогруппой на альфа-углероде другой аминокислоты. Концевая аминокислота на одной конце цепи (т.е. аминоконцевая) имеет свободную аминогруппу, а концевая аминокислота на другом конце цепи (т.е. карбоксиконцевая) имеет свободную карбоксильную группу. Так, понятие «аминоконец» (сокращенно N-конец) относится к свободной альфа-аминогруппе аминокислоты на аминоконце пептида или альфа-аминогруппе (иминогруппа, когда она участвует в образовании пептидной связи) аминокислоты в любом другом положении внутри пептида. Аналогично этому, понятие «карбоксиконец» (сокращенно С-конец) относится к свободной карбоксильной группе аминокислоты на карбоксиконце пептида или карбоксильной группе аминокислоты в любом другом положении внутри пептида.
Как правило, аминокислоты, из которых состоит пептид, нумеруют в определенной порядке, начиная с аминоконца и увеличивая номера по направлению к карбоксиконцу пептида. Таким образом, при упоминании, что одна аминокислота следует за другой, считается, что аминокислота расположена ближе к карбоксиконцу пептида, чем предыдущая аминокислота.
Понятие «остаток» в контексте настоящего описания относится к аминокислоте, которая включена в пептид посредством амидной связи. Так, аминокислота может представлять собой встречающуюся в естественных условиях аминокислоту или, если не имеется других ограничений, может представлять собой известные аналоги встречающихся в естественных условиях аминокислот (т.е. аминокислотные миметики). Кроме того, амидная связь миметика включает модификации пептидного каркаса, хорошо известные специалистам в данной области.
Выражение «состоит практически из» в контексте настоящего описания исключает наличие какого-либо элемента, который может заметно изменять характерные свойства пептидов, к которым эта фраза относится. Так, при описании пептида выражение «состоит практически из» исключает наличие любых аминокислотных замен, добавлений или делеций, которые могут заметно изменять биологическую активность указанного пептида.
Кроме того, специалисту в данной области должно быть очевидно, что упомянутые выше отдельные замены, делеции или добавления, которые изменяют, дополняют или элиминируют индивидуальную аминокислоту или небольшой процент аминокислот (как правило, менее 5%, более предпочтительно менее 1%) в кодируемой последовательности, представляют собой консервативно модифицированные варианты, при которых изменения приводят к замене аминокислоты на химически сходную аминокислоту. Таблицы консервативных замен функционально сходных аминокислот хорошо известны в данной области. Ниже представлены 6 групп, каждая из которых содержат аминокислоты, являющиеся консервативными заменами друг друга:
1) аланин (А), серин (S), треонин (Т);
2) аспарагиновая кислота (D), глутаминовая кислота (Е);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (K);
5) изолейцин (I), лейцин (L), метионин (М), валин (V); и
6) фенилаланин (F), тирозин (Y), трипотофан (W).
Понятия «выделенный» или «биологически чистый» относятся к материалу, который в значительной степени или практически свободен от компонентов, которые в норме сопровождают его в нативном состоянии. Так, пептиды, представленные в настоящем описании, не содержат материалы, которые в норме ассоциированы с их окружением in situ. Как правило, выделенные иммуногенные пептиды, представленные в настоящем описании, имеют чистоту, составляющую по меньшей мере примерно 80%, обычно по меньшей мере примерно 90% и предпочтительно по меньшей мере примерно 95% при оценке по интенсивности полос окрашенных серебром гелей.
Чистоту белка можно определять многочисленными методами, хорошо известными в данной области, такими как электрофорез в полиакриламидном геле образца белка с последующей визуализацией путем окрашивания. Для определенных целей требуется высокое разрешение и для очистки можно использовать ЖХВР или аналогичные методы.
Когда иммуногенные пептиды являются относительно короткими (т.е. состоят менее чем примерно из 50 аминокислот), их часто синтезируют с помощью стандартных методов химического синтеза пептидов.
Твердофазный синтез, при котором C-концевую аминокислоту последовательности присоединяют к нерастворимой подложке с последующим последовательным добавлением остальных аминокислот последовательности, представляет собой предпочтительный метод химического синтеза иммуноногенных пептидов, представленных в настоящем описании. Методы твердофазного синтеза известны специалистам в данной области.
В другом варианте представленные в настоящем описании иммуногенные пептиды синтезируют с помощью метода рекомбинантных нуклеиновых кислот. Как правило, он предусматривает создание нуклеотидной последовательности, которая кодирует пептид, перенос нуклеиновой кислоты в кассету экспрессии под контроль конкретного промотора, экспрессию пептида в хозяине, выделение экспрессируемого пептида или полипептида и при необходимости ренатурацию пептида. Из литературы известны методики, дающие достаточную информацию специалисту в данной области, для осуществления указанных процедур.
После их экспрессии рекомбинантные пептиды можно очищать с помощью стандартных методик, включая осаждение сульфатом аммония, аффинную хроматографию на колонках, колоночную хроматографию, гель-электрофорез и т.п. Для применения в качестве терапевтических агентов предпочтительными являются композиции, гомогенные примерно на 50-95%, и наиболее предпочтительные гомогенные на 80-95% или более.
Специалисту в данной области должно быть очевидно, что после химического синтеза, биологической экспрессии или очистки конформация иммуногенных пептидов может существенно отличаться от нативной присущей пептидам конформации. В этом случае часто необходимо денатурировать и восстанавливать антипролиферативный пептид и затем осуществлять повторную укладку пептида с получением предпочтительной конформации. Методы восстановления и денатурации белков и индукции повторной укладки хорошо известны специалистам в данной области.
Антигенность очищенного белка можно подтверждать, например, демонстрируя реакцию с иммунной сывороткой или антисывороткой, продуцируемой против самого белка.
В контексте настоящего описания упоминание единственного числа может обозначать «один или несколько» и, если не указано иное, то оно включает множественное число.
Понятия «выявление (обнаружение)» или выявленный (обнаруженный)» в контексте настоящего описания означает применение известных методик для выявления биологических молекул, таких как иммунохимические или гистологические методы, и относятся к качественному или количественному выявлению присутствия или определения концентрации исследуемой биологической молекулы.
Понятие «выделенная» относится к биологической молекуле, свободной по меньшей мере от некоторых компонентов, с которыми она связана в естественных условиях.
Понятия «антитело» или «антитела» в контексте настоящего описания имеют известное с данной области значение и относятся к молекулам или активным фрагментам молекул, которые связываются с известными антигенами, прежде всего к молекулам иммуноглобулинов и к иммунологически активным фрагментам молекул иммуноглобулинов, т.е. молекулам, которые содержат сайт связывания, иммуноспецифически связывающийся с антигеном. Иммуноглобулин, предлагаемый в изобретении, может представлять собой любой тип (IgG, IgM, IgD, IgE, IgA и IgY) или класс (IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласс молекулы иммуноглобулина.
Согласно настоящему изобретению подразумевается, что к «антителам» относятся моноклональные антитела, поликлональные, химерные, одноцепочечные, биспецифические, симианизированные (включающие участки обезьяньих антител), человеческие и гуманизированные антитела, а также их активные фрагменты. Например, к активным фрагментам молекул, которые связываются с известными антигенами, относятся Fab- и F(аb')2-фрагменты, включая продукты экспрессионной библиотеки Fab-фрагментов иммуноглобулинов, и связывающиеся с эпитопом фрагменты любых антител и их указанных фрагментов.
Указанные активные фрагменты можно получать из антитела, предлагаемого в настоящем изобретении, с помощью многочисленных методик. Например, очищенные моноклональные антитела можно расщеплять ферментом, таким как пепсин, и подвергать ЖХВР-гель-фильтрации. Затем соответствующую фракцию, содержащую Fab-фрагменты, можно собирать и концентрировать с помощью фильтрации через мембрану и т.п. Дополнительное описание общих методик выделения активных фрагментов антител, см., например, у Khaw В. А. и др. J. Nucl. Med. 23, 1982, cc.1011-1019; Rousseaux и др. Methods Enzymology, 121, 1986, cc.663-669, Academic Press.
Понятие «гуманизированное антитело» относится к типу сконструированного антитела, в котором CDR получены из иммуноглобулина организма-донора, кроме человека, остальные выведенные из иммуноглобулина области получают из одного (или нескольких) человеческого(их) иммуноглобулина(ов). Кроме того, поддерживающие каркас остатки (остатки каркасного участка) можно изменять для сохранения аффинности к связыванию. Методы получения «гуманизированных антител» хорошо известны специалистам в данной области (см., например, Queen и др., Proc. Natl Acad Sci USA, 86, 1989, cc.10029-10032 (1989), Hodgson и др., Bio/Technology, 9, 1991, с.421).
«Гуманизированное антитело» можно получать также с помощью нового подхода генетической инженерии, который позволяет получать напоминающие человеческие поликлональные антитела с созревшей аффинностью в крупных животных, таких, например, как кролики (http://www.rctech.com/bioventures/therapeutic.php).
Понятие «моноклональное антитело» хорошо известно в данной области и относится к антителу, которое в больших количествах получают в лабораторных условиях из индивидуального клона и которое распознает только один антиген. Моноклональные антитела, как правило, создают путем слияния продуцирующей антитела В-клетки, как правило, с коротким временем жизни, с быстро растущей клеткой, такой как раковая клетка (иногда ее называют «иммортализованной» клеткой). Образовавшаяся гибридная клетка или гибридома быстро размножается, создавая клон, который продуцирует антитело в больших количествах.
Понятие «функционально эквивалентное антитело» в контексте настоящего изобретения относится к антителу, которое в целом сохраняет по меньшей мере одно из основных функциональных свойств антитела, в том числе: способность к специфическому связыванию с белком β-амилоида, прежде всего с белком Aβ1-42 и более предпочтительно с эпитопной 4-16-областью белка Aβ1-42, иммунореактивность in vitro, ингибирование агрегации мономеров Aβ1-42, приводящей к образованию высокомолекулярных полимерных фибрилл, и/или нарушение агрегации ранее сформированных полимерных фибрилл Aβ1-42, и/или нарушение правильности β-складчатой конформации и облегчение воздействий ассоциированных с амилоидозом нарушений, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, при введении с целью профилактики или лечения. Антитела могут принадлежать к любому классу, такому как IgG, IgM или IgA и т.д., или любому подклассу, такому как IgG1, IgG2a и т.д., и другим упомянутым выше или известным в данной области подклассам. Кроме того, антитела можно получать с помощью любого метода, такого как фаговая презентация, или получать в любом организме или линии клеток, в том числе в клетках бактерий, насекомых, млекопитающих или другом типе клеток или клеточных линий, которые продуцируют антитела с требуемыми характеристиками, такие как гуманизированные антитела. Антитела можно создавать также путем объединения Fab-фрагмента и Fc-участка из различных видов.
Понятие «антиген» относится к полному агенту или его фрагменту, который может индуцировать иммунный ответ в организме, прежде всего в организме животного, более предпочтительно млекопитающего, включая человека. Понятие включает иммуногены и области, ответственные за антигенность, или антигенные детерминанты.
В контексте настоящего описания понятие «растворимый» обозначает частично или полностью растворимый в водном растворе.
В контексте настоящего описания понятие «иммуногенные» относится к субстанциям, которые вызывают или усиливают производство антител, Т-клеток и других реактивных иммунных клеток, направленных против иммуногенного агента и участвующих в иммунном ответе в организме человека или животных.
Иммунный ответ имеет место, когда в организме индивидуума продуцируется достаточное количество антител, Т-клеток и других реактивных иммунных клеток против введенных иммуногенных композиций, предлагаемых в настоящем изобретении, для ослабления или облегчения подлежащего лечению нарушения.
Понятие «гибридома» известно в данной области и обычным специалистам в данной области и относится к клетке, полученной слиянием продуцирующей антитело клетки и иммортализованной клетки, например клетки множественной миеломы. Эта гибридная клетка обладает способностью обеспечивать постоянную поставку антител (см. выше определение понятия «моноклональное антитело» и ниже раздел «Примеры», в которых метод слияния описан более подробно).
Понятие «носитель» в контексте настоящего описания означает структуру, в которую антигенный пептид или надмолекулярную конструкцию можно встраивать или с которой их можно ассоциировать, осуществляя тем самым презентацию или обеспечивая доступность антигенных пептидов или фрагмента пептида для иммунной системы человека или животных. Любую частицу, которую можно применять для лечения животных или человека, такую, например, как пузырек, частицу или состоящее из частиц тельце, можно использовать в качестве носителя в контексте настоящего изобретения.
Под понятие «носитель» подпадают также другие методы введения, при которых композиции надмолекулярных антигенных конструкций, содержащих антигенный пептид, можно транспортировать к требуемым областям с помощью механизмов введения. Одним из примеров такой системы введения является система, в которой используют коллоидные металлы, такие как коллоидное золото.
Белки-носители, которые можно применять в композициях надмолекулярных антигенных конструкций, предлагаемых в настоящем изобретении, включают (но не ограничиваясь ими) белок, связывающий мальтозу «МВР»; бычий сывороточный альбумин «БСА»; гемоцианин лимфы улитки «KLH»; яичный белок, флагеллин; тироглобулин; сывороточный альбумин любых видов; гамма-глобулин любых видов; сингенные клетки; сингенные клетки, несущие антигены Iа; и полимеры D- и/или L-аминокислот.
В надмолекулярной антигенной конструкции, предлагаемой в настоящем изобретении, липосома может выполнять двойную функцию, в том плане, что ее можно применять в качестве носителя, содержащего описанную выше надмолекулярную конструкцию, и в то же время она может выполнять функцию адъюванта, повышающего или стимулирующего иммунный ответ в животном- или человеке-мишени, подлежащем лечению терапевтической вакциной, предлагаемой в изобретении. Следует понимать также, что композиции надмолекулярных антигенных конструкций, предлагаемых в настоящем изобретении, могут содержать также дополнительные адъюванты, включая, но не ограничиваясь ими, гемоцианин лимфы улитки (KLH), бычий сывороточный альбумин (БСА) и другие адъюванты, такие, например, как липид А, квасцы, фосфат кальция, интерлейкин 1 и/или микрокапсулы полисахаридов и белков, но прежде всего детоксифицированный липид А, такой как монофосфорильный или дифосфорильный липид А, или квасцы, дополнительные консерванты, разбавители, эмульгаторы, стабилизаторы и другие компоненты, которые являются известными и которые нашли применение в известных из существующего уровня техники вакцинах. Кроме того, любую известную в данной области систему адъювантов можно применять в композиции, предлагаемой в настоящем изобретении. К таким адъювантам относятся (но не ограничиваясь ими) неполный адъювант Фрейнда, полный адъювант Фрейнда, полидисперсный β-(1,4)-связанный ацетилированный маннан («Acemannan»), TITERMAX® (адъюванты на основе сополимера полиоксиэтилена-полиоксипропилена фирмы CytRx Corporation), модифицированные липидные адъюванты фирмы Chiron Corporation, адъюванты, являющиеся производными сапонина фирмы Cambridge Biotech, убитые Bordetella pertussis, липополисахарид (LPS) грамотрицательных бактерий, крупные полимерные анионы, такие как сульфат декстрана, и неорганические гели, такие как квасцы, гидроксид алюминия или фосфат алюминия.
Кроме того, понятие «эффективное количество» относится к количеству антигенной/иммуногенной композиции, которое при введении человеку или животному вызывает иммунный ответ. Эффективное количество легко может определить специалист в данной области с помощью общепринятых процедур.
Понятие «надмолекулярная антигенная конструкция» относится к антигенной конструкции, предлагаемой в настоящем изобретении и описанной выше. В частности, понятие «надмолекулярная антигенная конструкция» относится к антигенной конструкции, содержащей антиген, представляющий собой Aβ-пептид, предлагаемый в изобретении и описанный выше, в частности фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но предпочтительно фрагмент Aβ-пептида, состоящий из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антиген, представляющий собой Aβ1-16(Δ15)-пептид, более предпочтительно антиген, представляющий собой Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой Aβ1-14-пептид, конкретно антиген, представляющий собой Aβ1-15-пептид, и прежде всего фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, где антигенный пептид презентуют в виде антигена, присоединенного или встроенного или реконструированного в носителе, таком, например, как пузырек, состоящее из частиц тельце или молекула, но прежде всего липосома. Более предпочтительно антигенный пептид, предлагаемый в изобретении, модифицируют с помощью липофильного или гидрофобного остатка, который облегчает встраивание в липидный бислой липосомы-носителя/иммунного адъюванта, прежде всего с помощью липофильного или гидрофобного фрагмента, который представляет собой (но не ограничиваясь ими) жирную кислоту, триглицерид или фосфолипид, но особенно предпочтительно жирную кислоту, триглицерид или фосфолипид, где углеродный каркас жирной кислоты содержит по меньшей мере 10 атомов углерода, которые функционируют в качестве «якоря» для закрепления пептида в бислое липосомы и имеет размер, который обеспечивает положение пептида в непосредственной близости от поверхности липосомы и стабилизирует его в таком положении.
Например, композиции надмолекулярных антигенных конструкций, предлагаемые в изобретении, можно вводить парентерально, но прежде всего внутрибрюшинно, внутривенно, подкожно и внутримышечно, из расчета примерно от 1,0 мкг до 10,0 мг на пациента, хотя этот диапазон не следует рассматривать как ограничивающий. Фактическое количество композиции, требуемое для того, чтобы вызывать иммунный ответ, должно варьировать для каждого индивидуального пациента в зависимости от иммуногенности вводимой композиции и иммунного ответа индивидуума. Таким образом, конкретные вводимые индивидууму количества можно определять с помощью общепринятых экспериментов и основываясь на знаниях и опыте специалиста в данной области.
Надмолекулярные антигенные конструкции, предлагаемые в настоящем изобретении, можно применять для приготовления композиции вакцины, предназначенной для индукции иммунного ответа в организме, прежде всего в организме животного или человека, с целью предупреждения, лечения или облегчения воздействий амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, но прежде всего заболевание или состояние, характеризующееся утратой когнитивной способности к запоминанию, такое, например, как умеренное ухудшение когнитивной способности (MCI).
Таким образом, объектом настоящего изобретения является способ предупреждения, лечения или облегчения воздействий амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, но прежде всего заболевание или состояние, характеризующееся утратой когнитивной способности к запоминанию, такое, например, как умеренное ухудшение когнитивной способности (MCI), путем введения надмолекулярной антигенной конструкции, предлагаемой в настоящем изобретении, но прежде всего композиции вакцины, которая содержит указанные надмолекулярные антигенные конструкции, предлагаемые в изобретении, животному, прежде всего млекопитающему или человеку, пораженному указанным нарушением и поэтому нуждающемуся в указанном лечении.
Следующим вариантом осуществления изобретения является способ приготовления композиции вакцины, предназначенной для индукции иммунного ответа в организме, в частности в организме животного или человека, пораженного указанным нарушением, заболеванием или состоянием и в результате нуждающегося в таком лечении, с целью предупреждения, лечения или облегчения воздействий амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, но прежде всего заболевание или состояние, характеризующееся утратой когнитивной способности к запоминанию, такое, например, как умеренное ухудшение когнитивной способности (MCI).
Еще одним вариантом осуществления изобретения является способ приготовления композиции, предназначенной для предупреждения, лечения или облегчения воздействий амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, но прежде всего заболевание или состояние, характеризующееся утратой когнитивной способности к запоминанию, такое, например, как умеренное ухудшение когнитивной способности (MCI), заключающийся в приготовлении препарата антитела, предлагаемого в изобретении, в виде фармацевтически приемлемой формы.
Конкретным вариантом осуществления настоящего изобретения является применение презентации антигена, что приводит к более эффективной доступности и стабилизации предпочтительной конформации антигена, что в конце концов приводит к получению высокоспецифического иммунного ответа и приводит к образованию антител с уникальными свойствами.
Одним из вариантов осуществления настоящего изобретения являются иммуногенные композиции, содержащие надмолекулярную антигенную конструкцию, которая включает антигенный β-амилоидный пептид, предлагаемый в изобретении и описанный выше, который представлен N-концевой областью β-амилоидного пептида, где антигенный пептид модифицируют так, чтобы он обладал способностью поддерживать и стабилизировать определенную конформацию антигена, прежде всего конформацию, которая отличается сбалансированным соотношением участков произвольных спиралей, α-спиралей и β-складок. Указанная конформация приводит к индукции сильного и высокоспецифического иммунного ответа при интродукции животному или человеку.
Одним из путей достижения образования и стабилизации требуемой конформации антигенного пептида является презентация антигенного пептида, присоединенного, или встроенного, или реконструированного, частично или полностью, в носителе, таком, например, как пузырек, состоящее из частиц тельце или молекула, или любые другие средства, которые могут служить в качестве носителя/адъюванта для антигенного пептида. В конкретном варианте осуществления изобретения антигенный пептид присоединяют, или встраивают, или реконструируют в носителе благодаря слабым взаимодействиям, таким, например, как взаимодействие Ван-дер-Ваальса, гидрофобное или электростатическое взаимодействие, или комбинация двух или большего количества указанных типов взаимодействий, в результате пептид презентуется в специфической конформации, которая поддерживается и стабилизируется путем ограничения сдвига трехмерной структуры антигенного пептида, в результате чего конформационные изменения предупреждаются или в значительной степени ограничиваются.
Когда пузырек, частицу или состоящее из частиц тельце применяют в качестве носителя/адъюванта, например липосому, то композицию антигенного пептида можно выбирать так, чтобы ее общий чистый заряд был идентичен заряду на поверхности носителя/адъюванта, к которому пептид присоединен. Электростатические силы отталкивания, которые обладают эффективностью между одинаково заряженной поверхностью носителя/адъюванта и антигенного пептида, но прежде всего между одинаково заряженной поверхностью носителя и аминокислотными остатками, из которых состоит антигенный пептид, и более предпочтительно между одинаково заряженной поверхностью носителя и одинаково заряженными аминокислотными остатками, из которых состоит антигенный пептид, могут приводить к тому, что антигенный пептид приобретает определенную высокоспецифическую и стабилизированную конформацию, которая гарантирует высокую биологическую активность. В результате антигенный пептид выставляется и презентуется в конформации, которая обладает высокой биологической активностью и позволяет иммунной системе организма-мишени свободно взаимодействовать с антигенными детерминантами, входящими в антигенную конструкцию в биологически активной конформации, что приводит к сильному и специфическому для конформации иммунному ответу, приводящему, например, к образованию высокого титра антител в организме-хозяине. Благодаря тщательной координации общих чистых зарядов антигенного пептида, с одной стороны, и носителя, к которому пептид присоединяют, встраивают или реконструируют, с другой стороны, антигенный пептид презентуется на поверхности носителя или вблизи ее в конформации, которая индуцируется и стабилизируется электростатическими силами отталкивания, которые обладают эффективностью между одинаково заряженной поверхностью носителя и антигенного пептида, но прежде всего между одинаково заряженной поверхностью носителя и аминокислотными остатками, из которых состоит антигенный пептид, и более предпочтительно между одинаково заряженной поверхностью носителя и одинаково заряженными аминокислотными остатками, из которых состоит антигенный пептид. Это приводит к презентации антигенной конструкции, которая является легкодоступной для механизма иммунной защиты организма-мишени и поэтому может индуцировать сильный и высокоспецифический иммунный ответ при введении животному или человеку. Иммуногенный ответ можно дополнительно усиливать при использовании липосомы в качестве носителя, поскольку липосома может функционировать в качестве адъюванта, усиливающего или стимулирующего иммунный ответ в организме животного- или человека-мишени, подлежащего лечению с помощью терапевтической вакцины, предлагаемой в изобретении. Необязательно липосома может содержать также дополнительный адьювант, такой, например, как липид А, квасцы, фосфат кальция, интерлейкин 1 и/или микрокапсулы из полисахаридов и белков, но предпочтительно детоксифицированный липид А, такой как монофосфорильный или дифосфорильный липид А, или квасцы.
В конкретном варианте осуществления изобретения антигенный пептид, предлагаемый в изобретении и описанный выше, прежде всего антигенный пептид, общий чистый заряд которого является отрицательным, применяют в реконструированном в липосоме виде, прежде всего в липосоме, компоненты которой выбирают так, чтобы общий чистый заряд головной группы липосомы был отрицательным. В частности, липосома состоит из компонентов, выбранных из группы, включающей димиристоилфосфатидиохолин (DMPC), димиристоилфосфатидилэтаноламин (DMPEA), димиристоилфосфатидилглицерин (DMPG) и холестерин, и необязательно содержит также монофосфорильный липид А или любой другой адъювант, который можно применять в объеме настоящего изобретения, такой, например, как квасцы, фосфат кальция, интерлейкин 1 и/или микрокапсулы из полисахаридов и белков.
Другим конкретным вариантом осуществления изобретения является модифицированный антигенный пептид, предлагаемый в изобретении и описанный выше, ковалентно связанный с молекулой якорного типа, которую можно встраивать в носитель/адъювант, фиксируя тем самым пептид с носителем/адъювантом и осуществляя его презентацию на поверхности молекулы носителя/адъюванта или в непосредственной близости от ее поверхности так, чтобы электростатические силы становились эффективными, как описано выше.
Когда липосомы применяют в качестве носителя/адъюванта, антигенная пептидная конструкция, как правило, имеет гидрофобный хвост, который встраивается в мембрану липосомы при ее формировании. Кроме того, антигенные пептиды можно модифицировать так, чтобы они содержали гидрофобный хвост, который можно встраивать в липосому.
Надмолекулярные антигенные конструкции, предлагаемые в настоящем изобретении, как правило, содержат пептиды, модифицированные с целью усиления антигенного действия, при этом указанные пептиды можно модифицировать путем пэгилирования (используя полиэтиленгликоль или модифицированный полиэтиленгликоль) или модифицировать с помощью других методов, например, с использованием пальмитиновой кислоты, как описано выше, полиаминокислот (например, полиглицина, полигистидина), полисахаридов (например, полигалактуроновой кислоты, полимолочной кислоты, полигликолида, хитина, хитозана), синтетических полимеров (полиамиды, полиуретаны, сложные полиэфиры) или сополимеров (например, поли(метакриловой кислоты) и N-(2-гидрокси)пропилметакриламида) и т.п.
Конкретным вариантом осуществления изобретения являются антигенные пептиды, предлагаемые в изобретении и описанные выше, которые в результате модификации содержат гидрофобный хвост, в результате указанные пептиды можно встраивать в липосому. В частности, β-амилоидный пептид можно модифицировать с помощью липофильного или гидрофобного фрагмента, который облегчает встраивание в липидный бислой носителя/адъюванта. Липофильные или гидрофобные фрагменты, предлагаемые в настоящем изобретении, могут представлять собой жирные кислоты, триглицериды и фосфолипиды, прежде всего жирные кислоты, триглицериды и фосфолипиды, где углеродный каркас жирной кислоты содержит по меньшей мере 10 атомов углерода, прежде всего липофильные фрагменты, включающие жирные кислоты, углеродный каркас которых состоит по меньшей мере примерно из 14 атомов углерода и вплоть примерно до 24 атомов углерода, более предпочтительные гидрофобные фрагменты имеют углеродный каркас, состоящий по меньшей мере из 14 атомов углерода. Примерами гидрофобных фрагментов являются (но не ограничиваясь ими) пальмитиновая кислота, стеариновая кислота, миристиновая кислота, лауриновая кислота, олеиновая кислота, линолевая кислота, линоленовая кислота и холестерин или DSPE. В конкретном варианте осуществления настоящего изобретения гидрофобный фрагмент представляет собой пальмитиновую кислоту.
Пальмитоилирование, обеспечивающее «заякоривание» пептида в бислое липосомы из-за относительно небольшой длины фрагменты жирной кислоты C16:0, приводит к тому, что пептид презентуется на поверхности липосомы или в непосредственной близости к поверхности. Таким образом, клетки, процессирующие антиген, должны включать полную липосому с пептидом.
В другом варианте осуществления изобретения используют ПЭГ для получения надмолекулярной конструкции, в которой свободный конец ПЭГ ковалентно связывают с молекулой фосфатидилэтаноламина (где жирная кислота может представлять собой: миристиновую, пальмитиновую, стеариновую, олеиновую кислоту и т.д. или их комбинацию). Указанную надмолекулярную структуру можно реконструировать в липосомах, состоящих из фосфолипидов и холестерина (фосфатидилэтаноламин, фосфатидилглицерин, холестерин в различных молярных соотношениях). Можно применять другие фосфолипиды. Липид А применяют в концентрации примерно 40 мкг/пмоль фосфолипидов.
Следующим объектом настоящего изобретения являются композиции вакцины, которые содержат надмолекулярные антигенные конструкции, содержащие антигенный пептид, предлагаемый в изобретении и описанный выше, где пептид модифицируют с целью повышения антигенного действия, при этом указанный пептид, прежде всего фрагмент Aβ-пептида из N-концевой области Aβ-пептида, и прежде всего фрагмент Aβ-пептида, содержащий аминокислотные остатки, выбранные из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), антиген, представляющий собой Aβ1-16(Δ15)-пептид, более предпочтительно антиген, представляющий собой Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой Aβ1-14-пептид, конкретно антиген, представляющий собой Aβ1-15-пептид, и прежде всего фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, модифицируют путем пэгилирования (используя полиэтиленгликоль или модифицированный полиэтиленгликоль), или модифицируют с помощью других методов, например, с использованием полиаминокислот (например, полиглицина, полигиститида, полисахарида (например, полигалактуроновой кислоты, полимолочной кислоты, полигликолида, хитина, хитозана), синтетических полимеров (полиамиды, полиуретаны, сложные полиэфиры) или сополимеров (например, поли(метакриловой кислоты) и N-(2-гидрокси)пропилметакриламида) и т.п.
В другом варианте осуществления изобретения антигенный β-амилоидный пептид, предлагаемый в изобретении и описанный выше, представляет собой пальмитоилированный фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего пальмитоилированный фрагмент Aβ-пептида из N-концевой области Aβ-пептида, но прежде всего пальмитоилированный фрагмент Aβ-пептида, который состоит из аминокислотных остатков, выбранных из группы, включающей 1-15, 2-15, 3-15, 1-14, 2-14, 1-13; 1-16(Δ2), 1-16(Δ4), 1-16(Δ5), 1-16(Δ6), 1-16(Δ8), 1-16(Δ9), 1-16(Δ10); 1-16(Δ12), 16(Δ13), 16(Δ14), 1-16(Δ15), 1-15(Δ2), 1-15(Δ4), 1-15(Δ5), 1-15(Δ6), 1-15(Δ8), 1-15(Δ9), 1-15(Δ10); 1-15(Δ12), 15(Δ13), 15(Δ14), прежде всего антиген, представляющий собой пальмитоилированный Aβ1-16(Δ15)-пептид, более предпочтительно антиген, представляющий собой пальмитоилированный Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептид, еще более предпочтительно антиген, представляющий собой пальмитоилированный Aβ1-14-пептид, конкретно антиген, представляющий собой пальмитоилированный Aβ1-15-пептид, и прежде всего пальмитоилированный фрагмент Aβ-пептида, содержащий аминокислотные остатки 1-15, представленные в SEQ ID NO:1, и 1-16(Δ14), представленные в SEQ ID NO:3, модифицированный путем присоединения с помощью ковалентной связи пальмитоильных остатков к каждому концу пептида с получением от 2 до 4 остатков, более конкретно 4 остатка, реконструируют в липосоме. Указанную антигенную пальмитоилированную конструкцию можно применять для лечения амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз, и для облегчения симптомов, ассоциированных с заболеванием, или для восстановления состояния, характерного для здоровых индивидуумов, которые не поражены заболеванием.
В конкретных вариантах осуществления изобретения надмолекулярные антигенные конструкции, предлагаемые в настоящем изобретении, содержат описанную выше антигенную пептидную последовательность, ковалентно связанную по меньшей мере с одним пэгилированным лизином на каждом конце, но предпочтительно с одним или двумя на каждом конце. Длина ПЭГ-(полиэтиленгликольной) цепи может варьироваться от n=8 до n=150000 или более, прежде всего от n=10 до n=80000, более предпочтительно от n=10 до n=10000. В конкретном варианте осуществления изобретения длина ПЭГ-цепи составляет не более чем n=45, прежде всего от n=5 до n=40, более предпочтительно от n=10 до n=30 и еще более предпочтительно n=10.
Липосомы, которые можно применять в композициях, предлагаемых в настоящем изобретении, представляют собой липосомы, известные специалистам в данной области. Можно использовать любые стандартные липиды, применяемые для приготовления липосом. Для создания композиций, предлагаемых в настоящем изобретении, можно применять стандартные состоящие из двух или нескольких слоев липосомы. Хотя можно применять любой метод приготовления липосом, известный специалистам в данной области, наиболее предпочтительные липосомы получают согласно методу, описанному у Alving и др., Infect. Immun. 60, 1992, cc.2438-2444, публикация включена в настоящее описании в качестве ссылки. Липосома может необязательно содержать адъювант, или иммуномодулятор, или оба указанных агента. Предпочтительным иммуномодулятором является липид А, прежде всего детоксифицированный липид А, такой, например, как монофосфорильный или дифосфорильный липид А.
Липосома может обладать двойной функцией, поскольку ее можно применять в качестве носителя, содержащего описанную выше надмолекулярную конструкцию, и в то же время она может выполнять функцию адъюванта для усиления или стимуляции иммунного ответа в организме животного- или человека-мишени, подлежащего лечению терапевтической вакциной, предлагаемой в изобретении. Необязательно липосома, кроме того, может содержать дополнительный адъювант, или иммуномодулятор, или оба указанных агента, такой, например, как липид А, квасцы, фосфат кальция, интерлейкин-1 и/или микрокапсулы из полисахаридов и белков, но прежде всего липид А, более предпочтительно детоксифицированный липид А, такой как монофосфорильный или дифосфорильный липид А, или квасцы.
В частности, связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, но прежде всего заболевание или состояние, характеризующееся утратой когнитивной способности к запоминанию, такое, например, как умеренное ухудшение когнитивной способности (MCI), лечат путем введения надмолекулярной антигенной конструкции, предлагаемой в настоящем изобретении, но прежде всего композиции вакцины, которая содержит указанные надмолекулярные антигенные конструкции, предлагаемые в изобретении, животному, прежде всего млекопитающему или человеку, которое поражено указанным нарушением и поэтому нуждается в указанном лечении, но прежде всего болезнь Альцгеймера, симптоматическое проявление которой выражается в нарушении памяти от слабой забывчивости до полной потери памяти.
Композицию, предлагаемую в настоящем изобретении, которая содержит надмолекулярную антигенную конструкцию, предлагаемую в изобретении и описанную выше, можно получать в форме жидкого раствора или инъецируемой суспензии, а также в твердой форме, пригодной для солюбилизации перед инъекцией, в составе, например, набора, предназначенного для применения указанной композиции, как описано ниже.
Композицию, предлагаемую в настоящем изобретении, которая содержит надмолекулярную антигенную конструкцию, вводят человеку или животному, страдающему ассоциированным с амилоидом заболеванием, для индукции иммунного ответа у человека или животного, с целью облегчения симптомов, ассоциированных с заболеванием, или с целью восстановления состояния, характерного для здоровых индивидуумов, которые не поражены заболеванием.
Композиции, предлагаемые в настоящем изобретении, вводят человеку или животному с помощью любых общепринятых стандартных путей введения. Как правило, композицию можно вводить с использованием местного, орального, ректального, назального или парентерального (например, внутривенного, подкожного или внутримышечного) пути введения. Кроме того, композицию можно включать в обеспечивающие пролонгированное высвобождение матрицы, например, из биоразложимых полимеров, полимеры можно имплантировать в область, в которую требуется осуществлять введение, например в область опухоли. Метод предусматривает введение однократной дозы, введение повторных доз с предварительно установленными временными интервалами и пролонгированное введение в течение предварительно определенного периода времени.
В частности, антигенную пептидную композицию, предлагаемую в изобретении, вводят с помощью парентеральной, прежде всего внутрибрюшинной, внутривенной, подкожной и внутримышечной инъекции.
Доза композиции должна зависеть от состояния, подлежащего лечению, конкретной применяемой композиции и других клинических факторов, таких как вес, размер и состояние пациента, площадь поверхности тела, конкретное соединение или композиция, подлежащая введению, другие одновременно применяемые лекарственные средства и путь введения.
Композицию терапевтической вакцины, предлагаемой в изобретении, можно вводить в сочетании с другими биологически активными субстанциями и процедурами, предназначенными для лечения заболеваний. Другие биологически активные субстанции могут быть компонентами той же композиции, которая уже содержит терапевтическую вакцину, предлагаемую в изобретении, в форме смеси, при этом терапевтическую вакцину и другую биологически активную субстанцию смешивают в фармацевтически приемлемом растворителе и/или носителе или с ним, или они могут присутствовать отдельно в виде компонента других композиции, которые могут поступать в продажу отдельно или вместе в форме состоящего из компонентов набора.
Композицию терапевтической вакцины, предлагаемой в изобретении, можно вводить в сочетании с другой(ими) биологически активной(ыми) субстанцией или субстанциями поочередно или последовательно. Например, композицию терапевтической вакцины, предлагаемой в изобретении, можно вводить одновременно с первой дополнительной биологически активной субстанцией или последовательно после или до введения терапевтической вакцины. Если выбрана приемлемая схема, при которой более одной дополнительной обладающей биологической активностью субстанции вводят в сочетании по меньшей мере с одной терапевтической вакциной, предлагаемой в изобретении, то соединения или субстанции можно частично вводить одновременно, частично последовательно в различных комбинациях.
Другим объектом настоящего изобретения являются смеси терапевтической вакцины, предлагаемой изобретении, и необязательно одной или нескольких дополнительных биологически активных субстанций, а также способы применения терапевтической вакцины, предлагаемой в изобретении, или их смесей, включая композиции, которые содержат указанную терапевтическую вакцину или смеси терапевтических вакцин, предназначенные для профилактического и/или терапевтического лечения и/или облегчения воздействий амилоидозов, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надьядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна.
Смеси, предлагаемые в изобретении, могут содержать помимо терапевтической вакцины, предлагаемой в изобретении, биологически активную субстанцию, такую, например, как известные соединения, применяемые для медикаментозного лечения амилоидозов, группы заболеваний и нарушений, ассоциированных с амилоидом или амилоидоподобным белком, таким как Aβ-белок, который участвует в патогенезе болезни Альцгеймера, включая образование антитела к иммуногенному пептидному антигену, прежде всего образование антитела к иммуногенному антигену, присутствующему в форме надмолекулярной антигенной конструкции, более предпочтительно антитела, предлагаемого в настоящем изобретении и описанного выше.
В следующем варианте осуществления изобретения другая биологически активная субстанция или соединение может представлять собой также терапевтический агент, который можно применять для лечения заболеваний и нарушений, которые вызываются или ассоциированы с амилоидом или амилоидоподобными белками, включая амилоидоз, вызываемый амилоидом β, или их можно применять для медикаментозного лечения других неврологических нарушений.
Другая биологически активная субстанция или соединение может обладать биологическим действием, опосредуемым таким же или сходным механизмом, что и терапевтическая вакцина, предлагаемая в изобретении, или обладать неродственным механизмом действия или сочетанием родственных и/или неродственных механизмов действия.
Как правило, другое биологически активное соединение может представлять собой энхансеры нейтронной трансмиссии, психотерапевтические лекарственные средства, ингибиторы ацетилхолинэстеразы, блокаторы кальциевых каналов, биогенные амины, транквилизаторы на основе бензодиазепинов, усилители синтеза, накопления или высвобождения ацетилхолина, агонисты постсинаптического рецептора ацетилхолина, ингибиторы моноаминоксидазы-А или -В, антагонисты рецептора N-метил-D-аспартатглутамата (NMDA), нестероидные противовоспалительные лекарственные средства, антиоксиданты и антагонисты серотонергического рецептора.
В частности, смесь, предлагаемая в изобретении, может содержать по меньшей мере одно другое биологически активное соединение, выбранное из группы, включающей соединения против окислительного стресса, антиапоптозные соединения, хелаты металлов, ингибиторы репарации ДНК, такие как пирензепин и метаболиты, 3-амино-1-пропансульфоновую кислоту (3APS), 1,3-пропандисульфонат (1,3PDS), активаторы секретаз, ингибиторы β- и γ-секретаз, tau-белки, нейромедиатор, разрушители β-складчатой конформации, противовоспалительные молекулы или ингибиторы холинэстеразы (ChEI), такие как такрин, ривастигмин, донепезил и/или галантамин, и другие лекарственные средства и пищевые добавки, в сочетании с терапевтической вакциной, предлагаемой в изобретении, и необязательно фармацевтически приемлемым носителем, и/или разбавителем, и/или эксципиентом.
Согласно еще одному варианту осуществления изобретения смеси, предлагаемые в изобретении, могут содержать ниацин или мемантин в сочетании с терапевтической вакциной, предлагаемой в изобретении, и необязательно фармацевтически приемлемым носителем, и/или разбавителем, и/или эксципиентом.
Еще одним вариантом осуществления изобретения являются смеси, которые содержат «атипичные антипсихотические средства», такие, например, как клозапин, зипрасидон, рисперидон, арипипразол или оланзапин, предназначенные для лечения позитивных или негативных психотических симптомов, включая галлюцинации, бред, нарушения мышления (проявляющиеся в выраженной непоследовательности действий, психическом расстройстве, расстройстве ассоциативного мышления) и эксцентричное или неорганизованное поведение, а также ангедонию, пониженную эмоциональную реакция, апатию и отказ от общества, в сочетании с терапевтической вакциной, предлагаемой в изобретении, необязательно фармацевтически приемлемым носителем, и/или разбавителем, и/или эксципиентом.
В конкретных вариантах осуществления изобретения композиции и смеси, предлагаемые в изобретении и описанные выше, содержат вакцину, предлагаемую в изобретении, и биологически активную субстанцию соответственно в терапевтически или профилактически эффективном количестве.
Другие соединения, которые можно применять в смесях в сочетании с вакциной, предлагаемой в изобретении, описаны, например, в WO 2004/058258 (см. прежде всего сс.16 и 17), включая мишени терапевтических лекарственных средств (сс.36-39), алкансульфоновые кислоты и алкансерную кислоту (сс.39-51), ингибиторы холинэстеразы (сс.51-56), антагонисты NMDA-рецептора (сс.56-58), эстрогены (сс.58-59), нестероидные противовоспалительные лекарственные средства (сс.60-61), антиоксиданты (сс.61-62), агонисты рецепторов, активируемых пероксисомальными пролифераторами (PPAR) (сс.63-67), агенты, понижающие уровень холестерина (сс.68-75); ингибиторы амилоида (сс.75-77), ингибиторы образования амилоида (сс.77-78), хелаторы металлов (сс.78-79), антипсихотические средства и антидепрессанты (сс.80-82), пищевые добавки (сс.83-89) и соединения, повышающие доступность биологически активных субстанций в головном мозге (см. сс.89-93) и пролекарства (сс.93 и 94), указанный документ включен в настоящее описание в качестве ссылки, но прежде всего соединения, упомянутые на указанных выше страницах.
В настоящее время известно, что вакцинация животного- или человека-хозяина белком здорового хозяина может приводить к производству аутоантител к белку хозяина, что приводит к нарушениям, которые называют в целом аутоиммунными нарушениями. Aβ и его белок-предшественник АРР представляют собой такие белки здорового хозяина. Таким образом, применение указанных белков хозяина для вакцинации потенциально может приводить к возникновению нежелательных побочных действий. Из литературы известны данные о том, что Aβ может активировать нейровоспалительный ответ, который частично может вызываться сверхактивацией системы комплемента, который уже является высокоактивированным у пациентов, страдающих болезнью Альцгеймера или другими нейродегенеративными заболеваниями.
Человеческий Aβ в его β-складчатой конформации представляет собой сильный активатор человеческой системы комплемента. Он связывается с высокой аффинностью с коллагеновым хвостом человеческого комплемента C1q. Сверхактивация системы комплемента может приводить к переориентации естественной защитной системы хозяина и приводить к самоуничтожению клеток и тканей, включая нейроны и их процессинг. Например, мембраноатакующий комплекс (MAC), который является частью естественной защитной системы хозяина и защищает хозяина от внедряющихся в его организм бактерий и вирусов путем встраивания его самого в бактерии и вирусы, при сверактивации может сам встраиваться в клетки хозяина и вызывать самоуничтожение. Сверхактивация может приводить также к стимуляции микроглии к производству токсических веществ, таких как свободные кислородные радикалы и оказывающие вредное воздействие протеазы.
Таким образом, еще одним объектом настоящего изобретения является предупреждение возможных побочных действий, таких как неврологические осложнения, вызываемые вакцинацией животного или человека, который страдает аутоиммунным заболеванием, вызываемым аутоантигеном, который может дополнительно стимулировать уже сверхактивированную систему комплемента. Согласно настоящему изобретению для этой цели можно вводить антиген, представляющий собой Aβ-пептид, в частности антиген, представляющий собой пальмитоилированный Aβ-пептид, более предпочтительно антиген, представляющий собой пальмитоилированный Aβ1-15-пептид, но прежде всего антиген, представляющий собой пальмитоилированный Aβ1-15-пептид (ACI-24, Aβ1-15), в сочетании с ингибитором комплемента.
Таким образом, следующим вариантом осуществления изобретения является композиция вакцины, содержащая помимо антигена, представляющего собой Aβ-пептид, прежде всего антигена, представляющего собой Aβ-пептид, предлагаемый в изобретении и описанный выше; ингибитор системы комплемента.
Ингибитор комплемента может представлять собой соединение, выбранное из группы, включающей растворимый рецептор 1 человеческого комплемента, антитело к белку С5 человеческого комплемента, такое, например, как гуманизированное моноклональное антитело к С5 или одноцепочечный фрагмент гуманизированного моноклонального антитела, ингибитор-N С1-эстеразы и встречающийся в естественных условиях человеческий ингибитор С1.
В настоящее время придается значение взаимосвязи между Aβ и заболеваемости цереброваскулярными заболеванием, связи между Aβ и атеросклерозом, с когнитивным нарушением, ассоциированным с амилоидной ангиопатией, важной патологией микрососудов головного мозга и дефицитом клиренса Aβ через гематоэнцефалический барьер при болезни Альцгеймера, все эти данные свидетельствуют о том, что сосудистое нарушение является важной особенностью хронического нейродегенеративного состояния при болезни Альцгеймера (Zlokovic, В., Trends in Neurosciences 28, 2005, сс.202-208). Таким образом, нейроваскулярная дисфункция может играть важную роль в патогенезе болезни Альцгеймера.
Имеется достаточное количество данных о выраженной ассоциации между снижением умственных способностей при болезни Альцгеймера и цереброваскулярным нарушением (Torre de la, J. С., Neurol. Res. 26, 2004, сс.517-524, Gorelick Р.В., Stroke 35, 2004, сс.2620-2622). При болезни Альцгеймера описано наличие пониженной плотности микрососудов, повышенного количества фрагментированных сосудов, заметно измененного диаметра сосудов и т.д. (Bailey Т.L. и др, Neurol. Res. 26, 2004, сс.573-578, Farkas E. и Luiten P.G., Prof. Neurobiol. 64, 2001, сс.575-611).
В нескольких исследованиях, в том числе в роттердамском исследовании, проведенном на большой популяции (Greenberg S. М. и др. Stroke 35, 2004, сс.2616-2619), установлено, что сосудистые факторы риска могут быть ответственны за снижение умственных способностей в престарелом возрасте, приводя к так называемой «сосудистой деменции». Некоторые факторы риска болезни Альцгеймера и сосудистой деменции перекрываются, включая кратковременные ишемические приступы, атеросклероз, сердечно-сосудистое заболевание, высокую вязкость сыворотки и т.д.
Сосудистая деменция является следствием повреждения ткани головного мозга в результате кислородной недостаточности из-за суженных или блокированных кровеносных сосудов в головном мозге, и она представляет собой вторую наиболее часто встречающуюся форму деменции. Пациенты часто страдают как болезнью Альцгеймера, так и сосудистой деменцией. Установлено, что 1,7 миллиона человек в Евросоюзе и 55000 человек в США страдают сосудистой деменцией.
Лечение, направленное на восстановление нормального давления O2 в головном мозге, несмотря на нарушение кровотока, является перспективным с позиций существенного воздействия на развитие болезни Альцгеймера и на снижение выраженной сосудистой деменции.
Таким образом, еще одним вариантом осуществления изобретения является композиция вакцины, которая содержит помимо антигена, представляющего собой Aβ-пептид, прежде всего антигена, представляющего собой Aβ-пептид, предлагаемый в изобретении и описанный выше, соединение, которое индуцирует процесс снижения аффинности O2/гемоглобина, в результате чего кислород постепенно высвобождается в тканях органа.
В частности, соединение, модулирующее аффинность O2/гемоглобина, можно выбирать из группы, включающей антилипидемическое лекарственное средство, такое, например, как клофибриновая кислота или безафибрат, включая производные безафибрата LR16 и L35, производные мочевины, такие, например, как [2-[4[[(ариламино)карбонил]амино]фенокси]-2-метилпропионовая кислота, аллостерический эффектор гемоглобина, такой, например, как 2,3-дифосфоглицерат (DPG), инозитгексакисфосфат (IHP) и пиридоксалфосфат.
Более конкретно, соединение, модулирующее аффинность O2/гемоглобина, может представлять собой соединение, содержащее анионный лиганд для аллостернического сайта гемоглобина, где анионный лиганд содержит внутреннее пирофосфатное кольцо необязательно в сочетании с нетоксичным катионом.
Еще более предпочтительно соединение, модулирующее аффинность O2/гемоглобина, представляет собой производное инозитгексафосфата (IHP), содержащее по меньшей мере одно внутреннее пирофосфатное кольцо необязательно в сочетании с нетоксичным катионом.
Для обеспечения благоприятных воздействий ингибитора комплемента и соединения, модулирующего аффинность O2/гемоглобина, в отношении облегчения потенциально вредных воздействий сверхактивированной системы комплемента и цереброваскулярных нарушений соответственно, в настоящем изобретении предложена композиция вакцины, которая содержит антиген, представляющий собой Aβ-пептид, прежде всего антиген, представляющий собой Aβ-пептид, предлагаемый в изобретении и описанный выше, в комбинации с ингибитором системы комплемента и соединения, модулирующего аффинность O2/гемоглобина, прежде всего аллостерическим эффектором гемоглобина.
Композицию вакцины, предлагаемой в изобретении, которая содержит антиген, представляющий собой Aβ-пептид, прежде всего антиген, представляющий собой Aβ-пептид, предлагаемый в изобретении и описанный выше, можно вводить одновременно, поочередно или последовательно с ингибитором комплемента и соединением, модулирующим аффинность O2/гемоглобина, для облегчения потенциально вредных воздействий сверхактивированной системы комплемента и цереброваскулярных нарушений соответственно. Например, композицию вакцины, предлагаемую в изобретении, можно вводить одновременно с ингибитором комплемента или последовательно после или до введения вакцины. Если выбрана схема применения, при использовании которой ингибитор комплемента и соединение, модулирующее аффинность O2/гемоглобина, прежде всего аллостерический эффектор гемоглобина, вводят в сочетании по меньшей мере с одной вакциной, предлагаемой в изобретении, то соединения или субстанции можно частично вводить одновременно, частично последовательно в различных комбинациях.
Следующим объектом настоящего изобретения являются смеси вакцины, предлагаемой в изобретении, и ингибитора комплемента и/или соединения, модулирующего аффинность O2/гемоглобина, прежде всего аллостерического эффектора гемоглобина, а также способы применения вакцины, предлагаемой в изобретении, или ее смесей, включая композиции, которые содержат вакцины или смеси вакцин, предлагаемых в и изобретении, и ингибитора комплемента и соединения, модулирующего аффинность O2/гемоглобина, прежде всего аллостерического эффектора гемоглобина, для предупреждения, и/или терапевтического лечения, и/или облегчения воздействий амилоидозов, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна.
Модифицированный амилоидный 1-15-пептид можно синтезировать с помощью метода, описанного у Nicolau и др., Рrос Natl. Acad. Sci USA 99, 2002, сс.2332-2337. Подход, описанный у Nicolau с соавторами, включает модификацию антигенного пептида путем осуществления прививки на смоле липофильного или гидрофобного фрагмента с концевыми аминокислотными остатками ранее полученного пептида. В частности, защищенную аминокислоту, прежде всего защищенную с помощью Fmoc аминокислоту, присоединяют к смоле с помощью известной химии сочетания. Защитную группу удаляют и сшивают со вторым защищенным аминокислотным остатком. Затем применяют стандартный автоматический пептидный синтез с использованием известной процедуры химической защиты, в частности Fmoc/tBu-химии, и стандартных защитных групп боковых цепей для синтеза антигенного Aβ-пептида, прежде всего антигенного Aβ1-15-пептида, путем сочетания аминокислот 1-15 амилоидного белка Aβ1-42 с получением пептидного фрагмента, последовательность которого представлена в SEQ ID NO:1. На конечной стадии для удлинения пептидного фрагмента связывают две дополнительные аминокислоты. Затем Mtt-группы можно избирательно расщеплять и сшивать с пальмитиновой кислотой. После промывки смолы защитную группу удаляют и смолу одновременно расщепляют с последующим удалением защитных групп боковых цепей с помощью стандартной методологии. После этого получают конечный продукт высокой чистоты и его идентичность подтверждают известными в данной области методами, такими, например, как масс-спектрометрия с использованием электроспрея.
Липофильный или гидрофобный фрагмент, предлагаемый в настоящем изобретении, может представлять собой жирную кислоту, триглицерид или фосфолипид, где углеродный каркас жирной кислоты содержит по меньшей мере 10 атомов углерода. В частности, липофильный или гидрофобный фрагмент представляет собой жирную кислоту, углеродный каркас которой содержит по меньшей мере примерно 14 атомов углерода и вплоть до примерно 24 атомов углерода, при этом под объем настоящего изобретения подпадает вариант с каждым индивидуальным количеством атомов углерода в указанном диапазоне. Более конкретно липофильный или гидрофобный фрагмент имеет углеродный каркас, состоящий по меньшей мере из 14 атомов углерода, но более предпочтительно из 16 атомов углерода. Примерами гидрофобных фрагментов являются (но не ограничиваясь ими) пальмитиновая кислота, стеариновая кислота, миристиновая кислота, лауриновая кислота, олеиновая кислота, линолевая кислота и линоленовая кислота. В конкретном варианте осуществления настоящего изобретения липофильный или гидрофобный фрагмент представляет собой пальмитиновую кислоту.
Затем можно получать липосомные антигены, предлагаемые в изобретении, согласно методу, описанному у Nicolau и др., 2002. Модифицированный антигенный амилоидный Aβ-пептид, прежде всего модифицированный антигенный Aβ1-15-пептид, можно реконструировать в конструкции, состоящей из липосом, прежде всего липосом на основе димиристоилфосатидиохолина (DMPC), димиристоилфосфатидилэтаноламина (DMPEA), димиристоилфосфатидилглицерина (DMPG) и холестерина, необязательно содержащих монофосфорильный липид А.
В конкретном варианте осуществления изобретения липосомы с добавлением липида А применяют в качестве адъюванта для приготовления противоамилоидной вакцины. Димиристоилфосфатидилхолин, - глицерин и холестерин смешивают, в частности, в молярном соотношении 0,9: 1,0: 0,7. Затем добавляют сильный иммуномодулятор, такой, например, как монофосфорильный липид А, в приемлемой концентрации, прежде всего в концентрации от 30 до 50 мг на ммоль, более предпочтительно 40 мг на ммоль фосфолипидов. Затем добавляют модифицированный антигенный Aβ-пептид в молярном соотношении пептида и фосфолипидов от 1:30 до 1:200, прежде всего в молярном соотношении от 1:50 до 1:120, более предпочтительно 1:100. Растворители удаляют, например, выпариванием и образовавшуюся пленку гидрируют стерильным буферным раствором, таким как ЗФР.
Липосомы можно получать также методом инъекции в перекрестном потоке, который описан, например, у Wagner и др., Journal of Liposome Research т.12(3), 2002, сс.259-270. При инъекции липидных растворов в водной буферной системе липиды имеют тенденцию образовывать «осадки (преципитаты)» с последующей самоагрегацией в пузырьки. Размер полученных пузырьков зависит от таких факторов, как концентрация липида, скорость перемешивания, скорость инъекции и выбор липидов. Предназначенная для получения система может состоять из модуля для инъекции в перекрестном потоке, емкостей для полярной фазы (например, раствор ЗФР-буфера), емкости для этанольного/липидного раствора и устройства для создания давления, но прежде всего устройство для создания давления азота. В то время как водный или полярный раствор нагнетают насосом через модуль для перекрестной инъекции, этанольный/липидный раствор инъецируют в полярную фазу с помощью различных величин прилагаемого давления.
Для определения иммуногенности антигенной конструкции на основе модифицированного Aβ выбирают приемлемое животное, выбранное из группы, включающей мышей, крыс, кроликов, свиней, птиц и т.д., но предпочтительно мышей, прежде всего мышей линии C57BL/6, иммунизированных антигенным пептидом. Иммуногенность антигенной конструкции определяют путем зондирования образцов сыворотки через определенные интервалы времени после иммунизации с помощью иммуноанализа, такого, например, как ELISA.
Модифицированную антигенную конструкции, прежде всего пальмитоилированную антигенную конструкцию и более предпочтительно пальмитоилированную Aβ1-15-конструкцию, применяют для иммунизации животного, прежде всего млекопитающего или человека, страдающего симптомами, связанными с амилоидозом, группой заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона; а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, но прежде заболеванием или состоянием, которое характеризуется утратой когнитивной способности к запоминанию, таким, например, как умеренное ухудшение когнитивной способности (MCI) или любое другое ассоциированное с амилоидом заболевание.
Надмолекулярную антигенную конструкцию, предлагаемую в настоящем изобретении, но прежде всего композицию вакцины, которая содержит надмолекулярную антигенную конструкцию, предлагаемую в изобретении, вводят животному, прежде всего млекопитающему или человеку, с помощью любого стандартного пути введения. Как правило, композицию можно вводить с использованием местного, орального, ректального, назального или парентерального (например, внутривенного, подкожного или внутримышечного) пути введения. Кроме того, композицию можно включать в обеспечивающие замедленное высвобождение матрицы, например, из биоразложимых полимеров, полимеры можно имплантировать в область, в которую требуется осуществлять введение, например в область опухоли. Метод предусматривает введение однократной дозы, введение повторных доз с предварительно установленными временными интервалами и пролонгированное введение в течение предварительно определенного периода времени.
В конкретном варианте осуществления изобретения антигенную конструкцию, предлагаемую в изобретении, прежде всего композицию вакцины, которая содержит антигенную конструкцию в фармацевтически приемлемой форме, вводят в виде повторяющихся доз, прежде всего 1-15 доз, более предпочтительно 2-10 доз, более предпочтительно 3-7 доз и еще более предпочтительно 4-6 доз, с временными интервалами, составляющими 1-10 недель, прежде всего с временными интервалами, составляющими 1-6 недель, более предпочтительно с временными интервалами, составляющими 1-4 недели и еще более предпочтительно с временными интервалами от 2 до 3 недель. Иммунный ответ оценивают в полученных образцах сыворотки через приемлемый промежуток времени после ревакцинации, прежде всего через 3-10 дней после ревакцинации, более предпочтительно через 4-8 дней после ревакцинации и более предпочтительно через 5-6 дней после ревакцинации, и определяют иммуногенность антигенной конструкции с помощью известной методологии, прежде всего с помощью одного из обычно применяемых иммуноанализов, таких, например, как ELISA.
Иммунизация антигенной конструкцией, предлагаемой в изобретении, но прежде всего композицией вакцины, которая содержит антигенную конструкцию, предлагаемую в изобретении, в фармацевтически приемлемой форме, приводит к выраженному и высокоспецифическому иммунному ответу у обработанного животного или человека.
Композиции, содержащие надмолекулярную антигенную конструкцию, предлагаемую в настоящем изобретении, вводят человеку или животному для индукции иммунитета к антигенным агентам, таким как инфекционные организмы, или к антигенным аспектам других патологических состояний, таким как агрегация β-амилоида (болезнь Альцгеймера), или гиперпролиферативные нарушения, такие как рак. У иммунизированного человека или животного вырабатываются поступающие в кровоток антитела против инфекционного организма, тем самым снижая или инактивируя его способность стимулировать болезнь.
Композиции, предлагаемые в настоящем изобретении, можно применять также для получения антител против антигенных пептидов. Полученные антитела вводят индивидуумам с целью их пассивной иммунизации против различных заболеваний или нарушений, включая (но не ограничиваясь ими) заболевания, ассоциированные с амилоидным белком.
Так, согласно конкретному варианту осуществления изобретения композиции, которые содержат надмолекулярные антигенные конструкции, предлагаемые в настоящем изобретении, применяют для получения панели моноклональных или поликлональных антител, специфических в отношении различных нарушений, включая, например, болезнь Альцгеймера. Антитела получают методами, хорошо известными обычным специалистам в данной области.
Композиции, предлагаемые в настоящем изобретении, вводят человеку или животному любыми соответствующими путями, предпочтительно с помощью инъекции. Например, модифицированный антигенный пептид, реконструированный в липосомах, вводят с помощью подкожной инъекции. Вне зависимости от того, образовались ли антитела внутри организма или получены из внешнего источника, находящиеся в кровотоке антитела связываются с антигеном и снижают или инактивируют его способность стимулировать болезнь.
В определенных вариантах осуществления изобретения надмолекулярные антигенные конструкции сдержат пептид, который имеет аминокислотную последовательность β-амилоида. Пептиды могут содержать также или соответствовать целому пептиду амилоида-бета и его активному фрагменту. Кроме того, пептиды, которые применяют согласно настоящему изобретению, дополнительно содержат Aβ.
Предложен также способ получения антитела, включая любое функционально эквивалентное антитело или его функциональны фрагмент, предлагаемый в изобретении, заключающийся в выработке антител, но прежде всего моноклональных антител к надмолекулярной антигенной конструкции, которая содержит антигенный пептид, соответствующий аминокислотной последовательности антигенного Aβ-пептида, предлагаемого в изобретении и описанного выше, но прежде всего антигенного Aβ1-16(Δ15)-пептида, более предпочтительно антигенного Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептида, еще более предпочтительно антигенного Aβ1-14-пептида, но особенно предпочтительно β-амилоидного Aβ1-15-пептида, модифицированного с помощью гидрофобных фрагментов, таких, например, как пальмитиновая кислота, или гидрофильного фрагмента, такого, например, как полиэтиленгликоль (ПЭГ), или с помощью комбинации обоих указанных агентов, где гидрофобный и гидрофильный фрагмент соответственно ковалентно связывают с каждым концом антигенного пептида по меньшей мере через одну, прежде все 1 или 2 аминокислоты, сшитые с концевым аминокислотным остатком на каждом конце антигенного пептида, таким, например, как лизин или любая другая приемлемая аминокислота или аналог аминокислоты, который может служить в качестве связующего элемента для сочетания гидрофобного и гидрофильного остатка с пептидным фрагментом, такая, например, как глутаминовая кислота и цистеин.
Антитело, прежде всего моноклональное антитело, получаемое с помощью указанного метода, обладает способностью при введении животному, прежде всего млекопитающему или человеку, страдающему нарушением памяти, сохранять или повышать когнитивную способность к запоминанию обработанного животного, млекопитающего или человека. Таким образом, еще одним объектом изобретения является антитело, включая любое функционально эквивалентное антитело или его функциональный фрагмент, предлагаемый в изобретении, которые образовались против надмолекулярной антигенной конструкции, которая содержит антигенный пептид, соответствующий аминокислотной последовательности антигенного Aβ-пептида, предлагаемого в изобретении и описанного выше, но прежде всего антигенного Aβ1-16(Δ15)-пептида, более предпочтительно антигенного Aβ1-16(Δ14)- или Aβ1-16(Δ13)-пептида, еще более предпочтительно антигенного Aβ1-14-пептида, но особенно предпочтительно β-амилоидного Aβ1-15-пептида, модифицированного с помощью гидрофобных фрагментов, таких, например, как пальмитиновая кислота, или гидрофильного фрагмента, такого, например, как полиэтиленгликоль (ПЭГ), или с помощью комбинации обоих указанных агентов, где гидрофобный и гидрофильный фрагмент соответственно ковалентно связывают с каждым концом антигенного пептида с помощью аминокислоты, такой, например, как лизин или любая другая приемлемая аминокислота или аналог аминокислоты, который может служить в качестве линкерной молекулы. Когда в качестве гидрофильного фрагмента применяют ПЭГ, то свободные концы ПЭГ ковалентно связывают с фосфатидилэтаноламином или любым другим соединением, которое может функционировать в качестве «заякоривающего» элемента, предназначенного для закрепления антигенной конструкции в бислое липосомы.
Примеры
Пример 1: Синтез антигенного тетра(пальмитоилизин)-Aβ1-15-пептида
Протокол синтеза 1:
Пальмитоилированный амилоидный 1-15-пептид синтезировали с помощью усовершенствованного описанного ранее метода (Nicolau и др., 2002). Указанный новый подход включает прививку на смоле пальмитиновой кислоты с концевыми остатками Lys ранее полученного пептида вместо ступенчатого твердофазного синтеза, посредством которого включают модифицированную аминокислоту Fmoc (9-флуоренилметоксикарбонил)-Lys(Pal)-ОН. Этот новый подход увеличивает эффективность сочетания и позволяет получать продукт существенно более высокой чистоты. Так, ортогонально защищенную аминокислоту Fmoc-Lys(Mtt)-OH присоединяли к смоле Ванга с помощью синтеза, основанного на сочетании с использованием ГБТУ [гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония]. Fmoc-группу удаляли помощью 20%-ного пиперидина в ДМФ и осуществляли сочетание с вторым остатком Fmoc-Lys(Mtt)-OH. Затем общепринятый автоматический пептидный синтез с использованием Fmoc/tBu-химии и общепринятые защитные группы боковых цепей применяли для сочетания следующих 15 аминокислот. И, наконец, осуществляли сочетание последних двух аминокислот Fmoc-Lys(Mtt)-ОН. Затем Mtt-группы избирательно расщепляли с помощью 1% трифторуксусной кислоты (ТФК) в дихлорметане и после этого осуществляли сочетание с пальмитиновой кислотой с использованием ГБТУ. После промывки смолы Fmoc-групп удаляли с помощью 20%-ного пиперидина в N,N-диметилформамида (ДМФ) и одновременно окончательно расщепляли смолу, и удаление защитных групп боковых цепей осуществляли с помощью ТФК в стандартных условиях. После растирания в холодном простом диэтиловом эфире получали продукт в виде твердого вещества белого цвета. С помощью масс-спектрометрии с использованием электроспрея подтверждали идентичность продукта (ожидаемая величина m/z: 1097,9 ([М]3+); обнаруженная: 1096,8 ([М-3H]3+), при этом не обнаружено никаких других три-, ди- или монопальмитоилированных пептидов.
Протокол синтеза 2:
Можно использовать другой подход для синтеза антигенного тетра(пальмитоиллизин)-Aβ1-15-пептида, основанный на прививке на смоле пальмитиновой кислоты с концевыми остатками лизина ранее полученного пептида. Так, осуществляли сочетание на 2-хлортритильной смоле ортогонально защищенной аминокислоты Fmoc-Lys(ivDde)-OH. После удаления защитной группы Fmoc осуществляли сочетание второго остатка Fmoc-Lys(ivDde)-OH с последующим проведением 15 циклов общепринятого автоматического пептидного синтеза с использованием Fmoc/tBu-химии и общепринятых защитных групп боковых цепей. После сочетания двух последних остатков Fmoc-Lys(ivDde)-OH Fmoc-группу удаляли, используя 20%-ный пиперидин в ДМФ, а N-конец защищали Boc-группой с использованием трет-бутилдикарбоната. Затем хемоселективно удаляли защитные группы ivDde путем обработки 3%-ным гидразином в ДМФ и после этого осуществляли сочетание пальмитиновой кислоты с указанными четырьмя остатками лизина с помощью ГБТУ, используя две реакции сочетания, продолжительностью 18 ч каждая. После отмывки смолы защитные группы боковых цепей удаляли с помощью ТФК/TIPS в стандартных условиях. После растирания в холодном простом диэтиловом эфире получали продукт в виде твердого вещества белого цвета. С помощью MALDI-Tof подтверждали идентичность продукта, при этом не было обнаружено никаких других три-, ди- или монопальмитоилированных пептидов.
Липосомные вакцины получали с помощью метода, описанного в US 6843942 и ЕР 1337322.
Пример 2: Синтез антигенного несущего N- и С-концевой липид-ПЭГ β-амилоидного пептида
Пальмитоилирование, создающее якорь для пептида в бислое липосомы благодаря относительно невысокой длине остатка C16:0-жирной кислоты, приводит к тому, что пептид практически простирается на поверхности липосомы. Вследствие этого клетки, процессирующие антиген, должны презентовать всю липосому с пептидом, что может приводить к относительно медленному иммунному ответу.
С целью усиления иммунного ответа для реконструкции пептида в липосоме применяли другой якорь/спейсер, например полиэтиленгликоль (ПЭГ). ПЭГ присоединяли с помощью ковалентной связи к обоим концам пептида. Другой конец цепи (ПЭГ, n=70) ковалентно связывали с фосфатидилэтаноламином (PEA), функционирующим в качестве элемента для «заякоривания» в бислое липосомы. Таким образом, липосома начинала функционировать в качестве адъюванта, и пептид, находясь на достаточном удалении от бислоя, мог процессироваться индивидуально, и это повышало его иммуногенность по сравнению с пальмитоилированным антигеном.
Методики монопэгилирования пептидов в N-α-положении известны и широко используются. Также описано сайтспецифическое монопэгилирование внутренних, N- или C-концевых аминокислотных остатков пептидов средней длины с использованием либо твердофазного метода синтеза, либо метода, основанного на прививке пептида.
Для того, чтобы избежать проблем, связанных со стерической помехой, реакцию осуществляли в жидкой фазе. Этот дающий преимущество поход включает синтез пептидных последовательностей с использованием стандартной защиты боковых цепей аминокислот с помощью Fmoc/tBu. Для пептидных последовательностей, которые содержат внутри цепи остатки Lys или His (1-16, 1-15), к каждому концу добавляли ортогонально защищенный Lys(ivDde). Дополнительный Gly добавляли к С-концу для облегчения синтеза. Fmoc-группу удаляли с помощью 20%-ного пиперидина в ДМФ и осуществляли N-ацетилирование с помощью уксусного ангидрида. Для избирательного расщепления ivDde-групп использовали обработку 3%-ным гидратом гидразина в ДМФ в течение 1 ч. Для этой цели 2-хлортритильная смола является более предпочтительной по сравнению с более широко применяемой смолой Ванга, поскольку она является существенно более устойчивой к гидразинолизу. Кроме того, 2-хлортритильная смола обладает очень высокой чувствительностью к кислотам и в результате, в отличие от смолы Ванга, позволяет осуществлять выделение защищенных пептидов. Естественно, необходимо осуществлять реакцию сочетания в фазе раствора, поскольку сочетание связанного со смолой пептида с предварительно активированным пэгилированным липидным реагентом DSPE-ПЭГ-SPA не приводит к получению какого-либо продукта сочетания. Таким образом, избирательное отщепление от смолы в мягких условиях (уксусная кислота/трифторэтанол/дихлорметан, 1:1:8, 1 ч, КТ) позволяло получать пептиды с внутренними защитными группами.
Реакции сочетания в фазе раствора позволяли успешно получать пептид, выведенный из последовательности 1-16, 1-15, с использованием DSPE-ПЭГ-SPA в ДМСО и избытка основания. Затем реакции прекращали, добавляя избыток этаноламина в течение 2 ч, и раствор лиофилизировали.
После очистки с помощью ЖХВР (полупрепаративная, с обращенной фазой, колонка C4) получали N- и C-концевые конъюгаты ПЭГ-липид, имеющие чистоту 50-70%, идентичность которых подтверждали с помощью MALDI. Для каждой последовательности обнаружены существенные вариации с позиций легкости осуществления реакции сочетания и условий, которые соответственно регулировали (температура, количество молярных эквивалентов DSPE-ПЭГ-SPA, продолжительность). Для удаления избытка DSPE-ПЭГ-SPA из требуемого продукта применяли очистку с помощью ЖХВР. Разделение продуктов, полученных в результате одного и двух сочетаний, перед конечной стадией удаления защитных групп можно осуществлять с помощью катионообменной хроматографии. Последующее удаление защитных групп боковой цепи и отделение избытка DSPE-ПЭГ-SPA после прекращения реакции позволяло выделять требуемые конъюгаты с достаточной степенью чистоты.
Пэгилированные и пальмитоилированные антигены
Aβ1-15 (ACI-24)
H2N-Lys-Lys-Asp(OtBu)-Ala-Glu(OtBu)-Phe-Arg(Pbf)-His(Trt)-Asp(OtBu)-Ser(tBu)-Gly-Tyr(tBu)-Glu(OtBu)-Val-His(Trt)-His(Trt)-Gln(Trt)-Lys(Boc)-Lys-Lys-ОН
Aβ1-16 (ACI-01)
Ac-Lys-Asp(OtBu)-Ala-Glu(OtBu)-Phe-Arg(Pbf)-His(Trt)-Asp(OtBu)-Ser(tBu)-Gly-Tyr(tBu)-Glu(OtBu)-Val-His(Trt)-His(Trt)-Gln(Trt)-Lys(Boc)-Lys-Gly-OH
Aβ1-16(Δ14) (ACI-02)
Ac-Lys-Asp(OtBu)-Ala-Glu(OtBu)-Phe-Arg(Pbf)-His(Trt)-Asp(OtBu)-Ser(tBu)-Gly-Tyr(tBu)-Glu(OtBu)-Val-His(Trt)-Gln(Trt)-Lys(Boc)-Lys-Gly-OH
Aβ22-35 (ACI-11)
Ac-Lys-Glu(OtBu)-Asp(OtBu)-Val-Gly-Ser(tBu)-Asn(Trt)-Lys(Boc)-Gly-Ala-Ile-Ile-Gly-Leu-Met-Lys-Gly-OH
Aβ29-40 (ACI-12)
Ac-Lys-Gly-Ala-Ile-Ile-Gly-Leu-Met-Val-Gly-Gly-Val-Val-Lys-Gly-OH
Пример 3: Структурный и конформационный анализ
3.1 Анализ конформации реконструированного антигена
Для «заякоривания» антигена Aβ1-15 на поверхности липосомы применяли описанный ранее тандем пальмитоилированного лизина на каждом конце пептида (Nicolau С. и др., 2002).
Установлено, что среди жирных кислот пальмитиновая кислота, содержащая 16 атомов углерода, имеет длину, приемлемую для стабильного встраивания в бислой липосомы. В такой конструкции пептид практически простирается на поверхности липосомы в результате длины остатка C16-жирной кислоты. С целью создания антигенного пептида, ассоциированного с липосомой-липидом А в другой конформации, применяли другой якорь/спейсер для реконструирования пептида Aβ1-16 (ACI-01) в липосомах, а именно полиэтиленгликоль (ПЭГ с 77 повторяющимися звеньями). Влияние спейсера между липосомным якорем и Aβ-пептидом на вторичную конформацию последовательности амилоида, реконструированного в липосомах, оценивали количественно с помощью кругового дихроизма (CD) (фиг.1а). Пэгилированный Aβ1-16, по-видимому, имеет конформацию белка в виде произвольной спирали или неструктурированную конформацию (отрицательный сигнал при 210 нм и медленное приближение сигнала к оси абсцисс вплоть до 260 нм), в то время как пальмитоилированный пептид Aβ1-15 содержит значительную долю пептида в β-складчатой конформации (положительный сигнал вплоть до 210 нм, пересечение оси абсцисс и затем вновь приближение к ней вплоть до 260 нм). Таким образом, можно предположить, что непосредственная близость пальмитоилированного пептида к поверхности липосомы может обеспечивать определенную вторичную конформацию. Она, возможно, является результатом электростатических взаимодействий пептида с поверхностью липосомы, что, по-видимому, невозможно в случае пэгилированого пептида.
3.2 Структурный анализ пальмитоилированного β-амилоида 1-15, реконструированного в липосомах
Для анализа воздействия различных линкерных молекул на конформацию β-амилоидного пептида 1-15, реконструированного в липосомах, осуществляли ЯМР-анализ (фиг.1б и 1в). Для этой цели пальмитиновую кислоту и полиэтиленгликоль (ПЭГ, n=77) соответственно использовали в качестве линкерной молекулы или якоря для присоединения к липосоме.
Для ЯМР-исследований образцы, содержащиее пальмитоилированный амилоидный пептид 1-15 (ACI-24) и антиген, представляющий собой Aβ1-16-пептид (ACI-01), реконструированные в липосомах, гомогенизировали путем встряхивания и концентрацию раствора повышали центрифугированием (3000 об/мин, 3×90 мин при 4°C) и образовавшийся дебрис во влажном состоянии переносили в MAS-роторы. Дополнительные образцы приготавливали путем суспендирования препаратов пептидов ACI-01 и ACI-24 в концентрации 1М в ЗФР-буфере при рН 7,2, а также в виде 4 мМ раствора пептидной последовательности без линкера в таком же буфере. В каждый образец добавляли 10% D2O.
1H-HR-MAS ЯМР-спектры регистрировали с помощью спектрометра Bruker Avance 500, работающего при частоте 500,13 МГц (11,4Т), снабженного 4-милимметровым трехрезонансным (1H/13C/2Н) HR-MAS-зондом. Каждый образец вводили в 4-миллиметровых ZrO2-роторах, заполненных 50 мкл цилиндрическими вкладышами. Для всех ЯМР-исследований образцы вращали при частоте, равной спектральной ширине (6250 Гц), что позволяло исключать из спектра вращающиеся боковые полосы. Одномерные протонные ЯМР-спектры получали как для предварительного насыщения, так и для последовательности Уотергейта (Watergate) (Piotto M. и др., 1992, Piotto M. и др., 2005) и накапливали 1000-1500 сканированных изображений. Температуру пропускаемого через зонд потока воздуха поддерживали на уровне 295 K для того, чтобы обеспечивать температуру в образце 298 K.
На фиг.1б и 1в продемонстрированы различия одномерных ЯМР-спектров пальмитоилированного и пэгилированного β-амилоидного пептида. Видны два важных различия при 8,00 и 8,25 част./млн. С учетом того факта, что оба пептида имеют практически одинаковую аминокислотную последовательность за исключением лизина в положении 1 6, указанные различия, обнаруженные при 8,00 и 8,25 част./млн, свидетельствуют о различиях во вторичной структуре, поскольку лизин не может давать положительный сигнал в этой области спектра ароматических аминокислотных остатков.
С помощью одномерных протонных ЯМР-спектров в области ароматических аминокислотных остатков можно продемонстрировать, что специально сконструированная надмолекулярная конструкция, предлагаемая в настоящем изобретении, приводит к получению амилоидного антигенного пептида с уникально высокой специфичностью и важной вторичной структурой при реконструировании в липосомах, которая отличается при использовании различных линкерных молекул. Это может свидетельствовать о том, что линкер/якорь придает и фиксирует пептид в определенной вторичной структуре, которая зависит от применяемой линкерной молекулы. В случае применения этих молекул в вакцине для активной иммунизации, вероятно, антитела, вырабатываемые против структурно различных антигенов, должны быть специфическими для антигена и конформации.
Полученные ранее с помощью ELISA и ORT (задача на опознавание объекта в тесте на когнитивное запоминание) после иммунизации АРР × PS-1-мышей пальмитоилированным антигеном Aβ1-15 и пэгилированным антигеном Aβ1-16 (см. ниже в разделе «Примеры») позволили установить, что только пальмитоилированный антиген восстанавливает нарушение памяти на указанной модели болезни Альцгеймера, хотя оба антигена обладают одинаковой иммуногенностью. Возможный механизм, посредством которого эти два антигена презентуют один и тот же пептид, приводящий in vivo к образованию двух функционально различных антител, наиболее вероятно связан с различной вторичной структурой презентованного пептида, что связано с линкерной технологией.
Пример 4: Количественная оценка ориентированного кнаружи и внутрь реконструированного пептида
Количество реконструированного пептида в липсомах ACI-01 и ACI-24 определяли с помощью анализа с использованием флурескамина (FLA), который специфически взаимодействует с первичными аминами с образованием обладающих высокой флуоресцентностью ковалентных аддуктов (Udenfriend S. и др., 1972). Предполагали, что FLA должен взаимодействовать с N-концом Pall-15-пептида в ACI-24 и с Lys-16 в ACI-01.
Для отделения свободных пептидов от пептидов, находящихся в липосомах, образцы подвергали ультрацентрифугированию и в образовавшихся супернатантах оценивали содержание пептидов с помощью FLA-анализа. Никаких свободных пептидов не обнаружено в супернатантах ни ACI-01, ни ACI-24. Мечение пеллетированных фракций с помощью FLA продемонстрировало очень высокую избирательность реакции с пептидом в обеих липосомах ACI-24 и ACI-01. Для определения общего пептида, присутствующего на поверхности липосом, анализы повторяли в присутствии Тритон Х-100 (2% в ЗФР), предназначенного для разрушения липидных бислоев. Это приводило к значительному повышению уровня мечения; что свидетельствует о том, что примерно 63% пептида выставлено на наружной поверхности мембраны. С другой стороны, при мечении ACI-01 с помощью FLA уровень достигает плато только при использовании 1,2 мМ FLA, при этой концентрации испускание является идентичным, когда анализ осуществляют либо в присутствии Тритон Х-100, либо без него. Эти результаты демонстрируют, что пептид выставлен на поверхности пэгилированной вакцины ACI-01.
Пример 5: Сравнение иммуногенности пэгилированных и пальмитоилированных антигенов на мышах линии C57BL/6 дикого типа (ELISA)
Липосомные антигены получали согласно методу, описанному у Nicolau и др., 2002. Антигены, представляющие собой пэгилированный Aβ1-16(Δ14), Aβ4-11 и пальмитоилированный Aβ1-15, реконструировали в конструкции, представляющей собой липосомы из димидистоилфосфатидилхолина (DMPC), димиристоилфосфатидилэтаноламина (DМРЕА), димиристоилфосфатидилглицерина (DMPG) и холестерина (молярные соотношения 0,9:0,1:0,1:0,7), которые содержали монофосфорильный липид А (фирма Sigma-Aldrich, Сент-Луис, шт.Миссури, США) в концентрации 40 мг/мМ фосфолипидов.
Антигены, представляющие собой пэгилированные Aβ1-16(Δ14), Aβ4-11 и пальмитоилированный Aβ1-15 (ACI-24), применяли для иммунизации мышей линии C57BL/6 с 2-недельными интервалами. Каждым антигеном иммунизировали 10-12 животных. Образцы сыворотки получали через 5 дней после ревакцинаций и осуществляли ELISA с использованием серийных разведений сыворотки. Сравнительные результаты свидетельствовали о наличии иммуногености различных антигенов.
Полученные с помощью ELISA данные свидетельствуют о том, что липосомные конструкции ПЭГ-Aβ1-16(Δ14) обладали существенно более высокой иммуногенностью, чем пальмитоилированные конструкции Aβ1-15. Добавление квасцов не повышало иммуногенность ПЭГ-Aβ1-16(Δ14) для мышей. Гуморальный иммунный ответ, индуцируемый ПЭГ-Aβ4-11, оказался замедленным по сравнению с ПЭГ-Aβ1-16(Δ14).
Поскольку вопрос о корреляции более быстрого иммунного ответа с более высокой способностью к запоминанию является спорным, пэгилированный антиген сравнивали с пальмитоилированным антигеном с использованием модели болезни Альцгеймера на мышах, несущих два трансгена.
Можно использовать альтернативный метод, описанный в US 6843942 и ЕР 1337322.
Пример 6: Сравнение иммуногенности пэгилированных и пальмитоилированных антигенов на мышиной модели болезни Альцгеймера (ELISA)
6.1 В опытах по иммунизации in vivo мышей линии АРР717 C57BL/6×PS-1 А246Е FVBe (APP×PS-1-мыши), помещенных индивидуально в клетки, осуществляли двойное слепое рандомицированное исследование с использованием животных соответствующего возраста и определенным с помощью ПЦР генотипом
Использовали молодых (3-4-месячных) самок мышей несущей двойной трансген линии, которые экспрессировали как мутантный человеческий амилоидный белок-предшественник (APP-V717I), так и мутантный человеческий пресенилин-1 (PS1-A246E), оба под контролем мышиного промотора гена thy1 и в генетическом каркасе F1 (FVB×C57B1). Генотип всех мышей определяли с помощью полимеразной цепной реакции (ПЦР) в возрасте 3 недель и каждую мышь метили уникальной для нее меткой. Генотип всех мышей определяли дважды в течение их жизни в помощью второй ПЦР, которую проводили в начале эксперимента и перед слепым произвольным распределением на различные экспериментальные группы. Мыши имели свободный доступ к воде и стандартному мышиному корму (Muracon-G, фирма Trouw Nutrition, Гент, Бельгия). Мышей содержали в условиях обратного ритма день-ночь в стандартных металлических клетках в соответствии с местными законами, касающимися обращения с животными. За 5 дней до начала поведенческого опыта мышей помещали в клетки из макролона типа 2 и переносили в лабораторию по осуществлению поведенческих опытов, и они проходили акклиматизацию и привыкали к среде лаборатории для опытов.
Иммунизация
Пальмитоилированный (ACI-24, Aβ1-15) и пэгилированный (ACI-01, Aβ1-16) антигены применяли для иммунизации APP×PS-1-мышей с 2-недельными интервалами (5 i.p.-инокуляций через каждые две недели). В каждой экспериментальной группе по 10 животных иммунизировали каждым антигеном путем внутрибрюшинной инъекции (200 мкл на инъекцию, 8 нмолей пептидов). Незагруженные (не содержащие антиген) липосомы использовали в качестве контроля. Образцы сыворотки отбирали с определенными интервалами (через каждые две недели), а также через 5 дней после ревакцинации и осуществляли ELISA использованием антител к амилоиду с серийными разведениями сыворотки. Сравнительные результаты свидетельствовали о наличии иммуногености различных антигенов.
Выраженный иммунный ответ обнаружен у APP×PS-1-мышей, иммунизированных пальмитоилированной, а также пэгилированной липосомой/Aβ-антигеном, через 5 дней после шестой инокуляции антигена. Но в отличие от иммунного ответа у здоровых мышей линии C57BL/6, при использовании мышей, у которых смоделирована болезнь, пэгилированный антиген не приводил к возникновению более высокого титра антител, чем пальмитоилированный антиген.
Специфический в отношении Aβ иммунный ответ в виде IgG повышался быстрее при использовании ACI-24, достигая пика через 5 дней. Обе вакцины приводили к появлению в значительной степени различающихся классов и изотипов иммуноглобулинов, при этом пальмитоилированный антиген ACI-24 приводил к появлению более высоких титров IgG, в отличие от пэгилированного антигена ACI-01, в ответ на обработку которым появлялись антитела IgM-класса. В полученных в конце эксперимента образцах крови всех животных анализировали также титр изотипа IgG (фиг.2).
Aβ1-42-специфические антитела в виде IgG и IgM идентифицировали с помощью ELISA. Планшеты сенсибилизировали 10 мкг/мл амилоида β1-42 в течение ночи при 4°C. После промывки каждой лунки ЗФР-0,05% Твин 20 и блокады с использованием 1% БСА, серийные разведения сыворотки добавляли в планшеты и инкубировали при 37°C в течение 2 ч. После промывки планшеты инкубировали с конъюгированным с фосфатазой антимышиным Ig (IgG, полное антитело, фирма Sigma-Aldrich, Сент-Луис, шт.Миссури, США) или специфическими для изотипа антителами (IgM, IgG1, IgG2a и IgG3, фирма Pharmingen BD, Сан-Диего, шт.Калифорния, США, и Ig2b, фирма Zymed Laboratories, Сан-Франциско, шт.Калифорния) в течение 2 ч при 37°C. После конечной промывки планшеты инкубировали с субстратом для фосфатазы PNPP (пара-нитрофенилфосфатом) и считывали при 405 нм с помощью планшет-ридера для ELISA. Результаты выражали с учетом серийных разведений титрируемого пула сыворотки из иммунизированных взрослых мышей или из серийных разведений поступающего в продажу антитела (6Е10, фирма Chemicon International, Темекула, шт.Калифорния, США). В другом варианте результаты выражали в виде ОП для разведения, при котором сыворотка не была на уровне насыщения (таблица 1).
Обработка AСI-24 приводила в основном к образованию изотипа IgG1 и IgG2b, которые оба относятся в основном к невоспалительным Th2-подтипам, а также IgG3, который относится к зависимому от Т-клеток подклассу IgG. За исключением одного животного, вакцинированного ACI-24, обе вакцины индуцировали только очень невысокие уровни IgG2a (Th1).
Картирование эпитопов образовавшихся антител осуществляли с помощью ELISA с использованием пептидной библиотеки, содержащей в целом 33 биотинилированных пептида, перекрывающих всю аминокислотную последовательность Aβ1-42, используя биотинилированный полный β-пептид в качестве положительного контроля. Иммунизация обеими вакцинами, т.е. ACI-01 и ACI-24, приводила к появлению антител к Aβ, эпитопы для которых определялись одними и теми же аминокислотами 1-9 Aβ (пептид 1). Кроме того, при создании изобретения анализировали возможную конформационную зависимость, оценивая специфическое связывание образовавшейся антисыворотки к Aβ с полимерным Aβ, адаптируя ELISA для волокон Aβ1-42. При иммунизации с помощью ACI-24 образовывались существенно более высокие титры антител к Aβ, распознающих волокна Aβ1-42, чем в антисыворотке, образовавшейся в организме мышей, иммунизированных ACI-01 (таблица 2). Из полученных результатов следует, что иммунизация ACI-01 и ACI-24 продуцировали иммунные ответы, которые отличались не только титрами, подклассами и Ig-изотипами, но и конформационной специфичностью.
Пример 7: Сравнение пэгилированных и пальмитоилированных антигенов в отношении воздействия на способность к опознаванию при использовании мышиной модели болезни Альцгеймера (ORT)
7.1 Воздействие на улучшение непространственной, зависящей от гиппокампа способности к запоминанию у АРР×PS1-мышей, на которых моделировали болезнь Альцгеймера
Для анализа воздействия на улучшение непространственной, зависящей от гиппокампа способности к запоминанию у АРР×PS1-мышей, на которых моделировали болезнь Альцгеймера, мышей в течение 3 месяцев иммунизировали путем активной вакцинации против Aβ1-16/1-15 с использованием пальмитоилированного (ACI-24, Aβ1-15) и пэгилированного (ACI-01, Aβ1-16) антигенов, тест на опознавание объекта (ORT) осуществляли в целом, как описано у (Tang и др. 1999; Rampon и др., 2000). Статистический анализ осуществляли с помощью известного, применяемого для дисперсионного анализа критерия для множественного сравнения Turkey-Kramer (Moechars D. и др., 1999 и 1996). Для расчета критерия использовали программу GraphPad InStat, версия 3,06 для Windows, GraphPad Software, Сан-Диего, шт.Калифорния, США, www.graphpad.com.
В целом, метод состоял в следующем: применяли схему трехмесячной иммунизации, включающую шесть осуществляемых раз в две недели инокуляций ACI-01 и ACI-24. Одной группе мышей вводили незагруженные липосомы в качестве контроля. Мышам давали адаптироваться в течение 1 ч в ящике из плексигласа (52×52×40 см) с открытым полем с черными вертикальными стенками и прозрачным полом, тускло освещенным лампой, расположенной под ящиком. На следующий день животных помещали в этот же ящик и подвергали 10-минутному опыту по обучению. Во время этого опыта мышей помещали индивидуально в открытое поле в присутствии объекта А (мраморный шарик или игральная кость) и оценивали время, затраченное на исследование объекта А (когда морда животного была направлена к объекту и находилась на расстоянии от него <1 см). В 10-минутном опыте по сохранению в памяти (запоминанию) (второй опыт), который осуществляли спустя 3 ч, новый объект (объект Б: мраморный шарик или игральная кость) помещали в открытое поле вместе с известным объектом (объект А). Фиксировали время (tA и tБ), затраченное животным на исследование двух объектов. Коэффициент опознавания (RI), который определяли как отношение времени, затраченного на исследование нового объекта, по сравнению со временем, затраченным на исследование обоих объектов [(tБ/(tA+tБ))×100], применяли в качестве критерия непространственной памяти. Статистический анализ осуществляли с помощью известного однофакторного дисперсионного анализа (Moechars и др., 1999; Moechars и др., 1996).
Пальмитоилированный (ACI-24) и пэгилированный (ACI-01) антигены применяли для иммунизации APP×PS-1-мышей с 2-недельными интервалами. По 10 животных трехмесячного возраста иммунизировали путем i.p.-инъекции каждого антигена (по 200 мкл на каждую i.p.-инъекцию, 100 мкг пептида) и незагруженную липосому использовали в качестве контроля. Образцы сыворотки получали через 5 дней после ревакцинации и осуществляли ELISA с использованием нескольких разведений сыворотки. Сравнительные результаты свидетельствовали о наличии иммуногености различных антигенов.
Когнитивную способность трансгенных APP×PS-1-мышей, иммунизированных Aβ-антигенами, т.е. пальмитоилированным (ACI-24) и пэгилированным (ACI-01) антигенами, оценивали на примере непространственной визуальной опознавательной памяти, ставя перед ними задачу по опознаванию объекта, которая, как известно, зависит от активности гиппокампа ((Tang и др., 1999), (Rampon и др., 2000)). В целом, через 3 ч после обучения, включающего ознакомление с данным объектом, у них оценивали способность к сохранению в памяти, предлагая им новый объект после и в дополнение к известному.
Сохранение в памяти или когнитивная способность к запоминанию у APP×PS-1-мышей существенно повышалась в результате иммунизации пальмитоилированным Aβ1-15-антигеном (ACI-24) по сравнению с обработанными контролем APP×PS-1-мышами (76,1±3,9% против 49,1±4,5% в контроле; таблица 3). Эти результаты доказывают, что иммунизированные с помощью ACI-24 мыши распознавали и запоминали оригинальный объект по меньшей мере в течение 3 ч, отсюда следует, что их мотивационная активность и способность к обучению оказалась полностью соответствующей здоровым аналогичным по возрасту, полу мышам соответствующей линии, при их сравнении со здоровыми не обработанными и не трансгенными мышами дикого типа (61,8±5,1%). Хотя ACI-01-пептид отличается от ACI-24-пептида только удлинением на С-конце на одну аминокислоту (лизин в положении 16), а эти вакцины отличались только примененной при их приготовлении линкерной технологией, при иммунизации пэгилированным Aβ1-16-антигеном (ACI-01) не обнаружено какое-либо восстановление памяти (45,6±6,2%), сопоставимое с иммунизацией ACI-24.
7.2 Возможное участие различных классов антител, т.е. IgM и IgG, в когнитивной функции
Для оценки возможного участия различных классов антител IgM и IgG в когнитивной функции проводили корреляционный анализ.
Наличие антител IgM-класса не коррелировало со способностью к запоминанию (r2=0,2333), но уровень образовавшихся антител IgG-класса приблизительно коррелировал (r2=0,857) с уровнем способности к запоминанию (коэффициент опознавания в ORT-тесте (ORT-коэффициент)), что характеризовалось двухфазной зависимостью. При значениях ORT-коэффициента от 0 до 20 обнаружена более линейная зависимость, а при значениях ORT-коэффициента, превышающих 20, корреляция переходила на фазу насыщения. Этот результат может свидетельствовать о том, что антитела IgM-класса, которые не проникают через гематоэнцефалический барьер, не участвовали в восстановлении памяти. В противоположность этому, антитела IgG-класса пересекают гематоэнцефалический барьер в зависимости от их подкласса, и они связаны с улучшением памяти.
Для оценки способности иммунизации с использованием ACI-24 модифицировать количество растворимых и нерастворимых амилоидных пептидов в головном мозге АРР×PS-1-мышей с помощью специфического ELISA оценивали уровень человеческого Aβ1-40 и Aβ1-42 в растворимой фракции гомогенатов головного мозга. Использовали поступающие в продажу наборы для ELISA (Amyloid β40 или β42 ELISA, фирма Genetocs Company, Цюрих, Швейцария). ELISA осуществляли согласно протоколу производителя. Количественную оценку содержания Aβ в образцах получали путем сравнения абсорбции со стандартными кривыми, построенными с использованием синтетического Aβ1-40 или Aβ1-42 (таблица 4).
Данные представлены в виде средних значений (Aβ нг/г гомогената головного мозга±СКО)
Иммунизация с использованием ACI-24 приводила к существенному снижению уровня нерастворимых связанных с бляшками Aβ1-40 и Aβ1-42. Уровни растворимого Aβ1-42 также существенно снижались, а уровни растворимого Aβ1-40 имели лишь тенденцию к снижению.
Пример 8: Иммунизация ACI-01 и -24 не вызывает воспаления
Безопасность обеих липосомных вакцин ACI-01 и ACI-24 оценивали путем измерения местного производства воспалительных цитокинов IL-1β, IL-6, IFN-γ и TNF-α с помощью специфического ELISA. Уровни TNF-α, IFN-γ, IL-6 и IL-1β оценивали в гомогенатах всего головного мозга с помощью сэндвич-ELISA согласно руководству производителя (все от фирмы R&D Systems, Миннеаполис, шт.Миннесота, США). Результаты выражали с пг/мл относительно серийных разведений рекомбинантных цитокинов. Уровень активированных клеток микроглии (ГКГП) и астроглиоза (GFAP, фибриллярный кислый белок глии) в головном мозге в области основания оценивали с помощью количественной иммуногистохимии.
Иммунизация как ACI-01, так и ACI-24 не приводила к существенному повышению уровней IL-1β, IL-6, IFN-γ и TNF-α в головном мозге. Аналогично этому не обнаружено различий в астроглиозе при иммунизации с использованием ACI-24, однако обнаружена тенденция к снижению уровня активированной микроглии после трехмесячного периода иммунизации.
Пример 9: Получение МАт
Пальмитоилированный антиген (ACI-24, Aβ1-15) применяли для иммунизации мышей линии C57BL/6 с двухнедельными интервалами. По 10-12 животных иммунизировали каждым антигеном (применяемый для инъекции объем, содержащий 8 нмолей пептида, составлял 200 мкл). Последнюю инъекцию осуществляли за 4 дня до умерщвления животных. После 5 ревакцинаций мышей, у которых обнаружены терапевтические титры (когда разведение сыворотки 1:5000 давало положительную реакцию по данным ELISA), отбирали для слияния. Из организма иммунизированных животных получали спленоциты и создавали гидридомы путем слияния сенсибилизированных спленоцитов с линией клеток миеломы. Слияние мышиных селезеночных В-лимфоцитов осуществляли с линией клеток мышиной миеломы SP2-0 (АТСС, Манассас, шт.Виргиния) с помощью хорошо известных методов, описанных у Kohler и Milstein (Nature 256, 1975, сс.495-497) и Harlow и Lane (Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory, New York, 1988)).
Клетки индуцировали к слиянию, добавляя полиэтиленгликоль. Образовавшиеся гибридные клетки затем клонировали общепринятым образом, например, используя ограничивающее разведение продуцирующих IgG клонов гибридомы, которые отбирали и оценивали в отношении специфического связывания с Aβ1-42-пептидом с помощью ELISA, и образовавшиеся клоны, которые продуцировали требуемые моноклональные антитела, культивировали.
Полученные таким образом гибридомы отбирали с помощью химических агентов, высевая клетку в среду для селекции, содержащую гипоксантин, аминоптерин и тимидин (HAT).
Затем гибридомы подвергали скринингу в отношении способности продуцировать моноклональные антитела против специфических ассоциированных с амилоидом заболеваний или нарушений. Гибридомы, продуцирующие представляющие интерес антитела, клонировали, размножали и хранили в замороженном состоянии до дальнейшего применения. Предпочтительные гибридомы продуцировали моноклональное антитело, имеющее изотип IgG, более предпочтительно изотип IgG2.
Пример 10: Специфичность распознавания амилоидов антителом mACI-24-Ab4
Для анализа специфичности антитела ACI-24-Аb4 различные концентрации предварительно полученных волокон амилоида 1-42, 1-40 и 1-38 блоттировали на нитроцеллюлозную мембрану Hybond ECL (фирма Amersham Biosciences). После блокады 10%-ным сухим молоком и 0,7% Твин 20 мембраны инкубировали с первичным антителом в концентрации 20 мкг/мл в течение 2 ч при КТ. После отмывки мембраны инкубировали с конъюгированным с пероксидазой из хрена овечьим антимышиным антителом изотипа IgG (фирма Amersham Biosciences) в течение 1 ч при КТ, отмывали и инкубировали с хемилюминесцентным раствором с последующем экспонированием мембраны на рентгеновскую пленку.
Для оценки связывания МАт (mACI-24-Ab4) с волокнами амилоида β предварительно формировали в течение 7 дней при 37°C волокна 1-42, Aβ 1-42, 1-40 и 1-38 и блоттировали на мембрану. Для оценки способности к связыванию использовали 20 мкг/мл антитела и связанное антитело выявляли с помощью конъюгированного с пероксидазой из хрена овечьего мышиного антитела к изотипу IgG при 20-минутной экспозиции.
Как можно продемонстрировать с помощью дот-блот анализа, связывание антитела mACI-24-Ab4 с различными предварительно полученными волокнами Aβ характеризовалось различной чувствительностью. Антитело проявляло наибольшую чувствительность к связыванию с Aβ1-42-волокнами по сравнению с Aβ1-40 или Aβ1-38. Оно обладало способностью обнаруживать по меньшей мере 0,001 мкг Aβ1-42-волокон, в то время как предел обнаружения антителом Aβ1-40-волокон составлял по меньшей мере 0,1 мкг, а Aβ1-38-волокон - 1 мкг, это означает, что чувствительность в отношении этих типов амилоидных волокон в 100-1000 раз ниже. Эти данные демонстрируют, что антитело ACI-24-Аb4 обладает по меньшей мере в 100 раз более высокой чувствительностью в отношении амилоидной формы (1-42), которая, как известно, становится нерастворимой в результате изменения вторичной конформации и представляет собой основную часть амилоидных бляшек в головном мозге страдающих болезнью Альцгеймера пациентов.
Пример 11: Фракционирование путем ультрацентрифугирования в градиенте плотности
Способность моноклональных антител ингибировать полимеризацию Aβ1-42-волокон и нарушать агрегацию Aβ1-42-фибрилл оценивали с помощью ультрацентрифугирования в градиенте плотности (Rzepecki и др., 2004), которое основано на принципе распределения имеющих различный размер пептидных волокон после инкубации с добавлением антител или без антител с последующим седементационным анализом с помощью ДСН-ПААГ на предварительно созданном градиенте (OptiPrep™). Очевидным преимуществом такого метода является одновременный анализ популяции предварительно сформированных Aβ-волокон, способности совместно инкубированных антител нарушать агрегацию и ингибировать агрегацию, а также связывания антител с волокнами.
Все моноклональные антитела к Aβ1-15 (mACI-24-Ab4) анализировали в отношении нарушения агрегации и ингибирования.
Для ингибирования агрегации Aβ1-42 мономеры Aβ1-42 инкубировали с МАт в двух различных молярных соотношениях (молярное содержание мономера Aβ1-42 в 30-100 раз выше, чем МАт) при использовании конечной концентрации Aβ 50 мкМ. После инкубации в течение 24 ч при 37°C образцы наслаивали на прерывистый градиент Optiprep™ и пробирки вращали при 259000×g в течение 3 ч при 4°C. Собирали 15 фракций (по 140 мкл каждая), фракция 1 представляла собой фракцию с наименьшей плотностью, полученную на вершине градиента, а фракция 15 представляла собой наиболее плотную фракцию, полученную со дна градиента. Собирали также дебрис. Объединенные фракции анализировали с помощью ДСН-ПААГ с окрашиванием серебром. Концентрация Aβ1-42 для анализов ингибирования была в 5 раз ниже, чем для анализов нарушения агрегации, которая снижала кинетику амилоидной агрегации и обеспечивала проведение измерений в пределах линейной фазы.
Без добавления MAT агрегация Aβ-пептида происходила после 24-часовой инкубации, и наибольшее количество белка было обнаружено во фракциях от 13 до дебриса (дебрис, очень небольшое количество во фракции 12), что свидетельствовало о полной полимеризации мономеров Aβ-пептида. Успешное и существенное ингибирование агрегации должно приводить к образованию волокон меньшего размера или олигомеров, которые должны присутствовать во фракциях с более низкой плотностью. При анализе агрегации установлено, что антитело mACI-24-Ab4 вызывало сдвиг полос в сторону их увеличения (наиболее сильно окрашенная полоса) с 13 к 11 и 12 и приводило к выраженной солюбилизации полос от фракции 13 до дебриса. Эти результаты свидетельствуют о том, что mACI-24-Ab4 обладает выраженной способностью игибировать полимеризацию мономеров Aβ-пептида с образованием волокон и свидетельствуют о специфическом связывании с Aβ-волокнами (во фракциях 11 и 12).
Для нарушения агрегации ранее сформированных Aβ1-42-волокон при совместной инкубации с МАт (при двух различных молярных соотношениях 1:30 и 1:100, МАт + мономер Aβ1-42 при конечной концентрации Aβ 246 мкМ) образцы инкубировали в течение 24 ч при 37°C. Через 24 ч образцы фракционировали ультрацентрифугированием и разделяли с помощью ДСН-ПААГ согласно описанному выше и разработанному ранее методу (Rzepecki и др., 2004).
Аналогично данным, полученным при анализе агрегации, полную полимеризацию можно обнаруживать по распределению только Aβ1-42-волокон во фракциях с 12 до Р (дебрис). В данных исследованиях сдвиг основного уровня волокон во фракции с более низкой плотностью может свидетельствовать о способности антитела нарушать агрегацию при совместной инкубации с ранее сформированными волокнами. Добавление mACI-24-Ab4 в молярном соотношении 1:100 приводило к сдвигу максимума амилоидных волокон с 12-й фракции в 11-ю фракцию. Таким образом, mACI-24-Ab4 также характеризуется выраженной активностью в отношении нарушения агрегации.
Пример 12: Совместное применение пальмитоилированного антигена и ингибитора активации комплемента при осуществлении теста по сохранению способности к запоминанию на мышиной модели болезни Альцгеймера (ORT)
Для предупреждения возможных побочных действий, таких как неврологические осложнения, вызванные дополнительной стимуляцией вакцинацией уже сверхактивированной системы комплемента, пальмитоилированный антиген (ACI-24, Aβ1-15) вводили в сочетании с ингибитором комплемента, выбранным из группы, включающей ТР10 (растворимый рецептор 1 человеческого комплемента), экулизумаб (антитело к белку С5 человеческого комплемента), пекселизумаб (антитело к белку С5 комплемента), встречающийся в естественных условиях ингибитор C1 Cetor® (C1-эстеразный ингибитор-N) и встречающийся в естественных условиях ингибитор человеческого C1.
Ингибитор комплемента вводили перед вакцинацией больного человека пальмитоилированным (ACI-24, Aβ1-15) антигеном или вскоре после вакцинации.
При использовании схемы применения, согласно которой ингибитор комплемента вводят перед вакцинацией пальмитоилированным (ACI-24, Aβ1-15) антигеном, соединение-ингибитор вводили в пределах временного окна, начинающегося вплоть до 20 ч до вакцинации и заканчивающегося непосредственно перед вакцинацией (схема применения 1).
При использовании схемы применения, согласно которой ингибитор комплемента вводят после вакцинации пальмитоилированным (ACI-24, Aβ1-15) антигеном, соединение-ингибитор вводили в пределах временного окна, начинающегося сразу после вакцинации и заканчивающегося через 1 день после вакцинации (схема применения 2).
12.1 ТР10 (растворимый рецептор 1 человеческого комплемента)
В опытах на людях, проведенных в использованием ТР10, установлено, что предпочтительно поддерживать концентрацию ТР10 в пределах от 100 до 160 мкг/мл в течение 24 ч после СРВ. Для достижения такого диапазона концентраций наиболее целесообразно вводить начальную дозу 10 мг/кг в течение 0,5 ч, а затем вводить 10 мг/кг в течение 23,5 ч (Li JS, Am Heart J., 147(1), январь 2004 г., сс.173-180).
Вакцинацию пальмитоилированным (ACI-24, Aβ1-15) антигеном проводили либо после достижения требуемой концентрации ТР10 при использовании схемы применения 1, либо в другом варианте перед введением начальной дозы 10 мг/кг ТР10 согласно схеме применения 2.
12.2 Экулизумаб (антитело к белку С5 человеческого комплемента)
Экулизумаб (600 мг) вводили путем инфузии каждую неделю в течение 4 недель, с последующим введением через 1 неделю дозы 900 мг, в затем опять применяли дополнительные дозы по 900 мг через каждые 2 недели в течение 12 недель (Hillmen Р, N Engl J Med., 5;350(6), февраль 2004 г., сс.552-559).
При продолжительном лечении экулизумабом его можно вводить в дозе 900 мг каждые 12-14 дней (Hill A, Blood., 1; 106(7), октябрь 2005 г., сс.2559-2565, электронная публикация (Epub) 28 июня 2005 г.).
Вакцинацию пальмитоилированным (ACI-24, Aβ1-15) антигеном осуществляли либо после введения первой 600-миллиграммовой дозы экулизумаба согласно схеме применения 1, либо в другом варианте перед введением первой 600-миллиграммовой дозы экулизумаба согласно схеме применения 2.
В некоторых случаях более целесообразно применять схему 1 только после 4-й недели, когда заканчиваются первые четыре цикла введения экулизума и достигается стабильный уровень концентрации в организме человека.
12.3 Пекселизумаб (антитело к белку С5 комплемента)
Пекселизумаб вводили внутривенно в виде болюса 2,0 мг/кг в течение 10 мин, после этого болюсного введения можно осуществлять введение путем инфузии 1,0 мг/кг в течение 20 ч (http://circ.ahajournals.org/cgi/content/full/106/23/2986-а) или 0,05 мг/кг/ч в течение 24 ч.
Вакцинацию пальмитоилированным (ACI-24, Aβ1-15) антигеном осуществляли либо после первого введения пекселизумаба в виде болюса 2,0 мг/кг согласно схеме применения 1, либо в другом варианте перед первым введением пекселизумаба в виде болюса 2,0 мг/кг согласно схеме применения 2.
В некоторых случаях может оказаться более целесообразным применять схему 1 только тогда, когда второе введение путем инфузии завершается и достигается стабильный уровень концентрации в организме человека.
12.4 Встречающийся в естественных условиях ингибитор человеческого С1
Ингибитор С1 вводили в дозах от 6,25 до 100 ед./кг (van Doorn MB, Allergy Clin Immunol., 116(4), октябрь 2005 г., сс.876-883. Epub 8 августа 2005 г.).
В альтернативном варианте пастеризованный концентрат эстеразного ингибитора С1 можно вводить в дозах 500-1000 ME (De Serres J, Transfus Apher Sci., 29(3), 29 декабря 2003 г., сс.247-254); (Bork K, Arch Intern Med., 12,161(5), март 2001, сс.714-718).
Ингибитор С1 можно вводить также внутривенно путем 1-часовой инфузии, начиная с 6000 ME, затем применяя 3000, 2000 и 1000 ME с 12-часовыми интервалами (Caliezi C, Crit Care Med., 30(8), август 2002 г., сс.1722-1728).
И, наконец, ингибитор С1 можно вводить внутривенно каждый третий день в виде нагреваемого паром концентрата ингибитора в концентрация 25 единиц плазмы на килограмм веса тела (Waytes AT, N Engi J Med., 20, 334(25), июнь 1996 г., сс.1630-1634).
Вакцинацию пальмитоилированным (ACI-24, Aβ1-15) антигеном осуществляли либо после введения ингибитора С1 согласно схеме применения 1, либо в альтернативном варианте перед начальным введением ингибитора С1 согласно схеме применения 2.
12.5 Встречающийся в естественных условиях ингибитор С1 Cetor® (С1-эстеразный ингибитор-N)
C1-эстеразный ингибитор-N или Cetor® вводили в дозе 1000, 1500 или 2000 ед. или в виде другого продукта в такой же дозе.
Вакцинацию пальмитоилированным (ACI-24, Aβ1-15) антигеном осуществляли либо после введения 2-ой дозы согласно схеме применения 1, либо в альтернативном варианте перед начальным введением дозы 1000, 1500 или 2000 ед. C1-эстеразного ингибитора-N или Cetor® согласно схеме применения 2.
Чертежи
На чертежах показано:
на фиг.1 - особенности конструкции и биофизические характеристики двух липосомных вакцин, содержащих пептидные иммуногены с первыми 15 (ACI-24, Aβ1-15) и 16 (ACI-01, Aβ1-16) аминокислотами полноразмерного амилоидного β1-42-пептида, б) ACI-01 содержит Aβ1-16, фланкированный одним пэгилированным остатком лизина на каждой стороне, который несет DSPE, служащий липосомным якорем, на стороне ПЭГ-цепи (а). Для создания ACI-24 (б) два концевых пальмитоилированных остатка лизина ковалентно связывали с каждым концом Aβ1-15 для реконструкции и «заякоривания» антигена в липосоме (а), в) CD-спектры двух антигенов, реконструированных в липосоме. Для ACI-01 характерен спектр, свидетельствующий о конформации белка в виде произвольной спирали или неструктурированной конформации (отрицательный сигнал при 210 нм и медленное приближение сигнала к оси абсцисс вплоть до 260 нм), в то время как спектр ACI-24 содержит значительную долю пептида, находящегося в бета-складчатой конформации (положительный сигнал вплоть до 210 нм, пересечение оси абсцисс и затем вновь приближение к ней вплоть до 260 нм). Для получения CD-спектров образцы бета-амилоида (ACI-01 и -24) реконструировали в липосомах и обрабатывали ультразвуком с использованием зондового ультразвукового излучателя при концентрации пептида 0,9865 мг/мл (1 мл в ЗФР). CD-спектры регистрировали с помощью дихрографа JASCO J-810, снабженного кварцевой кюветой с длиной оптического пути 0,1 см. Спектральное окно составляло 190-260 нм при скорости сканирования 20 нм/мин при 25°C, и необработанные данные выражали в виде эллиптичности в единицах θ (мград);
на фиг.1б - 1Н-спектральная область, соответствующая пептидным амидным протонам и ароматическим боковым цепям, вращательного магического углового ЯМР-спектра А - ACI-01-вакцины, Б - ACI-24-вакцины, В - 1 мМ ACI-01, Г - 1 мМ ACI-24 и Д - 4 мМ Aβ1-15-пептида в ЗФР-буфере, рН 7,2;
на фиг.1в - одномерный 1Н-ЯМР спектр от 9 до 5,5 част./млн пэгилированного (ПЭГ-пептид, черный) и пальмитоилированного бета-амилоида 1-15 (pal-пептид, голубой). Пептиды синтезировали, ковалентно связывали с пальмитиновой кислотой или ПЭГ соответственно и реконструировали в ЗФР. Для ЯМР-анализа образцы центрифугировали и определяли общий спектр в диапазоне от 9 до 0,2 част./млн;
на фиг.2 - анализ специфических для амилоида титров в сыворотке APP×PS1-мышей, иммунизированных пэгилированным (ACI-01) или пальмитоилированным (ACI-24) антигенами в липосомах, по сравнению с мышами, иммунизированными «незагруженными» липосомами (контроль), а) иммунизация ACI-24 приводила к появлению высоких уровней специфических для амилоида антител IgG-изотипа (а, слева) только после двух иммунизаций и через 3 недели после первой, и максимум достигался через 5 недель. В то время как иммунизация ACI-01 приводила к появления высоких уровней специфических для амилоида антител IgM-изотипа (а, справа) с максимумом через 7 недель и лишь к невысоким уровням IgG по сравнению с ACI-24 (а, слева, p<0,5).
Депонирование
В соответствии с Будапештским договором в Немецкой коллекции микроорганизмов и клеточных культур («Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSMZ)», Braunschweig, Mascheroder Weg 1 В, 38124 Branuschweig) депонированы следующие линии клеток гибридом:





| название | год | авторы | номер документа |
|---|---|---|---|
| СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ АМИЛОИДА БЕТА (А БЕТА) 1-42 МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, ОБЛАДАЮЩИЕ ТЕРАПЕВТИЧЕСКИМИ СВОЙСТВАМИ | 2006 |
|
RU2551782C2 |
| МОНОКЛОНАЛЬНОЕ ТЕЛО ПРОТИВ АМИЛОИДА БЕТА | 2008 |
|
RU2571856C2 |
| СПОСОБ ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ | 2010 |
|
RU2579659C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО | 2008 |
|
RU2538709C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К АМИЛОИДУ БЕТА | 2013 |
|
RU2668161C2 |
| БЕЗОПАСНЫЕ И ФУНКЦИОНАЛЬНЫЕ ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА | 2011 |
|
RU2607368C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2604181C2 |
| ПЕПТИДНАЯ ВАКЦИНА ДЛЯ ПРЕДУПРЕЖДЕНИЯ И ИММУНОТЕРАПИИ ДЕМЕНЦИИ АЛЬЦГЕЙМЕРОВСКОГО ТИПА | 2013 |
|
RU2696566C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ АМИЛОИДОЗОВ | 2009 |
|
RU2491953C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К АМИЛОИДУ БЕТА | 2008 |
|
RU2567151C2 |
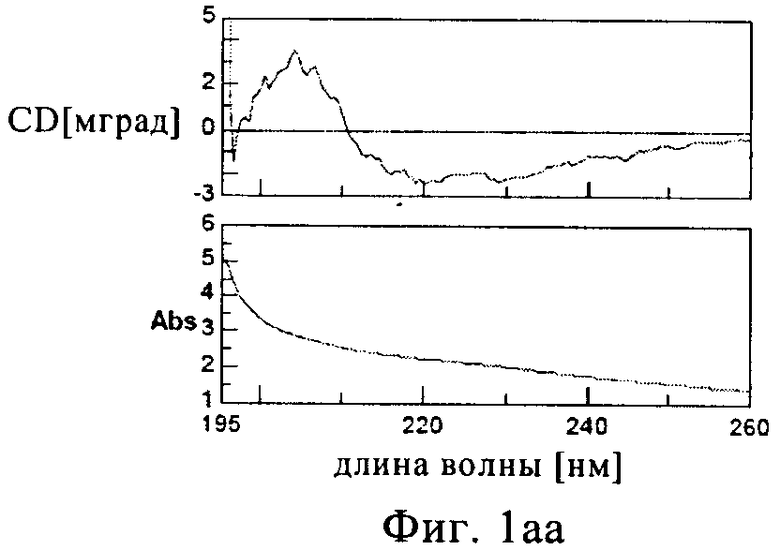
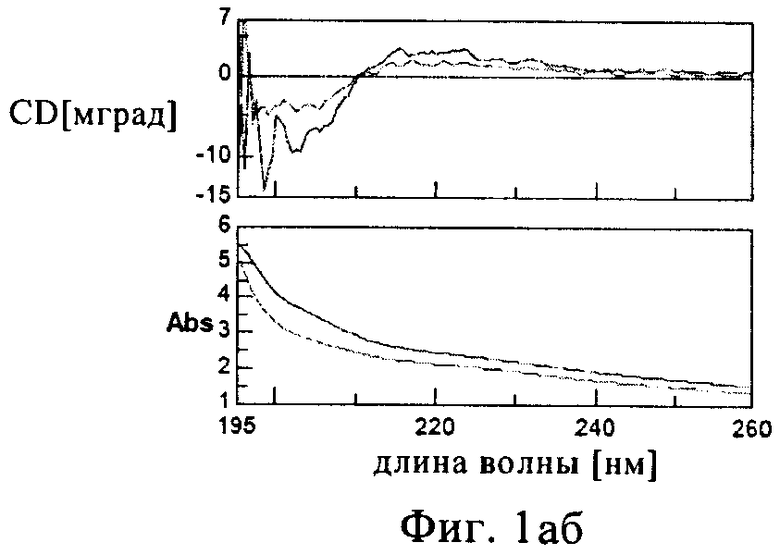
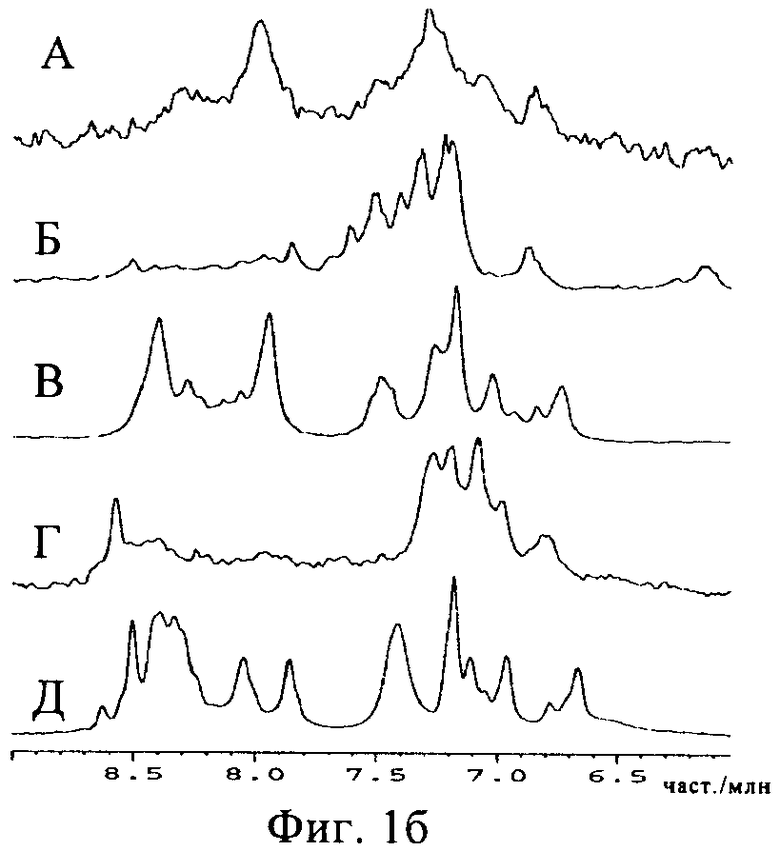
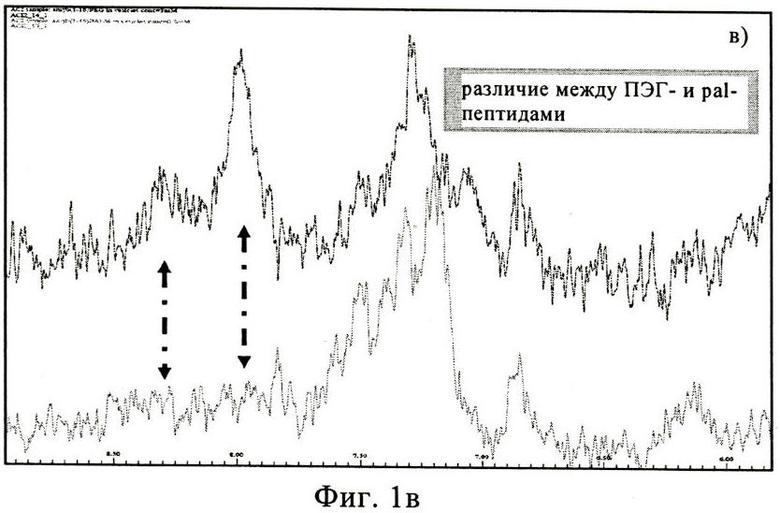
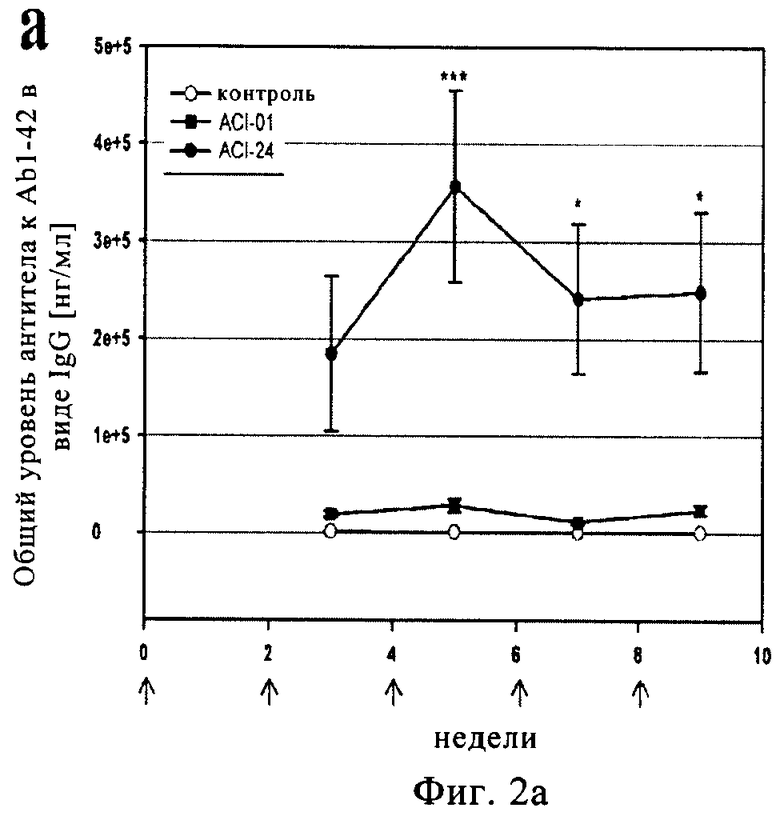
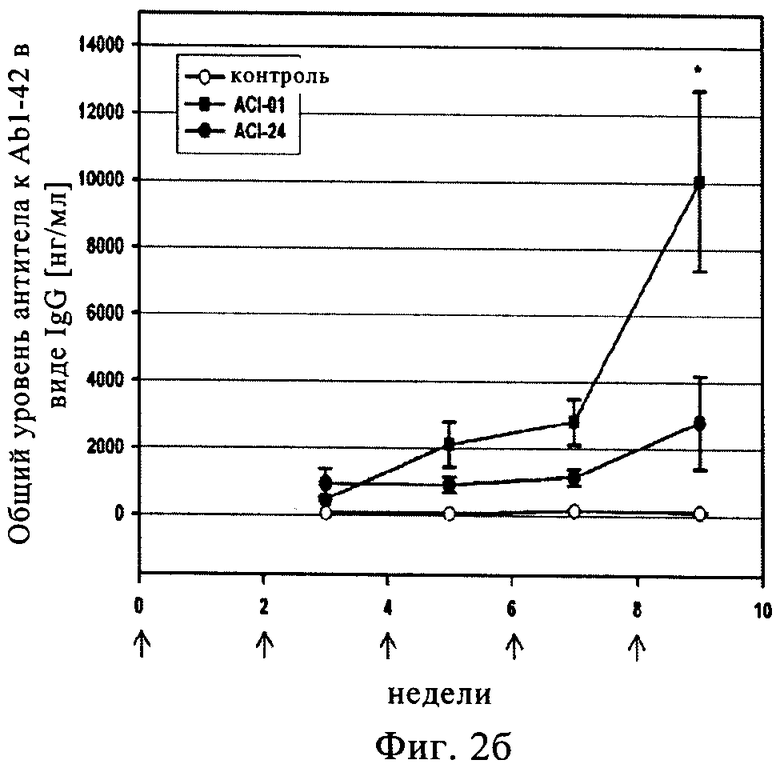
Группа изобретений относится к области медицины и касается терапевтической вакцины. Сущность изобретения включает антигенную конструкцию, содержащую фрагмент антигенного Аβ-пептида, реконструированного в липосоме, который состоит из встречающегося один раз или повторяющегося несколько раз участка, включающего от 13 до 15 смежных аминокислотных остатков из N-концевой 1-16- или 1-17-фрагмента Аβ-пептида, которые выбраны из группы, включающей остатки 1-15, 1-14 и 1-13, и модифицирован с помощью липофильного или гидрофобного фрагмента, который облегчает встраивание в липидный бислой липосомы. Изобретения также включают композицию терапевтической вакцины, способ получения композиции вакцины, способ применения композиции терапевтической вакцины для приготовления лекарственного средства и антитела, которые получают из организма животного после иммунизации терапевтической вакциной. Группа изобретений предназначена для терапевтического применения при лечении заболеваний и нарушений, которые вызываются или ассоциированы с амилоидными или амилоидоподобными белками, включая амилоидоз. Преимущество изобретений заключается в создании высокоспецифического иммунного ответа. 5 н.п. и 44 з.п. ф-лы, 4 табл., 6 ил.
1. Антигенная конструкция, содержащая фрагмент антигенного Аβ-пептида, реконструированного в липосоме, который состоит из встречающегося один раз или повторяющегося несколько раз участка, включающего от 13 до 15 смежных аминокислотных остатков из N-концевой 1-16- или 1-17-фрагмента Аβ-пептида, которые выбраны из группы, включающей остатки 1-15, 1-14 и 1-13, и модифицирован с помощью липофильного или гидрофобного фрагмента, который облегчает встраивание в липидный бислой липосомы, для индукции высоко специфичного иммунного ответа при введении животному или человеку.
2. Антигенная конструкция по п.1, в которой композиция терапевтической вакцины содержит встречающийся один раз или повторяющийся несколько раз фрагмент Аβ-пептида, выбранный из группы, включающей антигенный Аβ1-15-пептид, последовательность которого представлена в SEQ ID NO:1, и Аβ1-16(Δ14), последовательность которого представлена в SEQ ID NO:3.
3. Антигенная конструкция по п.1 или 2, в которой антигенный Аβ-пептид имеет определенную конформацию, отличающуюся сбалансированным соотношением α-спиралей и/или β-складок, и/или произвольных спиралей.
4. Антигенная конструкция по любому из пп.1-3, в которой липофильный или гидрофобный фрагмент представляет собой жирную кислоту, триглицериды или фосфолипид.
5. Антигенная конструкция по п.4, в которой гидрофобный фрагмент представляет собой пальмитиновую кислоту.
6. Антигенная конструкция по п.5, в которой β-амилоидный пептид антигена является пальмитоилированным Аβ1-15-пептидом антитела, модифицированным путем присоединения с помощью ковалентной связи от 2 до 4 пальмитоильных остатков, причем каждый конец пептида реконструирован в липосому.
7. Антигенная конструкция по п.6, где Аβ-пептид антигена модифицирован 2-мя пальмитоильными аминокислотными остатками.
8. Антигенная конструкция по п.6, где Aβ-пептид антигена модифицирован 4-мя пальмитоильными аминокислотными остатками, два из которых присоединены к N- и С-терминальным концам пептида соответственно.
9. Антигенная конструкция по любому из пп.6-7, в которой 2 или более пальмитоилированных молекул антигена Аβ1-15-пептида модифицированы путем присоединения с помощью ковалентной связи пальмитоильных остатков, причем каждый конец пептида реконструирован в отдельную липосому.
10. Композиция вакцины, содержащая антигенную конструкцию по любому из пп.1-9, для индукции высоко специфичного иммунного ответа при введении животному или человеку.
11. Композиция вакцины по п.10, содержащая Аβ1-15-пептид антигена, которая предназначена для лечения ассоциированного с амилоидом заболевания или состояния.
12. Композиция вакцины по п.11, в которой β-амилоидный пептид антигена является пальмитоилированным Аβ1-15-пептидом антигена, модифицированным путем присоединения с помощью ковалентной связи от 2 до 4 пальмитоильных остатков, причем каждый конец пептида реконструирован в липосому.
13. Композиция вакцины по одному из пп.10-12, в которой препарат липосомы содержит адъювант и/или иммуномодулятор.
14. Композиция вакцины по одному из пп.10-13, где препарат липосомы содержит ингибитор системы комплемента.
15. Композиция вакцины по одному из пп.10-14, где препарат липосомы содержит аллостерический эффектор гемоглобина, который индуцирует повышенное, регулируемое высвобождение кислорода в тканях.
16. Композиция вакцины по одному из пп.10-14, где препарат липосомы содержит ингибитор системы комплемента и аллостерический эффектор гемоглобина, который индуцирует повышенное, регулируемое высвобождение кислорода в тканях.
17. Композиция вакцины по одному из п.14 или 16, в которой ингибитор комплемента представляет собой соединение, выбранное из группы, включающей растворимый рецептор 1 человеческого комплемента, антитело к белку С5 человеческого комплемента, такое, например, как гуманизированное моноклональное антитело к С5 или одноцепочечный фрагмент гуманизированного моноклонального антитела, ингибитор-N Cl-эстеразы и встречающийся в естественных условиях ингибитор человеческого Сl.
18. Композиция вакцины по п.15 или 16, в которой соединение, модулирующее аффинность O2/гемоглобина, представляет собой соединение, выбранное из группы, включающей антилипидемическое лекарственное средство, такое, например, как клофибриновая кислота или производные безафибрата LR16 и L35, производные мочевины, такие, например, как [2-[4-[[(ариламино)карбонил]амино]фенокси]-2-метилпропионовая кислота, аллостерический эффектор гемоглобина, такой, например, как 2,3-дифосфоглицерат (DPG), инозитгексакисфосфат (IHP) и пиридоксалфосфат.
19. Композиция вакцины по п.15 или 16, в которой соединение, модулирующее аффинность O2/гемоглобина, представляет собой соединение, содержащее анионный лиганд аллостерического сайта гемоглобина, где анионный лиганд содержит внутреннее пирофосфатное кольцо, необязательно в сочетании с нетоксичным катионом.
20. Композиция вакцины по п.15 или 16, в которой соединение, модулирующее аффинность О2/гемоглобина, представляет собой производное инозитгексафосфата (IHP), содержащее по меньшей мере одно внутреннее пирофосфатное кольцо, необязательно в сочетании с нетоксичным катионом.
21. Композиция вакцины по любому из пп.10-20, введение которой животному или человеку приводит в основном к образованию антител невоспалительных подтипов.
22. Композиция вакцины по п.21, где указанные антитела представляют собой антитела невоспалительного Тh2-подтипа.
23. Композиция вакцины по любому из пп.10-20, введение которой животному или человеку приводит в основном к образованию не зависимых от Т-клеток антител IgG-подкласса.
24. Композиция вакцины по п.23, где указанные антитела представляют собой антитела IgG3-изотипа.
25. Композиция вакцины по любому из пп.10-24, введение которой животному или человеку не приводит к значительному повышению уровня воспалительных маркеров в головном мозге.
26. Композиция вакцины по любому из пп.10-24, введение которой животному или человеку приводит к значительному снижению уровня нерастворимых связанных с бляшками Аβ1-40 и Aβ1-42 в головном мозге.
27. Композиция вакцины по любому из пп.10-25, введение которой животному или человеку приводит к значительному снижению уровня растворимого Аβ1-42 в головном мозге.
28. Композиция вакцины по любому из пп.11 или 12 для лечения ассоциированных с амилоидом заболеваний или состояний, включая неврологические нарушения и заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию у животных или человека, страдающего такими состояниями.
29. Композиция вакцины по п.28, где ассоциированное с амилоидом заболевание или состояние выбирают из группы заболеваний, включающей болезнь Альцгеймера (AD), умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона, прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна.
30. Композиция вакцины по п.29, где ассоциированное с амилоидом заболевание или состояние представляет собой болезнь Альцгеймера.
31. Композиция по любому из пп.11 или 12, введение которой животному или человеку, страдающему ассоциированным с амилоидом состоянием, которое характеризуется утратой когнитивной способности к запоминанию, приводит к повышению сохранения когнитивной способности к запоминанию и/или к полному восстановлению когнитивной способности к запоминанию.
32. Способ получения композиции терапевтической вакцины, включающий добавление Аβ-антигенной конструкции по любому из пп.1-9 адьюванта и/или иммуномодулятора и/или ингибитора системы комплемента и/или аллостерического эффектора гемоглобина, который индуцирует повышенное, регулируемое высвобождение кислорода в тканях.
33. Способ применения композиции терапевтической вакцины по любому из пп.10-31 для приготовления лекарственного средства для индукции высокоспецифического иммунного ответа при введении животному или человеку.
34. Способ по п.33 применения композиции терапевтической вакцины, включающей пальмитоилированный Аβ1-15-пептид антигена, модифицированный путем присоединения с помощью ковалентной связи пальмитоильных остатков и реконструированный в липосому для приготовления лекарственного средства для лечения ассоциированного с амилоидом заболевания или состояния.
35. Способ по любому из пп.33 или п.34, где Аβ-пептид антигена модифицирован 2-мя пальмитоильными аминокислотными остатками, ковалентно присоединенными к N- и С-терминальным концам пептида, соответственно.
36. Способ по любому из пп.33 или 34, где Аβ-пептид антигена модифицирован 4-мя пальмитоильными аминокислотными остатками, два из которых присоединены к N- и С-терминальным концам пептида соответственно.
37. Способ по любому из пп.33 или 34, в которой 2 или более пальмитоилированных молекул антигена Аβ1-15-пептида модифицированы путем присоединения с помощью ковалентной связи пальмитоильных остатков, причем каждый конец пептида реконструирован в отдельную липосому.
38. Способ по п.34, где ассоциированное с амилоидом заболевание или состояние выбрано из группы заболеваний, включающей неврологические нарушения, болезнь Альцгеймера (AD), умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); комплекс деменции Гуама-Паркинсона, прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна.
39. Способ по п.38, где ассоциированное с амилоидом заболевание или состояние представляет собой болезнь Альцгеймера.
40. Способ по любому из пп.34 и 38-39, где ассоциированное с амилоидом состояние представляет собой состояние, характеризующееся утратой когнитивной способности к запоминанию у человека или животного, и где лечение животного или человека, страдающего ассоциированным с амилоидом состоянием, которое характеризуется утратой когнитивной способности к запоминанию, приводит к повышению сохранения когнитивной способности к запоминанию и/или к полному восстановлению когнитивной способность к запоминанию.
41. Способ по любому из пп.33-40, при котором введение композиции вакцины приводит в основном к образованию антител невоспалительных подтипов.
42. Способ по п.41, при котором антитела представляют собой антитела невоспалительного Тh2-подтипа.
43. Способ по п.41, при котором введение композиции вакцины приводит в основном к образованию не зависимых от Т-клеток антител IgG-подкласса.
44. Способ по п.43, при котором антитела представляют собой антитела IgG3-изотипа.
45. Способ по любому из пп.33-40, при котором введение композиции вакцины не приводит к значительному повышению уровня воспалительных маркеров в головном мозге.
46. Способ по любому из пп.33-40, при котором введение композиции вакцины приводит к значительному снижению уровня нерастворимых связанных с бляшками Aβ1-40 и Aβ1-42 в головном мозге.
47. Способ по любому из пп.33-40, при котором введение композиции вакцины приводит к значительному снижению уровня растворимого Аβ1-42 в головном мозге.
48. Антитело или смесь антител, которые получают из организма животного, иммунизированного композицией вакцины по одному из пп.10-31.
49. Антитело по п.48, отличающееся тем, что оно представляет собой моноклональное антитело или его производное.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| NICOLAU С | |||
| et al., A liposome-based therapeutic vaccine against beta-amiloid plaques on the pancreas of transgenic Norba mice, Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| USA, 2002, v.99, №4, pp.2332-2337 | |||
| Передвижной стеллаж для укладки и сушки табачных листьев | 1952 |
|
SU96350A1 |
Авторы
Даты
2012-01-27—Публикация
2006-12-08—Подача