Настоящее изобретение относится к способам и композициям, предназначенным для диагностики и лечения амилоидоза, группы нарушений и патологий, ассоциированных с амилоидным белком, таких как болезнь Альцгеймера.
Амилоидоз представляет собой не отдельное заболевание, а скорее группу разнообразных прогрессирующих болезненных процессов, которые характеризуются внеклеточными отложениями в ткани воскообразного крахмалоподобного белка, называемого амилоидом, который накапливается в одном или нескольких органах или системах организма. После образования амилоидных отложений они начинают препятствовать нормальному функционированию органа или системы организма. Известно по меньшей мере 15 различных типов амилоидоза. Основными формами являются первичный амилоидоз, не имеющий известных предвестников (состояний-предшественников) заболевания, вторичный амилоидоз, сопровождающий определенное другое состояние, и наследственный амилоидоз.
Вторичный амилоидоз возникает у людей, страдающих хроническим инфекционным или воспалительным заболеванием, таким как туберкулез, бактериальная инфекция, которую называют семейной средиземноморской лихорадкой, костные инфекционные заболевания (остеомиелит), ревматоидный артрит, воспаление тонкого кишечника (гранулематозный илеит), болезнь Ходжкина и проказа.
Амилоидные отложения включают такой компонент, как амилоид Р (пентагональный) (АР), гликопротеин, родственный амилоиду Р сыворотки здорового индивидуума (SAP), и сульфатированные гликозаминогликаны (GAG), комплекс углеводов соединительной ткани. Фибриллы амилоидного белка, на долю которых приходится примерно 90% амилоидного материла, содержат один из нескольких различных типов белков. Эти белки обладают способностью складываться в фибриллы, имеющие так называемую «бета-складчатую» конформацию, уникальную конфигурацию белка, при которой сайты связывания становятся доступными для красителя конго красного, что приводит к уникальным особенностям окрашивания амилоидного белка.
Многие связанные с возрастом заболевания обусловлены или ассоциированы с амилоидоподобными белками и характеризуются, в частности, образованием внеклеточных отложений амилоида или амилоидоподобного материала, которые участвуют в патогенезе, а также в развитии заболевания. Такие заболевания включают (но не ограничиваясь только ими) неврологические нарушения, такие как болезнь Альцгеймера (AD), деменция, связанная с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландского типа); комплекс деменции Гуама-Паркинсона. Другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, представляют собой прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна.
Хотя патогенез этих заболеваний может быть различным, характерные для них отложения часто содержат многие сходные молекулярные компоненты. В значительной степени это может относиться к местной активации провоспалительных путей, приводя тем самым к конкурентному отложению компонентов активированного комплемента, реактантов острой фазы, иммуномодуляторов и других воспалительных медиаторов (McGeer и др., 1994).
Болезнь Альцгеймера (AD) представляет собой неврологическое нарушение, которое, как предполагается, вызывается прежде всего амилоидными бляшками, накоплением патологических отложений белков в головном мозге. Наиболее часто встречающийся тип амилоида, выявленный в головном мозге пораженных заболеванием индивидуумов, в основном состоит из Аβ-фибрилл. Научно доказано, что увеличение производства и накопления бета-амилоидного белка в бляшках приводит к гибели нервных клеток, что способствует возникновению и развитию болезни Альцгеймера. В свою очередь, утрата нервных клеток в стратегически важных областях головного мозга приводит к уменьшению уровня нейромедиаторов и ухудшению памяти. К белкам, которые в первую очередь ответственны за образование бляшки, относятся амилоидный белок-предшественник (АРР) и два пресенилина (пресенилин I и пресенилин II). Последовательное расщепление амилоидного белка-предшественника (АРР), который конститутивно экспрессируется и катаболизируется в большинстве клеток ферментами β- и γ-секретазами, приводит к высвобождению состоящего из 39-43 аминокислот Аβ-пептида. Расщепление АРР, по-видимому, приводит к повышению их способности к агрегации с образованием бляшек. Аβ(1-42)-фрагмент обладает прежде всего наиболее высокой способностью образовывать агрегаты благодаря наличию двух высокогидрофобных аминокислотных остатков на его С-конце. Поэтому предполагается, что прежде всего Аβ(1-42)-фрагмент участвует и ответствен за инициацию образования нейритной бляшки при AD и следовательно обладает высоким патологическим потенциалом. Таким образом, существует необходимость в создании агентов, предназначенных для предупреждения образования амилоидных бляшек и разрушения существующих при AD бляшек.
Симптомы болезни Альцгеймера проявляются медленно, и первым симптомом может быть лишь слабая забывчивость. На этой стадии индивидуумы могут забывать последние события, действия, имена знакомых людей или названия вещей и могут быть не в состоянии решить простые математические задачи. По мере прогрессирования болезни симптомы становятся более заметными и настолько серьезными, что вынуждают людей, пораженных AD, или членов их семьи прибегать к медицинской помощи. Симптомы, характерные для средней стадии AD, включают забывание того, как выполнять простые функции, такие как приводить себя в порядок, при этом возникают проблемы с речью, пониманием, чтением или письмом. Пациенты на поздней стадии AD могут становиться боязливыми или агрессивными, могут уходить далеко от дома и, в конце концов, нуждаться в полном уходе.
В настоящее время единственным надежным путем диагностики AD является идентификация бляшек и сплетений в ткани головного мозга при вскрытии после смерти индивидуума. Таким образом, пока индивидуум еще жив, доктора могут ставить только диагноз «возможна» или «вероятна» AD. С помощью современных методов лечащие врачи могут правильно диагностировать вплоть до 90 процентов случаев AD с помощью ряда средств, позволяющих диагностировать «возможную» AD. Лечащие врачи задают вопросы об общем состоянии здоровья индивидуума, медицинских проблемах, имевших место в прошлом, и истории каких-либо затруднений у индивидуума при выполнении повседневных действий. Поведенческие тесты на память, решение задач, внимание, счет и речь позволяют получать информацию о когнитивной дегенерации, а медицинские анализы, такие как анализы крови, мочи или спинномозговой жидкости, и сканирование головного мозга могут дать некоторую дополнительную информацию.
Борьба с AD заключается в осуществлении лечения, основанного на применении лекарственных средств, и лечения без использования лекарственных средств (немедикаментозного лечения). Лечение с целью изменения основного течения болезни (замедления или реверсирования развития) до сих пор были по большей части безуспешными. Было продемонстрировано, что лекарственные средства, которые восстанавливают дефицит (дефект) или недостаточную функцию химических медиаторов нервных клеток (нейромедиаторов), в частности, ингибиторы холинэстеразы (ChEI), такие как такрин и ривастигмин, позволяют улучшать симптомы. ChEI задерживают ферментативное расщепление нейромедиаторов, повышая тем самым количество химических медиаторов, пригодных для передачи нервных сигналов в головном мозге.
Для некоторых людей на ранней и средней стадиях заболевания такие лекарственные средства, как такрин (COGNEX®, Моррис-Плейнс, шт. Нью-Джерси), донепезил (ARICEPT®, Токио, Япония), ривастигмин (EXELON®, Ист-Хановер, шт. Нью-Джерси) или галантамин (REMINYL®, Нью-Брансуик, шт. Нью-Джерси), могут предупреждать ухудшение некоторых симптомов в течение ограниченного периода времени. Другое лекарственное средство, мемантин (NAMENDA®, Нью-Йорк, шт. Нью-Йорк), разрешено для лечения AD от средней до тяжелой степени. Лекарственные средства могут воздействовать также на психиатрические проявления AD. Некоторые лекарственные средства могут помогать также контролировать поведенческие симптомы AD, такие как бессонница, возбуждение, блуждание, тревога и депрессия. Лечение этих симптомов часто делает жизнь пациентов более комфортной и облегчает обслуживающему персоналу уход за ними. К сожалению, несмотря на значительные успехи лечения, демонстрирующие, что этот класс агентов существенно превосходит по эффективности плацебо, болезнь продолжает прогрессировать, а влияние на умственные функции в среднем является очень ограниченным. Многие лекарственные средства, применяемые для лечения AD, такие, например, как ChEI, обладают также побочными действиями, которые включают желудочно-кишечные нарушения, токсичность для печени и потерю веса.
Еще одним заболеванием, обусловленным или ассоциированным с накоплением и отложением амилоидоподобного белка, является дегенерация желтого пятна.
Дегенерация желтого пятна представляет собой обычное заболевание глаза, которое вызывает деградацию желтого пятна, т.е. центральной области сетчатки (тонкий слой ткани на задней части глаза, откуда светочувствительные клетки посылают зрительные сигналы в головной мозг). Желтое пятно опосредует острое, четкое, «неискаженное» зрение. Повреждение желтого пятна приводит к развитию слепых пятен и затуманенному или нарушенному зрению. Связанная с возрастом дегенерация желтого пятна (AMD) является основной причиной ухудшения зрения в Соединенных Штатах, и у людей старше 65 лет она представляет собой основную причину медицински подтвержденной слепоты среди лиц кавказской расы. Примерно 1,8 миллионов американцев в возрасте 40 лет и старше имеют развитую AMD, а еще у 7,3 миллионов людей с умеренной AMD имеется значительный риск потери зрения. По оценкам правительства к 2020 г. 2,9 миллиона людей будут иметь развитую AMD. Жертвы AMD часто бывают удивлены и расстроены, когда узнают, как мало известно о причинах и методах лечения этого состояния слепоты.
Существуют две формы дегенерации желтого пятна: сухая дегенерация желтого пятна и влажная дегенерация желтого пятна. Сухая форма, при которой клетки желтого пятна медленно начинают разрушаться, диагностирована в 85 процентов случаев дегенерации желтого пятна. Как правило, сухая AMD поражает оба глаза, хотя при этом один глаз может потерять зрение, а второй глаз может оставаться непораженным. Обычно ранними признаками сухой AMD являются друзы, которые представляют собой отложения желтого тела под сетчаткой. Риск возникновения развитой сухой AMD или влажной AMD повышается с увеличением количества или размера друз. Сухая AMD может прогрессировать и вызывать потерю зрения, не превращаясь во влажную форму заболевания; однако на ранней стадии сухая AMD может внезапно переходить во влажную форму.
Хотя на долю влажной формы приходится только 15 процентов случаев, она в 90 процентах приводит к слепоте, и ее рассматривают как развитую AMD (не существует ранней или промежуточной стадии влажной AMD). Влажной AMD всегда предшествует сухая форма заболевания. При прогрессировании сухой формы у некоторых людей начинается патологический рост кровеносных сосудов позади желтого пятна. Эти сосуды являются очень хрупкими, и из них просачивается жидкость и кровь (отсюда название «влажная» дегенерация желтого пятна), приводя к быстрому повреждению желтого пятна.
Сухая форма AMD первоначально часто вызывает слегка затуманенное зрение. Затем, прежде всего, центральная часть зрительного поля может становиться затуманенной, и эта область увеличивается в размерах по мере прогрессирования заболевания. Если поражен только один глаз, то симптомы могут оставаться незамеченными. В случае влажной AMD прямые линии могут представляться волнистыми и при этом может быстро наступать потеря центрального зрения.
Для установления диагноза дегенерации желтого пятна, как правило, проводят исследование расширенного глаза (зрачка), тест на остроту зрения и обследование задней стенки глаза с использованием процедуры, называемой фундоскопией, помогающей установлению диагноза AMD, и, если имеется предположение о наличии влажной AMD, то может быть проведена ангиография с использованием флуоресцеина. В настоящее время отсутствуют средства лечения, позволяющие предупреждать потерю зрения, если сухая AMD достигла развитой стадии. Однако применение определенной композиции, содержащей высокую дозу антиоксидантов и цинка, может замедлять или предупреждать прогрессирование промежуточной стадии AMD, приводящее к переходу в развитую стадию. Macugen® (инъекция пегаптаниба натрия), лазерное фотокоагулирование и фотодинамическая терапия позволяют контролировать патологический рост кровеносных сосудов и кровоизлияние в желтом пятне, что является полезным для определенной группы людей с влажной AMD; однако зрение, если оно уже потеряно, не может быть восстановлено с помощью таких методов. Если зрение потеряно, то существуют средства для слабого зрения, которые могут помогать улучшать качество жизни.
Одним из самых ранних признаков связанной с возрастом дегенерации желтого пятна (AMD) является накопление внеклеточных отложений, известных как друзы, в области, находящейся между базальным слоем пигментированного эпителия сетчатки (RPE) и базальной оболочкой Бруха (ВМ). Результаты современных исследований, проведенных Anderson с соавторами, подтвердили, что друзы содержат амилоид-бета (Experimental Eye Research 78, 2004, сс. 243-256).
В настоящее время проводятся исследования, в которых изучают факторы окружающей среды, генетические и связанные с питанием факторы, которые могут влиять на AMD. Исследуют также новые стратегии лечения, включая применение трансплантатов клеток сетчатки, лекарственных средств, которые должны предупреждать или замедлять прогрессирование заболевания, лучевой терапии, генной терапии, компьютерного чипа, имплантированного в сетчатку, который может помогать стимулировать зрение, и агентов, которые должны предупреждать рост новых кровеносных сосудов под желтым пятном.
Важным фактором, который необходимо принимать во внимание при разработке новых лекарственных средств, является простота их применения пациентами, для которых они предназначены. На долю вводимых оральным путем лекарственных средств, в частности, таблеток, капсул и мягких гелей, приходится 70% всех применяемых лекарственных форм из-за удобства их применения пациентами. Разработчики лекарственных средств признают, что пациенты предпочитают оральное применение по сравнению с инъекциями, или другими более инвазивными формами, применяемыми в медицине. Также предпочтительными являются препаративные формы, которые позволяют снижать количество доз (т.е. формы, применяемые один раз в день, или формы с пролонгированным высвобождением). Простота применения антибиотиков в виде оральных лекарственных форм приводит к тому, что соблюдение пациентом режима и схемы лечения в процессе лечения улучшается.
Таким образом, необходима разработка эффективных способов и композиций, предназначенных для предупреждения или направленных на борьбу с осложнениями, ассоциированными с амилоидозом, представляющим собой группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь только ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), деменция, связанная с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландского типа); комплекс деменции Гуама-Паркинсона, а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна. В частности, существует необходимость в разработке агентов, которые обладают способностью противодействовать физиологическим проявлениям заболевания, таким как образование бляшек, ассоциированное с агрегацией волокон амилоида или амилоидоподобного пептида. Было установлено, что антитела к амилоидам, которые вырабатываются при инокуляции Аβ1-42 в смеси с полным или неполным адъювантом Фрейнда, обладают способностью снижать амилоидную загрузку у трансгенных мышей, на которых смоделирована человеческая болезнь Альцгеймера (Schenk и др., 1999). Внутрибрюшинная инокуляция тетрапальмитоилированного Аβ1-16, реконструированного в липосомах, трансгенным мышам линии NORBA приводила к получению высоких титров антител к амилоидам, которые, как установлено, обладали способностью солюбилизировать амилоидные волокна и бляшки in vitro и in vivo (Nicolau и др., 2002).
Впервые гипотеза о возможном механизме, посредством которого происходит растворение амилоидных бляшек и волокон, была предложена Bard с соавторами, 2000, которые сделали заключение о том, что антитела опсонизируют бляшки, которые затем разрушаются макрофагами микроглии. De Mattos с соавторами, 2001 установили, что МАт к центральному домену β-амилоида обладает способностью связываться и полностью разрушать амилоид в плазме. Они доказали, что присутствие указанных МАт в кровотоке сдвигает равновесие Аβ между головным мозгом и плазмой в сторону периферического клиренса и катаболизма вместо накопления в головном мозге.
Длительное лечение человека антителами грызунов можно вызывать антиглобулиновый ответ, который выявляется примерно на 8-12 день после введения и достигает пика примерно через 20-30 дней. Если такой антиглобулиновый ответ обнаружен, то лечение необходимо прерывать не более чем через примерно 10 дней, и повторную обработку в более поздний момент времени, как правило, не проводят, поскольку она может приводить к быстрому возникновению вторичного антиглобулинового ответа. Хотя для антител грызунов характерен заметный уровень консервативности последовательностей с человеческими антителами, существует много различий в последовательностях грызунов и человека, что является достаточным для иммуногенности антител грызунов для человека.
Эту проблему можно решить путем создания антител непосредственно в организме человека или путем создания «гуманизированных» (известных также как «реконструированные» антитела). Гуманизированные антитела содержат аминокислотную последовательность вариабельной области, которая несет полученные из антител грызунов CDR, распределенные в человеческих или напоминающих человеческие последовательностях каркасных участков. Поскольку специфичность гуманизированного антитела обеспечивается полученными из антител грызунов CDR, эти остатки следует применять практически в неизмененном виде, при этом допустимы лишь минорные модификации, которые не оказывают существенного воздействия на аффинность и специфичность антитела в отношении его антигена-мишени. Каркасные остатки можно получать из вариабельной области антитела любого примата или прежде всего из любой человеческой вариабельной области или их комбинации и созданную в результате вариабельную область следует рассматривать как реконструированную.
Для максимизации вероятности того, что аффинность будет сохраняться в реконструированном антителе, важно осуществлять соответствующий отбор каркасного участка. Известно, что последовательности каркасных участков служат для поддержания CDR в их правильной пространственной ориентации для взаимодействия с антигеном, и что каркасные остатки могут иногда даже принимать участие в связывании антигена. Для поддержания аффинности антитела к его антигену целесообразно выбирать последовательности человеческих каркасных участков, обладающие наибольшим подобием с последовательностями каркасных участков грызунов. Затем может оказаться необходимым заменять одну или несколько аминокислот в последовательности человеческого каркасного участка на соответствующий остаток в каркасном участке грызунов для того, чтобы избежать потери аффиности. Эту замену можно осуществлять с помощью компьютерного моделирования.
Настоящее изобретение относится к новым способам и композициям, которые содержат обладающие высокой специфичностью и высокой эффективность антитела, прежде всего химерные антитела, включая их фрагменты, более конкретно частично или полностью гуманизированные антитела, включая их фрагменты, которые обладают способностью распознавать и связываться со специфическими эпитопами ряда β-амилоидных антигенов, которые могут презентоваться антителу в мономерной, димерной, тримерной и т.д., полимерной форме, в форме агрегата, волокон, филаментов или в конденсированной форме бляшки. Антитела, предлагаемые в настоящем изобретении, наиболее предпочтительно применять для лечения амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь только ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), деменция, связанная с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландского типа); комплекс деменции Гуама-Паркинсона, а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, наследственная церебральная геморрагия с амилоидозом (голландского типа), болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, но не ограничиваясь указанными заболеваниями.
Краткое изложение сущности изобретения
Одним из вариантов осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который распознает и связывается по меньшей мере с одним индивидуальным определенным сайтом связывания, прежде всего по меньшей мере с двумя индивидуальными сайтами связывания и более предпочтительно по меньшей мере с тремя индивидуальными сайтами связывания на β-амилоидном белке, при этом каждый из указанного одного, указанных по меньшей мере двух, указанных по меньшей мере трех сайтов связывания содержит по меньшей мере один или два последовательно расположенных аминокислотных остатка, которые преимущественно участвуют в связывание антитела.
В частности, химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в изобретении, связывается по меньшей мере с двумя, прежде всего по меньшей мере с тремя индивидуальными сайтами связывания на β-амилоидном белке, при этом по меньшей мере два из трех индивидуальных сайтов связывания содержат по меньшей мере два последовательно расположенных аминокислотных остатка, которые преимущественно участвуют в связывание антитела, и по меньшей мере один из трех индивидуальных сайтов связывания содержит по меньшей мере один аминокислотный остаток.
По меньшей мере два индивидуальных сайта связывания, которые содержат по меньшей мере два последовательно расположенных аминокислотных остатка, преимущественно участвующих в связывании антитела, локализованы в непосредственной близости относительно друг друга на антигене, разделены и/или фланкированы по меньшей мере одним аминокислотным остатком, который не участвует в связывании антитела, или участвует в существенно меньшей степени по сравнению с двумя указанными последовательно расположенными аминокислотными остатками, формируя тем самым конформационный прерывистый эпитоп.
По меньшей мере три индивидуальных сайтов связывания, которые содержат по меньшей мере два последовательно расположенных аминокислотных остатка и по меньшей мере один аминокислотный остаток соответственно, преимущественно участвующих в связывании антитела, локализованы в непосредственной близости относительно друг друга на эпитопе, разделены и/или фланкированы по меньшей мере одним аминокислотным остатком, который не участвует в связывании антитела или участвует в существенно меньшей степени по сравнению с аминокислотными остатками, которые преимущественно участвуют в связывание антитела, формируя тем самым конформационный прерывистый эпитоп.
В частности, предложено химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который распознает и связывается по меньшей мере с одним индивидуальным сайтом связывания, прежде всего по меньшей мере с двумя индивидуальными сайтами связывания, более предпочтительно по меньшей мере с тремя индивидуальными сайтами связывания на β-амилоидном белке, при этом каждый из указанного по меньшей мере одного или указанных по меньшей мере двух сайтов связывания содержит по меньшей мере два последовательно расположенных аминокислотных остатка, которые преимущественно участвуют в связывание антитела, где по меньшей мере два последовательно расположенных аминокислотных остатка, образующие первый сайт связывания, представляют собой -Phe-Phe-, встроенные в следующую коровую последовательность (SEQ ID NO: 9):
Хаа3-Phe-Phe-Хаа4-Xaa5-Хаа6, где
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile;
Хаа4 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, Ser и Ile;
Xaa5 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp;
Хаа6 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, и где указанные аминокислотные Хаа3, Хаа4, Хаа5 и Хаа6 не участвуют в связывании антитела, или участвуют в существенно меньшей степени по сравнению с сайтом связывания -Phe-Phe-.
Другим вариантом изобретения является химерное антитело или его фрагмент или гуманизированное антитело или его фрагмент, в котором
Хаа3 обозначает Val или Leu, но предпочтительно Val;
Хаа4 обозначает Ala или Val, но предпочтительно Ala;
Xaa5 обозначает Glu или Asp, но предпочтительно Glu;
Хаа6 обозначает Glu или Asp, но предпочтительно Asp.
В частности, предложено химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который распознает и связывается по меньшей мере с одним индивидуальным сайтом связывания, прежде всего по меньшей мере с двумя индивидуальными сайтами связывания, более предпочтительно по меньшей мере с тремя индивидуальными сайтами связывания на β-амилоидном белке, при этом указанные индивидуальные сайты связывания содержат по меньшей мере один и по меньшей мере два последовательно расположенных аминокислотных остатка соответственно, которые преимущественно участвуют в связывание антитела, где по меньшей мере два последовательно расположенных аминокислотных остатка, образующие первый сайт связывания, представляют собой -Phe-Phe-, и по меньшей мере один аминокислотный остаток представляет собой -His-, встроенные в следующую коровую последовательность:
-Xaa1-His-Хаа3-Хаа4-Xaa5-Хаа6-Phe-Phe-Хаа7-Xaa8-Хаа9-, в которой
Xaa1 обозначает аминокислотный остаток, выбранный из группы, включающей His, Asn, Gln, Lys и Arg,
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Asn и Gln,
Хаа4 обозначает аминокислотный остаток, выбранный из группы, включающей His, Asn, Gln, Lys и Arg,
Xaa5 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, Ser и Ile;
Хаа6 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile,
Xaa7 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu и Не,
Xaa8 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp,
Хаа9 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, и где аминокислотные остатки Xaa1, Хаа3, Хаа6, Хаа7, Xaa8 и Хаа9 не участвуют в связывании антитела или участвуют в существенно меньшей степени по сравнению с сайтом связывания -His- и -Phe-Phe- соответственно.
Другим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, в котором
Хаа3 обозначает Gln или Asn, но предпочтительно Gln;
Хаа4 обозначает Lys;
Xaa5 обозначает Leu;
Хаа6 обозначает Val или Leu, но предпочтительно Val;
Хаа7 обозначает Ala или Val, но предпочтительно Ala;
Xaa8 обозначает Glu или Asp, но предпочтительно Glu; и
Хаа9 обозначает Asp или Glu, но предпочтительно Asp.
Следующим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который распознает и связывается по меньшей мере с одним индивидуальным сайтом связывания, прежде всего по меньшей мере с двумя индивидуальными сайтами связывания, более предпочтительно по меньшей мере с тремя индивидуальными сайтами связывания на β-амилоидном белке, при этом каждый из указанного по меньшей мере одного или по меньшей мере из указанных двух индивидуальных сайтов связывания содержит по меньшей мере два последовательно расположенных аминокислотных остатка, которые преимущественно участвуют в связывании антитела, где по меньшей мере два последовательно расположенных аминокислотных остатка, образующие второй сайт связывания, представляют собой -Lys-Leu-, встроенные в следующую коровую последовательность (SEQ ID NO: 10):
Xaa1-Хаа2-Lys-Leu-Хаа3, в которой
Xaa1 обозначает аминокислотный остаток, выбранный из группы, включающей His, Asn, Gln Lys и Arg;
Хаа2 обозначает аминокислотный остаток, выбранный из группы, включающей Asn и Gln;
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile; и где аминокислотные остатки Хаа2, Хаа3 не участвуют в связывании антитела, или участвуют в существенно меньшей степени по сравнению с сайтом связывания -Lys-Leu-.
Следующим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который распознает и связывается по меньшей мере с одним индивидуальным сайтом связывания, прежде всего по меньшей мере с двумя индивидуальными сайтами связывания, более предпочтительно по меньшей мере с тремя индивидуальными сайтами связывания на β-амилоидном белке, при этом указанные индивидуальные сайты связывания содержат по меньшей мере один и по меньшей мере два последовательно расположенных аминокислотных остатка соответственно, которые преимущественно участвуют в связывании антитела, где по меньшей мере один и по меньшей мере два последовательно расположенных аминокислотных остатка, которые разделены по меньшим мере одним аминокислотным остатком, не участвующим в связывании антитела или участвующим в существенно меньшей степени по сравнению с аминокислотными остатками, которые преимущественно участвуют в связывание антитела, представляют собой -His- и -Lys-Leu- соответственно, встроенные в следующую коровую последовательность:
His-Хаа2-Lys-Leu-Хаа3-Хаа4-Xaa5-Xaa6-Xaa7-Xaa8-, в которой
Хаа2 обозначает аминокислотный остаток, выбранный из группы, включающей Asn и Gln;
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile;
Xaa4 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile;
Xaa5 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile;
Хаа6 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, Ser и Ile;
Xaa7 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp;
Xaa8 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp,
и где аминокислотные остатки Хаа2, Хаа3, Хаа6, Хаа7, Xaa8 не участвуют в связывании антитела, или участвуют в существенно меньшей степени по сравнению с сайтом связывания -His- и -Lys-Leu- соответственно.
Другим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, в котором
Хаа2 обозначает Gln или Asn, но предпочтительно Gln;
Хаа3 обозначает Val или Leu, но предпочтительно Val;
Хаа4 обозначает Phe;
Xaa5 обозначает Phe;
Хаа6 обозначает Ala или Val, но предпочтительно Ala;
Хаа7 обозначает Glu или Asp, но предпочтительно Glu; и
Xaa8 обозначает Asp или Glu, но предпочтительно Asp.
Следующим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который распознает и связывается по меньшей мере с двумя индивидуальными сайтами связывания на β-амилоидном белке, при этом каждый из по меньшей мере двух указанных сайтов связывания содержит по меньшей мере два последовательно расположенных аминокислотных остатка, которые преимущественно участвуют в связывании антитела, где по меньшей мере два последовательно расположенных аминокислотных остатка, которые разделены по меньшим мере одним аминокислотным остатком, не участвующим в связывании антитела, или участвующим в существенно меньшей степени по сравнению с последовательно расположенными, аминокислотными остатками, такими как -Phe-Phe- и -Lys-Leu- соответственно, образуют первый и второй сайт связывания, встроенные в следующую коровую последовательность:
Xaa1-Хаа2-Lys-Leu-Хаа3-Phe-Phe-Хаа4-Xaa5-Хаа6, в которой
Xaa1 обозначает аминокислотный остаток, выбранный из группы, включающей His, Asn, Gln Lys и Arg;
Хаа2 обозначает аминокислотный остаток, выбранный из группы, включающей Asn и Gln;
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile;
Хаа4 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, Ser и Ile;
Xaa5 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp;
Хаа6 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, и где аминокислотные остатки Хаа2, Хаа3, Хаа4, Xaa5 и Хаа6 не участвуют в связывании антитела, или участвуют в существенно меньшей степени по сравнению с сайтом связывания -Lys-Leu- и -Phe-Phe- соответственно.
Следующим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который распознает и связывается по меньшей мере с одним индивидуальным сайтом связывания, прежде всего по меньшей мере с двумя индивидуальными сайтами связывания, более предпочтительно по меньшей мере с тремя индивидуальными сайтами связывания на β-амилоидном белке, при этом указанные индивидуальные сайты связывания содержат по меньшей мере один и по меньшей мере два последовательно расположенных аминокислотных остатка соответственно, которые преимущественно участвуют в связывании антитела, где по меньшей мере один и по меньшей мере два последовательно расположенных аминокислотных остатка разделены по меньшим мере одним аминокислотным остатком, не участвующим в связывании антитела или участвующим в существенно меньшей степени по сравнению с аминокислотными остатками, которые преимущественно участвуют в связывании антитела, и где указанные аминокислотные остатки представляют собой -His- и -Phe-Phe- и -Lys-Leu- соответственно, встроенные в следующую коровую последовательность:
His-Хаа2-Lys-Leu-Хаа3-Phe-Phe-Хаа4-Xaa5-Хаа6, в которой
Хаа2 обозначает аминокислотный остаток, выбранный из группы, включающей Asn и Gln;
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile;
Хаа4 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, Ser и Ile;
Xaa5 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp;
Хаа6 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, и где аминокислотные остатки Хаа2, Хаа3, Хаа4, Xaa5, Хаа6 не участвуют в связывании антитела, или участвуют в существенно меньшей степени по сравнению с сайтом связывания -His-, -Lys-Leu- и -Phe-Phe- соответственно.
Другим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, в котором
Хаа2 обозначает Gln или Asn, но предпочтительно Gln;
Хаа3 обозначает Val или Leu, но предпочтительно Val;
Хаа4 обозначает Ala или Val, но предпочтительно Ala;
Xaa5 обозначает Glu или Asp, но предпочтительно Glu, и
Хаа6 обозначает Asp или Glu, но предпочтительно Asp.
Следующим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/которое распознает и связывается по меньшей мере с двумя индивидуальными сайтами связывания на β-амилоидном белке, при этом каждый из по меньшей мере двух индивидуальных сайтов связывания содержит по меньшей мере два последовательно расположенных аминокислотных остатка, которые преимущественно участвуют в связывании антитела, где по меньшей мере два последовательно расположенных аминокислотных остатка разделены по меньшим мере одним аминокислотным остатком, не участвующим в связывании антитела или участвующим в существенно меньшей степени по сравнению с указанными последовательно расположенными аминокислотными остатками, представляющими собой -Phe-Phe- и -Lys-Leu- соответственно, которые образуют первый и второй сайт связывания, встроенные в следующую коровую последовательность:
Xaa1-Хаа2-Lys-Leu-Хаа3-Phe-Phe-Хаа4-Xaa5-Хаа6, в которой
Xaa1 обозначает аминокислотный остаток, выбранный из группы, включающей His, Asn, Gln, Lys и Arg;
Хаа2 обозначает аминокислотный остаток, выбранный из группы, включающей Asn и Gln;
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Val, Ala, Leu, Met, Phe, норлейцин и Ile;
Хаа4 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu и Ile;
Xaa5 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp;
Хаа6 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, и где аминокислотные остатки Хаа2, Хаа3, Хаа4, Xaa5, Хаа6 не участвуют в связывании антитела, или участвуют в существенно меньшей степени по сравнению с сайтами связывания -Lys-Leu- и -Phe-Phe- соответственно.
Другим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, в котором
Xaa1 обозначает His или Arg, но предпочтительно His;
Хаа2 обозначает Gln или Asn, но предпочтительно Gln;
Хаа3 обозначает Val или Leu, но предпочтительно Val;
Хаа4 обозначает Ala или Val, но предпочтительно Ala;
Xaa5 обозначает Glu или Asp, но предпочтительно Glu, и
Хаа6 обозначает Asp или Glu, но предпочтительно Asp.
Следующим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который распознает и связывается по меньшей мере с двумя индивидуальными сайтами связывания на β-амилоидном белке, при этом каждый из по меньшей мере двух индивидуальных сайтов связывания содержит по меньшей мере два последовательно расположенных аминокислотных остатка, которые преимущественно участвуют в связывании антитела, представляющие собой -Phe-Phe-Ala-Glu-, прежде всего -Phe-Phe-Ala-, но наиболее предпочтительно -Phe-Phe- и -Lys-Leu- соответственно, и указанные по меньшей мере два индивидуальных сайтов связывания имеют аминокислотную последовательность -Val-Phe-Phe-Ala-Glu-Asp-, представленную в SEQ ID NO: 7, и аминокислотную последовательность His-Gln-Lys-Leu-Val-, представленную в SEQ ID NO: 8, соответственно.
Одним из вариантов осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который распознает и связывается по меньшей мере с одним индивидуальным сайтом связывания, прежде всего по меньшей мере с двумя индивидуальными сайтами связывания, более предпочтительно по меньшей мере с тремя индивидуальными сайтами связывания на β-амилоидном белке, при этом указанный по меньше мере один или указанные по меньшей мере два индивидуальные сайты связывания содержит(ат) по меньшей мере один и по меньшей мере два последовательно расположенных аминокислотных остатка соответственно, преимущественно участвующие в связывании антитела, которые представляют собой -Phe-Phe- и -Lys-Leu и -His- соответственно, где указанные индивидуальные сайты связывания встроены в аминокислотную последовательность -Val-Phe-Phe-Ala-Glu- и аминокислотную последовательность -His-Gln-Lys-Leu-Val- соответственно.
Следующим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который распознает и связывается по меньшей мере с двумя индивидуальными сайтами связывания на β-амилоидном белке, каждый из которых содержит по меньшей мере два последовательно расположенных аминокислотных остатка в аминокислотных последовательностях,
представленных в SEQ ID NO: 7 и 8 соответственно, где указанные последовательно расположенные аминокислотные остатки, прежде всего -Phe-Phe- и -Lys-Leu-, преимущественно участвуют в связывании β-амилоидного белка.
Следующим конкретным вариантом осуществления изобретения является антитело или его фрагмент, предлагаемое/предлагаемый в изобретении, которое/который связывается с 4 индивидуальными сайтами связывания на β-амилоидном белке, при этом 4 индивидуальных сайтов связывания включают 2 сайта связывания, каждый из которых содержит один аминокислотный остаток, и 2 сайта связывания, каждый из которых содержит два последовательно расположенных аминокислотных остатка, которые преимущественно участвуют в связывании антитела, где указанные 4 индивидуальных сайта связывания локализованы в непосредственной близости относительно друг друга на β-амилоидном белке и где указанные 4 сайта связывания разделены по меньшей мере одним аминокислотным остатком, который не участвует в связывании антитела или участвует в существенно меньшей степени по сравнению с указанным одним аминокислотным остатком, и указанными двумя последовательно расположенными аминокислотными остатками 4 индивидуальных сайтов связывания, образуя тем самым конформационный прерывистый эпитоп.
В частности, первые из двух последовательно расположенных аминокислотных остатков, преимущественно участвующих в связывании антитела, представляют собой -Lys-Leu-, а вторые из по меньшей мере двух последовательно расположенных аминокислотных остатков представляют собой -Phe-Phe-, первый из одиночных аминокислотных остатков представляет собой -His-, а второй из одиночных аминокислотных остатков представляет собой -Asp-, которые встроены в следующую коровую последовательность: -Xaa1-His-Хаа2-Lys-Leu-Хаа3-Phe-Phe-Хаа4-Xaa5-Asp-Хаа6, в которой
Xaa1 обозначает аминокислотный остаток, выбранный из группы, включающей His, Asn, Gln, Lys и Arg, но предпочтительно His;
Хаа2 обозначает аминокислотный остаток, выбранный из группы, включающей Asn и Gln, но предпочтительно Gln;
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile, но предпочтительно Val;
Хаа4 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, Ser и Ile, предпочтительно Ala;
Xaa5 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, предпочтительно Glu;
Хаа6 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile, предпочтительно Val; где аминокислотные остатки Xaa1, Хаа2, Хаа3, Хаа4, Xaa5, Хаа6 не участвуют в связывании антитела, или участвуют в существенно меньшей степени по сравнению с сайтом связывания -His-, -Asp-, -Lys-Leu и -Phe-Phe-.
Одним из вариантов осуществления изобретения является антитело или его фрагмент, предлагаемое/предлагаемый в изобретении, которое/который связывается с 4 индивидуальными сайтами связывания на β-амилоидном белке, при этом 4 индивидуальных сайта связывания включают 2 сайта связывания, каждый из которых содержит один аминокислотный остаток, и два сайта связывания, каждый из которых содержит два последовательно расположенных аминокислотных остатка, при этом первые из двух последовательно расположенных аминокислотных остатков, преимущественно участвующих в связывании антитела, представляют собой -Lys-Leu-, а вторые из по меньшей мере двух последовательно расположенных аминокислотных остатков представляют собой -Phe-Phe-, первый из одиночных аминокислотных остатков представляет собой -His-, а второй из одиночных аминокислотных остатков представляет собой -Asp-, где остатки встроены в следующую коровую последовательность:
-Xaa1-His-Хаа2-Lys-Leu-Хаа3-Phe-Phe-Хаа4-Xaa5-Asp-Хаа6, в которой
Xaa1 обозначает аминокислотный остаток, выбранный из группы, включающей His, Asn, Gln, Lys и Arg, но предпочтительно His;
Хаа2 обозначает аминокислотный остаток, выбранный из группы, включающей Asn и Gln, но предпочтительно Gln;
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile, предпочтительно Val;
Хаа4 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, Ser и Ile, предпочтительно Ala;
Xaa5 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, предпочтительно Glu;
Хаа6 обозначает аминокислотный остаток, выбранный из группы, включающей Ala, Val, Leu, норлейцин, Met, Phe и Ile, предпочтительно Val; и где аминокислотные остатки Xaa1, Хаа2, Хаа3, Хаа4, Xaa5, Хаа6 не участвуют в связывании антитела или участвуют в существенно меньшей степени по сравнению с сайтом связывания -His-, -Asp-, -Lys-Leu и -Phe-Phe-.
В одном из вариантов осуществления изобретения указанные выше сайты распознавания и связывания образуют конформационный прерывистый эпитоп, локализованный в области β-амилоидного белка между аминокислотными остатками 12-24, прежде всего между остатками 14-23, более конкретно между аминокислотными остатками 14 и 20, при этом по меньшей мере каждый из двух индивидуальных сайтов распознавания и связывания, содержащих по меньше мере 2 аминокислотных остатка, локализован в положении 16 и 17 и в положении 19 и 20 соответственно, и при этом по меньшей мере один индивидуальный сайт распознавания и связывания, содержащий по меньшей мере 1 аминокислотный остаток, локализован в положении 14, при этом указанные остатки преимущественно участвуют в связывании β-амилоидного белка и при этом индивидуальные сайты распознавания и связывания по меньшей мере на одной стороне фланкированы аминокислотными остатками, прежде всего остатками 21 и 22, и разделены одним аминокислотным остатком, локализованным в положении 15 и 18, эти аминокислотные остатки не участвуют непосредственно в связывании антигена или участвуют по меньшей мере в существенно меньшей степени.
В еще одном варианте осуществления изобретения указанные по меньшей мере три индивидуальных сайта распознавания и связывания фланкированы на обоих концах аминокислотными остатками, прежде всего остатками 12 и 13 и остатками 21 и 22, и разделены одним аминокислотным остатком, локализованным в положении 15 и 18, эти аминокислотные остатки не участвуют непосредственно в связывании антигена или по меньшей мере участвуют в существенно меньшей степени.
В конкретном варианте осуществления изобретения указанные последовательно расположенные аминокислотные остатки, прежде всего -Lys-Leu- в положении 16 и 17 и -Phe-Phe- в положении 19 и 20, которые преимущественно участвуют в связывании β-амилоидного белка, встроены в следующую коровую область:
В другом конкретном варианте осуществления изобретения указанные аминокислотные остатки, прежде всего -Lys-Leu- в положении 16 и 17 и -Phe-Phe- в положении 19 и 20, и -His- в положении 14, которые преимущественно участвуют в связывании β-амилоидного белка, встроены в следующую коровую область:
Другим вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, которое/который содержит вариабельную область легкой и тяжелой цепи соответственно, по меньшей мере один CDR из нечеловеческого антитела, прежде всего два CDR из нечеловеческого антитела, более предпочтительно три CDR из нечеловеческого антитела, встроенные в один или несколько полученных организма человека или приматов каркасных участков, и необязательно константную область, полученную из антитела человека или приматов, где гуманизированное антитело или его фрагмент обладает способностью специфически распознавать и связывать β-амилоидный белок, прежде всего β-амилоидный мономерный пептид, более предпочтительно β-амилоидный полимерный пептид, еще более предпочтительно β-амилоидные волокна, фибриллы или филаменты в выделенном состоянии или в виде части β-амилоидной бляшки, в эпитопе, который содержит следующую аминокислотную последовательность (SEQ ID NO: 11):
Xaa1-Хаа2-Lys-Leu-Хаа3-Phe-Phe-Хаа4-Xaa5-Хаа6, в которой
Xaa1 обозначает аминокислотный остаток, выбранный из группы, включающей His, Asn, Gln, но предпочтительно His;
Хаа2 обозначает аминокислотный остаток, выбранный из группы, включающей Asn и Gln, но предпочтительно Gln; и
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Val, Leu и Ile, но предпочтительно Val;
Хаа4 обозначает аминокислотный остаток, выбранный из группы, включающей Ala и Val, но предпочтительно Ala;
Xaa5 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, но предпочтительно Glu;
Хаа6 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, но предпочтительно Asp.
Еще одним вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, которое/который содержит вариабельные области легкой и тяжелой цепи соответственно, по меньшей мере один CDR из нечеловеческого антитела, прежде всего два CDR из нечеловеческого антитела, более предпочтительно три CDR из нечеловеческого антитела, встроенные в один или несколько полученных из антитела человека или приматов каркасных участков, и необязательно константную область, полученную из антитела человека или приматов, где гуманизированное антитело или его фрагмент обладает способностью специфически распознавать и связывать β-амилоидный белок, прежде всего β-амилоидный мономерный пептид, более предпочтительно β-амилоидный полимерный пептид, еще более предпочтительно β-амилоидные волокна, фибриллы или филаменты в выделенном состоянии или в виде части β-амилоидной бляшки, в эпитопе, который содержит следующую аминокислотную последовательность:
His-Хаа2-Lys-Leu-Хаа3-Phe-Phe-Хаа4-Xaa5-Хаа6, в которой
Хаа2 обозначает аминокислотный остаток, выбранный из группы, включающей Asn и Gln, но предпочтительно Gln; и
Хаа3 обозначает аминокислотный остаток, выбранный из группы, включающей Val, Leu и Ile, но предпочтительно Val;
Хаа4 обозначает аминокислотный остаток, выбранный из группы, включающей Ala и Val, но предпочтительно Ala;
Xaa5 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, но предпочтительно Glu;
Хаа6 обозначает аминокислотный остаток, выбранный из группы, включающей Glu и Asp, но предпочтительно Glu; и где указанные аминокислотные остатки Хаа2, Хаа3, Хаа4, Xaa5, Хаа6, не участвуют в связывании антитела или участвуют в существенно меньшей степени по сравнению с сайтом связывания -His- и -Lys-Leu-, и -Phe-Phe-.
В конкретном варианте осуществления изобретения CDR из нечеловеческого антитела получают из донорского антитела, но предпочтительно из мышиного донорского антитела к фрагменту антигена, которое не содержит указанный индивидуальный сайт связывания. Этот сдвиг в эпитопной области можно по меньшей мере частично вызывать путем применения надмолекулярной антигенной конструкции, содержащей антигенный пептид, который соответствует аминокислотой последовательности β-амилоидного пептида, прежде всего β-амилоидного пептида Аβ1-16, модифицированного гидрофильным фрагментом, таким, например, как полиэтиленгликоль (ПЭГ), где гидрофильный фрагмент ковалентно связан с каждым концом антигенного пептида по меньшей мере через одну, прежде всего через одну или две аминокислоты, такие, например, как лизин, глутаминовая кислота и цистеин, или любую другую приемлемую аминокислоту или аналог аминокислоты, которые могут служить связующим элементом для сочетания гидрофильного фрагмента с описанным ниже пептидным фрагментом, в процессе иммунизации. Когда ПЭГ применяют в качестве гидрофильного фрагмента, то свободные концы ПЭГ ковалентно связывают с фосфатидилэтаноламином или любым другим соединением, которое может функционировать в качестве «заякоривающего» элемента, например, для встраивания антигенной конструкции в бислой липосомы, как представлено в настоящем описании.
В частности, CDR из нечеловеческого антитела получают из мышиного донорского антитела, которое обладает характерными свойствами антитела ACI-01-Ab7C2 (которое в настоящем описании обозначено также как «mC2»), депонированного в соответствии с требованиями Будапештского договора 01 декабря 2005 г. в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ), Брауншвейг, Mascheroder Weg 1 В, 38124 Braunschweig, под регистрационным номером DSM АСС2750.
В одном из вариантов осуществления изобретения CDR из нечеловеческого антитела получают из мышиного донорского антитела ACI-01-Ab7C2 (которое в настоящем описании обозначено также как «mC2»), депонированного в соответствии с требованиями Будапештского договора 01 декабря 2005 г. в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ), Брауншвейг, Mascheroder Weg 1 В, 38124 Braunschweig, под регистрационным номером DSM АСС2750).
В качестве компонента протокола иммунизации для сдвига эпитопной области можно применять также липид А.
Конкретным вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, содержащее/содержащий интегрированный в полученные из антитела человека или приматов каркасные участки по меньшей мере один пептид, аминокислотная последовательность которого выбрана из группы последовательностей, включающей SEQ ID NO:2, которая соответствует CDR2, и SEQ ID NO:3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR), и SEQ ID NO:4, которая соответствует CDR1 вариабельной области легкой цепи (LCVR).
Другим вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, где указанное гуманизированное антитело содержит интегрированный в полученные из антитела человека или приматов каркасные участки по меньшей мере один пептид, аминокислотная последовательность которого выбрана из группы последовательностей, включающей SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR).
Еще одним вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, где указанное гуманизированное антитело содержит интегрированный в полученные из антитела человека или приматов каркасные участки по меньшей мере один пептид, имеющий аминокислотную последовательность SEQ ID NO: 4, которая соответствует CDR1 вариабельной области легкой цепи (LCVR).
В частности, изобретение относится к вариабельной области легкой цепи (LCVR), которая содержит интегрированный в полученные из антитела человека или приматов каркасные участки по меньшей мере один пептид, имеющий аминокислотную последовательность SEQ ID NO: 4, которая соответствует CDR1 вариабельной области легкой цепи (LCVR).
Другим конкретным вариантом осуществления изобретения является вариабельная область тяжелой цепи (HCVR), которая содержит интегрированный в полученные из антитела человека или приматов каркасные участки по меньшей мере один пептид, аминокислотная последовательность которого выбрана из группы последовательностей, включающей SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR).
Изобретение относится также к гуманизированному антителу или его фрагменту, содержащему интегрированные в полученные из антитела человека или приматов каркасные участки по меньшей мере два пептида, эти пептиды являются различными и содержат аминокислотную последовательность, выбранную из группы последовательностей, включающей SEQ ID NO: 1, которая соответствует CDR1, SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR), и SEQ ID NO: 4, которая соответствует CDR1, SEQ ID NO: 5, которая соответствует CDR2, и SEQ ID NO: 6, которая соответствует CDR3 вариабельной области легкой цепи (LCVR), где один и тот же CDR не может присутствовать дважды в антителе. В частности, если по меньшей мере два присутствующих CDR оба представляют собой CDR вариабельной области легкой цепи (LCVR), то по меньшей мере один из указанных CDR должен представлять собой CDR1, которому соответствует SEQ ID NO: 4.
Изобретение относится также к гуманизированному антителу или его фрагменту, содержащему интегрированные в полученные из организма человека или приматов каркасные участки тяжелой цепи по меньшей мере два пептида, аминокислотная последовательность которых выбрана из группы последовательностей, включающей SEQ ID NO: 1, которая соответствует CDR1, SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR), но прежде всего к гуманизированному антителу или его фрагменту, в котором один и тот же CDR не может присутствовать дважды в антителе.
В частности, изобретение относится к вариабельной области тяжелой цепи (HCVR), которая содержит интегрированные в полученные из антитела человека или приматов каркасные участки тяжелой цепи по меньшей мере два пептида, аминокислотная последовательность которых выбрана из группы последовательностей, включающей SEQ ID NO: 1, которая соответствует CDR1, SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR).
Следующим вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, содержащее/содержащий интегрированные в полученные из антитела человека или приматов каркасные участки легкой цепи по меньшей мере два пептида, аминокислотная последовательность которых выбрана из группы последовательностей, включающей SEQ ID NO: 4, которая соответствует CDR1, SEQ ID NO: 5, которая соответствует CDR2, и SEQ ID NO: 6, которая соответствует CDR3 вариабельной области легкой цепи (LCVR).
В частности, изобретение относится к вариабельной области легкой цепи (LCVR), которая содержит интегрированные в полученные из антитела человека или приматов каркасные участки легкой цепи по меньшей мере два пептида, аминокислотная последовательность которых выбрана из группы последовательностей, включающей SEQ ID NO: 4, которая соответствует CDR1, SEQ ID NO: 5, которая соответствует CDR2, и SEQ ID NO: 6, которая соответствует CDR3 вариабельной области легкой цепи (LCVR), где один и тот же CDR не может присутствовать дважды в антителе, и, в частности, по меньшей мере один из указанных CDR должен представлять собой CDR1, которому соответствует SEQ ID NO: 4.
Изобретение относится также к гуманизированному антителу или его фрагменту, которое/который содержит интегрированные в полученные из антитела человека или приматов каркасные участки тяжелой цепи пептиды, имеющие аминокислотную последовательность SEQ ID NO: 1, которая соответствует CDR1, SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR), предпочтительно в указанном выше порядке.
В частности, изобретение относится к вариабельной области тяжелой цепи (HCVR), которая содержит интегрированные в полученные из антитела человека или приматов каркасные участки тяжелой цепи пептиды, имеющие аминокислотную последовательность SEQ ID NO: 1, которая соответствует CDR1, SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR), предпочтительно в указанном выше порядке.
Изобретение относится также к гуманизированному антителу или его фрагменту, которое/который содержит интегрированные в полученные из антитела человека или приматов каркасные участки легкой цепи пептиды, имеющие аминокислотную последовательность SEQ ID NO: 4, которая соответствует CDR1, SEQ ID NO: 5, которая соответствует CDR2, и SEQ ID NO: 6, которая соответствует CDR3 вариабельной области тяжелой цепи (LCVR), предпочтительно в указанном выше порядке.
В частности, изобретение относится к вариабельной области легкой цепи (LCVR), которая содержит интегрированные в полученные из антитела человека или приматов каркасные участки легкой цепи пептиды, имеющие аминокислотную последовательность SEQ ID NO: 4, которая соответствует CDR1, SEQ ID NO: 5, которая соответствует CDR2, и SEQ ID NO: 6, которая соответствует CDR3 вариабельной области легкой цепи (LCVR), предпочтительно в указанном выше порядке.
Изобретение относится также к гуманизированному антителу или его фрагменту, содержащему интегрированные в полученные из антитела человека или приматов каркасные участки по меньшей мере три пептида, которые имеют аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 1, которая соответствует CDR1, SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR), и SEQ ID NO: 4, которая соответствует CDR1, SEQ ID NO: 5, которая соответствует CDR2, и SEQ ID NO: 6, которая соответствует CDR3 вариабельной области легкой цепи (LCVR), но предпочтительно к гуманизированному антителу или его фрагменту, где один и тот же CDR не может присутствовать дважды в антителе.
Другим вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, где антитело содержит интегрированные в полученные из антитела человека или приматов каркасные участки по меньшей мере четыре пептида, которые имеют аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 1, которая соответствует CDR1, SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR), и SEQ ID NO: 4, которая соответствует CDR1, SEQ ID NO: 5, которая соответствует CDR2, и SEQ ID NO: 6, которая соответствует CDR3 вариабельной области легкой цепи (LCVR), но предпочтительно к гуманизированному антителу или его фрагменту, где один и тот же CDR не может присутствовать дважды в антителе.
Еще одним вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, содержащее/содержащий интегрированные в полученные из антитела человека или приматов каркасные участки по меньшей мере пять пептидов, которые имеют аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 1, которая соответствует CDR1, SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR), и SEQ ID NO: 4, которая соответствует CDR1, SEQ ID NO: 5, которая соответствует CDR2, и SEQ ID NO: 6, которая соответствует CDR3 вариабельной области легкой цепи (LCVR), но предпочтительно к гуманизированному антителу или его фрагменту, где один и тот же CDR не может присутствовать дважды в антителе.
Еще одним вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, которое/который содержат интегрированные в полученные из антитела человека или приматов каркасные участки пептиды, имеющие аминокислотную последовательность SEQ ID NO: 1, которая соответствует CDR1, SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR), и SEQ ID NO: 4, которая соответствует CDR1, SEQ ID NO: 5, которая соответствует CDR2, и SEQ ID NO: 6, которая соответствует CDR3 вариабельной области легкой цепи (LCVR).
Конкретным вариантом осуществления изобретения является гуманизированное антитело, его вариабельная область тяжелой цепи (HCVR) или фрагмент, где гуманизированное антитело, его вариабельная область тяжелой цепи (HCVR) или фрагмент содержит интегрированный в полученные из антитела человека или приматов каркасные участки тяжелой цепи по меньшей мере пептид, имеющий аминокислотную последовательность SEQ ID NO: 2, которая соответствует CDR2 вариабельной области тяжелой цепи (HCVR).
Другим конкретным вариантом осуществления изобретения является гуманизированное антитело, его вариабельная область тяжелой цепи (HCVR) или фрагмент, где гуманизированное антитело, его вариабельная область тяжелой цепи (HCVR) или фрагмент содержит интегрированный в полученные из антитела человека или приматов каркасные участки тяжелой цепи по меньшей мере пептид, имеющий аминокислотную последовательность SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR).
Другим конкретным вариантом осуществления изобретения являются гуманизированное антитело, его вариабельная область тяжелой цепи (HCVR) или фрагмент, где гуманизированное антитело, его вариабельная область тяжелой цепи (HCVR) или фрагмент содержит интегрированные в полученные из антитела человека или приматов каркасные участки тяжелой цепи по меньшей мере два пептида, имеющих аминокислотную последовательность SEQ ID NO: 1, которая соответствует CDR1, и SEQ ID NO: 2, которая соответствует CDR2 вариабельной области тяжелой цепи (HCVR).
Следующим конкретным вариантом осуществления изобретения является гуманизированное антитело, его вариабельная область тяжелой цепи (HCVR) или фрагмент, где гуманизированное антитело, его вариабельная область тяжелой цепи (HCVR) или фрагмент содержит интегрированные в полученные из антитела человека или приматов каркасные участки тяжелой цепи по меньшей мере два пептида, имеющих аминокислотную последовательность SEQ ID NO: 1, которая соответствует CDR1, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR).
Другим конкретным вариантом осуществления изобретения является гуманизированное антитело, его вариабельная область тяжелой цепи (HCVR) или фрагмент, где гуманизированное антитело, его вариабельная область тяжелой цепи (HCVR) или фрагмент содержит интегрированные в полученные из антитела человека или приматов каркасные участки тяжелой цепи по меньшей мере два пептида, имеющих аминокислотную последовательность SEQ ID NO: 2, которая соответствует CDR2, и SEQ ID NO: 3, которая соответствует CDR3 вариабельной области тяжелой цепи (HCVR).
Другим конкретным вариантом осуществления изобретения является гуманизированное антитело, его вариабельная область легкой цепи (LCVR) или фрагмент, где гуманизированное антитело, его вариабельная область легкой цепи (LCVR) или фрагмент содержит интегрированные в полученные из антитела человека или приматов каркасные участки легкой цепи по меньшей мере два пептида, имеющих аминокислотную последовательность SEQ ID NO: 4, которая соответствует CDR1, и SEQ ID NO: 5, которая соответствует CDR2 вариабельной области легкой цепи (LCVR).
Следующим конкретным вариантом осуществления изобретения является гуманизированное антитело, его вариабельная область легкой цепи (LCVR) или фрагмент, где гуманизированное антитело, его вариабельная область легкой цепи (LCVR) или фрагмент содержит интегрированные в полученные из антитела человека или приматов каркасные участки легкой цепи по меньшей мере два пептида, имеющих аминокислотную последовательность SEQ ID NO: 4, которая соответствует CDR1, и SEQ ID NO: 6, которая соответствует CDR3 вариабельной области легкой цепи (LCVR).
Кроме того, под объем изобретения подпадают гуманизированное антитело или его фрагмент, причем и из вариабельной области тяжелой цепи (HCVR), и из вариабельной области легкой цепи (LCVR) мышиного антитела С2 встраивают по меньшей мере один из их CDR-участков в по меньшей мере два CDR-участка гуманизированного антитела. Таким образом, полученное в результате гуманизированное антитело или его фрагмент содержит
- по меньшей мере одну аминокислотную последовательность SEQ ID NO: 1, которая соответствует CDR1 (HCVR), в сочетании с аминокислотной последовательностью SEQ ID NO: 4, которая соответствует CDR1 (LCVR);
- по меньшей мере одну аминокислотную последовательность SEQ ID NO: 2, которая соответствует CDR2 (HCVR), в сочетании с аминокислотной последовательностью SEQ ID NO: 4, которая соответствует CDR1 (LCVR);
- по меньшей мере одну аминокислотную последовательность SEQ ID NO: 3, которая соответствует CDR3 (HCVR), в сочетании с аминокислотной последовательностью SEQ ID NO: 4, которая соответствует CDR1 (LCVR);
- по меньшей мере одну аминокислотную последовательность SEQ ID NO: 1, которая соответствует CDR1 (HCVR), в сочетании с аминокислотной последовательностью SEQ ID NO: 5, которая соответствует CDR2 (LCVR);
- по меньшей мере одну аминокислотную последовательность SEQ ID NO: 2, которая соответствует CDR2 (HCVR), в сочетании с аминокислотной последовательностью SEQ ID NO: 5, которая соответствует CDR2 (LCVR);
- по меньшей мере одну аминокислотную последовательность SEQ ID NO: 2, которая соответствует CDR2 (HCVR), в сочетании с аминокислотной последовательностью SEQ ID NO: 6, которая соответствует CDR3 (LCVR);
- по меньшей мере одну аминокислотную последовательность SEQ ID NO: 1, которая соответствует CDR1 (HCVR), в сочетании с аминокислотной последовательностью SEQ ID NO: 6, которая соответствует CDR3 (LCVR);
- по меньшей мере одну аминокислотную последовательность SEQ ID NO: 3, которая соответствует CDR3 (HCVR), в сочетании с аминокислотной последовательностью SEQ ID NO: 5, которая соответствует CDR2 (LCVR);
- по меньшей мере одну аминокислотную последовательность SEQ ID NO: 3, которая соответствует CDR3 (HCVR), в сочетании с аминокислотной последовательностью SEQ ID NO: 6, которая соответствует CDR3 (LCVR).
Еще одним вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, описанное/описанный выше, где антитело содержит константную область легкой цепи и/или тяжелой цепи, полученную из антитела человека или приматов.
Еще одним вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, в котором по меньшей мере одна, прежде всего по меньшей мере одна, но не более 5, более предпочтительно по меньшей мере одна, но не более 4, еще более предпочтительно по меньшей мере одна, но не более 3, но наиболее предпочтительно по меньшей мере одна, но не более 2, аминокислот, присутствующих CDR-участках легкой цепи и/или тяжелой цепи, которые представлены в SEQ ID NO: 1-6, заменены путем консервативной замены таким образом, что антитело полностью сохраняет свою функциональную активность.
В частности, изобретение относится к химерному антителу или его фрагменту, либо к гуманизированному антителу или его фрагменту, в котором в CDR2 вариабельной области легкой цепи (LCVR), последовательность которого представлена в SEQ ID NO: 5, Lys в положении 50 согласно номенклатуре Кэбота заменен аминокислотным остатком, выбранным из группы, включающей Arg, Gln и Glu, предпочтительно Arg.
В частности, изобретение относится к вариабельной области легкой цепи (LCVR), в которой в CDR2, последовательность которого представлена в SEQ ID NO: 5, Lys в положении 50 согласно номенклатуре Кэбота заменен аминокислотным остатком, выбранным из группы, включающей Arg, Gln и Glu, предпочтительно Arg.
Другим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, в котором в CDR2 вариабельной области легкой цепи (LCVR), последовательность которого представлена в SEQ ID NO: 5, Ser в положении 53 согласно номенклатуре Кэбота заменен аминокислотным остатком, выбранным из группы, включающей Asn и Thr, но предпочтительно Asn.
В частности, изобретение относится к вариабельной области легкой цепи (LCVR), в которой в CDR2, последовательность которого представлена в SEQ ID NO: 5, Ser в положении 53 согласно номенклатуре Кэбота заменен аминокислотным остатком, выбранным из группы, включающей Asn и Thr, но предпочтительно Asn.
Одним из вариантов осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, в котором аминокислотная последовательность вариабельной области тяжелой цепи (HCVR) идентична на 90%, предпочтительно на 95%, более предпочтительно на 98% последовательности, представленной в SEQ ID NO: 15 и 16 соответственно.
Другим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, в котором аминокислотная последовательность вариабельной области легкой цепи (LCVR) идентична на 90%, предпочтительно на 95%, более предпочтительно на 98% последовательности, представленной в SEQ ID NO: 12 и 13 соответственно.
Еще одним вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, в котором аминокислотная последовательность по меньшей мере двух, но особенно предпочтительно трех CDR-участков вариабельной области тяжелой цепи (HCVR), идентична на 90%, предпочтительно на 95%, более предпочтительно на 98% последовательности соответствующего CDR-участка, представленной в SEQ ID NO: 1-3.
Еще одним вариантом осуществления изобретения является гуманизированное антитело или его фрагмент, в котором аминокислотная последовательность по меньшей мере двух, но особенно предпочтительно трех CDR-участков вариабельной области легкой цепи (LCVR), идентична на 90%, предпочтительно на 95%, более предпочтительно на 98% последовательности соответствующего CDR-участка, представленной в SEQ ID NO: 4-6.
Другим вариантом осуществления изобретения является описанное/описанный выше химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в настоящем изобретении, в котором аминокислотная последовательность вариабельной области тяжелой цепи (HCVR) идентична на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% последовательности, представленной в SEQ ID NO: 15 и 16 соответственно.
Еще одним вариантом осуществления изобретения является описанное выше химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в настоящем изобретении, в котором аминокислотная последовательность вариабельной области легкой цепи (LCVR) идентичная на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% последовательности, представленной в SEQ ID NO: 12 и 13 соответственно.
Другим вариантом осуществления изобретения является описанное выше химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в настоящем изобретении, в котором аминокислотная последовательность по меньшей мере одного, предпочтительно по меньшей мере двух, но особенно предпочтительно трех CDR-участков вариабельной области тяжелой цепи (HCVR) идентична на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% последовательности, соответствующего CDR-участка, представленной в SEQ ID NO: 1-3.
Другим вариантом осуществления изобретения является описанное выше химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в настоящем изобретении, в котором аминокислотная последовательность по меньшей мере одного, предпочтительно по меньшей мере двух, но особенно предпочтительно трех CDR-участков вариабельной области легкой цепи (LCVR) идентична на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% последовательности, соответствующего CDR-участка, представленной в SEQ ID NO: 4-6.
Еще одним вариантом осуществления изобретения является описанное выше гуманизированное антитело, предлагаемое в настоящем изобретении, в котором по меньшей мере одна из аминокислот, входящих в последовательности акцепторных каркасных участков, полученных из последовательностей Vh и Vk человеческой зародышевой линии соответственно, заменена на аминокислоту из соответствующей области мышиного антитела ACI-01-Ab7C2 или ее консервативную замену.
В частности, изобретение относится к вариабельной области тяжелой цепи и гуманизированному антителу, содержащему эту вариабельную область тяжелой цепи, соответственно, в которых Trp в положении 47 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Leu, норлейцин, Ile, Val, Met, Ala и Phe, предпочтительно Leu и Ile, но наиболее предпочтительно Leu, как показано в SEQ ID NO: 15.
Изобретение относится также к вариабельной области тяжелой цепи и гуманизированному антителу, содержащему эту вариабельную область тяжелой цепи, соответственно, в которых Arg в положении 94 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Ser и Thr, но особенно предпочтительно Ser, как показано в SEQ ID NO: 15.
Еще одним вариантом осуществления изобретения являются вариабельная область тяжелой цепи и гуманизированное антитело, содержащее эту вариабельную область тяжелой цепи, соответственно, в которых Trp в положении 47 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Leu, норлейцин, Ile, Val, Met, Ala и Phe, предпочтительно Leu и Ile, но особенно предпочтительно Leu, и Arg в положении 94 согласно номенклатуре Кэбота заменен аминокислотой, выбранной из группы, включающей Ser и Thr, но особенно предпочтительно Ser, как показано в SEQ ID NO: 15.
Изобретение относится также к вариабельной области легкой цепи и гуманизированному антителу, содержащему эту вариабельную область легкой цепи, соответственно, в которых Gln в положении 45 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VK человеческой зародышевой линии, которая относится к подгруппе VKII вариабельной области легкой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Lys, Arg, Gln и Asn, предпочтительно Lys и Arg, но особенно предпочтительно Lys.
Изобретение относится также к вариабельной области легкой цепи и гуманизированному антителу, содержащему эту вариабельную область легкой цепи, соответственно, в которых Tyr в положении 87 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VK человеческой зародышевой линии, которая относится к подгруппе VKII вариабельной области легкой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Phe, Leu, Val, Ile и Ala, предпочтительно Leu и Phe, но особенно предпочтительно Phe.
Изобретение относится также к вариабельной области легкой цепи и гуманизированному антителу, содержащему эту вариабельную область легкой цепи, соответственно, в которых Lys в положении 50 согласно номенклатуре Кэбота в CDR2-участке, полученном из мышиного моноклонального антитела, предпочтительно мышиного антитела ACI-01-Ab7C2, последовательность которого представлена в SEQ ID NO: 12, заменен аминокислотой, выбранной из группы, включающей Arg, Gln, His и Asn, но особенно предпочтительно Arg.
Еще одним вариантом осуществления изобретения являются вариабельная область легкой цепи и гуманизированное антитело, содержащее эту вариабельную область легкой цепи, соответственно, в которых Asn в положении 53 согласно номенклатуре Кэбота в CDR2-участке, полученном из мышиного моноклонального антитела, предпочтительно мышиного антитела ACI-01-Ab7C2, последовательность которого представлена в SEQ ID NO: 12, заменен аминокислотой, выбранной из группы, включающей Ala, Val, Leu, Ser и Ile; но предпочтительно Ser.
Еще одним предпочтительным вариантом осуществления изобретения является гуманизированное антитело, в котором Trp в положении 47 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Leu, норлейцин, Ile, Val, Met, Ala и Phe, предпочтительно Leu и Ile, но наиболее предпочтительно Leu, и Arg в положении 94 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Ser и Thr, но наиболее предпочтительно Ser, как показано в SEQ ID NO: 15, и Tyr в положении 87 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VK человеческой зародышевой линии, которая относится к подгруппе VKII вариабельной области легкой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Phe, Leu, Val, Ile и Ala, предпочтительно Leu и Phe, но наиболее предпочтительно Phe.
Еще одним вариантом осуществления изобретения является вариабельная область тяжелой цепи и гуманизированное антитело, содержащее эту вариабельную область тяжелой цепи, соответственно, в которых Trp в положении 47 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, показанной в SEQ ID NO: 15, заменен на Leu.
Еще одним вариантом осуществления изобретения является вариабельная область тяжелой цепи и гуманизированное антитело, содержащее эту вариабельную область тяжелой цепи, соответственно, в которых Arg в положении 94 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен на Ser, как показано в SEQ ID NO: 15.
Еще одним вариантом осуществления изобретения является вариабельная область тяжелой цепи и гуманизированное антитело, содержащее эту вариабельную область тяжелой цепи, соответственно, в которых Trp в положении 47 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VhIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен на Leu и Ile, но наиболее предпочтительно на Leu, и Arg в положении 94 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен на Ser, как показано в SEQ ID NO: 15.
Еще одним вариантом осуществления изобретения является вариабельная область легкой цепи и гуманизированное антитело, содержащее эту вариабельную область легкой цепи, соответственно, в которых Tyr в положении 87 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VK человеческой зародышевой линии, которая относится к подгруппе VKII вариабельной области легкой цепи согласно номенклатуре Кэбота, заменен на Phe.
Еще одним вариантом осуществления изобретения является вариабельная область тяжелой цепи и гуманизированное антитело, содержащее эту вариабельную область тяжелой цепи, соответственно, в которых Trp в положении 47 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен на Leu и Ile, но наиболее предпочтительно на Leu, и Arg в положении 94 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен на Ser, как показано в SEQ ID NO: 15, и Tyr в положении 87 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VK человеческой зародышевой линии, которая относится к подгруппе VKII вариабельной области легкой цепи согласно номенклатуре Кэбота, заменен на Phe.
Одним из вариантов осуществления изобретения является вариабельная область тяжелой цепи и гуманизированное антитело, содержащее эту вариабельную область тяжелой цепи, соответственно, в которых Trp в положении 47 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Leu, норлейцин, Ile, Val, Met, Ala и Phe, предпочтительно Leu и Ile, но наиболее предпочтительно Leu, и Arg в положении 94 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VhIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Ser и Thr, но наиболее предпочтительно Ser, как показано в SEQ ID NO: 15, и в которых Lys в положении 50 согласно номенклатуре Кэбота в CDR2-участке, полученном из мышиного моноклонального антитела, предпочтительно мышиного антитела ACI-01-Ab7C2, заменен аминокислотой, выбранной из группы, включающей Arg, Gln, His и Asn, но наиболее предпочтительно Arg.
Одним из вариантов осуществления изобретения является вариабельная область тяжелой цепи и гуманизированное антитело, содержащее эту вариабельную область тяжелой цепи, соответственно, в которых Trp в положении 47 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VhIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Leu, норлейцин, Ile, Val, Met, Ala и Phe, предпочтительно Leu и Ile, но наиболее предпочтительно Leu, и Arg в положении 94 согласно номенклатуре Кэбота в последовательности акцепторного каркасного участка, полученной из последовательностей VH человеческой зародышевой линии, которая относится к подгруппе VHIII вариабельной области тяжелой цепи согласно номенклатуре Кэбота, заменен аминокислотой, выбранной из группы, включающей Ser и Thr, но наиболее предпочтительно Ser, как показано в SEQ ID NO: 15, и в которых Asn в положении 53 согласно номенклатуре Кэбота в CDR2-участке, полученном из мышиного моноклонального антитела, предпочтительно мышиного антитела ACI-01-Ab7C2, заменен аминокислотой, выбранной из группы, включающей Ala, Val, Leu, Ser и Ile; но наиболее предпочтительно Ser.
Конкретным вариантом осуществления изобретения является вариабельная область легкой цепи, последовательность которой представлена в SEQ ID NO: 12.
Другим конкретным вариантом осуществления изобретения является гуманизированное антитело, содержащее вариабельную область легкой цепи, последовательность которой представлена в SEQ ID NO: 12.
Конкретным вариантом осуществления изобретения является вариабельная область легкой цепи, включая сигнальные последовательности, как показано в SEQ ID NO: 13.
Другим конкретным вариантом осуществления изобретения является гуманизированное антитело, содержащее полную вариабельную область легкой цепи, включая сигнальные последовательности, как показано в SEQ ID NO: 13.
Другим конкретным вариантом осуществления изобретения является гуманизированное антитело, содержащее вариабельную область легкой цепи, последовательность которой представлена в SEQ ID NO: 12, и константную область легкой цепи, последовательность которой представлена в SEQ ID NO: 14.
Следующим конкретным вариантом осуществления изобретения является гуманизированное антитело, содержащее полную вариабельную область легкой цепи, последовательность которой представлена в SEQ ID NO: 13, и константную область легкой цепи, последовательность которой представлена в SEQ ID NO: 14.
Конкретным вариантом осуществления изобретения является вариабельная область тяжелой цепи, последовательность которой представлена в SEQ ID NO: 15.
Другим конкретным вариантом осуществления изобретения является гуманизированное антитело, содержащее вариабельную область тяжелой цепи, последовательность которой представлена в SEQ ID NO: 15.
Конкретным вариантом осуществления изобретения является вариабельная область тяжелой цепи, включая сигнальные последовательности, как показано в SEQ ID NO: 16.
Другим конкретным вариантом осуществления изобретения является гуманизированное антитело, содержащее полную вариабельную область тяжелой цепи, включая сигнальные последовательности, как показано в SEQ ID NO: 16.
Следующим конкретным вариантом осуществления изобретения является гуманизированное антитело, содержащее вариабельную область тяжелой цепи, последовательность которой представлена в SEQ ID NO: 15, и константную область тяжелой цепи, последовательность которой представлена в SEQ ID NO: 17.
Другим конкретным вариантом осуществления изобретения является гуманизированное антитело, содержащее вариабельную область тяжелой цепи, последовательность которой представлена в SEQ ID NO: 16, и константную область тяжелой цепи, последовательность которой представлена в SEQ ID NO: 17.
В одном из вариантов осуществления гуманизированное антитело, предлагаемое в изобретении, и описанное выше, при совместной инкубации с мономерным Аβ-пептидом, который имеет по меньшей мере 30, предпочтительно по меньшей мере 35, более предпочтительно по меньшей мере 38, еще более предпочтительно по меньшей мере 40 аминокислотных остатков, и/или с полимерным растворимым амилоидным Аβ-пептидом, содержащим множество указанных мономерных Аβ-звеньев, но наиболее предпочтительно с мономерным Аβ1-42 и/или полимерным растворимым амилоидным Аβ-пептидом, содержащим множество указанных мономерных Aβ1-42-звеньев, прежде всего при соотношении молярных концентраций антитела и Аβ1-42 вплоть до 1:1000, предпочтительно вплоть до 1:500, более предпочтительно вплоть до 1:300, еще более предпочтительно вплоть до 1:200, но наиболее предпочтительно при соотношении молярных концентраций от 1:10 до 1:100, ингибирует агрегацию Аβ-мономеров, приводящую к образованию высокомолекулярных полимерных фибрилл.
В частности, совместную инкубацию антитела, предлагаемого в изобретении, с амилоидными мономерными и/или полимерными растворимыми амилоидными пептидами осуществляют в течение промежутка времени, составляющего от 24 до 60 ч, предпочтительно от 30 до 50 ч, более предпочтительно в течение 48 ч, но наиболее предпочтительно в течение 24 ч, при температуре от 28 до 40°С, предпочтительно от 32 до 38°С, наиболее предпочтительно при 37°С.
В конкретном варианте осуществления изобретения совместную инкубацию с амилоидными мономерными и/или полимерными растворимыми амилоидными пептидами осуществляют в течение 24 ч при температуре 37°С.
В частности, антитело, прежде всего гуманизированное антитело, предлагаемое в изобретении, включая любые функциональные эквиваленты антитела или его функциональные фрагменты, связывается с мономерным Aβ1-42-пептидом и/или полимерным растворимым амилоидным Аβ-пептидом, содержащим множество указанных мономерных Aβ1-42-звеньев, и при совместной инкубации с мономерным Аβ1-42-пептидом и/или полимерным растворимым амилоидным Аβ-пептидом, содержащим множество указанных мономерных Aβ1-42-звеньев, ингибирует агрегацию Аβ-мономеров, приводящую к образованию высокомолекулярных полимерных фибрилл.
В одном из вариантов осуществления изобретения антитело, прежде всего гуманизированное антитело, предлагаемое в изобретении, включая любые функциональные эквиваленты антитела или его функциональные фрагменты, ингибирует агрегацию мономеров Аβ и/или растворимых полимеров Аβ, содержащих множество указанных мономерных Аβ-звеньев, приводящую к образованию высокомолекулярных полимерных фибрилл, по меньшей мере на 50%, предпочтительно по меньшей мере на 60%, предпочтительно по меньшей мере на 65%, более предпочтительно по меньшей мере на 75%, еще более предпочтительно по меньшей мере на 80%, но наиболее предпочтительно по меньшей мере на 85%-90% или более, по сравнению с соответствующими мономерами амилоидного пептида, инкубированными в буфере (контроль), при соотношении молярных концентраций антитела и Аβ1-42 вплоть до 1:1000, предпочтительно при соотношении молярных концентраций от 1:10 до 1:100, но наиболее предпочтительно при соотношении молярных концентраций 1:10.
В конкретном варианте осуществления изобретения антитело, прежде всего гуманизированное антитело, предлагаемое в изобретении, включая любые функциональные эквиваленты антитела или его функциональные фрагменты, ингибирует агрегацию мономеров Аβ и/или растворимых полимеров Аβ, содержащих множество указанных мономерных Аβ-звеньев, приводящую к образованию высокомолекулярных полимерных фибрилл, по меньшей мере на 30% при соотношении молярных концентраций антитела и Аβ1-42 1:100.
В другом конкретном варианте осуществления изобретения антитело, прежде всего гуманизированное антитело, предлагаемое в изобретении, включая любые функциональные эквиваленты антитела или его функциональные фрагменты, ингибирует агрегацию мономеров Аβ и/или растворимых полимеров Аβ, содержащих множество указанных мономерных Аβ-звеньев, приводящую к образованию высокомолекулярных полимерных фибрилл, по меньшей мере на 80% при соотношении молярных концентраций антитела и Аβ1-42 1:10.
Связывание антител, предлагаемых в изобретении и описанных выше, с амилоидогенными мономерными пептидами и/или полимерными пептидами, но прежде всего с амилоидной формой (1-42), приводит к ингибированию агрегации мономерных и/или полимерных амилоидогенных пептидов, приводящей к образованию высокомолекулярных фибрилл или филаментов. Вследствие ингибирования агрегации амилоидогенных мономерных и/или полимерных пептидов антитела, предлагаемые в настоящем изобретении, обладают способностью предупреждать или замедлять образование амилоидных бляшек, прежде всего амилоидной формы (1-42), которая, как известно, становится нерастворимой в результате изменения вторичной конформации и представляет собой основную часть амилоидных бляшек в головном мозге больных животных или людей.
Способность антител, предлагаемых в изобретении, ингибировать агрегацию можно определять любым приемлемым методом, известным в данной области, прежде всего ультрацентрифугированием в градиенте плотности с последующим анализом продукта седиментации с использованием ДСН-ПААГ на предварительно созданном градиенте и/или с помощью флуоресцентного анализа с использованием тиофлавина Т (Th-T).
Одним из вариантов осуществления изобретения является антитело, прежде всего гуманизированное антитело, описанное в изобретении, включая любые функциональные эквиваленты антитела или его функциональные фрагменты, где антитело при совместной инкубации, прежде всего при соотношении молярных концентраций от 1:5 до 1:1000, предпочтительно от 1:10 до 1:500, более предпочтительно при соотношении от 1:10 до 1:300, еще более предпочтительно при соотношении от 1:10 до 1:100, с ранее сформированными высокомолекулярными полимерными амилоидными фибриллами или филаментами, которые образовались в результате агрегации мономерных Аβ-пептидов, которые имеют по меньшей мере 30, предпочтительно по меньшей мере 35, более предпочтительно по меньшей мере 38, еще более предпочтительно по меньшей мере 40 аминокислотных остатков, но наиболее предпочтительно мономерных Aβ1-42-пептидов, обладает способностью нарушать агрегацию ранее сформированных высокомолекулярных полимерных фибрилл или филаментов по меньшей мере на 20%, прежде всего по меньшей мере на 30%, более предпочтительно по меньшей мере на 35%, еще более предпочтительно по меньшей мере 40%, но наиболее предпочтительно по меньшей мере на 50% или более.
В конкретном варианте осуществления изобретения ингибирование антителом агрегации и способность антитела нарушать агрегацию соответственно определяют ультрацентрифугированием в градиенте плотности с последующим анализом продукта седиментации с использованием ДСН-ПААГ на предварительно созданном градиенте.
В другом конкретном варианте осуществления изобретения ингибирование антителом агрегации и способность антитела нарушать агрегацию соответственно определяют с помощью флуоресцентного анализа с использованием тиофлавина Т (Th-T).
В другом конкретном варианте осуществления изобретения антитело, предлагаемое в изобретении, совместно инкубируют с амилоидом в виде ранее сформированных высокомолекулярных полимерных фибрилл или филаментов в течение 12-36 ч, предпочтительно 18-30 ч, более предпочтительно 24 ч при температуре от 28 до 40°С, предпочтительно от 32 до 38°С, более предпочтительно при 37°С.
В частности, совместную инкубацию с ранее сформированными высокомолекулярными полимерными фибриллами или филаментами осуществляют в течение 24 ч при температуре 37°С.
В конкретном варианте осуществления изобретения антитело, прежде всего гуманизированное антитело, предлагаемое в изобретении, включая любые функциональные эквиваленты антитела или его функциональные фрагменты, обладает способностью нарушать агрегацию ранее сформированных полимерных фибрилл или филаментов по меньшей мере на 24% при соотношении молярных концентраций антитела и Аβ1-42 1:100.
В другом конкретном варианте осуществления изобретения антитело, прежде всего гуманизированное антитело, предлагаемое в изобретении, включая любые функциональные эквиваленты антитела или его функциональные фрагменты, обладает способностью нарушать агрегацию ранее сформированных полимерных фибрилл или филаментов по меньшей мере на 32% при соотношении молярных концентраций антитела и Аβ1-42 1:10.
Посредством нарушения агрегации амилоидогенных полимерных фибрилл или филаментов антитела, предлагаемые в настоящем изобретении, обладают способностью предупреждать или замедлять образование амилоидных бляшек, что приводит к облегчению симптомов, ассоциированных с заболеванием, и замедлению или прекращению его развития.
Таким образом, следующим вариантом осуществления изобретения является антитело, прежде всего гуманизированное антитело, включая любые функциональные эквиваленты антитела или его функциональные фрагменты, описанные выше, где антитело обладает способностью снижать общее количество Аβ в головном мозге животного, прежде всего млекопитающего, но предпочтительно человека, страдающего заболеванием или состоянием, которое приводит к повышенной концентрации Аβ в головном мозге.
Следующим вариантом осуществления изобретения является гуманизированное антитело, предлагаемое в изобретении и описанное выше, где антитело обладает бифункциональностью, что проявляется как в способности ингибировать агрегацию, так и в способности нарушать агрегацию, прежде всего в сочетании с высоким уровнем конформационной чувствительности.
В частности, изобретение относится к химерному антителу или его фрагменту, либо к гуманизированному антителу или его фрагменту, предлагаемому в изобретении и описанному выше, где антитело при совместной инкубации с амилоидными мономерными и/или полимерными растворимыми амилоидными пептидами, прежде всего с β-амилоидными мономерными пептидами, такими, например, как мономерные Аβ-пептиды 1-39, 1-40, 1-41 или 1-42, и/или полимерным растворимым β-амилоидным пептидом, содержащим множество указанных мономерных Аβ-звеньев, но прежде всего с Аβ1-42-мономерным и/или полимерным растворимым Аβ-амилоидным пептидом, содержащим множество указанных мономерных Аβ-звеньев, ингибирует агрегацию Аβ-мономеров в высокомолекулярные полимерные фибриллы или филаменты и, кроме того, при совместной инкубации с ранее сформированными высокомолекулярными полимерными амилоидными фибриллами или филаментами, которые образовались в результате агрегации амилоидных мономерных пептидов, прежде всего мономерных β-амилоидных пептидов, таких, например, как мономерные Аβ-пептиды 1-39, 1-40, 1-41 или 1-42, но прежде всего мономерные Аβ-пептиды, обладает способностью нарушать агрегацию ранее сформированных полимерных фибрилл или филаментов.
Другим объектом изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в настоящем изобретении и описанное/описанный выше, где антитело обладает способностью индуцировать переход β-складчатой конформации в конформацию в виде α-спирали и/или произвольной спирали, но прежде всего в конформацию в виде произвольной спирали, еще более предпочтительно в конформацию в виде произвольной спирали в конкретной области молекулы, прежде всего в окрестности Tyr 10 и Val 12 Аβ-белка, что приводит к повышению доли конформации в виде произвольной спирали за счет β-складчатой конформации и повышает солюбилизацию ранее сформированных высокомолекулярных полимерных амилоидных фибрилл или филаментов. В частности, происходит снижение доли β-складчатой конформации по меньшей мере на 30%, прежде всего по меньшей мере на 35% и более предпочтительно по меньшей мере на 40% и более по сравнению с соответствующими ранее сформированными амилоидными полимерными фибриллами или филаментами, которые инкубировали в буфере (контроль).
Способность антитела индуцировать конформационный переход вторичной структуры можно определять любым приемлемым методом, известным в данной области, прежде всего с помощью 13С-ЯМР-спектроскопии твердого тела, но предпочтительно путем определения интегральных интенсивностей, обусловленных конформациями Tyr 10 и Val 12 Cβ в Аβ1-42-пептиде.
Следующим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в настоящем изобретении и описанное/описанный выше, которое/который содержит по меньшей мере одну легкую цепь или ее фрагмент или по меньшей мере одну тяжелую цепь или ее фрагмент, где связывание антитела или его фрагмента с Аβ-мономером характеризуются высокой аффинностью связывания, при этом значение KD составляет от по меньшей мере примерно 1×10-7М до по меньшей мере примерно 1×10-12М, предпочтительно от по меньшей мере примерно 1×10-8М до по меньшей мере примерно 1×10-11М, более предпочтительно от по меньшей мере примерно 1×10-9М до по меньшей мере примерно 1×10-10М, еще более предпочтительно от по меньшей мере примерно 1×10-8М до по меньшей мере примерно 2×10-8М, но предпочтительно антитело или его фрагмент не дает какую-либо существенную перекрестную реакцию с амилоидным белком-предшественником (АРР).
Еще одним вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в настоящем изобретении и описанное/описанный выше, которое/который содержит по меньшей мере одну легкую цепь или ее фрагмент или по меньшей мере одну тяжелую цепь или ее фрагмент, где связывание антитела или его фрагмента с Аβ-волокном, -фибриллой или -филаментом характеризуются высокой аффинностью связывания, при этом значение KD составляет от по меньшей мере примерно 1×10-7М до по меньшей мере примерно 1×10-12М, предпочтительно от по меньшей мере примерно 1×10-8М до по меньшей мере примерно 1×10-11М, более предпочтительно от по меньшей мере примерно 1×10-9М до по меньшей мере примерно 1×10-10М, еще более предпочтительно от по меньшей мере примерно 2×10-9М до по меньшей мере примерно 5×10-9М, но предпочтительно антитело или его фрагмент не дает какую-либо существенную перекрестную реакцию с амилоидным белком-предшественником (АРР).
В другом варианте осуществления изобретения для антитела, предлагаемого в изобретении и описанного выше, или его фрагмента характерна аффинность к связыванию с Аβ-волокном, -фибриллой или -филаментом, по меньшей мере в 2 раза, прежде всего по меньшей мере в 4 раза, предпочтительно по меньшей мере в 10 раз, предпочтительно по меньшей мере в 15 раз, более предпочтительно по меньшей мере в 20 раз, но наиболее предпочтительно по меньшей мере в 25 раз более высокая, чем аффинность к связыванию с Аβ-мономером.
Еще одним вариантом осуществления изобретения являются химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, описанное/описанный выше, где антитело характеризуется значительным связыванием с агрегированным Аβ, включая Аβ-бляшки, в организме млекопитающих, прежде всего в головном мозге человека, но предпочтительно не дает какую-либо существенную перекрестную реакцию с амилоидным белком-предшественником (АРР).
Другим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, описанное/описанный выше, где антитело характеризуется значительным связыванием с растворимым полимерным амилоидом, прежде всего амилоидом β (Аβ), включая Аβ-мономеры, в организме млекопитающих, прежде всего в головном мозге человека, но предпочтительно не дает какую-либо существенную перекрестную реакцию с амилоидным белком-предшественником (АРР).
Другим вариантом осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в изобретении и описанное/описанный выше, где антитело существенно снижает загрузку Аβ-бляшками (т.е. относительную площадь поверхности, занятую бляшками) в организме млекопитающего, прежде всего головного мозга человека. Это может происходить либо в результате связывания антитела с бляшкой, либо в результате сдвига равновесия между амилоидом, прежде всего амилоидом β (Аβ) в его нерастворимом и агрегированном состоянии, в сторону его растворимой формы в результате нарушения агрегации волокон с образованием растворимых поли- и мономерных форм путем индукции изменения конформации и связывания и стабилизации амилоидных форм с нарушенной агрегацией и солюбилизированных амилоидных форм, прежде всего форм амилоида β (Аβ), в ткани и/или жидкости организма, прежде всего в головном мозге. Благодаря активности антитела, предлагаемого в изобретении, происходит главным образом периферический клиренс и катаболизм вместо накопления в ткани и/или жидкости организма, прежде всего в головном мозге. Таким образом, благоприятное действие антитела, предлагаемого в изобретении, можно получать без связывания антитела с бляшкой.
Благодаря его стабилизирующей активности, антитело, предлагаемое в изобретении, обладает способностью нейтрализовать токсические действия полимерного и менее агрегированного растворимого амилоидного белка, прежде всего белка амилоида β (Аβ), в ткани и/или жидкости организма. Таким образом, в конкретном варианте осуществления изобретения антитело, предлагаемое в изобретении, может оказывать благоприятное действие без необходимости в связывании агрегированного амилоида бета в головном мозге.
Еще одним объектом изобретения является гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в настоящем изобретении и описанное/описанный выше, которое/который содержит по меньшей мере одну легкую цепь или ее фрагмент или по меньшей мере одну тяжелую цепь или ее фрагмент, в которые встроены по меньшей мере один, предпочтительно два и более предпочтительно три CDR-участка, полученных из мышиного донорского антитела, прежде всего мышиного антитела ACI-01-Ab7C2 (в контексте настоящего описания обозначенное также как «mC2» и «hC2» в случае гуманизированного антитела С2), которое депонировано 01 декабря 2005 г. в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ), Брауншвейг, Mascheroder Weg 1 В, 38124 Branuschweig, под регистрационным номером DSM АСС2750, где антитело или его фрагмент обладает аффинностью к антигену Аβ, по меньшей мере в 5 раз, предпочтительно по меньшей мере в 8 раз, более предпочтительно по меньшей мере в 10 раз, но наиболее предпочтительно меньшей мере в 15 раз более высокой по сравнению с мышиным донорским антителом.
В одном из вариантов осуществления изобретения антитело, предлагаемое в настоящем изобретении, может представлять собой полное антитело (например, с двумя полноразмерными легкими цепями и двумя полноразмерными тяжелыми цепями) любого изотипа и подтипа (например, IgM, IgD, IgG1, IgG2, IgG3, IgG4, IgE, IgA1 и IgA2); но наиболее предпочтительно антитело IgG4-изотипа; в альтернативном варианте в другом варианте осуществления изобретения оно может представлять собой антигенсвязывающий фрагмент (например, Fab, F(ab’)2 и Fv) полного антитела.
Таким образом, изобретение относится также к антигенсвязывающим фрагментам антител, представленных в настоящем описании. В одном из вариантов осуществления изобретения фрагмент выбирают из группы, включающей Fab-фрагмент, Fab’-фрагмент, F(ab)2-фрагмент и Fv-фрагмент, включая продукты экспрессирующей Fab библиотеки иммуноглобулинов и эпитопсвязывающие фрагменты любого из указанных выше антител и фрагментов.
В одном из вариантов осуществления изобретения антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый в изобретении, конъюгируют с полиэтиленгликолем. А другом варианте осуществления изобретения константную область антитела, предлагаемого в изобретении, модифицируют для снижения по меньшей мере одной опосредуемой константной областью биологической эффекторной функции по сравнению с немодифицированным антителом. В еще одном варианте осуществления изобретения антитело или антигенсвязывающий фрагмент, предлагаемые в изобретении, содержат Fc-область с измененной эффекторной функцией.
Изобретение относится также к нуклеотидной молекуле, которая содержит нуклеотидную последовательность, кодирующую химерное антитело или его фрагмент или гуманизированное антитело или фрагмент, предлагаемое(ый) в изобретении и описанные выше.
В частности, изобретение относится к нуклеотидной молекуле, которая содержит нуклеотидную последовательность, кодирующую состоящий из смежных молекул аминокислот участок, последовательность которого представлена в SEQ ID NO: 2 и 3 соответственно, или комплементарную последовательность, которые представляют собой гипервариабельные участки (CDR) 2 и 3 вариабельной области тяжелой цепи (HCVR).
Более конкретно, изобретение относится к нуклеотидной молекуле, которая содержит нуклеотидную последовательность, кодирующую состоящий из смежных молекул аминокислот участок, последовательность которого представлена в SEQ ID NO: 4, или комплементарную последовательность, которая представляет собой гипервариабельный участок (CDR) 1 вариабельной области легкой цепи (LCVR).
Другим вариантом осуществления изобретения является нуклеотидная молекула, которая содержит нуклеотидную последовательность, представленную в SEQ ID NO: 18 и SEQ ID NO: 19, или комплементарную последовательность, которая кодирует аминокислотную последовательность CDR2 и CDR3 соответственно вариабельной области тяжелой цепи (HCVR).
Следующим вариантом осуществления изобретения является нуклеотидная молекула, которая содержит нуклеотидную последовательность, представленную в SEQ ID NO: 20, или комплементарную последовательность, кодирующую CDR1 вариабельной области легкой цепи (LCVR).
Еще одним вариантом осуществления изобретения является нуклеотидная молекула, которая содержит нуклеотидную последовательность, представленную в SEQ ID NO: 21, или комплементарную последовательность, кодирующую вариабельную область легкой цепи.
Другим вариантом осуществления изобретения является нуклеотидная молекула, которая содержит нуклеотидную последовательность, представленную в SEQ ID NO: 22, или комплементарную последовательность, кодирующую вариабельную область легкой цепи, включая сигнальные последовательности.
Другим вариантом осуществления изобретения является нуклеотидная молекула, которая содержит нуклеотидную последовательность, кодирующую вариабельную область легкой цепи, которая представлена в SEQ ID NO: 22, и константную область легкой цепи, которая представлена в SEQ ID NO: 23. Изобретение относится также к комплементарной цепи указанной нуклеотидной молекулы.
Еще одним вариантом осуществления изобретения является нуклеотидная молекула, которая содержит нуклеотидную последовательность, представленную в SEQ ID NO: 24, которая кодирует вариабельную область тяжелой цепи. Изобретение относится также к комплементарной цепи указанной нуклеотидной молекулы.
Другим вариантом осуществления изобретения является нуклеотидная молекула, которая содержит нуклеотидную последовательность, представленную в SEQ ID NO: 25, которая кодирует вариабельную область тяжелой цепи, включая сигнальные последовательности. Изобретение относится также к комплементарной цепи указанной нуклеотидной молекулы.
Другим вариантом осуществления изобретения является нуклеотидная молекула, которая содержит нуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, которая представлена в SEQ ID NO: 25, и константную область тяжелой цепи, которая представлена в SEQ ID NO: 26. Изобретение относится также к комплементарной цепи указанной нуклеотидной молекулы.
Настоящее изобретение относится также к нуклеотидной последовательности, которая гибридизуется с одной из описанных выше кодирующих антитело нуклеотидных последовательностей, предлагаемых в изобретении, прежде всего с ее комплементарной цепью, либо в выделенном состоянии, либо в виде фрагмента более крупной нуклеотидной молекуле.
В частности, изобретение относится к любой нуклеотидной последовательности, которая гибридизуется в общепринятых условиях гибридизации, прежде всего в строгих условиях гибридизации, с любой нуклеотидной последовательностью, представленной в SEQ ID NO: 18-26 и 29-32, прежде всего с ее комплементарной цепью.
Еще одним вариантом осуществления изобретения является экспрессионный вектор, который содержит молекулу нуклеиновой кислоты, предлагаемую в изобретении и описанную выше.
Следующим вариантом осуществления изобретения является клетка, которая содержит экспрессионный вектор, включающий нуклеиновую кислоту, предлагаемую в изобретении и описанную выше.
Еще одним вариантом осуществления изобретения является композиция, которая содержит антитело, предлагаемое в изобретении, но предпочтительно химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в изобретении и описанное/описанный выше, включая любое функционально эквивалентное антитело или любое производное, или функциональные фрагменты, в терапевтически эффективном количестве, в частности композиция, представляющая собой фармацевтическую композицию, которая необязательно содержит также фармацевтически приемлемый носитель.
В другом варианте осуществления изобретения композиция содержит антитело в терапевтически эффективном количестве.
Кроме того, под объем изобретения подпадает смесь, которая содержит антитело, прежде всего моноклональное антитело, предлагаемое в изобретении, но прежде всего химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в изобретении и описанное/описанный выше, включая любое функционально эквивалентное антитело или любое производное, или функциональные фрагменты, в терапевтически эффективном количестве и необязательно дополнительную биологически активную субстанцию и/или фармацевтически приемлемый носитель и/или разбавитель, и/или эксципиент.
В частности, изобретение относится к смеси, в которой дополнительная биологически активная субстанция представляет собой соединение, которое применяют для медикаментозного лечения амилоидоза, группы заболеваний и нарушений, ассоциированных с амилоидом или амилоидоподобным белком, таким как Аβ-белок, включая болезнь Альцгеймера.
В другом варианте осуществления изобретения дополнительная биологически активная субстанция или соединение может представлять собой также терапевтический агент, который можно использовать для лечения амилоидоза, вызываемого амилоидом β, или можно использовать для медикаментозного лечения других неврологических нарушений.
Дополнительная биологически активная субстанция или соединение может обладать биологическим действием, опосредуемым таким же или сходным механизмом, что и антитело, предлагаемое в изобретении, или обладать неродственным механизмом действия или сочетанием родственных и/или неродственных механизмов действия.
Дополнительная биологически активная субстанция или соединение может представлять собой энхансеры нейтронной трансмиссии, психотерапевтические лекарственные средства, ингибиторы ацетилхолинэстеразы, блокаторы кальциевых каналов, биогенные амины, транквилизаторы на основе бензодиазепинов, усилители синтеза, накопления или высвобождения ацетилхолина, агонисты постсинаптического рецептора ацетилхолина, ингибиторы моноаминоксидазы-А или -В, антагонисты рецептора М-метил-О-аспартатглутамата (NMDA), нестероидные противовоспалительные лекарственные средства, антиоксиданты и антагонисты серотонергического рецептора.
Более конкретно, смесь, предлагаемая в изобретении, может содержать по меньшей мере одно соединение, выбранное из группы, включающей соединения против окислительного стресса, антиапоптозные соединения, хелаторы металлов, ингибиторы репарации ДНК, такие как пирензепин и метаболиты, 3-амино-1-пропансульфоновую кислоту (3APS), 1,3-пропандисульфонат (1,3PDS), активаторы секретаз, ингибиторы β- и γ-секретаз, tau-белки, нейромедиатор, разрушители β-складчатой конформации, аттрактанты для клеточных компонентов, участвующих в клиренсе/истощении амилоида бета, ингибиторы укороченного на N-конце амилоида бета, включая пироглутаматированный амилоид бета 3-42, противовоспалительные молекулы или ингибиторы холинэстеразы (ChEI), такие как такрин, ривастигмин, донепезил и/или галантамин, агонисты M1 и другие лекарственные средства, включая любое модифицирующее амилоид или tau-белок лекарственное средство, и пищевые добавки, в сочетании с антителом, предлагаемым в изобретении, и необязательно фармацевтически приемлемым носителем и/или разбавителем, и/или эксципиентом.
Изобретение относится также к смеси, в которой соединение представляет собой ингибитор холинэстеразы (ChEI), прежде всего, к смеси, в которой соединение представляет собой соединение, выбранное из группы, включающей такрин, ривастигмин, донепезил, галантамин, ниацин и мемантин.
В следующем варианте осуществления изобретения смеси, предлагаемые в изобретении, содержат ниацин или мемантин в сочетании с антителом, предлагаемым в настоящем изобретении, и необязательно фармацевтически приемлемый носитель и/или разбавитель, и/или эксципиент.
Еще одним вариантом осуществления изобретения являются смеси, которые содержат «атипичные антипсихотические средства», такие, например, как клозапин, зипрасидон, рисперидон, арипипразол или оланзапин, предназначенные для лечения позитивных или негативных психотических симптомов, включая галлюцинации, бред, нарушения мышления (проявляющиеся в выраженной непоследовательности действий, психическом расстройстве, расстройстве ассоциативного мышления) и эксцентричное или неорганизованное поведение, а также ангедонию, пониженную эмоциональную реакцию, апатию и отказ от общества, в сочетании с антителом, прежде всего моноклональным антителом, предлагаемым в изобретении, но предпочтительно с химерным антителом или его фрагментом или гуманизированным антителом или его фрагментом, предлагаемыми в изобретении и описанными выше, и необязательно фармацевтически приемлемым носителем и/или разбавителем, и/или эксципиентом.
В конкретных вариантах осуществления изобретения композиции и смеси, предлагаемые в изобретении и описанные выше, содержат антитело, и биологически активную субстанцию соответственно в терапевтически эффективном количестве.
Другие соединения, которые можно применять в смесях в сочетании с антителом, предлагаемым в настоящем изобретении, описаны, например, в WO 2004/058258 (см. прежде всего сс. 16 и 17), включая мишени терапевтических лекарственных средств (сс. 36-39), алкансульфоновые кислоты и алкансерные кислоты (сс. 39-51), ингибиторы холинэстеразы (сс. 51-56), антагонисты NMDA-рецептора (сс. 56-58), эстрогены (сс.58-59), нестероидные противовоспалительные лекарственные средства (сс. 60-61), антиоксиданты (сс. 61-62), агонисты рецепторов, активируемых пероксисомальными пролифераторами (PPAR) (сс. 63-67), агенты, понижающие уровень холестерина (сс. 68-75); ингибиторы амилоида (сс. 75-77), ингибиторы образования амилоида (сс. 77-78), хелаторы металлов (сс. 78-79), антипсихотические средства и антидепрессанты (сс. 80-82), пищевые добавки (сс. 83-89) и соединения, повышающие доступность биологически активных субстанций в головном мозге (см. сс. 89-93) и пролекарства (сс. 93 и 94); указанный документ включен в настоящее описание в качестве ссылки.
Другим вариантом осуществления изобретения является смесь, содержащая антитело, прежде всего моноклональное антитело, предлагаемое в изобретении, но предпочтительно химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый в изобретении и описанное/описанный выше, и/или биологически активную субстанцию в терапевтически эффективном количестве.
Изобретение относится также к применению антитела, прежде всего моноклонального антитела, предлагаемого в изобретении, но предпочтительно химерного антитела или его фрагмента, либо гуманизированного антитела или его фрагмента, предлагаемого в изобретении и описанного выше, и/или его функционального фрагменты и/или фармацевтической композиции или смеси, содержащей указанное антитело, для приготовления лекарственного средства, предназначенного для лечения или облегчения воздействий амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь только ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), деменция, связанная с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландского типа); комплекс деменции Гуама-Паркинсона, а также других заболеваний, которые обусловлены или ассоциированы с амилоидоподобными белками, таких как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и других заболеваний, включая дегенерацию желтого пятна.
Настоящее изобретение относится также к способу получения антитела, прежде всего моноклонального антитела, предлагаемого в изобретении, но предпочтительно химерного антитела или его фрагмента, либо гуманизированного антитела или его фрагмента, предлагаемого в изобретении и описанного выше, и/или его функционального фрагмента, и/или фармацевтической композиции, или смеси, содержащей указанное антитело, предпочтительно в терапевтически эффективном количестве, для использования в способе предупреждения, лечения или облегчения воздействий амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь только ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), деменция, связанная с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландского типа); комплекс деменции Гуама-Паркинсона, а также других заболеваний, которые обусловлены или ассоциированы с амилоидоподобными белками, таких как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и других заболеваний, включая дегенерацию желтого пятна, заключающемуся в том, что приготавливают препарат антитела, предлагаемого в изобретении, прежде всего моноклонального антитела, предлагаемого в изобретении, но предпочтительно химерного антитела или его фрагмента или гуманизированного антитела или его фрагмента, предлагаемых в изобретении, в виде фармацевтически приемлемой формы.
Кроме того, настоящее изобретение относится к способу предупреждения, лечения или облегчения воздействий амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь только ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), деменция, связанная с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландского типа); комплекс деменции Гуама-Паркинсона, а также других заболеваний, которые обусловлены или ассоциированы с амилоидоподобными белками, таких как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и других заболеваний, включая дегенерацию желтого пятна, заключающемуся в том, что вводят антитело и/или его функциональный фрагмент, но предпочтительно гуманизированное антитело и/или его функциональный фрагмент, или композицию, или смесь, содержащую указанное антитело и/или его функциональный фрагмент, животному или человеку, пораженному указанным нарушением, при этом антитело вводят в терапевтически эффективном количестве.
Кроме того, объектом изобретения является способ лечения амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь только ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), прежде всего заболевания или состояния, которое характеризуется утратой когнитивной способности к запоминанию, заключающемуся в том, что вводят животному, прежде всего млекопитающему или человеку, антитело, предпочтительно фармацевтическую композицию, предлагаемую в изобретении и описанную выше.
Конкретным вариантом осуществления изобретения является способ сохранения или повышения когнитивной способности к запоминанию, но прежде всего для восстановления когнитивной способности к запоминанию у животного, прежде всего млекопитающего или человека, страдающего нарушением памяти, заключающийся в том, что вводят животному, прежде всего млекопитающему или человеку, антитело, предпочтительно фармацевтическую композицию, предлагаемую в изобретение и описанную выше.
Еще одним объектом изобретения является терапевтическая композиция и способ получения указанной композиции, а также способ лечения амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь только ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), прежде всего заболевания или состояния, которое характеризуется утратой когнитивной способности к запоминанию, с помощью антитела, предлагаемого в изобретении и описанного выше.
В частности, изобретение относится к лечению животного, прежде всего млекопитающего или человека, страдающего ассоциированным с амилоидом состоянием, которое характеризуется утратой когнитивной способности к запоминанию, приводящему к сохранению когнитивной способности к запоминанию.
Изобретение относится также к способу диагностирования ассоциированного с амилоидом заболевания или состояния у пациента, заключающемуся в том, что выявляют иммуноспецифическое связывание антитела или его активного фрагмента с эпитопом амилоидного белка в образце in situ, включающему стадии, на которых
(а) приводят в контакт образец или специфическую часть организма или область организма, которая, как ожидается, может содержать амилоидный белок, с антителом, прежде всего с моноклональным антителом, предлагаемым в изобретении, но предпочтительно с химерным антителом или его фрагментом, либо с гуманизированным антителом или его фрагментом, предлагаемым в изобретении и описанным выше, и/или его функциональным фрагментом, где антитело связывается с эпитопом амилоидного белка;
(б) дают возможность антителу и/или его функциональному фрагменту связаться с амилоидным белком с образованием иммунологического комплекса;
(в) выявляют образование иммунологического комплекса; и
(г) устанавливают корреляцию между присутствием или отсутствием иммунологического комплекса и присутствием или отсутствием амилоидного белка в образце или специфической части или области организма.
Кроме того, в изобретении предложен способ определения степени загрузки амилоидогенными бляшками ткани и/или жидкости организма, заключающийся в том, что
а) получают образец, репрезентативный для изучаемой ткани и/или жидкости организма;
б) оценивают присутствие в образце амилоидного белка с помощью антитела, прежде всего моноклонального антитела, предлагаемого в изобретении, но предпочтительно химерного антитела или его фрагмента, либо гуманизированного антитела или его фрагмента, предлагаемого в изобретении и описанного выше, и/или его функционального фрагмента;
в) определяют количество антитела, связанного с белком; и
г) рассчитывают загрузку бляшками ткани и/или жидкости организма.
В частности, изобретение относится к способу определения степени загрузки амилоидогенными бляшками ткани и/или жидкости организма, в котором образование иммунологического комплекса на стадии в) определяют таким образом, что присутствие или отсутствие иммунологического комплекса коррелирует с присутствием или отсутствием амилоидного белка.
Еще одним вариантом осуществления изобретения является тест-набор для выявления и диагностирования ассоциированных с амилоидом заболеваний и состояний, который содержит антитело, прежде всего моноклональное антитело, предлагаемое в изобретении, но предпочтительно химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, предлагаемое/предлагаемый изобретении и описанное/описанный выше, и/или его функциональный фрагмент.
В частности изобретение относится к тест-набору для выявления и диагностирования ассоциированных с амилоидом заболеваний и состояний, который содержит контейнер, в котором находится одно или несколько антител, предлагаемых в настоящем изобретении, и/или его/их функциональный фрагмент и инструкции по применению антител для связывания с амилоидным белком с образованием иммунологического комплекса и выявления образования иммунологического комплекса таким образом, что присутствие или отсутствие иммунологического комплекса коррелирует с присутствием или отсутствием амилоидного белка.
Следующим объектом изобретения является антитело, которое содержит вариабельную область, представленную в SEQ ID NO: 27, или ее вариант. Еще одним вариантом осуществления изобретения является клеточная линия, экспрессирующая антитело.
Другим объектом изобретения является ген антитела, которое содержит вариабельную область, последовательность которой представлена в SEQ ID NO: 29, или ее вариант. Еще одним вариантом осуществления изобретения является клеточная линия, экспрессирующая антитело.
Следующим объектом изобретения является способ нарушения агрегации ранее сформированных бета-амилоидных волокон, заключающийся в том, что осуществляют взаимодействие антитела hC2 с ранее сформированными бета-амилоидными волокнами.
Еще одним объектом изобретения является гуманизированное антитело или его фрагмент по одному из предыдущих пунктов, где антитело или его фрагмент защищают нейроны от индуцируемой Абета деградации.
Еще одним объектом изобретения является способ предупреждения индуцируемой Абета деградации нейронов, заключающийся в том, что обрабатывают нейроны взятым в эффективном количестве гуманизированным антителом или его фрагментом, предлагаемым в настоящем изобретении.
Еще одним объектом изобретения является применение гуманизированного антитела или его фрагмента, предлагаемого в настоящем изобретении, для приготовления лекарственного средства, предназначенного для предупреждения дегенерации нейронов, связанной с олигомером Абета.
Эти и другие объекты, особенности и преимущества настоящего изобретения должны стать очевидными после ознакомления с приведенным ниже подробным описанием вариантов осуществления изобретения и прилагаемой формулы изобретения.
Краткое описание чертежей и последовательностей
На чертежах показано:
на фиг. 1 (пример 2) - кассета экспрессии вариабельной области мышиной легкой цепи химерного антитела;
на фиг. 2 (пример 2) - кассета экспрессии вариабельной области мышиной тяжелой цепи химерного антитела;
на фиг. 3 (пример 5.2) - сравнение вариабельной области мышиной тяжелой цепи с наиболее близкой последовательностью мышиной зародышевой линии; на фиг. 4 (пример 8) - активность очищенных гуманизированных антител С2;
на фиг. 5 - (пример 9) - активность связывания антител, образовавшихся в результате кратковременной экспрессии конструкций С2 с модифицированным CDRL2, в сочетании с химерной тяжелой цепью С2, по сравнению с химерным антителом C2ChVHAF/ChVK, образовавшимся в результате кратковременной трансфекции, и очищенным антителом;
на фиг. 6 (пример 11) - результаты иммуногистохимического анализа связывания с химерным антителом AF и гуманизированным антителом Н4К1;
на фиг. 7 (пример 12) - функциональная активность mC2 в отношении амилоидных волокон;
на фиг. 8 (пример 12) - аффинность связывания гуманизированного С2, оцененная с помощью ELISA;
на фиг. 9 (пример 14) - конформационная специфичность связывания mC2 с различными классами амилоидного белка. Получение гранул (Pellet) в описании к данному чертежу относится к получению волокон Аβ1-42, получение супернатанта относится к мономерам амилоида;
на фиг. 10 - последовательности VK гуманизированного С2 в сравнении с мышиной последовательностью и человеческими акцепторными последовательностями DPK15 и JK1;
на фиг. 11 - последовательности VH гуманизированного С2 в сравнении с мышиной последовательностью и человеческими акцепторными последовательностями DP54 и JH6;
на фиг. 12 - полная последовательность ДНК и последовательность белка вариабельной области легкой цепи гуманизированного антитела С2, т.е. C2HuVK1;
на фиг. 13 - полная последовательность ДНК и последовательность белка константной области легкой цепи (человеческая С-каппа цепь) гуманизированного антитела С2;
на фиг. 14 - полная последовательность ДНК и последовательность белка константой области тяжелой цепи (человеческий IgG4 ser228-pro) гуманизированного антитела С2;
на фиг. 15А-В (пример 15) - результаты экспериментов по эпитопному картированию;
на фиг. 16 (пример 13) - результаты экспериментов по оценке агрегации;
на фиг. 17 (пример 13) - результаты экспериментов по оценке нарушения агрегации;
на фиг. 18 (пример 16) - результаты экспериментов по оценке нейрозащитного действия гуманизированного антитела С2.
SEQ ID NO: 1 Аминокислотная последовательность гуманизированной вариабельной области тяжелой цепи (CDR1) С2 HuVH AF 4.
SEQ ID NO: 2 Аминокислотная последовательность гуманизированной вариабельной области тяжелой цепи (CDR2) С2 HuVH AF 4.
SEQ ID NO: 3 Аминокислотная последовательность гуманизированной вариабельной области тяжелой цепи (CDR3) С2 HuVH AF 4.
SEQ ID NO: 4 Аминокислотная последовательность гуманизированной вариабельной области легкой цепи (CDR1) С2 HuVK 1.
SEQ ID NO: 5 Аминокислотная последовательность гуманизированной вариабельной области легкой цепи (CDR2) С2 HuVK 1.
SEQ ID NO: 6 Аминокислотная последовательность гуманизированной вариабельной области легкой цепи (CDR3) С2 HuVK 1.
SEQ ID NO: 7 Аминокислотная последовательность области 2 эпитопа Аβ.
SEQ ID NO: 8 Аминокислотная последовательность области 1 эпитопа Аβ.
SEQ ID NO: 9 Аминокислотная последовательность модифицированной области 2 эпитопа Аβ.
SEQ ID NO: 10 Аминокислотная последовательность модифицированной области 1 эпитопа Аβ.
SEQ ID NO: 11 Аминокислотная последовательность модифицированной полной области эпитопа.
SEQ ID NO: 12 Аминокислотная последовательность гуманизированной вариабельной области легкой цепи С2 HuVK 1.
SEQ ID NO: 13 Аминокислотная последовательность гуманизированной легкой цепи С2.
SEQ ID NO: 14 Аминокислотная последовательность константной области легкой цепи гуманизированного С2.
SEQ ID NO: 15 Аминокислотная последовательность гуманизированной вариабельной области тяжелой цепи С2 HuVH AF 4.
SEQ ID NO: 16 Аминокислотная последовательность гуманизированной тяжелой цепи С2.
SEQ ID NO: 17 Аминокислотная последовательность модифицированной С-области гамма-4 цепи IG.
SEQ ID NO: 18: Нуклеотидная последовательность CDR2 гуманизированной вариабельной области тяжелой цепи С2 HuVH AF 4,
SEQ ID NO: 19: Нуклеотидная последовательность CDR3 гуманизированной вариабельной области тяжелой цепи С2 HuVH AF 4.
SEQ ID NO: 20: Нуклеотидная последовательность CDR1 гуманизированной вариабельной области легкой цепи С2 HuVK 1.
SEQ ID NO: 21: Нуклеотидная последовательность гуманизированной вариабельной области легкой цепи С2 HuVK 1.
SEQ ID NO: 22: Нуклеотидная последовательность гуманизированной легкой цепи С2.
SEQ ID NO: 23: Нуклеотидная последовательность гуманизированной константной области легкой цепи С2.
SEQ ID NO: 24: Нуклеотидная последовательность гуманизированной вариабельной области тяжелой цепи С2 HuVH AF 4.
SEQ ID NO: 25: Нуклеотидая последовательность гуманизированной тяжелой цепи С2.
SEQ ID NO: 26: Нуклеотидная последовательность гуманизированной константной области тяжелой цепи С2.
SEQ ID NO: 27: Аминокислотная последовательность вариабельной области легкой цепи мышиного С2.
SEQ ID NO: 28: Аминокислотная последовательность вариабельной области тяжелой цепи мышиного С2.
SEQ ID NO: 29: Нуклеотидная последовательность вариабельной области легкой цепи мышиного С2.
SEQ ID NO: 30: Нуклеотидная последовательность легкой цепи мышиного С2.
SEQ ID NO: 31: Нуклеотидная последовательность вариабельной области тяжелой цепи мышиного С2.
SEQ ID NO: 32: Нуклеотидная последовательность тяжелой цепи мышиного С2.
Определения
Понятия «полипептид», «пептид» и «белок» в контексте настоящего описания используют взаимозаменяемо, и они обозначают биологическую молекулу, состоящую из аминокислот, сцепленных пептидной связью.
В контексте настоящего описания упоминание единственного числа может обозначать «один или несколько» и, если не указано иное, то оно включает множественное число.
Понятие «заболевания и нарушения, которые обусловлены или ассоциированы с амилоидом или амилоидоподобными белками» включает (но не ограничиваясь только ими) заболевания и нарушения, обусловленные присутствием или активностью амилоидоподобных белков в мономерном, фибриллярном или полимерном состоянии или в любом сочетании указанных трех состояний. Такие болезни и нарушения включают (но не ограничиваясь только ими) амилоидоз, эндокринные опухоли и дегенерацию желтого пятна.
Понятие «амилоидоз» относится к группе заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая (но не ограничиваясь только ими) вторичный амилоидоз и связанный с возрастом амилоидоз, включая такие болезни как (но не ограничиваясь только ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), включая заболевания или состояния, характеризующиеся утратой когнитивной способности к запоминанию, такие, например, как умеренное ухудшение когнитивной способности (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландского типа); комплекс деменции Гуама-Паркинсона, а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), миозит, вызываемый тельцами включения (IBM), диабет взрослых и старческий сердечный амилоидоз; и различные глазные болезни, включая дегенерацию желтого пятна, связанную с друзами оптическую невропатию и катаракту, связанную с отложением бета-амилоида.
Понятия «выявление (обнаружение)» или выявленный (обнаруженный)» в контексте настоящего описания означает применение известных методик для выявления биологических молекул, таких как иммунохимические или гистологические методы, и относятся к качественному или количественному выявлению присутствия или определению концентрации исследуемой биологической молекулы.
Понятие «полимерный растворимый амилоид» относится к множеству агрегированных мономеров амилоидных пептидов или амилоидоподобных пептидов, или модифицированных или укороченных амилоидных пептидов, или других производных амилоидных пептидов, формирующих олигомерные или полимерные структуры, которые являются растворимыми в организме млекопитающего или человека, более предпочтительно в головном мозге, но предпочтительно относится к множеству агрегированных мономеров амилоида β (Аβ) или модифицированных или укороченных пептидов амилоида β (Аβ) или их производных, которые являются растворимыми в организме млекопитающего или человека, более предпочтительно в головном мозге.
Понятие «амилоид β, Аβ или β-амилоид» имеет значение, известное в данной области, и относится к белкам или пептидам амилоида β, белку-предшественнику амилоида β (АРР), а также к их модификациям, фрагментам и любым функциональным эквивалентам. В частности, под понятие «амилоид β» в контексте настоящего описания подпадает любой фрагмент, полученный протеолитическим расщеплением АРР, но прежде всего фрагменты, которые участвуют или которые ассоциированы с амилоидной патологией, включая (но не ограничиваясь только ими) Aβ1-38, Аβ1-39, Aβ1-40, Аβ1-41, Aβ1-42 и Aβ1-43.
Структура и последовательности указанных выше пептидов амилоида β хорошо известны специалистам в данной области и методы получения указанных пептидов или их экстракции из головного мозга и других тканей описаны, например, у Glenner и Wong, Biochem Biophys Res Comm 129, 1984, cc. 885-890. Кроме того, пептиды амилоида β имеются также в продаже в различных формах.
Понятие «выделенный» относится к биологической молекуле, свободной по меньшей мере от некоторых компонентов, с которыми она встречается в естественных условиях.
Понятия «антитело» или «антитела» в контексте настоящего описания имеют известное в данной области значение и относятся к молекулам или активным фрагментам молекул, которые связываются с известными антигенами, прежде всего к молекулам иммуноглобулинов и к иммунологически активным фрагментам молекул иммуноглобулинов, т.е. молекулам, которые содержат сайт связывания, специфически связывающийся с антигеном. Иммуноглобулин представляет собой белок, который содержит один или несколько полипептидов, которые практически кодируются генами каппа- и лямбда-, альфа-, гамма, дельта-, эпсилон- и мю-цепи константной области иммуноглобулина, а также множеством генов вариабельных областей иммуноглобулина. Легкие цепи классифицируются как либо каппа-, либо лямбда-цепь. Тяжелые цепи классифицируются как гамма-, мю-, альфа, дельта- или эпсилон-цепь, которые в свою очередь определяют классы иммуноглобулинов, т.е. IgG, IgM, IgA, IgD и IgE соответственно. Известны также подклассы тяжелых цепей. Например, тяжелые цепи IgG у человека могут относиться к любому из подклассов IgG1, IgG2, IgG3 и IgG4. Иммуноглобулины, предлагаемые в изобретении, могут относиться к любому классу (IgG, IgM, IgD, IgE, IgA и IgY) или подклассу (IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) молекулы иммуноглобулина.
В контексте настоящего описания понятие «специфически связывает(ся)» касательно антитела означает, что антитело связывается с его антигеном-мишенью с более высокой аффинностью, чем со структурно отличным(и) антигеном(ами).
Известно, что типичная структурная единица иммуноглобулина представляет собой тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара включает одну «легкую» (примерно 25 кДа) и одну «тяжелую» цепь (примерно 50-70 кДа). N-конец каждой цепи представляет собой вариабельную область, состоящую примерно из 100-110 или большего количества аминокислот, которые прежде всего ответственны за распознавание антигена. Понятия вариабельная область легкой цепи (VL) и вариабельная область тяжелой цепи (VH) относятся к этим легким и тяжелым цепям соответственно.
Антитела могут представлять собой полноразмерные интактные антитела или множество хорошо охарактеризованных фрагментов, полученных в результате расщепления различными пептидазами или химическими агентами. Так, например, пепсин расщепляет антитело ниже дисульфидных связей в шарнирной области с образованием F(ab’)2, димера Fab, который сам представляет собой легкую цепь, соединенную с VH-CH1 дисульфидным мостиком. F(ab’)2 можно восстанавливать в мягких условиях с расщеплением дисульфидной связи в шарнирной области, превращая тем самым димер F(ab’)2 в мономер Fab’. Мономер Fab’ практически представляет собой Fab-фрагмент с частью шарнирной области (см., Fundamental Immunology, под ред. W. Е. Paul, изд-во Raven Press, N.Y. 1993, где более подробно описаны другие фрагменты антител). Хотя различные фрагменты антител описывают с позиций расщепления интактного антитела, специалисту в данной области должно быть очевидно, что любые из разнообразных фрагментов антител можно синтезировать de novo либо химически, либо с помощью рекомбинантой ДНК. Таким образом, понятие «антитело» в контексте настоящего описания включают фрагменты антител, либо полученные модификацией полных антител, либо синтезированные de novo, либо антитела и фрагменты, полученные с помощью методов рекомбинантной ДНК.
Согласно настоящему изобретению подразумевается, что к «антителам» относятся моноклональные антитела, поликлональные антитела, химерные, одноцепочечные, биспецифические, симианизированные (включающие участки обезьяньих антител), человеческие и гуманизированные антитела, а также их активные фрагменты. Например, к активным фрагментам молекул, которые связываются с известными антигенами, относятся разделенные легкие и тяжелые цепи, Fab-, Fab/c-, Fv-, Fab’- и F(ab’)2-фрагменты, включая продукты экспрессионной библиотеки Fab-фрагментов иммуноглобулинов и связывающиеся с эпитопом фрагменты любых антител и их указанных фрагментов.
Указанные активные фрагменты можно получать из антитела, предлагаемого в настоящем изобретении, с помощью многочисленных методик. Например, очищенные моноклональные антитела можно расщеплять ферментом, таким как пепсин, и подвергать ЖХВР-гель-фильтрации. Затем соответствующую фракцию, содержащую Fab-фрагменты, можно собирать и концентрировать с помощью фильтрации через мембрану и т.п. Дополнительное описание общих методик выделения активных фрагментов антител описано, например, у Khaw В. А. и др. J. Nucl. Med. 23, 1982, сс. 1011-1019; Rousseaux и др., Methods Enzymology, 121, изд-во Academic Press, 1986, сс. 663-669.
Рекомбинантные антитела могут представлять собой обычные полноразмерные антитела, известные активные фрагменты антител, полученные в результате протеолитического расщепления, одиночные активные фрагменты антител, такие как Fv или одноцепочечные Fv (scFv), антитела с удаленными в результате делеции домена или т.п. Fv-фрагмент антитела имеет размер примерно 50 кДа и содержит вариабельные области легкой и тяжелой цепи. Полипептид одноцепочечного Fv («scFv») представляет собой ковалентно связанный гетеродимер VH::VL, который может экспрессироваться нуклеиновой кислотой, содержащей кодирующие VH- и VL-последовательности либо соединенные непосредственно, либо соединенные с помощью кодирующего пептид линкера (см. Huston и др., Proc. Nat. Acad. Sci. USA, 85, 1988, cc. 5879-5883). Известно много структур для превращения встречающихся в естественных условиях агрегированных, но химически разделенных полипептидов легких и тяжелых цепей из V-области антитела, в scFv-молекулы, которые складываются в трехмерную структуру, практически сходную со структурой антигенсвязывающего центра (см., например, US 5091513, 5132405 и 4956778).
Антигенсвязывающий центр обозначает часть молекулы антитела, которая участвует в связывании антигена. Антигенсвязывающий центр образуется аминокислотными остатками N-концевых вариабельных («V») областей тяжелой («Н») и легкой («L») цепей. Вариабельные области антитела содержат три отличающиеся высокой дивергентностью участка, которые называют «гипервариабельными участками» или «определяющими комплементарность участками» (CDR), которые расположены между более консервативными фланкирующими участками, которые называют «каркасными участками» (FR). В молекуле антитела три гипервариабельных участка легкой цепи (LCDR1, LCDR2 и LCDR3) и три гипервариабельных участка тяжелой цепи (HCDR1, HCDR2 и HCDR3) располагаются относительно друг друга в трехмерном пространстве, образуя антигенсвязывающую поверхность или «карман». Таким образом, антигенсвязывающий центр антитела представлен аминокислотами, которые формируют CDR антитела, и любыми каркасными участками, которые формируют «карман» центра связывания.
Идентичность аминокислотных остатков в конкретном антителе, которые образуют антигенсвязывающий центр, можно определять с помощью методов, хорошо известных в данной области. Например, CDR антитела можно идентифицировать как гипервариабельные участки, определение которых первоначально было дано Кэботом с соавторами (см. «Sequences of Proteins of Immunological Interest», E. Kabat и др., U.S. Department of Ilealth and Human Services; Johnson G и Wu TT, Kabat Database and its applications: future directions. Nucleic Acids Research, 29, 2001, cc. 205-206; http://immuno.bme.nwa.edu). Положения CDR можно идентифицировать также в виде структур, имеющих форму петель, первоначально описанных Chothia с соавторами (см. Chothia и Lesk, J. Mol. Biol. 196, 1987, с. 901, Chothia и др., Nature 342, 1989, с. 877 и Tramontano и др., J. Mol. Biol. 215, 1990, с. 175). Другие методы включают использование номенклатуры, основанной на применении программы моделирования антител (AbM-номенклатура), которая представляет собой компромисс между номенклатурой Кэбота и Chothia, и ее реализуют с помощью пакета программ Oxford Molecular’s AbM antibody modeling (в настоящее время принадлежит компании Accelrys), или определение CDR на основе «анализа контакта», предложенного Macallum с соавторами («Antibody-antigen interactions: contact analysis and binding topography», J Mol Biol., 11, 262(5), октябрь 1996 г., cc. 732-745). Ниже представлены схемы идентификации CDR на основе различных известных определений.
Ниже приведены общие руководства, с помощью которых можно идентифицировать CDR в антителе только на основе информации о последовательности:
LCDR1:
Начало - приблизительно на остатке 24. Остаток, расположенный перед участком, всегда представляет собой Cys. Остаток, расположенный после участка, всегда представляет собой Trp. Как правило, за TRP располагаются TYR-GLN, но также могут располагаться LEU-GLN, PHE-GLN или TYR-LEU. Длина участка составляет 10-17 остатков.
LCDR2:
Начало - через 16 остатков после конца L1. Расположенная перед участком последовательность, как правило, представляет собой ILE-TYR, но она может также представлять собой VAL-TYR, ILE-LYS или ILE-PHE. Длина участка, как правило, составляет 7 остатков.
LCDR3:
Начало - как правило, через 33 остатка после конца L2. Остаток, расположенный перед участком, представляет собой Cys. Расположенная за участком последовательность представляет собой PHE-GLY-X-GLY. Длина участка составляет 7-11 остатков.
HCDR1:
Начало - приблизительно на остатке 26 (через четыре остатка после CYS) [номенклатура Chothia/AbM], согласно номенклатуре Кэбота начало находится на 5 остатков дальше. Расположенная перед участком последовательность представляет собой CYS-X-Х-Х. Последующие остатки - TRP, за которым, как правило, расположен VAL, но также может располагаться ILE или ALA. Длина участка составляет 10-12 остатков согласно AbM-номенклатуре, в то время как согласно номенклатуре Chothia исключены 4 последних остатка.
HCDR2:
Начало - через 15 остатков после конца CDR-H1 согласно номенклатуре Кэбота/AbM. Расположенная перед участком последовательность, как правило, представляет собой LEU-GLU-TRP-ILE-GLY (SEQ ID NO: 1), но возможен ряд вариантов. Расположенная за участком последовательность представляет собой LYS/ARG-LEU/ILE/VAL/PHE/THR/ALA-THR/SER/ILE/ALA. Длина участка составляет 16-19 остатков согласно номенклатуре Кэбота (согласно AbM-номенклатуре участок заканчивается на 7 остатков раньше).
HCDR3:
Начало - через 33 остатка после конца CDR-H2 (через два остатка после CYS). Расположенная перед участком последовательность представляет собой CYS-X-X (как правило, CYS-ALA-ARG). Расположенная за участком последовательность представляет собой TRP-GLY-X-GLY. Длина участка составляет 3-25 остатков.
Идентичность аминокислотных остатков конкретного антитела, которые расположены вне CDR, но тем не менее образуют часть антигенсвязывающего центра благодаря боковой цепи, которая является частью линейной структуры антигенсвязывающего центра (т.е. доступна для связывания через антигенсвязывающий центр), можно определять с помощью методов, хорошо известных в данной области, таких как молекулярное моделирование и рентгеновская кристаллография (см., например, Riechmann и др., Nature, 332, 1988, сс. 323-327).
Химерные антитела представляют собой антитела, в которых одна или несколько областей антитела получены из одних видов животных и одна или несколько областей антитела получены из других видов животных. Предпочтительное химерное антитело представляет собой антитело, которое включает области из иммуноглобулина приматов. Считается, что химерное антитело, которое можно применять для лечения человека, как правило, имеет вариабельные области из антитела животного кроме человека, например, грызуна, а константные области из иммуноглобулина человека. В противоположность этому, в гуманизированном антителе применяют CDR из нечеловеческого антитела, а большинство вариабельных каркасных участков или все вариабельные каркасные участки полностью получают из константных областей человеческого иммуноглобулина. Считается, что человеческое химерное антитело, как правило, имеет вариабельные области из иммуноглобулина грызунов. Типичное человеческое химерное антитело имеет человеческие константные области тяжелых цепей и человеческие константные области легких цепей, а вариабельные области как тяжелых, так и легких цепей из антитела грызунов. Химерное антитело может нести некоторые замены относительно нативной аминокислотной последовательности человеческих константных областей и нативной последовательности вариабельной области грызунов. Химерное и гуманизированное антитела можно получать с помощью методов, хорошо известных в данной области, включая подходы, основанные на трансплантации CDR (см., например, US 5843708; 6180370; 5693762; 5585089; 5530101), стратегии, основанные на перестановке цепи (см., например, US 5565332; Rader и др., Proc. Natl. Acad. Sci. USA, 95, 1998, cc. 8910-8915), стратегии молекулярного моделирования (US 5639641) и т.п.
Понятие «гуманизированное антитело» в контексте настоящего описания в случае двухцепочечного антитела относится к антителу, в котором по меньшей мере одна цепь является гуманизированной. Цепь гуманизированного антитела имеет вариабельную область, в которой один или несколько каркасных участков являются человеческими. Гуманизированное антитело, которое имеет одну цепь, представляет собой одноцепочечное антитело, цепь которого имеет
вариабельную область, в которой один или несколько каркасных участков являются человеческими. Нечеловеческие участки вариабельной области цепи гуманизированного антитела или его фрагмента получают из источника, отличного от человеческого, в частности нечеловеческого антитела, как правило, из антитела грызунов. Вклад нечеловеческого антитела в гуманизированное антитело как правило, представляет собой по меньшей мере один CDR-участок, который находится между каркасными участками, полученными из одного (или нескольких) человеческого(их) иммуноглобулина(ов). Кроме того, можно изменять поддерживающие каркасные остатки для сохранения аффинности к связыванию.
Гуманизированное антитело может содержать также константные области (например, по меньшей мере одну константную области или ее часть, в случае легкой цепи, и предпочтительно три константные области в случае тяжелой цепи). Константные области гуманизированного антитела, если они присутствуют, как правило, являются человеческими.
Методы получения «гуманизированных антител» хорошо известны специалистам в данной области (см., например, Queen и др., Proc. Natl Acad Sci USA, 86, 1989, cc. 10029-10032, Hodgson и др., Bio/Technology, 9, 1991, с. 421).
«Гуманизированное антитело» можно получать также с помощью нового подхода генетической инженерии, который позволяет получать напоминающие человеческие поликлональные антитела с созревшей аффинностью в крупных животных, таких, например, как кролики или мыши (см., например, US 6632976).
Понятие «константная область» (CR) в контексте настоящего описания относится к генам константных областей иммуноглобулина. Гены константных областей кодируют участок молекулы антитела, который обусловливает эффекторные функции. Для создания химерных человеческих антител и гуманизированных антител, как правило, нечеловеческие (например, мышиные), константные области заменяют на человеческие константные области. Константные области химерных или гуманизированных антител, предлагаемых в изобретении, как правило, получают из человеческих иммуноглобулинов. Константную область тяжелой цепи можно выбирать из любого из пяти изотипов: альфа, дельта, эпсилон, гамма или мю. Кроме того, различные подклассы тяжелых цепей (такие как тяжелые цепи подклассов IgG) ответственны за разные эффекторные функции и таким образом, путем выбора требуемой константной области тяжелой цепи можно получать антитела с нужной эффекторной функцией. Константные области, которые можно применять согласно настоящему изобретению, представляют собой гамма 1 (IgG1), прежде всего Fc-фрагмент изотипа гамма 1 (IgG1), гамма 3 (IgG3) и наиболее предпочтительно гамма 4 (IgG4). Константная область легкой цепи может быть каппа- или лямбда-типа, предпочтительно каппа-типа. В одном из вариантов осуществления изобретения константная область легкой цепи представляет собой человеческую константную область каппа-цепи (Heiter и др., Cell 22, 1980, сс. 197-207), константная область тяжелой цепи представляет собой константную область человеческого IgG4.
Понятие «моноклональное антитело» хорошо известно в данной области и относится к антителу, которое является продуктом одной клонированной клетки, продуцирующей антитело. Моноклональные антитела, как правило, создают путем слияния продуцирующей антитела В-клетки, как правило, с коротким временем жизни, с быстро растущей клеткой, такой как раковая клетка (иногда ее называют «иммортализованной» клеткой). Образовавшаяся гибридная клетка или гибридома быстро размножается, создавая клон, который продуцирует антитело.
Для целей настоящего изобретения к «моноклональному антителу» относят также антитела, полученные с помощью материнского клона, который еще не достиг полной моноклональности.
В контексте настоящего изобретения понятие «функциональный эквивалент антитела» относится к антителу, которое в целом сохраняет по меньшей мере одно из упомянутых выше основных функциональных свойств антитела, в том числе: способность к специфическому связыванию с белком β-амилоида, прежде всего с белком Аβ1-42 и более предпочтительно с эпитопной 16-21-областью белка Аβ1-42, иммунореактивность in vitro, способность к ингибированию агрегации мономеров Аβ1-42, приводящей к образованию высокомолекулярных полимерных фибрилл, и/или нарушению агрегации ранее сформированных полимерных фибрилл Аβ1-42, и/или нарушению правильности β-складчатой конформации и облегчению воздействий на амилоидоз, группу заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь только ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), деменция, связанная с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландского типа); комплекс деменции Гуама-Паркинсона, а также другие заболевания, которые обусловлены или ассоциированы с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая дегенерацию желтого пятна, при введении с целью профилактики или лечения. Антитела могут принадлежать к любому классу, такому как IgG, IgM или IgA и т.д., или любому подклассу, такому как IgG1, IgG2a и т.д., и другим упомянутым выше или известным в данной области подклассам, но прежде всего к классу IgG4. Кроме того, антитела можно получать с помощью любого метода, такого как фаговая презентация, или получать в любом организме или линии клеток, в том числе в клетках бактерий, насекомых, млекопитающих или другом типе клеток или клеточных линий, которые продуцируют антитела с требуемыми характеристиками, такие как гуманизированные антитела. Антитела можно создавать также путем объединения Fab-фрагмента и Fc-участка из различных видов.
Понятие «гибридизовать» в контексте настоящего описания относится к общепринятым условиям гибридизации, предпочтительно условиям гибридизации, при которых в качестве раствора применяют 5×SSPE, 1% ДСН, 1-кратный (1×) раствор Денхардта и/или гибридизацию проводят при температуре от 35 до 70°С, предпочтительно 65°С. После гибридизации отмывку предпочтительно осуществляют сначала с использованием 2×SSC, 1% ДСН, а затем 0,2×SSC при температуре от 35 до 70°С, предпочтительно 65°С (описание состава SSPE, SSC и раствора Денхардта см. у Sambrook и др., loc. cit.). Наиболее предпочтительными являются строгие условия гибридизации, описанные, например, у Sambrook и др. выше. Особенно предпочтительными строгими условиями гибридизации являются, например, условия, при которых гибридизацию и отмывку осуществляют при 65°С, как описано выше. Менее предпочтительной является гибридизация в условиях пониженной жесткости, когда, например, гибридизацию и отмывку осуществляют при 45°С, и еще менее предпочтительно, когда их осуществляют при 35°С.
«Гомологию» между двумя последовательностями определяют по идентичности последовательностей. Если две последовательности, которые требуется сравнить друг с другом, различаются по длине, то понятие «идентичность последовательностей» предпочтительно относится к проценту нуклеотидных остатков в более короткой последовательности, которые идентичны нуклеотидным остаткам более длинной последовательности. Идентичность последовательностей можно определять с помощью общепринятых компьютерных программ, таких как программа Bestfit (Wisconsin Sequence Analysis Package, версия 8 для Unix, Genetics Computer Group, University Research Park, 575 Science Drive Madison, W1 53711). Программа Bestfit основа на использовании локального алгоритма гомологии Смита и Ватермана (Smith и Waterman, Advances in Applied Mathematics 2, 1981, cc. 482-489), для поиска сегмента, характеризующегося самой высокой идентичностью последовательности между двумя последовательностями. При использовании Bestfit или другой программы сравнительного анализа первичной структуры последовательностей для определения того, идентична ли конкретная последовательность, например на 95%, последовательности, с которой производят сравнение (референс-последовательность), предлагаемой в настоящем изобретении, параметры предпочтительно регулируют так, чтобы процент идентичности рассчитывать для всей длины референс-последовательности, и при этом при определении указанного уровня гомологии разрешается введение брешей, количество которых составляет вплоть до 5% от общего количества нуклеотидов в референс-последовательности. Когда используют программу Bestfit, то так называемым необязательным параметрам предпочтительно оставляют ранее установленные («принятые по умолчанию») значения. Отклонения, появляющиеся при сравнении данной последовательности и вышеописанных последовательностей, предлагаемых в изобретении, могут обусловливаться, например, добавлением, делецией, заменой, инсерцией или рекомбинацией. Такое сравнение последовательностей можно предпочтительно осуществлять с помощью программы «fasta20u66» (версия 2.0u66, сентябрь 1998 г., разработанной William R. Pearson и Университетом Виргинии, см. также W. R. Pearson, Methods in Enzymology 183, 1990, cc. 63-98, прилагаемые примеры, а также http://workbench.sdsc.edu/). Для этой цели можно использовать набор «задаваемых по умолчанию параметров».
Антитело, предлагаемое в изобретении, может представлять собой иммуноглобулин или антитело, для которого установлено, что каждый из его сайтов связывания является идентичным (в случае мультивалентного антитела) или в альтернативном варианте оно может представлять собой «биспецифическое» или «бифункциональное антитело».
«Биспецифическое» или «бифункциональное антитело» представляет собой искусственное гибридное антитело, имеющее две различные пары тяжелых/легких цепей и два различных сайта связывания. Биспецифические антитела можно получать различными методами, включая слияние гибридом или связывание Fab’-фрагментов (см., например, Songsivilai и Lachmann, Clin. Exp. Immunol. 79, 1990, cc. 315-321; Kostelny и др., J. Immunol. 148, 1992, cc. 1547-1553.
Понятие «фрагмент» относится к части или участку антитела или цепи антитела, которая/который содержит меньшее количество аминокислотных остатков, чем интактное или полное антитело или цепь антитела. Фрагменты можно получать путем обработки химическими агентами или ферментами интактного или полного антитела или цепи антитела. Фрагменты можно получать также с помощью рекомбинации. Примерами фрагментов являются Fab-, Fab’-, F(ab’)2-, Fabc- и/или Fv-фрагменты. Понятие «антигенсвязывающий фрагмент» относится к полипептидному фрагменту иммуноглобулина или антитела, который связывает антиген или конкурирует с интактным антителом (т.е. с интактным антителом, из которого он получен) за связывание с антигеном (т.е. характеризуется специфичностью связывания).
Связывающие фрагменты получают методом рекомбинантной ДНК или путем ферментативного или химического расщепления интактных иммуноглобулинов. Связывающие фрагменты включают Fab, Fab’, F(ab’)2, Fabc, Fv, одноцепочечные фрагменты и одноцепочечные антитела.
Понятие «фрагмент» относится также к пептиду или полипептиду, содержащему аминокислотную последовательность, которая состоит по меньшей мере из 5 смежных аминокислотных остатков, по меньшей мере из 10 смежных аминокислотных остатков, по меньшей мере из 15 смежных аминокислотных остатков, по меньшей мере из 20 смежных аминокислотных остатков, по меньшей мере из 25 смежных аминокислотных остатков, по меньшей мере из 40 смежных аминокислотных остатков, по меньшей мере из 50 смежных аминокислотных остатков, по меньшей мере из 60 смежных аминокислотных остатков, по меньшей мере из 70 смежных аминокислотных остатков, по меньшей мере из 80 смежных аминокислотных остатков, по меньшей мере из 90 смежных аминокислотных остатков, по меньшей мере из 100 смежных аминокислотных остатков, по меньшей мере из 125 смежных аминокислотных остатков, по меньшей мере из 150 смежных аминокислотных остатков, по меньшей мере из 175 смежных аминокислотных остатков, по меньшей мере из 200 смежных аминокислотных остатков или по меньшей мере из 250 смежных аминокислотных остатков, аминокислотной последовательности другого полипептида. В конкретном варианте осуществления изобретения фрагмент полипептида сохраняет по меньшей мере одну функцию полипептида.
Понятие «антиген» относится к полной субстанции или ее фрагменту, который может связываться с антителом. Понятие «иммуноген» относится к антигену, который может вызывать иммунный ответ в организме, прежде всего животного, более предпочтительно млекопитающего, включая человека. Понятие «антиген» включает области, которые известны как антигенные детерминанты или эпитопы, которые представляют собой часть антигена (которая осуществляет контакт или играет важную роль в поддержании контакта, присущего антигену), ответственную за антигенность, или антигенные детерминанты.
В контексте настоящего описания понятие «растворимый» обозначает частично или полностью растворимый в водном растворе.
В контексте настоящего описания понятие «иммуногенные» относится к субстанциям, которые вызывают или усиливают производство антител, Т-клеток и других реактивных иммунных клеток, направленных против иммуногена антигена.
Иммунный ответ имеет место, когда в организме индивидуума продуцируется достаточное количество антител, Т-клеток и других реактивных иммунных клеток против введенных иммуногенных композиций, предлагаемых в настоящем изобретении, с целью ослабления или облегчения подлежащего лечению нарушения.
Понятие «иммуногенность» в контексте настоящего описания относится к мере способности антигена вызывать иммунный ответ (гуморальный или клеточный) при введении реципиенту. Настоящее изобретение относится к подходам, которые снижают иммуногенность предлагаемых в изобретении человеческих химерных или гуманизированных антител.
Понятие «гуманизированное антитело с пониженной иммуногенностью» относится к гуманизированному антителу, которое обладает более низкой иммуногенностью по сравнению с родительским антителом, например, мышиным антителом.
Понятие «гуманизированное антитело, практически сохраняющее способность к связыванию родительского антитела» относится к гуманизированному антителу, которое сохраняет способность специфически связывать антиген, распознаваемый родительским антителом, которое применяют для получения указанного гуманизированного антитела. Предпочтительно гуманизированное антитело должно иметь такую же или практически такую же аффинность к связыванию антигена и авидность, что и родительское антитело. В идеальном варианте аффинность антитела должна составлять не менее 10% от аффинности родительского антитела, более предпочтительно не менее чем примерно 30% и наиболее предпочтительно аффинность должна составлять не менее 50% относительно родительского антитела. Методы анализа аффинности к связыванию антигена хорошо известны в данной области и включают анализы связывания, составляющего половину от максимального, конкурентные анализы и анализ Скэтчарда. Приемлемые анализы связывания антигенов представлены в настоящем описании.
«Обратная мутация» представляет собой мутацию, интродуцированную в нуклеотидную последовательность, которая кодирует гуманизированное антитело, эта мутация приводит к получению аминокислот, соответствующих аминокислотам в родительском антителе (например, в донорском антителе, например, в мышином антител). Определенные каркасные остатки из родительского антитела можно сохранять в процессе гуманизации антител, предлагаемых в изобретении, для того, чтобы практически сохранять способность к связыванию родительского антитела, минимизируя при этом потенциальную иммуногенность полученного антитела. В одном из вариантов осуществления изобретения родительское антитело имеет мышиное происхождение. Например, обратная мутация приводит к изменению человеческого каркасного остатка на родительский мышиный остаток. Примерами каркасных остатков, которые можно подвергать обратной мутации, являются (но не ограничиваясь только ими) канонические остатки, упаковывающие остатки поверхности раздела, необычные родительские остатки, которые примыкают к сайту связывания, остатки из «верньер-зоны) (которая образует «платформу», на которой располагаются CDR) (Foote и Winter, J. Mol. Biol. 224, 1992, cc. 487-499) и остатки, примыкающие к CDRH3.
В контексте настоящего описания понятие «консервативная замена» относится к изменениям, которые являются практически нейтральными с позиций конформации или антигенности, приводят к минимальным изменениям третичной структуры зрелых полипептидов или приводят к минимальным изменениям антигенных детерминант зрелых полипептидов соответственно, по сравнению с нативным белком. Касательно антител и фрагментов антител, предлагаемых в изобретении, консервативная замена означает аминокислотную замену, которая не приводит к отсутствию способности антитела к связыванию с рецептором-мишенью. Обычные специалисты в данной области могут предсказывать, какие аминокислотные замены можно осуществлять, сохраняя при этом высокую вероятность того, что они будет нейтральной с позиций конформации или антигенности. Указанное руководство представлено, например у Berzofsky, Science 229, 1985, сс. 932-940 и Bowie и др. Science, 247, 1990, сс. 1306-1310. Факторы, которые, как считается, влияют на вероятность сохранения конформационной и антигенной нейтральности включают (но не ограничиваясь только ими): (а) маловероятно, что замена гидрофобных аминокислот может влиять на антигенность, поскольку маловероятно, что гидрофобные остатки могут быть локализованы внутри белка; (б) маловероятно, что замена сходных по физико-химическим характеристикам аминокислот может влиять на конформацию, поскольку заменяющая аминокислота структурно напоминает нативную аминокислоту; и (в) вероятно, что изменение созданных в результате эволюции консервативных последовательностей может оказывать вредное воздействие на конформацию, поскольку считается, что такая консервативность предполагает, что аминокислотные последовательности могут иметь важное значение. Обычный специалист в данной области может оценивать конформационные изменения белка с помощью хорошо известных анализов, таких как (но не ограничиваясь только ими) методы фиксации микрокомплемента (Wasserman и др., J. Immunol. 87, 1961, сс. 290-295; Levine и др., Meth. Enzymol. 11, 1967, сс. 928-936) и исследования связывания с использованием зависящих от конформации моноклональных антител (Lewis и др., Biochem. 22, 1983, сс. 948-954).
Понятие «терапевтически эффективное количество» относится к количеству антитела, которое при введении человеку или животному является достаточным для оказания терапевтического действия на человека или животного. Специалист в данной области легко может определять эффективное количество с помощью общепринятых процедур.
В контексте настоящего описания понятия «лечить» «предупреждать», «предупреждение» и «профилактика» относятся к предупреждению рецидива или возникновения одного из симптомов нарушения у индивидуума в результате введения профилактического или терапевтического агента.
Конструирование гуманизированных антител
Настоящее изобретение может стать более понятным после ознакомления с подробным описанием конкретных с вариантов осуществления изобретения, приведенным в настоящем описании. Хотя настоящее изобретение описано со ссылкой на конкретные детали определенных вариантов осуществления изобретения, не подразумевается, что такие детали направлены на ограничение объема изобретения.
Настоящее изобретение относится к новым способам и композициям, содержащим высокоспецифические и высокоэффективные антитела, которые обладают способностью специфически распознавать и связываться с эпитопами из широкого разнообразия β-амилоидных антигенов. Антитела, предлагаемые в настоящем изобретении, наиболее целесообразно применять для лечения амилоидоза, группы заболеваний и нарушений, ассоциированных с образованием амилоидных бляшек, включая вторичный амилоидоз и связанный с возрастом амилоидоз, включая (но не ограничиваясь только ими) неврологические заболевания, такие как болезнь Альцгеймера (AD), деменция, связанная с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландского типа); комплекс деменции Гуама-Паркинсона, а также других заболеваний, которые обусловлены или ассоциированы с амилоидоподобными белками, таких как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, наследственная церебральная геморрагия с амилоидозом (голландского типа), болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и других заболеваний, включая дегенерацию желтого пятна.
Полностью гуманизированную или реконструированную вариабельную область, предлагаемую в настоящем изобретении, можно создавать согласно изобретению сначала путем конструирования аминокислотной последовательности вариабельной области, которая содержит нечеловеческие, предпочтительно полученные из антител грызунов CDR, но наиболее предпочтительно CDR, выведенные из мышиного антитела ACI-01-Ab7C2 (которое в контексте настоящего описания обозначают также как «mC2»), которое депонировано в соответствии с требованиями Будапештского договора 01 декабря 2005 г. в Немецкой коллекции микроорганизмов и клеточных культур» (DSMZ), Брауншвейг, Mascheroder Weg 1 В, 38124 Braunschweig, под регистрационным номером DSM АСС2750), встроенные в полученные из человеческих антител каркасные последовательности. Нечеловеческие, предпочтительно полученные из антител грызунов CDR, которые можно получать из антитела, предлагаемого в настоящем изобретении, обеспечивают требуемую специфичность. Таким образом, эти остатки следует включать при создании реконструированной вариабельной области практически в неизменном виде. При этом все модификации должны быть ограничены до минимума и следует тщательно оценивать изменения специфичности и аффинности антитела. С другой стороны, каркасные остатки теоретически можно получать из любой человеческой вариабельной области.
Для создания реконструированного антитела, которое обладает приемлемой или даже улучшенной аффинностью, следует отбирать человеческие каркасные последовательности, которые одновременно пригодны для создания реконструированной вариабельной области и для сохранения аффинности антитела.
Для решения этой задачи была разработана стратегия «наилучшего подбора». Как известно, каркасные последовательности служат для поддержания CDR в их правильной пространственной ориентации для взаимодействия с антигеном, и каркасные остатки могут иногда принимать даже участие в связывании антигена, поэтому данная стратегия направлена на минимизацию изменений, которые могут оказывать отрицательное действие на трехмерную структуру антитела, путем использования человеческой каркасной последовательности для реконструкции антитела из человеческой вариабельной области, которая в наибольшей степени гомологична или подобна нечеловеческой, предпочтительно полученной из антител грызунов вариабельной области. Это также максимально увеличивает вероятность того, что у реконструированного антитела будет сохраняться аффинность.
В наиболее простом варианте стратегия «наилучшего подбора» включает сравнение донорской V-области грызунов со всеми известными человеческими аминокислотными последовательностями V-области и последующий отбор последовательностей с наибольшей степенью гомологии для получения акцепторных каркасных участков для экспериментов по гуманизации. Фактически известно несколько других факторов, которые следует принимать во внимание и которые могут влиять на окончательный отбор акцепторных каркасных участков. В этой связи прогнозы молекулярного моделирования можно использовать перед любой экспериментальной работой, направленной на увеличение до максимума аффинности образовавшегося реконструированного антитела. Практически задача по моделированию представляет собой предсказание того, какие имеющие решающее значение остатки (если они существуют), наиболее гомологичные остаткам человеческого каркасного участка, следует сохранять в каркасном участке грызунов для получения наиболее высокой аффинности у реконструированного антитела.
В одном из вариантов осуществления изобретения CDR получают из мышиного моноклонального антитела, прежде всего из мышиного моноклонального антитела ACI-01-Ab7C2 (которое в настоящем описании обозначено также как «mC2»), описанного в находящейся в совместном рассмотрении ЕР 05027092.5 поданной 12.12.2005 г., описание которой включено в настоящее описание в качестве ссылки.
Клетки гибридомы линии FP-12H3-C2, продуцирующие мышиное моноклональное антитело ACI-01-Ab7C2 (обозначенное в настоящем описании как «mC2» и как «hC2» в случае гуманизированного антитела С2), описанной в находящейся в совместном рассмотрении заявке ЕР05027092.5, депонированы в соответствии с требованиями Будапештского договора 01 декабря 2005 г. в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ), Брауншвейг, Mascheroder Weg 1 В, 38124 Braunschweig, под регистрационным номером DSM АСС2750.
Мышиное антитело может вырабатываться против надмолекулярной антигенной конструкции, которая содержит антигенный пептид, соответствующий аминокислотной последовательности β-амилоидного пептида, прежде всего β-амилоидного пептида Aβ1-15, Аβ1-16 и Аβ1-16(Δ14), модифицированного с помощью гидрофобного фрагмента, такого, например, как пальмитиновая кислота, или гидрофильного фрагмента, такого, например, как полиэтиленгликоль (ПЭГ), или комбинации обоих указанных агентов, где гидрофобный и гидрофильный фрагмент соответственно соединяют с помощью ковалентной связи с каждым концом антигенного пептида по меньшей мере через одну, прежде все одну или две аминокислоты, такие, например, как лизин, глутаминовая кислота и цистеин или любая другая приемлемая аминокислота или аналог аминокислоты, который может служить в качестве соединяющего элемента для сшивания гидрофобного и гидрофильного фрагмента с пептидным фрагментом. Когда в качестве гидрофильного фрагмента применяют ПЭГ, то свободные концы ПЭГ ковалентно связывают с фосфатидилэтаноламином или любым другим соединением, которое может функционировать в качестве «заякоривающего» элемента, предназначенного для встраивания антигенной конструкции в бислой липосомы.
В частности, мышиное антитело может вырабатываться против надмолекулярной антигенной конструкции, которая содержит антигенный пептид, соответствующий аминокислотной последовательности β-амилоидного пептида Аβ1-16, модифицированного с помощью гидрофильного фрагмента, такого, например, как полиэтиленгликоль (ПЭГ), где гидрофильный фрагмент соединяют с помощью ковалентной связи с каждым концом антигенного пептида по меньшей мере через одну, прежде все одну или две аминокислоты, такие, например, как лизин, глутаминовая кислота и цистеин или любая другая приемлемая аминокислота или аналог аминокислоты, который может служить в качестве соединяющего элемента для сшивания гидрофобного и гидрофильного фрагмента с пептидным фрагментом. Когда в качестве гидрофильного фрагмента применяют ПЭГ, то свободные концы ПЭГ ковалентно связывают с фосфатидилэтаноламином или любым другим соединением, которое может функционировать в качестве «заякоривающего» элемента, предназначенного для встраивания антигенной конструкции в бислой липосомы.
Одним из вариантов осуществления изобретения является химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент, которое/который содержит в вариабельной области по меньшей мере один CDR нечеловеческого происхождения, встроенный в один или несколько полученных из человеческого антитела или антител приматов каркасных участков, и объединенные с константной областью, полученной из человеческого антитела или антитела приматов, при этом химерное антитело или его фрагмент, либо гуманизированное антитело или его фрагмент обладают способностью специфически распознавать и связывать β-амилоидный мономерный пептид.
CDR содержат остатки, которые с наибольшей вероятностью связываются с антигеном и должны сохраняться в реконструированном антителе. CDR идентифицируют по их последовательности согласно номенклатуре Кэбота с соавторами, описанной в: «Sequences of Proteins of Immunological Interest», 5-e изд., изд-во U.S. Department of Ilealth and Human Services, The United States Government Printing Office, 1991. Положения CDR подпадают под канонические классы (Chothia и др., Nature, 342, 1989, сс. 877-883), в которых имеющие решающее значение остатки в значительной степени определяют структурную конформацию петли CDR. Эти остатки практически всегда сохраняют в реконструированном антителе.
В процессе получения гуманизированного антитела, предлагаемого в изобретении, аминокислотные последовательности вариабельных областей тяжелой и легкой цепи (VH и VK) антитела С2 сравнивают с последовательностями VH и VK антитела грызунов на основе баз данных Национального центра биотехнологической информации (NCBI) и Кэбота.
Наиболее близким по совместимости геном мышиной зародышевой линии к VK С2 является bb1, локус MMU231201 (Schable и др., 999). Сравнение позволило установить, что две аминокислоты, отличные от этой последовательности зародышевой линии, обе локализованы в CDRL1. Были обнаружены зрелые мышиные антитела с подобными, но не идентичными последовательностями. Некоторые антитела имели идентичные CDRL2 и идентичные CDRL3, но CDRL1 С2, по-видимому, является уникальным. Сравнение с последовательностями VK человеческой зародышевой линии показало, что гены из подгруппы VKII наиболее хорошо совместимы с VK С2 (Сох и др., 1994). Таким образом, VK С2 можно отнести к подгруппе последовательностей MuVKII согласно номенклатуре Кэбота.
DPK15 в сочетании с человеческой J-областью HuJKI можно отбирать для получения акцепторных каркасных последовательностей для гуманизированной VK.
Были идентифицированы остатки на поверхности раздела вариабельных областей легкой и тяжелой цепей (Chothia и др., J. Mol. Biol., 186, 1985, сс. 651-663). Их, как правило, сохраняют в реконструированном антителе. Phe в положении 87 VK мышиного С2 не является характерным остатком для поверхности раздела, а Tyr является более распространенным в подгруппе VKII, что свидетельствует о том, что этот каркасный остаток может быть важным для активности антитела. Tyr 87 присутствует в человеческой зародышевой линии и в гуманизированной VK С2.
Таким образом, можно создавать гуманизированные последовательности VK, такие как C2HuVK1, состоят из мышиного CDR VK С2 с каркасными участками из DPK 15 и человеческой области JK1. В конкретном варианте осуществления изобретения мышиные остатки можно заменять в человеческом каркасном участке в положениях 45 и/или 87. В CDR2-участке, полученном из мышиного моноклонального антитела, прежде всего мышиного антитела ACI-01-Ab7C2, аминокислотные замены можно осуществлять в положениях 50 и/или 53 согласно номенклатуре Кэбота. Остаток 45 может принимать участие в поддержании конформации CDR. Остаток 87 локализован на поверхности раздела VH- и VK-областей. Таким образом, эти остатки могут иметь решающее значение для сохранения способности антитела к связыванию.
Наиболее близким по совместимости геном мышиной зародышевой линии к VH AF С2 является VH7183, локус AF120466, (Langdon и др., 2000). Сравнение с последовательностями VH человеческой зародышевой линии показало, что гены из подгруппы VHIII наиболее совместимы с VH С2. VH AF С2 можно отнести к подгруппе Mu VHIIID согласно номенклатуре Кэбота. Последовательность DP54 в сочетании с человеческой J-областью HuJh6 можно отбирать для получения акцепторных каркасных последовательностей для гуманизированной VH.
Сравнение позволило установить, что существует девять аминокислотных различий между последовательностями VH С2 и последовательностью DP54 и JH6 человеческой акцепторной зародышевой линией, большая часть которых локализована в CDRH2. Обнаружены зрелые мышиные антитела, идентичные или подобные (отличающиеся одним остатком) CDRH1 или подобные CDRH2 (отличающиеся одним остатком), но не обнаружено ни одного антитела, у которого все три CDR были бы идентичны VH AF С2. CDRH3 антитела С2 является необычно коротким, состоит только из трех остатков. Однако в базе данных обнаружены другие антитела, у которых CDRH3 имеет такую же длину. Остаток 47 VH С2 более предпочтительно представляет собой Leu, чем наиболее часто встречающийся в этом положении Trp, а остаток 94 более предпочтительно представляет собой Ser, чем обычно встречающийся Arg, что свидетельствует о том, что эти каркасные остатки могут быть важными для активности антитела.
Можно создавать различные гуманизированные последовательности VH. C2HuVH1 состоит из CDR Vh AF С2 с каркасными участками из DP54 и HuJh6. В конкретном варианте осуществления изобретения мышиные остатки можно заменять в человеческом каркасном участке в положениях 47 или 94 или в обоих положениях. Остаток 47 в каркасном участке 2 имеет контакт как с CDR, так и с VK-областью. Остаток 94 может принимать участие в поддержании конформации CDR. Таким образом, эти остатки могут иметь решающее значение для сохранения способности антитела к связыванию.
Можно создавать различные HCVR- и LCVR-области, которые содержат нечеловеческие CDR, полученные из донорского антитела, например, мышиного антитела, встроенные в нативные или модифицированные полученные из антител человека или приматов каркасные участки. Модификация может, в частности, включать замену одного или нескольких аминокислотных остатков в каркасном участке на нечеловеческие остатки, прежде всего мышиные остатки, наиболее часто встречающиеся в этом положении в соответствующих подгруппах, или на остатки, которые обладают подобными свойствами, что и остатки, наиболее часто встречающиеся в этом положении в соответствующих подгруппах.
Модификация каркасного участка в каркасных последовательностях служит для поддержания CDR в их правильной пространственной ориентации для взаимодействия с антигеном, и эти каркасные остатки могут иногда даже принимать участие в связывании антигена. В одном из вариантов осуществления изобретения принимают меры для дополнительной адаптации выбранных человеческих каркасных последовательностей для придания им наибольшего подобия с последовательностями каркасных участков грызунов для повышения до максимума вероятности того, что реконструированное антитело сохранит свою аффинность.
Так, можно заменять мышиные остатки в человеческом каркасном участке. В частности, мышиные остатки можно заменять человеческим каркасным участком из вариабельной области тяжелой цепи (HCVR) в положениях 47 или 94 или в обоих положениях и в человеческом каркасном участке вариабельной области легкой цепи (LCVR) в положениях 45 и/или 87. В CDR2-участке, полученном из мышиного моноклонального антитела, прежде всего мышиного антитела ACI-01-Ab7C2, аминокислотные замены можно осуществлять в положениях 50 и/или 53 согласно номенклатуре Кэбота.
Остатки, обнаруженные в указанных выше положениях в человеческом каркасном участке, можно заменять на мышиные остатки, наиболее часто встречающиеся в этом положении в соответствующих подгруппах. В частности, Trp в положении 47 согласно номенклатуре Кэбота в полученном из антитела человека или примата каркасном участке вариабельной области тяжелой цепи, представленной в SEQ ID NO: 15, можно заменять на Leu или на аминокислотный остаток с аналогичными свойствами и эта замена приводит к изменениям, которые являются практически нейтральными с позиций конформации или антигенности, приводят к минимальным изменениям третичной структуры мутантных полипептидов или приводят к минимальным изменениям антигенных детерминант. В частности, Trp в положении 47 согласно номенклатуре Кэбота в полученном из антитела человека или примата каркасном участке вариабельной области тяжелой цепи, представленной в SEQ ID NO: 15, можно заменять также на аминокислоту, выбранную из группы, включающей норлейцин, Ile, Val, Met, Ala и Phe, прежде всего Ile. Можно осуществлять другие консервативные замены, которые являются нейтральными с позиций конформации и антигенности.
Arg в положении 94 согласно номенклатуре Кэбота в полученном из антитела человека или приматов каркасном участке вариабельной области тяжелой цепи, представленной в SEQ ID NO: 15, можно заменять на Ser или на аминокислотный остаток с аналогичными свойствами, и эта замена приводит к изменениям, которые являются практически нейтральными с позиций конформации или антигенности, приводят к минимальным изменениям третичной структуры мутантных полипептидов или приводят к минимальным изменениям антигенных детерминант. В частности, в другом варианте Arg в положении 94 согласно номенклатуре Кэбота в полученном из антитела человека или приматов каркасном участке вариабельной области тяжелой цепи, представленной в SEQ ID NO: 15, можно заменять на Thr.
В другом варианте осуществления изобретения оба остатка можно заменять в гуманизированном антителе.
Gln в положении 45 согласно номенклатуре Кэбота в полученном из антитела человека или приматов каркасном участке вариабельной области легкой цепи, представленной в SEQ ID NO: 12, можно заменять на Lys или на аминокислотный остаток с аналогичными свойствами, и эта замена приводит к изменениям, которые являются практически нейтральными с позиций конформации или антигенности, приводят к минимальным изменениям третичной структуры мутантных полипептидов или приводят к минимальным изменениям антигенных детерминант. В частности, Gln в положении 45 согласно номенклатуре Кэбота в полученном из антитела человека или приматов каркасном участке вариабельной области легкой цепи, представленной в SEQ ID NO: 12, можно заменять на аминокислоту, выбранную из группы, включающей Arg, Gln и Asn, предпочтительно Arg.
Leu в положении 50 согласно номенклатуре Кэбота в полученном из антитела человека или приматов каркасном участке вариабельной области легкой цепи, представленной в SEQ ID NO: 12, можно заменять на Lys или на аминокислотный остаток с аналогичными свойствами, и эта замена приводит к изменениям, которые являются практически нейтральными с позиций конформации или антигенности, приводят к минимальным изменениям третичной структуры мутантных полипептидов или приводят к минимальным изменениям антигенных детерминант. В частности, Leu в положении 50 согласно номенклатуре Кэбота в полученном из антитела человека или приматов каркасном участке вариабельной области легкой цепи, представленной в SEQ ID NO: 12, можно заменять на аминокислоту, выбранную из группы, включающей Arg, Gln, и Asn, предпочтительно Arg.
Asn в положении 53 согласно номенклатуре Кэбота в полученном из антитела человека или приматов каркасном участке вариабельной области легкой цепи, представленной в SEQ ID NO: 12, можно заменять на His и Gln или на аминокислотный остаток с аналогичными свойствами, и эта замена приводит к изменениям, которые являются практически нейтральными с позиций конформации или антигенности, приводят к минимальным изменениям третичной структуры мутантных полипептидов или приводят к минимальным изменениям антигенных детерминант. В частности, Asn в положении 53 согласно номенклатуре Кэбота в полученном из антитела человека или приматов каркасном участке вариабельной области легкой цепи, представленной в SEQ ID NO: 12, можно заменять на аминокислоту, выбранную из группы, включающей Gln, His, Lys и Arg.
Thr в положении 87 согласно номенклатуре Кэбота в полученном из антитела человека или приматов каркасном участке вариабельной области легкой цепи, представленной в SEQ ID NO: 12, можно заменять на Phe или на аминокислотный остаток с аналогичными свойствами, и эта замена приводит к изменениям, которые являются практически нейтральными с позиций конформации или антигенности, приводят к минимальным изменениям третичной структуры мутантных полипептидов или приводят к минимальным изменениям антигенных детерминант. В частности, Tyr в положении 87 согласно номенклатуре Кэбота в полученном из антитела человека или приматов каркасном участке вариабельной области легкой цепи, представленной в SEQ ID NO: 12, можно заменять на аминокислоту, выбранную из группы, включающей Leu, Val, Ile и Ala, предпочтительно Leu.
Полученную таким образом вариабельную область, содержащую по меньшей мере один CDR нечеловеческого происхождения, встроенный в один или несколько полученных из антитела человека или приматов каркасных участков, можно затем объединять с константной областью, выведенной из взятого в качестве источника антитела человека или приматов, прежде всего с человеческими константными областями IgG4 или к соответственно. Константная область IgG4 может быть модифицирована, например, заменой серина в положении 228 в шарнирной области на пролин (HuIgG4 Ser-Pro). Эта мутация стабилизирует находящийся между цепями дисульфидный мостик и предупреждает образование «полумолекул», что может происходить в препаратах нативного человеческого IgG4. Константную область IgG4 можно модифицировать также путем делеции концевого Lys в положении 439, что показано в SEQ ID NO: 16.
Модифицированные вариабельные области можно конструировать с помощью метода, известного в данной области, например путем перекрывающей ПЦР-рекомбинации. Кассеты экспрессии для химерного антитела С2 ChVH AF и С2 ChVK можно использовать в качестве матриц для мутагенеза каркасных участков с получением требуемых последовательностей. Синтезируют наборы пар праймеров для мутагенеза, содержащие области, подлежащие изменению. Полученные кассеты экспрессии гуманизированных VH и VK можно клонировать в соответствующих клонирующих векторах, известных в данной области, таких, например, как pUC19. После подтверждения правильности полной последовательности ДНК каждой VH и VK гены модифицированных V-областей тяжелой и легкой цепи можно вырезать из клонирующего вектора в виде кассет экспрессии. Затем их можно переносить в соответствующие экспрессионные векторы, такие как pSVgpt и pSVhyg, которые включают константные области IgG4 Ser-Pro или κ соответственно.
Экспрессионные векторы
Основой экспрессионного вектора pSVgpt является pSV2gpt (Mulligan и Berg, 1980), и он включает ген, обусловливающий устойчивость к ампициллину, для селекции в бактериальных клетках и ген gpt для селекции в клетках млекопитающих, энхансерную область тяжелой цепи мышиного иммуноглобулина, геномную последовательность, кодирующую ген константной области, и поли-А-последовательности SV40. Для экспрессии вариабельную область тяжелой цепи встраивают в виде HindIII-BamHI-фрагмента.
Экспрессионный вектор pSVhyg включает ген, обусловливающий устойчивость к ампициллину, для селекции в бактериальных клетках, ген hyg для селекции в клетках млекопитающих, энхансерную область тяжелой цепи мышиного иммуноглобулина, геномную последовательность, кодирующую ген константной области каппа-цепи и включает энхансер каппа-цепи и поли-А-последовательности SV40. Для экспрессии вариабельную область легкой цепи встраивают в виде HindIII-BamHI-фрагмента.
Затем необходимо подтверждать правильность последовательности ДНК гуманизированных VH и VK в экспрессионных векторах.
Для получения антитела экспрессионные векторы гуманизированной тяжелой и легкой цепи можно интродуцировать в соответствующие клеточные линии-продуценты, известные в данной области, такие, например, как NS0-клетки. Интродукцию экспрессионных векторов можно осуществлять путем котрансфекции с помощью электропорации или с использованием другой приемлемой технологии трансформации, известной в данной области. Продуцирующие антитела клеточные линии можно затем отбирать и размножать и очищать гуманизированные антитела. Затем очищенные антитела можно анализировать с помощью стандартных методов, таких как ДСН-ПААГ.
Антитело с улучшенной аффинностью, специфичностью и стабильностью
Последовательность CDRL2 («KVSNRFS») мышиного антитела С2 можно подвергать небольшим модификациям без отрицательного воздействия на активность антитела. Можно осуществлять консервативные замены, такие как замена R на K в положении 50 и S на N в положении 53. Таким образом, две другие последовательности CDRL2 представляют собой «RVSNRFS» и «KVSSRFS» соответственно. Их встраивают в мышиную последовательность VK, в которой отсутствуют другие замены, такую как VK-R С2 и VK-S С2 соответственно.
Аффинность, специфичность и стабильность описанного выше антитела, предлагаемого в изобретении, или его фрагмента можно модифицировать путем изменения его профиля или схемы гликозилирования, приводящего к улучшению его терапевтических качеств.
Для изменения схемы гликозилирования можно создавать клетки-хозяева, которые обладают способностью экспрессировать модифицирующую гликопротеин гликозил-трансферазу с предпочтительным уровнем активности, которая повышает уровень комплексных N-связанных олигосахаридов, несущих двухсекционные GIcNAc. Кроме того, можно получать модифицированные гликоформы гликопротеинов, например, антител, включая полные молекулы антител, фрагменты антител или слитые белки, которые включают область, эквивалентную Fc-фрагменту иммуноглобулина, обладающие повышенной Fc-опосредуемой клеточной цитотоксичностью.
Методы получения антител с модифицированной схемой гликозилирования известны специалистам в данной области и описаны, например, в ЕР 1071700, US 2005272128, у Ferrara и др., J Biol Chem 281(8), 2006, сс. 5032-5036; Ferrara и др., Biotechnology and Bioengineering 93(5), 2006, cc. 851-861.
Фармацевтические препараты и их введение
Антитела, предлагаемые в изобретении, но прежде всего моноклональное антитело, предлагаемое в изобретении, можно получать с помощью известных методов в физиологически приемлемой форме, которая может включать фармацевтически приемлемый носитель, разбавитель и/или эксципиент. Например, антитело, предлагаемое в изобретении и описанное выше, включая любое функционально эквивалентное антитело или его функциональные фрагменты, прежде всего моноклональное антитело, включая любое функционально эквивалентное антитело или его функциональные фрагменты, объединяют с фармацевтически приемлемым носителем, разбавителем и/или эксципиентом с получением терапевтической композиции. Приемлемые фармацевтические носители, разбавители и/или эксципиенты хорошо известны в данной области, и к ним относятся, например, забуференные фосфатом физиологические растворы, вода, эмульсии, такие как эмульсии типа масло/вода, различные типы смачивающих агентов, стерильные растворы и т.д.
Препаративную форму фармацевтической композиции, предлагаемой в изобретении, можно получать с помощью общепринятой методологии, известной специалистам в данной области.
Композиции, предлагаемые в настоящем изобретении, можно вводить индивидууму в твердой, жидкой форме или в виде аэрозоля, которые содержат приемлемую фармацевтически эффективную дозу. Примерами твердых композиций являются пилюли, кремы и имплантируемые стандартные дозы. Пилюли можно вводить орально. Терапевтические кремы можно наносить местно. Имплантируемые стандартные дозы можно наносить местно, пример, на область опухоли, или можно имплантировать с целью системного высвобождения терапевтической композиции, например, подкожно. Примерами жидких композиций являются препаративные формы, адаптированные для внутримышечной, подкожной, внутривенной, внутриартериальной инъекции, или препаративные формы для местного или внутриглазного нанесения. Примерами препаративных форм в виде аэрозоля являются применяемые путем ингаляции препаративные формы, предназначенные для введения в легкие.
Композиции можно вводить с помощью стандартных путей введения. Как правило, композицию можно вводить с использованием местного, орального, ректального, назального, внутрикожного, внутрибрюшинного или парентерального (например, внутривенного, подкожного или внутримышечного) пути введения. Кроме того, композицию можно включать в обеспечивающие пролонгированное высвобождение матрицы, например, из биоразложимых полимеров, полимеры можно имплантировать в область, в которую требуется осуществлять введение, например, в область опухоли. Метод предусматривает введение однократной дозы, введение повторных доз через предварительно установленные интервалы времени и пролонгированное введение в течение предварительно определенного периода времени.
Применяемая в настоящем изобретении матрица, обеспечивающая пролонгированное высвобождение, представляет собой матрицу, изготовленную из материалов, как правило, полимеров, которые расщепляются путем ферментативного или кислотного/щелочного гидролиза или путем растворения. При внесении в организм матрица подвергается воздействию ферментов и жидкости организма. Матрицу, обеспечивающую пролонгированное высвобождение, следует выбирать из биосовместимых материалов, таких как липосомы, полилактиды (полимолочная кислота), полигликолид (полимер гликолевой кислоты), сополимер полилактида и гликолида (сополимеры молочной кислоты и гликолевой кислоты), полиангидриды, сложные поли(орто)эфиры, полипептиды, гиалуроновая кислота, коллаген, хондроитинсульфат, карбоновые кислоты, жирные кислоты, фосфолипиды, полисахариды, нуклеиновые кислоты, полиаминокислоты, аминокислоты, такие как фенилаланин, тирозин, изолейцин, полинуклеотиды, поливинилпропилен, поливинилпирролидон и силикон. Предпочтительная биоразложимая матрица представляет собой матрицу из любого следующего материала: полилактид, полигликолид или сополимер полилактида и гликолида (сополимеры молочной кислоты и гликолевой кислоты).
Как хорошо известно специалистам в данной области, доза композиции должна зависеть от ряда факторов, таких, например, как состояние, подлежащее лечению, конкретная применяемая композиция и другие клинические факторы, такие как вес, размер, пол и общее состояние здоровья пациента, площадь поверхности тела, конкретное соединение или композиция, подлежащая введению, другие одновременно применяемые лекарственные средства и путь введения.
Композицию можно вводить в сочетании с другими композициями, содержащими биологически активную субстанцию или соединение, прежде всего по меньшей мере одно соединение, выбранное из группы, включающей соединения против окислительного стресса, антиапоптозные соединения, хелаторы металлов, ингибиторы репарации ДНК, такие как пирензепин и метаболиты, 3-амино-1-пропансульфоновую кислоту (3APS), 1,3-пропандисульфонат (1,3PDS), активаторы α-секретаз, ингибиторы β- и γ-секретаз, tau-белки, нейромедиатор, разрушители β-складчатой конформации, аттрактанты для клеточных компонентов, участвующих в клиренсе/истощении амилоида бета, ингибиторы укороченного на N-конце амилоида бета, включая пироглутаматированный амилоид бета 3-42, противовоспалительные молекулы, «атипичные антипсихотические средства», такие, например, как клозапин, зипрасидон, рисперидон, арипипразол или оланзапин, или ингибиторы холинэстеразы (ChEI), такие как такрин, ривастигмин, донепезил и/или галантамин, агонисты M1 и другие лекарственные средства, включая любое модифицирующие амилоид или tau-белок лекарственное средство, и пищевые добавки, такие, например, как витамин В12, цистеин, предшественник ацетилхолина, лецитин, холин, Ginkgo biloba, ациэтил-L-карнитин, идебенон, пропентофиллин или производное ксантина, в сочетании с антителом, предлагаемым в настоящем изобретении, и необязательно фармацевтически приемлемым носителем и/или разбавителем, и/или эксципиентом и в сочетании с процедурами, предназначенными для лечения заболеваний.
Белковое фармацевтически активное действующее вещество может присутствовать в количестве от 1 нг до 10 мг на дозу. Как правило, схема применения может предусматривать введение от 0,1 мкг до 10 мг антитела, предлагаемого в изобретении, прежде всего от 1,0 мкг до 1,0 мг и более предпочтительно от 1,0 мкг до 100 мкг, при этом все индивидуальные количества, входящие в указанный диапазон, подпадают под объем изобретения. Если введение осуществляют путем непрерывной инфузии, то более приемлемая доза может составлять от 0,01 мкг до 10 мг на килограмм веса тела в час, при этом все индивидуальные количества, входящие в указанный диапазон, подпадают под объем изобретения.
Введение, как правило, является парентеральным, например, внутривенным. Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. К неводным растворителям относятся (но не ограничиваясь только ими) пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные растворители можно выбирать из группы, включающей воду, спиртовые/водные растворы, эмульсии или суспензии, включая физиологический раствор и забуференные среды. Парентеральные наполнители включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактированный раствор Рингера или жидкие жиры. Наполнители для внутривенного введения представляют собой добавки для восполнения дефицита жидкости или питательных веществ, электролитные добавки (например, на основе декстрозы Рингера) и другие вещества. Могут присутствовать также консерванты, такие, например, как антимикробные средства, антиоксиданты, хелатирующие агенты, инертные газы и др.
Фармацевтическая композиция может содержать также белковые носители, такие, например, как сывороточный альбумин или иммуноглобулин, в частности человеческого происхождения. В зависимости от назначения в фармацевтической композиции, предлагаемой в изобретении, могут присутствовать дополнительные биологически активные агенты.
Когда мишень для связывания локализована в головном мозге, то конкретными вариантами осуществления изобретения является антитело или его активный фрагмент, которые могут преодолевать гематоэнцефалический барьер. Некоторые нейродегенеративные заболевания ассоциированы с повышением проницаемости гематоэнцефалического барьера, в результате антитело или его активный фрагмент можно легко интродуцировать в головной мозг. Когда гематоэнцефалический барьер остается интактным, то существует несколько известных в данной области подходов для транспортирования молекул через него, включая (но не ограничиваясь только ими) физические методы, методы, основанные на применении липидов и методы, основанные на применении рецепторов и каналов.
Физические методы транспортирования антитела или его активного фрагмента через гематоэнцефалический барьер включают (но не ограничиваясь только ими) проникновение, полностью обходящее гематоэнцефалический барьер, или создание отверстий в гематоэнцефалическом барьере. Методы обхода включают (но не ограничиваясь только ими) непосредственную инъекцию в головной мозг (см., например, Papanastassiou и др., Gene Therapy 9, 2002, сс. 398-406) и имплантацию устройства для введения в головной мозг (см., например, Gill и др., Nature Med. 9, 2003, сс. 589-595; и Gliadel Wafers™, фирма Guildford Pharmaceutical). Метод создания отверстий в барьере включают (но не ограничиваясь только ими) обработку ультразвуком (см., например публикацию US № 2002/0038086), осмотическое давление (например, путем введения гипертонического раствора маннита (Neuwelt Е. A., Implication of the Blood-Brain Barrier and its Manipulation, т. 1 и 2, Plenum Press, N.Y., 1989), увеличение проницаемости с помощью, например, брадикинина или агента, увеличивающего проницаемости (permeabilizer А-7) (см., например, US 5112596, 5268164, 5506206 и 5686416), и трансфекцию нейронов, которые присутствуют в гематоэнцефалическом барьере, векторами, которые содержат гены, кодирующие антитело или его антигенсвязывающий фрагмент (см., например, публикацию патента США № 2003/0083299).
Методы транспортирования антитела или его активного фрагмента через гематоэнцефалический барьер, основанные на применении липидов, включают (но не ограничиваясь только ими) капсулирование антитела или его активного фрагмента в липосомы, которые сшивают со связывающими фрагментами антитела, которые связываются с рецепторами в сосудистом эпителии гематоэнцефалического барьера (см., например, публикацию патента США № 2002/0025313), и нанесение на антитело или его активный фрагмент покрытия из липопротеиновых частиц низкой плотности (см., например, публикацию патента США 2004/0204354) или аполипропротеина Е (см., например, публикацию патента США № 2004/0131692).
Методы транспортирования антитела или его активного фрагмента через гематоэнцефалический барьер, основанные на применении рецепторов и каналов включают (но не ограничиваясь только ими) применение глюкокортикоидных блокаторов для повышения проницаемости гематоэнцефалического барьера (см., например, публикации заявок на патент США №№ 2002/0065259, 2003/0162695 и 2005/0124533); активацию калиевых каналов (см., например, публикацию заявки на патент США № 2005/0089473), ингибирование транспортеров лекарственных средств ABC (см., например, публикацию заявки на патент США № 2003/0073713); нанесение на антитела покрытия из трансферрина и модуляцию активности одного или нескольких рецепторов трансферрина (см., например, публикацию заявки на патент США № 2003/0129186), и канонизацию антител (см., например, US 5004697).
Выявление/диагностирование
Следующим вариантом осуществления настоящего изобретения являются способы и наборы, предназначенные для выявления и диагностики ассоциированных с амилоидом заболеваний или состояний. Эти методы включают известные иммунологические методы, которые обычно применяют для выявления и количественной оценки субстанций в биологических образцах или в условиях in situ.
Диагностирование ассоциированного с амилоидом заболевания или состояния у пациента можно осуществлять путем выявления иммуноспецифического связывания моноклонального антитела или его активного фрагмента с эпитопом амилоидного белка в образце или in situ, которое заключается в том, что приводят в контакт образец или специфическую часть организма или область организма, которая, как ожидается, может содержать амилоидный белок, с антителом, которое связывается с эпитопом амилоидного белка, дают возможность антителу связаться с амилоидным антигеном с образованием иммунологического комплекса, выявляют формирование иммунологического комплекса и устанавливают корреляцию между присутствием или отсутствием иммунологического комплекса и присутствием или отсутствием амилоидного белка в образце или специфической части или области организма.
Биологические образцы, которые можно применять для диагностирования ассоциированного с амилоидом заболевания или состояния, представляют собой, например, жидкости, такие как сыворотка, плазма, слюна, желудочные секреты, слизистая, спинномозговая жидкость, лимфатическая жидкость и т.п., или образцы клеток или тканей, полученные из организма, такие как нейронная ткань, ткань головного мозга, сердечная или сосудистая ткань. Для выявления присутствия или отсутствия амилоидного белка в образце можно применять любой иммуноанализ, известный обычному специалисту в данной области (см. Harlow и Lane, Antibodies: A Laboratory Manual, изд-во Cold Spring Harbor Laboratory, New York, 1988, cc. 555-612), такой, например, как анализы, которые применяют в методах выявления с использованием вторичных реагентов для выявления, ELISA и анализы иммунопреципитации и агглютинации. Подробное описание этих анализов представлено, например, в WO 96/13590 на имя Maertens и Stuyver, Zrein и др., 1998 и в W096/29605.
Для установления диагноза in situ антитело или его любой активный и функциональный фрагмент можно вводить в организм, подлежащий диагностированию, с помощью методов, известных в данной области, таких, например, как внутривенная, интраназальная, внутрибрюшинная, внутрицеребральная, внутриартериальная инъекция, так, чтобы могло произойти специфическое связывание антитела, предлагаемого в изобретении, с эпитопной областью на амилоидном белке. Комплекс антитело/антиген можно выявлять путем присоединения метки к антителу или его функциональному фрагменту.
Иммуноанализы, применяемые в диагностике, как правило, основаны на использовании меченых антигенов, антител или вторичных реагентов, предназначенных для обнаружения. Эти белки или реагенты можно метить с помощью соединений, как правило, хорошо известных специалистам в данной области, таких как ферменты, радиоактивные изотопы и флуоресцентные, люминесцентные и хромогенные субстанции, включая окрашенные частицы, такие как коллоидное золото и гранулы из латекса. Среди указанных методов мечение с помощью радиоактивных изотопов можно применять практически во всех типах анализов и с наибольшим количеством вариаций. Конъюгированные с ферментами метки являются особенно предпочтительными, когда требуется избежать применения радиоактивности или когда требуется быстрое получение результатов. Флуорохромы, хотя для их применения требуется дорогостоящее оборудование, обеспечивают очень чувствительный метод обнаружения. Антитела, применяемые в этих анализах, представляют собой моноклональные антитела, поликлональные антитела и поликлональные антитела, очищенные на основе аффинности.
В другом варианте антитело можно метить косвенно путем взаимодействия с мечеными субстанциями, которые обладают аффинностью к иммуноглобулину, такими как протеин А или G или вторичные антитела. Антитело можно конъюгировать с вторичной субстанцией и выявлять с помощью меченой третьей субстанции, которая обладает аффинностью ко второй субстанции, конъюгированной с антителом. Например, антитело можно конъюгировать с биотином и конъюгат антитело-биотин выявлять с помощью мечения авидином или стрептавидином. Аналогично этому антитело можно конъюгировать с гаптеном и конъюгат антитело-гаптен выявлять с помощью меченого антитела к гаптену.
Специалистам в данной области должны быть хорошо известны указанные и другие приемлемые метки, которые можно применять согласно настоящему изобретению. Связывание этих меток с антителами или их фрагментами можно осуществлять с помощью стандартных методов, как правило, известных обычным специалистам в данной области. Общепринятые методики описаны у Kennedy J. Н. и др., Clin. Chim. Acta 70, 1976, сс. 1-31; и у Schurs А. Н. W. М. и др., Clin. Chim. Acta 81, 1977, сс. 1-40. Упомянутые в последней ссылке методы сочетания представляют собой методы на основе глутарового альдегида, метод на основе периодата, метод на основе дималеимида и т.д., все они включены в настоящее описание в качестве ссылки.
В современных иммуноанализах применяют метод, основанный на использовании двойных антител, для выявления присутствия анализируемого вещества, при котором антитело метят косвенно путем реактивности со вторым антителом, которое предварительно метят выявляемой меткой. Второе антитело предпочтительно представляет собой антитело, которое связывается с антителами животного, из которого получено моноклональное антитело. Другими словами, если моноклональное антитело представляет собой мышиное антитело, то меченое второе антитело представляет собой антимышиное антитело. Для моноклонального антитела, предназначенного для применения в описанном ниже анализе, эта метка предпочтительно представляет собой сенсибилизированную антителом гранулу, предпочтительно магнитную гранулу. Для поликлонального антитела, предназначенного для применения в иммуноанализах, представленных в настоящем описании, метка предпочтительно представляет собой выявляемую молекулу, такую как радиоактивная, флуоресцентная или электрохемилюминисцентная субстанция.
Согласно настоящему изобретению можно применять также альтернативную систему, основанную на использовании двойных антител, которую часто называют системами быстрого формата, поскольку они адаптированы к быстрому выявлению присутствия анализируемого вещества. Для этой системы требуется высокая аффинность антитела и анализируемого вещества. Согласно одному из вариантов осуществления настоящего изобретения присутствие амилоидного белка определяют с использованием пары антител, каждое из которых специфично для амилоидного белка. Одно из указанной пары антител обозначают в контексте настоящего описания как «идентифицирующее антитело», а второе из указанной пары антител обозначают в контексте настоящего описания как «иммобилизованное антитело».
Моноклональное антитело, предлагаемое в настоящем изобретении, можно применять как в качестве иммобилизованного антитела, так и в качестве идентифицирующего антитела. Моноклональное антитело, предлагаемое в настоящем изобретении, можно применять также в качестве и иммобилизованного, и идентифицирующего антитела в одном анализе. Таким образом, одним из вариантов осуществления настоящего изобретения является применение сэндвич-анализа с использованием двойного антитела для выявления амилоидного белка в образце биологической жидкости. В этом анализе анализируемое вещество (амилоидный белок) помещают посередине между идентифицирующим антителом и иммобилизованным антителом, при этом иммобилизованное антитело необратимо иммобилизовано на твердой подложке. Идентифицирующее антитело должно содержать выявляемую метку, предназначенную для идентификации присутствия сэндвича антитело-анализируемое вещество и, как следствие, присутствия анализируемого вещества.
Примерами твердофазных субстанций являются (но не ограничиваясь только ими) титрационные микропланшеты, лабораторные пробирки из полистирола, магнитные, пластиковые или стеклянные гранулы и предметные стекла, которые хорошо известны в области радиоиммуноанализов и иммунноферментных анализов. Методы сочетания антител с твердыми фазами хорошо известны специалистам в данной области. В последние годы в качестве твердых подложек начали применять целый ряд пористых материалов, таких как нейлон, нитроцеллюлоза, ацетат целлюлозы, стеклянные волокна и другие пористые полимеры.
Настоящее изобретение относится также к диагностическому набору, предназначенному для выявления амилоидного белка в биологическом образце, который содержит указанную выше композицию. Кроме того, настоящее изобретение относится к указанному диагностическому набору, который помимо указанной выше композиции содержит также реагент для выявления, описанный выше. Понятие «диагностический набор» относится в целом к любому диагностическому набору, известному в данной области. Более конкретно, последнее понятие относится к диагностическому набору, описанному у Zrein и др., 1998.
Еще одним объектом настоящего изобретения являются новые иммунозонды и тест-наборы, предназначенные для выявления и диагностики ассоциированных с амилоидом заболеваний и состояний, которые содержат антитела, предлагаемые в настоящем изобретении. Для получения иммунозондов антитела прямо или косвенно присоединяют к приемлемой репортерной молекуле, например, ферменту или радионуклиду. Тест-набор включает контейнер, который содержит одно или несколько антител, предлагаемых в настоящем изобретении, и инструкции по применению антител для целей связывания с амилоидным белком с получением иммунологического комплекса и выявления формирования иммунологического комплекса, при этом присутствие или отсутствие иммунологического комплекса коррелирует с присутствием или отсутствием амилоидного белка.
Примеры
Материалы
Разработка и получение мышиного моноклонального антитела ACI-01-Ab7C2 (обозначенное в настоящем описании как «mC2» и «hC2» в случае гуманизированного антитела) представлены в находящейся в совместном рассмотрении заявке ЕР 05027092.5, поданной 12.12.2005 г., описание которой включено в настоящее описание в качестве ссылки.
Клетки гибридомы линии FP-12H3-C2, продуцирующие мышиное моноклональное антитело ACI-01-Ab7C2 (обозначенное в настоящем описании как «mC2» и «hC2» в случае гуманизированного антитела), описание которого представлено в находящейся в совместном рассмотрении заявке ЕР 05027092.5, в соответствии с требованиями Будапештского договора депонированы 01 декабря 2005 г. в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ), Брауншвейг, Mascheroder Weg 1 В, 38124 Braunschweig, под регистрационным номером DSM АСС2750.
Клетки гибридомы культивировали в модифицированной по методу Дульбекко среде Игла (DMEM), дополненной 10% фетальной бычьей сыворотки и антибиотиками (пенициллин/стрептомицин). Оценивали изотип полученного антитела и, как и ожидалось, обнаружено, что оно относится к мышиному IgG2b/каппа.
Анализ
ELISA, позволяющий оценивать связывание амилоида бета, является приемлемым анализом для определения эффективности антитела С2. В качестве положительных контрольных антител применяли мышиное антитело FP-12H3-C2 (фирма Genovac, лот № АК379/01), и стандартное антитело 1560 фирмы Chemicon (лот № 0508008791).
Выбор человеческих константных областей
Рекрутмент иммунной системой является нежелательным для антитела, являющегося кандидатом для клинического применения, поэтому отобранная человеческая константная область тяжелой цепи представляла собой область человеческого IgG4, модифицированную путем замены серина в положении 228 в шарнирной области на пролин (HuIgG4 Ser-Pro). Эта мутация стабилизирует находящийся между цепями дисульфидный мостик и предупреждает образование «полумолекул», что может происходить в препаратах нативного человеческого IgG4. В антителе, экспрессируемом клеточными линиями- продуцентами, также должен быть удален концевой лизин. Последовательности человеческих константных областей HuIgG4 Ser-Pro и человеческой каппа-цепи представлены в SEQ ID NO: 17 и 14 соответственно.
Пример 1. Клонирование и секвенирование вариабельных областей антитела
Общую РНК получали из 3×106 клеток гибридомы (одна колба Т175) с помощью мининабора Qiagen RNeasy (каталожный № 74104). РНК элюировали 50 мкл воды и оценивали на 1,2%-ном агарозном геле. Кондиционированную клеточную среду сохраняли и образец использовали для оценки активности антитела.
Получали кДНК VH и VK с помощью обратной транскриптазы с использованием праймеров для константой области мышиного IgG и к-цепи. Первую цепь кДНК амплифицировали с помощью ПЦР, используя большой набор праймеров сигнальных последовательностей. Амплифицированные ДНК очищали на геле и клонировали в векторе pGem® Т Easy (фирма Promega). Полученные клоны VH и VK подвергали скринингу с помощью ПЦР в отношении вставок ожидаемого размера и последовательность ДНК отобранных клонов определяли путем автоматического секвенирования ДНК. Локализацию гипервариабельных участков (CDR) в последовательностях определяли на основе других последовательностей антител (Kabat Е.А. и др., 1991). В настоящем описании использовали принятую номенклатуру Кэбота для вариабельных областей антител; поэтому нумерация остатков может отличаться от точного линейного номера.
Последовательность ДНК и выведенная аминокислотная последовательность VK mC2 представлены в SEQ ID NO: 29 и 27 соответственно. Четыре клона имели идентичную продуктивную последовательность. В некоторых клонах были обнаружены также непродуктивная аберрантная последовательность VK, полученная от участвующего в слиянии компонента гибридомы.
Выделяли две различные продуктивные последовательности VH mC2. Последовательность VH AF mC2 (см. SEQ ID NO: 30) обнаружена в целом в 29 клонах, имеющих 14 одиночные замены пар оснований в индивидуальных клонах. Последовательность VH В mC2 обнаружена в целом в 8 клонах. Пять из них имели одинаковую последовательность, а в трех остальных клонах обнаружены вариации. Вероятно, указанные подобные последовательности VH В образуются в качестве артефакта ПЦР-амплификации. Обнаружена также непродуктивная аберрантная VH в гибридоме С2, и это связано с дефектным сочленением V-D-J.
Для выявления VH mC2 с требуемой («правильной») активностью получали две различные последовательности VH, т.е. AF и В, объединенные с VK mC2, для тестирования в отношении требуемой активности антитела.
Пример 2. Конструирование генов химерного антитела
Человеческое химерное антитело в его наиболее общей форме состоит из человеческих константных областей, сцепленных с мышиными (или другими нечеловеческими) вариабельными областями. Химерное антитело представляет собой очень ценный «инструмент», во-первых, для подтверждения того, что «правильные» вариабельные области являются идентичными, и, во-вторых, для применения с качестве контрольного антитела в анализах связывания антигенов с одинаковыми эффекторными функциями и при использовании одинаковых вторичных реагентов для выявления, таких как гуманизированное или сконструированное с помощью генной инженерии антитело, и его можно применять также для изучения фармакокинетических и других свойств человеческих константных областей с учетом конкретной мишени для антитела.
Конструировали экспрессионные векторы для двух химерных тяжелых цепей, содержащих вариабельные области VH AF mC2 или VH В mC2, сцепленные с константной областью rHuIgG4 (Ser-Pro) в экспрессионном векторе pSVgpt. Его основой является вектор pSV2gpt (Mulligan и Berg, 1980), и он включает ген, обусловливающий устойчивость к ампициллину, для селекции в бактериальных клетках, ген gpt для селекции в клетках млекопитающих, энхансерную область тяжелой цепи мышиного иммуноглобулина, геномную последовательность, кодирующую ген константной области, и полиА-последовательности SV40. Для экспрессии вариабельную область тяжелой цепи встраивали в виде HindIII-BamHI-фрагмента.
Конструировали вектор химерной легкой цепи, содержащую VK С2, сцепленную с константной областью человеческой С-каппа, в экспрессионном векторе pSVhyg. (Hieter РА и др., 1980) pSVhyg включает ген, обусловливающий устойчивость к ампициллину, для селекции в бактериальных клетках, ген hyg для селекции в клетках млекопитающих, энхансерную область тяжелой цепи мышиного иммуноглобулина, геномную последовательность, кодирующую константную область каппа-цепи, и включает энхансер каппа-цепи и полиА-последовательности SV40. Для экспрессии вариабельную область легкой цепи встраивали в виде HindIII-BamHI-фрагмента.
Кассеты экспрессии для мышиных последовательностей VH и VK С2 конструировали путем добавления 5’-фланкирующей последовательности, включающей лидерную последовательность сигнального пептида, лидерную последовательность интрона и промотор мышиного иммуноглобулина, и 3’-фланкирующей последовательности, включающей сайт сплайсинга и интронную последовательность, используя векторы VH-PCR1 и VK-PCR1 в качестве матриц (Riechmann и др., 1988). Правильность последовательности ДНК подтверждали для VH и VK в химерных экспрессионных векторах. ДНК генов и аминокислотные последовательности VH и VK в кассетах экспрессии представлены на фиг. 1 и 2.
Пример 3. Экспрессия химерных антител
3.1 Экспрессия в стабильных клеточных линиях
Линия клеток-хозяев для экспрессии антитела представляла собой линию NS0, т.е. не продуцирующую иммуноглобулины линию мышиной миеломы, которую получали из Европейской коллекции культур клеток животных, (European Collection of Animal Cell Cultures, Porton UK) (ECACC No 85110503). Экспрессионными векторами для тяжелой и легкой цепи совместно трансфектировали NS0-клетки путем электропорации. Колонии, экспрессирующие ген gpt, отбирали в модифицированной по методу Дульбекко среде Игла (DMEM), дополненной 10% фетальной бычьей сыворотки (FBS), 0,8 мкг/мл микофенольной кислоты и 250 мкг/мл ксантина. Клоны трансфектированнных клеток подвергали скринингу в отношении производства человеческого антитело с помощью ELISA для человеческого IgG. Клеточные линии, секретирующие антитело, размножали и наиболее эффективные продуценты отбирали и замораживали в жидком азоте. Клеточные линии, наиболее эффективно продуцирующие каждое антитело, размножали в указанной выше среде, но дополненной только 5% FBS. Химерные антитела очищали с помощью Prosep®-A (фирма Bioprocessing Ltd). Концентрацию определяли с помощью ELISA для человеческого антитела в виде IgGK. Антитела анализировали также с помощью ДСН-ПААГ.
3.2 Кратковременная экспрессия химерных антител
Для экспресс-оценки различных химерных антител применяли кратковременную экспрессию для быстрого получения небольших количеств клеточных супернатантов, содержащих рекомбинантное антитело, предназначенное для тестирования. Кассеты экспрессии VH и VK mC2 переносили в векторы, основой которых являлся pcDNA3.1 (фирма Invitrogen), для кратковременной экспрессии. Вектор для тяжелой цепи включал константную область человеческого IgG. Вектор для легкой цепи включал константную область человеческой каппа-цепи. Клетки почки человеческого эмбриона (НЕК 298) трансфектировали как VH AF mC2, так и VH В mC2 в сочетании с VK mC2 с использованием такого реагента как Lipofectamine 2000 (фирма Invitrogen, каталожный номер 11668), согласно протоколу производителя. Кондиционированную клеточную среду собирали через 3 дня после трансфекции. Количество продуцируемого антитела определяли с помощью ELISA для человеческого антитела в виде IgGκ.
Пример 4. Активность химерных антител С2
4.1 Активность химерных антител С2, продуцируемых в результате кратковременной трансфекции
Образцы кондиционированной среды после кратковременной трансфекции, содержащие два различных химерных антитела, оценивали с помощью ELISA в отношении связывания с амилоидом бета. Результаты четко свидетельствуют о том, что VH AF С2 имеет правильную последовательность. Химерное антитело VH AF C2/VK С2 обладало высокой способностью к связыванию при использовании этого анализа, но антитело, содержащее VH В С2/VK С2 совсем не обладало способностью к связыванию. Мышиное контрольное антитело Chemicon 1560 обладало высокой способностью к связыванию, но связывание полученного от фирмы-поставщика очищенного мышиного антитела С2 было низким. Следует отметить, что для мышиных антител с мышиными константными областями применяли вторичное антитело, отличное от того, которое применяли в случае химерных антител с человеческими константными областями, поэтому нельзя проводить непосредственное сравнение результатов. Позднее установлено, что в этом анализе был получен хороший результат при использовании кондиционированной среды гибридомы С2.
4.2 Активность очищенных химерных антител С2
Два различных химерных антитела С2 очищали из описанных выше стабильных клеточных линий NS0, как описано выше, и анализировали с помощью ELISA для амилоида бета. Полученные результаты коррелировали с результатами, полученными при использовании антител после кратковременной экспрессии. С2-антитело ChVH AF/ChVK обладало способностью к эффективному связыванию при оценке с помощью ELISA, а С2-антитело ChVH B/ChVK антитело совсем не обладало способностью к связыванию.
Пример 5. Создание генов гуманизированного антитела С2
Сравнивали аминокислотные последовательности VH и VK mC2 с последовательностями VH и VK антитела грызунов с использованием баз данных NCBI и Кэбота.
5.1 Вариабельная область легкой цепи
Геном мышиной зародышевой линии, наиболее близким по совместимости к VK mC2, является bb1, локус MMU231201 (Schable и др., 1999). В нем только две аминокислоты отличаются от указанной последовательности зародышевой линии, они обе локализованы в CDRL1. Обнаружены зрелые мышиные антитела с подобной, но не идентичной последовательностью. Некоторые из них имели идентичный CDRL2 и идентичный CDRL3, но CDRL1 mC2, вероятно, является уникальным. VK mC2 соответствовала подгруппе MuVKII согласно номенклатуре Кэбота. В положении 87 VK mC2 предпочтительно присутствует F, а не Y, который является более обычным для этой подгруппы, это свидетельствует о том, что указанный каркасный остаток может быть важным для активности антитела. Сравнение с VK-последовательностями человеческой зародышевой линии позволило установить, что гены из подгруппы VKII являются более близкими по совместимости с VK mC2 (Сох и др., 1994). Последовательность DPK15 в сочетании с человеческой J-областью HuJKI отбирали для получения акцепторных каркасных последовательностей для гуманизированной VK.
Создавали четыре последовательности гуманизированной VK. C2HuVK1 состоит из CDR VK mC2 с каркасами из DPK5 и человеческим JK1-участком. В версиях 2, 3 и 4 мышиные остатки заменяли в каркасе в положениях 45 или 87 или в обоих положениях. Остаток 45 может принимать участие в поддержании конформации CDR. Остаток 87 локализован на поверхности раздела VH- и VK-областей. Таким образом, эти остатки могут иметь решающее значение для сохранения способности антитела к связыванию.
Положения и замены, которые были осуществлены в каркасных участках легкой цепи, представлены в таблице 6. Проводили сравнения гуманизированных последовательностей с последовательностью VK mC2 и с DPK15 и человеческим JK1-участком.
5.2 Вариабельная область тяжелой цепи
Геном мышиной зародышевой линии, наиболее близким по совместимости к VH AF mC2, является VH7183, локус AF120466 (Langdon и др., 2000). Сравнение представлено на фиг. 3. В нем девять аминокислот отличаются от указанной последовательности зародышевой линии, большинство из которых локализовано в CDR2. Обнаружены зрелые мышиные антитела, идентичные или подобные (отличаются одним остатком) CDRH1 или подобные CDRH2 (отличаются одним остатком), но не обнаружено ни одного антитела, у которого все три CDR были бы идентичны VH AF mC2. CDRH3 антитела mC2 является необычно коротким, он состоит только из трех остатков. Однако в базе данных обнаружены другие антитела, у которых CDR3 имеет такую же длину. VH AF mC2 соответствовала подгруппе Mu VHIIID согласно номенклатуре Кэбота. Остаток 47 VH mC2 предпочтительно представлял собой L, а не более обычный W, а остаток 94 предпочтительно представлял собой S, а не более обычный R, что свидетельствует о том, что эти каркасные остатки могут быть важными для активности антитела. Сравнение с последовательностями VH человеческой зародышевой линии показало, что гены подгруппы VHIII являются наиболее близкими по совместимости с VH mC2. Последовательность DP 15 в сочетании с человеческой J-областью HuJH6 отбирали для получения акцепторных каркасных последовательностей для гуманизированной VH.
Создавали четыре последовательности гуманизированной VH. C2HuVH1 состоит из CDR VH AF с каркасами из DP54 и HuJh6. В версиях 2, 3 и 4 мышиные остатки заменяли в каркасе в положениях 47 или 94 или в обоих положениях. Остаток 47 в каркасном участке 2 имеет контакт как с CDR, так и с VK-областью. Остаток 94 может принимать участие в поддержании конформации CDR. Таким образом, эти остатки могут иметь решающее значение для сохранения способности антитела к связыванию.
Положения и замены, которые были осуществлены в каркасных участках тяжелой цепи, представлены в таблице 7.
Пример 6. Конструирование генов гуманизированных антител
Модифицированные вариабельные области конструировали с помощью метода перекрывающейся ПЦР-рекомбинации. Кассеты экспрессии для химерного антитела, 2 ChVH AF С2 и 2 ChVK С2 использовали для мутагенеза каркасных участков с получением требуемых последовательностей. Синтезировали набор пар праймеров для мутагенеза, содержащих области, подлежащие изменению. Полученные кассеты экспрессии гуманизированных VH и VK клонировали в pUC19 и анализировали полную последовательность ДНК для подтверждения правильности каждой VH и VK. Модифицированные гены V-области тяжелой и легкой цепи вырезали из pUC19 в виде HindIII-BamHI-кассет экспрессии. Их переносили в экспрессионные векторы pSVgpt и pSVhyg, которые включали человеческие константные области IgG4 Ser-Pro или κ-цепи соответственно, таким же образом, как и векторы для химерного антитела. Подтверждали правильность последовательности ДНК для гуманизированных VH и VK в экспрессионных векторах.
Пример 7. Экспрессия гуманизированных антител
7.1 Экспрессия в стабильных клеточных линиях
Экспрессионными векторами для гуманизированных тяжелой и легкой цепи совместно трансфектировали NS0-клетки путем электропорации аналогично методу, описанному для экспрессии химерных антител. Отбирали продуцирующие антитела клеточные линии и размножали и очищали гуманизированные антитела полностью аналогично методу, описанному для химерных антител. Очищенные антитела анализировали с помощью ДСН-ПААГ.
7.2 Кратковременная экспрессия гуманизированных антител
Для экспресс-оценки различных конструкций гуманизированных VH и VK кассеты экспрессии гуманизированных VH и VK С2 также переносили в векторы для кратковременной экспрессии согласно методу, описанном в разделе 3.2. Четырьмя конструкциями гуманизированных VK С2 трансфектировали совместно с конструкцией VH химерного С2 клетки линии НЕК293. Аналогично этому четырьмя конструкциями гуманизированных VH С2 трансфектировали совместно с конструкцией VK химерного С2 клетки линии НЕК293. Кондиционированную среду собирали через три дня после трансфекции. Количество продуцируемого антитела определяли с помощью ELISA для человеческого антитела в виде IgGK.
Пример 8. Активность гуманизированных антител С2
8.1 Активность гуманизированных антител С2, полученных с помощью кратковременной трансфекции
Образцы кондиционированной среды, полученной в результате кратковременной трансфекции, тестировали с помощью ELISA для амилоида бета. Полученные результаты ясно свидетельствуют о том, что версии 2 и 4 конструкции гуманизированных VH С2 HuVH AF являются функциональными, при их объединении с каппа-цепью химерного С2 и сопоставимы в этом анализе по активности с химерным антителом С2. В противоположность этому, антитела, содержащие версии 1 и 3 С2 HuVH AF, объединенные с каппа-цепью химерного С2, совсем не обладали способностью к связыванию в этом анализе. Это свидетельствует о том, что замена мышиного остатка в положении 94 является важной для активности антитела. Антитела, содержащие тяжелую цепь химерного С2, объединенную с четырьмя каппа-цепями гуманизированных С2, все обладали высокой способностью к связыванию, сопоставимой с химерным антителом, при анализе с помощью ELISA.
8.2 Активность очищенных гуманизированных антител С2
Восемь различных гуманизированных антител С2, которые все содержали комбинации двух гуманизированных тяжелых цепей и четырех гуманизированных легких цепей, очищали из стабильных клеточных линий NS0 согласно описанному выше методу и тестировали с помощью ELISA для амилоида бета (фиг. 4).
Полученные результаты ясно свидетельствуют о том, что антитела С2 HuVH4 обладали более высокими характеристиками в этом анализе, чем антитела С2 HuVH2. Среди антител С2 HuVH2 антитело С2 HuVH2/HuVK3 обладало наиболее высокой активностью связывания, но приблизительно в 2 раза более низкой по сравнению с химерным контрольным антителом С2 ChVHAF/ChVK. Активность С2 HuVH2/HuVK2 была в 4-5 раз ниже по сравнению с активностью контрольного антитела. Активность антител, содержащих C2HuVH4 с четырьмя различными гуманизированными легкими цепями, оказалась сопоставимой. Наиболее высокая активность обнаружена у C2HuVH4/HuVK1, и все четыре антитела оказались близки по активности к контрольному химерному антителу в этом анализе.
Пример 9. Модификации CDRL2
9.1 Создание легкой цепи с модифицированным CDR2
Как отмечалось выше, многие антитела обладают такой же последовательностью CDRL2 («KVSNRFS»), что и антитело С2. Осуществляли тест для решения вопроса о том, можно ли вносить небольшие модификации в CDRL2 без отрицательного воздействия на активность антитела. Были выбраны две консервативные замены: R на K в положении 50 и S на N в положении 53. Таким образом, получали две разные последовательности CDRL2 «RVSNRFS» и «KVSSRFS». Их встраивали в последовательность мышиной VK, не имеющую других замен, получая VK-R mC2 и VK-S mC2 соответственно.
9.2 Кратковременная экспрессия антитела с модифицированным CDRL2
Две конструкции легкой цепи С2 с модифицированным CDRL2, описанные в разделе 11.2.1, клонировали в векторе для легкой цепи с целью кратковременной экспрессии. Каждой конструкцией совместно с VH химерного С2 трансфектировали НЕК293-клетки. Кондиционированную клеточную среду собирали через 3 дня после трансфекции. Количество продуцируемого антитела определяли с помощью ELISA для человеческого антитела в виде IgGK.
9.3 Активность антитела С2 с модифицированным CDRL2
Образцы кондиционированной среды, которые получали в результате кратковременной трансфекции VK mC2 с модифицированным CDRL2, объединенной с VH mC2, тестировали с помощью ELISA для амилоида бета (фиг. 5). Активность обоих антитела VK-R и VK-S оказалась сопоставимой с активностью химерного антитела С2, что свидетельствует о том, что выбранные индивидуальные модификации CDRL2 не оказывали существенного влияния на активность антитела в этом анализе.
Пример 10. Определение аффинности
Для оценки специфичности и аффинности к связыванию мышиного (ACI-01-Ab-7-С2), химерного (AF) и гуманизированного антител (Н4К1; Н4К4), осуществляли BIACORE.RTM.-анализ с использованием мономеров и волокон амилоида бета 1-42 в качестве антигена, иммобилизованного на СМ5-чипе. Технология BIACORE.RTM. основана на изменении показателя преломления в поверхностном слое при связывании антитела с антигеном, иммобилизованном на этом слое. Связывание определяли с помощью резонанса поверхностного плазмона (SPR) света лазера, отражающегося от поверхности. Анализ кинетики сигналов скорости ассоциации и диссоциации позволяет отличать неспецифическое и специфическое взаимодействие. Применяемая концентрация антитела составляла от 0,05 до 1,0 мкМ.
Специфичность и аффинность связывания мышиного (ACI-01-Ab-7-С2), химерного (AF) и гуманизированного антител (Н4K1; Н4K4) в отношении мономеров и волокон амилоида бета 1-42
(1/Mc)
(1/c)
(1/Mc)
(1/c)
Пример 11. Иммунохимический анализ связывания
11.1 Срезы человеческого головного мозга
Головной мозг здоровых людей, пациентов с пре-AD, не сопровождающейся деменцией, и страдающих AD пациентов получали из Университетской клиники Бонна (Universitats klinik in Bonn) после одобрения Этического комитета. Головной мозг фиксировали в формальдегиде и область гиппокампа обезвоживали, заливали в парафин и с помощью микротома делали среды толщиной 5 мкм. Парафиновые срезы хранили при КТ до использования. При использовании свежего материала делали криосрезы толщиной 5 мкм с помощью криостата и срезы хранили при -80°С до использования.
11.2 Иммуногистохимия
Удаляли парафин парафиновых срезов и повторно гидратировали путем погружения слайдов в ксилол, а затем в 100%-ный этанол, 90%-ный этанол и 70%-ный этанол. Фоновый уровень снижали путем 30-минутной инкубации в 10% H2O2, 10%-ном растворе метанола в воде. Для восстановления антигена применяли инкубацию слайдов с 100%-ной муравьиной кислотой в течение 3 мин. После трех отмывок в забуференном Трис физиологическом растворе (TBS, рН 7,5) неспецифическое мечение блокировали путем инкубации слайдов в течение 2 ч в 10% БСА, 0,25% Triton Х-100 в TBS. После отмывки (3 отмывки в TBS) осуществляли блокаду эндогенных антител путем добавления немеченого антитела к человеческому IgG (фирма Biomeda) и инкубации слайдов в увлажняющих камерах в течение ночи при КТ. После еще 3 отмывок добавляли к слайдам первичное человеческое антитело к амилоиду и инкубировали в течение еще 24 ч при КТ. После отмывки добавляли к слайдам меченное с помощью щелочной фосфатазы вторичное антитело к человеческому IgG (фирма Sigma) и инкубировали в течение 2 ч при КТ. После отмывки слайды окрашивали с помощью жидкого красителя перманентного красного (фирма Dakocytomation), отмывали водой и сушили на воздухе перед погружением в заливочную среду (корбитбальзам).
Криосрезы фиксировали в метаноле в течение 30 мин при -80°С и фоновый уровень снижали путем добавления Н2О2 к холодному метанолу до конечной концентрации 10% и инкубации в течение 30 мин при КТ. После трех отмывок в забуференном Трис физиологическом растворе (TBS, рН 7,5) неспецифическое мечение блокировали путем инкубации слайдов в течение 2 ч в 10% БСА, 0,25% Triton Х-100 в TBS, как описано выше, и осуществляли описанную выше процедуру окрашивания.
Срезы оценивали с помощью микроскопа типа DMLB Leica и фотографировали с помощью фотоаппарата типа Leica DC500, используя программное обеспечение Leica FireCaml.2.0.
Оба человеческих антитела А и В метили бляшки головного мозга страдающих AD пациентов (фиг. 6). Они метили как рассеянные (диффузные), так и централизованные бляшки. Кроме того, с помощью антител А и В можно было выявлять также рассеянные бляшки у пациентов с пре-AD, не сопровождающейся деменцией. Оба антитела метили амилоид при церебральной амилоидной ангиопатии (САА) и в определенной степени окрашивали нейроны, которые могли соответствовать внутриклеточному амилоиду. Не обнаружено мечения контрольных образцов головного мозга здоровых людей. Бляшки можно было выявлять в парафиновых срезах, предварительно обработанных муравьиной кислотой, но бляшки не выявлялись в парафиновых срезах, которые предварительно не обрабатывали муравьиной кислотой, и в криосрезах, которые фиксировали в метаноле. Человеческое антитело Б не выявляло бляшки в парафиновых срезах, а мышиное антитело не окрашивало ни парафиновые срезы, ни криосрезы человеческого головного мозга.
Сокращения:
А = связывающееся химерное антитело AF (IgG4) (mC2ChVHAF)
Б = несвязывающееся химерное антитело Б (IgG4) (mC2VHB)
В = связывающееся гуманизированное антитело Н4K1 (IgG4) (HuVH4/HuVK1).
Мышиное = мышиное антитело ACI-01-Ab-C2 (IgG2b).
Пример 12. Функциональная активность mC2 в отношении амилоидных волокон
12.1 Модификация конформации Aβ1-42-волокон и инициация нарушения агрегации после связывания антитела mC2
Для оценки механизма, с помощью которого антитело нарушает агрегацию ранее сформированных бета-амилоидных (Аβ1-42) волокон осуществляли прямое сравнение (по типу «лицом к лицу») результатов, полученных с использованием флуоресцентного тиофлавин-Т-(Th-Т)-анализа, который проводили для оценки нарушения агрегации, и анализа с помощью ядерного магнитного резонанса (ЯМР-спектроскопия твердого тела) меченного с помощью U-13C тирозина10 и меченного с помощью валина12 пептида Аβ1-42, который применяли для определения вторичной конформации (фиг. 7А). Антитело mC2 солюбилизировало 35,4% ранее сформированных Aβ1-42-волокон и в то же время индуцировало сдвиг вторичной конформации от бета-складчатой конформации в сторону конформации в виде произвольных спиралей. Снижение популяции бета-складчатой конформации в сторону конформации в виде произвольной спирали, составляло порядка 35% и, таким образом, хорошо совпадало с результатами, полученными с помощью флуоресцентного Th-T-анализа (фиг. 7Б). Эти данные свидетельствуют о том, что связывание антитела mC2 инициировало переход вторичной структуры, что, возможно, вызывало дестабилизацию параллельного межмолекулярного устройства бета-складок, оказывая воздействие, приводящее к расщеплению удлиненных волокон на более мелкие фрагменты.
12.2 Зависящая от конформации аффинность к связыванию антитела mC2
Поскольку из научной литературы хорошо известно, что часть энергии связывания антитело-антиген можно использовать для зависящей от энергии модификации конформации антигена (Blond и Goldberg, 1987), осуществляли сравнительный эксперимент по оценке аффинности связывания антитела mC2 с полным белком Aβ1-42 и с более коротким, состоящим из 9 аминокислот пептидом, который содержал эпитоп для антитела (фиг. 8). Для этого сравнения аффинности гуманизированного антитела С2 применяли ELISA с использованием биотинилированных пептидов, перекрывающих полную аминокислотную последовательность эпитопа С2 (созданные на фирме Mimotopes и поступающие в продажу от фирмы ANAWA Trading SA), и биотинилированного полного пептида Аβ1-42 (фирма Bachem). Анализ осуществляли согласно инструкциям производителя (фирма Mimotopes). Как видно из фиг. 8 и таблицы 2, аффинность к связыванию антитела с пептидом, содержащим специфический эпитоп (аминокислоты 13-21 последовательности Аβ1-42), оказалась на 38,40% выше по сравнению с аффинностью к связыванию с полным белком Аβ1-42. Таким образом, можно предположить, что различие в энергии аффинности связывания использовалось для связанного с поглощением энергии перехода вторичной структуры амилоидного белка для презентации антигена в более доступном положении для связи с антителом. Это объясняет, почему аффинность антитела является более низкой для нативной (полный амилоидный белок), чем для выделенной субъединицы.
Пример 13. Воздействие антиамилоидного антитела hC2 на агрегацию пептида амилоида бета 1-42
Для оценки способности гуманизированного моноклонального антитела к человеческому амилоиду бета hC2 опосредовать антагонизирующее действие в отношении агрегации и нарушать агрегацию амилоида бета (Аβ) осуществляли спектрофлуоресцентный анализ с использованием тиофлавина Т.
13.1 Анализ ингибирования агрегация
Лиофилизированный порошок Aβ1-42 восстанавливали в гексафторизопропаноле (HFIP) до концентрации 1 мМ. Раствор пептида облучали ультразвуком в течение 15 мин при комнатной температуре, перемешивали в течение ночи и распределяли на аликвоты в несиликонизированные микроцентрифужные пробирки. Затем HFIP выпаривали в потоке аргона. Образовавшуюся пептидную пленку сушили в вакууме в течение 10 мин и хранили при -80°С до использования.
Для оценки обусловленного антителом ингибирования агрегации Аβ1-42 антитело hC2 предварительно разводили в ЗФР и приготавливали в несиликонизированной пробирке для инкубации раствор для анализа, содержащий следующие компоненты: 3,3 или 0,33 мкМ предварительно разведенное антитело, 10 мкМ тиофлавин Т, 33 мкМ Аβ1-42 и 8,2% ДМСО. В результате конечные молярные соотношения антитела к Aβ1-42 составляли 1:10 и 1:100. Приготавливали также соответствующие контрольные растворы. Затем растворы инкубировали в течение 24 ч при 37°С и определяли спектрофлуоресценцию (в относительных флуоресцентных единицах; RFU) в шести повторностях в черных 384-лучночных планшетах (фирма Perkin-Elmer) с помощью спектрофлуориметра фирмы Perkin-Elmer типа FluoroCount. Затем количественно оценивали спектрофлуоресценцию и рассчитывали нарушение агрегации в % согласно описанному ниже методу.
13.2 Анализ нарушения агрегации
Для анализа опосредуемого антителом нарушения агрегации ранее агрегированного Аβ1-42 приготавливали растворы низкомолекулярного Аβ1-42 согласно описанному выше методу с концентрацией вплоть до 110 мкМ в 27% ДМСО и 1х ЗФР. Затем этому раствору давали агрегироваться при 37°С в течение 24 ч, после чего добавляли следующие компоненты: 3,3 или 0,33 мкМ предварительно разведенное антитело и 10 мкМ тиофлавин Т. В результате конечные молярные соотношения антитела к Aβ1-42 составляли 1:10 и 1:100. Этот раствор затем инкубировали в течение еще 24 ч при 37°С. Затем количественно оценивали спектрофлуоресценцию и рассчитывали нарушение агрегации в % согласно описанному ниже методу.
13.3 Расчет
Ингибирование агрегации или нарушение агрегации выражали в виде среднего значение (в %) ингибирования или нарушения агрегации соответственно ± среднее квадратичное отклонение (СКО) согласно следующему уравнению:

13.4 Результаты
13.4.1 Ингибирование агрегации Aβ1-42
Данные об ингибировании агрегации Aβ1-42 с помощью антитела hC2 представлены в таблице 3 и на фиг. 11. При молярном соотношении антитела и Aβ1-42 1:100 ингибирование составляло примерно 30% (2 независимых эксперимента), а при молярном соотношении 1:10 ингибирование составляло 80% (2 независимых эксперимента; см. таблицу 3).
Опосредуемое hC2 ингибирование агрегации Aβ1-42 при молярных соотношениях антитела и Aβ1-42 1:100 и 1:10
13.4.2 Нарушение агрегации ранее агрегированного Aβ1-42
Данные о нарушении агрегации ранее агрегированного Aβ1-42 с помощью антитела hC2 представлены в таблице 4 и на фиг. 12. При молярном соотношении антитела и Aβ1-42 1:100 нарушение агрегации составляло примерно 24%, а при молярном соотношении 1:10 нарушение агрегации составляло 32% (3 независимых эксперимента; см. таблицу 4).
Опосредуемое hC2 нарушение агрегации ранее агрегированного Aβ1-42 при молярных соотношениях антитела и Aβ1-42 1:100 и 1:10
С помощью анализа на основе тиофлавина Т можно продемонстрировать бифункциональные свойства гуманизированного антитела к Аβ hC2, а именно, способность ингибировать агрегацию Aβ1-42 с образованием патогенной протофибриллярной конформации, а также нарушать агрегацию ранее сформированных протофибрилл Aβ1-42. hC2 ингибировало агрегацию Aβ1-42 на 80% при молярном соотношении антитела и Aβ1-42 1:10. Установлена способность hC2 нарушать агрегацию на 32% ранее агрегированных протофибрилл Aβ1-42 при молярном соотношении 1:10.
Пример 14. Специфическое для конформации связывание mC2 с различными классами амилоидного белка
Для оценки специфичности mC2 в отношении амилоидного белка на разных стадиях его полимеризации осуществляли анализ мономерных, полимерных растворимых амилоидов и фибриллярного амилоида с использованием планшетов для ELISA, сенсибилизированных полимерным бета-амилоидом на указанных разных стадиях его полимеризации (фиг. 9). Мономеры получали согласно методу, являющемуся модификацией ранее опубликованного метода (Klein, 2002), полимерный растворимый амилоид бета получали согласно методу, описанному у Barghorn и др., 2005, а волокна получали инкубацией амилоида (фирма Bachem, Швейцария) с конечной концентрацией 1 мкг/мкл Трис/HCl, рН 7,4 при 37°С в течение 5 дней с последующей стадией центрифугирования (10000 об/мин в течение 5 мин). После этого амилоидными полимерами сенсибилизировали планшеты для ELISA с использованием конечной концентрации 55 мкг/мл, и аффинность к связыванию определяли с помощью ELISA с использованием моноклонального антитела к мышиному IgG (фирма Jackson ImmunoResearch Laboratories, Inc.), меченного щелочной фосфатазой. Как продемонстрировано в таблице 5, антитело mC2 связывалось с более высокой аффинностью с полимерным растворимым амилоидом бета, чем с волокнами, и с наименьшей аффинностью с мономерами. Эти результаты демонстрируют, что на связывание антитела влияет помимо эпитопа конформация различных амилоидных агрегатов.
Специфическое для конформации связывание mC2 с амилоидными мономерами, олигомерами и волокнами
Пример 14. Картирование эпитопов АС-иммунного моноклонального антитела hC2
Эпитопное картирование гуманизированного моноклонального антитела hC2 осуществляли с помощью ELISA, используя три различные пептидные библиотеки. Одна библиотека содержала в целом 33 биотинилированных пептида, перекрывающих полную аминокислотную (ак) последовательность Aβ1-42, (созданную на фирме Mimotopes и поступающую в продажу от фирмы ANAWA Trading SA), вторая библиотека содержала биотинилированные пептиды, в ней использовали пептид 12 (ак 12-20 Аβ) из первой пептидной библиотеки и заменяли каждую ак в последовательности аланином (см. таблицу 8, ниже), а третья библиотека содержала биотинилированные пептиды 13, 14 или 15 (ак 13-21, 14-22 или 15-23 Аβ) и в ней заменяли в каждом случае последние аминокислоты на аланин или на глицин, как в случае ак 21, которая уже представляла собой аланин (см. таблицу 9 ниже). В качестве положительного контроля использовали биотинилированный полный пептид Aβ1-42 (фирма Bachem). Картирование эпитопов осуществляли согласно инструкциям производителя (фирма Mimotopes). В целом, метод состоял в следующем: сенсибилизированные стрептавидином планшеты (фирма NUNC) блокировали 0,1% БСА в ЗФР в течение ночи при 4°С. После промывки ЗФР- 0,05% Твин 20 планшеты сенсибилизировали в течение 1 ч при КТ различными пептидами из библиотеки, разведенными в 0,1% БСА, 0,1% азида натрия в ЗФР до конечной концентрации 10 мкМ. После отмывки планшеты инкубировали в течение 1 ч при КТ с антителом hC2 или с несвязывающимся с Аβ химерным антителом в виде IgG4, разведенным до концентрации 200 мкг/мл в 2% БСА, 0,1% азида натрия в ЗФР. Планшеты вновь промывали и инкубировали с конъюгированным со щелочной фосфатазой козьим антителом к человеческому IgG в течение 1 ч при КТ. После окончательной отмывки планшеты инкубировали с субстратом фосфатазы (pNPP) и считывали при 405 им с помощью планшет-ридера для ELISA.
Установлено, что гуманизированное моноклональное антитело hC2 связывалось специфически с пептидами 12, 13, 14 и 15 из первой пептидной библиотеки. Эти пептиды содержали ак 12-20, 13-21, 14-22 и 15-23 (QKLVFFAED) Aβ1-42, это позволяло предположить, что эпитоп находится в области ак 12-23 Аβ. Вторую библиотеку, созданную путем замены на аланин, использовали для определения ак, имеющих решающее значение для связывания с Aβ1-42 (VHHQKLVFF). Связывание антитела hC2 практически полностью элиминировалось при замене аминокислот 16, 17, 19 или 20 на аланин, эти результаты свидетельствуют о том, что эти ак имеют в высшей степени решающее значение для связывания антитела с Аβ. Связывание антитела hC2 частично снижалось, когда заменяли ак 15 и 18.
Связывание также практически полностью элиминировалось, когда ак 14 заменяли на аланин, что свидетельствует о том, что ак 14 также очень важна для связывания.
И, наконец, третью библиотеку применяли для выяснения вопроса о том, имеют ли решающее значение для связывания с эпитопом ак 21, 22 или 23. Связывание антитела с ак 15-23 снижалось, когда ак 23 заменяли на аланин, что свидетельствует о важности ак 23 для связывания. Связывание частично снижалось при замене ак 21 на глицин и слегка снижалось при замене ак 22 на аланин.
Пример 16: Нейрозащитное действие антитела hC2
Способность антитела hC2 защищать нейроны от индуцируемой олигомером Абета дегенерации оценивали с помощью анализа in vitro. Мышиные кортикальные нейроны эмбрионов возрастом 16,5-17,5 дней выделяли, иссекали и культивировали in vitro в среде N3-F12. Клетки выращивали в течение в целом 9 дней и заменяли среду в день 3 и в день добавления олигомера Абета или олигомера Абета плюс антитело к Абета hC2. В день 5 (для опыта - «4 дня с добавленным Абета») или день шесть (для опыта - «3 дня с добавленным Абета») некоторые лунки с клетками обрабатывали либо только 2 мМ олигомером Абета, либо комбинацией, включающей 2 мМ олигомер Абета и 50 мкг/мл антитела к Абета hC2.
Олигомер Абета получали, растворяя Абета 1-42 (рекомбинантный пептид - rPeptide) в HFIP, из которого отбирали аликвоты Абета-пептидов по 10 мкл с концентрацией 1 мг/мл и затем упаривали в вытяжном шкафу в течение 30 мин и пептидные пленки хранили при -80°С до использования. Перед применением пептидную пленку растворяли в 10 мкл ДМСО, затем в 78,6 мкл среды Хэма F12 и раствор Абета-пептида инкубировали при 4°С в течение 24-48 ч (конечная концентрация Абета 25 мкМ).
Для создания контрольных клеток добавляли только среду ДМСО-F12 в таком же объеме, что и Абета-ДМСО в день 5, и клетки культивировали в течение еще 4 дней без дополнительной обработки. В день 9 нейроны, полученные при всех условиях культивирования, фиксировали и окрашивали Tuj1 (антитело к бета-тубулину), с последующим окрашиванием вторичным антителом, меченным ФИТЦ, для визуализации микротрубок, и таким образом, осуществляли обработку нейронов в целом. Результаты представлены на фиг. 13.
Для необработанных мышиных эмбриональных кортикальных нейронов обнаружено обычное морфологическое строение после 9-дневного культивирования (фиг. 13, самая левая панель). Обработка клеток олигомером Абета в течение 3 дней индуцировала дегенерацию аксонов и приводила к снижению общего количества аксонов (фиг. 13, нижняя центральная панель), и это явление еще более усиливалось к четвертому дню обработки (фиг. 13, верхняя центральная панель)). В противоположность этому клетки, обработанные комбинацией олигомера Абета и антитела к Абета hC2, выглядели также как контрольные клетки (фиг. 13, верхняя и нижняя правые панели). Эти результаты свидетельствуют о том, что антитело к Абета hC2 обладало способностью защищать эмбриональные мышиные кортикальные нейроны от индуцируемой олигомером Абета дегенерации.
Положения и изменения, сделанные в каркасных участках легкой цепи гуманизированного С2
Положения и изменения, сделанные в каркасных участках тяжелой цепи гуманизированного С2
Конструировали в общей сложности 8 различных антител с гуманизированными легкими цепями C2HuVK1, C2HuVK2, C2HuVK3, C2HuVK4 и тяжелым цепями C2HuVHAF4 и C2HuVHAF2.
Ак, важные для связывания выделены курсивом и подчеркнуты, а ак, которые абсолютно необходимы для связывания, выделены курсивом и жирным шрифтом.
Обобщенные данные о пептидах, применяемых для второй библиотеки
Ак, важные для связывания выделены курсивом и подчеркнуты, а ак, которые абсолютно необходимы для связывания, выделены курсивом и жирным шрифтом.
Обобщенные данные о пептидах, применяемых для третьей библиотеки
Список литературы
1. Barghorn S., Nimmrich V., Striebinger A., Krantz C., Keller P., Janson В., Bahr M., Schmidt M., Bitner R.S., Harlan J., Barlow E., Ebert U., Hillen H., Globular amiloid beta-peptide oligomer - a homogenous and stable neuropathological protein in Alzheimer disease, J. Neuropchem., 95, 2005, cc. 834-847.
2. Blond and Goldberg, PNAS March 1, 1987, vol. 84, № 5, 1987, cc.1147-1151.
3. Cox J.P.L., Tomlinson I.M. и Winter G., A directory of human germ-line Vk segments reveals a strong bias in their usage, Eur. J. Immunol., 24, 1994, cc. 827-836.
4. Hieter P.A., Max E.E., Seidman J.G., Maizel J.V. Jr., Leder P., Cloned human and mouse kappa immunoglobuline constant and J region genes conserve homology in functional segments, Cell, 22(1 Pt 1), ноябрь 1980, cc. 197-207.
5. Kabat E.A., Wu T.T., Perry H.M., Gottesman K.S., Foeller C., Sequences of Proteins of Immunological Interest, изд-во US Department of Ilealth and Human Service, 1991.
6. Klein W.L., Abeta toxicity in Alzheimer disease: globular soluble polymeric amiloid beta (ADDLs) as new vaccine and drug targets, Neurochem. Int., 41(5), 2002, cc. 345-352.
7. Langdon S.D., Inaioki M., Kelsoe G. и Tedder T.F., Germline sequences of V(H)7183 gene family members in C57BL/6 mice demonstrate natural selection of particular sequences during recent evolution, Immunogenetics, 51, 2000, cc. 241-245.
8. Milligan R.C. and Berger P., Expression of a bacterial gene in mammalian cells, Science, 209, 1080, cc. 1422-1427.
9. Riechmann L., Clark M., Waldmann H., Winter G., Reshaping human antibodies for therapy, Nature, 332, 1988, cc. 323-327.
10. Schable K.F., Thiebe R., Bensch A., Brensing-Kueppers J., Ileim V., Kirschbaum Т., Lamm R., Ohnrich M., Pourrajabi S., Roschenthaler F., Schwendinger J., Wichelhaus D., Zocher L and Zaxhau H.G., Characteristics of the immunoglobuline V kappa genes, pseudogenes, relics and orphons in the mouse genome, Eur. J. Immunol., 29, 1999, cc. 2082-2086.
11. Tonlinson I.M., Walter G., Marks J.D., Llewelyn M.B. и Winter G.J., The repertoire of human germline VH sequences reveals approximately 50 groups of VH segments with different hypervariable loops. J. Mol. Biol., 227, 1992, cc. 776-798.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К АМИЛОИДУ БЕТА | 2007 |
|
RU2498999C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО | 2008 |
|
RU2538709C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К АМИЛОИДУ БЕТА | 2008 |
|
RU2567151C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА-БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2571859C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2542967C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ АМИЛОИДОЗОВ | 2018 |
|
RU2746812C1 |
| ПРЕДУПРЕЖДЕНИЕ И ЛЕЧЕНИЕ ЦЕРЕБРАЛЬНОЙ АМИЛОИДНОЙ АНГИОПАТИИ | 2008 |
|
RU2523894C2 |
| ХИМЕРНЫЕ АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ХАРАКТЕРИЗУЮЩИХСЯ ОТЛОЖЕНИЕМ АМИЛОИДА | 2018 |
|
RU2746325C1 |
| ГУМАНИЗИРОВАННОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ Aβ и ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2783528C1 |
| СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ АМИЛОИДА БЕТА (А БЕТА) 1-42 МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, ОБЛАДАЮЩИЕ ТЕРАПЕВТИЧЕСКИМИ СВОЙСТВАМИ | 2006 |
|
RU2551782C2 |















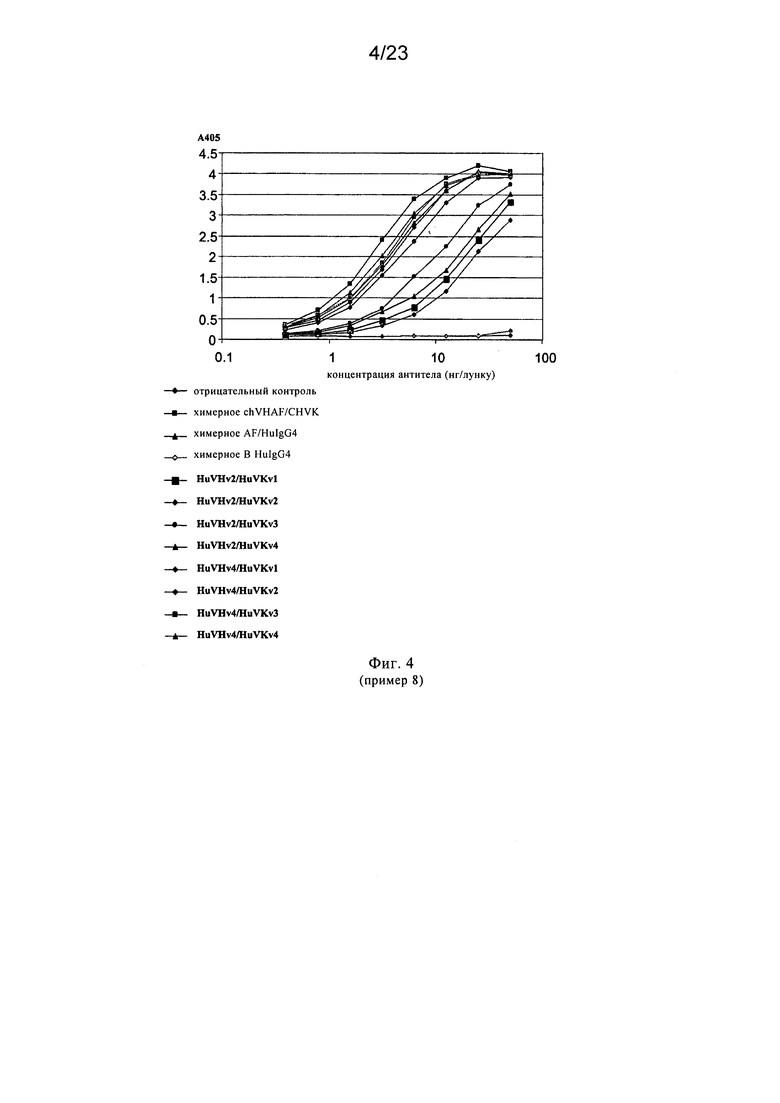


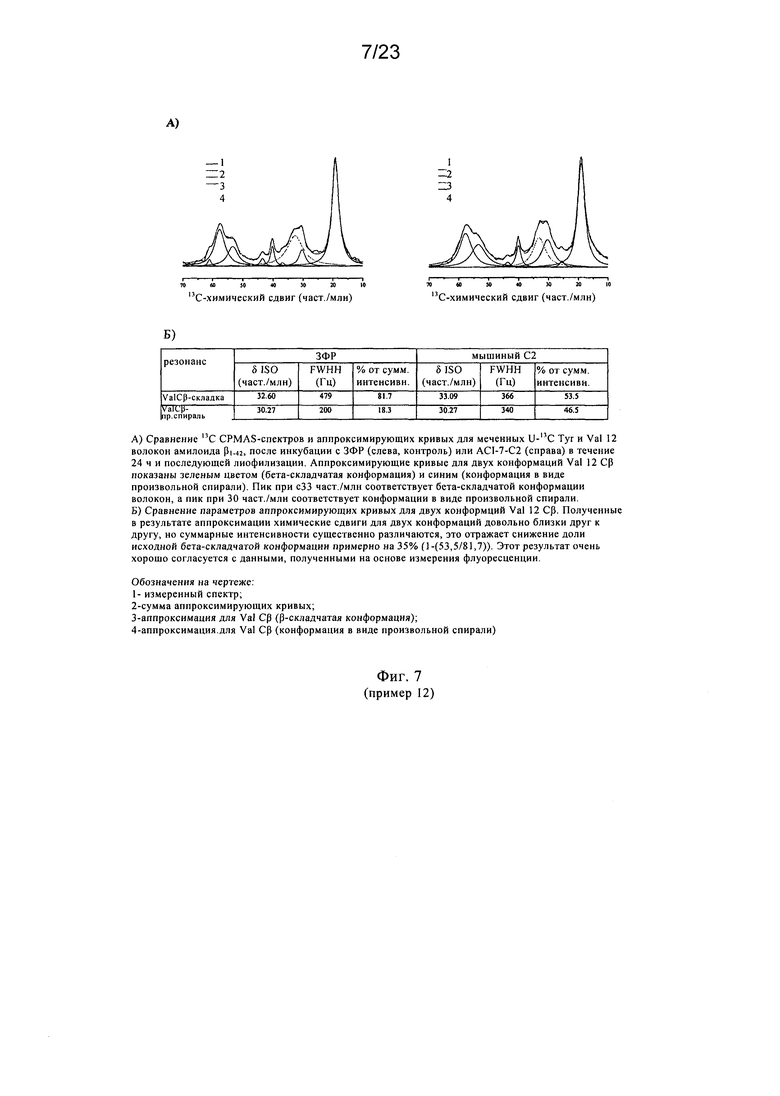

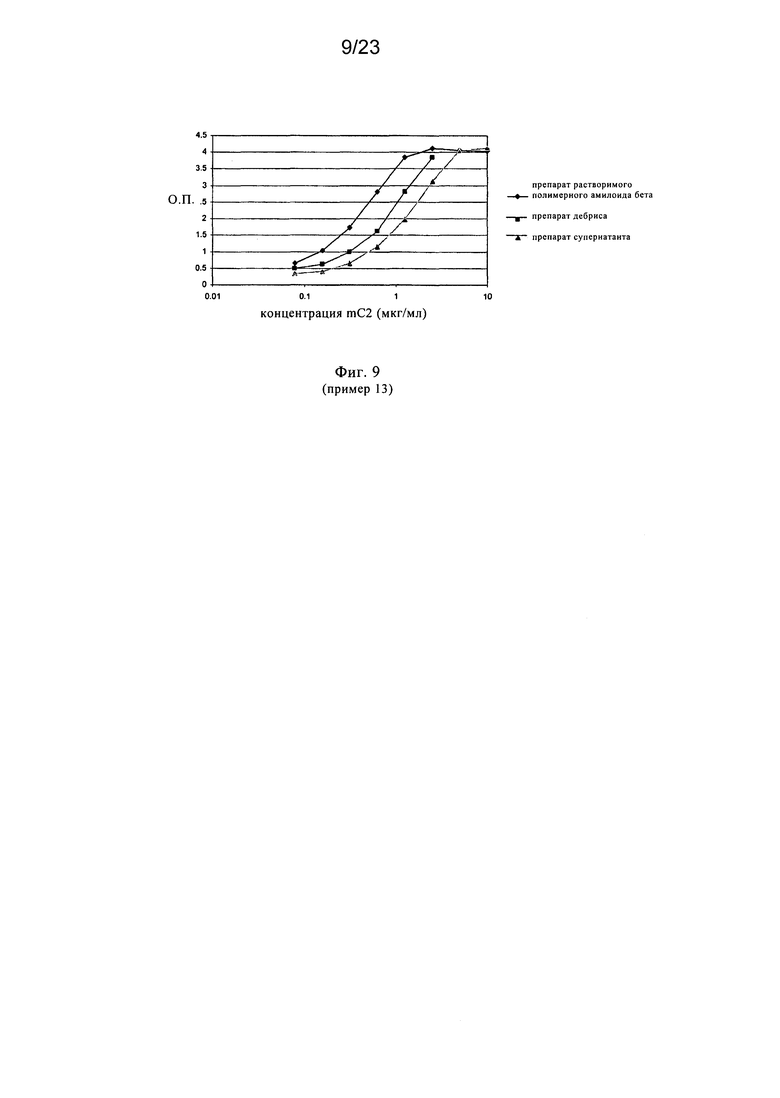











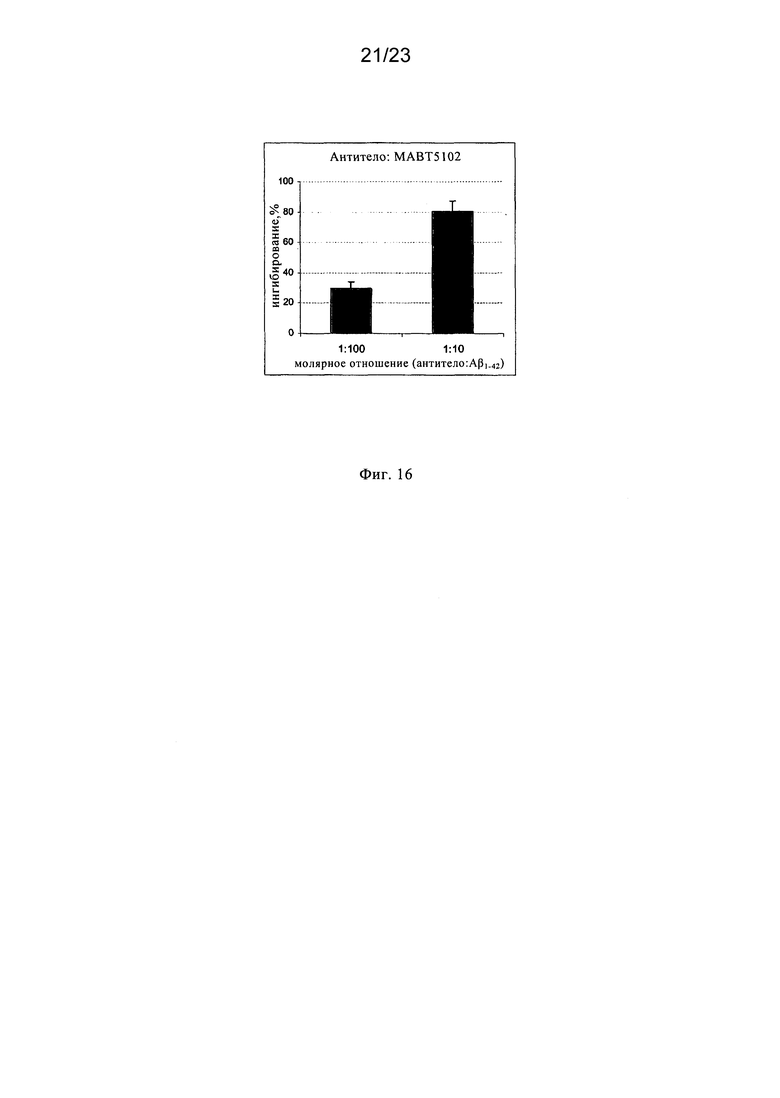
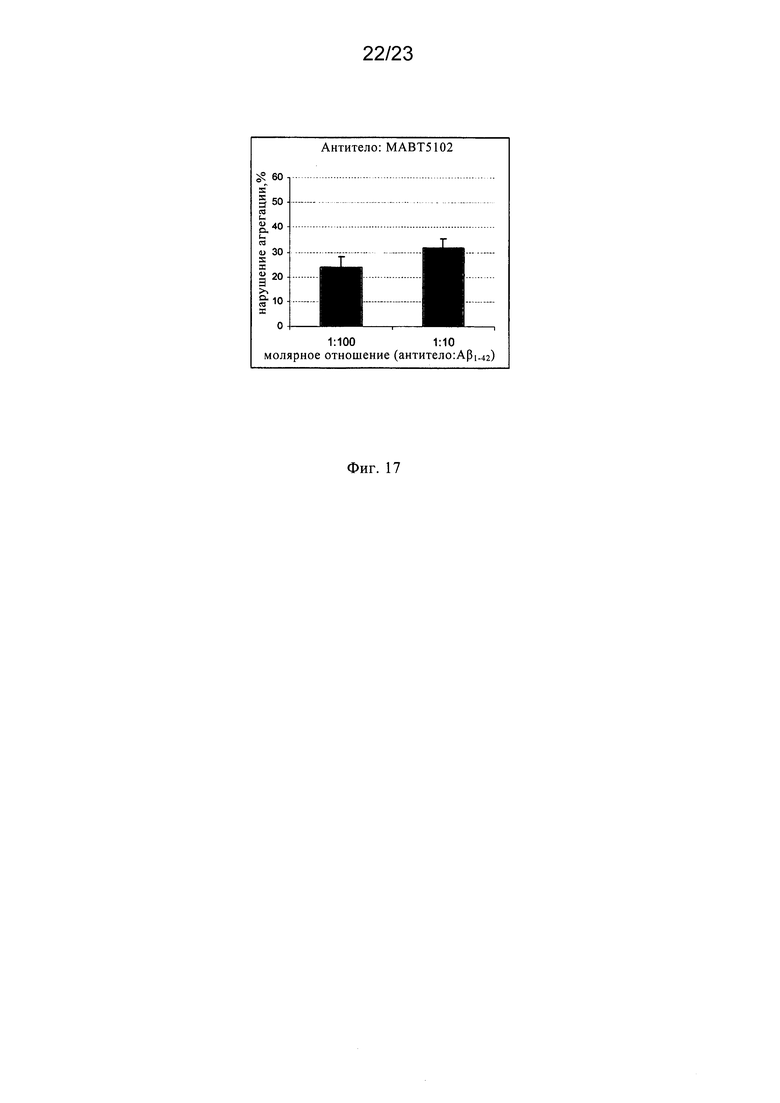
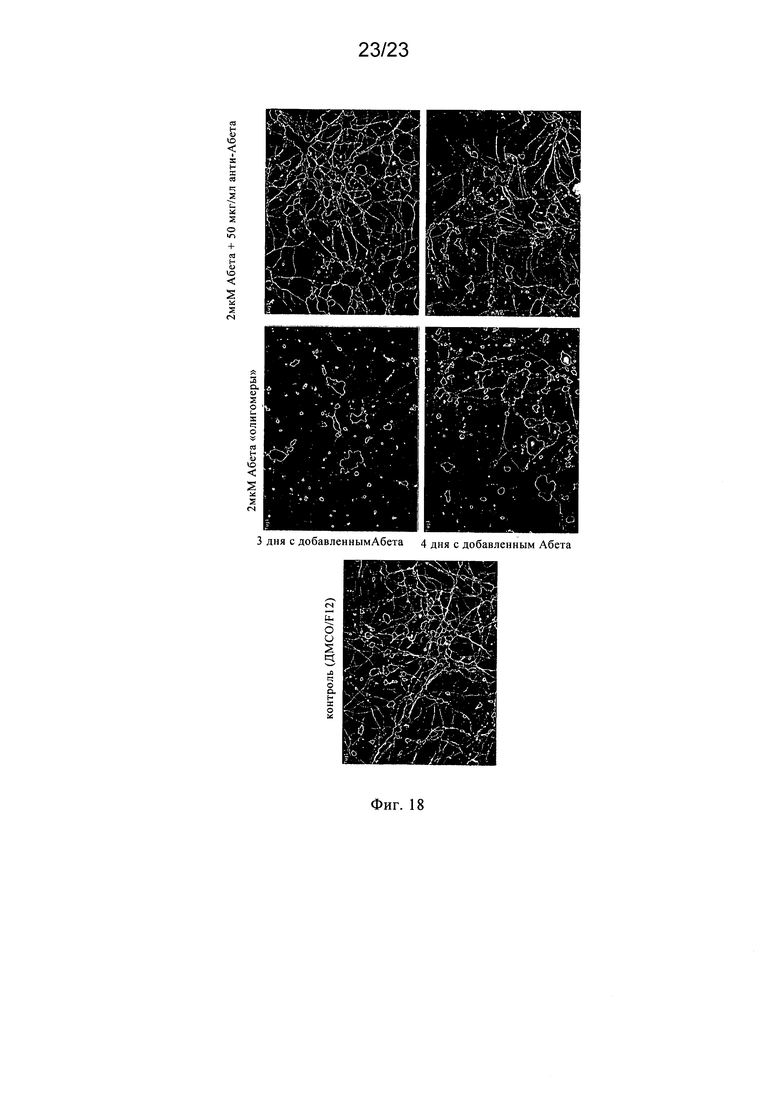
Настоящее изобретение относится к иммунологии. Предложены варианты антитела, содержащие две различные пары тяжелых/легких цепей, одна из которых распознает и связывает β-амилоидный белок. Для получения антитела предложены молекула нуклеиновой кислоты, экспрессионный вектор и клетка. Кроме того, описано применение антитела для получения лекарственного средства, фармацевтическая композиция и способы предупреждения, лечения или облегчения эффектов амилоидоза, а также способ нарушения агрегации ранее сформированных бета-амилоидных волокон и способ предупреждения деградации нейронов. Рассмотрен способ диагностирования амилоидоза у пациента, способ определения степени нагрузки амилоидогенными бляшками и набор для определения и диагностирования ассоциированных с амилоидами заболеваний и состояний. Антитела по настоящему изобретению могут найти применение в терапии и диагностике болезни Альцгеймера и других заболеваний, ассоциированных с амилоидозом. 21 н. и 40 з.п. ф-лы, 18 ил., 9 табл., 16 пр.
1. Искусственное химерное антитело для лечения или облегчения эффектов амилоидоза, причем искусственное химерное антитело содержит две различные пары тяжелых/легких цепей, причем каждая пара содержит различные сайты связывания, где первая пара тяжелой/легкой цепи распознает и связывает β-амилоидный белок и содержит:
(i) вариабельную область тяжелой цепи (HCVR), содержащую каркасные участки, полученные из тяжелой цепи антитела человека, определяющий комплементарность участок (CDR)1, содержащий аминокислотную последовательность SEQ ID NO:1, CDR2, содержащий аминокислотную последовательность SEQ ID NO:2, и CDR3, содержащий аминокислотную последовательность SEQ ID NO:3, и
(ii) вариабельную область легкой цепи (LCVR), содержащую аминокислотную последовательность, которая по меньшей мере на 98% аминокислотной последовательности SEQ ID NO:12, где LCVR содержит CDR1, содержащий аминокислотную последовательность SEQ ID NO:4, CDR2, содержащий аминокислотную последовательность SEQ ID NO:5, аминокислотную последовательность RVSNRFS или аминокислотную последовательность KVSSRFS, и CDR3, содержащий аминокислотную последовательность SEQ ID NO:6.
2. Искусственное химерное антитело для лечения или облегчения эффектов амилоидоза, причем искусственное химерное антитело содержит две различные пары тяжелых/легких цепей, причем каждая пара содержит различные сайты связывания, где первая пара тяжелой/легкой цепи распознает и связывает β-амилоидный белок и содержит:
(i) LCVR, содержащую каркасные участки, полученные из легкой цепи антитела человека, CDR1, содержащий аминокислотную последовательность SEQ ID NO:4, CDR2, содержащий аминокислотную последовательность SEQ ID NO:5, аминокислотную последовательность RVSNRFS или аминокислотную последовательность KVSSRFS, и CDR3, содержащий аминокислотную последовательность SEQ ID NO:6; и
(ii) HCVR, содержащую аминокислотную последовательность, которая по меньшей мере на 96% идентична аминокислотной последовательности SEQ ID NO:15, где HCVR содержит CDR1, содержащий аминокислотную последовательность SEQ ID NO:1, CDR2, содержащий аминокислотную последовательность SEQ ID NO:2, и CDR3, содержащий аминокислотную последовательность SEQ ID NO:3.
3. Искусственное гибридное антитело по п.2, где HCVR содержит аминокислотную последовательность, которая по меньшей мере на 98% идентична последовательности, представленной в SEQ ID NO: 15.
4. Искусственное химерное антитело для лечения или облегчения эффектов амилоидоза, причем искусственное химерное антитело содержит две различные пары тяжелых/легких цепей, причем каждая пара содержит два различных сайта связывания, где первая пара тяжелой/легкой цепи распознает и связывает β-амилоидный белок и содержит:
(i) HCVR, содержащую аминокислотную последовательность, которая по меньшей мере на 96% идентична аминокислотной последовательности SEQ ID NO:15, где HCVR содержит CDR1, содержащий аминокислотную последовательность SEQ ID NO:1, CDR2, содержащий аминокислотную последовательность SEQ ID NO:2, и CDR3, содержащий аминокислотную последовательность SEQ ID NO:3, и
(ii) LCVR, содержащую аминокислотную последовательность, которая по меньшей мере на 96% идентична аминокислотной последовательности SEQ ID NO:12, где LCVR содержит CDR1, содержащий аминокислотную последовательность SEQ ID NO:4, CDR2, содержащий аминокислотную последовательность SEQ ID NO:5, аминокислотную последовательность RVSNRFS или аминокислотную последовательность KVSSRFS, и CDR3, содержащий аминокислотную последовательность SEQ ID NO:6.
5. Искусственное химерное антитело по п.4, где HCVR содержит аминокислотную последовательность, которая по меньшей мере на 98% идентична последовательности, представленной в SEQ ID NO:15.
6. Искусственное химерное антитело по п.4, где LCVR содержит аминокислотную последовательность, которая по меньшей мере на 98% идентична последовательности, представленной в SEQ ID NO:12.
7. Искусственное химерное антитело по п.4, где HCVR содержит аминокислотную последовательность, которая по меньшей мере на 98% идентична последовательности, представленной в SEQ ID NO:15, и где LCVR содержит аминокислотную последовательность, которая по меньшей мере на 98% идентична последовательности, представленной в SEQ ID NO:12.
8. Искусственное гибридное антитело по п.1, где CDR2 LCVR содержит аминокислотную последовательность SEQ ID NO:5.
9. Искусственное гибридное антитело по п.2, где CDR2 LCVR содержит аминокислотную последовательность SEQ ID NO:5.
10. Искусственное гибридное антитело по п.4, где CDR2 LCVR содержит аминокислотную последовательность SEQ ID NO:5.
11. Искусственное гибридное антитело по п.1, где CDR2 LCVR содержит аминокислотную последовательность RVSNRFS или аминокислотную последовательность KVSSRFS.
12. Искусственное гибридное антитело по п.2, где CDR2 LCVR содержит аминокислотную последовательность RVSNRFS или аминокислотную последовательность KVSSRFS.
13. Искусственное гибридное антитело по п.4, где CDR2 LCVR содержит аминокислотную последовательность RVSNRFS или аминокислотную последовательность KVSSRFS.
14. Искусственное гибридное антитело по п.1, где: (а) аминокислота в положении 47 согласно номенклатуре Кэбота в каркасном участке из вариабельной области тяжелой цепи представляет собой Leu; (b) аминокислота в положении 94 согласно номенклатуре Кэбота в каркасном участке из вариабельной области тяжелой цепи представляет собой Ser; (c) аминокислота в положении 87 согласно номенклатуре Кэбота в каркасном участке из вариабельной области легкой цепи представляет собой Phe или Tyr; и/или (d) аминокислота в положении 45 согласно номенклатуре Кэбота в каркасном участке из вариабельной области легкой цепи представляет собой Lys или Gln.
15. Искусственное гибридное антитело по п.2, где: (а) аминокислота в положении 47 согласно номенклатуре Кэбота в каркасном участке из вариабельной области тяжелой цепи представляет собой Leu; (b) аминокислота в положении 94 согласно номенклатуре Кэбота в каркасном участке из вариабельной области тяжелой цепи представляет собой Ser; (c) аминокислота в положении 87 согласно номенклатуре Кэбота в каркасном участке из вариабельной области легкой цепи представляет собой Phe или Tyr; и/или (d) аминокислота в положении 45 согласно номенклатуре Кэбота в каркасном участке из вариабельной области легкой цепи представляет собой Lys или Gln.
16. Искусственное гибридное антитело по п.3, где: (а) аминокислота в положении 47 согласно номенклатуре Кэбота в каркасном участке из вариабельной области тяжелой цепи представляет собой Leu; (b) аминокислота в положении 94 согласно номенклатуре Кэбота в каркасном участке из вариабельной области тяжелой цепи представляет собой Ser; (c) аминокислота в положении 87 согласно номенклатуре Кэбота в каркасном участке из вариабельной области легкой цепи представляет собой Phe или Tyr; и/или (d) аминокислота в положении 45 согласно номенклатуре Кэбота в каркасном участке из вариабельной области легкой цепи представляет собой Lys или Gln.
17. Искусственное гибридное антитело по п.4, где: (а) аминокислота в положении 47 согласно номенклатуре Кэбота в каркасном участке из вариабельной области тяжелой цепи представляет собой Leu; (b) аминокислота в положении 94 согласно номенклатуре Кэбота в каркасном участке из вариабельной области тяжелой цепи представляет собой Ser; (c) аминокислота в положении 87 согласно номенклатуре Кэбота в каркасном участке из вариабельной области легкой цепи представляет собой Phe или Tyr; и/или (d) аминокислота в положении 45 согласно номенклатуре Кэбота в каркасном участке из вариабельной области легкой цепи представляет собой Lys или Gln.
18. Искусственное гибридное антитело по любому из пп.1-10, где вариабельная область легкой цепи (LCVR) содержит аминокислотную последовательность SEQ ID NO:12.
19. Искусственное гибридное антитело по любому из пп.1-10, где вариабельная область тяжелой цепи (HCVR) содержит аминокислотную последовательность SEQ ID NO:15.
20. Искусственное химерное антитело для лечения или облегчения эффектов амилоидоза, причем искусственное химерное антитело содержит две различные пары тяжелых/легких цепей, причем каждая пара содержит различные сайты связывания, где первая пара тяжелой/легкой цепи распознает и связывает β-амилоидный белок, и содержит вариабельную область тяжелой цепи (HCVR), содержащую аминокислотную последовательность SEQ ID NO:15, и вариабельную область легкой цепи (LCVR), содержащую аминокислотную последовательность SEQ ID NO:12.
21. Искусственное гибридное антитело по любому из пп.1-10 или 20, где первая пара тяжелой/легкой цепи содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13.
22. Искусственное гибридное антитело по любому из пп.1-10 или 20, где первая пара тяжелой/легкой цепи содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
23. Искусственное гибридное антитело по любому из пп.1-10 или 20, где первая пара тяжелой/легкой цепи содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16, не содержащую C-концевой Lys в положении 439.
24. Искусственное химерное антитело для лечения или облегчения эффектов амилоидоза, причем искусственное химерное антитело содержит две различные пары тяжелых/легких цепей, причем каждая пара содержит различные сайты связывания, где первая пара тяжелой/легкой цепи распознает и связывает β-амилоидный белок, и содержит (i) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:13, и (ii) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:16, или тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:16, не содержащую C-концевой Lys в положении 439.
25. Искусственное химерное антитело по п.24, где первая пара тяжелой/легкой цепи содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:16.
26. Искусственное химерное антитело по п.24, где первая пара тяжелой/легкой цепи содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:16, не содержащую C-концевой Lys в положении 439.
27. Искусственное химерное антитело по любому из пп.1,17 или 24-26, где антитело обладают способностью ингибировать агрегацию бета-амилоидных мономеров, а также способностью нарушать агрегацию ранее сформированных бета-амилоидных волокон.
28. Молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, которая кодирует искусственное химерное антитело по любому из пп.1-27.
29. Экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по п.28.
30. Клетка, содержащая экспрессионный вектор по п.29, которая продуцирует искусственное гибридное антитело по любому из пп.1-27.
31. Фармацевтическая композиция, содержащая искусственное гибридное антитело по любому из пп.1-27 в количестве, эффективном для лечения одного или более симптомов амилоидоза.
32. Фармацевтическая композиция по п.31, где амилоидоз представляет собой болезнь Альцгеймера.
33. Способ предупреждения, лечения или облегчения одного или более эффектов амилоидоза, включающий введение животному или человеку, пораженному амилоидозом, терапевтически эффективного количества искусственного химерного антитела по любому из пп.1-27.
34. Способ по п.33, где амилоидоз представляет собой вторичный амилоидоз, связанный с возрастом амилоидоз, неврологические заболевания, деменцию, связанную с тельцами Леви, синдром Дауна, наследственную церебральную геморрагию с амилоидозом (голландского типа), комплекс деменции Гуама-Паркинсона, прогрессирующий надъядерный паралич, рассеянный склероз, болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанную с ВИЧ деменцию, амиотрофический боковой склероз (ALS), диабет взрослых, старческий сердечный амилоидоз, эндокринные опухоли или дегенерацию желтого пятна.
35. Способ по п.33, где амилоидоз представляет собой болезнь Альцгеймера.
36. Способ по п.33, где искусственное химерное антитело предназначено для внутривенного введения.
37. Способ по п.33, где искусственное химерное антитело предназначено для подкожной инъекции.
38. Способ предупреждения, лечения или облегчения одного или более эффектов амилоидоза, включающий введение животному или человеку, пораженному амилоидозом, фармацевтической композиции по п.31.
39. Способ по п.38, где амилоидоз представляет собой вторичный амилоидоз, связанный с возрастом амилоидоз, неврологические заболевания, деменцию, связанную с тельцами Леви, синдром Дауна, наследственную церебральную геморрагию с амилоидозом (голландского типа), комплекс деменции Гуама-Паркинсона, прогрессирующий надъядерный паралич, рассеянный склероз, болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанную с ВИЧ деменцию, амиотрофический боковой склероз (ALS), диабет взрослых, старческий сердечный амилоидоз, эндокринные опухоли или дегенерацию желтого пятна.
40. Способ по п.38, где амилоидоз представляет собой болезнь Альцгеймера.
41. Способ по п.38, где фармацевтическая композиция предназначена для внутривенного введения.
42. Способ по п.38, где фармацевтическая композиция предназначена для подкожной инъекции.
43. Применение искусственного химерного антитела по любому из пп.1-27 для получения лекарственного средства для лечения или облегчения одного или более эффектов амилоидоза у животного или человека.
44. Применение по п. 43, где амилоидоз представляет собой вторичный амилоидоз, связанный с возрастом амилоидоз, неврологические заболевания, деменцию, связанную с тельцами Леви, синдром Дауна, наследственную церебральную геморрагию с амилоидозом (голландского типа), комплекс деменции Гуама-Паркинсона, прогрессирующий надъядерный паралич, рассеянный склероз, болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанную с ВИЧ деменцию, амиотрофический боковой склероз (ALS), диабет взрослых, старческий сердечный амилоидоз, эндокринные опухоли или дегенерацию желтого пятна.
45. Применение по п.43, где амилоидоз представляет собой болезнь Альцгеймера.
46. Применение по п.43, где лекарственное средство предназначено для внутривенного введения.
47. Применение по п.43, где лекарственное средство предназначено для подкожной инъекции.
48. Способ приготовления фармацевтической композиции по п.30 для применения в способе предупреждения, лечения или облегчения эффектов амилоидоза, заключающийся в том, что приготавливают искусственное химерное антитело по любому из пп.1-27 в фармацевтически приемлемой форме.
49. Способ по п.48, где амилоидоз представляет собой вторичный амилоидоз, связанный с возрастом амилоидоз, неврологические заболевания, деменцию, связанную с тельцами Леви, синдром Дауна, наследственную церебральную геморрагию с амилоидозом (голландского типа), комплекс деменции Гуама-Паркинсона, прогрессирующий надъядерный паралич, рассеянный склероз, болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанную с ВИЧ деменцию, амиотрофический боковой склероз (ALS), диабет взрослых, старческий сердечный амилоидоз, эндокринные опухоли или дегенерацию желтого пятна.
50. Способ по п.48, в котором амилоидоз представляет собой болезнь Альцгеймера.
51. Способ по п.48, где фармацевтическая композиция предназначена для внутривенного введения.
52. Способ по п.48, где фармацевтическая композиция предназначена для подкожной инъекции.
53. Способ диагностирования амилоидоза у пациента, включающий:
(а) приведение в контакт образца, полученного у пациента, с искусственным химерным антителом по любому из пп.1-27 в условиях, позволяющих связывание искусственного гибридного антитела с β-амилоидным белком; и
(b) обнаружение искусственного гибридного антитела, связанного с β-амилоидным белком; при этом наличие или отсутствие антитела, связанного с амилоидным белком, указывает на присутствие или отсутствие β-амилоидного белка в образце.
54. Способ определения степени нагрузки амилоидогенными бляшками в образце ткани или образце жидкости организма, включающий:
а) тестирование образец ткани или образец жидкости тела на присутствие β-амилоидного белка с помощью искусственного химерного антитела по любому из пп.1-27;
b) определение количества искусственного гибридного антитела, связанных с белком; и
c) подсчет нагрузки бляшками образца ткани или образца жидкости организма.
55. Набор для определения и диагностирования ассоциированных с амилоидами заболеваний и состояний, содержащий искусственное химерное антитело по любому из пп.1-27 и инструкции по его применению.
56. Способ нарушения агрегации ранее сформированных бета-амилоидных волокон, включающий контактирование искусственного химерного антитела по любому из пп.1-27 с ранее сформированными бета-амилоидными волокнами.
57. Применение искусственного химерного антитела по любому из пп.1-27 для получения лекарственного средства для нарушения агрегации ранее сформированных бета-амилоидных волокон у животного, страдающего амилоидозом.
58. Способ предупреждения Аβ-индуцируемой деградации нейронов, включающий обработку нейронов эффективным количеством искусственного химерного антитела по любому из пп.1-27.
59. Применение искусственного химерного антитела по любому из пп.1-27 для приготовления лекарственного средства для предупреждения дегенерации нейронов под действием β-амилоидных олигомеров.
60. Способ получения искусственного химерного антитела по любому из пп.1-27, включающий стадии (i) культивирования клетки по п.30 и (ii) сбора антитела, продуцированного клеткой.
61. Способ по п.60, дополнительно включающий стадию очистки собранного искусственного химерного белка.
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| WO 00/072880 A2, 12.07.2000 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КЛИОХИНОЛА ДЛЯ ЕЕ ЛЕЧЕНИЯ | 1997 |
|
RU2193406C2 |
| BARD F | |||
| et al., "Epitope and isotype specificities of antibodies to β-amyloid peptide for protection against Alzheimer's disease-like neuropathology." Proceedings of the National Academy of Sciences, 2003, 100(4):2023-2028 | |||
| SOLOMON B | |||
| et al., "Monoclonal antibodies inhibit in vitro fibrillar aggregation of the Alzheimer beta-amyloid peptide." Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| USA Neurobiology, 1996, 93: 452-455. | |||
Авторы
Даты
2018-09-26—Публикация
2013-04-05—Подача