Родственные заявки
Данная заявка является международной патентной заявкой, испрашивающей приоритет предварительной заявки на патент США № 60/839163, поданной 21 августа 2006, предварительной заявки на патент США № 60/871600, поданной 22 декабря 2006, и предварительной заявки на патент США № 60/917624, поданной 11 мая 2007, включенных в данное описание посредством ссылки.
Область техники, к которой относится изобретение
Изобретение относится к азабензотиофенильным соединениям с противораковой и/или противовоспалительной активностью, и более конкретно, к азабензотиофенильным соединениям, ингибирующим активность киназы МЕК. Изобретение также относится к способам применения соединений для диагностики in vitro, in situ и in vivo или обработки клеток млекопитающих или лечения ассоциированных патологических состояний.
Предпосылки создания изобретения
В поисках понимания того, каким образом Ras передает внеклеточные сигналы роста, метаболический путь киназы МАР (митогенактивированного белка) (МАРК) выявлен как критический путь между мембраносвязанной Ras и ядрами. Метаболический путь МАРК охватывает каскад событий фосфорилирования, включающий три ключевые киназы, а именно Raf, MEK (киназа киназы MAP) и ERK (киназа MAP). Активная GTP-связанная Ras приводит к активации и непрямому фосфорилированию киназы Raf. Затем Raf фосфорилирует МЕК1 и 2 по двум сериновым остаткам (S218 и S222 в случае МЕК1 и S222 и S226 в случае МЕК2) (Ahn et al., Methods in Enzymology, 2001, 332, 417-431). Затем активированная МЕК фосфорилирует только ее известные субстраты - киназы МАР, ERK1 и 2. Фосфорилирование ERK МЕК происходит по Y204 и Т202 в случае ERK1 и Y185 и Т183 в случае ERK2 (Ahn et al., Methods in Enzymology, 2001, 332, 417-431). Фосфорилированная ERK димеризуется и затем перемещается в ядро, где она накапливается (Khokhlatchev et al., Cell, 1998, 93, 605-615). В ядре ERK вовлекается в некоторые важные клеточные функции, включая, но не ограничиваясь ими, ядерный перенос, сигнальную трансдукцию, репарацию ДНК, сборку и транслокацию нуклеосомы, и процессинг и трансляцию мРНК (Ahn et al., Molecular Cell, 2000, 6, 1343-1354). В целом обработка клеток факторами роста приводит к активации ERK1 и 2, которая приводит к пролиферации и в некоторых случаях дифференцировке (Lewis et al., Adv. Cancer Res., 1998, 74, 49-139).
Имеются серьезные свидетельства того, что генетические мутации и/или сверхэкспрессия протеинкиназ, вовлеченных в каскад реакций киназы МАР, ведет к нерегулируемой клеточной пролиферации и, очевидно, образованию опухоли при пролиферативных заболеваниях. Например, некоторые карциномы содержат мутации, которые приводят в непрерывной активации такого каскада из-за непрерывного продуцирования факторов роста. Другие мутации могут приводить к нарушениям дезактивации активированного GTP-связанного комплекса Ras, причем снова приводят к активации каскада реакции киназы МАР. Мутированные онкогенные формы Ras обнаружены в 50% раковых заболеваний толстой кишки и более 90% раковых заболеваний поджелудочной железы, а также при многих других типах раковых заболеваний (Kohl et al., Science, 1993, 260, 1834-1837). В последнее время мутации bRaf идентифицированы в более чем 60% случаев злокачественной меланомы (Davies H. et al., Nature, 2002, 417, 949-954). Такие мутации bRaf приводят к конститутивно активному каскаду киназы МАР. Исследования образцов первичных опухолей и клеточных линий также показывают конститутивный или сверхактивацию пути обмена киназы МАР при раковых заболеваниях поджелудочной железы, толстой кишки, легких, яичников и почек (Hoshino R. et al., Oncogene, 1999, 18, 813-822).
МЕК выявлена как привлекательная терапевтическая мишень в пути обмена киназы МАР. МЕК по ходу сигнального пути Ras и Raf является высокоспецифической для фосфорилирования киназы МАР; действительно, единственными известными субстратами фосфорилирования МЕК являются киназы МАР ERK1 и 2. В некоторых исследованиях показано, что ингибирование МЕК имеет потенциально благоприятное терапевтическое действие. Например, показано, что низкомолекулярные ингибиторы МЕК ингибируют рост человеческих опухолей в ксенотрансплантатах у голых мышей (Sebolt-Leopold et al., Nature-Medicine, 1999, 5(7), 810-816); Trachet et al., AACR Apr., 6-10, 2002, Poster #5426; Tecle H., IBC, 2.sup.nd International Conference of Protein Kinases, Sep., 9-10, 2002), блокируют статическую аллодинию (allodynia) у животных (WO 01/053090, опубликована 25 января 2001) и ингибируют рост клеток острого миелоидного лейкоза (Milella et al., J. Clin. Invest., 2001, 108(6), 851-859).
Некоторые низкомолекулярные ингибиторы МЕК также обсуждаются в, например, WO 02/06213, WO 03/077855 и WO 03/077914. Все еще существует потребность в новых ингибиторах МЕК в качестве эффективных и безопасных терапевтических средств для лечения различных пролиферативных заболеваний, таких как состояния, связанные с гиперактивностью МЕК, а также заболевания, модулируемые каскадом МЕК.
Сущность изобретения
Изобретение относится, в общем, к азабензотиофенильным соединениям формулы I (и/или их сольватам и солям), обладающим противораковой и/или противовоспалительной активностью и, более конкретно, активностью ингибирования киназы МЕК. Некоторые гиперпролиферативные и воспалительные расстройства характеризуются модуляцией функции киназы МЕК, например, за счет мутаций или сверхэкспрессии белков. Соответственно, соединения данного изобретения и их композиции полезны при лечении гиперпролиферативных расстройств, таких как рак, и/или воспалительных заболеваний, таких как ревматоидный артрит.
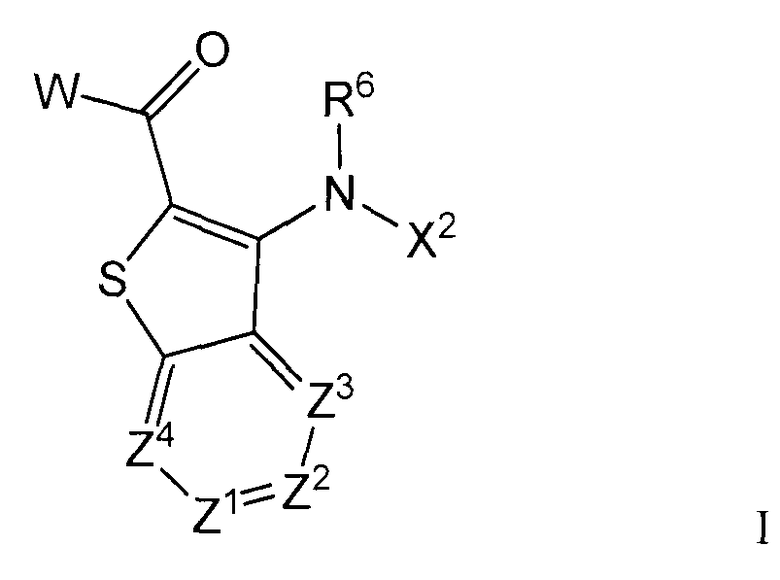
где Z1 представляет собой CR1 или N;
Z2 представляет собой CR2 или N;
Z3 представляет собой CR3 или N;
Z4 представляет собой CR4 или N;
где один или два из Z1, Z2, Z3 и Z4 представляют собой N;
R1, R2, R3 и R4 независимо выбирают из Н, галогена, CN,
CF3, -OCF3, -NO2, -(CR14R15)nC(=Y)R11, -(CR14R15)nC(=Y)OR11,
-(CR14R15)nC(=Y)NR11R12, -(CR14R15)nNR11R12, -(CR14R15)nOR11,
-(CR14R15)nSR11, -(CR14R15)nNR12C(=Y)R11, -(CR14R15)nNR12C(=Y)OR11,
-(CR14R15)nNR13C(=Y)NR11R12, -(CR14R15)nNR12SO2R11, -(CR14R15)nOC(=Y)R11,
-(CR14R15)nOC(=Y)OR11, -(CR14R15)nOC(=Y)NR11R12,
-(CR14R15)nOS(O)2(OR11), -(CR14R15)nOP(=Y)(OR11)(OR12),
-(CR14R15)nOP(OR11)(OR12), -(CR14R15)nS(O)R11, -(CR14R15)nS(O)2R11,
-(CR14R15)nS(O)2NR11R12, -(CR14R15)nS(O)(OR11), -(CR14R15)nS(O)2(OR11),
-(CR14R15)nSC(=Y)R11, -(CR14R15)nSC(=Y)OR11, -(CR14R15)nSC(=Y)NR11R12,
(C1-C12)алкила, (C2-C8)алкенила, (C2-C8)алкинила, карбоциклила,
гетероциклила, арила и гетероарила;
W представляет собой
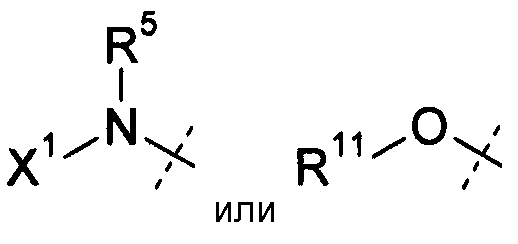
R5 и R6 независимо выбирают из Н или (C1-C12)алкила;
Х1 выбирают из R11, -OR11, -NR11R12, -S(O)R11 и S(O)2R11; когда Х1 представляет собой R11 или -OR11, R11 или -OR11 из Х1 и -R5, необязательно, взятые вместе с атомом азота, к которому они присоединены, образуют 4-7-членное насыщенное или ненасыщенное кольцо, имеющее 0-2 дополнительных гетероатома, выбранных из атомов О, S и N, где указанное кольцо необязательно замещено одной или несколькими группами, выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -Si(C1-С6алкила), -(CR19R20)nC(=Y')R16,
-(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17,
-(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17,
-(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17,
-(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21;
Х2 выбирают из карбоциклила, гетероциклила, арила и гетероарила;
R11, R12 и R13 независимо представляют собой Н, (C1-C12)алкил, (C2-C8)алкенил, (C2-C8)алкинил, карбоциклил, гетероциклил, арил или гетероарил;
или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют 3-8-членное насыщенное, ненасыщенное или ароматическое кольцо, имеющее 0-2 гетероатома, выбранных из атомов О, S и N, где указанное кольцо необязательно замещено одной или несколькими группами, выбранными из галогена, CN, CF3, -OCF3, -NO2, (C1-C6)алкила, -ОН, -SH, -O(C1-C6)алкила,
-S(C1-C6)алкила, -NH2, -NH(C1-C6)алкила, -N(C1-С6алкил)2,
-SO2(C1-C6)алкила, -CO2H, -CO2(C1-C6)алкила, -C(O)NH2,
-C(O)NH(C1-C6)алкила, -C(O)N(C1-С6алкил)2,
-N(C1-С6алкил)CO(О)(C1-C6)алкила, -NHC(O)(C1-C6)алкила,
-NHSO2(C1-C6)алкила), -N(C1-С6алкил)SO2(C1-C6)алкила, -SO2NH2,
SO2NH(C1-C6)алкила, -SO2N(C1-С6алкил)2, -OC(O)NH2,
-OC(O)NH(C1-C6)алкила, -OC(O)N(C1-С6алкил)2, -OC(O)O(C1-C6)алкила,
-NHC(O)NH(C1-C6)алкила, -NHC(O)N(C1-С6алкил)2,
-N(C1-С6алкил)C(O)NH(C1-C6)алкила,
-N(C1-С6алкил)C(O)N(C1-С6алкил)2, -NHC(O)O(C1-C6)алкила и
-N(C1-С6алкил)C(O)О(C1-C6)алкила;
R14 и R15 независимо выбирают из Н, (C1-C12)алкила, арила, карбоциклила, гетероциклила и гетероарила;
m и n независимо выбирают из 0, 1, 2, 3, 4, 5 или 6;
Y независимо представляет собой O, NR11 или S;
где каждый указанный алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил в R1, R2, R3, R4, R5, R6, X1, X2, R11, R12, R13, R14 и R15 необязательно и независимо замещен одной или несколькими группами, независимо выбранными из галогена, CN,
CF3, -OCF3, -NO2, оксо, -Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16,
-(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17,
-(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17,
-(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17,
-(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21;
каждый R16, R17 и R18 независимо представляет собой Н, (C1-C12)алкил, (C2-C8)алкенил, (C2-C8)алкинил, карбоциклил, гетероциклил, арил или гетероарил, где указанный алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил или гетероарил необязательно замещен одной или несколькими группами, выбранными из галогена, CN, -OCF3, CF3, -NO2, (C1-C6)алкила, -ОН, -SH,
-O(C1-C6)алкила, -S(C1-C6)алкила, -NH2, -NH(C1-C6)алкила,
-N(C1-С6алкил)2, -SO2(C1-C6)алкила, -CO2H, -CO2(C1-C6)алкила,
-C(O)NH2, -C(O)NH(C1-C6)алкила, -C(O)N(C1-С6алкил)2,
-N(C1-С6алкил)С(O)(C1-C6)алкила, -NHC(O)(C1-C6)алкила,
-NHSO2(C1-C6)алкила, -N(C1-С6алкил)SO2(C1-C6)алкила, -SO2NH2,
SO2NH(C1-C6)алкила, -SO2N(C1-С6алкил)2, -OC(O)NH2,
-OC(O)NH(C1-C6)алкила, -OC(O)N(C1-С6алкил)2, -OC(O)O(C1-C6)алкила,
-NHC(O)NH(C1-C6)алкила, -NHC(O)N(C1-С6алкил)2,
-N(C1-С6алкил)C(O)NH(C1-C6)алкила,
-N(C1-С6алкил)C(O)N(C1-С6алкил)2, -NHC(O)O(C1-C6)алкила и
-N(C1-С6алкил)C(O)О(C1-C6)алкила;
или R16 и R17 вместе с атомом азота, к которому они присоединены, образуют 3-8-членное насыщенное, ненасыщенное или ароматическое кольцо, имеющее 0-2 гетероатома, выбранных из атомов О, S и N, где указанное кольцо необязательно замещено одной или несколькими группами, выбранными из галогена, CN,
-OCF3, CF3, -NO2, (C1-C6)алкила, -ОН, -SH, -O(C1-C6)алкила,
-S(C1-C6)алкила, -NH2, -NH(C1-C6)алкила, -N(C1-С6алкил)2,
-SO2(C1-C6)алкила, -CO2H, -CO2(C1-C6)алкила, -C(O)NH2,
-C(O)NH(C1-C6)алкила, -C(O)N(C1-С6алкил)2,
-N(C1-С6алкил)С(O)(C1-C6)алкила, -NHC(O)(C1-C6)алкила,
-NHSO2(C1-C6)алкила, -N(C1-С6алкил)SO2(C1-C6)алкила, -SO2NH2,
SO2NH(C1-C6)алкила, -SO2N(C1-С6алкил)2, -OC(O)NH2,
-OC(O)NH(C1-C6)алкила, -OC(O)N(C1-С6алкил)2, -OC(O)O(C1-C6)алкила,
-NHC(O)NH(C1-C6)алкила, -NHC(O)N(C1-С6алкил)2,
-N(C1-С6алкил)C(O)NH(C1-C6)алкила,
-N(C1-С6алкил)C(O)N(C1-С6алкил)2, NHC(O)O(C1-C6)алкила и
-N(C1-С6алкил)C(O)О(C1-C6)алкила;
R19 и R20 независимо выбирают из Н, (C1-C12)алкила, -(CH2)n-арила, -(CH2)n-карбоциклила, -(CH2)n-гетероциклила и -(CH2)n-гетероарила;
R21 представляет собой (C1-C12)алкил, (C2-C8)алкенил, (C2-C8)алкинил, карбоциклил, гетероциклил, арил или гетероарил, где каждый заместитель R21 необязательно замещен одной или несколькими группами, выбранными из галогена, оксо, CN, -OCF3,
CF3, -NO2, (C1-C6)алкила, -ОН, -SH, -O(C1-C6)алкила,
-S(C1-C6)алкила, -NH2, -NH(C1-C6)алкила, -N(C1-С6алкил)2,
-SO2(C1-C6)алкила, -CO2H, -CO2(C1-C6)алкила, -C(O)NH2,
-C(O)NH(C1-C6)алкила, -C(O)N(C1-С6алкил)2,
-N(C1-С6алкил)С(O)(C1-C6)алкила, -NHC(O)(C1-C6)алкила,
-NHSO2(C1-C6)алкила, -N(C1-С6алкил)SO2(C1-C6)алкила, -SO2NH2,
SO2NH(C1-C6)алкила, -SO2N(C1-С6алкил)2, -OC(O)NH2,
-OC(O)NH(C1-C6)алкила, -OC(O)N(C1-С6алкил)2, -OC(O)O(C1-C6)алкила,
-NHC(O)NH(C1-C6)алкила, -NHC(O)N(C1-С6алкил)2,
-N(C1-С6алкил)C(O)NH(C1-C6)алкила,
-N(C1-С6алкил)C(O)N(C1-С6алкил)2,
-NHC(O)O(C1-C6)алкила и -N(C1-С6алкил)C(O)О(C1-C6)алкила;
каждый Y' независимо представляет собой О, NR22 или S; и
R22 представляет собой Н или (C1-C12)алкил.
Настоящее изобретение относится к композиции (например, фармацевтической композиции), содержащей соединение формулы I (и/или его сольваты и соли) и носитель (фармацевтически приемлемый носитель). Настоящее изобретение также относится к композиции (например, фармацевтической композиции), содержащей соединение формулы I (и/или его сольваты и соли) и носитель (фармацевтически приемлемый носитель), и дополнительно содержащей второе химиотерапевтическое средство и/или второе противовоспалительное средство. Композиции настоящего изобретения полезны для ингибирования аномального клеточного роста или лечения гиперпролиферативного расстройства у млекопитающего (например, человека). Композиции настоящего изобретения полезны для лечения воспалительных заболеваний у млекопитающего (например, человека).
Настоящее изобретение относится к способу ингибирования аномального клеточного роста или лечения гиперпролиферативного расстройства у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или композиции, содержащей указанное соединение, как таковых или в комбинации со вторым химиотерапевтическим средством.
Настоящее изобретение относится к способу лечения воспалительного заболевания у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или композиции, содержащей указанное соединение, как таковых или в комбинации со вторым противовоспалительным средством.
Настоящее изобретение относится к способу применения соединений настоящего изобретения для диагностики in vitro, in situ и in vivo или обработки клеток млекопитающего, лечения организмов или ассоциированных патологических состояний.
Подробное описание примеров вариантов осуществления
Теперь будут подробно описаны некоторые варианты осуществления изобретения, примеры которых поясняются прилагаемыми структурами и формулами. Хотя изобретение будет описано в связи с приведенными вариантами осуществления, следует иметь в виду, что не предполагается ограничение изобретения указанными вариантами осуществления. Напротив, предполагается, что изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения, как определено в формуле изобретения. Специалист в данной области техники сможет представить многие способы и материалы, схожие или равнозначные описанным в данном описании, которые можно использовать при практическом осуществлении настоящего изобретения. Настоящее изобретение никоим образом не ограничивается описанными способами и материалами. В случае когда одна или несколько из включенных в описание литературных ссылок, патентов и подобных материалов отличаются или вступают в противоречие с данным описанием, включая, но без ограничения, определенные термины, применение терминов, описанные методы или подобное, это регулирует данное описание.
Определения
Термин «алкил», используемый в данном описании, относится к насыщенному линейному или разветвленному одновалентному углеводородному радикалу с одним-двенадцатью атомами углерода. Примеры алкильных групп включают, но не ограничиваются ими, метил (Ме, -СН3), этил (Et, -CH2CH3), 1-пропил (н-Pr, н-пропил, -СН2СН2СН3), 2-пропил (изо-Pr, изопропил, -СН(СН3)2), 1-бутил (н-Bu, н-бутил, -СН2СН2СН2СН3), 2-метил-1-пропил (изо-Bu, изобутил, -СН2СН(СН3)2), 2-бутил (втор-Bu, втор-бутил, -СН(СН3)СН2СН3), 2-метил-2-пропил (трет-Bu, трет-бутил, -С(СН3)3), 1-пентил (н-пентил, -СН2СН2СН2СН2СН3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-СН(СН2СН2)2), 2-метил-2-бутил (-С(СН3)2СН2СН3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-СН2СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-СН(СН2СН3)(СН2СН2СН3)), 2-метил-2-пентил (-С(СН3)2СН2СН2СН3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (-СН(СН3)СН2СН(СН3)2), 3-метил-3-пентил (-С(СН3)(СН2СН3)2), 2-метил-3-пентил (-СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-диметил-2-бутил (-СН(СН3)С(СН3)3), 1-гептил, 1-октил и т.п.
Термин «алкенил» относится к линейному или разветвленному одновалентному углеводородному радикалу с двумя-двенадцатью атомами углерода по меньшей мере с одним сайтом ненасыщенности, т.е. углерод-углеродной двойной связью sp2, где алкенильный радикал включает радикалы, имеющие ориентацию «цис» и «транс», или, альтернативно, ориентацию “E” и “Z”. Примеры включают, но не ограничиваются ими, этиленил или винил (-СН=СН2), аллил (-СН2СН=СН2) и т.п.
Термин «алкинил» относится к линейному или разветвленному одновалентному углеводородному радикалу с двумя-двенадцатью атомами углерода по меньшей мере с одним сайтом ненасыщенности, т.е. углерод-углеродной тройной связью sp. Примеры включают, но не ограничиваются ими, этинил (-СН≡СН), пропинил (пропаргил, -СН2С≡СН) и т.п.
Термины «карбоцикл», «карбоциклил», «карбоциклическое кольцо» и «циклоалкил» относятся к одновалентному неароматическому насыщенному или частично ненасыщенному кольцу с 3-12 атомами углерода как моноциклическому кольцу и 7-12 атомами углерода как бициклическому кольцу. Бициклические карбоциклы с 7-12 атомами могут быть представлены, например, как бицикло [4,5], [5,5], [5,6] или [6,6] система, и бициклические карбоциклы с 9 или 10 атомами в кольце могут быть представлены как бицикло [5,6] или [6,6] система, или как мостиковые системы, такие как бицикло[2.2.1]гептан, бицикло[2.2.2]октан и бицикло[3.2.2]нонан. Примеры моноциклических карбоциклов включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил, циклододецил и т.п.
Термин «арил» означает одновалентный ароматический углеводородный радикал с 6-18 атомами углерода, образованный удалением одного атома водорода от одного атома углерода исходной ароматической кольцевой системы. Некоторые арильные группы представлены в примерах структур как «Ar». Арил включает бициклические радикалы, включающие ароматическое кольцо, конденсированное с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим или гетероциклическим кольцом. Типичные арильные группы включают, но не ограничиваются ими, радикалы, образованные из бензола (фенил), замещенных бензолов, нафталина, антрацена, инденила, инданила, образованные из 1,2-дигидронафталина, 1,2,3,4-тетрагидронафталина и т.п.
Термины «гетероцикл», «гетероциклил» и «гетероциклическое кольцо» используются в данном описании как взаимозаменяемые и относятся к насыщенному или частично ненасыщенному (т.е. с одной или несколькими двойными и/или тройными связями в пределах кольца) карбоциклическому радикалу с 3-18 атомами в кольце, в котором по меньшей мере один атом в кольце представляет собой гетероатом, выбранный из атомов азота, кислорода и серы, причем остальные атомы в кольце являются атомами С, где один или несколько атомов в кольце могут быть необязательно независимо замещены одним или несколькими заместителями, описанными ниже. Гетероцикл может представлять собой моноцикл с 3-7 атомами в кольце (2-6 атомов углерода и 1-4 гетероатома, выбранных их атомов N, O, P и S) или бицикл с 7-10 атомами в кольце (4-9 атомов углерода и 1-6 гетероатомов, выбранных их атомов N, O, P и S), например бицикло[4,5], [5,5], [5,6] или [6,6] систему. Гетероциклы описаны у Paquette Leo A, “Principles of Modern Heterocyclic Chemistry” (W.A. Benjamin, New York, 1968), в частности в главах 1, 3, 4, 6, 7 и 9; в “The Chemistry of Heterocyclic Compounds, A series of Monographs” (John Wiley & Sons, New York, 1950 и до настоящего времени), в частности в томах 13, 14, 16, 19 и 28; и в J. Am. Chem. Soc. (1960), 82: 5566. «Гетероциклил» также включает радикалы, в которых гетероциклические радикалы конденсированы с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим или гетероциклическим кольцом. Примеры гетероциклических колец включают, но не ограничиваются ими, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 2-пирролинил, 3-пирролинил, индолинил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, пиразолидинилимидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил и азабицикло[2.2.2]гексанил. Спирогруппы также входят в объем данного определения. Примерами гетероциклических групп, в которых 2 атома в кольце замещены группами оксо (=О), являются пиримидинонил и 1,1-диоксотиоморфолинил.
Термин «гетероарил» относится к одновалентному ароматическому радикалу 5- или 6-членных колец и включает конденсированные циклические системы (по меньшей мере, один из которых является ароматическим) с 5-18 атомами, содержащему один или несколько гетероатомов, независимо выбранных из атомов азота, кислорода и серы. Примерами гетероарильных групп являются пиридинил (включая, например, 2-гидроксипиридинил), имидазолил, имидазопиридинил, пиримидинил (включая, например, 4-гидроксипиримидинил), пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензооксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил.
Гетероциклические или гетероарильные группы могут присоединяться по атому углерода (углерод-присоединение) или азота (азот-присоединение), где это возможно. Как пример, но не ограничение, присоединяемые по атому углерода гетероциклы или гетероарилы присоединяются в положении 2, 3, 4, 5 или 6 пиридина, положении 3, 4, 5 или 6 пиридазина, положении 2, 4, 5 или 6 пиримидина, положении 2, 3, 5 или 6 пиразина, положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, положении 2, 4 или 5 оксазола, имидазола или тиазола, положении 3, 4 или 5 изоксазола, пиразола или изотиазола, положении 2 или 3 азиридина, положении 2, 3 или 4 азетидина, положении 2, 3, 4, 5, 6, 7 или 8 хинолина или положении 1, 3, 4, 5, 6, 7 или 8 изохинолина.
Как пример, но не ограничение, присоединяемые по атому азота гетероциклы или гетероарилы присоединяются в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1Н-индазола, положении 2 изоиндола или изоиндолина, положении 4 морфолина и положении 9 карбазола или β-карболина.
Термин «галоген» относится к F, Cl, Br или I. Гетероатомы, присутствующие в гетероариле или гетероциклиле, включают окисленные формы, такие как N+→O-, S(O) и S(O)2.
Термины «лечить» и «лечение» относятся как к мерам лечебного свойства, так и к профилактическим или предупредительным мерам, когда у объекта необходимо предотвратить или замедлить (уменьшить) нежелательное физиологическое изменение или расстройство, такое как развитие или распространение рака. Для целей данного изобретения благоприятные или желательные клинические результаты включают, но не ограничиваются ими, смягчение симптомов, снижение степени заболевания, стабилизацию (т.е. отсутствие ухудшения) состояния заболевания, устранение или замедление развития заболевания, уменьшение интенсивности или ослабление болезненного состояния и ремиссию (или частичную или полную), поддающиеся обнаружению или не поддающиеся обнаружению. «Лечение» также может означать более длительную продолжительность существования по сравнению с ожидаемой, если лечение не получают. Нуждающиеся в лечении включают индивидуумов, у которых уже имеется состояние или расстройство, а также предрасположенных к приобретению болезненного состояния или расстройства, или индивидуумов, у которых состояние или расстройство необходимо предупредить.
Выражение «терапевтически эффективное количество» обозначает количество соединения настоящего изобретения, которое (i) лечит или предупреждает определенное заболевание, состояние или расстройство, (ii) облегчает, уменьшает интенсивность или устраняет один или несколько симптомов определенного заболевания, состояния или расстройства или (iii) предупреждает или отдаляет появление одного или нескольких симптомов определенного заболевания, состояния или расстройства, описанных в данном описании. В случае рака терапевтически эффективное количество лекарственного средства может уменьшать число раковых клеток; уменьшать размер опухоли; ингибировать (т.е. ослаблять до некоторой степени и, предпочтительно, останавливать) инфильтрацию раковых клеток в отдаленные органы; ингибировать (т.е. ослаблять до некоторой степени и, предпочтительно, останавливать) метастазирование опухоли; ингибировать до некоторой степени рост опухоли и/или ослаблять до некоторой степени один или несколько симптомов, связанных с раком. По степени, до которой лекарственное средство может предупреждать рост и/или убивать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Эффективность лечения рака можно измерить, например, оценивая время до развития заболевания (ТТР) и/или определяя скорость ответа (RR).
Термины «аномальный клеточный рост» и «гиперпролиферативное заболевание» в данном описании являются взаимозаменяемыми. Термин «аномальный клеточный рост» в данном описании, если не указано иное, относится к клеточному росту, который не зависит от нормальных регулирующих механизмов (например, отсутствие контактного торможения). Указанный термин включает, например, аномальный рост (1) опухолевых клеток (опухолей), которые пролиферируют путем экспрессии мутированной тирозинкиназы или сверхэкспрессии рецепторной тирозинкиназы; (2) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых происходит аберрантная активация тирозинкиназы; (3) любых опухолей, которые пролиферируют за счет рецепторных тирозинкиназ; (4) любых опухолей, которые пролиферируют за счет аберрантной активации серин/треонинкиназы; и (5) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых происходит аберрантная активация серин/треонинкиназы.
Термины «рак» и «раковый» относятся к или описывают физиологическое состояние у млекопитающего, которое конкретно характеризуется нерегулируемым клеточным ростом. «Опухоль» включает одну или несколько раковых клеток. Примеры рака включают, но не ограничиваются ими, карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественности. Более конкретные примеры таких видов рака включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких (“NSCLC”), аденокарциному легких и плоскоклеточную карциному легких, рак брюшины, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, цервикальный рак, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, ректальный рак, эндометриальный рак или рак матки, рак слюнных желез, рак почек, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, анальную карциному, карциному полового члена, острый лейкоз, а также рак головы/головного мозга и рак шеи.
«Химиотерапевтическое средство» представляет собой химическое соединение, используемое при лечении рака. Примеры химиотерапевтических средств включают эрлотиниб (tarceva®, Genetech/OSI Pharm.), бортезомиб (velcade®, Millennium Pharm.), фулвестрант (faslodex®, AstraZeneca), сутент (SU11248, Pfizer), летрозол (femara®, Novartis), мезилат иматиниба (gleevec®, Novartis), РТК787/ZK 222584 (Novartis), оксалиплатин (eloxatin®, Sanofi), 5-FU (5-флуороурацил), лейковорин, рапамицин (сиролимус, rapamune®, Wyeth), лапатиниб (tukerb®, GSK572016, Glaxo Smith Kline), лонафарниб (SCH 66336), сорафениб (BAY43-9006, Bayer Labs) и гефитиниб (iressa®, AstraZeneca), AG1478, AG1571 (SU 5271; Sugen), алкилирующие агенты, такие как тиотепа и циклофосфамид cytoxan®; алкилсульфонаты, такие как бисульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогинины (в частности, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карцелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая его синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотные аналоги горчичного газа, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлортамин, гидрохлорид оксида мехлортамина, мельфалан, новембицин, фенестерин, преднимустин, трофосфамид, uracil mustard; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энединовые антибиотики (например, калихеамицин, в частности, калихеамицин-гамма1I и калихеамицин-омегаI1 (Angew. Chem. Intl. Ed. Engl. (1994), 33: 183-186); динемицин, включая динемицин А; бисфосфонаты, такие как клодронат; эсперамицин; а также хромофор неокарзиностатина и родственные хромофоры хромпротеинэнединовых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, adriamycin® (доксорубицин, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, редорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадренергические средства, такие как аминоглутетимид, митотан, трилостан; средство для пополнения фолиевой кислоты, такое как фролиновая кислота; ацеглатон; гликозид альдофосфамид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазихон; элфонитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лониданин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; полисахаридные комплексы PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазихон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); циклофосфамид; тиотепа; таксоиды, например, taxol® (паклитаксел; Bristol-Myers Squibb Oncology, Princeton, N.J.), abraxane™ (кремофор-фри), нанокомпозиции паклитаксела на основе альбумина (American Pharmaceutical Pertners, Schaumberg, Illinois) и taxotere® (доксетаксел; Rhфne-Poulenc Rorer, Antony, France); хлоранамбуцил; gemzar® (гемцитабин); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; navelbine® (винорелбин); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; капецитабин (xeloda®); ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; и фармацевтически приемлемые соли, кислоты и производные любого из перечисленных выше средств.
В определение «химиотерапевтическое средство» также входят (i) антигормональные средства, которые действуют на опухоли как регулирующие или ингибирующие действие гормонов, такие как антиэстрогены и селективные модуляторы эстрогеновых рецепторов (SERM), включающие, например, тамоксифен (включая nolvadex®; цитрат тамоксифена), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и fareston® (цитрат торемифина); (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующий продуцирование эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглютетимид, megase® (ацетат мегестрола), aromazin® (экземестан; Pfizer), форместани, фадрозол, rivizor® (ворозол), femara® (летрозол, Novartis) и arimidex® (анастрозол; AstraZeneca); (iii) антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (аналог 1,3-диоксоланнуклеозидцитозина); (iv) ингибиторы протеинкиназ; (v) ингибиторы липидкиназ; (vi) антисмысловые олигонуклеотиды, в частности, олигонуклеотиды, ингибирующие экспрессию генов в каскадах передачи сигналов, вовлеченных в аберрантную клеточную пролиферацию, такие как, например, РКС-альфа, Ralf и Н-Ras; (vii) рибозимы, такие как ингибиторы экспрессии VEGF (например, angiozime®), и ингибиторы экспрессии HER2; (viii) вакцины, такие как вакцины для генной терапии, например allovectin®, leuvectin® и vexid®; proleukin® rIL-2; ингибиторы топоизомеразы 1, такие как lurtotecan®, abarelix® rmRH; (ix) антиангиогенные средства, такие как бевацизумаб (avastin®, Genetech); и (х) фармацевтически приемлемые соли, кислоты и производные любого из перечисленных выше средств. Другие антиангиогенные средства включают ингибиторы ММР-2 (металлопротеинкиназа матрикса 2), ингибиторы ММР-9 (металлопротеинкиназа матрикса 9), ингибиторы COX-II (циклооксигеназа II) и ингибиторы тирозинкиназы рецепторов VEGF. Примеры таких используемых ингибиторов металлопротеинкиназ матрикса, которые можно применять в комбинации с соединениями/композициями настоящего изобретения, описаны в WO 96/33172, WO 96/27583, EP 818442, EP 1004578, WO 98/07697, WO 98/03516, WO 98/34918, WO 98/34915, WO 98/33768, WO 98/30566, EP 606046, EP 931788, WO 90/05719, WO 99/52910, WO 99/52889, WO 99/29667, WO 99/07675, EP 945864, патенте США № 5863949, патенте США № 5861510 и ЕР 780386, все из которых включены в данное описание посредством ссылки. Примеры ингибиторов тирозинкиназы рецепторов VEGF включают 4-(4-бром-2-фторанилино)-6-метокси-7-(1-метилпипридин-4-илметокси)хиназолин (ZD6474; пример 2 в WO 01/32651), 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171; пример 240 в WO 00/47212), ваталаниб (РТК787; WO 98/35985) и SU11248 (сунитиниб; WO 01/60814), а такие соединения, как раскрыто в публикации РСТ №№ WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354).
Другие примеры химиотерапевтических средств, которые можно использовать в комбинации с соединениями настоящего изобретения, включают ингибиторы PI3K (фосфоинозитид-3-киназы), такие как описанно у Yaguchi et al. (2006), в Jour. of the Nat. Cancer Inst., 98(8): 545-556; US 7173029; US 7037915; US 6608056; US 6608053; US 6838457; US 6770641; US 6653320; US 6403588; WO 2006/046031; WO 2006/046035; WO 2006/046040; WO 2007/042806; WO 2007/042810; WO 2004/017950; US 2004/092561; WO 2004/007491; WO 2004/006916; W) 2003/037886; US 2003/149074; WO 2003/035618; WO 2003/034997; US 2003/158212; EP 141796; US 2004/053946; JP 2001247477; JP 0817990; JP 08176070; US 6703414 и WO 97/15658, все из которых включены в данное описание посредством ссылки. Конкретные примеры таких ингибиторов PI3K включают SF-116 (ингибитор PI3K, Semafore Pharmaceuticals), BEZ-235 (ингибитор PI3K, Novartis), XL-147 (ингибитор PI3K, Exelixis, Inc.).
Термин «воспалительные заболевания», используемый в данном описании, включает, но не ограничивается ими, ревматоидный артрит, атеросклероз, застойную сердечную недостаточность, воспалительное заболевание кишечника (включая болезнь Крона и неспецифический язвенный колит, и другие заболевания), хроническое обструктивное заболевание легких, фиброзное заболевание печени и почек, болезнь Крона, заболевания кожи, такие как псориаз, экзема и склеродерма, остеоартрит, рассеянный склероз, астму, заболевания и расстройства, связанные с осложнениями при диабете, фиброзную недостаточность в органах, таких как легкие, печень, почки, и осложнения из-за воспаления сердечно-сосудистой системы, такие как острый коронарный синдром.
«Противовоспалительное средство» представляет собой соединение, применимое при лечении воспаления. Примеры противовоспалительных средств включают белковые лекарственные средства для инъекции, такие как Enbrel®, Remicade®, Humira® и Kineret®. Другие примеры противовоспалительных средств включают нестероидные противовоспалительные средства (NSAID), такие как ибупрофен или аспирин (которые снижают опухание и ослабляют боль); модифицирующие заболевание противоревматические лекарственные средства (DMARD), такие как метотрексат; 5-аминосалицилаты (сульфазалазин и средства, не содержащие серу); кортикостероиды; иммуномодуляторы, такие как 6-меркатопутин («6-МР»), азатиоприн (“AZA”), циклоспорины и модификаторы биологических реакций, такие как remicad.RTM. (инфликсимаб) и Enbrel.RTM. (этанерцепт); факторы роста фибробластов; тромбоцитарные факторы роста; ферментные блокаторы, такие как Arava.RTM. (лефлуномид); и/или средство, защищающее хрящевую ткань, такое как гиалуроновая кислота, глюкозамин и хондроитин.
Термин «пролекарство», используемый в данном описании, относится к предшественнику или производному соединения данного изобретения, которое способно активироваться или ферментативно или гидролитически, или превращаться в более активную исходную форму. См., например, Wilman, “Prodrugs in Cancer Chemotherapy”, Biochemical Society Transactions, 14, pp.375-382, 615th Meeting Belfast (1986), и Stella et al., “Prodrugs: A Chemical Approach to Targeted Drug Delivery”, Directed Drug Delivery, Borchardt et al. (ed.), pp.247-267, Humana Press (1985). Пролекарства по данному изобретению включают, но не ограничиваются ими, пролекарства, содержащие сложные эфиры, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, пролекарства на основе модифицированных D-аминокислот, гликозилированные пролекарства, β-лактамсодержащие пролекарства, пролекарства, содержащие необязательно замещенные феноксиацетамиды, пролекарства, содержащие необязательно замещенные фенилацетамиды, 5-фторцитозин и другие пролекарства на основе 5-фторуридинов, которые могут преобразовываться в более активное цитотоксическое свободное лекарственное средство. Примеры цитотоксических лекарственных средств, которые можно преобразовать в форму пролекарства для применения в данном изобретении, включают соединения по данному изобретению и химиотерапевтические средства, такие как описано выше, и другие лекарственные средства.
«Метаболит» представляет собой продукт, полученный при метаболизме в организме определенного соединения или его соли. Метаболиты соединения можно идентифицировать с использованием традиционных методов, известных в данной области, и их активность определяют с использованием испытаний, таких как описано в данном описании. Такие продукты могут быть результатом, например, окисления, гидроксилирования, восстановления, гидролиза, амидирования, деамидирования, этерификации, деэтерификации, ферментативного расщепления и т.п. введенного соединения. Соответственно, изобретение включает метаболиты соединений данного изобретения, включая соединения, полученные способом, включающим контактирование соединения по данному изобретению с организмом млекопитающего в течение времени, достаточного для получения продукта его метаболизма.
«Липосома» представляет собой небольшую везикулу, состоящую из различных типов липидов, фосфолипидов и/или поверхностно-активного вещества, которая применима для доставки лекарственного средства (такого как ингибиторы МЕК, раскрытые в данном описании, и необязательно химиотерапевтического средства) в организм млекопитающего. Компоненты липосом обычно располагаются в два слоя, подобно расположению липидов в биологических мембранах.
Термин «вкладыш в упаковку» используется в отношении инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, в которых содержится информация о показаниях, полезности, дозировке, введении, противопоказаниях и/или предостережениях, касающихся применения таких лечебных продуктов.
Термин «хиральный» относится к молекулам, обладающим свойством невозможности совмещения с соответствующим зеркальным отображением, в то время как термин «ахиральный» относится к молекулам, которые могут совмещаться с соответствующим зеркальным отображением.
Термин «стереоизомер» относится к соединениям, которые имеют идентичный химический состав и связи, но различные ориентации своих атомов в пространстве, которые не могут взаимно превращаться поворотом вокруг простой связи.
Термин «диастереомер» относится к стереоизомеру с двумя или большим числом центров хиральности, молекулы которых не являются зеркальными отображениями друг друга. Диастереомеры имеют различные физические свойства, например температуры плавления, температуры кипения, спектральные свойства и реакционноспособность. Смеси диастереомеров можно разделить аналитическими методами высокого разрешения, такими как кристаллизация, электрофорез и хроматография.
Термин «энантиомеры» относится к двум стереоизомерам соединения, которые являются несовместимыми зеркальными отображениями друг друга.
Стереохимические определения и правила, используемые в данном описании, соответствуют работе S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984), McGraw-Hill Book Company, New York; и Eliel E. and Wilen S., “Stereochemistry of Organic Compounds”, John Wiley & Sons,Inc., New York, 1994. Соединения данного изобретения могут содержать асимметричные или хиральные центры и, следовательно, существовать в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений данного изобретения, включая, но не ограничиваясь ими, диастереомеры, энантиомеры и атропизомеры, а также их смеси, такие как рацемические смеси, образуют часть настоящего изобретения. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскополяризованный свет. При описании оптически активных соединений префиксы D и L, R и S используются для обозначения абсолютной конфигурации молекулы относительно ее хирального(ых) центра(ов). Префиксы d и l или (+) и (-) используются для обозначения знака вращения плоскополяризованного света соединением, причем (-) или l означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Для данной химической структуры такие стереоизомеры являются идентичными, за исключением того, что они являются зеркальными отображениями друг друга. Конкретный стереоизомер также можно отнести к энантиомеру, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 называют рацемической смесью или рацематом, которая может иметь место, когда в химической реакции или процессе отсутствуют стереоселективность или стереоспецифичность. Термины «рацемическая смесь» и «рацемат» относятся к эквимолярной смеси двух энантиомерных видов, лишенной оптической активности.
Термин «таутомер» или «таутомерная форма» относится к структурным изомерам различной энергии, которые могут взаимопреобразовываться через низкий энергетический барьер. Например, протонные таутомеры (также известные как прототропные таутомеры) путем миграции протона вовлекаются во взаимопреобразования, такие как кето-енольная и имино-енаминовая изомеризация. Валентные таутомеры вовлекаются во взаимопреобразования путем реорганизации некоторых связывающих электронов.
Выражение «фармацевтически приемлемая соль», используемое в данном описании, относится к фармацевтически приемлемым органическим или неорганическим солям соединения данного изобретения. Примеры солей включают, но не ограничиваются ими, сульфаты, цитраты, ацетаты, оксалаты, хлориды, бромиды, иодиды, нитраты, бисульфаты, фосфаты, гидрофосфаты, изоникотинаты, лактаты, салицилаты, гидроцитраты, тартраты, олеаты, таннаты, пантотенаты, битартраты, аскорбаты, сукцинаты, малеаты, гентизинаты, фумараты, глюконаты, сахараты, формиаты, бензоаты, глутаматы, метансульфонаты, «мезилаты», этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, памоаты (т.е. 1,1'-метиленбис(2-гидрокси-3-нафтоаты), соли щелочных металлов (например, натрия и калия), соли щелочноземельных металлов (например, магния) и соли аммония. Фармацевтически приемлемая соль может включать включение другой молекулы, такое как ацетат-ион, сукцинат-ион или другой противоион. Противоион может представлять собой органическую или неорганическую частицу, которая стабилизирует заряд на исходном соединении. Более того, фармацевтически приемлемая соль может иметь несколько заряженных атомов в своей структуре. В случаях, когда многозарядные атомы являются частью фармацевтически приемлемой соли, могут иметься несколько противоионов. Следовательно, фармацевтически приемлемая соль может иметь один или несколько заряженных атомов и/или один или несколько противоионов.
Если соединение данного изобретения представляет собой основание, нужную фармацевтически приемлемую соль можно получить любым подходящим способом, доступным в данной области, например обработкой свободного основания неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, метансульфоновая кислота, фосфорная кислота и т.п., или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидильная кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-оксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как п-толуолсульфоновая кислота или этансульфоновая кислота, или подобным соединением.
Если соединение данного изобретения представляет собой кислоту, нужную фармацевтически приемлемую соль можно получить любым подходящим способом, например обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочноземельного металла, или подобным соединением. Характерные примеры подходящих солей включают, но не ограничиваются ими, органические соли, полученные с аминокислотами, такими как глицин и аргинин, аммиаком, первичными, вторичными или третичными аминами и циклическими аминами, такими как пиперидин, морфолин и пеперазин, и неорганические соли, полученные с натрием, кальцием, калием, магнием, марганцем, железом, медью, цинком, алюминием и литием.
Выражение «фармацевтически приемлемый» показывает, что вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, составляющими композицию, и/или организмом млекопитающего, которого подвергают лечению.
Термин «сольват» относится к ассоциации или комплексу одной или нескольких молекул растворителя и соединения данного изобретения. Примеры растворителей, которые образуют сольваты, включают, но не ограничиваются ими, воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин.
Термин «гидрат» относится к комплексу, в котором молекулой растворителя является вода.
Термин «защитная группа» относится к заместителю, который обычно используют для блокировки или защиты определенной функциональной группы в то время, когда в реакцию вступают другие группы соединения. Например, «аминозащитная группа» представляет собой заместитель, присоединяемый к аминогруппе, который блокирует или защищает функциональную аминогруппу соединения. Подходящие аминозащитные группы включают ацетил, трифторацетил, трет-бутоксикарбонил (ВОС), бензилоксикарбонил (CBZ) и 9-флуоренилметиленоксикарбонил (Fmoc). Подобным образом термин «гидроксизащитная группа» относится к заместителю гидроксигруппы, который блокирует или защищает функциональную гидроксигруппу соединения. Подходящие защитные группы включают ацетил и силил. Термин «карбоксизащитная группа» относится к заместителю карбоксигруппы, который блокирует или защищает функциональную карбоксигруппу соединения. Обычные карбоксизащитные группы включают фенилсульфонилэтил, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этоксиметил, 2-(п-толуолсульфонил)этил, 2-(п-нитрофенилсульфенил)этил, 2-(дифенилфосфино)этил, нитроэтил и подобные группы. Общее описание защитных групп и их применение см. в T.W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991.
Термины «соединение по данному изобретению» и «соединения настоящего изобретения» и «соединения формулы I», если не указано иное, включают соединения формулы I и их стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, соли (например, фармацевтически приемлемые соли) и пролекарства.
Настоящее изобретение относится к азабензотиофенильным соединениям формулы I, описанным выше, полезным в качестве ингибиторов киназ, в частности в качестве ингибиторов киназы МЕК. Настоящее изобретение включает соединения формул I-a, I-b, I-c, I-d, I-e, I-f, I-g, I-h, I-i, II-a, II-b, II-c, II-d, II-e, II-f, II-g, II-h, II-i, III-a, III-b, III-c, III-d, III-e, III-f, III-g, III-h и III-i, и все другие переменные имеют значения, указанные для формулы I.

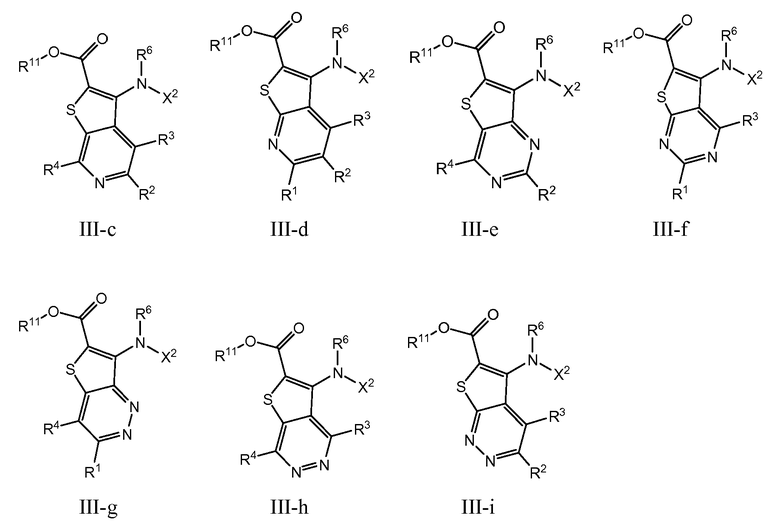
В варианте осуществления настоящего изобретения соединения представляют собой соединения формул I-b, I-f, I-g, I-h, II-b, II-f, II-g, II-h, III-b, III-f, III-g и III-h, и все другие переменные имеют значения, указанные для формулы I.
В варианте осуществления настоящего изобретения соединения представляют собой соединения формулы III-c, и все другие переменные имеют значения, указанные для формулы I.
В варианте осуществления настоящего изобретения R1 представляет собой Н, галоген, CN, CF3, -NR11R12, -OR11, -SR11, -C(=O)NR11R12 или (С1-С6)алкил, и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-d, I-f, I-g, II-a, II-b, II-d, II-f, II-g, III-a, III-b, III-d, III-f или III-g.
В другом варианте осуществления настоящего изобретения R1 представляет собой Н, галоген, CN, CF3, (С1-С6)алкил, -NR11R12, где R11 и R12 независимо представляют собой Н или (С1-С6)алкил, -OR11, где R11 представляет собой Н или (С1-С6)алкил, или -SR11, где R11 представляет собой Н или (С1-С6)алкил; и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-d, I-f, I-g, II-a, II-b, II-d, II-f, II-g, III-a, III-b, III-d, III-f или III-g.
В другом варианте осуществления настоящего изобретения R1 представляет собой Н, Cl, CN, CF3, метил, -NH2, -NH(CH3), -N(CH3)2, -OH или -ОСН3; и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-d, I-f, I-g, II-a, II-b, II-d, II-f, II-g, III-a, III-b, III-d, III-f или III-g.
В еще одном варианте осуществления настоящего изобретения R1 представляет собой Н; и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-d, I-f, I-g, II-a, II-b, II-d, II-f, II-g, III-a, III-b, III-d, III-f или III-g.
В варианте осуществления настоящего изобретения R2 представляет собой Н, галоген, CN, CF3, -NR11R12, -OR11, -SR11, -C(=O)NR11R12 или (С1-С6)алкил, и все другие переменные имеют значения, указанные для формул I, I-a, I-с, I-d, I-е, I-i, II-a, II-с, II-d, II-е, II-i, III-a, III-с, III-d, III-е или III-i, или указанные выше значения.
В другом варианте осуществления настоящего изобретения R2 представляет собой Н, галоген, CN, CF3, (С1-С6)алкил, -NR11R12, где R11 и R12 независимо представляют собой Н или (С1-С6)алкил, -OR11, где R11 представляет собой Н или (С1-С6)алкил, или -SR11, где R11 представляет собой Н или (С1-С6)алкил; и все другие переменные имеют значения, указанные для формул I, I-a, I-с, I-d, I-е, I-i, II-a, II-с, II-d, II-е, II-i, III-a, III-с, III-d, III-е или III-i, или указанные выше значения.
В другом варианте осуществления настоящего изобретения R2 представляет собой Н, Cl, CN, CF3, метил, -NH2, -NH(CH3), -N(CH3)2, -OH или -ОСН3; и все другие переменные имеют значения, указанные для формул I, I-a, I-с, I-d, I-е, I-i, II-a, II-с, II-d, II-е, II-i, III-a, III-с, III-d, III-е или III-i, или указанные выше значения.
В варианте осуществления настоящего изобретения R3 представляет собой Н, галоген, CN, CF3, -NR11R12, -OR11, -SR11, -C(=O)NR11R12 или (С1-С6)алкил, и все другие переменные имеют значения, указанные для формул I, I-a, I-с, I-d, I-е, I-i, II-a, II-с, II-d, II-е, II-i, III-a, III-с, III-d, III-е или III-i, или указанные выше значения.
В другом варианте осуществления настоящего изобретения R3 представляет собой Н, галоген, CF3, (С1-С6)алкил; и все другие переменные имеют значения, указанные для формул I, I-a, I-с, I-d, I-е, I-i, II-a, II-с, II-d, II-е, II-i, III-a, III-с, III-d, III-е или III-i, или указанные выше значения.
В еще одном варианте осуществления настоящего изобретения R3 представляет собой Н, F, CF3 или метил; и все другие переменные имеют значения, указанные для формул I, I-a, I-с, I-d, I-е, I-i, II-a, II-с, II-d, II-е, II-i, III-a, III-с, III-d, III-е или III-i, или указанные выше значения.
В еще одном варианте осуществления настоящего изобретения R3 представляет собой Н, F, Cl, метил или CN; и все другие переменные имеют значения, указанные для формул I, I-a, I-с, I-d, I-е, I-i, II-a, II-с, II-d, II-е, II-i, III-a, III-с, III-d, III-е или III-i, или указанные выше значения.
В варианте осуществления настоящего изобретения R4 представляет собой Н, галоген, CN, CF3, -NR11R12, -OR11, -SR11, -C(=O)NR11R12 или (С1-С6)алкил, и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-с, I-е, I-g, I-h, II-a, II-b, II-с, II-е, II-g, II-h, III-a, III-b, III-с, III-е, III-g или III-h, или указанные выше значения.
В другом варианте осуществления настоящего изобретения R4 представляет собой Н, галоген, CN, CF3, -NR11R12 или -С(=О)NR11R12, где R11 и R12 независимо представляют собой Н или (С1-С6)алкил, -OR11, где R11 представляет собой Н или (С1-С6)алкил, или -SR11, где R11 представляет собой Н или (С1-С6)алкил; и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-с, I-е, I-g, I-h, II-a, II-b, II-с, II-е, II-g, II-h, III-a, III-b, III-с, III-е, III-g или III-h, или указанные выше значения.
В другом варианте осуществления настоящего изобретения R4 представляет собой Н, Br, CN, CF3, -NH2, -NH(CH3), -N(CH3)2, -C(O)NH2, -C(O)NH(CH3), C(O)N(CH3)2, -OH или -ОСН3; и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-с, I-е, I-g, I-h, II-a, II-b, II-с, II-е, II-g, II-h, III-a, III-b, III-с, III-е, III-g или III-h, или указанные выше значения.
В другом варианте осуществления настоящего изобретения R4 представляет собой Н, Br, Cl, CN, CF3, -NH2, -NH(CH3), -N(CH3)2, -C(O)NH2, -C(O)NH(CH3), -C(O)N(CH3)2, -OH или -ОСН3; и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-с, I-е, I-g, I-h, II-a, II-b, II-с, II-е, II-g, II-h, III-a, III-b, III-с, III-е, III-g или III-h, или указанные выше значения.
В другом варианте осуществления настоящего изобретения R4 представляет собой галоген, -ОН или (С1-С6)алкил, необязательно замещенный галогеном, и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-с, I-е, I-g, I-h, II-a, II-b, II-с, II-е, II-g, II-h, III-a, III-b, III-с, III-е, III-g или III-h, или указанные выше значения.
В другом варианте осуществления настоящего изобретения R4 независимо представляет собой Cl, Br, Ме, Et, F, CHF2, CF3 или -OH; и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-с, I-е, I-g, I-h, II-a, II-b, II-с, II-е, II-g, II-h, III-a, III-b, III-с, III-е, III-g или III-h, или указанные выше значения.
В варианте осуществления настоящего изобретения R5 представляет собой Н или (С1-С6)алкил; и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i) или (II-a)-(II-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения R5 представляет собой Н или метил; и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i) или (II-a)-(II-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения R5 представляет собой Н; и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i) или (II-a)-(II-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения R5 представляет собой метил; и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i) или (II-a)-(II-i), или указанные выше значения.
В варианте осуществления настоящего изобретения R6 представляет собой Н или (С1-С6)алкил; и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения R6 представляет собой Н или метил; и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения R6 представляет собой Н; и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения R6 представляет собой метил; и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В варианте осуществления настоящего изобретения Х1 представляет собой OR11 (т.е. формулы (II-a)-(II-i)); и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой OR11, где R11 представляет собой Н; и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой OR11, где R11 представляет собой (С1-С12)алкил (например, (С1-С6)алкил), замещенный одной или несколькими группами, независимо выбранными из галогена, CN, CF3, -OCF3,
-NO2, оксо, -Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16,
-(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17,
-(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17,
-(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17,
-(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
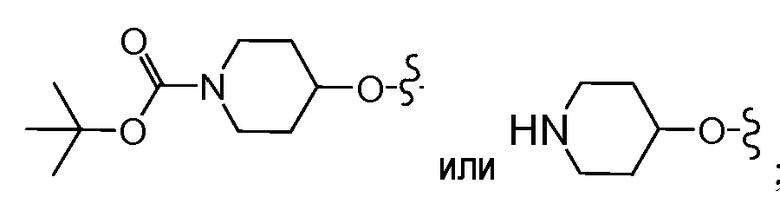
В другом варианте осуществления настоящего изобретения Х1 представляет собой


и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой
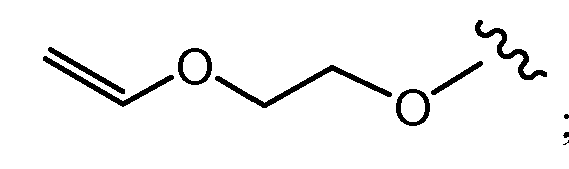
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
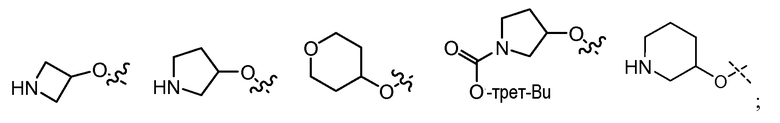
В другом варианте осуществления настоящего изобретения Х1 представляет собой
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой
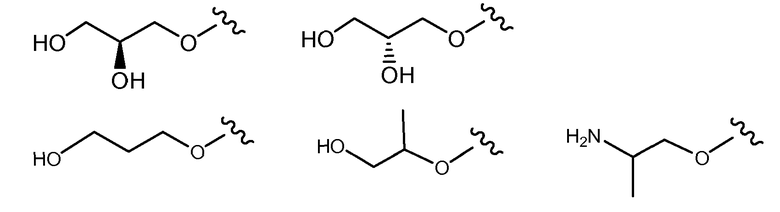
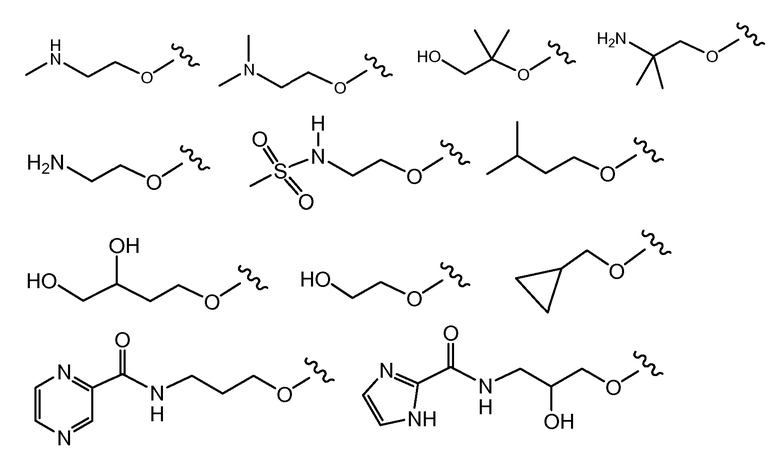
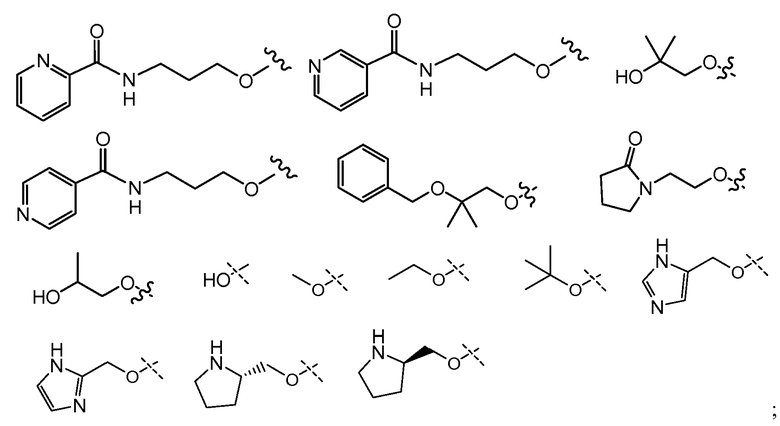
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-I), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой
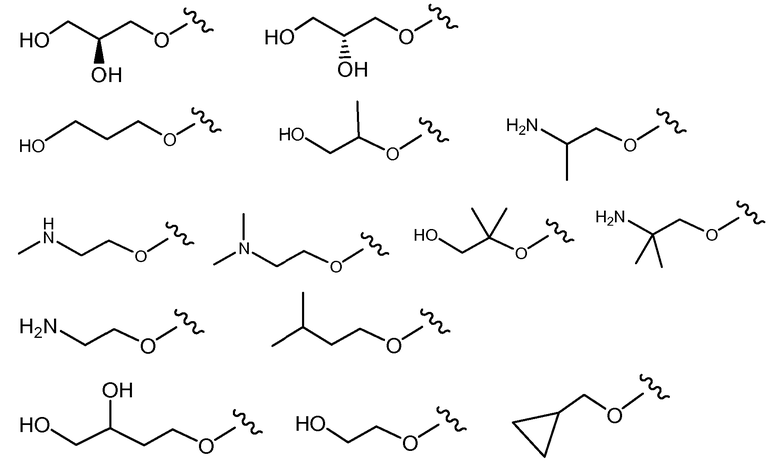
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-I), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой OR11, где R11 представляет собой гетероциклил (например, 4-6-членный гетероциклил), необязательно замещенный одной или несколькими группами, независимо выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -Si(C1-C6)алкила,
-(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17,
-(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16,
-(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17,
-(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16,
-(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21;
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой OR11, где R11 представляет собой 4-6-членный гетероциклил с 1 атомом азота в кольце, где указанный гетероциклил необязательно замещен одной или несколькими группами, независимо выбранными из галогена, CN, CF3, -OCF3,
-NO2, оксо, -Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16,
-(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17,
-(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17,
-(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17,
-(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и
все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
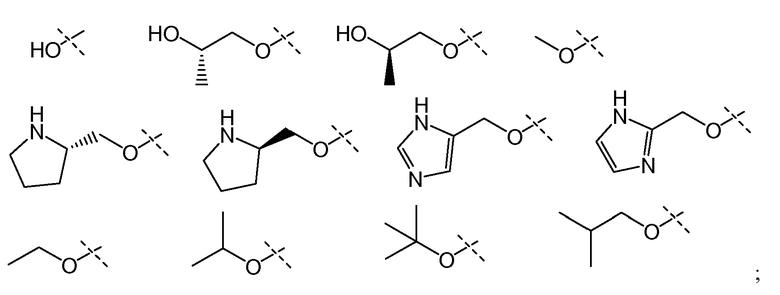
В другом варианте осуществления настоящего изобретения Х1 представляет собой
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой
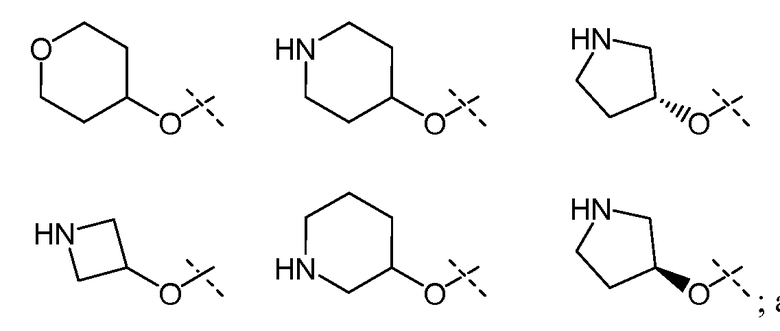
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В варианте осуществления настоящего изобретения Х1 представляет собой R11, и Х1 и R5, взятые вместе с атомом азота, к которому они присоединены, образуют 5-7-членное насыщенное или ненасыщенное кольцо, имеющее 0-2 дополнительных гетероатома, выбранных из атомов O, S и N, где указанное кольцо необязательно замещено одной или несколькими группами, выбранными из галогена,
CN, CF3, -OCF3, -NO2, оксо, -Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17,
-(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17,
-(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17,
-(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и
все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой R11, и Х1 и R5, взятые вместе с атомом азота, к которому они присоединены, образуют 5-6-членное насыщенное кольцо, имеющее 0-2 дополнительных гетероатома, выбранных из атомов O, S и N, где указанное кольцо необязательно замещено одной или несколькими группами, выбранными из галогена, CN, CF3,
-OCF3, -NO2, оксо, -Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16,
-(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17,
-(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17,
-(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17,
-(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и
все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения W представляет собой
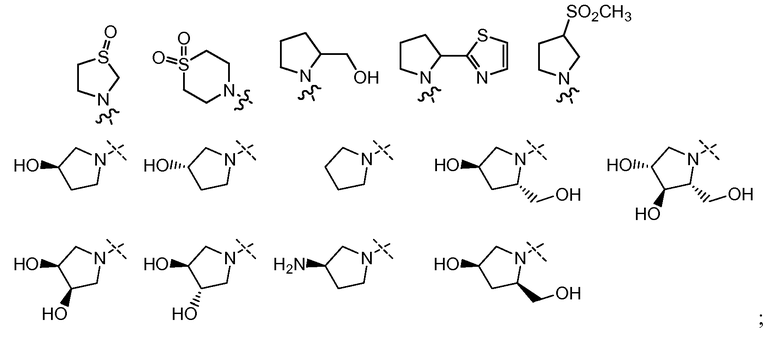
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения W представляет собой
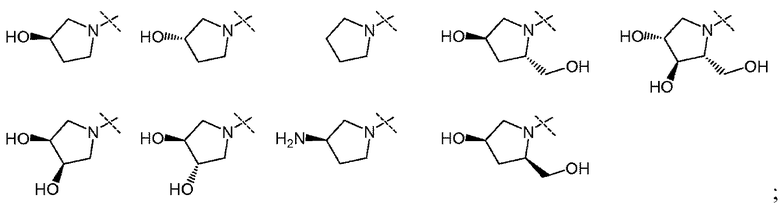
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения W представляет собой
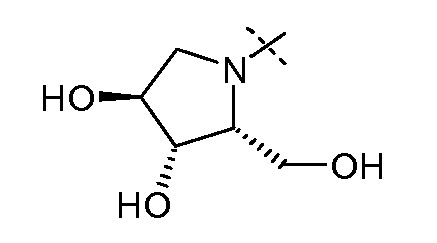 ;
;
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В варианте осуществления настоящего изобретения Х1 представляет собой R11, и Х1 и R5, взятые вместе с атомом азота, к которому они присоединены, образуют 4-членное насыщенное или ненасыщенное кольцо, имеющее 0-1 дополнительный гетероатом, выбранный из атомов O, S и N, где указанное кольцо необязательно замещено одной или несколькими группами, выбранными из галогена,
CN, CF3, -OCF3, -NO2, оксо, -Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16,
-(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17,
-(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17,
-(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17,
-(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и
все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения W представляет собой
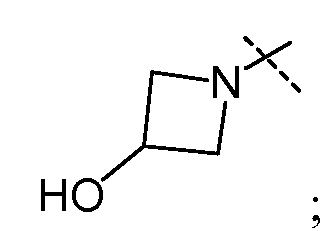
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В варианте осуществления настоящего изобретения Х1 представляет собой -OR11, и -OR11 из Х1 и R5, взятые вместе с атомом азота, к которому они присоединены, образуют 4-7-членное насыщенное или ненасыщенное кольцо, имеющее 0-2 дополнительных гетероатома, выбранных из атомов O, S и N, где указанное кольцо необязательно замещено одной или несколькими группами, выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16,
-(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16,
-(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17,
-(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16,
-(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и
все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой -OR11, и -OR11 из Х1 и R5, взятые вместе с атомом азота, к которому они присоединены, образуют 5-7-членное насыщенное или ненасыщенное кольцо, имеющее 0-2 дополнительных гетероатома, выбранных из атомов O, S и N, где указанное кольцо необязательно замещено одной или несколькими группами, выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо,
-Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16,
-(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16,
-(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17,
-(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16,
-(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и
все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой -OR11, и -OR11 из Х1 и R5, взятые вместе с атомом азота, к которому они присоединены, образуют 5-6-членное насыщенное кольцо, имеющее 0-2 дополнительных гетероатома, выбранных из атомов O, S и N, где указанное кольцо необязательно замещено одной или несколькими группами, выбранными из галогена,
CN, CF3, -OCF3, -NO2, оксо, -Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16,
-(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17,
-(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17,
-(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17,
-(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и
все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения W представляет собой
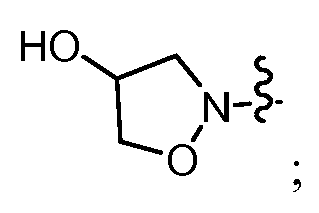
и все другие переменные имеют значения, указанные для формул I или (I-a)-(I-i), или указанные выше значения.
В варианте осуществления настоящего изобретения Х1 представляет собой R11; и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-c, I-d, I-e, I-f, I-g, I-h или I-i, или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой R11, где R11 представляет собой Н; и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-c, I-d, I-e, I-f, I-g, I-h или I-i, или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой R11, где R11 представляет собой (С1-С12)алкил (например, (С1-С6)алкил), замещенный одной или несколькими группами, независимо выбранными из галогена, CN, CF3, -OCF3,
-NO2, оксо, -Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16,
-(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17,
-(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17,
-(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17,
-(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и все
другие переменные имеют значения, указанные для формул I, I-a, I-b, I-c, I-d, I-e, I-f, I-g, I-h или I-i, или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой
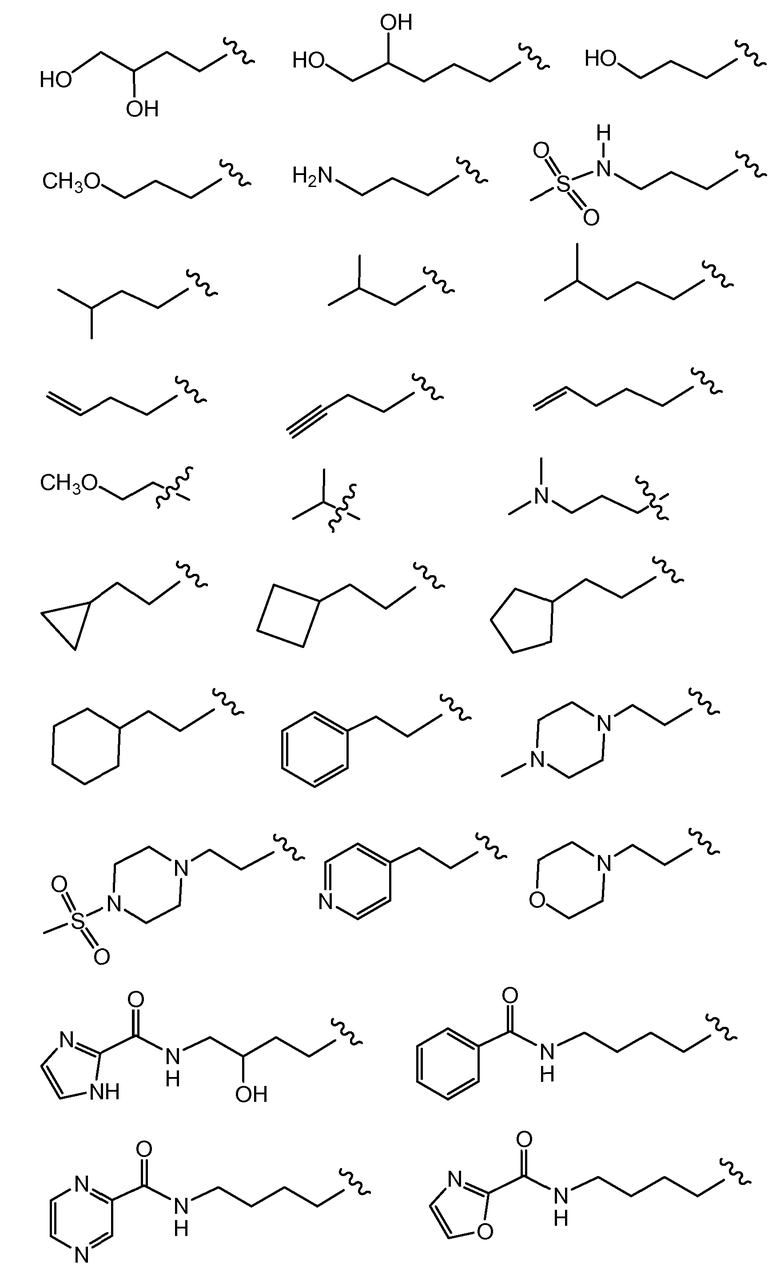
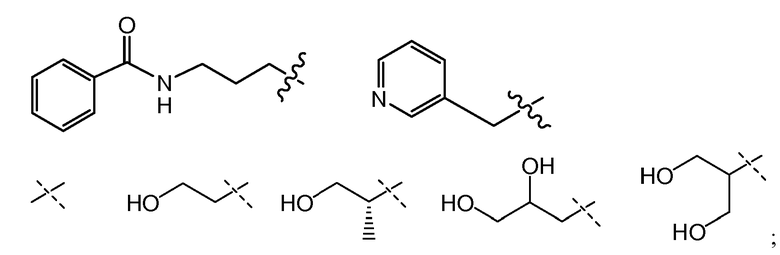
и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-c, I-d, I-e, I-f, I-g, I-h или I-i, или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой
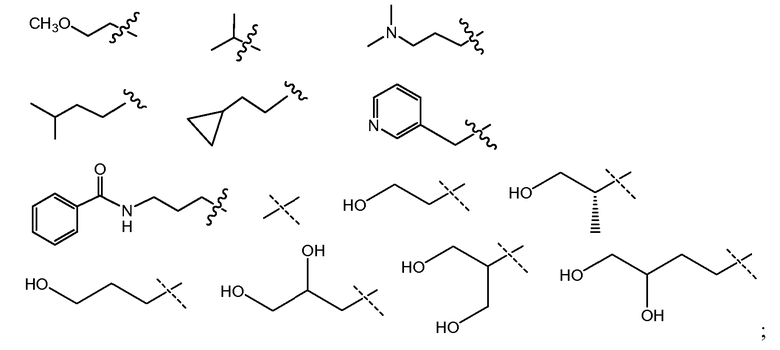
и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-c, I-d, I-e, I-f, I-g, I-h или I-i, или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой -S(O)2R11, и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-c, I-d, I-e, I-f, I-g, I-h или I-i, или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х1 представляет собой -S(O)2R11, где R11 представляет собой Н или метил; и все другие переменные имеют значения, указанные для формул I, I-a, I-b, I-c, I-d, I-e, I-f, I-g, I-h или I-i, или указанные выше значения.
В другом варианте осуществления настоящего изобретения W представляет собой -OR11 (т.е. соединение имеет формулу III-a, III-b, III-c, III-d, III-e, III-f, III-g, III-h или III-i), где R11 W представляет собой Н или (С1-С12)алкил; и все другие переменные имеют указанные выше значения.
В другом варианте осуществления настоящего изобретения W представляет собой -OR11 (т.е. соединение имеет формулу III-a, III-b, III-c, III-d, III-e, III-f, III-g, III-h или III-i), где R11 W представляет собой Н; и все другие переменные имеют указанные выше значения.
В другом варианте осуществления настоящего изобретения W представляет собой -OR11 (т.е. соединение имеет формулу III-a, III-b, III-c, III-d, III-e, III-f, III-g, III-h или III-i), где R11 W представляет собой (С1-С6)алкил; и все другие переменные имеют указанные выше значения.
В варианте осуществления настоящего изобретения Х2 представляет собой арил (например, фенил), где указанный арил необязательно замещен одной или несколькими группами, независимо выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо,
-Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16,
-(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16,
-(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17,
-(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16,
-(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и
все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой
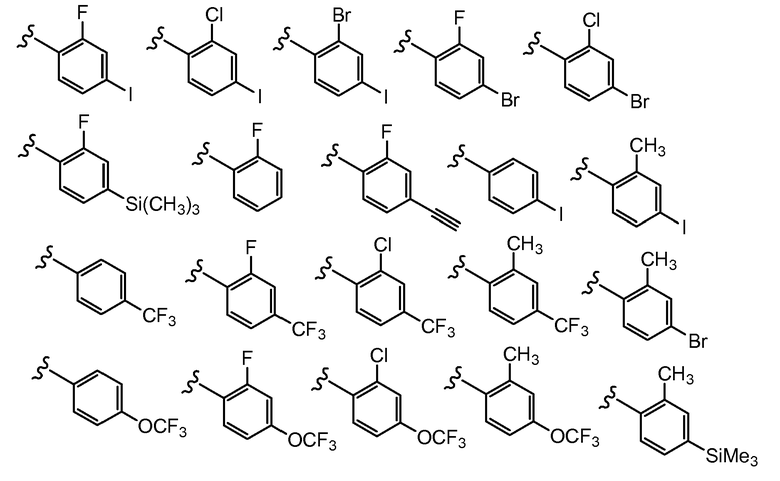
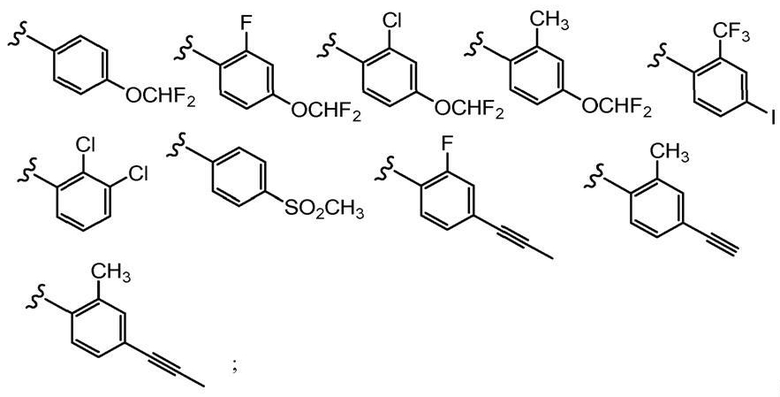
и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой
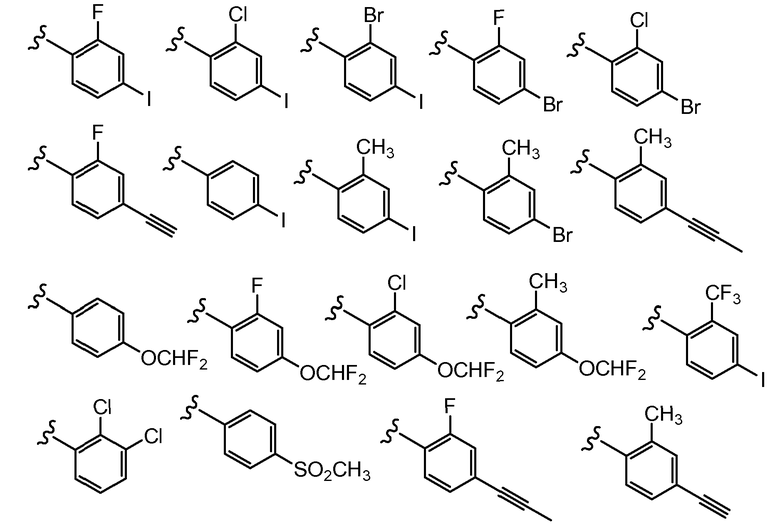
и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой

и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой
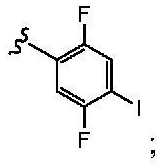
и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой  и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой (С6-С10)арил, замещенный(С1-С4)алкилом; и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой
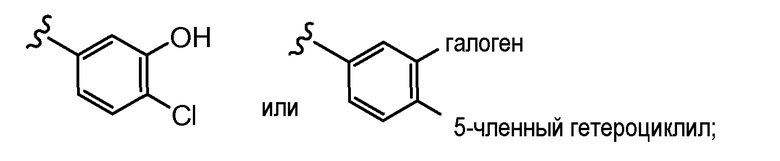
и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой
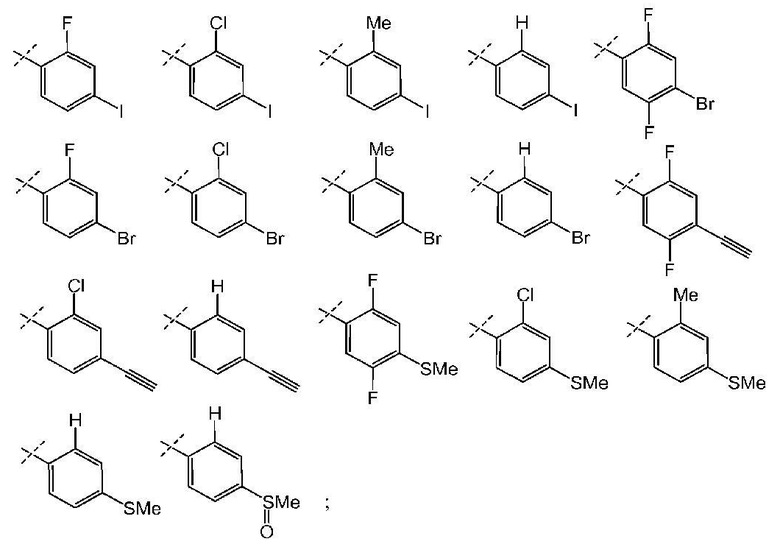
и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой
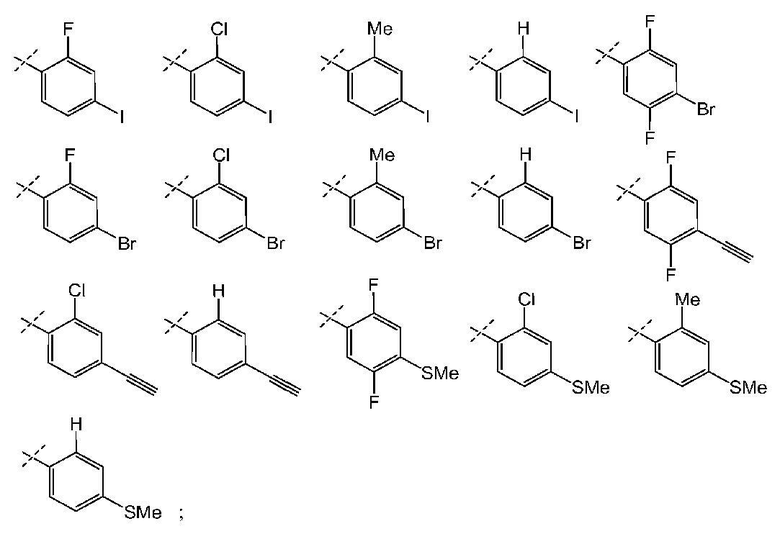
и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой карбоциклил (например, (С4-С6)карбоциклил) или гетероциклил (например, 4-6-членный гетероциклил), где указанный карбоциклил или гетероциклил необязательно замещен одной или несколькими группами, независимо выбранными из галогена, CN, CF3,
-OCF3, -NO2, оксо, -Si(C1-C6)алкила, -(CR19R20)nC(=Y')R16,
-(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17,
-(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17,
-(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17,
-(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16,
-(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16),
-(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17),
-(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17,
-(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16,
-(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и
все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой (С4-С6)карбоциклил, замещенный -C(=Y')R16; и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
В другом варианте осуществления настоящего изобретения Х2 представляет собой

и все другие переменные имеют значения, указанные для формул I, (I-a)-(I-i), (II-a)-(II-i) или (III-a)-(III-i), или указанные выше значения.
Другой вариант осуществления настоящего изобретения включает соединения, описанные в примерах 5-12, и соединения, указанные ниже:


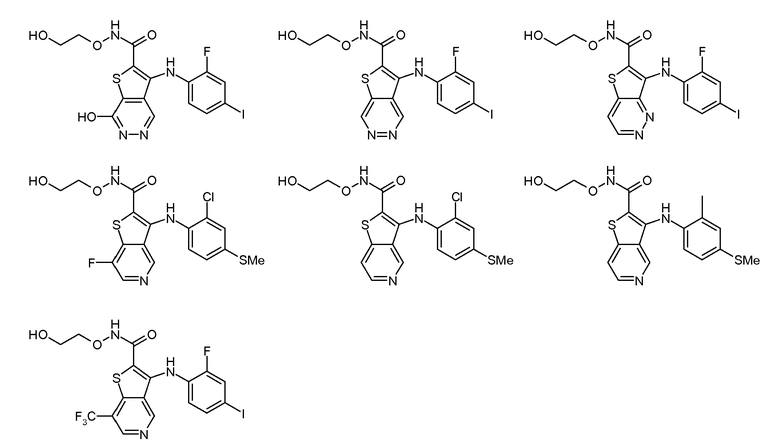
Соединения настоящего изобретения получают по методикам, описанным ниже на схемах и в примерах, или способами, известными в данной области. Исходные вещества и различные промежуточные соединения можно получить из коммерческих источников, получить из коммерчески доступных соединений или получить с использованием хорошо известных синтетических способов (например, способов, описанных в WO 02/06213, WO 03/077855 и WO 03/077914).
Например, 5-азабензотиофены формулы (I-b), (II-b) или (III-b) можно получить с использованием путей синтеза, отображенных на схемах 1, 2 и 3.
Схема 1
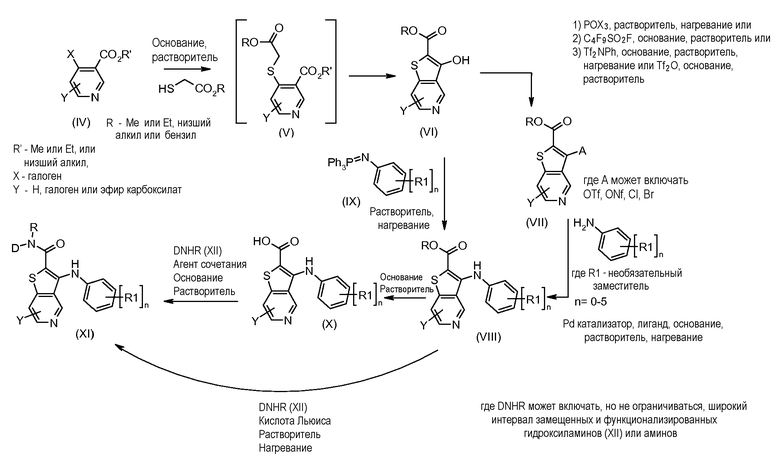
Соединения формулы (IV) можно получить с использованием способов, описанных в литературе. Они могут быть подвергнуты взаимодействию с метилтиогликолятом или этилтиогликолятом в присутствии основания, такого как гидрид натрия, в подходящем растворителе, таком как N,N-диметилформамид или 1,2-диметоксиэтан, при температуре от -50°С до комнатной температуры, с получением соединения формулы (VI).
Соединения формулы (VI) можно преобразовать в соединения формулы (VII) взаимодействием с галогенирующим агентом, таким как оксибромид фосфора, чистым или в подходящем растворителе, таком как толуол, при температуре от комнатной температуры до 140°С. Альтернативно, соединения формулы (VI) можно подвергнуть взаимодействию с нонафторбутансульлфонилфторидом в присутствии основания, такого как диизопропилэтиламин, и катализатора, такого как N,N-диметил-4-аминопиридин, в растворителе, таком как дихлорметан, при комнатной температуре, с N-фенилтрифторметансульфонимидом в присутствии основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как 1,2-диметоксиэтан, при температуре от комнатной температуры до температуры дефлегмации растворителя. Кроме того, соединения формулы (VI) можно обработать ангидридом трифторметансульфоновой кислоты в присутствии основания, такого как пиридин, в растворителе, таком как дихлорметан, при температуре от -20°С до температуры окружающей среды.
Соединения формулы (VIII) можно получить из соединений формулы (VII) взаимодействием с анилином (включающим соответствующие заместители R1) в присутствии катализатора, такого как трис(дибензилиденацетон)дипалладий(0) или ацетат палладия, основания, такого как фосфат калия, трет-бутоксид натрия, 1,8-диазабицикло[5.4.1]ундец-7-ен или карбонат цезия, лиганда, такого как 9,9'-диметил-4,5-бис(дифенилфосфино)ксантен, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил, 2-дициклогексилфосфино-2',6'-(диметокси)бифенил или трибутилфосфин, в подходящем растворителе, таком как толуол, 1,2-диметоксиэтан, тетрагидрофуран или диоксан, при температуре от комнатной температуры до температуры дефлегмации растворителя или при воздействии микроволнового облучения при температуре от 70°С до 150°С.
Альтернативно, соединения формулы (VIII) можно получить из соединений формулы (VI) взаимодействием с соединениями формулы (IX) (полученных с использованием способов, описанных в литературе), в подходящем растворителе, таком как толуол или 1,2-диметоксиэтан, при температуре от комнатной температуры до температуры дефлегмации растворителя или при воздействии микроволнового облучения при температуре от 100°С до 180°С.
Соединения формулы (Х) можно получить из соединений формулы (VIII) взаимодействием с основанием, таким как гидроксид натрия, в протонном растворителе, таком как этанол или метанол, при температуре от комнатной температуры до температуры кипения с обратным холодильником.
Соединения формулы (Х) можно подвергнуть взаимодействию с функционализированным гидроксиламином формулы (XII) (коммерчески доступным или полученным согласно схеме 6) или амином и подходящим агентом сочетания, таким как гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония, гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида или N,N'-дициклогексилкарбодиимид, в присутствии N-гидрокси-1,2,3-бензотриазола, в присутствии подходящего основания, такого как диизопропилэтиламин или триэтиламин, в инертном растворителе, таком как тетрагидрофуран, N,N-диметилформамид или дихлорметан, при примерно комнатной температуре, с получением соединения формулы (XI). Альтернативно, соединения формулы (XI) можно получить непосредственно из соединений формулы (VIII) взаимодействием с амином или гидроксиламином DNHR в присутствии кислоты Льюиса, такой как триметилалюминий, в растворителе, таком как DCM, при температуре от комнатной температуры до температуры кипения с обратным холодильником.
Альтернативно, соединения формулы (VIII) можно получить из соединений формулы (XIII) согласно схеме 2.
Схема 2
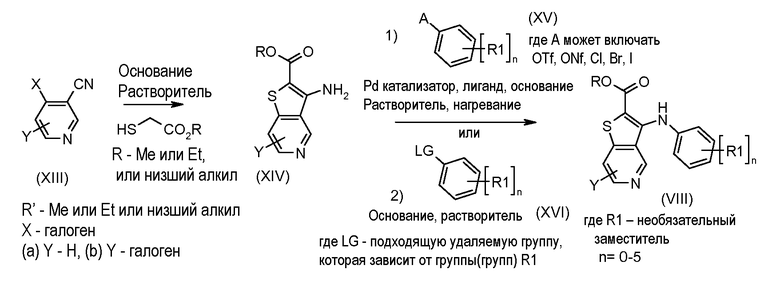
Соединения формулы (XIII) можно получить с использованием способов, описанных в литературе. Соединения общей формулы (XIV) можно получить из соединений формулы (XIII) с использованием способов, описанных выше для получения соединений формулы (VI) из соединений формулы (IV).
Соединения формулы (VIII) можно получить из соединений формулы (XIV) взаимодействием с соединениями формулы (XV) (включающими соответствующие заместители R1) с использованием способов, описанных выше для получения соединений формулы (VIII) из соединений формулы (VI). Альтернативно, соединения формулы (VIII) можно получить из соединений формулы (XIV) взаимодействием с соединениями формулы (XVI) (включающими соответствующие заместители R1) в присутствии основания, такого как гидрид натрия или гексаметилдисилазан лития, в подходящем растворителе, таком как тетрагидрофуран или N,N-диметилформамид, при температуре от комнатной температуры до 150°С.
Альтернативно, соединения формулы (Х) также можно получить из соединений формулы (VII) согласно схеме 3.
Схема 3
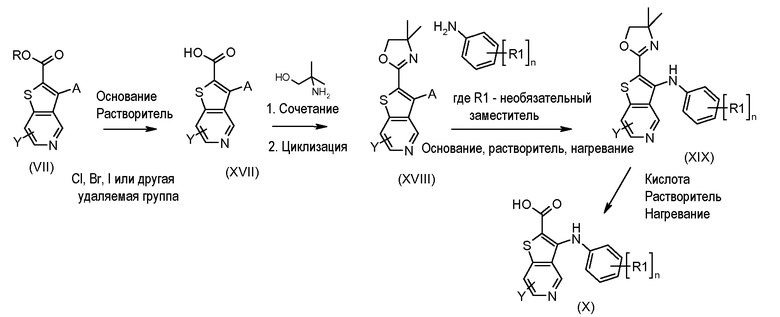
Соединения формулы (VII) можно преобразовать в соединения формулы (XVII) с использованием способов, описанных выше для получения соединений формулы (Х) из соединений формулы (VIII). Соединения формулы (XVII) можно подвергнуть реакции сочетания с аминами, такими как 2-амино-2-метил-1-пропанол, с использованием способов, описанных выше для получения соединений формулы (XI) из соединений формулы (Х), с последующим взаимодействием с таким агентом, как тионилхлорид или оксихлорид фосфора, чистым или в подходящем растворителе, таком как дихлорметан, хлороформ или диэтиловый эфир, при температуре от комнатной температуры до температуры дефлегмации растворителя, с получением соединений формулы (XVIII).
Соединения формулы (XIX) можно получить из соединений формулы (XVIII) взаимодействием с анилином (включающим соответствующие заместители R1) в присутствии катализатора, такого как трис(дибензилиденацетон)дипалладий(0) или ацетат палладия, основания, такого как фосфат калия, трет-бутоксид натрия, 1,8-диазабицикло[5.4.1]ундец-7-ен или карбонат цезия, лиганда, такого как 9,9'-диметил-4,5-бис(дифенилфосфино)ксантен, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил, 2-дициклогексилфосфино-2',6'-(диметокси)бифенил или трибутилфосфин, в подходящем растворителе, таком как толуол, 1,2-диметоксиэтан, тетрагидрофуран или диоксан, при температуре от комнатной температуры до температуры дефлегмации растворителя или при воздействии микроволнового облучения при температуре от 70°С до 150°С.
Альтернативно, соединения формулы (XIX) можно получить из соединений формулы (XVIII) взаимодействием с анилинами (включающими соответствующие заместители R1) в присутствии основания, такого как гидрид натрия или гексаметилдисалазан лития, в подходящем растворителе, таком как тетрагидрофуран или N,N-диметилформамид, при температуре от комнатной температуры до 150°С. Соединения формулы (X) можно получить из соединений формулы (XIX) взаимодействием с кислотой, такой хлористый водород или уксусная кислота, в подходящем растворителе, таком как вода, при температуре от комнатной температуры до температуры дефлегмации растворителя.
6-Азабензотиофены формулы I-c, II-c или III-c можно получить с использованием путей синтеза, отображенных на схеме 4.
Схема 4
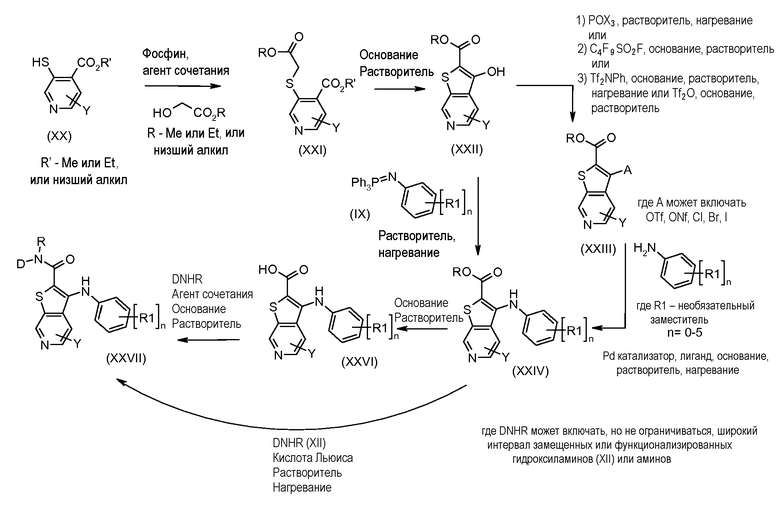
Соединения формулы (ХХ) можно получить с использованием способов, описанных в литературе. Они могут быть подвергнуты взаимодействию с метилгликолятом или этилгликолятом в присутствии фосфина, такого как трифенилфосфин, алкилкарбоксилата, такого как диэтилазодикарбоксилат или диизопропилазодикарбоксилат, в апротонном растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от комнатной температуры до температуры дефлегмации растворителя, с получением соединений формулы (XXI).
Соединения формулы (XXI) можно подвергнуть взаимодействию в присутствии основания, такого как гидрид натрия, в подходящем растворителе, таком как N,N-диметилформамид или 1,2-диметоксиэтан, при температуре от -50°С до комнатной температуры, с получением соединений формулы (XXII).
Соединения формулы (XXII) можно преобразовать в соединения формулы (XXIII) взаимодействием с галогенирующим агентом, таким как оксибромид фосфора, чистым или в подходящем растворителе, таком как толуол, при температуре от комнатной температуры до 140°С. Альтернативно, соединения формулы (XXII) можно подвергнуть взаимодействию с нонафторбутансульфонилфторидом в присутствии основания, такого как диизопропилэтиламин, и катализатора, такого как N,N-диметил-4-аминопиридин, в растворителе, таком как дихлорметан, при комнатной температуре, с N-фенилтрифторметансульфонимидом в присутствии основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как 1,2-диметоксиэтан, при температуре от комнатной температуры до температуры дефлегмации растворителя. Кроме того, соединения формулы (VI) можно обработать ангидридом трифторметансульфоновой кислоты в присутствии основания, такого как пиридин, в растворителе, таком как дихлорметан, при температуре от -20°С до температуры окружающей среды.
Соединения формулы (XXIV) можно получить из соединений формулы (XXIII) взаимодействием с анилином (включающим соответствующие заместители R1) в присутствии катализатора, такого как трис(дибензилиденацетон)дипалладий(0) или ацетат палладия, основания, такого как фосфат калия, трет-бутоксид натрия, 1,8-диазабицикло[5.4.1]ундец-7-ен или карбонат цезия, лиганда, такого как 9,9'-диметил-4,5-бис(дифенилфосфино)ксантен, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил, 2-дициклогексилфосфино-2',6'-(диметокси)бифенил или трибутилфосфин, в подходящем растворителе, таком как толуол, 1,2-диметоксиэтан, тетрагидрофуран или диоксан, при температуре от комнатной температуры до температуры дефлегмации растворителя или при воздействии микроволнового облучения при температуре от 70°С до 150°С.
Альтернативно, соединения формулы (XXIV) можно получить из соединений формулы (XXII) взаимодействием с соединениями формулы (IX) (полученными с использованием способов, описанных в литературе), в подходящем растворителе, таком как толуол или 1,2-диметоксиэтан, при температуре от комнатной температуры до температуры дефлегмации растворителя или при воздействии микроволнового облучения при температуре от 100°С до 180°С.
Соединения формулы (XXVI) можно получить из соединений формулы (XXIV) взаимодействием с основанием, таким как гидроксид натрия, в протонном растворителе, таком как этанол или метанол, при температуре от комнатной температуры до температуры кипения с обратным холодильником.
Соединения формулы (XXVI) можно подвергнуть взаимодействию с функционализированным гидроксиламином формулы (XII) (коммерчески доступным или полученным согласно схеме 6) или амином и подходящим агентом сочетания, таким как гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония, гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида или N,N'-дициклогексилкарбодиимид, в присутствии N-гидрокси-1,2,3-бензотриазола, в присутствии подходящего основания, такого как диизопропилэтиламин или триэтиламин, в инертном растворителе, таком как тетрагидрофуран, N,N-диметилформамид или дихлорметан, при примерно комнатной температуре, с получением соединений формулы (XXVIII). Альтернативно, соединения формулы (XXVI) можно получить непосредственно из соединений формулы (XXIV) взаимодействием с амином или гидроксиламином DNHR в присутствии кислоты Льюиса, такой как триметилалюминий, в растворителе, таком как DCM, при температуре от комнатной температуры до температуры кипения с обратным холодильником.
Тиено[2,3-d]пиримидины формулы I-f, II-f или III-f можно получить с использованием путей синтеза, отображенных на схеме 5.
Схема 5
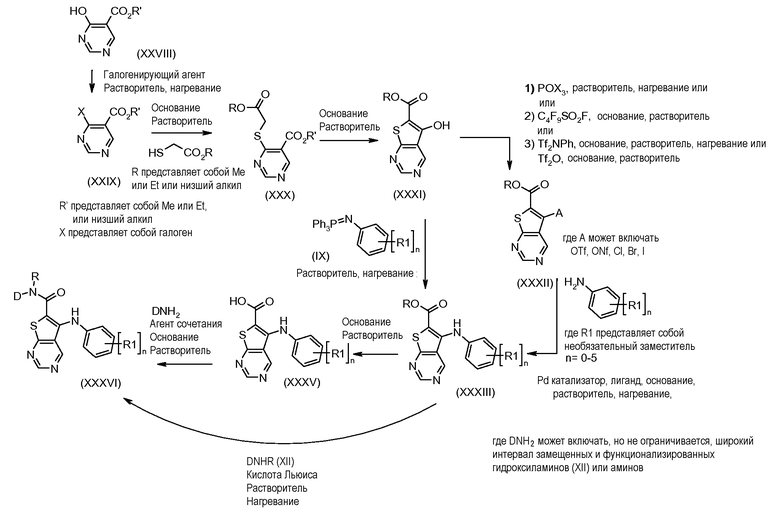
Соединения формулы (XXVIII) можно получить согласно способам, описанным в литературе. Они могут быть подвергнуты взаимодействию с галогенирующим агентом, таким как оксихлорид фосфора, чистым или в подходящем растворителе, таком как толуол, при температуре от комнатной температуры до температуры кипения с обратным холодильником, с получением соединений формулы (XXIX).
Соединения формулы (XXXVI) можно получить из соединений формулы (XXXIX) с использованием способов, описанных для получения соединений формулы (XI) из соединений формулы (IV), как показано на схеме 5.
Гидроксиламины формулы (XII) можно получить с использованием способов, описанных в литературе, или синтетическим путем, отображенным на схеме 6.
Схема 6

Первичные или вторичные спирты общей формулы (XXXVII) можно получить с использованием способов, описанных в литературе. Они могут быть подвергнуты взаимодействию с 1-гидроксифталимидом с использованием фосфина и реагентов сочетания, таких как диэтилазодикарбоксилат, с получением соединений общей формулы (XXXVIII). Из соединений общей формулы (XXXVIII) можно удалить защитную группу с использованием гидразина или метилгидразина и получить гидроксиламины общей формулы (XII-a). Соединения общей формулы (XII-a) можно модифицировать далее восстановительным аминированием с альдегидами или кетонами с использованием восстановителя, такого как триацетоксиборгидрид натрия, цианоборгидрид натрия или боран-пиридин, в растворителе, таком как дихлорэтан, при температуре от температуры окружающей среды до температуры кипения с обратным холодильником. Кроме того, соединения общей формулы (XII-a) можно модифицировать далее алкилированием алкилгалогенидом в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан, с получением гидроксиламинов общей формулы (XII-b).
Анилины общей формулы (XXXIX), используемые в реакциях перекрестного сочетания, описанных выше, можно получить с использованием способов, описанных в литературе, или согласно схеме 7.
Схема 7
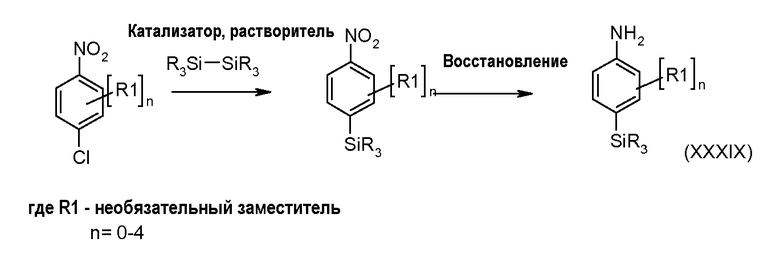
Замещенный 4-хлорнитробензол можно подвергнуть взаимодействию с гексаметилдисиланом в растворителе, таком как ксилол, с использованием катализатора, такого как тетракис(трифенилфосфин)палладий, при температуре от комнатной температуры до температуры кипения с обратным холодильником. Нитрогруппу можно восстановить с использованием способов, описанных в литературе, таких как реакция в атмосфере водорода при давлении от 1 до 5 атмосфер в присутствии катализатора, такого как палладий-на-углероде, и в растворителе, таком как этанол или этилацетат, при комнатной температуре.
Трифторметансульфонильные эфиры общей формулы (XL), используемые в реакциях перекрестного сочетания, описанных выше, можно получить с использованием способов, описанных в литературе, или согласно схеме 8.
Схема 8
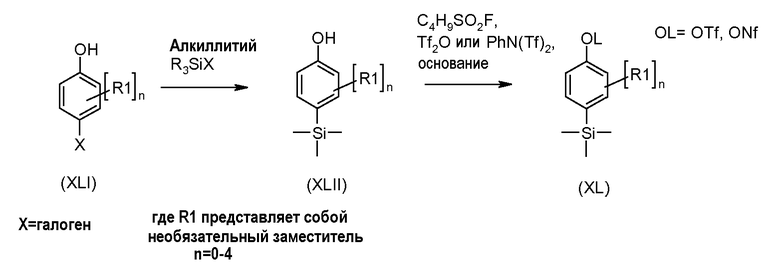
Галогенфенолы общей формулы (XLI) можно подвергнуть взаимодействию с двумя эквивалентами алкиллитиевых реагентов, таких как н-бутиллитий, в растворителе, таком как ТГФ, с последующим гашением триалкилсилилгалогенидом, таким как триметилсилилхлорид, с получением триалкилсилилфенолов (XLII). Затем триалкилсилилфенолы можно подвергнуть взаимодействию с использованием методик, описанных в литературе, с получением трифторметансульфонатов или нонафталатов общей формулы (XL).
Следует иметь в виду, что когда имеются соответствующие функциональные группы, соединения формул (I), (II), (III) или любые промежуточные соединения, используемые при их получении, можно далее дериватизировать одним или несколькими стандартными методами синтеза с использованием реакций замещения, окисления, восстановления или расщепления. Определенные обращения к реакциям замещения включают обычные методы алкилирования, арилирования, гетероарилирования, ацилирования, сульфонилирования, гелогенирования, нитрования, формилирования и сочетания.
Например, арилбромидные или хлоридные группы можно преобразовать в арилиодидные группы с использованием реакции Финкельштейна с использованием источников йода, таких как йодид натрия, катализатора, такого как йодид меди, и лиганда, такого как транс-N,N'-диметил-1,2-циклогександиамин, в растворителе, таком как 1,4-диоксан, при нагревании реакционной смеси до температуры кипения с обратным холодильником. Арилтриалкилсиланы можно преобразовать в арилиодиды обработкой силана источником йода, таким как монохлорид йода, в растворителе, таком как дихлорметан, без или с кислотой Льюиса, такой как тетарфторборат серебра, при температуре от -40°С до температуры кипения с обратным холодильником.
В другом примере первичные аминогруппы (-NH2) можно алкилировать с использованием метода восстановительного алкилирования с использованием альдегида или кетона и боргидрида, например триацетоксиборгидрида натрия или цианоборгидрида натрия, в растворителе, таком как галогенсодержащий углеводород, например, 1,2-дихлорэтан, или спирт, такой как этанол, при необходимости, в присутствии кислоты, такой как уксусная кислота, при температуре окружающей среды. Вторичные аминогруппы (-NH-) можно алкилировать подобным образом с использованием альдегида.
В другом примере первичные или вторичные аминогруппы можно преобразовать в амидные группы (-NHCOR' или -NRCOR') ацилированием. Ацилирования можно достичь взаимодействием с соответствующим хлорангидридом в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан, или взаимодействием с соответствующей карбоновой кислотой в присутствии подходящего агента сочетания, такого как HATU (гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония), в подходящем растворителе, таком как дихлорметан. Подобным образом аминогруппы можно преобразовать в сульфонамидные группы (-NHSO2R' или -NR”SO2R') взаимодействием с соответствующим сульфонилхлоридом в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан. Первичные или вторичные аминогруппы можно преобразовать в карбамидные группы (-NHCONR'R” или -NRCONR'R”) взаимодействием с соответствующим изоцианатом в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан.
Амин (-NH2) можно получить восстановлением нитрогруппы (-NO2), например, каталитическим гидрированием с использованием, например, водорода в присутствии металлического катализатора, например палладия на носителе, таком как уголь, в растворителе, таком как этилацетат или спирт, например, метанол. Альтернативно, преобразование можно осуществить химическим восстановлением с использованием, например, металла, такого как олово или железо, в присутствии кислоты, такой как хлористоводородная кислота.
В другом примере аминогруппы (-CH2NH2) можно получить восстановлением нитрилов (-CN), например, каталитическим гидрированием с использованием, например, водорода в присутствии металлического катализатора, например палладия на носителе, таком как уголь, или никеля Ренея, в растворителе, таком как простой эфир, например, циклический простой эфир, такой как тетрагидрофуран, при температуре от -78°С до температуры дефлегмации растворителя.
В другом примере аминогруппы (-NH2) можно получить из карбоксильных групп (-СО2Н) конверсией в соответствующий ацилазид (-CON3), перегруппировкой Куртиса и гидролизом полученного изоцианата (-N=C=O).
Альдегидные группы (-СНО) можно преобразовать в аминогруппы (-CH2NR'R”) восстановительным аминированием с использованием амина и боргидрида, например триацетоксиборгидрида натрия или цианоборгидрида натрия, в растворителе, таком как галогенсодержащий углеводород, например, дихлорметан, или спирт, такой как этанол, при необходимости, в присутствии кислоты, такой как уксусная кислота, при температуре окружающей среды.
В другом примере альдегидные группы можно преобразовать в алкенильные группы (-CH=CHR'), используя реакцию Виттига или Вадсворса-Эммонса, с использованием соответствующего фосфоната в стандартных условиях, известных специалистам в данной области.
Альдегидные группы можно получить восстановлением сложноэфирных групп (таких как -CO2Et) или нитрилов (-CN) с использованием гидрида диизобутилалюминия в подходящем растворителе, таком как толуол. Альтернативно, альдегидные группы можно получить окислением спиртовых групп с использованием подходящего окислителя, известного специалистам в данной области.
Сложноэфирные группы (-CO2R') можно преобразовать в соответствующие кислотные группы (-СО2Н) катализируемым кислотой или основанием гидролизом, в зависимости от природы R. Если R представляет собой трет-бутил, гидролиз, катализируемый кислотой, можно осуществить, например, обработкой органической кислотой, такой как трифторуксусная кислота, в водном растворителе или обработкой неорганической кислотой, такой как хлористоводородная кислота, в водном растворителе.
Карбоксильные группы (-СО2Н) можно преобразовать в амидные группы (-CONHR' или -CONR'R”) взаимодействием с соответствующим амином в присутствии подходящего агента сочетания, такого как HATU, в подходящем растворителе, таком как дихлорметан.
В другом примере карбоновые кислоты можно подвергнуть гомологенизации на один атом углерода (т.е. от -СО2Н до - СН2СО2Н) конверсией в соответствующий хлорангидрид (-COCl) с последующим синтезом по Арндту-Эйстерту.
В другом примере группы -ОН можно получить из соответствующих сложноэфирных (например, -CO2R') или альдегидных (-СНО) групп восстановлением с использованием, например, металлогидридного комплекса, такого как алюмогидрид лития в диэтиловом эфире или тетрагидрофуране или боргидрид натрия в растворителе, таком как метанол. Альтернативно, можно получить спирт восстановлением соответствующей кислоты (-СО2Н) с использованием, например, алюмогидрида лития в растворителе, таком как тетрагидрофуран, или с использованием борана в растворителе, таком как тетрагидрофуран.
Спиртовые группы можно преобразовать в удаляемые группы, такие как атомы галогена, или сульфонилоксигруппы, такие как алкилсульфонилокси, например, трифторметилсульфонилокси, или арилсульфонилокси, например, п-толуолсульфонилоксигруппа, с использованием условий, известных специалистам в данной области. Например, спирт можно подвергнуть взаимодействию с тионилхлоридом в галогенсодержащем углеводороде (например, дихлорметане), с получением соответствующего хлорида. При взаимодействии также можно использовать основание (например, триэтиламин).
В другом примере спиртовые, фенольные или амидные группы можно алкилировать сочетанием фенола или амида со спиртом в растворителе, таком как тетрагидрофуран, в присутствии фосфина, например трифенилфосфина, и активатора, такого как диэтил-, диизопропил- или диметилазодикарбоксилат. Альтернативно, алкилирование можно осуществить депротонированием с использованием подходящего основания, например гидрида натрия, с последующим добавлением алкилирующего агента, такого как алкилгалогенид.
Ароматические галогенсодержащие заместители в соединениях можно подвергнуть обмену галогена на металл обработкой основанием, например литиевым основанием, таким как н-бутил- или трет-бутиллитий, необязательно при низкой температуре, например, примерно -78°С, в растворителе, таком как тетрагидрофуран, и затем погасить электрофильным соединением для введения нужного заместителя. Так, например, можно ввести формильную группу с использованием в качестве электрофила N,N-диметилформамида. Альтернативно, ароматические галогенсодержащие заместители можно подвергнуть реакциям, катализируемым металлами (например, палладием или медью), для введения, например, кислотных, сложноэфирных, циано-, амидных, арильных, гетероарильных, алкенильных, алкинильных, тио- или аминозаместителей. Подходящие методики, которые можно использовать, включают методики, описанные Хеком, Судзуки, Стилле, Бухвальдом или Хартвигом.
Ароматические галогенсодержащие заместители также можно подвергнуть нуклеофильному замещению, следуя взаимодействию с соответствующим нуклеофилом, таким как амин или спирт. Такое взаимодействие преимущественно можно осуществить при повышенной температуре при наличии микроволнового облучения.
Соединения настоящего изобретения испытывали на их способность ингибировать активность и активацию МЕК (первичные анализы) и на их биологическое действие на рост клеток (вторичные анализы), как описано ниже. Соединения, имеющие IC50 менее 10 мкМ (предпочтительнее, менее 5 мкМ, даже предпочтительнее, менее 1 мкМ, наиболее предпочтительно, менее 0,5 мкМ) в анализе активности МЕК в примере 1а или 1b, имеющие IC50 менее 5 мкМ (предпочтительнее, менее 0,1 мкМ, наиболее предпочтительно, менее 0,01 мкМ) в анализе активации МЕК в примере 2, IC50 менее 10 мкМ (предпочтительнее, менее 5 мкМ, наиболее предпочтительно, менее 0,5 мкМ) в анализе клеточной пролиферации МЕК в примере 3, и/или IC50 менее 10 мкМ (предпочтительнее, менее 1 мкМ, наиболее предпочтительно, менее 0,1 мкМ) в анализе фосфорилирования ERK в примере 4, могут быть использованы в качестве ингибиторов МЕК.
Настоящее изобретение относится к композиции (например, фармацевтической композиции), содержащей соединение формулы I (и/или его сольваты и соли) и носитель (фармацевтически приемлемый носитель). Настоящее изобретение также относится к композиции (например, фармацевтической композиции), содержащей соединение формулы I (и/или его сольваты и соли) и носитель (фармацевтически приемлемый носитель), и дополнительно содержащей второе химиотерапевтическое средство и/или второе противовоспалительное средство, такое, как описано в данном описании. Композиции настоящего изобретения полезны для ингибирования аномального клеточного роста или лечения гиперпролиферативного расстройства у млекопитающего (например, человека). Композиции настоящего изобретения также полезны для лечения воспалительных заболеваний у млекопитающего (например, человека).
Соединения и композиции настоящего изобретения также полезны для лечения аутоиммунного заболевания, деструктивного костного расстройства, пролиферативных расстройств, инфекционного заболевания, вирусного заболевания, фиброзного заболевания или нейродегенеративного заболевания у млекопитающего (например, человека). Примеры таких заболеваний/расстройств включают, но не ограничиваются ими, диабет и диабетические осложнения, диабетическую ретинопатию, ретролетальную фиброплазию, связанную с возрастом дегенерацию желтого пятна, гемангиому, идиопатический фиброз легких, ринит и атопический дерматит, болезнь почек и почечную недостаточность, поликистозную болезнь почек, застойную сердечную недостаточность, нейрофиброматоз, отторжение трансплантата органа, кахексию, удар, септический шок, сердечную недостаточность, болезнь Альцгеймера, хроническую или невропатическую боль и вирусные инфекции, такие как ВИЧ, вирус гепатита В (HBV), вирус папилломы человека (HPV), цитомегаловирус (CMV) и вирус Эпштейна-Барр (EBV). Хроническая боль для целей настоящего изобретения включает, но не ограничивается ими, идиопатическую боль и боль, связанную с хроническим алкоголизмом, витаминной недостаточностью, уремией, гипотиреозом, воспалением, артритом, и послеоперационную боль. Невропатическая боль ассоциируется с рядом состояний, которые включают, но не ограничиваются ими, воспаление, послеоперационную боль, фантомную боль, боль от ожога, подагру, тригеминальную невралгию, острую герпетическую и постгерпетическую боль, каузалгию, диабетическую невропатию, авульсию сплетения, неврому, васкулит, вирусную инфекцию, размозжение, повреждение сдавливания, повреждение ткани, ампутацию конечности, артритную боль и повреждение нервов между периферической нервной системой и центральной нервной системой.
Соединения и композиции настоящего изобретения также полезны для лечения панкреатита или болезни почек (включая пролиферативный гломерулонефрит и вызванное диабетом заболевание почек) у млекопитающего (например, человека).
Соединения и композиции настоящего изобретения также полезны для предупреждения имплантации бластоцита у млекопитающего (например, человека).
Настоящее изобретение относится к способу ингибирования аномального клеточного роста или лечения гиперпролиферативного расстройства у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции. Настоящее изобретение также относится к способу лечения воспалительного заболевания у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции.
Настоящее изобретение относится к способу ингибирования аномального клеточного роста или лечения гиперпролиферативного расстройства у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции в комбинации со вторым химиотерапевтическим средством, таким, как описано в данном описании. Настоящее изобретение также относится к способу лечения воспалительного заболевания у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции в комбинации со вторым противовоспалительным средством, таким, как описано в данном описании.
Настоящее изобретение относится к способу лечения аутоиммунного заболевания, деструктивного костного расстройства, пролиферативных расстройств, инфекционного заболевания, вирусного заболевания, фиброзного заболевания или нейродегенеративного заболевания у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции, а также необязательно второго терапевтического средства. Примеры таких заболеваний/расстройств включают, но не ограничиваются ими, диабет и диабетические осложнения, диабетическую ретинопатию, ретролетальную фиброплазию, связанную с возрастом дегенерацию желтого пятна, гемангиому, идиопатический фиброз легких, ринит и атопический дерматит, заболевания почек и почечную недостаточность, поликистозную болезнь почек, застойную сердечную недостаточность, нейрофиброматоз, отторжение трансплантата органа, кахексию, удар, септический шок, сердечную недостаточность, болезнь Альцгеймера, хроническую или невропатическую боль и вирусные инфекции, такие как ВИЧ, вирус гепатита В (HBV), вирус папилломы человека (HPV), цитомегаловирус (CMV) и вирус Эпштейна-Барра (EBV).
Настоящее изобретение относится к способу лечения панкреатита или заболевания почек (включая пролиферативный гломерулонефрит и вызванное диабетом заболевание почек) у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции, а также необязательно второго терапевтического средства.
Настоящее изобретение относится к способу предупреждения имплантации бластоцита у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции, а также необязательно включающему введение второго терапевтического средства.
Настоящее изобретение относится к способу применения соединений настоящего изобретения in vitro, in situ и in vivo для диагностики или лечения клеток млекопитающего, организмов или ассоциированных патологических состояний.
Также предполагается, что соединения настоящего изобретения могут придать аномальным клеткам большую чувствительность к лечению облучением для целей уничтожения и/или ингибирования роста таких клеток. Соответственно, данное изобретение также относится к способу сенсибилизации аномальных клеток у млекопитающего (например, человека) к лечению облучением, включающему введение указанному млекопитающему количества соединения формулы I (и/или его сольватов и солей) или его композиции, эффективного для сенсибилизации аномальных клеток к лечению облучением.
Введение соединений настоящего изобретения (далее в данном описании «активного(ых) соединения(й)») можно осуществлять любым способом, который обеспечивает доставку соединений в место действия. Такие способы включают пероральные пути, интрадуоденальные пути, парентеральную инъекцию (включая внутривенную, подкожную, внутримышечную, интраваскулярную инъекцию или инфузию), местные пути, ингаляцию и ректальное введение.
Количество вводимого активного соединения будет зависеть от субъекта, которого подвергают лечению, тяжести расстройства или состояния, способа введения, размещения соединения и выбора и предписаний лечащего врача. Однако эффективная дозировка находится в интервале примерно от 0,001 до примерно 100 мг на кг массы тела в сутки, предпочтительно, примерно от 1 до примерно 35 мг/кг/сутки, в однократной дозе или разделенных дозах. Для человека массой 70 кг это может представлять количество примерно 0,05-7 г/сутки, предпочтительно, примерно от 0,05 до примерно 2,5 г/сутки. В некоторых случаях адекватными могут быть дозы ниже нижнего предела вышеуказанного интервала, в то время как в других случаях можно использовать еще более высокие дозы без появления какого-либо вредного побочного действия, при условии, что такие более высокие дозы сначала делятся на несколько небольших доз для введения в течение суток.
Активное соединение можно применять как единственную терапию или в комбинации с одним или несколькими химиотерапевтическими средствами, например, средствами, описанными в данном описании. Такого комбинированного лечения можно достичь посредством одновременного, последовательного или раздельного дозирования отдельных компонентов лечения.
Фармацевтическая композиция может находиться, например, в форме, подходящей для перорального введения в виде таблетки, капсулы, пилюли, порошка, композиций с замедленным высвобождением, раствора, суспензии, для парентеральной инъекции в виде стерильного раствора, суспензии или эмульсии, для наружного введения в виде мази или крема или для ректального введения в виде суппозитория. Фармацевтическая композиция может находиться в единичных дозированных формах, подходящих для однократного введения точных дозировок. Фармацевтическая композиция будет включать обычный фармацевтический носитель или эксципиент и соединение настоящего изобретения в качестве активного ингредиента. Кроме того, композиция может содержать другие лекарственные или фармацевтические средства, носители, адъюванты и т.д.
Примеры форм для парентерального введения включают растворы или суспензии активных соединений в стерильных водных растворах, например водных растворах пропиленгликоля или декстрозы. Такие дозированные формы могут быть забуферены, если это желательно.
Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Фармацевтические композиции могут, если желательно, содержать дополнительные ингредиенты, такие как корригенты, связующие вещества, эксципиенты и подобные компоненты. Так, в случае перорального введения в таблетках, содержащих различные эксципиенты, такие как лимонная кислота, могут также использоваться различные дезинтегранты, такие как крахмал, альгиновая кислота и некоторые сложные силикаты, и связующие вещества, такие как сахароза, желатин и аравийская камедь. Кроме того, для целей таблетирования часто используются лубриканты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также могут использоваться в мягких и твердых наполненных желатиновых капсулах. Поэтому предпочтительные материалы включают лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии или эликсиры, активный компонент в них может быть объединен с различными подслащивающими веществами или корригентами, подкрашивающими веществами или красителями и, если желательно, эмульгаторами или суспендирующими веществами, наряду с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их комбинация.
Способы получения фармацевтических композиций с определенным количеством активного соединения известны или будут очевидны для специалистов в данной области. Например, см. Remington's Pharmaceutical Sciences, Mack Publishing Company, Ester, Pa., 15.sup.th Edition (1975).
Примеры
Аббревиатуры
Общие условия экспериментов
Спектры 1Н ЯМР записывают при температуре окружающей среды с использованием спектрометра Varian Unity Inova (400 МГц) с 5-мм зондом тройного резонанса. Химические сдвиги выражают в м.д. относительно тетраметилсилана. Используются следующие аббревиатуры: уш = уширенный сигнал, с = синглет, д = дублет, дд = двойной дублет, т = триплет, к = квартет, м = мультиплет.
Эксперименты с высокоэффетивной жидкостной хроматографией-масс-спектрометрией (ЖХМС) для определения времени удерживания (RT) и массы ассоциированных ионов осуществляют с использованием одного из следующих способов.
Способ А. Эксперименты осуществляют на квадрупольном масс-спектрометре Waters Micromass ZQ, соединенном с системой ЖХ Hewlett Packard HP1100 с детектором с диодной матрицей. Используют колонку 100×3,0 мм, Higgins Clipeus, C18, 5 мкм, и скорость потока 1 мл/мин. Начальная система растворителей состоит на 95% из воды, содержащей 0,1% муравьиной кислоты (растворитель А), и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты (растворитель В), в течение первой минуты с последующим градиентом до 5% растворителя А и 95% растворителя В в течение следующих 14 минут. Конечную систему растворителей выдерживают постоянной еще в течение 5 минут.
Способ В. Эксперименты осуществляют на квадрупольном масс-спектрометре Waters Platform LC, соединенном с системой ЖХ Hewlett Packard HP1100 с детектором с диодной матрицей и 100-позиционным автоматическим пробоотборником с использованием колонки 30×4,6 мм, Phenomena Luna, C18(2), и скорости потока 2 мл/мин. Система растворителей представляет собой 95% растворителя А и 5% растворителя В в течение первых 0,50 минут с последующим градиентом до 5% растворителя А и 95% растворителя В в течение следующих 4 минут. Конечную систему растворителей выдерживают постоянной еще в течение 0,50 минут.
Эксперименты с микроволновым облучением осуществляют с использованием инициатора Personal Chemistry Emrys Initiator или Optimizer, в которых используются одномодовый резонатор и динамическая настройка поля, и то и другое дают воспроизводимость и регулировку. Можно достичь температуры 40-250°С и поднимать давление до 20 бар.
Пример 1а
Анализ МЕК (анализ активности МЕК)
Конститутивно активированную человеческую мутантную МЕК1, экспрессированную в клетках насекомого, используют в качестве источника ферментативной активности в конечной концентрации в анализе киназы 62,5 нМ.
Анализ осуществляют в течение 30 минут в присутствии 50 мкМ АТФ с использованием в качестве субстрата рекомбинантной GST-ERK1, продуцированной в E. coli. Фосфорилирование субстрата обнаруживают и определяют количественно с использованием реагентов HTRF, поставляемых Cisbio. Реагенты состоят из антител против GST, конъюгированных с аллофикоцианином (XL665), и антител против фосфо(Thr202/Tyr204)-ERK, конъюгированных с европием-криптатом. Антитела против фосфо распознают ERK1, дифосфорилированную по Thr202 и Tyr204. Когда оба вида антител связываются с ERK1 (т.е. когда субстрат фосфорилирован), происходит перенос энергии от криптата к аллофикоцианину после возбуждения при 340 нм, приводящий к излучению флуоресценции, пропорциональному количеству полученного фосфорилированного субстрата. Флуоресценцию обнаруживают с использованием многолуночного флуориметра.
Соединения разводят в ДМСО перед добавлением к буферу для анализа, и конечная концентрация ДМСО в анализе составляет 1%.
IC50 определяют как концентрацию, при которой с данным соединением достигают 50% ингибирования от контроля. Величины IC50 вычисляют с использованием программного обеспечения XLift (версия 2.0.5).
Пример 1b
Анализ МЕК (анализ активности МЕК)
Конститутивно активированную человеческую мутантную МЕК1, экспрессированную в клетках насекомого, используют в качестве источника ферментативной активности в конечной концентрации в анализе киназы 15 нМ.
Анализ осуществляют в течение 30 минут в присутствии 50 мкМ АТФ с использованием в качестве субстрата рекомбинантной GST-ERK1, продуцированной в E. coli. Фосфорилирование субстрата обнаруживают и определяют количественно с использованием реагентов HTRF, поставляемых Cisbio. Реагенты состоят из антител против GST, конъюгированных с аллофикоцианином (XL665), и антител против фосфо(Thr202/Tyr204)-ERK, конъюгированных с европием-криптатом. Их используют в конечной концентрации 4 мкг/мл и 0,84 мкг/мл, соответственно. Антитела против фосфо распознают ERK1, дифосфорилированную по Thr202 и Tyr204. Когда оба вида антител связываются с ERK1 (т.е. когда субстрат фосфорилирован), происходит перенос энергии от криптата к аллофикоцианину после возбуждения при 340 нм, приводящий к излучению флуоресценции, пропорциональному количеству полученного фосфорилированного субстрата. Флуоресценцию обнаруживают с использованием многолуночного флуориметра.
Соединения разводят в ДМСО перед добавлением к буферу для анализа, и конечная концентрация ДМСО в анализе составляет 1%.
IC50 определяют как концентрацию, при которой с данным соединением достигают 50% ингибирования от контроля. Величины IC50 вычисляют с использованием программного обеспечения XLift (версия 2.0.5).
Соединения примеров 5-8 и 10-12 показывают IC50 менее 10 мкМ в анализе, описанном в примере 1а или 1b, большинство из указанных соединений показывают IC50 менее 5 мкМ.
Пример 2
Анализ bRaf (анализ активации МЕК)
Конститутивно активированный мутант bRaf, экспрессированный в клетках насекомого, используют в качестве источника ферментативной активности.
Анализ осуществляют в течение 30 минут в присутствии 200 мкМ АТФ с использованием в качестве субстрата рекомбинантной GST-MEK1, продуцированной в E. coli. Фосфорилирование субстрата обнаруживают и определяют количественно с использованием реагентов HTRF, поставляемых Cisbio. Реагенты состоят из антител против GST, конъюгированных с аллофикоцианином (XL665), и антител против фосфо(Ser217/Ser221)-MEK, конъюгированных с европием-криптатом. Антитела против фосфо распознают MEK, дифосфорилированную по Ser217 и Ser221 или монофосфорилированную по Ser217. Когда оба вида антител связываются с MEK (т.е. когда субстрат фосфорилирован), происходит перенос энергии от криптата к аллофикоцианину после возбуждения при 340 нм, приводящий к излучению флуоресценции, пропорциональному количеству полученного фосфорилированного субстрата. Флуоресценцию обнаруживают с использованием многолуночного флуориметра.
Соединения разводят в ДМСО перед добавлением к буферу для анализа, и конечная концентрация ДМСО в анализе составляет 1%.
IC50 определяют как концентрацию, при которой с данным соединением достигают 50% ингибирования от контроля. Величины IC50 вычисляют с использованием программного обеспечения XLift (версия 2.0.5).
В данном анализе соединения примеров 5-7 и 10 показывают IC50 менее 5 мкМ.
Пример 3
Анализ клеточной пролиферации
Соединения испытывают в анализе клеточной пролиферации с использованием следующих клеточных линий:
НСТ116 - колоректальная карцинома человека (АТСС);
А375 - злокачественная меланома человека (АТСС).
Обе клеточные линии сохраняют в средах DMEM/F12 (1:1) (Gibco) с добавлением 10% FCS при 37°С во влажной камере с 5% СО2.
Клетки высевают в 96-луночные планшеты при 2000 клеток/лунка и через 24 часа их подвергают воздействию различных концентраций соединений в 0,83% ДМСО. Клетки выращивают еще в течение 72 часов и в каждую лунку добавляют равный объем реагента CellTiter (Promega). Это приводит к лизису клеток и генерирует люминесцентный сигнал, пропорциональный количеству высвобожденного АТФ (и, следовательно, пропорциональный числу клеток в лунке), что можно обнаружить с использованием многолуночного люменометра.
EC50 определяют как концентрацию, при которой данным соединением достигается 50% ингибирования от контроля. Величины EC50 вычисляют с использованием программного обеспечения XLift (версия 2.0.5).
В данном анализе соединения примеров 5 и 10 показывают EC50 менее 10 мкМ в любой из клеточных линий.
Пример 4
Анализ на основе клеток с фосфо-ERK
Соединения испытывают в ELISA фосфо-ERK клеток с использованием следующих клеточных линий:
НСТ116 - колоректальная карцинома человека (АТСС);
А375 - злокачественная меланома человека (АТСС).
Обе клеточные линии сохраняют в средах DMEM/F12 (1:1) (Gibco) с добавлением 10% FCS при 37°С во влажной камере с 5% СО2.
Клетки высевают в 96-луночные планшеты при 2000 клеток/лунка и через 24 часа их подвергают воздействию различных концентраций соединений в 0,83% ДМСО. Клетки выращивают еще в течение 2 часов или 24 часов, фиксируют формальдегидом (конечная концентрация 2%) и пропитывают метанолом. После блокировки TBST-3% BSA фиксированные клетки инкубируют с первичными антителами (против кроличьей фосфо-ERK) в течение ночи при 4°С. Клетки инкубируют с йодидом пропидия (флуоресцентный краситель для ДНК) и осуществляют детекцию клеточной p-ERK с использованием антикроличьих вторичных антител, конъюгированных с флуоресцентным красителем Alexa Fluor 488 (молекулярные зонды). Флуоресценцию анализируют с использованием лазерного сканирующего цитометра для микропланшетов Acumen Explorer (TTP Labtech), и сигнал Alexa Fluor 488 нормализуют к сигналу PI (пропорциональному числу клеток).
EC50 определяют как концентрацию, при которой данным соединением достигается прохождение наполовину сигнала между базовой линий и максимальным ответом. Величины EC50 вычисляют с использованием программного обеспечения XLift (версия 2.0.5).
В данном анализе соединения примеров 5 и 10-12 показывают EC50 менее 10 мкМ в любой из клеточных линий.
Пример 5
4-Хлорникотиновая кислота
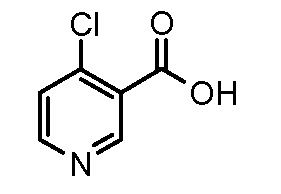
Согласно методике в Guillier et al. (1995), J. Org. chem., 60(2): 292-6, к охлажденному (-78°С) раствору LDA (21 мл, 1,6М в гексане, 33,3 ммоль) в безводном ТГФ (70 мл) в атмосфере аргона добавляют 4-хлорпиридин (5,0 г, 33,3 ммоль). После выдерживания при -78°С в течение 1 часа раствор быстро выливают на слой твердого СО2, содержащегося в 250-мл конической колбе. После того как реакционный раствор нагреется до комнатной температуры, раствор гасят водой (30 мл). Летучие органические растворители удаляют в вакууме и оставшуюся водную суспензию экстрагируют диэтиловым эфиром (3×100 мл). Водную фазу охлаждают до 0°С и доводят рН до 4, добавляя концентрированную хлористоводородную кислоту. Полученный осадок выдерживают в течение 30 минут и затем отделяют фильтрованием. Твердое вещество промывают холодным диэтиловым эфиром (10 мл) с получением указанного в заголовке соединения в виде белого твердого вещества (3,2 г, 61%).
Этил-4-хлорникотинат
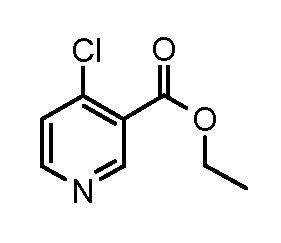
Суспензию 4-хлорникотиновой кислоты (3,0 г, 19,0 ммоль) в тионилхлориде (50 мл) кипятят с обратным холодильником в течение 90 минут. После охлаждения до температуры окружающей среды раствор концентрируют досуха, затем остаток подвергают азеотропной перегонке с толуолом (2×50 мл) с получением твердого вещества. Полученное твердое вещество добавляют по частям к охлажденной (0°С) смеси этанола (25 мл) и DIPEA (15 мл). Реакционную смесь перемешивают при комнатной температуре в течение 4 часов, затем концентрируют в вакууме и добавляют воду (75 мл). Раствор экстрагируют этилацетатом (2×75 мл), затем объединенные органические фазы сушат над сульфатом натрия и затем концентрируют с получением указанного в заголовке соединения в виде коричневого масла (3,3 г, 94%). 1H ЯМР (CDCl3, 400 МГц) 9,03 (c, 1H), 7,58 (д, J=5,4 Гц, 1Н), 7,41 (дд, J=5,4 Гц, 0,5 Гц, 1Н), 4,45 (кв, J=7,3 Гц, 2Н), 1,43 (т, J=7,3 Гц, 3Н).
Этиловый эфир 3-гидрокситиено[3,2-c]пиридин-2-карбоновой кислоты
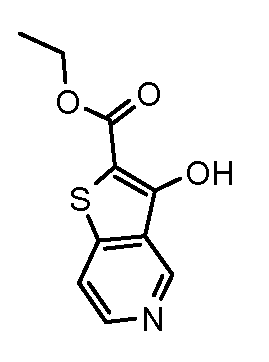
К охлажденному (5°С) раствору этил-4-хлорникотината (1,55 г, 8,4 ммоль) и этилового эфира меркаптоуксусной кислоты (2,6 мл, 23,4 ммоль) в безводном ДМФА (30 мл) при перемешивании в атмосфере аргона добавляют по частям в течение 20 минут гидрид натрия (21,7 ммоль, 60% дисперсия в масле, 868 мг). Перемешивание продолжают при 5°С в течение 10 минут и затем в течение 1,5 часов при комнатной температуре. Затем реакцию гасят, добавляя воду (5 мл), реакционную смесь подкисляют, добавляя уксусную кислоту (1 мл), затем концентрируют и получают остаток. Остаток обрабатывают этилацетатом (150 мл) и водой (100 мл). Слои разделяют и водную фазу экстрагируют DCM (100 мл). Объединенные органические фазы сушат над сульфатом натрия, фильтруют и упаривают с получением твердого вещества. Твердое вещество растирают в смеси диэтиловый эфир:пентан (1:1, 15 мл) с получением указанного в заголовке соединения в виде желтого твердого вещества (1,5 г, 81%). ЖХМС (способ В): RT=2,21 мин, М+Н+=224.
Этиловый эфир 3-(нонафторбутан-1-сульфонилокси)тиено[3,2-c]пиридин-2-карбоновой кислоты
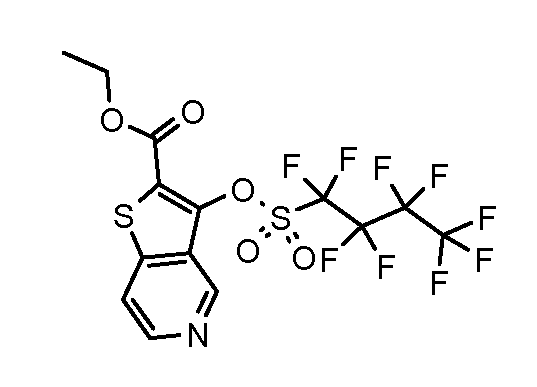
К раствору этилового эфира 3-гидрокситиено[3,2-c]пиридин-2-карбоновой кислоты (1,3 г, 5,82 ммоль) и DMAP (35 мг, 0,29 ммоль) в DCM (10 мл) при перемешивании при 0°С добавляют DIPEA (2,5 мл, 14,0 ммоль) и нонафторбутилсульфонилхлорид (1,36 мл, 7,56 ммоль). Через 10 минут реакционную смесь нагревают до комнатной температуры и перемешивают еще в течение 20 часов. Реакционную смесь разбавляют DCM (50 мл) и промывают водой (30 мл). Органическую фазу отделяют, сушат над сульфатом натрия, фильтруют и упаривают с получением коричневого масла. Масло очищают флэш-хроматографией (Si-SPE, пентан:диэтиловый эфир, градиент от 100:0 до 70:30) с получением указанного в заголовке соединения в виде бесцветного масла, которое кристаллизуется при стоянии (420 мг, 14%). ЖХМС (способ В): RT=4,46 мин, М+Н+=508.
Этиловый эфир 3-(4-бром-2-фторфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты

Дегазированный раствор этилового эфира 3-(нонафторбутан-1-сульфонилокси)тиено[3,2-c]пиридин-2-карбоновой кислоты (206 мг, 1,08 ммоль), 4-бром-2-фторанилина (206 мг, 1,08 ммоль), Pd2dba3 (38 мг, 0,04 ммоль), ксантфоса (48 мг, 0,08 ммоль) и DBU (316 мкл, 2,08 ммоль) в толуоле (1 мл) подвергают воздействию микроволнового облучения при 150°С в течение 10 минут. Реакционную смесь охлаждают до температуры окружающей среды и затем разбавляют этилацетатом (30 мл). Полученный раствор промывают водой (20 мл), сушат над сульфатом натрия и концентрируют в вакууме с получением твердого остатка. Твердый остаток очищают флэш-хроматографией (Si-SPE, пентан:диэтиловый эфир, градиент от 90:10 до 70:30) с получением указанного в заголовке соединения в виде белого твердого вещества (210 мг, 64%). ЖХМС (способ В): RT=3,78 мин, М+Н+=395/397.
Этиловый эфир 3-(2-фтор-4-иодфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты
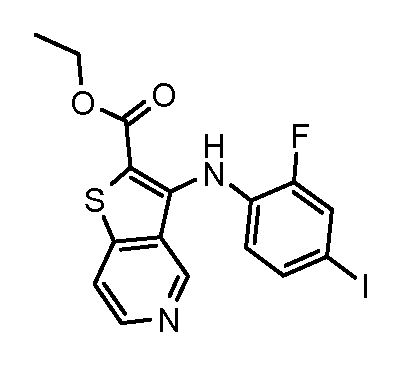
Смесь этилового эфира 3-(4-бром-2-фторфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (209 мг, 0,53 ммоль), йодида меди(I) (5 мг, 0,026 ммоль), йодида натрия (159 мг, 1,06 ммоль) и транс-N,N'-диметил-1,2-циклогександиамина (8,5 мкл, 0,053 ммоль) в 1,4-диоксане (1,0 мл) нагревают при 105°С в течение 24 часов в атмосфере аргона. Добавляют йодид меди(I) (5 мг, 0,026 ммоль) и транс-N,N'-диметил-1,2-циклогександиамин (8,5 мкл, 0,053 ммоль) и продолжают нагревание еще в течение 24 час. Как только реакционная смесь охладится до комнатной температуры, ее обрабатывают этилацетатом (30 мл) и смесью 10% об/об аммиака 0,880/вода (20 мл). Слои разделяют и водную фазу экстрагируют DCM (30 мл). Объединенный органический слой сушат над сульфатом натрия, фильтруют и упаривают, затем остаток очищают флэш-хроматографией на Si-SPE (элюирование смесями пентан:диэтиловый эфир, градиент от 90:10 до 70:30) с получением указанного в заголовке соединения в виде желтого твердого вещества (174 мг, 74%). ЖХМС (способ В): RT=3,97 мин, М+Н+=443.
((R)-2,2-Диметил[1,3]диоксолан-4-илметокси)амид 3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты

Смесь этилового эфира 3-(2-фтор-4-иодфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты (50 мг, 0,11 ммоль), 1н. водного раствора NaOH (0,12 мл, 0,12 ммоль) и этанола (2 мл) нагревают при 65°С в течение 45 минут. Реакционную смесь концентрируют и затем подвергают азеотропной перегонке с толуолом (2×2 мл) с получением твердого остатка. Твердый остаток растворяют в безводном ТГФ (2 мл) и добавляют О-((R)-2,2-диметил[1,3]диоксолан-4-илметил)гидроксиламин (27 мг, 0,23 ммоль), EDCI (27 мг, 0,14 ммоль), HOBt (21 мг, 0,16 ммоль) и DIPEA (59 мкл, 0,34 ммоль). После перемешивания в течение 19 часов растворитель выпаривают и остаток обрабатывают этилацетатом (30 мл) и водой (20 мл). Органический слой сушат над сульфатом натрия, фильтруют и упаривают с получением желтого масла. Масло очищают флэш-хроматографией (Si-SPE, пентан:этилацетат, градиент от 80:20 до 50:50) с получением указанного в заголовке соединения в виде желтого твердого вещества (18 мг, 30%). ЖХМС (способ В): RT=3,09 мин, М+Н+=544.
((R)-2,3-Дигидроксипропокси)амид 3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
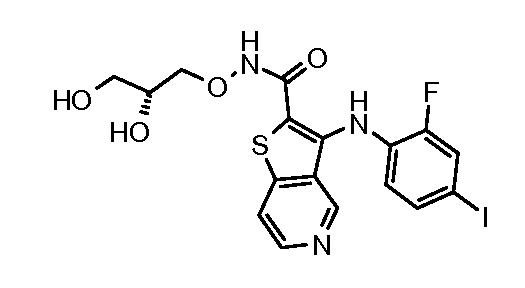
((R)-2,2-Диметил[1,3]диоксолан-4-илметокси)амид 3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (18 мг, 0,03 ммоль) растворяют в метаноле (1 мл) и добавляют концентрированную хлористоводородную кислоту (1 капля). Смесь перемешивают в течение 2 часов и затем упаривают досуха с получением остатка. Остаток обрабатывают водным насыщенным раствором NaHCO3 (10 мл), водой (20 мл) и DCM (20 мл). Органический слой отделяют, сушат над сульфатом натрия, фильтруют и упаривают с получением желтого твердого вещества. Твердое вещество очищают флэш-хроматографией (Si-SPE, DCM:MeOH, градиент от 98:2 до 92:8), с получением указанного в заголовке соединения в виде желтого твердого вещества (8 мг, 50%). ЖХМС (способ А): RT=6,32 мин, М+Н+=504. 1Н ЯМР (d4-MeOH, 400 МГц) 8,56 (с, 1Н), 8,34 (д, J=5,7 Гц, 1Н), 7,87 (д, J=5,7 Гц, 1Н), 7,45 (дд, J=10,5 Гц, 1,8 Гц, 1Н), 7,27 (д, J=8,5 Гц, 1Н), 6,61 (дд, J=8,5 Гц, 8,5 Гц), 3,89-3,94 (м, 1Н), 3,76-3,85 (м, 2Н), 3,45-3,54 (м, 2Н).
Пример 6
((R)-2,2-Диметил[1,3]диоксолан-4-илметокси)амид 3-(4-бром-2-фторфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
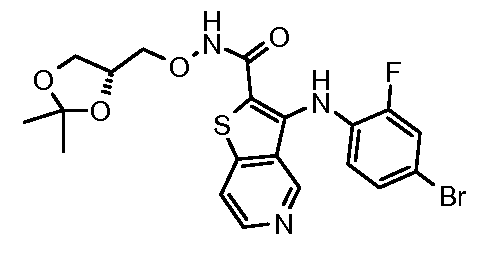
Смесь этилового эфира 3-(4-бром-2-фторфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (36 мг, 0,09 ммоль), 1н. водного раствора NaOH (0,10 мл, 0,10 ммоль) и метанола (2 мл) нагревают при 65°С в течение 45 минут. Реакционную смесь концентрируют и затем подвергают азеотропной перегонке с толуолом (2×2 мл) с получением твердого остатка. Твердый остаток растворяют в безводном ТГФ (2 мл) и добавляют О-((R)-2,2-диметил[1,3]диоксолан-4-илметил)гидроксиламин (22 мг, 0,18 ммоль), EDCI (22 мг, 0,12 ммоль), HOBt (17 мг, 0,13 ммоль) и DIPEA (48 мкл, 0,28 ммоль). После перемешивания в течение ночи при температуре окружающей среды реакционную смесь концентрируют в вакууме и получают желтый остаток. Полученный остаток растворяют в этилацетате (30 мл), раствор промывают водой (20 мл) и затем насыщенным раствором соли (10 мл), затем органический слой отделяют, сушат над сульфатом натрия и концентрируют в вакууме с получением желтого масла. Масло очищают флэш-хроматографией (Si-SPE, пентан:этилацетат, градиент от 90:10 до 50:50) с получением указанного в заголовке соединения в виде желтого масла (18 мг, 41%). ЖХМС (способ В): RT=3,03 мин, М+Н+=496/498.
((R)-2,3-Дигидроксипропокси)амид 3-(4-бром-2-фторфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты

Раствор ((R)-2,2-диметил[1,3]диоксолан-4-илметокси)амида 3-(4-бром-2-фторфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (18 мг, 0,036 ммоль) в метаноле (1 мл) загружают в картридж с isolute® SCX-2 (5 г). Затем картридж промывают метанолом (15 мл), затем элюируют требуемый продукт с использованием 2М раствора аммиака в МеОН, затем собранный элюент концентрируют и получают остаток. Остаток очищают флэш-хроматографией (Si-SPE, DCM:MeOH, градиент от 100:0 до 94:6) с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (9 мг, 53%). ЖХМС (способ А): RT=5,59 мин, М+Н+=456/458. 1Н ЯМР (d4-MeOH, 400 МГц) 8,60 (c, 1H), 8,40 (д, J=5,7 Гц, 1Н), 7,94 (д, J=5,7 Гц, 1Н), 7,39 (дд, J=10,6 Гц, 2,2 Гц, 1Н), 7,16 (д, J=8,5 Гц, 1Н), 6,80 (дд, J=8,5 Гц, 1Н), 4,01-4,10 (м, 1Н), 3,89-4,00 (м, 2Н), 3,57-3,67 (м, 2Н).
Пример 7
Этиловый эфир 3-хлоризоникотиновой кислоты

Суспензию 3-хлоризоникотиновой кислоты (1,0 г, 6,35 ммоль) в тионилхлориде (10 мл) кипятят с обратным холодильником в течение 2,5 часов. После охлаждения до температуры окружающей среды раствор концентрируют досуха, затем остаток подвергают азеотропной перегонке с толуолом (10 мл) и получают масло. Полученное масло добавляют по каплям в течение 10 минут к охлажденной (0°С) смеси этанола (15 мл) и DIPEA (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, затем концентрируют в вакууме и добавляют воду (20 мл). Раствор экстрагируют этилацетатом (30 мл), органическую фазу сушат над сульфатом натрия и затем концентрируют с получением указанного в заголовке соединения в виде оранжевого масла (1,1 г, 94%). 1Н ЯМР (CDCl3, 400 МГц) 8,72 (с, 1Н), 8,59 (д, J=4,9 Гц, 1Н), 7,63 (дд, J=4,9 Гц, 0,5 Гц, 1Н), 4,44 (кв, J=7,3 Гц, 2Н), 1,42 (т, J=7,3 Гц, 3Н).
Этиловый эфир 3-гидрокситиено[2,3-c]пиридин-2-карбоновой кислоты
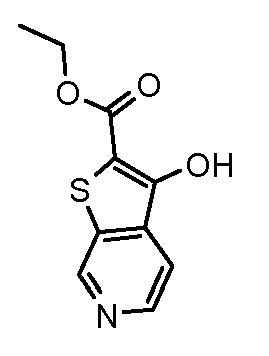
К охлажденному (5°С) раствору этилового эфира 3-хлоризоникотиновой кислоты (1,11 г, 6,0 ммоль) и этилового эфира меркаптоуксусной кислоты (1,8 мл, 16,7 ммоль) в безводном ДМФА (20 мл) при перемешивании в атмосфере аргона добавляют по частям в течение 20 минут гидрид натрия (15,6 ммоль, 60% дисперсия в масле, 622 мг). Перемешивание продолжают при 5°С в течение 20 минут и затем в течение 18 часов при комнатной температуре. Затем реакцию гасят, добавляя воду (5 мл), реакционную смесь подкисляют, добавляя уксусную кислоту (1 мл), затем концентрируют и получают остаток. Остаток обрабатывают этилацетатом (150 мл) и водой (50 мл). Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают с получением желтого масла. Масло очищают флэш-хроматографией (Si-SPE, пентан:этилацетат, градиент от 80:20 до 30:70) с получением указанного в заголовке соединения в виде желтого твердого вещества (1,33 г, 99%). ЖХМС (способ В): RT=2,57 мин, М+Н+=224.
Этиловый эфир 3-(нонафторбутан-1-сульфонилокси)тиено[2,3-c]пиридин-2-карбоновой кислоты
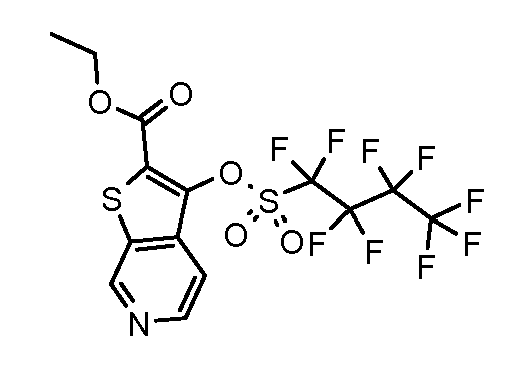
К раствору этилового эфира 3-гидрокситиено[2,3-c]пиридин-2-карбоновой кислоты (950 мг, 4,26 ммоль) и DMAP (26 мг, 0,21 ммоль) в DCM (12 мл) при перемешивании при 0°С добавляют DIPEA (1,8 мл, 10,2 ммоль) и нонафторбутилсульфонилхлорид (0,99 мл, 5,53 ммоль). Через 10 минут реакционную смесь нагревают до комнатной температуры и перемешивают еще в течение 20 часов. Реакционную смесь разбавляют DCM (30 мл) и промывают водой (20 мл). Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают, с получением желтого масла. Масло очищают флэш-хроматографией (Si-SPE, пентан:диэтиловый эфир, градиент от 90:10 до 65:35), с получением указанного в заголовке соединения в виде бесцветного масла, которое кристаллизуется при стоянии (678 мг, 31%). ЖХМС (способ В): RT=4,49 мин, М+Н+=508.
Этиловый эфир 3-(4-бром-2-фторфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты
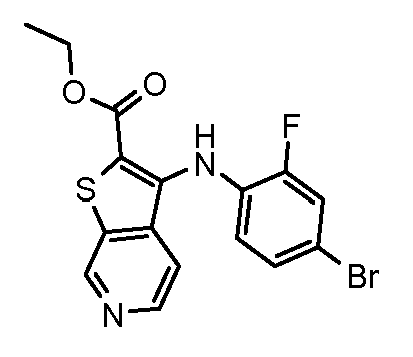
Дегазированный раствор этилового эфира 3-(нонафторбутан-1-сульфонилокси)тиено[2,3-c]пиридин-2-карбоновой кислоты (678 мг, 1,33 ммоль), 4-бром-2-фторанилина (329 мг, 1,73 ммоль), Pd2dba3 (61 мг, 0,07 ммоль), ксантфоса (78 мг, 0,14 ммоль) и DBU (509 мкл, 3,35 ммоль) в толуоле (3 мл) подвергают воздействию микроволнового облучения при 150°С в течение 10 минут. Реакционную смесь охлаждают до температуры окружающей среды и затем разбавляют этилацетатом (70 мл). Полученный раствор промывают водой (20 мл), сушат над сульфатом натрия и концентрируют в вакууме с получением оранжевого масла. Масло очищают флэш-хроматографией (Si-SPE, пентан:диэтиловый эфир, градиент от 90:10 до 50:50), с последующей кристаллизацией из смеси этилацетат:пентан с получением указанного в заголовке соединения в виде белого твердого вещества (353 мг, 67%). ЖХМС (способ В): RT=4,08 мин, М+Н+=395/397.
Этиловый эфир 3-(2-фтор-4-иодфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты
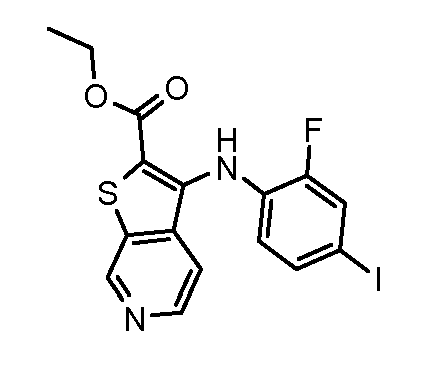
Смесь этилового эфира 3-(4-бром-2-фторфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты (288 мг, 0,73 ммоль), йодида меди(I) (7 мг, 0,036 ммоль), йодида натрия (219 мг, 1,46 ммоль) и транс-N,N'-диметил-1,2-циклогександиамина (10,4 мг, 0,073 ммоль) в 1,4-диоксане (1,0 мл) нагревают при 105°С в течение 24 часов в атмосфере аргона. Добавляют йодид меди(I) (7 мг, 0,036 ммоль) и транс-N,N'-диметил-1,2-циклогександиамин (10,4 мг, 0,073 ммоль) и продолжают нагревание еще в течение 24 часов. Реакционную смесь охлаждают до комнатной температуры и смесь обрабатывают DCM (30 мл) концентрированным водным раствором аммиака (2 мл) и водой (13 мл). Органический слой отделяют, сушат над сульфатом натрия, фильтруют и упаривают, затем остаток очищают флэш-хроматографией (Si-SPE, DCM) с получением указанного в заголовке соединения в виде желтого твердого вещества (275 мг, 85%). ЖХМС (способ В): RT=4,23 мин, М+Н+=443.
((R)-2,2-Диметил[1,3]диоксолан-4-илметокси)амид 3-(2-фтор-4-иодфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты
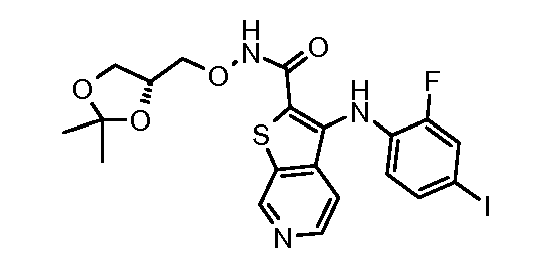
Смесь этилового эфира 3-(2-фтор-4-иодфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты (50 мг, 0,11 ммоль), 1н. водного раствора NaOH (0,12 мл, 0,12 ммоль) и этанола (2 мл) нагревают при 65°С в течение 45 минут. Реакционную смесь концентрируют и затем подвергают азеотропной перегонке с толуолом (2×2 мл) и получают твердый остаток. Твердый остаток растворяют в безводном ТГФ (4 мл) и добавляют О-((R)-2,2-диметил[1,3]диоксолан-4-илметил)гидроксиламин (27 мг, 0,23 ммоль), EDCI (27 мг, 0,14 ммоль), HOBt (21 мг, 0,16 ммоль) и DIPEA (59 мкл, 0,34 ммоль). После перемешивания в течение 19 часов растворитель выпаривают и остаток обрабатывают этилацетатом (20 мл) и водой (15 мл). Органический слой отделяют, сушат над сульфатом натрия, фильтруют и упаривают с получением коричневого масла. Масло очищают флэш-хроматографией (Si-SPE, пентан:этилацетат, градиент от 80:20 до 0:100) с получением указанного в заголовке соединения в виде оранжевого масла (40 мг, 66%). ЖХМС (способ В): RT=3,30 мин, М+Н+=544.
((R)-2,3-Дигидроксипропокси)амид 3-(2-фтор-4-иодфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты
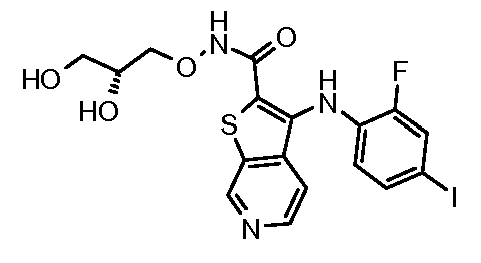
((R)-2,2-Диметил[1,3]диоксолан-4-илметокси)амид 3-(2-фтор-4-иодфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты (40 мг, 0,07 ммоль) растворяют в метаноле (1 мл) и добавляют концентрированную хлористоводородную кислоту (1 капля). Смесь перемешивают в течение 2 часов и затем упаривают досуха с получением остатка. Остаток обрабатывают водным насыщенным раствором NaHCO3 (3 мл), водой (20 мл) и DCM (20 мл). Органический слой отделяют, сушат над сульфатом натрия, фильтруют и упаривают с получением желтого твердого вещества. Твердое вещество очищают флэш-хроматографией (Si-SPE, DCM:MeOH, градиент от 99:1 до 92:8) с получением указанного в заголовке соединения в виде желтого твердого вещества (21 мг, 57%). ЖХМС (способ А): RT=7,12 мин, М+Н+=504. 1Н ЯМР (d4-MeOH, 400 МГц) 9,15 (с, 1Н), 8,38 (д, J=5,7 Гц, 1Н), 7,52 (дд, J=10,6 Гц, 2,0 Гц, 1Н), 7,44 (дд, J=5,7 Гц, 1,0 Гц, 1Н), 7,32 (ддд, J=8,5 Гц, 2,0 Гц, 1,0 Гц, 1Н), 6,56 (дд, J=8,5 Гц, 8,5 Гц, 1Н), 4,00-4,13 (м, 1Н), 3,85-3,95 (м, 2Н), 3,54-3,65 (м, 2Н).
Пример 8
((R)-2,2-Диметил[1,3]диоксолан-4-илметокси)амид 3-(4-бром-2-фторфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты
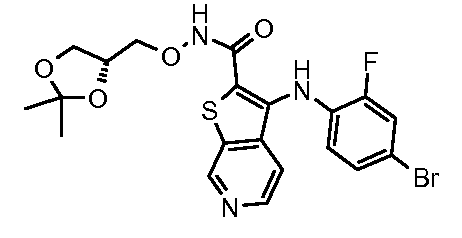
Смесь этил-3-(4-бром-2-фторфениламино)тиено[2,3-c]пиридин-2-карбоксилата (63 мг, 0,16 ммоль), 1н водного раствора NaOH (0,17 мл, 0,17 ммоль) и этанола (2 мл) нагревают при 65°С в течение 45 минут. Полученную реакционную смесь концентрируют в вакууме, затем остаток подвергают азеотропной перегонке с толуолом (2×2 мл) и получают твердый остаток. Полученный твердый остаток суспендируют в безводном ТГФ (2 мл) и затем добавляют О-((R)-2,2-диметил[1,3]диоксолан-4-илметил)гидроксиламин (38 мг, 0,32 ммоль), EDCI (38 мг, 0,20 ммоль), HOBt (30 мг, 0,22 ммоль) и DIPEA (83 мкл, 0,48 ммоль). После перемешивания в течение 66 часов при температуре окружающей среды реакционную смесь концентрируют в вакууме и получают желтый остаток. Полученный остаток растворяют в этилацетате (50 мл), раствор промывают водой (20 мл), затем органический слой отделяют, сушат над сульфатом натрия, затем концентрируют в вакууме и получают желтое масло. Масло очищают флэш-хроматографией (Si-SPE, пентан:этилацетат, градиент от 60:40 до 0:100) с получением указанного в заголовке соединения в виде желтой пены (61 мг, 77%). ЖХМС (способ В): RT=3,02 мин, М+Н+=496/498.
((R)-2,3-Дигидроксипропокси)амид 3-(4-бром-2-фторфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты
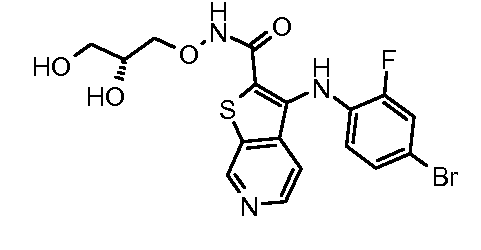
Раствор ((R)-2,2-диметил[1,3]диоксолан-4-илметокси)амида 3-(4-бром-2-фторфениламино)тиено[2,3-c]пиридин-2-карбоновой кислоты (61 мг, 0,12 ммоль) и 1 капли концентрированной HCl в метаноле (2 мл) перемешивают при температуре окружающей среды в течение 2 часов. Растворитель выпаривают в вакууме и полученный остаток обрабатывают дихлорметаном (20 мл), водой (10 мл) и насыщенным раствором NaHCO3 (3 мл). Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме с получением желтого масла. Полученное желтое масло очищают флэш-хроматографией (Si-SPE, DCM:MeOH, градиент от 99:1 до 92:8) с последующим растиранием в смеси метанол/ацетонитрил, получая указанное в заголовке соединение в виде не совсем белого твердого вещества (15 мг, 26%). ЖХМС (способ А): RT=6,01 мин, М+Н+=456/458. 1Н ЯМР (d4-MeOH, 400 МГц) 9,16 (д, J=0,8 Гц, 1Н), 8,38 (д, J=5,8 Гц, 1Н), 7,37-7,46 (м, 2Н), 7,17 (ддд, J=8,6 Гц, 2,3 Гц, 2,2 Гц, 1Н), 6,72 (дд, J=8,7 Гц, 8,7 Гц, 1Н), 4,00-4,05 (м, 1Н), 3,84-3,96 (м, 2Н), 3,53-3,64 (м, 2Н).
Пример 9
(2-Винилэтокси)амид 3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
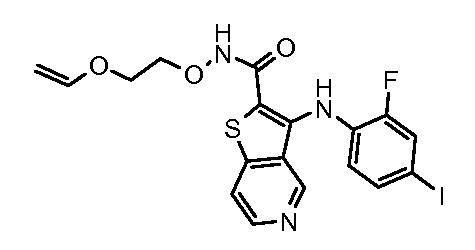
Смесь этилового эфира 3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (124 мг, 0,28 ммоль), 1н. водного раствора NaOH (0,30 мл, 0,30 ммоль) и этанола (4 мл) нагревают при 65°С в течение 45 минут. Реакционную смесь концентрируют в вакууме, затем полученный остаток подвергают азеотропной перегонке с толуолом (2×2 мл) и получают твердый остаток. Твердый остаток растворяют в безводном ТГФ (4 мл) и затем добавляют О-(2-винилоксиэтил)гидроксиламин (58 мг, 0,56 ммоль), EDCI (67 мг, 0,35 ммоль), HOBt (53 мг, 0,39 ммоль) и DIPEA (147 мкл, 0,84 ммоль). После перемешивания в течение 18 часов при температуре окружающей среды растворитель выпаривают, полученный остаток разбавляют водой (20 мл), затем экстрагируют этилацетатом (30 мл) и затем дихлорметаном (30 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают с получением желтого масла. Полученное желтое масло очищают флэш-хроматографией (Si-SPE, дихлорметан:метанол, градиент от 100:0 до 98:2) с получением указанного в заголовке соединения в виде желтого твердого вещества (91 мг, 65%). ЖХМС (способ В): RT=3,05 мин, М+Н+=500.
Пример 10
(2-Гидроксиэтокси)амид 3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
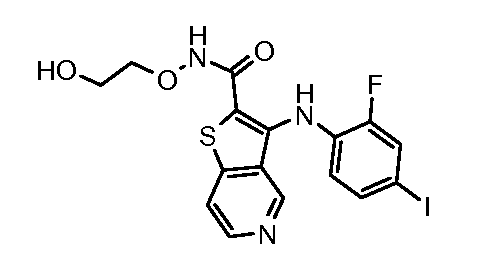
(2-Винилэтокси)амид 3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (91 мг, 0,18 ммоль) растворяют в этаноле (2 мл) и добавляют 1М хлористоводородную кислоту (0,5 мл). Смесь перемешивают в течение 2 часов, затем упаривают досуха и получают остаток. Полученный остаток обрабатывают водным насыщенным раствором NaHCO3 (3 мл), водой (20 мл) и DCM (20 мл). Органический слой отделяют, сушат над сульфатом натрия, фильтруют и упаривают с получением желтого твердого вещества. Полученное желтое твердое вещество очищают флэш-хроматографией (Si-SPE, DCM:MeOH, градиент от 100:0 до 98:2) и затем ВЭЖХ с обращенной фазой (Phenomenex Luna 5 фенил/гексил, 0,1% ТФК в воде при градиенте с метанолом от 95:5 до 40:60) с получением указанного в заголовке соединения в виде желтого твердого вещества (34 мг, 40%). ЖХМС (способ А): RT=6,00 мин, М+Н+=474. 1Н ЯМР (d4-MeOH, 400 МГц) 8,68 (д, J=5,7 Гц, 1Н), 7,98 (дд, J=5,7 Гц, 0,8 Гц, 1Н), 7,55 (дд, J=10,5 Гц, 1,8 Гц, 1Н), 7,35-7,40 (м, 1Н), 6,7 (дд, J=8,5 Гц, 8,5 Гц, 1Н), 3,98 (т, J=Гц, 2Н), 3,74 (т, J=Гц, 2Н).
Пример 11

Этиловый эфир 3-амино-7-фтортиено[3,2-c]пиридин-2-карбоновой кислоты
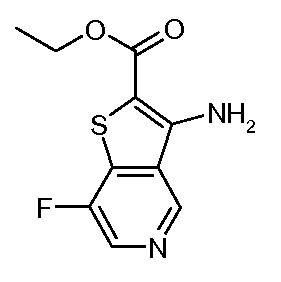
К смеси 4-хлор-5-фторникотинонитрила (1,0 г, 6,4 ммоль) и карбоната калия (4,4 г, 32 ммоль) в ДМФА (15 мл) при 0°С добавляют по каплям этилтиогликолят (0,73 мл, 6,7 ммоль). Реакционную смесь перемешивают при 0°С в течение 10 мин, при комнатной температуре в течение 20 мин и затем при 40°С в течение 30 мин. Реакционную смесь охлаждают до комнатной температуры и обрабатывают водой и этилацетатом. Органический слой отделяют и промывают водой, затем насыщенным раствором соли, сушат над сульфатом натрия и концентрируют, с получением указанного в заголовке соединения в виде желтого твердого вещества (1,5 г, количественный). ЖХМС (способ В): RT=3,41 мин, М+Н+=241.
Этиловый эфир 7-фтор-3-(2-фтор-4-триметилсиланилфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
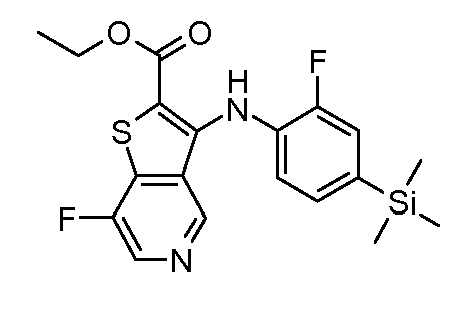
Смесь этилового эфира 3-амино-7-фтортиено[3,2-c]пиридин-2-карбоновой кислоты (360 мг, 1,5 ммоль), 2-фтор-4-триметилсиланилфенилового эфира трифторметансульфоновой кислоты (411 мг, 1,3 ммоль), Pd2dba3 (69 мг, 0,075 ммоль), ксантфоса (86 мг, 0,15 ммоль) и Cs2CO3 (685 мг, 2,1 ммоль) в толуоле (6 мл) подвергают воздействию микроволнового облучения при 160°С в течение 20 минут. Реакционную смесь фильтруют через слой celite®. Фильтрат концентрируют при пониженном давлении, получая остаток, который подвергают флэш-хроматографии (Si-SPE, пентан:диэтиловый эфир, градиент от 100:0 до 90:10) с получением указанного в заголовке соединения в виде желтого твердого вещества (338 мг, 55%). ЖХМС (способ В): RT=5,20 мин, М+Н+=407.
Этиловый эфир 7-фтор-3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
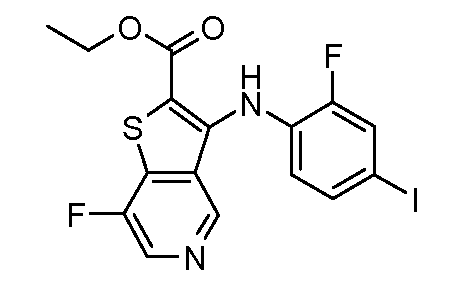
К охлажденному (0°С) раствору этилового эфира 7-фтор-3-(2-фтор-4-триметилсиланилфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (330 мг, 0,81 ммоль) в DCM (10 мл) добавляют по каплям 1М раствор монохлорида йода в DCM (1,6 мл, 1,6 ммоль). По завершении добавления смесь перемешивают при 0°С в течение 1 часа, и затем реакцию гасят, добавляя насыщенный раствор тиосульфата натрия (10 мл). Смесь энергично перемешивают в течение 10 мин и обрабатывают этилацетатом и водой. Органический слой отделяют и промывают насыщенным раствором гидрокарбоната натрия, затем насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и концентрируют с получением указанного в заголовке соединения в виде желтого твердого вещества (358 мг, 54%.). ЖХМС (способ В): RT=4,72 мин, М+Н+=461.
(2-Винилоксиэтокси)амид 7-фтор-3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
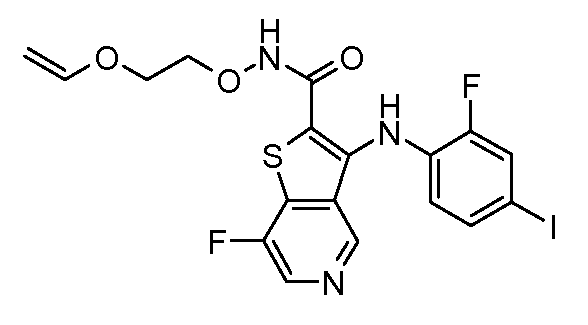
К раствору этилового эфира 7-фтор-3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (175 мг, 0,38 ммоль) в IMS (4 мл) добавляют 1,0М водный раствор гидроксида натрия (0,5 мл, 0,5 ммоль). Реакционную смесь нагревают при 65°С в течение 1 часа, затем охлаждают до комнатной температуры и концентрируют в вакууме. Полученный остаток подвергают азеотропной перегонке с толуолом (3×10 мл) и затем остаток суспендируют в ТГФ (5 мл). Затем последовательно добавляют О-(2-винилоксиэтил)гидроксиламин (78 мг, 0,76 ммоль), N,N-диизопропилэтиламин (0,26 мл, 1,52 ммоль), EDCI (146 мг, 0,76 ммоль) и HOBt (103 мг, 0,76 ммоль) и реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь концентрируют в вакууме и остаток обрабатывают водой и этилацетатом. Органический слой отделяют и промывают насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и концентрируют, получая остаток, который очищают колоночной хроматографией (Si-SPE, градиент 0-2% метанола в DCM) с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (106 мг, 54%). ЖХМС (способ В): RT=3,92 мин, М+Н+=518.
(2-Гидроксиэтокси)амид 7-фтор-3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
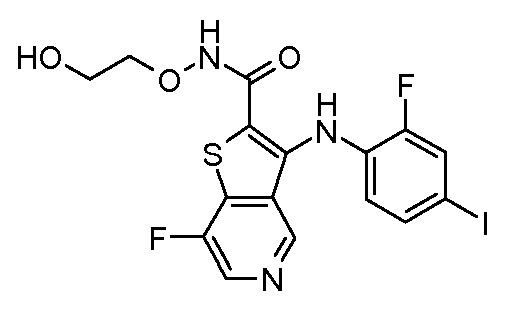
Раствор (2-винилоксиэтокси)амид 7-фтор-3-(2-фтор-4-иодфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (100 мг, 0,19 ммоль) в смеси метанола и DCM загружают в картридж с 5 г SCX-2, который элюируют метанолом и затем 2М раствором аммиака в метаноле. Соответствующие фракции объединяют и концентрируют при пониженном давлении. Оставшееся твердое вещество очищают колоночной хроматографией (Si-SPE, градиент 0-40% трет-бутилдиметилового эфира в DCM, затем смесь 10% метанола в DCM) и получают указанное в заголовке соединение в виде желтого твердого вещества (50 мг, 53%). ЖХМС (способ А): RT=9,60 мин, М+Н+=492. 1H ЯМР (CD3OD, 400 МГц) 3,58 (2Н, т, J=4,89 Гц), 3,84 (2Н, т, J=4,91 Гц), 6,89 (1Н, т, J=8,76 Гц), 6,98 (1Н, дд, J=8,41, 2,15 Гц), 7,21-7,26 (1Н, м), 8,02 (1Н, д, J=5,61 Гц), 8,45 (1Н, дд, J=8,25, 5,61 Гц), 8,53-8,59 (1Н, м).
Пример 12

Этиловый эфир 3-(2-фтор-4-метилсульфанилфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
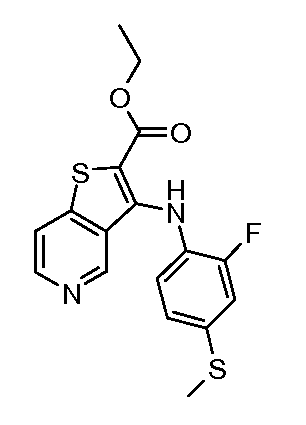
Дегазированный раствор этилового эфира 3-(нонафторбутан-1-сульфонилокси)тиено[3,2-c]пиридин-2-карбоновой кислоты (0,74 г, 1,5 ммоль), 2-фтор-4-метилсульфанилфениламина (0,12 г, 0,76 ммоль), Pd2dba3 (0,035 г, 0,038 ммоль), ксантфоса (0,044 г, 0,076 ммоль) и K3PO4 (0,32 г, 1,5 ммоль) в толуоле (10 мл) кипятят с обратным холодильником в течение 18 часов. Реакционную смесь охлаждают до температуры окружающей среды и затем фильтруют через слой гилфо, промывая этилацетатом. Фильтрат концентрируют в вакууме, полученный остаток подвергают флэш-хроматографии (Si-SPE, градиент 0-10% этилацетата в дихлорметане) с получением указанного в заголовке соединения в виде желтого твердого вещества (0,16 г, 57%). ЖХМС (способ В): RT=3,84 мин, М+Н+=363.
3-(2-Фтор-4-метилсульфанилфениламино)тиено[3,2-c]пиридин-2-карбоновая кислота
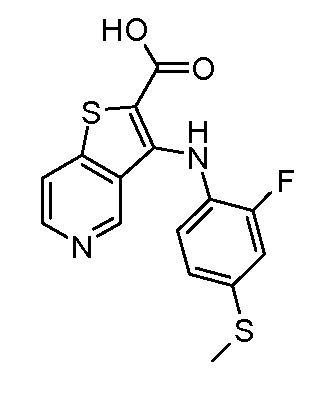
Суспензию этилового эфира 3-(2-фтор-4-метилсульфанилфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (0,19 г, 0,52 ммоль) в IMS (10 мл) обрабатывают гидроксидом натрия (1М водный раствор, 0,63 мл) и реакционную смесь нагревают при 60°С в течение 3 часов. Полученную смесь охлаждают и затем концентрируют в вакууме. Неочищенный остаток обрабатывают водой и доводят смесь до рН 5 уксусной кислотой. Полученную суспензию фильтруют, остаток отделяют и сушат в вакууме с получением указанного в заголовке соединения в виде зеленого твердого вещества (0,107 г, 56%), которое используют на следующей стадии без дополнительной очистки.
(2-Винилоксиэтокси)амид 3-(2-фтор-4-метилсульфанилфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
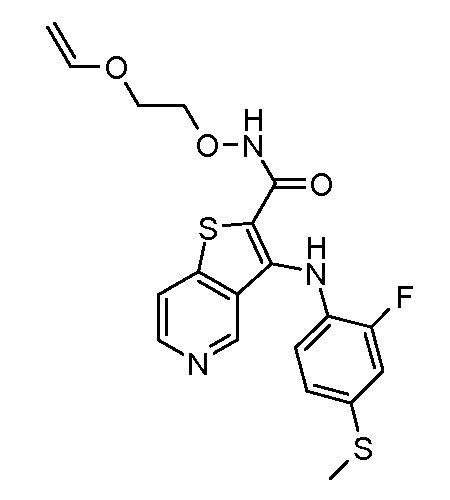
Суспензию 3-(2-фтор-4-метилсульфанилфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (0,107 г, 0,32 ммоль) в сухом дихлорметане (5 мл) в атмосфере азота охлаждают до 0°С и обрабатывают ДМФА (1 капля) и оксалилхлоридом (0,081 мл, 0,96 ммоль). Реакционную смесь перемешивают в течение 1 часа и затем растворитель удаляют в вакууме. Полученный остаток снова суспендируют в сухом дихлорметане (1 мл) и обрабатывают, добавляя по каплям раствор О-(2-винилоксиэтил)гидроксиламина (0,066 г, 0,64 ммоль) и DIPEA (0,167 мл, 0,96 ммоль) в сухом дихлорметане (4 мл), и затем перемешивают в течение 18 часов. Реакционную смесь промывают (вода, насыщенный раствор соли), сушат (MgSO4), фильтруют и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (Si-SPE, градиент 0-30% этилацетата в дихлорметане) с получением указанного в заголовке соединения в виде желтого твердого вещества (0,024 г, 18%). ЖХМС (способ В): RT=3,17 мин, М+Н+=420.
(2-Гидроксиэтокси)амид 3-(2-фтор-4-метилсульфанилфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты
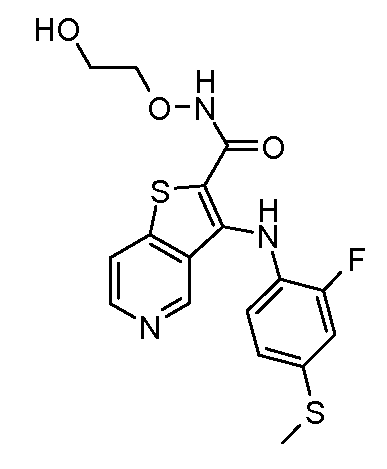
(2-Винилоксиэтокси)амид 3-(2-фтор-4-метилсульфанилфениламино)тиено[3,2-c]пиридин-2-карбоновой кислоты (20 мг, 0,048 ммоль) растворяют в метаноле (1 мл), обрабатывают концентрированной хлористоводородной кислотой (0,01 мл, 0,12 ммоль) и затем перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют в вакууме и полученный остаток подвергают ВЭЖХ с обращенной фазой (0,1% НСО2Н в воде, в градиенте ацетонитрила). Соответствующие фракции объединяют и сушат вымораживанием с получением указанного в заголовке соединения (9 мг, 47%). ЖХМС (способ А): RT=6,36 мин, М+Н+=394. 1Н-ЯМР (ДМСО-d6, 400 МГц) 3,58 (2Н, т, J=4,89 Гц), 3,84 (2Н, т, J=4,91 Гц), 6,89 (1Н, т, J=8,76), 6,98 (1H, дд, J=8,41, 2,15 Гц), 7,21-7,26 (1Н, м), 8,02 (1Н, д, J=5,61 Гц), 8,45 (1Н, дд, J=8,25, 5,61 Гц), 8,53-8,59 (1Н, м).
| название | год | авторы | номер документа |
|---|---|---|---|
| 8-АНИЛИНОИМИДАЗОПИРИДИНЫ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2008 |
|
RU2498985C2 |
| ИЗОИНДОЛОНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2495028C2 |
| АЗАИНДОЛИЗИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2483069C2 |
| СОЕДИНЕНИЯ АЗАБЕНЗОФУРАНИЛА И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2448111C2 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ МЕК | 2009 |
|
RU2509078C2 |
| 5-АНИЛИНОИМИДАЗОПИРИДИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2441004C1 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА С ПРИМЕНЕНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХСЯ С КОМПОНЕНТОМ СИГНАЛЬНОГО ПУТИ PD-1, И ИНГИБИТОРОВ MEK | 2015 |
|
RU2733735C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ БИАРИЛМОЧЕВИН И ИХ АНАЛОГОВ | 2006 |
|
RU2431630C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПИРАЗОЛА И СРЕДСТВО, ОБЛАДАЮЩЕЕ ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2154644C2 |
| КОМПОЗИЦИЯ, ПРИМЕНИМАЯ ДЛЯ ИМИТАЦИИ ТАБАЧНОГО АРОМАТА | 2017 |
|
RU2728416C1 |
Изобретение относится к азабензотиофенильным соединениям формулы I или к его соли, где Z1 представляет собой CR1; Z2 представляет собой N; Z3 представляет собой CR3; Z4 представляет собой CR4; R1, R3 и R4 независимо выбирают из Н или галогена; W представляет собой
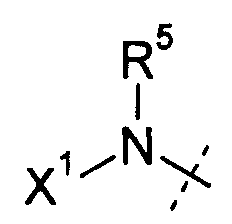 ,
,
R5 и R6 представляют собой Н; X1 представляет собой -OR11; X2 представляет собой фенил, необязательно замещенный одной или двумя группами, выбранными из галогена или (С1-С3)алкилсульфанила; R11 представляет собой (C1-C12) алкил, замещенный одной или двумя группами, независимо выбранными из - (CR19R20)nOR16; n равно 0; R16 представляет собой Н, (C1-C12) алкил или (C2-C8) алкенил. Изобретение также относится к фармацевтической композиции для лечения гиперпролиферативного расстройства, на основе указанных соединений, которые могут найти применение в медицине. 4 н. и 7 з.п. ф-лы, 12 пр.
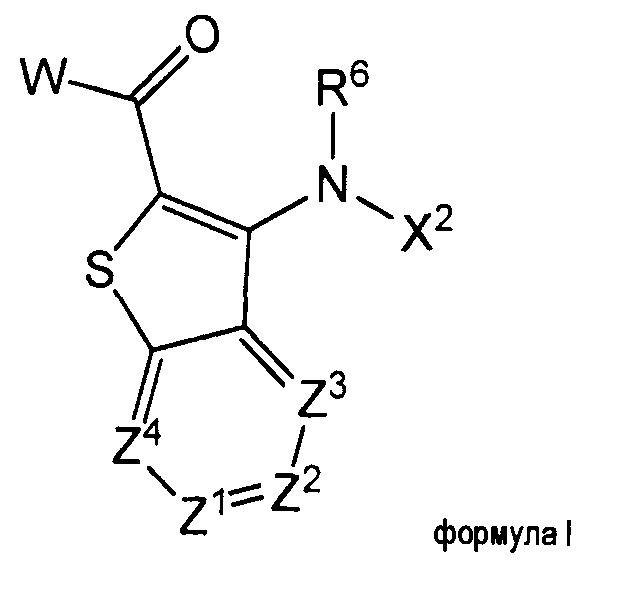
1. Соединение формулы I

и его соли,
где Z1 представляет собой CR1;
Z2 представляет собой N;
Z3 представляет собой CR3;
Z4 представляет собой CR4;
R1, R3 и R4 независимо выбирают из Н или галогена;
W представляет собой
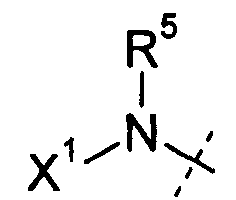
R5 и R6 представляют собой Н;
X1 представляет собой -OR11;
Х2 представляет собой фенил, необязательно замещенный одной или двумя группами, выбранными из галогена или (С1-С3)алкилсульфанила;
R11 представляет собой (C1-C12) алкил, замещенный одной или двумя группами, независимо выбранными из - (CR19R20)nOR16;
n равно 0;
R16 представляет собой Н, (C1-C12) алкил или (C2-C8) алкенил.
2. Соединение по п.1, где X1 выбирают из
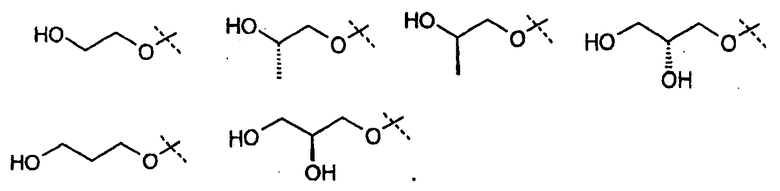
3. Соединение по п.1, где X1 выбирают из
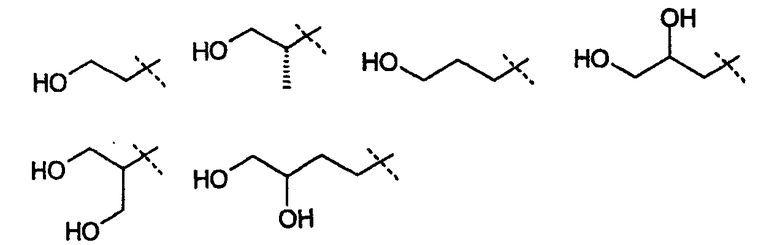
4. Соединение по п.1, где X2 представляет собой
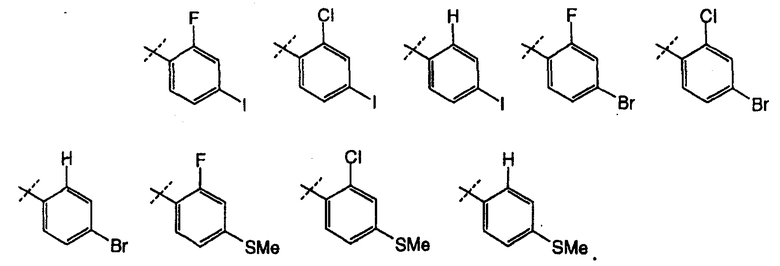
5. Соединение по п.1, где R1 выбирают из Н или Сl.
6. Соединение по п.1, где R3 выбирают из Н или галогена.
7. Соединение по п.1, где R4 выбирают из Н или галогена.
8. Соединение по п.7, где R4 выбирают из Сl, Вr или F.
9. Соединение, выбранное из:
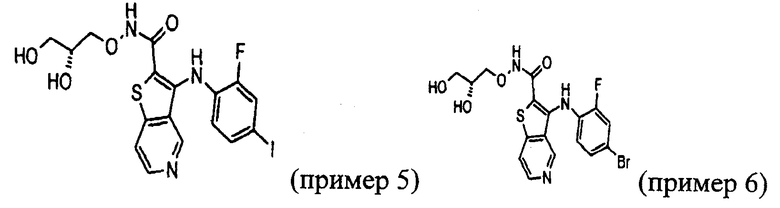
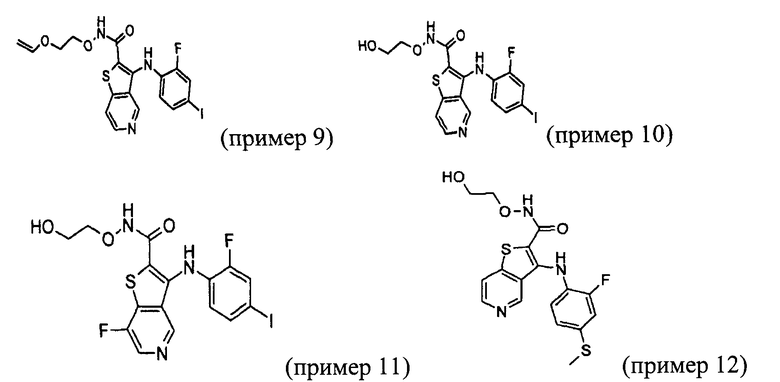
10. Фармацевтическая композиция для лечения гиперпролиферативного расстройства, содержащая соединение по любому из пп.1-9 и фармацевтически приемлемый носитель.
11. Способ ингибирования аномального клеточного роста или лечения гиперпролиферативного расстройства у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества фармацевтической композиции по п.10.
| US 20050049419 A1, 03.05.2005 | |||
| US 6469004 В1, 22.10.2002 | |||
| ДИСКОВЫЙ КУЛЬТИВАТОР для РАБОТЫ В САДАХ | 0 |
|
SU206213A1 |
| RU 2004127926 A, 27.06.2005 | |||
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОАРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ LH АГОНИСТОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2248979C2 |
Авторы
Даты
2012-03-10—Публикация
2007-08-20—Подача