Изобретение относится к химии производных адамантана, а именно к новому способу получения адамантиловых эфиров непредельных кислот общей формулы
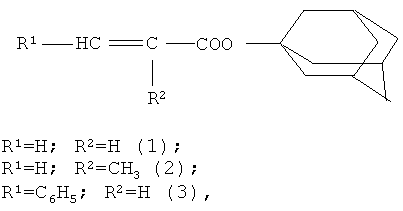
которые используются в качестве мономеров для получения полимеров, применяемых в световолоконной оптике.
Существует способ получения адамантил(мет)акрилового эфира взаимодействием соответствующих бромпроизводных адамантана: 1-бромадамантана, 1-бромметиладамантана или 1-(β-бромэтил)адамантана) с серебряной солью метакриловой кислоты в среде инертного органического растворителя (а.с. СССР 490795, C07C 69/54, опубл. 1976).
Недостатками данного метода являются использование дорогостоящего реактива (серебряной соли метакриловой кислоты), наличие дополнительной стадии получения данной соли, усложнение стадий выделения целевого вещества - отделение бромистого серебра и его регенерирование, что приводит к увеличению количества стадий процесса, а соответственно и его продолжительности.
Известен способ получения адамантилакрилового эфира взаимодействием 3,5-диметил-1-адамантанола с хлористым акрилом в смеси бензола и пиридина в течение 6 часов при комнатной температуре (Pat, US №3518241, C08f 3/64, 3/66 опубл. 30.06.70; Pat. US №3639362, C08f 15/16, опубл. 01.02.72; Pat. US №3533947, C10m 1/26, опубл. 13.10.70).
Недостатками этого метода являются применение легко гидролизуемого хлористого акрила, что приводит к повышенной коррозии и его перерасходу, а также большая продолжительность синтеза. Кроме того, хлористый акрил является сильным лакриматором, а применяемый пиридин является высокотоксичным веществом.
Описан способ получения адамантил(мет)акрилового эфира взаимодействием 3,5-диметил-1-адамантанола с хлористым метакрилом в смеси бензола и триэтиламина в течение 12 часов при охлаждении (Pat. US №3518241, C08f 3/64, 3/66 опубл. 30.06.70; Pat. US №3639362, C08f 15/16, опубл. 01.02.72; Pat. US №3533947, C10m 1/26, опубл. 13.10.70).
Недостатками этого метода являются большая продолжительность реакции (12 часов) и применение вспомогательных веществ (триэтиламина, щелочи) в качестве акцептора хлористого водорода, что приводит к увеличению количества стадий процесса.
Известен метод получения адамантил(мет)акрилового эфира взаимодействием адамантантриола-1,3,5 с (мет)акриловой кислотой в присутствии кислотного катализатора в органическом растворителе (Pat. JP №2010018566 (А), C07C 67/08, C07C 67/52, C07C 69/54, опубл. 11.07.08).
Основными недостатками этого метода являются многостадийность процесса, а также применение кислотного катализатора.
Существует метод получения 1-адамантил(мет)акрилового эфира взаимодействием адамантанола-1 с (мет)акриловой кислотой в среде насыщенных жирных кислот и присутствии кислотного катализатора (Pat. JP №2006036732 (А), C07C 67/08, C07C 97/54, C07B 61/00, C07C 67/00, C07C 69/0, опубл. 09.02.06).
Основными недостатками этого метода являются применение кислотного катализатора и насыщенных жирных кислот углеводородных соединений, что приводит к добавлению дополнительных стадий очистки, регенерации жирных кислот, и соответственно увеличению продолжительности процесса.
Описан метод получения 1-адамантил(мет)акрилового эфира и его производных взаимодействием гидрокси-, метил- или (мет)акроилзамещенного адамантанола-1 с (мет)акриловой кислотой в присутствии кислотного катализатора (Pat. JP №2007291041, C07C 67/08, C07C 69/54, C07B 61/00, C07C 67/00, C07C 69/00, C07B 61/00, опубл. 08.11.07).
Основным недостатком этого метода является применение кислотного катализатора, который необходимо удалять, а это приводит к дополнительной стадии процесса.
Известен также метод получения адамантил(мет)акрилового эфира термическим взаимодействием (мет)акриловой кислоты с адамантанолом-1, предварительно полученным из бромпроизводных адамантана в среде серной кислоты в присутствии сульфата серебра. По окончании реакции реакционную смесь промывают щелочью, отфильтровывают и отгоняют растворитель. (Pat. JP №63033350 (А), C07C 69/54, C08F 20/10, C08F 20/12, C08F 220/18, C07C 69/00, C08F 20/00, C08F 220/00, C07C 69/54, опубл. 13.02.88).
Основными недостатками этого метода являются многостадийность процесса получения адамантанола-1, применение катализатора, а также возможность полимеризации (мет)акриловой кислоты и ее эфира при повышенной температуре.
Наиболее близкой к предлагаемому изобретению является методика получения адамантилакрилового эфира взаимодействием 3,5-диметил-1-адамантанола с акриловой кислотой в соотношении акриловая кислота : адамантанол = 3:1 в толуоле в присутствии n-толуолсульфокислоты. Реакцию проводили в течение 72 часов (Pat. US №3518241, C08f 3/64, 3/66, опубл. 30.06.70; Pat. US №3639362, C08f 15/16, опубл. 01.02.72; Pat. US №3533947, C10m 1/26, опубл. 13.10.70).
Основными недостатками этого метода является большая продолжительность синтеза (72 ч) и применение катализатора, который необходимо удалять, а это приводит к дополнительной стадии процесса.
Задачей предлагаемого изобретения является разработка технологичного универсального и малостадийного метода синтеза сложных адамантиловых эфиров непредельных карбоновых кислот, протекающего с высоким выходом по исходному производному адамантана.
Техническим результатом является разработка технологичного и универсального способа получения соединений с высоким выходом.
Поставленный технический результат достигается в новом способе получения сложных адамантиловых эфиров непредельных карбоновых кислот общей формулы

заключающемся во взаимодействии производного адамантана с непредельными кислотами, причем в качестве производного адамантана используют 1,3-дегидроадамантан, а в качестве непредельного соединения используют соединения из ряда: акриловая, метакриловая или коричная кислоты, при мольном соотношении реагентов, равном 1:(1,5-2), в среде диэтилового эфира при температуре его кипения в течение 20-30 мин.
Сущностью этого метода является, реакция присоединения 1,3-дегидроадамантана к непредельным карбоновым кислотам по карбоксильной группе:

Преимуществом данного метода является высокий (82-86%) выход продуктов реакции, небольшая продолжительность реакции (20-30 мин), простота выделения продуктов, а также возможность получения широкого спектра сложных адамантиловых эфиров непредельных карбоновых кислот.
Способ заключается во взаимодействии 1,3-дегидроадамантана с непредельными кислотами в инертном растворителе (диэтиловом эфире) с последующей его отгонкой.
Оптимальное время реакция 20-30 мин. При уменьшении продолжительности реакции не достигается высокий выход основного продукта. Увеличение продолжительности реакции более 30 мин не приводило к возрастанию выхода продуктов, и поэтому является нецелесообразным и экономически невыгодным.
Найдено, что оптимальным условием проведения реакции присоединения непредельных соединений к 1,3-дегидроадамантану является ее осуществление при мольном соотношении 1,3-дегидроадамантан : непредельная кислота (1:1,5-2). Дальнейшее увеличение избытка непредельной кислоты не влияло на выход целевых продуктов и являлось нецелесообразным.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Адамантиловый эфир акриловой кислоты

Мольное соотношение 1,3-дегидроадамантан : акриловая кислота 1:1,5.
К 1,80 г (0,0134 моль) свежевозогнанного 1,3-дегидроадамантана (1,3-ДГА), растворенного в 20 мл диэтилового эфира, в атмосфере сухого аргона прикапывают 1,37 мл (0,0201 моль) акриловой кислоты. Реакцию проводят при температуре кипения диэтилового эфира в течение 20 мин. По окончании реакции раствор промывают слабым водным раствором щелочи. Органический слой отделяют и сушат безводным сульфатом натрия. После декантирования раствора растворитель отгоняют. Получено 2,27 г (82%). Вычислено для C13H18O2, %: C 75,69, H 8,80. Найдено, %: C 75,75, H 8,72. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 1,17-2,03 м (15Н, Ad); 5,49 д (1H, СН2=); 5,89 м (1Н, СН); 6,13 д (1Н, СН2=).
Пример 2. Адамантиловый эфир метакриловой кислоты
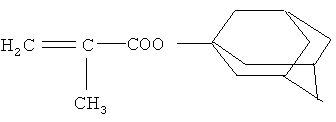
Мольное соотношение 1,3-дегидроадамантан : метакриловая кислота 1:2.
К 1,30 г (0,0097 моль) свежевозогнанного 1,3-дегидроадамантана (1,3-ДГА), растворенного в 20 мл диэтилового эфира, в атмосфере сухого аргона прикапывают 1,64 мл (0,0194 моль) метакриловой кислоты. Реакцию проводят при температуре кипения диэтилового эфира в течение 20 мин. По окончании реакции раствор промывают слабым водным раствором щелочи. Органический слой отделяют и сушат безводным сульфатом натрия. После декантирования раствора растворитель отгоняют. Получено 1,79 г (84%). Вычислено для С14Н20O2, %: C 76,33, H 9,15. Найдено, %: C 76,39, H 9,08. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 1,70 с (6Н, Ad); 1,89 с (3Н, СН3); 2,08 с (6Н, СН2); 2,12 с (3Н, СН); 5,51 с (1Н, СН2); 5,92 с (1Н, СН2). Масс-спектр, m/z (интенсивность, %): 220 ([М]+, 20,8%), 205 ([М-СН3]+, 1,04%), 135 ([Ad]+, 100%).
Пример 3.
Адамантиловый эфир коричной кислоты

Мольное соотношение 1,3-дегидроадамантан : коричная кислота 1:1,5.
К 1,60 г (0,0119 моль) свежевозогнанного 1,3-дегидроадамантана (1,3-ДГА), растворенного в 20 мл диэтилового эфира, в атмосфере сухого аргона добавляют 2,65 г (0,0178 моль) коричной кислоты. Реакцию проводят при температуре кипения диэтилового эфира в течение 30 мин. По окончании реакции раствор промывают слабым водным раствором щелочи. Органический слой отделяют и сушат безводным сульфатом натрия. После декантирования раствора растворитель отгоняют. Получено 2,90 г (86%). Т.пл. 63-65°C. Вычислено для С19Н22O2, %: С 80,82, Н 7,85. Найдено, %: С 80,91, Н 7,78. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 1,68-2,15 м (15Н, Ad); 6,5 д (1H, СН); 7,4 д (3Н, С6Н5); 7,55 д (1H, С6Н5); 7,68 д (2Н, С6Н5). Масс-спектр, m/z (интенсивность, %): 282 ([М]+, 53%), 151 ([AdO]+, 3,3%), 135 ([Ad]+, 100%), 131 ([С6Н5СН=СНСО]+, 87,6%), 103 ([С6Н5СН=СН]+, 53,7%), 77 ([С6Н5]+, 47,9%).
Таким образом, вышеизложенные сведения свидетельствуют о выполнении при использовании заявленного изобретения следующей совокупности условий:
- средство, воплощающее заявленное изобретение, при его осуществлении предназначено для применения в различных отраслях промышленности;
- для заявленного изобретения в том виде, как оно охарактеризовано в независимом пункте нижеизложенной формулы изобретения, подтверждена возможность его осуществления с помощью вышеописанных в заявке или известных до даты приоритета средств и методов;
- средство, воплощающее заявленное изобретение, при его осуществлении способно обеспечить достижение технического результата.
Следовательно, заявленное изобретение соответствует требованию "промышленная применимость".
Выводы
Разработан новый малостадийный способ получения сложных адамантиловых эфиров непредельных кислот, позволяющий получать соединения заявленной структурной формулы с достаточно высокими выходами. Структура полученных соединений подтверждена методом масс-спектрометрии, ЯМР-1Н-спектроскопией и элементным анализом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТ-1-ИЛСОДЕРЖАЩИХ ЭФИРОВ 3-R-4,5-ДИГИДРОИЗОКСАЗОЛ-5-КАРБОНОВЫХ КИСЛОТ | 2011 |
|
RU2461547C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(1-АДАМАНТИЛ)-3,4,5-ТРИНИТРО-1Н-ПИРАЗОЛА | 2012 |
|
RU2528404C2 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТ-1-ИЛСОДЕРЖАЩИХ АЗОЛОВ | 2005 |
|
RU2280032C1 |
| СПОСОБ ПОЛУЧЕНИЯ α-АДАМАНТИЛСОДЕРЖАЩИХ АЛИФАТИЧЕСКИХ И ЖИРНОАРОМАТИЧЕСКИХ КЕТОНОВ | 2000 |
|
RU2186760C2 |
| СПОСОБ ПОЛУЧЕНИЯ N,N-ДИАЛКИЛЗАМЕЩЕННЫХ АМИДОВ АДАМАНТИЛАЛКИЛКАРБОНОВЫХ КИСЛОТ | 2007 |
|
RU2348611C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ БЕТА-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ | 2012 |
|
RU2496766C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА-АДАМАНТИЛСОДЕРЖАЩИХ АЛЬДЕГИДОВ | 2003 |
|
RU2240303C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-(1-АДАМАНТИЛ)АНИЛИНА | 2014 |
|
RU2570909C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ ПРОИЗВОДНЫХ ФЕНОЛА | 2011 |
|
RU2458904C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-БРОМАДАМАНТИЛ-1-АЛКИЛ(АРИЛ)КЕТОНОВ | 2006 |
|
RU2309937C1 |
Изобретение относится к химии производных адамантана, а именно к новому способу получения адамантиловых эфиров непредельных кислот общей формулы

где R1=H, R2=H (1); R1=H, R2=CH3 (2); R1=C6H5, R2=H (3). Способ заключается во взаимодействии производного адамантана с непредельными кислотами, причем в качестве производного адамантана используют 1,3-дегидроадамантан, а в качестве непредельных кислот используют соединения из ряда: акриловая кислота, метакриловая кислота или коричная кислота, при мольных соотношениях реагентов, равном 1:(1,5-2) в среде диэтилового эфира при температуре его кипения в течение 20-30 мин. Техническим результатом является разработка технологичного и универсального способа получения сложных адамантиловых эфиров непредельных карбоновых кислот с высоким выходом. 3 пр.
Способ получения адамантиловых эфиров непредельных кислот общей формулы

заключающийся во взаимодействии производного адамантана с непредельными кислотами, отличающийся тем, что в качестве производного адамантана используют 1,3-дегидроадамантан, а в качестве непредельных кислот используют соединения из ряда: акриловая кислота, метакриловая кислота или коричная кислота, при мольных соотношениях реагентов, равных 1:(1,5-2) в среде диэтилового эфира при температуре его кипения в течение 20-30 мин.
| US 3518241 A, 30.06.1970 | |||
| US 3639362 A, 01.02.1972 | |||
| US 3533947 A, 13.10.1970 | |||
| Способ получения продукта конденсации бетанафтола с формальдегидом | 1923 |
|
SU131A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| JP 63033350 A, 13.02.1988 | |||
| JP | |||
Авторы
Даты
2012-04-27—Публикация
2010-12-06—Подача