ОБЛАСТЬ ТЕХНИКИ
Данное изобретение касается области вакцин и относится к новым композициям, включающим два или более сахаридных антигенов, конъюгированных с полиэтитопным протеином-носителем, включающим эпитопы Т-клеток из многочисленных патогенных протеинов. Изобретение также относится к способам получения упомянутых композиций и применениям этих композиций.
УРОВЕНЬ ТЕХНИКИ
Поливалентные вакцины в уровне техники известны. Одним из их примеров является тетравалентная вакцина капсулярных полисахаридов из серогрупп А, С, Y и W135 N. Meningitides, которая известна уже в течение многих лет [1, 2] и разрешена для применения на человеке. Однако несмотря на эффективность для подростков и взрослых она индуцирует слабый иммунный ответ, защищает на короткое время и не может быть использована для маленьких детей [напр., 3]. Причина заключается в том, что полисахариды являются независимыми от Т-клеток антигенами, которые обычно индуцируют слабый иммунный ответ, который невозможно усилить. Часто возникает беспокойство относительно широко распространенного использования поливалентных вакцин, поскольку они склонны к значительному снижению иммунной функции, известной как иммуносупрессия. Иммуносупрессия может происходить, когда количество антигена, вводимого субъекту, превышает способность иммунной системы реагировать. Такое состояние называется антиген-перегрузкой. Иммуносупрессия может также возникать в результате того, что один компонент антигена препятствует иммунной системе реагировать на другой компонент антигена поливалентной вакцины. Последняя форма иммуносупрессии называется вакцинной интерференцией.
В последние 20 лет были разработаны конъюгатные вакцины, включающие бактериальные капсулярные полисахариды, конъюгированные с протеинами-носителями.
Примеры включают Haemophilus influenzae тип b (Hib) конъюгатную вакцину [4], а также конъюгатные вакцины против Streptococcus pneumoniae [5] и серогруппы С Neisseria meningitides (MenC) [6].
Протеины-носители, используемые в разрешенных вакцинах, включают токсоид столбняка (ТТ), дифтерийный токсоид (DT), нетоксичный СRМ197-мутант дифтерийного токсина и комплекс протеинов наружних мембран из группы В N. Meningitides. Поскольку все больше конъюгированных вакцин вводится в медицинскую практику, дети могут получать многочисленные инъекции протеина-носителя либо в виде самой вакцины (напр., ТТ или DT), либо в виде протеина-носителя, присутствующего в конъюгатной вакцине. Так как эти протеины являются высокоиммуногенными как на уровне В-, так и на уровне Т-клеток, избыток носителя может индуцировать иммунную супрессию у примированных индивидов [7]. Это явление, называемое индуцируемой носителем эпитопной супрессией, как предполагается, существует благодаря специфичным к носителю антителам и внутримолекулярной антигенной конкуренции [8]. В идеале, протеин-носитель должен индуцировать сильный вспомогательный эффект по отношению к конъюгированному эпитопу В-клеток (напр., полисахариду) без индуцирования ответа антител против самого себя. Использование универсальных эпитопов, которые иммуногенны в отношение большинства молекул главного комплекса гистосовместимости класса II, является одним из подходов к достижению этой цели [9]. Такие эпитопы идентифицированы в ТТ и других протеинах. Тем не менее, имеется потребность в дальнейших усовершенствованиях.
Таким образом, целью изобретения является обеспечение усовершенствованных сахаридных конъюгатов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Было обнаружено, что полиэпитопные протеины-носители являются особенно полезными в качестве носителей комбинаций сахаридов. Кроме того, было обнаружено, что против этих протеинов-носителей возникает лишь слабый иммуногенный ответ, хотя они включают ряд известных патогенных эпитопов, при этом можно было бы ожидать, что иммуногенный ответ усиливался бы пропорционально числу патогенных эпитопов.
В некоторых вариантах осуществления изобретения предлагается, таким образом, композиция, включающая комбинацию двух или более моновалентных конъюгатов (напр., 2, 3, 4, 5, 6 или более. См. Фигуру 1А). Каждый моновалентный конъюгат включает (i) протеин-носитель, включающий эпитопы Т-клеток из двух или более (напр., 2, 3, 4, 5, 6 или более) патогенов, конъюгированный с (ii) сахаридным антигеном. Предпочтительно, протеин-носитель, используемый в каждом конъюгате, является одним и тем же. Предпочтительно, по крайней мере, что один из эпитопов протеина-носителя не происходит из того же самого патогена, что и сахаридный антиген. Предпочтительно, никакой из эпитопов пртотеина-носителя не происходит из того же самого патогена, что и сахаридный антиген.
Хотя каждая молекула протеина-носителя в каждом моновалентном конъюгате может быть конъюгирована с более чем одной молекулой сахаридного антигена (напр., 1, 5, 10, 20 или более) благодаря многочисленным сайтам присоединения на каждой молекуле протеина-носителя (Фигура 1В), каждый сахаридный антиген, конъюгированный с любым данным протеином-носителем, предпочтительно, происходит из того же самого антиген-отдельного патогена. Например, сахаридные антигены из МеnА отличаются от каждого из сахаридных антигенов из MenC, MenW или MenY, и поэтому мы говорим, что они происходят из антиген-отдельного патогена, в то время как сахаридные антигены из Hib все происходят из того же самого антиген-отдельного патогена. В отдельном конъюгате длина цепей индивидуальных сахаридов, хотя и происходящих из того же самого антиген-отдельного патогена, могут быть различны.
В качестве альтернативы, в некоторых вариантах осуществления изобретения предлагается мультивалентный конъюгат, включающий два или более (напр., 2, 3, 4, 5, 6 или более) антигенно отличающихся сахаридных антигенов, конъюгированных с одной и той же молекулой протеина-носителя (Фигура 1C). В этом случае сахаридные антигены происходят из разных антиген-отдельных патогенов. Поэтому, например, в такой конъюгатной композиции каждая молекула протеина-носителя может иметь конъюгированные с ней сахаридные антигены из двух или более МеnА, MenC, MenW, MenY и Hib. Изобретение также обеспечивает композицию, включающую два или более (напр., 1, 3, 4, 5, 6 или более) этих мультивалентных конъюгатов.
В качестве еще одной альтернативы, изобретение обеспечивает композицию, включающую один или более (напр., 1, 2, 3, 4, 5, 6 или более) моновалентных конъюгатов и один или более (напр., 1, 2, 3, 4, 5, 6 или более) мультивалентных конъюгатов, описанных выше.
Протеин-носитель
Протеин-носитель может включать 2 или более эпитопов Т-клеток (напр., 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более). Предпочтительно, протеин-носитель включает 6 или более, либо 10 или более эпитопов. Более предпочтительно, протеин-носитель включает 19 или более эпитопов. Каждый протеин-носитель может иметь только одну копию конкретного эпитопа или может иметь более одной копии конкретного эпитопа. Предпочтительно, эпитопы являются CD44+ эпитопами Т-клеток. Предпочтительно, протеин-носитель включает, по крайней мере, один бактериальный эпитоп и, по крайней мере, один вирусный эпитоп. Предпочтительно, эпитопы происходят из антигенов, по отношению которым человеческая популяция часто подвергается либо природной инфекции, либо вакцинации, например эпитопы могут происходить из вируса гепатита А, вируса гепатита В, вируса кори, вируса гриппа, вируса опоясывающей ветряной оспы, протеинов теплового шока из Mycobacterium bovis и М. leprae и/или штаммов Streptococcus, и т.д. Предпочтительно, эпитопы выбирают из токсина столбняка (ТТ), Plasmodium falciparum CSP (PfCs), ядерного капсида вируса гепатита В (HBVnc), гемагглютинина гриппа (НА), поверхностного HBV-антигена (HBsAg) и матриксный белок гриппа (МТ). Эпитопы, используемые в протеинах-носителях, предпочтительно, выбирают из Р23ТТ (SEQ ID NO: 1), Р32ТТ (SEQ ID NO: 2). P21TT (SEQ ID NO: 3), PfCs (SEQ ID NO: 4), P30TT (SEQ ID NO: 5), P2TT (SEQ ID NO: 6), HBVnc (SEQ ID NO: 7), НА (SEQ ID NO: 8), HBsAg (SEQ ID NO: 9) и МТ (SEQ ID NO: 10).
Предпочтительно, эпитопы соединены спейсерами. Предпочтительно, спейсер является короткой аминокислотной последовательностью (напр., 1, 2, 3, 4 или 5), которая не является эпитопом. Предпочтительный спейсер включает один или более глициновых остатков, напр., -KG-. Предпочтительно, протеин-носитель включает N- или С-концевую область, включающую шести-His-овый хвост, иммуноаффинный тэг, полезный для скринирования протеина-носителя (например, может быть использована последовательность "MDYKDDDD" [SEQ ID NO: 12]), и/или последовательность расщепления протеазой. Предпочтительно, протеолитическая последовательность является сайтом распознавания фактора Ха.
Предпочтительно, носитель не включает эпитопов супрессора Т-клеток.
Предпочтительно, протеин-носитель является N19 (SEQ ID NO: 11). Показано, что генетически сконструированный протеин, обозначаемый как N19 [10], экспрессируемый в Escherichia coli и имеющий несколько универсальных эпитопов, распознаваемых CD4+ Т-клетками человека, ведет себя как сильный носитель, когда он конъюгирован с Hib-полисахаридом [11]. N-концевая область N19 состоит из (i) шести-His-ового хвоста, который может быть использован во время очистки, (ii) сигнальной пептидной последовательности Met-Asp-Tyr-Lys-Asp-Asp-Asp-Asp (SEQ ID NO: 12), распознаваемой кроличьим поликлональным антителом, которая может быть использована для скринирования позитивных колоний во время процедуры клонирования, (iii) последовательности Ile-Glu-Gly-Arg (SEQ ID NO: 13) сайта распознавания Фактора Ха для легкого удаления метки. N19 представляет собой дупликацию первых девяти эпитопов, перечисленных в Таблице 1, плюс эпитоп (МТ) матриксного белка гриппа, распознаваемый CD4+. Эпитопы разделены спейсером Lys-Gly для обеспечения гибкости молекулы и для возможности последовательной конъюгации полисахарида с первичными ε-аминогруппами остатков Lys.
Помимо эпитопов, распознаваемых CD4+, протеины-носители могут включать другие пептиды или протеиновые фрагменты, такие как эпитопы из иммуномодулирующих цитокинов, таких как интерлейкин-2 (IL-2) или гранулоцит-макрофаговый колониестимулирующий фактор (GM-CSF).
Сахаридные антигены
Предпочтительно, сахаридный антиген, конъюгированный с протеином-носителем в композиции согласно изобретению, является бактериальным сахаридом и, в частности, капсулярным бактериальным сахаридом.
Примеры капсулярных бактериальных сахаридов, которые могут входить в состав композиций согласно изобретению, включают капсулярные сахариды из Neisseria meningitidis (серогруппы А, В, С, W135 и/или Y), Streptococcus pneumoniae (серотипы 1, 2, 3, 4, 5, 6В, 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 19А, 19F, 20, 22F, 23F и 33F, в частности 4, 6В, 9V, 14, 18С, 19F и/или 23F), Streptococcus agalactiae (типы Ia, Ib, II, III, IV, V, VI, VII, и/или VIII, такие как сахаридные антигены, раскрытые в ссылочных документах 20-23), Haemophilus influenzae (группы штаммов: а, b, с, d, e и/или f), Pseudomonas aeruginosa (например, липополисахарид (LPS), выделенный из РА01, O5 серотип), Staphylococcus aureus (например, из серотипов 5 и 8), Enterococcus faecalis или E.faecium (трисахаридные повторы), Yersinia enterocolitica, Vibrio cholerae, Salmonella typhi, Klebsiella spp., и т.д. Другие сахариды, которые могут входить в состав композиций согласно изобретению, включают глюканы (напр., глюканы грибков, такие как содержащиеся в Candida albicans) и капсулярные грибковые сахариды, напр., из капсулы Cryptococcus neoformans.
Капсула N. meningitidis серогруппы А (МеnА) представляет собой гомополимер (α1→6)-связанного N-ацетил-D-маннозамин-1-фосфата, при частичном O-ацетилировании в С3-и С4-положениях. Капсула N. meningitidis серогруппы В (МеnВ) представляет собой гомополимер (α2→8)-связанной сиаловой кислоты. Капсулярный сахарид N. meningitidis серогруппы С (МеnС) представляет собой гомополимер (α2→9)-связанной сиаловой кислоты, при переменном O-ацетилировании в положениях 7 и/или 8. Сахарид N. meningitidis серогруппы W135 представляет собой полимер, содержащий дисахаридные единицы - сиаликовая кислота-галактоза [→4)-D-Neup5Ac(7/9ОAc)-α-(2→6)-D-Gal-α-(1→]. Имеет место переменное O-ацетилирование в положениях 7 и 9 в сиаловой кислоте данного сахарида [24]. Сахарид N. Meningitidis серогруппы Y подобен сахариду серогруппы W135, за исключением того, что повторяющаяся дисахаридная единица включает глюкозу вместо галактозы [→4)-D-Neup5Ac(7/9ОAc)-α-(2→6)-D-Glc-α-(1→]. Также имеет место переменное O-ацетилирование в положениях 7 и 9 в сиаловой кислоте данного сахарида.
Композиции согласно изобретению включают смеси сахаридных антигенов. Предпочтительно, композиции включают 2, 3, 4 или более различных сахаридных антигенов. Антигены могут происходить из таких же самых или антигенно отличающихся патогенов. Предпочтительно, композиции согласно изобретению включают сахаридные антигены из более чем одной серогруппы N. Meningitidis, напр., композиции могут включать сахариды-конъюгаты из серогрупп А+С, A+W135, A+Y, C+W135, C+Y, W135+Y, A+C+W135, A+C+Y, C+W135+Y, A+C+W135+Y, и т.д. Предпочтительные композиции включают сахариды из сегогрупп С и Y. Другие предпочтительные композиции включают сахариды из серогрупп С, W135 и Y. Особенно предпочтительные композиции включают сахариды из серогрупп А, С, W135 и Y.
В том случае, когда смесь включает менингококковые сахариды из серогруппы А и, по крайней мере, один сахарид другой серогруппы, соотношение (в/в (весовое соотношение)) сахарида МеnА с любым сахаридом другой серогруппы может быть более 1 (напр., 2:1, 3:1, 4:1, 5:1, 10:1 или более). Соотношения между 1:2 и 5:1 являются предпочтительными, как и соотношения между 1:1,25 и 1:2,5. Предпочтительными соотношениями (в/в) для сахаридов из серогрупп A:C:W135:Y являются: 1:1:1:1; 1:1:1:2; 2:1:1:1; 4:2:1:1; 8:4:2:1; 4:2:1:2; 8:4:1:2; 4:2:2:1; 2:2:1:1; 4:4:2:1; 2:2:1:2; 4:4:1:2 и 2:2:2:1.
Дальнейшие предпочтительные композиции согласно изобретению включают Hib-сахаридный конъюгат и сахаридный конъюгат из, по крайней мере, одной серогруппы N. Meningitidis, предпочтительно, из более чем одной серогруппы N. Meningitidis. Например, композиция согласно изобретению может включать Hib-сахарид и сахариды из одной или более (т.е., 1, 2, 3 или 4) серогрупп А, С, W135 и Y N. Meningitidis. Предлагаются также другие комбинации сахаридных конъюгатов из упомянутых выше патогенов.
В некоторых вариантах осуществления изобретения также предлагается комбинации конъюгатов, в которых протеин-носитель не является одним и тем же для каждого конъюгата.
Другие предпочтительные композиции согласно изобретению включают первый конъюгат и второй конъюгат. Первый конъюгат является полиэпитопным конъюгатом, как описано выше, а второй конъюгат включает сахаридный антиген, конъюгированный с протеином-носителем, отличающимся от протеина-носителя, который используется в первом конъюгате. Например, второй конъюгат может являться сахаридным антигеном, конъюгированным с носителем CRM197. Сахаридный(-ые) антиген(ы) во втором конъюгате может(-гут) быть тем(и) же самым(и) или отличаться от сахаридного(-ых) антигена(-ов) в первом конъюгате.
Получение капсулярных сахаридных антигенов
Методы получения капсулярных сахаридных антигенов хорошо известны. Например, в ссылочном документе 25 описывается получение сахаридных антигенов из N. Meningitidis. Получение сахаридных антигенов из Н. Influenzae описывается в главе 14 ссылочного документа 26. Получение сахаридных антигенов и конъюгатов из S. pneumoniae описано в уровне техники. Например, Prevenar™ представляет собой 7-валентную пневмококковую конъюгатную вакцину. Способы получения сахаридных антигенов из S. agalactiae детально описываются в ссылочных документах 27 и 28. Капсулярные сахариды могут быть очищены по известным методикам, как описано в нескольких упомянутых здесь ссылочных документах.
Сахаридные антигены могут быть химически модифицированны. Например, они могут быть модифицированы для замещения одной или более гидроксильных групп блокирующими группами. Это особенно полезно для менингококковай серогруппы А, где ацетильные группы могут быть замещены блокирующими группами для предотвращения гидролиза [29]. Такие модифицированные сахариды являются сахаридами серогруппы А по смыслу настоящего изобретения.
Сахариды могут быть химически модифицированы по отношению к капсулярному сахариду, обнаруживаемому в природе. Например, сахарид может быть де-O-ацетилирован (частично или полностью), де-N-ацетилирован (частично или полностью), N-пропионирован (частично или полностью), и т.д. Де-ацетилирование можно осуществить до, во время или после конъюгирования, но предпочтительно до конъюгирования. В зависимости от конкретного сахарида, де-ацетилирование может влиять, а может не влиять на иммуногенность, напр., в вакцине NeisVac-C™ используется де-O-ацетилированный сахарид, в то время как в Menjugate™ - ацетилированный, но обе вакцины являются эффективными. Влияние де-ацетилирования и т.д. может быть оценено рутинными анализами.
Капсулярные сахариды могут быть использованы в форме олигасахаридов. Традиционно их получают фрагментированием очищенного капсулярного полисахарида (напр., гидролизом), за которым обычно следует очистка фрагментов желаемого размера. Фрагментирование полисахаридов предпочтительно осуществляют таким образом, чтобы получить окончательную среднюю степень полимеризации (DP) в олигосахариде менее чем 30. DP удобно измерять ионообменной хроматографией или колориметрическими анализами [30].
В случае, если проводят гидролиз, гидролизат обычно измеряют, чтобы удалить короткие олигосахариды [31]. Этого можно достичь различными путями, такими как ультрафильтрация с последующей ионообменной хроматографией. Для серогруппы А meningococcus предпочтительно удаляют олигосахариды со степенью полимеризации, менее или равной 6, а для серогрупп W135 и Y предпочтительно удаляют олигосахариды со степенью полимеризации менее чем примерно 4.
Конъюгаты: Носитель-Сахарид
Конъюгаты согласно изобретению могут включать небольшие количества свободного (т.е. неконъюгированного) носителя. Когда в композиции согласно изобретению данный протеин-носитель присутствует как в свободной, так и конъюгированной форме, неконъюгированная форма, предпочтительно, составляет не более 5% от общего количества протеина-носителя в композиции в целом и, более предпочтительно, присутствует в количестве менее 2% (по весу).
После конъюгации свободные и конъюгированные сахариды можно разделять. Существует много подходящих методов, включая гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.д. [см. также ссылочные документы 32 и 33, и т.д.].
Может быть применена любая реакция конъюгации, с любым подходящим линкером, когда это необходимо. Предпочтительным является присоединение сахаридного антигена к носителю через -NH2-группу, напр., в боковой цепи лизинового или аргининового остатка в протеине-носителе. В случае, когда сахарид имеет свободную альдегидную группу, он может реагировать с амином носителя для формирования конъюгата посредством восстановительного аминирования. Присоединение может также осуществляться через -SH-группу, напр., в боковой цепи цистеинового остатка. Альтернативно, сахаридный антиген может быть присоединен к носителю через линкерную молекулу.
В типичном случае сахарид активируют или функционализируют до конъюгации. При активировании могут использоваться, например, цианилирующие агенты, такие как CDAP (напр., 1-циано-4-диметиламинопиридиний тетрафтороборат [34, 35 и т.д.]. В других подходящих методиках используются карбодиимиды, гидразиды, активные эфиры, норборан, р-нитробензойная кислота, N-гидроксисукцинимид, сульфо-N-гидроксисукцинимид (S-NHS), 1-(3-деметиламинопропил)-3-этилкарбодиимид (EDC), O-(N-сукцинимидил)N,N,N',N'тетраметил уроний тетрафтороборат (TSTU) (см. также введение в ссылочном документе 36).
Линкеры
Связывание через линкерную группу может быть выполнено, используя любую известную процедуру, например процедуры, описанные в ссылочных документах 37 и 38. Один тип связвывания предусматривает восстановительное аминирование сахарида, присоединение полученной аминогруппы к одному концу линкерной группы адипиновой кислоты и последующее присоединение протеина-носителя к другому концу линкерной группы адипиновой кислоты [39, 40]. Другие линкеры включают В-пропионамидо [41], нитрофенил-этиламин [42], галоацильные галогеновые соединения [43], гликозидные связи [44], 6-аминокапроновую кислоту [45], алкогольдегидразу (ADH) [46], части С2-С4 [47] и т.д. В качестве альтернативы использования линкера может быть применено прямое связывание. Прямые связывания с протеином могут включать окисление полисахарида с последующим восстановительным аминированием с помощью протеина, как описано, например, в ссылочных документах 48 и 49.
Предпочтительным является процесс, включающий введение в сахарид аминогрупп (напр., посредством замещения терминальных =O-групп на -NH2) с последующим получением производных с помощью адипинового диэфира (напр., N-гидроксисукцинимидо-диэфира адипиновой кислоты) и реакцию с протеином-носителем.
Для обеспечения соединения первой группы с аминогруппой сахарида и второй группы с носителем (в типичном случае для соединения с амином носителя) может быть использован бифункциональный линкер.
В этом случае первая группа бифункционального линкера должна быть способной реагировать с аминогруппой (-NH2) на сахариде. В типичном случае эта реакция включает электрофильное замещение водорода амина. Вторая группа бифункционального линкера должна быть способной реагировать с аминогруппой на носителе. Эта реакция в типичном случае также включает электрофильное замещение амина.
Таким образом, в случае, когда в реакции как с сахаридом, так и с носителем учавствуют амины, предпочтительно использовать бифункциональный линкер формулы X-L-X, где две Х-группы являются одинаковыми и могут реагировать с аминами, a L представляет собой связывающую часть в линкере. Предпочтительной Х-группой является N-оксисукцинимид. L предпочтительно имеет состав L'-L2-L', где L' - карбонил. Предпочтительными L2-группами являются прямые алкильные цепочки с 1-10 атомами углерода (напр., С1, С2, С3, C4, C5, С6, С7, C8, C9, С10), напр., -(СН2)4-.
Другими Х-группами являются те, которые образуют эфиры, когда соединяются с HO-L-ОН, такие как норборан, р-нитробензойная кислота и сульфо-N-гироксисукцинимид.
Другие бифункциональные линкеры для использования в данном изобретении включают акрилоилгалиды (напр,, хлорид) и галоацилгалиды.
Как правило, линкер может добавляться к модифицированному сахариду в молярном избытке.
После конъюгации свободные и конъюгированные сахариды могут быть разделены. Существует много подходящих методов, включая гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.д. [см. также ссылочные документы 50 и 51, и т.д.].
В тех случаях, когда композиция согласно изобретению включает деполимеризованный сахарид, предпочтительно, чтобы деполимеризация предшествовала конъюгированию.
Другие антигены
Композиции согласно изобретению могут включать один или более (напр., 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) других антигенов, таких как:
А. Бактериальные Антигены
Бактериальные антигены, подходящие для использования в изобретении, включают протеины, полисахариды, липополисахариды и визикулы наружних мембран, которые можно выделить, очистить или произвести из бактерий. Кроме того, бактериальные антигены могут включать бактериальные лизаты и инактивированные бактериальные препараты. Бактериальные антигены можно получить с помощью рекомбинантной экспрессии. Предпочтительно, бактериальные антигены включают эпитопы, которые располагаются на поверхности бактерий во время, по крайней мере, одной стадии их жизненного цикла. Предпочтительно, бактериальные антигены сохраняются в многочисленных серотипах. Бактериальные антигены включают антигены, происходящие из одной или более бактерий, перечисленных ниже, и ниже также приведены примеры специфических антигенов.
Neisseria meningitidis: менингококковые антигены могут включать протеины (такие, которые указаны в ссылочных документах 52-58), сахариды (включая полисахарид, олигосахарид или липополисахарид) или визикулы наружних мембран [59-62], очищенные или произведенные из серогрупп N. Meningitidis, таких как А, С, W135, Y и/или В. Менингококковые протеиновые антигены могут быть выбраны из адгезинов, аутопереносчиков, токсинов, поглощающих железо протеинов и связанных с мембраной протеинов (предпочтительно, интегральных наружных протеинов мембран). См. также ссылочные документы 63-71.
Streptococcus pneumoniae: антигены S. pneumoniae могут включать сахарид (включая полисахарид или олигосахарид) и/или протеин из S. pneumoniae. Протеиновые антигены могут быть выбраны, например, из протеина, идентифицированного в любом из ссылочных документов 72-77. Протеины S. pneumoniae могут быть выбраны из Полигистидинтриадного семейства (PhtX), семейства Холин-связывающих протеинов (СbрХ), усеченных СbрХ, семейства LytX, усеченных LytX, химерных протеинов: усеченный СbрХ- усеченный LytX, пневмолизина (Ply), PspA, PsaA, Sp128, Sp101, Sp130, Sp125 или Sp133. См. также ссылочные документы 78-84.
Streptococcus pyogenes (группа A Streptococcus): антигены Streptococcus группы А могут включать протеин, идентифицированный в ссылочном документе 85 или 86 (включая GAS40), соединение фрагментов GAS М-протеинов (включая те, которые описаны в ссылочных документах 87-89), фибронектин-связывающий протеин (Sfb1), Стрептококковый ассоциированный с гемом протеин (Shp) и Стрептолизин S (SagA). См. также ссылочные документы 85, 90 и 91.
Moraxella catarrhalis: антигены Moraxella включают антигены, идентифицированные в ссылочных документах 92 и 93, антигены, представляющие собой белок из мембранных везикул наружной поверхности (HMW-OMP), С-антиген и/или LPS. См. также ссылочный документ 94.
Bordetella pertussis: антигены pertussis включают голотоксин коклюша (РТ) и нитевидный гамагглютинин (FHA) из В. pertussis, необязательно, также в комбинации с пертактином и/или антигеном агглютиногенов 2 и 3. См. также ссылочные документы 95 и 96.
Staphylococcus aureus: антигены S. aureus включают капсулярные полисахариды типов 5 и 8 S. aureus, необязательно, конъюгированные с нетоксичным рекомбинантным экзотоксином A Pseudomonas aeruginosa, таким как StaphVAX™, или антигены, происходящие из протеинов поверхности, инвазинов (лейкоцидина, киназ, гиалуронидазы), поверхностных факторов, которые ингибируют поглощение фагоцитов (капсула, протеин А), каротеноидов, каталазных продуктов, протеина А, коагулазы, фактора свертывания крови и/или мембранно-разрушающих токсинов (при необходимости, детоксифицированных), которые лизируют мембраны эукариотических клеток (гемолизинов, лейкотоксина, лейкоцидина). См. также ссылочный документ 97.
Staphylococcus epidermis: антигены S. epidermidis включают ассоциированный со слизью антиген (SAA).
Clostridium tetani (столбняк): антигены столбняка включают токсоид столбняка (ТТ), предпочтительно используемый в качестве протеина-носителя в соединии/конъюгированного с композициями согласно настоящему изобретению.
Corynebacterium diphtheriae (дифтерия); дифтерийные антигены включают дифтерийный токсин или его детоксифицированный мутанты, такие как CRM197. Для комбинации/совместного введения/конъюгирования с композициями согласно настоящему изобретения дополнительно подразумеваются антигены, способные к модулированию, ингибированию или связанные путем АДФ-рибозилирования. Эти дифтерийные антигены могут использоваться как протеины-носители.
Haemophilus influenzae: антигены Н. influenzae включают сахаридный антиген из типа В или протеин D [98].
Pseudomonas aeruginosa: антигены Pseudomonas включают эндотоксин А, Wzz-протеин и/или белки визикул наружних мембран, включая белок F визикул наружних мембран (OprF) [99].
Legionella pneumophila. Бактериальные антигены могут происходить из Legionella pneumophila.
Streptococcus agalactiae (группа В Streptococcus): антигены Streptococcus группы В включают протеиновые антигены, идентифицированные в ссылочных документах 85 и 100-103. Например, антигены включают протеины GBS80, GBS104, GBS276 и GBS322.
Neisseria gonorrhoeae: гонококковые антигены включают Роr (или порин)-протеин, такой как PorB [104], транспортный связывающий протеин, такой как ТbрА и TbpB [105], протеин мутности (такой как Ора), протеин модифицируемый восстановлением (Rmp) и препараты визикул наружних мембран (OMV) [106]. См. также ссылочные документы 52-54 и 107.
Chlamydia trachomatis: антигены С. trachomatis включают антигены, происходящие из серотипов А, В, Ва и С (возбудитель трахомы, причина слепоты), серотипов L1, L2 и L3 (ассоциированных с Lymphogranuloma venereum) и серотипов D-K. Антигены С. trachomatis могут также включать антиген, идентифицированный в ссылочных документах 103 и 108-110, включая РерА (СТ045), LcrE (CT089), ArtJ(CT381), DnaK (СТ396), СТ398, OmpH-подобный (СТ242), L7/L12 (СТ316), OmcA (CT444), AtosS (CT467), CT547, Eno (CT587), HrtA (CT823) и MurG (CT761). См. также ссылочный документ 111.
Treponema pallidum (сифилис): антигены сифилиса включают TmpA-антиген.
Haemophilus ducreyi (вызывающий мягкий шанкр); антигены Ducreyi включают протеин наружних мембран (DsrA).
Enterococcus faecalis или Enterococcus faecium: антигены выключают трисахаридный повтор или другие происходящие из Enterococcus антигены, идентифицированные в ссылочном документе 112.
Helicobacter pylori: антигены H. pylori включают Cag, Vac, Nap, HopX, HopY и/или уреазный антиген [113-123].
Staphylococcus saprophyticus: антигены включают гемагглютинин 160 кДа из S. saprophyticus.
Yersinia enterocolitica: антигены включают LPS [124].
Escherichia coli: антигены E.coli могут происходить из штаммов энтеротоксикогенной Е. coli (ЕТЕС), энтероаггрегативной Е. coli (EAggEC), диффузионно адгезирующей Е. coli (DAEC), энтеропатогенной Е. coli (EPEC) и/или энтерогеморрагической E. coli (EHEC).
Bacillus anthracis (сибирская язва): антигены В. anthracis необязательно детоксифицируют и могут быть выбраны из А-компонентов (летальный фактор (LF) и фактор водянки (EF)), которые оба могут иметь общий В-компонент, известный как защитный антиген (РА). См. ссылочные документы 125-127.
Yersinia pestis (чума): антигены чумы включают F1-капсулярный антиген [128], LPS [129], V-антиген [130].
Mycobacterium tuberculosis: туберкулезные антигены включают липопротеины, LPS, BCG-антигены, слитый протеин антигена 85В (Ag85B) и/или ESAT-6, необязательно в составе катионных липидных везикул [131], Mycobacterium tuberculosis (Mtb) антигены, ассоцированные с изоцитрат дегидрогеназой [132], и/или МРТ51-антигены [133].
Rickettsia: антигены включают протеины наружной мембраны, включая протеин А и/или В наружной мембраны (OmpB) [134], LPS, антиген, состоящий из поверхностного белкового протеина (SPA) [135].
Listeria monocytogenes: бактериальные антигены могут происходить из Listeria monocytogenes.
Chlamydia pneumoniae: антигены включают те, которые идентифицированы в ссылочных документах 108 и 136-141.
Vibrio cholerae: антигены включают протеиназные антигены, в частности липополисахариды Vibrio cholerae II, O1 Inaba O-специфичные полисахариды, V. cholera 0139, антигены вакцины 1ЕМ108 [142] и/или токсин Zonula occludens (Zot).
Salmonella typhi (лихорадка брюшного тифа): антигены включают капсулярные полисахариды, предпочтительно конъюгаты (Vi, напр., vax-TyVi).
Borrelia burgdorferi (болезнь Лайма): антигены включают липопротеины (такие как OspA, OspB, Osp С и Osp D), другие поверхностные протеины, такие как OspE-связанные протеины (Erps), декорин-связывающие протеины (такие как DbpA) и антигенно вариабильные VI-протеины, такие как антигены, ассоциированные с Р39 и Р13 (интегральный протеин мембраны, [143]), и VlsE-протеин антигенной изменчивости [144].
Porphyromonas gingivalis: антигены включают протеин наружней мембраны (ОМР). См. также ссылочный документ 145.
Klebsiella: антигены включают ОМР, включая ОМР А, или полисахарид, при необходимости конъюгированный с токсоидом столбняка.
Другие бактериальные антигены могут быть капсулярными антигенами, сахаридными антигенами или протеиновыми антигенами любой из упомянутых выше бактерий. Кроме того, бактериальные антигены могут также включать препарат везикул наружней мембраны (OMV). Дополнительно, антигены включают живые, аттенюированные и/или очищенные разновидности любой из вышеупомянутых бактерий. Антигены, используемые в настоящем изобретении, могут происходить из грамотрицательных и/или грамположительных бактерий. Антигены, используемые в настоящем изобретении, могут происходить из аэробных и/или анаэробных бактерий.
В. Вирусные Антигены
Вирусные антигены, подходящие для использования в данном изобретении, включают инактивированный (или убитый) вирус, аттенюированный вирус, препараты расщепленного вируса, препараты очищенных субъединиц, вирусные протеины, которые могут быть выделены, очищены или произведены из вируса, и Вирусоподобные Частицы (VLPs). Вирусные антигены могут быть произведены из вирусов, размноженных на клеточной культуре или другом субстрате. Альтернативно, вирусные антигены могут быть экспрессированы рекомбинантно. Вирусные антигены предпочтительно включают эпитопы, которые расположены на поверхности вируса во время, по крайней мере, одной стадии его жизненного цикла. Предпочтительно, вирусные антигены сохраняются в многочисленных серотипах или изолятах. Вирусные антигены включают антигены, происходящие из одного или более вирусов, перечисленных ниже, и ниже также приведены примеры специфических антигенов.
Ортомиксовирус: вирусные антигены могут происходить из ортомиксовируса, такого как Influenza А, В и С. Ортомиксовирусные антигены могут быть выбраны из одного или более вирусных протеинов, включая гемагглютинин (НА), нейраминидазу (NA), нуклеопротеин (NP), протеин матрикса (M1), мембранный протеин (М2), один или более транскриптазных компонентов (РВ1, РВ2 и РВ3). Предпочтительные антигены включают НА и NA.
Антигены Influenza могут происходить из межпандемических (ежегодных) штаммов гриппа. Альтернативно, антигены гриппа могут происходить из штаммов, способных вызывать вспышки пандемии (т.е., штаммов гриппа с новым гемагглютинином по сравнению с гемагглютинином в штаммах, циркулирующих в данное время, или штаммов гриппа, которые являются патогенными для представителей птиц и имеют способность передаваться горизонтально в человеческой популяции, или штаммов гриппа, которые являются патогенными для человека).
Вирусы Paramyxoviridae: вирусные антигены могут происходить из вирусов Paramyxoviridae, таких как Пневмовирусы (RSV), Парамиксовирусы (PIV) и Морбилливирусы (кори) [146-148].
Пневмовирус: вирусные антигены могут происходить из Пневмовируса, такого как Респираторный синцитиальный вирус (RSV), Респираторный синцитиальный вирус крупного рогатого скота, Вирус пневмонии мышей и Вирус ринотрахеита индеек. Предпочтительно, пневмовирусом является респираторно-синцитиальный вирус (RSV). Пневмовирусные антигены могут быть выбраны из одного или более следующих протеинов, включая поверхностные протеины Слияния (F), Гликопротеин (G) и Малый Гидрофобный протеин (SH), матриксные протеины М и М2, нуклеокапсидные протеины N, Р и L и неструктурые протеины NS1 и NS2. Предпочтительные пневмовирусные антигены включают F, G и М. См., например, ссылочный документ 149. Пневмовирусные антигены могут также входить в состав или произведенными из химерных вирусов. Например, химерные RSV/PIV-вирусы могут включать компоненты как RSV, так и PIV.
Парамиксовирус: вирусные антигены могут происходить из Парамиксовируса, такого как вирус Парагриппа типов 1-4 (PIV), Свинки, вирус Сендай, Симиан-вирус 5, вирус Парагриппа крупного рогатого скота и вирус Ньюкаслской болезни. Предпочтительно, Парамиксовирус представляет собой PIV или вирус Свинки. Парамиксовирусные антигены могут быть выбраны из одного или более следующих протеинов: Гемагглютинин-Нейраминидаза (HN), слитые протеины F1 и F2, Нуклеопротеин (NP), Фосфопротеин (Р), Большой протеин (L) и Матриксный протеин (М). Предпочтительные парамиксовирусные протеины включают HN, F1 и F2. Парамиксовирусные антигены могут также входить в состав или произведенными из химерных вирусов. Например, химерные RSV/PIV-вирусы могут включать компоненты как RSV, так и PIV. Коммерчески доступные противопаротитные вакцины включают живой аттенюированный вирус свинки либо в моновалентной форме, либо в комбинации с вакцинами против кори и краснухи (MMR).
Морбилливирус: вирусные антигены могут происходить из морбилливируса, такого как вирус Кори. Морбилливирусные антигены могут быть выбраны из одного или более следующих протеинов: гемагглютинин (Н), Гликопротеин (G), фактор Слияния (F), Большой протеин (L), Нуклеопротеин (NP), фосфопротеин Полимеразы (Р) и Матриксный (М). Коммерчески доступные вакцины против кори включают живой ослабленный вирус кори, обычно в комбинации с вакцинами против свинки и краснухи (MMR).
Пикорнавирус: вирусные антигены могут происходить из Пикорнавирусов, таких как Энтеровирусы, Риновирусы, Гепарнавирус, Кардиовирусы и Афтовирусы. Антигены, происходящие из Энтеровирусов, таких как Полиовирус, являются предпочтительными. См. ссылочные документы 150 и 151.
Энтеровирус: вирусные антигены могут происходить из Энтеровируса, такого как Полиовирус типов 1, 2 или 3, вирус А Коксаки типов 1-22 и 24, вирус В Коксаки типов 1-6, Эховирус (ECHO) типов 1-9, 11-27 и 29-34 и Энтеровирус 68-71. Предпочтительно, Энтеровирус представляет собой полиовирус. Энтеровирусные антигены предпочтительно выбирают из одного или более следующих протеинов: Капсидные протеины VP1, VP2, VP3 и VP4. Коммерчески доступные полио-вакцины включают Вакцину Инактивированного полиомиелита (IPV) и оральную полиовирусную вакцину (OPV).
Гепарнавирус: вирусные антигены могут происходить из Гепарнавируса, такого как вирус Гепатита A (HAV). Коммерчески доступные HAV-вакцины включают вакцину инактивированного HAV [152, 153].
Тогавирус: вирусные антигены могут происходить из Тогавируса, такого как Рубивирус, Альфавирус или Артеривирус. Антигены, происходящие из Рубивируса, такого как вирус Краснухи, являются предпочтительными. Тогавирусные антигены могут быть выбраны из E1, E2, Е3, С, NSP-1, NSPO-2, NSP-3 или NSP-4. Предпочтительно, тогавирусные антигены выбирают из Е1, E2 и Е3. Коммерчески доступные вакцины против Краснухи включают живой, адаптированный к холоду вирус, обычно в комбинации с вакцинами против свинки и кори (MMR).
Флавивирус: вирусные антигены могут происходить из Флавивируса, такого как вирус Клещевого энцефалита (ТВЕ), Денге (типы 1, 2, 3 или 4), Желтой Лихорадки, Японского энцефалита, энцефалита Западного Нила, энцефалита Сент-Луиса, Российского весенне-летнего энцефалита, Повассанского энцефалита. Флавивирусные антигены могут быть выбраны из PrМ, М, С, Е, NS-1, NS-2a, NS2b, NS3, NS4a, NS4b и NS5. Предпочтительно, флавивирусные антигены выбирают из РrМ, М и Е. Коммерчески доступные ТВЕ-вакцины включают вакцины инактивированного вируса.
Пестивирус: вирусные антигены могут происходить из пестивируса, такого как вирус Диареи крупного рогатого скота (BVDV), Классической лихорадки свиней (CSFV) или болезни Бордера (BDV).
Гепаднавирус: вирусные антигены могут происходить из Гепаднавируса, такого как вирус Гепатита В. Гепаднавирусные антигены могут быть выбраны из поверхностных антигенов (L, М и S), коровых антигенов (НВс, НВе). Коммерчески доступные HBV-вакцины включают субъединичные вакцины, включающие S-протеин поверхностного антигена [153, 154].
Вирус Гепатита С: вирусные антигены могут происходить из вируса Гепатита С (HCV). HCV-антигены могут быть выбраны из одного или более Е1, E2, Е1/Е2, NS345-полипротеина, NS 345-корового полипротеина, капсида и/или пептидов из неструктурных областей [155, 156].
Рабдовирус: вирусные антигены могут происходить из Рабдовируса, такого как Лиссавирус (вирус Бешенства) и Везикуловирус (VSV). Рабдовирусные антигены могут быть выбраны из гликопротеина (G), нуклеопротеина (N), большого протеина (L), неструктурных протеинов (NS). Коммерчески доступные вакцины против вируса Бешенства включают убитые вирусы, выращенные на диплоидных клетках человека или эмбриональных резус-клетках легких [157, 158].
Caliciviridae: вирусные антигены могут происходить из Caliciviridae, таких как Норфолкский вирус и Норфолк-подобные Вирусы, такие как Гавайский Вирус и Вирус Снежных Гор.
Коронавирус: вирусные антигены могут происходить из Коронавируса, тяжелый острый респираторный синдром (SARS), Респираторного коронавируса человека, Птичьего инфекционного бронхита (IBV), Мышиного вируса гепатита (MHV) и Свиного передаваемого вируса гастроэнтерита (TGEV). Коронавирусные антигены могут быть выбраны из шипа (S), оболочки (Е), матрикса (М), нуклеокапсида (N) и/или Гемагглютинин-эстеразного гликопротеина (НЕ). Предпочтительно, Коронавирусный антиген происходит из SARS-вируса. SARS-вирусные антигены описаны в ссылочном документе 159.
Ретровирус: вирусные антигены могут происходить из Ретровируса, такого как Онковирус, Лентивирус или Спумавирус. Онковирусные антигены могут происходить из HTLV-1, HTLV-2 или HTLV-5. Лентивирусные антигены могут происходить из HIV-1 или HIV-2. Ретровирусные антигены могут быть выбраны из gag, pol, env, tax, tat, rex, rev, nef, vif, vpu и vpr. HIV-антигены могут быть выбраны из gag (p24gag и p55gag), env (gp160, gp120 и gp41), pol, tat, nef, rev, vpu, минипротеинов (предпочтительны р55 gag и gp140v с делецией). HIV-антигены могут происходить из одного или более следующих штаммов: HIVIIIb, HIVSF2, HIVLAV, HIVLAI, HIVMN, HIV-1CM235, HIV-1US4.
Реовирус: вирусные антигены могут происходить из Реовируса, такого как Ротавирус, Орбивирус или Колтивирус. Реовирусные антигены могут быть выбраны из структурных протеинов λ1, λ2, λ3, µ1, µ2, σ1, σ2 или σ3, либо неструктурных протеинов σNS, µNS или σ1s. Предпочтительные Реовирусные антигены могут происходить из Ротавируса. Ротавирусные антигены могут быть выбраны из VP1, VP2, VP3, VP4 (или продукта расщепления VP5 и VP8), NSP 1, VP6, NSP3, NSP2, VP7, NSP4 и/или NSP5. Предпочтительные ротавирусные антигены включают VP4 (или продукт расщепления VP5 и VP8) и VP7.
Парвовирус: вирусные антигены могут происходить из Парвовируса, такого как Парвовирус В 19. Парвовирусные антигены могут быть выбраны из VP-1, VP-2, VP-3, NS-1 и/или NS-2. Предпочтительно, Парвовирусный антиген представляет собой капсидный протеин VP-2.
Дельта вирус Гепатита(HDV): вирусные антигены могут происходить из HDV, в частности δ-антиген из HDV (см. напр, ссылочный документ 160).
Вирус Гепатита Е (HEV): вирусные антигены могут происходить из HEV.
Вирус Гепатита G (HGV): вирусные антигены могут происходить из HGV.
Герпесвирус Человека: вирусные антигены могут происходить из Герпесвируса Человека, такого как Вирус Простого Герпеса (HSV), вирус Опоясывающей ветряной оспы (VZV), вирус Эпстайна-Барр (EBV), Цитомегаловирус (CMV), Герпесвирус 6 Человека (HHV6), Герпесвирус 7 Человека (HHV7) и Герпесвирус 8 Человека (HHV8). Антигены герпесвируса человека могут выбраны из предранних протеинов (α), ранних протеинов (β) и поздних протеинов (γ). HCV-антигены могут происходить из штаммов HSV-1 или HSV-2. HSV-антигены могут быть выбраны из гликопротеинов gB, gC, gD и gH, слитого протеина (gB) или протеинов иммунного ускользания (gC, gE, or gI). VZV-антигены могут быть выбраны из коровых, нуклеокапсидных, тегументных или оболочечных протеинов. Живая аттенюированная VZV-вакцина является коммерчески доступной. EBV-антигены могут быть выбраны из ранних антигенных протеинов (ЕА), антигена вирусного капсида (VCA) и гликопротеинов мембранного антигена (МА). CMV-антигены могут быть выбраны из капсидных протеинов, гликопротеинов оболочки (таких как gB и gH) и протеинов тегумента.
Паповавирусы: антигены могут происходить из Паповавирусов, таких как Папилломавирусы и Полиомавирусы. Папилломавирусы включают HPV-серотипы 1, 2, 4, 5, 6, 8, 11, 13, 16, 18, 31, 33, 35, 39, 41, 42, 47, 51, 57, 58, 63 и 65. Предпочтительно, HPV-антигены происходят из серотипов 6, 11, 16 или 18. HPV-антигены могут быть выбраны из капсидных протеинов (L1) и (L2) или Е1 - Е7, или соединения, полученного в результате их слияния. Предпочтительно, HPV-антигены входят в состав вирусоподобных частиц (VLPs). Полиомавирусные вирусы включают ВК-вирус и JK-вирус. Полиомавирусные антигены могут быть выбраны из VP1, VP2 или VP3.
С. Грибковые Антигены
Грибковые антигены могут происходить из одного или более грибков, перечисленных ниже.

Способы получения грибковых антигенов хорошо известны в данной области техники [161]. Предпочтительный способ, по которому растворимую фракцию экстрагировали и отделяли от нерастворимой фракции, получаемой из клеток грибков, клеточные стенки которых в значительной мере удаляли или, по крайней мере, частично удаляли, характеризуется тем, что процесс включает стадии; получения живых грибковых клеток; получения грибковых клеток, клеточные стенки которых в значительной мере удалены или, по крайней мере, частично удалены; разрушения грибковых клеток, клеточные стенки которых в значительной мере удалены или, по крайней мере, частично удалены; получения нерастворимой фракции; и экстрагирования и отделения растворенной фракции от нерастворимой фракции.
D. STD-Антигены
Композиции согласно изобретению могут включать один или более антигенов, происходящих из возбудителей болезней, передающихся половым путем (STD). Такие антигены могут обеспечивать профилактику или терапию STDs, таких как хламидия, генитальный герпес, гепатиты (такие как HCV), генитальные бородавки, гонорея, сифилис и/или мягкий шанкр [162]. Антигены могут происходить из одной или более вирусных или бактериальных возбудителей STDs. Вирусные STD-антигены для использования в данном изобретении могут происходить, например, из HIV, вируса простого герпеса (HSV-1 и HSV-2), папиломавируса человека (HPV) и гепатита (HCV). Бактериальные STD-антигены для использования в данном изобретении могут происходить, например, из Neisseria gonorrhoeae, Chlamydia trachomatis, Treponema pallidum, Haemophilus ducreyi, Escherichia coli и Streptococcus agalactiae. Примеры специфических антигенов, происходящих из этих патогенов, описаны выше.
Е. Респираторные антигены (Антигены, происходящие из патогенов, которые вызывают респираторные заболевания)
Композиции согласно изобретению могут включать один или более антигенов, происходящих из патогена, который вызывает респираторное заболевание. Например, респираторные антигены могут происходить из респираторного вируса, такого как Ортомиксовирусы (грипп), Пневмовирус (RSV), Парамиксовирус (PIV), Морбилливирус (корь), Тогавирус (краснуха), вирус везикулярного стоматита (VZV) и Коронавирус (SARS). Респираторные антигены могут происходить из бактерий, которые вызывают респираторное заболевание, таких как Streptococcus pneumoniae, Pseudomonas aeruginosa, Bordetella pertussis, Mycobacterium tuberculosis, Mycoplasma pneumoniae, Chlamydia pneumoniae, Bacillus anthracis и Moraxella catarrhalis. Примеры специфических антигенов, происходящих из этих патогенов, описаны выше.
F. Антигены, используемые в педиатрических вакцинах
Композиции согласно изобретению могут включать один или более антигенов, подходящих для применения детям. Возраст детей типично менее примерно 3-х лет, или менее примерно 2-х лет, или менее примерно 1-го года. Педиатрические антигены могут вводиться много раз в течение курса 6 месяцев, 1-го, 2-х или 3-х лет. Антигены, используемые в педиатрических вакцинах, могут происходить из вируса, который может поражать детей, и/или вируса, к инфицированию которым дети предрасположены. Вирусный антигены, вызывающие болезни детей, включают антигены, происходящие из одного или более вирусов, таких как Ортомиксовирус (грипп), Пневмовирус (RSV), Парамиксовирус (PIV и свинка), Морбилливирус (корь), Тогавирус (краснуха), Энтеровирус (полио), HBV, Коронавирус (SARS), вирус Опоясывающей ветряной оспы (VZV), вирус Эпстейна-Барр (EBV). Бактериальные антигены, вызывающие болезни детей, включают антигены, происходящие из одной или более Streptococcus pneumoniae, Neisseria meningitidis, Streptococcus pyogenes (Группа А Стрептококка), Moraxella catarrhalis, Bordetella pertussis, Staphylococcus aureus, Clostridium tetani (Столбняк), Corynebacterium diphtherias (Дифтерия), Haemophilus influenzae типа В (Hib), Pseudomonas aeruginosa. Streptococcus agalactiae (Группа В Стрептококка) и Escherichia coli. Примеры специфических антигенов, происходящих из этих патогенов, описаны выше.
G. Антигены, подходящие для применения пожилым людям и лицам с ослабленным иммунитетом
Композиции согласно изобретению могут включать один или более антигенов, подходящих для применения пожилым людям и лицам с ослабленным иммунитетом. Такие индивидуумы могут нуждаться в более частой вакцинации с более высокими дозами или стимулирующими составами для улучшения их иммунного ответа на вводимые антигены. Антигены, которые могут применяться для введения пожилым людям или лицам с ослабленным иммунитетом, включают антигены, происходящие из одного или более следующих патогенов: Neisseria meningitidis, Streptococcus pneumoniae, Streptococcus pyogenes (Группа А Стрептококка), Moraxella catarrhalis, Bordetella pertussis, Staphylococcus aureus, Staphylococcus epidermis, Clostridium tetani (Столбняк), Cornynebacterium diphtheriae (Дифтерия), Haemophilus influenzae типа В (Hib), Pseudomonas aeruginosa, Legionella pneumophila, Streptococcus agalactiae (Группа В Стрептококка), Enterococcus faecalis, Helicobacter pylori, Chlamydia pneumoniae, Ортомиксовирус (грипп), Пневмовирус (RSV), Парамиксовирус (PIV и Свинка), Морбилливирус (корь), Тогавирус (Краснуха), Энтеровирус (полио), HBV, Коронавирус (SARS), вирус Опоясывающей ветряной оспы (VZV), вирус Эпстейна-Барр (EBV), Цитомегаловирус (CMV). Примеры специфических антигенов, происходящих из этих патогенов, описаны выше.
Н. Антигены, подходящие для использования в вакцинах для подростков
Композиции согласно изобретению могут включать один или более антигенов, подходящих для применения подросткам. Подростки могут нуждаться в стимуляции ранее вводимых антигенов, применяемых детям. Антигены, применяемые детям, которые могут быть пригодны для применения подросткам, описаны выше. Кроме того, подростки могут быть объектами, получающими антигены, происходящие из STD-патогенов, для того чтобы обеспечить защитный или терапевтический иммунитет до начала половой жизни. STD-антигены, которые могут быть пригодны для применения подросткам, описаны выше.
I. Опухолевые Антигены
Одно выполнение изобретения включает опухолевый антиген или антиген рака. Опухолевые антигены могут быть, например, пептид-содержащими опухолевыми антигенами, такими как полипептидный опухолевый антиген или гликопротеиновые опухолевые антигены. Опухолевый антиген может быть также, например, сахарид-содержащим опухолевым антигеном, таким как гликолипидный опухолевый антиген или ганглиозидный опухолевый антиген. Кроме того, опухолевый антиген может быть, например, полинуклеотид-содержащим опухолевым антигеном, который экспрессирует полипептид-содержащий опухолевый антиген, например, векторный РНК-конструкт или векторный ДНК-конструкт, такой как плазмидная ДНК.
Опухолевые антигены, пригодные для практического использования настоящего изобретения, охватывают широкий круг молекул, таких как (а) полипептид-содержащие опухолевые антигены, включающие полипептиды (которые могут иметь длину, например, 8-20 аминокислот, хотя выход длины за пределы этого интервала также является обычным), липополипептиды и гликопротеины, (b) сахарид-содержащие опухолевые антигены, включающие полисахариды, муцины, ганглиозиды, гликолипиды и гликопротеины, и (с) полинуклеотиды, которые экспрессируют антигенные полипептиды.
Опухолевые антигены могут быть, например, (а) молекулами полной длины, сопутствующими с раковыми клетками, (b) гомологами и модифицированными формами таких молекул, включая молекулы с делегированными, добавленными и/или замещенными частями, и (с) фрагментами таких молекул. Опухолевые антигены могут быть получены в рекомбинантной форме. Опухолевые антигены включают, например, класса I-консервативные антигены, распознаваемые CD8+- лимфоцитами, или класса II-консервативные антигены, распознаваемые CD4+- лимфоцитами.
Многочисленные опухолевые антигены известны в данной области техники и включают:
(а) антигены рака семенников, такие как NY-ESO-1, SSX2, SCP1, а также полипептиды семейств RAGE, BAGE, GAGE и MAGE, например, GAGE-1, GAGE-2, MAGE-1, MAGE-2, MAGE-3, MAGE-4, MAGE-5, MAGE-6 и MAGE-12 (которые могут быть использованы, например, для направления на меланому, опухоли легких, головы и шеи, NSCLC, опухоли молочных желез, желудочно-кишечные и мочевого пузыря), (b) мутированные антигены, например, р53 (связанный с различными массивными опухолями, например, раком прямой кишки, легких, головы и шеи), p21/Ras (связанный, напр., с меланомой, раком поджелудочной железы и раком прямой кишки), CDK4 (связанный, напр., с меланомой), MUM1 (связанный, напр., с меланомой), каспаза-8 (связанная, напр., с раком головы и шеи), CIA 0205 (связанный, напр., с раком мочевого пузыря), HLA-A2-R1701, бета-катенин (связанный, напр., с меланомой), TCR (связанный, напр., с Т-клеточной не-Ходжкинской лимфомой), BCR-ab1 (связанный, напр., с хронической миелогенной лейкемией), триозофосфат изомераза, KIA 0205, CDC-27 и LDLR-FUT, (с) сверхэкспрессированные антигены, например, Галектин 4 (связанный, напр., с раком прямой кишки), Галектин 9 (связанный, напр., с болезнью Ходжкина), протеиназа 3 (связанная, напр., с хронической миелогенной лейкемией), WT 1 (связанный, напр., с различными лейкемиями), карбоангидраза (связанная, напр., с раком почки), альдолаза А (связанная, напр., с раком легких), PRAME (связанный, напр., с меланомой), HER-2/neu (связанный, напр., с раком молочной железы, толстой кишки, легких и яичников), альфа-фетопротеин (связанный, напр., с гепатомой), KSA (связанный, напр., с раком прямой кишки), гастрин (связанный, напр., с раком поджелудочной железы и желудка), теломеразный каталитический протеин, MUC-1 (связанный, напр., с раком молочной железы и яичников), G-250 (связанный, напр., с карциномой клеток почек), р53 (связанный, напр., с раком молочной железы и толстой кишки) и карциноэмбрионный антиген (связанный, напр., с раком молочной железы, раком легких и раками желудочно-кишечного тракта, такими как рак прямой кишки), (d) являющиеся общими антигены, например, антигены меланома-меланоцитной дифференциации, такие как MART-1/Melan A, gp100, MC1R, меланоцит-стимулирующий рецептор гормонов, тирозиназа, тирозиназ-связанный протеин-1/TRP1 и тирозиназ-связанный протеин-2/ТRР2 (ассоциированные, напр., с меланомой), (е) ассоциированные с простатой антигены, такие как PAP, PSA, PSMA, PSH-P1, PSM-P1, PSM-P2, связанные, напр., с раком простаты, (f) иммуноглобулиновые идиотипы (связанные с миеломой и В-клеточной лимфомой, например), и (g) другие опухолевые антигены, такие как полипептид- и сахарид-содержащие антигены, включая (i) гликопротеины, такие как сиалил Tn и сиалил Lex (связанные, напр., с раком молочной железы и прямой кишки), а также различные муцины; гликопротеины могут быть соединены с протеином-носителем (напр., MUC-1 может быть соединен с KLH); (ii) липополипептиды (напр., MUC-1, сцепленный с липидным фрагментом); (iii) полисахариды (напр., Globo Н-синтетический гексасахарид), которые могут быть соединены с протеинами-носителями (напр., с KLH), (iv) ганглиозиды, такие как GM2, GM12, GD2, GD3 (связанные, напр., с головным мозгом, раком легкого, меланомой), которые могут быть соединены с протеинами-носителями (напр., KLH).
Другие опухолевые антигены, известные в данной области техники, включают р15, Hom/Mel-40, H-Ras, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR, антигены вируса Эпстейна Барр, ядерный антиген вируса Эпштейн-Барр (EBNA), антигены папилломавируса человека (HPV), включая Е6 и Е7, антигены вирусов гепатита В и С, антигены Т-клеточного лимфотропического вируса человека, TSP-180, p185erbB2, p180erbB-3, c-met, mn-23H1, TAG-72-4, СА 19-9, СА 72-4, САМ 17.1, NuMa, K-ras, pl6, TAGE, PSCA, CT7, 43-9F, 5T4, 791 Tgp72, beta-HCG, BCA225, BTAA, СА 125, СА 15-3 (СА 27.29/ВСАА), СА 195, СА 242, СА-50, САМ43, CD68/KP1, CO-029, FGF-5, Ga733 (EpCAM), HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCAS1, SDCCAG16, TA-90 (Mac-2-связывающий/циклоспорин С-ассоциированный протеин), TAAL6, TAG72, TLP, TPS, и т.п. Эти, а также другие клеточные компоненты описаны, например, в ссылочном документе 163 и в документах, цитированных в нем.
Полинуклеотид-содержащие антигены в соответствии с настоящим изобретением в типичном случае включают полинуклеотиды, которые кодируют полипептидные раковые антигены, такие как перечисленные выше. Предпочтительные полинуклеотид-содержащие антигены включают ДНК- и РНК-векторные конструкты, такие как плазмидные векторы (напр., pCMV), которые способны экспрессировать полипептидные раковые антигены in vivo.
Опухолевые антигены могут происходить, например, из зрелых или измененных клеточных компонентов. После изменения клеточные компоненты более не выполняют свои регуляторные функции, и, следовательно, клетки могут испытывать неконтролируемый рост. Представительные примеры измененных клеточных компонентов включают ras, p53, Rb, измененный протеин, кодируемый геном опухоли Вильмса, убиквитин, муцин, протеин, кодируемый DCC-, АРС- и МСС-генами, а также рецепторы или рецептороподобные структуры, такие как нейрон, рецептор гормона щитовидной железы, тромбоцитарный рецептор ростового фактора (PDGF), инсулиновый рецептор, рецептор эпидермального ростового фактора (EGF) и рецептора колониестимулирующего фактора (CSF). Эти, а также другие клеточные компоненты описаны, например, в ссылочном документе 164 и в документах, цитированных в нем.
Кроме того, для лечения рака бактериальные и вирусные антигены могут быть использованы вместе с композициями согласно настоящему изобретению. В частности, для лечения рака могут использоваться протеины-носители, такие как CRM197, токсоид столбняка или антиген Salmonella typhimurium, вместе/конъюгации с соединениями согласно настоящему изобретению. Комбинированная с антигенами рака терапия должна показать повышенную эффективность и биологическую доступность по сравнению с существующей терапией.
Дополнительную информацию о раковых или опухолевых антигенах можно найти, например, в ссылочном документе 165 (напр., Таблицы 3 и 4), в ссылочном документе 166 (напр., Таблица 1) и в ссылочных документах 167-189.
Иммунизацию можно также использовать против болезни Альцгеймера, напр., используя в качестве анигена А-бета [190].
J. Антигенные составы
В других аспектах изобретения обеспечиваются методы получения микрочастиц, имеющих адсорбированные антигены. Эти методы включают: (а) обеспечение эмульсии посредством диспергирования смеси, включающей (i) воду, (ii) детергент, (iii) органический растворитель и (iv) биодеградируемый полимер, выбранный из группы, состоящей из поли(α-гидроксикислоты), полигидроксимасляной кислоты, поликапролактона, полиортоэфира, полиангидрида и полицианоакрилата. В типичном случае полимер присутствует в смеси в концентрации примерно 1% до примерно 30% по отношению к органическому растворителю, в то время как детергент типично присутствует в смеси в масс./масс. соотношении детергент/полимер от примерно 0,00001:1 до примерно 0,1:1 (более типично от примерно 0,0001:1 до примерно 0,1:1, от примерно 0,001:1 до примерно 0,1:1 или от примерно 0,005:1 до примерно 0,1:1); (b) удаление органического растворителя из эмульсии; и (с) адсорбирование антигена на поверхность микрочастиц. В некоторых выполнениях биодеградируемый полимер присутствует в концентрации примерно 3% до примерно 10% по отношению к органическому растворителю.
Микрочастицы, которые используются в этих составах, получают из материалов, которые являются стерилизуемыми, нетоксичными и биодеградируемыми. Такие материалы включают, без ограничения, поли(α-гидроксикислоту), полигидроксимасляную кислоту, поликапролактон, полиортоэфир, полиангидрид, поли(алил-α-цианоакрилат), РАСА и полицианоакрилат. Предпочтительно, микрочастицы, используемые в настоящем изобретения, получают из поли(α-гидроксикислоты), в частности, из поли(лактида) ("PLA"), или сополимера D,L-лактида и гликолида или гликолевой кислоты, например, поли(D,L-лактид-ко-гликолид) ("PLG" или "PLGA"), или сополимера D,L-лактида и капролактона. Микрочастицы могут быть получены из любых различных полимеризующихся первоначальных материалов, которые имеют различные молекулярные веса и, в случае сополимеров, таких как PLG, различные соотношения лактида и гликолида, выбор которых является, главным образом, случайным и зависит, в частности, от совместно вводимых макромолекул. Эти характеристики более подробно обсуждаются ниже.
Другие методы получения составов и антигены (особенно опухолевые антигены) показаны в ссылочном документе 191.
Медицинские методы и применения
Сразу же после получения состава, композиции согласно изобретению могут быть непосредственно введены субъекту. Субъекты, которым требуется лечение, могут быть животными; в частности можно лечить людей. Композиции могут быть составлены в виде вакцин, которые особенно полезны для вакцинации детей и подростков. Они могут вводиться общим путем и/или через слизистые оболочки.
В типичном случае, композиции приготовляются как для инъекций - либо в виде жидких растворов, либо суспензий; могут приготовляться твердые формы, подходящие для растворения или суспендирования в первых, а также жидкие носители до инъецирования. Непосредственное введение композиций обычно является парентеральным (напр., путем инъекции, либо подкожно, либо внутрибрюшинно, либо внутривенно, либо внутримышечно, либо введением в интерстициальное пространство ткани). Композиции могут также вводиться в место повреждения. Другие способы введения включают оральное или дыхательное введение, суппозиторное и трансдермальные или чрескожные применения (напр., см. ссылочный документ 192), иглами и гипоаэрозолями. Дозировка для лечения может быть в режиме единственной дозы или в режиме множества доз (напр., включая повторные дозы).
Вакцины согласно изобретению, предпочтительно, являются стерильными. Предпочтительно, они не содержат пирогена. Предпочтительно, они буферированы, напр., при рН между 6 и 8, обычно около рН 7. Когда вакцина включает соль гидроксида алюминия, предпочтительно использовать гистидиновый буфер [193].
Вакцины согласно изобретению могут включать детергент (напр., Твин, такой как Твин 80) в низкой концентрации (напр., <0,01%). Вакцины согласно изобретению могут включать сахарный спирт (напр., маннитол) или трегалозу, напр., около 15 мг/мл, особенно если их предстоит лиофилизировать.
Оптимальные дозы индивидуальных антигенов могут быть оценены эмпирически. В целом, однако, сахаридные антигены согласно изобретению вводят в дозе между 0,1 и 100 мкг каждого сахарида на дозу, при типичной дозировке в объеме 0,5 мл. Обычно, доза составляет между 5 и 20 мкг сахарида на дозу. Эти величины измеряют относительно сахарида.
Вакцины согласно изобретению могут быть либо профилактическими (т.е. для предотвращения инфицирования), либо терапевтическими (т.в. для лечения заболевания после инфицирования), но обычно являются профилактическими.
Изобретение предусматривает конъюгат для применения в медицине.
Изобретение также предусматривает способ усиления иммунного ответа у пациента, включающий введение пациенту конъюгата согласно изобретению. Иммунный ответ предпочтительно является защитным против менингококкового заболевания, пневмококкового заболевания или Н. Influenzae и может включать гуморальный иммунный ответ и/или клеточный иммунный ответ. Пациентом предпочтительно является ребенок. Способ может усиливать повторный иммунный ответ у пациента, который уже был примирован против менингококка, пневмококка или Н. Influenzae.
Изобретение обеспечивает также использование конъюгата согласно изобретению в производстве медикамента для усиления иммунного ответа у пациента, который был предварительно обработан сахаридным антигеном, другим по отношению к антигену, включенному в композицию, конъюгированную с носителем.
Изобретение предусматривает также использование конъюгата в производстве медикамента для усиления иммунного ответа у пациента, который был предварительно обработан сахаридным антигеном, сходным с тем, который включен в композицию, коньюгтрованную с носителем.
Предпочтительно, медикамент является иммуногенной композицией (напр., вакциной). Предпочтительно, медикамент предназначен для предотвращения и/или лечения заболевания, вызываемого Neisseria (напр., менингита, септикемии, гонореи и т.д.), Н. influenzae (напр., среднего отита, бронхита, пневмонии, целлюлита, перикардита, менингита и т.д.) или пневмококками (напр., менингита, сепсиса, пневмонии и т.д.). Предпочтительным является предотвращение и/или лечение бактериального менингита.
Вакцины можно тестировать на стандартных животных моделях (см., напр., ссылочный документ 194).
Кроме того, изобретение предусматривает набор, включающий: а) первый конъюгат согласно изобретению и b) второй конъюгат согласно изобретению.
Адъюванты
Конъюгаты согласно изобретению могут вводиться вместе с другими иммунорегуляторными агентами. В частности, композиции обычно включают адъювант. Адъюванты, которые могут быть использованы в композициях согласно изобретению, включают, но не ограничиваются ими:
А. Минерал-содержащие композиции:
Минерал-содержащие составы, подходящие для использования в качестве адъювантов в данном изобретении, включают минеральные соли, такие как соли алюминия и соли кальция. Такие минеральные составы могут включать минеральные соли, такие как гидроксиды (напр., оксигидроксиды), фосфаты (напр., гидроксифосфаты, ортофосфаты), сульфаты и т.д. [см., напр., главы 8 и 9 в ссылочном документе 195] или смеси разных минеральных соединений (напр., смесь фосфата и гидроксидного адъюванта, необязательно, с избытком фосфата), причем соединения могут иметь любую подходящую форму (напр., гели, кристаллические, аморфные и т.д.) и, предпочтительно, адсорбированы на соли(-ях). Минерал-содержащие составы могут быть также приготовлены в виде частиц солей металлов [196].
Алюминиевые соли могут быть включены в композиции согласно изобретению таким образом, что содержание Al3+ находится в интервале между 0,2 и 1,0 мг на дозу.
Типичный фосфат-алюминиевый адъювант представляет собой аморфный гидроксифосфат алюминия с молярным соотношением РO4/Аl между 0,84 и 0,92, при концентрации 0,6 мг Аl3+/мл. Можно использовать адсорбцию с небольшим количеством фосфата алюминия, напр., между 50 и 100 мкг Al3+ в конъюгате на дозу. Когда используется фосфат алюминия, и желательно не адсорбировать антиген на адъюванте, подойдет включение свободных ионов фосфата в раствор (напр., используя фосфатный буфер).
В. Масляные эмульсии
Масляно-эмульсионные составы, подходящие для использования в качестве адъювантов с конъюгатами согласно изобретению, включают сквален-водные эмульсии, такие как MF59 (5% Сквалена, 0,5% Твин 80 и 0,5% Спан 85, приготовленные в виде субмикронных частиц, используя микрофлюидизатор) [Глава 10 ссылочного документа 195; см. также документы 197-199]. MF59 используется в качестве адъюванта в вакцине FLUAD™, содержащей тривалентную субъединицу вируса гриппа. Эмульсия MF59 имеет преимущество в том, что включает цитрат-ионы, напр., 10 мМ натрий-цитратный буфер.
Особенно предпочтительными адъювантами для использования в композициях являются субмикронные эмульсии масло-в-воде. Предпочтительными субмикронными эмульсиями масло-в-воде для использования в данном случае являются эмульсии сквален/вода, необязательно, содержащие различные количества МТР-РЕ, такие как субмикронная эмульсия масло-в-воде, содержащая 4-5% масс./об. сквалена, 0,25-1% масс./об. Твин 80 (моноолеат полиоксиэтиленсорбитана) и/или 0,25-1,0% Спан 85 (сорбитана триолеат), и, необязательно, N-ацетилмурамил-L-аланил-D-изоглуатминил-L-аланин-2-(1'-2'-дипалмитоил-sn-глицеро-3-гидроксифосфофорилокси)-этиламин (МТР-РЕ). Субмикронные эмульсии масло-в-воде, методы их приготовления и иммуностимулирующие агенты, такие как мурамил-пептиды, для использования в композициях детально описаны в ссылочных документах 197 и 200-201.
Может использоваться эмульсия сквалена, токоферола и Твина 80. Эмульсия может включать забуференный фосфатом физиологический раствор (PBS). Она также может включать Спан 85 (напр., при 1%) и/или лецитин. Эти эмульсии могут содержать от 2 до 10% сквалена, от 2 до 10% токоферола и от 0,3 до 3% Твин 80 и иметь весовое соотношение сквален:токоферол, предпочтительно, ≤1, поскольку оно обеспечивает более стабильную эмульсию. Одна такая эмульсия может быть приготовлена растворением Твин 80 в PBS с получением 2%-го раствора, последующим смешиванием 90 мл этого раствора со смесью (5 г DL-α-токоферола и 5 мл сквалена) и дальнейшим микрофлюидизированием смеси. Полученная эмульсия может содержать капельки масла субмикронного размера, напр., со средним диаметром между 100 и 250 нм, предпочтительно около 180 нм.
Может быть использована эмульсия сквалена, токоферола и детергента Тритон (напр., Тритон Х-100).
Может быть использована эмульсия сквалена, полисорбата 80 и полоксамера 401 ("Pluronic™ L121"). Эмульсия может быть приготовлена в забуференном фосфатом физиологическом растворе, рН 7,4. Эта эмульсия является пригодным носителем для доставки мурамиловых дипептидов и применяется с треонил-MDP в адъюванте "SAF-1" [202] (0,05-1% Thr-MDP, 5% сквалена, 2,5% Pluronic L121 и 0,2% полисорбата 80). Она может также использоваться без Thr-MDP, как в адъюванте "AF" [203] (5% сквалена, 1,25% Pluronic L121 и 0,2% полисорбата 80). Предпочтительно использование микрофлюидизации.
Полный адъювант Фройнда (CFA) и неполный адъювант Фройнда (IFA) также могут использоваться в качестве адъювантов.
С. Сапониновые составы
Сапониновые составы могут также быть использованы в качестве адъювантов конъюгатов согласно изобретению. Сапонины представляют собой разнородную группу стерольных гликозидов и тритерпеноидных гликозидов, которые обнаружены в коре, листьях, стеблях, корнях и даже цветках широкого круга видов растений. Сапонины, выделенные из коры Quillaia saponaria Мыльного дерева, хорошо изучены в качестве адъювантов. Сапонин может быть также коммерчески получен из Smilax ornata (сассапариль), Gypsophilla paniculata (гипсофила ползучая) и Saponaria officianalis (мыльный корень). Составы сапониновых адъювантов включают очищенные составы, такие как QS21, а также липидные составы, такие как ISCOMs. QS21 маркетируется как Stimulon™. Сапониновые составы очищают, используя HPLC и RP-HPLC. Используя эти методики, идентифицируют специфические очищенные фракции, включающие QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C. Предпочтительно, сапонином является QS21. Метод получения QS21 раскрыт в ссылочном документе 204. Сапониновые составы могут также включать стерол, такой как холестерол [205].
Сочетания сапонинов и холестеролов можно использовать для получения уникальных частиц, называемых иммуностимулирующими комплексами (ISCOM) [глава 23 ссылочного документа 195]. ISCOMs в типичных случаях также включают фосфолипид, такой как Фосфатидилэтаноламин или Фосфатидилхолин. В ISCOMs может использоваться любой известный сапонин. Предпочтительно ISCOM включает один или более QuilA, QHA и QHC. ISCOMs также описаны в ссылочных документах 205-207. При необходимости, ISCOMs не содержат дополнительного(-ых) детергента(-ов) [208].
Обзор адъювантов, разработанных на основе сапонинов, можно найти в ссылочных документах 209 и 210.
D. Виросомы и вирусоподобные частицы
Виросомы и вирусоподобные частицы (VLPs) также могут быть использованы в качестве адъювантов в изобретении. Эти структуры обычно содержат один или более протеинов из вируса, необязательно объединенные с или включающие фосфолипид. Они обычно являются не-патогенными, не-реплицирующимися и обычно не содержат какого-либо нативного вирусного генома. Вирусные протеины могут быть получены рекомбинантным путем или выделены из полных вирусов. Эти вирусные протеины, подходящие для использования в виросомах или VLPs, включают протены, происходящие из вируса гриппа (такие как НА или NA), вируса Гепатита В (такие как коровый или капсидный протеины), вируса Гепатита Е, вируса кори, вируса Синдбиса, Ротавируса, вируса Ящура, ретровируса, Норуокского вируса, человечьего вируса Папилломы, HIV, РНК-фагов, Qβ-фага (такие как оболочечные протеины), GA-фага, fr-фага, фага АР205 и Ту (такого как протеин р1 ретротранспозона Ту). VLPs обсуждаются также в ссылочных документах 211-216. Виросомы обсуждаются также, например, в документе 217.
Е. Бактериальные или микробные производные
Адъюванты, подходящие для использования в изобретении, включают бактериальные или микробные производные, такие как не-токсичные производные энтеробактериального липополисахарида (LPS), производные липида А, иммуностимуляторные олигонуклеотиды и ADP-рибозилирующие токсины и их детоксифицированные производные.
Нетоксичные производные LPS включают монофосфорила липид A (MPL) и 3-O-деацилированный MPL (3dMPL). 3dMPL представляет собой смесь 3 де-O-ацилированного монофосфорила липида А с 4, 5 или 6 ацилированными цепями. Предпочтительная форма «малые частицы» 3 де-O-ацилированного монофосфорила липида А раскрыта в ссылочном документе 218. Такие «малые частицы» 3dMPL достаточно малы, чтобы стерильно фильтроваться через 0,22 мкм мембрану [218]. Другие не-токсичные производные LPS включают мимики монофосфорила липида А, такие как аминоалкил-глюкозаминид-фосфатные производные, напр., RC-529 [219, 220].
Производные липида А включают производные липида А из Escherichia coli, такие как ОМ-174. ОМ-174 описаны, например, в ссылочных документах 221 и 222.
Иммуностимуляторные олигонуклеотиды, подходящие для использования в качестве адъювантов в изобретении, включают нуклеотидные последовательности, содержащие CpG-мотив (динуклеотидная последовательность, содержащая неметилированный цитозин, сцепленный посредством фосфатной связи с гуанозином). Также показано, что двунитевые РНК и олигонуклеотиды, содержащие палиндромные или поли(dG) последовательности, являются иммуностимуляторными.
CpG's могут включать нуклеотидные модификации/аналоги, такие как фосфоротиоатные модификации, и могут быть двунитевыми или однонитевыми. Ссылочные документы 223, 224 и 225 раскрывают возможные аналогичные замещения, напр., замещение гуанозина 2'-дезокси-7-деазагуанозином. Адъювантное действие CpG-олигонуклеотидов раскрывается также в ссылочных документах 226-231.
CpG-последовательность, такая как мотив GTCGTT или TTCGTT, может быть направлена на TLR9 [232]. CpG-последовательность может быть специфичной для включения Тh1-иммунного ответа, такая как CpG-A ODN, или она может быть специфичной для индуцирования ответа В-клеток, такая как CpG-B ODN. CpG-A ODN и CpG-B ODN обсуждаются в ссылочных документах 233-235. Предпочтительно, CpG является CpG-A ODN.
Предпочтительно, CpG-олигонуклеотид конструируют так, чтобы 5'-конец оказался доступным для распознавания рецептором. Необязательно, две CpG-олигонуклеотидные последовательности могут быть присоединены своими 3'-концами с образованием «иммуномеров». См., например, ссылочные документы 232 и 236-238.
Бактериальные ADP-рибозилирующие токсины и их детоксифицированные производные могут быть использованы в качестве адъювантов в изобретении. Предпочтительно, протеин происходит из Е. coli (Е. coli тепловой лабильный энтеротоксин "LT"), холеры ("СТ") или коклюша ("РТ"). Использование детоксифицированных ADP-рибозилирующих токсинов в качестве мукозных адъювантов описано в ссылочном документе 239 и в качестве парентеральных адъювантов - в документе 240. Токсин или токсоид предпочтительно представлен в форме голотоксина, включающего как А-, так и В-субъединицы. Предпочтительно, А-субъединица содержит детоксифицирующую мутацию; предпочтительно, В-субъединица не является мутированной. Предпочтительно, адъювант является детоксифицированным LT-мутантом, таким как LT-K63, LT-R72 и LT-G192. Использование ADP-рибозилирующих токсинов и их детоксифицированных производных, в частности LT-K63 и LT-R72, в качестве адъювантов можно найти в ссылочных документах 241-248. Многочисленные ссылки на аминокислотные замещения, основанные, предпочтительно, на выравнивании А- и В-субъединиц ADP-рибозилирующих токсинов, представлены в документе 249, специально включенном здесь посредством ссылки во всей его полноте.
В качестве адъювантов могут также быть использованы соединения формул I, II или III, или их соли:
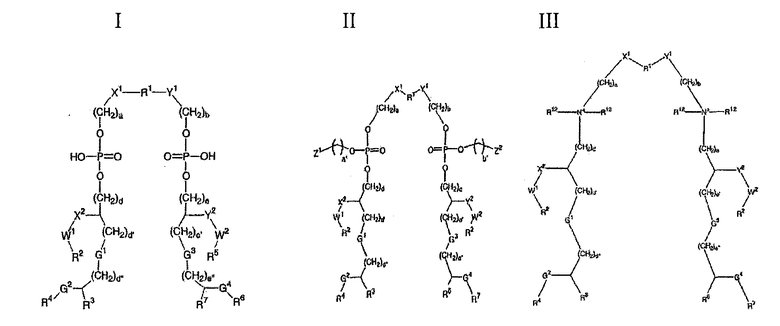
как определено в ссылочном документе 250, такие как 'ER 803058', 'ER 803732', 'ER 804053', ER 804058', 'ER 804059', 'ER 804442', 'ER 804680', 'ER 804764', ER 803022 или 'ER 804057', напр.,
ER 804057
 ER 803022
ER 803022
F. Иммуномодуляторы человека
Иммуномодуляторы человека, подходящие для использования в качестве адъювантов в изобретении, включают цитокины, такие как интерлейкины (напр., IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 [251], IL-23, IL-27 [252] u т.д.) [253], интерфероны (напр., интерферон-γ), макрофаговый колониестимулирующий фактор, фактор некроза опухоли и макрофаговый воспалительный протеин-1 альфа (М1Р-1альфа), и М1Р-1бета [254].
G. Биоадгезивы и Мукоадгезивы
Биоадгезивы и мукоадгезивы также могут быть использованы в качестве адъювантов в изобретении. Подходящие биоадгезивы включают этерифицированные микросферы гиалуроновой кислоты [255] или мукоадгезивы, такие как поперечно-сшитые производные поли(акриловой кислоты), поливинилового спирта, поливинилового пироллидона, полисахариды и карбоксиметилцеллюлоза. Хитозан и его производные также могут быть использованы в качестве адъювантов в изобретении [256].
Н. Микрочастицы
Микрочастицы также могут быть использованы в качестве адъювантов в изобретении. Микрочастицы (т.е. частицы от ~100 нм до ~150 мкм в диаметре, более предпочтительно от ~200 нм до 30 мкм в диаметре и наиболее предпочтительно от ~500 нм до 10 мкм в диаметре), формированные из материалов, которые являются биодеградируемыми и нетоксичными (напр., поли(α-гидроксикислота), полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапролактон и т.д.), с поли(лактид-ко-гликозид) являются предпочтительными, которые, необязательно, обработаны с получением отрицательно заряженной поверхности (напр., с помощью SDS) или положительно заряженной поверхности (напр., с помощью катионного детергента, такого как СТАВ).
I. Липосомы (Главы 13 и 14 ссылочного документа 195)
Примеры липосомных составов, подходящих для использования в качестве адъювантов, описаны в реферативных документах 257-259.
J. Полиоксиэтиленовый эфир и составы с полиоксиэтилвновым эфиром
Адъюванты, подходящие для использования в изобретении, включают полиоксиэтиленовые эфиры и полиоксиэтиленовые эфиры [260]. Такие составы далее включают полиоксиэтиленовые суфрактанты эфиров сорбита в комбинации с октоксинолом [261], а также полиоксиэтиленовые эфиры алкилов или суфрактанты эфиров в комбинации с, по крайней мере, одним дополнительным не-ионным суфрактантом, таким как октоксинол [262]. Предпочтительные полиоксиэтиленовые эфиры выбирают из следующей группы: полиоксиэтилен-9-лауриловый эфир (лаурет 9), полиоксиэтилен-9-стеориловый эфир, полиоксиэтилен-8-стеориловый эфир, полиоксиэтилен-4-лауриловый эфир, полиоксиэтилен-35-лауриловый эфир и полиоксиэтилен-23-лауриловый эфир.
K. Полифосфазен (РСРР)
Составы РСРР (поли[ди(карбоксилатофенокси)фосфазен]) описаны, например, в ссылочных документах 263 и 264.
L. Мурамиловые пептиды
Примеры мурамиловых пептидов, подходящих для использоания в качестве адъювантов в изобретении, включают N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нормурамил-L-аланил-D-изоглутамин (nor-MDP) и Н-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитол-sn-глицеро-3-гидроксифосфорилокси)-этиламин МТР-РЕ).
М. Имидазохинолоновые соединения
Примеры имидазохинолоновых соединений, подходящих для использования в качестве адъювантов в изобретении включают Имикамод и его гомологи (напр., Резикимод 3М), описанные в ссылочных документах 265 и 266.
N. Тиосемикарбазоновые соединения
Примеры тиосемикарбазоновых соединений, а также методы составления, производства и скринирования соединений, полностью походящих для использования в качестве адъювантов в изобретении, включают те, которые описаны в ссылочном документе 267. Тиосемикарбазоны особенно эффективны в стимуляции одноядерных клеток периферической крови человека для выработки цитокинов, таких как TNF-α.
О. Триптантриновые соединения
Примеры триптантриновых соединений, а также методы составления, производства и скринирования соединений, полностью походящих для использования в качестве адъювантов в изобретении, включают те, которые описаны в ссылочном документе 268. Триптантриновые соединения особенно эффективны в стимуляции одноядерных клеток периферической крови человека для выработки цитокинов, таких как TNF-α.
Р. Нуклеозидные аналоги
В качестве адъювантов могут быть использованы различные аналоги нуклеозидов, такие как (а) Изаторабин (ANA-245; 7-тиа-8-оксогуанозин):
и их пролекарства; (b) ANA975; (с) ANA-025-1; (d) ANA380; (е) соединения, раскрытые в ссылочных документах 269-271; (f) соединения, имеющие формулу:
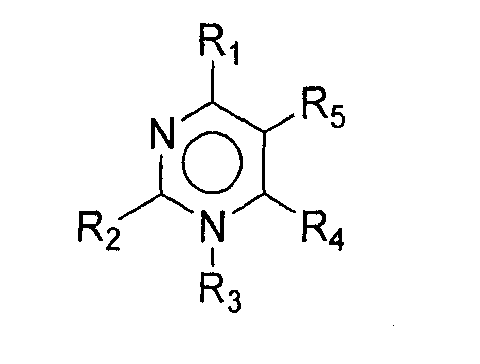
где:
R1 и R2 являются каждый независимо Н, галогеном, -NRaRb, -ОН, C1-6-алкокси, замещенным C1-6-алкокси, гетероциклом, замещенным гетероциклом, С6-10-арилом, замещенным С6-10-арилом, C1-6-алкилом или замещенным C1-6-алкилом;
R3 или отсутствует, или является Н, C1-6-алкилом, замещенным C1-6-алкилом, С6-10-арилом, замещенным С6-10-арилом, гетероциклом, замещенным гетероциклом;
R4 и R5 являются каждый независимо один от другого Н, галогеном, гетероциклом, замещенным гетероциклом, -C(O)-Rd, C1-6-алкилом, замещенньш C1-6-алкилом, или связаны одно с другим с образованием 5-членного кольца, как в R4-5:
при этом соединение осуществляется по связям, обозначенным « »,
»,
X1 и Х2 являются каждый независимо один от другого N, С, О или S,
R8 представляет собой Н, галоген, ОН, C1-6-алкил, С2-6-алкенил, С2-6-алкинил, -ОН, -NRaRb, -(CH2)n-O-Rc, -O-(C1-6-алкил), -S(O)pRe или -C-(O)-Rd;
R9 является Н, C1-6-алкилом, замещенным C1-6-алкилом, гетероциклом, замещенным гетероциклом или R9a,
где R9a представляет собой
при этом соединение осуществляется по связи, обозначенной « »,
»,
R10 и R11 каждый независимо один от другого является Н, галогеном, C1-6-алкокси, замещенным C1-6-алкокси, -NRaRb или -ОН;
Ra и Rb независимо один от другого являются Н, C1-6-алкилом, замещенным C1-6-алкилом, -C-(O)-Rd, С6-10-арилом;
каждый Rc независимо является Н, фосфатом, дифосфатом, трифосфатом, C1-6-алкилом или замещенным C1-6-алкилом;
каждый Rd независимо является Н, галогеном, C1-6-алкилом, замещенным C1-6-алкилом, C1-6-алкокси, замещенным C1-6-алкокси, -NH2, -NH(С1-6-алкилом),
-NH(замещенным C1-6-алкилом), -N(С1-6-алкилом)2, -N(замещенным С1-6-алкилом)2, С6-10-арилом или гетероциклом;
каждый Re независимо является Н, C1-6-алкилом, замещенным C1-6-алкилом, С6-10-арилом, замещенным С6-10-арилом, гетероциклом или замещенным гетероциклом;
каждый Rf независимо является Н, C1-6-алкилом, замещенным C1-6-алкилом, -С-(O)-Rd, фосфатом, дифосфатом или трифосфатом;
каждый n независимо является 0, 1, 2 или 3;
каждый p независимо является 0, 1, 2; или
(g) фармацевтически приемлемая соль любого из (а) - (f), таутомер любого из (а) - (f) или фармацевтически приемлемая соль таутомера.
Q. Липиды, сцепленные с фосфат-содержащим ациклическим каркасом
Адъюванты, содержащие липиды, сцепленные с фосфат-содержацим ациклическим каркасом, включают TLR4-антагонист Е5564 [272, 273]:
R. Малые молекулы иммунопотенциаторов (SMIPs)
SMIPs включают:
- N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
- N2,N2-диметил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
- N2-этил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
- N2-метил-1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
- 1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
- N2-бутил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
- N2-бутил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
- N2-мeтил-1-(2-мeтилпpoпил)-N2-пeнтил-1H-имидaзo[4,5-c]xинoлин-2,4-диaмин;
- N2-метил-1-(2-метилпропил)-N2-проп-2-енил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
- 1-(2-метилпропил)-2-[(фенилметил)тио]-1Н-имидазо[4,5-с]хинолин-4-амин;
- 1-(2-метилпропил)-2-(пропилтио)-1Н-имидазо[4,5-с]хинолин-4-амин;
- 2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этанол;
- 2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этил ацетат;
- 4-амино-1-(2-метилпропил)-1,3-дигидро-2Н-имидазо[4,5-с]хинолин-2-один;
- N2-бутил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
- N2-бyтил-N2-мeтил-1-(2-мeтилпpoпил)-N4,N4-биc(фeнилмeтил)-1H-имидaзo[4,5-с]хинолин-2,4-диамин;
- N2-метил-1-(2-метилпропил)-Н4,Н4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
- N2,N2-диметил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н- имидазо[4,5-с]хинолин-2,4-диамин;
- 1-{4-амино-2-[метил(пропил)амино]-1Н-имидазо[4,5-с]хинолин-1-ил}-2-метилпропан-2-ол;
- 1-[4-амино-2-(пропиламино)-1Н-имидазо[4,5-с]хинолин-1-ил]-2-метилпропан-2-ол;
- N4,N4-дибензил-1-(2-метокси-2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин.
S. Протеосомы
Один адъювант является препаратом белка наружней мембраны протеосомы, приготовленным из первой грамотрицательной бактерии, в комбинации с липосахаридным препаратом, полученным из второй грамотрицательной бактерии, при этом препараты белка наружней мембраны протеосомы и липосахарида образуют стабильный не-ковалентный адъювантный комплекс. Такие комплексы включают "IVX-908", комплекс, включающий наружную мембрану Neisseria meningitidis, и полисахариды. Они используются как адъюванты для вакцин против гриппа [274].
Т. Другие адъюванты
Другие вещества, которые действуют как иммуностимулирующие агенты, раскрываются в ссылочных документах 195 и 275. Пригодные вещества-адъюванты также включают:
- Метилинозин-5'-монофосфат ("MIMP") [276].
- Полигидроксилированное пирролизидиновое соединение [277], такое как соединение, имеющее формулу:
где R выбрано из группы, включающей водород, линейная или разветвленная, незамещенная или замещенная, ненасыщенная или насыщенная ацильная, алкильная (напр., циклоалкильная), алкенильная, алкинильная и арильная группы, или их фармацевтически приемлемые соли или производные. Примеры включают, но не ограничиваются: казуарин, казуарин-6-α-D-глюкопиранозу, 3-epi-казуарин, 7-epi-казуарин, 3,7-диepи-казуарин, и т.д.
- Гамма-инулин [278] или его производное, такое как альгаммулин.
- Соединения, раскрытые в ссылочном документе 279.
- Соединения, раскрытые в ссылочном документе 280, включая: Ацилпиперазиновые соединения, Индоледионовые соединения, Тетрагидраизохинолиновые (THIQ) соединения, Бензоциклодионовые соединения, Аминоазавиниловые соединения, Аминобензимидазол хинолиноновые (ABIQ) соединения [281, 282], Гидрафталамидовые соединения, Бензофеноновые соединения, Изоксазоловые соединения, Стерольные соединения, Хиназилиноновые соединения, Пиррольные соединения [283], Антрахиноновые соединения, Хиноксалиновые соединения, Триазиновые соединения, Пиразалопиримидиновые соединения и Бензазольные соединения [284].
- Локсорибин (7-аллил-8-оксогуанозин) [285].
Состав катионного липида и (обычно нейтрального) ко-липида - такой как аминопропил-диметил-миристолейлокси-пропанаминий бромид-дифитаноилфосфатидил-этаноламин ("Vaxfectin™") или аминопропил-диметил-бис-додецилокси-пропанаминий бромид-диолеоилфосфатидил-этаноламин ("GAP-DLRIE:DOPE"). Составы, содержащие соли (±)-N-(3-aминoпpoпил)-N,N-димeтил-2,3-биc(cин-9-тeтpaдeцeнeилoкcи)-1-пpoпaнaминия, предпочтительны [286].
Изобретение может также включать комбинации аспектов одного или более адъювантов, идентифицированных выше. Например, в качестве адъювантных составов в изобретении могут использоваться следующие комбинации: (1) сапонин и эмульсия масло-в-воде [287]; (2) сапонин (напр., QS21) + не-токсичное LPS-производное {напр., 3dMPL) [288]; (3) сапонин (напр., QS21) + не-токсичное LPS-производное (напр., 3dMPL) + холестерол; (4) сапонин (напр., QS21) + 3dMPL + IL-12 (необязательно + стерол) [289]; (5) комбинации 3dMPL с, например, QS21 и/или эмульсиями масло-в-воде [290]; (6) SAF, содержащий 10% сквален, 0,4% Твин 80™, 5% плюроник-блок полимер L121, и thr-MDP, либо микрофлюидизированный в субмикронную эмульсию или подверженный встряхиванию с целью образования эмульсии частиц более крупного размера; (7) Ribi™-адъювантная система (RAS), (Ribi Immunochem), содержащая 2% сквален, 0,2% Твин 80 и один или более компонентов бактериальной клеточной стенки, из группы, состоящей из монофосфорилипида A (MPL), димиколат трегалозы (TDM) и каркаса клеточной стенки (CWS), предпочтительно MPL + CWS (Detox™); (8) одна или более минеральных солей (такой как алюминиевая соль) + не-токсичное производное LPS (такое как 3dMPL); и (9) одна или более минеральных солей (таких как алюминиевая соль) + иммуностимуляторный олигонуклеотид (такой как нуклеотидная последовательность, включающая CpG-мотив).
Определения
Термин «включающий» охватывает «содержащий» и «состоящий», напр., композиция, «включающая» X, может состоять исключительно из Х или может содержать что-либо дополнительное, напр., Х+Y.
Термин «примерно» в отношении числовой величины x означает, например, x±10%. Все числовые величины могут здесь рассматриваться как определяемые посредством «примерно», если иное не вытекает из контекста.
Слово «существенно» не исключает значения «полностью», напр., композиция, которая «существенно свободна» от Y, может быть полностью свободна от Y. Где это необходимо, слово «существенно» может быть опущено из определения изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 показывает различные возможные комбинации носителя и сахаридного антигена: (А) два моновалентных конъюгата, (В) моновалентный конъюгат, демонстрирующий, что каждая молекула протеина-носителя может быть связана с более чем одной молекулой сахаридного антигена, и (С) мультивалентный конъюгат, в котором более чем один антигенно отличающийся сахарид соединен с каждой молекулой протеина-носителя.
Фигура 2 показывает IgG иммунные ответы сыворотки против МеnС. Группы из шести BALB/c-мышей иммунизировались три раза уменьшающимися количествами N19-MenC или CRM-MenC (2,5; 0,625; 0,156 и 0,039 мкг МеnС/доза) и 0,5 мг гидроксида алюминия. Образцы сыворотки собирали до (пре) и после (пост-1, -2 и -3) каждой иммунизации и тестировали индивидуально, чтобы количественно определить титры МеnС-специфических IgG-антител. Каждая точка представляет средний титр антител (±1 SD) каждой группы в каждой временной точке.
Фигура 3 показывает IgG иммунный ответы на носитель в единичных образцах сыворотки мышей, иммунизированных, как описано выше. Поскольку мыши иммунизировались равными количествами МеnС в любом конъюгате, конечное количество протеина-носителя немного различается в группах, получавших CRM-MenC, и тех, которые получали N19-MenC, вследствие некоторой разницы в соотношении сахар-протеин в двух конструктах. Образцы сыворотки собирали до (пре) и после (пост-1, -2 и -3) каждой иммунизации и тестировали индивидуально, чтобы количественно оценить специфические к носителю IgG-антитела. Каждая точка представляет средний титр антител (±1 SD) каждой группы в каждой временной точке.
Фигура 4 показывает бактериальную активность в образцах сыворотки мышей, иммунизированных три раза уменьшающимися количествами N19-MenC или CRM-MenC (2,5 мкг; 0,625 мкг; 0,156 мкг; 0,039 мкг МеnС/доза) и 0,5 мг гидроксида алюминия. Показаны титры антитела с бактерицидными свойствами из образцов объединенной сыворотки, собранных до (пре) и после (пост-1, -2 и -3) каждой иммунизации. Результаты выражали в виде значений, обратных самому высокому разбавлению сыворотки, дающему более 50% гибели бактерий.
Фигура 5 показывает иммунные ответы против МеnА и МеnС в сыворотке. Группы из шести BALB/c-мышей иммунизировались три раза уменьшающимися количествами N19-MenA и N19-MenC, либо по отдельности, либо в комбинации, либо основанными на CRM конъюгатами (0,625; 0,156 и 0,039 мкг МеnА и/или МеnС/доза) в присутствии 0,06 мг фосфата алюминия. Образцы сыворотки собирали до (пре) и после (пост-1, -2 и -3) каждой иммунизации и измеряли титры IgG-антител против МеnА- и МеnС. Каждая точка представляет средний титр антител (±1 SD) каждой группы в каждой временной точке.
Фигура 6 показывает влияние на ответы серогрупп-специфических антител при увеличении дозы N19-тетравалентных комбинированных конъюгатных вакцин. Группы из шести BALB/c-мышей иммунизировались уменьшающимися количествами N19-MenACWY (непрерывные линии) или CRM-MenACWY (прерывистые линии) (от 2 до 0,074 мкг каждого MenPS/доза) в присутствии 0,06 мг фосфата алюминия в качестве адъюванта. Иммунизации производили на 0, 21 и 35 день и после каждой иммунизации (пост-1, -2 и -3) измеряли титры IgG-антител против MenA, MenC, MenW и MenY в сыворотке. Каждая точка представляет средний титр антител (±1 SD) каждой группы в каждой временной точке.
Фигура 7 показывает бактерицидную активность против групп С и W-135 в единичных сыворотках, полученных от мышей после двух (пост-2) и трех (пост-3) иммунизации посредством 0,074 мкг каждой PS на дозу (N19-MenACWY или CRM-MenACWY). Титры выражены как величины, обратные самым высоким разбавлениям сыворотки, дающим, по меньшей мере, 50% гибели бактерий. Каждая колонка представляет средние титры (±SD) группы в каждой временной точке.
Фигура 8 показывает динамику профиля авидности антител против МепС, сформированных у мышей после иммунизации посредством N19-MenACWY или CRM-MenACWY, как детализировано в разделе описания Материалы и Методы. Высокая авидность IgG-титров была измерена на смешанных сыворотках посредством модифицированного ELISA-метода. Результаты выражены в индексе авидности (AI), соответствующему процентному содержанию связанных антител после элюирования с помощью 75 мМ NH4SCN каждой группы после каждой иммунизации (пост 1-ая, пост 2-ая, пост 3-ья).
Фигура 9 показывает иммунные ответы против носителей и их родительских протеинов в смешанных сывортках, полученных после третьей иммунизации. Каждая точка представляет титр антител каждой группы после трех иммунизации, как описано выше.
Фигура 10 показывает иммунные ответы против анти-МепА. Группы из шести BALB/c-мышей иммунизировались три раза уменьшающимися количествами тетравалентных составов, приготовленных смешиванием вместе MenA, конъюгированного либо с N19, либо CRM, с MenCWY, конъюгированного либо с CRM, либо с N19 (N19-MenA+CRM-MenCWY и, наоборот, CRM-MenA+N19-MenCWY), Контрольные группы получали тетравалентные составы, содержащие одни носитель (N19-MenACWY или CRM-MenACWY). Мыши получали уменьшающееся количество тетравалентных рецептур (от 0,67 мкг до 0,074 мкг каждого MenSP/доза) в присутствии 0,06 мг фосфата алюминия в качестве адъюванта. Для простоты мы сообщаем лишь результаты, полученные после самой высокой (0,67 мкг) и самой низкой (0,074 мкг) иммунизирующей дозировки.
Фигура 11 показывает сывороточную бактерицидную активность BALB/c-мышей, иммунизированных три раза уменьшающимся количеством состава би-носителя или моно-носителя, как описано выше. Измерялись титры антител с бактерицидными свойствами из образцов объединенной сыворотки, собранных после второй (пост -2) и третьей (пост -3) иммунизации. Результаты выражали как величины, обратные самому высокому разбавлению сыворотки, дающему более 50% гибели бактерий.
Фигура 12 показывает иммунные ответы IgG-антител против капсул. Группы из BALB/c- или С57 ВL/6-мышей иммунизировали дважды посредством N19-MenACWY- или CRM-MenACWY-конъюгатов (0,67 или 0,22 мкг/доза каждого MenPS) в присутствии 0,06 мг фосфата алюминия. Образцы сыворотки собирали до (пре) и после (пост-1 и -2) каждой иммунизации, и измеряли титры MenA, MenC, MenW, MenY-специфических IgG-антител. Каждая точка представляет средний титр антител (±1 SD) каждой группы в каждой временной точке.
Фигура 13 показывает иммунные ответы IgG-антител против капсулх. BALB/c H-2 d, BALB/B H-2 b, B10.BR H-2 k, B10.D2N H-2 q и B10.D1 H-2 d мыши иммунизировались три раза N19-MenACWY или CRM-MenACWY (0,67 мкг/доза каждого PS) в присутствии 0,06 мг фосфата алюминия. Образцы сыворотки собирали до и после (пост-1, -2 и -3) каждой иммунизации, и измеряли титры MenA-, MenC-, MenW-, MenY-специфических IgG-антител. Каждый столбец представляет средний титр антител, и обозначения соответствуют отдельной мыши каждой группы в каждой временной точке.
Фигура 14 показывает бактерицидную активность сыворотки мышей разного происхождения, иммунизированных три раза посредством N19-MenACWY или CRM-MenACWY (0,67 мкг каждого MenPS/доза) и 0,06 мг фосфата алюминия. Показаны титры антител с бактерицидными свойствами образцов объединенной сыворотки, собранных после третьей иммунизации (пост-3). Результаты выражали как величины, обратные самому высокому разбавлению сыворотки, дающему более 50% гибели бактерий.
Фигура 15 показывает ответы пролиферации Т-клеток против N19 эпитопа. Клетки селезенки мышей, иммунизированных три раза посредством N19-MenACWY (6 мкг N19/доза), тестировали на пролиферацию in vitro в присутствии 0,9-30 мкМ трех отдельных пептидов (Р2ТТ, Р23ТТ, Р30ТТ) и 0,312-10 мкг/мл протеина N19, свободного или конъюгированного с PS, как показано на графике. Результаты выражали в виде индекса стимуляции (SI)=(число импульсов в мин (чим) в эксперименте/ число импульсов в мин нестимулированный фон).*=М19-концентрации от 0,312 до 10 мкг/мл.
Фигура 16 показывает ответы пролиферации Т-клеток против N19 эпитопа. Клетки селезенки мышей, иммунизированных два раза посредством N19-MenACWY (6 мкг N19/доза), тестировали на пролиферацию in vitro в присутствии 0,12-30 мкМ отдельных пептидов (Р2ТТ, Р21ТТ, Р23ТТ, Р30ТТ, Р32ТТ, НА, HBsAg) и 0,004-1 мкМ N19, как показано на графике. Результаты выражали в виде индекса стимуляции (SI)=(-число импульсов в мин в эксперименте/ число импульсов в мин нестимулированный фон)*=N19-концентрации от 1 до 0,004 мкМ.
Фигура 17 показывает Т-клеточный пролиферативный ответ конгенных линий мышей, иммунизированных N19-MenACWY. Штаммы мышей с различным Н-2 гаплотипом иммунизировали три раза посредством N19-MenACWY (6 мкг N19/доза) в присутствии 0,06 мг фосфата алюминия. Клетки селезенки тестировали на пролиферацию in vitro в присутствии 1,7-15 мкМ пептидов N19 (перечислены в Таблице 1) и 0,1-10 мкг/мл протеина N19, свободного или конъюгированного с MenPSs. Результаты выражали в виде индекса стимуляции (SI)=(число импульсов в мин в эксперименте/ число импульсов в мин нестимулированный фон). SI>2 считался положительным.
Фигура 18 показывает Т-клеточную активацию, специфичную для Р23ТТ, НА и HBsAg. Стимуляция указана относительно гомологичных пептидов и N19-протеина, как определено пролиферационным анализом. Группы из трех мышей иммунизировали у основания хвоста 50 мкл объема, содержащего 50 мкг индивидуального пептида, эмульгированного 1:1 в CFA. Спустя семь дней лимфатические узлы удаляли, и NL-клетки тестировали на их способность к пролиферации в присутствии гомологичного пептида или N19-протеина в различных концентрациях. Реазультаты были получены на основе одной мыши в трех культурах. Результаты выражали в виде индекса стимуляции (SI), расчитанного из расчета отношения среднего числа имульсов в мин экспериментальной группы к числу имульсов в мин фона.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
1. Приготовление гликоконъюгатов
1.1. Экспрессия и очистка полиэпитопного протеина N19
Штаммы Е. coli, несущие рекомбинантные плазмиды pQE-N19, выращивали в течение ночи на блюдцах с LB-агаром, 100 мкг/мл ампициллина при 37°С. Выращенные бактерии затем инокулировали в 500 мл LB-среды, 100 мкг/мл ампициллина, и выращивали в течение ночи при 37°С. 500 мл затем разводили в 5 л среды в ферментаторе. Рост осуществляли в оптимизированных условиях. При получении OD600нм-значения 4,2 экспрессию полиэпитопного протеина индуцировали в течение 3,5 часов посредством добавления 1 мМ IPTG (изо-пропил-тио-галактозид) до тех пор, пока значение OD600нм не достигало 7,2. Отбирали два образца супернатанта бактериальной культуры в нулевой момент времени перед добавлением IPTG (to OD 4,2) и во временной точке окончания экспрессии (tend OD 7,2). Полученный после центрифугирования осадок ресуспендировали в буферном образце и нагружали на 12,5% SDS-PAGE в серийном разведении, соответствующем различным ODs бактериальной культуры. Всю бактериальную культуру центрифугировали при 5000g в JA10-роторе (Beckman, Фуллертон, Калиф.) в течение 20 мин при 4°С. 60 г полученного клеточного осадка суспендировали в 500 мл лизисного буфера (6 М гуанидин-HCl, 100 мМ NaH2PO4, 2 мМ ТСЕР (Pierce) pH 8, размешивали в течение 1 ч при комнатной температуре (RT) и затем инкубировали в течение 1 ч при 37°С. Супернатант, содержащий растворенный протеин, собирали центрифугированием при 12000 об/мин в J20-роторе (Beckman) в течение 20 мин при RT и подвергали иммобилизирующей металл-аффинной хроматографии (IMAC). Перед адсорбированием образца на IMAC-колонке добавляли 1 мМ ТСЕР (Трис (2-карбоксиэтил) фосфин гидрохлорид, Pierce), который ранее показал свою важность во время очистки, чтобы избежать совместной очистки примесей, ковалентно связанных с N19 дисульфидными связями. Растворенный материал заливали в ХК50-колонку, содержащую 360 мл активированного никелем Chelating Sepharose Fast Flow модифицированной IDA (иминодиуксусной кислотой) (Pharmacia, Упсала, Швеция), после чего колонку промывали 5-ью объемами лизисного буфера. Затем применяли 300 мл градиента от гуанидин-НСl 6 М pH 8 - мочевины 8 М 8, содержащей 1 мМ ТСЕР. Колонку промывали 3-мя объемами буфера В (8 М мочевины, 100 мМ NaH2PO4, pH 7), и элюировали протеины с помощью 1800 мл 0-200 мМ градиента имидазола в буфере В. Фракции, собранные с колонки, качественно анализировали на 12,5% SDS-PAGE (BioRad) и оценивали количественно с помощью метода определения протеинов по Брэдфорду (BioRad-анализ протеинов).
Отобранные градиентные фракции, содержащие очищенные рекомбинантные протеины, подвергали Катионо-Обменной Хроматографии (СЕС). 600 мл объединенной фракций заливали в колонку ХК50-колонку, содержащую 120 мл SP-Sepharose Fast Flow полимера (Pharmacia, Упсала, Швеция). Колонку промывали 5-ью объемами буфера С (7 М мочевины, 20 мМ NaH2PO4, рН 7, 10 мМ β-Меркаптоэтанола), и элюировали протеины с помощью 1300 мл 0-500 мМ градиента NaCl в буфере С. Градиентные фракции, содержащие очищенные рекомбинантные протеины, селектированные с помощью 12,5% SDS-PAGE-анализа (BioRad), объединяли и подвергали диализу посредством 10 мМ NaH2PO4, 150 мМ NaCl, 10% глицерола. Конечные концентрации протеина определяли методом микро-ВСА согласно инструкциям производителя (Pierce). Протеин анализировали на 12,5% SDS-PAGE (BioRad). Оптическую плотность полос измеряли для полной оценки (с помощью компьютерной программы Image Master ID Elite v4.00 LabScan). Уровень эндотоксинов в конечном препарате протеина определялся Департатентом по Контролю Качества (Chiron Vaccines Siena) методом кинетической турбодиметрии пробы с лизатом амебоцитов (LAL).
1.2. Получение олигосахаридов
Группы А, С, W, Y менингококковых полисахаридов очищали из штаммов Neisseria meningitides по стандартной процедуре, описанной для получения менингококковых вакцин (291). Затем очищенные капсулярные полисахариды деполимеризовали и активировали, чтобы соединить с протеином-носителем, как описано ранее (292, 293). 3десь мы вкратце описываем методику приготовления олигосахаридов менингококковой серогруппы С. Очищенный капсулярный полисахарид МеnС подвергали гидролизу в 10 мМ натрий-ацетатного буфера рН 5,0, чтобы уменьшить среднюю степень полимеризации (DP). Реакцию проводили при 80°С в течение примерно 12 ч, пока DP не достигала 10. За DP можно следить он-лайн во время гидролиза, анализируя общее содержание сиаловой кислоты в исходном растворе полисахарида (постоянное во время гидролиза) и формальдегида, высвобождаемого из терминальной группы каждой цепи после окисления. Это измерение в реальном времени DP позволяло экстраполировать конечное время гидролиза. Размер олигосахаридов был определен по размеру с помощью Q-Sepharose FF ионообменной хроматографии, при которой полисахариды с более высоким молекулярным весом удерживались на колонке, в то время как олигосахариды, имеющие низкий молекулярный вес (DP<6), элиюровались с колонки 5 мМ натрий-ацетатным буфером, 100 мМ в NaCl, pH 6,5. Затем желаемую олисахаридную фракцию элюировали с помощью 0,7 М тетрабутиламмоний бромида (TAB), положительным противоионом, который вытеснял отрицательно заряженные олигосахариды из колонки. После этого продукты подвергали концентрации/диафильтрации водой на 3К отделяющей мембране, чтобы удалить избыток TAB и концентрировать МеnС-олигосахарид в препарате. После диафильтрации концентрат высушивали стадией роторного испарения. Далее МеnС-олигосахарид подвергали восстановительному аминированию, чтобы получить олигосахарид с терминальной первичной аминогруппой. Реакционную смесь составляли из 10% DMSO, 90% метанола, 50 мМ ацетата аммония и 10 мМ натрий-цианоборгидрида и инкубировали в течение 24 ч в закрытой водяной бане при 50°С. Затем реакционную смесь подвергали стадии роторного испарения для уменьшения содержания метанола в реакционной смеси аминирования, чтобы избежать возможного взаимодействия с силиконовыми трубками и диафильтрационными мембранами на последующей стадии диафильтрации. Аминированные олигосахариды затем очищали от реагентов (цианоборгидрида, DMSO, метанола) с помощью концетрации/диафильтрации 8-ью объемами 0,5 М NaCl, а затем 4-мя объемами 20 мМ NaCl. Очищенные аминированные олигосахариды высушивали в вакууме при подготовке к стадии активации. МеnС-олигосахарид солюбилизировали в воде, а затем добавляли к этой смеси DMSO. Добавляли триэтиламин (TEA), чтобы гарантировать достаточное депротонирование олигосахаридной первичной аминогруппы и ди-N-гидроксисукцинимид (бис-NHS) эфира адипиновой кислоты. Бис-NHS добавляли в молярном избытке, чтобы способствовать образованию ковалентной связи единичного олигосахаридного полимера с каждой молекулой бис-NHS эфира. Активированный олигосахарид осаждали добавлением ацетона к реакционной смеси ацетона, который также использовался для отделения олигосахаридов от DMSO, бис-NHS эфира и TEA. Осадок высушивали в вакууме, взвешивали и хранили при -20°С до тех пор, пока не использовали для конъюгации.
Процедура очистки других PSs была в основном такой же самой с небольшими модификациями во времени и температуре реакции.
1.3. Конъюгация N19 с менингококковыми олигосахаридами
После очистки, определения размера и активации олигосахариды использовали для последующей конъюгации с протеином N19 [295]. Перед началом эксперимента по конъюгации мы предварительно оценивали возможную аспецифическую адсорбцию полисахаридов на Ni-активированный полимер. В типичном эксперименте конъюгации 343,2 нмол протеина-носителя N19 растворяли в Гуанидий-НСl рН 8, 100 мМ Na2HPO4 и адсорбировали на предварительно нанесенные 5 мл Ni-активированного полимера Sepharose Fast Flow (Pharmacia, Упсала, Швеция), уравновешенного в таком же буфере. Гуанидий-НСl удаляли промывкой полимера 50 мл 100 мМ фосфатного буфера рН 7,5, и затем на колонку добавляли 1 мл 100 мМ фосфатного буфера рН 7,5, содержащего 6864 нмол активированного менингококкового олигосахарида (MenA, MenC, MenW или MenY), с рециркуляцией в течение 2 ч при комнатной температуре. Колонку промывали 50 мл 100 мМ Na2HPO4 рН 7,5, чтобы удалить избыток неконъюгированного олигосахарида. В заключение конъюгатный продукт элюировали 300 мМ имидазола, рН 7, NaH2PO4 и анализировали на 7,5% SDS-PAGE. Отобранные фракции, содержащие конъюгат, объединяли и подвергали диализу PBS. Глико-конъюгаты анализировали на содержание сахара и протеина. Содержание сахарида в MenC-, MenW- и MenY-конъюгатах квалифицировали посредством определения сиаловой кислоты (143), в то время как его содержание в МеnА-конюгате определяли маннозамин-1-фосфатной хроматографией (121). Содержание протеина измеряли микро-ВСА-анализом (Pierce, Рокфорд, Илл.). Степень гликозилирования вычисляли из весового соотношения сахар-протеин. Основанные на CRM конъюгатные вакцины (CRM-MenA, CRM-MenC, CRM-MenW, CRM-MenY), взятые в качестве эталона в данном исследовании, были приготовлены Производственным Департаментом (Chiron Vaccines Siena).
2. Линии мышей
Если не указано иначе, использовались группы из шести самок мышей BALB/c 7-недельного возраста. В другом эксперименте использовали конгенные линии 7-недельных самок мышей со следующим Н-2 гаплотипом: BALB/B (Н-2b), конгенные с BALB/c (Н-2d) и B10.BR (Н-2k) B10.D2N (H-2q), B10.D1 (Н-2d) конгенный с C57BL/6 (Н-2b). Мыши были получены от Charles River (Калько, Италия) или от Jackson Laboratories (Бар Харбор, Мэн).
3. График и препараты для иммунизации мышей
Мышей иммунизировали подкожно на 0, 21 и 35 день N19- или CRM-конъюгатами посредством различных 0,5 мл препаратов моновалентной, бивалентной, тетравалентной или с би-носителем конъюгатной вакцины, основанной на сахаридном содержании, разведенном в NaCl 0,9% буфере, как конкретно описано ниже. Индивидуальные образцы сыворотки брали в дни -1 (до), 20 (пост- 1), 34 (пост- 2) и 45 (пост- 3) и замораживали при -20°С до использования. Селезенки собирались от мышей, иммунизированных N19-конъюгатами для оценки Т-клеточной пролиферации, как описано в разделе, касающемся иммунного ответа, опосредованного клетками.
3.1. Моновалентная менингококковая-С коньюгатная вакцина
Мышей иммунизировали уменьшающимися количествами N19-MenC или CRM-MenC (от 2,5 до 0,039 мкг МеnС/доза) в присутствии 0,5 мг гидроксида алюминия в качестве адъюванта. Титры антител измеряли, как детализировано ниже.
Конъюгат, содержащий N19, был более иммуногенным, чем тот, который содержал CRM (Фигура 2). После двух иммунизации основанные на N19 конструкты индуцировали IgG-антитела сыворотки против МеnС при значительно более высоких титрах, чем титры, которые индуцировались тремя дозами CRM-MenC-конъюгата (напр., пост-2 N19-MenC при 0,625 мкг против пост-3 CRM-MenC при 0,625 мкг [Р<0,01]; пост-2 N19-MenC при 0,156 мкг против пост-3 CRM-MenC при 0,156 мкг [Р<0,05]). Кроме того, после трех доз более низкие количества N19-конъюгата были достаточны, чтобы индуцировать IgG-антитела против МеnС в значительно большем количестве, чет те, которые индуцировались CRM-MenC-конъюгатом (напр., N19-MenC при 0,156 мкг против CRM-MenC при 0,625 мкг [Р<0,01]).
Две и три иммунизации с помощью конъюгатов, основанных на CRM, индуцировали сильные ответы антител к носителю по сравнению с CRM даже при самых низких тестовых дозах (т.е. 0,3 мкг и ниже). В противоположность этому, имунный ответ против N19 всегда был ничтожным и обнаруживался (хотя и при очень низких титрах) только при самой высокой дозе (т.е. 0,6 мкг) (Фигура 3). Эти низко-титровые антитела против N19 не распознавали токсоид столбняка в твердой фазе. Эти результаты ясно показывают, что сильный хелперный сигнал №9-полиэпитопа не сопровождается индукцией значительных титров антител ни против N19, ни против нативных протеинов.
Поскольку защитный иммунитет против МеnС основывается, в основном, на антителах с бактерицидными свойствами, которые убивают бактерии в присутствии комплемента, измерялась функциональная активность индуцированных антител. Согласно результатам, полученным в ELISA, Фигура 4 показывает, что N19-конъюгаты были способны индуцировать антитела с бактерицидными свойствами при иммунизирующих дозах, более низких, чем дозы, использованные с конъюгатами, основанными на CRM. Стоит отметить, что после одной иммунизации самой высокой дозой М19-МеnС-конъюгат индуцировал антитела с бактерицидными свойствами с титрами, подобными титрам, индуцированным двумя дозами CRM-MenC-конъюгата. Мыши, иммунизированные дважды более низкими количествами N19-MenC, продуцировали более высокие титры антител с бактерицидными свойствами, чем мыши, иммунизированные CRM-MenC. Этим иммунизированным CRM-МеnС мышам требовалась третья доза для достижения титра антител с бактерицидными свойствами, сравнимого с титрами, индуцированными N19-конъюгатами. Следовательно, N19 показал, что ведет себя как более сильный носитель, чем CRM, индуцируя антитела с существенной функциональной активностью против МеnС после меньшего числа инъекций с более низкой дозировкой.
3.2. Бивалентная менингококковая-АС конъюгатная вакцина
Мышей иммунизировали N19-MenA и N19-MenC по отдельности и в комбинации или CRM-MenA и CRM-MenC по отдельности и в комбинации (0,625, 0,156 или 0,039 мкг каждого MenPS/доза) в присутствии 0,06 мг фосфата алюминия в качестве адъюванта. Титры антител измеряли ELISA, как описано ниже.
Как показано в верхней части Фигуры 5, при совместном введении МеnА- и МеnС-конъюгатов, содержащих либо N19-, либо CRM-носитель, иммуногенность против МеnА сопровождалась, как и ожидалось, значительным уменьшением по сравнению с таковой от единичных данных конъюгатов (напр., при 0,156 мкг пост-2 N19-MenA по сравнению N19-MenAC [Р<0,05]; при 0,625 мкг пост-3 N19-MenA по сравнению N19-MenAC [P<0,05]; при 0,625 мкг по сравнению пост-2 CRM-MenA в сравнении с CRM-MenAC [Р<0,05]; при 0,156 мкг в сравнении с пост-3 CRM-MenA в сравнении с CRM-MenAC [Р<0,05]). Тем не менее, оба бивалентных состава, содержащих либо N19-, либо CRM-носитель, индуцировали сравнимые (статистическая разница отсутствует) титры антител против МеnА после двух и трех иммунизации. N19-носитель в моно- и бивалентной конъюгатной вакцинах был способен индуцировать более быстрый иммунный ответ на МеnА, повышая иммунный ответ уже после первой дозы, в то время как CRM-конъюгаты не индуцировали какой-либо измеримый титр антител. Кроме того, после двух инъекций N19-конъюгатов была тенденция вызывать более высокий иммунный ответ, чем после инъекций CRM-конъюгатов, но различия стали статистически значимыми только при самой низкой заданной дозировке моновалентной вакцины (напр., при 0,039 мкг пост-2 N19-MenA в сравнении с CRM-MenA [P<0,05]).
Когда измерялся иммунный ответ антител против МеnС (нижняя часть Фигуры 5), не наблюдалось никакого уменьшения титров после двух или трех доз при сравнении моновалентного и бивалентного препаратов. После одного введения, снижая иммунизирующие дозы моновалентной вакцины, титры антител против МеnС, полученные посредством CRM-конъюгатов, исчезали, в то время как таковые, полученные благодаря N19-конъюгатам, поддерживались стабильными. При сравнении титров, полученных после одной иммунизации бивалентными вакцинами, CRM-конъюгаты показали неспособность к существенному увеличению иммунного ответа против МеnС, в то время как N19-конъюгаты индуцировали более высокие уровни в реакции доза-ответ.
3.3. Тетравалентная менингококковая-ACWY конъюгатная вакцина
Тетравалентные препараты приготовляли смешиванием в эквивалентных сахаридных количествах N19-MenA, N19-MenC, N19-MenW и N19-MenY (N19-MenACWY). В качестве эталона использовали клинические мерные дозы CRM-конъюгатной вакцины (Chiron Vaccines, Siena), составленные перед употреблением путем смешивания жидкого CRM-MenCWY с лиофилизированным CRM-MenA. Мыши получали уменьшающиеся количества тетравалентных препаратов (от 2 мкг до 0,074 мкг каждого MenPS/доза) в присутствии 0,06 мг фосфата алюминия в качестве адъюванта.
Фигура 6 показывает для любой из четырех серогрупп капсулярных полисахаридов и всех заданных дозировок, что две или три иммунизации посредством N19-MenACWY продуцировали сходные IgG-титры. При сравнении иммунных ответов на CRM-конъюгаты после трех иммунизаций и таковых на N19-конъюгаты после только двух иммунизаций не было обнаружено никаких существенных различий для всех четырех серогрупп. После второй дозы, титры антител против серогрупп А и С при конъюгации с N19 были значительно выше по сравнению с титрами, полученными при конъюгации с CRM (IgG анти-МеnА и анти-МеnС: пост-2 при всех заданных дозировках N19 в сравнении с CRM: P<0,05). N19-конъюгаты индуцировали образование антител против всех четырех полисахаридов после первичной иммунизации, в то время как CRM-конъюгаты не индуцировали. В частности, как показано в части В Фигуры 6, были получены значительно более высокие титры антител против МеnC с N19-конъюгатами при всех заданных дозировках (пост-1 при всех заданных дозировках N19 в сравнении с CRM: [P<0,05]). Титры против МеnА и MenW, показанные в частях А и С, были значительно выше при самой высокой дозировке, когда N19-конъюгаты вводились однократно (при 2 мкг пост-1 N19 в сравнении с CRM: [P<0,05]). Антитела, индуцированные обоими конъюгатами, были преимущественно IgG1 (данные не показаны). Важно, как мы заметили, что число мышей с иммунным ответом было больше, когда их иммунизировали N19-конъюгатами, чем тех, которых иммунизировали CRM-конъюгатами, особенно после первой и второй дозы, в то время как после третьей дозы все мыши давали ответ (Таблица 2).
N19-MenACWY был высокоэффективным при индуцировании антител с бактерицидными свойствами против всех четырех Меn-полисахаридов. В частности, бактерицидные титры против группы С были значительно выше при всех заданных дозировках после двух доз N19-конъюгатов, чем CRM-конъюгатов. При повышении дозы активность 19-носителя была наиболее заметной, поскольку при ограничении дозы N19-конъюгаты индуцировали более высокие титры антител с бактерицидными свойствами против всех четырех полисахаридов, чем титры, индуцируемые CRM-конъюгатами. В частности, были проанализированы бактерицидные титры против МеnС и MenW на единичных сыворотках от мышей, иммунизированных самой низкой дозой (0,074 мкг). Фигура 7 показывает, что относительно титров по ELISA, титры Сывороточного Антитела с бактерицидными свойствами (SBA), полученные посредством N19-конъюгатов, были также сравнимы после двух или трех доз. Бактерицидные титры против МеnС были уже значительно выше после двух иммунизаций N19-конъюгатами, чем титры, полученные после трех инъекций CRM-конъюгатами (SBA анти-МеnС: пост-2 N19 в сравнении с пост-3 CRM: [Р<0,05]). Сравнивая бактерицидные титры против MenW после двух доз или после трех, полученных либо с помощью основанных на N19-, либо посредством основанных на CRM-конъюгатах, мы обнаружили, что N19-конъюгаты индуцировали значительно более высокие титры антител с бактерицидными свойствами (SBA анти-MenW пост-2 N19 в сравнении с CRM: [Р<0,05]; пост-3 N19 в сравнении с CRM: [Р<0,05]).
Детальный анализ функциональной активности групп А и С антител был проведен, используя модифицированный анализ антигенного связывания, с помощью которого оцениваются только высокоаффинные антитела [296]. Приведенные на Фигуре 8 результаты показывают, что антитела, полученные против МеnC с помощью 2 мкг N19-конъюгатов, были уже высокоавидными после одной дозы. Двух иммунизаций было достаточно, чтобы индуцировать высокую силу созревания почти всех антител. Другие группы, иммунизированные либо более низкими количествами N19-конъюгатов, либо CRM-конъюгатов, показали сходный профиль созревания, с увеличением от базовой линии до примерно 50% высокоавидных антител только после двух доз (для простоты показаны только группы, иммунизированные сами высокими и самыми низкими дозами).
Чтобы оценить влияние протеина-носителя у четырех полисахаридов на индукцию антител против них, мы измеряли антитела против обоих использованных протеинов-носителей (Фигура 9). Кроме того, мы анализировали, способны ли были продуцированные антитела против носителей связывать также родительские протеины. Фигура 9 в части А показывает, что антитела, продуцированные с помощью CRM-конъюгатов, в равной степени отлично распознавали DT, CRM's-родительский протеин. В противоположность этому, антитела к N19-конъюгатам не давали перекрестную реакцию с их родительскими протеинами, такими как токсоид столбняка (ТТ) и гемагглютинин гриппа (НА), от которых происходили N19-эпитопы. Следует отметить, что в N19 содержалось десять эпитопов (пять повторенных дважды) из ТТ, представляющих более 50% их последовательности.
3.4. Тетравалентная менингококковая-ACWY конъюгатная вакцина с би-носителем
Тетравалентные препараты приготовляли смешиванием МеnА, конъюгированного либо с N19, либо CRM, с MenCWY, конъюгированного либо с CRM, либо с N19 (N19-MenA+CRM-MenCWY, и наоборот, CRM-MenA+N19-MenCWY). Контрольные группы получали тетравалентные препараты, содержащие один носитель (N19-MenACWY или CRM-MenACWY). Мыши получали уменьшающиеся количества тетравалентных препаратов (от 0,67 мкг до 0,074 мкг каждого Меn-полисахарида/доза) в присутствии 0,06 мг фосфата алюминия в качестве адъюванта. Титры антител определяли, используя методы, описанные ниже.
N19-MenACWY продуцировали, после первой дозы, титры анти-МеnА, сравнимые с титрами, полученными после двух доз вакцины, основанной на CRM (Фигура 6). Более того, мыши, дважды иммунизированные N19-конъюгатами, вызывали значительно более высокие бактерицидные титры против МеnА, чем мыши, иммунизированные CRM-конъюгатами (Фигура 10). Мы наблюдали, что когда N19-MenA вводился одновременно с CRM-MenCWY или, наоборот, заменяя носитель на МеnА, имунный ответ был значительно увеличен по сравнению с тетравалентным препаратом, содержащим уникальный носитель (напр., пост-2 при 0,67 мкг: N19-MenA+CRM-MenCWY в сравнении с N19-MenACWY: [Р<0,05]; пост-3 при 0,67 мкг: N19-MenA+CRM-MenCWY в сравнении с CRM-MenACWY: [Р<0,01]; пост-2 при 0,22 мкг: CRM-MenA+N19-MenCWY в сравнении с CRM-MenACWY: [Р<0,001]). Однако мы заметили, что при уменьшении иммунизирующей дозы обоих препаратов с би-носителем IgG-титр антител против МеnА значительно уменьшался, но их бактерицидный титр не уменьшался ни после двух, ни после трех иммунизаций (Фигура 10). Более того, обе вакцины с би-носителем индуцировали сравнимые бактерицидные титры во всех дозировках (Фигура 11). Стоит отметить, что присутствие N19 во всех препаратах постоянно вызывало иммунный ответ уже после одной иммунизации, в то время как присутствие только CRM - не вызывало (Фигура 10).
3.5. Линии мышей различного происхождения
В предварительном эксперименте две группы мышей, BALB/c и C57BL/6, дважды иммунизировали. 0.67 или 0.22 мкг N19-MenACWY или CRM-MenACWY с 0,06 мг фосфата алюминия. В другом эксперименте конгенные линии мышей иммунизировали три раза тетравалентными препаратами N19-MenACWY или CRM-MenACWY (0.67 мкг каждого Меn-полисахарида/доза) в присутствии 0,06 мг фосфата, приготовленного, как описано выше. BALB/c-мыши использовались в качестве контроля.
Основываясь на упомянутых выше результатах, полученных с BALB/c-мышами, мы решили иммунизировать мышей только дважды двумя разными дозировками тетравалентных препаратов, содержащих N19 или CRM, и измерили иммунные ответы против четырех полисахаридов (Фигура 12). Вновь для BALB/c-мышей было засвидетельствовано, что N19 ведет себя как более сильный носитель, чем CRM в тетравалентной вакцине, в частности при индуцировании антител против МеnА (BALB/c 0,22 мкг пост 2 N19 в сравнении с CRM: [Р<0,001]). Мы наблюдали, что оба конъюгата, содержащих либо N19, либо CRM, были менее иммуногенными у C57BL/6-, чем у BALB/c-мышей, и иммунные ответы были более вариабельными. Кроме того, лучший эффект носителя у N19 был менее очевидным в сравнении со всеми четырьмя полисахаридами, чем эффект, который наблюдался у BALB/c. Тем не менее, N19-конъюгаты были способны постоянно вызывать титры антител против всех четырех полисахаридов уже после первой иммунизации, в то время как CRM-конъюгаты не были способны на это.
Как показано на Фигуре 13, N19- и CRM-конъюгаты были более иммуногенными по отношению четырех конъюгатов у штаммов BALB/c Н-2d и B10.D1 Н-2g. В целом, большее число мышей имели иммунный ответ, когда их иммунизировали конъюгатами, основанными на N19, чем на CRM. B10.D2N Н-2d с таким же гаплотипом, что и BALB/c-мыши, были лучшими рецепиентами к N19-, чем к CRM-конъюгатам. С одной стороны, BALB/B Н-2b, конногенные к BALB/c-мышам, были лучшими рецепиентами к CRM-, чем к N19-конъюгатам. С другой стороны, CRM-конъюгаты не вызывали какого-либо иммунного ответа против любого из четырех полисахаридов у B10.BR Н-2k, в то время как N19-конъюгаты вызывали. Замечательно, что N19-конъюгаты вызывали существенный иммунный ответ после первой дозы во всех тестированных линиях мышей против четырех полисахаридов за небольшими исключениями для менее иммуногенных линий. Большинство мышей разного происхождения, использованные в данном исследовании, продуцировали антитела к четырем полисахаридам, показывая отсутствие какого-либо явного генетического ограничения иммунного ответа после иммунизации N19-конъюгатами.
Как показано на Фигуре 14, в согласии с IgG-ответами, измеренными посредством ELISA, бактерицидные титры, полученные с помощью N19- и CRM-конъюгатов, также были выше у BALB/c H-2d-реципиентов. Мы наблюдали, что N19-конъюгаты индуцировали более высокие бактерицидные титры, чем CRM-конъюгаты, против четырех полисахаридов во всех тестированных штаммах, за исключением титров у BALB/c-мышей против МеnА. Оценка функциональной активности продуцируемых антител сывороточно-бактерицидным анализом дополнительно подтвердила лучший эффект носителя у N19 по сравнению с CRM.
4. Протоколы твердофазного иммуноферментного анализа (ELISA)
4.1. Полисахарид-специфические IgG менингококковых серогрупп А, С, W-135 и Y
Титрование МеnА-, МеnС-, MenW- и MenY-специфических иммуноглобулинов G (IgG) производилось на индивидуальных сыворотках от каждой мыши в соответствии с уже описанными анализами [297]. 96-луночные плоскодонные планшеты Nunc Maxisorp покрывали в течение ночи при 4°С по отдельности 5 мкг/мл очищенными полисахаридами N. meningitidis серогрупп А, С, W и Y в присутствии 5 мкг/мл метилированного сывороточного альбумина человека. Планшеты промывали три раза PBS, содержащим 0,33% Brij-35 (PBS-Brij), затем насыщали 200 мкл/лунка PBS, содержащим 5% FCS и 0,33% Brij-35 (PBS-FCS-Brij) в течение 1 ч при RT. Единичные сыворотки разводили в PBS-FCS-Brij и титровали четыре полисахарида по отдельности. Планшеты инкубировали в течение ночи при 4°С. На следующий день планшеты промывали PBS-Brij, и добавляли козье антимышиное IgG, конъюгированное с щелочной фосфатазой (Sigma Chemical Co., SA Louis, Монт.), разведенное в PBS-FCS-Brij, и планшеты инкубировали 2 часа при 37°С. Связанные антитела обнаруживали, используя 1 мг/мл р-нитрофенил-фосфата (Sigma Chemical Co., SA Louis, Монт.) в растворе диэтаноламина. После 20 мин инкубирования считывали поглощение при 405 нм. Доиммунизационные значения давали постоянно величину OD ниже 0,1. Результаты выражали в титрах относительно своей внутренней стандартной сыворотки путем параллельной группы анализов, чтобы минимизировать вариации от планшета-к-планшету. IgG-титры вычисляли, используя Анализ Линий Сравнения [298] и выражали как логарифм ЭЕ/мл.
4.2. Полисахарид-специфический изотип IgG1/IgG2а-менингококковых серогрупп А и С
Чтобы измерить IgG1- и IgG2a-антитела против МеnА и МеnС планшеты покрывали 5 мкг метилированного человечьего сывороточного альбумина/мл и 5 мкг очищенного МеnА или МеnС на мл в PBS и выдерживали в течение ночи при 4°С, как описано выше для IgG ELISA. Затем планшеты промывали и блокировали PBS-FCS-Brij в течение 1 ч при RT. Образцы сыворотки разводили в PBS-FCS-Brij через два планшета параллельно, начиная от 1:100 и инкубировали в течение 2 ч при 37°С. Добавляли биотинилированные козьи антимышиные IgG1- и IgG2а-антитела (Southern Biotechnology Associates, Inc.). После 2 ч инкубирования при 37°С в лунки добавляли конъюгированный с пероксидазой хрена стрептавидин (DAKO), и планшеты инкубировали в течение 1 ч при 37°С. Планшеты обрабатывали с помощью субстратного O-фенилендиамин дигидрохлорида (Sigma). Титры подсчитывали как обратную величину разведения сыворотки, при котором OD составляла 0,5 (450 нм).
4.3. N19-, ТТ-, НА- или CRM-, DT-специфические IgG-антитела
Титрование протеинов-носителей N19, CRM197 и их родительских протеинов, среди которых были токсоид столбняка (ТТ), haemophilus influenzae (НА) и дифтерийный токсоид (DT), производилось на объединенных сыворотках, как описано ранее [299, 300]. Если коротко, 96-луночные планшеты (Nunc Maxisorp) покрывали 200 мкг раствора PBS, содержащего по отдельности 2 мкг/мл N19-, ТТ-, НА- или CRM197- или 5 мкг/мл DT-антигена и выдерживали в течение ночи при 4°С. Затем планшеты промывали и блокировали PBS-BSA 1% в течение 1 ч при 37°С. Образцы сыворотки разводили в PBS-BSA 1%-Твин20 0,05% по планшету, начиная от 1:100 и инкубировали в течение 2 ч при 37°С. Для обнаружения использовали козлиное антимышиное IgG, коньюгированное с щелочной фосфатазой, и р-нитрофенил-фосфат. Наличие антиген-специфических антител обнаруживали, как описано выше. Результаты выражали в титрах относительно внутренней стандартной сыворотки с помощью параллельной группы анализов, чтобы минимизировать вариации от планшета-к-планшету.
4.4. Авидностъ IgG-антител менингококковых серогрупп А и С
Авидность специфических IgG-антител менингококковых серогрупп А и С оценивали с помощью анализа элюирования ELISA объединенных сывороток, используя 75 мМ тиоцианата аммония [NH4SCN] в качестве хаотропного агента, согласно хорошо известному методу [301, 302]. Анализ достоверности включал оценку стабильности антигена с последующей инкубацией с 4 М NH4SCN [303]. Nunc Maxisorp 96-луночные плоскодонные планшеты покрывали 5 мкг/мл очищенных полисахаридов N. meningitidis серогрупп А и С по отдельности и выдерживали в течение ночи при 4°С. Раствор удаляли, и лунки промывали три раза PBS-Brij и блокировали в течение 1 ч при комнатной температуре блокирующим буфером (PBS-FCS-Brij). Затем планшеты промывали буфером для промывки (PBS-Brij). Тестируемую и эталонную сыворотки разводили в буфере для разведения PBS-FCS-Brij, и в одном микропланшете дважды дублировали серийные разведения. После 2 ч инкубирования при 37°С планшеты промывали три раза. Образцы сыворотки в одном из дубликатов инкубировали 15 минут при комнатной температуре с 75 мМ NH4SCN в буфере для разведения сыворотки PBS-FCS-Brij, в то время как другой дубликат инкубировали только с буфером для разведения. После промывки планшеты инкубировали с козлиными антимышиными IgG-антителами, коньюгированными с щелочной фосфатазой (Sigma Chemical Co., SA Louis, Монт.), как в упомянутом выше анализе ELISA. Количество антител, оставшихся связанными с планшетом после элюирования с 75 мМ NH4SCN, подсчитывали в ELISA-единицах, сверяясь со стандартными ELISA-кривыми, соответствующими 100% связанных антител. Титры высокоавидных IgG представляли в % связанных антител в зависимости от времени.
5. Анализ на бактерицидные свойства сыворотки против менингококковых штаммов А, С, W и Y
Метод, использованный для измерения титров антител с бактерицидными свойствами, ранее был описан (94). Предназначенные для исследования штаммы N. meningitidis серогрупп А (штамм F8238), С (штамм 11), W (штамм 240070) и Y (штамм 240539) выращивали в течение ночи при 37°C с 5% СО2 на планшетах с шоколадным агаром (начиная с замороженного раствора). Колонии с поглощением 0,05-0,1 на 600 нм суспендировали в 7 мл бульона Меллера Хинтона, содержащего 0,25% глюкозы, и инкубировали, встряхивая, в течение 1,5 часа при 37°C с 5% СO2, чтобы достичь поглощения ~0,24-0,4 на 600 нм. Суспензиии бактериальных клеток разводили в GBSS-буфере (равновесный солевой раствор Гея) (SIGMA) и 1% BSA (буфер для анализа), чтобы получить приблизительно 105 КОЕ/мл. Инактивированные теплом (56°С в течение 30 мин) образцы отдельных или объединенных сывороток (50 мкл) разводили последовательно в двух экземплярах (реципрокное исходное разведение 4) в буфере на 96-луночных плоскодонных планшетах для клеточных культур (Costar, Inc., Кембридж, Масс.). Мягко смешивали равные объемы клеточных суспензий и объединенного комплемента крольчат (25%), и 25 мкл добавляли к последовательно разведенным сывороткам. Конечный объем в каждой лунке был 50 мкл. Контроли включали (i) бактерия-комплемент-буфер (коплемент-зависимый контроль) и (ii) инактивированный теплом тестовый сыворотка-бактерия-буфер (комплемент-независимый контроль). Сразу же после добавления комлемента крольчат 10 мкл контролей помещали на агаровые планшеты Меллера-Хинтона методом наклона (нулевой момент времени, t0). Микротитровальные планшеты инкубировали для всех штаммов целевых серогрупп при 37°С в течение 1 ч с 5% СО2. После инкубирования 10 мкл каждого образца точечно помещали на агаровые планшеты Меллера-Хинтона, при этом 10 мкл контролей помещали методом наклона (первый момент времени, t1). Планшеты с агаром инкубировали в течение 18 ч при 37°C с 5% СO2, и подсчитывали колонии, соответствующие t0 и t1. Колонии при t1 служили контролем возможной токсичности комплемента или сыворотки и приходились на 1,5 колоний при t0. Бактерицидные титры выражали как реципрокное разведение сыворотки, приводящее к ≥50% гибели по сравнению с количеством клеток-мишеней, присутствовавших до инкубирования с сывороткой и комплементом (t0). Титры считались достоверными, если, по крайней мере, два последующих разбавления приводили к ≥90% гибели актерий.
Для сравнения титров антител между группами и при различном времени использовался критерий Стьюдента (2 шлейфа). Значение Р<0,05 рассматривалось как статистически значимое.
6. Клеточно-опосредованные иммунные ответы
6.1. In vitro пролиферационный анализ с помощью N19-эпитопов, N19 или N19-конъюгатов BALBc-мышей, примированных N19-MenACWY
Чтобы оценить, была ли иммунизация с помощью N19-конъюгатов для примирования Т-клеток, специфичных к эпитопам носителей, селезенки мышей, иммунизированных два или три раза тетравалентным N19-MenACWY (~6 или 2 мкг протеина/доза), как описано выше, были удалены спустя 10 дней после последней иммунизации и тестированы на способность к пролиферации с последующей in vitro стимуляцией с помощью единичных пептидов, образующих N19 или не содержащих N19, или конъюгированных [304]. Очищенный N19, применявшийся в этом анализе, не содержал обнаруживаемого LPS, который, возможно, был блокирован. Селезенки каждой группы мышей объединяли и вручную диспергировали. Сразу же после промывки и подсчета клетки культивировали при плотности 5×105 клеток на лунку в RPMI (GIBCO BRL Life Technologies), дополненном 25 мМ HEPES-буфера, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина, 50 мкМ 2-меркаптоэтанола, 0,15 мМ L-глутамина, пируватом натрия, витаминами и коктейлем из не-незаменимых аминокислот (GIBCO BRL Life Technologies 1% из 100-кратно разбавленного исходного раствора) и 5% сыворотки плода теленка (Hyclone) в плоскодонных 96-луночных планшетах для клеточной культуры (Coming NY). Клетки культивировали в трех экземплярах в присутствии индивидуальных пептидов от 0,12 до 30 мкМ на лунку (двух- или трехкратные разведения) (~0,15-50 мкг/мл) или свободных, или конъюгированных с N19 от 0,004 до 1 мкМ, разведенных в этой же среде, и добавляли в эти лунки, чтобы суммарное количество составляло 200 мкл на лунку. Контроли проводили с полной средой культивирования или 10 мкг/мл Конканвалина А, чтобы показать пролиферативную способность клеток. Планшеты инкубировали при 37°C с 5% СО2. Спустя пять суток, клетки подвергали вибрации с 0,5 мкCi [3H]-тимидина (Amersham Biosciences 1 мCi/мл исходного раствора) на лунку в течение дополнительных 18 ч, собирали с помощью Filtermate Harvester и подсчитывали в жидкостном сцинтилляционном счетчике (Packard Bioscience). Результаты пролиферативных анализов выражали в виде индекса стимуляции (SI), подсчитываемого как отношение число импульсов в минуту (срm) в экспериментальных культурах со стимулом к числу импульсов в минуту в контрольных культурах (фон) без стимула. Три экземпляра культур испытывались параллельно. SI>2 считалось положительным.
Чтобы определить, был ли сильный Т-хелперный сигнал N19 у мыши опосредован любым из CD4+-эпитопов, изначально включенных в N19, оценивали Т-клеточную пролиферацию спленоцитов из BALB/c-мышей, примированных два или три раза N19-MenACWY (6 мкг N19/доза). Клетки селезенки стимулировали in vitro различными концентрациями N19-пептидов или целым N19, свободным или конъюгированным с полисахаридами. Как показано на Фигуре 15, в присутствии свободного или конъюгированного N19 лимфоциты пролиферировали в значительной степени. Мы наблюдали также Т-клеточную пролиферацию с Р23ТТ-пептидом постоянно во всех наших экспериментах (Фигуры 15 и 16). Среди других тестируемых пептидов мы наблюдали Т-клеточную пролиферацию, индуцированную Р30ТТ, Р32ТТ, НА и HbsAg, хотя только в присутствии более высоких концентраций. Когда анализы проводили с С57BL/6-мышами, никакой из эпитопов не стимулировал пролиферацию лимфоцитов, а N19 стимулировал клетки только при высокой концентрации.
Кроме того, мы измеряли Т-клеточную активацию против N19 у когенных линий мышей, чтобы исследовать, имелась ли какая-либо МНС-рестрикционная карта. Активацию анализировали in vitro, измерением пролиферативных ответов клеток селезенки мышей различного происхождения в присутствии различных концентраций N19, или 1) свободного, или 2) конъюгированного с полисахаридами, или с 3) отдельными составляющими N19 пептидами, или 4) свободными полисахаридными компонентами. Мы наблюдали, что свободный N19 индуцировал активацию Т-клеток во всех штаммах, но N19-конъюгаты приводили к различающимся пролиферативным ответам в тестируемых штаммах (Фигура 17). Оценивая влияние генотипов (BALB или В 10) на Н2-ответы, мы наблюдали, что мыши Н-2d-гаплотипа производили Т-клетки противных эпитопов. Т-клеточный ответ на Р23ТТ-эпитоп был получен у двух генетически неродственных мышей (BALB/c Н-2d и B10.BR Н-2k). С другой стороны, конгенные мыши (BALB или В10) с разными Н-2-гаплотипами производили различную эпитоп-специфическую Т-клеточную пролиферацию, предположительно потому, что внешние для МНС-комплекса генетические факторы также влияли на ответ. Однако мыши с тем же самым генетическим фоном (BALB) продуцировали Т-клетки, реактивные по отношению Р30ТТ-эпитопу. В целом, несмотря на то, что пептиды отличались по своему уровню Р-2-рестрикции, все линии были способны создавать хороший иммунный ответ против всех четырех полисахаридов с N19-конъюгатами. Более того, мы наблюдали, что каждый из четырех полисахаридов был способен индуцировать пролиферацию в каждой тестируемой линии, и это указывало на то, что они являлись Т-клеточно-независимым антигеном и конъюгация с протеином-носителем не влияла на их характеристики, такие как способность индуцировать полисахарид-специфическую активацию Т-клеток.
6.2. Оценка муриновой эпитоп-специфической Т-клеточной пролиферации: протокол иммунизации и анализ пролиферации
Синтетические пептиды (Р2ТТ, Р21ТТ, Р23ТТ, Р30ТТ, Р32ТТ, НА и HBsAg) с 95% очистки были приобретены у Primm s.r.l. (Италия). Группы из трех BALB/c-мышей иммунизировали подкожно у основания хвоста посредством 50 мкл объема на мышь, содержащего 50 мкг отдельного пептида (Р2ТТ, Р30ТТ, Р23ТТ, Р32ТТ, НА, HBsAg) или N19, эмульгированного в полном адъюванте Фройнда (CFA). Спустя семь дней мышей умерщвляли, паховые и периаортальные лимфатические узлы удаляли и объединяли у мышей внутри каждой группы, и приготовляли суспензиальную культуру. Клетки культивировали при плотности клеток 3×105 клеток на лунку в полной среде (дополненной RPMI, как описано выше для клеток селезенки) в плоскодонных 96-луночных планшетах для культивирования клеток (Costar Corp., Кембридж, Масс.). N19 или гомологичный пептид, разведенные в той же самой среде, добавляли в лунки трех экземпляров отдельной мыши или объединенных культивируемых клеток в трех различных концентрациях (15; 7,5 и 3,75 мМ всех пептидов и 10, 1 и 0,1 мкг/мл N19). После пяти дней инкубирования при 37°C с 5% СО2 клетки подвергали вибрации с 0,5 мСi [3H]-тимидина в течение 16 ч, и затем собирали, как описано выше. Неродственный пептид СН60 (in silico предсказанный как связывающийся с HLA-A2), происходящий из поверхностного протеина Chlamydia pneumoniae, в этих экспериментах применяли в качестве отрицательного контроля.
Фигура 18 показывает, что иммунизация BALB/c-мышей индивидуальными пептидами приводит к ответу Т-клеток против Р23ТТ, НА- и HbsAg-пептидов и N19, но не против не-родственного СН60-пептида. Мыши, иммунизированные Р32ТТ, не имели ответа на этот пептид. Клетки из адъювантных контрольных мышей пролиферировали в ответ на СоnА, но не в ответ на любой пептид или N19, демонстрируя тем самым, что пептиды не были митогенными. Несмотря на использование эпитопов человека, данные открытия могут объяснить сильный эффект носителя N19 также у мышей.
Понятно, что данное изобретение описано здесь только посредством примеров, и могут быть сделаны модификации, остающиеся, тем не менее, в пределах объема и сущности изобретения.













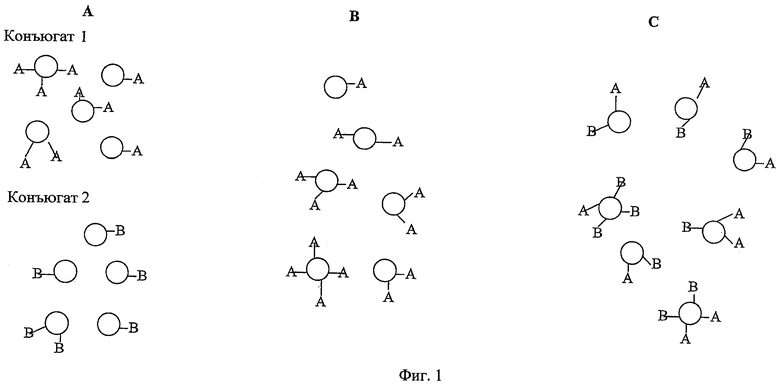
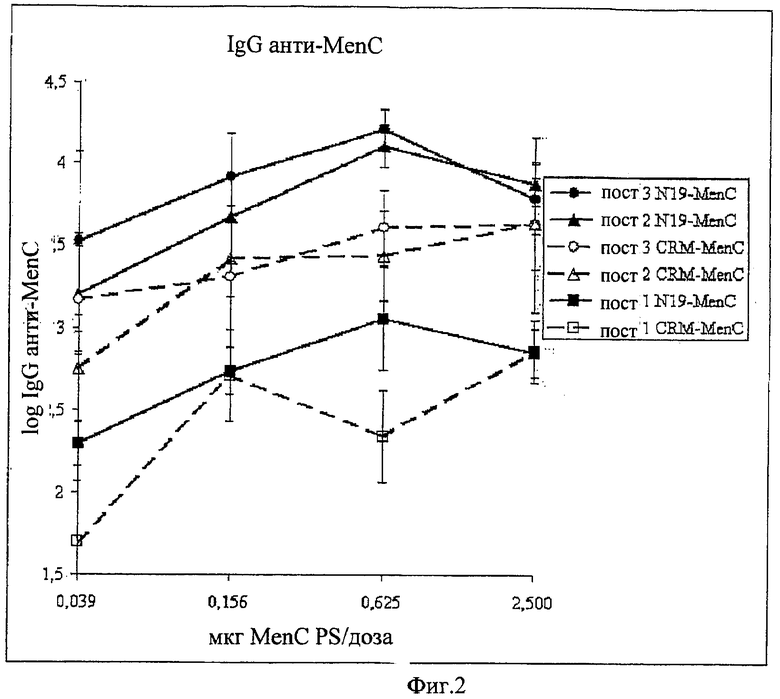
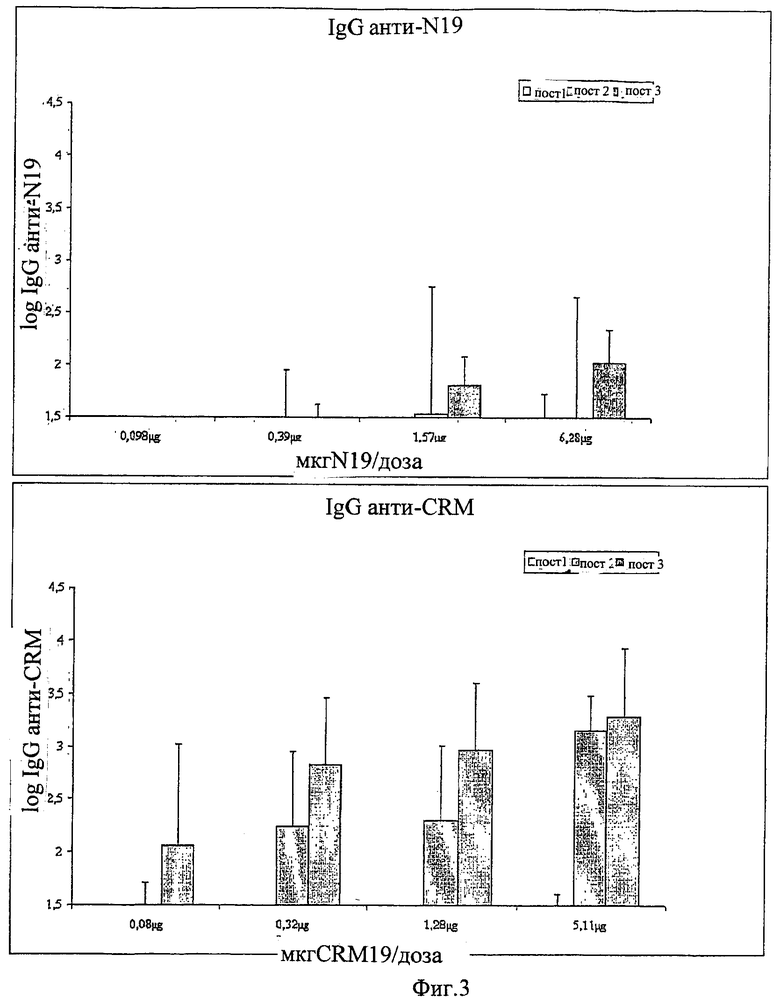
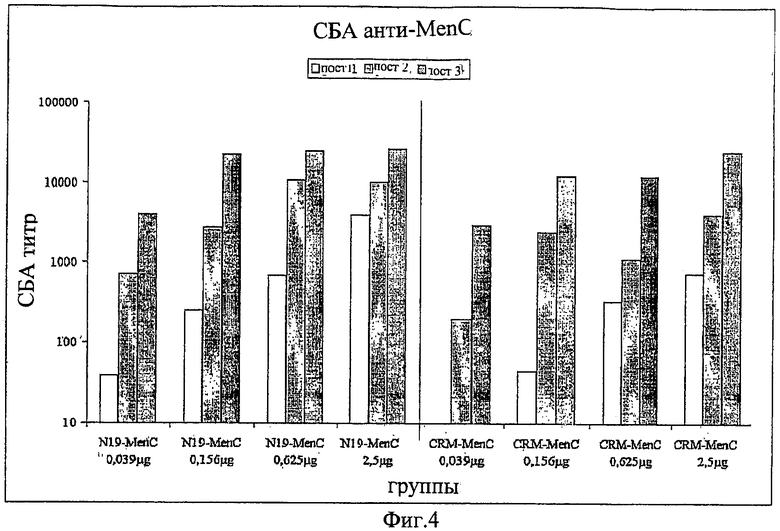
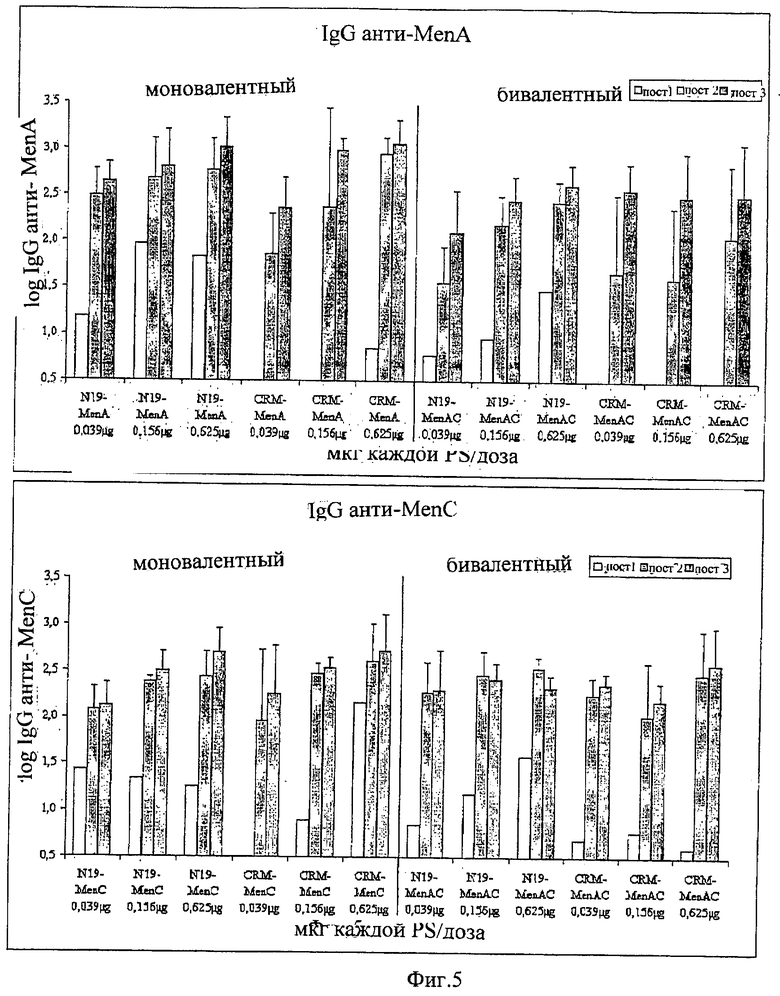
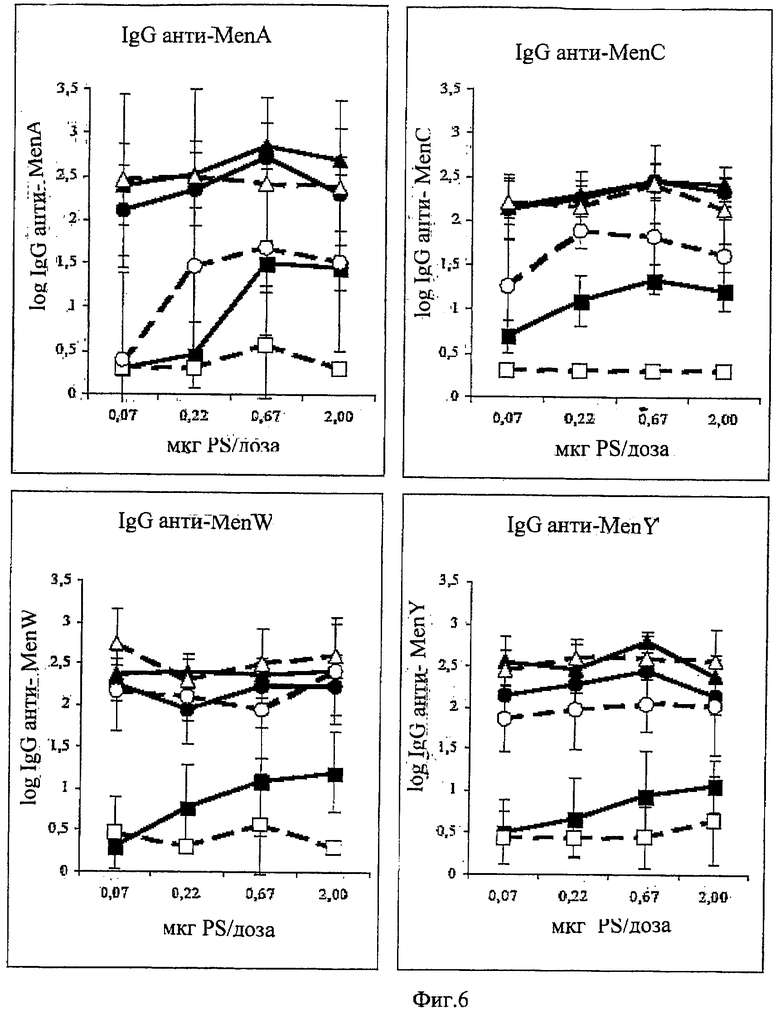
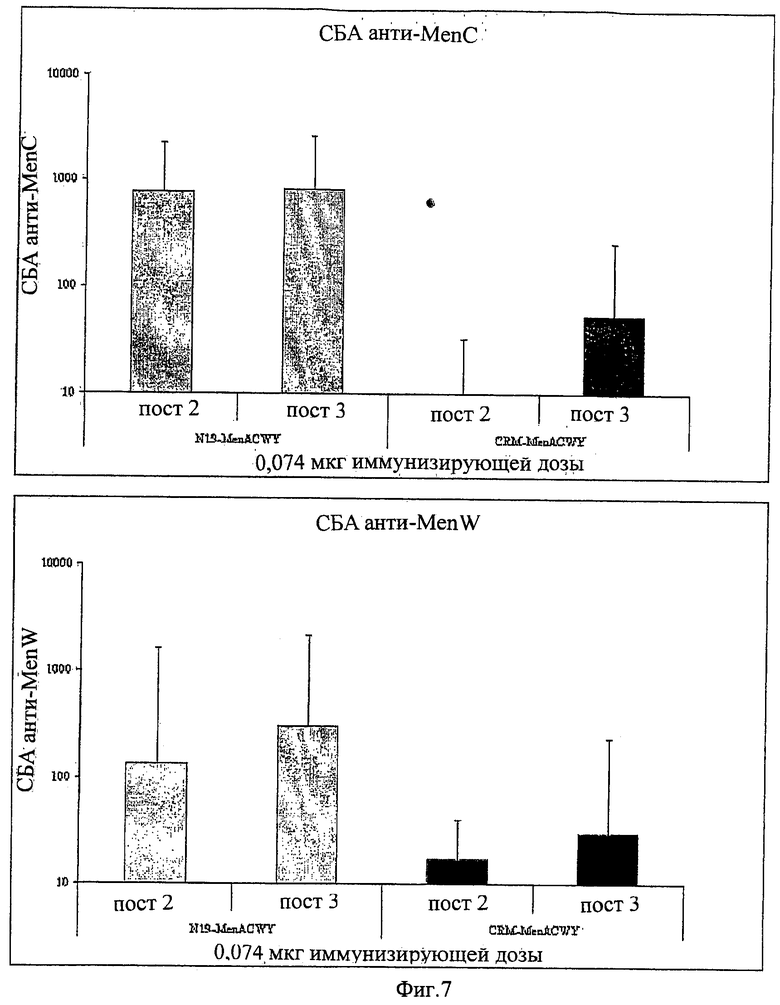
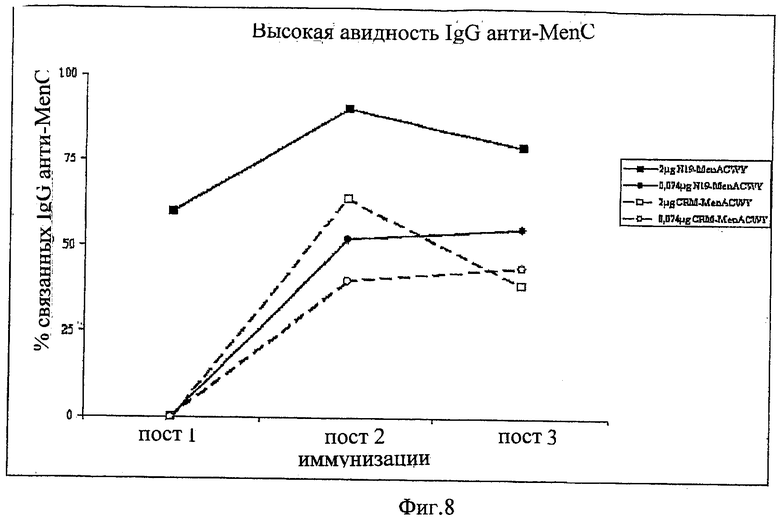
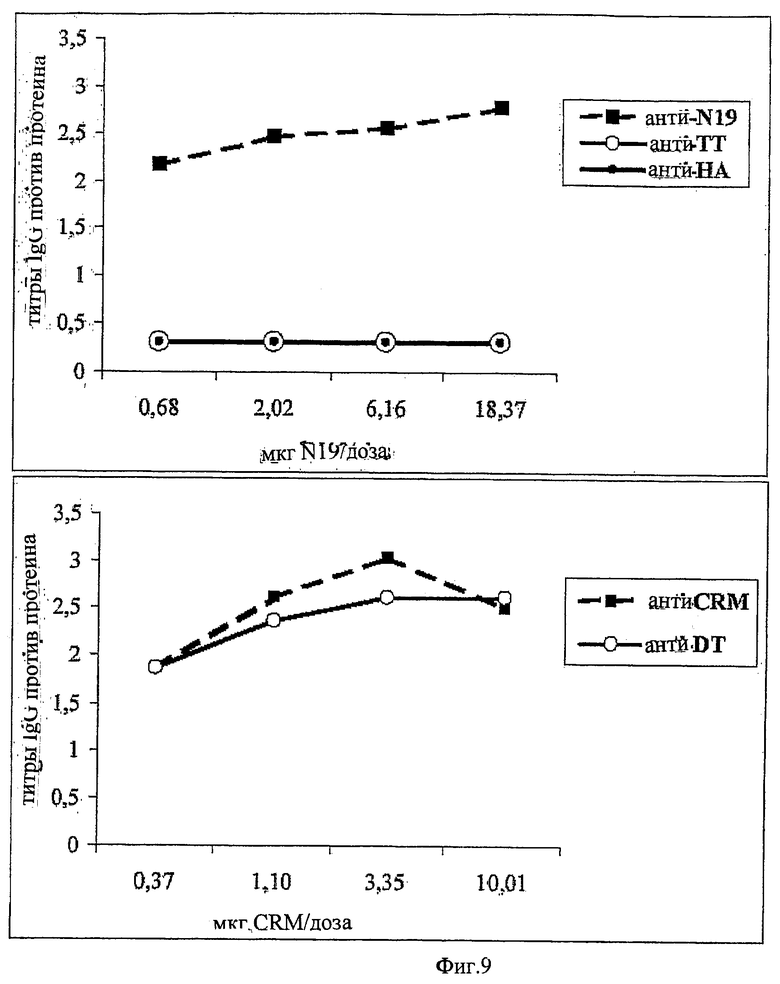
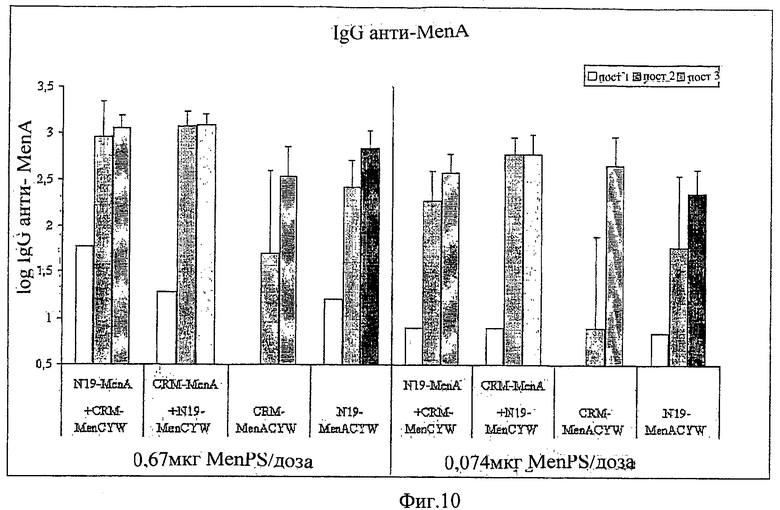
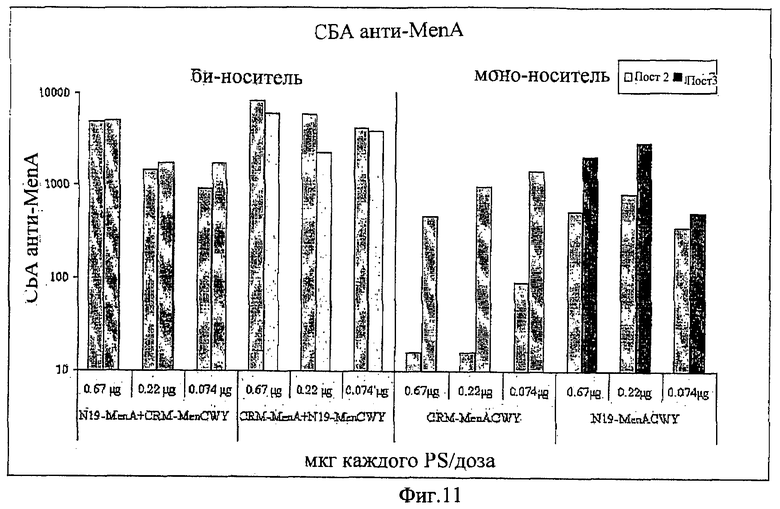
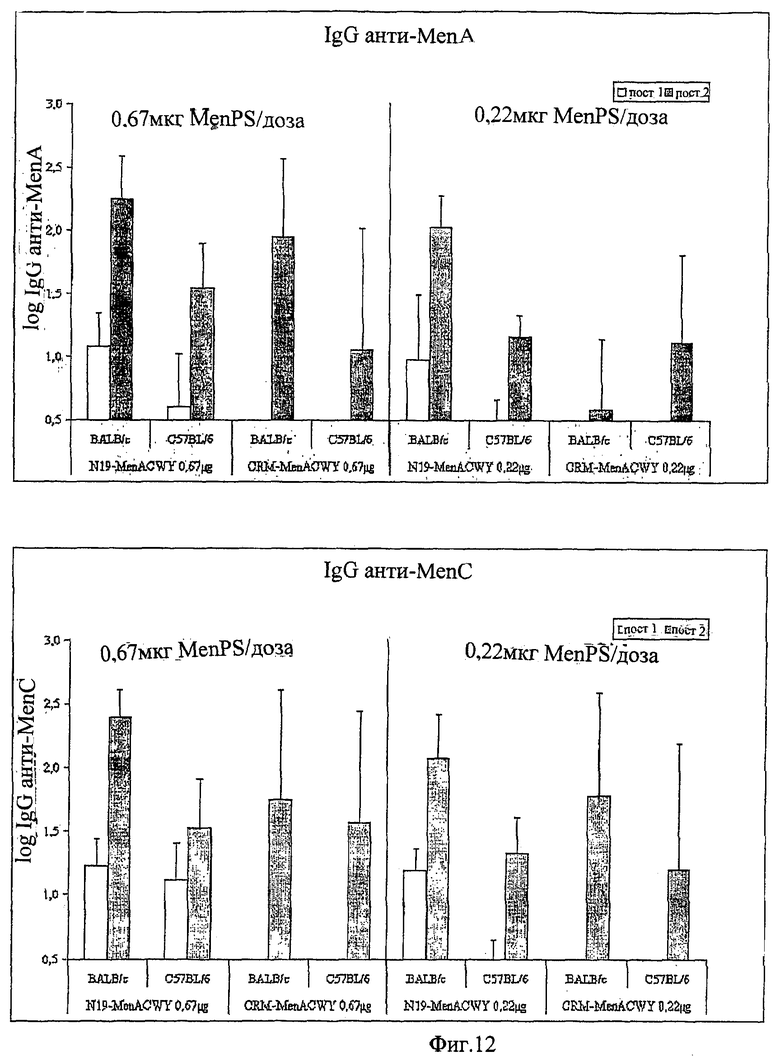
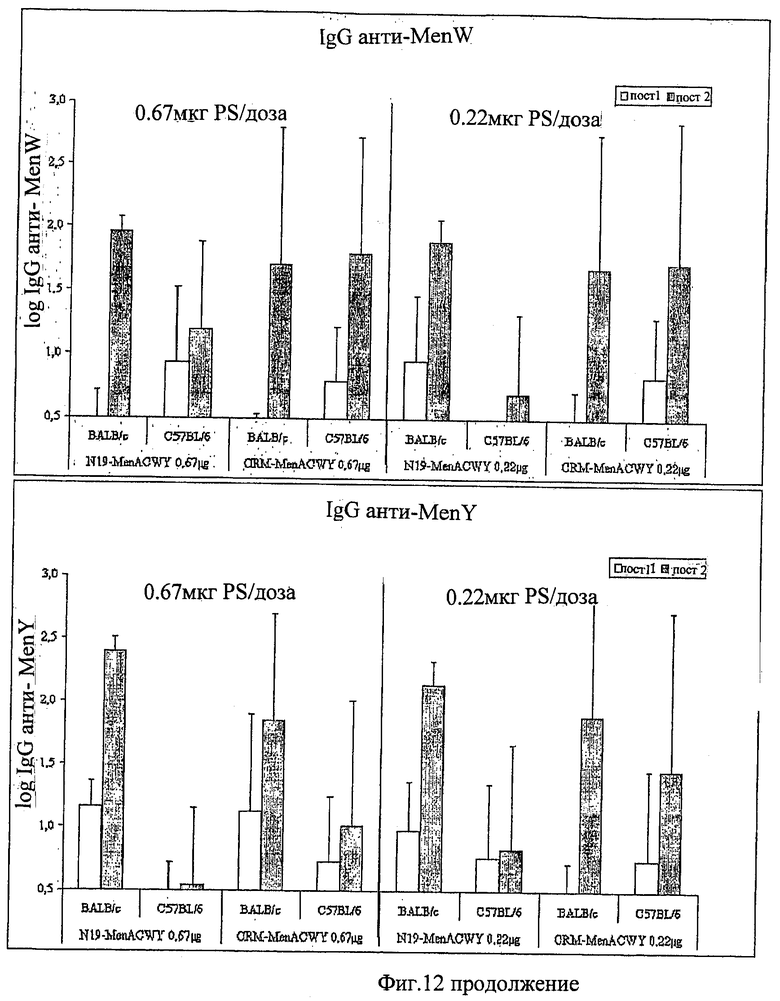
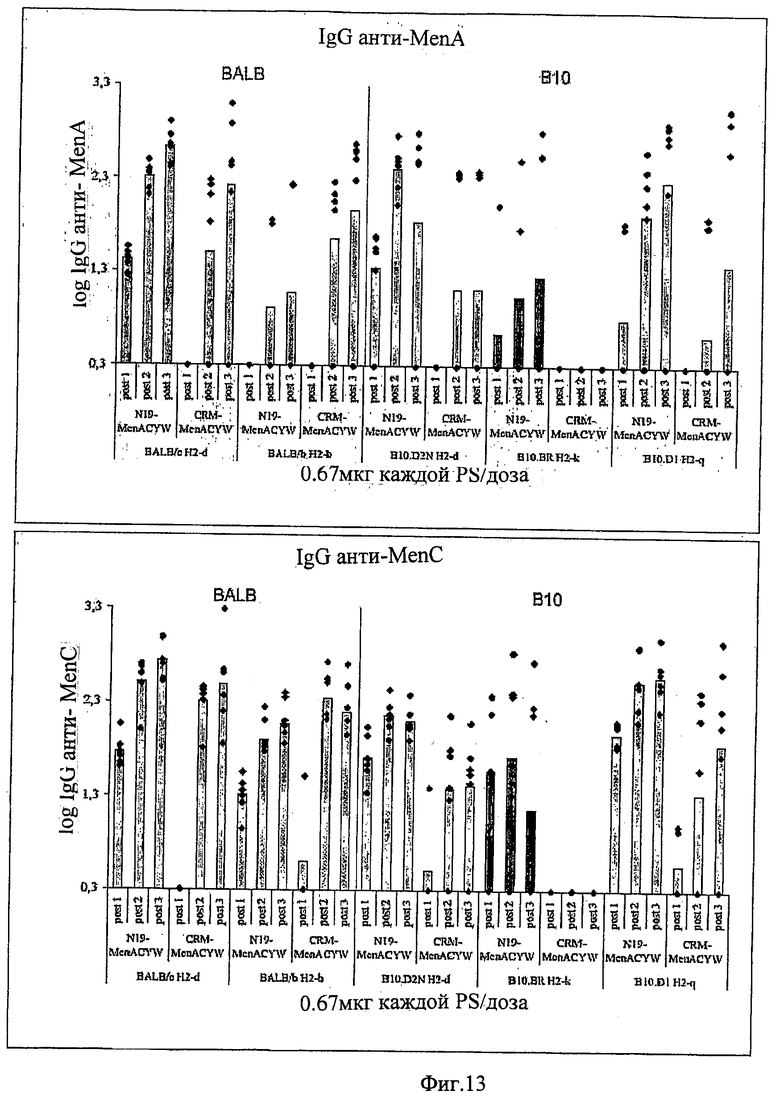
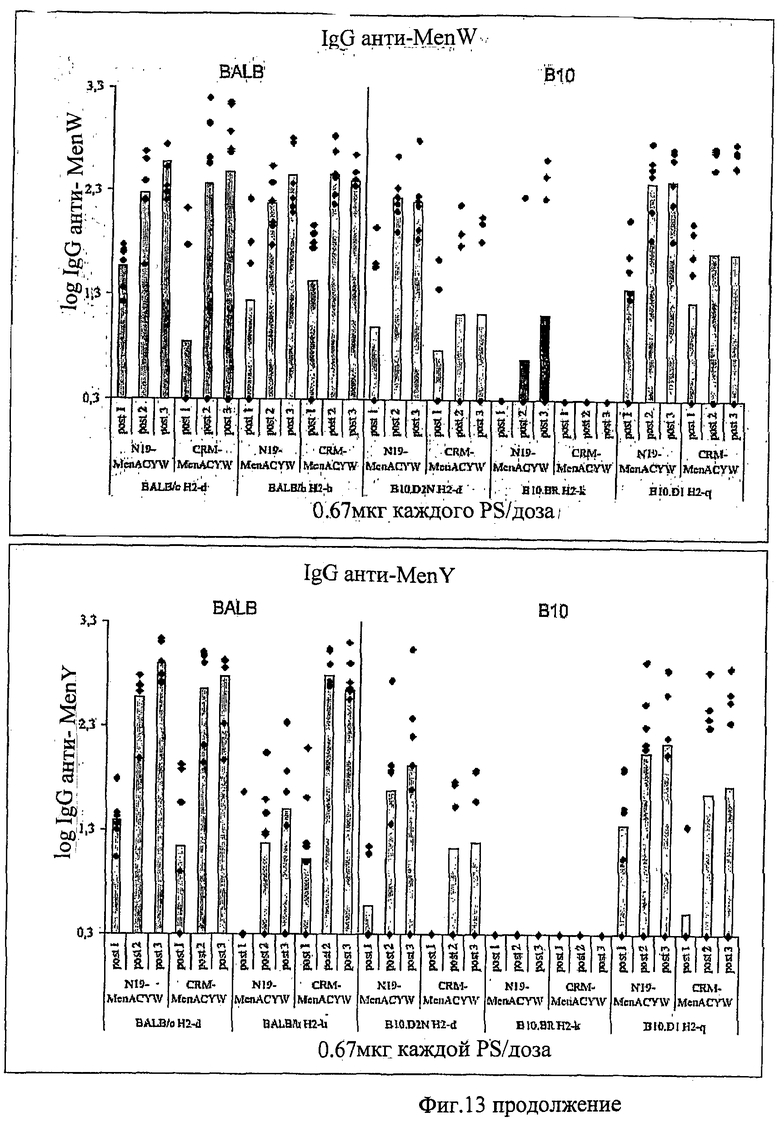
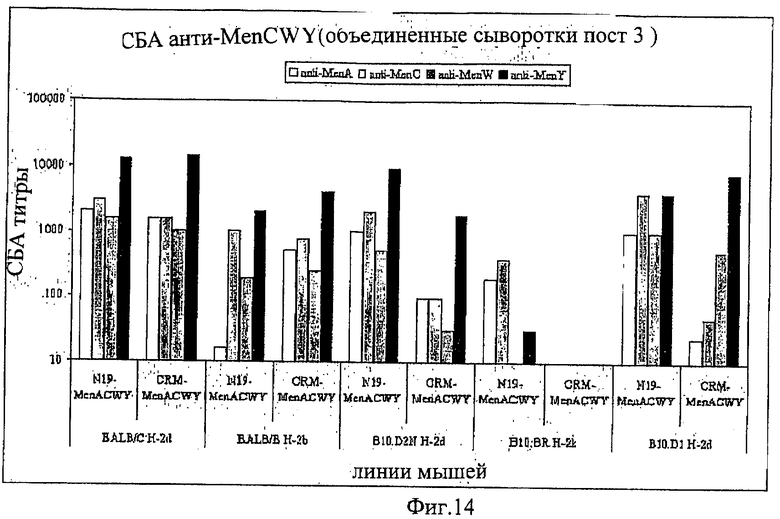
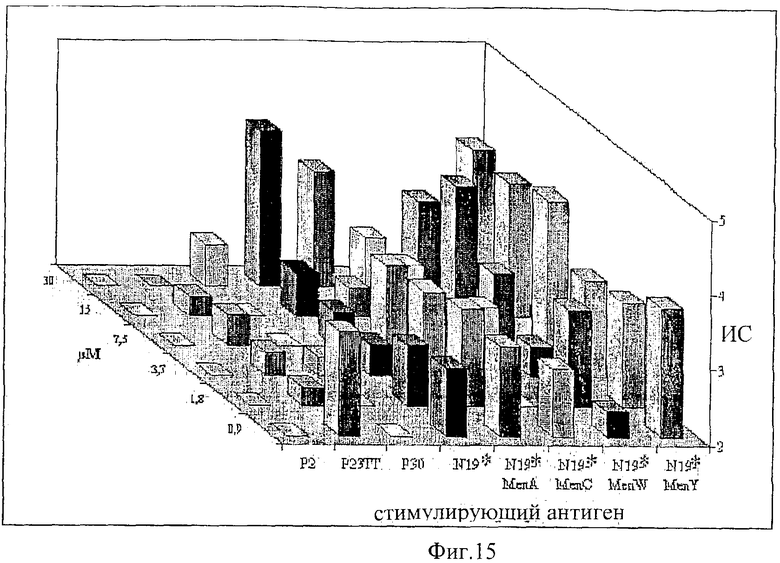
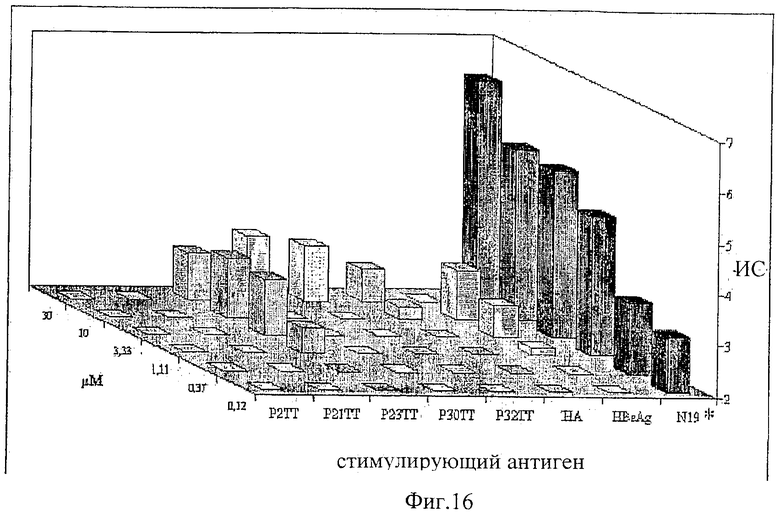
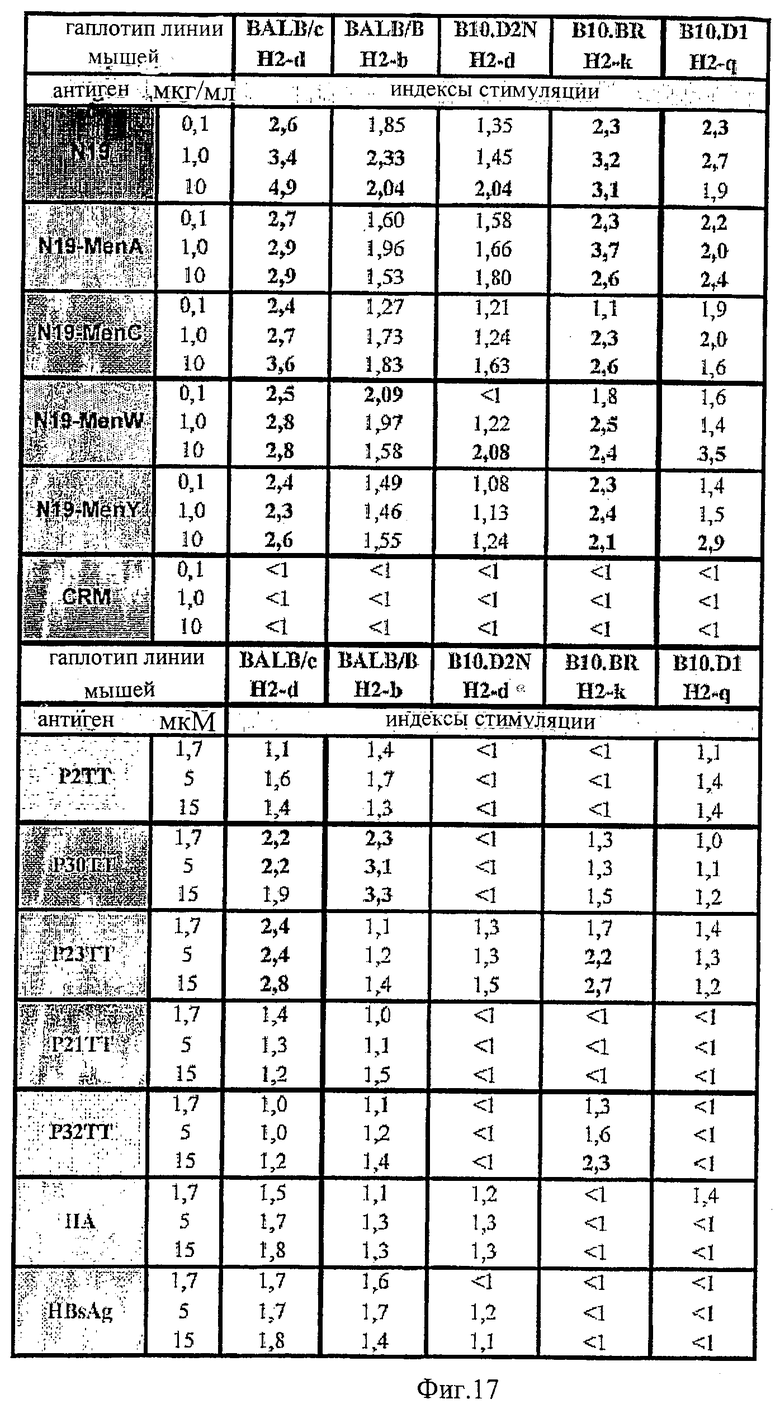
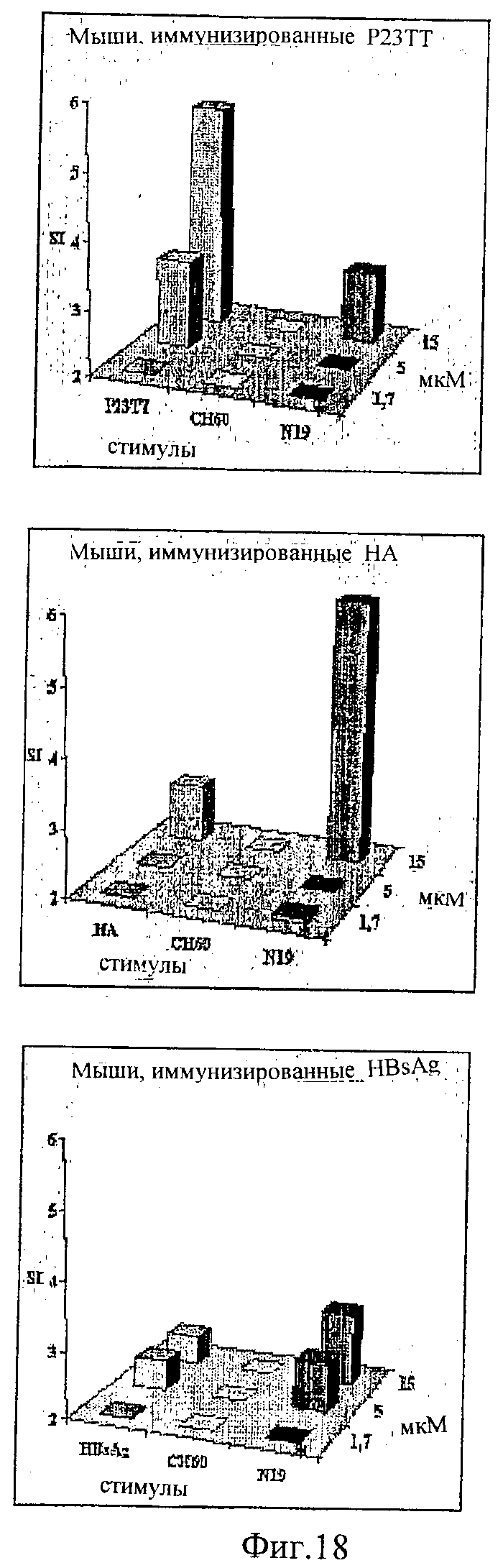
Изобретение раскрывает композиции для вызывания иммунного ответа у пациента, включающие комбинацию двух или более моновалентных конъюгатов, где каждый из моновалентных конъюгатов включает протеин-носитель N19, конъюгированный с сахаридным антигеном из серогрупп А, С, W135 или Y Neissera meningitides. При этом предпочтительно, что молекула протеина-носителя в моновалентном конъюгате конъюгирована более чем с одной молекулой сахаридного антигена. Изобретение также раскрывает мультивалентный конъюгат для вызывания иммунного ответа у пациента, включающий два или более антигенно отличающихся сахаридных антигенов из серогрупп А, С, W135 или Y Neissera meningitides, конъюгированных с протеином-носителем N19. Композиции могут включать один или более упомянутых моновалентных конъюгатов и один или более упомянутых мультивалентных конъюгатов. В изобретении показана возможность применения мультивалентного конъюгата и композиций в производстве медикамента для усиления иммунного ответа у пациента. Композиции по изобретению при их использовании вызывают значительно более сильный и быстрый иммунный ответ и обладают пониженной реактогенностью для пациента. 7 н. и 9 з.п. ф-лы, 18 ил., 2 табл.
1. Композиция для вызывания иммунного ответа у пациента, включающая комбинацию двух или более моновалентных конъюгатов, где каждый из упомянутых двух или более моновалентных конъюгатов включает (i) протеин-носитель N19, конъюгированный с (ii) сахаридным антигеном, происходящим из серогрупп А, С, W 135 или Y Neisseria meningitidis.
2. Мультивалентный конъюгат для вызывания иммунного ответа у пациента, включающий два или более антигенно отличающихся сахаридных антигена, происходящих из серогрупп А, С, W135 или Y Neisseria meningitidis, где указанные сахаридные антигены конъюгированны с протеином-носителем N19.
3. Мультивалентный конъюгат по п.2, дополнительно включающий адъювант.
4. Мультивалентный конъюгат по п.2, дополнительно включающий несахаридный антиген.
5. Мультивалентный конъюгат по п.2 для применения в терапии.
6. Композиция для вызывания иммунного ответа у пациента, включающая два или более мультивалентных конъюгата по п.2.
7. Композиция по п.1, где молекула упомянутого протеина-носителя в упомянутом моновалентном конъюгате конъюгирована с более чем одной молекулой упомянутого сахаридного антигена.
8. Композиция по п.1, где каждая молекула протеина-носителя в каждом моновалентном конъюгате конъюгирована с более чем одной молекулой сахаридного антигена.
9. Композиция по п.1 или 6, дополнительно включающая адъювант.
10. Композиция по п.1 или 6, дополнительно включающая несахаридный антиген.
11. Композиция по п.1 или 6 для применения в терапии.
12. Применение конъюгата или композиции по пп.1, 2 или 6 в производстве медикамента для усиления иммунного ответа у пациента.
13. Применение конъюгата или композиции по пп.1, 2 или 6 в производстве медикамента для усиления иммунного ответа у пациента, где упомянутый пациент предварительно обработан другим сахаридным антигеном, конъюгированным с носителем.
14. Применение конъюгата или композиции по пп.1, 2 или 6 в производстве медикамента для усиления иммунного ответа у пациента, где упомянутый пациент предварительно обработан тем же сахаридным антигеном, конъюгированным с другим носителем.
15. Композиция для вызывания иммунного ответа у пациента, содержащая первый конъюгат и второй конъюгат, где указанный первый конъюгат содержит сахаридный антиген, происходящий из серогрупп А, С, W135 или Y Neisseria meningitidis, конъюгированный с протеином-носителем N19, и указанный второй конъюгат содержит сахаридный антиген, происходящий из серогрупп А, С, W135 или Y Neisseria meningitidis, конъюгированный с протеином-носителем, отличным от N19.
16. Композиция по п.15, кроме того, включающая адъювант.
| WO 02058737 А2, 01.08.2002 | |||
| WO 9640242 A1, 19.12.1996 | |||
| WO 9955730 А2, 04.11.1999 | |||
| WO 9843677 A1, 08.10.1998 | |||
| ПОЛИСАХАРИД NEISSERIA MENINGITIDIS С МОДИФИЦИРОВАННОЙ ГРУППОЙ B, КОНЪЮГИРОВАННЫЙ АНТИГЕН, ВАКЦИНА ПРОТИВ МЕНИНГИТА ГРУППЫ B И СПОСОБ ИНДУКЦИИ ОТВЕТА АНТИТЕЛ К МЕНИНГИТУ ГРУППЫ B | 1990 |
|
RU2105568C1 |
Авторы
Даты
2012-06-27—Публикация
2005-12-23—Подача