Все цитируемые документы включены в полном объеме в виде ссылки.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области комбинированных вакцин, которые представляют собой вакцины, содержащие смесь иммуногенов из более чем одного патогена, так что введение вакцины может одновременно иммунизировать человека против более чем одного патогена.
УРОВЕНЬ ТЕХНИКИ
Комбинированные вакцины предоставляют пациентам преимущество получения меньшего числа инъекций, которое приводит к клиническому эффекту большего соответствия требованиям (например, см. главу 29 ссылки 1).
Шесть патогенов, представляющих особый интерес, особенно у детей, Corynebacterium diphtheriae (возбудитель дифтерии), Clostridium tetani (возбудитель столбняка/тризма), Bordetella pertussis (коклюш), вирус гепатита В (“гепатит В”, вирусный гепатит), Haemophilus influenzae тип b ('Hib', возбудитель бактериального менингита и пневмонии) и Neisseria meningitidis (менингококковый менингит и сепсис).
Известны вакцины против каждого из указанных патогенов, а также GlaxoSmithKline представляет на рынке пентавалентную вакцину под названием TRITANRIX-HepB/Hib, включающую в себя все пять компонентов 'D', 'T', 'P', 'HepB' и 'Hib' для одновременного комбинированного введения. Компонент 'P' в данной пентавалентной вакцине основан на антигене коклюша цельных клеток ('Pw'). Компоненты данной вакцины DTP и HepB находятся в комбинированном растворе в пузырьке (и данная тетравалентная DTPw-HepB комбинация продается отдельно как продукт TRITANRIX-HepB), но Hib-компонент является лиофилизированным и содержится в отдельном флаконе. Раствор DTPw-HepB используют для восстановления Hib-компонента во время применения, формируя пентавалентную вакцину в пузырьке для немедленного приема.
TRITANRIX-HepB/Hib не предохраняет против менингококковой инфекции.
Пример 3 ссылки 2 раскрывает результаты клинических испытаний на пациентах, в которых тетравалентный продукт TRITANRIX-HepB смешивали экстемпорально с конъюгированными капсулярными сахаридами из Hib и из серогрупп А и С менингококков ('MenA' и 'MenC'). Авторы сообщают, что данная гептавалентная смесь вызывает хороший иммунный ответ против каждого антигена и хорошо переносится детьми. Полное описание компонентов Hib, MenA и MenC не представлено. Сходная информация дана в ссылках 3 и 4.
Целью изобретения является предоставить другую и улучшенную комбинацию вакцин для защиты против всех шести инфекций: Corynebacterium diphtheriae, Clostridium tetani, Bordetella pertussis, вирус hepatitis B, Haemophilus influenzae типа b и Neisseria meningitidis.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение основано на исследованиях вакцины, которая включает в себя антигены D-T-Pw-HepB-Hib (как в продукте TRITANRIX-HepB/Hib), а также включает в себя один или более менингококковых конъюгированных антигенов. Исследовано некоторое количество усовершенствований и вариантов данных вакцин, которые и являются предметом обсуждения в данном изобретении.
Вакцины согласно изобретению включают в себя
(i) дифтерийный анатоксин 'D';
(ii) анатоксин столбняка 'T';
(iii) клеточный антиген коклюша 'wP';
(iv) поверхностный антиген вируса гепатита В 'HBsAg';
(v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем;
(vi) по меньшей мере один капсулярный сахарид Neisseria meningitidis, конъюгированный с белком-носителем.
Менингококковый сахарид(ы) может быть одного или более серотипов А, С, W135 и Y. Согласно общепринятой номенклатуре, данные четыре серогруппы обозначаются как 'MenA', 'MenC', 'MenW135' и 'MenY'. Конъюгированные антигены обозначаются в данном документе в общем виде как 'MenA-X' и т.д., где 'X' представляет собой белок-носитель конъюгата. Конъюгаты со специфическими белками-носителями обозначаются как 'MenA-CRM' или 'MenC-D' и т.д.
Предпочтительные вакцины содержат менингококковые конъюгаты по меньшей мере серогруппы С и предпочтительно обеих серогрупп А и С. Таким образом, предпочтительные вакцины являются гептавалентными (D-T-Pw-HBsAg-Hib-MenC) или пентавалентными (D-T-Pw-HBsAg-Hib-MenA-MenC).
В дополнение к антигенам (i)-(vi), перечисленным выше, могут быть представлены другие антигены, например, для получения 8-валентной, 9-валентной, 10-валентной вакцины и т.д.
Вакцины согласно изобретению могут быть приготовлены в жидком формате (где все антигены находятся в водном растворе или суспензии) при производстве, или они могут быть приготовлены по мере необходимости во время использования путем смешивания двух компонентов: (а) первого компонента, включающего в себя антигены D, T, wP и HBsAg; и (b) второго компонента, включающего в себя Hib и менингококковые конъюгаты. Указанные два компонента находятся предпочтительно в разных контейнерах (например, пузырьках или шприцах), и изобретение обеспечивает набор, включающий в себя компоненты (a) и (b). Содержимое первого контейнера предпочтительно является растворенным в воде, и содержимое второго контейнера предпочтительно является лиофилизированным, так что вакцины согласно изобретению могут быть приготовлены путем восстановления лиофилизированного компонента водным компонентом D-T-wP-HBsAg.
(1) Весовое соотношение Hib-конъюгата
Hib-конъюгаты хорошо известны, однако они представлены в разных формах. Например, в таблице 14-7 ссылки 1 даны характеристики 4 различных Hib-конъюгатов. В данной таблице показано, что соотношение веса сахарид:носитель варьируется от 1,4:1 в 'PRP-D' (избыточный сахарид) до 0,06:1 в 'PRP-OMP' (избыточный белок). Все указанные конъюгаты используют в комбинированных вакцинах, но один из аспектов изобретения связан с выбором специфического диапазона весового соотношения для применения в комбинированных вакцинах, которые включают в себя менингококковые конъюгаты.
Показано, что весовое отношение белка-носителя к сахариду в Hib-конъюгатах играет важную роль в эффективности комбинированных вакцин. Согласно ссылке 5, в комбинированных вакцинах, где белок-носитель выступает также и в качестве антигена (например, где анатоксин столбняка используют и как носитель, и как антиген, как в настоящем изобретении), Hib-конъюгат должен иметь весовое отношение сахарид:носитель от 1:0,3 до 1:2.
И напротив, согласно настоящему изобретению весовое отношение сахарида к носителю должно быть выше данного диапазона и должно находиться в диапазоне между 1:2 и 1:4. Hib-конъюгаты в данном диапазоне проявляют отличную иммуногенность, когда они объединены с менингококковыми конъюгатами в комбинированных педиатрических вакцинах, и не отличаются никаким иммунным взаимодействием, даже если белок-носитель является свободным антигеном (например, белок-носитель представляет собой анатоксин столбняка или анатоксин дифтерии). Несомненно, экстра-белок-носитель может способствовать иммунности, например, против столбняка или дифтерии.
Таким образом, настоящее изобретение предоставляет комбинированную вакцину, включающую в себя (i) анатоксин дифтерии, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вирусного гепатина В, (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (vi) по меньшей мере один капсулярный сахарид Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат H. influenzae имеет весовой избыток носителя по отношению к сахариду, где весовое соотношение носителя к сахариду составляет от 2:1 до 4:1.
Изобретение также связано со способом получения комбинированной вакцины, которая включает в себя (i) анатоксин дифтерии ('D'), (ii) анатоксин столбняка ('T'), (iii) клеточный антиген коклюша ('Pw'), (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (vi) по меньшей мере один капсулярный сахарид Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что способ включает в себя стадии (а) совмещения трехвалентного D-T-Pw-компонента с моновалентным HВsAg-компонентом, с получением тетравалентного компонента D-T-Pw-HBsAg; (b) совмещение конъюгатов H. influenzae и N. meningitidis, с получением компонента смешанного конъюгата, где конъюгат H. influenzae имеет избыток веса носителя по отношению к сахариду с весовым отношением носителя к сахариду между 2:1 и 4:1; и (с) смешивание компонента D-T-Pw-HBsAg с компонентом конъюгатов, с получением комбинированной вакцины.
Hib-конъюгат имеет избыток по весу белка-носителя. Весовое соотношение составляет от 2:1 до 4:1 и предпочтительно составляет от 2,5:1 до 3,5:1. Можно использовать весовое соотношение от 2,8:1 до 3,2:1, а предпочтительным является соотношение 3:1. Следовательно, в обычной дозе 10 мкг (измеренной по сахариду) композиция согласно изобретению будет включать в себя 20-40 мкг, предпочтительно 30 мкг носителя. Данное соотношение является прямо противоположным таковому, указанному в ссылке 5.
Белок-носитель для Hib-конъюгата предпочтительно представляет собой анатоксин столбняка, и, следовательно, для 10 мкг Hib-сахарида композиция может включать в себя 20-40 мкг анатоксина столбняка из Hib-конъюгата плюс другой анатоксин столбняка в качестве 'T'-антигена для защиты против инфекции C. tetani.
В предпочтительных композициях и способах используют менингококковые конъюгаты серогруппы С. В более предпочтительных композициях и способах используют отдельные менингококковые конъюгаты обеих серогрупп А и С. Их предпочтительно конъюгируют с белком D - носителем H. influenzae, однако они также могут быть конъюгированы с носителем-анатоксином столбняка, носителем-анатоксином дифтерии или носителем CRM197.
(2) Связь носитель/сахарид в Hib-конъюгате
Как показано в таблице 14-7 ссылки 1, несколько разных по химическому составу связей используют для создания Hib-конъюгатов. Конъюгаты создают путем активации сахарида, активации носителя и активации обоих компонентов - и сахарида, и носителя. Для активации сахарида используют периодат и цианоборогидрат в продукте 'HbOC', и ADH, CNB и карбодиимид HCl в продукте 'PRP-T'. В комбинированных вакцинах используют все указанные конъюгаты, но согласно одному из аспектов настоящего изобретения выбирают специфический тип связи для использования в комбинированных вакцинах, которые включают в себя менингококковые конъюгаты.
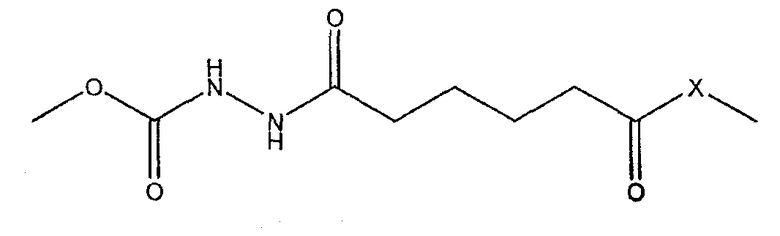
Согласно настоящему изобретению, полисахарид может быть активирован бромистым цианом, затем соединен со связывающим агентом - адипиновой кислотой, и затем данная субстанция линкер-сахарид реагирует с белком-носителем, в частности с белком-носителем анатоксином столбняка.
Первая стадия включает в себя цианилирование свободной -OH-группы на Hib-сахариде, и она показана следующим образом:

Данную реакцию проводят бромистым цианом (CNBr). Вкратце, CNBr реагирует с сахаридом в кислых условиях (обычно рН 10-12). При данном высоком рН образуются эфиры циановой кислоты с гидроксильными группами сахаридов. Высокое значение рН ионизирует гидроксильную группу, что делает возможной нуклеофильную атаку гидроксильного иона на ион цианата. Из-за высокого рН могут происходить различные побочные реакции, но только образование эфира циановой кислоты является предметом обсуждения в данном изобретении.
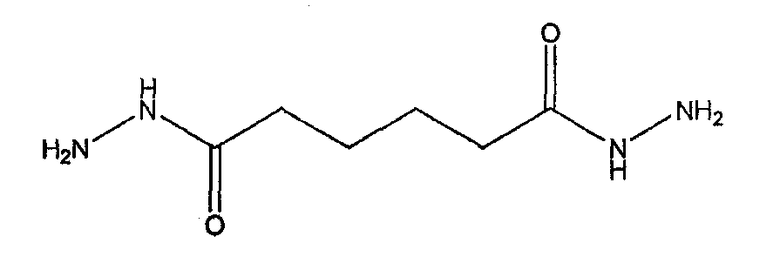
Эфир циановой кислоты реагирует с бифункциональным реагентом (гетеробифункциональным или предпочтительно с гомобифункциональным) с целью обеспечения спейсера для связывания носителя. Согласно изобретению может быть использован адипин-гидразидный спейсер. Для этого удобно использовать дигидразид адипиновой кислоты (AADH)
Механизм реакции AADH с эфиром циановой кислоты (с образованием имидокарбаминовой связи) может быть проиллюстрирован следующим образом:
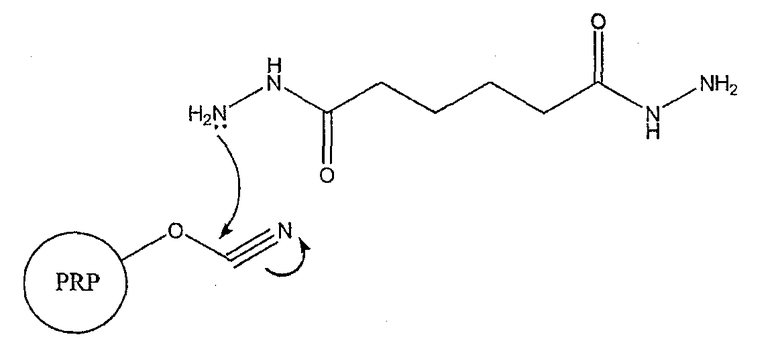
Активированный сахарид затем реагирует с носителем - анатоксином столбняка - в присутствии EDAC (1-этил-3-(3-диметиламинопропил)карбодиимид)
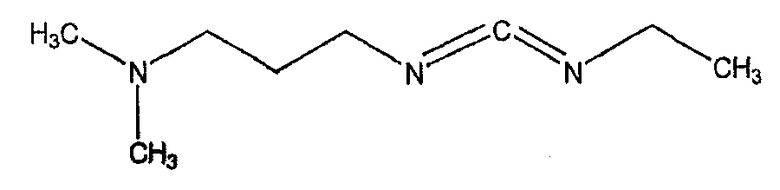
EDAC обычно используют в виде соли его гидрохлорида:
(CH3)2N(CH2)3-N=C=N-CH2CH3· HCl.
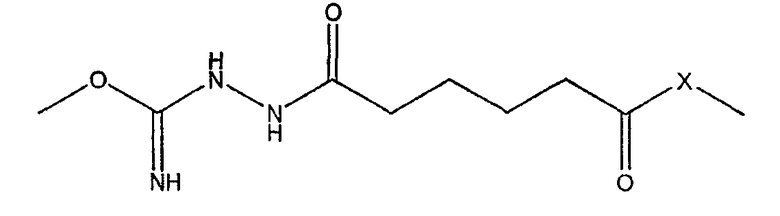
EDAC позволяет карбоксильной группе адипиновой кислоты на свободном конце линкера реагировать с белком-носителем (обычно со свободными -SH, -NH2 или -OH на аминокислотной боковой цепи) с образованием конъюгата, что можно проиллюстрировать следующим образом, где -X- представляет собой -S-, -O- или -NH-, в зависимости от носителя.
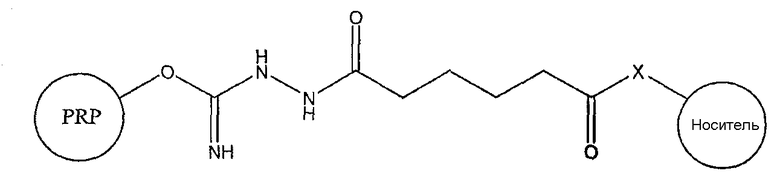
В водных условиях C=NH может превращаться в C=O, давая карбамат:
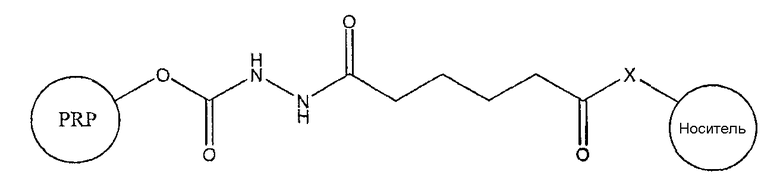
Таким образом, изобретение предоставляет комбинированную вакцину, включающую в себя (i) дифтерийный анатоксин, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В, (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) по меньшей мере один капсулярный сахарид Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат H. influenzae получен способом, включающим в себя стадии (а) активации капсулярного сахарида Haemophilus influenzae типа b бромистым цианом, с получением эфира циановой кислоты; (b) добавления адипин-гидразидного спейсера к эфиру циановой кислоты, с получением активированного сахарида; и (c) соединения активированного сахарида с белком-носителем путем карбодиимидной конденсации.
Изобретение также предоставляет комбинированную вакцину, включающую в себя (i) дифтерийный анатоксин, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В, (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) по меньшей мере один капсулярный сахарид Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат H.influenzae (v) включает в себя сшивающий агент, имеющий одну из следующих двух структур:
где -Х- выбран из группы, состоящей из -О-, -S- или -NH-. Карбамат является предпочтительным. Белок-носитель для Hib-конъюгата представляет собой предпочтительно анатоксин столбняка.
В предпочтительных композициях и способах используют менингококковый конъюгат серогруппы С, а в более предпочтительных композициях и способах используют раздельные менингококковые конъюгаты обеих серогрупп А и С. Их предпочтительно конъюгируют с белком-носителем D H.influenzae.
Смесь конъюгатов Hib, MenА и MenC используют или для смешивания с другими вакцинами или как собственно вакцину. Таким образом, изобретение также предоставляет смесь конъюгатов, включающую в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (ii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат H. influenzae получают способом, включающим в себя стадии (а) активации капсулярного сахарида Haemophilus influenzae типа b бромистым цианом, с получением эфира циановой кислоты; (b) добавления адипин-гидразидного спейсера к эфиру циановой кислоты, с получением активированного сахарида; и (c) соединения активированного сахарида с белком-носителем путем карбодиимидной конденсации.
Изобретение также предоставляет смесь конъюгатов, включающую в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (ii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат H. influenzae (i) включает в себя связывающий агент, имеющий одну из следующих двух структур:
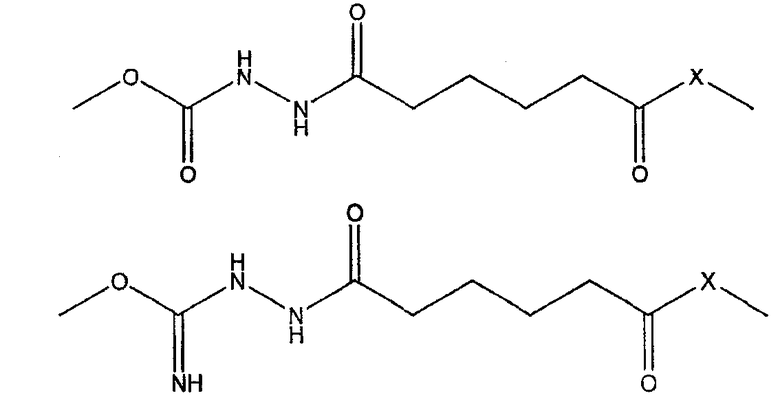
где -Х- выбран из группы, состоящей из -О-, -S-, или -NH-. Карбамат является предпочтительным.
(3) Прямое связывание носитель-сахарид в менингококковых конъюгатах
Hib-конъюгат, описанный выше, связывается с белком-носителем посредством спейсера. В отличие от этого, в менингококковых конъюгатах предпочтительно использовать прямое связывание. Установлено, что прямое связывание подходит, в частности, для менингококковых конъюгатов, особенно если в качестве носителя используют белок D и если в Hib-конъюгате не применяли прямое связывание (чтобы избежать связывающих агентов из-за превышения пороговых значений, при которых они могут стать иммуногенными).
В ситуации прямого связывания -ОН-группа в менингококковом сахариде цианилируется первой (например, как описано выше), с получением эфира циановой кислоты. Группа -OCN затем используется для прямого связывания с боковой цепью носителя, такой как свободная -NH2-группа, свободная -SH-группа или свободная -OH-группа. Связывание со свободной -NH2-группой в боковой цепи лизина является предпочтительным.
Механизм прямого связывания можно проиллюстрировать следующим образом:
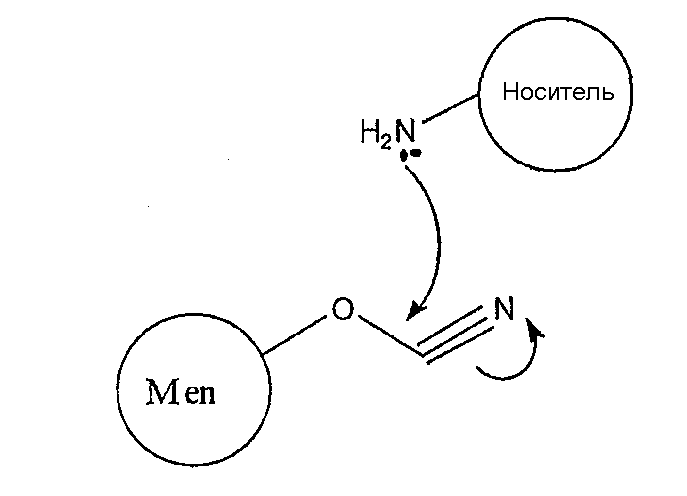
и конъюгированный продукт данной реакции можно изобразить следующим образом:
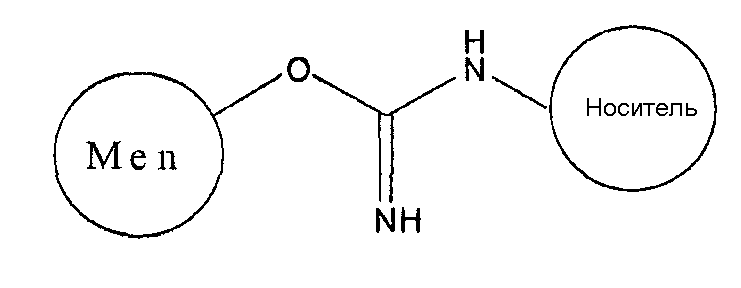
В водных условиях C=NH может превращаться в C=O, давая карбамат:
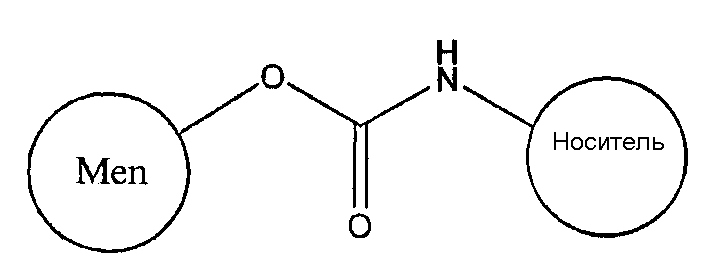
Вместо использования бромистого циана в качестве цианилирующего агента реакцию цианилирования предпочтительно проводить, используя органический цианилирующий реагент, такой как реагент 1-циано-4-(диметиламино)пиридиний ('CDAP'). Органический цианилирующий реагент может быть выбран из группы, состоящей из 1-циано-4-(диметиламино)пиридиния тетрафторбората, р-нитрофенилцианата ('pNPC'), N-цианотриэтиламмоний тетрафторбората ('CTEA'). Использование данных реагентов подразумевает, что реакция активации может быть проведена при нейтральном рН, который помогает сохранять стабильность и целостность полисахарида. В частности, это может помочь сохранить OAc группы (см. ниже). В предпочтительных способах цианилирующий реагент используют при рН 6-8 в ненуклефильном буфере, например в физиологическом растворе, HEPES, фосфатном буфере, воде и некоторых органических растворителях [6]. CDAP можно растворить в ацетонитриле и добавить к водному раствору сахарида. После конъюгации реакция может быть подавлена добавлением глицина, который блокирует все непрореагировавшие циановые группы.
Сосредотачиваясь на конъюгате менингококка серогруппы А, изобретение предоставляет комбинированную вакцину, включающую в себя (i) дифтерийный анатоксин, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В, (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы А получают способом, включающим в себя стадии (а) цианилирование капсулярного сахарида серогруппы А, с получением эфира циановой кислоты; и (b) присоединение эфира циановой кислоты прямо к белку-носителю. Вакцина может также включать в себя (vii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение также предоставляет способ приготовления смеси конъюгатов, включающей в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы А получают способом, включающим в себя стадии (а) цианилирование капсулярного сахарида серогруппы А, с получением эфира циановой кислоты; (b) присоединение эфира циановой кислоты прямо к белку-носителю.
Обращаясь к конъюгату менингококка серогруппы С, изобретение предоставляет комбинированную вакцину, включающую в себя (i) дифтерийный анатоксин, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В, (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы С получают способом, включающим в себя стадии (а) цианилирования капсулярного сахарида серогруппы С, с получением эфира циановой кислоты; и (b) присоединения эфира циановой кислоты прямо к белку-носителю. Вакцина может также включать в себя (vii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение также предоставляет способ приготовления смеси конъюгатов, включающей в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы C получают способом, включающим в себя стадии (а) цианилирования капсулярного сахарида серогруппы C, с получением эфира циановой кислоты; (b) присоединения эфира циановой кислоты прямо к белку-носителю.
Изобретение также предоставляет вакцины и способы, в которых конъюгаты обоих серогруппы А и серогруппы С приготовлены таким образом и затем совмещены. Hib-конъюгат также может быть добавлен для получения смеси конъюгатов, включающей в себя Hib, MenA и MenC.
(4) О-ацетилирование конъюгата серогруппы С
Капсулярный сахарид менингококка серогруппы С представляет собой α2→9 связанный гомополимер сиаловой кислоты (N-ацетил-нейраминовая кислота), обычно с О-ацетил (ОАс) группами в С-7- или С-8-остатках:
→9)-Neu p NAc 7/8 OAc-(α2→
Некоторые штаммы MenC (~12% инвазивных изолятов) продуцируют полисахарид, котрый имеет недостаток указанных групп ОАс+. Наличие или отсутствие ОАс групп создает уникальные эпитопы, и специфичность связывания антител с сахаридом может влиять на его бактериальную активность против О-ацетилированных (ОАс-) и де-О-ацетилированных (ОАс+) штаммов [7-9]. Лицензированные MenC конъюгированные вакцины включают в себя оба сахарида ОАс- (NeisVac-CTM) и ОАс+ (MenjugateTM & MeningitecTM).
Согласно изобретению могут быть использованы или штаммы ОАс+, или ОАс-.
Таким образом, изобретение предоставляет комбинированную вакцину, включающую в себя (i) дифтерийный анатоксин, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что по меньшей мере 50% остатков сиаловых кислот в капсулярном сахариде серогруппы С из (vi) являются О-ацетилированными в С-7- и С-8-положениях.
Изобретение также предоставляет комбинированную вакцину, включающую в себя (i) дифтерийный анатоксин, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что капсулярный сахарид серогруппы С из штамма ОАс+.
Изобретение также предоставляет комбинированную вакцину, включающую в себя (i) дифтерийный анатоксин, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком- носителем, и (vi) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что остатки сиаловой кислоты в капсулярном сахариде серогруппы С из (vi) являются не О-ацетилированными.
Изобретение также предоставляет комбинированную вакцину, включающую в себя (i) дифтерийный анатоксин, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком- носителем, и (vi) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что капсулярный сахарид серогруппы С из штамма ОАс-.
Указанные вакцины могут также включать в себя (vii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение также предоставляет способ приготовления комбинированной вакцины, которая включает в себя (i) анатоксин дифтерии ('D'), (ii) анатоксин столбняка ('T'), (iii) клеточный антиген коклюша ('Pw'), (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что способ включает в себя стадии (а) совмещения трехвалентного D-T-Pw-компонента с моновалентным HBsAg-компонентом для получения тетравалентного компонента D-T-Pw-HBsAg; (b) совмещение конъюгатов H. influenzae и N. meningitidis для получения компонента смешанного конъюгата, где, по меньшей мере, 50% остатков сиаловой кислоты в капсулярном сахариде серогруппы С из (vi) являются О-ацетилированными в С-7- и С-8-положениях.
Изобретение также предоставляет способ приготовления комбинированной вакцины, которая включает в себя (i) анатоксин дифтерии ('D'), (ii) анатоксин столбняка ('T'), (iii) клеточный антиген коклюша ('Pw'), (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что способ включает в себя стадии (а) совмещения трехвалентного D-T-Pw-компонента с моновалентным HBsAg-компонентом, с получением тетравалентного компонента D-T-Pw-HBsAg; (b) совмещения конъюгатов H. influenzae и N. meningitidis для получения компонента смешанного конъюгата, где остатки сиаловой кислоты в капсулярном сахариде серогруппы С из (vi) не являются О-ацетилированными.
Изобретение также предоставляет способ приготовления комбинированной вакцины, которая включает в себя (i) анатоксин дифтерии ('D'), (ii) анатоксин столбняка ('T'), (iii) клеточный антиген коклюша ('Pw'), (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что способ включает в себя стадии (а) совмещения трехвалентного D-T-Pw-компонента с моновалентным HBsAg-компонентом для получения тетравалентного компонента D-T-Pw-HBsAg; (b) совмещения конъюгатов H. influenzae и N. meningitidis для получения компонента смешанного конъюгата, где капсулярный сахарид серогруппы С из штамма ОАс-.
Изобретение также предоставляет способ приготовления комбинированной вакцины, которая включает в себя (i) анатоксин дифтерии ('D'), (ii) анатоксин столбняка ('T'), (iii) клеточный антиген коклюша ('Pw'), (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что способ включает в себя стадии (а) совмещения трехвалентного компонента D-T-Pw с моновалентным компонентом HBsAg для получения тетравалентного компонента D-T-Pw-HBsAg; (b) совмещения конъюгатов H. influenzae и N. meningitidis для получения компонента смешанного конъюгата, где капсулярный сахарид серогруппы С из штамма ОАс+.
Вакцины, изготовленные данными способами, могут также включать в себя (vii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение также предоставляет смесь конъюгатов, включающую в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что остатки сиаловой кислоты в конъюгате MenC не являются О-ацетилированными.
Изобретение также предоставляет смесь конъюгатов, включающую в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы A Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем характеризующийся тем, что MenC капсулярный сахарид из штамма ОАс-.
Изобретение также предоставляет смесь конъюгатов, включающую в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы A Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что по меньшей мере 50% остатков сиаловой кислоты в конъюгате MenC являются О-ацетилированными в С-7- и С-8-положениях.
Изобретение также предоставляет смесь конъюгатов, включающую в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы A Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что капсулярный сахарид MenC из штамма ОАс+.
Где, по меньшей мере, 50% остатков сиаловой кислоты в конъюгате серогруппы С являются О-ацетилированными, минимальный процент может быть выше, например 60%, 70%, 80%, 90% и выше.
Предпочтительными штаммами для производства конъюгатов серогруппы С являются штаммы ОАс+, предпочтительно серотип 16, предпочтительно сероподтип Р1.7а,1. Таким образом С:16:Р1.7а,1 штаммы ОАс+ являются предпочтительными.
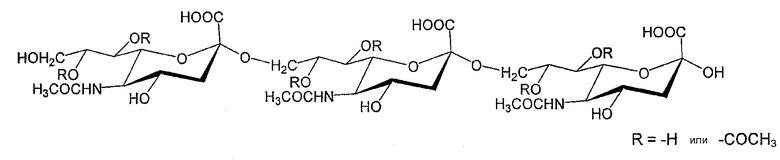
(5) О-ацетилирование конъюгата серогруппы А
Капсулярный сахарид менингококка серогруппы А представляет собой гомополимер N-ацетилманнозаминфосфат, соединенный α1→6 с частичным ацетилированием в С-3- и С-4-положениях:
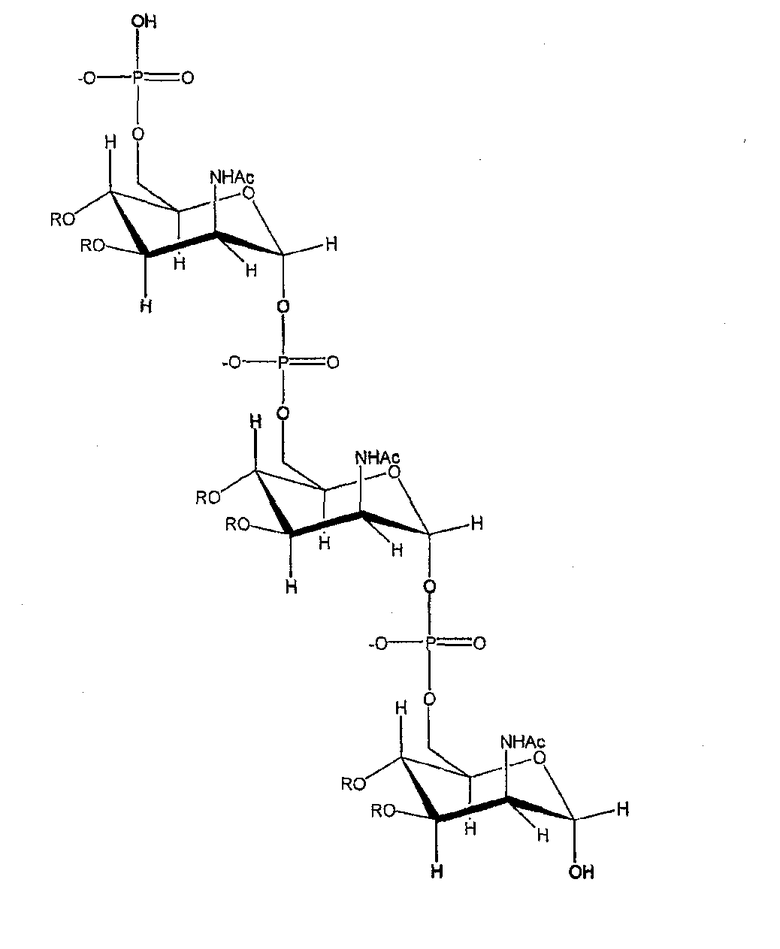 R= -H или СOOH3
R= -H или СOOH3
Ацетилирование в С-3-положении может достигать 70-95%. Условия, используемые для очистки сахарида, могут приводить к де-О-ацетилированию (например, при основных условиях), но настоящее изобретение обращено к сохраненным ОАс.
Таким образом, изобретение предоставляет комбинированную вакцину, включающую в себя (i) анатоксин дифтерии, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что по меньшей мере 50% маннозаминных остатков капсулярного сахарида серогруппы А являются О-ацетилированными в С-3-положении. Вакцина может также включать в себя (vii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение также предоставляет способ приготовления комбинированной вакцины, которая включает в себя (i) анатоксин дифтерии ('D'), (ii) анатоксин столбняка ('T'), (iii) клеточный антиген коклюша ('Pw'), (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что способ включает в себя стадии (а) совмещения трехвалентного компонента D-T-Pw с моновалентным компонентом HBsAg для получения тетравалентного компонента D-T-Pw-HBsAg; (b) совмещение конъюгатов H. influenzae и N. meningitidis для получения компонента смешанного конъюгата, где по меньшей мере 50% маннозаминных остатков капсулярного сахарида серогруппы А являются О-ацетилированными в С-3-положении.
Вакцина, изготовленная данным способом, может также включать в себя (vii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение также предоставляет смесь конъюгатов, включающую в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы A Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что по меньшей мере 50% маннозаминных остатков капсулярного сахарида серогруппы А являются О-ацетилированными в С-3-положении.
Где по меньшей мере 50% маннозаминных остатков в конъюгате серогруппы А являются О-ацетилированными, минимальный процент может быть выше, например 60%, 70%, 80%, 90% и выше.
(6) Подбор дозы конъюгатов
Производство антигенов Hib-конъюгата является дорогостоящим, и были разработаны различные стратегии для их экономного использования [10-12]. Один подход дает две дозы конъюгата в дозах ниже, чем стандартные 10 мкг/доза (обычно дробные части, например, 1/2, 1/3, 1/4 и так далее) [10,12]. Например, согласно ссылке 12, конъюгаты вводили как 5 мкг/доза или 3,33 мкг/доза, т.е. 1/2 или 1/3 или обычная доза.
Данный подход был перенесен на Hib-конъюгаты в DTP-Hib-вакцинах. Например, в ссылке 13 сравнивают применение полной дозы, половы дозы и трети дозы Hib-конъюгата в комбинации с DТwP-вакциной и несмотря на то, что геометрические средние концентрации антител к PRP были снижены у пациентов, получавших комбинированные DTP-Hib вакцины, по сравнению с раздельным введением DTP и Hib приемлемый защитный анти-Hib иммунный ответ был получен во всех случаях. В ссылке 14 используют 10-кратное разведение дозы Hib-конъюгата при восстановлении одной Hib дозы пузырьком с DTwP на 10 доз. Ссылка 2 раскрывает восстановление лиофилизированного Hib-конъюгата в полной дозе, в половине дозы или в четверти дозы, используя TRITANRIXTM DTwP-HBsAg-вакцину.
Не сообщалось о подобных исследованиях доз для менингококковых конъюгатов в комбинированных вакцинах.
Для комбинированных вакцин согласно изобретению выбирают Hib и менингококковые конъюгаты в количестве от 8 мкг до 12 мкг (измеренных по сахариду). Данное количество может быть представлено в одной однократной дозы или на миллилитр вакцины.
Таким образом, изобретение предоставляет комбинированную вакцину, включающую в себя (i) анатоксин дифтерии, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В, (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) по меньшей мере один капсулярный сахарид Neisseria meningitidis, конъюгированный с белком-носителем, характеризующуюся тем, что вакцина содержит от 8 мкг/мл до 12 мкг/мл капсулярного сахарида Haemophilus influenzae типа b. Предпочтительно, если в состав включены менингококковые конъюгаты обоих серогрупп А и С.
Изобретение также предоставляет комбинированную вакцину, включающую в себя (i) анатоксин дифтерии, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В, (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, характеризуемой тем, что вакцина содержит от 8 мкг/мл до 12 мкг/мл капсулярного сахарида менингококковой серогруппы А. Предпочтительно, вакцина также включает в себя (vii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение также предоставляет комбинированную вакцину, включающую в себя (i) анатоксин дифтерии, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы C Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что вакцина содержит от 8 мкг/мл до 12 мкг/мл капсулярного сахарида менингококковой серогруппы C. Предпочтительно, вакцина также включает в себя (vii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение предоставляет комбинированную вакцину, включающую в себя (i) анатоксин дифтерии, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В, (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi), по меньшей мере, один капсулярный сахарид Neisseria meningitidis, конъюгированный с белком-носителем, характеризующуюся тем, что вакцина содержит от 8 мкг/мл до 12 мкг/мл капсулярного сахарида Haemophilus influenzae типа b на единичную дозу. Предпочтительно, если в состав включены менингококковые конъюгаты обоих серогрупп А и С.
Изобретение также предоставляет комбинированную вакцину, включающую в себя (i) анатоксин дифтерии, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В, (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, характеризуемой тем, что вакцина содержит от 8 мкг до 12 мкг капсулярного сахарида менингококковой серогруппы А на единичную дозу. Предпочтительно вакцина также включает в себя (vii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение также предоставляет комбинированную вакцину, включающую в себя (i) анатоксин дифтерии, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы C Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что вакцина содержит от 8 мкг до 12 мкг капсулярного сахарида менингококковой серогруппы C на разовую дозу. Предпочтительно вакцина также включает в себя (vii) капсулярный сахарид Neisseria meningitidis серогруппы А, конъюгированный с белком-носителем.
Предпочтительные вакцины имеют дозу сахарида от 8 мкг до 12 мкг (на миллилитр или на разовую дозу) для всех трех конъюгатов Hib, MenA и MenC.
(7) Экстемпоральные способы для получения вакцин согласно изобретению
Как упоминалось ранее, вакцины согласно изобретению могут быть приготовлены экстемпорально, во время использования смешиванием двух компонентов: (а) первого компонента, включающего в себя антигены D, T, wP и HBsAg; и (b) второго компонента, включающего в себя Hib-конъюгат и, по меньшей мере, один менингококковый конъюгат. Два компонента предпочтительно упакованы отдельно и, таким образом, в целом, настоящее изобретение предоставляет набор, содержащий: (а) первый компонент, включающий в себя антигены D, T, wP и HBsAg; и (b) второй компонент, включающий в себя Hib-конъюгат и, по меньшей мере, один менингококковый конъюгат. При данном подходе избегают деполимеризации конъюгатов, которая может иметь место при хранении в водных условиях, что является особой проблемой для конъюгатов Hib и MenA, особенно для комбинированных.
Два компонента (а) и (b) пакуют отдельно, например в отдельные пузырьки. Содержимое первого пузырька (D, T, wP и HBsAg) предпочтительно водное, и содержимое второго пузырька предпочтительно лиофилизированное, так что вакцины согласно изобретению могут быть приготовлены восстановлением лиофилизированного компонента водным компонентом. Таким образом, изобретение предоставляет способ приготовления композиции вакцины согласно изобретению, включающий в себя стадии: (а) предоставление первого компонента, включающего в себя антигены D, T, wP и HBsAg в водной форме; (b) предоставление второго компонента, включающего в себя Hib и менингококковые конъюгаты в лиофилизированной форме; и (с) смешивание первого и второго компонентов для получения комбинированной вакцины. Стадия смешивания обычно имеет место во время использования.
Изобретение также предоставляет способ изготовления набора согласно изобретению, включающего в себя стадии: (а) получения или приготовления первого компонента, включающего в себя антигены D, T, wP и HBsAg; (b) получения или приготовления второго компонента, включающего в себя Hib и менингококковые конъюгаты; и (с) совмещение двух компонентов в форме набора.
Более конкретно изобретение предоставляет:
- набор, содержащий (а) первый компонент, включающий в себя антигены D, T, wP и HBsAg; (b) второй компонент, включающий в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и, по меньшей мере, один капсулярный сахарид N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, конъюгат H. influenzae имеет весовой избыток носителя к сахариду с весовым отношением носителя к сахариду от 2:1 до 4:1
- способ приготовления набора согласно изобретению, включающий в себя следующие стадии (а) приготовления первого компонента, включающего в себя антигены D, T, wP и HBsAg; (b) приготовления второго компонента, включающего в себя капсулярный сахарид H. influenzae типа b, конъюгированного с белком-носителем, и, по меньшей мере, одиного капсулярного сахарида N. meningitidis, конъюгированного с белком-носителем, характеризующегося тем, конъюгат H. influenzae имеет весовой избыток носителя к сахариду с весовым отношением носителя к сахариду от 2:1 до 4:1; и (с) совмещение двух компонентов в форме набора;
- набор, включающий в себя (i) первый компонент, включающий в себя антигены D, T, Pw и HBsAg; и (ii) второй компонент, включающий в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и, по меньшей мере, один капсулярный сахарид N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, конъюгат H. influenzae получают способом, включающим в себя стадии: (а) активации капсулярного сахарида Haemophilus influenzae типа b бромистым цианом для получения эфира циановой кислоты; (b) добавление адипин-гидразидного спейсера к эфиру циановой кислоты для получения активированного сахарида; и (c) соединение активированного сахарида с белком-носителем путем карбодиимидной конденсации;
- набор, включающий в себя (а) первый компонент, включающий в себя антигены D, T, wP и HBsAg; и (b) второй компонент, включающий в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и, по меньшей мере, один капсулярный сахарид N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, конъюгат H. influenzae включает в себя линкер, имеющий одну из следующих двух структур:
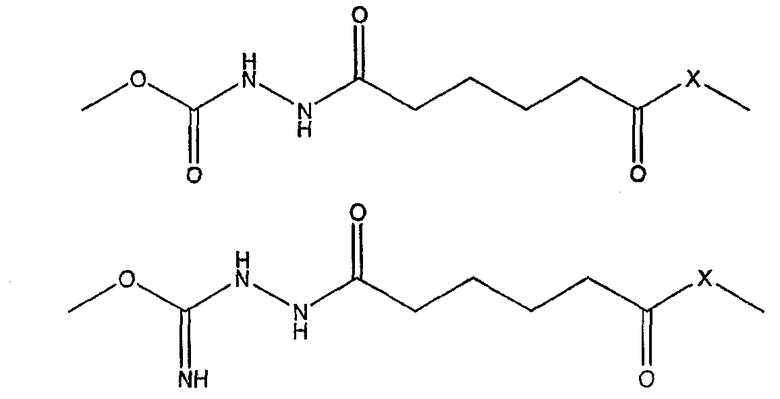
где Х выбран из группы, состоящей из -O-, -S- или -NH-.
- способ приготовления набора согласно изобретению, включающий в себя стадии (i) приготовления первого компонента, включающего в себя D, T, wP и HBsAg антигены; (ii) приготовления второго компонента, включающего в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и, по меньшей мере, один капсулярный сахарид N. meningitidis, конъюгированный с белком-носителем, и (iii) совмещения двух компонентов в форме набора, характеризующийся тем, что конъюгат H. influenzae получают способом, включающим в себя стадии (а) активации капсулярного сахарида Haemophilus influenzae типа b бромистым цианом для получения эфира циановой кислоты; (b) добавления адипин-гидразидного спейсера к эфиру циановой кислоты для получения активированного сахарида; и (c) соединение активированного сахарида с белком-носителем путем карбодиимидной конденсации;
- способ приготовления набора согласно изобретению, включающий в себя стадии (а) приготовления первого компонента, включающего в себя антигены D, T, wP и HBsAg; (b) приготовления второго компонента, включающего в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и по меньшей мере один капсулярный сахарид N. meningitidis, конъюгированный с белком-носителем, и (c) совмещения двух компонентов в виде набора, характеризующийся тем, что конъюгат H. influenzae содержит линкер одной из следующих двух структур:
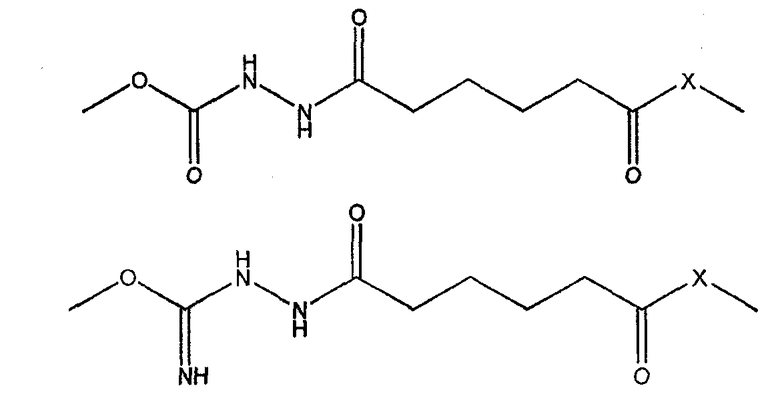
где Х выбран из группы, состоящей из -O-, -S- или -NH-;
- способ приготовления набора согласно изобретению, включающий в себя стадии (i) приготовления первого компонента, включающего в себя антигены D, T, Pw и HBsAg; (ii) приготовления второго компонента, включающего в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и капсулярный сахарид серогруппы А N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы А N. meningitidis получают способом, включающим стадии (а) цианилирования капсулярного сахарида серогруппы А для получения эфира циановой кислоты; (b) соединения эфира циановой кислоты непосредственно с белком-носителем;
- способ приготовления набора согласно изобретению, включающий в себя стадии: (а) приготовления первого компонента, включающего в себя антигены D, T, wP и HBsAg; (b) приготовления второго компонента, включающего в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и капсулярный сахарид серогруппы С N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы С N. meningitidis получают способом, включающим стадии: (а) цианилирования капсулярного сахарида серогруппы С для получения эфира циановой кислоты; (b) соединения эфира циановой кислоты непосредственно с белком-носителем;
- способ приготовления набора согласно изобретению, включающий в себя стадии (i) приготовления первого компонента, включающего в себя антигены D, T, wP и HBsAg; (ii) приготовления второго компонента, включающего в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и капсулярный сахарид серогруппы А N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы А N. meningitidis получают способом, включающим стадии (а) цианилирования капсулярного сахарида серогруппы А для получения эфира циановой кислоты; (b) взаимодействия эфира циановой кислоты с бифункциональным линкером для получения активированного сахарида; и (c) соединение активированного сахарида с белком-носителем;
- способ приготовления набора согласно изобретению, включающий в себя стадии (i) приготовления первого компонента, включающего в себя антигены D, T, wP и HBsAg; (ii) приготовления второго компонента, включающего в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и капсулярный сахарид серогруппы С N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы С N. meningitidis получают способом, включающим стадии (а) цианилирования капсулярного сахарида серогруппы С для получения эфира циановой кислоты; (b) взаимодействия эфира циановой кислоты с бифункциональным линкером для получения активированного сахарида; и (c) соединение активированного сахарида с белком-носителем;
- набор, включающий в себя (а) первый компонент, включающий в себя антигены D, T, wP и HBsAg; и (b) второй компонент, включающий в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и капсулярный сахарид серогруппы С N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что, по меньшей мере, 50% остатков сиаловой кислоты в конъюгате серогруппы С N. meningitidis являются О-ацетилированными в положениях С-7- и С-8-;
- набор, включающий в себя (а) первый компонент, включающий в себя антигены D, T, wP и HBsAg; и (b) второй компонент, включающий в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и капсулярный сахарид серогруппы С N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что остатки сиаловой кислоты в конъюгате серогруппы С N. meningitidis не являются О-ацетилированными;
- набор, включающий в себя (а) первый компонент, включающий в себя антигены D, T, wP и HBsAg; и (b) второй компонент, включающий в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и капсулярный сахарид серогруппы С N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что капсулярный сахарид серогруппы С N. meningitidis из штамма OAc+;
- набор, включающий в себя (а) первый компонент, включающий в себя антигены D, T, wP и HBsAg; и (b) второй компонент, включающий в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и капсулярный сахарид серогруппы С N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что капсулярный сахарид серогруппы С N. meningitidis из штамма OAc-;
- набор, включающий в себя (а) первый компонент, включающий в себя антигены D, T, wP и HBsAg; и (b) второй компонент, включающий в себя капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и капсулярный сахарид серогруппы A N. meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что, по меньшей мере, 50% маннозаминных остатков в капсулярном сахариде серогруппы A N. meningitidis являются О-ацетилированными в С-3-положении;
- способ приготовления набора согласно изобретению, включающий в себя стадии (а) совмещения трехвалентного D-T-Pw-компонента с моновалентным HBsAg-компонентом для получения первого компонента набора; (b) совмещение капсулярного сахарида H. influenzae типа b, конъюгированного с белком-носителем, капсулярного сахарида серогруппы A N. meningitidis, конъюгированного с белком-носителем, и капсулярного сахарида серогруппы С N. meningitidis, конъюгированного с белком-носителем, для получения второго компонента набора.
Первый компонент набора предпочтительно получают смешиванием DTPw-компонента с HBsAg-компонентом. Второй компонент набора предпочтительно представляет собой трехвалентный конъюгат, включающий в себя (1) капсулярный сахарид Haemophilus influenzae, конъюгированный с белком-носителем; (2) капсулярный сахарид серогруппы A Neisseria meningitidis, конъюгированный с белком-носителем; и (3) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем.
(8) Способы изготовления вакцин согласно изобретению
Предпочтительные гептавалентные вакцины согласно изобретению включают в себя семь антигенных компонентов D, T, Pw, HBsAg, Hib-X, MenA-X и MenC-X. Несмотря на то, что они, в принципе, могут быть смешаны в другом порядке, особенно предпочтительно, как описано выше, приготовить первый компонент (с антигенами D, T, Pw, HBsAg) и второй компонент (с конъюгатами Hib, MenA и MenC) и соединить данные два компонента во время применения.
Кроме того, предпочтительно, чтобы D-T-Pw-HBsAg-компонент получали смешиванием D-T-Pw-компонента с HBsAg-компонентом. Обнаружено, что данный порядок смешивания (а именно добавление HBsAg к смеси DTPw, а не добавление HBsAg до любого из антигенов D, T, Pw) особенно применим для создания комбинированных вакцин, особенно, если индивидуальные компоненты вакцины адсорбируют на солях алюминия. Это отличается от порядка смешивания, описанного в ссылке 15, где сначала получают смесь D-T-HBsAg, к которой затем добавляют сток-раствор Pw. Это отличается от порядка смешивания, описанного в ссылке 16, где смесь Pw-HBsAg соединяют со смесью D-T.
Таким образом, изобретение предоставляет способ приготовления комбинированной вакцины, которая включает в себя (i) анатоксин дифтерии ('D'), (ii) анатоксин столбняка ('T'), (iii) клеточный антиген коклюша ('Pw'), (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем ('Hib-X'), (vi) капсулярный сахарид Neisseria meningitidis серогруппы А, конъюгированный с белком-носителем ('MenA-X'), и (vii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем ('MenC-X'), характеризующийся тем, что способ включает в себя стадии: (а) соединения трехвалентного D-T-Pw-компонента с моновалентным HBsAg-компонентом для получения D-T-Pw-HВsAg-тетравалентного компонента; (b) соединения Hib-конъюгата, по меньшей мере, с одним менингококковым конъюгатом для получения компонента смешанного конъюгата; и (c) смешивание тетравалентного D-T-Pw-HBsAg-компонента с компонентом смешанного конъюгата для получения комбинированной вакцины.
Трехвалентный D-T-Pw-компонент предпочтительно включает в себя адъювант фосфата алюминия и/или адъювант гидроксида алюминия. Наиболее предпочтительно компонент включает и адъювант фосфата алюминия и адъювант гидроксида алюминия.
Моновалентный HВsAg-компонент предпочтительно адсорбируют на адъюванте фосфате алюминия [17]. Анатоксины D и T предпочтительно адсорбируют на адъюванте гидроксиде алюминия.
Смешанный конъюгатный компонент предпочтительно включает в себя конъюгаты из Hib&MenA, Hib&MenC или Hib&MenA&MenC.
Другая ситуация с вакцинами типа INFANRIX HEXATM, предпочтительно, чтобы ни один из трех конъюгатов в конъюгатном компоненте не адсорбировали на соль алюминия [2], и более предпочтительно, чтобы конъюгатный компонент не содержал соль алюминия. Наиболее предпочтительные конъюгатные компоненты не содержат адъювантов. Однако они могут содержать сахара, такие как лактоза и/или сахароза.
Тетравалентный D-T-Pw-HBsAg-компонент предпочтительно представляет собой водную форму, и трехвалентный конъюгированный компонент представляет собой предпочтительно лиофилизированную форму для восстановления водным D-T-Pw-HBsAg-компонентом на стадии (с). Для получения тетравалентного компонента D-T-Pw-HBsAg оба компонента, D-T-Pw и HBsAg, представляют собой водную форму при смешивании.
Чтобы приготовить трехвалентный конъюгатный компонент, три конъюгата могут быть смешаны в любом порядке, например добавлением всех трех одновременно или смешиванием двух (например, MenA+MenC, MenA+Hib, MenC+Hib) и затем добавлением третьего.
(9) Адъюванты, содержащие алюминий
Вакцины согласно изобретению включают в себя не только антигены, но и, по меньшей мере, один адъювант - соль алюминия. Вакцины могут включать в себя оба адъюванта: гидроксид алюминия и фосфат алюминия.
Изобретение предоставляет набор, включающий в себя (а) первый компонент, содержащий D, T, wP, и HBsAg антигены и содержащий адъюванты гидроксида алюминия и фосфата амюминия; и (b) второй компонент, содержащий (i) капсулярный сахарид H. influenzae типа b, конъюгированный с белком-носителем, и (ii), по меньшей мере, один капсулярный сахарид N. meningitidis, конъюгированный с белком-носителем.
В первом компоненте HBsAg предпочтительно адсорбируют на адъювант фосфата алюминия. Анатоксины D и T предпочтительно адсорбируют адъювант гидроксида алюминия. Первый компонент предпочтительно получают смешиванием DTPw-компонента с HВsAg-компонентом. DTPw-компонент предпочтительно включает в себя как гидроксид алюминия, так и фосфат алюминия. HВsAg-компонент предпочтительно содержит фосфат алюминия.
Во втором компоненте предпочтительно ни один из конъюгатов не адсорбируют на соль алюминия, и более предпочтительно второй компонент не содержит соль алюминия. Наиболее предпочтительные вторые компоненты не содержат адъювантов. Они могут, однако, содержать сахара, такие как лактоза или предпочтительно сахароза.
Первый компонент предпочтительно представляет собой водную форму и второй компонент предпочтительно представляет собой лиофилизированную форму. Таким образом, первый компонент может быть использован для восстановления второго компонента для получения вакцины согласно изобретению.
(10) Носитель - сахаридный мостик в менингококковых конъюгатах, использующих спейсер
Hib-конъюгат, описанный выше, связывается с белком-носителем спейсером. Спейсеры также могут быть использованы в менингококковых конъюгатах, но предпочтительно прямое связывание (см. выше). В случае, если спейсеры используют в комбинации с цианилированием, общая схема представляет собой приготовление эфира циановой кислоты, как описано выше. Затем эфир активируют реакцией с одной функциональной группой бифункционального линкера (предпочтительно гомо-бифункциональный линкер), чтобы предоставить другие функциональные группы сохранившимися для связывания с носителем.
Таким образом, изобретение предоставляет комбинированную вакцину, включающую в себя (i) анатоксин дифтерии, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид Neisseria meningitidis серогруппы А, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы А из (vi) получают способом, включающим в себя стадии (а) цианилирования капсулярного сахарида серогруппы А для получения эфира циановой кислоты; (b) взаимодействия эфира циановой кислоты с бифункциональным линкером для получения активированного сахарида; и (c) соединения активированного сахарида с белком-носителем. Вакцина также может включать в себя (vii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение также предоставляет способ приготовления смеси конъюгатов, включающей в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид Neisseria meningitidis серогруппы А, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы А получают способом, включающим в себя стадии: (а) цианилирования капсулярного сахарида серогруппы А для получения эфира циановой кислоты; (b) взаимодействия эфира циановой кислоты с бифункциональным линкером для получения активированного сахарида; и (c) соединение активированного сахарида с белком-носителем.
Изобретение предоставляет комбинированную вакцину, включающую в себя (i) анатоксин дифтерии, (ii) анатоксин столбняка, (iii) клеточный антиген коклюша, (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, и (vi) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы С из (vii) получают способом, включающим в себя стадии (а) цианилирования капсулярного сахарида серогруппы С для получения эфира циановой кислоты; (b) взаимодействия эфира циановой кислоты с бифункциональным линкером для получения активированного сахарида; и (c) соединения активированного сахарида с белком-носителем. Вакцина также может включать в себя (vii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем.
Изобретение также предоставляет способ приготовления смеси конъюгатов, включающей в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что конъюгат серогруппы С получают способом, включающим в себя стадии: (а) цианилирования капсулярного сахарида серогруппы С для получения эфира циановой кислоты; (b) взаимодействия эфира циановой кислоты с бифункциональным линкером для получения активированного сахарида; и (c) соединение активированного сахарида с белком-носителем.
Изобретение также предоставляет вакцины и способы, в которых конъюгаты обеих серогрупп А и С готовят указанным способом и затем соединяют.
Может быть использован любой бифункциональный линкер, который может обеспечить одну функциональную группу для ковалентного присоединения цианилированного менингококкового сахарида и одну функциональную группу для присоединения носителя. Две функциональные группы могут быть одинаковыми (например, гомобифункциональный линкер) или они могут быть различными (например, гетеробифункциональный линкер) в зависимости от групп, к которым желательно присоединение.
(11) Способ добавления стабилизатора
Вакцины обычно содержат стабилизаторы для предотвращения вредного микробного роста. Специалист в данной области должен определить, где и когда вносить стабилизатор в комбинированную вакцину, полученную смешиванием различных компонентов. Согласно изобретению различные компоненты содержат различные стабилизаторы.
Таким образом, изобретение предоставляет способ приготовления комбинированной вакцины, включающей в себя (i) анатоксин дифтерии ('D'), (ii) анатоксин столбняка ('T'), (iii) клеточный антиген коклюша ('Pw'), (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (vi) по меньшей мере, один капсулярный сахарид Neisseria meningitidis, конъюгированный с белком-носителем, и (vii) ртутный стабилизатор, характеризующийся тем, что способ включает в себя стадии: (а) соединения трехвалентного компонента D-T-Pw с моновалентным HBsAg-компонентом для получения тетравалентного компонента D-T-Pw-HBsAg, где D-T-Pw-компонент также содержит стабилизатор; (b) соединения конъюгатов H. influenzae и N. meningitidis для получения смешанного конъюгатного компонента; и (c) смешивание тетравалентного компонента D-T-Pw-HBsAg с компонентом смешанного конъюгата для получения комбинированной вакцины.
Изобретение предоставляет способ приготовления набора согласно изобретению, включающий в себя стадии (а) соединения трехвалентного D-T-Pw-компонента с моновалентным компонентом HBsAg, где D-T-Pw-компонент также содержит ртутный стабилизатор, для получения первого компонента набора; и (b) соединения капсулярного сахарида Haemophilus influenzae типа b, конъюгированного с белком-носителем, по меньшей мере, с одним капсулярным сахаридом Neisseria meningitidis, конъюгированным с белком-носителем, для получения второго компонента набора.
В качестве альтернативной стадии (а) в данных способах первый компонент набора может быть получен смешиванием (i) трехвалентного компонента D-T-Pw (ii) HBsAg и (iii) отдельного стабилизатора, где стабилизатор из (iii) не представлен в (ii).
Ртутным стабилизатором может быть тиомерсал (также известный как тимеросал или мертиолят) или тимерфонат. Смешанный конъюгатный компонент (и второй компонент набора) может содержать или не содержать стабилизатор. Предпочтительно он не содержит стабилизатор. Моновалентный компонент HBsAg может содержать или не содержать стабилизатор. Если используют ртутный стабилизатор, то затем очищенный HBsAg может быть подвергнут диализу (например, с цистеином) перед тем, как быть использованным в комбинированной вакцине [18].
Смешанный конъюгатный компонент предпочтительно включает в себя Hib-конъюгат, MenA-конъюгат и MenС-конъюгат.
Таким образом, изобретение предоставляет способ приготовления комбинированной вакцины, включающей в себя (i) анатоксин дифтерии ('D'), (ii) анатоксин столбняка ('T'), (iii) клеточный антиген коклюша ('Pw'), (iv) поверхностный антиген вируса гепатита В ('HBsAg'), (v) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (vi) по меньшей мере, один капсулярный сахарид Neisseria meningitidis, конъюгированный с белком-носителем, и (vii) стабилизатор 2-феноксиэтанол, характеризующийся тем, что способ включает в себя стадии (а) соединения трехвалентного D-T-Pw-компонента с моновалентным HВsAg-компонентом для получения D-T-Pw-HBsAg-тетравалентного компонента, где D-T-Pw-компонент не содержит 2-феноксиэтанол; (b) соединения конъюгатов H. influenzae и N. meningitidis для получения смешанного конъюгатного компонента; и (c) смешивание D-T-Pw-HBsAg-компонента с компонентом смешанного конъюгата для получения комбинированной вакцины.
Изобретение предоставляет способ приготовления набора согласно изобретению, включающий в себя стадии (а) соединения трехвалентного D-T-Pw-компонента с моновалентным HВsAg-компонентом, где D-T-Pw-компонент не содержит стабилизатор 2-феноксиэтанол, для получения первого компонента набора; и (b) соединения капсулярного сахарида Haemophilus influenzae типа b, конъюгированного с белком-носителем, по меньшей мере, с одним капсулярным сахаридом Neisseria meningitidis, конъюгированным с белком-носителем, для получения второго компонента набора.
В качестве альтернативной стадии (а) в данных способах первый компонент набора может быть получен смешиванием (i) трехвалентного D-T-Pw-компонента (ii) HBsAg и (iii) отдельного стабилизатора 2-феноксиэтанола, где стабилизатор из (iii) не представлен в (i).
Смешанный конъюгатный компонент (и второй компонент набора) может содержать или не содержать стабилизатор 2-феноксиэтанол. Предпочтительно он не содержит стабилизатор. Моновалентный HBsAg-компонент может содержать или не содержать стабилизатор 2-феноксиэтанол.
(12) Удаление загрязнений из конъюгатов
Химия конъюгации не всегда обладает высокой точностью или стехиометрическим соотношением и может давать побочные продукты, которые нежелательны в конечном продукте - вакцине. Изобретение предоставляет способы анализа и/или удаления данных побочных продуктов при получении смешанного конъюгатного компонента. Данный компонент может быть использован для создания вакцин согласно изобретению или как компонент наборов согласно изобретению.
Изобретение предоставляет способ приготовления смеси конъюгатов, которая включает в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризуемой тем, что способ включает в себя стадии (а) конъюгирования капсулярного сахарида Hib с анатоксином столбняка, используя EDAC, и затем удаление EDU; (b) конъюгирования капсулярного сахарида MenA с белком-носителем, используя CDAP реагент, и затем удаление DMAP; (c) конъюгирования капсулярного сахарида MenC с белком-носителем, используя CDAP реагент, и затем удаление DMAP; и (d) смешивание Hib-конъюгата стадии (а), MenA-конъюгата стадии (b) и MenC конъюгата стадии (c) для получения конъюгатной смеси.
После стадии смешивания смесь конъюгатов может быть лиофилизирована, например, для получения компонента для использования в наборе согласно изобретению. Перед лиофилизацией рН трехвалентного компонента должен быть уменьшен, например, до диапазона 6,0±0,5 или примерно 6,1.
'EDAC' представляет собой 1-этил-3-(3-диметиламинопропил)карбодиимид, водорастворимый карбодиимид, который используют для сшивания биологических субстанций, которые содержат карбоксилатные кислоты и первичные амины (см. выше). Обычно используется в виде соли гидрохлорида.
'EDU' представляет собой N-этил-N'-(3-диметиламинопропил)мочевину, водорастворимый продукт реакции соединения EDAC:
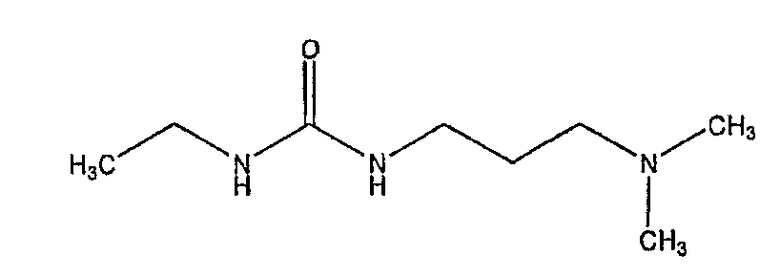
EDU и избыточный EDAC могут быть удалены после конъюгации отмыванием разбавленной кислотой или водой [19].
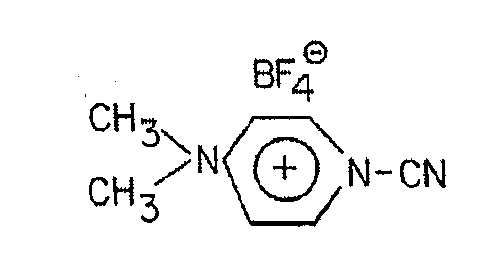
'CDAP' реагенты включают в себя 1-циано-4-(диметиламино)-пиридиниевую группу и используются как цианилирующие реагенты. Предпочтительно их применяют в виде соли тетрафторбората:
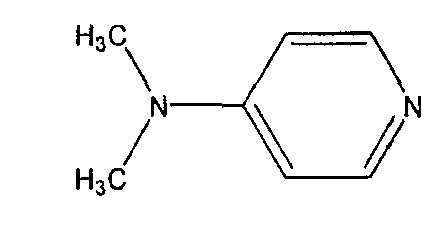
'DMAP' представляет собой 4-диметиламинопиридин, продукт реакции цианилирования CDAP:
DMAP может быть удален гель-фильтрацией, гель-фильтрационной хроматографией и т.д. Колонка гель-фильтрационной хроматографии может быть использована для выделения конъюгатов, непрореагировавшего носителя, непрореагировавшего сахарида, непрореагировавшего CDAP, непрореагировавшего глицина и DMAP в одном опыте для получения очищенного конъюгата.
Реакции конъюгации могут включать в себя использование линкеров и т.д., как описано ранее (например, использование адипин-гидразидного спейсера для получения Hib-T).
Изобретение предоставляет способ приготовления смеси конъюгатов, которая включает в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид Neisseria meningitidis серогруппы А, конъюгированный с белком-носителем, и (iii) капсулярный сахарид Neisseria meningitidis серогруппы С, конъюгированный с белком-носителем, характеризующийся тем, что способ включает в себя стадии: (а) конъюгирования капсулярного сахарида Hib с белком-носителем, используя EDAC; (b) конъюгирования капсулярного сахарида MenA с белком-носителем, используя реагент CDAP; (c) конъюгирования капсулярного сахарида MenC с белком-носителем, используя реагент CDAP; (d) смешивание Hib-конъюгата стадии (а), конъюгата MenA стадии (b) и MenC конъюгата стадии (c) для получения конъюгатной смеси; и (e) уданения EDU и/или DMAP из конъюгатной смеси.
Изобретение также предоставляет способ приготовления смеси конъюгатов, которая включает в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что способ включает в себя стадии (а) соединения капсулярного сахарида Hib с анатоксином столбняка, используя EDAC, и затем определение EDU; (b) соединения капсулярного сахарида MenA с белком-носителем, используя реагент CDAP и затем определение DMAP; (c) соединения капсулярного сахарида MenC с белком-носителем, используя реагент CDAP и затем определение DMAP.
Способ обычно включает в себя дополнительную стадию (d) смешивания Hib-конъюгата из стадии (а), MenA конъюгата из стадии (b) и MenС конъюгата из стадии (с) для получения конъюгатной смеси.
Изобретение также предоставляет способ приготовления смеси конъюгатов, которая включает в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что способ включает в себя стадии: (а) соединения капсулярного сахарида Hib с анатоксином столбняка, используя EDAC; (b) соединения капсулярного сахарида MenA с белком-носителем, используя реагент CDAP; (c) соединения капсулярного сахарида MenC с белком-носителем, используя реагент CDAP; (d) смешивания Hib-конъюгата из стадии (а), конъюгата MenA из стадии (b) и конъюгата MenС из стадии (с) для получения конъюгатной смеси; и (e) определения EDU и/или DMAP в конъюгатной смеси.
Изобретение предоставляет способ приготовления конъюгатной смеси, которая включает в себя (i) капсулярный сахарид Haemophilus influenzae типа b, конъюгированный с белком-носителем, (ii) капсулярный сахарид серогруппы А Neisseria meningitidis, конъюгированный с белком-носителем, и (iii) капсулярный сахарид серогруппы С Neisseria meningitidis, конъюгированный с белком-носителем, характеризующийся тем, что способ включает в себя стадии (а) конъюгирования капсулярного сахарида Hib с белком-носителем, используя EDAC; (b) конъюгирования капсулярного сахарида MenA с белком-носителем, используя реагент EDAC; (c) конъюгирования капсулярного сахарида MenC с белком-носителем, используя реагент EDAC; (d) смешивание Hib-конъюгата стадии (а), MenA-конъюгата стадии (b) и MenC-конъюгата стадии (c) для получения конъюгатной смеси и (e) удаление EDU из конъюгатной смеси.
Протокол EDAC/EDU особенно подходит, когда белком-носителем является анатоксин столбняка. Протокол CDAP/DMAP особенно подходит, когда белком-носителем является белок D.
(13) Сочетания отличительных особенностей
Секции (1)-(12), приведенные ранее, включают в себя отличительные особенности изобретения:
Несмотря на то, что указанные двенадцать отличительных особенностей являются независимыми друг от друга, они могут также быть соединены друг с другом. Таким образом, изобретение предоставляет все возможные 2-сторонние, 3-сторонние, 4-сторонние, 5-сторонние, 6-сторонние, 7-сторонние, 8-сторонние, 9- сторонние, 10-сторонние и 11-сторонние комбинации особенностей (1)-(12) и комбинацию всех 12 особенностей.
Особенно предпочтительные комбинации включают в себя:
a. (1) & (2)
b. (1) & (2) & (6)
c. (1) & (2) & (12)
d. (1) & (2) & (6) & (12)
e. (3) & (4)
f. (3) & (5)
g. (3) & (4) & (5)
h. (3) & (4) & (6)
i. (3) & (5) & (6)
j. (3) & (4) & (5) & (6)
k. (8) & (9)
l. (8) & (11)
m. Любой от а. до l. в комбинации с (12)
n. Любой от а. до m. в комбинации с (7)
o. Любой от а. до n. в комбинации с (8)
p. Любой от а. до o. в комбинации с (9)
q. Любой от а. до p. в комбинации с (11)
Комбинации e и f (и затем g, h, i&j) предпочтительны, поскольку там, где используют CDAP могут быть сохранены чувствительные ацетил-группы на менингококковых сахаридах. Комбинация k является предпочтительной, поскольку правильный порядок смешивания адъювантов и антигенов может быть важным для адсорбции и, следовательно, для эффективности и для стабильности при длительном хранении. Комбинация l является предпочтительной, поскольку она минимизирует потребность в стабилизаторе в многочисленных стадиях при производстве.
(14) Анатоксин дифтерии
Возбудителем дифтерии является Corynebacterium diphtheriae, грамположительная, неспорообразующая аэробная бактерия. Данный организм экспрессирует профаг-кодируемый АДФ-рибозилирующий экзотоксин ("дифтерийный токсин"), который может быть обработан (например, формалином или формальдегидом) для получения анатоксина, который уже не токсичен, но остается антигенным и способен стимулировать продукцию специфических антитоксических антител после прививки. Дифтерийные анатоксины подробно представлены в главе 13 ссылки 1. Предпочтительными являются дифтерийные анатоксины, приготовленные обработкой формальдегидом. Дифтерийный анатоксин может быть получен выращиванием C. diphtheriae в среде роста (например, среда Фентона или среда Лингуда-Фентона), которая может быть дополнена экстрактом сыворотки крупного рогатого скота с последующей обработкой формальдегидом, ультрафильтрацией и преципитацией. Материал анатоксина затем может быть обработан способом, включающим в себя фильтрацию и/или диализ.
Анатоксин дифтерии предпочтительно адсорбируют на адъювант гидроксид алюминия.
Предпочтительно компонент дифтерийного анатоксина, по существу, не содержит ртутных стабилизаторов.
Количество дифтерийного анатоксина может быть выражено в интернациональных единицах (IU). Например, NIBSC поставляет "Дифтерийный анатоксин адсорбированный, третий интернациональный стандарт 1999" ('Diphtheria Toxoid Adsorbed Third International Standard 1999') [20,21], который содержит 160 IU на ампулу. В качестве альтернативной IU системе система 'Lf' ("флокуляционные единицы" ("flocculating units") или "доза флокуляции по гидроокиси кальция" (the "limes flocculating dose")) выражается как количество анатоксина, которое при смешивании с одной интернациональной единицей (IU) антитоксина дает оптимальную флокуляционную смесь [22]. Например, NIBSC поставляет "Анатоксин дифтерии, обыкновенный" [23], который содержит 300 LF на ампулу, и также поставляет "Первый интернациональный референсный реагент для анатоксина дифтерии для флокуляционного теста" [24], который содержит 900 LF на ампулу.
Если материалы от крупного рогатого скота применяются в культуре C. diphtheriae, они должны быть получены из источников, свободных от губчатой энцефалопатии крупного рогатого скота (BSE) или от других заразных губчатых энцефалопатий (TSE).
Соотношение дифтерийного анатоксина к анатоксину столбняка в вакцинах согласно изобретению обычно составляет от 2:1 до 3:1 (измеренное в LF единицах), предпочтительно 2,4:1 и 2,6:1 и наиболее предпочтительно 2,5:1.
Количество дифтерийного анатоксина в вакцинах согласно изобретению обычно составляет, по меньшей мере, 30 IU/доза.
(15) Анатоксин столбняка
Возбудителем столбняка является Clostridium tetani, грамположительная, спорообразующая бацилла. Данный организм экспрессирует эндопептидазу ("токсин столбняка"), который может быть обработан для получения анатоксина, который уже не токсичен, но остается антигенным и способен стимулировать продукцию специфических антитоксических антител после прививки. Анатоксины столбняка подробно представлены в главе 27 ссылки 1. Предпочтительными являются анатоксины столбняка, приготовленные обработкой формальдегидом. Анатоксин столбняка может быть получен выращиванием C. tetani в среде роста (например, среда Латхам, полученная из бычьего казеина) с последующей обработкой формальдегидом, ультрафильтрацией и преципитацией. Материал анатоксина затем может быть обработан способом, включающим в себя стерильную фильтрацию и/или диализ.
Анатоксин столбняка может быть адсорбирован на адъювант гидроксид алюминия, но это не является необходимым (например, может быть использована адсорбция 0-10% всего анатоксина столбняка).
Предпочтительно компонент анатоксина столбняка, по существу, не содержит ртутных стабилизаторов.
Количество анатоксина столбняка может быть выражено в интернациональных единицах (IU). Например, NIBSC поставляет "Анатоксин столбняка адсорбированный, третий интернациональный стандарт 2000" [25,26], который содержит 469 IU на ампулу. В качестве альтернативной системе IU, система 'LF' ("флокуляционные единицы" ("flocculating units") или "доза флокуляции по гидроокиси кальция" (the "limes flocculating dose")) выражается как количество анатоксина, которое при смешивании с одной интернациональной единицей (IU) антитоксина дает оптимальную флокуляционную смесь [22]. Например, NIBSC поставляет "Первый интернациональный референсный реагент для анатоксина столбняка для флокуляционного теста" [27], который содержит 1000 LF на ампулу.
Если материалы от крупного рогатого скота применяются в культуре C. tetani, то они должны быть получены из источников, свободных от губчатой энцефалопатии крупного рогатого скота (BSE) или от других заразных губчатых энцефалопатий (TSE).
Соотношение анатоксина столбняка к дифтерийному анатоксину в вакцинах согласно изобретению обычно составляет от 1:2 до 1:3 (измеренное в Lf единицах), предпочтительно 1:2,4 и 1:2,6 и наиболее предпочтительно составляет 1:2,5.
Количество анатоксина столбняка в вакцинах согласно изобретению обычно составляет, по меньшей мере, 60 IU/доза.
(16) Клеточный антиген коклюша
Антигены коклюша в вакцинах являются либо клеточными, либо бесклеточными. В изобретении используют клеточные антигены коклюша в форме инактивированных клеток B. pertussis. Получение клеточных антигенов коклюша хорошо документировано [например, см. главу 21 ссылки 1], например, они могут быть получены инактивацией нагреванием фазы I культуры B. pertussis.
Клеточный антиген коклюша может быть адсорбирован или смешан с адъювантом фосфатом алюминия.
Количество wP антигенов может быть выражено в интернациональных единицах (IU). Например, NIBSC поставляет "Третий интернациональный стандарт вакцины коклюша" [28], который содержит 46 IU на ампулу. Каждая ампула содержит лиофилизированный остаток 2,0 мл аликвот водного раствора, который содержал 10 литров бактериальной суспензии (эквивалент 180 единиц мутности в единицах стандарта мутности США), разведенных восемью литрами М/15 буфера Соренсена, рН 7,0. В качестве альтернативы IU системы также используют 'OU' единицу ("opacity units") (например, 4 OU составляют примерно 1 IU).
Количество wP антигена в вакцинах согласно изобретению обычно составляет по меньшей мере 4 IU/доза.
(17) Поверхностный антиген гепатита В
Вирус гепатита В (HBV) является одним из известных агентов, который вызывает вирусный гепатит. HBV вирион состоит из внутреннего ядра, окруженного внешней белковой оболочной, или капсидом. Ядро содержит вирусный ДНК геном. Главный компонент капсида представляет собой белок, известный как поверхностный антиген HBV или, более часто, 'HBsAg' из 226 аминокислот, с молекулярным весом ~24 кДа. Все существующие вакцины от гепатита В содержат HBsAg, и когда данный антиген вводится пациенту, то он стимулирует продукцию анти-HBsAg антител, которые предохраняют против HBV инфекции.
Для производства вакцины HBsAg может быть получен двумя путями. Первый способ включает в себя очистку антигена в дисперсной форме из плазмы носителей хронического гепатита В, поскольку большие количества HBsAg синтезируются в печени и высвобождаются в кровяное русло при HBV инфекции. Второй путь включает в себя экспрессию белка методами рекомбинантной ДНК. HBsAg для использования со способом согласно изобретению может быть получен любым путем, но предпочитают использовать рекомбинантный HBsAg. В частности, предпочтителен HBsAg, который получают экспрессией в дрожжах, таких как Saccharomyces (таких как S.cerevisiae) или Hanensula (таких как H.polymorpha).
Экспрессированный дрожжами HBsAg, как правило, будет не гликозилированным.
HBsAg обычно имеет форму сферических частиц (средний диаметр 20 нм), содержащих липидный матрикс, состоящий из фосфолипидов. Экспрессированные дрожжами частицы HBsAg могут содержать фосфатидилинозитол, который не обнаружен в природных HBV вирионах. Частицы также могут содержать нетоксичное количество LPS для стимуляции иммунной системы [29].
HBsAg предпочтительно из подтипа HBV adw2.
Кроме того, HBsAg может быть адсорбирован на адъювант гидроксид алюминия в конечной вакцине (как в хорошо известном продукте ENGERIX-BTM) или может оставаться не адсорбированным, он может быть адсорбирован на адъювант фосфата алюминия перед использованием в способе согласно изобретению [17].
Количество HBsAg обычно выражают в микрограммах.
Стандартное количество HBsAg на дозу вакцины составляет 10 мкг.
(18) Конъюгат Hib
Антиген H.influenzae, тип В, использованный в вакцинах согласно изобретению, включает в себя капсулярный сахаридный антиген Hib. Сахаридные антигены из H.influenzae тип В хорошо известны [например, глава 14 ссылки 1]. Сахарид Hib конъюгируют с белком-носителем для усиления его иммуногенности, особенно у детей. Получение капсулярного сахарида Hib хорошо документировано [например, ссылки 30-39].
Как показано в таблице 14-7 ссылки 1, различные связанные белки-носители могут быть использованы в конъюгатах Hib. В продукте PRP-D используется дифтерийный анатоксиновый белок-носитель, и данный носитель может быть также использован согласно изобретению. В продукте HbOC использован белок-носитель CRM197, и данный носитель может быть также использован согласно изобретению. В продукте PRT-OMP в качестве носителя используется комплекс белков наружной мембраны серогруппы В менингоккока, и этот носитель также может быть использован согласно изобретению. В продукте PRP-T использован столбнячный анатоксиновый белок-носитель, и данный носитель может быть также использован согласно изобретению. Белок D H. influenzae (см. далее) также может быть использован в качестве носителя для конъюгата Hib.
В предпочтительных конъюгатах Hib, применяемых согласно настоящему изобретению, используют анатоксин столбняка в качестве белка-носителя для получения продукта, обычно называемого 'PRP-T'. Он представляет собой конъюгат, представленный в продукте HIBERIXTM.
Белок-носитель в конъюгате Hib предпочтительно отличается от белка-носителя в менингококковом конъюгате, но тот же носитель может быть использован в нескольких воплощениях.
Сахаридная часть конъюгата может включать в себя полный полирибозилрибитфосфат (PRP), который получен из бактерий Hib, и/или она может содержать фрагменты полного PRP.
Могут быть использованы конъюгаты с соотношением сахарид/белок (мас/мас.) от 1:5 (т.е. избыток белка) до 5:1 (т.е. избыток сахарида), например с соотношением от 1:2 до 5:1 и соотношением от 1:1,25 до 1:2,5. Однако в предпочтительных вакцинах весовое соотношение сахарида к белку-носителю составляет от 1:2,5 до 1:3,5.
В вакцинах, где анатоксин столбняка представлен и как антиген, и как белок-носитель, весовое соотношение сахарида к белку-носителю может составлять от 1:0,3 до 1:2 [5].
Без учета анатоксина столбняка, включенного в качестве антигена, неконъюгированный носитель составляет предпочтительно не более 5% общего количества белка-носителя в композиции в целом и более предпочтительно составляет менее 2% по весу.
Введение Hib-антигена предпочтительно дает в результате концентрацию антител анти-PRP ≥0,15 мкг/мл и более предпочтительно ≥1 мкг/мл. Это - стандартные допустимые пороговые значения реакций.
Количества Hib-конъюгатов обычно представлены в единицах массы сахарида (т. е. доза конъюгата (носитель+сахарид) в целом выше, чем указанная доза) для того, чтобы избежать варьирования из-за выбора носителя. Стандартное количество Hib-сахарида на дозу вакцины составляет 10 мкг.
Hib-конъюгаты могут быть лиофилизированы перед их использованием согласно изобретению. Другие компоненты также могут быть добавлены перед лиофилизацией, например, в качестве стабилизаторов. Предпочтительными стабилизаторами являются лактоза, сахароза и маннит, а также их смеси, например смеси лактоза/сахароза, сахароза/маннит и т.д. Таким образом, конечная вакцина может содержать лактозу и/или сахарозу. Использование смеси сахароза/маннит может ускорить процесс высушивания.
(19) Менингококковые конъюгаты
Менингококковые антигены, используемые в вакцинах согласно изобретению, включают в себя капсулярные сахаридные антигены, конъюгированные с белком-носителем. Сахаридные антигены N. meningitidis хорошо известны: бивалентная вакцина MENCEVAX ACTM и тетравалентная вакцина MENCEVAX ACWYTM известны много лет [40,41]. Кроме того, конъюгаты вакцин против серогруппы С одобрены для применения на человеке и включают в себя MENJUGATETM [42], MENINGITECTM и NEISVAC-CTM. Известны смеси конъюгатов из серогрупп А+С [43,44] и смеси конъюгатов из серогрупп А+С+W135+Y [45-48].
Менингококковые сахарид(ы), применяемые в продуктах и способах согласно изобретению, могут быть из одной или более серогрупп А, С, W135, Y, например А+С, A+W135, A+Y, C+W135, C+Y, W135+Y, A+C+W135, A+C+Y, C+W135+Y, A+C+W135+Y. Предпочтительно использовать по меньшей мере сахарид серогруппы С, и предпочтительно использовать сахариды обеих серогрупп А и С.
В изобретении могут быть использованы любые подходящие менингококковые конъюгаты, со связью любого химического состава и любыми подходящими спейсерами (за исключением особых деталей).
Продукты MENJUGATETM и MENINGITECTM используют белок-носитель CRM197, и данный носитель также может быть использован согласно изобретению. В продукте NEISVAC-CTM использован столбнячный анатоксиновый белок-носитель, и данный носитель также может быть использован согласно изобретению. Особенно предпочтительным белком-носителем для менингококковых конъюгатов является белок D из Haemophilus influenzae, который не представлен ни в одной из имеющихся одобренных к применению конъюгированных вакцинах. Данный белок подробно описан в ссылках 49&50, и его применение в качестве белка-носителя в конъюгатах описано в ссылке 51. Термин "белок D" подразумевает фрагменты нативного полноразмерного белка, как раскрыто в ссылке 51, а также слитые белки, содержащие либо полноразмерный белок D, либо данные фрагменты (например, слияние фрагмента белка вируса гриппа NS1 и фрагмента белка D). Фрагменты сохраняют способность превращать Т-независимые сахаридные антигены в Т-зависимый антиген, который к тому же конъюгирован. Типичные фрагменты будут включать в себя по меньшей мере 1/3 N-концевой части белка D. Белок удобно экспрессировать в E.coli [50], и данный рекомбинантный материал предпочтителен для использования в изобретении [51].
В случае если используют носитель-белок D, конъюгаты указывают как 'MenA-D' и 'MenC-D'.
Предпочтительно, чтобы отдельные менингококковые конъюгаты использовали отдельные белки-носители (сравните ссылка 52), но предпочтительно, чтобы данные отдельные носители были одинаковыми, например все менингококковые конъюгаты в композиции используют столбнячный анатоксиновый носитель, или все менингококковые конъюгаты в композиции используют белок D как носитель, и т.д.
Белок-носитель (носители) в менингококковом конъюгате (конъюгатах) предпочтительно отличается от белка-носителя в Hib-конъюгате, но тот же носитель может быть использован в нескольких воплощениях.
Сахаридная часть конъюгата может содержать полноразмерные сахариды, полученные из менингококков, и/или может содержать фрагменты полноразмерных сахаридов.
Могут быть использованы менингококковые конъюгаты с соотношением сахарид:белок (мас./мас.) от 1:10 (например, избыточный белок) до 10:1 (например, избыточный сахарид), например соотношением от 1:5 до 5:1, от 1:2,5 до 2,5:1, или от 1:1,25 до 1,25:1.
Введение менингококковых конъюгатов предпочтительно приводит к возрастанию в сывороточном бактериальном анализе (SBA) титра релевантной серогруппы по меньшей мере в 4 раза, а предпочтительно, по меньшей мере, в 8 раз. Титры SBA могут быть измерены с использованием комплемента крольчат или комплемента человека [53].
Концентрации менингококковых конъюгатов обычно выражают в единицах массы сахарида (т.е. доза конъюгата (носитель+сахарид) в целом выше, чем указанная доза), с тем, чтобы избежать варьирования из-за выбора носителя. Стандартное количество каждого менингококкового сахарида на дозу вакцины составляет около 5 мкг или около 10 мкг.
Менингококковые конъюгаты могут быть лиофилизированы перед их использованием согласно изобретению. Другие компоненты также могут быть добавлены перед лиофилизацией, например, в качестве стабилизаторов. Предпочтительными стабилизаторами для включения являются лактоза и/или сахароза. Таким образом, конечная вакцина может содержать лактозу и/или сахарозу.
(20) Смеси конъюгатов
Изобретение предоставляет смеси конъюгатов и способы их получения. Обычно они включают в себя смесь (i) Hib-конъюгат, (ii) MenA-конъюгат и (iii) MenC-конъюгат. Смеси конъюгатов сами по себе могут быть использованы как вакцины, а также как компоненты для смешивания с другими антигенами для получения комбинированных вакцин.
Смесь конъюгатов сожет содержать более чем три конъюгата, но предпочтительна трехвалентная конъюгатная смесь. Могут быть получены пентавалентные смеси конъюгатов, дополнительно содержащие конъюгированные капсулярные сахариды из менингококковых серогрупп W135 и Y.
Смеси конъюгатов предпочтительно имеют лиофилизированную форму.
Смеси конъюгатов предпочтительно не включают в себя следующие антигены: анатоксин дифтерии; антигены B.pertussis; антигены вируса полиомиелита; HBsAg.
Предпочтительно конъюгаты не адсорбируются на соли алюминия [2], и, более предпочтительно, они не содержат соли алюминия. Наиболее предпочтительные смешанные конъюгатные компоненты не содержат адъювантов. Однако они могут содержать сахара, такие как лактоза или предпочтительно сахароза.
(21) Адъюванты
В дополнение к антигенным компонентам вакцины согласно изобретению обычно содержат, по меньшей мере, один адъювант соли алюминия. Как уже упоминалось, вакцины могут включать в себя адъюванты гидроксида алюминия и фосфата алюминия. В случае, если в состав включают оба адъюванта, весовое соотношение двух адъювантов составляет примерно 1:1, например, соотношение гидроксид алюминия:фосфат алюминия составляет примерно 1,58:1,6.
Несмотря на то, что адъюванты алюминия обычно обозначают как адъюванты "гидроксида алюминия" или "фосфата алюминия", они представляют собой названия для удобства, и ни один из двух не является точным описанием фактического химического соединения, которое он представляет [см., например, главу 9 ссылки 54]. В изобретении может быть использован любой "гидроксидный" или "фосфатный" адъюванты, которые в целом используются в качестве адъювантов.
Адъюванты, известные как "гидроксид алюминия", представляют собой соли оксигидроксида алюминия, которые обычно, по меньшей мере, частично кристаллизованы. Оксигидроксид алюминия, который можно представить формулой AlO(OH), может быть определен в других соединениях алюминия, таких как гидроксид алюминия Al(OH)3, с помощью инфракрасной (ИК) спектроскопии, в частности, по полосе адсорбции при 1070 см-1 и по сильному "плечу" при 3090-3100 см-1 [глава 9 ссылки 54].
Адъюванты, известные как "фосфат алюминия", представляют собой гидроксифосфаты алюминия, часто содержащие небольшое количество сульфата (т.е. сульфат гидроксифосфата алюминия). Они могут быть получены путем преципитации, и условия реакции и концентрации при преципитации влияют на степень замещения фосфата на гидроксил в соли. Гидроксифосфаты обычно имеют молярное отношение PO4/Al между 0,3 и 1,2. Гидроксифосфаты могут быть выделены из AlPO4 по наличию гидроксильных групп. Например, полоса ИК-спектра при 3164 см-1 (например, при нагревании до 200°C) указывает на присутствие структурных гидроксилов [глава 9 ссылки 54].
Адъюванты могут быть в любой удобной форме (например, в форме геля, кристаллический, аморфный и т.д.).
Молярное отношение PO4/A13+ в адъюванте фосфате алюминия обычно составляет от 0,3 до 1,2, предпочтительно от 0,8 до 1,2, и более предпочтительно, 0,95±0,1. Типичный адъювант представляет собой аморфный гидроксифосфат алюминия с молярным отношением PO4/Al между 0,84 и 0,92, учтенный в 0,6 мг A13+/мл. Фосфат алюминия обычно является аморфным, особенно в солях гидроксифосфата. Фосфат алюминия обычно представлен в виде частиц. Обычный диаметр частиц находится в диапазоне 0,5-20 мкм (например, 5-10 мкм) после любой антигенной адсорбции.
PZC фосфата алюминия обратно пропорционален степени замещения фосфата гидроксилом, и указанная степень замещения может изменяться в зависимости от условий реакции и концентрации реагентов, использованных для приготовления соли для преципитации. PZC может быть изменен путем изменения концентрации свободных фосфатных ионов в растворе (больше фосфата=более кислый PZC) или добавления буфера, такого как гистидиновый буфер (делает PZC более основным). Фосфаты алюминия, используемые согласно изобретению, обычно имеют PZC между 5,0 и 7,0, более предпочтительно между 5,5 и 6,0, например 5,7.
Фосфат алюминия предпочтительно используют в виде водного раствора, к которому добавляют антигены (замечание: обычно называют водный фосфат алюминия "раствором", на строгий физико-химический взгляд, соль нерастворима и образует суспензию). Предпочтительно развести фосфат алюминия в требуемой концентрации и убедиться в гомогенности раствора перед добавлением антигенных компонентов.
Концентрация Al3+ перед добавлением антигенов обычно составляет от 0 до 10 мг/мл. Предпочтительная концентрация составляет от 2 до 6 мг/мл.
Раствор фосфата алюминия, используемый для приготовления вакцины согласно изобретению, может содержать буфер (например, фосфатный или гистидиновый буфер), но это не является необходимым. Раствор фосфата алюминия предпочтительно стерилен и не содержит пирогенов. Раствор фосфата алюминия может содержать свободные водные фосфатные ионы, например, представленные в концентрации от 1,0 до 20 мМ, предпочтительно от 5 до 15 мМ, наиболее предпочтительно 10 мМ. Раствор фосфата алюминия может также содержать хлорид натрия. Концентрация хлорида натрия предпочтительно находится в диапазоне от 0,1 до 100 мг/мл (например, 0,5-50 мг/мл, 1-20 мг/мл, 2-10 мг/мл), и более предпочтительна концентрация 3±1 мг/мл. Присутствие NaCl облегчает точное измерение рН перед адсорбцией антигенов.
В случае, если антиген описывают как адсорбированный на адъюванте, предпочтительно, чтобы было адсорбировано, по меньшей мере, 50% (по весу) данного антигена, например 50%, 60%, 70%, 80%, 90%, 95%, 98% и более. В некоторых воплощениях анатоксин дифтерии и анатоксин столбняка, оба являются полностью адсорбированными, т.е. в супернатанте ничего не определяется. Полная адсорбция HBsAg также является предпочтительной.
(22) Другие компоненты вакцины
В дополнение к антигенам и адъювантам, комбинированные вакцины могут включать в себя другие компоненты. Данные компоненты могут быть из различных источников. Например, они могут быть представлены в одном из антигенных компонентов, которые смешивают в способе согласно изобретению или которые могут быть добавлены в способе отдельно от антигенных компонентов.
Для контроля тоничности продукта конечной вакцины предпочтительно включать в состав физиологическую соль, такую как соль натрия. Предпочтителен хлорид натрия (NaCl), который может быть представлен в продукте конечной вакцины в концентрации от 1 до 20 мг/мл.
В результате адсорбированной природы антигенов конечный продукт вакцины может быть суспензией мутного вида.
Такой внешний вид не означает, что микробная контаминация является легко видимой и вакцина предпочтительно содержит антимикробный агент. Это является особенно важным, когда вакцина упакована в контейнеры, содержащие несколько доз. Предпочтительными противомикробными препаратами для включения в состав являются 2-феноксиэтанол и тимеросал. Предпочтительно не использовать ртутные стабилизаторы (например, тимеросал) в способе согласно изобретению. При этом присутствие следовых количеств может быть неблагоприятным, если антиген, применяемый в способе (например, HBsAg), подвергался перед этим обработке таким стабилизатором. Несмотря на это, для сохранности предпочтительно, чтобы конечный продукт вакцины содержал менее чем 25 нг/мл ртути. Более предпочтительно, чтобы конечный продукт вакцины не содержал определяемый тимеросал. Это может быть, в общем, достигнуто путем удаления ртутного стабилизатора из препарата антигена перед его добавлением в способе согласно изобретению или путем избегания использования тимеросала при получении индивидуальных антигенных компонентов.
Кроме таких веществ, как тимеросал, другие остаточные компоненты из индивидуальных антигенов также могут быть представлены в следовых количествах в конечной вакцине, полученной способом согласно изобретению. Например, если используют формальдегид для получения анатоксинов дифтерии, столбняка и коклюша, финальный продукт вакцины может содержать следовые количества формальдегида (например, менее 10 мкг/мл, предпочтительно <5 мкг/мл). Свободные аминокислоты (например, аланин, аргинин, аспартат, цистеин и/или цистин, глутамат, глутамин, глицин, гистидин, пролин и/или гидроксипролин, изолейцин, лейцин, лизин, метионин, фенилаланин, серин, треонин, триптофан, тирозин и валин), витамины (например, холин, аскорбиновая кислота), двузамещенный натрий фосфат, однозамещенный калий фосфат, кальций, глюкоза, аденин сульфат, фенол красный, натрий ацетат, калий хлорид и др., могут присутствовать в конечной вакцине в концентрации ≤100 мкг/мл каждый (например, ≤50 мкг/мл, ≤10мкг/мл). Другой возможный компонент конечной вакцины, который создается при обработке антигенов, возникает из-за неполной очистки антигенов. По этой причине могут появляться маленькие количества белков и геномной ДНК B. pertussis, C.diphtheriae, C.tetani и S.cerevisiae. Для уменьшения количеств данных остаточных компонентов препараты антигенов предпочтительно обрабатывают, чтобы удалить их, прежде чем использовать антигены в способе согласно изобретению.
В случае, если соли алюминия присутствуют в конечной вакцине, общее количество алюминия, выраженное в единицах Al3+, составляет предпочтительно ≤2 мг/мл (например, между 1,2-1,5 мг/мл, или около 1,4 мг/мл; или между 0,4 и 0,8 мг/мл, или около 0,6 мг/мл).
В способе согласно изобретению разбавление компонентов для получения требуемой конечной концентрации обычно производят водой для инъекций (WFI).
Для предотвращения взаимодействия между антигенами, в частности конъюгированными антигенами, можно включить в состав полианионный полимер, такой как поли-L-глутаминовая кислота [55].
(23) Способ упаковки комбинированной вакцины
В обычном применении способ согласно изобретению используют для предоставления большого количества комбинированной вакцины, которая удобна для упаковывания и затем для размещения и введения. Концентрации, упомянутые ранее, являются типичными концентрациями в конечной упакованной вакцине, и, следовательно, концентрации в нерассортированной партии вакцины могут быть выше (например, может быть уменьшение конечных концентраций при разбавлении).
Таким образом, способ согласно изобретению может включать в себя дополнительную стадию упаковки вакцины в контейнеры для употребления. Соответствующие контейнеры охватывают пузырьки и одноразовые шприцы (предпочтительно стерильные).
В случае, если вакцину упаковывают в пузырьки, они предпочтительно должны быть стеклянными или сделанными из пластика. Пузырек предпочтительно стерилизуют перед добавлением в него вакцины. Чтобы избежать проблем с пациентами, чувствительными к латексу, пузырьки закрывают пробками без латекса. Пузырек может содержать разовую дозу вакцины, или он может содержать более одной дозы ("многодозовый" пузырек), например 10 доз. При использовании многодозового пузырька каждую дозу следует извлекать стерильной иглой и шприцом в строго асептических условиях, избегая контаминации содержимого пузырька. Предпочтительными являются пузырьки из бесцветного стекла.
В случае, если вакцина упакована в шприц, шприц обычно не имеет присоединенной иглы, хотя игла может быть предоставлена отдельно со шприцом для присоединения и использования. Предпочтительны безопасные иглы. Обычными являются иглы: 1-дюймовая 23 размера, 1-дюймовая 25 размера, 5/8-дюймовая 25 размера. Могут быть предоставлены шприцы со снимаемой этикеткой, на которой напечатаны лот номера и срок годности содержимого для облегчения ведения регистрации. Поршень шприца предпочтительно имеет ограничитель, чтобы случайно не вынуть поршень при аспирации. Шприцы могут иметь латексную резиновую крышку или поршень. Одноразовые шприцы содержат разовую дозу вакцины. Шприц обычно имеет крышку на наконечник, чтобы запечатать наконечник до присоединения иглы, и крышка наконечника предпочтительно сделана из бутиловой резины. Если шприц и игла упакованы отдельно, то затем игла предпочтительно соответствует бутиловому резиновому колпачку. Предпочтительна серая бутиловая резина. Предпочтительными являются шприцы с торговым названием "Tip-Lok"TM.
Если используют стеклянный контейнер (например, шприц или пузырек), то предпочитают использовать контейнер, изготовленный из боросиликатного стекла, а не из смеси гидроксида натрия и оксида кальция.
Если хранимые отдельно конъюгированные антигены лиофилизированы в отдельных контейнерах, то упакованная вакцина будет содержать, по меньшей мере, два контейнера. Перед введением пациенту лиофилизированный материал восстанавливают и разводят жидкостью из другого контейнера. Следовательно, обычно контейнер конъюгата представляет собой пузырек, и другой контейнер содержит жидкость внутри пузырька или предварительно наполненный шприц. Жидкое содержимое второго контейнера переводят в пузырек, содержащий лиофилизированный конъюгированный антигенный порошок, тем самым восстанавливая конъюгированные антигены для введения пациенту.
Контейнер для лиофилизированных конъюгатов предпочтительно представляет собой пузырек с крышкой (например, Луер лок (Luer lock)), приспособленный таким образом, чтобы предварительно наполненный шприц можно было вставить в крышку, содержимое шприца можно выпустить в пузырек для восстановления лиофилизированного материала, и содержимое пузырька можно было поместить назад в шприц. После удаления шприца из пузырька может быть присоединена игла, и вакцина может быть введена пациенту. Крышка предпочтительно закрывается снаружи прокладкой или чехлом, так что прокладка или чехол удаляются для доступа к крышке.
Комбинированная вакцина согласно изобретению вводится пациентам в дозе 0,5 мл. Следовательно, способ согласно изобретению может включать в себя стадию извлечения и упаковки образца 0,5 мл объема вакцины в контейнер. В ситуациях множественных доз количества множественных доз извлекают и упаковывают в один флакон. Если вакцина представлена как набор с лиофилизированным компонентом, то конечная доза после восстановления составляет предпочтительно 0,5 мл. Рекомендации о 0,5 мл дозах следует понимать как среднее 0,5 мл±0,05 мл.
Контейнер, в который упаковывают вакцину, затем помещают в коробку для распространения, например в картонный ящик, и на ящик прикрепляют этикетку с информацией о вакцине, например ее торговое название, список антигенов в вакцине (например, 'дифтерия, столбняк, инактивированные цельные клетки коклюша и гепатит В рекомбинантная адсорбированная вакцина', и т.д.), представленный контейнер (например, 'одноразовые, предварительно наполненные Тип-лок шприцы' или '10 × 0,5 мл однодозовых пузырьков'), их дозы (например, 'каждый содержит одну 0,5 мл дозу'), предупреждения (например, 'только для педиатрического применения'), срок годности и т.д. Каждый ящик может содержать более чем одну упакованную вакцину, например пять или десять упакованных вакцин (особенно для пузырьков). Если вакцина содержится в шприце, то упаковка может иметь картинку со шприцом. Вакцина может быть упакована вместе (например, в одном ящике) с брошюрой, содержащей подробности о вакцине, например инструкции по введению, подробности об антигенах вакцины и т.д. Инструкции могут также содержать предупреждения, например, иметь легкодоступный раствор адреналина на случай анафилактической реакции на введение вакцины и т.д.
Упакованные материалы вакцины предпочтительно являются стерильными.
Упакованные материалы вакцины предпочтительно являются непирогенными, например содержат <1 EU (эндотоксиновая единица, стандартное измерение) на дозу и предпочтительно <0,1 EU на дозу.
Упакованные материалы вакцины предпочтительно не содержат глютен.
Любые водные упакованные материалы вакцины имеют рН от 6 до 8, например от 6,5 до 7,5. Таким образом, способ согласно изобретению может включать в себя стадию коррекции рН объема вакцины перед упаковкой.
Любой водный материал в упакованной вакцине представляет собой предпочтительно мутную белую суспензию.
Упакованную вакцину предпочтительно хранят при температуре от 2°C до 8°C. Ее не следует замораживать.
(24) Введение вакцины
Конечная комбинированная вакцина согласно изобретению удобна для введения людям и особенно детям. Обычный план введения доз вакцины или порядок для получения полной эффективности включает в себя введение более чем одной дозы в схеме первичной иммунизации. Обычная первичная схема включает в себя три дозы, вводимые в интервале от 6 до 8 недель, с первой дозой, введенной ребенку в возрасте между 6 и 9 неделями. Предпочтителен 3-дозовый первичный план введения в 6, 10 и 14 недель, и он может быть завершен четвертой дозой в 18 месяцев.
Вакцина может быть использована для завершения плана первичной иммунизации, сделанной другой вакциной.
Изобретение предоставляет способ увеличения иммунного ответа у пациента, включающий в себя введение композиции согласно изобретению пациенту.
Изобретение также предоставляет композицию согласно изобретению для применения в медицине.
Изобретение также предоставляет использование (i) анатоксина дифтерии, (ii) анатоксина столбняка, (iii) клеточного антигена коклюша, (iv) поверхностного антигена вируса гепатита В, (v) капсулярного сахарида Haemophilus influenzae типа b, конъюгированного с белком-носителем, (vi) по меньшей мере, одного капсулярного сахарида Neisseria meningitidis, конъюгированного с белком-носителем, в производстве медицинского препарата для иммунизации пациента.
Изобретение также предоставляет использование (i) анатоксина дифтерии, (ii) анатоксина столбняка, (iii) клеточного антигена коклюша, (iv) поверхностного антигена вируса гепатита В в производстве медицинского препарата для иммунизации пациента, где медицинский препарат используют для восстановления конъюгатной смеси.
Изобретение также предоставляет использование (i) капсулярного сахарида Haemophilus influenzae типа b, конъюгированного с белком-носителем, (ii) по меньшей мере, одного капсулярного сахарида Neisseria meningitidis, конъюгированного с белком-носителем, в производстве медицинского препарата для иммунизации пациента, где медицинский препарат является лиофилизированным и вводится после восстановления водной вакциной, включающей в себя, по меньшей мере, один дополнительный антиген.
Другие отличительные особенности различных медицинских препаратов указаны ранее. Предпочтительные медицинские препараты представляют собой вакцины.
Медицинские препараты обычно вводят непосредственно пациенту. Прямое введение может быть выполнено парентеральной инъекцией (например, внутривенно, подкожно, внутрибрюшинно, внутримышечно или в интерстициальное пространство ткани), или ректально, орально, вагинально, местно, трансдермально, интраназально, окулярно, аурально, пульморально, или введением через слизистые оболочки. Тем не менее обычно их вводят внутримышечной инъекцией. Предпочтительными областями для введения являются переднелатеральная часть бедра или дельтовидная мышца верхней части руки.
Указанные применения, способы и медицинские препараты являются предпочтительными для иммунизации против патогенов, указанных ранее. Пациентом является предпочтительно человек, может быть ребенок (например, ребенок, начинающий ходить, или новорожденный), подросток или взрослый, но, как правило, ребенок. Предпочтительными являются пациенты в возрасте 0-36 месяцев, например 0-24 месяца, 0-12 месяцев или 0-6 месяцев.
Методы проверки эффективности отдельных антигенов известны в данной области техники.
Вакцины согласно изобретению могут быть введены, по существу, в то же время, когда и оральная полиовакцина, такая как трехвалентная оральная полиовакцина, например, содержащая полиовирус типа 1, полиовирус типа 2 и полиовирус типа 3. Ребенок, получающий вакцину согласно изобретению в первый раз, может предварительно получить оральную полио вакцину и/или вакцину Bacillus Calmette-Guerin (BCG).
Таким образом, предпочтительные группы пациентов для иммунизации включают в себя, но не ограничиваются: (a) детей, которые ранее получили оральную полиовакцину; (b) детей, которые ранее получили BCG вакцину; (с) детей, которые ранее получили полиовакцину и BCG вакцину; (d) детей в группах (a), (b) или (с), которые ранее не получали любой из D, T, Pw, HBsAg, Hib-конъюгатов и по меньшей мере один менингококковый конъюгат; (e) детей, которые ранее получили оральную полиовакцину, BCG, D, T, Pw, HBsAg, Hib-конъюгат и, по меньшей мере, один менингококковый конъюгат. Указанные дети могут быть в любой возрастной группе, утвержденной ранее, например, 0-36, 0-24, 0-12 или 0-6 месяцев.
Таким образом, изобретение предоставляет использование (i) анатоксина дифтерии, (ii) анатоксина столбняка, (iii) клеточного антигена коклюша, (iv) поверхностного антигена вируса гепатита В, (v) капсулярного сахарида Haemophilus influenzae типа b, конъюгированного с белком-носителем, (vi) по меньшей мере, одного капсулярного сахарида Neisseria meningitidis, конъюгированного с белком-носителем, в производстве медицинского препарата для иммунизации пациента в одной из указанных групп от (a) до (e).
Если вакцина согласно изобретению содержит адъювант на основе алюминия, при хранении может появиться осадок компонентов. Поэтому вакцину следует взболтать перед введением пациенту. После взбалтывания вакцина будет представлять собой мутную белую суспензию.
Общая информация
Термин "включающий в себя" может означать "содержащий в себе", как и "состоящий из", например композиция "включающая в себя" X, может состоять исключительно из X или может содержать что-то дополнительное, например X+Y.
Слово "в основном" не исключает "полностью", например композиция, которая является в "основном свободной" от Y, может совсем не содержать Y. Если необходимо, то слово "в основном" может быть пропущено в определении изобретения.
Термин "около" в отношении численного значения x означает, например, x±10%.
Общая информация о технике конъюгации представлена в ссылке 39.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показаны результаты вестерн-блота исследования стабильности HBsAg в композиции. На фиг.1А линии представляют собой: (1) образец буфера Ламмели (LSB); (2) MW-маркеры; (3-5) 1 мкг трех отдельных контрольных препаратов HBsAg; (6-8) супернатант трех отдельных пентавалентных лотов; (9-10) LSB. На фиг.1В линии представляют собой: (1) MW-маркеры; (2-4) 1 мкг трех отдельных контрольных препаратов HBsAg; (5-7) супернатант трех отдельных пентавалентных лотов, хранившихся 2 недели при 2-8°C; (8-10) супернатант трех отдельных пентавалентных лотов, хранившихся 2 недели при 36-38°C.
На фиг.2 показано изменение рН во времени для пентавалентной композиции.
На фиг.3 показаны результаты вестерн-блота исследования стабильности HBsAg в октавалентной композиции. На фиг.3А, 3В: линия 1 содержит MW-маркеры; линия 2 содержит HBsAg контроль, 1 мкг/мл; линия 3 содержит супернатант октавалентной композиции. На фиг.3В: линия 4 содержит LSB; линия 5 содержит тот же контроль, что и линия 2; линия 6 содержит экстракт DOC/TCA.
СПОСОБЫ ОСУЩЕСТВЕНИЯ ИЗОБРЕТЕНИЯ
Октавалентная вакцина D-T-Pw-HBsAg-Hib-MenC-MenW135-MenY
Экспрессированный дрожжами HBsAg, дифтерийный анатоксин, столбнячный анатоксин и антигены коклюша цельных клеток добавляют к суспензии адъюванта соли алюминия. Регулируют рН смеси и затем добавляют конъюгат Hib-CRM197, так что он не адсорбируется на алюминиевый адъювант. Данным способом получают пентавалентную вакцину со следующей композицией:
В другой работе отдельные менингококковые-CRM197-конъюгаты каждой серогруппы С, W135 и Y добавляют после CRM-Hib-компонента для получения октавалентной вакцины:
Важным параметром для стабильности и эффективности вакцины является процент гидролиза Hib-конъюгата, клиническим лимитом является 25% свободного сахарида (в ссылке 56 сообщают, что 20% не влияет на клиническую иммуногенность). Данный параметр измеряли в пентавалентной вакцине с помощью HPAEC-PAD, который позволяет провести прямую количественную оценку неконъюгированных карбогидратов в пикомолярных количествах с минимальным выделением и очисткой. Анализировали количество свободного сахарида.
Сахарид исследуют на:
(a) общее количество в мкг/мл
(b) количество в супернатанте (т.е. неадсорбированный) в мкг/мл
(с) количество, которое является свободным (гидролиз CRM197-Hib-конъюгата) в мкг/мл
Значение (с) выражают или как (d) процент (b) или как (e) процент теоретической общей концентрации сахарида (20 мкг/мл). Результаты представлены ниже:
Максимум 25% свободного сахарида является клинически приемлемым. Все значения были ниже данного порогового значения и были ниже 6,5% вплоть до 4 недель хранения при 2-8°C. В условиях термального стресса (4 недели при 36-38°C) отмечают более высокий уровень, но который значительно ниже значения 25%, с максимумом 11,6% для лота 1. В более раннем исследовании мультивалентных Hib-вакцин показано, что один месяц хранения при 36-38°C вызывает больше гидролиза CRM-Hib, чем 2 года хранения при 2-8°C. Таким образом, допустимый гидролиз можно ожидать, по меньшей мере, через 2 года при нормальных условиях хранения.
Анализ HPAEC-PAD на свободный сахарид также провели через 6 месяцев хранения при 2-8°C. Результаты представлены ниже:
Таким образом, есть только небольшое увеличение процента свободного сахарида в 6 месяцев, по сравнению с 4 неделями, со значениями, остающимися значительно ниже значения 25%. Следовательно, CRM197-Hib является очень стабильным в трех составах.
На фиг.2А показаны изменения рН в пентавалентной вакцине через 6 месяцев в трех лотах, хранившихся при 2-8°C. На фиг.2В показаны изменения рН через 4 недели в трех лотах, хранившихся при 36-38°C. При 2-8°C рН был стабилен через 6 месяцев, в то время как при условиях термального стресса происходило небольшое уменьшение на 0,1 единицу рН через 2 недели и дальнейшее небольшое снижение через 4 недели. Даже при таких условиях все значения рН оставались в приемлемом диапазоне 6,0-7,0.
Осмолярность всех трех пентавалентных лотов была между 312 и 315 мОсм/кг, в центре приемлемого диапазона 240-360 мОсм/кг для инъекционных вакцин.
Оценка активности и иммуногенности антигенов является важной для определения эффективности комбинированной вакцины. Исследовали активность антигенов дифтерии, столбняка и коклюша в пентавалентной вакцине и тестировали иммуногенность CRM-Hib и HBsAg. Для оценки уровня специфических антител после иммунизации проводили ELISA. Иммуногенность HBsAg исследовали с использованием мышиной модели и различных графиков иммунизации, с учетом которых использовали для HBV активности.
Значения DTP активности представлены ниже:
Для каждого из данных трех антигенов результаты теста на активность были значительно выше, чем допустимый нижний лимит, и данные результаты показали хорошую эффективность данных трех антигенов.
Для оценки иммуногенности HBsAg группа из 10 мышей CD1 получала пентавалентную вакцину в виде подкожных инъекций (0,5 мл, разведенных 1:4 в физиологическом растворе) в дни 0 и 14. На 21 день у мышей брали кровь и оценивали специфические антитела к HBsAg в ELISA, используя либо (а) тест "Enzygnost Anti-HBs II" (Dade Behring)либо (b) тест "Ausab EIA" (Abbott). Данные ELISA тесты имеют разные форматы и разную чувствительность к HBsAg. Следовательно, значения геометрических средних титров (GMT) двух тестов несравнимы. Однако в пределах каждого теста значения GMT для сывороток были оптимальны. Результаты представлены ниже:
Все значения GMT, полученные данным тестом исследования иммуногенности на мышах, являются выше, чем значения, представленные в литературе. Процент ответа является согласованно выше для обоих антигенов с наилучшим уровнем ~ 100%.
Для оценки Hib иммуногенности группа из 8 мышей породы CD1 получала пентавалентную вакцину в виде подкожных инъекций (0,5 мл, разведенных 1:4 в физиологическом растворе) в дни 0 10 и 20. На 34 день у мышей брали кровь и оценивали специфические антитела к Hib в ELISA. Результаты представлены ниже:
Адсорбция HBsAg на алюминиевый адъювант является важным фактором иммуногенности вакцины, и данный параметр измеряли иммуноблотом. Процедура иммуноблота представляла собой следующее: 1 мл объема супернатанта вакцины осаждали DOC/TCA и денатурировали LSB и затем нагружали на 12% акриламидный SDS-PAGE; 1 мкл каждого лота HBsAg нагружали как контроль; препарат козьих анти-HBsAg антител использовали как первичные антитела (разведение 1:1000) и анти-козий POD-конъюгат (разведение 1:2500) использовали как вторичные антитела.
Результаты для пентавалентной вакцины показаны на фиг.1. Линии 6-8 фиг.1А показывают, что нет определяемого растворимого HBsAg в композиции в момент времени 0, и линии 5-10 фиг.1В и 1C подтверждают, что через 2 и 4 недели хранения при 2-8°C и 36-38°C это остается неизменным. В трех различных лотах ~99% HBsAg остается адсорбированным на адъювант при данных различных условиях.
Дополнительное исследование стабильности проводили через 6 месяцев хранения при 2-8°C (фиг.1D). Адсорбция сохранялась ~99% для каждого из трех лотов.
Положительные контроли в фиг.1 содержали 1 мкг HBsAg. Видна единичная полоса, соответствующая S пептиду (24 кДа), плюс полоса, характерная для агрегатов (45 кДа). Пре-S2 не был виден.
Октавалентную вакцину также тестировали на адсорбцию HВsAg сходным образом. Центрифугировали 1 мл образца при 3500 об/мин 10 минут. Супернатант помещали в чистую пробирку и осаждали DOC/TCA. Осадок ресуспендировали в 200 мкл экстракционного буфера, кипятили 5 минут и центрифугировали при 1300 об/мин 10 минут. 20 мкл данного экстракта и супернатант, осажденный DOC/TCA, загружали на 12% SDS-PAGE для вестерн-блота.
На фиг.3А показана октавалентная вакцина в момент времени 0, и на фиг.3В показана вакцина через 8 месяцев хранения при 2-8°C. Отсутствие значительной окраски в линиях 3&6 на фиг.3В (достоверно меньшее окрашивание, чем наблюдаемое с 1 мкг HBsAg в контроле, линии 2&5) показало, что адсорбция HBsAg оставалась стабильной в течение данного периода хранения.
Гептавалентная вакцина D-T-Pw -HВsAg-Hib-MenA-MenC
Пять антигенных компонентов собирают, как показано далее.
Трехвалентный компонент D-T-Pw: был приготовлен компонент D-T-Pw, который содержал анатоксин дифтерии, адсорбированный на адъюванте гидроксиде алюминия, анатоксин столбняка, также адсорбированный на адъюванте гидроксиде алюминия, и антигены коклюша цельных клеток с фосфатом алюминия. Данный компонент содержал тимеросал, но не содержал 2-феноксиэтанол.
Компонент HBsAg: HВsAg экспрессировали и выделяли из рекомбинантных S.cerevisiae. Очищенный белок адсорбировали на антиген фосфата алюминия [17].
Конъюгатный компонент Hib: Hib полисахарид получают из Hib, штамм 20752, и после активации бромцианом и получения производных с адипин-гидразидным спейсером, ковалентно соединяют с анатоксином столбняка карбодиимидной конденсацией в весовом отношении сахарид:носитель 1:3. После реакции с участием EDAC измеряют уровни EDU.
Конъюгатный компонент MenA: Капсулярный сахарид из менингококка серогруппы А очищали и ковалентно конъюгировали с белком D H.influenzae, используя CDAP технологию. После реакции с участием CDAP измеряли содержание остаточного DMAP и подтверждали сохранение ОАс групп в С-3. Конъюгат, использующий в качестве носителя анатоксин столбняка, получали так же, CDAP конъюгацией.
Конъюгатный компонент MenC: Капсулярный сахарид из менингококка ОАс+ серогруппы С очищали и ковалентно конъюгировали с белком D H.influenzae, используя CDAP технологию. После реакции с участием CDAP измеряли содержание остаточного DMAP. Также получали конъюгаты из штамма ОАс-. Конъюгат, использующий в качестве носителя анатоксин столбняка, получали так же, CDAP конъюгацией.
Компонент D-T-Pw смешивали с компонентом HBsAg и данную тетравалентную смесь упаковывали в водной форме в плотно закрывающийся пузырек. Уровень HBsAg составлял 10 мкг/доза.
Три конъюгата смешивали и лиофилизировали, как описано в ссылке 2. Лиофилизированный порошок упаковывали в плотно закрывающийся пузырек. Каждый конъюгат был представлен 5 мкг/дозу. Также готовили смесь с удвоенной дозой каждого конъюгата. Смесь конъюгатов не содержала адъювантов.
Два пузырька упаковывали в один ящик.
Для введения пациентам водный материал D-T-Pw-HBsAg забирали в шприц и вводили в пузырек с лиофилизированным конъюгатом. После реактивации лиофилизированного материала его забирали назад в шприц, в готовом виде для введения пациенту.
Дети получали 3-дозовую первичную вакцинацию в 6, 10 и 14 недель в виде внутримышечных инъекций.
Для сравнения 140 детей получали GSK вакцину TRITANRIX-HepB/Hib. Вакцина показала отличную иммуногенность.
В дополнительном испытании дети получали 7-валентную вакцину в 6, 10 и 14 недель. Пациенты контрольной группы получали TRITANRIX-HepB/Hib или TRITANRIX-HepB/Hib плюс MENINGITEC вакцину.
Уровни сывороточных антител измеряли до курса первичной вакцинации и через один месяц после него.
Данные подробного опроса о местных и общих побочных явлениях записывали в течение восьми дней, и данные без подробного опроса о побочных явлениях записывали в течение 30 дней после каждой дозы вакцины.
Проходившие первичный курс иммунизации 99-100% субъектов, получавшие семивалентную вакцину, добивались анти-PRP-уровня ≥0,15 мкг/мл по сравнению со 100% в контрольной группе TRITANRIX-HepB/Hib. 99-100% субъектов, получавших семивалентную вакцину, имели титр SBA-MenC > 1:8 (по сравнению с 100% субъектов, получавших Meningitec). Уровни сывороточной защиты против антигенов дифтерии, столбняка и гепатита В и концентрация анти-анатоксина B.pertussis, индуцированные семивалентными вакцинами, являются высокими и сходными с контрольными вакцинами. Число случаев клинически значимых побочных явлений было низким и равномерно представленным во всех группах. О серьезных побочных явлениях, связанных с вакцинацией, не сообщалось. Семивалентная вакцина показала отличную иммуногенность и хороший профиль безопасности, которые позволяют предположить, что она является подходящей комбинированной вакциной для первичной вакцинации детей, проживающих в эндемичных для MenA и MenC регионах.
В другом исследовании оценивали иммунологическую память и персистирование антител к компонентам Hib, MenA и MenC вакцины у детей в возрасте 10 месяцев. Персистирование антител и иммунологическая память к Hib, MenA и MenC у детей, привитых семивалентной вакциной, были отличными: 10 мкг каждого конъюгата вызывали высокий уровень соответствующих антител, свидельствуя об адекватности прививки конъюгированной вакциной, поскольку это выше, чем ответ у не привитых данной вакциной детей (для MenA и MenC), и сходен с HiberixTM (для Hib).
Следует понимать, что изобретение описано только на примерах, и возможны модификации в рамках концепции настоящего изобретения.
СПИСОК ЛИТЕРАТУРЫ


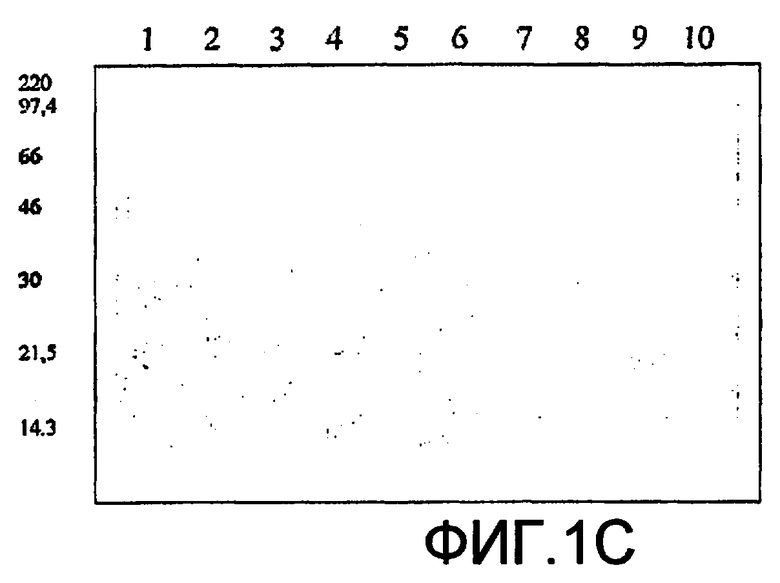

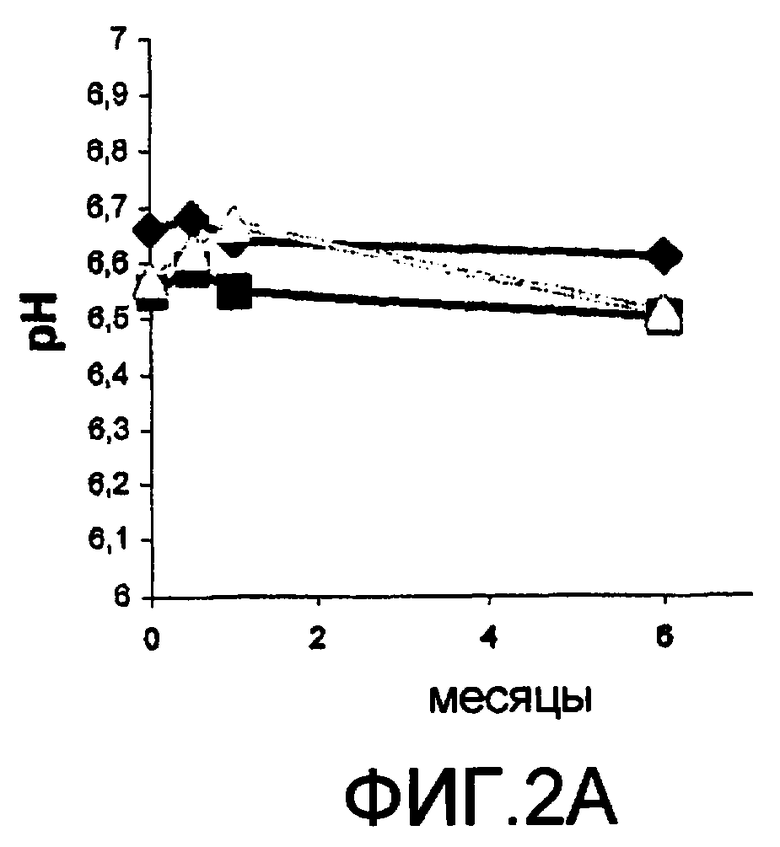
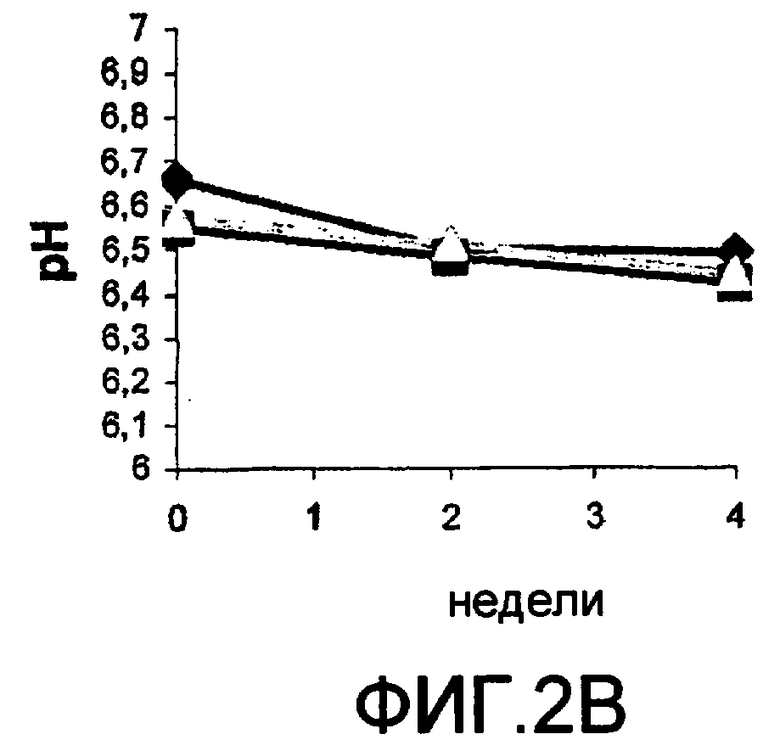
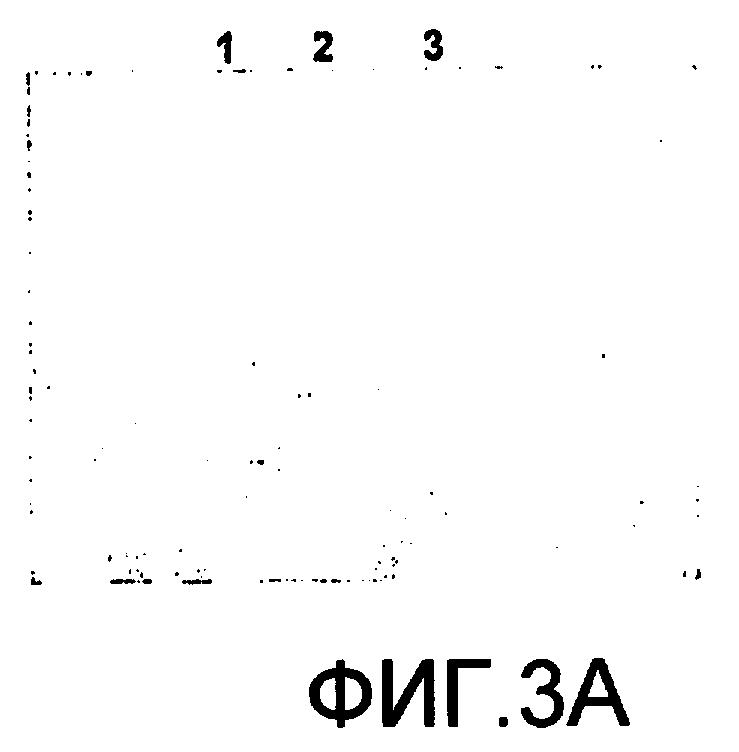

Комбинированные вакцины, описанные в изобретении, включают анатоксин дифтерии (D), анатоксин столбняка (Т), клеточный антиген коклюша (wP), поверхностный антиген вируса гепатита В (HBsAg), капсульный сахарид Haemophilus influenzae типа b (Hib), конъюгированный с белком-носителем, и капсулярный сахарид N. meningitidis, преимущественно серогрупп А и С, конъюгированный с белком-носителем, при этом белком-носителем является анатоксин столбняка. Соотношение веса сахарида к носителю составляет от 1:2 до 1:4. Раскрыт ряд усовершенствованных вариантов данных вакцин. Вакцины могут быть приготовлены экстемпорально в момент применения путем смешивания двух компонентов: (а) первого компонента, включающего в себя антигены D, Т, Pw и HBsAg, и (b) второго компонента, включающего в себя Hib-конъюгат и один или более менингококковых конъюгатов, которые представлены в соответствующем наборе для приготовления композиции вакцины. В изобретении раскрыт способ получения вакцины путем смешивания компонентов вакцины в определенном порядке и последовательности. Вакцина по изобретению представляет собой улучшенную комбинацию вакцин против шести видов инфекций для защиты пациентов и хорошо переносится детьми. 3 н. и 35 з.п. ф-лы, 8 ил.
1. Композиция вакцины, включающая в себя
(i) анатоксин дифтерии, 'D';
(ii) анатоксин столбняка, 'Т';
(iii) клеточный антиген коклюша, 'wP';
(iv) поверхностный антиген вируса гепатита В, 'HbsAg';
(v) капсулярный сахарид Haemophilus influenzae типа b (Hib), конъюгированный с белком-носителем, и
(vi) по меньшей мере один капсулярный сахарид Neisseria meningitidis, конъюгированный с белком-носителем, где каждый из капсулярного сахарида Haemophilus influenzae типа b и капсулярного сахарида (сахаридов) Neisseria meningitidis является конъюгированным с белком-носителем в виде анатоксина столбняка.
2. Вакцина по п.1, где компонент (vi) включает в себя сахариды из серогрупп А и С N. meningitidis.
3. Вакцина по п.1, где конъюгат компонента (iv) имеет весовой избыток носителя, и где соотношение веса сахарида к носителю составляет от 1:2 до 1:4.
4. Вакцина по любому из предшествующих пунктов, где конъюгат компонента (iv) получают способом, включающим в себя стадии (а) активации капсулярного сахарида Haemophilus influenzae типа b бромцианом с получением эфира циановой кислоты; (b) добавления адипин-гидразидного спейсера к эфиру циановой кислоты с получением активированного сахарида; и (с) присоединения активированного сахарида к белку-носителю путем карбодиимидной конденсации.
5. Вакцина по п.1, где конъюгат компонента (iv) включает в себя линкер следующей структуры:
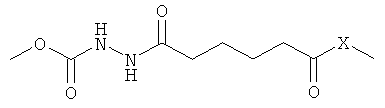
6. Вакцина по п.1, где конъюгат(ы) компонента (vi) получают способом, включающим в себя стадии (а) цианилирования менингококкового капсулярного сахарида с получением эфира циановой кислоты; и (b) присоединения эфира циановой кислоты непосредственно к белку-носителю.
7. Вакцина по п.6, где капсулярный сахарид менингококка является сахаридом серогруппы А.
8. Вакцина по п.6, где менингококковый капсулярный сахарид является сахаридом серогруппы С.
9. Вакцина по п.1, где конъюгат(ы) компонента (vi) включает в себя капсулярный сахарид менингококка ОАс+ серогруппы С.
10. Вакцина по п.1, где конъюгат(ы) компонента (vi) включает в себя капсулярный сахарид менингококка ОАс- серогруппы С.
11. Вакцина по п.1, где конъюгат(ы) компонента (vi) включает в себя капсулярный сахарид менингококка серогруппы А, в котором по меньшей мере 80% его остатков маннозамина являются O-ацетилированными в С3-положении.
12. Вакцина по п.1, где вакцина содержит от 8 мкг/мл до 12 мкг/мл конъюгата компонента (iv).
13. Вакцина по п.1, где единичная доза вакцины содержит от 8 мкг до 12 мкг конъюгата компонента (iv).
14. Вакцина по п.1, где вакцина содержит от 8 мкг/мл до 12 мкг/мл конъюгата (конъюгатов) компонента (vi).
15. Вакцина по п.1, где единичная доза вакцины содержит от 8 мкг до 12 мкг конъюгата (конъюгатов) компонента (vi).
16. Вакцина по п.1, где вакцина содержит адъювант в виде фосфата алюминия и адъювант в виде гидроксида алюминия.
17. Вакцина по п.1, где HBsAg адсорбируют на адъюванте-фосфате алюминия.
18. Вакцина по п.1, где анатоксин дифтерии адсорбируют на адъюванте-гидроксиде алюминия.
19. Вакцина по п.1, где анатоксин столбняка адсорбируют на адъюванте-гидроксиде алюминия.
20. Вакцина по п.1, где вакцина включает в себя ртутный стабилизатор и стабилизатор в виде 2-феноксиэтанола.
21. Вакцина по п.1, где отношение анатоксина дифтерии к анатоксину столбняка составляет от 2:1 до 3:1, измеренное в единицах Lf.
22. Вакцина по п.1, где HBsAg является не гликозилированным и представлен в виде частиц, которые содержат липидный матрикс, включающий в себя фосфолипиды и фосфатидилинозит.
23. Вакцина по п.1, где HBsAg получен из HBV подтипа adw2.
24. Вакцина по п.1, где вакцина предназначена для введения пациентам в количестве 0,5 мл.
25. Способ получения вакцины по любому из предшествующих пунктов, включающий в себя стадии (а) соединения трехвалентного компонента D-t-pw с моновалентным компонентом HBsAg с получением тетравалентного компонента D-T-Pw-HBsAg; (b) соединения конъюгата Hib по меньшей мере с одним менингококковым конъюгатом с получением смешанного конъюгатного компонента; и (с) смешивания тетравалентного компонента D-T-Pw-HBsAg со смешанным конъюгатным компонентом с получением вакцины.
26. Способ по п.25, где трехвалентный компонент D-T-Pw содержит оба адъюванта - адъювант в виде фосфата алюминия и адъювант в виде гидроксида алюминия.
27. Способ по п.26, где компоненты D и Т в трехвалентном компоненте D-T-Pw адсорбируют на адъюванте-гидроксиде алюминия.
28. Способ по любому из пп.25-27, где моновалентный компонент HBsAg адсорбируют на адъюванте-фосфате алюминия.
29. Способ по любому из пп.25-27, где смешанный конъюгатный компонент не содержит адъювантов.
30. Способ по любому из пп.25-27, где трехвалентный компонент D-T-Pw содержит ртутный стабилизатор.
31. Способ по п.30, где ртутный стабилизатор представляет собой тиомерсал.
32. Способ по любому из пп.25-27, где смешанный конъюгатный компонент не содержит ртутный стабилизатор.
33. Способ по любому из пп.25-27, где вакцина включает в себя стабилизатор 2-феноксиэтанол, но трехвалентный компонент D-T-Pw не содержит стабилизатор 2-феноксиэтанол.
34. Способ по любому из пп.25-27, где Hib-конъюгат получают путем конъюгирования Hib-сахарида со столбнячным анатоксиновым носителем, используя 1-этил-3-(3-диметиламинопропил)карбодиимид; и затем удаляют N-этил-N'-(3-диметиламинопропил)мочевину.
35. Способ по любому из пп.25-27, где менингококковый конъюгат(ы) получают путем конъюгирования менингококкового сахарида со столбнячным анатоксиновым носителем, используя 1-циано-4-(диметиламино)пиридиний; и затем удаляют 4-диметиламинопиридин.
36. Набор для приготовления композиции вакцины по любому из пп.1-24, включающий в себя:
(a) первый компонент, содержащий антигены D, Т, Pw и HBsAg; и
(b) второй компонент, содержащий Hib и менингококковые конъюгаты, где каждый из них является конъюгированным с белком-носителем в виде анатоксина столбняка, и где два компонента находятся в отдельных контейнерах.
37. Набор по п.36, где конъюгаты во втором компоненте являются лиофилизированными.
38. Набор по п.37, где второй компонент включает в себя лактозу, сахарозу и/или маннит.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| УСТАНОВКА ДЛЯ ИСПЫТАНИЯ АЕИАЦИОННЬ!Х ПРИБОРОВ | 0 |
|
SU200249A1 |
| СТАНОК ДЛЯ ИГЛОФРЕЗЕРОВАНИЯ | 1995 |
|
RU2080965C1 |
| КОМБИНИРОВАННАЯ ВАКЦИНА НА ОСНОВЕ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ПРЕДУПРЕЖДЕНИЯ ИНФЕКЦИИ ГЕПАТИТА В У ЧЕЛОВЕКА | 1993 |
|
RU2160120C2 |
Авторы
Даты
2011-06-10—Публикация
2006-03-16—Подача