Изобретение относится к химико-фармацевтической промышленности и касается создания радиофармацевтических препаратов (РФП) на основе пептидных аналогов нейрорегуляторных пептидов, меченных радиоизотопами, с целью диагностики и терапии раковых опухолей.
В последние годы наиболее перспективными для диагностики и терапии опухолей считаются РФП на основе таргетных селективных пептидов, имеющих высокое сродство к гиперэкспрессированным рецепторам опухолевых клеток. Применение таких РФП позволяет осуществлять раннее выявление первичных очагов и метастазов опухолей и начинать эффективную терапию, в том числе радиоизотопами, что существенно повышает выживаемость онкологических больных [Jean Claude Reubi; Helmut R.Macke; and Eric P.Krenning. Candidates for Peptide Receptor Radiotherapy Today and in the Future. J Nucl Med 2005; 46: 67-75].
Меланома является одной из самых злокачественных опухолей, занимает 6 место по частоте встречаемости, отличается быстрым метастазированием, резистентностью к химиотерапии и высокой смертностью. Поэтому ранняя диагностика метастазов меланомы и срочное начало лечения являются необходимыми для достижения положительных результатов терапии.
Вырабатываемый в организме альфа-меланоцит стимулирующий гормон (αМСГ) представляет собой тридекапептид, высокоаффинный к меланокортиновым рецепторам, в частности к меланокортиновому рецептору 1 типа (MC1R), который гиперэкспрессируют клетки меланомы животных и человека. Однако αМСГ нестабилен и быстро разрушается в тканях организма. Поэтому для создания РФП, высокоаффинных и длительно связывающихся с MC1R, были синтезированы различные стабильные, устойчивые к распаду в организме пептидные аналоги αМСГ, в том числе сложные циклические соединения [Quinn Т, Zhang X, Miao Y. Targeted melanoma imaging and therapy with radiolabeled alpha-melanocyte stimulating hormone peptide analogues. G Ital Dermatol Venereol. 2010 Apr; 145(2): 245-58].
Однако в последние годы было показано, что РФП для диагностики меланомы на основе линейных пептидных аналогов αМСГ, меченных радиоизотопом через хелатирующую группу, ковалентно связанную с ε-аминогруппой концевого лизина, обладают улучшенными фармакокинетическими свойствами и качеством визуализации при диагностике, за счет увеличения специфического связывания меченого соединения клетками опухоли и уменьшения уровня неспецифического связывания выводимых из организма меченых соединений в почках и печени [Sylvie Froidevaux; Martine Calame-Christe; Heidi Tanner; Alex N.Eberle. Melanoma Targeting with DOTA-α-Melanocyte-Stimulating Hormone Analogs: Structural Parameters Affecting Tumor Uptake and Kidney Uptake. J Nucl Med. 2005, Vol.46, No.5].
Кроме того, были получены новые данные, показывающие, что уменьшение длины пептидного аналога αМСГ в составе РФП увеличивает уровень и длительность накопления меченого соединения в клетках опухоли [Haixun Guo, Jianquan Yang, Fabio Gallazzi, Yubin Miao. Reduction of the Ring Size of Radiolabeled Lactam Bridge-Cyclized a-MSH Peptide, Resulting in Enhanced Melanoma Uptake. J Nucl Med. 2010; 51: 418-426].
Важным является существенно меньшая стоимость коротких линейных пептидов и технологичность их синтеза, по сравнению со сложными многозвенными циклическими соединениями.
В настоящее время радиоизотоп технеция (99mTc), получаемый непосредственно в клиниках из генератора 99Мо/99mTc, является наиболее приемлемым по цене и идеальным по физико-химическим характеристикам для создания РФП с целью проведения СПЕКТ диагностики с использованием доступных γ-камер в медицинской практике.
Однако разработанные линейные пептидные аналоги αМСГ, меченные 99mTc, крайне ограничены. Известен линейный пептид (NDP-MSH), меченный 99mTc через пептидную хелатирующую группу:
99mTc-Cys-Gly-Cys-Gly-NDP-MSH
Его недостатками являются: большая длина основного пептида (последовательность из 13 аминокислот) и то, что пептидная хелатирующая группа (Cys-Gly-Cys-Gly) соединена с N-концевой частью основного пептида. Поэтому в экспериментальных исследованиях не были получены удовлетворительная фармакокинетика и достаточное накопление соединения в опухоли [Chen J, Cheng Z, Hoffman TJ, Jurisson SS, Quinn TP. Melanoma-targeting properties of (99m)technetium-labeled cyclic alpha-melanocyte-stimulating hormone peptide analogues. Cancer Res. 2000 Oct 15; 60(20): 5649-58].
Наиболее близким техническим решением (прототипом) является радиофармацевтический препарат для диагностики меланомы и ее метастазов, содержащий линейный октапептид (последовательность из восьми аминокислот), меченый 99mTc через хелатирующую карбонильную группу (pz), ковалентно связанную с ε-аминогруппой С-концевого лизина:
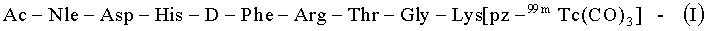
Недостатком РФП на основе I является повышенная гидрофобность, вносимая карбонильной составляющей, что существенно ухудшило его связывание с клетками меланомы и фармакокинетические свойства [Raposinho PD, Correia JD, Alves S, Botelho MF, Santos AC, Santos I. A (99m)Tc(CO)(3)-labeled pyrazolyl-alpha-melanocyte-stimulating hormone analog conjugate for melanoma targeting. Nucl Med Biol. 2008 Jan; 35(1): 91-9].
Задачей настоящего изобретения является получение нового РФП для диагностики меланомы и ее метастазов с улучшенными радиофармацевтическими свойствами на основе линейного аналога αМСГ, меченного 99mTc, позволяющего достигнуть высокого уровня накопления и длительности удержания меченого препарата клетками и тем самым улучшить качество визуализации меланомы при диагностике.
Поставленная задача достигается использованием линейного пептида - аналога альфа-меланоцит - стимулирующего гормона:
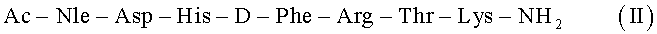
содержащего гидрофильную пептидную хелатирующую группу для мечения радионуклидом, с целью получения радиофармацевтического препарата общей формулы:
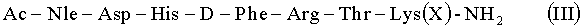
где X - хелатирующая группа в виде Gly-Cys-Gly-Cys-Н.
Содинение III отличается от прототипа тем, что входящий в него основной пептид II имеет меньшую длину (последовательность из 7 аминокислот), а также тем, что с ε-аминогруппой С-концевого лизина ковалентно связана гидрофильная пептидная хелатирующая группа (Gly-Cys-Gly-Cys-H).
Представленное в изобретении соединение III может быть также использовано в качестве таргетной пептидной составляющей для терапевтического РФП в случае его комплекса с β-излучающим радионуклидом, например, с 188Re, характеризующимся близкими к 99mTc физико-химическими характеристиками.
Примеры, иллюстрирующие предлагаемые изобретения
Список использованных сокращений:
АсОН - уксусная кислота
Asp - аспарагиновая кислота
Arg - аргинин
Cys - цистеин
Gly - глицин
His - гистидин
Nle - норлейцин
Lys - лизин
Ser - серин
Тгр - триптофан
Phe - фенилаланин
But - трет-бутил
Bz - бензоил
DCC - N,N'-дициклогексилкарбодиимид
DMF - диметилформамид
DIPEA - диизопропилэтиламин
EDT - этандитиол
НОВТ - 1-гидроксибензотриазол
HONB - ONp - n-нитрофениловый эфир
ONSu - N-гидроксисукцинимидный эфир
TFA - трифторуксусная кислота
TFMSA - трифторметансульфокислота
Z - бензилоксикарбонил
ВОР - гексафторфосфат-бензотриазол-1-ил-окси-трис-(диметиламино)фосфоний.
ONB-N-гидрокси-3-норборнен-2,3-дикарбоксиимидный эфир
ВЭЖХ - высокоэффективная жидкостная хроматография
Синтез пептидных продуктов проводился методами классической пептидной химии в жидкой фазе [Synthetic Peptides. A User's Guide. Second Edition / Ed. G.A.Grant. Oxford Univ. Press. Oxford, N.Y.: 2002].
Пример 1. Синтез целевого линейного пептида:
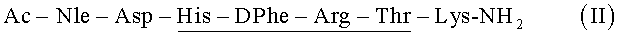
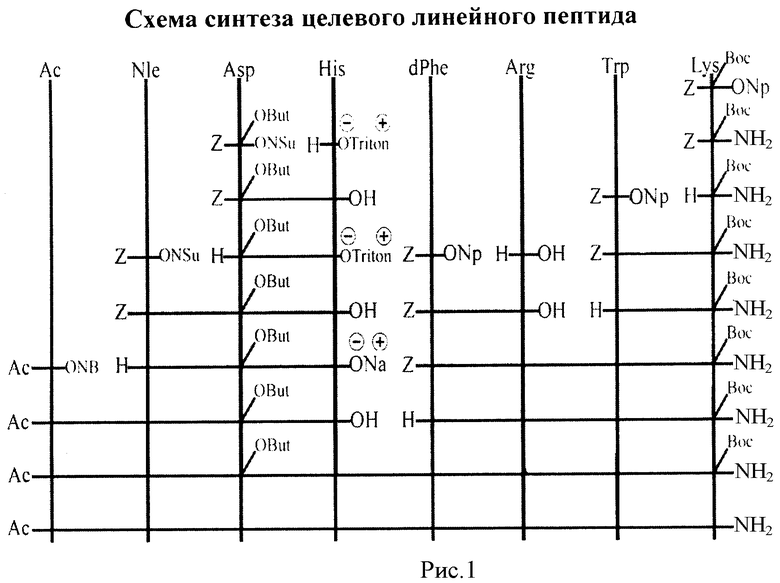
Схема синтеза целевого линейного пептида приведена на рис.1.
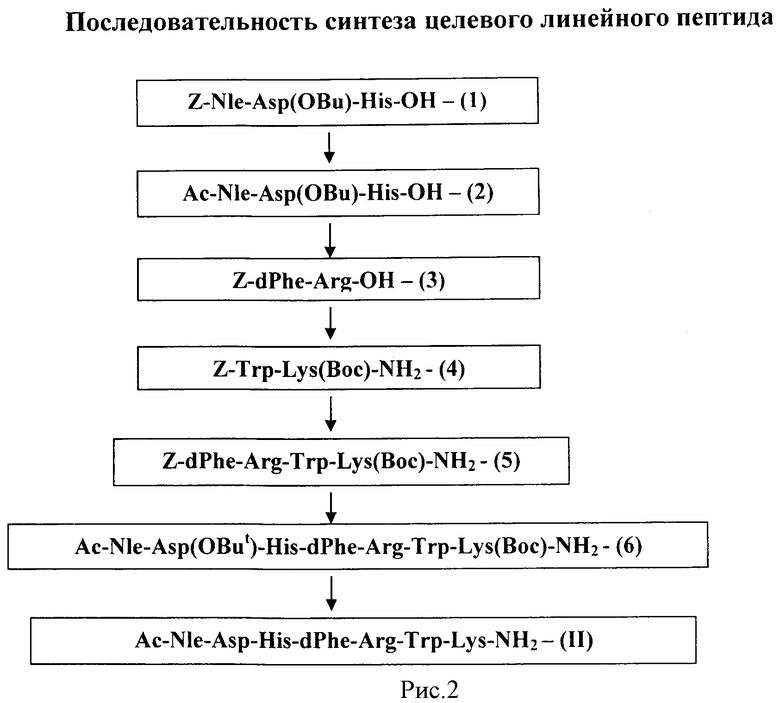
Синтез целевого линейного пептида изложен ниже в соответствии со схемами, представленными на рис.1 и 2
Z-Nle-Asp(OBu)-His-OH
К 8.5 г (0.055 моль) гистидина добавляли 27.5 мл Тритона В, упаривали, к остатку добавляли раствор 21.02 г (0.050 моль) Z-Asp-ONSu в 100 мл DMF. Реакционную смесь выдерживали 12 ч при 20°С, упаривали, к остатку добавляли 150 мл этилацетата, промывали 5% АсОН (2×50 мл) и водой до нейтральной реакции, упаривали. Остаток растворяли в 200 мл этанола, гидрировали над 5% Pd/C до исчезновения исходного Z-Asp-His-OH (контроль методом ТСХ в системе А). Катализатор отфильтровывали, фильтрат упаривали досуха. Полученное масло растворяли в 22.5 мл Тритона В, упаривали, к остатку добавляли раствор 16.3 г (0.045 моль) Z-Nle-ONSu в 100 мл DMF. Реакционную смесь перемешивали 12 ч при 20°С, упаривали, к остатку добавляли 150 мл этилацетата, промывали 5% АсОН (2×50 мл) и водой до нейтральной реакции, упаривали. Кристаллизовали из диэтилового эфира, отфильтровывали, сушили на воздухе. Выход 21.5 г (67%) в расчете на Z-Asp-ONSu. Rf 0.745 (Б).
Ac-Nle-Asp(OBu)-His-OH
К 21.5 г (0.037 моль) соединения (1) добавляли 37 мл 1N NaOH, растворяли в 150.0 мл этанола, гидрировали над 5% Pd/C до исчезновения исходного (1). Катализатор отфильтровывали, фильтрат упаривали досуха. Остаток растворяли в 150 мл DMF, добавляли 7.2 г (0.040 моль) AcONp. Реакционную смесь перемешивали 12 ч при 20°С, упаривали, к остатку добавляли 150 мл этилацетата, промывали 5% АсОН (2×50 мл) и водой до нейтральной реакции, упаривали. Кристаллизовали из диэтилового эфира, отфильтровывали, сушили на воздухе. Выход 12.69 г (79%). Rf 0.68 (В).
Z-dPhe-Arg-OH
Растворяли 29.4 г (0.070 моль) Z-dPhe-ONp в 200 мл DMF, добавляли 13.4 г (0.077 моль) аргинина. Реакционную смесь перемешивали 12 ч при 20°С, упаривали. К остатку добавили 100 мл этилацетата, выпавший осадок отфильтровывали, промывали на фильтре этилацетатом и диэтиловым эфиром, сушили на воздухе. Выход 25.5 г (80%). Rf 0.70 (В).
Z-Trp-Lys(Boc)-NH2
Растворяли 29.2 г (0.077 моль) Z-Lys(Boc)-NH2 в 250 мл этанола, гидрировали над 5% Pd/C до исчезновения исходного по ТСХ в системе (Б). Катализатор отфильтровывали, фильтрат упаривали досуха. Остаток растворяли в 250 мл DMF, добавляли 35.4 г (0.077 моль) Z-Trp-ONp. Реакционную смесь перемешивали 12 ч при 20°С, упаривали, к остатку добавляли 250 мл этилацетата, промывали 5% раствором NH4OH (3×150 мл), водой до нейтральной реакции, 2% H2SO4 (2×150 мл), водой до нейтральной реакции, упаривали. Кристаллизовали из диэтилового эфира, отфильтровывали, сушили на воздухе. Выход 39.0 г (89%). Rf 0.81 (Б).
Z-dPhe-Arg-Trp-Lys(Boc)-NH2
Растворяли 39.0 г (0.069 моль) соединения (4) в 250.0 мл этанола, гидрировали над 5% Pd/C до исчезновения исходного по ТСХ в системе (Б). Катализатор отфильтровывали, фильтрат упаривали досуха, остаток кристаллизовали из диэтилового эфира, сушили на воздухе при 20°C. Полученные 24.1 г (0.056 моль) H-Trp-Lys(Boc)-NH2 растворяли в 300.0 мл DMF, добавляли 25.5 г (0.056 моль) соединения (III), 17.0 г (0.122 моль) НОВТ. Реакционную смесь охлаждали до -30°С, добавляли при перемешивании 14.0 г (0.067 моль) DCC, перемешивали 1 ч при -30°C, 12 ч при 20°C. Реакционную смесь упаривали, остаток растворяли в этилацетате, промывали 5% раствором NaHCO3 (3×150 мл), водой до нейтральной реакции, 2% H2SO4 (2×150 мл), водой до нейтральной реакции, упаривали, кристаллизовали из эфира, осадок отфильтровывали, сушили на воздухе. Выход 40.1 г (82%). Rf 0.62 (В).
Ac-Nle-Asp(OBut)-His-dPhe-Arg-Trp-Lys(Boc)-NH2
Растворяли 4.35 г (0.005 моль) соединения (5) в 80.0 мл этанола, гидрировали над 5% Pd/C до исчезновения исходного по ТСХ в системе (Б). Катализатор отфильтровывали, фильтрат упаривали досуха, остаток растворяли в 80.0 мл DMF. Полученный аминокомпонент конденсировали с 2.40 г (0.005 моль) соединения (IV) при помощи 4.2 г (0.0055 моль) комплекса F. Реакционную смесь перемешивали 12 ч при 20°C, упаривали, остаток растворяли в 100 мл смеси бутанола и этилацетата (1:1), промывали 5% раствором NaHCO3 (3×150 мл), водой до нейтральной реакции, 2% H2SO4 (2×150 мл), водой до нейтральной реакции, упаривали. К остатку добавляли смесь этилацетата и диэтилового эфира, выпавший осадок отфильтровывали, сушили на воздухе. Выход 5.4 г (90%). Rf 0.43 (Б).
Ac-Nle-Asp-His-dPhe-Arg-Trp-Lys-NH2
5.4 г (0.0045 моль) соединения (6) обрабатывали 80.0 мл смеси TFA и этандитиола (9.5:0.5) 1 ч при 20°C. Реакционную смесь упаривали, масло растирали с эфиром, осадок отфильтровывали, промывали эфиром, сушили в вакууме над NaOH. Продукт подвергали очистке на колонке (250×400 мм) с SP-сефадексом С-25, уравновешенным 0.05 М пиридин-ацетатным буфером. Элюцию проводили градиентом ионной силы пиридин-ацетата от 0.05 до 2.0 М раствора со скоростью 25 мл/ч. Детекцию осуществляли при 280 нм. Фракции, содержащие основной продукт, объединяли, упаривали, растворяли в воде, лиофилизировали. Выход 2.8 г (60%). Rf 0.46 (Г).
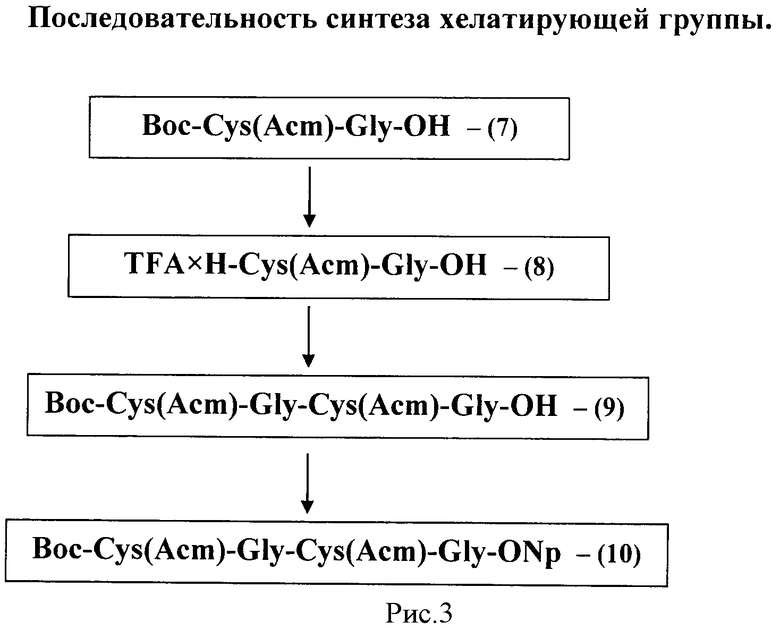
Пример 2. Синтез хелатирующей группы для присоединения к линейному пептиду
Схема синтеза хелатирующей группы приведена на рис.3.
Последовательность синтеза состоит из 4 стадий и включает синтез 4 соединений и наращивание цепи с замещением отдельных групп до получения хелатирующей группы для присоединению к целевому пептиду по следующей схеме, рис.3.
Синтез хелатирующей группы описывается в соответствии с представленной схемой.
Boc-Cys(Acm)-Gly-OH
Растворяли 4.13 г (0.010 моль) Boc-Cys(Acm)-ONp в 80.0 мл DMF, добавляли 0.90 г (0.012 моль) глицина в 12.0 мл 1N NaOH. Реакционную смесь перемешивали 12 ч при 20°С, упаривали, остаток растворяли в воде, экстрагировали выделившийся HONp эфиром, подкисляли водный раствор 20% H2SO4, экстрагировали целевой продукт 100 мл смеси бутанола и этилацетата (1:1), промывали водой до нейтральной реакции, упаривали. Маслообразный остаток растирали с эфиром и гексаном, осадок отфильтровывали, промывали гексином, сушили на воздухе при 20°С. Выход 2.1 г (60.0%). Rf 0.44 (Б).
TFA×H-Cys(Acm)-Gly-OH
Обрабатывали 4.0 г (0.011 моль) соединения (7) 50.0 мл TFA 1 ч при 20°С. Реакционную смесь упаривали, масло растирали с эфиром, осадок отфильтровывали, промывали эфиром, сушили в вакууме над NaOH. Выход 3.6 г (91%). Rf 0.63 (Г).
Boc-Cys(Acm)-Gly-Cys(Acm)-Gly-OH
Растворяли 4.0 г (0.011 моль) соединения (8) в 80 мл DMF, добавляли 1.60 г (0.011 моль) HONp. Реакционную смесь охлаждали до - 30°C, добавляли при перемешивании 3.0 г (0.014 моль) DCC, перемешивали 1 ч при -30°C, 12 ч при 20°C, упаривали, растирали с гексаном, гексан декантировали. Полученный маслообразный остаток растворяли в 40 мл DMF, добавляли раствор 3.6 г (0.010 моль) соединения (X) и 2.2 мл N-метилморфолина в 40 мл DMF. Реакционную смесь перемешивали 12 ч при 20°С, упаривали, остаток растворяли в воде, экстрагировали выделившийся HONp эфиром, подкисляли водный раствор 20% H2SO4, экстрагировали целевой продукт 100 мл смеси бутанола и этилацетата (1:1), промывали водой до нейтральной реакции, упаривали. Маслообразный остаток растирали с эфиром, осадок отфильтровывали, промывали на фильтре эфиром, сушили на воздухе при 20°С. Выход 3.77 г (65%).
Boc-Cys(Acm)-Gly-Cys(Acm)-Gly-ONp
Растворяли 0.77 г (0.0013 моль) соединения (9) в 20 мл DMF, добавляли 0.19 г (0.0013 моль) HONp. Реакционную смесь охлаждали до -30°C, добавляли при перемешивании 0.34 г (0.0016 моль) DCC, перемешивали 1 ч при -30°C, 12 ч при 20°C, упаривали, растирали с гексаном, гексан декантировали. Маслообразный остаток растирали с эфиром, осадок отфильтровывали, промывали на фильтре эфиром, сушили на воздухе при 20°C. Выход 0.80 г (87%). Rf 0.71 (Г).
Пример 3. Синтез целевого линейного пептидного с хелатирующей группой
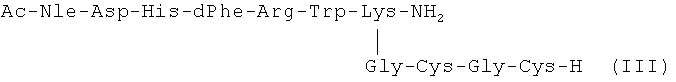
Последовательность синтеза состоит из 3 этапов и включает синтез 2 промежуточных соединений и наращивание цепи с замещением отдельных групп до получения целевого пептида 2 по следующей схеме, рис.4.
Синтез целевого линейного пептида с хелатирующей группой изложен в соответствии с представленной схемой.
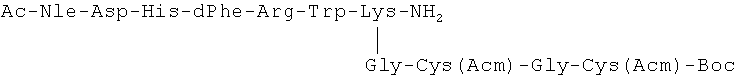
Растворяли 0.3 г (0.00026 моль) соединения (III) растворяли в 30.0 мл DMF, добавляли при перемешивании 0.100 мл DIPEA, 0.22 г (0.0003 моль) соединения (XI1). Реакционную смесь перемешивали 12 ч при 20°C, упаривали, добавляли 50.0 мл этилацетата, выпавший осадок отфильтровывали, промывали на фильтре этилацетатом. Выход 0.40 г (92%). Rf 0.64 (Г).
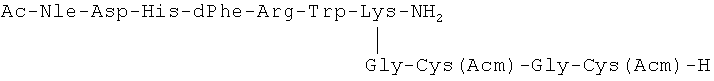
Обрабатывали 0.4 г (0.00025 моль) соединения (11) в 20.0 мл смеси TFA и этандитиола (9.5:0.5) 1 ч при 20°C. Реакционную смесь упаривали, масло растирали с эфиром, осадок отфильтровывали, промывали эфиром, сушили в вакууме над NaOH. Выход 0.4 г (98%). Rf 0.3 (Г).
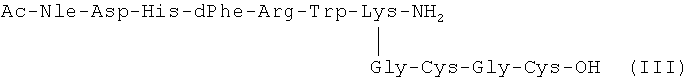
К раствору 1.13 г (0.0007 моль) соединения (12) в 80.0 мл 30% СН3СООН прибавляли раствор 1.80 г ацетата ртути в 20.0 мл 30% СН3СООН. Перемешивали реакционную смесь 1.5 ч при 20°С, пропускали H2S в течение 20 мин. Образовавшийся осадок отфильтровывали, промывали на фильтре дважды 30% СН3СООН, фильтрат упаривали досуха, остаток растворяли в воде, подвергали очистке с помощью ВЭЖХ на колонке (25×250 мл) Диасорб С-16-130Т, 10 мкм, при длине волны 226 нм. В качестве элюентов использовали буфер А 0.01% трифторуксусную кислоту, Б - 80% ацетонитрила в буфере А. Градиент 0.5% буфера Б в минуту. Выход 0.30 г (32%). Чистота целевого пептида 98.3% (колонка Ultropac TSK ODS-120T, 4.6×45 мм, 5 мкм; буфер А: 0.05М KH2PO4, pH 3.0, буфер Б: 70% ацетонитрил + 30% H2O; градиент Б от 20 до 80% за 30 мин, Rt - 13.87 мин). MALDI - MS: расчетная масса - 1362.636, найдено 1362.809.
Пример 4. Получение радиофармацевтического средства на основе линейного пептида с хелатирующей группой, меченного радионуклидом 99mTc
Данный пример описывает проведение реакции мечения радионуклидом 99mTc (технеций-99m) линейного пептида с хелатирующей группой (III) и полученного при этом радиофармацевтического препарата (РФП) для диагностики меланомы. В результате данной реакции был получен линейный пептидный аналог αМСГ, меченный 99mTc (99mTc-αМСГлп), структурная формула которого представлена ниже (IV):
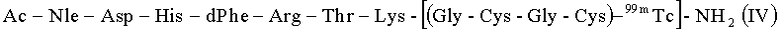
Образец (1 мг) лиофилизата пептидного фрагмента растворяли в 1 мл дистиллированной воды, фасовали по 30 мкл в пробирки Эппендорф и замораживали. Хранили в замороженном виде при -18°C. Образец пептида размораживали при комнатной температуре 5-10 мин. К размороженному пептиду в ту же пробирку дозатором добавляли цитратный буферный раствор и раствор дихлорида олова. Полученный раствор смеси переносили в защитный контейнер и затем к нему прибавляли элюат 99мTcO4 - в изотоническом растворе хлорида натрия из генератора 99Мо/99mTc. Соотношения компонентов в смеси обеспечивали pH в диапазоне 4,5-7,0. Реакционную смесь инкубировали при комнатной температуре. По истечении 30 мин инкубации реакция мечения была завершена.
Полученный в указанных условиях состав РФП, обеспечивающий высокий выход меченого пептида, соответствующего формуле (IV), представлен в таблице 1.
Пример 5. Определение радиохимической чистоты линейного пептида с хелатирующей группой, меченного радионуклидом 99mTc
Выход реакции мечения - радиохимическую чистоту полученного препарата (РХЧ) определяли методом тонкослойной хроматографии (радио-ТСХ). Для этого раздельно определяли содержание в препарате пертехнетата натрия, 99мTc, и гидролизованного восстановленного 99mTc. Затем РХЧ препарата рассчитывалась по формуле:
РХЧРФП(%)=100(%)-ПТ(%)-ГВТ(%),
где РХЧРФП - радиохимическая чистота пептидного РФП на основе 99mTc, в %;
ПТ - процентное содержание несвязанного пертехнетата;
ГВТ - процентное содержание несвязанного гидролизованного восстановленного 99mTc.
Определение ПТ
Для определения ПТ приготавливают пластины для ТСХ (силикагель на алюминиевой подложке, Merck №5553) длиной 100 мм и шириной 15 мм. Пробу исследуемого раствора (2-4 мкл) наносят на линию старта. Объем пробы подбирают в таком количестве, чтобы можно было статистически достоверно зарегистрировать активность пиков на радиометрической установке. Пластину высушивают на воздухе до полного испарения нанесенной жидкости. Пластину помещают в хроматографическую камеру и проводят хроматографирование до достижения подвижной фазой линии финиша, используя в качестве подвижной фазы ацетон. Проводят количественное определение распределения активности с помощью сканера для радио - ТСХ или прямой радиометрией частей пластины. В этих условиях ПТ имеет значение Rf 0,95±0,05, остальные продукты реакции находятся на линии старта.
Содержание ПТ (%) рассчитывают по формуле:
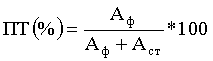 ,
,
где Афр - активность финишной части хроматограммы, содержащей ПТ;
Аст - активность остальной части хроматограммы.
Определение ГВТ:
Для определения ГВТ приготавливают пластины для ТСХ (целлюлоза Ф на алюминиевой подложке, Merck №5754) длиной 100 мм шириной 15 мм. Пробу исследуемого раствора (2-4 мкл) наносят на линию старта. Объем пробы подбирают в таком количестве, чтобы можно было статистически достоверно зарегистрировать активность пиков на радиометрической установке. Пластину высушивают на воздухе до полного испарения нанесенной жидкости. Пластину помещают в хроматографическую камеру и проводят хроматографирование восходящим методом, используя в качестве подвижной фазы смесь ацетонитрил-вода в соотношении 1:1 (по объему), до достижения подвижной фазой линии финиша. Проводят количественное определение распределения активности с помощью сканера для радио - ТСХ или прямой радиометрией частей пластины. В этих условиях ГВТ имеет значение Rf 0,05±0,05, остальные продукты реакции двигаются вместе с фронтом элюента. Содержание ГВТ (%) рассчитывают по формуле:
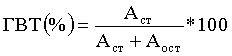 ,
,
где Аст - активность стартовой части хроматограммы, содержащей ГВТ;
Аост - активность остальной части хроматограммы.
Для всех образцов меченого пептида, полученного в соответствии с методикой и условиями примера 4, РХЧ составила 94-98%.
Пример 6. Изучение связывания линейного пептида, меченного 99mTc, опухолевыми клетками in vitro.
В экспериментах in vitro была использована культура мышиной меланомы B16F1 из коллекции Российского Научного Центра им. И.Н.Блохина. Использованная культура - фибробластоподобная, жизнеспособность: 98% (окраска трипановым синим на нулевом пассаже).
Клетки культивировали в пластиковых культуральных флаконах (Coming-Costar) с площадью поверхности 25 см2 в среде следующего состава: среда RPMI-1640 и среда Eagla (из полнокомпонентной смеси фирмы Gibco) в соотношении 3:1 с добавлением эмбриональной телячьей сыворотки - 5%, L-глутамина - 200 мМ и гентамицина 10 ед/мл в CO2-инкубаторе при 37°C в увлажненной атмосфере, содержащей 5% CO2. Клетки инкубировали до получения полноценного монослоя, количество клеток в котором составляло 2*106 клеток/флакон. Перед началом эксперимента клетки инкубировали в течение 2-х часов в среде без добавления сыворотки. Далее клетки снимали с пластика при помощи раствора трипсин/этилендиамитетраацетат (ЭДТА) (0,05% трипсина, 0,02% ЭДТА), центрифугировали, отмывали раствором Хэнкса и расфасовывали по 5·105 клеток в 1 мл среды в пробирки типа "Эппендорф".
Вначале определяли концентрацию 99mTc-αМСГлп, при которой наблюдается его максимальное связывание с рецепторами клеток меланомы. В суспезию клеток вносили 100 мкл раствора 99mTc-аМСГлп в диапазоне концентраций 30-0,003 мкг/мл с активностью элюата 99мTcO4 -, равной 1 мКи/мл.
Клетки инкубировали при 37°C в CO2-инкубаторе в течение двух часов. Затем клетки осаждали центрифугированием в течение 10 мин 2500 об/мин (центрифуга Heidolph), дважды промывали холодным (+4°C) раствором Хэнкса, ресуспендировали в 1 мл среды. Отдельно готовили эталон, представляющий собой 1 мл среды, содержащий 100 мкл исходного раствора 99mTc-αМСГлп в диапазоне концентраций 30-0,003 мкг/мл с активностью элюата 99мTcO4 -, равной 1 мКи/мл.
По окончании инкубирования радиоактивный раствор удаляли с помощью процедуры последовательно повторяемых трижды - осаждения центрифугированием и промывания раствором Хэнкса. Измеряли радиоактивность каждой пробы и эталона в гамма-счетчике Wizard 2480 («PerkinElmer LAS /Wallac», Финляндия). Уровень связывания оценивали по формуле:
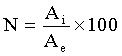 ,
,
где Ai - счет пробы в импульсах,
Ae - счет эталона в импульсах.
Каждая точка была взята в триплетах.
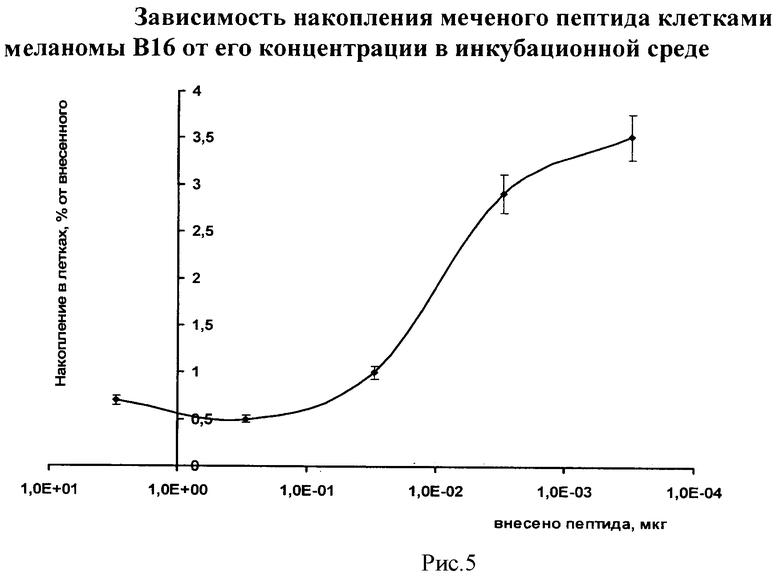
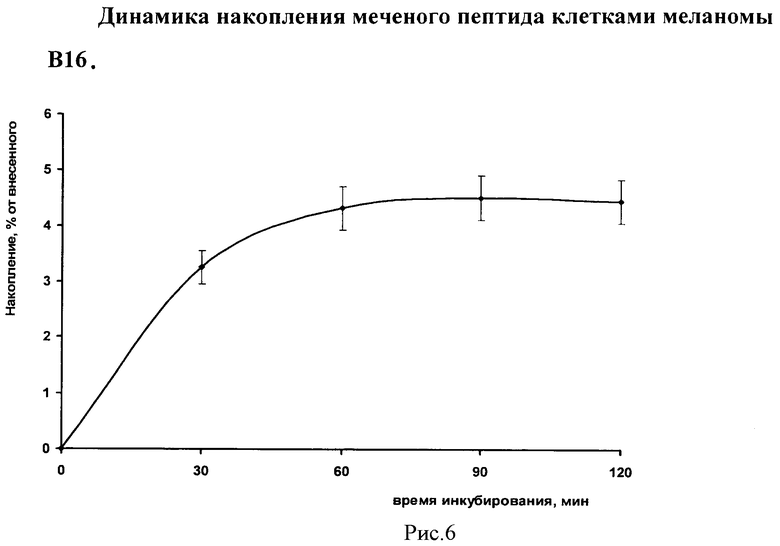
На рис.5 приведены полученные данные об уровне связывания 99mTc-αМСГлп клетками меланомы в зависимости от концентрации меченого соединения в инкубационной среде.
При внесении в инкубационную среду 99mTc-аМСГлп максимальное накопление в клетках меланомы В16 достигается в диапазоне концентраций 3·10-4-3·10-3 мкг/мл.
Для определения максимального уровня связывания исследовали динамику накопления 99mTc-аМСГлп клетками меланомы. Клетки готовили аналогичным способом, но в отдельных опытах инкубировали в течение 30, 60, 90 и 120 минут с внесенным в инкубационную среду 99mTc-аМСГлп в оптимальной концентрации 3·10-4 мкг/мл. Радиоактивный раствор удаляли троекратно путем осаждения центрифугированием и промыванием раствором Хэнкса. Радиоактивность проб и уровень связывания оценивали как в предыдущем эксперименте. Каждая точка была взята в триплетах.
На рис.6 приведены данные о зависимости уровня накопления 99mTc-αМСГлп клетками меланомы В16 от времени инкубации.
Инкубирование в течение двух часов клеток меланомы В16 с 99mTc-αМСГлп, внесенным в инкубационную среду в оптимальной концентрации, обеспечивает уровень связывания более 4% от внесенной дозы уже к 60 мин инкубации, достигая 4,4% к 120 мин, что принято оценивать как высокий результат. Для сравнения, уровень связывания клетками меланомы В16 меченного 99mTc прототипа (I), на 120 мин инкубации был несколько меньше - до 4,1%.
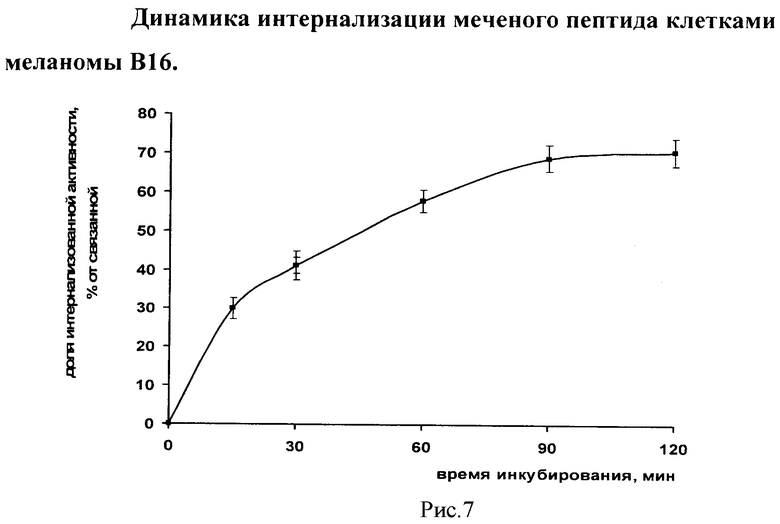
Пример 7. Исследование интернализации линейного пептида, меченного 99mTc, опухолевыми клетками
Интернализация была определена как включение меченого соединения в клеточные структуры путем их поглощения. Клетки меланомы В16, находящиеся в монослое, промывали охлажденной средой, содержащей 1% бычьей сыворотки. Затем из монослоя получали суспензию клеток. В каждую пробирку, содержащую 1·106 клеток, вносили радиоактивный раствор 99mTc-αМСГлп в концентрации, указанной ранее. Клетки в триплетах для каждой временной точки, инкубировали при 37°C в течение 15, 30, 60, 90 и 120 мин. Инкубирование прерывали путем охлаждения пробирок, центрифугирования и промывания суспензии клеток охлажденной до 4°С средой. Затем, в суспензию клеток вносили глициновый буферный раствор (50 мМ, pH 2,8, 0,1 М NaCl). В течение 5 мин клетки инкубировали в буферном растворе при комнатной температуре. При инкубировании в таких условиях, с поверхности мембран удаляется связанное соединение, не затрагивая при этом цитоплазматические структуры клеток. Клетки осаждали центрифугированием, супернатант удаляли и подвергали радиометрии. Осадок клеток лизировали раствором 1н. NaOH и также подвергали прямой радиометрии. Интернализацию определяли как отношение интернализованной активности к общей активности, связанной клетками (т.е. интернализованной активности и фракции, связанной с рецепторами, расположенными на мембранах). Динамика процесса интернализации 99mTc-αМСГлп показана на рисунке 7.
В данном примере показано связывание 99mTc-αМСГлп с рецепторами, расположенными на мембране клеток меланомы и проникновение его внутрь клетки. Уже через 60 минут после начала инкубирования во внутренние структуры опухолевых клеток включается до 60% от связанной клетками активности, соответственно менее 40% связанной активности остается фиксированными на мембранных рецепторах. К 90 мин достигается максимальный уровень интернализации (70%), который далее сохраняется неизменным в течение остального периода наблюдения. Такая динамика и уровень интернализации считаются оптимальными как критерии оценки степени аффинности пептидного аналога αМСГ к MC1R рецепторам клеток меланомы, что, в частности, определяет перспективность 99mTc-аМСГлп как основного компонента РФП для СПЭКТ диагностики меланомы. Для сравнения, уровень интернализации прототипа (I) на 120 мин инкубации с клетками меланомы В16 был существенно ниже и составил лишь 40%, что указывает на снижение связывания с рецепторами клеток меланомы исходно высокоаффинного аналога αМСГ при его мечении 99mTc через карбонильную хелатирующую группу.
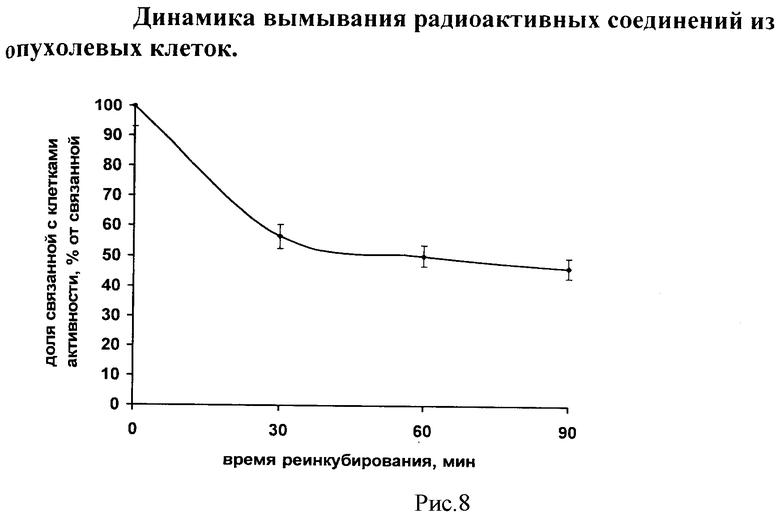
Пример 8. Исследование прочности связывания РФП на основе линейного пептида, меченного 99mTc, с опухолевыми клетками.
Исследование прочности связывания 99mTc-αМСГлп с опухолевыми клетками было проведено с целью косвенной оценки функциональной пригодности РФП на его основе в качестве средства диагностики меланомы in vivo. Для этого были смоделированы условия живого организма: клетки инкубировали в среде, состав которой приближен к составу плазмы крови, температура инкубирования составляла 36,8°C. Прочность связывания была изучена методом вымывания. Для максимального исключения повреждения клеток во время манипулирования с ними, данный эксперимент был осуществлен с монослоями клеточной культуры. В культуральные флаконы, содержащие полноценный монослой клеток и 5 мл культуральной среды, вносили 200 мкл 99mTc-αМСГлп. Клетки инкубировали до достижения максимального накопления изучаемого соединения. Затем радиоактивный раствор удаляли, монослой трижды аккуратно промывали раствором Хэнкса и вносили 5 мл свежей среды. Методом прямой радиометрии определяли уровень накопленной клетками активности. Затем культуральные флаконы вновь помещали в инкубатор и начинали процедуру реинкубирования, во время которой через определенные промежутки времени отбирали пробу культуральной среды (аликвоту). Аликвоты среды также подвергались радиометрии. По окончании была определена динамика вымывания радиоактивных продуктов из клеток в окружающую среду.
Процедуру радиометрии полученных проб осуществляли на автоматическом γ-счетчике Wizard 2480 фирмы "PerkinElmer LAS/Wallac" (Финляндия).
Динамика вымывания радиоактивных продуктов из клеток меланомы В16 в культуральную среду представлена на рисунке 8.
В данном примере регистрировали появление радиоактивного изотопа 99mTc в культуральной среде, не идентифицируя тех соединений, с которыми он был связан.
Как видно из приведенных данных, процесс вымывания радиоактивных продуктов из клеточных структур клеток меланомы В16 в окружающую среду имеет двойственную природу. Вначале, в течение первых 30 мин доля связанной с клетками активности быстро снижалась, но далее снижение резко замедлялось, а связанная активность оставалась высокой - около 60%. Далее продолжалось медленное высвобождение связанной клетками активности за счет выделения меченого пептида или его метаболизированных фрагментов из клеток. При этом через 90 мин реинкубирования до 50% активности оставалось внутри клеток. Что указывает на высокую прочность и длительность связывания меченого пептида с внутренними структурами клеток меланомы и дает хороший прогноз для возможности использования РФП на основе предложенного по изобретению линейного пептида, меченного 99mTc, в качестве способа диагностики меланомы и ее метастазов.
Таким образом, представленные примеры показывают преимущества, высокую функциональную пригодность и перспективность использования предложенного линейного пептидного аналога α-MSH, меченного 99mTc:
Ac-Nle-Asp-His-dPhe-Arg-Trp-Lys-[(Gly-Cys-Gly-Cys)-99mTc]-NH2
в качестве селективной векторной молекулы в составе радиофармацевтического препарата для диагностики меланомы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОКТАПЕПТИД ДЛЯ ПОЛУЧЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ, РАДИОФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ И СПОСОБ ДИАГНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ СОМАТОСТАТИНОВЫЕ РЕЦЕПТОРЫ | 2011 |
|
RU2457215C1 |
| ЦИКЛИЧЕСКИЙ ОКТАПЕПТИД, РАДИОФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ И СПОСОБ ПРИМЕНЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКОГО СРЕДСТВА ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ (ФАРМАЦЕВТИЧЕСКИХ) СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ, ЭКСПРЕССИРУЮЩИХ СОМАТОСТАТИНОВЫЕ РЕЦЕПТОРЫ | 2013 |
|
RU2528414C1 |
| КОНЪЮГАТЫ АНТАГОНИСТА ПЕПТИДА АНАЛОГА БОМБЕЗИНА | 2009 |
|
RU2523531C2 |
| МЕЧЕНЫЕ РАДИОАКТИВНЫМ ИЗОТОПОМ ПЕПТИДЫ ДЛЯ ДИАГНОСТИКИ И ТЕРАПИИ | 1996 |
|
RU2171117C2 |
| ПЕПТИДНЫЕ ВЕКТОРЫ | 2004 |
|
RU2361876C2 |
| УСОВЕРШЕНСТВОВАННЫЕ ПЕПТИДНЫЕ СОЕДИНЕНИЯ, ВЫСВОБОЖДАЮЩИЕ ГАСТРИН | 2003 |
|
RU2330859C2 |
| ЛИОФИЛИЗАТ ДЛЯ ПРИГОТОВЛЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКОГО ПРЕПАРАТА | 2017 |
|
RU2702238C2 |
| ЦИКЛОПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1996 |
|
RU2157379C2 |
| АНТАГОНИСТЫ GRPR ДЛЯ ОБНАРУЖЕНИЯ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ GRPR-ПОЗИТИВНОГО ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2013 |
|
RU2693465C2 |
| АНТАГОНИСТЫ GRPR ДЛЯ ОБНАРУЖЕНИЯ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ GRPR-ПОЗИТИВНОГО ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2013 |
|
RU2821944C2 |

Изобретение относится к химико-фармацевтической промышленности и касается создания радиофармацевтических препаратов (РФП) на основе пептидных аналогов нейрорегуляторных пептидов, меченных радиоизотопами, с целью диагностики раковых опухолей. Сущность изобретения: радиофармацевтический препарат для диагностики меланомы и ее метастазов, содержащий линейный гептапептид формулы: Ac-Nle-Asp-His-dPhe-Arg-Trp-Lys-NH2, меченный 99mTc через пептидную хелатирующую группу формулы: Gly-Cys-Gly-Cys-H, ковалентно связанную с ε-аминогруппой C-концевого лизина. Данное изобретение позволяет быстро и эффективно диагностировать раковые опухоли. 8 ил., 1 табл., 8 пр.
Радиофармацевтический препарат для диагностики меланомы и ее метастазов, содержащий линейный пептид, меченный 99mTc через хелатирующую группу (X), ковалентно связанную с ε-аминогруппой С-концевого лизина, отличающийся тем, что, с целью повышения качества диагностики используют линейный гептапептид формулы:
Ac-Nle-Asp-His-dPhe-Arg-Trp-Lys-NH2,
а в качестве хелатирующей группы (X) используют пептидное соединение формулы:
Gly-Cys-Gly-Cys-H.
| УСОВЕРШЕНСТВОВАННЫЕ КОНЪЮГАТЫ N4 ХЕЛАТООБРАЗУЮЩИХ АГЕНТОВ | 2005 |
|
RU2360701C2 |
| US 0005997844 A1, 07.12.1999 A1 | |||
| КЛЕМЕНТЬЕВА О.Е | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Автореферат диссертации на соискание ученой степени кандидата биологических наук | |||
| - М., 2001, с.7-19 | |||
| Edited by K.E.GERMAN ET AL | |||
| Associate | |||
Авторы
Даты
2012-10-27—Публикация
2011-04-27—Подача