В настоящем изобретении предлагаются комбинация, включающая в качестве компонентов (а) 3-(3-диметиламино-1-этил-2-метилпропил)фенол и (б) один или более нестероидных противовоспалительных препаратов (НПВП), фармацевтическая соль, включающая указанные компоненты, производные указанных компонентов, фармацевтический состав и лекарственная форма, включающая указанную комбинацию, соль или соединение, а также способ лечения боли, например хронической или острой боли, у млекопитающих, и указанный способ заключается в том, что компонент (а) вводят перед введением компонента (б) или после его введения, и компоненты (а) и (б) вводят одновременно или последовательно млекопитающему одним и тем же способом или различными способами.
В медицине чрезвычайно важным является лечение состояний хронической или острой боли. В настоящее время во всем мире существует необходимость в разработке не только опиоидных средств, но и высокоэффективных способов лечения боли.
В последнее время опубликовано множество работ в области разработки анальгетиков и фундаментальных исследований нотисепции, в которых обсуждается острая необходимость в действии лекарственных средств с учетом состояния пациента и в разработке способов лечения, направленных на лечение боли для обеспечения эффективного и удовлетворительного лечения боли у пациента.
Даже если анальгетики, используемые в настоящее время для лечения боли, например опиоиды, ингибиторы обратного захвата NA и 5НТ, нестероидные противовоспалительные препараты (НПВП) и ингибиторы СОХ, оказывают эффективный обезболивающий эффект, они, тем не менее, в некоторых случаях обладают побочными эффектами. В патенте WO 2004/047823 описаны комбинации веществ, включающие некоторые анальгетики, например, соединения 1-фенил-3-диметиламинопропана и ингибиторы COX-II, которые проявляют супераддитивный эффект при введении. Благодаря такому супераддитивному эффекту можно снизить общую дозу и, соответственно, риск побочных эффектов.
Таким образом, объектом настоящего изобретения является поиск других комбинаций, пригодных для лечения боли и предпочтительно проявляющих сниженные нежелательные побочные эффекты, по сравнению с индивидуальными компонентами, введенными в эффективных дозах.
Было установлено, что фармацевтическая комбинация, включающая (а) 3-(3-диметиламино-1-этил-2-метилпропил)фенол и (б) по крайней мере один НПВП, проявляет обезболивающее действие. Если эти компоненты присутствуют в комбинации в массовом соотношении, при котором после введения пациенту наблюдается синергетический эффект, общую вводимую дозу можно уменьшить, снижая тем самым нежелательные побочные эффекты.
Таким образом, настоящее изобретение относится к комбинации, включающей в качестве компонентов:
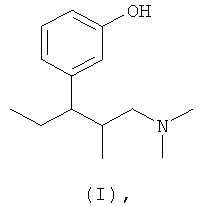
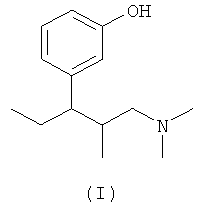
(а) 3-(3-диметиламино-1-этил-2-метилпропил)фенол формулы (I)
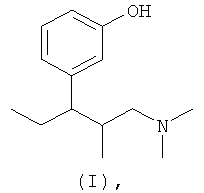
необязательно в форме одного из индивидуальных стереоизомеров, прежде всего, энантиометра или диастереомера, рацемата или в форме смеси стереоизомеров, прежде всего, энантиомеров и/или диастереомеров, в любом соотношении, или любые соответствующие кислотно-аддитивные соли, или любые их сольваты, и
(б) один или более НПВП.
В одном варианте осуществления компонент (а) в составе комбинации по изобретению выбирают из следующих соединений:
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1R,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол или любая смесь указанных соединений.
В другом варианте осуществления компонент (а) в составе комбинации по изобретению выбирают из следующих соединений:
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол или любая смесь указанных соединений.
В еще одном варианте осуществления комбинация включает:
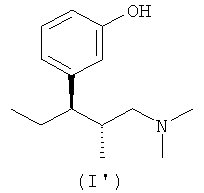
(а) (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол формулы (I')
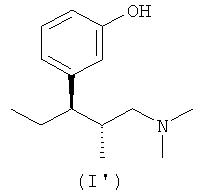
или его кислотно-аддитивную соль, и
(б) один или более НПВП.
3-(3-Диметиламино-1-этил-2-метилпропил)фенол формулы (I), его стереоизомеры и соответствующие соли, а также способы их получения описаны в литературе, например в патенте US 6248737 В1. Соответствующие части описания включены в данное описание в качестве ссылки и являются частью настоящего описания.
Компонент (а), использованный в данном контексте, включает 3-(3-диметиламино-1-этил-2-метилпропил)фенол и его стереоизомеры в любых возможных формах, прежде всего включая сольваты, кислотно-аддитивные соли и соответствующие сольваты и полиморфные формы.
Если любой из компонентов, прежде всего компонент (а), присутствует в виде смеси энантиомеров, такая смесь может содержать энантиомеры в рацемической или нерацемической форме. Нерацемическая форма, например, содержит энантиомеры в соотношении 60:40, 70:30, 80:20 или 90:10.
3-(3-Диметиламино-1-этил-2-метилпропил)фенол и его стереоизомеры, соответствующие компоненту (а), могут присутствовать в фармацевтической композиции по изобретению в форме кислотно-аддитивной соли, которую получают с использованием любой пригодной кислоты.
Превращение 3-(3-диметиламино-1-этил-2-метилпропил)фенола в соответствующую кислотно-аддитивную соль проводят известным методом при взаимодействии с пригодной кислотой. Пригодные кислоты включают, без ограничения перечисленным, соляную кислоту, бромистоводородную кислоту, серную кислоту, метансульфоновую кислоту, муравьиную кислоту, уксусную кислоту, щавелевую кислоту, янтарную кислоту, винную кислоту, миндальную кислоту, фумаровую кислоту, молочную кислоту, лимонную кислоту, глутаминовую кислоту и/или аспарагиновую кислоту. Образование соли предпочтительно проводят в растворителе, например диэтиловом эфире, диизопропиловом эфире, акилацетатах, ацетоне и/или 2-бутаноне. Более того, для получения гидрохлоридов также используют триметилхлорсилан в водном растворе.
Известно, что обезболивающее действие НПВП основано на ингибировании ферментативного образования простагландинов, причем циклооксигеназа (СОХ) является ключевым ферментом в превращении арахидоновой кислоты, образующейся из липидов клеточной мембраны, в простагландины и другие эйкозаноиды. СОХ существует в двух различных изоформах, характеризующихся различными особенностями экспрессии. COX-I конститутивно экспрессируется во многих клетках организма и отвечает, главным образом, за продуцирование эйкозаноидов, выполняющих нормальные физиологические функции. Экспрессия COX-II индуцируется при воспалении, а также COX-II экспрессируется в центральной нервной системе.
Термин "нестероидный противовоспалительный лекарственный препарат (НПВП)", используемый в настоящем описании, означает соединения, проявляющие, главным образом, специфическую ингибирующую активность, селективную в отношении COX-I или в отношении смеси COX-I/II, таким образом, селективные ингибиторы COX-II не включены в указанный термин. Термин НПВП, т.е. компонент (б), используемый в настоящем описании, включает любые возможные формы НПВП, прежде всего, включая стереоизомеры, такие как энантиомеры, сольваты, соли и их соответствующие сольваты и полиморфные формы. Например, термин ибупрофен, используемый в настоящем описании, прежде всего, включает его рацемические смеси, его нерацемические смеси, и его индивидуальный стереоизомер, такой как (S)-(+)-ибупрофен, термин диклофенак, используемый в настоящем описании, прежде всего, включает натриевую соль диклофенака.
НПВП, также как и способы их получения, известны и представлены, например, в справочниках Е.Friderichs и др. "Analgesics and Antipyretics", Ullmann's Encyclopedia of Industrial Chemistry, 6-е изд., Wiley-VCH Verlag GmbH, Германия, стр.1-22 (2000) и Н.Buschmann, Т.Christoph, Е.Friderichs, С.Maul, В.Sundermann, "Analgesics - From Chemistry and Pharmacology to Clinical Application", ч.II, Wiley-VCH Verlag, Германия (2002). Соответствующие части указанных публикаций включены в настоящее описание в качестве ссылки и являются частью настоящего описания.
В одном варианте компонент (б) комбинации по настоящему изобретению выбирают из группы, включающей ацеметацин, ацетилсалициловую кислоту, буфексамак, диклофенак, дифлунизал, дипирон (метамизол), этензамид, этофенамат, флуфенамовую кислоту, флурбипрофен, ибупрофен, индометацин, изоксикам, кебузон, кетопрофен, кеторолак, лоназолак, лорноксикам, меклофенамовую кислоту, мефенамовую кислоту, мофебутазон, набуметон, напроксен, (+)-ибупрофен, (-)-ибупрофен, (+)-напроксен, нифлуминовую кислоту, оксапрозин, оксифенбутазон, фенилбутазон, пироксикам, пропифеназон, салициламид, сулиндак, теноксикам, тиапрофеновую кислоту, SC560, сульфасалазин и толметин.
В другом варианте компонент (б) комбинации по настоящему изобретению выбирают из группы, включающей ацеметацин, ацетилсалициловую кислоту, буфексамак, диклофенак, натриевую соль диклофенака, дифлунизал, дипирон (метамизол), натриевую соль метамизола, этензамид, этофенамат, флуфенамовую кислоту, флурбипрофен, ибупрофен, индометацин, изоксикам, кебузон, кетопрофен, кеторолак, лоназолак, лорноксикам, меклофенамовую кислоту, мефенамовую кислоту, мофебутазон, набуметон, напроксен, (+)-ибупрофен, (-)-ибупрофен, (+)-напроксен, нифлуминовую кислоту, оксапрозин, оксифенбутазон, фенилбутазон, пироксикам, пропифеназон, салициламид, сулиндак, теноксикам, тиапрофеновую кислоту, SC560, сульфасалазин и толметин.
В еще одном варианте компонент (б) комбинации по настоящему изобретению выбирают из группы, включающей ацетилсалициловую кислоту, диклофенак, натриевую соль диклофенака, дипирон (метамизол), натриевую соль метамизола, флурбипрофен, ибупрофен, изоксикам, кетопрофен, напроксен, (+)-ибупрофен, (-)-ибупрофен, (+)-напроксен, фенилбутазон и пироксикам.
В другом варианте компонент (б) комбинации по настоящему изобретению выбирают из группы, включающей ацетилсалициловую кислоту, диклофенак, натриевую соль диклофенака, флурбипрофен, ибупрофен, изоксикам, кетопрофен, напроксен, (+)-ибупрофен, (-)-ибупрофен, (+)-напроксен, фенилбутазон и пироксикам.
В одном варианте компонент (б) комбинации по настоящему изобретению выбирают из группы, включающей диклофенак, натриевую соль диклофенака, дипирон (метамизол), натриевую соль метамизола, ибупрофен, напроксен, (+)-напроксен и кетопрофен.
В еще одном варианте компонент (б) комбинации по настоящему изобретению выбирают из группы, включающей диклофенак и ибупрофен.
В другом варианте компонент (б) комбинации по настоящему изобретению выбирают из группы, включающей метамизол, натриевую соль метамизола, кетопрофен, напроксен, (+)-напроксен.
Другие специфические варианты осуществления настоящего изобретения включают следующие комбинации:
(а) (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол или его гидрохлорид и (б) диклофенак, и
(а) (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол или его гидрохлорид и (б) ибупрофен.
Другие специфические варианты осуществления настоящего изобретения включают комбинации, выбранные из группы, включающей
(а) (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол или его гидрохлорид и (б) натриевую соль диклофенака,
(а) (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол или его гидрохлорид и (б) (+)-напроксен,
(а) (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол или его гидрохлорид и (б) кетопрофен, и
(а) (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол или его гидрохлорид и (б) натриевую соль метамизола.
Если компонентами комбинации по изобретению являются диклофенак или ибупрофен, то эти соединения вводят в стандартной суточной дозе. Предпочтительно, суточная доза диклофенака, вводимая пациенту, составляет от 25 до 300 мг, прежде всего, предпочтительно от 35 до 200, еще более предпочтительно от 50 до 150 мг. Предпочтительно, суточная доза ибупрофена, вводимая пациенту, составляет от 300 до 2400 мг, прежде всего, предпочтительно от 350 до 1600, еще более предпочтительно от 400 до 1200 мг.
Если компонентами комбинации по настоящему изобретению являются (+)-напроксен, кетопрофен, натриевая соль метамизола, то эти соединения вводят в стандартной суточной дозе. Предпочтительно суточная доза (+)-напроксена, вводимая пациенту, составляет от 1 до 1500 мг, более предпочтительно от 5 до 1250 мг.
Предпочтительно, суточная доза кетопрофена, вводимая пациенту, составляет от 1 до 250 мг, более предпочтительно от 5 до 200 мг.
Предпочтительно, суточная доза натриевой соли метамизола, вводимая пациенту, составляет от 1 до 4500 мг, более предпочтительно от 5 до 4000 мг.
Суточная доза (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола, вводимая пациенту, предпочтительно составляет от 25 до 1000 мг, прежде всего, предпочтительно от 50 до 800 мг, более предпочтительно от 100 до 600 мг.
В другом варианте осуществления настоящего изобретения комбинация по изобретению содержит компоненты (а) и (б) в равноэффективном соотношении.
В еще одном варианте осуществления компоненты (а) и (б) в составе комбинации по изобретению содержатся в массовом соотношении, при котором полученная композиция проявляет синергетический эффект при введении пациенту. Пригодные массовые соотношения можно определить известными методами, например по методике Рэндалла-Селитто, описанной ниже.
Оба компонента (а) и (б) могут содержаться в комбинации по изобретению в соотношениях, отличающихся от равноэффективного. Например, содержание каждого из компонентов может составлять от 1/5 до 5-кратного количества от равноэффективного количества, предпочтительно от 1/4 до 4-кратного, более предпочтительно от 1/3 до 3-кратного, и еще более предпочтительно от 1/2 до 2-кратного.
В другом варианте осуществления настоящего изобретения компоненты (а) и (б) вводят в специальных дозировках для лечения боли, например хронической или острой боли. Компоненты (а) и (б) вводят одновременно или последовательно, один за другим, в каждом случае одним и тем же или различными способами. Следовательно, другим объектом настоящего изобретения является способ лечения боли, например хронической или острой боли, заключающийся в том, что компоненты (а) и (б) вводят млекопитающему одновременно или последовательно, причем компонент (а) вводят перед компонентом (б) или после него, и компоненты (а) и (б) вводят млекопитающему одним и тем же или различными способами. Пригодные способы введения включают, без ограничения перечисленным, пероральный, внутривенный, внутрибрюшинный, чрескожный, интратекальный, внутримышечный, интраназальный, чресслизистый, подкожный или ректальный способы.
Некоторые НПВП, такие как диклофенак и ибупрофен, содержат в структуре кислотные группы, например карбоксильные, и образуют кислотно-аддитивные соли 3-(3-диметиламино-1-этил-2-метилпропил)фенола формулы (I), и в результате оба компонента, (а) и (б), включены в состав одной и той же соли.
Таким образом, в другом варианте осуществления настоящего изобретения комбинация по изобретению включает компоненты (а) и (б) в форме соли, содержащей два указанных компонента. Образование такой соли может быть частичным, т.е. композиция по изобретению включает также один или оба компонента в свободной форме, или образование соли является практически полным.
Соответственно, другим объектом настоящего изобретения является соль, содержащая:
(а) по крайней мере, один 3-(3-диметиламино-1-этил-2-метилпропил)фенол формулы (I)

необязательно в форме одного из индивидуальных стереоизомеров, прежде всего, энантиомера или диастереомера, рацемата, или в форме смеси стереоизомеров, прежде всего, энантиомеров и/или диастереомеров, смешанных в любом соотношении, или любого сольвата указанных соединений, и
(б) один или более НПВП, содержащих функциональную группу, способную образовывать соль компонента (а).
В другом варианте осуществления настоящего изобретения предлагается фармацевтическая соль, в которой катионный компонент соли представляет (а) 3-(3-диметиламино-1-этил-2-метилпропил)фенол формулы (I), и анионный компонент соли представляет (б) кислотный НПВП.
В одном варианте компонент (а) в составе фармацевтической соли по настоящему изобретению выбирают из следующих соединений:
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1R,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, или любая смесь указанных соединений.
В другом варианте компонент (а) в составе фармацевтической соли по настоящему изобретению выбирают из следующих соединений:
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, или любая смесь указанных соединений.
В еще одном варианте осуществления компонентом (а) фармацевтической соли по настоящему изобретению является (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол формулы (I')
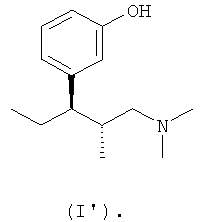
В еще одном варианте осуществления кислотный НПВП в составе фармацевтической соли по настоящему изобретению выбирают из ацетилсалициловой кислоты, диклофенака, дипирона (етамизола), флурбипрофена, ибупрофена, кетопрофена, напроксена, (+)-ибупрофена, (-)-ибупрофена и (+)-напроксена.
В другом варианте осуществления кислотный НПВП в составе фармацевтической соли по настоящему изобретению выбирают из группы, включающей диклофенак, дипирон (метамизол), ибупрофен, кетопрофен, и (+)-напроксен.
Специфические варианты фармацевтической соли по настоящему изобретению включают кислотно-аддитивные соли:
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола и диклофенака и
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола и ибупрофена.
Другие специфические варианты фармацевтической соли по настоящему изобретению включают кислотно-аддитивные соли:
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола и (+)-напроксена,
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенолаи кетопрофена и
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола и метамизола.
3-(3-Диметиламино-1-этил-2-метилпропил)фенол в качестве компонента (а) и НПВП в качестве компонента (б) можно также присоединить друг к другу, например, ковалентной связью. Такая ковалентная связь, например, образуется между фенольной гидроксильной группой компонента (а) и карбоксильной группой НПВП компонента (б), при этом образуется сложноэфирная связь.
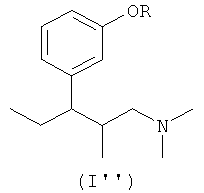
Соответственно, еще одним объектом настоящего изобретения является соединение общей формулы (I'')

где R означает фрагмент НПВП, связанный с атомом кислорода ковалентной связью,
необязательно в форме одного из индивидуальных стереоизомеров, прежде всего, энантиомера или диастереомера, рацемата, или в форме смеси стереоизомеров, прежде всего, энантиомеров и/или диастереомеров, смешанных в любом соотношении, или любой соответствующей соли, или любого сольвата указанных соединений.
В одном варианте осуществления изобретения соединение формулы (I'') получают из
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола,
(1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенола,
(1R,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенола,
(1S,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола, или любой смеси указанных соединений.
В другом варианте осуществления изобретения соединение формулы (I'') получают из
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола,
(1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенола, или любой смеси указанных соединений.
В еще одном варианте осуществления изобретения соединение формулы (I'') получают из (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола формулы (I')
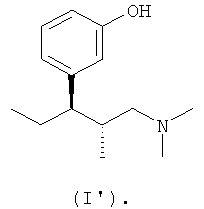
В другом варианте осуществления изобретения соединение формулы (I'') получают из кислотного НПВП, выбранного из ацетилсалициловой кислоты, диклофенака, дипирона (метамизола), флурбипрофена, ибупрофена, кетопрофена, напроксена, (+)-ибупрофена, (-)-ибупрофена и (+)-напроксена.
В еще одном варианте осуществления изобретения соединение формулы (I'') получают из кислотного НПВП, выбранного из группы, включающей диклофенак, дипирон (метамизол), ибупрофен, кетопрофен, и (+)-напроксен.
Комбинации, фармацевтические соли, и соединения формулы (I'') по настоящему изобретению являются токсикологически безопасными, и, следовательно, их можно использовать для лечения млекопитающих, прежде всего, человека, включая новорожденных, детей и взрослых.
Таким образом, другим объектом настоящего изобретения является фармацевтическая композиция, включающая описанную выше комбинацию по изобретению, и/или описанную выше фармацевтическую соль, и/или описанное выше соединение формулы (I'') и один или более вспомогательных агентов.
Еще одним объектом настоящего изобретения является фармацевтическая лекарственная форма, включающая описанную выше комбинацию по изобретению, и/или описанную выше фармацевтическую соль, и/или описанное выше соединение формулы (I'') и один или более вспомогательных агентов.
В одном варианте фармацевтическая лекарственная форма по изобретению дополнительно включает кофеин.
В другом варианте фармацевтическая лекарственная форма по изобретению является пригодной для перорального, внутривенного, внутрибрюшинного, чрескожного, интратекального, внутримышечного, интраназального, чресслизистого, подкожного или ректального способов введения.
Составы и лекарственные формы по изобретению содержат вспомогательные агенты, например носители, наполнители, растворители, разбавители, красители и/или связующие агенты. Выбор вспомогательных агентов и их количество зависит, например, от способа введения лекарственного средства, например перорального, внутривенного, внутрибрюшинного, внутрикожного, внутримышечного, интраназального или местного, например, для инъекций в кожу, слизистую оболочку или глаза.
Пригодными вспомогательными агентами в контексте настоящего изобретения являются любые известные вещества, применяемые для получения галеновых составов. Примеры пригодных вспомогательных агентов включают, без ограничения перечисленным, воду, этиловый спирт, 2-пропанол, глицерин, этиленгликоль, пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, глюкозу, фруктозу, лактозу, сахарозу, декстрозу, патоку, крахмал, модифицированный крахмал, желатин, сорбит, инозит, маннит, микрокристаллическую целлюлозу, метилцеллюлозу, карбоксиметилцеллюлозу, ацетатцеллюлозы, шеллак, цетиловый спирт, поливинилпирролидон, парафины, воски, природные и синтетические камеди, аравийскую камедь, альгинаты, декстран, насыщенные и ненасыщенные жирные кислоты, стеариновую кислоту, стеарат магния, стеарат цинка, глицерилстеарат, лаурилсульфат натрия, пищевые масла, кунжутное масло, кокосовое масло, арахисовое масло, соевое масло, лецитин, лактат натрия, сложные эфиры полиоксиэтилена и полипропилена и жирных кислот, сложный эфир сорбита и жирной кислоты, сорбиновую кислоту, бензойную кислоту, лимонную кислоту, аскорбиновую кислоту, дубильную кислоту, хлорид натрия, хлорид калия, хлорид магния, хлорид кальция, оксид магния, оксид цинка, диоксид кремния, оксид титана, диоксид титана, сульфат магния, сульфат цинка, сульфат кальция, карбонат калия, фосфат кальция, дикальцийфосфат, бромид калия, йодид калия, тальк, каолин, пектин, кросповидон, агар-агар и бентонит.
Фармацевтические составы (лекарственные формы) в виде таблеток, шипучих таблеток, жевательных таблеток, драже, капсул, капель, соков или сиропов, например, пригодны для перорального введения. Фармацевтические составы для перорального введения также получают в виде частиц, таких как гранулы, пеллеты, сферы, кристаллы и т.п., необязательно, спрессованных в таблетки, заполненных в капсулы, заполненных в пакетики или суспендированных в пригодной жидкой среде. Фармацевтические составы для перорального введения также покрывают энтеросолюбильным покрытием.
Фармацевтические составы, пригодные для парентерального, местного и ингаляционного введения, включают, без ограничения перечисленным, растворы, суспензии, диспергируемые сухие препараты и спреи.
Фармацевтические составы, пригодные для ректального введения, включают суппозитории. Для подкожного введения используют составы в виде резервуаров, в растворенной форме, в виде пластырей, необязательно с добавлением агентов, повышающих проницаемость через кожу.
Один или оба компонента (а) и (б) и/или фармацевтическая соль по изобретению и/или соединение формулы (I'') присутствуют в фармацевтическом составе по изобретению, по крайней мере, частично, в форме с контролируемым высвобождением. Более того, в фармацевтическом составе по изобретению указанные компоненты могут присутствовать в любой комбинации форм с контролируемым и быстрым высвобождением активного агента. Например, один или оба компонента могут высвобождаться из составов по изобретению с определенной задержкой, например, при пероральном, ректальном и подкожном способах введения. Такие составы, прежде всего, используются в препаратах, которые предназначены только для введения один или два раза в сутки. Для обеспечения контролируемого высвобождения используют известные пригодные материалы.
Фармацевтические составы по изобретению получают с применением известных материалов, средств, приборов и способов, описанных, например, в справочнике "Remington's Pharmaceutical Sciences", A.R.Gennaro (ред.), 17-е издание, Mack Publishing Company, Easton, Pa. (1985), прежде всего, часть 8, главы 76-93.
Для получения твердых фармацевтических составов, таких как, например, таблетки, компоненты фармацевтической композиции гранулируют в смеси с фармацевтическим носителем, например со стандартными ингредиентами для таблеток, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеарат магния, дикальций фосфат или фармацевтически приемлемые камеди, и фармацевтическими разбавителями, например водой, и получают гомогенное распределение компонентов в твердой композиции. Термин «гомогенное распределение» означает, что все компоненты равномерно распределены во всей композиции, таким образом указанную композицию можно разделить на стандартные лекарственные формы с равной эффективностью, такие как таблетки, пилюли или капсулы. Твердую композицию затем разделяют на стандартные лекарственные формы. На таблетки или пилюли, полученные из фармацевтической композиции по изобретению, можно наносить покрытия или перерабатывать их различными способами для получения лекарственных форм с контролируемым высвобождением.
Если необходимо, чтобы один из компонентов, например компонент (б), высвобождался раньше, чем другой компонент, например, по крайней мере, на 30 мин или 1 ч раньше, получают фармацевтические составы с соответствующим профилем высвобождения. Примером такого состава являются системы с осмотическим высвобождением, из которых обеспечивается замедленное высвобождение компонента (а) за счет нанесения покрытия, содержащего компонент (б), который, соответственно, высвобождается раньше. В системах с высвобождением такого типа, которые, прежде всего, пригодны для перорального введения, по крайней мере, часть, а предпочтительно весь поверхностный слой системы с высвобождением, предпочтительно только те части, которые контактируют со средой высвобождения, являются полупроницаемыми, и предпочтительно на систему нанесено полупроницаемое покрытие, и, таким образом, поверхностный слой(и) становится проницаемым для среды высвобождения, но в значительной степени, предпочтительно полностью, непроницаемым для активного ингредиента, компонента (а), так как поверхностный слой(и) и/или необязательно покрытие включают, по крайней мере, одно отверстие для высвобождения активного ингредиента, компонента (а). Более того, именно на тот(те) поверхностный(е) слой(и), который контактирует со средой высвобождения, наносят покрытие, содержащее и высвобождающее другой компонент, компонент (б). Предпочтительно такие системы получают в форме таблеток, включающих отверстие для высвобождения, ядро осмотической фармацевтической композиции, полупроницаемую мембрану и полимерную часть, которая оказывает давление при разбухании. Пригодные примеры для систем такого типа включают системы, выпускаемые фирмой ALZA Corporation, США, под торговым названием OROS®, прежде всего, система OROS® Push-Pull™, система OROS® Push-Pull™ с замедленным высвобождением, многослойная система OROS® Push-Pull™, система OROS® Push-Stick, а также, в некоторых случаях, система L-OROS™.
Варианты осуществления изобретения и примеры систем с осмотическим высвобождением описаны в патентах US 4765989, 4783337 и 4612008, которые включены в настоящее описание в виде ссылки и в виде части описания настоящего изобретения.
Другой пример пригодной фармацевтической композиции включает таблетки с гелевой матрицей, такие как разработанные фирмой Penwest Phannaceuticals (например, TimeRX). Пригодные примеры описаны в патентах US 5330761, 5399362, 5472711 и 5455046, которые включены в настоящее описание в виде ссылки и в виде части описания настоящего изобретения. Прежде всего, пригодны составы, содержащие замедляющую высвобождение матрицу с негомогенным распределением фармацевтически активной композиции, при этом, например, компонент (б) распределен во внешнем слое (который быстрее контактирует со средой высвобождения) матрицы, а другой компонент (а) распределен внутри матрицы. При контактировании со средой высвобождения внешний слой матрицы сначала (и быстро) набухает и высвобождается компонент НПВП, и затем значительно позже высвобождается компонент (а). Примеры пригодных матриц включают матрицы, содержащие от 1 до 80 мас.% одного или более гидрофильных или гидрофобных полимеров в качестве фармацевтически приемлемых образующих матрицу агентов. Другой пример пригодной матрицы описан в патенте US 4389393, который включен в настоящее описание в виде ссылки и в виде части описания настоящего изобретения.
Количество фармацевтически активной комбинации, соли или соединения по изобретению, вводимое пациенту, зависит от различных известных факторов, например массы пациента, способа введения, или тяжести заболевания.
Другим объектом настоящего изобретения является применение описанной выше комбинации по изобретению, и/или фармацевтической соли, и/или описанного выше соединения формулы (I'') для получения лекарственного средства, предназначенного для лечения боли.
В другом варианте осуществления настоящего изобретения предлагается применение описанной выше комбинации по изобретению, и/или описанной выше фармацевтической соли, и/или описанного выше соединения формулы (I'') для получения лекарственного средства, предназначенного для лечения боли, и боль выбирают из группы, включающей воспалительную боль, невропатическую боль, острую боль, хроническую боль, висцеральную боль, мигрень и боли при раке.
В еще одном варианте осуществления настоящего изобретения предлагается способ лечения боли у млекопитающего, предпочтительно человека, который заключается в том, что млекопитающему вводят эффективное количество описанной выше комбинации по изобретению, и/или описанной выше фармацевтической соли, и/или описанного выше соединения формулы (I'').
Еще одним объектом настоящего изобретения является способ лечения боли у млекопитающего, предпочтительно человека, который заключается в том, что млекопитающему вводят эффективное количество описанной выше комбинации по изобретению, и/или описанной выше фармацевтической соли, и/или описанного выше соединения формулы (I''), и боль выбирают из группы, включающей воспалительную боль, невропатическую боль, острую боль, хроническую боль, висцеральную боль, мигрень и боли при раке.
Фармакологические методы испытаний
А. Испытания методом Рэндалла-Селитто на модели крыс
Массовое соотношение компонентов (а) и (б), при котором наблюдается супераддитивный эффект (синергетический эффект) фармацевтической композиции по изобретению, можно определить методом Рэндалла и Селитто, описанным в статье Arch. Int. Pharmacodyn., 111: 409-419 (1957), в котором используют модель животных с воспалительной болью. Соответствующая часть статьи включена в настоящее описание в виде ссылки и в виде части настоящего описания.
С помощью внутрибрюшинной инъекции 0,1 мл суспензии каррагенана в задней лапе крысы индуцировали отек, в котором через 4 ч вызывали боль, оказывая непрерывно возрастающее давление с помощью клейма (диаметр 2 мм). Антиноцицептивную и антигипералгезическую активность исследуемого соединения определяли в различные моменты времени после введения соединения. Измеряемым значением и в то же время конечным параметром болевых испытаний является давление, при котором наблюдается голосовая реакция крысы. Рассчитывали максимально возможный эффект, выраженный в процентах (% МРЕ). Максимальное оказываемое клеймом давление составляло 250 г. Число животных в группе n=10.
Полученные результаты для оценки супераддитивного эффекта фармацевтической композиции по изобретению, включающей компоненты (а) и (б), анализировали статистическим методом сравнения теоретического аддитивного значения ED50 с экспериментально рассчитанными значениями ED50 так называемой фиксированной комбинации (изоболографический анализ, как описано в статье Tallarida J.T., Porreca F., и Cowan A., Statistical analysis of drug-drug and site-site interactions with isobolograms. Life Sci, 45: 947-961 (1989)). Исследования взаимодействия компонентов, представленные в настоящем описании, проводили с использованием равноэффективных доз двух компонентов, рассчитанных из соотношения соответствующих значений ED50 компонентов, введенных каждый в отдельности.
А.
(1R,2R)-3-(3-Диметиламино-1-этил-2-метилпропил)фенол (А) вводили внутривенно (в/в), а НПВП, натриевую соль диклофенака и ибупрофен, вводили внутрибрюшинно (в/б). При введении только одного компонента А максимальный эффект достигался через 15 мин после введения (момент времени первого измерения) и рассчитанное значение ED50 составило 1,878 (1,694-2,065) мг/кг в/в. Натриевая соль диклофенака и ибупрофен вызывали дозозависимые обезболивающие эффекты и значения ED50 составили 145,4 (134,4-154,6) и 139,1 (128,3-148,9) мг/кг в/б, соответственно, при этом максимальный эффект наблюдался через 30 мин после введения. С учетом времени достижения соответствующих максимальных эффектов (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол вводили за 15 мин, а натриевую соль диклофенака и ибупрофен за 30 мин до проведения экспериментов по взаимодействию компонентов (т.е. натриевую соль диклофенака или ибупрофен вводили за 15 мин до (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола, соответственно). Таким образом, момент расчета значения ED50 комбинации соответствует моменту времени проявления максимального эффекта соответствующего соединения. Результаты изоболографического анализа свидетельствуют о том, что экспериментальные значения ED50 для комбинации значительно ниже, чем соответствующие теоретические значения ED50. Таким образом, испытания комбинации свидетельствуют о значительном синергетическом взаимодействии (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола и обоих НПВП, натриевой соли диклофенака и ибупрофена.
Результаты изоболографического анализа суммированы в следующей таблице.

В.
(1R,2R)-3-(3-Диметиламино-1-этил-2-метилпропил)фенол (А) вводили внутривенно (в/в), а НПВП, (+)-напроксен, кетопрофен или натриевую соль метамизола, вводили внутрибрюшинно (в/б). При введении только одного компонента А максимальный эффект достигался через 15 мин после введения (момент времени первого измерения) и рассчитанное значение ED50 составило 1,88 (1,70-2,07) мг/кг в/в. (+)-Напроксен, кетопрофен или натриевая соль метамизола вызывали дозозависимые обезболивающие эффекты и значения ED50 составили 164 (158-169), 224 (210-237) и 88,1 (77,5-98,3) мг/кг в/б, соответственно, при этом максимальный эффект наблюдался через 45 мин после введения. С учетом времени достижения их соответствующих максимальных эффектов (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол вводили за 15 мин, а (+)-напроксен, кетопрофен или натриевую соль метамизола вводили за 45 мин до проведения экспериментов по взаимодействию компонентов (т.е. (+)-напроксен, кетопрофен или натриевую соль метамизола вводили за 30 мин до (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола, соответственно). Таким образом, момент расчета значения ED50 комбинации соответствует моменту времени проявления максимального эффекта соответствующего соединения. Испытания комбинации свидетельствуют о значительном синергетическом взаимодействии (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола и обоих НПВП, кетопрофена и натриевой соли метамизола, и об аддитивном взаимодействии (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола и напроксена.
Результаты изоболографического анализа суммированы в таблице 2.

Соотношение соединения А и (+)-напроксена, использованное в экспериментах, составляло 1:87,3, соотношение соединения А и кетопрофена - 1:119 и соотношение соединения А и натриевой соли метамизола - 1:46,9.
Следующие примеры приведены только для иллюстрации сущности изобретения и не ограничивают его объем.
Примеры
1. Получение 4-бутил-1,2-дифенилпиразолидин-3,5-диона и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенола (1:1)
3-((2R,3R)-1-(Диметиламино)-2-метилпентан-3-ил)фенол (250 мг) растворяли при нагревании в небольшом количестве этанола. 4-Бутил-1,2-дифенилпиразолидин-3,5-дион (фенилбутазон, 339 мг) растворяли при нагревании в смеси Н2О/этанол. Растворы смешивали, нагревали с обратным холодильником в течение 12 ч, охлаждали до комнатной температуры и выдерживали в течение ночи. Растворитель удаляли в вакууме и остаток сушили лиофильно, при этом получали твердое вещество белого цвета (589 мг).
2. Получение 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенилового эфира 2-(3-бензоилфенил)пропионовой кислоты
2-(3-Бензоилфенил)пропионовую кислоту (кетопрофен, 1,04 г, 4,257 ммоля) растворяли в дихлорметане (15 мл) и добавляли 4,4-диметиламинопиридин (43,3 мг, 0,387 ммоля) и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенол (1,0 г, 4,5 ммоля). Раствор охлаждали до 0°С и добавляли дициклогексилкарбодиимид (1,3 г, 6,3 ммоля) в дихлорметане (5 мл). Раствор перемешивали в течение 15 мин при 0°С и затем перемешивали в течение 48 ч при комнатной температуре. Реакционную смесь фильтровали, фильтрат промывали 0,5 М водным раствором соляной кислоты и водным раствором NaHCO3 (10%), сушили над сульфатом натрия и растворитель удаляли в вакууме, при этом получали твердое вещество белого цвета (2,16 г), которое затем очищали методом стандартной хроматографии.
3. Получение 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенилового эфира 2-(2-фторбифенил-4-ил)пропионовой кислоты
2-(2-Фторбифенил-4-ил)пропионовую кислоту (флурбипрофен, 1,04 г, 4,275 ммоля) растворяли в дихлорметане (15 мл) и добавляли 4,4-диметиламинопиридин (47,3 мг, 0,387 ммоля) и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенол (1,0 г, 4,5 ммоля). Раствор охлаждали до 0°С и добавляли дициклогексилкарбодиимид (1,3 г, 6,3 ммоля) в дихлорметане (15 мл). Раствор перемешивали в течение 15 мин при 0°С и затем перемешивали в течение 48 ч при комнатной температуре. Реакционную смесь фильтровали, фильтрат промывали 0,5 М водным раствором соляной кислоты и водным раствором NaHCO3 (10%), сушили над сульфатом натрия и растворитель удаляли в вакууме, при этом получали твердое вещество белого цвета (2,13 г), которое затем очищали методом стандартной хроматографии.
4. Получение 4-гидрокси-2-метил-N-2-пиридинил-2Н-1,2-бензотиазин-3-карбоксамид-1,1-диоксида и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенола (1:1)
4-Гидрокси-2-метил-N-2-пиридинил-2Н-1,2-бензотиазин-3-карбоксамид-1,1-диоксид (пироксикам, 302 мг) и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенол (200 мг) растворяли в небольшом количестве ацетона. Полученную смесь нагревали при 40°С в течение ночи и перемешивали в течение 24 ч при комнатной температуре. Растворитель удаляли в вакууме, и остаток высушивали лиофильно, при этом получали бесцветное масло (517 мг).
5. Получение 2-(2-фторбифенил-4-ил)пропионата ((2R,3R)-3-(3-гидроксифенил)-2-метилпентил)диметиламмония (1:1)
2-(2-Фторбифенил-4-ил)пропионовую кислоту (флурбипрофен, 220 мг, 0,903 ммоля) и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенол (200 мг, 0,903 ммоля) растворяли в небольшом количестве ацетона. Полученную смесь нагревали при 40°С в течение 13 ч и перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в вакууме, и остаток высушивали, при этом получали пену (450 мг).
6. Получение 4-гидрокси-2-метил-N-(5-метил-3-изоксазолил)-2Н-1,2-бензотиазин-3-карбоксамид-1,1-диоксида и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенола (1:1)
4-Гидрокси-2-метил-N-(5-метил-3-изоксазолил)-2Н-1,2-бензотиазин-3-карбоксамид-1,1-диоксид (изоксикам, 687 мг) и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенол (600 мг) растворяли в небольшом количестве ацетона. Полученную смесь нагревали при 40°С в течение ночи и перемешивали в течение 24 ч при комнатной температуре. Растворитель удаляли в вакууме и остаток высушивали лиофильно, при этом получали твердое вещество (350 мг).
7. Получение 2-(3-бензоилфенил)пропионата ((2R,3R)-3-(3-гидрокси6енил)-2-метилпентил)диметиламмония (1:1)
2-(3-Бензоилфенил)пропионовую кислоту (кетопрофен, 575 мг) и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенол (500 мг) растворяли в небольшом количестве ацетона. Полученную смесь перемешивали при комнатной температуре в течение 1 ч, нагревали при 40°С в течение 4 ч, охлаждали до комнатной температуры и выдерживали в течение ночи. Растворитель удаляли в вакууме и остаток высушивали лиофильно, при этом получали твердое вещество (740 мг).
8. Получение 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенилового эфира 2-(3-(2,6-дихлорфениламино)фенил)уксусной кислоты
2-(3-(2,6-Дихлорфениламино)фенил)уксусную кислоту (диклофенак, 761 мг, 2,57 ммоля) растворяли в дихлорметане (15 мл) и добавляли 4,4-диметиламинопиридин (27,6 мг, 0,23 ммоля) и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенол (600 мг, 2,71 ммоля). Раствор охлаждали до 0°С и добавляли дициклогексилкарбодиимид (759 мг, 3,79 ммоля) в дихлорметане (5 мл). Раствор перемешивали в течение 15 мин при 0°С и затем перемешивали в течение 48 ч при комнатной температуре. Реакционную смесь фильтровали, фильтрат промывали 0,5 М водным раствором соляной кислоты и водным раствором NaHCO3 (10%), сушили над сульфатом натрия и растворитель удаляли в вакууме, при этом получали твердое вещество белого цвета (1,40 г), которое затем очищали методом стандартной хроматографии.
9. Получение 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенилового эфира 2-(1-(4-хлорбензоил)-5-метокси-2-метил-1Н-индол-3-ил)уксусной кислоты
2-(1-(4-Хлорбензоил)5-метокси-2-метил-1Н-индол-3-ил)уксусную кислоту (индометазин, 1,53 г, 4,275 ммоля) растворяли в дихлорметане (15 мл), добавляли 4,4-диметиламинопиридин (47,3 мг, 0,387 ммоля) и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенол (1,0 г, 4,5 ммоля). Раствор охлаждали до 0°С и добавляли дициклогексилкарбодиимид (1,3 г, 6,3 ммоля) в дихлорметане (5 мл). Раствор перемешивали в течение 15 мин при 0°С и затем перемешивали в течение 48 ч при комнатной температуре. Реакционную смесь фильтровали, фильтрат промывали 0,5 М водным раствором соляной кислоты и водным раствором NaHCO3 (10%), сушили над сульфатом натрия и растворитель удаляли в вакууме, при этом получали твердое вещество белого цвета (1,84 г), которое затем очищали методом стандартной хроматографии.
10. Получение (S)-3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенилового эфира 2-(6-метоксинафталин-2-ил)пропионовой кислоты
(S)-2-(6-Метоксинафталин-2-ил)пропионовую кислоту ((S)-(+)-напроксен 0,98 г, 4,275 ммоля) растворяли в дихлорметане (15 мл), добавляли 4,4-диметиламинопиридин (47,3 мг, 0,387 ммоля) и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенол (1,0 г, 4,5 ммоля). Раствор охлаждали до 0°С и добавляли дициклогексилкарбодиимид (1,3 г, 6,3 ммоля) в дихлорметане (5 мл). Раствор перемешивали в течение 15 мин при 0°С и затем перемешивали в течение 48 ч при комнатной температуре. Реакционную смесь фильтровали, фильтрат промывали 0,5 М водным раствором соляной кислоты и водным раствором NaHCO3 (10%), сушили над сульфатом натрия и растворитель удаляли в вакууме, при этом получали твердое вещество белого цвета (1,54 г), которое затем очищали методом стандартной хроматографии.
11. Получение (2S)-3-(1-(диметиламино)-2-метилпентан-3-ил)фенилового эфира 2-(4-изобутилфенил)пропионовой кислоты
(R)-2-(4-Изобутилфенил)пропионовую кислоту (ибупрофен, 881 мг, 4,275 ммоля) растворяли в дихлорметане (15 мл), добавляли 4,4-диметиламинопиридин (47,3 мг, 0,387 ммоля) и 3-((2R,3R)-1-(диметиламино)-2-метилпентан-3-ил)фенол (1,0 г, 4,5 ммоля). Раствор охлаждали до 0°С и добавляли дициклогексилкарбодиимид (1,3 г, 6,3 ммоля) в дихлорметане (5 мл). Раствор перемешивали в течение 15 мин при 0°С и затем перемешивали в течение 48 ч при комнатной температуре. Реакционную смесь фильтровали, фильтрат промывали 0,5 М водным раствором соляной кислоты и водным раствором NaHCO3 (10%), сушили над сульфатом натрия и растворитель удаляли в вакууме, при этом получали твердое вещество белого цвета (2,0 г), которое затем очищали методом стандартной хроматографии.
12. Получение 3-(1-(диметиламино)-2-метилпентан-3-ил)фенилового эфира 2-(4-изобутилфенил)пропионовой кислоты
2-(4-Изобутилфенил)пропионовую кислоту (ибупрофен, 881 мг, 4,275 ммоля) растворяли в дихлорметане (15 мл), добавляли 4,4-диметиламинопиридин (47,3 мг, 0,387 ммоля) и 3-(1-(диметиламино)-2-метилпентан-3-ил)фенол (1,0 г, 4,5 ммоля). Раствор охлаждали до 0°С и добавляли дициклогексилкарбодиимид (1,4 г, 6,8 ммоля) в дихлорметане (5 мл). Раствор перемешивали в течение 15 мин при 0°С и затем перемешивали в течение 48 ч при комнатной температуре. Реакционную смесь фильтровали, фильтрат промывали 0,5 М водным раствором соляной кислоты и водным раствором NaHCO3 (10%), сушили над сульфатом натрия и растворитель удаляли в вакууме, при этом получали твердое вещество белого цвета (1,54 г), которое затем очищали методом стандартной хроматографии.
13. Получение 3-(1-(диметиламино)-2-метилпентан-3-ил)фенилового эфира 2-ацетоксибензойной кислоты
2-(Хлоркарбонил)фенилацетат (10 г, 50 ммоля) и 3-(1-(диметиламино)-2-метилпентан-3-ил)фенол (4,4 г, 19,9 ммоля) в дихлорметане (40 мл) перемешивали в течение ночи при комнатной температуре. Растворитель удаляли в вакууме и добавляли метилэтилкетон (40 мл), Н2О (0,4 мл), триметилхлорсилан (2,8 мл) и трет-бутилметиловый эфир. Растворитель удаляли в вакууме и выпавший осадок отделяли фильтрованием. Затем фильтрат сушили в вакууме, при этом получали твердое вещество белого цвета (4 г).
14. Получение ((1,5-диметил-3-оксо-2-фенилпиразолидин-4-ил)(метил)амино)метансульфоната 3-(1-(диметиламино)-2-метилпентан-3-ил)фенола
Натриевую соль ((1,5-диметил-3-оксо-2-фенилпиразолидин-4-ил)(метил)амино)метансульфоновой кислоты (дипирон (метамизол), 260,6 мг, 0,77 ммоля) и 3-(1-(диметиламино)-2-метилпентан-3-ил)фенол (200 мг, 0,77 ммоля) растворяли в небольшом количестве ацетона. Полученную смесь нагревали при 40°С в течение ночи и охлаждали до комнатной температуры. Растворитель удаляли в вакууме, добавляли ацетон и полученный осадок отделяли фильтрованием, при этом получали твердое вещество белого цвета (0,3 г).
15. Получение 2-ацетоксибензоата (3-(3-гидроксифенил)-N,N,2-триметилпентан-1-аммония
2-Ацетоксибензойную кислоту (405 мг, 2,5 ммоля) растворяли в воде. 3-(1-(Диметиламино)-2-метилпентан-3-ил)фенол (500 мг, 2,5 ммоля) растворяли при нагревании в этаноле. Оба раствора смешивали и нагревали с обратным холодильником в течение 4 ч. Растворитель удаляли в вакууме, при этом получали твердое вещество белого цвета (0,85 г).
16. Получение 2-(6-метоксинафталин-2-ил)пропиноата (3-(3-гидроксифенил)-N,N,2-триметилпентан-1-аммония
2-(6-Метоксинафталин-2-ил)пропионовую кислоту (напроксен, 518,1 мг, 2,25 ммоля) растворяли в воде. 3-(1-(Диметиламино)-2-метилпентан-3-ил)фенол (500 мг, 2,25 ммоля) растворяли при нагревании в этаноле. Оба раствора смешивали и нагревали с обратным холодильником в течение 7 ч. Растворитель удаляли в вакууме, при этом получали бесцветное масло, которое растворяли в небольшом количестве ацетона и гексана. После охлаждения до 4°С получали осадок, который отделяли фильтрованием.
17. Получение (R)-2-(4-изобутилфенил)пропиноата ((2R)-3-(3-гидроксифенил)-N,N,2-триметилпентан-1-аммония
(R)-2-(4-Изобутилфенил)пропионовую кислоту (464 мг, 2,25 ммоля) растворяли в ацетоне (1,7 мл) и нагревали при 40°С в течение 10 мин. Затем добавляли 3-(1-(диметиламино)-2-метилпентан-3-ил)фенол (500 мг, 2,25 ммоля), реакционную смесь нагревали при 40°С в течение 6 ч, охлаждали до комнатной температуры и выдерживали в течение ночи. Растворитель удаляли в вакууме и остаток охлаждали до 4°С. Образовавшийся осадок отделяли фильтрованием и получали требуемый продукт (350 мг).
18. Получение 2-(2-(2,6-дихлорфениламино)фенил)ацетата 3-(3-гидроксифенил)-N,N,2-триметилпентан-1-аммония
Диклофенак (267,6 мг, 0,9 ммоля) и 3-(1-(диметиламино)-2-метилпентан-3-ил)фенол (200 мг, 0,9 ммоля) растворяли при нагревании до 40°С в ацетоне (0,7 мл) в течение ночи. Растворитель удаляли в вакууме, снова добавляли ацетон, и реакционную смесь кристаллизовали при 4°С в течение ночи. Полученный осадок отделяли фильтрованием и высушивали, при этом получали требуемый продукт (125 мг).
Примеры фармацевтических лекарственных форм
19. Таблетки, содержащие натриевую соль диклофенака и (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол
Таблетки, содержащие (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол и натриевую соль диклофенака, получали в форме трехслойных таблеток, чтобы исключить образование соли вышеуказанных компонентов.
Слои для многослойной таблетки по изобретению сначала получали каждый в отдельности. Для этого слой, содержащий гидрохлорид (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенола, получали при смешивании соединения с микрокристаллической целлюлозой, тонкодисперсным диоксидом кремния и стеаратом магния в смесителе с кубическим барабаном.
Разделяющий слой получали при смешивании микрокристаллической целлюлозы, тонкодисперсного диоксида кремния и стеарата магния в смесителе с кубическим барабаном. Слой, содержащий натриевую соль диклофенака, получали при смешивании измельченной натриевой соли диклофенака, микрокристаллической целлюлозы, тонкодисперсного диоксида кремния и стеарата магния в смесителе с кубическим барабаном. Два слоя, содержащих активные вещества, вместе с расположенным между ними разделяющим слоем прессовали в одну стадию и получали трехслойные таблетки диаметром 12 мм. Для формирования таблетки каждый слой, соответственно, предварительно прессовали в эксцентриковой машине для таблетирования при малом давлении, а затем прессовали всю последовательность слоев.
Состав трехслойной таблетки
1-й слой: 250 мг
Разделяющий слой: 100 мг
3-й слой: 250 мг
20. Получение капсул, содержащих (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол и кетопрофен
Состав
Все соединения просеивали через сито с размером ячеек 1 мм, смешивали в барабанном смесителе и смесью заполняли твердые желатиновые капсулы размером 1, масса смеси в капсуле составляла 250 мг.
21. Получение таблеток, содержащих (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол и ибупрофен
Состав
Все соединения просеивали через сито с размером ячеек 1 мм, смешивали в барабанном смесителе и прессовали в прессе для таблетирования Korsch EKO, получали таблетки диаметром 12 мм и массой 500 мг.
Настоящее изобретение относится к комбинации, предназначенной для лечения боли, такой как воспалительная боль, невропатическая боль, острая боль, хроническая боль, висцеральная боль, мигрень, боли при раке. Комбинация включает: (а) по крайней мере, один 3-(3-диметиламино-1-этил-2-метилпропил)фенол формулы (I), необязательно в форме одного из его индивидуальных стереоизомеров, рацемата или смеси стереоизомеров, или в форме фармацевтически приемлемой кислотно-аддитивной соли, или в форме его сольвата в эффективном количестве, и (б) один или более нестероидных противовоспалительных препаратов (НПВП), выбранных из группы, включающей диклофенак, натриевую соль диклофенака, метамизол, натриевую соль метамизола, ибупрофен, кетопрофен, напроксен, (+)-ибупрофен, (-)-ибупрофен, (+)-напроксен в эффективном количестве. При этом введение компонентов комбинации может быть осуществлено одновременно или последовательно: соединение (а) вводят до или после соединения (б), одним и тем же, либо различными способами. Изобретение также относится к фармацевтической соли, образованной катионным компонентом (а) соединения 3-(3-диметиламино-1-этил-2-метилпропил)фенола формулы (I) и анионным компонентом (б) кислотного нестероидного противовоспалительного препарата (НПВП), а также соединению общей формулы (I''), в котором фенольная гидроксильная группа соединения а) и карбоксильная группа НПВП образуют ковалентную связь. 7 н. и 22 з.п. ф-лы, 2 табл., 21 пр.
1. Комбинация, предназначенная для лечения боли, включающая в качестве компонентов:
(а) по крайней мере один 3-(3-диметиламино-1-этил-2-метилпропил)фенол формулы (I)
необязательно в форме одного из его индивидуальных стереоизомеров, рацемата или смеси стереоизомеров, или в форме фармацевтически приемлемой кислотно-аддитивной соли, или в форме его сольвата в эффективном количестве, и
(б) один или более нестероидных противовоспалительных препаратов (НПВП), выбранных из группы, включающей диклофенак, натриевую соль диклофенака, метамизол, натриевую соль метамизола, ибупрофен, кетопрофен, напроксен, (+)-ибупрофен, (-)-ибупрофен, (+)-напроксен в эффективном количестве.
2. Комбинация по п.1, отличающаяся тем, что компонент (а) выбран из группы, включающей
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1R,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, или любую смесь указанных соединений.
3. Комбинация по п.2, отличающаяся тем, что компонент (а) выбран из группы, включающей (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, (1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, или любую смесь указанных соединений.
4. Комбинация по п.2, отличающаяся тем, что компонент (а) выбран из группы, включающей (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол формулы (I')
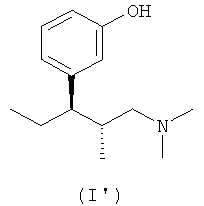
или его кислотно-аддитивная соль, предпочтительно гидрохлорид.
5. Комбинация по п.1, отличающаяся тем, что компонент (б) выбран из группы, включающей диклофенак, натриевую соль диклофенака, ибупрофен, кетопрофен, напроксен, (+)-ибупрофен, (-)-ибупрофен, (+)-напроксен.
6. Комбинация по п.1, отличающаяся тем, что компонент (б) выбран из группы, включающей диклофенак, натриевую соль диклофенака, ибупрофен, метамизол, натриевую соль метамизола, (+)-напроксен и кетопрофен.
7. Комбинация по п.1, отличающаяся тем, что компонент (б) выбран из группы, включающей диклофенак, натриевую соль диклофенака и ибупрофен.
8. Комбинация по п.1, отличающаяся тем, что компоненты (а) и (б) присутствуют в виде соли этих двух компонентов.
9. Комбинация по любому из пп.1-8, отличающаяся тем, что компоненты (а) и (б) присутствуют в массовом соотношении, при котором композиция проявляет синергетический эффект при введении пациенту.
10. Фармацевтическая соль, характеризующаяся тем, что катионный компонент соли образуется из (а) соединения 3-(3-диметиламино-1-этил-2-метилпропил)фенола формулы (I)

в форме одного из его индивидуальных стереоизомеров, рацемата или смеси стереоизомеров, или в форме его сольвата, и
анионный компонент соли образуется из (б) кислотного нестероидного противовоспалительного препарата (НПВП), выбранного из группы, включающей диклофенак, метамизол, ибупрофен, кетопрофен, напроксен, (+)-ибупрофен, (-)-ибупрофен и (+)-напроксен.
11. Фармацевтическая соль по п.10, отличающаяся тем, что катионный компонент соли образуется из (а) 3-(3-диметиламино-1-этил-2-метилпропил)фенола, а анионный компонент соли образуется из (б) кислотного НПВП.
12. Фармацевтическая соль по п.10, отличающаяся тем, что катионный компонент (а) выбран из группы, включающей
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1R,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, или любую смесь указанных соединений.
13. Фармацевтическая соль по п.12, отличающаяся тем, что компонент (а) выбран из группы, включающей (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, (1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, или любую смесь указанных соединений.
14. Фармацевтическая соль по п.12, отличающаяся тем, что компонентом (а) является (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол формулы (I')
15. Фармацевтически активная соль по п.10, отличающаяся тем, что кислотный НПВП выбран из группы, включающей диклофенак, метамизол, ибупрофен, кетопрофен, (+)-напроксен, напроксен.
16. Соединение общей формулы (I'')
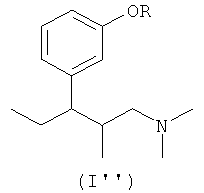
где R означает фрагмент кислотного нестероидного противовоспалительного препарата (НПВП), выбранного из группы, включающей диклофенак, метамизол, ибупрофен, кетопрофен, напроксен, (+)-ибупрофен, (-)-ибупрофен и (+)-напроксен, который присоединен к атому кислорода через ковалентную связь, необязательно в форме одного из его индивидуальных стереоизомеров, рацемата или смеси стереоизомеров, или в форме фармацевтически приемлемой кислотно-аддитивной соли, или в форме его сольвата.
17. Соединение по п.16, отличающееся тем, что ковалентная связь образуется между фенольной гидроксильной группой соединения общей формулы (I''), выбранной из
(1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1R,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол,
(1S,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, или любой смеси указанных соединений,
и карбоксильной группой НПВП.
18. Соединение по п.16, отличающееся тем, что фенольная гидроксильная группа соединения общей формулы (I'') представляет собой (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, (1R,2S)-3-(3-диметиламино-1-этил-2-метилпропил)фенол, или любую смесь указанных соединений.
19. Соединение по п.16, отличающееся тем, что фенольная гидроксильная группа соединения общей формулы (I'') представляет собой (1R,2R)-3-(3-диметиламино-1-этил-2-метилпропил)фенол формулы (I')

20. Соединение по п.16, отличающееся тем, что R означает диклофенак, метамизол, ибупрофен, кетопрофен, напроксен и (+)-напроксен.
21. Фармацевтическая композиция, предназначенная для лечения боли, включающая комбинацию по любому из пп.1-9, и/или фармацевтическую соль по любому из пп.10-15, и/или соединение формулы (I'') по любому из пп.16-20 в эффективном количестве, и необязательно один или более вспомогательных агентов.
22. Лекарственная форма, предназначенная для лечения боли, включающая комбинацию по любому из пп.1-9, и/или фармацевтическую соль по любому из пп.10-15, и/или соединение формулы (I'') по любому из пп.16-20 в эффективном количестве, и необязательно один или более вспомогательных агентов.
23. Лекарственная форма по п.22, отличающаяся тем, что она пригодна для перорального, внутривенного, внутрибрюшинного, внутрикожного, интратекального, внутримышечного, интраназального, чресслизистого, подкожного или ректального способов введения.
24. Лекарственная форма по п.22, отличающаяся тем, что один или оба компонента (а) или (б) присутствуют в составе формы с контролируемым высвобождением, и/или фармацевтическая соль присутствует в составе формы с контролируемым высвобождением, и/или соединение формулы (I'') присутствует в составе формы с контролируемым высвобождением.
25. Применение комбинации по любому из пп.1-9, и/или фармацевтической соли по любому из пп.10-15, и/или соединения по любому из пп.16-20 для получения лекарственного средства, предназначенного для лечения боли.
26. Применение по п.25, отличающееся тем, что боль выбрана из группы, включающей воспалительную боль, невропатическую боль, острую боль, хроническую боль, висцеральную боль, мигрень, боли при раке.
27. Способ лечения боли у млекопитающих, который заключается в том, что млекопитающему вводят комбинацию по любому из пп.1-9, и/или фармацевтическую соль по любому из пп.10-15, и/или соединение по любому из пп.16-20 в эффективном количестве.
28. Способ по п.27, отличающийся тем, что компоненты (а) и (б) в составе комбинации вводят млекопитающему одновременно или последовательно, и соединение (а) вводят до или после соединения (б), и соединения (а) и (б) вводят млекопитающему либо одним и тем же, либо различными способами.
29. Способ по п.27 или 28, отличающийся тем, что боль выбрана из группы, включающей воспалительную боль, невропатическую боль, острую боль, хроническую боль, висцеральную боль, мигрень, боли при раке.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЛИ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2002 |
|
RU2309942C2 |
| DE 4426245 A1, 22.02.1996 | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WO 00/51685 A1, 08.09.2000. | |||
Авторы
Даты
2012-10-27—Публикация
2007-04-25—Подача