Изобретение относится к области медицины, в частности к исследованию биологических материалов путем физико-химического анализа крови, основанного на иммунологических испытаниях и может быть использовано для диагностики гестоза в акушерской практике.
Гестоз - одно из наиболее распространенных осложнений беременности и наблюдается у 5-10% беременных женщин. Известно, что развитие гестоза протекает в два этапа:
- первый этап характеризуется нарушением инвазии трофобласта и гестационной трансформации спиральных артерий матки. Неравномерная перфузия плаценты приводит к местной ишемии и окислительному стрессу с образованием активных форм кислорода.
- второй этап связан с материнским ответом на пока неизвестный плацентарный фактор и последующее повреждение функции эндотелия сосудов, в итоге затрагивающее все материнские органы и приводящее к появлению симптомов заболевания (Olsson, M.G. Increased levels of cell-free hemoglobin, oxidation markers, and the antioxidative heme scavenger alpha(l)-microglobulin in preeclampsia / M.G.Olsson, M.Centlow, S.Rutardottir [et al.] // Free Radic Biol Med. - 2010. - Vol.48, №2. - P.284-291 [1]. Borekc, B. Placental tissue cyclo-oxygenase 1 and 2 in pre-eclamptic and normal pregnancy / B.Borekc, H.Aksoy, A.Toker, A.Ozkan // International Journal of Gynecology and Obstetrics. - 2006. - №95. - P.127-131 [2]. Hung, Т.Н. Hypoxia and reoxygenation: a possible mechanism for placental oxidative stress in preeclampsia / Т.Н.Hung, G.J.Burton // Taiwan J Obstet Gynecol. - 2006. - Vol.45, №3. - P.189-200) [3]. Развитие морфологических нарушений плаценты ассоциировано с развитием биохимических и физиологических патологических явлений.
В настоящее время известны следующие лабораторные способы диагностики гестоза:
- способ, основанный на определении антифосфолипидных антител в сыворотке крови (RU 2135999, МПК 6 G01N 33/53, опубликовано: 27.08.1999) [4].
Для ранней доклинической диагностики гестоза (в сроки 13-14 недель беременности) определяют уровни антифосфолипидных антител (аФЛ) к кардиолипиду (CL), фосфатидилсерину (PS) и фосфатидилхолину (PC) классов IgM и IgG в сыворотке периферийной крови, и повышение хотя бы одного из которых в 1,5 и более раза по отношению к нормативным показателям указывает на развитие гестоза. Это обусловлено тем, что аФЛ способны оказывать влияние на функциональное состояние эндотелиальных клеток и приводить к спазму сосудов, в результате чего возникают нарушения трофической функции плаценты, что влечет за собой развитие гестоза.
В стерильных условиях производят забор периферической венозной крови, затем в сыворотке крови определяют антифосфолипидные антитела IgM и IgG классов к: кардиолипину, фосфатидилсерину и фосфатидилхолину.
Указанные аФЛ могут быть определены иммуноферментным анализом и другими способами. Повышение уровней аФЛ классов IgM и IgG в 1,5 и более раз в I триместре по сравнению с показателями при физиологически протекающей беременности свидетельствуют о развитии гестоза.
Однако в известном способе недостаточно высокая достоверность диагностики гестоза. Это обусловлено тем, что антифосфолипидные антитела не являются специфическими маркерами диагностики при данной патологии, а также используются при диагностике сердечно-сосудистых (Sherer, Y. Antiphospholipid antibodies: are they pro-atherogenic or an epiphenomenon of atherosclerosis? / Y.Sherer, Y.Shoenfeld // Immunobiology. - 2003. - Vol.207, №1. - P.13-16 [5]. Urbanus, R.T. Antiphospholipid antibodies-we are not quite there yet / R.T.Urbanus, P.G. de Groot // Blood Rev. - 2011. - Vol.25, №2. P.97-106 [6]), аутоиммунных (Opatrny, L. Association between antiphospholipid antibodies and recurrent fetal loss in women without autoimmune disease: a meta-analysis / L.Opatrny, M.David, S.R.Kahn, E.Rey // J Rheumatol. - 2006. - Vol.33. - P.2214-2221 [7]), гинекологических (Кулаков В.И. Основные направления научных исследований по гинекологии в 90-е г. / В.И.Кулаков, В.А.Голубев // Акуш. и гинекол. - 1995. - №3. - С.3-5 [8]) и других заболеваний.
Другой известный способ диагностики гестоза состоит в периодическом определении концентрации порфириновых фракций (копропорфиринов и протопорфиринов) эритроцитов венозной крови спектрально-флуоресцентным методом (RU 2190848, МПК 7 G01N 33/52, G01N 33/48, опубликовано: 10.10.2002) [9].
Начиная с 12 недель беременности с интервалом четыре недели в динамике, осуществляют забор венозной крови и измеряют концентрацию порфириновых фракций - протопорфиринов (ПП) и копропорфиринов (КП) в эритроцитах крови беременных женщин методом спектрально-флуоресцентного анализа (Гуринович Г.П., Грубина Л.А., Гуринович И.Ф., Некрашевич С.Ф. // Вопр. онкол., 1991, т.37, 2, с.158-161.1) [10]. Затем определяли отношение концентрации протопорфиринов к концентрации копропорфиринов.
При этом концентрации указанных фракций эритроцитов определяются с относительной погрешностью не более 10% и высокой чувствительностью (1 мкг/л).
Однако необходимость динамического наблюдения беременных приводит к увеличению частоты забора крови. Отсутствует доказательство специфичности использования фракций эритроцитов для диагностики гестоза.
Известен способ прогнозирования гестоза, основанный на определении уровня карбонильных производных белков в ранние сроки (с 5 недель) в плазме крови беременной (RU 2249212, МПК 7 G01N33/48, опубликовано: 27.03.2005) [11], согласно которому в ранние сроки (с 5 недель) в плазме крови беременной определяют уровень карбонильных производных белков и при величине, равной 51,7 ед/г и выше прогнозируют развитие гестоза.
Однако в известном способе нельзя прогнозировать развитие гестоза при концентрациях карбонильных производных белков, находящихся в пограничных значениях нормы и патологии. Так, в примере 2 указано, что у пациентки Я-ко, 24 лет, уровень окислительной модификации белков находился в пределах нормы и соответствовал 51,6 ед оптической плотности/г белка, а в формуле изобретения при уровене карбонильных производных белков равном 51,7 ед оптической плотности/г белка и выше прогнозируют развитие гестоза.
Известен способ прогнозирования гестоза, основанный на определении активности катепсина D в сроке 6-13 недель гестации в периферической венозной крови (RU 2263913, МПК G01N 33/49, опубликовано: 10.11.2005) [12].
В 6-13 недель гестации в периферической венозной крови беременных женщин определяют активность катепсина D и при значениях этого показателя, равных или более 0,021 Ед. акт. ф./ч (единиц активности фермента в час), прогнозируют развитие гестоза в третьем триместре беременности с точностью 80,64%, чувствительностью 84,44% и специфичностью 70,58%. Катепсин D является лизосомальным ферментом класса эндопептидаз. Активность катепсина D, как и других лизосомальных ферментов, является отражением процессов свободнорадикального окисления в организме, патологическая активация которого является одним из пусковых механизмов развития гестоза. Также доказано участие катепсина D в процессах апоптоза и плацентации. Предполагается, что изменение активности катепсина D в ранние сроки беременности отражает развитие патологических процессов, которые в дальнейшем способствуют развитию гестоза.
Однако определение изменения активности катепсина D проводится только в ранние сроки беременности, что не позволяет использовать известный способ после 13-й недели беременности.
Для раннего прогнозирования развития гестоза используют два способа, основанных на определении в периферической венозной крови относительного содержания CD3+CD16+ лимфоцитов и содержания CD5+CD20+ лимфоцитов в популяции CD20+ клеток на сроке с 6 до 12 недель гестации (RU 2265221, МПК 7 G01N 33/577, опубликовано: 27.11.2005) [13], (RU №2271541 МПК G01N 33/577 (2006.01), опубликовано: 10.03.2006) [14].
В одном способе в 6-12 недель гестации в периферической венозной крови беременных женщин определяют относительное содержание CD3+CD16+ лимфоцитов и при значениях этого показателя, равных или более 5,4%, прогнозируют развитие гестоза легкой степени тяжести в третьем триместре беременности с точностью 78,12%, чувствительностью 75% и специфичностью 87,5%. При этом повышение уровня CD3+CD16+ клеток в ранние сроки гестации отражает развитие патологических процессов при беременности с усилением цитотоксических реакций как на системном, так и на локальном уровне, что в дальнейшем приводит к развитию гестоза.
В другом способе в 6-12 недель гестации в периферической венозной крови беременных женщин определяют содержание CD20+ и CD5+CD20+ клеток и математически вычисляют процентное содержание CD5+CD20+ лимфоцитов в общей популяции CD20+ лимфоцитов по формуле и при значениях этого показателя более 30% прогнозируют развитие гестоза с точностью. 86,67%.
Однако определение в периферической венозной крови относительного содержания CD3+CD16+ лимфоцитов и CD20+ и CD5+CD20+ клеток проводится только на сроке с 6 до 12 недель гестации, что ограничивает диагностику в более поздние сроки гестации. Кроме того, для осуществления данных способов необходимо дорогостоящее оборудование, что также ограничивает его широкое практическое использование.
Наиболее близким по технической сущности к заявляемому изобретению является способ диагностики тяжелых форм гестоза на поздних сроках (в третьем триместре) беременности (RU 2259568, МПК 7 G01N 33/68, опубликовано 27.08.2005) [15], принимаемый за прототип, заключающийся в определении уровня гомоцистеина в плазме венозной крови методом иммуноферментного анализа, и при увеличении его более чем в 2,2 раза от нормы диагностируют гестоз тяжелой степени.
Отмечается выраженное увеличение концентрации гомоцистеина в плазме по мере утяжеления течения гестоза: при легкой степени гестоза - 4,7±0,3 мкМ/л (от 2,82 мкМ/л до 6,9 мкМ/л), при средней - 5,0±0,4 мкМ/л (от 3,3 мкМ/л до 7,6 мкМ/л) и тяжелой - 7,7±0,7 мкМ/л (от 4,8 мкМ/л до 11,8 мкМ/л). У беременных с тяжелым гестозом уровень гомоцистеина был достоверно выше (р<0,01), чем у женщин с легкой и средней степенью гестоза.
Однако гомоцистеин не является специфическим метаболитом беременности. Его уровень может увеличиваться и при различных патологических состояниях (Кашежева А.З., Ефимов B.C. Гипергомоцистеинемия в патогенезе заболеваний коронарных сосудов // Кардиология. Хирургия. - 2007. - №11. [16]. Сидоренко Г.И., Мойсинок А.Г. Роль гомоцистеина в тромбогенезе и атерогенезе // Кардиология. Тез.: докл. - М., 2002 - С 56-61. [17]. Frank, J. No evidence for prooxidative effects of homocysteine in vascular endothelial cells / J. Frank, S.C. Beck, A. Flaccus, H.K. Biesalski // Eur J Nutr. - 2007. - Vol.46, №5. - P.286-292. [18]. Bao, X.M. Atorvastatin inhibits homocysteine-induced oxidative stress and apoptosis in endothelial progenitor cells involving Nox4 and p38MAPK / X.M.Bao, C.F.Wu, G.P.Lu // Atherosclerosis. - 2010. - Vol.210, №1. - P.114-121. [19]).
Следовательно, способ-прототип не позволяет достоверно диагностировать гестоз, так как содержание гомоцистеина может меняться в зависимости от наличия соматической патологии и употребляемой пищи.
Техническим результатом настоящего изобретения является повышение достоверности диагностики гестоза тяжелой степени для определения тактики ведения беременности и своевременного проведения необходимого комплекса лечебно-профилактических мероприятий.
Сущность изобретения заключается в том, что в известном способе диагностики гестоза тяжелой степени на поздних сроках (в третьем триместре) беременности, заключающемся в заборе в венозной крови с последующим ее исследованием на содержание специфических биохимических маркеров обмена веществ, согласно изобретению, в качестве биохимических маркеров обмена веществ используют гормоны лептин и грелин, при этом при увеличении концентрации лептина в сыворотке крови более 37,89 нг/мл и одновременном снижении концентрации грелина в плазме крови менее 0,26 нг/мл диагностируют гестоз тяжелой степени.
Другие отличия состоят в том, что концентрацию лептина определяют в сыворотке венозной крови, а концентрацию грелина в плазме венозной крови.
Использование гормонов лептина и грелина в качестве биохимических маркеров энергетического обмена для диагностики гестоза тяжелой степени не известно из уровня техники.
В таблице 1 приведена динамика гормонов энергетического обмена в крови у женщин с физиологическим течением беременности и с гестозом тяжелой степени.
В таблице 2 приведены пороговые значения гормонов энергетического обмена в крови у женщин с гестозом тяжелой степени, полученные в результате анализа ROC-кривых (Receiver Operating Characteristics - кривая операционных характеристик приемника).
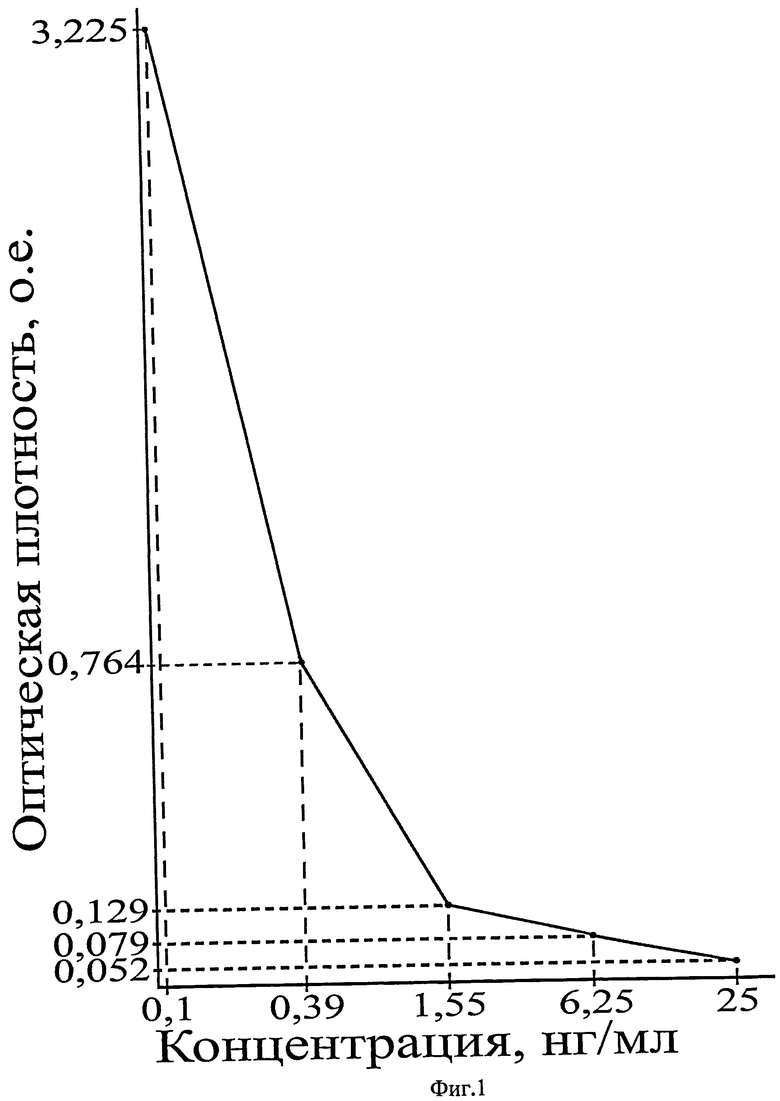
На фиг.1 приведен калибровочный график зависимости оптической плотности от концентрации в калибровочных образцах грелина, в нг/мл.
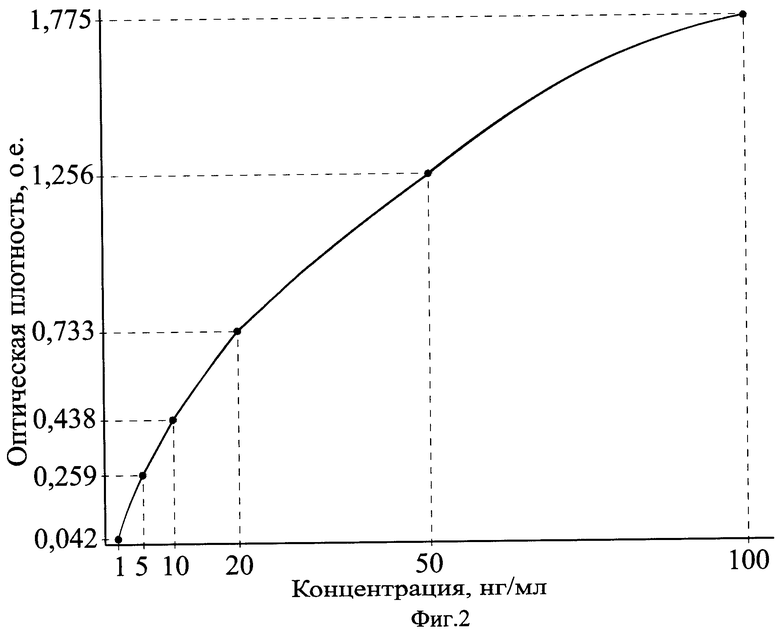
На фиг.2 приведен калибровочный график зависимости оптической плотности от концентрации в калибровочных образцах лептина в нг/мл.
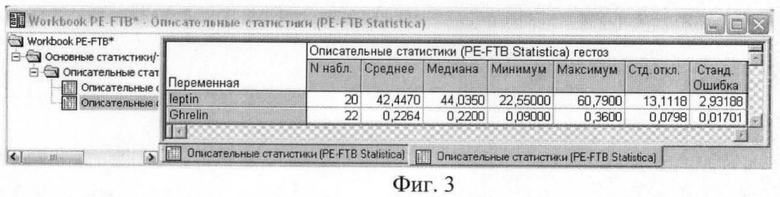
На фиг.3 приведены результаты описательного статистического анализа концентраций гормонов энергетического обмена у женщин с гестозом тяжелой степени.
На фиг.4 приведены результаты описательного статистического анализа концентраций гормонов энергетического обмена у женщин с физиологическим течением беременности.
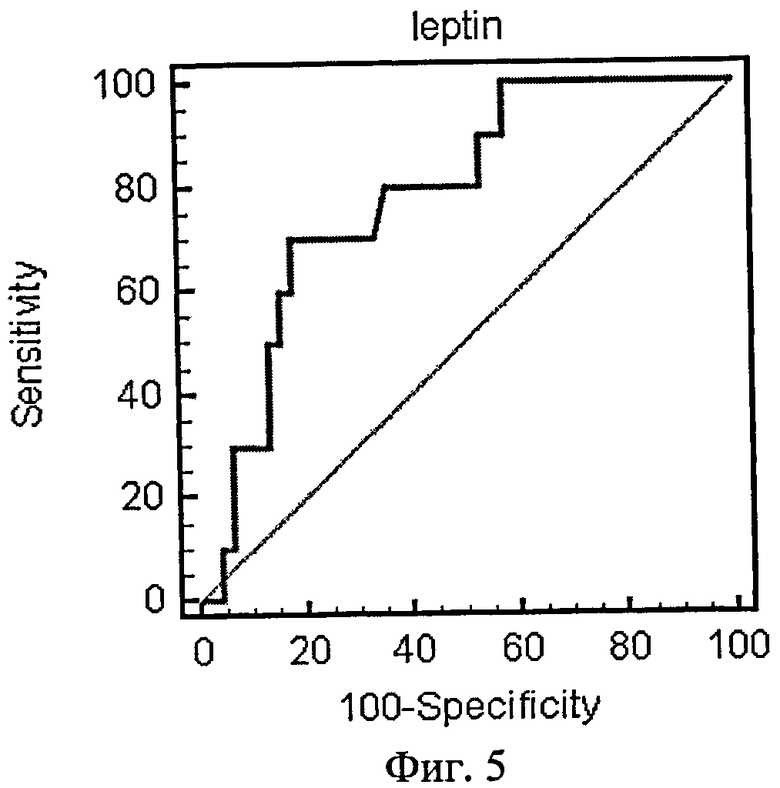
На фиг.5 приведена ROC-кривая лептина как биохимического маркера энергетического обмена.
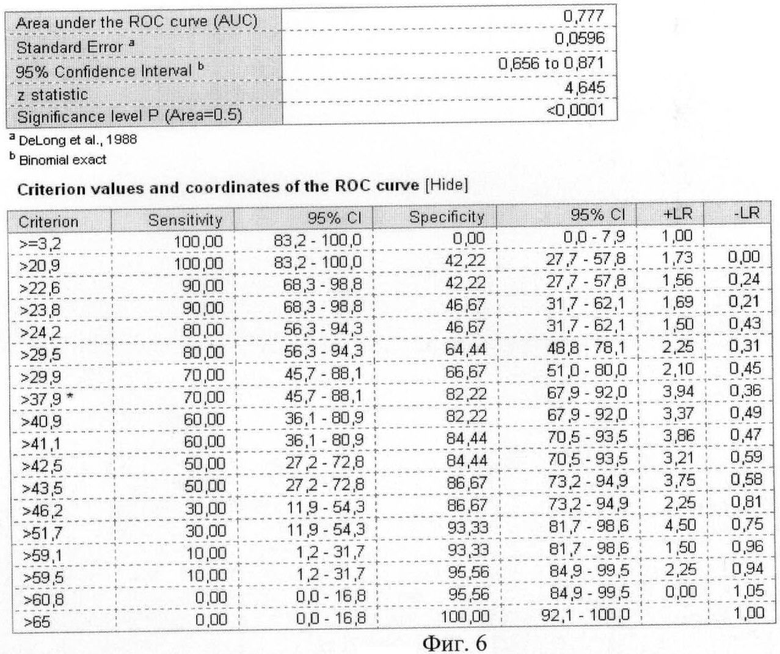
На фиг.6 приведены координаты и результаты статистического анализа ROC-кривой лептина.
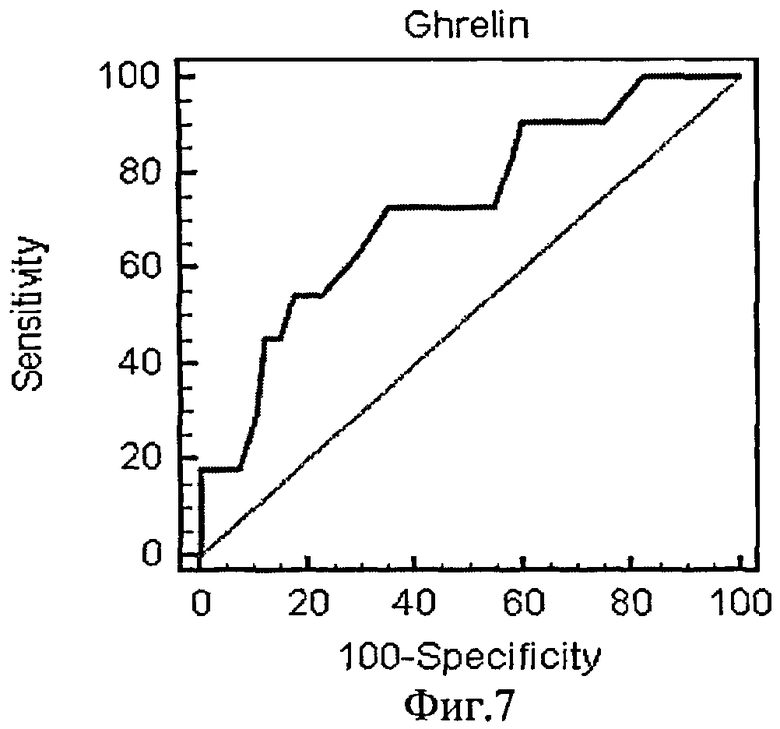
На фиг.7 приведена ROC-кривая грелина как биохимического маркера энергетического обмена.
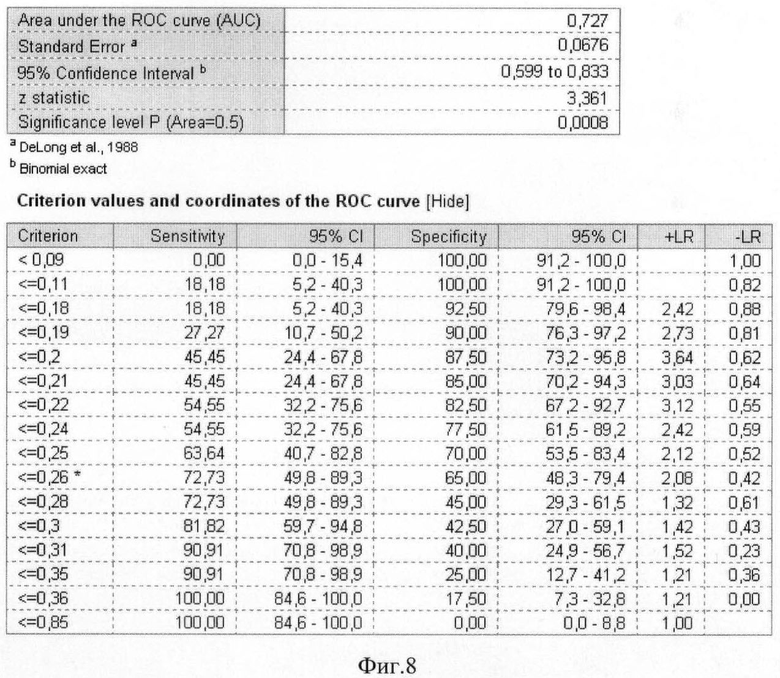
На фиг.8 приведены координаты и результаты статистического анализа ROC-кривой грелина.
Определение концентрации лептина основано на иммуноферментном анализе с использованием двухшагового сэндвич-анализа. Использовались высокоспецифичные моноклональные антитела: моноклональные антитела специфичные к лептину иммобилизованы в лунках микропланшета и другие моноклональные антитела специфичные к другому эпитопу лептина конъюгированы с биотином. Во время первого этапа лептин, присутствующий в образцах и стандартах, связывается с иммобилизованными антителами и с биотинилированными антителами, образуя сэндвич-комплекс. Избыток и несвязавшиеся биотинилированные антитела удаляют на этапе промывки. На втором этапе вносят конъюгат стрептавидин-пероксидаза хрена, который специфически связывается с биотинилированными антителами. Затем несвязавшийся конъюгат удаляют при промывке. После этого вносят субстрат тетраметилбензидина, который в результате ферментативной реакции образует продукт голубого цвета, при этом окраска прямо пропорциональна количеству присутствующего лептина. Ферментативную реакцию останавливают добавлением стоп-реагента, в результате голубая окраска превращается в желтую. Абсорбция при 450 нм измеряется с помощью микропланшетного спектрофотометра. Для построения калибровочной кривой используется набор стандартов. Концентрацию лептина в исследуемых образцах рассчитывают непосредственно из калибровочной кривой.
При определении содержания грелина использован иммунопланшет, предварительно сорбированный вторыми антителами и обработанный реагентом, блокирующим неспецифические сайты связывания. Вторые антитела могут связываться с Fc-фрагментом первичных антител, чей Fab-фрагмент конкурирует за связывание как биотинилированного грелина, так и грелина образцов и стандартов. Биотинилированный грелин связывается с пероксидазой хрена, конъюгированной со стрептавидином, которая катализирует реакцию раствора, содержащего тетраметилбензидин и перекись водорода, с развитием голубой окраски. Фермент-субстратная реакция останавливается добавлением соляной кислоты в качестве стоп-раствора. Раствор меняет цвет на желтый. Интенсивность развивающейся окраски пропорциональна количеству биотинилированного грелина, связавшегося с иммобилизованными в планшете антителами и обратно пропорциональна концентрации грелина в образце. Концентрацию грелина в неизвестном образце определяют по стандартной кривой.
Способ осуществляли следующим образом.
I. Производили забор крови из локтевой вены утром натощак у беременной в третьем триместре. В сыворотке крови определяли содержание лептина и в плазме содержание грелина методом иммуноферментного анализа.
II. Определение лептина проводили с помощью тест-систем производства Diagnostics Biochem Canada Inc (Canada):
1. Приготовили рабочие растворы стрептавидин/HRP и промывочного буфера.
2. Внесли по 20 мкл каждого стандарта (0, 1, 5, 10, 20, 50, 100 нг/мл) контроля и образца в дублях в соответствующим образом помеченные ячейки.
3. Внесли по 80 мкл раствора моноклональных антител к лептину, конъюгированных с биотином, во все ячейки.
4. Инкубировали 1 час при комнатной температуре на шейкере BioSan Thermoshaker PST-60HL-4 при 200 об/мин.
5. Промыли ячейки 3 раза, используя по 300 мкл разведенного буфера для промывок на ячейку, а затем постучали микропланшетом по фильтровальной бумаге, убедились, что ячейки сухие.
6. Внесли по 100 мкл раствора стрептавидин/HRP в каждую ячейку.
7. Инкубировали на шейкере BioSan Thermoshaker PST-60HL-4 в течение 30 минут при комнатной температуре при 200 об/мин.
8. Промыли ячейки, как указано в п.5.
9. Внесли по 100 мкл субстрата ТМБ в каждую ячейку.
10. Инкубировали на шейкере BioSan Thermoshaker PST-60HL-4 в течение 10-15 минут при комнатной температуре.
11. Внесли по 50 мкл стоп-раствора во все ячейки.
12. Определили оптическую плотность ячеек при длине волны 450 нм на автоматическом иммуноферментном анализаторе «Alisei».
Определение грелина проводили с помощью тест-систем производства Peninsula Laboratories (USA):
1. Приготовили рабочий буфер: развели концентрат рабочего буфера до 1000 мл деионизированной водой и тщательно перемешали. Полученный раствор использовали для растворения всех других компонентов набора и разведения образцов.
2. Разведение лиофилизированного стандарта: добавили 1 мл Рабочего буфера во флакон с лиофилизированным стандартом и тщательно перемешали, избегая вспенивания.
3. Разведение исходного стандарта: приготовили 6 пробирок 12×75 мм. В каждую пробирку добавили Рабочий буфер. В пробирку #1 внесли исходный раствор стандарта (1000 нг/мл). Перенесли 100 мкл полученного раствора из пробирки #1 в пробирку #2, тщательно перемешали на вортексе BioSan microspin FV-2400. Выполнили разведения в 4 раза до концентрации 0,02 нг/мл.
4. Разведение лиофилизированных первичных кроличьих антител к грелину IgG: добавили 5 мл Рабочего буфера и тщательно перемешали.
5. Разведение биотинилированного аналита: добавили 5 мл рабочего буфера и тщательно перемешали.
6. Внесли в каждую ячейку, исключая ячейку «бланк», по 25 мкл раствора первичных антител.
7. Внесли в ячейку «бланк» 25 мкл Рабочего буфера.
8. Закрыли планшет пленкой.
9. Инкубировали планшет 1 час при комнатной температуре.
10. Внесли по 50 мкл каждого приготовленного стандарта в соответствующие ячейки.
11. Внесли по 50 мкл исследуемых образцов в соответствующие ячейки.
12. Внесли 50 мкл разбавителя в ячейку «бланк».
13. Закрыли планшет пленкой.
14. Инкубировали планшет 2 часа при комнатной температуре.
15. Внесли в каждую ячейку по 25 мкл раствора биотинилированного аналита.
16. Инкубировали планшет в течение ночи при температуре 4°С.
17. Удалили содержимое ячеек перед первой промывкой, резко стряхнув планшет.
18. Промыли планшет 5 раз 300 мкл рабочего буфера, каждый раз промокая планшет фильтровальной бумагой.
19. Процентрифугировали флакон с конъюгатом стрептавидина и пероксидазы хрена на центрифуге Eppendorf Centrifuge 5702R в течение 15 секунд при 4°С и режиме центрифугирования 500-1000 об/мин. Внесли 12 мл рабочего буфера в пробирку. Добавили 60 мкл конъюгата стрептавидина и пероксидазы хрена в 12 мл Рабочего буфера и тщательно перемешали на вортексе BioSan microspin FV-2400.
20. Внесли в каждую ячейку по 100 мкл рабочего раствора конъюгата стрептавидина и пероксидазы хрена.
21. Инкубировали планшет 1 час при комнатной температуре.
22. Удалили содержимое ячеек перед первой промывкой, резко стряхнув планшет.
23. Промыли планшет 5 раз 300 мкл рабочего буфера, каждый раз промокая планшет фильтровальной бумагой.
24. Внесли по 100 мкл раствора хромогенного субстрата ТМБ в каждую ячейку, включая «бланк».
25. Накрыли планшет пленкой.
26. Инкубировали в течение 1 часа при комнатной температуре.
27. Внесли по 100 мкл 2 н НСl в каждую ячейку, включая «бланк».
28. Удалили пленку, закрывающую планшет, и поместили планшет в микропланшетный ридер.
29. Считали оптическую плотность при длине волны 450 нм на автоматическом иммуноферментном анализаторе «Alisei».
Результаты исследования содержания лептина и грелина в крови у женщин с физиологическим течением беременности и с гестозом тяжелой степени представлены в таблицах 1, 2.
Полученные результаты исследования свидетельствуют о том, что в сыворотке и плазме беременных женщин с гестозом тяжелой степени достоверно увеличено содержание лептина и снижено содержание грелина. Среднее значение концентрации лептина у женщин с физиологическим течением беременности составило 26,6±2,32 нг/мл, у женщин с гестозом тяжелой степени 42,4±2,93 нг/мл. Среднее значение уровня грелина у женщин с физиологическим течением беременности составило 0,3±0,02 нг/мл, у женщин с гестозом тяжелой степени - 0,2±0,02 нг/мл.
Были рассчитаны пороговые значения гормонов как биохимических маркеров энергетического обмена в крови у женщин с гестозом тяжелой степени при анализе ROC-кривых. Так, при увеличении концентрации гормона лептина в сыворотке крови более значения 37,89 нг/мл и одновременном снижении концентрации гормона грелина в плазме крови ниже значения 0,26 нг/мл диагностировали гестоз тяжелой степени.
Пример 1.
Пациентка П., 22 лет, диагноз при поступлении: беременность 39-40 недель, отягощенный акушерский анамнез. Тазовое предлежание плода. Гестоз легкой степени второй половины беременности. Наследственность не отягощена. Из перенесенных заболеваний отмечает детские инфекции. Менструации без особенностей. Гинекологические заболевания - эрозия шейки матки (пролеченная). Данная беременность I, протекала в I триместре без особенностей. В III триместре с 38 недель беременности появилась пастозность нижних конечностей, АД в пределах нормы. Прибавка в весе за беременность 8 кг. В общем анализе мочи белка нет. По данным допплерометрии нарушений фето-плацентарного кровотока не выявлено, нарушения маточно-плацентарного кровотока нет. В биохимическом анализе крови белок - 69 г/л, Билирубин общий - 8 мкмоль/л, прямой - 0, непрямой - 8, глюкоза 5,0 ммоль/л, мочевина 3,8 ммоль/л. Тромботест V ст., время рекальцификации 110'', гепариновое время 40'', толерантность плазмы к гепарину 10', количество фибриногена 3,5 г/л. В клиническом анализе крови - тромбоциты 286×109, гематокрит - 0,35, эритроциты - 3,7×1012 /л, гемоглобин - 135 г/л, лейкоциты -7,9×109 /л, сегментоядерные 67%, палочкоядерные - 1%, лимфоциты - 21%, моноциты - 10%, СОЭ - 27 мм/ч.
В 40 недель гестации, учитывая тазовое предлежание плода, в плановом порядке произведено поперечное надлобковое чревосечение, кесарево сечение в нижнем маточном сегменте поперечным разрезом. Извлечен живой доношенный мальчик, масса - 3800,0, длина - 55 см. Оценка по шкале Апгар 7/8 баллов. Кровопотеря во время операции составила 600,0. Послеоперационный период протекал без осложнений. Ребенок здоров. Выписана в удовлетворительном состоянии на 6 сутки. Уровень лептина в сыворотке крови составил 28,35нг/мл, уровень грелина в плазме - 0,27 нг/мл.
Пример 2.
Пациентка А., 38 лет, диагноз при поступлении: беременность 37-38 недель, отягощенный акушерско-гинекологический анамнез. Рубец на матке. Сочетанный гестоз II п/б. Нейроциркуляторная дистония по гипертоническому типу. Наследственность не отягощена. Из перенесенных заболеваний отмечает детские инфекции, НЦД по гипертоническому типу. Менструальная функция без особенностей. Гинекологические заболевания - эрозия шейки матки (пролеченная). Данная беременность IV. В анамнезе: 2001 м/аб; 2004 роды 3500 (тазовое предлежание) кесарево сечение; 2007 с/аб; 2010 - настоящая беременность. Данная беременность протекала в I триместре без особенностей. В III триместре с 34 недель беременности появилась пастозность нижних конечностей, повышение АД до 130/90 мм рт.ст. Угроза по невынашиванию. Находилась на стационарном лечении в ОПБ роддома №5 с 17.11.10 по 24.11.10. В сроке 37-38 недель беременности пастозность нижних конечностей, повышение АД до 160/100. Прибавка в весе за беременность 14 кг. В общем анализе мочи белок 0, 033 г/л. По данным допплерометрии нарушений фето-плацентарного кровотока не выявлено, нарушения маточно-плацентарного кровотока IA степени. В биохимическом анализе крови белок - 54 г/л, билирубин общий - 8 мкмоль/л, прямой - 0, непрямой - 8, глюкоза 6,0 ммоль/л, мочевина 4,0 ммоль/л. Тромботест V ст., время рекальцификации 110'', гепариновое время 40'', толерантность плазмы к гепарину 10', количество фибриногена 3,5 г/л. В клиническом анализе крови - тромбоциты 222×109, гематокрит - 0,35, эритроциты - 3,7×1012/ л, гемоглобин - 123 г/л, лейкоциты -11,9×109 л, сегментоядерные 67%, палочкоядерные - 1%, лимфоциты - 21%, моноциты - 10%, СОЭ - 27 мм/ч.
Развился гестоз тяжелой степени тяжести. Проводилась антигипертензивная терапия (клофелин 0,01% - 1,0 в\м, сульфат магния в/в капельно), метаболическая седативная терапия. Уровень лептина в сыворотке крови составил 45,55 нг/мл, уровень грелина в плазме - 0,19 нг/мл.
В 37 недель гестации, учитывая рубец на матке после операции кесарево сечение, осложненное течение данной беременности (гестоз тяжелой степени), тазовое предлежание плода в плановом порядке произведено поперечное надлобковое чревосечение, кесарево сечение в нижнем маточном сегменте поперечным разрезом. Извлечен живой доношенный мальчик, масса - 3100,0, длина - 50 см. Оценка по шкале Апгар 7/8 баллов. Кровопотеря во время операции составила 800,0. Послеоперационный период протекал без осложнений. Ребенок здоров. Выписана в удовлетворительном состоянии на 6 сутки.
Источники информации
1. Olsson, M.G. Increased levels of cell-free hemoglobin, oxidation markers, and the antioxidative heme scavenger alpha(1)-microglobulin in preeclampsia / M.G.Olsson, M.Centlow, S.Rutardottir [et al.] // Free Radic Biol Med. - 2010. - Vol.48, №2. - P.284-291.
2. Borekc, B. Placental tissue cyclo-oxygenase 1 and 2 in pre-eclamptic and normal pregnancy / B.Borekc, H.Aksoy, A.Toker, A.Ozkan // International Journal of Gynecology and Obstetrics. - 2006. - №95. - P.127-131.
3. Hung, Т.Н. Hypoxia and reoxygenation: a possible mechanism for placental oxidative stress in preeclampsia / Т.Н.Hung, G.J.Burton // Taiwan J Obstet Gynecol. - 2006. - Vol.45, №3. - P.189-200.
4. Способ доклинической диагностики гестоза RU 2135999, МПК 6 G01N 33/53, опубликовано: 27.08.1999
5. Sherer, Y. Antiphospholipid antibodies: are they pro-atherogenic or an epiphenomenon of atherosclerosis? / Y.Sherer, Y.Shoenfeld // Immunobiology. - 2003. - Vol.207, №1. - P.13-16.
6. Urbanus, R.T. Antiphospholipid antibodies~we are not quite there yet / R.T.Urbanus, P.G. de Groot // Blood Rev. - 2011. - Vol.25, №2. P.97-106.
7. Opatrny, L. Association between antiphospholipid antibodies and recurrent fetal loss in women without autoimmune disease: a meta-analysis / L.Opatrny, M.David, S.R.Kahn, E.Rey // J Rheumatol. - 2006. - Vol.33. - P.2214-2221.
8. Кулаков В.И. Основные направления научных исследований по гинекологии в 90-е г. / В.И.Кулаков, В.А.Голубев // Акуш. и гинекол. - 1995. - №3. - С.3-5.
9. Способ ранней диагностики гестоза беременных RU 2190848, МПК 7 G01N 33/52, G01N 33/48, опубликовано: 10.10.2002.
10. Гуринович Г.П., Грубина Л.А., Гуринович И.Ф., Некрашевич С.Ф. // Вопр. онкол., 1991, т.37, 2, с.158-161.1.
11. Способ прогнозирования гестоза RU 2249212, МПК 7 G01N 33/48, опубликовано: 27.03.2005.
12. Способ прогнозирования гестоза RU 2263913, МПК G01N 33/49, опубликовано: 10.11.2005.
13. Способ прогнозирования гестоза легкой степени тяжести с ранних сроков беременности RU 2265221, МПК 7 G01N 33/577, опубликовано: 27.11.2005).
14. Способ раннего прогнозирования гестоза RU №2271541 МПК G01N 33/577 (2006.01), опубликовано: 10.03.2006.
15. Способ диагностики тяжелых форм гестоза RU 2259568, МПК 7 G01N 33/68, опубликовано 27.08.2005.
16. Кашежева А.З., Ефимов B.C. Гипергомоцистеинемия в патогенезе заболеваний коронарных сосудов // Кардиология. Хирургия. - 2007. - №11.
17. Сидоренко Г.И., Мойсинок А.Г. Роль гомоцистеина в тромбогенезе и атерогенезе // Кардиология. Тез.: докл. - М., 2002 - С 56-61.
18. Frank, J. No evidence for prooxidative effects of homocysteine in vascular endothelial cells / J.Frank, S.C.Beck, A.Flaccus, H.K.Biesalski // Eur J Nutr. - 2007. - Vol.46, №5. - P.286-292.
19. Bao, X.M. Atorvastatin inhibits homocysteine-induced oxidative stress and apoptosis in endothelial progenitor cells involving Nox4 and p38MAPK / X.M.Bao, C.F.Wu, G.P.Lu // Atherosclerosis. - 2010. - Vol.210, №1. - P.114-121.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ ПРЕЭКЛАМПСИИ У БЕРЕМЕННЫХ С ХРОНИЧЕСКОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ | 2014 |
|
RU2561060C1 |
| СПОСОБ ДИАГНОСТИКИ ТЯЖЕЛОЙ ПРЕЭКЛАМПСИИ | 2015 |
|
RU2587781C1 |
| Способ диагностики присоединения преэклампсии у беременных с хронической артериальной гипертензией | 2016 |
|
RU2652447C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ПРЕЭКЛАМПСИИ У БЕРЕМЕННЫХ С САХАРНЫМ ДИАБЕТОМ 1 И 2 ТИПОВ | 2020 |
|
RU2751139C1 |
| Способ прогнозирования развития преэклампсии в поздние сроки беременности | 2018 |
|
RU2691114C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕСТИ ТЕЧЕНИЯ РАННЕЙ ПРЕЭКЛАМПСИИ | 2021 |
|
RU2753463C1 |
| Способ прогнозирования рецидива ранней преэклампсии по маркерам эндотелиальной дисфункции | 2022 |
|
RU2795090C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВОЗНИКНОВЕНИЯ ГЕСТОЗА У БЕРЕМЕННЫХ | 2011 |
|
RU2478960C2 |
| Способ определения степени тяжести преэклампсии по относительному содержанию CD16+ моноцитов в периферической крови беременных | 2019 |
|
RU2712228C1 |
| СПОСОБ ДИАГНОСТИКИ ПРЕЭКЛАМПСИИ У БЕРЕМЕННЫХ С ХРОНИЧЕСКОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ | 2012 |
|
RU2483311C1 |

Изобретение относится к медицине, а именно к акушерству, и может быть использовано для диагностики гестоза тяжелой степени на поздних сроках беременности. Для этого проводят биохимическое исследование крови беременной в третьем триместре для определения концентрации гормонов лептина и грелина в венозной крови методом иммуноферментного анализа. При увеличении концентрации гормона лептина в сыворотке крови более 37,89 нг/мл и одновременном снижении концентрации гормона грелина в плазме крови ниже 0,26 нг/мл диагностируют гестоз тяжелой степени. Способ позволяет повысить достоверность диагностики гестоза тяжелой степени для определения тактики ведения беременности. 2 з.п. ф-лы, 8 ил., 2 табл., 2 пр.
1. Способ диагностики гестоза тяжелой степени на поздних сроках беременности, заключающийся в заборе венозной крови с последующим ее исследованием на содержание специфических биохимических маркеров обмена веществ, отличающийся тем, что в качестве специфических биохимических маркеров обмена веществ используют гормоны лептин и грелин, при этом при увеличении концентрации лептина в сыворотке крови более 37,89 нг/мл и одновременном снижении концентрации грелина в плазме крови менее 0,26 нг/мл диагностируют гестоз тяжелой степени.
2. Способ по п.1, отличающийся тем, что концентрацию лептина определяют в сыворотке венозной крови.
3. Способ по п.1, отличающийся тем, что концентрацию грелина определяют в плазме венозной крови.
| СПОСОБ ДИАГНОСТИКИ ТЯЖЕЛЫХ ФОРМ ГЕСТОЗА | 2003 |
|
RU2259568C2 |
| US 20100119478 А1, 13.05.2010 | |||
| СИДОРОВА И.С | |||
| Гестоз | |||
| - М.: Медицина, 2003, с.44-84 | |||
| STRITTMATTER H.J | |||
| et al | |||
| Secretion and regulation of cytokines during pregnancy and gestosis // Z Geburtshilfe Neonatol | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2013-02-27—Публикация
2011-08-25—Подача