Изобретение относится к медицине, а именно оториноларингологии, и может быть использовано для раннего выявления болезни Паркинсона.
В 1817 году Джеймс Паркинсон в своей книге «Эссе о дрожательном параличе» описал болезнь, в последующем названную в его честь - болезнь Паркинсона (далее - БП), и в 1877 г. Ж.Шарко дополнил клиническую характеристику заболевания.
На сегодня происхождение болезни Паркинсона остается до конца не изученным. Болезнь Паркинсона - чаще заболевание пожилых людей, зачастую развивается в возрасте 70-80 лет. Однако в последние десятилетия болезнь Паркинсона неуклонно «молодеет», и поэтому нередки случаи возникновения паркинсонизма на шестом десятилетии жизни и даже раньше.
Известно, заболеваемость БП с каждым годом растет быстрее, чем население стареет, поражая примерно 1 из 1000 людей в возрасте старше 55 лет, а в возрасте 65 лет и старше 1 из 100 страдает болезнью Паркинсона. Лишь в 20% случаев удается диагностировать заболевание в возрасте до 50 лет и 0,8-10% до 40 лет.
В основе заболевания лежит прогрессирующая дегенерация нейронов, продуцирующих дофамин и другие моноамины, в определенных отделах центральной нервной системы, а также в периферических нервных ганглиях внутренних органов (желудочно-кишечный тракт и др.).
Распознавание начальных проявлений заболевания осуществляется крайне редко. Начало заболевания развивается субклинически и может пройти несколько лет до появления первых симптомов данного недуга. На сегодняшний день не существует каких-либо анализов, тестов, позволяющих достоверно диагностировать болезнь Паркинсона комплексно на до клиническом этапе.
Во всем мире ученые занимаются поиском алгоритма ранней диагностики болезни Паркинсона и других форм паркинсонизма, имеющих общие черты, с целью подбора адекватных профилактических мер, позволяющих замедлить развитие инвалидизирующего заболевания путем назначения соответствующего лечения.
Из практики известно, что в субклиническом периоде болезни Паркинсона нет ярких симптомов, характерных для стадии разгара заболевания, и соответственно число погибших двигательных нейронов не так велико, чтобы вызвать такие симптомы, как регидность мышц, тремор, скованность движений, нарушение равновесия, маскообразное выражение лица и т.д.
В период разгара болезни Паркинсона появляются такие симптомы, как нарушение моторики желудочно-кишечного тракта, слабость, нарушение сна по типу дневной сонливости и инсомнии, нарушение функции обоняния, депрессия, тревога, синдром беспокойных ног, нарушение мочеиспускания, сексуальная дисфункция, ортостатические гипотензии, тремор покоя, брадикинезия, мышечная ригидность, постуральные нарушения и другие симптомы, являющиеся результатом прогрессирующей дегенерации нервных клеток.
Болезнь Паркинсона относится к группе инвалидизирующих заболеваний и может развиваться от нескольких месяцев до десятка лет, проявляя себя тяжелыми изменениями в двигательной сфере или незначительными их нарушениями.
Несмотря на значительный прогресс в сфере медицины, в настоящее время диагностика болезни Паркинсона на ранних этапах развития является сложной задачей из-за отсутствия специфических лабораторно-диагностических критериев, позволяющих на начальном этапе установить правильный диагноз.
Поскольку данное заболевание имеет особенность при прогрессировании выводить пациента в состояние инвалидизации - беспомощности, классический способ диагностики БП имеет существенный недостаток из-за того, что клинические симптомы БП развиваются при дегенерации 80% и более нейронов черной субстанции головного мозга, причем данный процесс является необратимым и неуклонно ведет к гибели больного.
Поэтому задача поиска ранних диагностических критериев и разработки новых схем профилактики болезни Паркинсона является актуальной.
Проблемы диагностики БП на ранней стадии возникают не только из-за неярких проявлений в период начала заболевания, зарождающегося на клеточном уровне, но и из-за сложности анатомических структур нервной системы.
При патологическом процессе возникают изменения в нейронах, которые приводят к нарушению функции органов, контролируемых данным концевым отделом нервной системы.
Наиболее перспективным способом ранней диагностики болезни Паркинсона является оценка таких немоторных проявлений, как проблемы обоняния, сна и др.
Известно, волосковые клетки располагаются на конце периферического отростка обонятельной клетки обонятельного нерва и являются высокодифференцированными периферическими нейронами, располагающимися в толще слизистой оболочки верхней носовой раковины.
Обонятельная слизистая покрывает зону площадью около 2 см2 в области верхушки каждой носовой полости и простирается в сторону верхней носовой раковины и носовой перегородки.
При проникновении растворенных в секрете желез Боумана, ароматических веществ в верхний носовой ход, происходит возбуждение обонятельных рецепторов (биполярных нейронов) через воспринимающую поверхность волосковых клеток.
Далее возбуждение подобно центробежной силе передается через комплексы аксонов, образующих видимые глазом нити (fila olfactoria) к мозгу через отверстия пластинки решетчатой кости, присоединяясь к обонятельной луковице (bulbus olfactorius).
Известно, что скорость проведения импульсов по этим нервам самая низкая в сравнении с остальными нервными стволами. Первый нейрон вступает в контакт со вторым нейроном - митральными клетками обонятельной луковицы, которая является выпячиванием концевого мозга (telencephalon).
Обонятельная луковица может располагаться, частично погружаясь в носовую полость, кзади переходя в обонятельный тракт (tractus olfactorius), проходящий в одноименной борозде (sulcus olfactorius). Аксоны второго нейрона частично образуют синаптическую связь с третьим нейроном (обонятельный тракт), продолжающимся, уплощаясь, в обонятельный треугольник или бугорок (trigonum, s.tuberculum olfactorium), примыкающий к переднему продырявленному веществу (substantia perforata anterior).
Trigonum olfactorium преимущественно состоит из нервных клеток, на которых заканчивается часть волокон обонятельного пути.
В обонятельном треугольнике, разделенном на три обонятельные полоски, волокна различными путями достигают коркового конца обонятельного анализатора - крючка, uncus (извилины около аммонова рога). Вторые и третьи нейроны обонятельного тракта признаны «первичными» центрами обоняния.
Известно, что обонятельные волоски, канатик, бугорок по своему морфологическому строению и происхождению представляют собой часть коры головного мозга. Данный факт имеет значимое диагностическое значение при дифференциации заболеваний нервной системы.
Аксоны третьих нейронов и частично вторых, огибая мозолистое тело сверху и снизу, идут к вторичным корковым обонятельным центрам, к которым относятся извилины медиобазальной поверхности височной доли (парагиппокампова и грушевидная) и аммонов рог (гиппокамп), входящие в старую кору.
Аммонов рог является одной из важных структур лимбической системы и считается наиболее эпилептогенной частью головного мозга. При патологических процессах возникают припадко-подобные состояния, характеризующиеся на электроэнцефаллограмме синхронизированными разрядами биоэлектрической активности.
Приступы также могут заключаться в коротких абсансах или сноподобных состояниях, ощущениях отчуждения, преходящих макро- и микропсиях, переживании dejavu и транзиторных депрессиях, иногда сопровождающиеся нарушениями обоняния, а также оральными движениями, оценка топической симптоматики также имеет существенное диагностическое значение.
Далее три обонятельные полоски продолжают свое движение к корковому концу обонятельного анализатора: латеральная к миндалевидному телу, corpus amygdaloideum; промежуточная в нервных клетках переднего продырявленного вещества, substantia perforate anterior и медиальная направляется на медиальную поверхность полушария, под клюв мозолистого тела.
Отсюда одни волокна следуют в septum pellucidum, а затем по fornix и fimbria hippocampi достигают коркового конца обонятельного анализатора, другие волокна идут в составе striae longitudinales mediates и по связочковой и зубчатой извилинам также достигают обонятельного анализатора (uncus).
Соединение обонятельных центров друг с другом коллатералями имеет важное клинико-диагностическое значение, особенно значимо в период реабилитации больных.
Таким образом, обонятельная зона, располагающаяся в области верхней носовой раковины, представляет собой единое целое с корковыми центрами. Нарушение в любой зоне анатомических структур приводит к развитию нарушения функции обоняния.
Ранее было известно - гипосмия или аносмия может являться следствием различных патологических состояний, вовлекающих обонятельную зону, а при отсутствии изменений со стороны полости носа и околоносовых пазух закономерно возникает необходимость исключить неврологические расстройства.
Однако при классическом неврологическом обследовании больных с нарушением функции обоняния осуществляется поиск «грубых» изменений со стороны ЦНС, а при отсутствии таковых выставляется диагноз - гипо- или аносмия неясной этиологии.
Исследования Тихоокеанского научно-исследовательского института здоровья в Гонолулу показали возможную связь гипо- или аносмии с дегенеративными процессами в экстрапирамидной системе и могут являться ранними симптомами БП.
Болезнь Паркинсона, относящаяся к синуклеинопатиям, характеризуется накоплением белка альфа-синуклеина и формированием внутри глиальных клеток нитевидных структур диаметром 20-40 нм.
Концепция Braak и соавт. при болезни Паркинсона объясняет восходящий тип патологического нейро-дегенеративного процесса - от каудальных отделов ствола мозга (тонкие изменения в проекционных нейронах и структурах обонятельного комплекса) к коре большого мозга.
Премоторная стадия болезни может занимать до 8 лет.
К моменту манифестации симптомов нейродегенерация, носящая нелинейный характер, развивается стремительно, вызывая гибель большей части нейронов. В связи с данным утверждением очевидно - попытки нейропротекции на более поздней стадии не могут быть успешными.
Исследования Тихоокеанского научно-исследовательского института здоровья об гипо- и аносмии можно представить как ранний симптом заболевания Паркинсона, появляющегося до развития основных симптомов за 2-8 лет, однако недостатком данного метода является высказанное лишь предположение о возможном развитии заболевания, а также не достоверность данного способа диагностики, так как нарушение обонятельной функции может сопровождать и другие патологические состояния, а также вопрос восходящего патологического процесса остается дискутабельным, вследствие того, что нейро-дегенеративные изменения в нервной системе носят общий - системный характер и не могут возникать изолированно в отдельном участке нервного волокна или группы нейронов.
Процесс поражения нервной системы при болезни Паркинсона происходит медленно с вовлечением все большего количества нервных клеток. Пораженные дегенерацией клетки утрачивают функцию, следовательно, чем меньше в органе представлено клеточных элементов, тем быстрее будет утрачена его функция при развитии патологии.
Обонятельные клетки, также как и другие нейроны, поражающиеся на ранних этапах развития болезни Паркинсона, теряют свою функциональную активность, при этом утрата обоняния возникает постепенно с изменения порога чувствительности ароматических веществ.
При изучении и оценке обонятельного анализатора необходимо учитывать, что в процессе онтогенеза возникают изменения его функции, которые нельзя расценивать как патологию.
Еще в 1904 году Vashid выявил с помощью осмоэстезиометра значительное снижение обонятельной функции при старении. Дальнейшие исследования подтвердили данное наблюдение, однако отметили не одинаковую динамику порога обонятельной функции во всех возрастных группах и определили зависимость от пола, так женщины имели более острое обоняние, чем мужчины.
По данным А.И.Бронштейн, острота обоняния повышается к 6-ти летнему возрасту, затем отмечается постепенное снижение и к старости - угасание. Наиболее функциональной обонятельная система становится в период половой зрелости примерно до 45 лет, и снижение начинается с 45-50 летнего возраста и особенно резкое снижение отмечается в 70 летнем возрасте. Данный факт необходимо учитывать при оценке функции обоняния.
А.И.Бронштейн, одним из первых, предложил методику исследования обоняния при помощи набора из 8-ми пахучих веществ в определенной последовательности от самого слабого №1 до самого сильного №8 (Бабияк В.И., Накатис Я.А., «Профессиональные болезни верхних дыхательных путей и уха», Гиппократ, 2009, стр.342).
Ароматические вещества располагались в следующей последовательности: хозяйственное мыло, розовая вода, горькоминдальная вода, деготь, скипидар, 10% водный раствор аммиака, уксусная кислота и хлороформ. Было установлено, что ароматы №1-5 воспринимаются обонятельным нервом, 6 и 7 обонятельным и тройничным, а 8-й обонятельным и языкоглоточным нервами.
Данный способ диагностики позволяет дифференцировать ряд заболеваний, при которых происходит выключение обонятельного нерва и сохранение функций тройничного и языкоглоточного нервов, при этом пациент зачастую путает ароматы, воспринимая их в искаженном виде.
Данный способ до сегодняшнего дня считается уникальным и лишь совершенствуется учеными всего мира, с целью определения более тонких - пороговых изменений ощущения запахов, которое может быть применено, например, для диагностики болезни Паркинсона.
Можно оценивать обонятельный порог, способность к различению и отождествлению запахов.
Нарушение сна по типу дневной сонливости, инсомнии и синдрома беспокойных ног являются проявлениями БП в 19% случаев.
Следовательно изучение структуры сна у больных с гипо- и аносмией является актуальным.
При БП к наиболее частым парасомниям относятся двигательная активность во сне, периодические движения конечностей, ночная миоклония, ночные кошмары, ночные галлюцинации, панические атаки и т.д.
Психомоторное возбуждение во сне может проявляться сноговорением, стонами, криком, движениями конечностей и туловища, зачастую активными. Во время ночных кошмаров больные способны совершать защитные действия, проявляющиеся ударами рук, ног и т.д.
Парасомнии, возникающие не ранее 90-й минуты после засыпания, могут продолжаться недолго и при пробуждении больной, как правило, находится в ясном сознании, не теряя ориентации во времени и пространстве.
Двигательная активность во сне может возникать на фоне отсутствия мышечной атонии, развивающейся во сне, во время которого человек видит сновидения. В то время как в норме мышечная атония блокирует любые движения (за исключением движений глаз или отдельных мышечных подергиваний) даже во время кошмарных сновидений.
Обеспечение мышечной атонии осуществляется взаимодействием между структурами педункулопонтинного ядра и бульбоспинальной ингибиторной зоной. Бульбоспинальная ингибиторная зона через глицинергический путь вызывает активное торможение двигательных нейронов передних рогов.
Нарушение связей педункулопонтинного ядра, вследствие дегенерации глутаматергических нейронов, с медиальным сегментом бледного шара или бульбоспинальной зоной приводит к появлению двигательной активности во время сновидений.
Нарушения сна и бодрствования могут являться ранними недвигательными проявлениями начала болезни Паркинсона (20%).
Однако эти расстройства, практически, не диагностируются и, как правило, пациент связывает данное состояние с переутомлением, увеличением физической нагрузки, стрессом и т.д., тем самым недооценивая важность данных симптомов для ранней диагностики заболевания.
Chaudhuri K.R. с соавторами установили, что в основе расстройств сна лежат структурно-функциональные нарушения в системе нисходящих связей нейронов гипоталамуса с дофаминергическими нейронами вентральной покрышки, а также восходящих стволово-таламо-корковых проекций. Нарушения нейромедиаторных систем (норадренергической, серотонинергической, ацетилхолинергической, глутаматергической) вследствие дегенерации ядер ствола мозга играют одну из решающих ролей в патофизиологии нарушения сна и бодрствования.
Для болезни Паркинсона характерно нарушение ночного сна, сменяющееся дневной сонливостью, возрастающее с увеличением длительности болезни, а также наличие симптомов акатизии, сенсорных нарушений, никтурии, ночной и утренней дистонии, утреннего тремора и синдрома «беспокойных ног».
Способ полисомнографии позволяет во время сна прослеживать различные изменения функциональных систем организма (Дорохов В.Б., Институт Высшей нервной деятельности и Нейрофизиологии РАН, Москва; Физиология человека, 2002, т.28, №2, стр.105-112).
Полиграфическая регистрация различных физиологических и поведенческих показателей деятельности является уникальным экспериментальным подходом для исследования взаимоотношений между мозгом, различными системами организма и психикой человека. Проведение полисомнографического способа обследования стало возможным, благодаря бурному развитию компьютерных технологий.
Диагностика расстройств сна проводится в ночное время.
Метод основан на одномоментной регистрации большого количества физиологических параметров.
Стандартное полисомнографическое исследование предусматривает сбор и анализ информации о: а) структуре сна пациента, б) особенностях дыхания пациента, в) сердечной деятельности, г) оксигенации артериальной крови.
В полисомнографическом обследовании можно выделить три последовательных этапа:
1. Регистрация данных. Полисомнографическое обследование включает в себя видеомониторирование и регистрацию более 20 параметров: электроэнцефалограммы (ЭЭГ); электроокулограммы (ЭОГ); электромиограммы (ЭМГ); ороназального воздушного потока; грудного и брюшного дыхательных усилий; электрокардиограммы (ЭКГ); сатурацию артериальной крови (SaO2); актограмму и другие показатели.
2. Анализ данных. Анализ ПСГ-записи и определение стадий сна осуществляют вручную (мануально) или автоматически по специальным алгоритмам в соответствии с критериями, предложенными группой экспертов под руководством A.Rechtschaffen и А.Kales.
При анализе ПСГ-записи ее разбивают на эпохи длительностью 30 секунд и для каждой эпохи последовательно определяют стадии сна. Результаты построения профиля сна представляют в виде гипнограммы, на которой в сжатом виде можно видеть динамику стадий сна.
В компьютерных программах имеются алгоритмы, позволяющие автоматически определять отдельные физиологические паттерны (события) важные для описания сна, а затем на основании выделенных паттернов строить компьютерный профиль сна. Гистограммы для этих событий дают дополнительную информацию об изменениях физиологических систем организма на разных стадиях сна. Результаты автоматического распознавания событий, важных для описания сна, представляют в виде гистограмм и сохраняются в отдельном файле в текстовом формате.
3. Клиническое заключение. По результатам анализа ПСГ-записи пишут клиническое заключение. Существуют общепринятые показатели, которые должны быть отражены в тексте заключения. Наличие в программе возможности создания автоматизированного заключения значительно ускоряет его написание и позволяет включать в заключение подробные результаты количественного анализа данных.
Для автоматического распознавания функциональных состояний организма существуют две возможности создания нового алгоритма на основе алгоритмов для автоматического определения стадий сна.
Первый способ довольно трудоемкий, так как требует длительной настройки алгоритмов распознавания.
Второй способ более прост - для создания нового алгоритма часть записи обрабатывают мануально, и на основе полученного образца программа автоматически создает новый компьютерный алгоритм для конкретного испытуемого. Опыт показал, что качество автоматического анализа в этом случае довольно высоко и почти не отличается от мануального анализа.
Универсальные возможности ПСГ полиграфов можно использовать для диагностики патологий сна.
Так, например, при помощи полисомнографии, возможна идентификация недавно установленного маркера болезни Паркинсона - гиперэхогенности черной субстанции ствола мозга, однако чувствительность данного способа может быть отмечена и при других экстрапирамидных нарушениях, и, следовательно, нуждается в уточнении и дифференциации данного симптома с помощью других добавочных методов исследования.
Известно, что при БП нарушаются функции мышц гортани, что рано или поздно приводит к осиплости голоса. Основанные на этом факте попытки ранней диагностики заболевания по изменениям голоса уже проводились, однако были безуспешны.
Профессору Университета Хайфы Shimon Sapir удалось это сделать, применив альтернативный подход к анализу голоса и разработав программное обеспечение, выявляющее его характерные изменения до того, как они становятся различимы на слух.
Проведенные в Израиле и США испытания этой способа подтвердили его эффективность.
По мнению разработчиков, способ предполагают использовать для обследования людей с наследственной предрасположенностью к заболеванию, с возможным применением его в национальных скрининговых программах.
Однако утверждение о ранней диагностике может оставаться спорным, так как нарушение функции мышц гортани возникает при значительных дегенеративных поражениях нервной ткани.
Дегенерирующие заболевания центральной нервной системы могут иметь в своей основе инфекционное или аутоиммунное происхождение. Генетические и экологические факторы могут способствовать развитию и прогрессии болезни Паркинсона и его осложнений.
В ходе многочисленных исследований ученые обнаружили ассоциации различных заболеваний с аллелями локусов супергена HLA. Позже были сделаны выводы о возможной роли инфекционного фактора в развитии аутоиммунных процессов, лежащих в основе заболевания нервной системы, что может также подтверждать иммуногенетическую версию развития патологий.
В основе поражения нейронов черной субстанции мозга, контролирующей двигательную активность, лежит нарушение антигенного распознавания и срыв толерантности. Наличие определенных аллелей в HLA генотипе можно расценивать как фактор развития болезней. Изучение связей отдельных аллелей, гаплотипов, генотипов с возникновением различных заболеваний позволило охарактеризовать дополнительные диагностические маркеры для них.
Например, HLA-DQB 1*0602 аллель связан с катаплексией (кататонией) у больных нарколепсией, а также является одним из маркеров предрасположенности к рассеянному склерозу.
Патогенез аутоиммунных заболеваний зависит от генерации аутореактивного иммунного ответа. В норме уничтожение аутореактивных клеток происходит путем апоптозной делеции.
Известно, что частота аутореактивного ответа повышается с возрастом, хотя зачастую не приводит к патологическим состояниям. Возникновение аутореактивных иммуноцитов - необходимое, но не единственное условие развития аутоиммунного заболевания. Необходимо учитывать, что лишь часть влияния генотипа может быть объяснена действием генов локуса HLA, 30-50% общего генетического вклада приходится на локус HLA-DR4.
Ревматоидный артрит, относящийся к системным заболеваниям, считается аутоиммунной патологией, приводящей к хроническому воспалению суставов. Ревматоидный артрит является HLA-B*27 ассоциированным заболеванием, то есть риск возникновения болезни резко повышается, если в геноме присутствуют аллели HLA-B*27.
Реактивный артрит также на сегодняшний день считается HLA-B*27 ассоциированным заболеванием, развивающимся после перенесенной острой кишечной или мочеполовой инфекции.
Тест на HLA-B*27 - при аутоиммунных заболеваниях расценивается как генетический маркер предрасположенности. У пациентов, страдающих воспалительным артритом позвоночника и суставов, наличие HLA-B*27 свидетельствует о возможном развитии заболевания из группы серонегативных спондилоартропатий.
Данная группа включает анкилозирующий спондилоартрит, псориатический артрит и болезнь Рейтера. Положительный тест на HLA-B*27 - при анкилозирующем спондилоартрите (болезни Бехтерева) может отмечаться до 90% случаев, однако, данный ген не является единственным маркером того или иного заболевания, а расценивается как дополнительный диагностический маркер при комплексном обследовании.
Отсутствие HLA-B*27 в генотипе пациента тем не менее не гарантирует защиты от данной патологии.
По данным зарубежной литературы, в 47-60% больные с передними увеитами являются носителями HLA-B*27 аллели.
При идиопатической воспалительной миопатии - дерматомиозите также выявляется сцепленность с некоторыми аллелями локуса HLA, так определена строгая ассоциация гаплотипа HLA - DRB1*0301, DQA1*0501, DQB1*0201 у больных с наличием миозит-специфических аутоантител, особенно против гистидил-тРНК-синтетазы, аланил-тРНК-синтетазы и тРНК, причем корреляция более тесная с миозит-специфическими аутоантителами, чем с самой болезнью. Причем встречаемость HLA-DMA*0103-43%, в то время как у здоровых всего 8% и DMB*0102 20%, в сравнении с 3% здоровых.
Аутоиммунная патология, характеризующаяся кожным и висцеральным фиброзом, системная склеродермия, также считается генетически запрограмированным заболеванием в патогенезе, которого большую роль играют гены главного комплекса гистосовместимости. У всех пациентов выявляются аллели HLA - DRB1*1602, DQA1*050l и DQB1*0301.
Так же идентифицирован гаплотип по аллелям HLA класса II DRB1*1302, DRB1*0604 у пациентов, в организме которых образуется антифибрилларин (AF). Для большинства пациентов AF-позитивных характерна независимая ассоциация двух аллелей локуса HLA-DQB1*0604, HLA-DQB 1*0301, HLA-DQB1*0602 или HLA-DQB1*0302. При системной склеродермии как и для большинства аутоиммунных заболеваний имеет значение уровень экспрессии IL-4, который выступает в роли стимулятора синтеза коллагена.
В силу представленных данных рассматривать вклад только аллелей HLA-гена в формирование заболеваний, в том числе аутоиммунных - неверно. Гены главного комплекса гистосовместимости располагаются на коротком плече шестой хромосомы человека (6р21.3) и индуцируют выработку в организме специфических белков - лейкоцитарных антигенов человека.
Иммуногенетические исследования имеют колоссальное значение для практической медицины, так как HLA-антигены являются индивидуальным паспортом клеток. HLA - антигены представляют собой гликопротеиды и кодируются только соответствующим HLA - геном шестой хромосомы. Индивидуальность данного комплекса можно сравнить с отпечатками пальцев, которые позволяют безошибочно идентифицировать личность.
Способ HLA типирования (фиг.1) считается уникальным во всем мире, например, при трансплантации донорских органов, осложняющейся огромным числом возможных сочетаний HLA-антигенов, определяющих строгую антигенную индивидуальность.
Данный способ может применяться для диагностики заболевания, однако проведение исследования возможно только в комплексе, так как выявление варианта HLA-DRA можно расценивать как фактор возможного развития болезни. Обнаружение определенных аллелей генов с целью диагностики может быть использовано в комплексе с другими методами исследования, как генетические маркеры.
Необходимо учитывать, что клинические проявления аутоиммунных заболеваний находятся под контролем определенных ассоциаций, и каждый вид патологии определяется комбинацией этих генов.
Больные аутоиммунными заболеваниями отличаются набором специфических аллелей генов, однако рассмотрение патологии в отрыве от клинических проявлений не может быть ранним признаком болезни Паркинсона, так как частота встречаемости локусов при патологиях, сходных по аутоиммунному механизму, может быть одинаковая. Это объясняет необходимость комплексной оценки молекулярно-генетических анализов и данных объективного обследования.
В публикации «Researchers Find Connection between Parkinson's Disease and Immune System-Related Gene» представлено новое исследование, выявляющее вариант HLA-DRA локуса, как фактор риска развития болезни Паркинсона. Данные подтверждаются обследованием около 4000 участников, набранных по клиникам в Орегоне, Вашингтоне, Нью-Йорке и Грузии (http://www.ninds.nih.gov/news_and_events/news_articles/HLA_gene_parkinson_risk.htm).
Сравнительное исследование в области иммуногенетики, проведенное Hamza et al., на большой выборке пациентов (2 000) и здоровых доноров, показало значительную ассоциацию генов SNCA rs356220 SNP и HLA-DRA rs3129882 SNP с болезнью Паркинсона (Hamza et al. (2010), Nature Genetics, 15 August doi:10.1038/ng.642).
Также исследованиями подтверждается статистически значимое увеличение DQB1*06 аллели (р=0,002) при болезни Паркинсона, что свидетельствует о связи заболевания с иммунной системой.
При болезни Паркинсона выявлено снижение активности митохондриального комплекса I в тромбоцитах, а также уровня тирозин-гидроксилазы, дофамина, рецепторов к дофамину в лимфоцитах и цистеин-деоксигеназы в плазме крови.
Болезнь Паркинсона характеризуется патоморфологическими изменениями со стороны нервной системы, так в черном веществе и бледном шаре головного мозга возникают дегенеративные изменения и гибель нервных клеток, в цитоплазме нейронов обнаруживают тельца Леви, на месте погибших клеток возникают разрастания глиальных элементов или остаются пустоты.
Известно, что стадия заболевания, обусловленная развитием патоморфологических изменений в клетках, характеризуется необратимыми изменениями, прогрессирующими с течением времени и влекущими за собой неврологические осложнения.
Исследователями Каролинского института установлено, что нейродегенеративное заболевание, болезнь Паркинсона, частично может быть объяснена воспалением мозга. Ученые объясняют данное утверждение активацией клеток микроглии в головном мозге, которая может вызвать воспаление, приводящее к гибели нейронов. Проведенные в Гарварде исследования («Neurology») доказали снижение риска заболеваемости (до 40%) людей болезнью Паркинсона при использовании противовоспалительного эффекта нестероидных противовоспалительных препаратов, и также продолжается изучение их потенциала для профилактики рака прямой кишки, и лечения других состояний, таких как рак и сердечно-сосудистые заболевания.
Известно, что на ранней стадии болезни Паркинсона в организме человека начинают образовываться антитела для нейтрализации амилоид-образующего белка альфа-синуклеина.
Возможность образования антител в организме можно расценивать как результат воспалительной реакции, аутоиммунного происхождения. Аутоиммунные реакции выполняют «защитную» роль, приводя к поражению или дегенерации жизненно важных органов.
Пусковым моментом для начала аутоиммунных процессов может являться инфекционное воспаление. В период заболевания ОРВИ у пациентов зачастую возникает нарушение функции обоняния.
Гипо- и аносмия могут развиваться после ранее перенесенной острой респираторной вирусной инфекции, протекающей на фоне гипертермического синдрома. Так больные, обследованные в СПб НИИ ЛОР, отмечали в анамнезе в период острого заболевания заложенность носа, аносмию, обильную ринорею, головную боль, слабость, сонливость и повышение температуры тела выше 38,5°С.
Известно, что температурная реакция обеспечивается в первую очередь IL-1β, который считается мощным пирогеном, при значительном увеличении которого возникают состояния способные привести к денатурации белковых молекул, что неизменно приводит к гибели клеток - апоптозу.
На сегодняшний день известно множество вирусов, при внедрении которых происходит выброс IL-1β, обеспечивающего гиперэргическую реакцию и целый каскад иммунологических реакций, направленных в первую очередь на «защиту» организма с целью вытеснения патогенов. Крупные повреждения тканей, либо генерализация воспаления, вследствие неадекватного функционирования местных защитных механизмов, ведут к появлению IL-1 в циркуляции и его системному действию, связанному с активацией острофазового ответа на уровне организма и стимуляцией функций различных органов и систем, необходимых для обеспечения иммунологических реакций.
В этом плане системное действие IL-1 затрагивает следующие основные изменения регуляции постоянства внутренней среды организма, которые взаимосвязаны и могут быть определены как: 1) активация нейроэндокринной системы, 2) перестройка иммунопоэза и иммуностимуляция, 3) изменение синтеза острофазовых белков в печени, 4) изменение числа циркулирующих лейкоцитов и стимуляция костномозгового кроветворения.
Повышение температуры тела служит одним из первых признаков распространения воспалительного процесса. Пирогенность является одним из важных свойств IL-1, и эта функция в течение многих лет считалась главной характеристикой молекулы.
IL-1 не проникает через гематоэнцефалический барьер, а воздействует на нейроны особой зоны переднего гипоталамуса в области терморегуляторного центра, индуцируя целый каскад изменений с участием продукции других цитокинов и, в конечном итоге, синтез простагландина Е2.
Кроме влияния на терморегуляторный центр IL-1 вовлечен в многочисленные нейрогуморальные связи гипофиз-гипоталамического узла. Введение IL-1 вызывает увеличение синтеза ряда нейромедиаторов, повышение уровней АКТГ и кортикостерона в плазме за счет индукции кортикотропин-рилизинг фактора в гипоталамусе, хотя описано и прямое действие IL-1 на кору надпочечников.
IL-1 имеет множество центральных эффектов, приводящих к изменению некоторых поведенческих реакций, к индукции медленно-волнового сна, утрате аппетита, и направленных на полную мобилизацию защитных сил для борьбы с инфекцией.
Центральные проявления действия IL-1 могут отчасти объяснить эмоциональные и поведенческие сдвиги, наблюдаемые во время протекания инфекционных заболеваний. В естественных условиях синтезируемый на периферии и циркулирующий в крови IL-1 не проникает в мозг.
Однако, по данным В.А.Лесникова, экспериментальное введение IL-1 непосредственно в желудочки мозга вызывает изменения терморегуляции и показателей иммунного ответа. В последнее время доказано, что IL-1 может синтезироваться в мозгу в основном глиальными клетками, и это отражает развитие острофазового ответа на периферии.
Кроме того, в различных структурах головного мозга показано наличие экспрессии функционально активных рецепторов IL-1 I типа. Синтез и действие IL-1 в мозгу представляют собой особую изолированную внутримозговую систему регуляции, так как IL-1 не проникает из кровотока в мозг и наоборот. При этом передача активирующих и регуляторных сигналов на периферию к органам и клеткам иммунной системы происходит через нейтральные связи и синтез нейромедиаторов в области периферических нервных окончаний.
Пул синтезируемого в мозгу IL-1 прямо не связан с пулом данного цитокина на периферии, хотя они зависят друг от друга.
Таким образом, местно цитокины семейства IL-1 ответственны за все последовательные этапы развития адекватного ответа на внедрение патогена, обеспечения его локализации и удаления, а затем восстановления поврежденной структуры тканей, где бы ни развивалась воспалительная реакция, включая ткань мозга.
В случае несостоятельности местных защитных реакций воспаление продолжает развиваться, провоцируя увеличение синтеза цитокинов. Воспалительная реакция, сопровождающаяся гипертермическим синдромом в ткани мозга, приводит к поражению клеточных структур, и сигнальная система цитокиновой защиты поворачивает свои резервы вспять против своего собственного организма.
Цитокины представляют собой регуляторные пептиды, продуцируемые клетками организма. К цитокинам относятся простые полипептиды, более сложные молекулы с внутренними дисульфидными связями и белки, состоящие из двух и более одинаковых либо разных субъединиц, с молекулярной массой от 5 до 50 кДа.
Цитокины являются эндогенными медиаторами, которые могут синтезироваться практически всеми ядросодержащими клетками организма, причем, гены некоторых цитокинов экспрессируются во всех без исключения клетках организма.
К системе цитокинов в настоящее время относят около 200 индивидуальных полипептидных веществ. Все они имеют ряд общих биохимических и функциональных характеристик, среди которых важнейшими считаются следующие: плейотропность и взаимозаменяемость биологического действия, отсутствие антигенной специфичности, проведение сигнала путем взаимодействия со специфическими клеточными рецепторами, формирование цитокиновой сети.
В связи с этим цитокины выделены в новую самостоятельную систему регуляции функций организма, существующую наряду с нервной и гормональной регуляцией.
При этом цитокины являются наиболее универсальной системой регуляции, так как способны проявлять биологическую активность как дистантно после секреции клеткой-продуцентом (местно и системно), так и при межклеточном контакте, будучи биологически активными в виде мембранной формы.
Этим система цитокинов отличается от молекул адгезии, выполняющих более узкие функции только при непосредственном контакте клеток. В то же время система цитокинов отличается от гормонов, которые в основном синтезируются специализированными органами и оказывают действие после попадания в систему циркуляции.
Появление цитокинов в кровотоке сразу приводит к увеличению синтеза стероидных гормонов, причем IL-1 и другие провоспалительные цитокины вызывают как усиление синтеза рилизинг-факторов, так и стимуляцию продукции гормонов клетками коры надпочечников. Стероидные гормоны, известные как одни из наиболее мощных иммуносупрессоров, блокируют синтез цитокинов и не позволяют их уровню превысить предельные значения.
Это является эффективным механизмом отрицательной обратной связи для контроля гиперпродукции цитокинов. Тем не менее в ряде случаев уровни цитокинов превышают физиологические концентрации. Цитокины в низких концентрациях нужны для правильного формирования местного воспаления, более высокие дозы вызывают развитие системной воспалительной реакции, но патологически высокие концентрации приводят к состоянию септического шока и гибели организма.
К цитокинам относят интерфероны, колониестимулирующие факторы (КСФ), хемокины, трансформирующие ростовые факторы; фактор некроза опухолей; интерлейкины со сложившимися исторически порядковыми номерами и некоторые другие. К интерлейкинам относят про- и противовоспалительные цитокины, ростовые и дифференцировочные факторы лимфоцитов, отдельные регуляторные цитокины.
Название «интерлейкин» присваивается вновь открытому медиатору в том случае, если соблюдены критерии, выработанные номенклатурным комитетом Международного союза иммунологических обществ. Критерии составляют: молекулярное клонирование и экспрессию гена изучаемого фактора, наличие уникальной нуклеотидной и соответствующей ей аминокислотной последовательности, получение нейтрализующих моноклональных антител.
Кроме того, новая молекула должна продуцироваться клетками иммунной системы (лимфоцитами, моноцитами или другими типами лейкоцитов), иметь важную биологическую функцию в регуляции иммунного ответа, а также дополнительные функции, из-за чего ей не может быть дано функциональное название.
К провоспалительным цитокинам в настоящее время относят IL-1α, IL-1β, IL-2, IL-6, IL-8, TNFα, интерферон гамма (IFNg), к противовоспалительным цитокинам -рецепторный антагонист IL-1 (IL-1RA), IL-4, IL-10. В настоящее время получено большое число рекомбинантных аналогов цитокинов, в том числе, участвующих в регуляции воспаления, кроме того, их число постоянно растет.
В клинической иммунологии одной из самых сложных проблем считаются аутоиммунные заболевания. На протяжении десятка лет утверждение Пауля Эрлиха о том, что в норме иммунная система не должна развивать иммунный ответ против собственных тканей, поскольку это неизбежно ведет к гибели организма, подтверждается новыми исследованиями в области иммунологии.
На сегодняшний день существует более 20-ти теорий, объясняющих причины возникновения аутоиммунитета.
В последние годы уделяется большое внимание провоспалительным цитокинам IL-1, IL-2, γ-ИНФ с последующим включением апоптоза при аутоиммунных процессах. Известно, что активность всех цитокинов, участвующих в реакциях воспаления, реализуется по сходному механизму, поэтому нами был рассмотрен IL-1. Этот цитокин полифункционален и выполняет множество различных функций, мишенями которых служат клетки практически всех органов и тканей. Основными продуцентами IL-1 являются моноциты и макрофаги, также вырабатывать IL-1 могут многие другие клетки организма человека, в частности кератиноциты.
IL-1 является индуцибельным белком, синтез которого начинается в ответ на внедрение микроорганизмов либо повреждение тканей, который необходим для развития местного воспаления и осуществления всего комплекса защитных реакций, именуемых острофазовым ответом.
Аллергические состояния (аллергический ринит, бронхиальная астма, аллергический конъюнктивит, пищевая аллергия, IgE-ассоциированный атопический дерматит) являются генетически детерминированной группой заболеваний, характеризующихся повышенной способностью В-лимфоцитов синтезировать антитела класса Е (IgE), направленных против особой группы антигенов, называемых аллергенами. IgE взаимодействуют с высокоафинными мембранными Fcε R1 рецепторами базофилов и тучных клеток, что приводит к дегрануляции и выбросу вазоактивных аминов, в первую очередь, гистамина, а также хемокинов и провоспалительных цитокинов, индуцирующих развитие аллергического воспаления.
Поздняя фаза аллергического воспаления связана с миграцией в ткани различных типов лейкоцитов, особенно эозинофилов, и синтезом ими низкомолекулярных медиаторов и цитокинов, поддерживающих развитие аллергии.
Избыточная активация провоспалительными цитокинами какого-то из типов Т-хелперов, в норме находящихся в состоянии равновесия, может направить иммунный ответ по одному из вариантов развития. Хроническая несбалансированность активации Т-хелперов, наряду с генетическими предпосылками, приводит к развитию иммунопатологических состояний, связанных с проявлениями аллергии или аутоиммунитета.
В настоящее время доказано, что функциональный (ответственный за измененную экспрессию и продукцию соответствующего белка) полиморфизм генов, кодирующих ряд известных про- и противовоспалительных цитокинов, несущих небольшие мутационные изменения (точечные замены нуклеотидов (SNP, single nucleotide polymorphism) или тандемные повторы частей гена (VNTR, variable number tandem repeat)), может приводить к дисбалансу воспалительного и противоинфекционного иммунного ответа.
Выявлены аллельные варианты генов ряда про- и противовоспалительных цитокинов, ответственные за повышенную продукцию кодируемых ими белков: IL-1α-замена нуклеотидов в позиции (-889), IL-1β(+3953), IL-1β(-511) (фиг.11), IL-IRA(VNTR), TNFα(-308), IL-6(-174), IL-4(-590), IL-10(-1082), IFNg(+874), IL-2(-330) и др., частота встречаемости которых в ряде популяций в гетерозиготном виде достигает 40-50%, а в гомозиготном 10-15%.
Таким образом, в зависимости от индивидуального набора высоко- или низкопродуцирующих вариантов этих генов, характер воспалительного ответа может варьироваться между индивидуумами с «полярными» сочетаниями: например, «провоспалительный генотип» - большинство генов провоспалительных цитокинов (IL-1α, IL-1β, TNFα, IFNγ и др.) являются высокопродуцирующими, а противовоспалительных цитокинов (IL-1RA, IL-4, IL-10 и др.) - низкопродуцирующими; или «противовоспалительный генотип» - носительство нормальных вариантов генов провоспалительных цитокинов в сочетании с высокопродуцирующими вариантами генов противовоспалительных цитокинов.
Активность всех провоспалительных цитокинов, участвующих в реакциях воспаления, практически реализуется и регулируется по сходному механизму, влияние функционального полиморфизма генов цитокинов на характер иммунного ответа можно рассматривать на примере белка семейства IL-1, поскольку IL-1 является главным медиатором развития воспаления и всего комплекса реакций острофазного ответа.
Ранее было отмечено - IL-4 подавляет продукцию цитокина IL-1, уровень которого может превышать нормальные показатели и сохраняться длительное время в очаге воспаления.
IL-1 полифункциональный цитокин и выполняющий не менее 50 различных функций, мишенями которых могут служить и нервные клетки.
В семейство IL-1 принято включать IL-1α, IL-1β, IL-18 рецепторы IL-1(IL-1Re) и рецепторный антагонист этого цитокина (IL-RA). Равновесие между продукцией, экспрессией и ингибицией синтеза белков семейства IL-1 играет одну из ключевых ролей в развитии, регуляции и исходе воспалительного процесса. Кластер генов IL-1 (430 Kb) находится на 2ql3 хромосоме и содержит гены IL-1α, IL-1β, рецептора IL-1Re и IL-1RA, строение которых достаточно консервативно.
Некоторые аллельные ассоциации генов семейства IL-1 ответственны за измененный характер экспрессии и продукции кодируемых ими белков. Выявлен ряд SNP-маркеров высокопродуцирующего варианта гена IL-1β, наследуемых, как правило, совместно (+3953, -511, -3737, -1469, -999). Носительство полиморфного варианта 2 гена IL-IRA(VNTR), несущего ряд повторов по 86 п.о. (IL-1RA*2) связано с повышенным уровнем циркулирующего IL-1RA и уровнем экспрессии мРНК этого белка в ходе воспаления.
Известно, при носительстве высокопродуцирующих аллелей гена (IL-1β*2) белок, кодируемый молекулой ДНК, продуцирует большее количество цитокина на фоне развившегося воспаления. Присутствие в геноме сочетаний (знак «+» - вариант гена присутствует, знак «-» - отсутствует) IL-1β(SNP)+/IL-1RA*2-, IL-1β(SNP)-/IL-1RA*2+ и IL-1β(SNP)+/IL-1RA*2 + может оказывать существенное влияние на соотношение экспрессии и продукции этих белков и являться одной из главных причин дисрегуляции воспалительного ответа.
Согласно данным популяционных исследований, вариант IL-1RA*2 чаще встречается в ассоциации с нормальным (низкопродуцирующим) вариантом гена IL-1β(IL-1β*1) и редко присутствует совместно с высокопродуцирующим вариантом - IL-1β*2 (маркер - одна из замен нуклеотидов, перечисленных выше). Феномен такого наследования объясняется тем, что эти варианты генов, расположенных близко друг к другу, наследуются, как правило, совместно.
У лиц, гетерозиготных по этим вариантам генов, одна из хромосом несет гаплотип IL-1β*1/IL-1RA*2, вторая - IL-1β*2/IL-1RA*1, в результате давая сочетание «1/2»IL-1β+«1/2»IL-1RA. Гаплотип IL-1β*2/IL-1RA*2 встречается у 1-2% популяции и, по всей видимости, является результатом мейотической рекомбинации.
В настоящее время наблюдается переход от диагностики и терапии массовой к диагностике и терапии индивидуальной, позволяющей вылечить конкретного больного. Отсутствие значимых прогностических факторов доказательности развития патологии не позволяет врачам заблаговременно разработать тактику лечения пациента, позволяющую максимально отдалить клинические проявления заболевания, возможно, генетически запрограммированного.
Центральная нервная система человека многие десятилетия считалась привилегированно защищенной, от иммунного надзора, мощным гематоэнцефалическим барьером.
На сегодняшний день доказано, эндотелиальные клетки капилляров головного мозга отличаются от системных капилляров, они богаты митохондриальными клетками, имеют пиноцитарные везикулы и тесно контактируют друг с другом и астроцитами, регулирующими проницаемость эндотелиальных клеток, обеспечивая высокую электрическую резистентность. Гематоэнцефалический барьер является двунаправленной регуляторной мембраной между кровью и мозгом.
Регуляторная мембрана способна защитить мозговые клетки от неблагоприятных воздействий и селективно пропустить питательные вещества. При развитии аутоиммунных процессов, такая способность эндотелиальных клеток нарушается. В понимании иммунопатогенеза демиелинизирующих заболеваний нервной системы внесла разработка экспериментальных моделей, в частности, экспериментального аллергического энцефаломиелита.
При болезни Паркинсона в черном веществе и бледном шаре головного мозга обнаруживают тельца Lewy - сферические эозинофильные цитоплазматические включения (фиг.2).
Присутствие эозинофильных клеток может свидетельствовать об эозинофильном воспалении в ткани мозга. У больных с болезнью Паркинсона отмечается увеличение уровня IL-4 (В-клеточный стимулирующий фактор). Функция IL-4 состоит в переключении синтеза IgG1 на синтез IgG4 и IgE. IgE - белок, повышение которого, как правило, отмечается при аллергических состояниях, проявляющихся эозинофильным воспалением.
Увеличение уровня IL-4, в период разгара болезни Паркинсона с яркой клинической картиной, когда дегенерация нейронов головного мозга составляет около 80%, заставляет вспомнить тот факт, что IL-4 относится к провоспалительным цитокинам, являющимся антагонистом γ-интерферона. IL-4 подавляет продукцию острофазовых цитокинов IL-1, IL-6, IL-8, выбрасывающихся в период воспаления.
Аллергические состояния считаются генетически детерминированной патологией, характеризующейся повышенной способностью В-лимфоцитов синтезировать антитела класса Е (IgE), направленные против особой группы антигенов, называемых аллергенами.
IgE взаимодействуют с высокоафинными мембранными FcεR1 рецепторами базофилов и тучных клеток, что приводит к дегрануляции и выбросу вазоактивных аминов, в первую очередь, гистамина, а также хемокинов и провоспалительных цитокинов, индуцирующих развитие аллергического воспаления.
Аллергическое воспаление условно подразделяют на две основные фазы, немедленную и позднюю. Первая может развиваться в течение нескольких секунд и связана с индуцированным аллергеном IgE-зависимым синтезом гистамина и других медиаторов тканевыми тучными клетками. Поздняя фаза аллергического воспаления связана с миграцией в ткани различных типов лейкоцитов, особенно эозинофилов, и синтезом ими низкомолекулярных медиаторов и цитокинов, поддерживающих развитие аллергии.
Данная концепция подтверждает воспалительную и аутоиммунную теории развития болезни Паркинсона.
Цитокины оказывают плейотропные биологические эффекты на различные типы клеток, главным образом, участвуя в формировании и регуляции защитных реакций организма. Защита на местном уровне развивается путем формирования типичной воспалительной реакции после взаимодействия патогенов с паттерн-распознающими рецепторами (мембранными Toll рецепторами) с последующим синтезом провоспалительных цитокинов.
Синтезируясь в очаге воспаления, цитокины воздействуют практически на все клетки, участвующие в развитии воспаления, включая гранулоциты, макрофаги, фибробласты, клетки эндотелия и эпителиев, а затем на Т- и В-лимфоциты. В рамках иммунной системы цитокины осуществляют взаимосвязь между неспецифическими защитными реакциями и специфическим иммунитетом, действуя в обоих направлениях.
Примером цитокиновой регуляции специфического иммунитета служит дифференцировка и поддержание баланса между Т-лимфоцитами хелперами 1 и 2 типов. В случае несостоятельности местных защитных реакций цитокины попадают в циркуляцию, и их действие проявляется на системном уровне, что приводит к развитию острофазового ответа на уровне организма. При этом цитокины оказывают влияние практически на все органы и системы, участвующие в регуляции гомеостаза.
Действие цитокинов на центральную нервную систему приводит к изменению всего комплекса поведенческих реакций, меняется синтез большинства гормонов, острофазовых белков в печени, экспрессия генов ростовых и дифференцировочных факторов, изменяется ионный состав плазмы.
Однако ни одно из происходящих изменений не носит случайный характер: все они, либо нужны для непосредственной активации защитных реакций, либо выгодны в плане переключения энергетических потоков для одной лишь задачи - борьбы с внедрившимся патогеном. Цитокины являются главными медиаторами противоинфекционной резистентности, включая защиту от вирусов. На уровне организма цитокины осуществляют связь между иммунной, нервной, эндокринной, кроветворной и другими системами и служат для их вовлечения в организацию и регуляцию единой защитной реакции.
Таким образом, цитокины служат той организующей системой, которая формирует и регулирует весь комплекс патофизиологических сдвигов при внедрении патогенов.
Следует также отметить, что регуляторная роль цитокинов в организме не ограничивается только иммунным ответом. Она может быть разделена на 4 основных составляющих: регуляция эмбриогенеза, закладки и развития ряда органов, в том числе органов иммунной системы; регуляция отдельных нормальных физиологических функций, например, регуляция нормального кроветворения; регуляция защитных реакций организма на местном и системном уровне; регуляция процессов регенерации для восстановления поврежденных тканей.
Установление причинных связей между носительством генетических вариантов, предрасположенностью и характером развития болезни Паркинсона может дать возможность для проведения превентивных мероприятий с целью предотвращения тяжелых проявлений болезни, путем поиска и разработки эффективных методов лечения.
Индивидуальный характер функционирования цитокиновой системы может определяться несколькими факторами, в числе которых - различия в продукции цитокинов, обусловленные рядом биологических особенностей. Поиск наследственных основ, определяющих предрасположенность к развитию воспалительных и инфекционных заболеваний, направлен на выявление генов, ответственных за контроль иммунных реакций.
Прогноз эффективности комплексной ранней диагностики болезни Паркинсона является актуальным, а определение иммуногенетических характеристик больного позволит в перспективе разработать обоснованную и результативную тактику профилактики и лечения.
Известен способ доклинической диагностики болезни Паркинсона у практически здоровых лиц (см. патент RU №2318437, А61В 5/11, 2008).
При осуществлении данного способа проводят провокационный тест, при этом испытуемому вводят в кровь фармакологический препарат с последующим определением реакции организма испытуемого на его действие, причем в качестве фармакологического препарата вводят обратимый ингибитор синтеза катехоламинов α-метил-п-тирозин, визуально определяют у испытуемого наличие/отсутствие тремора и/или мышечной ригидности, при наличии которых диагностируют патологический процесс в латентной фазе течения.
Способ позволяет выявить заболевание в латентной фазе развития, а следовательно, применять профилактическое лечение.
Недостатком данного способа является то, что латентная (ранняя или скрытая) стадия болезни Паркинсона отличается отсутствием тремора и мышечной регидности, заметной визуально специалисту неврологу, а при появлении данных симптомов устанавливается диагноз и назначается терапия с целью их купирования. Стоит отметить, что клинические проявления диагноза возникают при дегенерации от 60 до 80% нервной ткани.
Известен также способ прогнозирования эффективности лечения интерлейкином-1 (см. патент RU №2301012, А61В 5/01,2007).
При осуществлении данного способа анализируют совокупность данных генотипирования по признакам аллельного полиморфизма гена цитокина и показателей температуры тела пациента в ответ на первое введение препарата. При наличии у пациента гомозиготного по высокопродуцирующему аллелю гена цитокина и изменении температуры в сторону повышения прогнозируют низкую эффективность лечения, а при наличии у пациента гомозиготного по низкопродуцирующему аллелю гена цитокина и отсутствии повышения температуры прогнозируют высокую эффективность лечения.
Данный способ прост в исполнении и позволяет сделать прогноз эффективности лечения препаратом IL-1 на основании индивидуальной восприимчивости больного к лечению этим препаратом для исключения побочного эффекта предстоящей терапии. Он дает комплексную оценку данных генотипирования и клинического симптома - гипертермии у больных.
Недостатком данного способа является то, что он применим только с целью прогноза эффективности цитокиновой терапии, но не может быть использован для ранней диагностики заболевания.
Наиболее близким по технической сущности к заявляемому решению является способ определения тактики лечения рекомбинантным цитокином, регулирующим воспаление (см. патент RU №2271827, A61K 38/20, C12Q 1/68, 2006).
При осуществлении данного способа используют определение функционального полиморфизма гена цитокина в качестве прогностического критерия степени эффективности и побочного эффекта терапии рекомбинантным аналогом цитокина.
Способ позволяет прогнозировать эффективность лечения рекомбинантным цитокином, регулирующим воспаление, в зависимости от генетических особенностей организма, однако он не пригоден для выявления ранних стадий заболевания.
Технический результат изобретения заключается в целенаправленной, комплексной диагностике болезни Паркинсона в латентной стадии.
Для достижения указанного технического результата в способе диагностики заболевания Паркинсона у больных с нарушением функции обоняния, включающем определение нарушения функции обоняния после перенесенной острой респираторной вирусной инфекции, сопровождающейся гипертермией, иммунодиагностику, согласно предложению, проводят комплекс исследований, содержащий определение аллелей IL-1β(-511)«2/2», «1/2», HLA-DRA rs3129882 SNP, повышенной продукции IL-1β, данные полисомнографии, и при выявлении у больных с гипо- или аносмией носительства аллелей IL-1β(-511)«2/2», «1/2», HLA-DRA rs3129882 SNP, повышенной сывороточной продукции цитокина, расстройства поведения, связанного с REM-сна, диагностируют болезнь Паркинсона.
На ранней стадии развития болезни Паркинсона нами были установлены с учетом первичной жалобы больного на снижение обонятельной функции, ранее перенесенной вирусной инфекции на фоне гипертермического синдрома, значимые изменения в цитокиновом статусе. Путем генотипирования было определено носительство высокопродуцирующих аллелей генов IL-1β*2. Это было сделано для выявления у пациента повышенной способности выработки сывороточной продукции в ответ на внедрение патогена (бактерий, вирусов и т.д.), что в последующем может завести каскад аутоиммунных реакций, приводящих к дегенеративным изменениям в нервной ткани, инвалидизирующей человека и неизбежно приводящей к его гибели.
На основании первой жалобы больного на снижение или отсутствие обоняния после ранее перенесенной острой респираторной вирусной инфекции, сопровождающейся значительным повышением температуры тела (выше 38,5°С), больному проводят полное ринологическое обследование, подтверждающее отсутствие объективных причин нарушения функции обоняния. Далее осуществляют забор крови для иммуногенетических анализов с целью выявления аллелей гена IL-1β(-511)«1/2»,«2/2» и носительства HLA-DRA rs3129882 SNP, а также оценивают уровень сывороточной продукции IL-1β. Проводят неврологическое обследование, позволяющее выявить симптомы экстрапирамидной недостаточности с последующим проведением полисомнографического исследования.
Способ основан на влиянии функционального полиморфизма генов цитокинов и главного комплекса гистосовместимости на характер иммунного ответа, поддержание высоких уровней сывороточной продукции, а также провокации аутоиммунного процесса, приводящего в последующем к дегенерации нервной ткани.
Первичные изменения головного мозга также находят отражение при оценке полисомнографии.
Из анализа приведенных известных источников информации ясно, что классические методы диагностики БП на сегодняшний день разнообразны, но не в полной мере позволяют достоверно установить диагноз, так как основываются на клинических признаках, не охватывающих всего спектра поражения нервной системы при болезни Паркинсона. Одни методы позволяют установить диагноз, когда число погибших двигательных нейронов достаточно велико, другие влекут за собой гипердиагностику.
Ранняя диагностика могла бы предотвратить разрушение до 60% нервных клеток соответствующих областей мозга, тем самым избавить значительное число пациентов от ранней инвалидизации и смерти.
Заявляемый способ содержит следующий комплекс исследований:
1. Сбор анамнеза заболевания (перенесенное ОРВИ с гипертермическим синдромом).
2. Оториноларингологическое обследование, с целью исключения патологических процессов в обонятельной зоне, включающее:
- риноскопию, осмотр полости носа при помощи эндовидеонаблюдения;
- компьютерно-томографическое исследование носа и околоносовых пазух (фиг.3);
- тестирование обонятельной функции, по методике Бронштейна.
3. Неврологическое обследование для выявления экстрапирамидной недостаточности, включающее оценку: двигательной сферы (мышечный тонус, сила, рефлексы); чувствительной сферы (поверхностная, глубокая); координаторных проб; менингиальных знаков, вегетативных функций.
4. Метод полисомнографии, включающий: электроэнцефалограмму (ЭЭГ), электромиографию (ЭМГ), электроокулографию (ЭОГ), электрокардиографию (ЭКГ), изучение фазы сна Rapid eye movement (REM), быстрые движения глаз.
Исследование проводят в ночь с использованием оборудования Grass Technologies в монтаже с 4 канальной ЭЭГ в монополярном отведении, двумя каналами ЭОГ, каналом подбородочной ЭМГ, каналом ЭКГ отведения, каналами регистрации грудного и брюшного дыхания, каналом положения тела, с параллельным видеомониторированием, без адаптационной ночи. Гипнограмму комментируют с учетом общего времени исследования (минут). Общее время сна (минут). Эффективность сна (%). Способность поддержания сна (%). Латенция ко сну (минут). Латенция к персистирующему сну (минут). Латенция к RЕМ сну (минут). Оценивают архитектуру сна (стадия N1) в процентах от общего времени сна, N2, N3, REM сна (%).
За период исследования учитывают число возникающих эпизодов REM сна и число пробуждений с общей продолжительностью в минутах. Регистрируют ЭЭГ активаций с определением связи с апноэ и гипопноэ, а также фиксируется спонтанный характер. Регистрируют индекс А\Н. Оценивают уровень насыщения артериальной крови кислородом (% - сатурации), минимальный и максимальный. Вычисляют индекс десатурации. Подсчитывают среднюю частоту сердечных сокращений в минуту. Измеряют АД вечером и АД утром (мм рт.ст.).
5. HLA типирование (фиг.1) выполняют по технологии Sequence Specific Primers, которое базируется на ПЦР с использованием аллель - специфических праймеров, «улавливающих» искомые HLA участки ДНК с последующей детекцией методом гель -электрофореза.
Первым этапом выделяют ДНК из исследуемого образца крови, ДНК амплифицируется (45 мин - 1,5 час). ДНК раскапывается в лунки ПЦР планшета, каждая из которых содержит праймеры определенной специфичности. Количество лунок (ПЦР реакций) соответственно определяется количеством аллельных вариантов в каждом локусе. Ампликоны переносят в лунки агарозного геля. В тех лунках, где специфичности праймеров совпали со специфическими участками ДНК, появляется полоса продукта в геле. По таблице интерпретации или при помощи программы определяли, какой HLA - аллели соответствует полоса продукта.
6. Иммуногенетический метод выполняют с целью выявления носительства высокопродуцирующих аллелей гена IL-1β(-511). Для выявления точечных однонуклеотидных замен (SNP) в гене IL-1β(-511) использовали метод анализа длины фрагментов рестрикции ПЦР продукта.
На первом этапе проводят полимеразную цепную реакцию (ПЦР) с использованием специфических праймеров (фиг.4, 5), специфичных к участку геномной ДНК, содержащей известные SNP.
Реакционную смесь готовят в объеме 30 мкл: 3 мкл 10-кратного буфера; смесь dNTP в концентрации 170 нМ; 50 пМ каждого праймера (0,5 мкл 100 мкМ раствора); 1 ед. Taq-полимеразы; 1-2 мкл ДНК; H2O до 30 мкл. Режимы амплификации ДНК приведены в фиг.6.
Продукт амплификации ДНК осаждают, для чего добавляют к 30 мкл реакционной смеси 90 мкл 96%-ного этанола и 3 мкл 7,5М ацетата аммония. Затем перемешивают и центрифугируют на микроцентрифуге в течение 15 минут с ускорением 10000g. Супернатант удаляют пипеткой, добавляют 400 мкл 70%-ного этанола и снова центрифугируют при ускорении 10000g в течение 6 минут, после чего удаляют спирт, а осадок подсушивали при 560°С и растворяли в 9 мкл дистиллированной воды.
Для проведения рестрикции ПЦР продукт инкубируют в течение трех часов с соответствующей рестриктазой (фиг.7). Продукты рестрикции разделяли электрофоретически в 2%-ном агарозном геле с бромистым этидием и визуализировали в УФ-свете на трансиллюминаторе (фиг.8).
В качестве маркера размера полученных фрагментов ДНК использовали маркеры молекулярного веса с шагом 100 п.о.
Для краткого обозначения аллелей генов IL-1β(-511) приняты следующие сокращения: нормальный, не несущий выявляемую мутацию, аллель обозначается цифрой 1, полиморфный - 2, соответственно, гомозиготный нормальный ген - «1/1», гомозиготный высокопродуцирующий ген - «2/2», гетерозиготный - «1/2».
При выявлении у больного варианта «2/2» гена цитокина прогнозируют развитие болезни Паркинсона. При выявлении у больного варианта «1/2» гена цитокина прогнозируют среднюю вероятность развития болезни Паркинсона. При выявлении у больного варианта «1/1» гена прогнозируют низкую вероятность развития болезни Паркинсона.
Принцип анализа: Количественное определение IL-1β основано на конструировании на твердой фазе (96-луночная плата для иммуноферментного анализа) комплекса, состоящего из: 1) мышиных моноклональных антител, специфически связывающих IL-1β из раствора; 2) IL-1β; 3) кроличьих поликлональных антител к IL-1β; 4) конъюгата пероксидазы хрена с козлиными антителами к иммуноглобулинам кролика.
Комплекс формируется при последовательном внесении в плату соответствующих реагентов, избыток которых после инкубации каждый раз удаляется аспирацией и промывкой платы. Количество связавшегося конъюгата, определяющего интенсивность развития окраски в каждой лунке после прибавления раствора хромогена, пропорционально количеству IL-1β в исследуемом образце. Результат анализа вычисляют по калибровочному графику после измерения оптической плотности.
7. Иммунологический метод выполняют с целью определения уровня сывороточной продукции IL-1β. Уровни цитокинов в сыворотке крови определяют методом твердофазного ИФА, используя полистироловые планшеты, тест-системы (IL-1).
Сначала на планшет сорбируют первые моноклональные антитела к соответствующему цитокину в количестве 50 мкл на лунку в концентрации 10 мкг/мл в сорбционном карбонатном буфере 0.1М рН 9.0 в течение 1 часа при комнатной температуре на шейкере.
После проводят двукратную отмывку фосфатным буфером 0.05М рН 7.2 с 0.1% детергентом NP-40. При отмывке в каждую лунку планшета вносят по 100 мкл отмывочного фосфатного буфера 12-канальной автоматической пипеткой, после чего аккуратно декантируют и аспирируют пипеткой внесенный буфер.
По окончании отмывки проводят стадию блокировки, внося по 100 мкл в каждую лунку фосфатного 0.05М буфера с 1% БСА, после чего так же проводят двукратную отмывку, как описано выше.
На следующей стадии вносят исследуемые образцы сывороток или супернатантов в количестве 50 мкл на лунку, проводя 2-3 двукратных разведения в 3 параллелях. Разведения сывороток и супернатантов проводят в отмывочном фосфатном буфере.
Одновременно с образцами в один из рядов планшета вносят стандартный образец цитокина в разной концентрации. Планшет с образцами инкубируют 1 час на шейкере при комнатной температуре, либо оставляют на ночь при +4°С. По окончании инкубации с образцами проводят двукратную отмывку, как описано выше.
Затем в планшет вносят вторые поликлональные кроличьи к соответствующим цитокинам антитела в количестве 50 мкл на лунку в концентрации 1 мкг/мл. Инкубацию со вторыми антителами проводят 1 час при тех же условиях, что и предыдущие стадии.
На последнем этапе после очередной двукратной отмывки в планшет вносят козьи анти-кроличьи антитела, меченные пероксидазой хрена для открытия поликлональных кроличьих антител. Инкубацию с последними конъюгатами проводят в течение 1 часа в тех же условиях, концентрация этих конъюгатов подбирается опытным путем для каждого конкретного цитокина.
По окончании последнего этапа проводят четырехкратную отмывку и затем окрашивают в фосфатно-цитратном буфере 0.1М рН 5.0 с внесенным красителем ортофенилендиамином в концентрации 0.5 мг/мл и перекисью водорода 0.06% в качестве субстрата.
Окрашивание проводят в темноте при комнатной температуре в течение 15-20 минут до полного появления окрашенного продукта ферментной реакции. Остановку реакции осуществляют внесением в лунки равного объема 1 мл HSO. Результаты реакции учитывают при длине волны 495 нм на спектрофотометре для планшет. Концентрацию конкретного цитокина в образце определяют по калибровочной кривой соотношения оптической плотности раствора в лунке и известной концентрации данного цитокина в качестве стандарта, умножая на соответствующее разведение образца.
И при наличии у больного гомо- и гетерозиготного аллеля гена цитокина-агониста прогнозируют высокую вероятность развития болезни Паркинсона.
На основании экспериментальных данных выявлена связь между лабораторными показателями носительством гомозиготного по аллелям гена цитокина IL-1β(-511)«1/2»,«2/2», носительства HLA-DRA rs3129882 SNP, клиническими симптомами, главным из которых является гипо- или аносмия, развившаяся после ранее перенесенной ОРВИ с гипертермическим синдромом, а также полисомнографическое исследование, что позволяет прогнозировать болезнь Паркинсона, в латентной (скрытой) стадии заболевания.
Этот вывод основан на данных генотипирования по признакам аллельного полиморфизма гена цитокина IL-1β(-511) и главного комплекса гистосовместимости HLA.
Данный способ позволяет диагностировать болезнь Паркинсона на ранней стадии развития, ассоциированной с высокой продукцией IL-1β, генетически опосредованной, носительством HLA-DRA rs3129882 SNP и IL-1β*2(-511) в сочетании с гипо- и аносмией, дополняющееся выявлением нарушения двигательной активности, в периоде сна, данными полисомнографического исследования.
Выявление гомо- или гетерозиготного высокопродуцирующего варианта гена цитокина, регулирующего воспаление, может объяснить воспалительную теорию пускового механизма в развитии дегенерирующего заболевания головного мозга, приводящего неумолимо к смерти больного.
Заявляемый способ позволит выбрать тактику лечения больных на ранних этапах развития с целью подавления воспалительной реакции в головном мозге путем индивидуального подбора комплекса терапевтических процедур с учетом иммуногенетических особенностей течения экстрапирамидной недостаточности.
Способ иллюстрируется чертежами, где;
на фиг.1 представлена картина электрофореза продуктов амплификации HLA;
на фиг.2 представлены микропрепараты, болезнь Паркинсона с тельцами Леви (Эдвард К.Клатт, MD);
на фиг.3 представлена компьютерная томография околоносовых пазух пациента с аносмией;
на фиг.4 представлена таблица - характеристика исследуемого IL-1β(-511), IL полиморфизма и праймер, использованный при их анализе методом ПДРФ-ПЦР;
на фиг.5 представлена картина электрофореза после проведения ПДРФ, полиморфный сайт - IL-1β(-511). Ряды: 1 - маркер молекулярный весов ДНК, по 100пн; 2, 3, 5 - гетерозиготы с аллелями 1/2; 4, 6 - гомозиготы по аллелям 1/1; 7 - гомозигота по аллели 2/2.
на фиг.6 представлена таблица - режимы амплификации ДНК, примененные для отдельного варианта полиморфизма;
на фиг.7 представлена таблица - характеристика полиморфного сайта гена цитокина IL-1β(-511);
на фиг.8 представлена фотография эндоскопического осмотра полости носа.
Способ осуществляют следующим образом.
При первичном обращении пациента с жалобой на снижение или отсутствие обоняния проводят оторинологическое обследование с целью исключения патологии, следствием которой может явиться нарушение обонятельной функции. Затем проводят переднюю и заднюю риноскопию, осмотр полости носа при помощи эндовидеонаблюдения (фиг.3), компьютерно-томографическое исследование носа и околоносовых пазух (фиг.4), тестирование по методике Бронштейна.
В случае если у больного нет объективных данных за наличие патологии носа и околоносовых пазух, а по результатам тестирования обонятельной функции отмечается снижение или отсутствие ощущения восприятия запахов, производят забор крови для иммуногенетического анализа (IL-1β(-511), уровень IL-1β, HLA - типирование) и полисомнографическое исследование.
Для точного прогноза выявляют:
1. Аллели гена IL-1β(-511) «1/2», «2/2»;
2. Уровень продукции IL-1β;
3. Носительство HLA-DRA rs3129882 SNP;
4. Наличие данных, характерных для расстройства поведения, связанного с REM-сна.
Исследование включает: сбор анамнеза, поражение черепно-мозговых нервов, поражение двигательной сферы, поражение чувствительной сферы, поражение рефлекторной сферы, нарушение координации, мозжечковую сферу, выявление менингеальных симптомов, определение корковых функций.
Исследование направлено на постановку топического диагноза - поражение экстрапирамидной системы.
Затем проводят полисомнографическое исследование.
У пациентов на ранних стадиях поражения экстрапирамидной системы отмечается нарушение процесса сна в виде снижения эффективности, повышенной фрагментарности. Удлиняется латентный период засыпания, укорачивается латентный период REM-сна. Представленность REM-сна увеличивается, в то время как на миограммме не возникает характерной REM атонии.
При видеомониторировании регистрируют двигательную активность в виде движений тела, попыток встать, сноговорение, мышечных подергиваний, совпадающих с периодом REM-сна.
При выявлении у больных с симптомами гипо- и аносмии, сочетающимися с носительством генов IL-1β(-511)«2/2», «1/2» и HLA-DRA rs3129882 SNP, дополненные данными полисомнографического исследования, подтверждающими проявления экстрапирамидных нарушений, прогнозируют развитие болезни Паркинсона.
При выявлении у пациента сочетания гена IL-1β(-511)«l/l» прогнозируют низкую вероятность развития болезни Паркинсона.
Однако, если у пациента по совокупности клинических признаков, данных генотипирования и полисомнографического исследования, отмечаются признаки заболевания с преимущественным поражением экстрапирамидной системы, пациента ставят на диспансерный учет невролога с целью динамического наблюдения и лечения с учетом индивидуальных особенностей течения неврологической патологии.
Известно, что IL-1 является основным медиатором в механизме развития лихорадки, благодаря чему в литературных источниках часто обозначается как эндогенный или лейкоцитарный пироген. В нормальных условиях он не проникает через гематоэнцефалический барьер.
Однако при нарушении иммунного гомеостаза IL-1 достигает преоптической области передней части гипоталамуса и взаимодействует с рецепторами нейронов центра терморегуляции.
Посредством активации циклооксигеназы, синтеза простагландинов, повышения внутриклеточного уровня циклического аденозинмонофосфата, происходит перестройка активности центров теплопродукции и теплоотдачи с повышением образования тепловой энергии и снижением тепловыделения, что и обусловливает повышение температуры тела.
Анализ представленных данных показывает, что указанный комплекс обследования больных дает возможность раннего прогноза дегенерируюшего заболевания головного мозга и позволит разработать ряд лечебных процедур, позволяющих замедлить развитие болезни Паркинсона.
Таким образом, носительство аллелей гена IL-1β(-511)«2/2», «1/2» и HLA-DRA rs3129882 SNP в сочетании с симптомами гипо- и аносмии, дополненное данными полисомнографического исследования, свидетельствует о запуске патологического-аутоиммунного процесса в экстрапирамидной системе и может быть применено для диагностики развития болезни Паркинсона.
У больных с гипо- и аносмией, возникшей после перенесенной ОРВИ на фоне гипертермического синдрома, анализ носительства аллелей IL-1β(-5H)«2/2», «1/2» и HLA-DRA rs3129882 SNP показал, что указанный комплекс полиморфизмов может являться одной из главных причин развития аутоиммунного процесса в ткани головного мозга, считающегося следствием воспалительного ответа на системном уровне и в очаге воспаления у больных болезнью Паркинсона.
Уровень IL-1β в сыворотке крови активирует функциональное состояние иммунного ответа непосредственно в очаге воспаления, который направлен на ускоренное завершение воспалительного процесса, однако при дефекте иммунного ответа на генетическом уровне возникает механизм обратной реакции, когда клеткой мишенью становится клетка собственного организма.
После постановки диагноза у всех больных, с течением времени, отмечалась тенденция наращивания неврологической симптоматики, свидетельствующей в сторону развития - прогресса болезни Паркинсона.
Таким образом, для пациентов с БП, являющихся, согласно проведенному генотипированию, носителями полиморфного варианта гена IL-1β(-511)«2/2», «1/2» и HLA-DRA rs3129882 SNP, дополненные данными полисомнографического исследования, подтверждающими проявления экстрапирамидных нарушений, данный способ является высокоэффективным.
Так как активность всех цитокинов, участвующих в реализации воспаления, регулируется по сходному механизму, то результаты, полученные на примере генов семейства IL-1 и генов HLA, позволяют утверждать: присутствие в генотипе IL-1β(-511)«2/2», «1/2» и HLA-DRA rs3129882 SNP является фактором, предрасполагающим к развитию болезни Паркинсона.
В настоящее время не существует лекарственных средств и методов лечения болезни Паркинсона. Возможность раннего прогноза открывает перспективу поиска патогенетического лечения, которое поможет предотвратить развитие заболевания и проследить иммунологический механизм стадийности инвалидизирующего заболевания.
Диагностика болезни Паркинсона на ранних этапах позволит использовать современные лекарственные и хирургические средства, позволяющие замедлить развитие и течение заболевания.
Таким образом, очевидны высокая медицинская и социальная значимость решения поставленной задачи.
Способ поясняется следующими примерами.
Пример 1.
Пациент М., 58 лет, жалобы на отсутствие ощущения восприятия запахов в течение 6 месяцев после перенесенной ОРВИ, сопровождавшейся повышением температуры тела выше 38,5°С.
Объективно: слизистая оболочка розовая, влажная. Носовые ходы широкие свободны, обозримы, зона верхних, средних и нижних носовых ходов без патологических изменений. Носовая перегородка умеренно искривлена. При исследовании обонятельной функции, по методике А.И.Бронштейн выявлено выключение I пары черепных нервов. На серии КТ-снимков отмечается воздушность околоносовых пазух, патологических изменений нет.
По данным иммуногенетического исследования, выявлено: носительство полиморфного высокопродуцирующего варианта гена IL-1β(-511)«2/2»; HLA-DRA rs3129882 SNP; уровень сывороточной продукции IL-1β-457 пг/мл.
По данным полисомнографического исследования отмечается нарушение процесса сна в виде снижения эффективности, повышенной фрагментарности. Удлинен латентный период засыпания и укорочен латентный период REM-сна. Представленность REM-сна увеличена, при этом на миограмме не возникает характерная REM атония. При видеомониторировании регистрируется двигательная активность в виде движений тела, попыток встать, мышечных подергиваний, совпадающих с периодом REM-сна. Полученные данные характерны для расстройства поведения, связанного с REM-сном.
По данным неврологического обследования установлена дисциркуляторная энцефалопатия с экстрапирамидной недостаточностью. Болезнь Паркинсона.
Полисомнографическое исследование - через 1 год наблюдения.
Заключение: Нарушение процесса сна в виде снижения эффективности, повышенной фрагментарности. Удлинен латентный период засыпания и укорочен латентный период REM-сна. Представленность REM-сна увеличена, при этом на миограмме не возникает характерная RЕМ атония. При видеомониторировании регистрируется двигательная активность в виде движений тела, попыток встать, мышечных подергиваний, совпадающих с периодом REM-сна.
Полученные данные характерны для расстройства поведения, связанного с REM-сном. По сравнению с предыдущим исследованием наблюдается отрицательная динамика в виде увеличения двигательной активности.
Пример 2.
Пациент А., 62 года, жалобы на отсутствие ощущения восприятия запахов, больным себя считает около 7 месяцев, снижение обоняния было постепенным. Обоняние полностью не исчезло, однако пациент отмечает извращение привычных запахов.
Объективно: слизистая оболочка розовая, влажная. Носовые ходы широкие свободны, зона средних и нижних носовых ходов без патологических изменений. Носовая перегородка умеренно искривлена. При исследовании обонятельной функции по методике А.И.Бронштейн выявлено выключение функции обоняния. На серии КТ-снимков отмечается воздушность околоносовых пазух, патологических изменений нет.
По данным иммуногенетического исследования, выявлено: носительство полиморфного высокопродуцирующего варианта гена IL-1β(-511)«2/2»; HLA-DRA rs3129882 SNP; уровень сывороточной продукции IL-1β-349 пг/мл.
Полисомнографическое исследование: нарушение процесса сна в виде снижения эффективности, повышенной фрагментарности. Синдром обструктивного апноэ сна легкой степени. Латентный период REM-сна укорочен. Представленность REM-сна увеличена, при этом на миограмме не возникает характерная RЕМ атония. При видеомониторировании регистрируется двигательная активность в виде движений тела, поворотов, попыток встать, сноговорения, мышечных подергиваний, совпадающих с периодом REM-сна.
Полученные данные характерны для расстройства поведения, связанного с REM-сном.
По данным комплексного обследования установлена дисциркуляторная энцефалопатия с экстрапирамидной недостаточностью. Болезнь Паркинсона.
Полисомнографическое исследование - через 1 год наблюдения.
Заключение: Нарушение процесса сна в виде снижения эффективности, повышенной фрагментарности. Синдром обструктивного апноэ сна средней степени. Латентный период REM-сна по сравнению с предыдущим исследованием значительно укорочен. Представленность REM-сна увеличена, при этом на миограмме не возникает характерная RЕМ атония. При видеомониторировании регистрируется двигательная активность в виде движений тела, поворотов, сноговорения, мышечных подергиваний совпадающих с периодом REM-сна.
Полученные данные характерны для расстройства поведения, связанного с REM-сном, наблюдается отрицательная динамика в виде укорочения латентного периода REM-сна, усугубления обструктивного апноэ по сравнению с предыдущим исследованием.
Пример 3.
Пациент И., 57 лет, жалобы на отсутствие ощущения восприятия запахов, в течение 4 месяцев, после перенесенной острой респираторной вирусной инфекции, сопровождавшейся повышением температуры тела выше 38,5°С, обильной ринореей, затруднением носового дыхания.
Объективно: слизистая оболочка полости носа - розовая, влажная. Носовые ходы широкие свободны, обозримы, зона верхних, средних и нижних носовых ходов без патологических изменений. Носовая перегородка по средней линии. При исследовании обонятельной функции, по методике А.И.Бронштейн выявлено, выключение I пары черепных нервов. На серии КТ-снимков патологических изменений не выявлено.
По данным иммуногенетического исследования, выявлено: носительство полиморфного гетерозиготного варианта гена IL-1β(-511)«l/2»; HLA-DRA rs3129882 SNP; уровень сывороточной продукции IL-1β-387 пг/мл.
Полисомнографическое исследование: нарушение процесса сна в виде снижения эффективности, повышенной фрагментарности. Синдром обструктивного апноэ сна легкой степени. Латентный период REM-сна укорочен. Представленность REM-сна увеличена, при этом на миограмме не возникает характерная КЕМ атония. При видеомониторировании регистрируется двигательная активность в виде движений тела, сноговорения, мышечных подергиваний, совпадающих с периодом REM-сна.
Полученные данные характерны для расстройства поведения, связанного с REM-сном.
По данным неврологического обследования установлена дисциркуляторная энцефалопатия с экстрапирамидной недостаточностью. Болезнь Паркинсона.
Полисомнографическое исследование через 1 год наблюдения: нарушение процесса сна в виде снижения эффективности, повышенной фрагментарности. Синдром обструктивного апноэ сна легкой степени. Латентный период REM-сна укорочен. Представленность REM-сна увеличена, при этом на миограмме не возникает характерная REM атония. При видеомониторировании регистрируется двигательная активность в виде движений тела, частых переворачиваний, вставаний, сноговорения, мышечных подергиваний, совпадающих с периодом REM-сна.
Полученные данные характерны для расстройства поведения, связанного с REM-сном, отрицательная динамика по сравнению с предыдущим исследованием.
Пример 4.
Пациент А., 60 лет, жалобы на отсутствие ощущения восприятия запахов, затруднение носового дыхания, частые острые респираторные заболевания, сопровождавшиеся повышением температуры тела не выше 37,3°С. Больным себя считает около 12 месяцев.
Объективно: слизистая оболочка розовая, влажная отечная. Носовые ходы сужены, зона верхних, средних носовых ходов не визуализируется. Нижние отделы полости носа, после анемизации, проходимы, свободного патологического отделяемого нет. Носовая перегородка искривлена больше в верхне-среднем отделе. При исследовании обонятельной функции, по методике А.И.Бронштейн, выявлена аносмия. На серии КТ-снимков отмечается пристеночный отек околоносовых пазух, более выраженный в клетках решетчатого лабиринта. Искривление носовой перегородки.
По данным иммуногенетического исследования, выявлено: носительство полиморфного низкопродуцирующего варианта гена IL-1β(-511)«1/1»; HLA-DQB1*03 аллеля HLAII класса, HLA-B*12 аллеля локуса HLA-B; повышенный уровень сывороточной продукции IL-1β-482 пг/мл.
Полисомнографическое исследование: Изменение процесса сна в виде повышенной фрагментарности, укорочения латентного периода REM-сна и увеличения его процентной представленности. Индексы дыхательных расстройств и периодических движений конечностей соответствуют норме. При видеомониторировании патологическая двигательная активность не зарегистрирована.
По данным неврологического обследования патологических изменений не выявлено.
Полисомнографическое исследование - через 1 год наблюдения.
Заключение: При видеомониторировании патологическая двигательная активность не зарегистрирована. Синдром обструктивного апноэ сна легкой степени.
У пациента по данным аллергологического обследования выставлен диагноз: хронический персистирующий аллергический ринит. После проведенных курсов лечения обонятельная функция и дыхание носом восстановлены.
Пример 5.
Пациент М., 55 лет, жалобы на отсутствие ощущения восприятия запахов, головную боль в области лба, повышение температуры тела до 38,5°С, артериальной гипертензии (190/80), считает себя больным после перенесенной ОРВИ.
Объективно: слизистая оболочка розовая, влажная. Носовые ходы широкие свободны, обозримы, зона верхних, средних и нижних носовых ходов без патологических изменений. Носовая перегородка по средней линии. При исследовании обонятельной функции, по методике А.И.Бронштейн, выявлена аносмия. На серии КТ-снимков патологических изменений нет.
По данным иммуногенетического исследования выявлено: носительство гетерозиготного варианта гена IL-1β(-511)«1/2»; HLA-DQB1*02 аллеля HLAII класса, HLA-B*27 аллеля локуса HLA-B; уровень сывороточной продукции IL-1β-528 пг/мл.
Полисомнографическое исследование: Изменение процесса сна в виде повышенной фрагментарности, укорочения латентного периода REM-сна и увеличения его процентной представленности. Индексы дыхательных расстройств и периодических движений конечностей соответствуют норме. При видеомониторировании патологическая двигательная активность не зарегистрирована.
На основании объективного неврологического обследования выявлены патологические изменения со стороны ЦНС с вовлечением экстрапирамидной и мозжечковой зоны. Назначено дополнительно МРТ обследование, на котором отмечаются очаги изменений интенсивности МР сигнала, сосудистого генеза, ангиома правой височной области.
Диагноз: Гипертоническая болезнь III. Состояние после повторных транзиторных ишемических атак.
Полисомнографическое исследование - через 1 год наблюдения.
Заключение: Нарушение процесса сна в виде снижения эффективности, повышенной фрагментарности. Удлинен латентный период засыпания и укорочен латентный период REM-сна.
Полученные данные не характерны для расстройства поведения, связанного с REM-сном. По сравнению с предыдущим исследованием отрицательная динамика в виде увеличения двигательной активности не наблюдается.
Пример 6.
Пациент С., 16 лет, жалобы на отсутствие ощущения восприятия запахов, чувство покалывания и «мурашек» в руках и ногах, приступы легкого головокружения, периодическую головную боль. Пациент считает себя больным в течение 5-ти месяцев, после перенесенной ОРВИ (температура выше 38,5°С).
Объективно: слизистая оболочка розовая, влажная. Носовые ходы широкие свободны, обозримы в полном объеме, зона верхних, средних и нижних носовых ходов без патологических изменений. Носовая перегородка умеренно искривлена. При исследовании обонятельной функции, по методике А.И.Бронштейн, выявлена - гипоосмия. На серии КТ-снимков, патологических изменений в полости носа и околоносовых пазухах не выявлено.
По данным иммуногенетического исследования, больной является носителем гомозиготного по высокопродуцирующему варианту гена IL-1β(-511)«2/2»; гаплотипа, состоящего из аллелей HLAII класса HLA-DRB1*1501, DQA1*0102, DQB1*0602 (сочетание характерно для рассеянного склероза). Уровень сывороточной продукции IL-1β-217 пг/мл.
Полисомнографическое исследование: Изменение процесса сна в виде повышенной фрагментарности, укорочения латентного периода REM-сна и увеличения его процентной представленности. На миограмме не возникает характерная REM атония. При видеомониторировании регистрируется двигательная активность в виде движений тела, мышечных подергиваний, совпадающих с периодом REM-сна.
Полученные данные характерны для расстройства поведения, связанного с REM-сном.
На основании объективного неврологического обследования выявлены патологические рефлексы. Учитывая совокупность данных обследования и возраст пациента, дополнительно назначено МРТ-обследование.
По данным МРТ головного мозга выявлено: в белом веществе полушарий головного мозга, в мозолистом теле и единично 1/2 моста определяются множественные очаги размерами от 0,5 до 2-х см, неправильной продолговатой и округлой формы (некоторые с тенденцией к слиянию) с явлениями умеренного перифокального отека вещества мозга. МРТ картина демиелинизирующего заболевания головного мозга.
Диагноз. Демиелинизирующее заболевание ЦНС. Рассеянный склероз.
Пример 7.
Пациент Г., 49 лет, жалобы на отсутствие ощущения восприятия запахов, в течение 12 месяцев, после перенесенной острой респираторной вирусной инфекции, сопровождавшейся повышением температуры тела выше 38,5°С.
Объективно: слизистая оболочка полости носа - розовая, влажная. Носовые ходы широкие свободны, обозримы, зона верхних, средних и нижних носовых ходов без патологических изменений. Носовая перегородка по средней линии. При исследовании обонятельной функции, по методике А.И.Бронштейн выявлена аносмия. На серии КТ-снимков патологических изменений обонятельной зоны нет. Околоносовые пазухи пневматизированы.
По данным иммуногенетического исследования выявлено: носительство полиморфного гетерозиготного варианта гена IL-1β(-511)«1/2»; HLA-DRA rs3129882 SNP; уровень сывороточной продукции IL-1β-320 пг/мл.
Полисомнографическое исследование: нарушение процесса сна в виде снижения эффективности, повышенной фрагментарности. Синдром обструктивного апноэ сна средней степени. Латентный период REM-сна укорочен. Представленность REM-сна увеличена, при этом на миограмме не возникает характерная RЕМ атония. При видеомониторировании регистрируется двигательная активность в виде движений тела, мышечных подергиваний, совпадающих с периодом REM-сна.
Полученные данные характерны для расстройства поведения, связанного с REM-сном.
По данным неврологического обследования установлена дисциркуляторная энцефалопатия с экстрапирамидной недостаточностью. Болезнь Паркинсона.
Полисомнографическое исследование через 1 год наблюдения: нарушение процесса сна в виде снижения эффективности, повышенной фрагментарности. Синдром обструктивного апноэ сна средней степени. Латентный период REM-сна укорочен. Представленность REM-сна увеличена, при этом на миограмме не возникает характерная REM атония. При видеомониторировании регистрируется двигательная активность в виде движений тела, мышечных подергиваний, совпадающих с периодом REM-сна, сноговорение, частые повороты с тенденцией к подъему в вертикальное положение.
Полученные данные характерны для расстройства поведения, связанного с REM-сном, отрицательная динамика по сравнению с предыдущим исследованием.
Данные исследования проведены на базе:
- ФГБУ «СПб НИИ уха, горла, носа и речи Минздравсоцразвития России»;
- ФГУП «ГосНИИ ОЧБ» ФМБА России;
- СПб ГУЗ «Городская станция переливания крови»;
- ФГУ «СПб НИИ психо-неврологический институт им. В.М.Бехтерева».
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО РИНОСИНУСИТА | 2011 |
|
RU2469737C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ГНОЙНОГО РИНОСИНУСИТА | 2008 |
|
RU2379050C2 |
| СПОСОБ ИММУНОТЕРАПИИ ГНОЙНОГО РИНОСИНУСИТА | 2009 |
|
RU2408385C1 |
| СПОСОБ ИММУНОТЕРАПИИ ГНОЙНОГО РИНОСИНУСИТА | 2010 |
|
RU2457789C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТАКТИКИ ЛЕЧЕНИЯ РЕКОМБИНАНТНЫМ ЦИТОКИНОМ, РЕГУЛИРУЮЩИМ ВОСПАЛЕНИЕ | 2004 |
|
RU2271827C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ БОЛЕЗНИ ПАРКИНСОНА И ЭССЕНЦИАЛЬНОГО ТРЕМОРА | 2011 |
|
RU2467697C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРЕДРАСПОЛОЖЕННОСТИ К БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2003 |
|
RU2337142C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ИНТЕРЛЕЙКИНОМ-1 | 2005 |
|
RU2301012C2 |
| ЛЕЧЕНИЕ БОЛЕЗНИ АЛЬЦГЕЙМЕРА ЦИТОКИНАМИ | 2003 |
|
RU2519651C2 |
| Способ выявления первично-рефрактерной формы множественной миеломы в дебюте заболевания | 2020 |
|
RU2749612C1 |

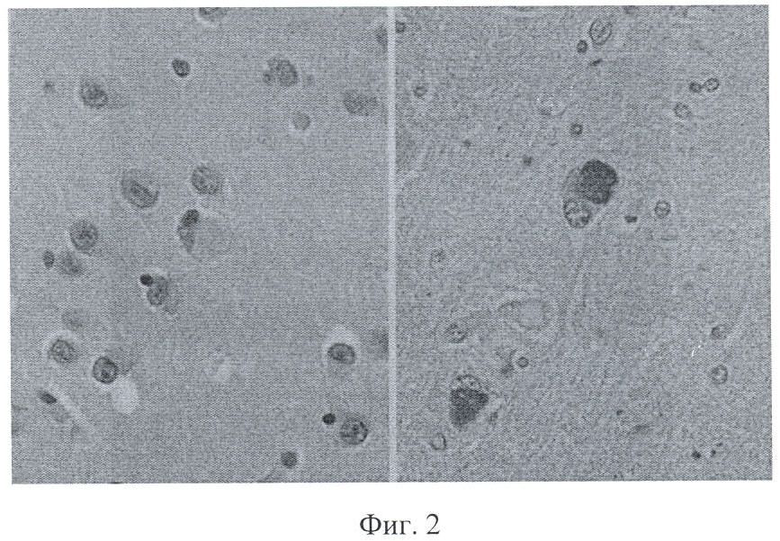
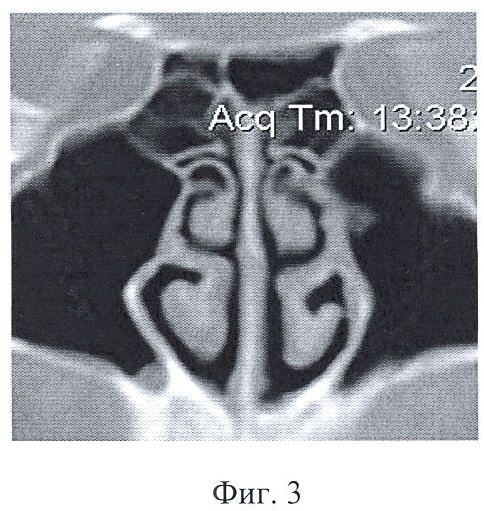



Изобретение относится к области медицины. Предложен способ диагностики заболевания Паркинсона у больных с нарушением функции обоняния. После перенесенной острой респираторной вирусной инфекции, сопровождающейся гипертермией, определяют нарушение функции обоняния. Проводят комплекс исследований, содержащий определение аллелей IL-1β(-511) «2/2», «1/2», HLA-DRA rs 3129882 SNP, повышенной продукции IL-1β, данные полисомнографии. При выявлении у больных с гипо- или аносмией носительства аллелей IL-1β(-511) «2/2», «1/2», HLA-DRA rs 3129882 SNP, повышенной сывороточной продукции цитокина, расстройства поведения, связанного с REM-сна, диагностируют болезнь Паркинсона. Изобретение позволяет осуществить диагностику болезни Паркинсона на ранних стадиях заболевания. 8 ил., 7 пр.
Способ диагностики заболевания Паркинсона у больных с нарушением функции обоняния, включающий определение нарушения функции обоняния после перенесенной острой респираторной вирусной инфекции, сопровождающейся гипертермией, иммунодиагностику, отличающийся тем, что проводят комплекс исследований, содержащий определение аллелей IL-1β(-511)«2/2», «1/2», HLA-DRA rs3129882 SNP, повышенной продукции IL-1β, данные полисомнографии, и при выявлении у больных с гипо- или аносмией носительства аллелей IL-1β(-511)«2/2», «1/2», HLA-DRA rs3129882 SNP, повышенной сывороточной продукции цитокина, расстройства поведения, связанного с REM-сна, диагностируют болезнь Паркинсона.
| POSTUMA R.B | |||
| et al | |||
| Markers of neurodegeneration in idiopathic rapid eye movement sleep behaviour disorder and Parkinson's disease | |||
| Brain | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| HAEHNER A | |||
| et al | |||
| Olfactory loss in Parkinson's disease | |||
| Parkinsons Dis | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2013-03-27—Публикация
2011-12-26—Подача