Изобретение относится к применению композиции, включающей адапален и пероксид бензоила (BPO), в приготовлении местного лекарственного средства, предназначенного для введения нуждающемуся в этом пациенту для обеспечения продолжительного лечения угрей обыкновенных, а также в изобретении предлагается способ продолжительного лечения угрей обыкновенных с помощью композиции, включающей адапален и BPO.
Угри обыкновенные представляют собой широко распространенное кожное нарушение, которым вызвано 20% обращений к дерматологам и которому подвержено большинство подросткового населения. Лечение угрей подвергается сомнению особенно при рассмотрении хронического течения заболевания и вариабельности в ответ на лечение.
Лечение угрей обыкновенных часто требует применения комбинированной терапии и продолжительной терапевтической стратегии (например, Thiboutot D. New treatments and therapeutic strategies for acne. Arch Family Med 2000; 9: 179-187; Gollnick H1 Cunliffe W, Berson D, et al. Management of acne, a report from a Global Alliance to Improve Outcomes in Acne. J Am Acad Dermatol. 2003;49 (1 suppl):S1-S37). Поддерживающая терапия необходима для многих пациентов с угревой сыпью, поскольку было показано, что повреждения в виде угревой сыпи рецидивируют после отмены схемы лечения (Gollnick H, Cunliffe W, Berson D, et al. Management of acne, a report from a Global Alliance to Improve Outcomes in Acne. J Am Acad Dermatol. 2003;49 (1 suppl):S1-S37; Thielitz A, Helmdach M, Ropke E-M, Gollnick H. Lipid analysis of follicular casts from cyanoacrylate strips as a new method for studying therapeutic effects of antiacne agents. Br J Dermatol. 2001; 145: 19-27). Продолжительная терапия необходима для многих пациентов с угревой сыпью для достижения целевого уменьшения повреждений в виде угревой сыпи, а также для увеличения вероятности поддержания краткосрочных улучшений этого часто рецидивирующего состояния (Tenaud I et al., In vitro modulation of TLR-2, CD1d and IL-10 by adapalene on normal human skin and acne inflammatory lesions Exp. Dermatol. 2007 Jun;16(6):500-6; and Thiboutot DM et al. Treatment considerations for inflammatory acne: clinical evidence for adapalene 0.1% in combination therapies, J Drugs Dermatol. 2006 Sep;5(8):785-94. Review. Erratum in: J Drugs Dermatol. 2007 Jan; 6(1): таблица содержания).
Несмотря на разнообразие лекарственных средств, доступных для лечения острой угревой сыпи, существует несколько исследований по поводу безопасности и эффективности продолжительного лечения пациентов, имеющих угри обыкновенные.
В настоящий момент наиболее эффективными комедолитическими агентами являются изотретиноин перорального применения и ретиноиды местного применения (Cunliffe WJ, Holland DB, Clark SM, Stables, Gl. Comedogenesis: some new aetiological, clinical and therapeutic strategies. Br J Dermatol. 2000;142:1084-1091). Изотретиноин перорального применения представляет собой непрактичный вариант для продолжительной терапии из-за его токсического и тератогенного потенциала. Лекарственные средства местного применения против угревой сыпи, такие как ретиноиды, могут быть ассоциированы с повышенной ирритацией кожи, таким образом, переносимость потенциальной поддерживающей терапии должна быть подвергнута тщательному рассмотрению. Кожные побочные эффекты могут уменьшить вероятность правильного соблюдения лечения, особенно при лечении бессимптомного состояния (Koo J. How do you foster medication adherence for better acne vulgaris management SKINmed. 2003; 2:229-33; и Haider A, Shaw JC. Treatment of acne vulgaris. JAMA. 2004;292:726-735).
Доступные местная и системная терапии для лечения угревой сыпи включают ретиноиды, пероксид бензоила (BPO), антибиотики и гормональную терапию. Так как угри обыкновенные включают множество этиологических факторов, включающих фолликулярный гиперкератоз, повышенное продуцирование секрета сальных желез, пролиферацию P. acnes и воспаление, (Thiboutot DM et al. Treatment considerations for inflammatory acne: clinical evidence for adapalene 0.1% in combination therapies, J Drugs Dermatol. 2006 Sep;5(8):785-94. Review. Erratum in: J Drugs Dermatol. 2007 Jan;6(1): таблица содержания; Pariser DM, Westmoreland P, Morris A, Gold MH, Liu Y, Graeber M. Long-term safety and efficacy of a new fixed-dose combination of adapalene 0.1% and benzoyl peroxide 2.5% for the treatment of acne vulgaris. J Drugs Dermatol. 2007; 6(9):899-905; Thiboutot DM, Bucko A, Eichenfield L, et al. Adapalene-benzoyl peroxide, a new fixed-dose combination for the treatment of acne vulgaris: results of a randomized, multi-centre, double-blind, controlled study. J Am Acad Dermatol. doi:10.1016/j.jaad.2007.06.006. Published online July 24, 2007), то в качестве продолжительной терапевтической стратегии используется комбинированная терапия, использующая агенты с взаимодополняющими механизмами, такие как ретиноид местного применения и противомикробное средство.
Настоящим руководством рекомендовано раннее начало комбинированной терапии с помощью ретиноидов местного применения и с помощью противомикробных средств для всех случаев угревой сыпи, но для наиболее тяжелых случаев с последующей поддерживающей ретиноидной терапией местного применения вместе с пероксидом бензоила (BPO) или в его отсутствии (Thiboutot DM et al., J Drugs Dermatol. 2006 Sep;5(8):785-94. Review. Erratum in: J Drugs Dermatol. 2007 Jan;6(1): таблица содержания). Хотя использование дополнительных агентов увеличивает сложность схемы лечения, комбинированная терапия является эффективной при ее применении к угревой сыпи с многосторонней патофизиологической природой. Комбинированные продукты с фиксированной дозой могут помочь пациентам и врачам в уменьшении сложности лечения угревой сыпи путем уменьшения количества лекарственных средств, которые пациенту следует помнить, чтобы принимать ежедневно, посредством чего потенциально улучшается соблюдение лечения. Несмотря на возможные преимущества, существует относительно немного комбинированных продуктов с фиксированной дозой, доступных для лечения угревой сыпи. Несколько комбинаций BPO-антибиотика доступны дополнительно к продукту, который объединяет ретиноид местного применения и антибиотик местного применения (Harkaway KS, McGinley KJ, Foglia AN et al. Antibiotic resistance patterns in coagulase-negative staphylococci after treatment with topical erythromycin, benzoyl peroxide, and combination therapy. Br J Dermatol. 1992; 126(6):586-90; Thielitz A, Krautheim A, Gollnick H. Update in retinoid therapy of acne. Dermatol Ther. 2006; 19(5):272-9; Adapalene-benzoyl peroxide, a new once daily fixed-dose combination for the treatment of acne vulgaris: a randomized, bilateral (split-face), dose-assessment study of cutaneous tolerability in healthy subjects. Cutis. Submitted).
Однако в настоящий момент не существует комбинированных продуктов, содержащих BPO и ретиноид местного применения, комбинации, которая была бы одновременно совместима с рекомендациями руководств по краткосрочному и продолжительному лечению угревой сыпи.
Таким образом, существует необходимость в появлении эффективного и безопасного лекарственного средства, которое бы соответствовало одновременно краткосрочному и продолжительному лечению угревой сыпи.
В настоящем изобретении предлагается безопасная и эффективная композиция, включающая адапален и пероксид бензоила, применяемая для продолжительного лечения угрей обыкновенных.
Таким образом, первое воплощение настоящего изобретения представляет собой применение композиции, которая в предпочтительном воплощении представляет собой комбинацию с фиксированной дозой, включающую адапален и BPO, в приготовлении местного лекарственного средства, предназначенного для введения нуждающемуся в этом пациенту для обеспечения продолжительного лечения угрей обыкновенных, где схема введения местного лекарственного средства включает введение терапевтически эффективного количества композиции в течение по меньшей мере 4 месяцев, предпочтительно в течение по меньшей мере 6 месяцев, более предпочтительно в течение по меньшей мере 9 месяцев, наиболее предпочтительно в течение по меньшей мере 12 месяцев. Местное лекарственное средство вводится ежедневно и предпочтительно раз в день. В другом воплощении местное лекарственное средство вводится каждые два дня и предпочтительно раз в день.
В обоих случаях местное лекарственное средство вводится вечером после очищающей кожу процедуры.
В предпочтительном воплощении местное лекарственное средство представляет собой гелевую композицию.
Местное лекарственное средство включает по меньшей мере 0,001% адапалена по массе по отношению к общей массе композиции, предпочтительно включает 0,01%-2% адапалена по массе, предпочтительно включает 0,01%-0,5% по массе, наиболее предпочтительно 0,1%-0,3% адапалена по массе по отношению к общей массе композиции. Лекарственное средство также включает 0,025%-20% BPO по массе, предпочтительно включает 0,5%-10% BPO по массе, наиболее предпочтительно 2%-10%, наиболее предпочтительно 2,5%-5% BPO по массе по отношению к общей массе композиции.
Другое воплощение изобретения представляет собой применение композиции, включающей адапален и BPO, в приготовлении местного лекарственного средства, предназначенного для введения пациенту для поддержания его биологической реакции при лечении угрей обыкновенных, где схема введения местного лекарственного средства включает применение к пораженной коже адапалена в количестве, которое находится в интервале 0,01%-0,5% по массе, и BPO в количестве, которое находится в интервале 2%-10% по массе по отношению к общей массе композиции в течение по меньшей мере 4 месяцев, предпочтительно в течение по меньшей мере 6 месяцев, более предпочтительно в течение по меньшей мере 9 месяцев; предпочтительно в течение по меньшей мере 12 месяцев. Конкретно, одно воплощение изобретения представляет собой применение композиции, включающей адапален и BPO, в приготовлении местного лекарственного средства, предназначенного для введения пациенту для поддержания его биологической реакции при лечении угрей обыкновенных, где схема введения местного лекарственного средства включает применение к пораженной коже адапалена в количестве, составляющем 0,1% по массе, и BPO в количестве, составляющем 2,5% по массе, раз в день ежедневно в течение по меньшей мере 6 месяцев, предпочтительно в течение по меньшей мере 9 месяцев, более предпочтительно в течение по меньшей мере 12 месяцев.
Согласно этим воплощениям местное лекарственное средство применяется к пораженной коже, которая содержит предпочтительно 20-100 невоспаленных повреждений и/или 20-50 воспаленных повреждений, и не содержит активных узелков или кист, и в предпочтительном воплощении композиция представляет собой гелевую композицию. В другом воплощении настоящее изобретение касается способа обеспечения продолжительного лечения угрей обыкновенных у нуждающегося в этом пациента, включающего местное применение к пораженной коже эффективного количества композиции, включающей адапален и пероксид бензоила в фармацевтически приемлемом носителе. Композиция применяется местно в течение по меньшей мере 4 месяцев, предпочтительно применяется в течение по меньшей мере 6 месяцев, предпочтительно в течение по меньшей мере 9 месяцев, более предпочтительно в течение по меньшей мере 12 месяцев.
Термин "фармацевтически приемлемый носитель" обозначает носитель, который совместим с кожей, с мембраной слизистой оболочки и наружным покровом.
Термин "фиксированная комбинация" следует понимать, как обозначение комбинации, чьи активные компоненты объединены в фиксированных дозах в одном и том же наполнителе/носителе (одна формула), который их вместе доставляет в точку применения. Предпочтительно фармацевтическая композиция в форме фиксированной комбинации представляет собой гель; в этом случае два активных компонента в процессе получения диспергированы и хорошо смешаны в одном и том же наполнителе, который осуществляет их совместную доставку во время применения геля.
Более конкретно в настоящем изобретении описана оценка клинической характеристики продолжительного действия этой комбинации с фиксированной дозой с помощью 12-месячного исследования, оценивающего безопасность и эффективность гелевой комбинации адапалена-BPO с фиксированной дозой при ежедневном применении раз в день для лечения субъектов, имеющих угри обыкновенные, при ее ежедневном использовании раз в день сроком до 12 месяцев.
Также в настоящем изобретении были приложены усилия к разработке эффективной композиции для дерматологических заболеваний, допускающей ежедневное применение раз в день и удобное использование для пациента.
Однако состав композиции, включающей BPO и ретиноиды, преподносит трудности. Прежде всего, эффективность BPO связана с его распадом при контактировании с кожей. Действительно, при распаде окислительные свойства свободных радикалов обеспечивают целевой эффект. Что касается оптимальной эффективности BPO, то, таким образом, является критичным предотвращение его распада во время хранения. Кроме того, BPO является нестабильным соединением, которое с трудом включают в состав комбинированных продуктов.
Растворимость и стабильность BPO были исследованы Chellquist et al. в этаноле, в пропиленгликоле и в смесях полиэтиленгликоля 400 (PEG 400) и воды (Chellquist E. M. et Gorman W. G., Pharm. Res., 1992, Vol.9: 1341-1346). Авторы отметили, что BPO в растворе деградирует в большей или меньшей степени согласно растворителю и его концентрации.
Время деградации BPO в PEG 400 (0,5 мг/г), в этаноле и в пропиленгликоле составляет соответственно 14, 29 и 53 дня при 40°C. Такая деградация не совместима с коммерциализированными продуктами. Другая техническая проблема, которую следует разрешить для получения композиции, включающей одновременно адапален и BPO, представляет собой химическую и физическую совместимость этих соединений внутри одного состава при условии, что обычные ретиноиды являются чувствительными к естественному окислению, к видимому свету и ультрафиолету, причем BPO представляет собой сильный окислительный агент.
Действительно, BPO инициирует быструю деградацию чувствительных к естественному окислению ретиноидов: 50% ретиноина деградирует в течение 2 часов, и 95% деградирует в течение 24 часов. Напротив, принимая во внимание композицию по изобретению, где адапален является ретиноидом, никакой деградации адапалена не выявляется в течение 24 часов. В контексте настоящего изобретения BPO может использоваться в свободной или инкапсулированной форме, например в адсорбированной форме BPO или в абсорбированной форме внутри любой пористой подложки. Он может представлять собой, например, инкапсулированный BPO внутри полимерной системы, состоящей из пористых микросфер, подобных микрогубкам, продаваемым под маркой Microsponges P009A пероксид бензоила от компании Cardinal Health.
Адапален (6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойная кислота) представляет собой производное нафтойной кислоты с потенциальными ретиноидными и противовоспалительными свойствами. Адапален был разработан для местного лечения угрей обыкновенных и других чувствительных к ретиноидам дерматозов, включающих разнообразные нарушения кератинизации, пролиферации и дифференцировки. Адапален функционирует, главным образом, путем регуляции дифференцировки кератиноцитов (комедолитический эффект и предотвращение образования новых комедонов), но также обладает противовоспалительной активностью. В особенности, адапален представляет собой хорошо переносимый ретиноид местного применения. Адапален продается под маркой Дифферин® с массовой концентрацией, составляющей 0,1%, в форме раствора в виде "спиртового лосьона", в форме водорастворимого геля и в форме крема. Эти композиции предназначены для лечения угревой сыпи.
Настоящее изобретение охватывает также соли адапалена. Под солями адапалена обозначаются соли, образованные с фармацевтически приемлемым основанием, особенно с минеральными основаниями, такими как гидроксид натрия, гидроксид калия и аммониевые или органические основания, такие как лизин, аргинин или N-метилглутамин. Термин "соли адапалена" также обозначает соли, образованные с помощью жирных аминов, таких как диоктиламин и стеариламин.
Кроме того, патентная заявка WO 03/055472 описывает стабильные фармацевтические композиции, включающие адапален и пероксид бензоила (BPO).
Опубликованные незначительные побочные реакции, ассоциированные с адапаленом, включают обычные признаки и симптомы локальных ирритативных реакций (эритема, шелушение, сухая кожа, зуд, ожог и жжение), редкие случаи локальных аллергических реакций (эдема в месте применения, контактная экзема или дерматит), или другие кожные и придаточные нарушения (очень редкие случаи гипопигментации и гиперпигментации, фоточувствительных реакций, истончения волос, роста волос, эрозии кожи после любой процедуры для лица). Однако адапален и другие эффективные ретиноиды были исследованы только с помощью краткосрочного клинического испытания (12 недель). Таким образом, существует необходимость разработки безопасного и эффективного способа продолжительного лечения угрей обыкновенных, и, кроме того, без индуцирования бактериальной устойчивости. BPO представляет собой хорошо исследованный противомикробный агент, который более эффективен в подавлении P acnes, чем антибиотики местного применения, без признаков устойчивости к нему микроорганизмов.
Так как ретиноиды не создают селективного давления на устойчивость, то ожидается, что эта комбинация уменьшит случаи возникновения эпидермальной устойчивости бактерий по отношению к антибиотику.
Кроме того, как показано в примере, композиция по настоящему изобретению, которая представляет собой комбинацию адапалена и пероксида бензоила (BPO) с фиксированной дозой, обнаружила при текущем продолжительном исследовании хорошую переносимость, с безопасностью и типом переносимости, подобно монотерапии адапалена.
Преимущественно настоящая композиция включает BPO в количестве, которое находится в интервале 0,0001-20% по массе, и адапален, в количестве, которое находится в интервале 0,0001-20% по массе по отношению к общей массе композиции; предпочтительно соответственно BPO 0,025-10% по массе и адапален 0,01-2% по массе по отношению к общей массе композиции.
Предпочтительно и в качестве примера в композиции, предназначенной для лечения угревой сыпи, BPO используется в концентрациях, которые находятся в интервале 2-10% по массе и предпочтительно в интервале 2,5-5% по массе по отношению к общей массе композиции. В этом типе композиции адапален используется в концентрации, которая находится в интервале 0,01-1% по массе и предпочтительно в интервале 0,01-0,5%, наиболее предпочтительно 0,1-0,3% по массе по отношению к общей массе композиции. Преимущественно частицы адапалена и BPO имеют размер такой, что по меньшей мере 80% частиц и предпочтительно по меньшей мере 90% частиц имеют диаметр менее чем 25 мкм и по меньшей мере 99% частиц имеют диаметр менее чем 100 мкм.
Целью настоящего изобретения является предложение эффективного способа лечения угрей обыкновенных на продолжительной основе с использованием композиции, объединяющей адапален и BPO. Другой целью настоящего изобретения является предложение продолжительного лечения угрей обыкновенных с повышенной эффективностью и сравнимой переносимостью с использованием повышенной эффективности адапалена и BPO по сравнению с краткосрочными исследованиями. Изобретение также относится к способу лечения пациента, пораженного заболеванием в виде угрей обыкновенных, причем способ включает местное применение к пораженному участку кожи пациента местного лекарственного средства (которое здесь представляет собой дерматологический препарат), включает введение терапевтически эффективного количества композиции, включающей адапален и BPO, по меньшей мере каждые два дня, предпочтительно по меньшей мере один раз каждые два дня. Более предпочтительно композиция вводится ежедневно, предпочтительно один раз ежедневно в течение по меньшей мере 6 месяцев, более предпочтительно один раз ежедневно в течение по меньшей мере 12 месяцев. Местное лекарственное средство, которое представляет собой дерматологический препарат, может применяться к пораженному участку кожи вечером после очищающей кожу процедуры, предпочтительно один раз ежедневно.
Более конкретно в настоящем изобретении предлагается применение адапалена и BPO в приготовлении местного лекарственного средства, предназначенного для введения пациенту для поддержания его биологической реакции при лечении угрей обыкновенных, где схема введения местного лекарственного средства включает введение адапалена в количестве, составляющем 0,1% по массе и BPO в количестве, составляющем 2,5% по массе, один раз ежедневно в течение более чем 3 месяцев, предпочтительно в течение по меньшей мере 4 месяцев, более предпочтительно в течение по меньшей мере 6 месяцев, более предпочтительно в течение по меньшей мере 9 месяцев, наиболее предпочтительно в течение по меньшей мере 12 месяцев.
Изобретение также относится к способу продолжительного лечения угрей обыкновенных, включающему местное применение к пораженной коже пациента местного лекарственного средства, включающего адапален в количестве, составляющем 0,1% по массе, и BPO в количестве, составляющем 2,5% по массе, один раз ежедневно в течение более чем 3 месяцев, предпочтительно в течение по меньшей мере 4 месяцев, более предпочтительно в течение по меньшей мере 6 месяцев, более предпочтительно в течение по меньшей мере 9 месяцев, наиболее предпочтительно в течение по меньшей мере 12 месяцев.
Местное лекарственное средство представлено в форме, совместимой с местным введением и, в особенности, в форме геля, крема, лосьона, эмульсии, суспензии.
Предпочтительно местное лекарственное средство представляет собой гелевую композицию и более предпочтительно представляет собой водорастворимую гелевую композицию, включающую адапален в количестве, составляющем 0,1% по массе, и BPO в количестве, составляющем 2,5% по массе, и применяется к пораженной коже в течение по меньшей мере 4 месяцев, более предпочтительно в течение по меньшей мере 6 месяцев, наиболее предпочтительно в течение по меньшей мере 9 месяцев, предпочтительно в течение по меньшей мере 12 месяцев. Местное лекарственное средство является в особенности эффективным, когда пораженная кожа содержит 20-100 невоспаленных повреждений, 20-50 воспаленных повреждений и не содержит активных узелков и кист. Для лучшего понимания изобретения, его используемых преимуществ и определенных целей, достигнутых с помощью его применения, должна иметься ссылка на чертеж и текстовый материал, в котором проиллюстрированы и описаны предпочтительные воплощения изобретения.
На чертежах:
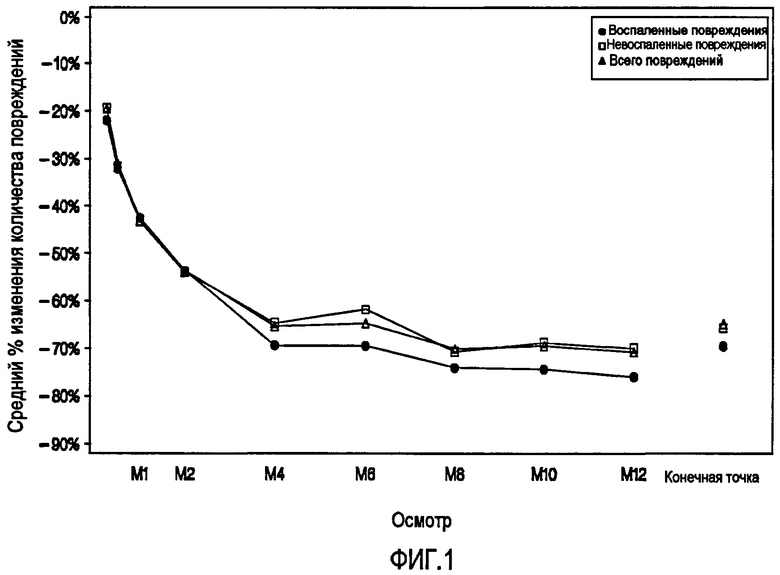
На Фиг.1 показана зависимость от времени среднего относительного изменения числа повреждений. Среднее Относительное Изменение Числа Повреждений (ITT-популяция, Наблюдаемые Данные, и Месяц 12 LOCF) Ожидаемый результат: последние доступные данные, наблюдаемые во время исследования. Использовали исходное значение, если данные после исходной точки исследования были не доступны.
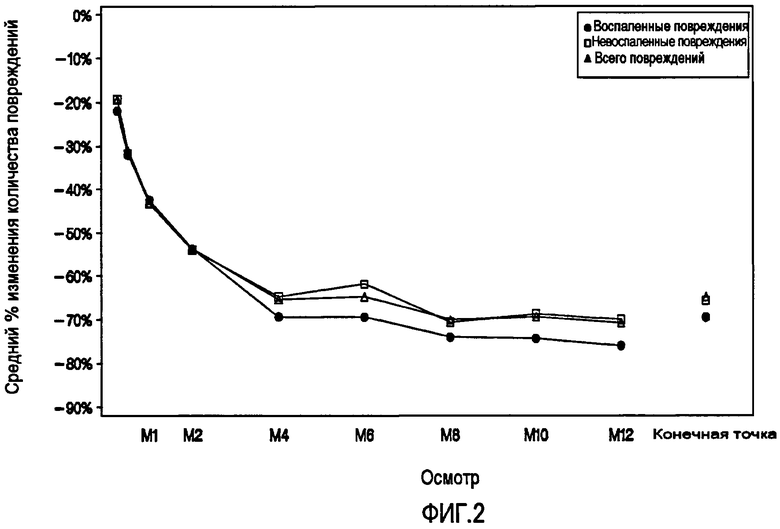
На фиг.2 показана зависимость от времени локальной кожной ирритации (выше, чем данные в исходной точке исследования, наблюдаемые данные и балльная оценка последних данных). Процентное содержание субъектов с балльной оценкой выше, чем в исходной точке исследования в каждый момент времени вместе с ожидаемым результатом.
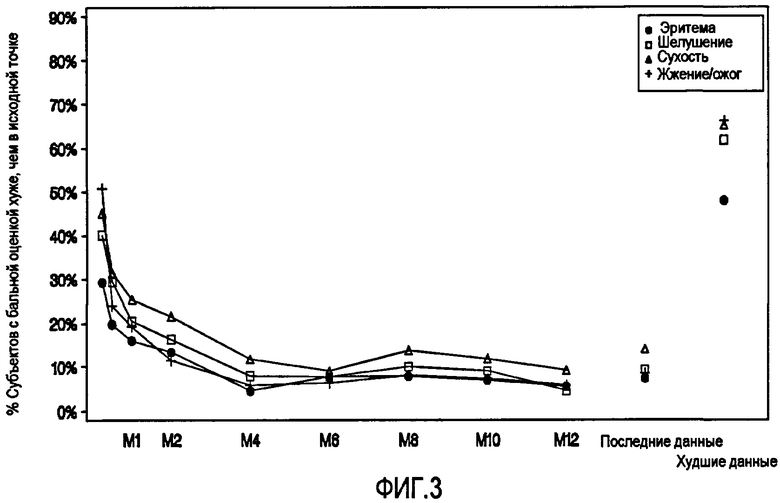
Фиг.3: показана локальная Переносимость с отображением Балльной Оценки Последний Данных и Балльной Оценки Данных по Ухудшению (Популяция Безопасности)
"Последние данные" обозначают последние доступные данные, наблюдаемые в течение периода после исходной точки исследования.
"Данные по Ухудшению" обозначают наблюдаемые данные о наибольшей степени тяжести в течение периода после исходной точки исследования.
В настоящем изобретении предлагается способ продолжительного лечения угрей обыкновенных с помощью применения гелевой композиции, содержащей адапален в количестве, составляющем 0,1% по массе, и пероксид бензоила в количестве, составляющем 2,5% по массе. Такой продукт описан в патентной заявке WO03/055472. Далее подробно описано исследование, которое ясно демонстрирует клиническое преимущество продолжительного лечения угревой сыпи с помощью вышеуказанной композиции.
Пример: Клинический тест продолжительного лечения угрей обыкновенных с помощью гелевой комбинации с фиксированной дозой, содержащей адапален в количестве, составляющем 0,1%, и BPO в количестве, составляющем 2,5% по массе по отношению к общей массе композиции.
План исследования и субъекты
Безопасность и эффективность продолжительного лечения с помощью гелевой комбинации адапалена-BPO с фиксированной дозой оценивали в многоцентровом, открытом, не сравнительном исследовании, проведенном в 28 центрах в Соединенных Штатах.
Субъекты, имеющие заболевание в виде угрей обыкновенных, применяли на лице один раз в день ежедневно адапален-BPO сроком до 12 месяцев.
Оценки безопасности и эффективности проводили в исходной точке, на 1 неделе, на 2 неделе, и в месяцы 1, 2, 4, 6, 8, 10, и 12. Тест мочи на беременность требовался для всех женщин с детородным потенциалом в исходной точке и при осмотре в последнем исследовании. Субъекты могли свободно выбывать из исследования в любое время и по любой причине. Состояние субъектов, не завершивших всего исследования, могло быть оценено, когда это возможно.
В целом было вовлечено 452 субъекта в 28 исследовательских центрах в Соединенных Штатах. Все 452 субъекта применяли исследуемое лекарственное средство по меньшей мере один раз и были проанализированы одновременно в популяциях безопасности и эффективности (ITT). В исследование были вовлечены субъекты мужчины и женщины в возрасте 12 лет или старше, имеющие 30-100 невоспаленных лицевых повреждений 20-50 воспаленных лицевых повреждений и не имеющие активных узелков или кист. Определенные периоды нейтрализации требовались для субъектов, принимающих определенные местные и системные лечения. Критерий исключения препятствовал вовлечению субъектов с тяжелой угревой сыпью, которым требуется терапия с использованием изотретиноина, или субъектов с другими дерматологическими состояниями, требующими противодействующего лечения. Женщины исключались в случае, если они были беременными, кормящими, или которые планировали беременность, а также мужчины с растительностью на лице, которая бы препятствовала оценке.
СУММИРОВАНИЕ ДЕМОГРАФИЧЕСКИХ ДАННЫХ О СУБЪЕКТАХ И ИСХОДНЫЕ ХАРАКТЕРИСТИКИ (ITT-ПОПУЛЯЦИЯ)
Оценки безопасности и эффективности
Безопасность и переносимость оценивали с помощью исследований локальной лицевой переносимости и побочных эффектов. При каждом осмотре исследователь оценивал эритему, шелушение, степень сухости, жжение/ожог по шкале в интервале от 0 (отсутствует) до 3 (тяжелое проявление). Побочные эффекты оценивали при каждом осмотре. Обычные лабораторные данные (гематологию, химический анализ крови и анализ мочи) собирали для скрининга на 6 месяц и 12 месяц. Параметры эффективности представляли собой процент уменьшения числа повреждений относительно исходной точки исследования (всего, воспаленные, невоспаленные), и проводили оценку состояния угревой сыпи субъекта (по шкале от 0 [полное улучшение] до 5 [ухудшение]). Число повреждений оценивали только на лице за исключением носа.
Параметры эффективности и безопасности
Таблица 2 представляет собой схему оценки измерений во время исследования.
СХЕМА ИЗМЕРЕНИЙ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ
Мес. = Месяц
Исследователь (или ответственное лицо) проводил оценки эффективности, состоящие из подсчета числа невоспаленных повреждений (открытых и закрытых комедонов) и подсчета числа воспаленных повреждений (папулы и пустулы) и узелки/кисты. Подсчет числа повреждений проводили только на лице. Оценку угревой сыпи субъекта также документировали.
Число невоспаленных и воспаленных повреждений подсчитывали на лбу, на левой и правой щеках и на подбородке выше челюстной кости (за исключением носа). Общее число повреждений рассчитывали с помощью организатора исследования. Использовали следующие определения:
Невоспаленные повреждения
- Открытый комедон: масса жирового материала, уплотненного за открытым фоллюкулярным отверстием (угри).
- Закрытый комедон: масса жирового материала, уплотненного за закрытым фоллюкулярным отверстием (белые угри).
Воспаленные повреждения
- Папула: небольшая твердая припухлость с диаметром менее чем один сантиметр.
- Пустула: Небольшая ограниченная припухлость кожи, которая содержит желто-белый экссудат.
Узелок/Киста: Ограниченное припухлое повреждение с диаметром, как правило, более чем 1 см.
Субъекты оценивали свою лицевую угревую сыпь на 6 месяц и 12 месяц/осмотр при досрочном завершении по сравнению с осмотром в исходной точке исследования согласно следующей шкале:
Оцениваемые параметры безопасности представляли собой: локальную переносимость (эритему, шелушение, сухость и жжение/ожог), побочные эффекты (ПЭ), и обычные лабораторные данные (гематология, химический анализ крови и анализ мочи). Побочные эффекты, ожидаемые во время лечения с помощью ретиноидов местного применения, включают эритему, шелушение, сухость и жжение/ожог. Во время исследования ряд этих ожидаемых событий оценивали как локальную переносимость.
Эритему, шелушение, сухость и жжение/ожог оценивали по следующим шкалам:
ЭРИТЕМА: АНОМАЛЬНОЕ ПОКРАСНЕНИЕ КОЖИ
ШЕЛУШЕНИЕ: АНОМАЛЬНАЯ ПОТЕРЯ РОГОВОГО СЛОЯ
СУХОСТЬ: ОЩУЩЕНИЕ ЛОМКОСТИ И/ИЛИ СТЯГИВАНИЯ
ЖЖЕНИЕ/ОЖОГ: ОЩУЩЕНИЕ ПОЩИПЫВАНИЯ СРАЗУ ПОСЛЕ ВВЕДЕНИЯ ДОЗЫ
(В ТЕЧЕНИЕ 5 МИНУТ)
Эритему, шелушение и сухость оценивали с помощью исследователя. Жжение/ожог оценивают с помощью Исследователя после обсуждения с субъектом.
Показатели локальной переносимости признаков и симптомов ирритации кожи предполагали наличие побочных эффектов только, если степень тяжести ожидаемых признаков и симптомов была такой, что приводила к прекращению участия субъекта в исследовании по его/ее просьбе или по усмотрению исследователя. Измененные схемы введения дозы (такие, как введение через день) для лечения ирритации не предполагали прекращения участия субъекта в исследовании.
Побочные эффекты (ПЭ)
ПЭ определяли как любой нежелательный или непредусмотренный признак, симптом или заболевание, временно ассоциированное с использованием лекарственного (исследовательского) продукта, связанное или нет с исследовательским продуктом. Любой новый признак, симптом или заболевание или клинически значимое увеличение интенсивности существующего признака, симптома или заболевания рассматривается в качестве ПЭ. Это включает любые новые признаки или симптомы, которыми страдает субъект после случайной или намеренной передозировки или неправильного применения. Отсутствие эффективности исследуемого лекарственного средства не предполагает наличия ПЭ до тех пор, пока оно не приводит к нежелательным медицинским проявлениям. Однако клинически значимое ухудшение заболевания, повергнутого лечению, предполагало наличие ПЭ. Беременность не предполагала наличия ПЭ, но представляла собой важное событие с медицинской точки зрения.
Степень тяжести ПЭ оценивали как небольшую, среднюю или тяжелую. Связь ПЭ с исследуемым лекарственным средством оценивали как: связанный (возможно, вероятно или определенно связанный) или не связанный (маловероятно или определенно не связанный).
Тяжелые побочные эффекты (ТПЭ)
ТПЭ определяли как любое неблагоприятное медицинское проявление, которое при любой дозе:
- приводило в результате к смерти - было опасным для жизни (т.e. субъект подвергался риску смерти во время проявления этого эффекта, но не такого эффекта, который гипотетически может вызывать смерть, если он будет более тяжелым);
- требовало госпитализации в стационаре или к продлению существующей госпитализации (не создают ТПЭ госпитализация исключительно для проведения диагностических тестов, даже если они связаны с побочным эффектом, элективная госпитализация для любого вмешательства, запланированного до того, как субъект был принят для участия в исследовании, или обращение в центр дневной медицинской помощи);
- приводило в результате к стойкой или значительной недееспособности/нетрудоспособности или
- приводило в результате к наследственной аномалии/появлению дефекта, или
- к другим важным медицинским эффектам, которые подвергают риску субъекта или требуют вмешательства для предотвращения одного из последствий, перечисленных выше.
Обычные лабораторные тесты
Образцы крови и мочи получали согласно плану, описанному в схеме исследования Таблицы 1. Оценивали следующие параметры химического анализа крови: белок, альбумин, глобулин, соотношение A/G, билирубин (общий), аланин трансаминазу (ALT), аспартат трансаминазу (AST), щелочные фосфаты, гамма-глутаминтрансферазу GGT, дегидрогеназу молочной кислоты (LDH), азот мочевины крови (BUN), креатинин, мочевую кислоту, холестерин (общий), триглицериды и глюкозу.
Оценивали следующие гематологические параметры: гематокрит, гемоглобин, количество эритроцитов, средний объем эритроцита (MCV), среднее содержание гемоглобина в эритроците (MCH), средняя концентрация гемоглобина в эритроците (MCHC), лейкоцитарную формулу, и количество тромбоцитов.
Осуществляли обычный анализ мочи для следующих параметров: цвет, прозрачность, удельный вес, реакция pH мочи, глюкоза, белок (качественный анализ), кетоны, скрытая кровь, билирубин, нитрит и лейкоциты.
Статистический анализ
Поскольку данное исследование являлось открытым, то проводили презентации только описательных данных. Не тестировали формальных статистических гипотез. Описательную статистику использовали, чтобы суммировать все данные. Для непрерывных переменных, количество субъектов (N), среднее значение, стандартное отклонение (SD), среднее, минимальное и максимальное значения представлены для данных, собранных при каждом осмотре, и представлены изменения/процент изменений относительно исходной точки исследования при каждом осмотре после исходной точки исследования. Для категорийных переменных представлены частота и процент каждой категории.
Все суммирования характеристик субъекта и данных по эффективности были осуществлены на основе популяции, сформированной в соответствии с назначенным вмешательством (ITT), (эта популяция состоит из всех вовлеченных субъектов, для кого предназначено исследуемое лекарственное средство). Все данные по безопасности основаны на популяции безопасности (все субъекты, кто принимал исследуемое лекарственное средство по меньшей мере один раз).
Аналитические осмотры проводили согласно алгоритму для суммирования данных на протяжении лечения. Если присутствовали многократные измерения внутри одного и того же интервала, то для анализа использовали измерение, ближайшее ко дню целевого исследования. Если два измерения снимали с равными различиями в расписании по сравнению с целевым днем, то для анализа использовали данные, полученные из номинального количества осмотров (записанные в индивидуальной регистрационной карте). Например, если измерения собирали в День 360 и День 367, то данные, собранные в День 360, использовали для анализа Месяца 12, тогда как данные, собранные в День 367, использовали для анализа конечной точки исследования. Хотя для анализа использовали все данные, полученные при проведении осмотров, некоторые данные использовали для анализа благодаря многократным наблюдениям внутри интервалов между осмотрами.
Данные субъектов для всех подвергнутых лечению субъектов суммировали по четырем кварталам исследования: "Исходная точка исследования - <3 месяца", "3 месяца - <6 месяцев", "6 месяцев - <9 месяцев", и "9 месяцев - 1 год". Табулировали количество субъектов, подверженных повышенному риску в каждый период (т.e. субъекты, доступные в момент начала каждого периода). Количество субъектов, подверженных повышенному риску, определяли на основе продолжительности лечения каждого субъекта. Для этих расчетов предполагалось, что каждый месяц содержит 30 дней, и использовали 7-дневные интервалы между осмотрами. Таким образом, "Исходная точка исследования - <3 месяца" представляет собой интервал от Дня 1 до Дня 82, "3 месяца - <6 месяцев" представляет собой интервал от Дня 83 до Дня 172, "6 месяцев - <9 месяцев" представляет собой интервал от Дня 173 до Дня 262, "9 месяцев - 1 год" представляет собой интервал от Дня 263 до Дня 352, и "1 год и более" представляет собой интервал от Дня 353 и более.
По тому же принципу суммировались данные о субъектах, завершивших/прекративших исследование, по количеству субъектов и в течение четырех кварталов. Степень прекращения исследования для каждого квартала рассчитывали как количество субъектов, кто прекратил исследование в течение данного периода, деленное на количество субъектов, подверженных повышенному риску на данный период. Запланированные параметры безопасности, которые следует проанализировать, представляли собой следующие:
1. Оценка локальной переносимости (эритема, шелушение, сухость, жжение/ожог) следовало оценить в исходной точке исследования и при каждом осмотре после исходной точки исследования по шкале от "0" (=Отсутствует) до "3" (=Тяжелое проявление).
2. ПЭ следовало оценивать при каждом осмотре.
3. Обычные лабораторные данные (гематология, химический анализ крови, анализ мочи) следовало собирать при скрининге, в месяц 6 и месяц 12/осмотр при досрочном прекращении исследования.
Запланированные параметры эффективности, которые следует проанализировать, представляли собой:
1. Процентное изменение относительно исходной точки исследования количества лицевых воспаленных повреждений, невоспаленных лицевых повреждений и общего количества Повреждений при предписанных осмотрах после исходной точки исследования.
2. Оценка угревой сыпи субъектов по шкале от "5" (Ухудшение) до "0" (Полное улучшение) в месяц 6 и месяц 12/осмотр при досрочном прекращении исследования.
Количество невоспаленных повреждений представляло собой сумму открытых комедон и закрытых комедонов. Количество воспаленных повреждений представляло собой сумму папул и пустул. Количество других повреждений представляло собой сумму узелков и кист. Общее количество повреждений представляло собой сумму воспаленных, невоспаленных и других повреждений. Оценку угревой сыпи субъекта оценивали по шкале от 5 (Ухудшение) до 0 (Полное улучшение).
Популяция, сформированная в соответствии с назначенным вмешательством (ITT), определялась как все вовлеченные в исследование субъекты, которым предназначено лекарственное средство. Популяция безопасности определялась как все вовлеченные в исследование субъекты, кто применял исследуемое лекарственное средство по меньшей мере один раз. Табулировали количество субъектов, для которых имели место отклонения от условий основного протокола. Для данного исследования не определяли популяцию (PP) из выполнивших условия протокола и завершивших исследование лиц.
Все анализы данных проводили согласно заранее установленному плану анализа. Объем выборки, составляющий 450, выбирали, чтобы гарантировать, что приблизительно 300 субъектов будут подвержены воздействию адапалена-BPO в течение по меньшей мере 6 месяцев, и 100 будут подвержены воздействию в течение срока до 1 года. Все данные по безопасности суммировали на основе популяции безопасности. Побочные эффекты табулировали в виде таблиц распределения и суммировали по кварталам для оценки профиля побочных эффектов в динамике по времени. Параметры переносимости (эритему, шелушение, сухость, жжение/ожог) суммировали с помощью балльной оценки силы этих процессов. Таблицу сдвигов для лабораторных данных при скрининге против последнего осмотра в период после исходной точки исследования табулировали для каждого лабораторного параметра. Все данные об эффективности суммировали на основе ITT-популяции. Суммировали данные по количеству повреждений, собранному при каждом осмотре, а также изменения и процент изменений относительно исходной точки исследования при осмотрах в период после исходной точки исследования. Табулировали оценку угревой сыпи субъектов. Использовали описательную статистику для суммирования данных. Не тестировали формальных статистических гипотез.
Популяция безопасности определялась как все пациенты, рандомизированные и подвергнутые лечению по меньшей мере один раз. Популяция, сформированная в соответствии с назначенным вмешательством (ITT), включала всех рандомизированных субъектов, которым предназначено исследуемое лекарственное средство. В каждый момент времени оценки эффективности оценивали с использованием наблюдаемых данных, а также с использованием методологии пролонгирования последнего наблюдения (LOCF). Табулировали количество субъектов, для которых имели место отклонения от основного протокола. Для данного исследования не определяли популяцию (PP) из выполнивших условия протокола и завершившие исследование лиц.
РЕЗУЛЬТАТЫ
Диспозиция субъектов и характеристики исходной точки исследования
Всего 452 субъекта были вовлечены в исследование (таблица 1). Все 452 субъекта применяли исследуемое лекарственное средство по меньшей мере один раз, и были проанализированы в ITT-популяции и в популяции безопасности. Всего 397 (87,8%) субъектов оценивали в течение 3 месяцев или более, 366 (81%) оценивали в течение 6 месяцев или более, и 334 (73,9%) оценивали в течение 9 месяцев или более. Суммарно, 327 (72,3%) субъектов завершили 12-месячное исследование. Средняя протяженность (±SD) воздействия составила 294,6 дня (±117,7). Ни один субъект не прекращал исследования из-за отсутствия эффективности, и процент прекращения из-за побочных эффектов был низким (2%). Характеристики исходной точки исследования ITT-популяции суммированы в Таблице I.
Оценка эффективности
Результаты процентного изменения количества повреждений в ITT-популяции показаны на Фиг.1 и в таблице 8.
СУММИРОВАНИЕ ВОСПАЛЕННЫХ, НЕВОСПАЛЕННЫХ И ОБЩЕГО КОЛИЧЕСТВА ПОВРЕЖДЕНИЙ: СРЕДНЕЕ КОЛИЧЕСТВО В ИСХОДНОЙ ТОЧКЕ ИССЛЕДОВАНИЯ И СРЕДНЕЕ ПРОЦЕНТНОЕ ИЗМЕНЕНИЕ ОТНОСИТЕЛЬНО ИСХОДНОЙ ТОЧКИ ИССЛЕДОВАНИЯ ПРИ КАЖДОМ ОСМОТРЕ И В МЕСЯЦ 12 LOCF (ITT-ПОПУЛЯЦИЯ)
Для 327 субъектов, кто остался в исследовании до осмотра в Месяц 12 (завершенные случаи), процентные уменьшения в целом, количества воспаленных и невоспаленных повреждений составили 70,8%, 76% и 70% соответственно. Когда рассматривались данные для ITT LOCF, то средние процентные уменьшения относительно исходной точки исследования в целом, количества воспаленных и невоспаленных повреждений составили 64,9%, 69,5%, и 65,7% в месяц 12 соответственно. Уменьшения воспаленных, невоспаленных и общего количества повреждений наблюдали уже на неделе 1. Для пациентов, оставшихся в исследовании, количество повреждений продолжало уменьшаться в течение первых 4 месяцев исследования, и уменьшения продолжались на протяжении времени исследования.
Оценка субъектов демонстрировала клиническое улучшение при лечении с помощью адапалена-BPO в течение 12 месяцев. В конце исследования 330 субъектов (330/411, 80,3%) сообщали о среднем, заметном или полном улучшении, 45 субъектов (45/411, 10,9%) сообщали о минимальном улучшении и 36 субъектов (36/411, 8,8%) сообщали об отсутствии изменения или об ухудшении. Результаты были подобны независимо от возраста, пола или расы.
Фиг.1 иллюстрирует эффект комбинированной терапии с помощью адапалена-BPO на лицевую угревую сыпь в течение 12-месячного курса исследования.
СУММИРОВАНИЕ ОЦЕНКИ УГРЕВОЙ СЫПИ СУБЪЕКТОВ (ITT-ПОПУЛЯЦИЯ, МЕСЯЦ 12 НАБЛЮДАЕМЫЕ ДАННЫЕ, И МЕСЯЦ 12 LOCF)
Оценка безопасности
Оценка локальной переносимости
Параметры локальной переносимости (эритему, шелушение, сухость и жжение/ожог) суммировали с помощью балльной оценки при каждом осмотре силы этих процессов по шкале из 4 точек (от 0=отсутствует до 3=тяжелое проявление). Каждую балльную оценку субъекта, соответствующую "Ухудшению" и "Последним данным", суммировали, где "Ухудшение" соответствовало наивысшей балльной оценке, и "Последние данные" соответствовали последнему наблюдению во время периода после исходной точки исследования.
При каждом осмотре в период после исходной точки исследования табулировали количество субъектов, чьи данные локальной переносимости были хуже (более высокая балльная оценка), чем их балльная оценка в исходной точке исследования. Балльные оценки для каждого субъекта табулировали в случае превышения балльных оценок, соответствующих "Ухудшению" и "Последним данным", над балльными оценками в исходной точке исследования.
В целом, лечение субъектов, имеющих заболевание в виде угревой сыпи, с помощью адапалена-BPO было безопасным и хорошо переносимым при использовании в течение периода до 12 месяцев. Балльные оценки по силе эритемы, шелушения, сухости, жжения/ожога после исследуемого лечения суммированы на Фиг.2. Локальная кожная переносимость исследуемого лечения была хорошей на протяжении всего исследования, где все средние балльные оценки переносимости для эритемы, шелушения, сухости, жжения/ожога составляли менее чем 1 (небольшие проявления) при каждом осмотре в период исследования. Средние значения худших балльных оценок всех субъектов были связаны с небольшой ирритацией. Средние значения наивысших балльных оценок кожи были записаны при первом осмотре после исходной точки исследования (неделя 1), и затем уменьшались до уровня, подобного балльным оценкам в исходной точке исследования.
Эритему, шелушение, сухость и жжение/ожог распределяли при осмотре в исходной точке исследования и при каждом осмотре после исходной точки исследования по шкале от "0" (=Отсутствует) до "3" (=Тяжелые проявления). Для каждого из признаков и симптомов результаты были подобны. Худшие балльные оценки степени тяжести соответствовали, как правило, небольшим или средним проявлениям, и редко тяжелым. С помощью оценок локальной переносимости в Таблице 10 для субъектов представлено суммирование балльных оценок, которые хуже, чем в исходной точке исследования. Частота балльных оценок локальной переносимости, соответствующих тяжелым проявлениям, находилась в интервале от 0,4% до 3,3% для всех признаков и симптомов.
СУММИРОВАНИЕ ДАННЫХ ОБ ОЦЕНКАХ ЛОКАЛЬНОЙ ПЕРЕНОСИМОСТИ - ПРОЦЕНТ СУБЪЕКТОВ С БАЛЛЬНЫМИ ОЦЕНКАМИ ХУЖЕ, ЧЕМ В ИСХОДНОЙ ТОЧКЕ ИССЛЕДОВАНИЯ (ПОПУЛЯЦИЯ БЕЗОПАСНОСТИ)
Ухудшение: Наблюдаемые данные, соответствующие наивысшей степени тяжести в период после исходной точки исследования.
В течение первой недели лечения с помощью геля, содержащего адапален/пероксид бензоила, поступили сообщения о большинстве балльных оценок, соответствующих оценкам локальной переносимости, которые были хуже, чем балльные оценки в исходной точке исследования, а именно о 29,3% субъектов с проявлениями эритемы, 40,2% с проявлениями шелушения, 45,2% с проявлениями сухости и 50,8% с проявлениями жжения/ожога (Таблица 10). Однако проявления эритемы, шелушения и жжения/ожога быстро уменьшились, и к месяцу 4 сообщалось о 10% субъектов или менее с этими проявлениями. Проявления сухости составляли менее чем 12% к месяцу 4, и после месяца 4 колебались от 9% до 14% для оставшихся в исследовании субъектов. Ожидаемые признаки и симптомы локальной кожной ирритации колебались по степени тяжести от небольших до средних.
Очень мало субъектов имело балльные оценки, соответствующие тяжелым проявлениям. (Таблица 11).
СУММИРОВАНИЕ ДАННЫХ ОБ ОЦЕНКАХ ЛОКАЛЬНОЙ ПЕРЕНОСИМОСТИ, КОТОРЫЕ БЫЛИ ХУЖЕ, ЧЕМ В ИСХОДНОЙ ТОЧКЕ ИССЛЕДОВАНИЯ - БАЛЛЬНЫЕ ОЦЕНКИ УХУДШЕНИЯ (ПОПУЛЯЦИЯ БЕЗОПАСНОСТИ)
N (%)
N (%)
bN = 448 представляет собой количество субъектов, данные о локальной переносимости которых были доступны в Исходной точке исследования и по меньшей мере один раз после Исходной точки исследования.
Побочные эффекты
Все ПЭ, записанные в индивидуальных регистрационных картах (CRF), продемонстрированы в распечатках данных.
Данные об ПЭ также были суммированы для всех субъектов. Субъектов учитывали только один раз по системе учета субъектов, даже если сообщалось более чем об одном случае, и только один раз по системе COSTART (Кодирующие Символы для Словаря Терминов Побочных Реакций), даже если сообщалось более чем об одном случае.
Проявление ПЭ по кварталам суммировали для периодов "Исходная точка исследования - <3 месяца", "3 месяца - <6 месяцев", "6 месяцев - <9 месяцев" и "9 месяцев - 1 год". Проявление ПЭ для каждого периода рассчитывали как количество субъектов с данными о проявлении ПЭ в данный период, деленное на количество субъектов, подверженных риску в данный период. Таблицы суммирования данных об ПЭ приведены в Плане Статистического Анализа (ПСА).
Суммирование данных о побочных эффектах в течение всего курса исследования показано в Таблице 12. Всего 288 субъектов (63,7%) испытали побочные эффекты в течение исследования. Всего 147 субъектов (32,5%) имели связанные с лечением побочные эффекты (т.e. связь побочного эффекта с исследуемым лекарственным средством оценивали как "возможную", "вероятную" или как "определенную связь"). Наиболее распространенным связанным с лечением побочным эффектом была сухая кожа (17,3%) (Таблица 13). Большинство побочных эффектов были небольшими или средними по степени тяжести. Большинство побочных эффектов встречалось в первые три месяца терапии, и их проявление снижалось при последующих осмотрах. Только 19 субъектов (4,2%) имели тяжелые побочные эффекты, и из них 10 субъектов (2,2%) имели тяжелые побочные эффекты, признанные, по меньшей мере, возможно связанными с исследуемым лечением. В течение 12-месячного курса исследования только 9 субъектов имели 10 побочных эффектов, которые привели к прекращению исследования. Из этих 10 побочных эффектов 7 были связаны с исследуемым лечением.
ОБЩЕЕ СУММИРОВАНИЕ ДАННЫХ О ПОБОЧНЫХ ЭФФЕКТАХ
(ПОПУЛЯЦИЯ БЕЗОПАСНОСТИ)
(N+=452)
(N+=397)
(N+=366)
(N+=334)
(N=452)
(63,7%)
(28,1%)
(32,5%)
Связанный с исследуемым лекарственным средством обозначает, что связь ПЭ с исследуемым лекарственным средством оценивали как 'возможную', 'вероятную' или 'определенную связь'.
Субъектов могли учитывать в течение более чем одного периода, благодаря множественным ПЭ.
ПЭ с неполной датой наступления или с датой наступления, предшествующей первому применению, только включали в Итоговую колонку.
N+=N, подверженных риску, количество субъектов в начале каждого периода.
НАИБОЛЕЕ ЧАСТО ВСТРЕЧАЮЩИЕСЯ ПОБОЧНЫЕ ЭФФЕКТЫ, О КОТОРЫХ СООБЩИЛ ПО МЕНЬШЕЙ МЕРЕ 1% ВСЕХ СУБЪЕКТОВ С ПОМОЩЬЮ СИСТЕМНО-ОРГАННЫХ КЛАССОВ И ТЕРМИНОВ ПРЕДПОЧТИТЕЛЬНОГО УПОТРЕБЛЕНИЯ (ПОПУЛЯЦИЯ БЕЗОПАСНОСТИ)
(N+=452)
(N+=397)
(N+=366)
(N+=334)
(N=452)
Многократные встречаемости термина предпочтительного употребления субъектом учитывались только один раз на систему терминов предпочтительного употребления.
Субъекта учитывали один раз, даже если субъект испытывал более чем один ПЭ во время исследования.
Субъекты могли учитываться в течение более чем одного периода благодаря множественным ПЭ.
ПЭ с неполной датой наступления или с датой наступления, предшествующей первому применению, только включали в Итоговую колонку.
N+=N, подверженных риску, количество субъектов в начале каждого периода.
Пять субъектов (5/452, 1,1%) имели в целом 6 тяжелых побочных эффектов (депрессию, стафилококковую инфекцию, перелом ключицы, обморок, биполярное расстройство и лекарственная зависимость), которые не являлись дерматологическими и не были связаны с исследуемым лекарственным средством. Во время исследования отсутствовали смертные случаи и не встречались подтвержденные случаи сенсибилизации. В течение курса сроком один год не наблюдали клинически релевантных связанных с лекарственным средством изменений в обычных лабораторных параметрах (клинической биохимии, гематологии и анализе мочи). Десять субъектов (10/452, 2,2%) имели клинически значимые лабораторные оценки в виде побочных эффектов в период после исходной точки исследования, хотя они не рассматривались, как связанные с лечением.
Это исследование представляет собой первую продолжительную клиническую оценку безопасности и эффективности уникальной комбинации ретиноида (адапалена 0,1%) и BPO 2,5% с фиксированной дозой. Эта одноразовая комбинация адресована множеству патогенных факторов угревой сыпи, обеспечивая быструю и устойчивую эффективность при отсутствии риска устойчивости к антибиотикам. В целом, результаты исследования поддерживают безопасное и эффективное применение гелевой комбинации адапалена и BPO с фиксированной дозой для продолжительного лечения субъектов, имеющих заболевание в виде угрей обыкновенных. Что касается безопасности, то большинство побочных эффектов и симптомов ирритации кожи представляли собой проявления со степенью тяжести от небольшой до средней, которые встречались на ранней стадии исследования и носили временный характер. Применение ежедневного увлажняющего средства в начале терапии может помочь избежать наиболее широко распространенных побочных эффектов, подобных сухости кожи. Представляется важным, что имела место низкая степень прекращений исследования, вызванных побочными эффектами (2%), и субъекты не прекращали исследования при отсутствии эффективности. Наблюдали уменьшение количества клинически значимых воспаленных и невоспаленных повреждений уже на неделе 1, которое поддерживалось сроком до 1 года. Восемьдесят процентов (80%) субъектов сообщили о среднем, заметном или полном улучшении их угревой сыпи. Результаты этого исследования согласуются с предыдущим 12-недельным контролируемым исследованием с двойной анонимностью, которое показало, что комбинация адапалена-BPO производила значительно больше уменьшения повреждений и обладала более быстрым проявлением действия по отношению к соответствующим монотерапиям, и обладала сравнимым с адапаленом профилем безопасности.
Так как угревая сыпь является хроническим заболеванием, то ее лечение часто требует продолжительной терапевтической стратегии для контроля угревой сыпи и поддержания улучшений. Для всех случаев угревой сыпи, но в особенности для наиболее тяжелых случаев следует применять комбинированную терапию с использованием агентов с взаимодополняющими механизмами действия так рано, как это возможно, и затем следует применять последующую поддерживающую терапию. Как наблюдалось в данном исследовании, применение комбинации адапалена-BPO с фиксированной дозой может применяться одновременно для начальной и продолжительной терапии для угревой сыпи со степенью тяжести от средней до тяжелой. Предыдущие исследования показали, что применение комбинированной терапии с использованием геля, содержащего 0,1% адапален, могут быть более переносимыми, и ассоциированы с меньшей степенью побочных эффектов по отношению к другим ретиноидам местного применения. Согласно этим предыдущим экспериментам, адапален, при объединении с BPO в составе с фиксированной дозой, хорошо переносился во время предварительных клинических исследований, в крупном контролируемом клиническом исследовании с двойной анонимностью и в настоящем продолжительном исследовании, обладая при этом профилем безопасности и переносимости, подобным профилю при монотерапии адапалена. Кроме того, хорошо переносимая комбинированная терапия с фиксированной дозой также может быть более удобной и может упростить схему лечения угревой сыпи, посредством чего потенциально улучшается соблюдение лечения.
Результаты этого исследования сравнимы с недавно опубликованными сообщениями об исследованиях поддерживающего лечения угревой сыпи. Было показано, что повреждения при угревой сыпи возвращаются после прекращения схемы комбинированной терапии и, таким образом, продолжительная терапия необходима для многих пациентов, имеющих заболевание в виде угревой сыпи. В этом исследовании повреждения при угревой сыпи продолжали уменьшаться от исходной точки исследования приблизительно до месяца 4, и терапевтический эффект поддерживался на протяжении года. Существует несколько опубликованных исследований, демонстрирующих значение продолжительного лечения, следующего за успешной начальной терапией, помогающего ограничить развитие субклинических микрокомедонов, и, посредством чего, предотвратить возврат заболевания после начального улучшения. Например, Thiboutot et al. оценили поддерживающий эффект геля, содержащего 0,1% адапалена, по отношению к гелю, содержащему носитель, у 253 субъектов, успешно подвергнутых лечению с помощью предыдущей исследуемой комбинированной терапии с использованием адапалена-доксициклина. Это 16-недельное исследование продемонстрировало значительное клиническое преимущество продолжительного лечения с помощью геля, содержащего 0,1% адапалена, по отношению к носителю. Хотя будущие исследования нуждаются в корректной оценке применения адапалена-BPO в качестве поддерживающей терапии, результаты настоящего исследования о безопасности и эффективности продолжительного лечения предполагают, что расширение набора инструментов и лекарственных средств, доступных для лечения угревой сыпи, обеспечит большую гибкость для осуществления одновременно краткосрочного и продолжительного лечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СХЕМА ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С АКНЕ | 2009 |
|
RU2490035C2 |
| СПОСОБ ПРИМЕНЕНИЯ АДАПАЛЕНА ПРИ ПОДДЕРЖИВАЮЩЕЙ ТЕРАПИИ УГРЕВОЙ СЫПИ | 2005 |
|
RU2413509C2 |
| ГЕЛЕВАЯ МОЮЩАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ БЕНЗОИЛПЕРОКСИД (ВРО) | 2013 |
|
RU2706695C2 |
| СОСТАВ ДЛЯ ТОПИЧЕСКОГО ПРИМЕНЕНИЯ, СОДЕРЖАЩИЙ МИКРОСФЕРЫ АДАПАЛЕНА И КЛИНДАМИЦИН | 2009 |
|
RU2497515C2 |
| АДАПАЛЕН ДЛЯ ДЛИТЕЛЬНОГО ЛЕЧЕНИЯ ОБЫКНОВЕННЫХ УГРЕЙ | 2006 |
|
RU2419424C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ МЕСТНОГО ПРИМЕНЕНИЯ, СОДЕРЖАЩИЕ ПРОТИВОУГРЕВОЕ СОЕДИНЕНИЕ И АНТИБИОТИЧЕСКОЕ СОЕДИНЕНИЕ | 2005 |
|
RU2404759C2 |
| ГЕЛЬ, СОДЕРЖАЩИЙ ПО МЕНЬШЕЙ МЕРЕ ОДИН РЕТИНОИД И ПЕРОКСИД БЕНЗОИЛА | 2002 |
|
RU2320327C2 |
| Средство для лечения акне | 2020 |
|
RU2764574C1 |
| ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ОСНОВЕ PORIFERA ДЛЯ ЛЕЧЕНИЯ И ПРЕДОТВРАЩЕНИЯ КОЖНЫХ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2345782C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ УГРЕВОЙ БОЛЕЗНИ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2548714C2 |
Изобретение относится к области фармацевтики и представляет собой применение композиции, включающей адапален и пероксид бензоила, в приготовлении местного лекарственного средства, предназначенного для применения к нуждающемуся в этом пациенту для обеспечения продолжительного лечения угрей обыкновенных, где схема применения местного лекарственного средства включает нанесение терапевтически эффективного количества композиции в течение по меньшей мере 9 месяцев. Изобретение обеспечивает достижение устойчивого положительного эффекта при продолжительном лечении акне композицией, включающей адапален и пероксид бензоила, а также отсутствие существенных побочных эффектов. 4 н. и 15 з.п. ф-лы, 1 пр., 3 ил.
1. Применение композиции, включающей адапален и пероксид бензоила, в приготовлении местного лекарственного средства, предназначенного для применения к нуждающемуся в этом пациенту для обеспечения продолжительного лечения угрей обыкновенных, где схема применения местного лекарственного средства включает нанесение терапевтически эффективного количества композиции в течение, по меньшей мере, 9 месяцев.
2. Применение по п.1, где композиция, включающая адапален и пероксид бензоила, представляет собой комбинацию с фиксированной дозой.
3. Применение по п.1, где местное лекарственное средство применяется в течение, по меньшей мере, 12 месяцев.
4. Применение по любому из пп.1-3, где местное лекарственное средство применяется ежедневно и предпочтительно раз в день.
5. Применение по любому из пп.1-3, где местное лекарственное средство применяется каждые два дня.
6. Применение по любому из пп.1-3, где местное лекарственное средство применяется вечером после очищающей кожу процедуры.
7. Применение по любому из пп.1-3, где местное лекарственное средство представляет собой гелевую композицию.
8. Применение по п.1 или 2, где местное лекарственное средство включает, по меньшей мере, 0,001% адапалена по массе по отношению к общей массе композиции.
9. Применение по п.1, где местное лекарственное средство включает 0,01-2% адапалена по массе, предпочтительно включает 0,01-0,5% по массе, наиболее предпочтительно 0,1-0,3% адапалена по массе, по отношению к общей массе композиции.
10. Применение по п.8, где местное лекарственное средство включает 0,025-20% пероксида бензоила по массе, предпочтительно включает 2-10% пероксида бензоила по массе, наиболее предпочтительно 2,5-5% пероксида бензоила по массе, по отношению к общей массе композиции.
11. Применение по п.9, где местное лекарственное средство включает 0,025-20% пероксида бензоила по массе, предпочтительно включает 2-10% пероксида бензоила по массе, наиболее предпочтительно 2,5-5% пероксида бензоила по массе по отношению к общей массе композиции.
12. Применение композиции, включающей адапален и пероксид бензоила в приготовлении местного лекарственного средства, предназначенного для применения к пациенту так, чтобы поддерживать его биологическую реакцию при лечении угрей обыкновенных, где схема применения местного лекарственного средства включает применение к пораженной коже адапалена в количестве, которое находится в интервале 0,01-0,5% по массе, и пероксида бензоила в количестве, которое находится в интервале 2-10% по массе по отношению к общей массе композиции, в течение, по меньшей мере, 9 месяцев.
13. Применение по п.12, где местное лекарственное средство вводится в течение, по меньшей мере, 12 месяцев.
14. Применение композиции, включающей адапален и пероксид бензоила, в приготовлении местного лекарственного средства, предназначенного для применения к пациенту для поддержания его биологической реакции при лечении угрей обыкновенных, где схема применения местного лекарственного средства включает применение к пораженной коже адапалена в количестве, составляющем 0,1% по массе, и пероксида бензоила в количестве, составляющем 2,5% по массе, раз в день ежедневно в течение, по меньшей мере, 9 месяцев.
15. Применение по п.14, где местное лекарственное средство применяется к пораженной коже в течение, по меньшей мере, 12 месяцев.
16. Применение по любому из пп.12-15, где пораженная кожа содержит 20-100 невоспаленных повреждений, 20-50 воспаленных повреждений, и не содержит активных узелков или кист.
17. Применение по любому из пп.1-3, 9-15, где композиция представляет собой гелевую композицию.
18. Способ обеспечения продолжительного лечения угрей обыкновенных у нуждающегося в этом пациента, включающий местное применение к пораженной коже эффективного количества композиции, включающей адапален и пероксид бензоила, в приемлемом фармацевтическом носителе в течение, по меньшей мере, 9 месяцев.
19. Способ по п.18, где композиция применяется местно в течение, по меньшей мере, 12 месяцев.
| US 2003170196 A1, 11.09.2003 | |||
| Korkut С, Piskin S | |||
| Benzoyl peroxide, adapalene, and their combination in the treatment of acne vulgaris // The Journal of dermatology, V.32, No 3, p.169-173, 2005 | |||
| WO 2006079563 A1, 03.08.2006 | |||
| US 2006128808 A1, 15.06.2006 | |||
| R.Capizzi et al | |||
| Skin tolerability and efficacy of combination therapy with hydrogen peroxide |
Авторы
Даты
2013-05-20—Публикация
2008-01-30—Подача