Изобретение относится к технологии получения углеродных сорбентов с антибактериальными свойствами на основе пористых углеродных адсорбентов и предназначено для применения в медицине и ветеринарии.
Разработка эффективных материалов, обладающих антибактериальными свойствами, по-прежнему является актуальной задачей. Одним из наиболее эффективных методов в эфферентной терапии для лечения инфекционных заболеваний является аппликационная сорбция (вульнеросорбция) - метод выведения токсичных компонентов через раневую поверхность или очаг воспаления. При наложении сорбента происходит очистка раневого содержимого или гнойной полости и ускоряется транспорт некоторых веществ из крови с их последующей сорбцией.
Известно, что углеродные материалы проявляют высокую сорбционную способность в отношении бактерий и бактериальных токсинов.
Проявление сорбционной способности активированного угля по отношению к стафилококковому токсину было установлено в работах Н.Н.Каплина, В.Ф.Серкова, В.Н.Алексеева и др. (Каплина Н.Н. [и др.] Метод повышения сорбционной емкости активированного угля по отношению к стафилококковому токсину // Лабораторное дело. 1979. №9. С.546). Также установлено, что характер и величина адсорбции бактериальных клеток зависит от объема пор углеродного сорбента (Коваленко Г.А. [и др.] // Углеродные материалы как адсорбенты для биологически активных веществ и бактериальных клеток. 1999. Т.61. №6. С.787-795).
Известны углеродные материалы СУМС-1 (на основе минерального носителя Al2O3) и СКН-1К, СКН-4М (на основе синтетических полимеров), способные сорбировать из лимфы клетки золотистого стафилококка (штамм «Wood-46»), пневмококка, стрептококка (Самсонов К.В. Сравнительная эффективность сорбции бактерий и бактериальных токсинов углеродными и углерод-минеральными сорбентами // Бюллетень физиологии и патологии дыхания. 2008. Вып.29. С.48-50). Согласно результатам исследований углерод-минеральный сорбент СУМС-1 осаждал на своей поверхности наибольшее количество исследуемых пневмотропных микроорганизмов, что объясняется наличием на его поверхности различных по химической природе центров: полярных и неполярных. В большей степени данным сорбентом осаждался стафилококк, несколько меньше - пневмококк и стрептококк.
Для повышения антибактериальных свойств углеродного гемосорбента СУМС-1 на его поверхность адсорбировали противопротозойный и противомикробный препарат метронидазол (действующее вещество: 1-(b-оксиэтил)-2-метил-5-нитроимидазол) (патенты РФ №№2121842, 2127595, 2144797). Данный препарат активен в отношении Trichomonas vaginalis, Gardnerella vaginalis, Giardia intestinalis, Entamoeba histolytica, облигатных анаэробных бактерий: Bacteroides spp. (в том числе Bacteroides fragilis, Bacteroides distasonis, Bacteroides ovatus, Bacteroides thetaiotaomicron, Bacteroides vulgatus), Fusobacterium spp., Veillonela spp.; некоторых грамположительных бактерий: Eubacterium spp., Clostridium spp., Peptococcus spp., Peptostreptococcus spp, а также Helicobacter pylori.
Действие данного препарата не исследовано по отношению к патогенным бактериям - возбудителям сепсиса. Кроме того, по применению метронидазола имеются противопоказания: повышенная чувствительность, нарушение кроветворения, активные заболевания центральной нервной системы, а также значительный ряд побочных эффектов.
Таким образом, для повышения эффективности антибактериальных свойств углеродных сорбентов необходимо использовать модификатор - препарат, проявляющий активность в отношении патогенной микрофлоры широкого спектра, но и не оказывающий отрицательного воздействия на организм.
Известно, что полимеры на основе N-винилпирролидона (ВП) находят широкое применение как гидрофильные нетоксичные материалы в медицине и биологии. Они допущены к применению в контакте с биологическими средами живого организма и могут выполнять разнообразные функции в составе материалов медицинского назначения (Черникова Е.В., Терпугова П.С., Филиппов А.Н. Контролируемая радикальная полимеризация N-винилпирролидона и N-винилсукцинимда в условиях обратимой передачи цепи по механизму присоединение-фрагментация. // ЖПХ. 2009. Т.82. №10. С.1730-1737). Полимеры на основе ВП используют для модификации анионных поверхностно-активных веществ, обладающих высокой бактерицидной активностью (Афиногенов Г.Е., Панарин Е.Ф. Антимикробные полимеры. С-Пб: Гиппократ, 1993, 263 с.). Ряд сополимеров ВП с ионогенными сомономерами обладает собственной антимикробной активностью, иммуностимулирующим и иммуномодулирующим действием. Для выведения токсических веществ из организма обычно используют поли-N-винилпирролидон (ПВП) с молекулярным весом 10000-15000.
Низкомолекулярный ПВП широко используется как вспомогательное вещество при создании различных лекарственных форм, обладающих антибактериальным воздействием (патенты РФ №№2281773, 2279278); при создании глазных пленок в офтальмологии (патент №2286170); в качестве солюбилизатора при создании дезинфицирующего средства (патент №2308292); как биологически активное вещество и структурообразователь в раневых повязках (патент №2331444); в качестве конъюгата при создании антибактериального лекарственного средства (патент №2371447); как стабилизатор в противовирусном препарате (патент №2438697); в качестве иммуномодулятора в препаратах для профилактики и лечения респираторных и желудочно-кишечных инфекционных заболеваний бактериальной и вирусной этиологии сельскохозяйственных животных (патент №2286171) и т.д.
Известно применение ПВП в составе мазей для лечения инфицированных ран с содержанием его до 5,5% (патенты №№2146127, 2233652). Согласно исследованиям В.Н.Мальцевой и др. (В.Н.Мальцева, В.А.Стрельников, Я.Я.Федоровский. Влияние поливинилпирролидона на микробные клетки // Журнал микробиологии. 1987. N 4. С.9-11) ПВП начинает проявлять антибактериальные свойства при концентрации в растворе порядка 1,0%.
Нанесение ПВП на поверхность углеродного сорбента позволяет повысить его детоксикационные свойства за счет миграции макромолекул ПВП в биологическую жидкость. При этом в качестве дополнительного положительного эффекта отмечается повышение смачиваемости углеродного материала, вследствие лиофилизации его поверхности и понижении поверхностной энергии.
Наиболее близким к предлагаемому сорбенту является углеродный мезопористый гемосорбент ВНИИТУ-1, который состоит из гранул размером 0,5-1,0 мм, характеризуется высокой химической чистотой (содержание углерода не менее 99,5%) и удельной адсорбционной поверхностью 300-400 м2/г (Технические условия ТУ 9398-002-71069834-2004 Гемосорбент углеродный в физиологическом растворе стерильный ВНИИТУ-1; рекламный проспект ВНИИТУ-1 Института проблем переработки углеводородов СО РАН, 2011 год).
Наиболее близким к предлагаемому способу получения углеродного сорбента является способ модифицирования углеродного сорбента путем пропитки гранул углеродного гемосорбента водным раствором аминокапроновой кислоты с концентрацией 5-20% при соотношении гемосорбент:раствор модифицирующей кислоты 1:10-1:20 в течение 2-4 час при температуре 25-90°С, отделение гемосорбента от пропитывающего раствора, сушку пропитанного гемосорбента при 105°С до постоянного веса, проведение процесса поликонденсации нанесенной на поверхность гемосорбента аминокапроновой кислоты в инертной среде при температуре 120-350°С в течение 0,25-6 час при перемешивании, кипячение в дистиллированной воде в течение 1-3 час и высушивание полученного продукта на воздухе при комнатной температуре (патент РФ №2440844).
Целью изобретения является разработка углеродного сорбента с выраженными антибактериальными свойствами.
Предлагаемый способ получения углеродного сорбента с антибактериальными свойствами включает пропитку гранул углеродного гемосорбента раствором модификатора и высушивание продукта и отличается тем, что пропитку гранул проводят 0,2-1,0% раствором инициатора в N-винилпирролидоне при рН 7,0-7,5, остаточном давлении 15-20 мм рт.ст. и соотношении гемосорбент:раствор инициатора в N-винилпирролидоне 1:1,4-2,0 в течение 15-30 минут с последующим подъемом температуры до 65-75°С, выдержкой при этой температуре в течение 0,5-8 часов в инертной атмосфере и отмывкой в воде от остаточного мономера при комнатной температуре в течение 0,5-2 часов.
Предлагаемый углеродный сорбент с антибактериальными свойствами представляет собой гранулы округлой формы, содержит поливинилпирролидон в количестве 4,5-5,5%, характеризуется удельной адсорбционной поверхностью менее 50 м2/г и общим объемом пор менее 0,30 см3/г.
Отличительными признаками данного изобретения являются:
- использование в качестве исходного материала углеродного гемосорбента с развитой удельной адсорбционной поверхностью 300-400 м2/г и суммарным объемом пор не менее 0,4 см3/г;
- модифицирование поверхности углеродного гемосорбента раствором инициатора в N-винилпирролидоне с последующей полимеризацией нанесенного вещества.
Процесс модифицирования проводится в несколько стадий:
- пропитка гранул углеродного гемосорбента раствором инициатора в N-винилпирролидоне с концентрацией 0,2-1,0% при рН 7,0-7,5, остаточном давлении 15-20 мм рт.ст. и соотношении гемосорбент:раствор инициатора в N-винилпирролидоне 1:1,4-2,0 в течение 15-30 минут;
- полимеризация нанесенного N-винилпирролидона, для чего проводят подъем температуры до 65-75°С и выдерживают гранулы при этой температуре в течение 0,5-8 часов в инертной атмосфере;
- отмывка гранул от остаточного мономера в воде при комнатной температуре в течение 0,5-2 часов;
- сушка отмытого продукта при комнатной температуре в течение 18-24 часов с получением углеродного сорбента с антибактериальными свойствами.
Модифицирование углеродного гемосорбента по предлагаемому способу модификатором - мономерм N-винилпирролидоном - с его последующей полимеризацией изменяет как химическую природу поверхности углеродной матрицы, так и его пористую структуру. Результаты, иллюстрирующие изменения параметров пористой структуры и химического состава образцов углеродного сорбента, полученных по прототипу и при модифицировании N-винилпироллидоном с последующей полимеризацией, в соответствии с примерами настоящего изобретения, приведены в таблице 1.
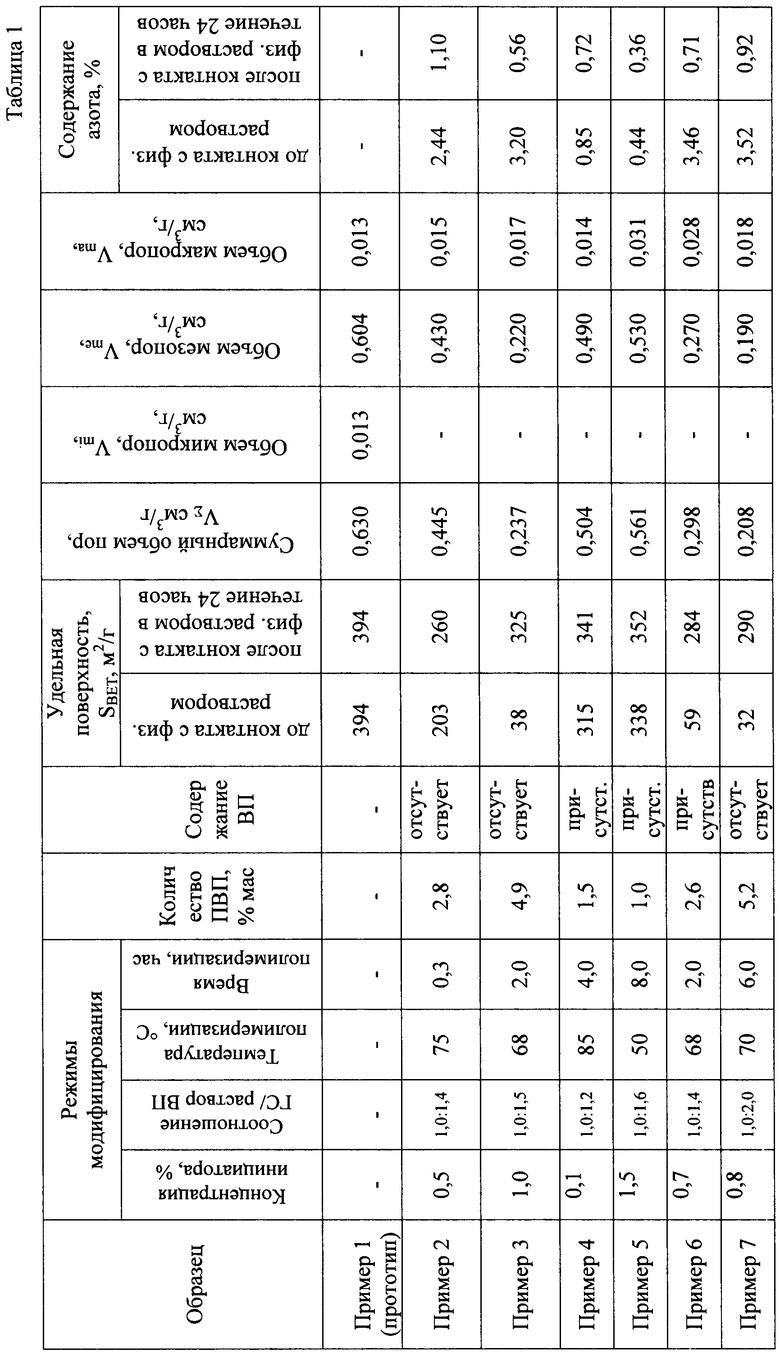
Определение физико-химических характеристик образцов исходного и модифицированного углеродного сорбента проводилось стандартными методами, применяемыми при исследовании пористых материалов: основные текстурные характеристики - удельную адсорбционную поверхность, суммарный объем пор и распределение пор по размерам определяли по изотермам адсорбции-десорбции азота, полученным на приборе «Gemini 2380» (США). Расчет величины адсорбционной удельной поверхности проводили по уравнению БЭТ. Рельеф и морфологию поверхности исследуемых образцов углеродного сорбента изучали методом растровой электронной микроскопии с использованием электронного микроскопа «JSM - 6460 LV» («JEOL», Япония). Рентгеновский микроанализ поверхности исследуемых образцов проводили на энергодисперсионном спектрометре EDAX («EDAX», Япония), оснащенном Si (Li) детектором с энергетическим разрешением 130 эВ. ИК спектры регистрировали на спектрометре NICOLET 5700 фирмы Thermo Fisher Scientific с разрешением 4 см-1 и числом накопления спектров 32. Спектры представлены после обработки в программном пакете "ORIGIN" (коррекция базовой линии и сглаживания). Измерения методом рентгеновской фотоэлектронной спектроскопии проводились на приборе ES-300 Kratos Analytical с применением Mg-анода (hv=1253.6 эВ). Количество нанесенного на поверхность гемосорбента полимера ПВП определяли методом дифференциального термического анализа по потере массы, которая фиксировалась по термограммам в диапазоне температур 330-340°С.
На фиг.1 представлены данные термогравиметрического (ТГА) и дифференциального термического (ДТА) анализов образцов - прототипа (а) и углеродных сорбентов по примеру 3(б) и по примеру 7(в).
Исследования проводились на приборе DTG-60H фирмы SHIMADZU (Япония), который одновременно записывает термические кривые: температуру - Т и ДТА, ТГ. Точность определения температуры составляла - 1°С, а изменения веса 0.1%. Съемки проводились в атмосфере воздуха, в интервале температур от комнатной до 1000°С, навеска образца составляла 10 мг, скорость подъема температуры 10°/мин.
Присутствие мономера (N-винилпирролидона) определяли по результатам анализа состава промывной воды модифицированных сорбентов методом ЯМР С13 на спектрометре "Advance-400". В случае присутствия ВП в составе промывных вод на ЯМР спектрах фиксировались пики, характерные для ВП.
Для изучения антибактериальных свойств модифицированных образцов углеродного гемосорбента в Центральной научно-исследовательской лаборатории Омской государственной медицинской академии проведены медико-биологические исследования (стендовые испытания).
В работе использовали грамположительные тест-микроорганизмы (Staphylococcus aureus, стафилококк золотистый) и грамотрицательные тест-микроорганизмы (Pseudomonas aeruginosa, синегнойная палочка; Klebsiella pneumonia, клебсиелла пневмонии, Escherichia coli, кишечная палочка). Кроме того, исследовали смесь испытуемых культур, которую готовили смешением равных объемов приготовленных рабочих концентраций микробных клеток. Исходное разведение с концентрацией 0,5 единиц по Мак Фарланду с использованием Денситометра, перемешивание культур, суспензий сорбента с культурой проводили на встряхивателе «Vortex». Рабочее разведение культур для опыта - 1×103 КОЕ в 1 мл. Сорбцию клеток проводят из физиологического раствора с концентрацией микробных клеток 1×103 КОЕ/мл.
Для оценки антибактериального действия углеродных сорбентов использовали метод прямого посева на питательные среды. В качестве питательной среды выбран мясопептонный агар.
Количественное определение микроорганизмов проводили подсчетом бактериальных колоний на двух чашках Петри диаметром 90 мм, находили среднее значение и, умножая на показатель разведения, вычисляли число бактерий в 1 г на 1 мл образца. Контролем служили посевы рабочих разведений испытуемых культур.
Стерилизацию сорбентов перед проведением стендовых медико-биологических испытаний проводили насыщенным паром при избыточном давлении 0,11±0,02 МПа и температуре (12±1)°С в автоклаве.
Для иллюстрации изобретения приведены следующие примеры.
Пример 1 (по прототипу)
К гемосорбенту (в объеме 0,5 мл) добавляют 1 мл микробной взвеси (тест-микроорганизмы) и выдерживают в течение суток при периодическом ручном встряхивании в течение первых 30 мин контакта (для удаления пузырьков воздуха). Проводят по три параллельных испытания для каждого вида бактериальных клеток и для смеси микроорганизмов.
Надосадочную жидкость в количестве 100 мкл засевают на агаровые пластины с питательной средой после 24 ч контакта с сорбентом. Засеянные чашки Петри инкубируют 18-20 часов при 37°С в термостате. Проводят подсчет выросших колоний по трафарету визуально в 5-ти полях по 1 см2 и пересчитывают на площадь чашки. Результат оценивают по количеству колониеобразующих единиц на поверхности агара по сопоставлению с контролем.
Углеродный гемосорбент проявил антибактериальную активность в отношении тест-микроорганизмов Staphylococcus aureus: количество бактериальных клеток после контакта с гемосорбентом снизилось с 1х103 до 30 КОЕ/мл (от 300 до 11 колоний на чашке). Концентрация грамотрицательных бактерий после контакта с углеродным гемосорбентом сопоставима с концентрацией в контрольных образцах.
Пример 2
Навеску гемосорбента (1,0 г) засыпают в трехгорлую колбу, герметично закрытую и подсоединенную к вакуум-насосу с разрежением не менее 15 мм рт.ст. и выдерживают при комнатной температуре в течение 1 час. Далее, заранее приготовленным 0,5% раствором инициатора (динитрил азобисизомасляной кислоты - ДИНИЗ) в ВП пропитывают вакуумированную навеску в течение 15 минут при соотношении гемосорбент:раствор инициатора в N-винилпирролидоне 1:1,4. Затем вакуумный насос отключают, в колбу подают инертный газ (аргон), поднимают температуру до 75°С и выдерживают в течение 0,3 часа. По окончании модифицирования образец сорбента извлекают из колбы и проводят отмывку дистиллированной водой при комнатной температуре в течение 0,5 час, после чего образец высушивают при комнатной температуре в течение 24 часов.
Пример 3
Навеску гемосорбента пропитывают 1% раствором инициатора в ВП при соотношении гемосорбент:раствор 1:1,5 и проводят полимеризацию при температуре 68°С в течение 2 часов с последующей отмывкой и сушкой.
Проводят адсорбцию бактериальных клеток по примеру 1.
Установлено, что углеродный сорбент обладает антибактериальной активностью в отношении исследуемых тест-микроорганизмов - после взаимодействия модифицированного сорбента с патогенной микрофлорой рост микроорганизмов на чашках Петри отсутствовал.
Пример 4
Навеску гемосорбента пропитывают 0,1% раствором инициатора в ВП при соотношении гемосорбент:раствор 1:1,2 и проводят полимеризацию при температуре 85°С в течение 4 часов с последующей отмывкой и сушкой.
Пример 5
Навеску гемосорбента пропитывают 1,5% раствором инициатора в ВП при соотношении гемосорбент:раствор 1:1,6 и проводят полимеризацию при температуре 50°С в течение 8 часов с последующей отмывкой и сушкой.
Пример 6
Навеску гемосорбента пропитывают 0,7% раствором инициатора в ВП при соотношении гемосорбент:раствор 1:1,4 и проводят полимеризацию при температуре 68°С в течение 2 часов с последующей отмывкой и сушкой.
Пример 7
Навеску гемосорбента пропитывают 0,8% раствором инициатора в ВП при соотношении гемосорбент:раствор 1:2 и проводят полимеризацию при температуре 70°С в течение 6 часов с последующей отмывкой и сушкой.
Анализ физико-химических характеристик образцов углеродного сорбента позволил установить влияние модифицирования на параметры пористой текстуры и на химический состав (таблица 1). В процессе модифицирования полностью закрываются микропоры, в ~2 раза снижается объем мезопор. Экранирование углеродной поверхности полимерной пленкой ПВП уменьшает ее значение в ~2-3 раза (от 394 до 32 м2/г), снижается общий объем пор от 0,630 см3/г до 0,208 см3/т. При этом, чем больше количество введенного модификатора в пористую структуру, тем ниже значение удельной поверхности и общий объем пор. Содержание азота в составе сорбента увеличивается от 0 до 3,52% для модифицированных образцов.
Как следует из примеров и таблицы 1, снижение количества модифицирующего раствора приводит к уменьшению содержания ПВП, сорбировнного на поверхности гемосорбента и, соответственно, к меньшим изменениям текстуры: объема пор и удельной поверхности. Снижение концентрации инициатора в модифицирующей рецептуре обуславливает неполную полимеризацию нанесенного мономера и присутствие ВП на поверхности модифицированного гемосорбента даже при времени полимеризации 4 часа и последующей отмывке. Увеличение содержания инициатора до 1,5% также снижает количество полимера на поверхности гемосорбента. Снижение температуры полимеризации до 50°С практически не приводит к полимеризации ВП, текстурные показатели при этом практически не снижаются, и количество ПВП при времени полимеризации 8 часов составляет 1,0%.
Для удаления ПВП образцы углеродного сорбента выдерживали в физиологическом растворе (0,15 М NaCl) в статических условиях при комнатной температуре в течение 24 часов. Далее образцы сушили при комнатной температуре и анализировали: исследовали адсорбционные свойства по адсорбции азота с определением величины удельной поверхности (SBET), определяли содержание общего азота (таблица 1). Водные растворы после контакта с образцами углеродного сорбента анализировали методом ЯМР для идентификации в них ПВП.
Установлено, что после контакта с физиологическим раствором в течение 24 часов величина удельной поверхности увеличивается, а содержание азота при этом закономерно снижается. Полученные результаты свидетельствуют о миграции нанесенного ПВП в физиологический раствор.
Результаты исследования антибактериальных свойств модифицированных образцов углеродного гемосорбента представлены в таблице 2. В контрольных посевах концентрация микроорганизмов составляла 1×103 КОЕ/мл. После контакта с исследуемыми углеродными сорбентами было установлено, что образец углеродного гемосорбента (прототип) проявляет антибактериальные свойства по отношению к грамположительным бактериям - (Staphylococcus aureus, стафилококк золотистый). Образец углеродного сорбента, модифицированный ВП с последующей полимеризацией, согласно стендовым медицинским испытаниям, проявляет антибактериальные свойства как по отношению к грамположительным, так и по отношению к грамотрицательным бактериям. После контакта данного сорбента с патогенной микрофлорой рост колоний бактериальных клеток на чашках Петри отсутствовал.
Таким образом, комплексом физико-химических методов установлено, что процесс модифицирования углеродного гемосорбента N-винилпирролидоном протекает с образованием полимера поли-N-винилпирролидона, который способен к миграции в биологическую среду (физиологический раствор), обуславливая проявление антибактериальных свойств полученного углеродного сорбента.
Предлагаемый углеродный сорбент с антибактериальными свойствами является перспективным материалом для вульнеросорбции (аппликационной медицины).
| название | год | авторы | номер документа |
|---|---|---|---|
| ФОРМОВАННЫЙ СОРБЕНТ ВНИИТУ-1ПВП, СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ЭНДОМЕТРИТА | 2014 |
|
RU2545743C1 |
| УГЛЕРОДНЫЙ СОРБЕНТ С АНТИБАКТЕРИАЛЬНЫМИ И АНТИМИКОТИЧЕСКИМИ СВОЙСТВАМИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2541103C1 |
| УГЛЕРОДНЫЙ СОРБЕНТ С БИОСПЕЦИФИЧЕСКИМИ СВОЙСТВАМИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2655301C2 |
| СПОСОБ МОДИФИЦИРОВАНИЯ УГЛЕРОДНОГО ГЕМОСОРБЕНТА И УГЛЕРОДНЫЙ ГЕМОСОРБЕНТ С ИММОБИЛИЗОВАННЫМ БЕЛКОМ | 2011 |
|
RU2452499C1 |
| Формованный углеродный сорбент с гликолевой кислотой, способ его получения и способ лечения бактериального вагиноза | 2020 |
|
RU2751000C1 |
| СПОСОБ МОДИФИЦИРОВАНИЯ УГЛЕРОДНОГО ГЕМОСОРБЕНТА | 2010 |
|
RU2440844C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРУГЛЕРОДНОГО ГЕМОСОРБЕНТА И ФТОРУГЛЕРОДНЫЙ ГЕМОСОРБЕНТ (ВНИИТУ-1Ф) | 2011 |
|
RU2477652C1 |
| ФОРМОВАННЫЙ СОРБЕНТ ВНИИТУ-1, СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ И СПОСОБ ПРОФИЛАКТИКИ ГНОЙНО-СЕПТИЧЕСКИХ ОСЛОЖНЕНИЙ В АКУШЕРСТВЕ | 2013 |
|
RU2516878C1 |
| Способ лечения послеродового эндометрита с использованием внутриматочного введения формованного сорбента ВНИИТУ-1 ПВП | 2017 |
|
RU2646496C1 |
| СПОСОБ МОДИФИЦИРОВАНИЯ УГЛЕРОДНОГО ГЕМОСОРБЕНТА | 2013 |
|
RU2534805C1 |
Группа изобретений относится к способу получения углеродного сорбента с антибактериальными свойствами и к углеродному сорбенту с антибактериальными свойствами, полученному указанным способом. Заявленный способ включает пропитку гранул углеродного гемосорбента раствором инициатора в N-винилпирролидоне при рН 7,0-7,5 и остаточном давлении 15-20 мм рт.ст. Соотношение гемосорбент:раствор инициатора в N-винилпирролидоне составляет 1:1,4-2,0. Затем поднимают температуру до 65-75°С, выдерживают при этой температуре в течение 0,5-8 часов в инертной атмосфере и отмывают в воде от остаточного мономера при комнатной температуре. Углеродный сорбент с антибактериальными свойствами, полученный указанным способом, представляет собой гранулы округлой формы, содержит поливинилпирролидон в количестве 4,5-5,5% и характеризуется удельной адсорбционной поверхностью менее 50 м2/г и общим объемом пор менее 0,30 см3/г. 2 н.п. ф-лы, 2 табл., 1 ил., 7 пр.
1. Способ получения углеродного сорбента с антибактериальными свойствами, включающий пропитку гранул углеродного гемосорбента раствором модификатора и высушивание продукта, отличающийся тем, что пропитку гранул проводят 0,2-1,0% раствором инициатора в N-винилпирролидоне при рН 7,0-7,5, остаточном давлении 15-20 мм рт.ст. и соотношении гемосорбент:раствор инициатора в N-винилпирролидоне 1:1,4-2,0 в течение 15-30 мин с последующим подъемом температуры до 65-75°С, выдержкой при этой температуре в течение 0,5-8 ч в инертной атмосфере и отмывкой в воде от остаточного мономера при комнатной температуре в течение 0,5-2 ч.
2. Углеродный сорбент с антибактериальными свойствами в виде гранул округлой формы, отличающийся тем, что получен способом по п.1, содержит поливинилпирролидон в количестве 4,5-5,5%, характеризуется удельной адсорбционной поверхностью менее 50 м2/г и общим объемом пор менее 0,30 см3/г.
| СПОСОБ ОБРАБОТКИ УГЛЕРОДНОГО МЕЗОПОРИСТОГО ГЕМОСОРБЕНТА | 2008 |
|
RU2362733C1 |
| СОРБЦИОННЫЙ МАТЕРИАЛ С БАКТЕРИЦИДНЫМИ СВОЙСТВАМИ НА ОСНОВЕ ОКСИДА АЛЮМИНИЯ | 2003 |
|
RU2254163C1 |
| СУРОВИКИН В.Ф | |||
| Новые гемо- и энтеросорбенты на основе нанодисперсных углерод-углеродных материалов | |||
| - Рос | |||
| хим | |||
| ж | |||
| (Ж | |||
| Рос | |||
| хим | |||
| об-ва | |||
| им | |||
| Д.И.Менделеева), 2007, т.LI, №5, с.159-165 [онлайн]. | |||
Авторы
Даты
2013-05-20—Публикация
2012-03-23—Подача