Настоящая заявка испрашивает приоритет предварительной заявки 60/727513, зарегистрированной 18 октября 2005 г., предварительной заявки 60/780847, зарегистрированной 10 марта 2006 г., предварительной заявки 60/800006, зарегистрированной 15 мая 2006 г., предварительной заявки 60/831196, зарегистрированной 17 июля 2006 г., предварительной заявки 60/832116, зарегистрированной 21 июля 2006 г., и предварительной заявки 60/845495, зарегистрированной 19 сентября 2006 г., все из которых включены здесь в качестве ссылки во всей своей полноте для всех целей.
Известный уровень техники
Вирус гриппа является членом семейства Orthomyxoviridae (в качестве обзора см. Murphy and Webster, 1996). Существует три подтипа вирусов гриппа, обозначаемых A, B и C. Вирион гриппа содержит сегментированный негативно-смысловой геном РНК. Вирион гриппа включает следующие белки: гемагглютинин (HA), нейраминидазу (NA), матрикс (Ml), белок-ионный канал протонов (M2), нуклеопротеин (NP), основной белок 1 полимеразы (PBl), основной белок 2 полимеразы (PB2), кислый белок полимеразы (PA) и неструктурный белок 2 (NS2). HA, NA, M1 и M2 связаны с мембраной, тогда как NP, PBl, PB2, PA и NS2 являются белками, связанными с нуклеокапсидом. NSl является единственным неструктурным белком, не связанным с вирионными частицами, но специфичным для инфицированных вирусом гриппа клеток. Белок Ml представляет собой наиболее представленный белок в частицах вируса гриппа. Белки HA и NA представляют собой гликопротеины оболочки, ответственные за прикрепление вируса и проникновение вирусных частиц в клетку, и являются источниками главных иммунодоминантных эпитопов для нейтрализации вирусов и защитного иммунитета. Как белок HA, так и NA рассматриваются в качестве наиболее важных компонентов для профилактических противогриппозных вакцин.
Инфицирование вирусом гриппа инициируется путем прикрепления поверхностного белка HA вириона к клеточному рецептору, содержащему сиаловую кислоту (гликопротеинам и гликолипидам). Белок NA опосредует процессинг рецептора с сиаловой кислотой, и проникновение вируса в клетку зависит от зависимого от HA, опосредуемого рецептором эндоцитоза. В кислых границах интернализованных эндосом, содержащих вирион гриппа, белок HA подвергается конформационным изменениям, которые ведут к слиянию мембран вируса и клетки-хозяина с последующей декапсидацией вируса и опосредуемым M2 высвобождением белков M1 из связанных с нуклеокапсидом рибонуклеобелков (RNPs), которые поступают в клеточное ядро для синтеза вирусной РНК. Антитела к молекуле HA могут предотвращать инфицирование вирусом путем нейтрализации вирусной инфекционности, тогда как антитела к белкам NA опосредуют их эффект на ранних стадиях репликации вирусов.
Вакцины с инактивированными вирусами гриппа A и B в настоящее время лицензированы в виде трехвалентных вакцин для парентерального введения. Эти трехвалентные вакцины получают как одновалентную массу в аллантоисной полости яиц эмбрионов цыплят, очищают с помощью скоростного зонального центрифугирования или колоночной хроматографии, инактивируют формалином или β-пропиолактоном и составляют в виде смеси двух штаммов, штамма типа A и типа B вирусов гриппа, циркулирующих в популяции людей в данном году. Доступные коммерческие вакцины против гриппа представляют собой вирусные вакцины с полным вирусом (WV) или субвирионные (SV; разложенные на компоненты или с очищенным антигеном поверхности). Вакцина WV содержит интактные инактивированные вирионы. Вакцины SV, обработанные растворителями, такими как три-н-бутилфосфат (Flu-Shield, Wyeth-Lederle), содержат примерно все вирусные структурные белки и некоторые из вирусных оболочек. Вакцины SV, солюбилизированные тритоном X-100 (Fluzone, Sanofi-Aventis; Fluvirin, Novartis), содержат главным образом агрегаты мономеров HA, NA и NP, хотя присутствуют остаточные количества других вирусных структурных белков. Живая, ослабленная, адаптированная к холоду вирусная вакцина (FluMist, Medlmmune) была недавно допущена на рынок FDA для коммерческого применения в качестве вакцины с интраназальной доставкой, показанной для активной иммунизации и профилактики заболевания, вызываемого вирусами гриппа A и B у здоровых детей и подростков 5-17 лет и здоровых взрослых 18-49 лет.
Несколько рекомбинантных продуктов было разработано в качестве кандидатов для рекомбинантной вакцины против гриппа. Эти подходы были сфокусированы на экспрессии, продукции и очистке белков HA и NA вируса гриппа типа A, включая экспрессию этих белков с применением инфицированных бакуловирусом клеток насекомого (Crawford et al., 1999; Johansson, 1999; Treanor et al., 1996), вирусных векторов (Pushko et al., 1997; Berglund et al., 1999) и вакцин с конструктами ДНК (Olsen et al., 1997).
Crawford et al. (1999) показал, что HA вируса гриппа, экспрессируемый в клетках насекомого, инфицированных бакуловирусом, способен предотвращать летальное заболевание гриппом, вызванное подтипами вируса H5 и H7 птичьего гриппа. В то же время другая группа показала, что бакуловирусная экспрессия белков вируса гриппа HA и NA индуцирует иммунные ответы у животных, более высокие по сравнению с индуцируемыми общепринятой вакциной (Johansson et al., 1999). Иммуногенность и эффективность экспрессирующегося в бакуловирусной системе гемагглютинина вируса гриппа лошадей сравнивали с кандидатной вакциной гомологичной ДНК (Olsen et al., 1997). Взятые вместе данные продемонстрировали, что высокая степень защиты против нагрузки вирусом гриппа может быть индуцирована рекомбинантными белками HA или NA с применением различных экспериментальных подходов и в различных животных моделях.
Lakey et al. (1996) показали, что происходящая из бакуловирусной системы HA вакцина против гриппа хорошо переносилась и была иммуногенной у группы людей-добровольцев при фазе I исследования безопасности при росте дозы. Однако результаты исследований фазы II, проведенные в нескольких клинических точках на людях-добровольцах, вакцинированных несколькими дозами вакцин против гриппа, включающих белки HA и/или NA, показали, что вакцины с рекомбинантной субъединицей белка не вызывают защитного иммунитета [G. Smith, Protein Sciences; M. Perdue, USDA, Personal Communications]. Эти результаты показали, что конформационные эпитопы, расположенные на поверхности пепломеров инфекционных вирионов HA и NA, важны для выработки нейтрализующих антител и защитного иммунитета.
В отношении включения других белков вируса гриппа в кандидатные рекомбинантные гриппозные вакцины был осуществлен ряд исследований, включая эксперименты с привлечением нуклеобелка, NP, одного или в сочетании с белком M1 (Ulmer et al., 1993; Ulmer et al., 1998; Zhou et al., 1995; Tsui et al., 1998). Эти кандидатные вакцины, которые состояли из квазиинвариантных внутренних белков вириона, вызывали широкий спектр иммунных ответов, которые были в первую очередь клеточными (как CD4+, так и CD8+ T-клетки памяти). Эти эксперименты включали использование ДНК или вирусных генных векторов. Были необходимы относительно большие количества вводимой ДНК, так как результаты экспериментов с более низкими дозами ДНК показали отсутствие или низкую защиту (Chen et al., 1998). Следовательно, дополнительные доклинические и клинические исследования могут потребоваться для оценки таких подходов на основе ДНК, включая безопасность, эффективность и устойчивость NP и M1 вируса гриппа.
Недавно при попытке разработать более эффективные вакцины против гриппа в качестве носителей эпитопов белка M2 вируса гриппа применены белки частиц. Логика разработки вакцины на основе M2 заключалась в том, что в исследованиях на животных защитный иммунитет против гриппа вызывался белками M2 (Slepushkin et al., 1995). Neirynck et al. (1999) применяли трансмембранный домен M2 из 23 аминокислот в качестве аминоконцевого гибридного партнера с основой антигена вируса гепатита B (HBcAg) для экспонирования эпитопа(ов) M2 на поверхности капсидоподобных частиц HBcAg. Однако несмотря на тот факт, что как полноразмерный белок M2, так и M2-HBcAg VLP индуцировали определяемые антитела и защиту у мышей, маловероятно, что будущие вакцины против гриппа будут основываться исключительно на белке M2, так как белок M2 присутствовал в низком количестве копий на вирион, был слабо антигенным, неспособным вызывать выработку антител, которые связывают свободные вирионы гриппа, и был не способен блокировать присоединение вируса к клеточным рецепторам (т.е. нейтрализовать вирус).
Так как предшествующие исследования показали, что поверхностные гликопротеины вируса гриппа, HA и NA, являются главными мишенями для индукции защитного иммунитета против вируса гриппа и что M1 обеспечивает консервативную мишень для клеточного иммунитета в отношении вируса гриппа, новая кандидатная вакцина может включать эти вирусные антигены в качестве белковой макромолекулярной частицы, такой как вирусоподобные частицы (VLPs). Кроме того, частица с этими антигенами вируса гриппа может экспонировать конформационные эпитопы, которые вызывают выработку нейтрализующих антител ко многим штаммам вирусов гриппа.
Несколько исследований показали, что рекомбинантные белки вируса гриппа могут самособираться в VLPs в клеточной культуре с применением экспрессионных плазмид для млекопитающих или бакуловирусных векторов (Gomez-Puertas et al., 1999; Neumann et al., 2000; Latham and Galarza, 2001). Gomez-Puertas et al. (1999) показали, что эффективное образование VLP зависит от уровней экспрессии вирусных белков. Neumann et al. (2000) создали систему экспрессионных плазмид для млекопитающих для формирования инфекционных вирусоподобных частиц гриппа полностью из клонированных кДНК. Latham and Galarza (2001) сообщали об образовании VLPs гриппа в клетках насекомого, инфицированных рекомбинантным бакуловирусом, коэкспрессирующим гены HA, NA, M1 и M2. Эти исследования показали, что белки вириона гриппа могут самособираться при коэкспрессии в клетках эукариот.
Краткое изложение сущности изобретения
В настоящем изобретении предлагается вирусоподобная частица (VLP), включающая белок M1 вируса гриппа и белки H5 и N1, гемагглютинин и нейраминидаза. В одном осуществлении белок M1 происходит от штамма вируса гриппа, отличного при сравнении с белками H5 и N1. В другом осуществлении указанные H5 или N1 происходят от клада 1 H5N1 вируса гриппа.
В настоящем изобретении предлагается также VLP, экспрессируемая в эукариотной клетке, включающая одну или более нуклеиновых кислот, кодирующих белки H5 и N1, и белок вируса гриппа M1, в условиях, которые позволяют образовываться VLPs. В одном осуществлении указанная эукариотная клетка выбрана из группы, состоящей из клеток дрожжей, насекомых, амфибий, птиц и млекопитающих. В другом осуществлении указанная эукариотная клетка представляет собой клетку насекомого.
В настоящем изобретении предлагается также VLP, которая вызывает образование нейтрализующих антител у человека или животного, которые являются защитными в отношении инфицирования вирусом гриппа при введении указанному человеку или животному.
В настоящем изобретении предлагается также иммуногенная композиция, включающая эффективную дозу VLP изобретения. В одном осуществлении указанная композиция включает адъювант.
В настоящем изобретении предлагается также вакцина, включающая эффективную дозу VLP изобретения. В одном осуществлении указанная вакцина включает, по меньшей мере, вторую VLP, которая включает HA и NA из различных штаммов вируса гриппа. В другом осуществлении указанная вакцина включает адъювант.
В настоящем изобретении предлагается также способ индукции прочного иммунитета к инфицированию вирусом гриппа у животного, включающий введение, по меньшей мере, одной эффективной дозы вакцины, включающей VLP изобретения. В одном осуществлении указанная вакцина вводится животному перорально, внутрикожно, интраназально, внутримышечно, внутрибрюшинно, внутривенно или подкожно.
В настоящем изобретении предлагается также применение VLP изобретения для получения вакцины для животного, где вакцина индуцирует прочный иммунитет к инфицированию вирусом гриппа у указанного животного.
В настоящем изобретении предлагается также способ получения VLP изобретения, включающий экспрессию белков M1, HA и NA в эукариотной клетке.
В настоящем изобретении предлагается вакцина, включающая VLP гриппа, где указанная VLP включает белки M1, HA и NA вируса гриппа, где указанная вакцина индуцирует прочный иммунитет к инфицированию вирусом гриппа у человека. В одном осуществлении указанная вакцина включает VLP гриппа, где указанная VLP состоит по существу из белков M1, HA и NA вируса гриппа, где указанная вакцина индуцирует прочный иммунитет к инфицированию вирусом гриппа у человека. В другом осуществлении указанная вакцина включает VLP гриппа, где указанная VLP состоит из белков вируса гриппа, выбранных из группы, состоящей из белков M1, HA и NA вируса гриппа, где указанная вакцина индуцирует прочный иммунитет к инфицированию вирусом гриппа у человека.
В настоящем изобретении предлагается также применение VLP гриппа, где указанная VLP включает белки M1, HA и NA вируса гриппа, для получения вакцины, где вакцина индуцирует прочный иммунитет к инфицированию вирусом гриппа у человека.
Таким образом, в изобретении предлагается макромолекулярная белковая структура, содержащая (a) первый белок M1 вируса гриппа и (b) дополнительный структурный белок, который может включать второй или более белок M1 вируса гриппа; первый, второй или более белок HA вируса гриппа; первый, второй или более белок NA вируса гриппа; и первый, второй или более белок M2 вируса гриппа. Если дополнительный структурный белок происходит не из второго или более белка M1 вируса гриппа, то включаются оба или все члены группы, например первый и второй белки M2 вируса гриппа. Как таковые предлагаются функциональная структура из белков вируса гриппа, включающая субвиральную частицу, VLP, или капсомерную структуру или ее часть, вакцина, мультивалентная вакцина и их смеси, состоящие по существу из структурных белков вируса гриппа, получаемых с помощью способа изобретения. В особенно предпочтительном осуществлении макромолекулярная белковая структура вируса гриппа включает белки HA, NA и M1 вируса гриппа, которые представляют собой продукты экспрессии генов вируса гриппа, клонированные в виде синтетических фрагментов из вируса дикого типа.
Макромолекулярная белковая структура может также включать дополнительный структурный белок, например нуклеопротеин (NP), мембранные белки из видов, отличных от вирусов не гриппа и мембранный белок из источника, не являющегося вирусом гриппа, которые происходят от птиц или млекопитающих и различных подтипов вируса гриппа, включая подтип A и B вирусов гриппа. Изобретение может включать гибридную макромолекулярную белковую структуру, которая включает часть из, по меньшей мере, одного белка, обладающего частью, не продуцируемой вирусом гриппа.
Профилактика гриппа может быть осуществлена с помощью предложения макромолекулярной белковой структуры, которая может самособираться в клетке-хозяине из рекомбинантного конструкта. Макромолекулярная белковая структура изобретения обладает способностью к самосборке в гомотипические или гетеротипические вирусоподобные частицы (VLPs), которые экспонируют конформационные эпитопы на белках HA и NA, что вызывает выработку нейтрализующих антител, которые являются защитными. Композиция может представлять собой вакцинную композицию, которая также содержит носитель или разбавитель и/или адъювант. Функциональные VLPs гриппа вызывают выработку нейтрализующих антител против одного или более штаммов или типов вируса гриппа в зависимости от того, содержат ли VLPs гриппа белки HA и/или NA от одного или более штаммов или типов вируса. Вакцина может включать белки вируса гриппа, которые представляют собой белки вируса гриппа дикого типа. Предпочтительно, чтобы структурные белки, содержащие VLP гриппа или ее часть, могли происходить из различных штаммов вирусов гриппа дикого типа. Вакцины против гриппа можно вводить человеку или животным для индукции защитного иммунитета против одного или более штаммов или типов вируса гриппа.
Макромолекулярные белковые структуры изобретения могут проявлять гемагглютининовую активность и/или нейраминидазную активность.
В изобретении предлагается способ получения VLP, происходящей от вируса гриппа, с помощью создания рекомбинантного конструкта, который кодирует структурные гены вируса гриппа, включая M1, HA, и, по меньшей мере, один структурный белок, происходящий от вируса гриппа. Рекомбинантный конструкт применяют для трансфекции, инфицирования или трансформации подходящей клетки-хозяина рекомбинантным бакуловирусом. Клетку-хозяин культивируют в условиях, которые позволяют экспрессироваться M1, HA и, по меньшей мере, одному структурному белку, происходящему от вируса гриппа, и VLP образуется в клетке-хозяине. Инфицированные культуральные среды, содержащие функциональную VLP гриппа, собирают и VLP очищают. Изобретение характеризуется также дополнительной стадией котрансфекции, коинфицирования или котрансформации клетки-хозяина вторым рекомбинантным конструктом, который кодирует второй белок вируса гриппа, тем самым включая второй белок вируса гриппа в VLP. Такие структурные белки могут происходить от вируса гриппа, включая NA, M2 и NP, и, по меньшей мере, один структурный белок происходит от птиц или млекопитающих. Структурный белок может быть от подтипа A и B вирусов гриппа. В соответствии с изобретением клетка-хозяин может представлять собой эукариотную клетку. Кроме того, VLP может представлять собой гибридную VLP.
В изобретении характеризуется также способ составления лекарственного вещества, содержащего VLP вируса гриппа, с помощью введения рекомбинантных конструктов, кодирующих гены вируса гриппа в клетки-хозяева, и позволения самосборки рекомбинантных белков вируса гриппа в функциональную гомотипическую или гетеротипическую VLP в клетках. VLP гриппа выделяют и очищают и лекарственное вещество составляют как содержащее VLP гриппа. Лекарственное вещество может дополнительно содержать адъювант. Кроме того, в изобретении предлагается способ составления лекарственного продукта с помощью смешивания такого лекарственного вещества, содержащего VLP гриппа, с липидным пузырьком, т.е. неионным липидным пузырьком. Таким образом, функциональные гомотипические или гетеротипические VLPs могут созревать как покрытые частицы из инфицированных клеток. Зрелые VLPs гриппа могут быть выделены и очищены с помощью ультрацентрифугирования или колоночной хроматографии в виде лекарственных веществ и составлены одни или с адъювантами, такими как Novasomes®, продукт Novavax, Inc., в качестве лекарственных продуктов, таких как вакцины. Novasomes®, который обеспечивает усиленный иммунный ответ, дополнительно описывается в патенте США № 4911928, который включен здесь в качестве ссылки.
В изобретении предлагается способ определения гуморального иммунитета в отношении инфицирования вирусом гриппа у позвоночного с помощью предложения тест-реагента, включающего эффективное количество детектирующего антитела белка вируса гриппа, обладающего, по меньшей мере, одним конформационным эпитопом макромолекулярной структуры вируса гриппа. Тест-реагент вводится в контакт с образцом жидкости организма от позвоночного, проверяемого на инфицирование вирусом гриппа. Антителам, специфичным для вируса гриппа, содержащимся в образце, дают связаться с конформационным эпитопом макромолекулярной структуры вируса гриппа с образованием комплексов антиген-антитело. Комплексы отделяют от несвязанных комплексов и вводят в контакт с определяемым меченым связывающим иммуноглобулины агентом. Оценивают количество определяемого меченого связывающего иммуноглобулины агента, которое связалось с комплексами.
Вирус гриппа может быть определен в образце от животного или человека, подозреваемого на инфицирование или инфицированного вирусом, с помощью обеспечения антителами, которые имеют определяемую метку, продуцирующую сигнал, или присоединены к определяемому меченому реагенту, обладающему специфичностью, по меньшей мере, к одному конформационному эпитопу частицы вируса гриппа. Образец вводят в контакт с антителами и антителам позволяют связаться с вирусом гриппа. Присутствие вируса гриппа в образце определяют с помощью определяемой метки.
В изобретении предлагаются способы лечения, профилактики и выработки защитного иммунного ответа с помощью введения позвоночному эффективного количества композиции изобретения.
Альтернативно, лекарственное вещество, VLP гриппа, может быть составлено в виде лабораторных реагентов, применяемых для исследований структуры вируса гриппа и клинических диагностических тестов. В изобретении предлагается также набор для лечения вируса гриппа с помощью введения эффективного количества композиции изобретения и инструкции для применения.
В изобретении предлагается также VLP, включающая белки HA, NA и M1, происходящие от вируса птичьего гриппа, который может вызывать заболеваемость или смертность у позвоночных. В одном осуществлении указанные белки HA, NA и M1 происходят от вируса птичьего гриппа типа A. В другом осуществлении HA выбран из группы, состоящей из H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 и H16, а NA выбран из группы, состоящей из N1, N2, N3, N4, N5, N6, N7, N8 и N9. В другом осуществлении указанные белки HA и NA представляют собой H5 и N1 соответственно. В другом осуществлении указанные белки HA и NA представляют собой H9 и N2 соответственно. В другом осуществлении указанный HA и/или NA проявляют гемагглютининовую активность и/или нейраминидазную активность предпочтительно. В одном осуществлении VLP состоит по существу из белков HA, NA и M1, т.е. в VLP присутствуют по существу только белки вируса гриппа.
В изобретении предлагается также способ получения VLP, включающий трансфецирование векторов, кодирующих белки вируса птичьего гриппа, в подходящую клетку-хозяина и экспрессию указанных белков вируса птичьего гриппа в условиях, которые позволяют образовываться VLPs. В одном осуществлении этот способ включает трансфекцию клетки-хозяина рекомбинантными молекулами ДНК, которые кодируют белки вируса гриппа HA, NA и M1.
Изобретение также включает антигенный состав, включающий VLP, включающую белки HA, NA и M1, происходящие от вируса птичьего гриппа, который может вызывать заболеваемость или смертность у позвоночного. В другом осуществлении HA выбран из группы, состоящей из H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 и H16, а NA выбран из группы, состоящей из N1, N2, N3, N4, N5, N6, N7, N8 и N9. В другом осуществлении указанные белки HA и NA представляют собой H5 и N1 соответственно. В другом осуществлении указанные белки HA и NA представляют собой H9 и N2 соответственно. В другом осуществлении указанный антигенный состав вводят субъекту перорально, внутрикожно, интраназально, внутримышечно, внутрибрюшинно, внутривенно или подкожно.
В изобретении дополнительно предлагается способ вакцинации позвоночного против вируса птичьего гриппа, включающий введение указанному позвоночному индуцирующего защитную реакцию количества VLP, включающей белки HA, NA и M1, происходящие от вируса птичьего гриппа.
Данное изобретение также включает способ индукции стойкого иммунитета в отношении инфицирования вирусом гриппа или, по меньшей мере, одного его симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP вируса гриппа. В одном осуществлении указанная VLP состоит по существу из HA, NA и M1. В другом осуществлении указанная VLP включает белки вируса гриппа, где указанные белки вируса гриппа состоят из HA, NA и M1. В другом осуществлении указанные HA и/или NA проявляют гемагглютининовую активность и/или нейраминидазную активность предпочтительно.
Данное изобретение также включает способ индукции стойкого иммунитета в отношении инфицирования вирусом гриппа или, по меньшей мере, одного его симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP вируса птичьего гриппа. В одном осуществлении указанная VLP гриппа состоит по существу из HA, NA и M1 птиц. В другом осуществлении указанная VLP гриппа включает белки вируса гриппа, где указанные белки вируса гриппа состоят из HA, NA и M1 птиц.
Данное изобретение дополнительно включает способ индукции стойкого иммунитета в отношении инфицирования вирусом гриппа или, по меньшей мере, одного его симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP вируса сезонного гриппа. В одном осуществлении указанная VLP гриппа состоит по существу из HA, NA и M1 вируса сезонного гриппа. В другом осуществлении указанная VLP гриппа включает белки вируса гриппа, где указанные белки вируса гриппа состоят из HA, NA и M1 вируса сезонного гриппа.
Данное изобретение дополнительно включает способ индукции стойкого иммунитета в отношении инфицирования вирусом гриппа или, по меньшей мере, одного его симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы, по меньшей мере, VLP одного вируса сезонного гриппа. В одном осуществлении указанная VLP гриппа состоит из HA, NA и M1 вируса сезонного гриппа. В другом осуществлении указанная VLP гриппа состоит по существу из HA, NA и M1 вируса сезонного гриппа.
Данное изобретение дополнительно включает способ индукции стойкого защитного ответа антител на инфицирование вирусом гриппа или, по меньшей мере, на один его симптом у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP гриппа.
Данное изобретение включает способ индукции стойкого защитного клеточного иммунного ответа на инфицирование вирусом гриппа или, по меньшей мере, на один его симптом у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP гриппа.
Данное изобретение дополнительно включает способ составления вакцины, которая индуцирует стойкий иммунитет в отношении инфицирования вирусом гриппа или, по меньшей мере, одного его симптома у субъекта, включающий добавление к указанному составу эффективной дозы VLP гриппа. В одном осуществлении указанный стойкий иммунитет в отношении инфицирования вирусом гриппа или, по меньшей мере, одного его симптома возникает от одной дозы. В другом осуществлении указанный стойкий иммунитет в отношении инфицирования вирусом гриппа или, по меньшей мере, одного его симптома возникает от многократных доз.
Данное изобретение дополнительно включает вакцину, включающую VLP гриппа, где указанная вакцина индуцирует стойкий иммунитет в отношении инфицирования вирусом гриппа или, по меньшей мере, одного его симптома при введении субъекту. В одном осуществлении указанная VLP гриппа представляет собой VLP вируса птичьего гриппа. В другом осуществлении указанная VLP гриппа представляет собой VLP вируса сезонного гриппа.
Данное изобретение дополнительно включает антигенный состав, включающий VLP гриппа, где указанная вакцина индуцирует стойкий иммунитет в отношении инфицирования вирусом гриппа или, по меньшей мере, одного его симптома при введении субъекту. В одном осуществлении указанная VLP гриппа представляет собой VLP вируса птичьего гриппа. В другом осуществлении указанная VLP гриппа представляет собой VLP вируса сезонного гриппа.
Краткое описание фигур
На фиг. 1 представлена нуклеотидная последовательность гена нейраминидазы (NA) вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2) (SEQ ID NO:1).
На фиг. 2 представлена нуклеотидная последовательность гена гемагглютинина (HA) вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2) (SEQ ID NO:2).
На фиг. 3 представлена нуклеотидная последовательность гена белка матрикса M1 (M1) вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2) (SEQ ID NO:3).
На фиг. 4 представлены векторы для переноса для конструирования рекомбинантных бакуловирусов для экспрессии белков HA, NA и M1 вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2). На фиг. 4A представлен вектор для переноса для экспрессии индивидуальных генов, а на фиг. 4B представлен вектор для переноса для множественной экспрессии генов.
На фиг. 5 представлена экспрессия белков HA, NA и M1 вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2) в клетках Sf-9S.
На фиг. 6 представлена очистка VLPs птичьего гриппа A/Hong Kong/1073/99 (H9N2) методом градиента плотности сахарозы.
На фиг. 7 представлено определение белка вируса гриппа с помощью гель-фильтрационной хроматографии. Антитела, применяемые при анализе Вестерн-блоттингом, представляют собой следующее: (A) кроличье анти-H9N2; (b) мышиное анти-M1 mAb; и (C) мышиное анти-BACgp64.
На фиг. 8 представлено определение белков вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2), включая субвиральные частицы, VLP и комплексы VLP с помощью электронной микроскопии.
На фиг. 9 представлена гемагглютининовая активность очищенных VLPs вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2).
На фиг. 10 представлена нейраминидазная активность очищенных VLPs вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2).
На фиг. 11 представлена иммунизация и схема взятия крови для изучения иммуногенности рекомбинантного вируса гриппа с помощью очищенных VLPs вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2).
На фиг. 12 представлены результаты исследования иммуногенности у мышей, иммунизированных рекомбинантными VLPs гриппа H9N2. На фиг. 12A представлены сыворотки от мышей BALB/c, иммунизированных рекомбинантными VLPs, включающими белки HA, NA и M1 из вируса птичьего гриппа типа A/H9N2/Hong Kong/1073/99. На фиг. 12B представлены сыворотки от новозеландских белых кроликов, иммунизированных инактивированным вирусом птичьего гриппа типа A H9N2, при взаимодействии в Вестерн-блоттах, содержащих инактивированный вирус птичьего гриппа типа A H9N2 (дорожки 1 и 3) или адаптированного к холоду вируса птичьего гриппа типа A H9N2 (дорожки 2 и 4).
На фиг. 13 представлено среднее геометрическое антительных ответов у мышей BALB/c после первичной и вторичной иммунизации.
На фиг. 14 представлены ответы ингибирования гемагглютинина (HI) сыворотки у мышей BALB/c.
На фиг. 15 представлена потеря массы (%) мышей BALB/c, нагруженных H9N2 гриппа.
На фиг. 16 представлены титры вируса в легких на 3 и 5 день после нагрузки H9N2.
На фиг. 17A, 17B и 17C представлен антительный ответ на A/Fujian/411/2002 при иммунизации VLP H3N2.
На фиг. 18A и B представлены изотипы антител IgG мыши.
На фиг. 19 представлены ответы ингибирования гемагглютинина (HI) антителами у мышей SD, иммунизированных вакциной с H9N2 VLP.
На фиг. 20A и 20B представлены ответы ингибирования гемагглютинина (HI) антителами при различных дозах H9N2 VLPs с и без адъюванта у мышей BALB/c.
На фиг. 21 представлены ответы ингибирования гемагглютинина сыворотки (HI) антителами у мышей BALB/c при различных дозах VLPs.
На фиг. 22 представлены ответы ингибирования гемагглютинина (HI) сыворотки у хорьков.
На фиг. 23 представлены ответы ингибирования гемагглютинина (HI) сыворотки хорьков из пулов сыворотки на 21 и 42 дни после введения различных штаммов H3N2 VLPs.
На фиг. 24 представлено антитело против HA (конечная точка титра разведения) мышей, инокулированных внутримышечно H5N1 (Vietnam/1203/2003) VLPs при низких дозах.
На фиг. 25 представлено антитело против HA (конечная точка титра разведения) мышей, инокулированных интраназально H5N1 (Vietnam/1203/2003) VLPs при низких дозах.
На фиг. 26 представлен пример получения, выделения и очистки VLPs изобретения.
На фиг. 27 представлены мыши, инокулированные H3N2 VLPs, введенными внутримышечно, и затем нагруженные интраназально вирусом A/Aichi/2/68x31 (H3N2).
На фиг. 28 представлены мыши, инокулированные H3N2 VLPs, введенными интраназально, и затем нагруженные интраназально вирусом A/Aichi/2/68x31 (H3N2).
На фиг. 29 представлено сбрасывание вируса в смывы носовой полости хорька, инокулированного H9N2 VLP вакциной и затем нагруженного интраназально вирусом H9N2.
На фиг. 30A, 30B, 30C, 30D, 30E, 30F, 30G, 30H представлены антительные ответы ингибирования гемагглютинина (HI) у мышей после инокуляции различными дозами A/Fujian/411/2002 (H3N2) VLPs внутримышечно или интраназально при тестировании против различных штаммов H3N2 вирусов гриппа.
Подробное описание изобретения
Применяемый здесь термин «бакуловирус», также известный как baculoviridae, относится к семейству оболочечных ДНК вирусов артропод, члены которого могут быть использованы в качестве экспрессионных векторов для получения рекомбинантных белков в клеточных культурах со вставкой. Вирион содержит один или более палочковидных нуклеокапсидов, содержащих молекулу кольцевой, гиперспирализованной двухцепочечной ДНК (отн. М.м. 54×106-154×106). Вирус, используемый в качестве вектора, представляет собой обычно вирус ядерного полиэдроза (NVP) Autographa californica. Экспрессия введенных генов находится под контролем сильного промотора, который в норме регулирует экспрессию белкового компонента полиэдроза, большого ядерного включения, в которое вирусы вставляются в инфицированных клетках.
Применяемый здесь термин «происходящий от» относится к происхождению или источнику и может включать существующие в природе, рекомбинантные, неочищенные или очищенные молекулы. Белки и молекулы настоящего изобретения могут происходить от молекул вируса гриппа или быть не вирусными.
Применяемый здесь термин «первый» белок вируса гриппа, т.е. первый белок M1 вируса гриппа, относится к белку, такому как M1, HA, NA и M2, который происходит от конкретного штамма вируса гриппа. Штамм или тип первого вируса гриппа отличается от штамма или типа второго белка вируса гриппа. Таким образом, «второй» белок вируса гриппа, т.е. второй белок M1 вируса гриппа, относится к белку, такому как M1, HA, NA и M2, который происходит от второго штамма вируса гриппа, который представляет собой штамм или тип, отличный от первого белка вируса гриппа.
Применяемый здесь термин «гемагглютининовая активность» относится к способности HA-содержащих белков, VLPs, или их частей связываться с красными клетками крови (эритроцитами) и агглютинировать их.
Применяемый здесь термин «нейраминидазная активность» относится к ферментативной активности NA-содержащих белков, VLPs, или их частей отщепляющей остатки сиаловой кислоты от субстратов, включая белки, такие как фетуин.
Применяемый здесь термин «гетеротипический» относится к одному или более различным типам или штаммам вируса.
Применяемый здесь термин «гомотипический» относится к одному типу или штамму вируса.
Применяемый здесь термин «макромолекулярная белковая структура» относится к конструкции или организации одного или более белков.
Применяемый здесь термин «мультивалентная» вакцина относится к вакцине против множества типов или штаммов вируса гриппа.
Применяемый здесь термин «не относящийся к вирусу гриппа» относится к белку или молекуле, которые не происходят от вируса гриппа.
Применяемый здесь термин «вакцина» относится к препарату убитых или ослабленных патогенов или происходящих от них антигенных детерминант, который применяется для индукции образования антител или иммунитета против патогена. Вакцина дается для обеспечения иммунитета в отношении заболевания, например гриппа, которое вызывается вирусами гриппа. В настоящем изобретении предлагаются композиции вакцин, которые являются иммуногенными и обеспечивают защиту. Кроме того, термин «вакцина» также относится к суспензии или раствору иммуногена (например, VLP), который вводится позвоночному для выработки защитного иммунитета, т.е. иммунитета, который снижает тяжесть заболевания, связанного с инфекцией.
Применяемый здесь термин «стойкий иммунитет» относится к иммунному ответу, при котором, когда VLPs изобретения вводят позвоночному, возникает индукция иммунной системы у указанного позвоночного, что ведет к предотвращению инфицирования вирусом гриппа, ослаблению инфицирования вирусом гриппа или снижению, по меньшей мере, одного симптома, относящегося к инфицированию вирусом гриппа у указанного позвоночного. Стойкий иммунитет может также относиться к титру ингибирования гемагглютинации (HI) ≥40 у млекопитающего, когда VLPs изобретения вводили и индуцировали иммунный ответ.
Применяемый здесь термин «адъювант» относится к соединению, которое при применении в сочетании со специфическим иммуногеном (например, VLP) в составе усиливает или другим образом изменяет или модифицирует конечный иммунный ответ. Модификация иммунного ответа включает интенсификацию или расширение специфичности только антительного или как антительного, так и клеточного иммунных ответов. Модификация иммунного ответа может также обозначать снижение или подавление определенных антиген-специфичных иммунных ответов.
Применяемый здесь термин «иммунный стимулятор» относится к соединению, которое увеличивает иммунный ответ путем собственных химических посредников организма (цитокинов). Эти молекулы включают различные цитокины, лимфокины и хемокины с иммуностимуляторной, иммунопотенцирующей и провоспалительной активностями, такие как интерлейкины (например, ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-12, ИЛ-13); факторы роста (например, гранулоцит-макрофаг(GM)-колониестимулирующий фактор (CSF); и другие иммуностимулирующие молекулы, такие как воспалительный фактор макрофагов, лиганд Flt3, B7.1; B7.2 и т.д. Иммуностимуляторные молекулы можно вводить в том же составе, что и VLPs гриппа, или можно вводить отдельно. Для индукции иммуностимуляторного эффекта может быть введен либо белок, либо экспрессионный вектор.
Применяемый здесь термин «эффективная доза» обычно относится к такому количеству VLP изобретения, которое достаточно для выработки иммунитета, профилактики и/или ослабления инфицирования вирусом гриппа или снижения, по меньшей мере, одного симптома гриппозной инфекции и/или повышения эффективности другой дозы VLP. Эффективная доза может относиться к количеству VLP, достаточному для замедления или сведения к минимуму наступления инфицирования вирусом гриппа. Эффективная доза может также относиться к количеству VLP, которое обеспечивает терапевтическое преимущество при лечении или управлении инфицированием вирусом гриппа. Далее, эффективная доза представляет собой количество в отношении только VLPs или в сочетании с другими терапевтическими агентами, которые обеспечивают терапевтическое преимущество при лечении или управлении инфицированием вирусом гриппа. Эффективная доза может также представлять собой количество, достаточное для усиления собственного иммунного ответа субъекта (например, человека) на последующую экспозицию с вирусом гриппа. Уровни иммунитета могут быть прослежены, например, с помощью измерения количеств нейтрализующих секреторных и/или сывороточных антител, например, с помощью нейтрализации зон гемолиза, фиксации комплемента, иммуносорбента, связанного с ферментом или теста микронейтрализации. В случае вакцины «эффективная доза» представляет собой такую, которая предотвращает заболевание или снижает тяжесть симптомов.
Применяемый здесь термин «вирус птичьего гриппа» относится к вирусам гриппа, найденным главным образом у птиц, но которые могут также инфицировать человека или других животных. В некоторых случаях вирусы птичьего гриппа могут переноситься или распространяться от одного человека к другому. Вирус птичьего гриппа, который инфицирует человека обладает возможностью вызывать пандемию гриппа, т.е. заболеваемость и/или смертность у человека. Пандемия наступает, когда новый штамм вируса гриппа (вируса, к которому у человека нет природного иммунитета) появляется, распространяясь больше, чем у локальных индивидуумов, возможно, по всему земному шару и инфицируя одновременно много людей.
Применяемый здесь термин «вирус сезонного гриппа» относится к штаммам вируса гриппа, которые были определены как передающиеся в популяции людей во время данного сезона гриппа на основе эпидемиологических осмотров, проводимых национальными центрами гриппа по всему миру. Эти эпидемиологические исследования и некоторые выделенные вирусы гриппа посылаются в одну из четырех референсных лабораторий Всемирной организации здравоохранения (ВОЗ), одна из которых находится в центрах по контролю и профилактике заболеваемости (CDC) в Атланте, для подробного тестирования. Эти лаборатории тестируют, насколько хорошо антитела, выработанные к текущей вакцине, взаимодействуют с циркулирующим вирусом и новыми вирусами гриппа. Эта информация вместе с информацией об активности гриппа суммируется и представляется в консультативный комитет управления по контролю за продуктами и лекарствами США (FDA) и на заседание ВОЗ. Эти заседания приводят к выбору трех вирусов (двух подтипов A вируса гриппа и одного B вируса гриппа) для вхождения в вакцины против гриппа на последующие ослабленность и зиму. Выбор осуществляется в феврале для северного полушария и в сентябре для южного полушария. Обычно один или два из трех штаммов вируса в вакцине изменяются каждый год.
Применяемый здесь термин «по существу защитный антительный ответ» относится к иммунному ответу, опосредуемому антителами против вируса гриппа, которые появляются у позвоночного (например, человека), которые предотвращают или ослабляют инфицирование вирусом гриппа или снижают, по меньшей мере, один его симптом. VLPs изобретения могут стимулировать продукцию антител, таких как, например, нейтрализующие антитела, которые блокируют выход вирусов гриппа из клеток, блокируют репликацию указанного вируса гриппа путем связывания с вирусом и/или защищают клетки-хозяева от инфицирования и деструкции.
Применяемый здесь термин «по существу защитный клеточный ответ» относится к иммунному ответу, который опосредуется Т-лимфоцитами и/или другими белыми клетками крови, против вируса гриппа, обнаруживаемому у позвоночного (например, человека), который предотвращает или ослабляет инфицирование вирусом гриппа или снижает, по меньшей мере, один его симптом. Один важный аспект клеточного иммунитета включает антиген-специфический ответ цитолитических Т-клеток («CTL»s). CTLs обладают специфичностью к пептидным антигенам, которые представляются в связи с белками, кодируемыми главным комплексом гистосовместимости (MHC) и экспрессируются на поверхности клеток. CTLs способствуют индукции и промоции деструкции внутриклеточных микробов или лизису клеток, инфицированных такими микробами. Другой аспект клеточного иммунитета включает антиген-специфический ответ Т-клеток-хелперов. Т-клетки-хелперы действуют, помогая стимулировать функцию и сфокусировать активность неспецифических эффекторных клеток против клеток, экспонирующих пептидные антигены в связи с молекулами MHC на своей поверхности. «Клеточный иммунный ответ» также относится к продукции цитокинов, хемокинов и других таких молекул, продуцируемых активированными Т-клетками и/или другими белыми клетками крови, включая происходящие от CD4+ и CD8+ Т-клеток.
Применяемый здесь термин «стойкий иммунитет в большой популяции» относится к иммунитету, образующемуся в результате введения VLPs изобретения индивидуумам в популяции. Иммунитет у указанного индивидуума в указанной популяции ведет к предотвращению, ослаблению инфицирования вирусом гриппа или снижению, по меньшей мере, одного симптома, относящегося к инфицированию вирусом гриппа у указанного индивидуума и предотвращает распространение указанного вируса гриппа другим индивидуумам в популяции. Термин популяция определяется как группа индивидуумов (например, школьники, пожилые, здоровые индивидуумы и т.д.) и может включать географическую область (например, конкретные города, школы, округа, рабочие места, страну, штат и т.д.).
Применяемый здесь термин «антигенный состав» или «антигенная композиция» относится к препарату, который при введении позвоночному, особенно птице или млекопитающему, будет индуцировать иммунный ответ.
Применяемый здесь термин «позвоночное», или «субъект», или «больной» относится к любому члену подтипа хордовых, включая без ограничения, человека и других приматов, включая приматов, не являющихся человеком, таких как шимпанзе и другие виды человекообразных приматов и обезьян. Сельскохозяйственные животные, такие как крупный рогатый скот, овцы, свиньи, козы и лошади; домашние животные, такие как собаки и кошки; лабораторные животные, включая грызунов, таких как мыши, крысы и морские свинки; птицы, включая домашних, диких и охотничье-промысловых птиц, таких как цыплята, индюшки и другие куриные птицы, утки, гуси и тому подобное, также являются не ограничивающими примерами. Термины «млекопитающие» и «животные» включаются в это определение. Для охвата предназначены как взрослые, так и новорожденные индивидуумы.
Грипп остается распространенной проблемой здравоохранения несмотря на доступность специальных инактивированных вирусных вакцин, которые эффективны на 60-80% при оптимальных условиях. Когда эти вакцины эффективны, заболевание обычно предотвращается с помощью препятствия инфицированию вирусом. Неудачность вакцины может возникнуть в результате аккумуляции антигенных различий (антигенной изменчивости и антигенного дрейфа). Например, вирус птичьего гриппа типа A H9N2 циркулировал совместно с вирусом гриппа человека типа A Sydney/97 (H3N2) у свиней и привел к генетической перестройке и возникновению новых штаммов вируса гриппа человека с пандемическим потенциалом (Peiris et al., 2001). В случае такой антигенной изменчивости маловероятно, что текущие вакцины будут обеспечивать адекватную защиту.
Другой причиной недостаточности программ по вакцинам против гриппа является относительно короткое сохранение иммунитета, вызываемое текущими вакцинами. Дополнительная неадекватность мер контроля за гриппом отражается в ограниченном применении текущих вакцин из-за реактогенности и побочных эффектов вакцин у маленьких детей, пожилых людей и людей с аллергией к компонентам яиц, которые применяются при производстве коммерчески лицензированных инактивированных вирусных вакцин против гриппа.
Кроме того, инактивированные вирусные вакцины против гриппа часто не содержат или содержат измененные конформационные эпитопы HA и NA, которые вызывают выработку нейтрализующих антител и играют главную роль в защите против заболевания. Таким образом, инактивированные вирусные вакцины, а также некоторые вакцины с рекомбинантными мономерными субъединицами белков вируса гриппа дают неадекватную защиту. С другой стороны, макромолекулярные белковые структуры, такие как капсомеры, субвирусные частицы и/или VLPs, включают множественные копии природных белков, экспонирующих конформационные эпитопы, что выгодно для оптимальной иммуногенности вакцин.
В настоящем изобретении описывается клонирование генов HA, NA и M1 вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2) в отдельный бакуловирусный экспрессионный вектор поодиночке или совместно и продукция кандидатных вакцин против гриппа или реагентов, включающих рекомбинантные вирусные структурные белки, которые самособираются в функциональные и иммуногенные гомотипические макромолекулярные белковые структуры, включая субвиральные частицы вируса гриппа и VLP гриппа, в инфицированных бакуловирусом клетках насекомого.
В настоящем изобретении описывается клонирование генов HA, NA, Ml, M2 и NP вируса гриппа человека A/Sydney/5/97 и A/Fujian/411/2002 (H3N2) в бакуловирусные экспрессионные векторы и продукция кандидатных вакцин против гриппа или реагентов, включающих вирусные структурные белки, которые самособираются в функциональные и иммуногенные гомотипические макромолекулярные белковые структуры, включая субвиральные частицы вируса гриппа и VLP гриппа, в инфицированных бакуловирусом клетках насекомого.
Кроме того, в настоящем изобретении описывается клонирование гена HA вируса гриппа человека A/Sydney/5/97 и A/Fujian/411/2002 (H3N2) и генов HA, NA и M1 вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2) в отдельный бакуловирусный экспрессионный вектор совместно и продукция кандидатных вакцин против гриппа или реагентов, включающих вирусные структурные белки, которые самособираются в функциональные и иммуногенные гетеротипические макромолекулярные белковые структуры, включая субвиральные частицы вируса гриппа и VLP гриппа, в инфицированных бакуловирусом клетках насекомого.
VLPs изобретения
VLPs гриппа изобретения пригодны для получения вакцин против вируса гриппа. Одной важной характеристикой данной системы является способность к замещению поверхностных гликопротеинов различными подтипами HA и/или NA или другими вирусными белками, таким образом позволяя каждый год модернизировать новые антигенные варианты вируса гриппа или получать их для пандемии гриппа. Так как антигенные варианты этих гликопротеинов идентифицированы, VLPs могут обновляться для включения этих новых вариантов (например, для вакцин против сезонного гриппа). Кроме того, поверхностные гликопротеины из потенциально пандемических вирусов, таких как H5N1 или другие сочетания HA, NA с пандемическим потенциалом, могут быть включены в VLPs без затрагивания высвобождающих генов, которые не циркулировали у людей в течение нескольких десятилетий. Это происходит потому, что VLPs не являются инфекционными, не реплицируются и не могут вызвать заболевание. Таким образом, эта система позволяет создавать новую кандидатную вакцину против гриппа каждый год и/или пандемическую вакцину против гриппа всякий раз, когда это необходимо.
Существует 16 различных гемагглютининов (HA) и 9 различных нейраминидаз (NA), все из которых найдены у диких птиц. Дикие птицы представляют собой первичный природный резервуар для всех типов вирусов гриппа A и, как считается, являются источником всех типов вирусов гриппа A у всех других позвоночных. Эти подтипы различаются из-за изменений в гемагглютинине (HA) и нейраминидазе (NA) на их поверхности. Возможны многие различные сочетания белков HA и NA. Каждое сочетание представляет собой отличный тип вируса гриппа A. Кроме того, каждый тип может быть дополнительно классифицирован в штаммы на основе различных мутаций, найденных в каждом из их 8 генов.
Все известные типы вирусов гриппа A могут быть обнаружены у птиц. Обычно вирусы птичьего гриппа не инфицируют людей. Однако некоторые вирусы птичьего гриппа выработали генетические изменения, связанные со способностью преодолевать видовой барьер. Такой вирус способен вызвать пандемию, так как люди не имеют естественного иммунитета к вирусу и могут легко передавать его от человека к человеку. В 1997 г. вирус птичьего гриппа перешел от птиц к человеку в Гонконге при вспышке птичьего гриппа у домашних птиц. Этот вирус был идентифицирован как вирус гриппа H5N1. Вирус вызвал тяжелое респираторное заболевание у 18 человек, шесть из которых умерли. С этого времени возникло намного больше случаев известных инфекций H5N1 среди людей по всему миру; примерно половина из этих людей умерла.
Таким образом, настоящее изобретение охватывает клонирование нуклеотидов HA, NA и M1 из вирусов птичьего гриппа, вирусов гриппа с пандемическим потенциалом и/или вирусов сезонного гриппа в экспрессионные векторы. В настоящем изобретении также описывается получение кандидатных вакцин против гриппа или реагентов, включающих белки вируса гриппа, которые самособираются в функциональные VLPs. Все сочетания вирусных белков должны быть коэкспрессированы с нуклеотидом M1.
VLPs изобретения состоят из или включают белки HA, NA и M1 вируса гриппа. В одном осуществлении указанная VLP включает HA из вируса птичьего, пандемического или сезонного гриппа и NA из вируса птичьего, пандемического или сезонного гриппа, где указанный HA выбран из группы, состоящей из Hl, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 и H16 и указанная NA выбрана из группы, состоящей из N1, N2, N3, N4, N5, N6, N7, N8 и N9. В другом осуществлении изобретение включает VLP, которая состоит по существу из HA, NA и M1. Указанные HA и NA могут быть из перечисленных выше HA и NA. Эти VLPs могут включать дополнительные белки вируса гриппа и/или белковые загрязнения в ничтожных концентрациях. В другом осуществлении указанная VLP гриппа включает белки вируса гриппа, где указанные белки вируса гриппа состоят из белков HA, NA и M1. Эти VLPs содержат HA, NA и M1 и могут содержать дополнительные клеточные составляющие, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительных белков вируса гриппа (отличных от фрагментов M1, HA и/или NA). В другом осуществлении HA и/или NA могут проявлять гемагглютининовую активность и/или нейраминидазную активность соответственно при экспрессии на поверхности VLPs.
В другом осуществлении указанная VLP включает HA и NA вируса H5N1 и белок M1 (белок M1 может быть или не быть из одного и того же штамма вируса). В другом осуществлении указанная VLP состоит по существу из HA, NA вируса H5N1 и белка M1. Эти VLPs могут содержать дополнительные белки вируса гриппа и/или белковые загрязнения в ничтожных концентрациях. В дополнительном осуществлении указанная VLP состоит из HA, NA вируса H5N1 и белка M1. В другом осуществлении указанная VLP гриппа включает белки вируса гриппа, где указанные белки вируса гриппа состоят из белков H5, N1 и M1. Эти VLPs содержат H5, N9 и M1 и могут содержать дополнительные клеточные компоненты, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительных белков вируса гриппа (отличных от фрагментов M1, H5 и/или N1). В другом осуществлении H5 и/или N1 могут проявлять гемагглютининовую активность и/или нейраминидазную активность соответственно при экспрессии на поверхности VLPs.
В другом осуществлении указанная VLP включает HA и NA вируса H9N2 и белок M1. В другом осуществлении указанная VLP состоит по существу из HA и NA вируса H9N2 и белка M1. Эти VLPs могут включать дополнительные белки вируса гриппа и/или белковые загрязнения в ничтожных концентрациях. В дополнительном осуществлении указанная VLP состоит из HA и NA вируса H9N2 и белка M1. В другом осуществлении указанная VLP гриппа включает белки вируса гриппа, где указанные белки вируса гриппа состоят из белков H9, N2 и M1. Эти VLPs содержат H9, N2 и M1 и могут содержать дополнительные клеточные компоненты, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительных белков вируса гриппа (отличных от фрагментов M1, H9 и/или N2). В другом осуществлении H9 и/или N2 могут проявлять гемагглютининовую активность и/или нейраминидазную активность соответственно при экспрессии на поверхности VLPs.
В другом осуществлении указанная VLP включает HA и NA из вируса B гриппа и белок M1. Вирусы B гриппа обычно находят только у человека. В отличие от вирусов A гриппа эти вирусы не классифицируются по подтипам. Вирусы B гриппа могут вызывать заболеваемость и смертность среди людей, но в целом связаны с менее тяжелыми эпидемиями, чем вирусы A гриппа. В другом осуществлении указанная VLP состоит по существу из HA, NA вируса B гриппа и белка M1. Эти VLPs могут включать дополнительные белки вируса гриппа и/или белковые загрязнения в ничтожных концентрациях. В другом осуществлении указанная VLP гриппа включает белки вируса гриппа, где указанные белки вируса гриппа состоят из белков HA, NA и M1. Эти VLPs содержат HA, NA и M1 и могут содержать дополнительные клеточные компоненты, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительных белков вируса гриппа (отличных от фрагментов M1, HA и/или NA). В другом осуществлении указанная VLP состоит из HA и NA вируса B гриппа и белка M1. В другом осуществлении HA и/или NA могут проявлять гемагглютининовую активность и/или нейраминидазную активность соответственно при экспрессии на поверхности VLPs.
Изобретение охватывает также варианты указанных белков вируса гриппа, экспрессируемых на или в VLPs изобретения. Варианты могут содержать изменения в аминокислотных последовательностях составляющих белков. Термин «вариант» в отношении полипептида относится к аминокислотной последовательности, которая изменена по одной или более аминокислот по сравнению с референсной последовательностью. Вариант может иметь «консервативные» изменения, когда замещенная аминокислота имеет сходные структурные или химические свойства, например замещение лейцина на изолейцин. Альтернативно, вариант может иметь «неконсервативные» изменения, например замену глицина на триптофан. Аналогичные минорные вариации могут также включать делецию или вставку аминокислоты или оба варианта. Руководство для определения, какие аминокислотные остатки могут быть замещены, вставлены или подвергнуты делеции без уничтожения биологической или иммунологической активности, может быть найдено при использовании компьютерных программ, хорошо известных в данной области техники, например компьютерной программы DNASTAR.
Природные варианты могут возникать благодаря антигенным дрейфам. Антигенные дрейфы представляют собой небольшие изменения в вирусных белках, которые происходят непрерывно в течение времени. Таким образом, индивидуум, инфицированный конкретным штаммом вируса гриппа, вырабатывает антитело против этого вируса, как только появляются более новые штаммы вируса, антитела против более старых штаммов больше не узнают более новый вирус и может наступить повторное инфицирование. Именно поэтому в каждый сезон существует новая вакцина против гриппа. Кроме того, некоторые изменения в вирусе гриппа могут вызывать преодоление вирусом гриппа видовой специфичности. Например, некоторые вирусы птичьего гриппа приобрели генетические вариации, связанные со способностью пересекать видовой барьер. Такой вирус способен вызывать пандемию, потому что люди не имеют естественного иммунитета к вирусу и вирус может легко распространяться от человека к человеку. Эти существующие в природе вариации вирусных белков являются осуществлением изобретения.
Обычные тексты, в которых описываются молекулярно-биологические способы, которые применимы к настоящему изобретению, такие как клонирование, мутация, клеточная культура и тому подобное, включают Berger and Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology volume 152 Academic Press, Inc., San Diego, Calif. (Berger); Sambrook et al., Molecular Cloning - A Laboratory Manual (3rd Ed.), Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N. Y., 2000 ("Sambrook") и Current Protocols in Molecular Biology, F. M. Ausubel et al., eds., Current Protocols, совместная деятельность Greene Publishing Associates, Inc. и John Wiley & Sons, Inc. ("Ausubel"). Эти тексты описывают мутагенез, применение векторов, промоторов и многие другие важные темы, относящиеся, например, к клонированию и мутации молекул HA и/или NA и т.д. Таким образом, изобретение также охватывает применение известных методов конструирования белков и способов рекомбинантных ДНК для улучшения или изменения характеристик белков вируса гриппа, экспрессируемых на или в VLPs изобретения. Могут быть использованы различные типы мутагенеза для получения и/или выделения вариантов молекул HA, NA и/или M1 и/или для дополнительной модификации/мутации полипептидов изобретения. Они включают, но не ограничиваются этим, сайт-направленный, случайный точечный мутагенез, гомологичную рекомбинацию (перестановки ДНК), мутагенез с применением содержащих урацил матриц, олигонуклеотид-направленный мутагенез, мутагенез с модифицированной фосфоротиоатом ДНК, мутагенез с применением двойных разрывов ДНК или тому подобное. Дополнительные подходящие методы включают точечное ошибочное спаривание оснований при репарации, мутагенез с использованием штаммов хозяина с дефектной репарацией, ограничение селекции и ограничение очистки, делеционный мутагенез, мутагенез с помощью тотального синтеза генов, разрыв репарации двойной спирали и тому подобное. Мутагенез, например, включающий химерные конструкты, также включается в настоящее изобретение. В одном осуществлении мутагенез может управляться с помощью известной информации о существующей в природе молекуле или об измененной, или о существующей молекуле с природной мутацией, например, о последовательности, сравнениях последовательностей, физических свойствах, кристаллической структуре или тому подобное.
Изобретение дополнительно включает варианты белков вируса гриппа, которые проявляют существенную биологическую активность, например способность вызывать эффективный антительный ответ при экспрессии на или в VLP. Такие варианты включают делеции, вставки, повторы и замены, выбранные в соответствии с общими правилами, известными в данной области техники как обладающие низким эффектом на активность.
Методы клонирования указанных белков вируса гриппа известны в данной области техники. Например, ген вируса гриппа, кодирующий конкретный белок вируса гриппа, может быть выделен с помощью ОТ-ПЦР из полиаденилированной мРНК, экстрагированной из клеток, которые были инфицированы вирусом гриппа. Результирующий генный продукт может быть клонирован в виде вставки ДНК в вектор. Термин «вектор» относится к средствам, с помощью которых нуклеиновая кислота может мультиплицироваться и/или переноситься между организмами, клетками или клеточными компонентами. Векторы включают плазмиды, вирусы, бактериофаги, провирусы, фагемиды, транспозоны, искусственные хромосомы и тому подобное, что реплицируется автономно или может интегрироваться в хромосому клетки-хозяина. Вектор может также быть депротеинизированным полинуклеотидом РНК, депротеинизированным полинуклеотидом ДНК, полинуклеотидом, состоящим из как ДНК, так и РНК в одной и той же цепи, полилизин-конъюгированной ДНК или РНК, пептид-конъюгированной ДНК или РНК, липосом-конъюгированной ДНК или тому подобное, что автономно не реплицируется. Во многих, но не во всех общих осуществлениях векторы настоящего изобретения представляют собой плазмиды или бакмиды.
Таким образом, изобретение включает нуклеотиды, которые кодируют белки вируса гриппа HA, NA и/или M1, клонированные в экспрессионный вектор, который может экспрессироваться в клетке, которая индуцирует образование VLPs. «Экспрессионный вектор» представляет собой вектор, такой как плазмида, который способен стимулировать экспрессию, а также репликацию включенной в него нуклеиновой кислоты. Обычно нуклеиновая кислота, которая будет экспрессироваться, «оперативно связана» с промотором и/или энхансером и является объектом транскрипционного регуляторного контроля промотором и/или энхансером. В одном осуществлении указанные нуклеотиды, которые кодируют HA из вируса птичьего, пандемического и/или сезонного гриппа, выбраны из группы, состоящей из H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 и H16. В другом осуществлении указанные нуклеотиды, которые кодируют NA из вируса птичьего, пандемического и/или сезонного гриппа, выбраны из группы, состоящей из N1, N2, N3, N4, N5, N6, N7, N8 и N9. В другом осуществлении указанный вектор включает нуклеотиды, которые кодируют белок вируса гриппа HA, NA и/или M1. Предпочтительный экспрессионный вектор представляет собой бакуловирусный вектор. После того как нуклеотиды, кодирующие указанные белки вируса гриппа, клонированы, с указанными нуклеотидами можно дополнительно манипулировать. Например, специалист в данной области техники может создать мутацию в конкретных основаниях в кодирующей области для получения вариантов. Варианты могут содержать изменения в кодирующих областях, некодирующих областях или в обеих. Такие варианты могут усиливать иммуногенность белка вируса гриппа или удалять сайт сплайсинга из белка или РНК. Например, в одном осуществлении донорское и акцепторное сайты сплайсинга на белке M вируса гриппа (полноразмерном) мутируются для предотвращения сплайсинга мРНК M в транскрипты M1 и M2. В другом осуществлении HA конструируется для удаления или мутации сайта расщепления. Например, дикий тип HA H5 обладает сайтом расщепления, который содержит множество основных аминокислот (RRRKR). Эта последовательность дикого типа делает HA более восприимчивым к множеству повсеместных протеаз, которые могут присутствовать у хозяина или в системе экспрессии этих Has. В одном осуществлении удаление этих аминокислот может снизить восприимчивость HA к различным протеазам. В другом осуществлении сайт расщепления может быть мутирован для удаления сайта расщепления (например, мутирован до RESR).
В изобретении также применяются нуклеиновая кислота и полипептиды, которые кодируют NA, HA и M1. В одном осуществлении нуклеиновая кислота или белок NA вируса гриппа идентичен, по меньшей мере, на 85%, 90%, 95%, 96%, 97%, 98% или 99% SEQ ID NOs 1, 11, 31, 32, 39, 38, 46, 47, 54 или 55. В другом осуществлении нуклеиновая кислота или белок HA вируса гриппа идентичен, по меньшей мере, на 85%, 90%, 95%, 96%, 97%, 98% или 99% SEQ ID NOs 2, 10, 56, 57, 58, 27, 28, 29, 30, 37, 36, 33, 34, 35, 42, 43, 44, 45, 50, 51, 52 или 53. В другом осуществлении нуклеиновая кислота или белок M1 вируса гриппа идентичен, по меньшей мере, на 85%, 90%, 95%, 96%, 97%, 98% или 99% SEQ ID NOs 12, 40, 41, 48 или 49.
В некоторых осуществлениях созданы мутации, содержащие изменения, которые дают молчащие замены, добавки или делеции, но не изменяют свойств или активностей кодируемого белка или способа продукции белка. Варианты нуклеотидов могут быть получены по разнообразным причинам, например, для оптимизации экспрессии кодонов у конкретного хозяина (замена кодонов в мРНК человека на те, которые предпочтительны для клеток насекомого, таких как клетки Sf9). См. патентную публикацию США 2005/0118191, включенную здесь в качестве ссылки во всей своей полноте для всех целей. Примеры последовательностей изобретения с оптимизированными кодонами раскрыты ниже (например, SEQ ID 42, 44, 46, 48, 50, 52 и 54).
Кроме того, нуклеотиды могут быть секвенированы для гарантии того, что были клонированы корректные кодирующие области и они не содержат каких-либо нежелательных мутаций. Нуклеотиды могут быть субклонированы в экспрессионный вектор (например, бакуловирус) для экспрессии в любой клетке. Представленное выше является только одним примером того, как могут быть клонированы белки вируса гриппа. Специалист в данной области техники понимает, что дополнительные способы доступны и возможны.
В изобретении также предлагаются конструкты и/или векторы, которые включают нуклеотиды, кодирующие структурные гены вируса птичьего, пандемического и/или сезонного гриппа, включая NA, M1 и/или HA. Вектор может представлять собой, например, фаг, плазмиду, вирусный или ретровирусный вектор. Конструкты и/или векторы, которые кодируют структурные гены вируса птичьего, пандемического и/или сезонного гриппа, включая NA, M1 и/или HA, должны быть оперативно связаны с подходящим промотором, таким как AcMNPV полигедриновый промотор (или другой бакуловирусный), промотор фага лямбда PL, промотор E. coli lac, phoA и tac, ранний и поздний промоторы SV40 и промоторы ретровирусных LTRs, которые являются не ограничивающими примерами. Другие подходящие промоторы должны быть известны специалисту в данной области техники и зависят от клетки-хозяина и/или желаемой скорости экспрессии. Экспрессионные конструкты должны дополнительно содержать сайты инициации транскрипции, терминации транскрипции и в транскрибируемой области сайт связывания рибосом для трансляции. Кодирующая часть транскриптов, экспрессируемая конструктами, должна предпочтительно включать кодон инициации трансляции в начале и кодон терминации, соответственно расположенный на конце полипептида, который будет транслироваться.
Экспрессионные векторы должны предпочтительно включать, по меньшей мере, один селектируемый маркер. Такие маркеры включают дигидрофолатредуктазу, G418 или устойчивость к неомицину для культуры эукариотных клеток и гены устойчивости к тетрациклину, канамицину или ампициллину для культивирования в E. coli и других бактериях. Среди векторов предпочтительными являются вирусные векторы, такие как бакуловирус, поксвирус (например, вирус коровьей оспы, вирус птичьей оспы, вирус канареечной оспы, вирус оспы домашней птицы, вирус оспы енотов, вирус оспы свиней и т.д.), вирус герпеса и ретровирус. Другие векторы, которые могут быть использованы в изобретении, включают векторы для применения в бактериях, которые включают pQE70, pQE60 и pQE-9, векторы pBluescript, векторы Phagescript, pNH8A, pNH16a, pNH18A, pNH46A, ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5. Среди предпочтительных эукариотных векторов находятся pFastBacl pWINEO, pSV2CAT, pOG44, pXTl и pSG, pSVK3, pBPV, pMSG и pSVL. Другие подходящие векторы должны быть вполне очевидные специалисту в данной области техники. В одном осуществлении указанный вектор, который включает нуклеотиды, кодирующие структурные гены вируса птичьего, пандемического и/или сезонного гриппа, включая HA, M1 и/или NA, представляет собой pFastBac. В другом осуществлении указанный вектор, который включает вставку, которая состоит из нуклеотидов, кодирующих структурные гены вируса птичьего, пандемического и/или сезонного гриппа, включая HA, M1 и NA, представляет собой pFastBac.
Затем рекомбинантный вектор может быть трансфецирован, инфицирован или трансформирован в подходящую клетку-хозяин. Таким образом, в изобретении предлагаются клетки-хозяева, которые включают вектор (или векторы), которые содержат нуклеиновые кислоты, которые кодируют HA, M1 и/или NA, и позволяют экспрессироваться HA, M1 и/или NA в указанной клетке-хозяине в условиях, которые позволяют образовываться VLPs.
В одном осуществлении рекомбинантные конструкты, упомянутые выше, могут быть использованы для трансфекции, инфицирования или трансформации и могут экспрессировать белки вируса гриппа HA, M1 и NA в эукариотных клетках и/или прокариотных клетках. Среди эукариотных клеток клетками-хозяевами являются дрожжи, насекомые, птицы, растения, C. elegans (или нематода) и клетки-хозяева млекопитающих. Не ограничивающими примерами клеток насекомых являются клетки Spodoptera frugiperda (Sf), например, Sf9, Sf21, клетки Trichoplusia ni, например, клетки High Five и клетки Drosophila S2. Примерами клеток-хозяев грибов (включая дрожжи) являются S. cerevisiae, Kluyveromyces lactis (K. lactis), штаммы Candida, включая C. albicans и C. glabrata, Aspergillus nidulans, Schizosaccharomyces pombe (S. pombe), Pichia pastoris и Yarrowia lipolytica. Примерами клеток млекопитающих являются клетки COS, клетки почек детенышей хомячков, L клетки мыши, клетки LNCaP, клетки яичника китайского хомячка (CHO), клетки эмбриональной почки человека (HEK) и клетки африканской зеленой мартышки, клетки CVl, клетки HeLa, клетки MDCK, клетки Vero и Hep-2. Могут быть также использованы ооциты Xenopus laevis или другие клетки, происходящие от амфибий. Прокариотные клетки-хозяева включают бактериальные клетки, например E. coli, B. subtilis и микобактерии.
Векторы, например векторы, включающие полинуклеотиды HA, NA и/или M1, могут быть трансфецированы в клетки-хозяева в соответствии с методами, хорошо известными в данной области техники. Например, введение нуклеиновых кислот в эукариотные клетки может представлять собой копреципитацию, электропорацию, микроинъекцию, липофекцию и трансфекцию с применением полиаминных трансфекционных реагентов. В одном осуществлении указанный вектор представляет собой рекомбинантный бакуловирус. В другом осуществлении указанный рекомбинантный бакуловирус трансфецируют в эукариотную клетку. В предпочтительном осуществлении указанная клетка представляет собой клетку насекомого. В другом осуществлении указанная клетка насекомого представляет собой клетку Sf9.
В другом осуществлении указанные вектор и/или клетка-хозяин включают нуклеотиды, которые кодируют белок HA вируса птичьего, пандемического и/или сезонного гриппа, выбранные из группы, состоящей из H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 и H16. В другом осуществлении указанные вектор и/или клетки-хозяева включают нуклеотиды, которые кодируют белок NA, выбранный из группы, состоящей из Nl, N2, N3, N4, N5, N6, N7, N8 и N9. В другом осуществлении указанные вектор и/или клетка-хозяин включают HA, M1 и/или NA вируса гриппа. В другом осуществлении указанные вектор и/или клетка-хозяин состоят по существу из HA, M1 и/или NA. В дополнительном осуществлении указанные вектор и/или клетка-хозяин состоят из белка вируса гриппа, включающего HA, M1 и NA. Эти вектор и/или клетка-хозяин содержат HA, NA и M1 и могут содержать дополнительные клеточные составляющие, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительных белков вируса гриппа (отличных от фрагментов M1, HA и/или NA). В другом осуществлении указанные нуклеотиды кодируют HA и/или NA, которые проявляют гемагглютининовую активность и/или нейраминидазную активность соответственно при экспрессии на поверхности VLPs.
В этом изобретении предлагаются также конструкты и способы, которые должны увеличить эффективность продукции VLPs. Например, удаление сайтов расщепления из белков для увеличения экспрессии белков (см. выше). Другой способ включает добавление лидирующих последовательностей к белку HA, NA и/или M1 для более эффективного транспорта. Например, гетерологичная сигнальная последовательность может быть соединена с белком вируса гриппа HA, NA и/или M1. В одном осуществлении сигнальная последовательность может происходить от гена клетки насекомого и соединяться с белком HA вируса гриппа (для экспрессии в клетках насекомых). В другом осуществлении сигнальный пептид представляет собой сигнальную последовательность хитиназы, которая эффективно работает в бакуловирусных экспрессионных системах. В другом осуществлении лидирующие последовательности, взаимозаменяемые между белками вируса гриппа, могут обеспечить улучшенный транспорт белков. Например, было показано, что гемагглютинин H5 менее эффективен в отношении транспорта на поверхность частиц. Гемагглютинин H9, однако, направленно доставляется на поверхность и интегрируется на поверхности более эффективно. Таким образом, в одном осуществлении лидирующая последовательность H9 гибридизуется с белком H5.
Другим способом увеличения эффективности продукции VLP является оптимизация кодонов нуклеотидов, которые кодируют белки HA, NA и/или M1, для конкретного клеточного типа. Например, кодон-оптимизированные нуклеиновые кислоты для экспрессии в клетке Sf9 (см. патентную публикацию США 2005/0118191, включенную здесь в качестве ссылки во всей своей полноте для всех целей). Примеры последовательностей с оптимизированными кодонами для клеток Sf9 раскрыты ниже (например, SEQ ID 42, 44, 46, 48, 50, 52 и 54). В одном осуществлении последовательность нуклеиновой кислоты с оптимизированными кодонами белка вируса гриппа соответствует, по меньшей мере, на 85%, 90%, 95%, 96%, 97%, 98% или 99% любой SEQ ID Nos. 42, 44, 46, 48, 50, 52 и 54.
В изобретении предлагаются также способы получения VLPs, причем указанные способы включают экспрессию белков вируса птичьего, пандемического и/или сезонного гриппа в условиях, которые дают возможность образоваться VLP. В зависимости от экспрессионной системы и выбранной клетки-хозяина VLPs продуцируются растущими клетками-хозяевами, трансформированными экспрессионным вектором в условиях, при которых рекомбинантные белки экспрессируются, а VLPs образуются. Отбор подходящих условий выращивания находится в компетенции специалиста или работника с навыками в данной области техники.
Способы выращивания клеток, сконструированных для продукции VLPs изобретения, включают, но не ограничиваются этим, способы суспензионной, суспензионной с подпиткой, проточной и перфузионной культур. Клеточная культура обозначает рост и размножение клеток в биореакторе (ферментационной камере), где клетки размножаются и экспрессируют белок (например, рекомбинантные белки) для очистки и выделения. Обычно клеточная культура выращивается в стерильных условиях при контролируемой температуре и атмосферных условиях в биореакторе. Биореактор представляет собой камеру, применяемую для культивирования клеток, в которой могут быть прослежены условия среды, такие как температура, атмосфера, перемешивание и/или рН. В другом осуществлении указанный биореактор представляет собой предварительно стерилизованный пластиковый мешок (например, Cellbag®, Wave Biotech, Bridgewater, NJ). В другом осуществлении указанные предварительно стерилизованные пластиковые мешки представляют собой мешки от приблизительно 50 л до 1000 л.
VLPs затем выделяют с применением способов, которые предохраняют их целостность, таких как с помощью центрифугирования в градиенте, например, хлорида цезия, сахарозы и йодиксанола, а также стандартных способов очистки, включающих, например, ионообменную и гель-фильтрационную хроматографию.
Последующее является примером того, как VLPs изобретения могут быть получены, выделены и очищены. Обычно VLPs получают из рекомбинантных клеточных линий, сконструированных для создания VLP, где указанные клетки выращивают в клеточной культуре (см. выше). Продукция VLPs может осуществляться по схеме, проиллюстрированной на фиг. 26. Специалист в данной области техники должен понимать, что существуют дополнительные методы, которые могут быть использованы для создания и очистки VLPs изобретения, таким образом, изобретение не ограничивается описанным методом.
Продукция VLPs изобретения может начинаться высеванием клеток Sf9 (неинфицированных) во встряхиваемые сосуды, позволяя клеткам распространяться и увеличиваться в масштабе по мере роста и размножения клеток (например, от 125-мл сосуда до 50 л мешка Wave). Среда, применяемая для выращивания клеток, составляется для подходящей клеточной линии (предпочтительны среды, свободные от сыворотки, например среда для насекомых ExCell-420, JRH). Затем указанные клетки инфицируются рекомбинантным бакуловирусом при наиболее эффективной множественности инфицирования (например, от приблизительно 1 до приблизительно 3 единиц, образующих бляшки на клетку). Как только инфекция возникает, белки вируса гриппа HA, NA и M1 экспрессируются в вирусном геноме, самособираются в VLPs и секретируются из клеток приблизительно через от 24 до 72 часов после инфицирования. Обычно инфицирование наиболее эффективно, когда клетки находятся в середине логарифмической фазы роста (4-8×106 клеток/мл) и жизнеспособны, по меньшей мере, на приблизительно 90%.
VLPs изобретения могут быть собраны приблизительно через от 48 до 96 часов после инфицирования, когда уровни VLPs в среде клеточной культуры находятся приблизительно на максимуме, но до экстенсивного клеточного лизиса. Плотность и жизнеспособность клеток Sf9 во время сбора может составлять от приблизительно 0,5×106 клеток/мл до приблизительно 1,5×106 клеток/мл с жизнеспособностью, по меньшей мере, 20%, как свидетельствует тест по исключению красителя. Затем среда удаляется и очищается. NaCl может быть добавлен к среде до концентрации от приблизительно 0,4 до приблизительно 1,0 М, предпочтительно до приблизительно 0,5 М для избегания агрегации VLPs. Удаление клеток и клеточных остатков из среды клеточной культуры, содержащей VLPs изобретения, может быть осуществлено с помощью тангенциальной проточной фильтрации (TFF) с однократным использованием предварительно стерилизованного картриджа с фильтром из полого волокна 0,5 или 1,00 мкм или сходного устройства.
Затем VLPs в очищенной культуральной среде могут быть сконцентрированы с помощью ультрафильтрации с применением одноразового предварительно стерилизованного картриджа из полого волокна с ограничением молекулярной массы 500000. Концентрированные VLPs могут быть отфильтрованы с помощью диализа против 10 объемов забуференного физиологического раствора (ЗФР), содержащего 0,5 М NaCl для удаления остаточных компонентов среды.
Концентрированные, отфильтрованные с помощью диализа VLPs могут быть дополнительно очищены в ступенчатом градиенте сахарозы от 20% до 60% в буфере ЗФР с 0,5 М NaCl при рН 7,2 при центрифугировании при 6500×g в течение 18 часов при от приблизительно 4°С до приблизительно 10°С. Обычно VLPs должны образовывать отличительную видимую полосу между от приблизительно 30% до приблизительно 40% сахарозы или на границе раздела (в от 20% до 60% ступенчатом градиенте), которая может быть собрана из градиента и сохранена. Этот продукт может быть разведен до содержания 200 мМ NaCl в препарате для следующей стадии процесса очистки. Этот продукт содержит VLPs и может содержать интактные бакуловирусные частицы.
Дополнительная очистка VLPs может быть достигнута с помощью ионообменной хроматографии или центрифугирования через подушку из 44% изопикнической сахарозы. При анионообменной хроматографии образец с градиента сахарозы (см. выше) наносится на колонку, содержащую среду с анионом (например, Matrix Fractogel EMD TMAE), и элюируется через градиент соли (от приблизительно 0,2 М до приблизительно 1,0 М NaCl), что может отделить VLP от других загрязнений (например, бакуловируса и ДНК/РНК). В случае метода с подушкой сахарозы образец, включающий VLPs, добавляют к подушке 44% сахарозы и центрифугируют в течение приблизительно 18 часов при 30000 g. VLPs образуют полосу на верхушке 44% сахарозы, в то время как бакуловирус преципитирует на дно, а другие загрязняющие белки остаются в слое 0% сахарозы наверху. Пик или полоса VLP собирается.
Интактный бакуловирус может быть инактивирован, если это желательно. Инактивация может быть осуществлена с помощью химических методов, например, формалина или β-пропиллактона (BPL). Удаление и/или инактивация интактного бакуловируса может быть также в значительной степени осуществлена с помощью применения селективной преципитации и хроматографических методов, известных в данной области техники, как проиллюстрировано выше. Способы инактивации включают инкубацию образца, содержащего VLPs, в 0,2% BPL в течение 3 часов при приблизительно от 25°С до приблизительно 27°С. Бакуловирус может быть также инактивирован с помощью инкубации образца, содержащего VLPs, в 0,05% BPL при 4°С в течение 3 дней, затем при 37°С в течение одного часа.
После стадии инактивации/удаления продукт, включающий VLPs, можно пропустить через другую стадию фильтрации с помощью диализа для удаления любого реагента со стадии инактивации и/или любой остаточной сахарозы и для помещения VLPs в желаемый буфер (например, ЗФР). Раствор, включающий VLPs, может быть стерилизован с помощью способов, известных в данной области техники (например, стерильной фильтрации), и сохранен в холодильнике или морозильнике.
Указанные выше способы могут быть осуществлены в различных масштабах. Например, в Т-образных колбах, качалках, вращающихся флаконах до биореакторов промышленных размеров. Биореакторы могут включать либо резервуар из нержавеющей стали, либо предварительно стерилизованный пластиковый мешок (например, систему, продаваемую Wave Biotech, Bridgewater, NJ). Специалист в данной области техники должен знать что наиболее желательно для его целей.
Расширение и получение бакуловирусных экспрессионных векторов и инфицирование клеток рекомбинантным бакуловирусом для продукции рекомбинантных VLPs вируса гриппа может быть осуществлено в клетках насекомых, например клетках насекомых Sf9, как описано ранее. В предпочтительном осуществлении клетки представляют собой SF9, инфицированные рекомбинантным бакуловирусом, сконструированным для продукции VLPs вируса гриппа.
Фармацевтические или вакцинные составы и введение
Применяемые здесь фармацевтические составы содержат фармацевтически приемлемый носитель, включая любой подходящий разбавитель или наполнитель, который включает любой фармацевтический агент, который сам не индуцирует индукцию иммунного ответа, вредного для позвоночного, получающего композицию, и который может вводиться без чрезмерной токсичности, и VLP изобретения. Применяемый здесь термин «фармацевтически приемлемый» обозначает одобренный федеральным правительством, или правительством штата, или фармакопеей США, европейской фармакопеей или другой широко известной фармакопеей для применения у позвоночных и более конкретно у человека. Эти композиции могут быть пригодны в качестве вакцины и/или антигенных композиций для индукции защитного иммунного ответа у позвоночного.
Указанные фармацевтические составы изобретения включают VLPs, включающие белок M1, HA и/или NA вируса гриппа и фармацевтически приемлемый носитель или наполнитель. Фармацевтически приемлемые носители включают, но не ограничиваются этим, физиологический раствор, забуференный физиологический раствор, декстрозу, воду, глицерин, стерильный изотонический водный буфер и их сочетания. Всестороннее обсуждение фармацевтически приемлемых носителей, разбавителей и других наполнителей представлено в Remington's Pharmaceutical Sciences (Mack Pub. Co. N.J., текущее издание). Состав должен подходить к способу введения. В предпочтительном осуществлении состав подходит для введения человеку, предпочтительно является стерильным, не содержащим частиц и/или непирогенным.
Композиция, если это желательно, может также содержать минорные количества увлажняющих или эмульгирующих агентов или доводящих рН буфера агентов. Композиция может представлять собой твердую форму, такую как лиофилизованный порошок, подходящий для воссоздания, жидкий раствор, суспензию, эмульсию, таблетку, пилюлю, капсулу, состав для постоянного высвобождения или порошок. Пероральный состав может включать стандартные носители, такие как фармацевтического качества манит, лактоза, крахмал, стеарат магния, натриевая соль сахарина, целлюлоза, карбонат магния и т.д.
В изобретении также предлагается фармацевтическая упаковка или набор, включающий один или более контейнеров, заполненных одним или более ингредиентами составов вакцины изобретения. В предпочтительном осуществлении набор включает два контейнера, один содержащий VLPs и другой содержащий адъювант. В сочетании с таким(и) контейнером(амии) может быть представлено уведомление в форме предписаний правительственного органа, регулирующего производство, применение или продажу фармацевтических или биологических продуктов, причем уведомление отражает одобрение органа на производство, применение или продажу для введения человеку.
В изобретении также предполагается, что состав VLP будет упакован в герметически запаянный контейнер, такой как ампула или саше, с указанием количества композиции. В одном осуществлении композиция VLP предоставляется в виде жидкости, в другом осуществлении в виде сухого, стерильного, лиофилизованного порошка или свободного от воды концентрата в герметически запаянном контейнере, и он может быть воссоздан, например, с помощью воды или физиологического раствора до подходящей концентрации для введения субъекту. Предпочтительно композиция VLP предлагается в виде сухого, стерильного, лиофилизованного порошка в герметически запаянном контейнере в единице лекарственной формы, составляющей предпочтительно приблизительно 1 мкг, приблизительно 5 мкг, приблизительно 10 мкг, приблизительно 20 мкг, приблизительно 25 мкг, приблизительно 30 мкг, приблизительно 50 мкг, приблизительно 100 мкг, приблизительно 125 мкг, приблизительно 150 мкг или приблизительно 200 мкг. Альтернативно, единица лекарственной формы композиции VLP составляет менее приблизительно 1 мкг (например, приблизительно 0,08 мкг, приблизительно 0,04 мкг; приблизительно 0,2 мкг, приблизительно 0,4 мкг, приблизительно 0,8 мкг, приблизительно 0,5 мкг или менее, приблизительно 0,25 мкг или менее или приблизительно 0,1 мкг или менее) или более приблизительно 125 мкг (например, приблизительно 150 мкг или более, приблизительно 250 мкг или более или приблизительно 500 мкг или более). Эти дозы могут быть измерены в виде суммарных VLPs или в виде мкг HA. Композиция VLP должна вводиться в пределах приблизительно 12 часов, предпочтительно в пределах приблизительно 6 часов, в пределах приблизительно 5 часов, в пределах приблизительно 3 часов или в пределах приблизительно 1 часа после воссоздания из лиофилизованного порошка.
В альтернативном осуществлении композиция VLP предлагается в жидкой форме в герметически запаянном контейнере с указанием количества и концентрации композиции VLP. Предпочтительно жидкая форма композиции VLP поставляется в герметически запаянном контейнере в концентрации, по меньшей мере, приблизительно 50 мкг/мл, более предпочтительно, по меньшей мере, приблизительно 100 мкг/мл, по меньшей мере, приблизительно 200 мкг/мл, по меньшей мере, приблизительно 500 мкг/мл или, по меньшей мере, приблизительно 1 мг/мл.
Обычно VLPs вируса гриппа изобретения вводят в эффективном количестве или размере (как определено выше), достаточном для стимуляции иммунного ответа против одного или более штаммов вируса гриппа. Предпочтительно введение VLP изобретения вызывает стойкий иммунитет против, по меньшей мере, одного вируса гриппа. Обычно доза может быть доведена в пределах данного диапазона, основываясь на возрасте, физическом состоянии, массе тела, поле, диете, времени введения и других клинических факторах. Профилактический вакцинный состав вводят системно, например, путем подкожной или внутримышечной инъекции с применением иглы и шприца или безыгольного устройства для введения. Альтернативно, вакцинный состав вводят интраназально либо по каплям, либо в виде аэрозоля из крупных частиц (более чем приблизительно 10 микрон), либо в виде спрея в верхние дыхательные пути. Несмотря на то что любой из указанных выше путей доставки ведет к иммунному ответу, интраназальное введение предоставляет дополнительное преимущество, вызывая иммунитет в слизистой, являющейся входными воротами для вируса гриппа.
Таким образом, изобретение также включает способ составления вакцины или антигенной композиции, которая индуцирует стойкий иммунитет в отношении инфицирования вирусом гриппа или, по меньшей мере, одного его симптома у субъекта, включающий добавление к указанному составу эффективной дозы VLP вируса гриппа.
Несмотря на то что стимуляция стойкого иммунитета одной дозой предпочтительна, для достижения желаемого эффекта могут быть введены дополнительные дозы тем же самым или отличным путем. У новорожденных и детей, например, могут требоваться множественные введения для индукции достаточных уровней иммунитета. Введение может продолжаться с интервалами в течение всего детства, так как необходимо поддерживать достаточные уровни защиты от инфицирования вирусом гриппа. Сходно, взрослым, которые особенно восприимчивы к повторной или тяжелой инфекции вирусом гриппа, такие как, например, работники здравоохранения, работники дневного ухода, члены семьи с маленькими детьми, пожилые люди и индивидуумы с нарушенной функцией сердца и легких, может требоваться множественная иммунизация для установления и/или поддержания защитных иммунных ответов. Уровни индуцированного иммунитета могут быть прослежены, например, с помощью измерения количеств нейтрализующих секретируемых и сывороточных антител, и дозировки доводят или вакцинации повторяют, как это необходимо для индукции и поддержания желаемых уровней защиты.
Таким образом, в одном осуществлении способ индукции стойкого иммунитета к инфицированию вирусом гриппа или, по меньшей мере, к одному его симптому у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP включает белки HA, NA и M1. В другом осуществлении способ индукции стойкого иммунитета к инфицированию вирусом гриппа или, по меньшей мере, к одному его симптому у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP состоит по существу из HA, NA и M1. Указанные VLPs могут включать дополнительные вирусные белки и/или белковые загрязнения в ничтожных концентрациях. В другом осуществлении способ индукции стойкого иммунитета к инфицированию вирусом гриппа или, по меньшей мере, к одному его симптому у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP состоит из HA, NA и M1. В другом осуществлении указанные HA, NA и M1 вируса гриппа происходят от вируса сезонного гриппа и/или вируса птичьего гриппа. В другом осуществлении способ индукции стойкого иммунитета к инфицированию вирусом гриппа или, по меньшей мере, к одному его симптому у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, включающей белки вируса гриппа, где указанные белки вируса гриппа состоят из белков HA, NA и M1. Эти VLPs содержат HA, NA и M1 и могут содержать дополнительные клеточные составляющие, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительных белков вируса гриппа (отличных от фрагментов M1, HA и/или NA). В другом осуществлении указанный HA и/или NA проявляют гемагглютининовую активность и/или нейраминидазную активность соответственно. В другом осуществлении указанный субъект представляет собой млекопитающее. В другом осуществлении указанное млекопитающее является человеком. В другом осуществлении способ включает индукцию стойкого иммунитета к инфицированию вирусом гриппа или, по меньшей мере, к одному его симптому с помощью введения указанного состава в однократной дозе. В другом осуществлении способ включает индукцию стойкого иммунитета к инфицированию вирусом гриппа или, по меньшей мере, к одному его симптому с помощью введения указанного состава в множественных дозах.
Способы введения композиции, включающей VLPs (вакцины и/или антигенных составов), включают, но не ограничиваются этим, парентеральное введение (например, внутридермальное, внутримышечное, внутривенное и подкожное), эпидуральное и мукозное (например, интраназальное и пероральное или пути через легкие, или с помощью суппозиториев). В конкретном осуществлении композиции настоящего изобретения вводят внутримышечно, внутривенно, подкожно, трансдермально или внутридермально. Композиции могут быть введены с помощью любого традиционного способа, например путем инфузии или болюсного введения, путем всасывания через эпителиальную или слизисто-кожную выстилку (например, слизистую полости рта, ободочную кишку, конъюнктиву, носоглотку, ротовую часть глотки, влагалище, уретру, мочевой пузырь и слизистую кишечника и т.д.), и могут вводиться совместно с другими биологически активными агентами. В некоторых осуществлениях интраназальный путь или другие пути введения через слизистые композиции, включающей VLPs изобретения, могут индуцировать антительный или другой иммунный ответ, который существенно выше, чем при других путях введения. В другом осуществлении интраназальный путь или другие пути введения через слизистые композиции, включающей VLPs изобретения, могут индуцировать антительный или другой иммунный ответ, который будет индуцировать перекрестную защиту против других штаммов вирусов гриппа. Введение может быть системным или местным.
В еще одном осуществлении вакцину и/или антигенный состав вводят таким способом, чтобы мишенями были слизистые ткани для того, чтобы индуцировать иммунный ответ в месте иммунизации. Например, слизистые ткани, такие как кишечник, связанный с лимфоидной тканью (GALT), могут представлять собой мишени для иммунизации при применении перорального введения композиций, которые содержат адъюванты с конкретными свойствами, направленными на слизистую мишень. Дополнительные слизистые ткани, такие как носоглоточная лимфоидная ткань (NALT) и связанная с бронхами лимфоидная ткань (BALT), также могут представлять собой мишени.
Вакцины и/или антигенные составы изобретения можно также вводить по схеме дозировки, например первоначальное введение вакцинной композиции с последующими бустерными введениями. В конкретных осуществлениях вторая доза композиции вводится куда угодно от двух недель до одного года, предпочтительно от приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5 до приблизительно 6 месяцев после первоначального введения. Дополнительно после второй дозы может быть введена третья доза и от приблизительно трех месяцев до приблизительно двух лет или даже дольше, предпочтительно от приблизительно 4, приблизительно 5, или приблизительно 6 месяцев, или приблизительно 7 месяцев до приблизительно одного года после первоначального ведения. Третья доза может быть необязательно введена, когда в сыворотке и/или моче или в секретах слизистых субъекта после второй дозы не определяются или определяются низкие уровни специфических иммуноглобулинов. В предпочтительном осуществлении вторую дозу вводят приблизительно через один месяц после первого введения, а третью дозу вводят приблизительно через шесть месяцев после первого введения. В другом осуществлении вторую дозу вводят приблизительно через шесть месяцев после первого введения.
В другом осуществлении указанную VLP изобретения можно вводить в виде части сочетанной терапии. Например, VLPs изобретения могут быть составлены с другими иммуногенными композициями и/или противовирусными агентами (например, амантадином, римантадином, занамивиром и остелтамивиром).
Доза фармацевтического состава может быть легко определена опытным специалистом, например, путем первоначального выявления доз, эффективных в индукции профилактического или терапевтического иммунного ответа, например измерением титра специфичных в отношении вируса иммуноглобулинов в сыворотке или измерением ингибирующего отношения антител в образцах сыворотки или образцах мочи или секретах слизистых. Указанные дозы могут быть определены на основании исследований на животных. Неограничивающий перечень животных, используемых для изучения вируса гриппа, включает морскую свинку, сирийского хомячка, шиншиллу, ежа, курицу, крысу, мышь и хорька. Большинство животных не являются природными хозяевами вируса гриппа, но, тем не менее, могут быть использованы для изучения разных аспектов заболевания. Например, любому из указанных выше животных можно ввести изучаемую вакцину, например VLPs изобретения, для частичной характеристики индуцируемого иммунного ответа и/или определения того, продуцируются ли какие-либо нейтрализующие антитела. Например, многие исследования были проведены на мышиной модели, поскольку мыши благодаря малому размеру и низкой стоимости дают возможность ученым проводить более широкомасштабные исследования. Тем не менее, малый размер мыши усложняет также наблюдение любых клинических проявлений заболевания, и мышь не служит предсказательной моделью для заболевания у человека.
Для изучения различных аспектов инфекции вирусом гриппа человека и хода ее развития интенсивно использовали хорьков. Развитие многих современных концепций иммунитета к вирусу гриппа было бы невозможно без использования хорька (Maher et al., 2004). Было показано, что хорьки являются хорошей моделью для изучения гриппа по нескольким причинам: инфекция гриппа у хорька очень сходна с таковой у человека в отношении клинических проявлений, патогенеза и иммунной реакции; вирус гриппа типа A и B человека является природной инфекцией хорька, что предоставляет возможность исследовать полностью контролируемую популяцию, в которой можно наблюдать взаимодействие передачи инфекции, болезни и вариации последовательности аминокислот в гликопротеинах вируса гриппа; и хорьки имеют другие физические особенности, которые делают их идеальной моделью для расшифровки проявлений заболевания. Например, хорьки и люди проявляют очень сходные клинические признаки инфекции гриппа, которые, видимо, зависят от возраста хозяина, штамма вируса, окружающих условий, степени вторичной бактериальной инфекции и многих других параметров. Таким образом, специалисту в данной области техники проще перенести корреляцию между эффективностью вакцины гриппа и режимом введения дозы с модели хорька на человека по сравнению с мышиной или любой другой моделью, описанной выше.
Кроме того, опытным специалистом могут быть проведены клинические испытания на человеке для определения предпочтительной эффективной дозы для людей. Такие клинические испытания являются обычными и хорошо известны в данной области техники. Конкретная доза для применения обычно также зависит от пути введения. Эффективные дозы могут быть рассчитаны путем экстраполяции на основании кривых доза-ответ, полученных в системах тестирования in vitro или на животных.
Как также хорошо известно в данной области техники, иммуногенность композиции частиц может быть увеличена путем применения неспецифических стимуляторов иммунного ответа, известных как адъюванты. Адъюванты использовались в эксперименте для стимуляции генерализованного повышения иммунитета против неизвестных антигенов (например, патент США № 4877611). В протоколах иммунизации адъюванты использовали для стимуляции ответов в течение многих лет, и в этом качестве адъюванты хорошо известны специалисту в данной области техники. Некоторые адъюванты влияют на путь презентации антигенов. Например, иммунный ответ увеличивается, когда белковые антигены осаждают квасцами. Эмульгирование антигенов также продлевает презентацию антигена. Включение любого адъюванта, описанного в Vogel et al. “A Compendium of Vaccine Adjuvants and Excipients (2nd Edition)”, включенной здесь в качестве ссылки во всей своей полноте для всех целей, предусматривается объемом данного изобретения.
В качестве иллюстрации, адъюванты включают полный адъювант Фрейнда (неспецифический стимулятор иммунного ответа, содержащий убитую Mycobacterium tuberculosis), неполные адъюванты Фрейнда и адъювант гидроксида алюминия. Другие адъюванты включают GMCSF, BCG, гидроксид алюминия, соединения MDP, такие как thur-MDP, nor-MDP, CGP (MTP-PE), липид A и монофосфорил-липид A (MPL). Рассматривается также RIBI, который содержит три компонента, экстрагированных из бактерий, MPL, трегалозы димиколат (TDM) и скелет клеточной стенки (CWS) в 2% эмульсии сквален/твин 80. Могут быть также использованы MF-59, Novasomes®, антигены MHC.
В одном осуществлении изобретения адъювант представляет собой липидную частицу с несколькими слоями, от двух до десяти двойных слоев, организованных в форме по существу сферических оболочек, разделенных водными слоями, окружающими большую аморфную центральную полость, свободную от двойных липидных слоев. Липидные частицы с несколькими слоями могут стимулировать иммунный ответ несколькими путями, в качестве неспецифических стимуляторов, в качестве носителей антигена, в качестве носителей дополнительных адъювантов и их сочетаний. Липидные частицы с несколькими слоями действуют в качестве неспецифических иммуностимуляторов когда, например, вакцину готовят смешиванием антигена с предварительно полученными везикулами, так что антиген остается снаружи везикул. При инкапсулировании антигена в центральную полость везикулы последняя действует и как иммуностимулятор, и как носитель антигена. В другом осуществлении везикулы исходно изготавливают из нефосфолипидных везикул. В другом осуществлении везикулы представляют собой Novasomes. Novasomes® являются нефосфолипидными везикулами с несколькими слоями в диапазоне от приблизительно 100 нм до приблизительно 500 нм. Они включают Brij 72, холестерин, олеиновую кислоту и сквален. Было показано, что Novasomes являются эффективным адъювантом для антигенов гриппа (см. патенты США 5629021, 6387373 и 4911928, включенные здесь в качестве ссылки во всей своей полноте для всех целей).
В одном аспекте адъювантное действие достигается применением агента, такого как квасцы, используемого в растворе от приблизительно 0,05 до приблизительно 0,1% в забуференном фосфатом солевом растворе. Альтернативно, VLPs могут быть получены в виде смеси с синтетическими полимерами сахаров (Carbopol®), используемой в форме приблизительно 0,25% раствора. Некоторые адъюванты, например определенные органические молекулы, полученные из бактерий, действуют на хозяина, а не на антиген. Примером служит мурамиловый дипептид (N-ацетилмурамил-L-аланил-D-изоглутамин [MDP]), бактериальный пептидогликан. В других осуществлениях с VLPs изобретения могут быть использованы гемоцианины и гемоэритрины. В некоторых осуществлениях предпочтительным является применение гемоцианина из моллюска фиссуреллия (KLH), хотя могут использоваться гемоцианины и гемоэритрины других моллюсков и членистоногих.
Могут использоваться также различные полисахаридные адъюванты. Например, было описано применение различных полисахаридных адъювантов пневмококка для стимуляции ответа антител у мышей (Yin et al., 1989). Следует использовать указанные дозы, которые вызывают оптимальный ответ или которые по крайней мере не вызывают супрессии (Yin et al., 1989). Особенно предпочтительны такие полиаминовые разновидности полисахаридов, как хитин и хитозан, включая деацетилированный хитин. В другом осуществлении применяют липофильное дисахарид-трипептидное производное мурамилового дипептида, которое используют, как описано, в искусственных липосомах, образуемых из фосфатидилхолина и фосфатидилглицерина.
Еще одну группу адъювантов для использования с VLPs изобретения образуют амфипатические и поверхностно-активные агенты, например сапонин и такие производные, как QS21 (Cambridge Biotech). Могут также использоваться неионные блок-сополимерные поверхностно-активные агенты (Rabinovich et al., 1994). Другой пригодной группой адъювантов являются олигонуклеотиды (Yamamoto et al., 1988). Другими адъювантами, которые могут быть использованы в некоторых осуществлениях настоящего изобретения, являются Quil A и лентинен.
Другой группой адъювантов являются детоксицированные эндотоксины, такие как очищенный детоксицированный эндотоксин патента США № 4866034. Такие очищенные детоксицированные эндотоксины эффективны в получении адъювантного ответа у позвоночных. Разумеется, детоксицированные эндотоксины могут быть соединены с другими адъювантами с получением мультиадъювантного состава. Например, сочетание детоксицированных эндотоксинов с трегалозы димиколатом, как описано в патенте США № 4435386, рассматривается как особенно перспективное. Предусматриваются также сочетания детоксицированных эндотоксинов с трегалозы димиколатом и эндотоксичными гликолипидами (патент США № 4505899), а также сочетание детоксицированных эндотоксинов со скелетом клеточной стенки (CWS) или CWS с трегалозы димиколатом, как описано в патентах США № 4436727, 4436728 и 4505900. Ожидается, что сочетание только CWS и трегалозы димиколата, без детоксицированных эндотоксинов, также может быть пригодно, как описано в патенте США № 4520019.
Специалистам в данной области техники должны быть знакомы разные типы адъювантов, которые можно соединять с вакцинами по данному изобретению, и они наряду с прочими включают алкиллизофосфолипиды (ALP); BCG и биотин (включая биотинилированные производные). Некоторыми адъювантами, особо предусматриваемыми для применения, служат тейхоевые кислоты из грам-положительных клеток. Они включают липотейхоевые кислоты (LTA), рибитолтейхоевые кислоты (RTA) и глицеролтейхоевую кислоту (GTA). В связи с изобретением могут быть также использованы активные формы их синтетических аналогов (Takada et al., 1995).
Различные адъюванты, даже те, которые обычно не используются у человека, могут, тем не менее, использоваться у других позвоночных, у которых, например, желательно увеличить уровень антител или затем получить активированные T-клетки. Токсичность или другие неблагоприятные эффекты, которые могут возникать либо за счет адъюванта, либо за счет клеток, например, как это может иметь место при использовании необлученных опухолевых клеток, в данных обстоятельствах не имеют значения.
Другой способ индукции иммунного ответа может сопровождаться составлением VLPs изобретения с «иммуностимуляторами». Последние представляют собой собственные химические посредники организма (цитокины), повышающие ответ иммунной системы. Иммуностимуляторы включают, но не ограничиваются этим, различные цитокины, лимфокины и хемокины с иммуностимулирующей, иммунопонтециирующей и провоспалительной активностями, такие как интерлейкины (например, ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-12, ИЛ-13); факторы роста (например, колониестимулирующий фактор (CSF) гранулоцитов-макрофагов (GM); и другие иммуностимулирующие молекулы, такие как фактор воспаления макрофагов, лиганд Flt3, B7.1, B7.2 и т.д. Иммуностимулирующие молекулы можно вводить в том же составе, что и VLPs гриппа, или можно вводить отдельно. Для получения иммуностимулирующего эффекта можно вводить либо белок, либо экспрессионный вектор, кодирующий белок.
Способ стимуляции иммунного ответа против гриппа
VLPs изобретения пригодны для получения композиций, которые стимулируют иммунный ответ, обеспечивающий иммунитет или стойкий иммунитет к вирусам гриппа. В иммунитет к инфекции и заболеванию гриппом могут вносить вклад и слизистый, и клеточный иммунитет. Антитела, секретируемые местно в верхних дыхательных путях, служат главным фактором резистентности к природной инфекции. В защите верхних дыхательных путей участвует секретируемый иммуноглобулин A (sIgA), а в защите нижних дыхательных путей участвует сывороточный IgG. Индуцируемый инфекцией иммунный ответ защищает от повторной инфекции тем же вирусом или антигенно сходным вирусным штаммом. Вирус гриппа подвержен частым и непредсказуемым изменениям; поэтому после естественной инфекции эффективный период защиты, обеспечиваемый иммунитетом хозяина, может составлять лишь несколько лет в отношении штаммов вируса, циркулирующих в сообществе.
VLPs изобретения могут индуцировать стойкий иммунитет у позвоночного (например, человека) при введении указанному позвоночному. Стойкий иммунитет возникает в результате иммунного ответа против VLP гриппа изобретения, который защищает от инфекции гриппом, или улучшает защиту, или, по меньшей мере, подавляет симптомы инфекции вирусом гриппа у указанного позвоночного. В некоторых случаях при инфицировании указанного позвоночного указанная инфекция может протекать асимптоматично. Ответ может быть не полностью защитным ответом. В этом случае, если указанное позвоночное инфицировано вирусом гриппа, позвоночное должно страдать от подавленных симптомов или от симптомов на протяжении более короткого периода времени по сравнению с неиммунизированным позвоночным.
В одном осуществлении изобретение включает способ индукции стойкого иммунитета к инфекции вирусом гриппа или, по меньшей мере, одного ее симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP гриппа. В другом осуществлении указанная индукция стойкого иммунитета снижает продолжительность симптомов гриппа. В другом осуществлении способ индукции стойкого иммунитета к инфекции вирусом гриппа или, по меньшей мере, одного ее симптома у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP включает белки HA, NA и M1 гриппа. В другом осуществлении VLP гриппа включает белки гриппа, где указанные белки гриппа состоят из белков HA, NA и M1. Данные VLPs содержат HA, NA и M1 и могут содержать дополнительные клеточные компоненты, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительные белки гриппа (отличные от фрагментов M1, HA и/или NA). В другом осуществлении способ индукции стойкого иммунитета к инфекции вирусом гриппа или, по меньшей мере, одного ее симптома у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP состоит по существу из HA, NA и M1 гриппа. Указанные VLPs могут включать дополнительные белки гриппа и/или белковые загрязнения в незначительных концентрациях. В другом осуществлении способ индукции стойкого иммунитета к инфекции вирусом гриппа или, по меньшей мере, одного ее симптома у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP состоит из HA, NA и M1 гриппа. В другом осуществлении HA и/или NA проявляют гемагглютининовую активность и/или нейраминидазную активность соответственно. В другом осуществлении указанным субъектом является млекопитающее. В другом осуществлении указанным млекопитающим является человек. В еще одном осуществлении указанную VLP составляют с адъювантом или иммуностимулятором.
Недавно были предприняты совместные усилия для создания вакцины против птичьего гриппа, который потенциально способен создать пандемию. Это обусловлено тем, что ряд вирусов птичьего гриппа преодолел видовой барьер и прямо инфицирует человека, вызывая заболевание и в некоторых случаях смерть. Этими вирусами были H5N1, H9N2 и H7N7 (Cox et al., 2004). В недавнем исследовании была оценена возможность применения инактивированного вируса H5N1 в качестве вакцины. Состав вакцины был сходен с лицензированными инактивированными вакцинами, лицензируемыми в настоящее время для продажи. Исследование привело к заключению, что применение инактивированного вируса H5N1 не индуцирует иммунного ответа у человека, однако вводимая доза была очень высокой (90 мкг птичьего гриппа по сравнению с 15 мкг лицензированной вакцины) (Treanor et al., 2006). Такое большое количество антигена птичьего гриппа не применяется в кампании вакцинации во всем мире. Как показано ниже, VLPs изобретения индуцируют иммунный ответ у позвоночного при введении указанному позвоночному.
Таким образом, изобретение охватывает способ индукции стойкого иммунитета к инфекции вирусом гриппа или, по меньшей мере, одного ее симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP птичьего гриппа. В другом осуществлении указанная индукция стойкого иммунитета снижает продолжительность симптомов гриппа. В другом осуществлении указанная индукция иммунитета состоит во введении, по меньшей мере, 0,2 мкг птичьего HA в VLPs изобретения. В другом осуществлении указанная индукция иммунитета состоит во введении от приблизительно 0,2 мкг птичьего HA до приблизительно 15 мкг птичьего HA в VLPs изобретения. Введение может производиться в виде одной или более доз, но преимущественно может производиться в виде однократной дозы. В другом осуществлении птичий HA указанной VLP берет начало от птичьего гриппа H5N1.
В другом осуществлении изобретение включает способ индукции стойкого иммунитета к инфекции вирусом птичьего гриппа или, по меньшей мере, одного ее симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP птичьего гриппа, где указанная VLP включает HA, NA и M1 птичьего гриппа. В другом осуществлении указанная VLP птичьего гриппа включает белки птичьего гриппа, где указанные белки птичьего гриппа состоят из белков HA, NA и M1. Данные VLPs содержат HA, NA и M1 и могут содержать дополнительные клеточные компоненты, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительные белки гриппа (отличные от фрагментов M1, HA и/или NA). В другом осуществлении способ индукции стойкого иммунитета к инфекции вирусом птичьего гриппа или, по меньшей мере, одного ее симптома у субъекта, включает введение, по меньшей мере, одной эффективной дозы VLP птичьего гриппа, где указанная VLP состоит по существу из HA, NA и M1 птичьего гриппа. Указанные VLPs могут включать дополнительные белки гриппа и/или белковые загрязнения в незначительных концентрациях. В другом осуществлении способ индукции стойкого иммунитета к инфекции вирусом гриппа или, по меньшей мере, одного ее симптома у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP состоит из HA, NA и M1 птичьего гриппа. В другом осуществлении указанные HA и NA птичьего гриппа относятся к H5N1 соответственно. В другом осуществлении указанные HA и NA птичьего гриппа относятся к H9N2 соответственно. В другом осуществлении указанные HA и NA птичьего гриппа относятся к H7N7 соответственно. В другом осуществлении указанные HA и NA птичьего гриппа проявляют гемагглютининовую активность и/или нейраминидазную активность соответственно. В другом осуществлении указанный субъект представляет собой млекопитающее. В другом осуществлении указанное млекопитающее является человеком. В еще одном осуществлении указанная VLP составлена с адъювантом или иммуностимулятором.
В другом осуществлении указанные VLPs птичьего гриппа обычно индуцируют иммунный ответ у позвоночного, который возрастает приблизительно в 2 раза, приблизительно в 4 раза, приблизительно в 8 раз, приблизительно в 16 раз, приблизительно в 32 раза, приблизительно в 64 раза, приблизительно в 128 раз (или более) сильнее, чем при применении сходных антигенов птичьего гриппа, составленных сходно с лицензированными инактивированными вакцинами, лицензируемыми в настоящее время для продажи. Существующие составы включают вакцины цельного инактивированного вируса (например, инактивированного формальдегидом), расщепленного вируса (химически разрушенного) или субъединиц (очищенного гликопротеина). Способы определения эффективности вакцины известны и широко применяются в данной области техники. Например, для определения эффективности вакцины птичьей VLP по сравнению с антигенами птичьего гриппа, составленными сходно с лицензированными инактивированными вакцинами, лицензируемыми в настоящее время для продажи, могут быть проведены тесты микронейтрализации и тесты ингибирования гемагглютинации. В одном осуществлении указанное повышение эффективности реализуется при введении позвоночному приблизительно 0,2 мкг, приблизительно 0,4 мкг, приблизительно 0,6 мкг, приблизительно 0,8 мкг, приблизительно 1 мкг, приблизительно 2 мкг, приблизительно 3 мкг, приблизительно 4 мкг, приблизительно 5 мкг, приблизительно 6 мкг, приблизительно 7 мкг, приблизительно 9 мкг, приблизительно 10 мкг, приблизительно 15 мкг, приблизительно 20 мкг, приблизительно 25 мкг, приблизительно 30 мкг, приблизительно 35 мкг, 40 мкг, приблизительно 45 мкг, приблизительно 50 мкг или более VLPs и антигена, составленного сходно с инактивированными вакцинами, лицензируемыми в настоящее время для продажи (т.е. эквивалентных количеств HA и/или NA в VLP и HA и/или NA, составленных сходно с лицензированными инактивированными вакцинами, и/или другого антигена). Количество может быть измерено в соответствии с содержанием HA. Например, 1 мкг VLP изобретения представляет собой приблизительно 1 мкг HA в растворе VLPs, включающих HA, или может быть измерено по массе VLPs.
Сезонные вакцины гриппа вводят людям ежегодно для снижения количества случаев гриппа каждый год. В настоящее время имеются два подтипа гриппа A и грипп B, циркулирующие в Соединенных Штатах. Поэтому существующие вакцины являются трехвалентными для обеспечения защиты от циркулирующих в настоящее время штаммов. Ежегодно отдельный штамм или вариация вируса гриппа изменяется. Поэтому почти во все годы производят и вводят новую композицию вакцины. Инактивированные вакцины производят размножением вируса в яйцах с эмбрионами кур. Собирают жидкость аллантоиса, вирус концентрируют и очищают и затем инактивируют. Таким образом, существующие лицензированные вакцины вируса гриппа могут содержать следовые количества остаточных белков яйца, и, следовательно, их не следует вводить лицам с анафилактической гиперчувствительностью к яйцам. Кроме того, должно быть организовано снабжение яйцами, а штаммы для получения вакцины должны отбираться за месяцы до следующего сезона гриппа, что ограничивает гибкость данного подхода и часто приводит к задержкам и дефициту в получении и распространении. Кроме того, некоторые штаммы гриппа плохо реплицируются в яйцах с эмбрионами кур, что может ограничивать штаммы гриппа, которые можно выращивать и составлять в вакцины.
Как отмечалось выше, для получения VLP изобретения не требуется яиц. Эти VLPs получают с помощью системы клеточной культуры. Таким образом, изобретение охватывает способ индукции стойкого иммунитета к инфекции вируса гриппа или, по меньшей мере, одного ее симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы сезонной VLP гриппа. Как обсуждалось выше, термин сезонный вирус гриппа относится к штаммам вируса гриппа, для которых было выявлено прохождение через популяцию людей в данный сезон гриппа по данным эпидемиологических обследований Национальных центров гриппа во всем мире. Указанные исследования и некоторые выделенные вирусы гриппа присылаются для детального изучения в одну из четырех поверочных лабораторий Всемирной организации здравоохранения (ВОЗ), одна из которых располагается в Центрах контроля и профилактики болезней (CDC) в Атланте. В этих лабораториях проверяется, насколько хорошо антитела, полученные против существующей вакцины, взаимодействуют с циркулирующим вирусом и новыми вирусами гриппа. Эта информация, наряду с информацией об активности гриппа, обобщается и представляется наблюдательному комитету Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США и заседанию ВОЗ. На этих заседаниях производится отбор трех вирусов (двух подтипов вируса A и одного вируса B) для вакцин наступающих осени и зимы. Отбор производится в феврале для северного полушария и в сентябре для южного полушария. Обычно один или два из трех вирусных штаммов изменяются каждый год. В другом осуществлении указанная индукция стойкого иммунитета снижает продолжительность симптомов гриппа.
В другом осуществлении изобретение включает способ индукции стойкого иммунитета к сезонной инфекции вируса гриппа или, по меньшей мере, одного ее симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы сезонной VLP гриппа, где указанная VLP включает сезонные HA, NA и M1 гриппа. В другом осуществлении указанная сезонная VLP гриппа включает сезонные белки гриппа, где указанные белки гриппа состоят из белков HA, NA и M1. Данные VLPs содержат HA, NA и M1 и могут содержать дополнительные клеточные компоненты, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительные белки гриппа (отличные от фрагментов M1, HA и/или NA). В другом осуществлении указанный способ индукции стойкого иммунитета к сезонной инфекции вируса гриппа или, по меньшей мере, одного ее симптома у субъекта включает введение, по меньшей мере, одной эффективной дозы сезонной VLP гриппа, где указанная VLP состоит по существу из сезонных HA, NA и M1 гриппа. Указанные VLPs могут включать дополнительные белки гриппа и/или белковые загрязнения в незначительных концентрациях. В другом осуществлении способ индукции стойкого иммунитета к инфекции вируса гриппа или, по меньшей мере, одного ее симптома у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP состоит из сезонных HA, NA и M1 гриппа. В другом осуществлении указанные HA и/или NA птичьего гриппа проявляют гемагглютининовую активность и/или нейраминидазную активность соответственно. В другом осуществлении указанный субъект является млекопитающим. В другом осуществлении указанное млекопитающее является человеком. В другом осуществлении указанную VLP составляют с адъювантом или иммуностимулятором.
Обычно сезонные VLPs гриппа изобретения вводят в количестве, достаточном для стимуляции стойкого иммунитета в отношении одного или более штаммов сезонного вируса гриппа. В одном осуществлении VLPs смешивают с другими VLPs, включающими белки разных подтипов гриппа (перечисленных выше). В другом осуществлении состав представляет собой трехвалентный состав, который включает смесь VLPs с сезонными белками HA и/или NA гриппа из, по меньшей мере, двух подтипов гриппа A и/или, по меньшей мере, одного подтипа B. В другом осуществлении указанный подтип B получают тем же способом, что и описанный выше. В другом осуществлении многовалентный состав включает одну или более VLP изобретения, как описано выше.
В другом осуществлении VLPs изобретения (птичьи или сезонные VLPs) могут вызывать иммунный ответ, который должен обеспечивать защиту от более чем одного штамма вируса гриппа. Данная перекрестная защита позвоночного с помощью VLP гриппа, сконструированной из конкретного штамма конкретной подгруппы, может индуцировать перекрестную защиту от вируса гриппа различных штаммов и/или подгрупп. Представленные ниже примеры показывают, что VLPs изобретения способны индуцировать перекрестное взаимодействие с разными штаммами и/или подгруппами.
Гуморальная иммунная система вырабатывает антитела против различных антигенов гриппа, среди которых антитело, специфичное в отношении HA, является наиболее важным для нейтрализации вируса и тем самым предотвращения заболевания. Специфичные в отношении NA антитела менее эффективны в предотвращении инфекции, но они подавляют высвобождение вируса из инфицированных клеток. Слизистые ткани служат главными воротами для проникновения многих патогенов, включая грипп, и иммунная система слизистой обеспечивает первую линию защиты от инфекции, наряду с врожденным иммунитетом. SIgA и в определенной мере IgM являются основными нейтрализующими антителами, направленными против патогенов слизистой, предотвращающими вхождение патогенна, и могут действовать внутриклеточно, ингибируя репликацию вируса. Назальные секреты содержат нейтрализующие антитела, особенно в отношении HA и NA гриппа, которые преимущественно относятся к изотипу IgA и образуются местно. Во время первичной инфекции все три основные класса Ig (IgG, IgA и IgM), специфичные в отношении HA, могут быть выявлены с помощью связанного с ферментом иммуносорбентного анализа в назальных смывах, хотя IgA и IgM выявляются чаще, чем IgG. И IgA, и - в определенной мере - IgM активно секретируются местно, в то время как IgG имеет сывороточное происхождение. У субъектов с местным ответом IgA наблюдается также ответ IgA сыворотки. Местный ответ IgA, стимулированный естественной инфекцией, длится, по меньшей мере, 3-5 месяцев, и специфичные в отношении гриппа, коммитированные с IgA клетки памяти можно выявить локально. IgA также представляет собой преобладающий изотип Ig в местных секретах после вторичной инфекции, и ответ IgA выявляется в сыворотке после инфекции. Наличие местно продуцируемых нейтрализующих антител, индуцируемых живой вирусной вакциной, коррелирует с устойчивостью к инфекции и заболеванию после провоцирующего введения вируса дикого типа.
Устойчивость к инфекции гриппа или заболеванию коррелирует с уровнем местного и/или сывороточного антитела против HA и NA. Сывороточные антитела против HA служат наиболее часто измеряемым коррелятом защиты от гриппа (Cox et al., 1999). Ответ защитного сывороточного антитела (титр ингибирования гемагглютинации (HI) ≥40) может быть определен у приблизительно 80% субъектов после естественной инфекции гриппа. B-клетки, продуцирующие Ig всех трех основных классов, находятся в периферической крови здоровых субъектов (Cox et al., 1994) и индивидуумов, подвергшихся инфекции гриппа. У человека антитела сыворотки важны и для защиты от инфекции гриппа, и для выздоровления. Уровень сывороточного антитела против HA и NA у человека может коррелировать с устойчивостью к заболеванию после экспериментальной инфекции и естественной инфекции. Во время первичной инфекции Ig трех основных классов могут быть обнаружены в пределах 10-14 дней. Уровни IgA и IgM достигают пика через 2 недели, после чего начинают снижаться, тогда как уровень IgG достигает максимума через 4-6 недель. В то время, как IgG и IgM доминируют в первичном ответе, IgG и IgA преобладают во вторичном иммунном ответе.
Таким образом, изобретением охватывается способ индукции значительного защитного ответа антител на инфекцию вируса гриппа или, по меньшей мере, одного ее симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP гриппа. В другом осуществлении указанная индукция значительного защитного ответа антител снижает продолжительность симптомов гриппа. В другом осуществлении способ индукции значительного защитного ответа антител на инфекцию вируса гриппа или, по меньшей мере, одного ее симптома у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP включает белки гриппа HA, NA и M1.
В другом осуществлении изобретение включает способ индукции значительного защитного ответа антител на инфекцию вируса гриппа или, по меньшей мере, одного ее симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP состоит по существу из HA, NA и M1 гриппа. Указанные VLPs могут включать дополнительные белки гриппа и/или белковые загрязнения в незначительных концентрациях. В другом осуществлении указанная VLP гриппа включает белки гриппа, где указанные белки гриппа состоят из белков HA, NA и M1. Эти VLPs содержат HA, NA и M1 и могут содержать дополнительные клеточные компоненты, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительные белки гриппа (отличные от фрагментов M1, HA и/или NA). В другом осуществлении способ индукции стойкого иммунитета к инфекции вируса гриппа или, по меньшей мере, одного ее симптома у субъекта включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP состоит из HA, NA и M1 гриппа. В другом осуществлении указанные HA, NA и M1 гриппа берут начало от сезонного гриппа и/или птичьего гриппа. В другом осуществлении указанные HA и/или NA проявляют гемагглютининовую активность и/или нейраминидазную активность соответственно. В другом осуществлении указанным субъектом является млекопитающее. В другом осуществлении указанным млекопитающим является человек. В еще одном осуществлении указанную VLP составляют с адъювантом или иммуностимулятором.
Используемый здесь термин «антитело» обозначает белок, включающий один или более полипептидов, в значительной мере или частично кодируемых генами иммуноглобулинов или фрагментами генов иммуноглобулинов. Выявленные гены иммуноглобулинов включают гены каппа, лямбда, альфа, гамма, дельта, эпсилон и мю константной области, а также огромное количество генов вариабельной области иммуноглобулинов. Легкие цепи классифицируются как каппа или лямбда. Тяжелые цепи классифицируются как гамма, мю, альфа, дельта или эпсилон, которые в свою очередь определяют классы иммуноглобулинов IgG, IgM, IgA, IgD и IgE, соответственно. Типичная иммуноглобулиновая (антительная) структурная единица включает тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, причем каждая пара содержит одну «легкую» (приблизительно 25 кДа) и одну «тяжелую» цепь (приблизительно 50-70 кДа). N-конец каждой цепи определяет вариабельную область из от приблизительно 100 до 110 или более аминокислот, являющейся главной детерминантой узнавания антигена. Антитела существуют в виде интактных иммуноглобулинов или в виде ряда хорошо охарактеризованных фрагментов, получаемых гидролизом с помощью различных пептидаз.
Клеточный иммунитет также важен для излечения от инфекции гриппа и может предотвращать связанные с гриппом осложнения. Специфичные в отношении гриппа лимфоциты были обнаружены в крови и секретах нижних дыхательных путей инфицированных субъектов. Цитолиз инфицированных гриппом клеток опосредуется CTLs вместе со специфичными в отношении гриппа антителами и комплементом. Первичный цитотоксичный ответ выявляется в крови через 6-14 дней и исчезает к 21 дню у инфицированных или вакцинированных индивидуумов (Ennis et al., 1981). Специфичные в отношении гриппа CTLs проявляют перекрестную специфичность в культурах in vitro; так, они лизируют клетки, инфицированные тем же типом гриппа, но не другими типами (например, вирусом гриппа A, но не вирусом гриппа B). Были выделены CTLs, которые узнают внутренние негликозилированные белки, M, NP и PB2 (Fleischer et al., 1985). Ответ CTL является перекрестным для штаммов вируса A (Gerhard et al., 2001) и важен для сведения распространения вируса до минимума в сочетании с антителом (Nguyen et al., 2001).
Клеточный иммунитет также важен для излечения от инфекции гриппа и может предотвращать связанные с гриппом осложнения. Специфичные в отношении гриппа лимфоциты были обнаружены в крови и секретах нижних дыхательных путей инфицированных субъектов. Цитолиз инфицированных гриппом клеток опосредуется CTLs вместе со специфичными в отношении гриппа антителами и комплементом. Первичный цитотоксичный ответ выявляется в крови через 6-14 дней и исчезает к 21 дню у инфицированных или вакцинированных индивидуумов (Ennis et al., 1981). Специфичные в отношении гриппа CTLs проявляют перекрестную специфичность в культурах in vitro; так, они лизируют клетки, инфицированные тем же типом гриппа, но не другими типами (например, вирусом гриппа A, но не вирусом гриппа B). Были выделены CTLs, которые узнают внутренние негликозилированные белки, M, NP и PB2 (Fleischer et al., 1985). Ответ CTL является перекрестным для штаммов вируса A (Gerhard et al., 2001) и важен для сведения распространения вируса до минимума в сочетании с антителом (Nguyen et al., 2001).
Таким образом, изобретение охватывает способ индукции значительного защитного клеточного иммунного ответа на инфекцию вируса гриппа или, по меньшей мере, одного ее симптома у субъекта, включающий введение, по меньшей мере, одной эффективной дозы VLP гриппа. В другом осуществлении способ индукции стойкого иммунитета к инфекции вируса гриппа или, по меньшей мере, одного ее симптома у субъекта, включает введение, по меньшей мере, одной эффективной дозы VLP гриппа, где указанная VLP состоит из HA, NA и M1 гриппа. В другом осуществлении указанная VLP гриппа включает белки гриппа, где указанные белки гриппа состоят из белков HA, NA и M1. Данные VLPs содержат HA, NA и M1 и могут содержать дополнительные клеточные компоненты, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительные белки гриппа (отличные от фрагментов M1, HA и/или NA). В другом осуществлении указанные HA, NA и M1 гриппа берут начало от сезонного и/или птичьего вируса гриппа. В другом осуществлении указанные HA и/или NA проявляют гемагглютининовую активность и/или нейраминидазную активность соответственно. В другом осуществлении указанным субъектом является млекопитающее. В другом осуществлении указанным млекопитающим является человек. В еще одном осуществлении указанную VLP составляют с адъювантом или иммуностимулятором.
Как упоминалось выше, VLPs изобретения (например, птичьего и/или сезонного гриппа) предотвращают или снижают, по меньшей мере, один симптом инфекции гриппа у субъекта. Симптомы гриппа хорошо известны в данной области техники. Они включают лихорадку, миалгию, головную боль, тяжелое недомогание, непродуктивный кашель, фарингит, потерю массы и ринит. Таким образом, способ изобретения включает предотвращение или снижение, по меньшей мере, одного симптома, связанного с инфекцией вируса гриппа. Снижение симптома может быть определено субъективно или объективно, например самооценкой субъекта, оценкой врача или проведением подходящего теста или измерения (например, температуры тела), включая, например, оценку качества жизни, замедление развития инфекции гриппа или дополнительных симптомов, снижение тяжести симптомов гриппа или подходящие тесты (например, титр антител и/или тест активации T-клеток). Объективная оценка включает оценку и животного, и человека.
Основной стратегией, поддерживаемой Наблюдательным комитетом по практике иммунизации (ACIP), в контроле гриппа служила вакцинация лиц с риском серьезных осложнений гриппа, в частности людей старше 65 лет. Ежегодные эпидемии гриппа, однако, не ослабевают и являются значительным бременем для здоровья и финансов общества (Glaser et al., 1996). За последние 20 лет (1976-1999) произошел значительный рост связанной с гриппом смертности по всем причинам. С 1990 по 1999 ежегодное количество смертей, связанных с гриппом по всем причинам, превысило 50000 (Thompson et al., 2003). Несмотря на увеличение охвата вакциной людей ≥65 лет до 65% за последнее десятилетие, соответствующего снижения связанной с гриппом смертности по всем причинам не наблюдалось.
Таким образом, другой стратегией профилактики и контролирования гриппа является всеобщая вакцинация здоровых детей и индивидуумов. У детей имеется высокая степень инфекции, требующей медицинского вмешательства заболеваемости и госпитализации из-за гриппа (Neuzil et al., 2000). Дети играют важную роль в распространении гриппа в школах, семьях и сообществах. Вакцинирование существующими вакцинами гриппа приблизительно 80% школьников в сообществе снизило респираторные заболевания у взрослых и избыточную смертность у пожилых (Reichert et al., 2001). Эта концепция известна как иммунитет сообщества или «иммунитет населения» и, как считается, играет важную роль в защите сообщества от болезни. Поскольку у вакцинированных людей имеются антитела, которые нейтрализуют вирус гриппа, имеется гораздо меньшая вероятность того, что они передают вирус другим людям. Таким образом, даже невакцинированные люди (и люди, вакцинация которых ослабла или чьи вакцины не являются полностью эффективными) часто могут быть защищены иммунитетом населения благодаря тому, что окружающие их вакцинированные люди не заболевают. Эффективность иммунитета населения растет с увеличением процента вакцинированных людей. Полагают, что для достижения иммунитета населения приблизительно 95% людей в сообществе должны быть защищены вакциной. Неиммунизированные люди увеличивают вероятность того, что они или другие люди заболеют.
Таким образом, изобретение охватывает способ индукции стойкого защитного иммунитета к инфекции вируса гриппа в популяции или сообществе для снижения случаев инфекции вируса гриппа у индивидуумов с ослабленным иммунитетом или невакцинированных индивидуумов путем введения VLPs изобретения популяции в сообществе. В одном осуществлении большинство детей школьного возраста иммунизируют против вируса гриппа введением VLPs изобретения. В другом осуществлении большинство здоровых индивидуумов в сообществе иммунизируют против вируса гриппа введением VLPs изобретения. В другом осуществлении VLPs изобретения составляют часть стратегии «динамической вакцинации». Динамическая вакцинация представляет собой постоянное получение низкоэффективной вакцины, которая связана с появляющимся пандемическим штаммом, но которая из-за антигенного дрейфа не способна обеспечить полную защиту у млекопитающего (см. Germann et al., 2006). Из-за неопределенности относительно будущей идентичности пандемического штамма практически невозможно запастись хорошо соответствующим пандемическим штаммом. Однако вакцинация плохо соответствующей, но потенциально эффективной вакциной может замедлить распространение пандемического вируса и/или снизить тяжесть симптомов пандемического штамма вируса гриппа.
Изобретением также охватывается вакцина, включающая VLP гриппа, где указанная вакцина индуцирует стойкий иммунитет к инфекции вируса гриппа или, по меньшей мере, одного из ее симптомов при введении субъекту. В другом осуществлении указанная индукция стойкого иммунитета снижает продолжительность симптомов гриппа. В другом осуществлении указанная вакцина, индуцирующая стойкий иммунитет к инфекции вируса гриппа или, по меньшей мере, одного из ее симптомов у субъекта, включает VLP, которая включает белки HA, NA и M1 гриппа. В другом осуществлении указанная вакцина, индуцирующая стойкий иммунитет к инфекции вируса гриппа или, по меньшей мере, одного из ее симптомов у субъекта, включает VLP, которая состоит по существу из белков HA, NA и M1 гриппа. Указанные VLPs могут включать дополнительные белки гриппа и/или белковые загрязнения в незначительных концентрациях. В другом осуществлении указанная вакцина, индуцирующая стойкий иммунитет к инфекции вируса гриппа или, по меньшей мере, одного из ее симптомов у субъекта, включает VLP, которая состоит из белков HA, NA и M1 гриппа. В другом осуществлении указанная вакцина, индуцирующая стойкий иммунитет к инфекции вируса гриппа или, по меньшей мере, одного из ее симптомов у субъекта, включает VLP, включающую белки гриппа, где указанные белки гриппа состоят из белков HA, NA и M1. Эти VLPs содержат HA, NA и M1 и могут содержать дополнительные клеточные компоненты, такие как клеточные белки, бакуловирусные белки, липиды, углеводы и т.д., но не содержат дополнительные белки гриппа (отличные от фрагментов M1, HA и/или NA). В другом осуществлении указанные белки HA, NA и M1 гриппа берут начало от птичьего и/или сезонного вируса гриппа. В другом осуществлении HA и/или NA проявляют гемагглютининовую активность и/или нейраминидазную активность соответственно. В другом осуществлении указанным субъектом является млекопитающее. В другом осуществлении указанным млекопитающим является человек. В еще одном осуществлении указанную VLP составляют с адъювантом или иммуностимулятором. В другом осуществлении указанную вакцину вводят млекопитающему. В еще одном осуществлении указанным млекопитающим является человек.
Данное изобретение дополнительно иллюстрируется следующими примерами, которые не следует толковать как ограничивающие. Содержимое всех ссылок, патентов и опубликованных патентных заявок, цитированных в настоящей заявке, а также фигуры и перечень последовательностей включены здесь в качестве ссылки.
ПРИМЕРЫ
Пример 1
Вещества и способы
Гены HA, NA и M1 вируса A/Hong Kong/1073/99 (H9N2) экспрессировали в клетках Spodoptera frugiperda (линия клеток Sf-9S; ATCC PTA-4047) с использованием бакуловирусной бакмидной экспрессионной системы. Гены HA, NA и M1 синтезировали обратной транскрипцией и полимеразной цепной реакцией (ПЦР) с использованием РНК, выделенной из вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2) (фиг. 1, 2 и 3). Для обратной транскрипции и ПЦР использовали олигонуклеотидные праймеры, специфичные для генов HA, NA и M1 вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2) (таблица 1). Копии кДНК этих генов исходно клонировали в бактериальный субклонирующий вектор, pCR2.1TOPO. Из полученных трех плазмид на основе pCR2.1TOPO гены HA, NA и M1 вставляли ниже AcMNPV полигедриновых промоторов в бакуловирусный переносящий вектор, pFastBac1 (InVitrogen), что дало три плазмиды на основе pFastBac1: pHA, pNA и pM1, экспрессирующие эти гены вируса гриппа, соответственно. Затем была сконструирована единая плазмида pHAM на основе pFastBac1, кодирующая гены и HA, и M1, каждый из которых расположен ниже отдельного полигедринового промотора (фиг. 4). Была определена нуклеотидная последовательность гена NA с прилегающими 5'- и 3'-областями в плазмиде pNA (SEQ ID NO: 1) (фиг. 1). Одновременно были также определены нуклеотидные последовательности генов HA и M1 с прилегающими областями с использованием плазмиды pHAM (SEQ ID NOS:2 и 3) (фиг. 2 и 3). Наконец, рестрикционный фрагмент ДНК из плазмиды pHAM, который кодирует обе экспрессионные кассеты HA и M1, клонировали в плазмиду pNA. Это дало плазмиду pNAHAM, кодирующую гены HA, NA и M1 вируса птичьего гриппа A/Hong Kong/1073/99 (H9N2) (фиг. 4).
Плазмиду pNAHAM использовали для конструирования рекомбинантного бакуловируса, содержащего интегрированные в геном гены HA, NA и M1 вируса гриппа, каждый из которых расположен ниже отдельного бакуловирусного полигедринового промотора. Инфекция пермиссивных клеток Sf-9S насекомого полученным рекомбинантным бакуловирусом приводила к совместной экспрессии этих трех генов гриппа в каждой клетке Sf-9S, инфицированной таким рекомбинантным бакуловирусом.
Продукты экспрессии инфицированных клеток Sf-9S характеризовали через 72 часа после инфекции (с помощью анализа ДДС-Na-ПАГЭ, окраска белка кумасси синим, и анализа вестерн-иммуноблоттингом с использованием антител, специфичных в отношении HA и M1 (фиг. 5). Анализ вестерн-иммуноблоттингом проводили с использованием кроличьего антитела, выработанного против вируса гриппа типа A/Hong Kong/1073/99 (H9N2) (CDC, Atlanta, Ga., США), или мышиного моноклонального антитела против белка Ml гриппа (Serotec, UK). Белки HA, NA и M1 ожидаемой молекулярной массы (64 кДа, 60 кДа и 31 кДа соответственно) были выявлены с помощью анализа вестерн-иммуноблоттингом. По сравнению с количеством белка HA, определяемым при данном анализе, белок NA проявлял меньшее взаимодействие с сывороткой кролика против вируса гриппа A/Hong Kong/1073/99 (H9N2). Объяснения количества определяемого белка NA включали более низкий уровень экспрессии белка NA в клетках Sf-9S, инфицированных рекомбинантным бакуловирусом, по сравнению с белком HA, более слабое взаимодействие NA с сывороткой в денатурирующих условиях пор анализе вестерн-иммуноблоттингом (из-за удаления важных эпитопов при гель-электрофорезе мембранного связывания), более низкую авидность NA-антитело по сравнению с HA-антитело или меньшую представленность NA-антител в сыворотке.
Культуральную среду от клеток Sf-9S, инфицированных рекомбинантным бакуловирусом, экспрессирующим белки HA, NA и M1 A/Hong Kong/1073/99 (H9N2), также зондировали на белки гриппа. Осветленные культуральные супернатанты подвергали ультрацентрифугированию при 27000 об/мин для концентрирования высокомолекулярных белковых комплексов вируса гриппа, таких как субвирусные частицы, VLP, комплексы VLP и, возможно, другие частицы самосборки, составленные из белков гриппа HA, NA и M1. Осажденные белковые продукты ресуспендировали в забуференном фосфатом солевом растворе (ЗФР, pH 7,2) и дополнительно очищали ультрацентрифугированием на прерывистых ступенчатых градиентах 20-60% сахарозы. Фракции из сахарозных градиентов собирали и анализировали с помощью ДДС-Na-ПАГЭ анализа, анализа вестерн-иммуноблоттингом и электронной микроскопии.
Белки HA и M1 гриппа ожидаемой молекулярной массы были выявлены в многочисленных фракциях градиента плотности сахарозы с помощью окраски кумасси синим и анализа вестерн-иммуноблоттингом (фиг. 6, таблица 1). Это позволило предположить, что белки вируса гриппа из инфицированных клеток Sf-9S агрегируют в высокомолекулярные комплексы, такие как капсомеры, субвирусные частицы, VLP и/или комплексы VLP. Белки NA, хотя и не постоянно, выявлялись с помощью окраски кумасси синим и анализа вестерн-иммуноблоттингом, что, вероятно, было обусловлено неспособностью антисыворотки кролика против гриппа распознавать денатурированный белок NA при анализе вестерн-иммуноблоттингом, но они постоянно выявлялись при анализе ферментативной нейраминидазной активности (фиг. 10).
**Отрицательный контроль
***Положительный контроль





Наличие высокомолекулярных VLPs было подтверждено хроматографией гель-фильтрацией. Аликвоту из фракций градиента плотности сахарозы, содержащую белки вируса гриппа, наносили на колонку сефарозы VL-4B для фракционирования по массе. Колонку калибровали декстраном синим 2000, декстраном желтым и витамином B12 (Amersham Pharmacia) с кажущимися молекулярными массами 2000000, 20000 и 1357 дальтон соответственно и определяли свободный объем колонки. Как и ожидалось, высокомолекулярные белки вируса гриппа двигались в свободном объеме колонки, что служило характерной чертой макромолекулярных белков, таких как вирусные частицы. Фракции анализировали с помощью анализа вестерн-иммуноблоттингом для определения белков гриппа и бакуловируса. Например, белки M1 выявлялись во фракциях свободного объема, которые также содержали бакуловирусные белки (фиг. 7).
Морфологию VLPs и белков гриппа во фракциях градиента сахарозы выясняли с помощью электронной микроскопии. Для негативно окрашиваемой электронной микроскопии белки гриппа из двух фракций градиента плотности сахарозы фиксировали 2% глутаральдегидом в ЗФР, pH 7,2. Электронно-микроскопическое обследование негативно окрашенных образцов выявило наличие макромолекулярных белковых комплексов или VLPs в обеих фракциях. Эти VLPs имели разные размеры, включая диаметры приблизительно 60 и 80 нм, и морфологию (сферы). Были выявлены более крупные комплексы частиц обоего типа, а также частицы в форме палочек (фиг. 8). Все наблюдавшиеся макромолекулярные структуры имели выступы (пепломеры) на своей поверхности, что характерно для вирусов гриппа. Поскольку размер и вид частиц 80 нм были сходны с частицами вируса гриппа дикого типа, эти структуры, видимо, представляют собой VLPs, которые имеют отдельные черты сходства с частицами вируса гриппа дикого типа, включая сходство геометрии частиц, архитектуры, триангуляционного числа, симметрии и других свойств. Меньшие частицы приблизительно 60 нм могут представлять собой субвирусные частицы, которые отличаются от VLPs и морфологически, и структурно. Сходный феномен рекомбинантных макромолекулярных белков разного размера и морфологии сообщался также для других вирусов. Например, рекомбинантный антиген основы (HBcAg) вируса гепатита B образует частицы разного размера, которые имеют разную архитектуру и триангуляционное число T=4 и T=3 соответственно (Crowther et al., 1994).
Для характеристики функциональных свойств очищенных образцов VLPs A/Hong Kong/1073/99 (H9N2) образцы тестировали анализом гемагглютинации (фиг. 9) и анализом ферментативной нейраминидазной активности (фиг. 10). Для анализа гемагглютинации 2-кратные разведения очищенных VLPs гриппа смешивали с 0,6% эритроцитами морской свинки и инкубировали при 4°С в течение 1 час или 16 час. Степень гемагглютинации оценивали визуально и определяли и фиксировали наибольшее разведение рекомбинантных белков гриппа, способное к агглютинации эритроцитов (фиг. 9). И вновь, многие фракции градиента плотности сахарозы проявляли гемагглютинирующую активность, что позволяет предполагать наличие множественных макромолекулярных и мономерных форм белков гриппа. Наибольший измеренный титр составлял 1:4000. В контрольном эксперименте вирус гриппа дикого типа A/Shangdong проявлял титр 1:2000. Тест гемагглютинации показал, что рекомбинантные VLPs, состоящие из белков HA, NA и M1 вируса A/Hong Kong/1073/99 (H9N2), являются функционально активными. Это позволяет предполагать, что сборка, конформация и укладка белковых субъединиц HA в VLPs сходны или идентичны таковым в вирусе гриппа дикого типа.
Кроме того, был произведен анализ фермента нейраминидазы в образцах очищенных VLPs H9N2. Величину нейраминидазной активности во фракциях градиента плотности сахарозы определяли с применением фетуина в качестве субстрата. В нейраминидазном тесте для измерения используется высвобождаемая сиаловая кислота, отщепляемая от молекул субстрата нейраминидазой. Для остановки ферментативной реакции использовали арсенитный реагент. Количество высвобожденной сиаловой кислоты определяли химически с помощью тиобарбитуровой кислоты, которая дает розовую окраску, пропорциональную количеству свободной сиаловой кислоты. Уровень окраски (хромофора) измеряли спектрофотометрически при длине волны 549 нм. С помощью этого способа была показана нейраминидазная активность во фракциях сахарозного градиента, содержащих VLPs гриппа (фиг. 10). Как и ожидалось, активность наблюдалась в нескольких фракциях с пиками в двух фракциях. В качестве положительного контроля использовали вирус гриппа дикого типа. Вирус гриппа дикого типа проявлял нейраминидазную ферментативную активность, сопоставимую с таковой очищенных VLPs гриппа. Эти данные подтвердили результаты с HA в отношении конформации белка и позволили предположить, что очищенные VLPs вируса гриппа A/Hong Kong/1073/99 (H9N2) функционально сходны с вирусом гриппа дикого типа.
Результаты приведенных выше анализов и тестов показали, что экспрессия белков HA, NA и M1 гриппа A/Hong Kong/1073/99 (H9N2) достаточна для самосборки и транспорта VLPs из инфицированных бакуловирусом клеток насекомого. Поскольку эти VLPs гриппа представляли собой самособираемые структурные белки гриппа и проявляли функциональные и биохимические свойства, сходные с таковыми вируса гриппа дикого типа, эти VLPs гриппа сохраняли важные элементы конформации структуры, включая поверхностные эпитопы, требующиеся для эффективных вакцин гриппа.
Пример 2
ОТ-ПЦР Клонирование генов вируса птичьего гриппа A/Hong Kong/1073/99
Целью настоящего изобретения служит предложение синтетических последовательностей нуклеиновых кислот, способных направлять получение рекомбинантных белков вируса гриппа. Такие синтетические последовательности нуклеиновых кислот были получены с помощью способов обратной транскрипции и полимеразной цепной реакции (ПЦР) с применением природной геномной РНК вируса гриппа, выделенной из вируса. В контексте данной заявки последовательность нуклеиновой кислоты относится к РНК, ДНК, кДНК или любому их синтетическому варианту, которые кодируют белок.
Вирус птичьего гриппа A/Hong Kong/1073/99 (H9N2) был предоставлен д-ром K. Subbarao (Centers for Disease Control, Atlanta, Ga., США). Вирусную геномную РНК выделяли способом кислой фенольной экстракции РНК в условиях требований биологической безопасности 3 уровня (BSL3) CDC с использованием реагента тризола LS (Invitrogen, Carlsbad, Calif. США). Молекулы кДНК вирусных мРНК получали обратной транскрипцией с использованием обратной транскриптазы MuLV (InVitrogen) и ПЦР с использованием олигонуклеотидных праймеров, специфичных для белков HA, NA и M1, и ДНК-полимеразы Taq I (InVitrogen) (таблица 1). Фрагменты ПЦР клонировали в бактериальный субклонирующий вектор pCR2.1TOPO (InVitrogen) между сайтами EcoRI, что дало три рекомбинантные плазмиды, содержащие клоны кДНК HA, NA и M1.
Пример 3
ОТ-ПЦР Клонирование генов вируса гриппа человека A/Sydney/5/94 (H3N2)
Вирус гриппа A/Sydney/5/97 (H3N2) был получен от д-ра M. Massare (Novavax, Inc., Rockville, Md.). Вирусную геномную РНК выделяли способом кислой фенольной экстракции РНК в условиях требований BSL2 в Novavax, Inc. с использованием реагента тризола LS (Invitrogen). Молекулы кДНК вирусных мРНК получали обратной транскрипцией и ПЦР с использованием олигонуклеотидных праймеров, специфичных для белков HA, NA, M1, M2 и NP (таблица 1). Фрагменты ПЦР клонировали в бактериальный субклонирующий вектор pCR2.1TOPO (InVitrogen) между сайтами EcoRI, что дало пять рекомбинантных плазмид, содержащих клоны кДНК HA, NA, M1, M2 и NP.
Пример 4
Клонирование кДНК вируса птичьего гриппа A/Hong Kong/1073/99 в бакуловирусные переносящие векторы
Из плазмид на основе pCR2.1TOPO гены HA, NA и M1 субклонировали в бакуловирусный переносящий вектор pFastBac1 (InVitrogen) в полигедронном локусе и сайтах присоединения Tn7 и ниже бакуловирусного полигедринового промотора и выше последовательности сигнала полиаденилирования. Вирусные гены лигировали с помощью T4 ДНК-лигазы. Для гена HA фрагмент ДНК BamHI-KpnI из pCR2.1TOPO-HA вставляли в плазмидную ДНК pFastBac1, гидролизованную BamHI-KpnI. Для гена NA фрагмент ДНК EcoRI из pCR2.1TOPO-NA вставляли в плазмидную ДНК pFastBac1, гидролизованную EcoRI. Для гена M1 фрагмент ДНК EcoRI из pCR2.1TOPO-M1 вставляли в плазмидную ДНК pFastBac1, гидролизованную EcoRI. Компетентные бактерии E. coli DH5α (InVitrogen) трансформировали с помощью этих реакций лигирования ДНК, получали трансформированные колонии и бактериальные клоны выделяли. Полученные плазмиды на основе pFastBac1, pFastBac1-HA, pFastBac1-NA и pFastBac1-M1, характеризовали картированием ферментами рестрикции на агарозных гелях (фиг. 4A). Нуклеотидные последовательности клонированных генов, представленные на фиг. 1-3, определяли с помощью автоматизированного секвенирования ДНК. Анализ последовательности ДНК показал, что клонированные гены гриппа HA, NA и M1 идентичны последовательностям этих генов, опубликованным ранее [гены HA, NA и M1 гриппа A/Hong Kong/1073/99 (H9N2) (номера регистрации GenBank AJ404629, AJ404626 и AJ278646 соответственно)].
Пример 5
Клонирование кДНК вируса гриппа A/Sydney/5/97 в бакуловирусные переносящие векторы
Из плазмид на основе pCR2.1TOPO гены HA, NA, M1, M2 и NP субклонировали в бакуловирусный переносящий вектор pFastBac1 в полигедронном локусе и сайтах присоединения Tn7 и ниже бакуловирусного полигедринового промотора и выше последовательности сигнала полиаденилирования. Вирусные гены лигировали с помощью T4 ДНК-лигазы. Для гена HA фрагмент ДНК BamHI-KpnI из pCR2.1TOPO-hHA3 вставляли в плазмидную ДНК pFastBac1, гидролизованную BamHI-KpnI. Для гена NA фрагмент ДНК EcoRI из pCR2.1TOPO-hNA вставляли в плазмидную ДНК pFastBac1, гидролизованную EcoRI. Для гена M1 фрагмент ДНК EcoRI из pCR2.1TOPO-hM1 вставляли в плазмидную ДНК pFastBac1, гидролизованную EcoRI. Для гена M2 фрагмент ДНК EcoRI из pCR2.1TOPO-hM2 вставляли в плазмидную ДНК pFastBac1, гидролизованную EcoRI. Для гена NP фрагмент ДНК EcoRI из pCR2.1TOPO-hNP вставляли в плазмидную ДНК pFastBac1, гидролизованную EcoRI. Компетентные бактерии E. coli DH5α трансформировали с помощью этих реакций лигирования ДНК, получали трансформированные колонии и бактериальные клоны выделяли. Полученные плазмиды на основе pFastBac1, pFastBac1-hHA3, pFastBac1-hNA2, pFastBac1-hM1, pFastBac1-hM2 и pFastBac1-hNP характеризовали картированием ферментами рестрикции на агарозных гелях. Нуклеотидные последовательности клонированных генов определяли с помощью автоматизированного секвенирования ДНК. Анализ последовательности ДНК показал, что клонированные гены гриппа HA, NA, M1, M2 и NP идентичны последовательностям этих генов, опубликованным ранее.
Пример 6
Клонирование мультигенных бакуловирусных переносящих векторов, кодирующих множественные гены вируса птичьего гриппа A/Hong Kong/1073/99
Для конструирования бакмидных переносящих векторов на основе pFastBac1, экспрессирующих множество генов вируса гриппа A/Hong Kong/1073/99 (H9N2), сначала фрагмент ДНК SnaBI-HpaI из плазмиды pFastBac1-M1, содержащей ген M1, клонировали в сайт HpAI pFastBac1-HA. Это дало плазмиду pFastBac1-HAM, кодирующую гены и HA, и M1 в независимых экспрессионных кассетах и экспрессируемых под контролем отдельных полигедриновых промоторов.
Наконец, фрагмент ДНК SnaBI-AvrII из pFastBac1-HAM, содержащий экспрессионные кассеты HA и M1, переносили в плазмидную ДНК pFastBac1-NA, гидролизованную HpaI-AvrII. Это дало плазмиду pFastBac1-NAHAM, кодирующую три независимые экспрессионные кассеты для экспрессии генов гриппа HA, NA и M1 и экспрессируемых под контролем отдельных полигедриновых промоторов (фиг. 4B).
В другом примере ген H3 из pFastBac1-hHA3 (см. пример 5) клонировали в pFastBac1-NAHAM в качестве четвертого гена вируса гриппа для экспрессии и получения гетеротипичных VLPs гриппа.
Пример 7
Получение мультигенного рекомбинантного бакуловируса, кодирующего гены HA, NA и M1 вируса птичьего гриппа A/Hong Kong/1073/99 в клетках насекомого
Полученный мультигенный бакмидный переносящий вектор pFastBac1-NAHAM использовали для получения мультигенного рекомбинантного бакуловируса, кодирующего гены HA, NA и M1 птичьего гриппа A/Hong Kong/1073/99 (H9N2), для экспрессии в клетках насекомого. Рекомбинантные бакмидные ДНК получали сайт-специфичной рекомбинацией на последовательностях ДНК присоединения полигедрина и Tn7 между ДНК pFastBac1-NAHAM и AcMNPC бакуловирусного генома, укрывшегося в компетентных клетках E. coli DH10BAC (InVitrogen) (фиг. 4B). Рекомбинантную бакмидную ДНК выделяли мини-препаративным способом для плазмидной ДНК и трансфецировали в клетки Sf-9s с помощью катионного липида CELLFECTIN (InVitrogen). После трансфекции рекомбинантные бакуловирусы выделяли, бляшки очищали и амплифицировали в клетках Sf-9S насекомого. Запасы вируса получали в клетках Sf-9S насекомого и характеризовали на предмет экспрессии продуктов генов HA, NA и M1 вируса птичьего гриппа. Полученный Рекомбинантный бакуловирус был обозначен как bNAHAM-H9N2.
Пример 8
Экспрессия рекомбинантных белков птичьего гриппа A/Hong Kong/1073/99 в клетках насекомого
Клетки Sf-9S насекомого, поддерживаемые в виде суспензионных культур во встряхиваемых сосудах при 28°С в бессывороточной среде (HyQ SFM, HyClone, Ogden, Utah), инфицировали при плотности клеток 2×106 клеток/мл рекомбинантным бакуловирусом bNAHAM-H9N2 при кратности инфекции (MOI) 3 pfu (фаг-образующие единицы)/клетку. Вирусная инфекция продолжалась 72 час для обеспечения экспрессии белков гриппа. Экспрессия белков HA и M1 птичьего гриппа A/Hong Kong/1073/99 (H9N2) в инфицированных клетках насекомого была подтверждена с помощью анализов ДДС-ПАГЭ и вестерн-иммуноблоттинга. Анализ ДДС-ПАГЭ проводили на гелях NuPAGE (Invitrogen) c 4-12% линейным градиентом в восстанавливающих и денатурирующих условиях. Первичными антителами при анализе вестерн-иммуноблоттингом служила поликлональная антисыворотка кролика против птичьего гриппа A/Hong Kong/1073/99 (H9N2), полученная из CDC, и моноклональная мышиная антисыворотка против белка M1 гриппа (Serotec, UK). Вторичным антителом для анализа вестерн-иммуноблоттингом служила щелочная фосфатаза, конъюгированная с IgG антисыворотки козы, полученной против IgG мыши (H+L) (Kirkegaard and Perry Laboratories, Gaithersburg, Md., США). Результаты этих анализов (фиг. 5) показали, что белки HA и M1 экспрессируются в инфицированных бакуловирусом клетках насекомого.
Пример 9
Очистка рекомбинантных вирусоподобных частиц птичьего гриппа H9N2 и макромолекулярных белковых комплексов
Культуральные супернатанты (200 мл) из клеток Sf-9S насекомого, инфицированных рекомбинантным бакуловирусом bNAHAM-H9N2, которые экспрессируют продукты генов HA, NA и M1 птичьего гриппа A/Hong Kong/1073/99 (H9N2), собирали низкоскоростным центрифугированием. Культуральные супернатанты осветляли центрифугированием на высокоскоростной центрифуге Sorval RC-5B в течение 1 час при 10000g и 4°С с использованием ротора GS-3. Вирус и VLPs выделяли из осветленных культуральных супернатантов центрифугированием на ультрацентрифуге Sorval OTD-65 в течение 3 час при 27000 об/мин при 4°С с использованием качающегося бакет-ротора Sorval TH-641. Вирусный осадок ресуспендировали в 1 мл ЗФР (pH 7,2), наносили на ступенчатый прерывистый 20-60% (масс./об.) градиент сахарозы и разделяли центрифугированием на ультрацентрифуге Sorval OTD-65 в течение 16 час при 27000 об/мин при 4°С с использованием Sorval TH-641. Фракции (0,5 мл) собирали с верха градиента сахарозы.
Белки гриппа во фракциях градиента сахарозы анализировали с помощью анализов ДДС-ПАГЭ и вестерн-иммуноблоттинга, как описано выше в примере 6. Белки HA и M1 были обнаружены в одних и тех же фракциях градиента сахарозы (фиг. 6), как показано с помощью анализа вестерн-иммуноблоттингом, что позволило предположить, что белки HA и M1 связаны в виде макромолекулярных белковых комплексов. Кроме того, белки HA и M1 были обнаружены во фракциях вдоль всего градиента сахарозы, что позволяет предполагать, что эти рекомбинантные вирусные белки связаны с макромолекулярными белковыми комплексами различной плотности и состава.
Пример 10
Анализ рекомбинантных VLPs и белков птичьего гриппа H9N2 хроматографией гель-фильтрацией
Белковые макромолекулы, такие как VLPs, и мономерные белки движутся по-разному на хроматографических колонках при гель-фильтрации или исключении по размеру на основании размера массы и формы. Для определения того, являлись ли рекомбинантные белки гриппа из фракций градиента сахарозы мономерными белками или макромолекулярными белковыми комплексами, такими как VLPs, готовили хроматографическую колонку (7×140 мм) с заполненным смолой объемом 14 мл, сефарозой CL-4B (Amersham). Исключающий объем колонки уравновешивали ЗФР и колонку калибровали декстраном синим 2000, декстраном желтым и витамином B12 (Amersham Pharmacia) с кажущимися молекулярными массами 2000000, 20000 и 1357 дальтон соответственно для определения свободного объема колонки. Декстран синий 2000 элюировался с колонки также в свободном объеме (фракция 6 мл). Как и ожидалось, рекомбинантные белковые комплексы гриппа элюировались с колонки в свободном объеме (фракция 6 мл). Этот результат был характерен для макромолекулярного белкового комплекса, такого как VLPs. Вирусные белки во фракциях с колонки выявляли анализом вестерн-иммуноблоттинга, как описано выше в примере 6. Белки M1 выявлялись во фракциях свободного объема (фиг. 7). Как и ожидалось, бакуловирусные белки также находились в свободном объеме.
Пример 11
Электронная микроскопия рекомбинантных VLPs гриппа
Для определения того, имеют ли макромолекулярные белковые комплексы, выделенные с градиента сахарозы и содержащие белки птичьего гриппа, морфологию, сходную с таковой вирионов гриппа, была проведена оценка электронной микроскопией негативно окрашенных образцов. Рекомбинантные белковые комплексы птичьего гриппа A/Hong Kong/1073/99 (H9N2) концентрировали и очищали из культуральных супернатантов ультрацентрифугированием на ступенчатых градиентах сахарозы, как описано в примере 7. Аликвоты фракций градиента сахарозы обрабатывали 2% глутаральдегидом в ЗФР, pH 7,2, абсорбировали на свежеполученных пластиковых покрытых углем решетках и промывали дистиллированной водой. Образцы окрашивали 2% фосфовольфраматом натрия, pH 6,5, и обследовали с помощью электронного микроскопа с проходящим пучком (Philips). Электронные микроснимки негативно окрашенных образцов рекомбинантных белковых комплексов птичьего гриппа H9N2 из двух фракций градиента сахарозы показали наличие сферических и частиц в форме палочек (фиг. 8). Частицы имели разный размер (60 и 80 нм) и морфологию. Были выявлены также более крупные комплексы обоих типов частиц, а также частицы в форме палочек (фиг. 8). Все наблюдавшиеся структуры белковых комплексов имели подобные шипам выступы на своей поверхности, напоминающие пепломеры HA и NA вируса гриппа. Поскольку размер и вид частиц 80 нм были сходны с частицами вируса гриппа дикого типа, эти структуры, видимо, представляют собой VLPs гриппа, покрытые оболочкой. Меньшие частицы приблизительно 60 нм могут представлять собой субвирусные частицы, которые отличаются от указанных выше VLPs и морфологически, и структурно.
Пример 12
Анализ функциональных свойств белков гриппа тестом гемагглютинации
Для определения того, обладают ли очищенные VLPs и белки гриппа функциональной активностью, такой как гемагглютинирующая и нейраминидазная активность, которые характерны для вируса гриппа, очищенные VLPs и белки гриппа тестировали анализом гемагглютинации и нейраминидазной активности.
Для анализа гемагглютинации готовили ряд 2-кратных разведений фракций градиента сахарозы, содержащих VLPs гриппа или контрольный вирус типа A дикого типа. Затем их смешивали с 0,6% эритроцитами морской свинки в ЗФР (pH 7,2) и инкубировали при 4°С в течение от 1 до 16 час. В качестве отрицательного контроля использовали ЗФР. Степень гемагглютинации определяли визуально и определяли наибольшее разведение фракции, способное агглютинировать эритроциты крови морской свинки (фиг. 9). Наибольший титр агглютинации, наблюдавшийся для очищенных VLPs и белков гриппа, равнялся 1:400, что превышало титр, проявляемый контрольным гриппом дикого типа, который составлял 1:2000.
Пример 13
Анализ функциональных свойств белков гриппа анализом нейраминидазы
Величину нейраминидазной активности в содержащих VLP гриппа фракциях градиента сахарозы определяли анализом нейраминидазы. В данном тесте NA (фермент) действовала на субстрат (фетуин) и высвобождала сиаловую кислоту. Для прекращения активности фермента добавляли арсенитный реагент. Количество выделенной сиаловой кислоты определяли химически с помощью тиобарбитуровой кислоты, которая давала розовую окраску, пропорциональную свободной сиаловой кислоте. Уровень окраски (хромофора) измеряли на спектрофотометре при длине волны 594 нм. Результаты, представленные на фиг. 8, показали, что значительное количество сиаловой кислоты образуется содержащими VLP фракциями градиента сахарозы и что эти фракции соответствуют фракциям, проявляющим гемагглютинирующую активность.
Пример 14
Иммунизация мышей BALB/c функциональными гомотипичными рекомбинантными VLPs гриппа H9N2
Иммуногенность рекомбинантных VLPs гриппа выясняли иммунизацией мышей с последующим вестерн-блот анализом иммунной сыворотки. Рекомбинантные VLPs (1 мкг/инъекция), состоящие из белков HA, NA и M1 вируса птичьего гриппа типа A/Honk Kong/1073/99 и очищенные на градиентах сахарозы, инокулировали подкожно в область дельтовидной мышцы десяти (10) самок мыши BALB/c на 0 и 28 дни (фиг. 11). В качестве отрицательного контроля сходным образом вводили ЗФР (pH 7,2) пяти (5) мышам. У мышей брали кровь из надглазничной полости в 1 день (предварительный отбор крови), 27 день (первичный отбор крови) и 54 день (вторичный отбор крови). Сыворотку получали из образцов крови после свертывания в течение ночи и центрифугирования.
Для анализа вестерн-блоттингом 200 нг инактивированного вируса птичьего гриппа типа A H9N2 или адаптированного к холоду вируса птичьего гриппа типа A H9N2, а также предварительно окрашенные белковые стандарты See Blue Plus 2 (InVitrogen) денатурировали (95°С, 5 мин) и подвергали электрофорезу в восстанавливающих условиях (10 мМ β-меркаптоэтанол) на 4-12% градиентных полиакриламидных гелях NuPAGE (InVitrogen) в буфере MES при 172 вольтах до исчезновения красителя-свидетеля бромфенолового синего. Для белковых гелей белки после электрофореза визуализировали окрашиванием коллоидным реагентом кумасси синего (InVitrogen). Белки переносили из геля на нитроцеллюлозные мембраны в метаноле с помощью стандартной процедуры вестерн-блоттинга. Сыворотку от иммунизированных VLP мышей и кроликов, иммунизированных инактивированным вирусом птичьего гриппа H9N2 (сыворотка положительного контроля), разбавляли 1:25 и 1:100 соответственно в растворе ЗФР (pH 7,2) и использовали в качестве первичного антитела. Мембраны со связанным белком, которые блокировали 5% казеином, вводили во взаимодействие с первичной антисывороткой в течение 60 минут при комнатной температуре при постоянном встряхивании. После отмывки мембран от первичного антитела забуференным фосфатом солевым раствором их вводили во взаимодействие с раствором, содержащим твин 20, вторичную антисыворотку [конъюгат антимышиного IgG козы-щелочная фосфатаза (1:10000) или конъюгат антикроличьего IgG козы-щелочная фосфатаза (1:10000)], в течение 60 минут. После отмывки мембран от вторичного антитела забуференным фосфатом солевым раствором, содержащим твин 20, связывающие антитело белки на мембранах визуализировали проявлением хромогенным субстратом, таким как NBT/BCIP (InVitrogen).
Результаты анализа вестерн-блоттингом (фиг. 12) заключались в том, что белки с молекулярными массами, сходными с вирусными белками HA и M1 (75 и 30 кДа соответственно), связывались с сывороткой положительного контроля (фиг. 12 B) и сывороткой мышей, иммунизированных рекомбинантными VLPs гриппа H9N2 (фиг. 9A). Эти результаты показали, что рекомбинантные VLPs гриппа H9N2 являются сами по себе иммуногенными у мышей при данном пути введения.
Пример 15
Иммуногенность VLP Kong/1073/99 (H9N2) и исследование провоцирующего введения у мышей BALB/c
Мышей BALB/c иммунизировали VLPs H9N2 (1 мкг HA или 10 мкг HA/доза) без или со 100 мкг адъюванта Novasome на 0 и 21 день и провоцировали гомологичным инфекционным вирусом IN на 57 день. У мышей брали кровь в 0, 27 и 57 дни и сыворотку анализировали на антитела против HA в тесте ингибирования гемагглютинации (HI) с использованием RBCs индейки и с помощью ИФА. Результаты этого исследования показаны с фиг. 13 по фиг. 16.
Высокие титры антител против H9N2 индуцировались после однократной иммунизации (первичной) вакциной VLP H9N2 без Novasome или с ним и при дозе VLPs 10 мкг, содержащей 1 мкг HA (фиг. 13). Титры специфических антител увеличивались приблизительно на полпорядка после бустерной иммунизации.
После иммунизации и поддерживающего введения 1 мкг HA в форме VLPs H9N2 уровни HI сыворотки приблизительно соответствовали или превышали уровни, обычно считающиеся защитными (log 2=5) у всех животных (фиг. 14, нижняя левая часть). VLPs H9N2, составленные с адъювантом Novasome, увеличивали ответ приблизительно в 2 раза после первичной иммунизации и приблизительно в 4 раза после бустерного введения (фиг. 14, нижняя правая часть). Очищенная гемагглютининовая субъединица H9N2 также индуцировала защитный уровень HI антител после поддерживающего введения, и Novasomes вновь повышали ответ антител приблизительно в 2 раза после первичной и в 4 раза после поддерживающей иммунизации (фиг. 14, верхние части). Уровень HI антител, индуцированных 10 мкг HA, вводимого в виде субъединицы вакцины, был эквивалентен 1 мкг HA, вводимого в форме VLP. Кроме того, снижение массы было значительно меньшим у мышей, иммунизированных VLPs H9N2 плюс адъювант, по сравнению с невакцинированными контрольными животными (фиг. 15). Не было статистического отличия между снижением массы в группах, иммунизированных VLPs H9N2 и VLPs H9N2 плюс адъювант Novasome.
Кроме того, титры вируса в легких на 3 и 5 дни после провоцирующего введения вируса H9N2 были значительно снижены у мышей, иммунизированных VLPs H9N2 (фиг. 16). На 3 день, когда титры вируса гриппа достигают максимума в тканях легких, у мышей, иммунизированных VLPs H9N2 плюс Novasomes®, происходило значительно большее снижение титра вируса по сравнению с мышами, иммунизированными только VLPs, и невакцинированными контрольными мышами.
Пример 16
Иммуногенность VLP A/Fujian/411/2002 (H3N2) и перекрестное взаимодействие между несколькими штаммами гриппа
Мышей BALB/c иммунизировали VLPs A/Fujian/411/2002 (3,0, 0,6, 0,12 и 0,24 мкг HA/доза), дважды IM и IN. У мышей брали кровь в 0 и 35 дни. Сыворотку затем анализировали на антитела против HA в тесте ингибирования гемагглютинации (HI) с использованием RBCs индейки и на антитела против гриппа с помощью ИФА. Результаты этого исследования показаны на фиг. 17A, 17B и 17C. Эти результаты показывают, что иммунный ответ увеличивался и IM, и IN против HA и NA.
Пример 17
Определение изотипов IgG у мышей после инокуляции VLPs H3N2
Мышей инокулировали VLPs внутримышечно и интраназально. Через 5 недель получали сыворотку и анализировали на изотипы IgG.
Сыворотку тестировали в планшетах, покрытых очищенным HA (Protein Sciences) A/Wyoming/3/2003, с помощью ИФА. Последовательные пятикратные разведения сыворотки добавляли в лунки и планшеты инкубировали. Затем добавляли биотинилированные Ig козы против мыши или против IgG1мыши, против IgG2a мыши, против IgG2b мыши и против IgG3 мыши. После этого в лунки добавляли стрептавидин-пероксидазу. Выявлялись связанные конъюгаты. Результаты иллюстрируются на фиг. 18A и B. Эти результаты показывают, что IgG2a являются наиболее представленным изотипом у мыши при иммунном ответе против VLPs.
Пример 18
Исследование ранжирования дозы VLP A/Hong Kong/1073/99 (H9N2) у крыс SD
Крыс SD (n=6 на дозу) иммунизировали на 0 и 21 дни очищенными VLPs A/Hong Kong/1073/99 (H9N2), разбавленными ЗФР при нейтральном pH до 0,12, 0,6, 3,0 и 15 мкг HA или только ЗФР. У животных отбирали образцы крови на 0, 21, 35 и 49 дни и сыворотку анализировали в тесте ингибирования гемагглютинации (HI) для выявления функциональных антител, способных ингибировать связывающую функцию HA. Дозировка основывалась на содержании HA, измеренном с помощью ДДС-ПАГЭ, и сканирующей денситометрии очищенных VLPs H9N2. Результаты определения титров в тесте ингибирования гемагглютинации показаны на фиг. 19. Однократная доза 0,6 мкг HA VLPs H9N2 или две дозы 0,12 мкг HA вызывали защитные уровни HI антител у крыс. Эти данные показывают, что меньшее количество HA может индуцировать защитный ответ, когда указанный HA является частью VLP.
Пример 19
Иммуногенность VLP Kong/1073/99 (H9N2)
Мышей BALB/c иммунизировали VLPs H9N2 (0,12, 0,6 мкг/доза) со 100 мкг Novasome или квасцового адъюванта или без них на 0 и 21 дни и подвергали провоцирующей инфекции гомологичным вирусом IN на 57 день. Мышей также иммунизировали 3,0 и 15,0 мкг HA/доза (без адъюванта). У мышей брали кровь на 0, 21, 35 и 49 дни и сыворотку анализировали на антитела против HA в тесте ингибирования гемагглютинации (HI) с использованием RBCs индейки и ИФА гриппа. Результаты этого исследования показаны на фиг. 20A и B.
Результаты показывают, что более сильный в целом иммунный ответ наблюдается при введении VLPs с адъювантом. Однако защитный ответ вызывался 0,12 мкг HA/доза на 3 неделе по сравнению с VLPs, составленными с квасцами и VLPs без адъюванта. Кроме того, на 7 неделе VLPs, включающие Novasomes, обеспечивали титр HI приблизительно на 2 порядка выше по сравнению с VLP с квасцами. Величина ответа была сходной с таковой при введении VLPs при 3,0 и 15,0 мкг HA/доза без адъюванта. Эти результаты показывают, что Novasomes обеспечивают более сильный ответ по сравнению с квасцами. Кроме того, защитный иммунный ответ может быть достигнут при количестве VLPs, в 25 раз меньшем, когда указанные VLPs вводят в составе, включающем Novasomes.
Кроме того, по данным с 0,6 мкг NA/доза состав с Novasome вызывал приблизительно на 1,5 порядка больший ответ по сравнению с квасцами. Иммунные ответы были сходны по величине с таковыми VLPs, вводимыми при 3,0 и 15,0 HA/доза без адъюванта. Эти результаты показывают, что с адъювантом требуется введение приблизительно в 5 раз меньшего количества VLPs для достижения защитного ответа.
Кроме того, на фиг. 20B показан титр HI VLPs H9N2 при применении разных составов Novasomes. В эксперименте использовали следующие формулы:
Группа 1: VLP H9N2 (0,1 мкг) (n=5)
Группа 2: VLP H9N2 (0,1 мкг) с неразбавленным DCW (n=5)
Группа 3: VLP H9N2 (0,1 мкг) с DCW 1:3) (n=5)
Группа 4: VLP H9N2 (0,1 мкг) с DCW 1:9) (n=5)
Группа 5: VLP H9N2 (0,1 мкг) с DCW 1:27) (n=5)
Группа 6: VLP H9N2 (0,1 мкг) с NVAX 1) (n=5)
Группа 7: VLP H9N2 (0,1 мкг) с NVAX 2) (n=5)
Группа 8: VLP H9N2 (0,1 мкг) с NVAX 3) (n=5)
Группа 9: VLP H9N2 (0,1 мкг) с NVAX 4) (n=5)
Группа 10: VLP H9N2 (0,1 мкг) с NVAX 5) (n=5)
Группа 11: VLP H9N2 (0,1 мкг) с квасцами-OH) (n=5)
Группа 12: VLP H9N2 (0,1 мкг) с CpG) (n=5)
Группа 13: ЗФР (0,6 мкг) (n=5)
Группа 14: H3 VLPs (0,6 мкг) (n=5)
Группа 15: H5 VLPs (0,6 мкг) (n=8)
-H9: (лот #11005)
-DCW: Novasomes (лот #121505-2, полиоксиэтилен-2-цетиловый эфир, холестерин, сверхчистое соевое масло и цетилпридиния хлорид)
-NVAX 1: B35P83, MF-59 реплика (сквален, полисорбат и span)
-NVAX 2: B35P87 (соевое масло, brij, холестерин, плуроник F-68)
-NVAX 3: B35P88 (соевое масло, brij, холестерин, плуроник F-68 и полиэтиленимин)
-NVAX 4: B31P60 (сквален, brij, холестерин, олеиновая кислота)
-NVAX 5: B31P63 (соевое масло, глицерилмоностеарат, холестерин, полисорбат)
-CpG: (лот #1026004)
-H5: (лот #22406)
На фиг. 21 показана кривая доза-ответ для VLP H9N2. Эти данные показывают, что доза VLPs в количестве 0,6 мкг HA/доза является минимальной для вызова защитного иммунного ответа у мышей через 3 недели.
Пример 20
Вещества и способы для исследований на хорьках
Хорьков получали из Triple F Farms (FFF, Sayre, PA). Все приобретенные хорьки имели титр HAI менее 10 гемагглютининовых единиц. Приблизительно за два дня до вакцинации животным имплантировали температурный датчик (BioMedic Data Systems, Inc.). Животных (6 животных/группа) вакцинировали в 0 день либо (1) ЗФР (отрицательный контроль, группа один), (2) VLPs гриппа H3N2 с 15 мкг H3 (группа 2), (3) VLPs гриппа H3N2 с 3 мкг H3 (группа 2), (4) VLPs гриппа H3N2 с 0,6 мкг H3 (группа 3), (5) VLPs гриппа H3N2 с 0,12 мкг H3 (группа 5) или rH3HA с 15 мкг (группа 6). На 21 день животным вводили бустерную вакцину. У животных брали кровь в 0 день (до вакцинации), на 21 день (до введения бустерной вакцины) и 42 день. Животных обследовали на клинические признаки неблагоприятных эффектов вакцины раз в неделю на протяжении периода исследования. Сходные исследования проводили с другими VLPs гриппа.
Уровень HAI в сыворотке хорьков
Сыворотку хорьков получали от FFF, обрабатывали разрушающим рецептор ферментом (RDE) и анализировали в тесте ингибирования гемагглютинации (HAI) с помощью стандартных процедур (Kendal et al. (1982)). Все отобранные для исследования хорьки были негативными (HAI=10) в отношении предсуществующих антител к циркулирующему в данный момент вирусу гриппа человека (A/New Caledonia/20/99 (HlNl), A panama/2007/99 (H3N2), A/Wellington/01/04 (H2N3) и B/Sichuan/379/99 и H5Nl).
Хорьки
Приблизительно 8-месячных, не контактировавших с гриппом, кастрированных и опущенных самцов хорьков Fitch (Mustela putorius furo) приобретали в FFF. Животных содержали в клетках из нержавеющей стали для кроликов (Shor-line, KS), содержащих санитарную подложку из стружек для лабораторных животных (P.J. Murphy Forest Products, NJ). Хорьков кормили диетой Teklad Global Ferret Diet (Harlan Teklad, WI) и давали свежую воду по желанию. Поддоны заменяли три раза в неделю и клетки чистили раз в две недели.
Вакцинирование и отбор крови у хорьков
Вакцину, VLPs гриппа H3N2 или VLPs гриппа H9N2 и контроли, например, rH3NA (A/Wyoming/3/2003) и ЗФР (отрицательный контроль), хранили при 4°С перед применением. В большинстве исследований шесть групп хорьков (N-6/группа) вакцинировали внутримышечно вакциной любой концентрации или контролем в объеме 0,5 мл.
Перед сбором крови и вакцинацией животных анестезировали внутримышечным введением во внутреннюю часть бедра раствора катамина (25 мг/кг), атропина (0,05 мг/кг) и ксилазина (2,0 мг/кг), “KAX”. В анестезированном состоянии хорьков укладывали на спину и отбирали кровь (объемом от 0,5 до 1,0 мл) из верхней полой вены с помощью иглы размера 23 1'', соединенной с туберкулиновым шприцем на 1 см3. Кровь переносили в пробирку, содержащую сепаратор сыворотки и активатор свертывания, и давали свернуться при комнатной температуре. Пробирки центрифугировали, сыворотку отделяли и замораживали при -80°C. Кровь отбирали до вакцинации (день 0), до введения бустерной дозы (день 21) и на 42 день и анализировали в тесте HAI.
Наблюдение за хорьками
Температуру измеряли еженедельно приблизительно в одно и то же время на протяжении всего периода исследования. Величины до вакцинации усредняли для получения исходной температуры для каждого хорька. Изменение температуры (в градусах по Фаренгейту) рассчитывали для каждой временной точки для каждого животного. Хорьков обследовали еженедельно на предмет клинических признаков неблагоприятных эффектов вакцины, включая температуру, снижение массы, снижение активности, носовые выделения, чихание и диарею. Для оценки уровня активности использовали систему оценки на основе, описанной Reuman et al. (1989), где 0 = бодрость и веселость; 1 = бодрость и веселость только при стимуляции; 2 = бодрость, но не веселость при стимуляции; 3 = ни бодрость, ни веселость при стимуляции. На основании показателей для каждой группы животных рассчитывали относительный индекс неактивности как Σ(день 0 - день 42)[показатель активности +1]/Σ(день 0 - день 42), где n равно общему количеству наблюдений. Величину 1 прибавляли к каждому показателю с тем, чтобы показатель «0» можно было разделить на знаменатель, что дает величину индекса 1,0.
Получение сыворотки
Сыворотки обычно имели низкий уровень неспецифических ингибиторов гемагглютинации. Для инактивации этих неспецифических ингибиторов сыворотки обрабатывали (RDE) перед тестированием. Вкратце, три части RDE добавляли к одной части сыворотки и инкубировали в течение ночи при 37°С. RDE инактивировали инкубацией при 56°С в течение приблизительно 30 минут. После инактивации RDE к образцу добавляли ЗФР до конечного разведения сыворотки 1:10 (RDE-Tx). Разбавленные RDE-Tx сыворотки хранили при 4°С перед тестированием (в течение 7 дней) или хранили при -20°С.
Получение эритроцитов индейки
Вирусы гриппа человека связываются с рецепторами сиаловой кислоты, содержащими α связи N-ацетилнейраминовой кислоты и 2,6-галактозы. Вирусы птичьего гриппа связываются с рецепторами сиаловой кислоты, содержащими N-ацетилнейраминовой кислоты α 2,3-галактозу (α 2,3 связи), и экспрессируют и α 2,3, и α 2,6 связи. Эритроциты индеек (TRBC) используют для анализа HAI, поскольку A/Fujian является вирусом человека. TRBCs разбавляют ЗФР до получения суспензии 0,5% об/об. Клетки хранят при 4°С и используют в течение 72 часов после получения.
Анализ HAI
Анализ HAI был адаптирован из руководства CDC по лабораторному наблюдению за гриппом (Kendal et al. (1982) Concepts and procedures for laboratory based influenza surveillance, U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control, Atlanta, Georgia, включенного здесь в качестве ссылки во всей своей полноте для всех целей). RDE-Tx сыворотки последовательно двукратно разбавляли в v-образных планшетах для микротитрования. В каждую лунку добавляли равный объем разбавленного вируса, разбавленного до приблизительно 8 HAU/50 мкл. Планшеты закрывали и инкубировали при комнатной температуре в течение 15 минут с последующим добавлением 0,5% TRBC. Планшеты перемешивали встряхиванием, закрывали и TRBC давали осесть в течение 30 минут при комнатной температуре. Титр HAI определяли как величину, обратную разбавлению для последнего ряда, который содержал неагглютинировавшие TRBC. В каждый планшет включали положительные и отрицательные контроли сыворотки.
Пример 21
Исследование по подбору дозы VLP A/Hong Kong/1073/99 (H9N2) у хорьков
Для оценки титра антител и HI после инокуляции VLPs H9N2 использовали хорьков, серологически негативных в отношении ингибирования гемагглютинации для вирусов гриппа. У хорьков брали кровь на 0 и 21 дни и сыворотку анализировали на антитела против HA с помощью теста ингибирования гемагглютинации (HI) с использованием RBCs индеек и на антитела против гриппа с помощью ИФА. Результаты иллюстрированы на фиг. 22. Эти результаты показывают титры HI, соответствующие защитному уровню антител при дозах VLP 1,5 и 15 мкг.
Пример 21
Вакцинация хорьков VLPs H3N2
Хорьков вакцинировали на 0 день и давали им бустерную инъекцию на 21 день VLPs разных штаммов H3N2 в разных дозах (дозы HA 0,12, 0,6, 3,0, 15,0 мкг). В качестве положительного контроля служил rH3HA в дозе 15 мкг, а в качестве отрицательного контроля - только ЗФР. Сыворотки, как описано выше, получали от хорьков на 0 день перед вакцинацией, на 21 день (перед бустерным введением) и на 42 день. Образцы сыворотки анализировали в тесте HI для определения того, имелся ли иммунный ответ против VLPs. Эти результаты иллюстрированы на фиг. 23. Эти данные показывают, что VLPs H3N2 при введении хорькам действительно индуцируют иммунный ответ. Таким образом, VLPs H3N2 являются иммуногенными у хорьков.
Пример 22
ОТ-ПЦР и клонирование генов HA, NA и M1 вируса гриппа A/Indonesia/5/05 (H5N1)
Вирусную РНК монофилетического таксона 2 вируса гриппа A/Indonesia/5/05 (H5N1) экстрагировали с помощью тризола LS (Invitrogen, Carlsbad, CA) в условиях защиты BSL-3. Обратную транскрипцию (ОТ) и ПЦР проводили на экстрагированной вирусной РНК с использованием одноступенчатой системы ОТ-ПЦР (Invitrogen) со специфичными для генов олигонуклеотидными праймерами. Использовали следующие пары праймеров для синтеза генов гемагглютинина (HA), нейраминидазы (NA) и матрикса (M1) H5N1 соответственно:
5'-AACGGTCCGATGGAGAAAATAGTGCTTCTTC-3' (SEQ ID. 4) и
5'-AAAGCTTTTAAATGCAAATTCTGCATTGTAACG-3' (SEQ ID. 5) (HA);
5'-AACGGTCCGATGAATCCAAATCAGAAGATAAT-3' (SEQ ID. 6) и
5'-AAAGCTTCTACTTGTCAATGGTGAATGGCAAC-3' (SEQ ID. 7) (NA); и
5'-AACGGTCCGATGAGTCTTCTAACCGAGGTC-3' (SEQ ID. 8) и
5'-AAAGCTTTCACTTGAATCGCTGCATCTGCAC-3' (SEQ ID. 9) (Ml) (кодоны ATG подчеркнуты).
После ОТ-ПЦР фрагменты кДНК, содержащие гены HA, NA и M1 гриппа с молекулярными массами 1,7, 1,4 и 0,7 т.п.н. соответственно, клонировали в вектор pCR2.1-TOPO (Invitrogen). Нуклеотидные последовательности генов HA, NA и M1 определяли секвенированием ДНК. Сходной стратегии придерживались при клонировании монофилетического таксона 1 вируса гриппа H5N1 из Vietnam/1203/2003.
Пример 23
Получение рекомбинантных бакуловирусов, включающих H5N1
Ген HA клонировали в виде фрагмента ДНК RsrII-HindIII (1,7 т.п.н.) ниже AcMNPV полигедринового промотора в бакмидный переносящий вектор (Invitrogen), гидролизованный RsrII и HindIII. Сходным образом, гены NA и M1 клонировали в виде фрагментов ДНК EcoRI-HindIII (1,4 и 0,8 т.п.н. соответственно) в гидролизованную EcoRI-HindIII плазмидную ДНК pFastBac1. Три полученные бакуловирусные переносящие плазмиды pHA, pNA и pM1, содержащие гены HA, NA и M1 гриппа A/Indonesia/5/05 (H5N1) соответственно, использовали для получения рекомбинантных бакмид.
Бакмиды получали сайт-специфичной гомологичной рекомбинацией с последующей трансформацией содержащими гены гриппа бакмидными переносящими Плазмидами компетентных клеток E. coli DH10Bac, которые содержали AcMNPV бакуловирусный геном (Invitrogen). Рекомбинантной бакмидной ДНК трансфецировали клетки Sf9 насекомого.
Нуклеотидные последовательности генов HA, NA и M1 A/Indonesia/5/05
HA (SEQ ID. 10)

NA (SEQ ID. 11)


M1 (SEQ ID. 12)

Один клонированный ген HA, pHA5, содержал две нуклеотидные замены, nt#1172 и nt#1508 (в диком типе) по сравнению с последовательностью гена HA дикого типа. Сходной стратегии придерживались при конструировании и создании монофилетического таксона 1 вируса гриппа H5N1 из VLPs Vietnam/1203/2003 (см. ниже). Далее приведено выравнивание нуклеотидных и аминокислотных последовательностей pHA5.



Выравнивание аминокислотной последовательности гемагглютинина

Пример 26
Получение генов HA, NA и M1 гриппа A/Indonesia/5/05, оптимизированных для эффективной экспрессии в клетках Sf9
Следующие полипептиды были получены на основе оптимизированных по кодонам нуклеотидов, соответствующих гену HA Indonesia/5/05 (см. пример 31). Оптимизированные по кодонам нуклеотиды были сконструированы и получены (Geneart GMBH, Regensburg, ФРГ) в соответствии со способами, раскрытыми в публикации патента США 2005/0118191, включенной здесь в качестве ссылки во всей своей полноте и для всех целей. Последовательности нуклеиновой кислоты см. в примере 31.
Vac2-hac-opt (немодифицированная а.к. последовательность) (SEQ ID 27)
Vac2-hac-spc-opt (модифицированная, сигнальный пептид из хитиназы, подчеркнут) (SEQ ID 28)

Vac2-hac-sph9-opt (модифицированная, сигнальный пептид из H9, подчеркнут) (SEQ ID 29)


Vac2-hac-cs-opt (модифицированная по сайту расщепления) (SEQ ID 30)

Синтезировали также следующие полипептиды, соответствующие немодифицированным, оптимизированным по кодонам генам NA и M1.
Vac2-naj-opt (нейраминидаза) (SEQ ID 31)

Vac2-mc-opt (матрикс) (SEQ ID 32)

Синтетические, оптимизированные по кодонам гены HA, NA и M1 субклонировали в переносящую плазмиду pFastBac1 с использованием сайтов BamHI и HindIII, как описано выше. Рекомбинантные бакмиды для экспрессии синтетических генов HA, NA и M1 в клетках Sf9 получают, как описано выше, с использованием штамма E.coli DH10Bac (Invitrogen).
Пример 24
Клонирование вируса гриппа монофилетического таксона 1 A/Viet Nam/1203/04 (H5N1) с помощью ОТ-ПЦР
Гены HA, NA и M1 клонировали с помощью ОТ-ПЦР по способу, описанному выше. Показанные ниже последовательности представляют собой сравнение опубликованных генов и клонированных генов.
Ген HA для монофилетического таксона 1 A/Viet Nam/1203/04 (H5N1)
Верхняя строка: ген HA с рег. № AY818135 (SEQ ID 36)
Нижняя строка: ген HA A/Vietnam/1203/04 (H5N1) по Novavax (SEQ ID 37)



Сравнение генов NA
Ген NA для монофилетического таксона 1 A/Viet Nam/1203/04 (H5N1) (SEQ ID 39) H5N1naLANL ISDN 38704 x NA_Vietl203_Lark (NVAX) (SEQ ID 38)


Сравнение генов M1
Ген M1 для монофилетического таксона 1 A/Viet Nam/1203/04 (H5N1) (SEQ ID 40) H5N1m1LAN1 ISDN38704 x M1_Vietl203_Lark (NVAX) (SEQ ID 41)

Все последовательности клонировали и анализировали в соответствии со способами, раскрытыми выше.
Пример 25
Получение генов HA, NA и M1 монофилетического таксона 1 гриппа H5N1 A/Viet Nam/1203/04, оптимизированных для эффективной экспрессии в клетках Sf9
Из оптимизированных по кодонам нуклеотидов, соответствующих A/Viet Nam/1203/04, были получены следующие полипептиды. Нуклеотиды были сконструированы и синтезированы (Geneart GMBH, Regensburg, ФРГ), как раскрыто выше (см. пример 24).
VN1203-ha-cs-opt (модифицированная по сайту расщепления, подчеркнуто) (SEQ ID 33)

VN1203-ha-spc-opt (модифицированный сигнальный пептид, подчеркнуто) (SEQ ID 34)

VN1203-ha-sph9-opt (сигнальный пептид и сайт расщепления затенены) (SEQ ID 35)

Пример 26
Иммуногенность VLP H5N1 Vietnam/1203/2003 (предельно низкие дозы)
Мышей BALB/C иммунизировали внутримышечно и интраназально VLPs H5N1 при очень низких дозах VLPs (0,2, 0,04, 0,008, 0,0016 мкг HA/доза). У мышей брали кровь на 0, 21 и 35 дни. Мыши получали бустерную дозу на 21 день. Сыворотку анализировали на антитела против HA в тесте ингибирования гемагглютинации (HI) с использованием RBCs индейки и вируса гриппа с помощью ИФА. Результаты этого исследования показаны на фиг. 24 и 25.
Результаты показывают, что значительный общий иммунный ответ наблюдался при введении VLPs внутримышечно в очень низких дозах. Величина ответа была сходна с контролем в дозе 3,0 и 0,6 мкг HA. Эти данные позволяют видеть истинную зависимость ответа от дозы и показывают, что ответ антител на 0,2 мкг VLP выше, чем на 3,0 мкг белка rHA. Хотя ответ на интраназальное введение не был столь же сильным, доза VLPs 0,2 мкг HA все же индуцировала значительный ответ. Титр ИФА с дозой 0,2 мкг в этом эксперименте сходен с таковым при дозе 0,12 мкг вакцины VLP H3N2 в предшествующих экспериментах, см. выше.
Пример 27
Исследования с провоцирующим введением
После инокуляции мышей BALB/c VLPs в концентрациях 3 мкг, 0,6 мкг, 0,12 мкг и 0,02 мкг VLPs H3N2 внутримышечно и интраназально (суммарная доза HA) мышам производили провоцирующее введение вируса гриппа A/Aichi/268×31. Результаты этого исследования показаны на фиг. 27 и 28. Эти данные показывают снижение массы у всех вакцинированных животных, однако животные, вакцинированные 3,0 мкг и 0,12 мкг VLPs, выздоравливали быстрее, чем другие животные, и при внутримышечной, и при интраназальной вакцинации. Интраназальные дозы обеспечивали повышенную защиту.
Пример 29
Исследования с провоцирующим введением (хорьки)
В этом исследовании хорьков вакцинировали VLPs H9N2. В исследовании с провоцирующим введением было использовано всего 18 хорьков: 6 с ложной вакцинацией, 6 вакцинированных средней дозой (1,5 мкг) и 6 вакцинированных высокой дозой (15 мкг) внутримышечно. Затем хорькам производили провоцирующее введение 106 EID50 A/HK/1073/99 интраназально. Собирали назальные смывы на 1, 3, 5 и 7 дни. Вирус в назальных смывах всех животных титровали на 3, 5 и 7 дни. Эти данные представлены в таблице 2 и на фиг. 29. Эти данные показывают, что к 7 дню в назальных смывах всех вакцинированных животных вирус не определялся, в то время как в группе с ложной вакцинацией имелись выявляемые титры вируса.
Группа: низкая доза
Группа: высокая доза
Пример 30
Исследования внутримышечной и интраназальной инокуляции у мышей
Мышей инокулировали VLPs A/Fujian/411/2002 (H3N2) в концентрациях 3 мкг, 0,6 мкг, 0,12 мкг или 0,024 мкг (общая доза HA) внутримышечно или интраназально на 0 день и через 3 недели производили бустерное введение. Контрольных мышей инокулировали инактивированным формалином A/Wyoming (Fujian-подобный вакцинный штамм) или ЗФР. От инокулированных мышей получали сыворотки через 0, 3, 5 и 8 недель. Собранные сыворотки анализировали на антитела против HA в тесте ингибирования гемагглютинации (HI) для антител против гриппа с помощью ИФА. Анализ проводили с использованием A/Fujian/411/2002, A/Panama/2007/99, A/Wyoming/3/03 и A/New York/55/2004 штаммов вируса гриппа H3N2. Результаты этого исследования показаны на фиг. 30A-H. Эти данные показывают, что VLPs H3N2 индуцировали антитела против исходных штаммов A/Fujian/411/2002 вируса гриппа и против других штаммов H3N2. Эти данные также показывают, что титры у интраназально инокулированных мышей увеличиваются позже, чем у мышей, инокулированных внутримышечно. Однако после приблизительно 8 недель интраназальные титры выше внутримышечных титров. Кроме того, титры к инактивированному вирусному антигену, по-видимому, сопоставимы с таковыми к VLP при эквивалентных дозах после внутримышечной инокуляции. Однако инактивированный антиген, видимо, не является столь же иммуногенным после интраназальной инокуляции и не оказывает столь же широкую защиту после интраназальной инокуляции.
Пример 31
Получение генов HA, NA и M1 монофилетического таксона 2 гриппа H5N1, оптимизированных для эффективной экспрессии в клетках Sf9
Были сконструированы и синтезированы (Geneart GMBH, Regensburg, ФРГ), как раскрыто выше, следующие оптимизированные нуклеотиды и полипептиды, соответствующие HA, NA и M1 вирусов H5N1 монофилетического таксона 2 A A/Indonesia/5/05, A/Bar headed goose/Qinghai/lA/2005 и A/Anhui/1/2005. Оптимизированные нуклеотиды и полипептиды перечислены ниже. Для получения VLPs A/Anhui HA можно экспрессировать с A/Indonesia NA и M1. Для VLPs, включающих A/Quinghai HA и NA, ген Ml A/Indonesia можно экспрессировать совместно с A/Quinghai HA и NA.
A/INDONESIA/5/05
Оптимизированный HA A/INDONESIA (стартовый и стоп-кодоны подчеркнуты) (SEQ ID 42)


Белковая последовательность HA A/INDONESIA (SEQ ID 43)

Оптимизированный HA A/INDONESIA (с удаленным сайтом расщепления) (стартовый и стоп-кодоны подчеркнуты) (SEQ ID 44)

Белковая последовательность HA A/INDONESIA (SEQ ID 45)

Оптимизированный NA A/INDONESIA (стартовый и стоп-кодоны подчеркнуты) (SEQ ID 46)

Белковая последовательность NA A/INDONESIA (SEQ ID 47)

Оптимизированный M1 A/INDONESIA (SEQ ID 48)

Белковая последовательность M1 A/INDONESIA (SEQ ID 49)

A/Anhui/1/2005
Оптимизированный HA A/Anhui (стартовый и стоп-кодоны подчеркнуты) (SEQ ID 50)

Белковая последовательность HA A/Anhui (SEQ ID 51)

A/Bar headed goose/Qinghai/1A/2005
Оптимизированный HA A/Qinghai (стартовый и стоп-кодоны подчеркнуты) (SEQ ID 52)

Белковая последовательность HA A/Qinghai (SEQ ID 53)

Оптимизированный NA A/Qinghai (стартовый и стоп-кодоны подчеркнуты) (SEQ ID 54)

Белковая последовательность NA A/Qinghai (SEQ ID 55)

Следующие ссылки включены здесь в качестве ссылок:





Другие осуществления
Специалисты в данной области техники должны понимать или быть способными убедиться путем не более чем обычного экспериментирования, что возможно много эквивалентов описанных здесь конкретных осуществлений изобретения. Такие эквиваленты предназначены для охвата следующей формулой изобретения.



























































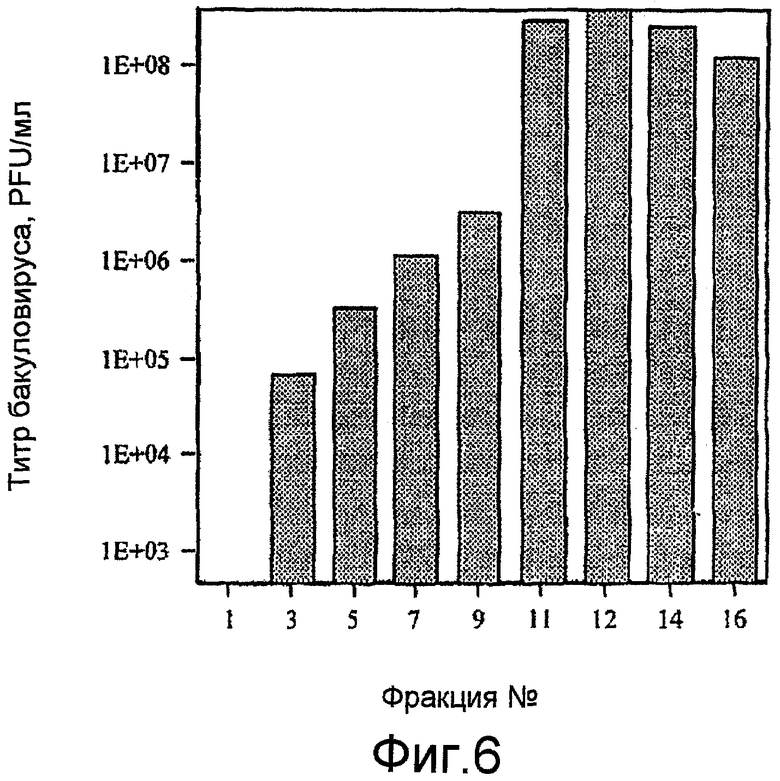
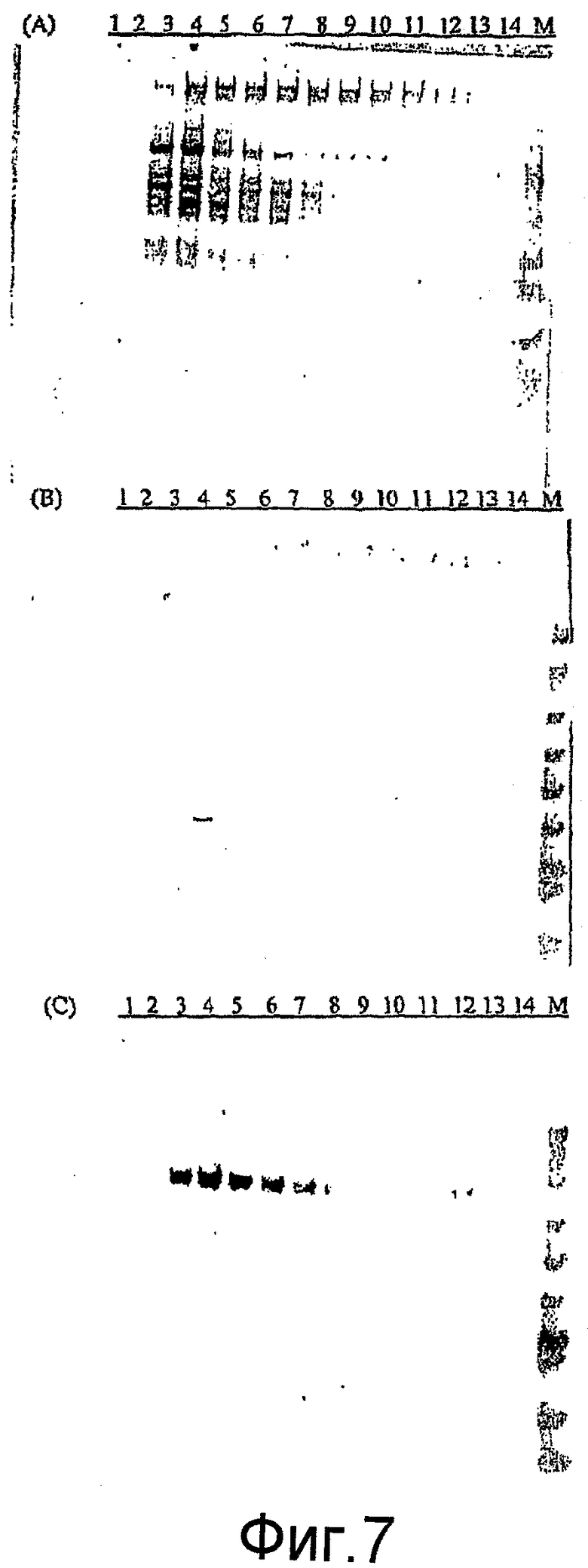
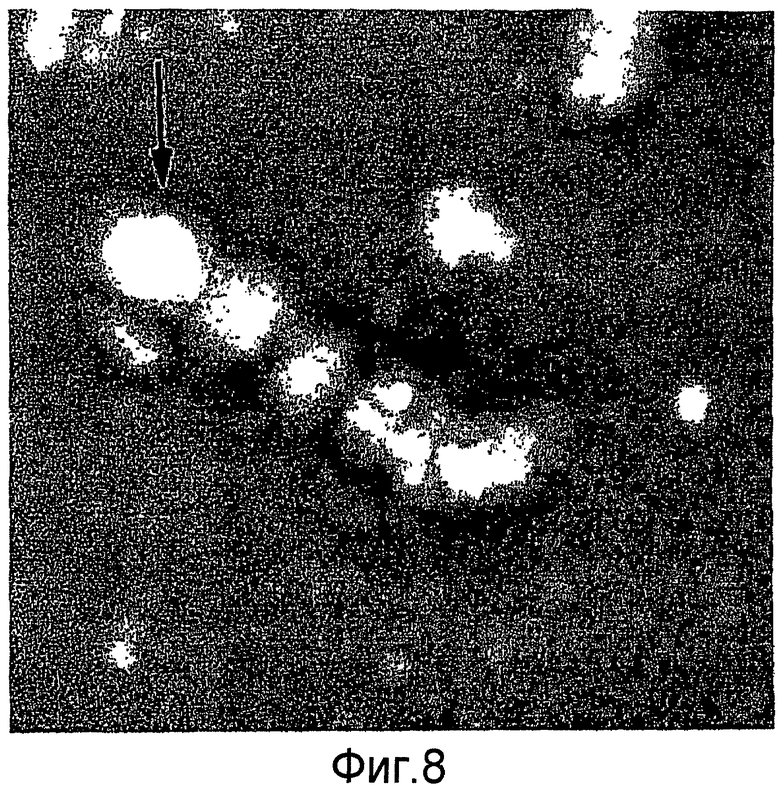


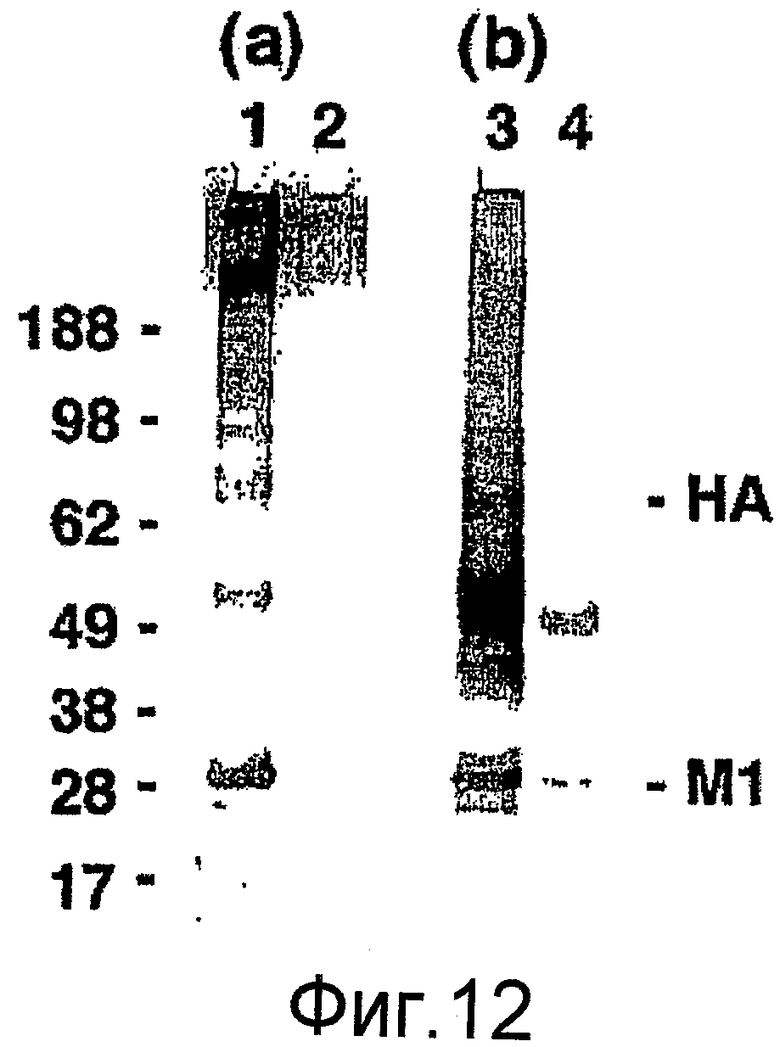
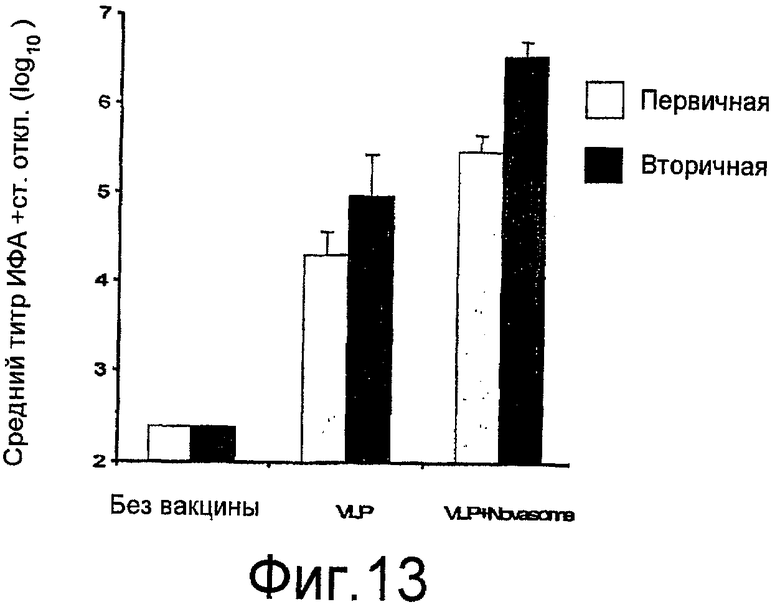

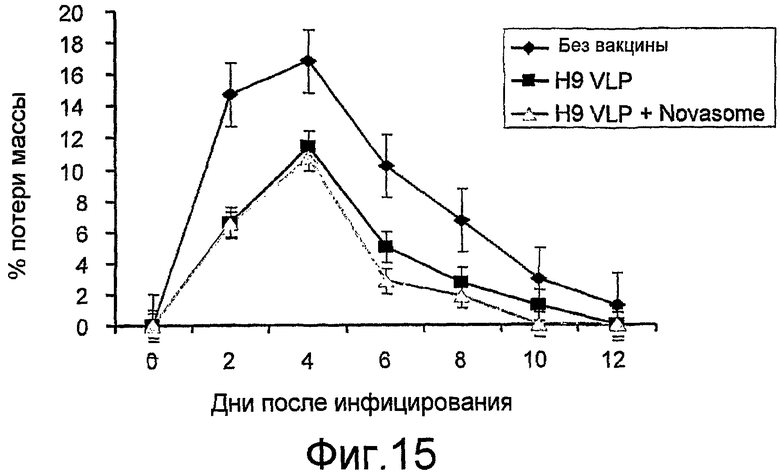
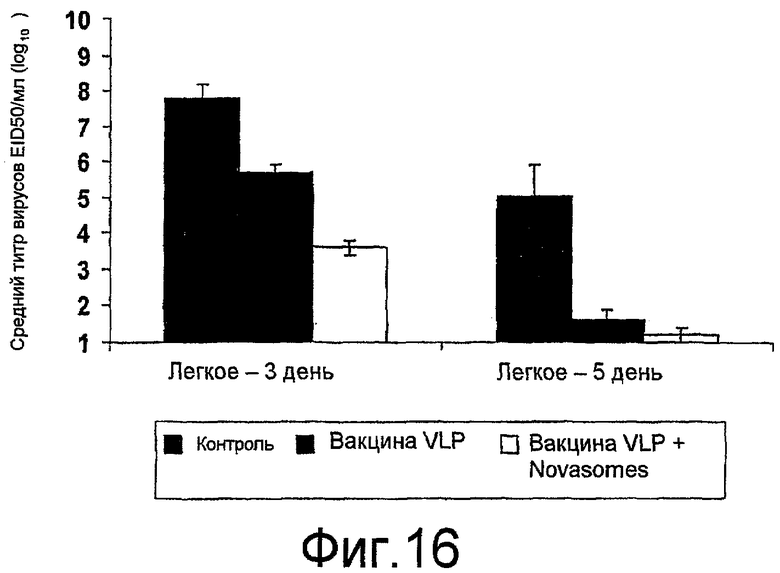
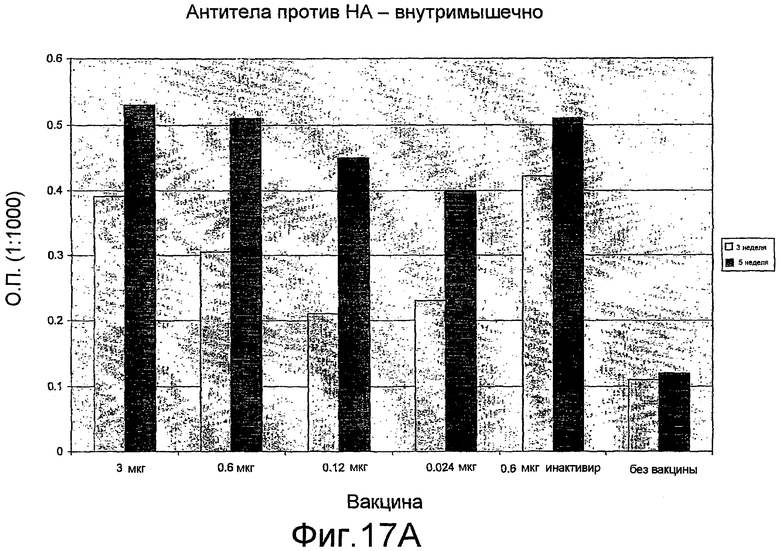
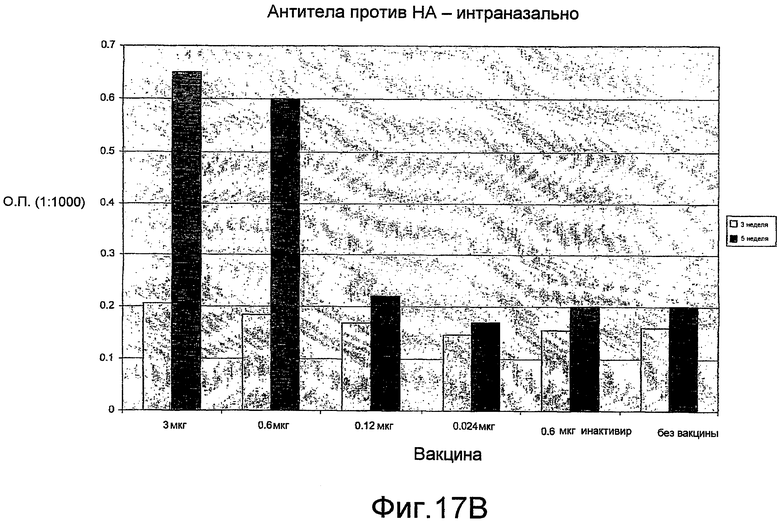
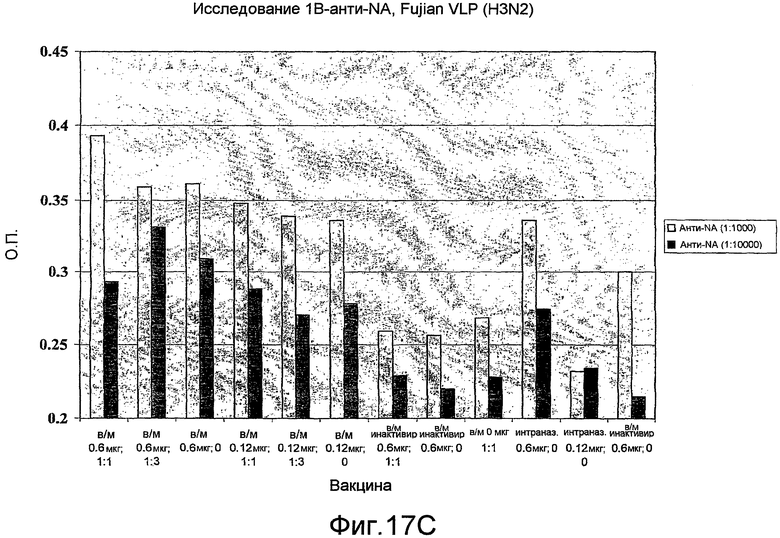
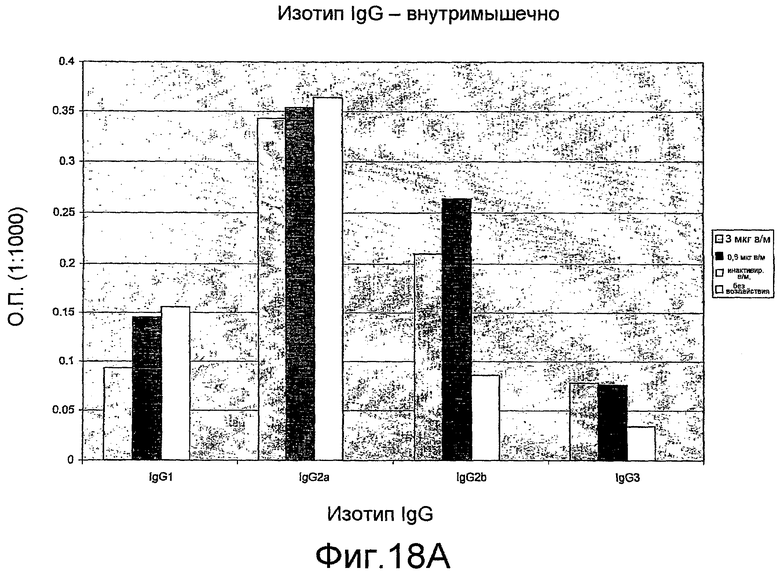
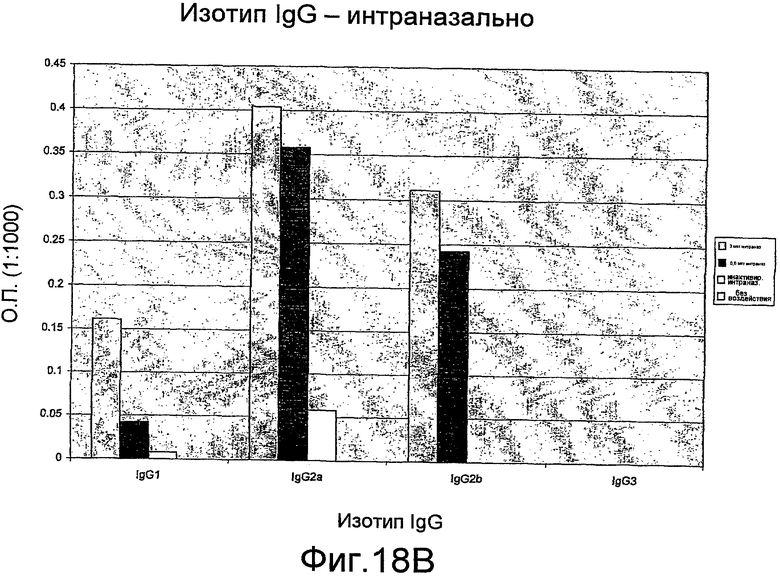
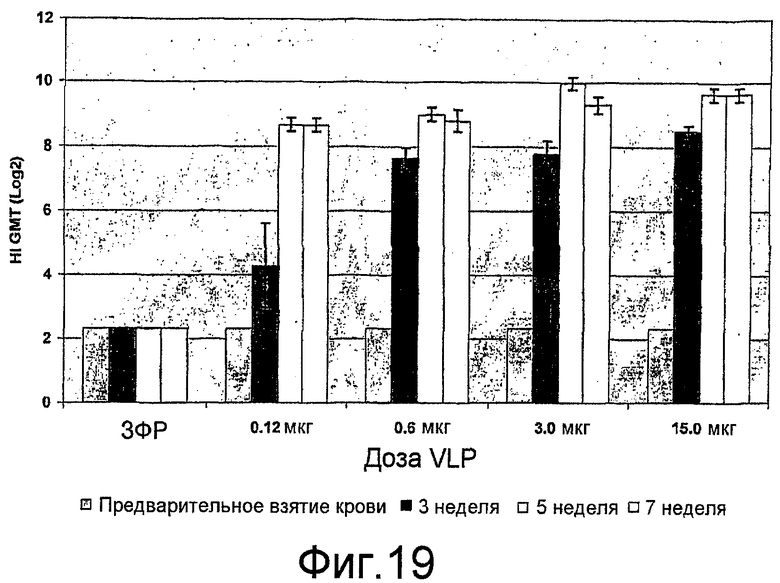
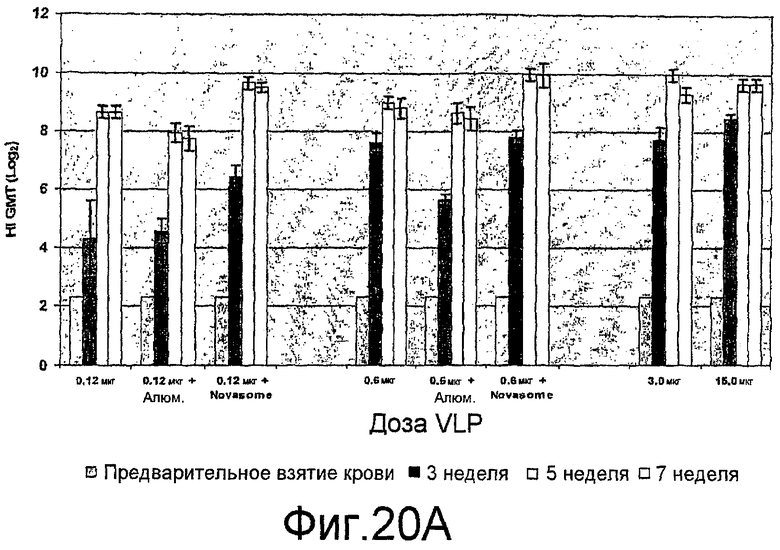
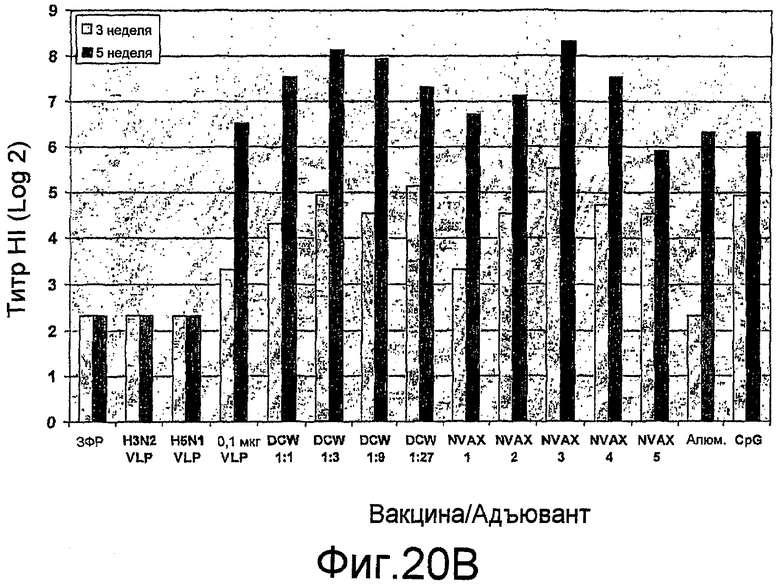
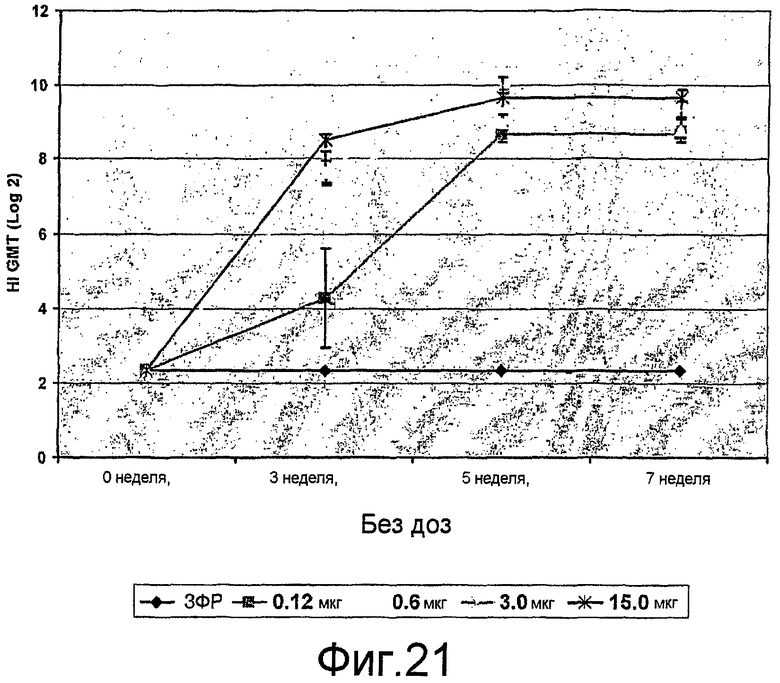
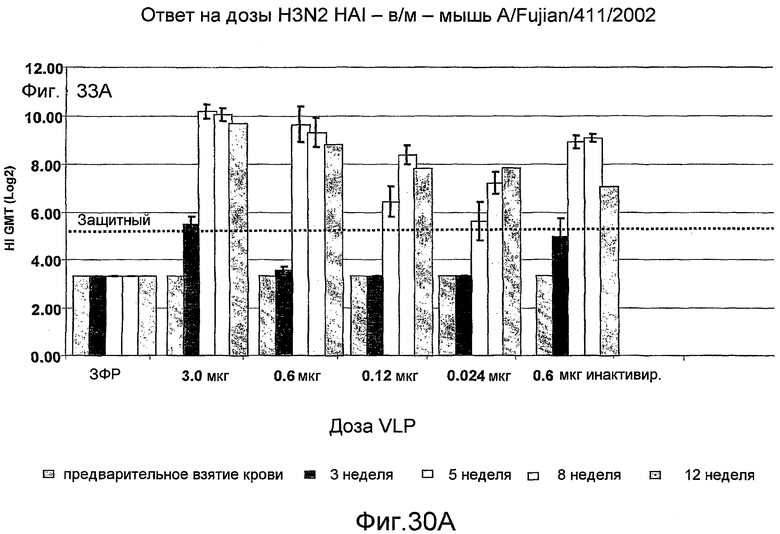
Группа изобретений относится к области медицины, а именно биофармацевтики, и может быть использована для приготовления вакцин. Для этого вакцина, включающая VLP гриппа, включает белки M1, НА и NA вируса гриппа, где указанная вакцина индуцирует стойкий иммунитет к инфицированию вирусом гриппа у человека, восприимчивого к гриппу, и где белок M1 гриппа получен из штамма A/Indonesia/5/05 вируса гриппа. Группа изобретений также относится к применению вакцины с вышеуказанным составом для индукции стойкого иммунитета к инфицированию вирусом гриппа у человека. Использование данного состава вакцины позволяет наиболее эффективным способом получать количества VLP, необходимые для производства вакцин. 6 н. и 15 з.п. ф-лы, 41 ил., 31 пр., 2 табл.
1. Вакцина, включающая VLP гриппа, где указанная VLP включает белки M1, НА и NA вируса гриппа, где указанная вакцина индуцирует стойкий иммунитет к инфицированию вирусом гриппа у человека, восприимчивого к гриппу, и где белок M1 гриппа получен из штамма A/Indonesia/5/05 вируса гриппа.
2. Вакцина по п.1, где указанные белки НА и NA получают из вируса сезонного гриппа.
3. Вакцина по п.2, где указанный вирус сезонного гриппа является вирусом гриппа типа А.
4. Вакцина по п.2, где указанный вирус сезонного гриппа является вирусом гриппа типа В.
5. Вакцина по п.1, где указанные белки НА и NA получают из вируса птичьего гриппа.
6. Вакцина по п.5, где указанный вирус птичьего гриппа представляет собой H5N1.
7. Вакцина по п.5, где указанный вирус птичьего гриппа представляет собой H9N2.
8. Вакцина по п.1, где указанный белок M1 получают из штамма вируса гриппа, отличного от штамма вируса гриппа, из которого получают белки НА и NA.
9. Вакцина по п.1, где указанные белки НА и/или NA проявляют активность гемагглютинина и/или активность нейраминидазы соответственно.
10. Вакцина по п.1, где указанную VLP гриппа готовят в виде состава с адъювантом или иммуностимулятором.
11. Вакцина по п.10, где указанный адъювант включает Novasomes®.
12. Вакцина по п.1, где указанный белок M1 содержит SEQ ID NO:49.
13. Вакцина, включающая VLP гриппа, где указанная VLP состоит, по существу, из белков M1, НА и NA вируса гриппа, где указанная вакцина индуцирует стойкий иммунитет к инфицированию вирусом гриппа у человека, восприимчивого к гриппу, и где белок M1 гриппа получен из штамма A/Indonesia/5/05 вируса гриппа.
14. Вакцина по п.13, где указанные белки НА и NA представляют собой белки НА и NA вируса сезонного гриппа.
15. Вакцина по п.13, где указанные белки НА и NA представляют собой белки НА и NA птичьего вируса гриппа.
16. Вакцина по п.13, где указанный белок M1 получают из штамма вируса гриппа, отличного от штамма вируса гриппа, из которого получают белки HA и NA.
17. Способ индукции стойкого иммунитета к инфицированию вирусом гриппа у человека, восприимчивого к гриппу, включающий введение, по меньшей мере, одной эффективной дозы вакцины по любому из пп.1-16.
18. Способ по п.17, где указанный способ включает введение человеку указанной VLP гриппа перорально, внутридермально, интраназально, внутримышечно, внутрибрюшинно, внутривенно или подкожно.
19. Применение VLP гриппа, где указанная VLP включает белки M1, НА и NA вируса гриппа для получения вакцины, где вакцина индуцирует стойкий иммунитет к инфицированию вирусом гриппа у человека, восприимчивого к гриппу, и где белок M1 гриппа получен из штамма A/Indonesia/5/05 вируса гриппа.
20. Применение VLP гриппа, где указанная VLP состоит, по существу, из белков M1, НА и NA вируса гриппа для получения вакцины, где вакцина индуцирует стойкий иммунитет к инфицированию вирусом гриппа у человека, восприимчивого к гриппу, и где белок M1 гриппа получен из штамма A/Indonesia/5/05 вируса гриппа.
21. Применение VLP гриппа, где указанная VLP состоит из белков M1, HА и NA вируса гриппа для получения вакцины, где вакцина индуцирует стойкий иммунитет к инфицированию вирусом гриппа у человека, восприимчивого к гриппу, и где белок M1 гриппа получен из штамма A/Indonesia/5/05 вируса гриппа.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| GALARZA J.M | |||
| et al | |||
| Vims-like particle (VLP) vaccine conferred complete protection against a lethal influenza virus challenge // Viral | |||
| Immunol., 2005, v.18, №1, рр.244-251 | |||
| CHEN H | |||
| et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2013-06-10—Публикация
2006-10-18—Подача