Изобретение относится к способу определения активности пируватдегидрогеназы (PDH) путем 13C-МР обнаружения (магнитно-резонансного обнаружения на основе изотопа 13C) с использованием сред визуализации, которые содержат гиперполяризованный 13C-пируват, и к средам визуализации для применения в указанном способе.
В тканях аденозинтрифосфат (АТФ) обеспечивает энергию для синтеза сложных молекул, а в мышцах для сокращения. АТФ образуется в результате метаболизма богатых энергией субстратов, таких как глюкоза или длинноцепочечные жирные кислоты. В окислительных тканях, таких как мышца, основная часть АТФ образуется из ацетил-CoA, который вступает в цикл лимонной кислоты, поэтому обеспечение ацетил-CoA является критической детерминантой продуцирования АТФ в окислительных тканях.
Ацетил-CoA продуцируется либо путем β-окисления жирных кислот, либо в результате метаболизма глюкозы посредством гликолитического биохимического пути. Ключевым регуляторным ферментом при регуляции скорости образования ацетил-CoA из глюкозы является пируватдегидрогеназа (PDH), которая катализирует окисление пирувата до ацетил-CoA и диоксида углерода при сопутствующем восстановлении никотинамидаденин-динуклеотида (NAD) до его восстановленной формы (NADH). Таким образом, PDH является ключевым ферментом в регуляции скорости окислительного гликолиза и регуляции равновесия между окислением углеводных и липидных источников энергии.
Недавно возобновлен интерес к структуре и функционированию комплекса PDH благодаря пониманию того, что измененная активность комплекса PDH является характерным признаком при многих заболеваниях человека в диапазоне от относительно нераспространенной первичной недостаточности PDH до основных причинных факторов заболеваемости и смертности, таких как диабет, истощение, сепсис и болезнь Альцгеймера.
PDH представляет собой внутримитохондриальный полиферментный комплекс, состоящий из множественных копий нескольких субъединиц, включая три ферментативных активности Е1, Е2 и Е3, необходимых для завершения преобразования пирувата в ацетил-CoA (Patel et al., FASEB J. 4, 1990, 3224-3233). Е1 катализирует необратимую потерю диоксида углерода из пирувата; Е2 образует ацетил-CoA, и Е3 восстанавливает NAD до NADH. С этим комплексом связаны две дополнительных ферментативных активности: специфичная киназа, которая способна к фосфорилированию Е1 по трем остаткам серина, и слабо связанная специфичная фосфатаза, которая вызывает обратное протекание реакции фосфорилирования. Фосфорилирование единственного остатка из трех остатков серина делает Е1 неактивным. Доля PDH в ее активном (дефосфорилированном) состоянии определяется равновесием между активностью киназы (PDH-киназы, PDHK) и фосфатазы. Активность киназы может регулироваться in vivo относительными концентрациями метаболических субстратов, таких как [NADH]/[NAD+],
[ацетил-CoA]/[СоА] и [АТР]/[аденозиндифосфат (АДФ)], а также доступностью самого пирувата.
Реакции PDH служат для взаимосвязи путей метаболизма гликолиза, глюконеогенеза и синтеза жирных кислот с циклом лимонной кислоты. Как следствие, активность PDH в высокой степени регулируется рядом аллостерических эффекторов и ковалентной модификацией.
При болезненных состояниях, таких как диабет типа 1 и типа 2, повышено окисление липидов при сопутствующем снижении утилизации глюкозы, которое вносит вклад в гипергликемию. Сниженная утилизация глюкозы при обоих типах диабета 1 и 2 ассоциирована со снижением активности PDH. Кроме того, дополнительным следствием сниженной активности PDH может быть то, что повышение концентрации пирувата приводит в результате к повышенной доступности лактата в качестве субстрата печеночного глюконеогенеза. Резонно ожидать, что повышение активности PDH может повысить скорость окисления глюкозы и, следовательно, общую утилизацию глюкозы в дополнение к сниженной выработке глюкозы в печени.
Другим фактором, вносящим вклад в сахарный диабет, является нарушенная секреция инсулина, которая, как показано, ассоциирована с пониженной активностью PDH в β-клетках поджелудочной железы (Zhou et al., Diabetes 45, 1996, 580-586).
Окисление глюкозы может давать больший выход АТФ на моль кислорода, чем окисление жирных кислот. В условиях, где потребность в энергии может превышать обеспечение энергии, таких как сердечная недостаточность и некоторые кардиомиопатии, ишемия миокарда, периферическое сосудистое заболевание (включая перемежающуюся хромоту), церебральная ишемия и реперфузия, мышечная слабость, гиперлипидемия, болезнь Альцгеймера и атеросклероз, можно ожидать, что сдвиг в равновесии утилизации субстрата в пользу метаболизма глюкозы за счет повышения активности PDH улучшит способность к поддержанию уровней АТФ и, следовательно, функции.
Как упомянуто выше, при диабетическом состоянии может быть полезна активация PDH посредством ингибирования глюконеогенеза и стимуляции расходования глюкозы в периферических тканях. Предварительные данные в подтверждение этого предположения были получены с использованием дихлорацетата (ДХА). Поиск новых низкомолекулярных ингибиторов PDHK, дающих возможность улучшенной эффективности и специфичности, идет в настоящее время на протяжении нескольких лет.
На основании вышесказанного очевидно, что определение активности PDH играет ключевую роль в диагностике некоторых расстройств и заболеваний. Кроме того, определение активности PDH является критическим при оценке ответа на лечение, например ответа на лечение лекарственными средствами, которые влияют на активность PDH, а именно повышают ее, а также при скрининге лекарственных средств, которые влияют на активность PDH.
Известны различные способы определения активности PDH, которые в целом могут быть разделены на тесты in vitro и in vivo.
В WO-A-2004/021000 раскрыты антитела, специфичные к PDH, которые могут быть использованы для иммунопреципитации PDH из образца от пациента в активном состоянии. Количество и/или активное состояние PDH может быть определено in vitro в иммунологическом анализе.
Тесты на активность PDH in vitro дополнительно раскрыты в WO-A-99/62506. Эти анализы представляют собой либо анализы in vitro с выделенными ферментами, которые включают подготовки, требующие затрат времени, такие как выделение посредством полимеразной цепной реакции (ПЦР) и клонирование PDH-киназы, либо клеточные анализы, которые требуют выделения первичных клеток.
Активность PDH in vivo может быть определена в анализе ex vivo путем извлечения образцов ткани (например, мышечной ткани или печеночной ткани), которые экстрагируют, как описано в WO-A-99/62506. Часть экстракта обрабатывают PDH-фосфатазой, полученной из свиных сердец, и активность необработанного образца сравнивают с активностью дефосфорилированного образца, полученного таким образом Stansbie et al., Biochem. J. 154 (1976), 225.
Следовательно, существует необходимость в новых и усовершенствованных способах определения активности PDH, особенно активности PDH in vivo.
В настоящее время обнаружено, что гиперполяризованный 13C-пируват может быть использован в качестве агента для определения активности PDH in vivo и in vitro путем использования 13C-МР обнаружения.
Как упомянуто выше, пируват является предшественником в цикле лимонной кислоты, и PDH катализирует окисление пирувата до ацетил-CoA и диоксида углерода (CO2), который находится в быстром равновесии с бикарбонатом (HCO3 -).
Обнаружено, что метаболическое преобразование гиперполяризованного 13C-пирувата в его метаболит гиперполяризованный 13C-лактат, гиперполяризованный 13C-бикарбонат (только в случае 13C1пирувата, 13C1,2-пирувата, 13C1,3-пирувата или 13C1,2,3-пирувата) и гиперполяризованный 13C-аланин можно использовать для исследования метаболических процессов в организме человека и животного, отличного от человека, используя МР. 13C1-пируват имеет T1 релаксации (время релаксации) в цельной крови человека при 37°C примерно 42 с, однако обнаружено, что преобразование гиперполяризованного 13C-пирувата в гиперполяризованный 13C-лактат, гиперполяризованный 13C-бикарбонат и гиперполяризованный 13C-аланин является достаточно быстрым, чтобы дать возможность обнаружения сигнала исходного соединения 13C-пирувата и его метаболитов. Количество аланина, бикарбоната и лактата зависит от метаболического статуса ткани при исследовании. Интенсивность МР-сигнала гиперполяризованного 13C-лактата, гиперполяризованного 13C-бикарбоната и гиперполяризованного 13C-аланина связана с количеством этих соединений и степенью поляризации, остающейся в момент обнаружения, следовательно, путем мониторинга преобразования гиперполяризованного 13C-пирувата в гиперполяризованный 13C-лактат, гиперполяризованный 13C-бикарбонат и гиперполяризованный 13C-аланин возможно исследовать метаболические процессы in vivo в организме человека или животного, отличного от человека, путем использования неинвазивной МР-визуализации или МР-спектроскопии.
Кроме того, обнаружено, что амплитуды МР-сигнала, возникающего от различных метаболитов пирувата, варьируют в зависимости от типа ткани. Уникальная картина метаболического пика, образуемого аланином, лактатом, бикарбонатом и пируватом, может быть использована в качестве характерного признака метаболического состояния исследуемой ткани и, таким образом, дает возможность отличить здоровую ткань от опухолевой ткани. Использование гиперполяризованного 13C-пирувата для визуализации опухоли, где опухолевая ткань проявляет высокую метаболическую активность, подробно описано в WO-A-2006/011810.
Кроме того, использование гиперполяризованного 13C-пирувата для визуализации сердца описано в WO-A-2006/054903.
Таким образом, в первом аспекте изобретения предложен способ определения активности PDH путем 13C-МР обнаружения с использованием среды визуализации, содержащей гиперполяризованный 13C-пируват, при котором обнаруживают сигнал 13C-бикарбоната и возможно 13C-пирувата.
Термин "определение активности PDH" означает исходное измерение активности PDH, включая измерение исходной скорости и определение константы скорости.
Термин "13C-МР обнаружение" означает 13C-МР визуализацию или 13C-МР спектроскопию либо комбинированную 13C-МР визуализацию и 13C-МР спектроскопию, то есть 13C-МР спектроскопическую визуализацию. Этот термин дополнительно означает 13C-МР спектроскопическую визуализацию в различные моменты времени.
Термин "среда визуализации" означает жидкую композицию, содержащую гиперполяризованный 13C-пируват в качестве МР-активного агента, то есть агента визуализации.
Среду визуализации, используемую в способе по изобретению, можно использовать в качестве среды визуализации для 13C-МР обнаружения in vivo, то есть у живых людей и животных, отличных от людей. Кроме того, среду визуализации, используемую в способе по изобретению, можно использовать в качестве среды визуализации для 13C-МР обнаружения in vitro, например, в клеточных культурах образцов организма, таких как кровь или цереброспинальная жидкость, ткань ех vivo, например ткань ех vivo, полученная в результате биопсии, или изолированные органы, все из которых имеют происхождение из организма человека или животного, отличного от человека.
Термин "13C-пируват" означает соль 13C-пировиноградной кислоты, которая является обогащенной изотопом 13C, то есть в которой количество изотопа 13C выше, чем его природное относительное содержание.
Изотопное обогащение гиперполяризованного 13C-пирувата, используемого в способе по изобретению, предпочтительно составляет по меньшей мере 75%, более предпочтительно по меньшей мере 80% и особенно предпочтительно по меньшей мере 90%, причем наиболее предпочтительно изотопное обогащение более 90%. Идеально, изотопное обогащение составляет 100%. 13C-пируват, используемый в способе по изобретению, должен быть обогащен изотопом по меньшей мере по С1-положению (далее обозначен как 13C1-пируват), поскольку именно C1-атом пирувата составляет часть диоксида углерода (и, следовательно, бикарбоната), образованного в результате PDH-катализируемого окисления пирувата. Кроме того, 13C-пируват, используемый в способе по изобретению, может быть обогащен изотопом по С1- и С2-положению (далее обозначен как 13C1,2-пируват), по С1- и С3-положению (далее обозначен как 13C1,3-пируват) или по С1-, С2- и С3-положению (далее обозначен как 13C1,2,3-пируват). Изотопное обогащение только по С1-положению предпочтительно, поскольку 13C1-пируват легко доступен и имеет благоприятно высокое время релаксации T1 в цельной крови человека при 37°C (примерно 42 с).
Термины "гиперполяризованный" и "поляризованный" здесь далее используют взаимозаменяемо и обозначают ими уровень ядерной поляризации свыше 0,1%, более предпочтительно свыше 1% и наиболее предпочтительно свыше 10%.
Уровень поляризации можно, например, определить путем измерений 13C-ЯМР твердого состояния в твердом гиперполяризованном 13C-пирувате, например в твердом гиперполяризованном 13C-пирувате, полученном путем динамической поляризации ядер (ДПЯ) 13C-пирувата. Измерение 13C-ЯМР твердого состояния предпочтительно состоит в записи ЯМР с простой импульсной последовательностью с использованием низкого угла отклонения вектора намагниченности. Интенсивность сигнала гиперполяризованного 13C-пирувата в ЯМР-спектре сравнивают с интенсивностью сигнала 13C-пирувата в ЯМР-спектре, снятом до процесса поляризации. Затем уровень поляризации вычисляют из отношения интенсивностей сигнала до и после поляризации.
Подобным образом, уровень поляризации для растворенного гиперполяризованного 13C-пирувата можно определить путем измерений ЯМР жидкого состояния. Снова интенсивность сигнала растворенного гиперполяризованного 13C-пирувата сравнивают с интенсивностью сигнала сравнительного образца известной композиции, например жидкой пировиноградной кислоты или пирувата натрия, растворенных в водном растворе. Затем уровень поляризации вычисляют из отношения интегралов сигнала гиперполяризованного 13C-пирувата и известного сравнительного образца, возможно скорректированного на относительные концентрации. Поляризацию можно также определить путем сравнения с сигналом термического равновесия того же образца 13C-пирувата после затухания гиперполяризации.
Гиперполяризация ЯМР активных 13C-ядер может быть достигнута различными способами, которые, например, описаны в WO-A-98/30918, WO-A-99/24080 и WO-A-99/35508, которые включены в данную заявку посредством ссылки, и способы гиперполяризации представляют собой перенос поляризации из инертного газа, "поляризацию накачкой", поляризацию охлаждением спинов, параводородный способ и динамическую поляризацию ядер (ДПЯ).
Для получения гиперполяризованного 13C-пирувата предпочтительно либо поляризовать 13C-пируват непосредственно, либо поляризовать 13C-пировиноградную кислоту и преобразовать поляризованную 13C-пировиноградную кислоту в поляризованный 13C-пируват, например, путем нейтрализации основанием.
Одним из подходящих путей получения гиперполяризованного 13C-пирувата является перенос поляризации из гиперполяризованного инертного газа, который описан в WO-A-98/30918. Инертные газы, имеющие ненулевой ядерный спин, можно подвергать гиперполяризации путем использования света с круговой поляризацией. Гиперполяризованный инертный газ, предпочтительно Не или Хе, или смесь таких газов можно использовать для осуществления гиперполяризации 13C-ядер. Гиперполяризованный газ может находиться в газовой фазе, либо он может быть растворен в жидкости/растворителе, либо сам гиперполяризованный газ может служить в качестве растворителя. Альтернативно, газ можно конденсировать на охлажденной твердой поверхности и использовать в этой форме, либо дать возможность его сублимации. Предпочтительно тщательное смешивание гиперполяризованного газа с 13C-пируватом или 13C-пировиноградной кислотой. Следовательно, если поляризуют 13C-пировиноградную кислоту, которая является жидкой при комнатной температуре, гиперполяризованный газ предпочтительно растворяют в жидкости/растворителе, либо она служит в качестве растворителя. Если поляризуют 13C-пируват, гиперполяризованный газ предпочтительно растворяют в жидкости/растворителе, который также растворяет пируват.
Другой подходящий путь для получения гиперполяризованного 13C-пирувата состоит в том, что поляризацию придают 13C-ядрам путем термодинамического равновесия при очень низкой температуре и сильном поле. Гиперполяризацию по сравнению с рабочим полем и температурой ЯМР-спектрометра осуществляют путем использования очень сильного поля и очень низкой температуры (поляризации накачкой). Используемая сила магнитного поля должна быть насколько возможно высокой, соответственно, выше 1 Т, предпочтительно выше 5 Т, более предпочтительно выше 15 Т или еще более и особенно предпочтительно 20 Т или более. Температура должна быть очень низкой, например 4,2 К или менее, предпочтительно 1,5 К или менее, более предпочтительно 1,0 К или менее, особенно предпочтительно 100 мК или менее.
Другим подходящим путем получения гиперполяризованного 13C-пирувата является способ поляризации охлаждением спинов. Этот способ охватывает поляризацию ядерных спинов твердого соединения или системы путем охлаждения. В систему вводят подходящие кристаллические парамагнитные вещества, такие как ионы Ni2+, лантаноида или актиноида с осью симметрии порядка трех или более, или тщательно смешивают с ними. Оборудование является более простым, чем необходимо для ДПЯ, без необходимости в однородном магнитном поле, поскольку поле возбуждения резонанса не прилагают. Этот процесс проводят путем физического вращения образца вокруг оси, перпендикулярной направлению магнитного поля. Предпосылка данного способа состоит в том, что парамагнитные частицы обладают высоким анизотропным g-фактором. В результате вращения образца электронный парамагнитный резонанс вступит в контакт с ядерными спинами, приводя к снижению температуры ядерных спинов. Вращение образца проводят до тех пор, пока поляризация ядерных спинов не достигнет нового равновесия.
В предпочтительном воплощении для получения гиперполяризованного 13C-пирувата используют ДПЯ (динамическую поляризацию ядер). При ДПЯ на поляризацию МР активных ядер в соединении, которое должно быть поляризовано, воздействует агент поляризации или так называемый ДПЯ-агент, соединение, содержащее неспаренные электроны. В процессе ДПЯ обеспечивают энергию, обычно в форме микроволнового излучения, которая исходно возбуждает ДПЯ-агент. При распаде до основного состояния происходит перенос поляризации от неспаренного электрона ДПЯ-агента на ЯМР активные ядра соединения, которое должно быть поляризовано, например на ядра 13C в 13C-пирувате. Как правило, в процессе ДПЯ используют среднее или сильное магнитное поле и очень низкую температуру, например, путем проведения процесса ДПЯ в жидком гелии и в магнитном поле примерно 1 Т или выше. Альтернативно, можно использовать среднее магнитное поле и любую температуру, при которой достигается достаточное усиление поляризации. Методика ДПЯ дополнительно описана, например, в WO-A-98/58272 и в WO-A-01/96895, оба документа включены в данную заявку посредством ссылки.
Для поляризации соединения способом ДПЯ готовят смесь соединения, которое должно быть поляризовано, и ДПЯ-агента ("образец"), которую либо замораживают и вносят в ДПЯ-поляризатор для поляризации, либо вносят в ДПЯ-поляризатор в виде жидкости, и она замерзает внутри указанного поляризатора вследствие очень низкой окружающей температуры. После поляризации замороженный твердый гиперполяризованный образец быстро переводят в жидкое состояние либо путем оттаивания, либо путем растворения его в подходящей среде растворения. Растворение является предпочтительным, и процесс растворения замороженного гиперполяризованного образца и подходящие устройства, таким образом, подробно описаны в WO-A-02/37132. Процесс оттаивания и подходящие устройства для оттаивания описаны, например, в WO-A-02/36005.
С целью получения высокого уровня поляризации в соединении, которое должно быть поляризовано, указанное соединение и ДПЯ-агент необходимо привести в тесный контакт во время процесса ДПЯ. Недопустимо, чтобы образец кристаллизовался при замораживании или охлаждении. Во избежание кристаллизации либо необходимо, чтобы в образце присутствовали стеклообразователи, либо для поляризации необходимо выбирать соединения, которые не кристаллизуются при замораживании, но вероятнее образуют стекловидное вещество.
Как упомянуто выше, 13C-пировиноградная кислота или 13C-пируват являются подходящими исходными веществами для получения гиперполяризованного 13C-пирувата.
Обогащенный изотопами 13C-пируват имеется в продаже, например, в виде 13C-пирувата натрия. Альтернативно, его можно синтезировать, как описано S.Anker, J. Biol. Chem 176, 1948, 133-1335.
В данной области техники известно несколько способов синтеза 13C1-пировиноградной кислоты. Вкратце, авторами Seebach et al., Journal of Organic Chemistry 40(2), 1975, 231-237 описан путь синтеза, который основан на защите и активации карбонилсодержащего исходного вещества, такого как S,S-ацеталь, например 1,3-дитиан или 2-метил-1,3-дитиан. Дитиан металлируют и подвергают взаимодействию с метилсодержащим соединением и/или 13CO2. Путем использования соответствующего обогащенного изотопами 13C-компонента, как подчеркнуто в данной ссылке, возможно получить 13C1-пируват или 13C1,2-пируват. Затем карбонильную функциональную группу высвобождают путем использования общепринятых способов, описанных в литературе. Другой путь синтеза начинается с уксусной кислоты, которую сначала преобразуют в ацетилбромид, а затем подвергают взаимодействию с Cu13CN. Полученный нитрил преобразуют в пировиноградную кислоту через амид (см., например, S.H.Anker et al., J. Biol. Chem. 176 (1948), 1333 или J.E.Thirkettle, Chem Commun. (1997), 1025). Кроме того, 13C-пировиноградная кислота может быть получена путем протонирования имеющегося в продаже 13C-пирувата натрия, например, способом, описанным в US 6232497, или способом, описанным в WO-A-2006/038811.
Гиперполяризация 13C-пировиноградной кислоты посредством ДПЯ подробно описана в WO-A1-2006/011809, которая включена в данную заявку путем ссылки. Вкратце, 13C-пировиноградную кислоту можно непосредственно использовать для ДПЯ, поскольку она образует стекловидное вещество при замораживании. После ДПЯ замороженную гиперполяризованную 13C-пировиноградную кислоту необходимо растворить и нейтрализовать, то есть преобразовать в 13C-пируват. Для этого преобразования необходимо сильное основание. Кроме того, поскольку 13C-пировиноградная кислота является сильной кислотой, необходимо выбрать ДПЯ-агент, который устойчив к данной сильной кислоте. Предпочтительным основанием является гидроксид натрия, и преобразование гиперполяризованной 13C-пировиноградной кислоты гидроксидом натрия приводит в результате к гиперполяризованному 13C-пирувату натрия, который является предпочтительным 13C-пируватом для среды визуализации, которую используют для МР-визуализации и/или спектроскопии in vivo, то есть МР-визуализации и/или спектроскопии, осуществляемой у живых людей или животных, отличных от людей.
Альтернативно, 13C-пируват, то есть соль 13C-пировиноградной кислоты, можно использовать для ДПЯ. Предпочтительными солями являются 13C-пируваты, которые содержат неорганический катион из группы, состоящей из NH4 +, K+, Rb+, Cs+, Ca2+, Sr2+ и Ва2+, предпочтительно NH4 +, K+, Rb+ или Cs+, более предпочтительно K+, Rb+, Cs+ и наиболее предпочтительно Cs+, как подробно описано в WO-A2-2007/111515, включенной в данную заявку посредством ссылки. Синтез этих предпочтительных 13C-пируватов также раскрыт в WO-A2-2007/111515. Если гиперполяризованный 13C-пируват используют в среде визуализации для МР-визуализации и/или спектроскопии in vivo, предпочтителен обмен неорганического катиона из группы, состоящей из NH4 +, К+, Rb+, Cs+, Са2+, Sr2+ и Ва2+, на физиологически очень хорошо переносимый катион, подобный Na4+ или меглумину. Это можно осуществить способами, известными в данной области техники, например использованием катионообменной колонки.
Дополнительными предпочтительными солями являются 13C-пируваты органического амина или аминного соединения, предпочтительно TRIS-13C1-пируват или меглумин-13C1-пируват, как подробно описано в WO-A2-2007/069909, включенной в данную заявку посредством ссылки. Синтез этих предпочтительных 13C-пируватов также раскрыт в WO-A2-2007/069909.
Если гиперполяризованный 13C-пируват, используемый в способе по изобретению, получают путем ДПЯ, образец для поляризации, содержащий 13C-пировиноградную кислоту или 13C-пируват и ДПЯ-агент, может дополнительно содержать ион парамагнитного металла. Обнаружено, что результатом присутствия ионов парамагнитного металла в композиции для поляризации путем ДПЯ являются повышенные уровни поляризации в 13C-пировиноградной кислоте/13C-пирувате, как подробно описано в WO-A2-2007/064226, которая включена в данную заявку посредством ссылки.
В другом воплощении среда визуализации, используемая в способе по изобретению, содержит гиперполяризованный 13C-пируват и малат. Таким образом, во втором аспекте изобретения предложен способ определения активности PDH путем 13C-МР обнаружения с использованием среды визуализации, содержащей малат и гиперполяризованный 13C-пируват, при котором обнаруживают сигнал 13C-бикарбоната и возможно 13C-пирувата.
В контексте данного изобретения термин "малат" означает соль яблочной кислоты. Малат не является гиперполяризованным.
Малат подходящим образом добавляют к гиперполяризованному 13C-пирувату после процесса поляризации. Возможно несколько путей добавления малата. Когда результатом процесса поляризации является жидкая композиция, содержащая гиперполяризованный 13C-пируват, малат можно растворить в указанной жидкой композиции, либо к жидкой композиции можно добавить раствор малата в подходящем растворителе, предпочтительно в водном носителе. Если результатом процесса поляризации является твердая композиция, содержащая гиперполяризованный 13C-пируват или 13C-пировиноградную кислоту, например, когда использована ДПЯ, малат можно добавить в среду растворения, которую используют для растворения твердой композиции, и растворить в ней. Например, 13C-пируват, поляризованный способом ДПЯ, можно растворить в водном носителе, таком как вода или буферный раствор, содержащий воду, включающем малат, либо 13C-пировиноградную кислоту, поляризованную способом ДПЯ, можно растворить в среде растворения, содержащей основание, для преобразования пировиноградной кислоты в пируват и малат. Альтернативно, малат можно добавить в конечную жидкую композицию, то есть в жидкую композицию после растворения/оттаивания, или в жидкую композицию после удаления ДПЯ-агента и/или возможного иона парамагнитного металла. Снова малат можно добавить в виде твердого вещества в жидкую композицию или предпочтительно растворить в водном растворителе, например в водном носителе, таком как вода или буферный раствор. Для стимуляции растворения малата в данной области техники известно несколько способов, таких как встряхивание, перемешивание, перемешивание на вортексе или обработка ультразвуком. Однако предпочтительны способы, которые являются быстрыми и не требуют перемешивающего устройства или способствуют приведению в контакт с жидкой композицией.
Соответственно, малат добавляют в форме яблочной кислоты или соли яблочной кислоты, предпочтительно малата натрия. Концентрация гиперполяризованного 13C-пирувата и малата в среде визуализации, используемой в способе по изобретению, примерно одинакова, либо малат присутствует при более низкой или более высокой концентрации, чем 13C-пируват. Если, например, среда визуализации содержит х М 13C-пирувата, она содержит х М или примерно х М или меньшее количество малата, но предпочтительно не менее чем одну десятую х М малата или большее количество малата, но предпочтительно не более чем трижды х М малата. В предпочтительном воплощении концентрация малата в среде визуализации, используемой в способе по изобретению, примерно равна или равна концентрации гиперполяризованного 13C-пирувата. Термин "примерно равная концентрация" означает концентрацию малата, которая составляет +/-30% концентрации 13C-пирувата, предпочтительно +/-20%, более предпочтительно +/-10%.
Используя среду визуализации, содержащую малат и гиперполяризованный 13C-пируват, можно установить природу регуляции PDH. Поток PDH может быть ингибирован либо посредством инактивации ферментного комплекса PDK, как описано ранее, либо также мгновенно посредством ингибирования конечным продуктом. Продемонстрировано, что повышенные соотношения NADH/NAD+ или ацетил-CoA/СоА снижают PDH-опосредованное окисление пирувата, и доступность оксалоацетата для включения ацетил-CoA в цикл Кребса является основной детерминантой внутримитохондриальной концентрации ацетил-CoA. Малат является промежуточным соединением окислительного метаболизма глюкозы и может поступать в цикл Кребса в виде оксалоацетата посредством анаплеротических последовательностей реакций для повышения общего углеродного потока. Не желая быть связанными этой гипотезой, авторы изобретения предполагают, что в результате введения среды визуализации, содержащей малат и гиперполяризованный 13C-пируват, степень ингибирования конечным продуктом на PDH может быть ограничена, и в случаях высокой активности PDH увеличен поток пирувата через ферментный комплекс, который можно определить способом по изобретению. В ситуациях низкой активности PDH авторы изобретения могут предположить, что ингибирование конечным продуктом менее важно, и что малат, присутствующий в среде визуализации, не должен влиять на поток пирувата через ферментный комплекс, который можно определить способом по изобретению.
В еще одном воплощении сам малат не присутствует в среде визуализации, но его вводят субъекту, подлежащему исследованию, то есть живому человеку или животному, отличному от человека, в клеточную культуру, в образец организма, такой как образцы крови, ткань ex vivo, такая как ткань, полученная в результате биопсии, или изолированный орган, перед введением среды визуализации, используемой в способе по изобретению.
Как упомянуто выше, среду визуализации согласно способу по изобретению можно использовать в качестве среды визуализации для определения активности PDH in vivo путем 13C-МР обнаружения, то есть у живых людей или животных, отличных от людей. Для этой цели среда визуализации предложена в виде композиции, которая подходит для введения в организм живого человека или животного, отличного от человека. Такая среда визуализации предпочтительно содержит в дополнение к МР активному агенту 13C-пирувату водный носитель, предпочтительно физиологически переносимый и фармацевтически приемлемый водный носитель, такой как вода, буферный раствор или физиологический раствор. Такая среда визуализации может дополнительно содержать общепринятые фармацевтические или ветеринарные носители или эксципиенты, например добавки для препаратов, которые являются общепринятыми для диагностических композиций в медицине или ветеринарии.
Кроме того, среду визуализации в соответствии со способом по изобретению можно использовать в качестве среды визуализации для определения активности PDH in vitro путем 13C-МР обнаружения, например, в клеточных культурах, образцах организма, таких как образцы крови, ткани ех vivo, такие как ткани, полученные в результате биопсии, или изолированные органы. Для этой цели среда визуализации предложена в виде композиции, которая подходит для добавления, например, к клеточным культурам, образцам крови, тканям ех vivo, таким как ткани, полученные в результате биопсии, или изолированным органам. Такая среда визуализации предпочтительно содержит, в дополнение к МР активному агенту 13C-пирувату, растворитель, который совместим с клеточными или тканевыми анализами in vitro, и который используют в этих анализах, например ДМСО, или метанол, или смесь растворителей, содержащую водный носитель и неводный растворитель, например смесь ДМСО и воды, либо буферного раствора или метанола и воды, либо буферный раствор. Как очевидно специалистам в данной области техники, фармацевтически приемлемые носители, эксципиенты и добавки для препаратов могут присутствовать в такой среде визуализации, но не требуются для такой цели.
Если среду визуализации, используемую в способе по изобретению, используют для определения активности PDH in vivo, то есть в организме живого человека или животного, отличного от человека, указанную среду визуализации предпочтительно вводят в указанный организм парентерально, предпочтительно внутривенно. Как правило, исследуемый организм помещают в МР-магнит. Специализированные 13C-МР радиочастотные катушки располагают для покрытия интересующей области. Точная дозировка и концентрация среды визуализации будет зависеть от ряда факторов, таких как токсичность и путь введения. Подходящим образом, среду визуализации вводят при концентрации вплоть до 1 ммоль пирувата на кг массы тела, предпочтительно от 0,01 до 0,5 ммоль/кг, более предпочтительно от 0,1 до 0,3 ммоль/кг. Менее чем через 400 с после введения, предпочтительно менее чем через 120 с, более предпочтительно менее чем через 60 с после введения применяют последовательность МР-визуализации, предпочтительно последовательность, которая кодирует интересующий объем при составной частоте и пути пространственного выбора. Точное время применения последовательности МР в высокой степени зависит от интересующего объема и от вида.
Если среду визуализации, используемую в способе по изобретению, используют для определения активности PDH in vitro, указанная среда визуализации составляет от 1 мМ до 100 мМ по 13C-пирувату, более предпочтительно от 20 мМ до 90 мМ и наиболее предпочтительно от 40 до 80 мМ по 13C-пирувату.
Активность PDH может быть определена в соответствии со способом по изобретению путем обнаружения сигнала 13C-бикарбоната и возможно сигнала 13C-пирувата. Это определение основано на приведенной ниже реакции, которая проиллюстрирована для 13C1-пирувата; * обозначает 13C-метку:
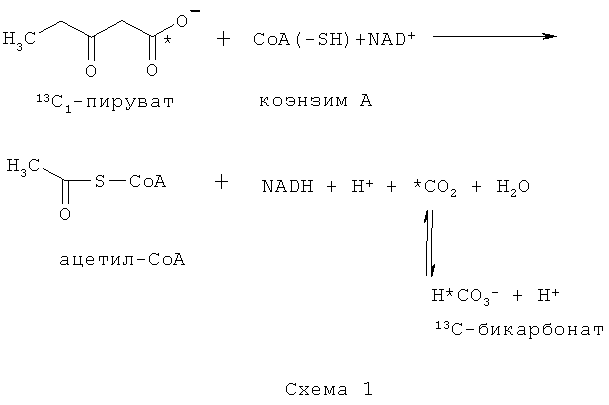
Согласно схеме 1 сниженная активность PDH проявляется в сниженном образовании диоксида углерода и, следовательно, в сниженном сигнале 13C-бикарбоната. При физиологическом pH равновесие CO2/бикарбонат сдвинуто в сторону бикарбоната.
Термин "сигнал" в контексте изобретения относится к амплитуде МР-сигнала либо к интегралу или площади пика по отношению к фону в спектре 13C-МР, который представляет 13C-бикарбонат и возможно 13C-пируват. В предпочтительном воплощении сигнал представляет собой площадь пика.
В предпочтительном воплощении обнаруживают сигналы 13C-бикарбоната и 13C-пирувата.
В предпочтительном воплощении способа по изобретению вышеупомянутый сигнал 13C-бикарбоната и возможно 13C-пирувата используют для создания метаболического профиля, который является показателем активности PDH. Если способ по изобретению осуществляют in vivo, то есть у живого человека или животного, отличного от человека, указанный метаболический профиль может быть снят со всего организма, например, получен путем 13C-МР обнаружения in vivo на всем организме. Альтернативно, указанный метаболический профиль создают с интересующей области или объема, то есть с определенной ткани, органа или части указанного организма человека или животного, отличного от человека.
В другом предпочтительном воплощении способа по изобретению вышеупомянутый сигнал 13C-бикарбоната и возможно 13C-пирувата используют для создания метаболического профиля клеток в клеточной культуре, образцов из организма, таких как образцы крови, ткани ex vivo, такой как ткань, полученная при биопсии, или изолированного органа, имеющего происхождение из человека или животного, отличного от человека. Указанный метаболический профиль затем создают путем 13C-МР обнаружения in vitro.
Таким образом, в предпочтительном воплощении предложен способ определения активности PDH путем 13C-МР обнаружения с использованием среды визуализации, содержащей гиперполяризованный 13C-пируват, при котором обнаруживают сигнал 13C-бикарбоната и возможно 13C-пирувата, и где указанный сигнал или указанные сигналы используют для создания метаболического профиля.
В предпочтительном воплощении для создания указанного метаболического профиля используют сигналы 13C-бикарбоната и 13C-пирувата.
В одном воплощении для создания метаболического профиля используют интенсивность спектрального сигнала 13C-бикарбоната и возможно 13C-пирувата. В другом воплощении для создания метаболического профиля используют интеграл спектрального сигнала 13C-бикарбоната и возможно 13C-пирувата. В другом воплощении для создания метаболического профиля используют интенсивности сигналов от отдельных изображений 13C-бикарбоната и возможно 13C-пирувата. В еще одном воплощении интенсивности сигнала 13C-бикарбоната и возможно 13C-пирувата получают в двух или более чем двух временных точках для вычисления скорости изменения 13C-бикарбоната и возможно 13C-пирувата.
В другом воплощении метаболический профиль включает использование данных обработанных сигналов 13C-бикарбоната и возможно 13C-пирувата или получен из них, например отношений сигналов, скорректированных сигналов или информации по динамической или метаболической константе скорости, выведенной на основании картины сигналов множественных МР обнаружений, то есть спектров или изображений. Таким образом, в предпочтительном воплощении скорректированный сигнал 13C-бикарбоната, то есть отношение сигнала 13C-бикарбоната к сигналу 13C-пирувата, включают в метаболический профиль или используют для его создания. В следующем предпочтительном воплощении сигнал 13C-бикарбоната, скорректированный по суммарному сигналу 13C-углерода, включают в метаболический профиль или используют для его создания, где суммарный сигнал 13C-углерода представляет собой сумму сигналов 13C-бикарбоната и 13C-пирувата. В более предпочтительном воплощении отношение сигнала 13C-бикарбоната к сигналу 13C-пирувата включают в метаболический профиль или используют для его создания.
Метаболический профиль, созданный в предпочтительном воплощении способа согласно изобретению, является показателем для активности PDH исследуемого организма, части организма, клеток, ткани, образца из организма и так далее, и указанную полученную информацию можно использовать на последующей стадии для различных целей.
Одной из этих целей может быть оценка соединений, которые изменяют активность PDH, предпочтительно соединений, которые повышают активность PDH. Соединение, которое повышает активность PDH, может потенциально иметь ценность при лечении болезненных состояний, ассоциированных с нарушениями утилизации глюкозы, таких как сахарный диабет, ожирение (Curto et al., Int. J. Obes. 21, 1997, 1137-1142) и лактацидемия. Кроме того, можно ожидать, что такое соединение полезно при заболеваниях, где снабжение тканей энергетически богатыми субстратами ограничено, таких как периферическое сосудистое заболевание (включая перемежающуюся хромоту), сердечная недостаточность и некоторые кардиомиопатии, мышечная слабость, гиперлипидемии и атеросклероз (Stacpoole et al., N. Engl. J. Med. 298, 1978, 526-530). Соединение, которое активирует PDH, может быть также полезно при лечении болезни Альцгеймера (Gibson et al., J. Neural. Transm. 105, 1998, 855-870).
В одном воплощении способ по изобретению осуществляют in vitro, и полученную информацию используют при оценке эффективности потенциальных лекарственных средств, которые изменяют активность PDH, например, при разработке лекарственных средств и/или в процессе скрининга. В таком воплощении способ по изобретению можно осуществлять в подходящих клеточных культурах или ткани. Клетки или ткань приводят в контакт с потенциальным лекарственным средством, и активность PDH определяют путем 13C-МР обнаружения согласно способу по изобретению. Информация об эффективности потенциального лекарственного средства может быть получена путем сравнения активности PDH обработанных клеток или ткани с активностью PDH необработанных клеток или ткани. Альтернативно, варьирование активности PDH можно определить путем определения активности PDH клеток или ткани до и после обработки. Такую оценку эффективности лекарственного средства можно осуществлять, например, на микропланшетах, которые дают возможность параллельного тестирования различных потенциальных лекарственных средств и/или различных доз потенциальных лекарственных средств и, следовательно, дают возможность для скрининга с высоким выходом.
В другом воплощении способ по изобретению осуществляют in vivo, и полученную информацию используют при оценке эффективности потенциальных лекарственных средств, которые изменяют активность PDH in vivo. В таком воплощении способ можно осуществлять, например, на подопытных животных или на добровольцах в клиническом испытании. Подопытному животному или добровольцу вводят потенциальное лекарственное средство и определяют активность PDH путем 13C-МР обнаружения согласно способу по изобретению. Информация об эффективности потенциального лекарственного средства может быть получена путем определения варьирования активности PDH до и после введения, например, за определенный период времени при повторном введении. Такую оценку эффективности лекарственного средства можно проводить в доклиническом исследовании (подопытные животные) или в клинических испытаниях.
В другом воплощении способ по изобретению осуществляют in vivo или in vitro, и полученную информацию используют для оценки ответа на лечение и/или для определения эффективности лечения у больных пациентов, проходящих лечение от этого заболевания. Если, например, пациента с диабетом лечат противодиабетическим лекарственным средством, которое, как ожидают, повышает активность PDH, данную активность PDH можно определить согласно способу по изобретению. Подходящим образом, активность PDH определяют способом по изобретению перед началом лечения указанным противодиабетическим лекарственным средством, а затем после этого, например, за определенный период времени. Путем сравнения исходной активности PDH с активностью PDH во время и после лечения возможно оценить, проявляет ли противодиабетическое лекарственное средство вообще какое-либо положительное влияние на активность PDH, и, если проявляет, то в какой степени. Для осуществления способа по изобретению для вышеупомянутой цели in vitro, конечно, необходимо, чтобы можно было получить подходящие образцы от пациента, проходящего лечение, например образцы ткани или образцы из организма, такие как образцы крови.
Как указано выше, информацию, полученную способом по изобретению, можно использовать на последующей стадии для различных целей.
Другая цель может состоять в получении достоверной информации о болезненных состояниях, например, при идентификации пациентов группы риска, раннем обнаружении заболеваний, оценке прогрессирования заболевания, тяжести и осложнений, связанных с заболеванием.
Таким образом, в одном воплощении способ по изобретению осуществляют in vivo или in vitro, и полученную информацию используют для идентификации пациентов группы риска развития заболевания и/или для профилактических мер во избежание развития заболевания. Диагностика диабета 2 типа часто запаздывает, до тех пор пока не появляются осложнения (Harris et al., Diabetes Metab. Res. Rev. 16, 2001, 230-236). Раннее лечение предупреждает некоторые из наиболее поражающих осложнений, но, поскольку современные методы лечения диабета 2 типа остаются неадекватными, предупреждение является в высокой степени предпочтительным. Остается необходимость в определении оптимальных подходов к идентификации пациентов группы риска и/или кандидатов для проведения профилактических мер, таких как изменение образа жизни, включающее низкокалорийную диету с низким содержанием жиров и физическую активность. Обычные подходы включают тесты на толерантность к глюкозе и измерения глюкозы в плазме натощак, однако пациенты группы риска еще не страдают гипергликемией и, следовательно, их не идентифицируют этими тестами. Поэтому было бы полезно иметь способ, полезный для идентификации пациентов группы риска по развитию диабета 2 типа и идентификации кандидатов на профилактические меры. Способ по изобретению может предоставить необходимую информацию для осуществления этой идентификации. В данном воплощении способ по изобретению можно применять для определения исходной активности PDH в первый момент времени и для осуществления последующих определений активности PDH за период времени с определенной частотой, например каждые полгода или ежегодно. Можно ожидать, что снижение активности PDH укажет на повышенный риск развития прогрессирования диабета 2 типа, и скорость снижения может быть использована врачом для принятия решения о начале профилактических мер и/или лечения. Кроме того, результаты определения активности PDH по времени можно объединить с результатами тестов на толерантность к глюкозе и измерений глюкозы в плазме натощак, и объединенные результаты можно использовать для принятия решения о профилактических мерах и/или лечении. Для осуществления способа по изобретению для вышеупомянутой цели in vitro, конечно, необходимо, чтобы можно было получить подходящие образцы от пациента, проходящего лечение, например образцы ткани или образцы из организма, такие как образцы крови.
В другом воплощении способ по изобретению осуществляют in vivo или in vitro, и полученную информацию используют для раннего обнаружения заболеваний. Для некоторых нейродегенеративных заболеваний, включая болезнь Альцгеймера, сообщали о сниженной активности PDH. Для болезни Альцгеймера этот эффект специфичен для определенных областей головного мозга, и он наиболее выражен в теменной и височной долях. Ранняя диагностика таких нейродегенеративных заболеваний дала бы возможность раннего вмешательства. Способ по изобретению может предоставить необходимую информацию для осуществления такой ранней диагностики. В данном воплощении способ по изобретению можно применять для определения исходной активности PDH и сравнения ее с нормальной активностью PDH, например с активностью PDH у здоровых субъектов, или для определения исходной активности PDH в определенных областях головного мозга, о которой известно, что она поражена определенным нейродегенеративным заболеванием, и сравнения ее с активностью PDH в областях головного мозга, о которых известно, что они не поражены указанным заболеванием. Активность PDH можно предпочтительно использовать для ранней диагностики в сочетании с другими клиническими маркерами и/или симптомами, характерными, например, для болезни Альцгеймера. Для осуществления способа по изобретению для вышеупомянутой цели in vitro, конечно, необходимо, чтобы можно было получить подходящие образцы от пациента, проходящего лечение, например спинномозговую жидкость.
В еще одном воплощении способ по изобретению осуществляют in vivo или in vitro, и полученную информацию используют для мониторинга прогрессирования заболевания. Это может быть полезно для заболеваний или расстройств, где заболевание не прогрессировало до уровня, при котором показано или рекомендовано лечение, например, в связи с тяжелыми побочными эффектами, связанными с указанным лечением. В такой ситуации выбор действия представляет собой "внимательное ожидание", то есть пациента тщательно наблюдают на прогрессирование заболевания и раннее обнаружение ухудшения. В данном воплощении способ по изобретению можно применять для определения исходной активности PDH и для осуществления последующих определений активности PDH за период времени с определенной частотой. Можно ожидать, что снижение активности PDH укажет на прогрессирование и ухудшение заболевания, и указанное снижение может быть использовано врачом для принятия решения о начале лечения. Для осуществления способа по изобретению для вышеупомянутой цели in vitro, конечно, необходимо, чтобы можно было получить подходящие образцы от пациента, проходящего лечение, например образцы ткани или образцы из организма, такие как образцы крови.
В еще одном воплощении способ по изобретению осуществляют in vivo или in vitro, и полученную информацию используют для определения тяжести заболевания. Часто заболевания прогрессируют от их возникновения с течением времени. В зависимости от вида симптомов и/или обнаружения определенных клинических маркеров заболевания характеризуются определенными стадиями, например ранней (легкой) стадией, средней (умеренной) стадией и тяжелой (поздней) стадией. Более уточненные стадии являются общими для некоторых заболеваний. Известно, что ряд клинических маркеров используют для определения стадии заболевания, включая более специфичные, такие как определенные ферменты или экспрессия белков, а также более общие, такие как показатели крови, уровни электролитов и так далее. В данном контексте активность PDH может представлять собой такой клинический маркер, который используют, отдельно или в сочетании с другими маркерами и/или симптомами, для определения стадии заболевания и, следовательно, тяжести заболевания. Следовательно, может быть возможно применение способа по изобретению для определения активности PDH у пациента количественным путем и на основании значения активности PDH определения стадии заболевания пациента. Диапазоны PDH, которые характерны для определенной стадии заболевания, могут быть установлены путем определения активности PDH согласно способу по изобретению у пациентов, страдающих, например, заболеванием на ранней, средней и поздней стадии, и определения диапазона активности PDH, который характерен для определенной стадии.
В еще одном воплощении способ по изобретению осуществляют in vivo или in vitro, и полученную информацию используют для идентификации и оценки осложнений, связанных с заболеванием. Некоторые заболевания, например диабет, могут вызвать множество осложнений, не только острых, таких как гипогликемия, кетоацидозная или некетонная гиперосмолярная кома, но также долговременные осложнения, относящиеся к органам, включая сердечно-сосудистое заболевание, почечное повреждение и/или недостаточность и повреждение сетчатки. В зависимости от того, поражает ли диабет и до какой степени поражает органы, такие как сердце или почки, необходимо модифицировать лечение заболевания таким образом, чтобы оно было направлено на эти повреждения и вызывало их обратное развитие. В способе по изобретению можно определять активность PDH специфично для органов, например, путем 13C-МР обнаружения in vivo, проводимого с поверхностными катушками, помещенными над сердцем или почками. Можно ожидать, что низкая активность PDH в сердце или почках является показателем поражения указанного органа, например, диабетом (Huang et al., Diabetes 52, 2003, 1371-1376).
Поскольку на активность PDH влияет ряд факторов, таких как состояние питания, доступность/состояние кислорода, инсулин, и ряд кофакторов, важно контролировать эти факторы, например, путем обеспечения пациентов планом диеты или стандартизованными продуктами питания перед осуществлением способа по изобретению. Также обнаружено, что пациент не должен голодать, поскольку это может привести в результате к сниженному сигналу 13C-бикарбоната.
В одном аспекте изобретения активность PDH целенаправленно и регулируемо модулируют путем перорального или парентерального введения, например, глюкозы, жирных кислот или кетоновых тел. Кислородный статус можно модулировать путем воздействия на вдыхаемый газ до осуществления способа по изобретению или фармацевтически путем индукции стресса или изменения перфузии.
В другом воплощении активность PDH определяют описанным способом, но последовательно или одновременно с количественным определением метаболизма жирных кислот, либо перед ним. Как описано выше, ацетил-CoA образуется в результате гликолиза или метаболизма жирных кислот, и сдвиг от одного к другому составляет часть многих болезненных состояний. В дополнение к прямому определению активности PDH способом по изобретению, косвенная мера активности PDH путем измерения метаболизма жирных кислот была бы дополняющей и важной. Метаболизм жирных кислот может быть количественно определен путем введения среды визуализации, содержащей гиперполяризованный 13C-ацетат, и 13C-МР обнаружения сигналов от метаболита 13C-ацетилкарнитина и возможно 13C-ацетил-CoA или 13C-ацетил-CoA и исходного соединения 13C-ацетата.
Таким образом, другой аспект изобретения составляет способ определения активности PDH путем 13C-МР обнаружения с использованием среды визуализации, содержащей гиперполяризованный 13C-пируват и гиперполяризованный 13C-ацетат, при котором обнаруживают сигналы 13C-бикарбоната и возможно 13C-пирувата и сигналы 13C-ацетилкарнитина и возможно 13C-ацетил-CoA или 13C-ацетил-CoA и 13C-ацетата.
Еще один аспект изобретения составляет способ определения активности PDH путем 13C-МР обнаружения с использованием среды визуализации, содержащей гиперполяризованный 13C-пируват, при котором обнаруживают сигналы 13C-бикарбоната и возможно 13C-пирувата, и где до или после этого 13C-МР обнаружения осуществляют 13C-МР обнаружение с использованием среды визуализации, которая содержит гиперполяризованный 13C-ацетат, и где обнаруживают сигналы 13C-ацетилкарнитина и возможно 13C-ацетил-CoA или 13C-ацетил-CoA и 13C-ацетата.
13C-пируват и 13C-ацетат можно подвергать гиперполяризации и вводить одновременно, поскольку ожидают, что среда визуализации, содержащая гиперполяризованный 13C-пируват и гиперполяризованный 13C-ацетат, дает более точное и полное определение активности PDH.
Анатомическая и/или, где подходит, перфузионная информация может быть включена в способ по изобретению при осуществлении in vivo. Анатомическая информация может быть, например, получена путем снятия протонного или 13C-МР изображения с применением или без применения подходящего контрастного агента до или после способа по изобретению.
Среда МР-визуализации, содержащая малат и гиперполяризованный 13C-пируват, как обсуждено выше, является новой, следовательно, в другом аспекте изобретения предложена среда МР-визуализации, содержащая малат и гиперполяризованный 13C-пируват.
Кроме того, среда визуализации, содержащая гиперполяризованный 13C-пируват и гиперполяризованный 13C-ацетат, как обсуждено выше, является новой, следовательно, в еще одном аспекте изобретения предложена среда МР-визуализации, содержащая 13C-пируват и гиперполяризованный 13C-ацетат.
Как упомянуто и подробно обсуждено выше, среду МР-визуализации согласно изобретению, то есть среду МР-визуализации, содержащую малат и гиперполяризованный 13C-пируват, и среду МР-визуализации, содержащую 13C-пируват и гиперполяризованный 13C-ацетат, можно использовать в способе определения активности PDH путем 13C-МР обнаружения.
Среду визуализации согласно изобретению можно использовать в качестве среды визуализации in vivo, то есть у живых людей и животных, отличных от людей. Для этой цели среда визуализации предложена в виде композиции, подходящей для введения в организм живого человека или животного, отличного от человека. Такая среда визуализации предпочтительно содержит, в дополнение к МР активному агенту 13C-пирувату или 13C-пирувату и 13C-ацетату или малату и МР активному агенту 13C-пирувату, водный носитель, предпочтительно физиологически переносимый и фармацевтически приемлемый водный носитель, такой как вода, буферный раствор или физиологический раствор. Такая среда визуализации может дополнительно содержать общепринятые фармацевтические или ветеринарные носители или эксципиенты, например добавки для препаратов, такие, которые являются общепринятыми для диагностических композиций в медицине или ветеринарии.
Кроме того, среду визуализации согласно изобретению можно использовать в качестве среды визуализации in vitro, то есть в клеточных культурах, образцах из организма, таких как образцы крови, тканях ex vivo, такие как ткань после биопсии, или изолированных органах. Для этой цели среда визуализации предложена в виде композиций, подходящих для добавления, например, к клеточным культурам, образцам крови, тканям ех vivo, таким как ткань после биопсии, или изолированным органам. Такая среда визуализации предпочтительно содержит, в дополнение к МР активному агенту 13C-пирувату или 13C-пирувату и 13C-ацетату или малату и МР активному агенту 13C-пирувату, растворитель, который совместим с клеточными или тканевыми анализами in vitro, или который используют для них, например ДМСО или метанол, либо смесь растворителей, содержащую водный носитель и неводный растворитель, например смеси ДМСО и воды или буферного раствора, либо метанола и воды или буферного раствора. Как очевидно специалисту в данной области техники, фармацевтически приемлемые носители, эксципиенты и добавки для препаратов могут присутствовать в таких средах визуализации, но не требуются для этой цели.
Краткое описание графических материалов
На Фиг.1 показано сравнение отношения амплитуды пика 13C-бикарбоната к 13C-пирувату до ("STZ-pre") и после ("STZ-post") инъекции стрептозотоцина (STZ) крысам для индукции модели диабета 1 типа. "*" обозначает р=0,01.
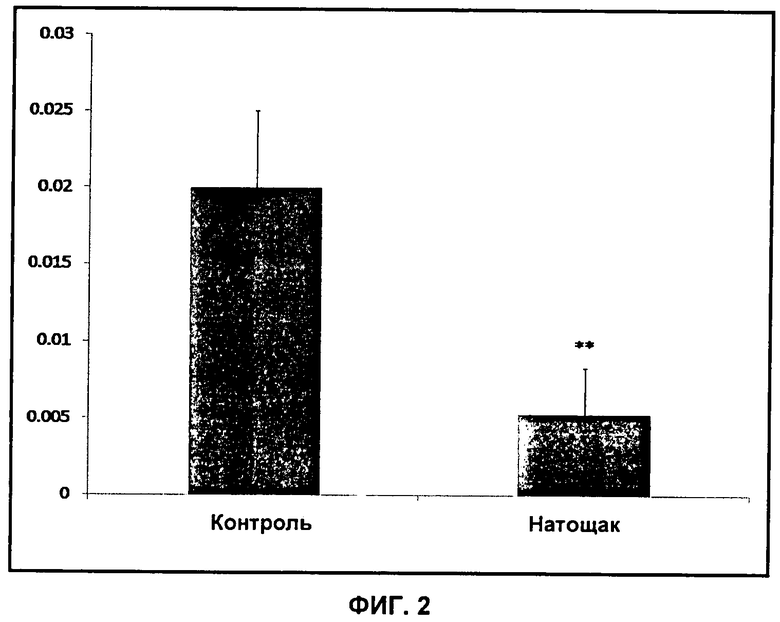
На Фиг.2 показан эффект голодания ("натощак") на отношение амплитуды пика 13C-бикарбоната к 13C-пирувату у крыс. "**" обозначает p<0,0001.
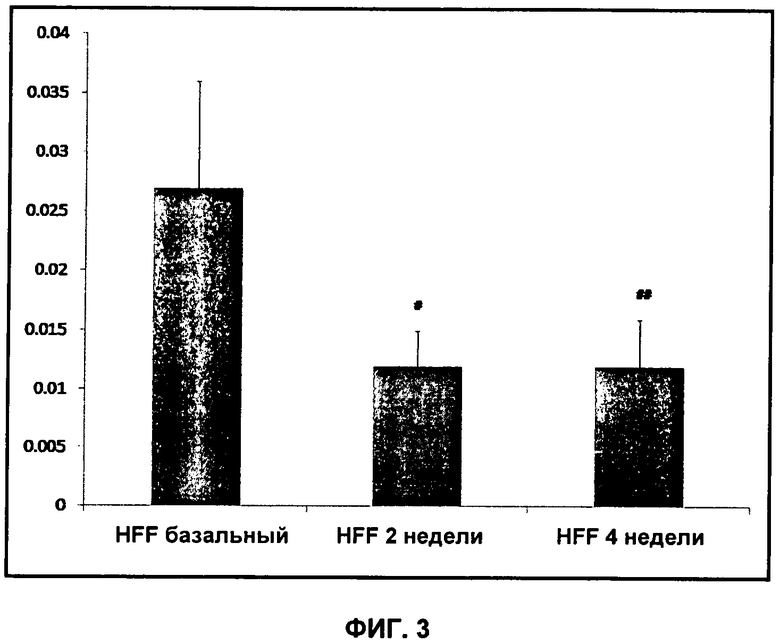
На Фиг.3 показано изменение отношения амплитуды пика 13C-бикарбоната к 13C-пирувату по времени (2 недели и 4 недели) для крыс на рационе с высоким содержанием жиров ("HFF") по сравнению с базальным уровнем. "#" обозначает p<0,002, "##" обозначает p<0,005.
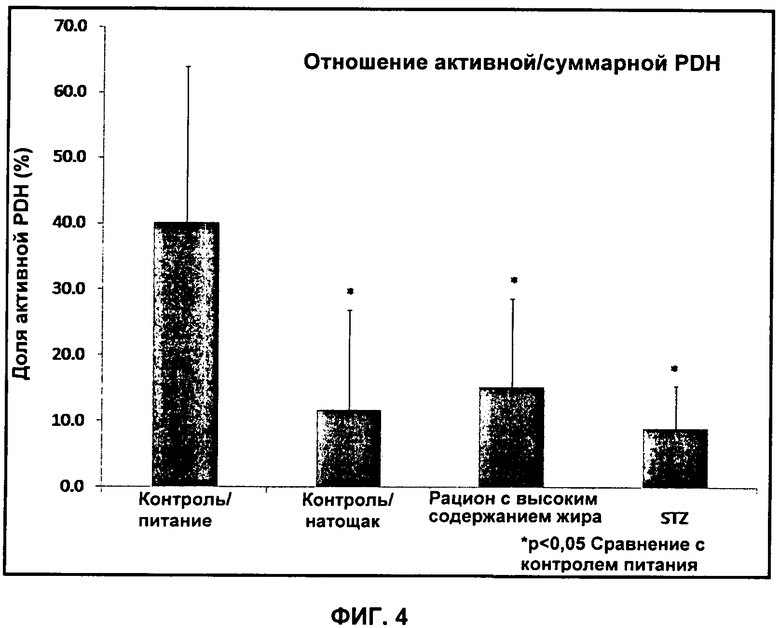
На Фиг.4 показано отношение активной/суммарной PDH (%) для питающихся крыс ("контроль питания"), голодающих крыс ("контроль натощак"), крыс на рационе с высоким содержанием жиров ("High Fat Fed") и крыс с диабетом ("STZ").
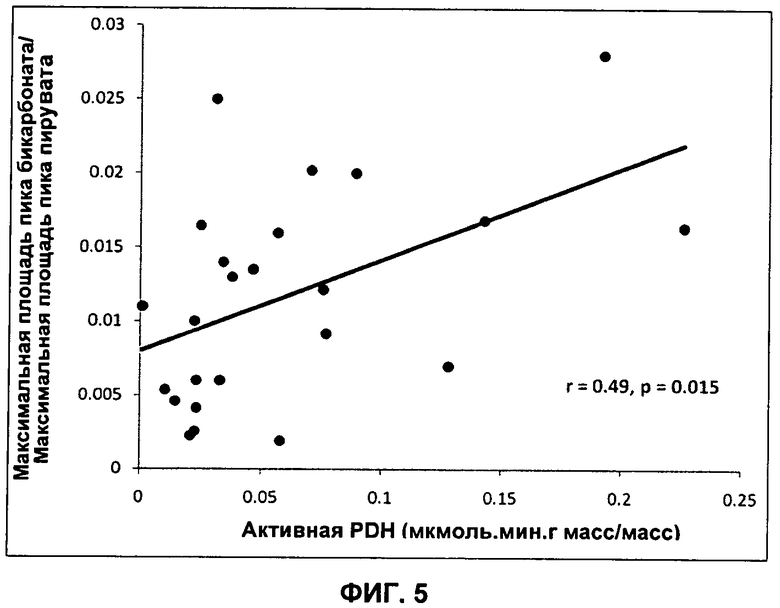
На Фиг.5 показана корреляция между активностью PDH, измеренной на ткани сердца ex vivo (протокол описан ранее авторами Seymour et al (Seymour, A.M. & Chatham, J.C. (1997) J Mol Cell Cardiol 29, 2771-2778), и определение активности PDH согласно способу по изобретению путем измерения отношения амплитуды пика 13C-бикарбоната к 13C-пирувату.
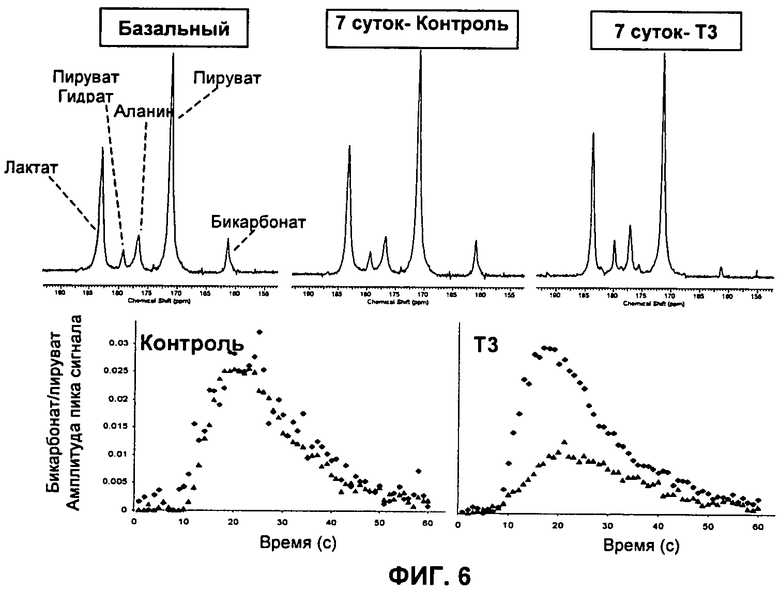
На Фиг.6 показаны в ее верхней части активные усредненные МР-спектры, снятые у крыс до ("базальный") и после индукции гипертиреоза (7 суток - Т3) и в сравнении с МР-спектрами, снятыми в контрольной группе (7 суток - контроль). В нижней части Фиг.6 показано сравнение отношения амплитуды пика 13C-бикарбоната к 13C-пирувату на сутки 7 группы с заболеванием (Т3) и контрольной группы (Контроль) (серые треугольники) по сравнению с базальным уровнем (черные ромбики).
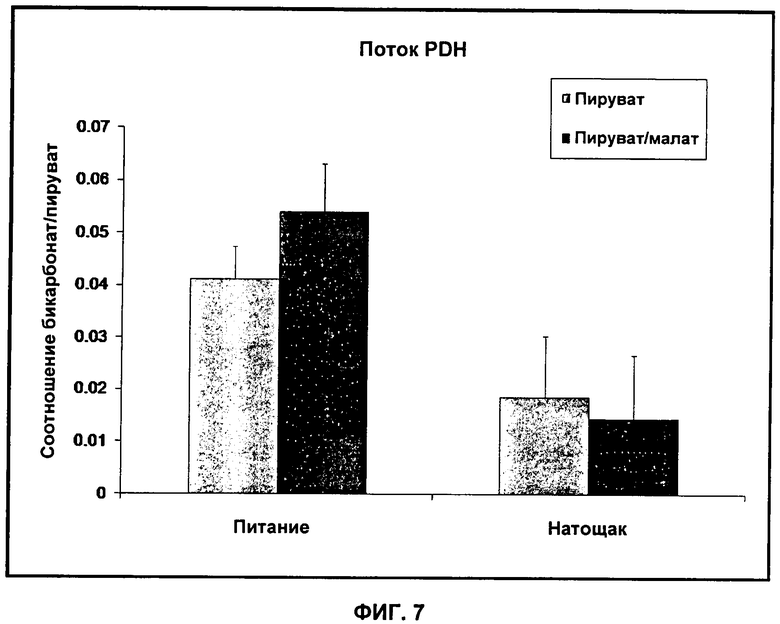
На Фиг.7 показано сравнение отношения 13C-бикарбоната к 13C-пирувату у питающихся крыс и голодающих крыс после инъекции гиперполяризованного 13C-пирувата (светло-серые столбцы) или смеси гиперполяризованного 13C-пирувата и малата (темно-серые столбцы).
Примеры
Далее термины пируват, 13C-пируват и 13C1-пируват используют взаимозаменяемо, и все они обозначают 13C1-пируват. Подобным образом, термины пировиноградная кислота, 13C-пировиноградная кислота и 13C-пировиноградная кислота используют взаимозаменяемо, и все они обозначают 13C1-пировиноградную кислоту.
Пример 1. Получение среды визуализации, содержащей гиперполяризованный 13С1-пируват, полученный способом ДПЯ
Трис(8-карбокси-2,2,6,6-(тетра(гидроксиэтил)-бензо-[1,2-4,5']-бис-(1,3)-дитиол-4-ил)-метил-натриевую соль (тритиловый радикал), который синтезирован в соответствии с примером 7 WO-A1-98/39277, добавляли к 13C-пировиноградной кислоте (40 мМ) в пробирке с получением композиции, составляющей 15 мМ по тритиловому радикалу. Далее готовили водный раствор Gd-хелата 1,3,5-трис-(N-(DO3A-ацетамидо)-N-метил-4-амино-2-метилфенил)-[1,3,5]триазинан-2,4,6-триона (иона парамагнитного металла), который синтезирован в соответствии с примером 4 WO-A-2007/064226, и 0,8 мкл (14,6 мМ) добавляли в пробирку с 13C1-пировиноградной кислотой и тритиловым радикалом.
Композицию переносили из пробирки в кювету для образца, и эту кювету для образца вносили в ДПЯ-поляризатор. Композицию подвергали поляризации в условиях ДПЯ при 1,2 К в магнитном поле 3,35 Т при микроволновом облучении (93,89 ГГц) в течение 45 мин.
Затем композицию растворяли в водном растворе гидроксида натрия, Трис-буфере и ЭДТА при давлении 10 бар (1 МПа) и температуре 170°C. Полученная в результате среда визуализации содержала 80 мМ гиперполяризованного 13C1-пирувата натрия при pH 7,2-7,9 с поляризацией примерно 30% во время введения.
Пример 2. Определение активности PDH согласно способу по изобретению в животных моделях заболевания диабета
В данное исследование были включены три группы самцов крыс Вистар для исследования как диабета I типа, так и инсулинорезистентности, предшествующей диабету II типа.
Исходную активность PDH (базальный уровень) определяли в первой группе из 6 крыс согласно Примеру 3. Затем у всех крыс индуцировали диабет I типа с помощью одной внутрибрюшинной инъекции свежеприготовленного стрептозотоцина (STZ; 50 мг/кг массы тела) в 50 мМ холодном цитратном буфере (pH 4,5). Через пять суток после индукции STZ-диабета снова определяли активность PDH, где каждая крыса служила собственным экспериментальным контролем. Сравнение отношения амплитуды пика 13C-бикарбоната к 13C-пирувату до и после инъекции STZ четко показывает снижение указанного отношения и, следовательно, снижение активности PDH (Фиг.1).
Затем крыс восстанавливали и умерщвляли спустя 1 ч с помощью внутрибрюшинной инъекции пентобарбитала натрия для анализа тканевых препаратов и плазмы крови. Сердце, легкое, печень, а также камбаловидную и икроножную мышцы быстро вырезали, сразу замораживали, используя охлажденные N2 алюминиевые щипцы, и хранили при -80°C для последующего анализа. Примерно 3 мл крови отбирали из грудной полости после вырезания сердца. Кровь сразу центрифугировали (3200 об/мин в течение 10 мин при 4°C) и отделяли плазму. Отделяли 200 мкл аликвоту плазмы и добавляли ингибитор липопротеинлипазы тетрагидролипостатин (ТГЛ) для анализа неэтерифицированных жирных кислот (НЭЖК). Все образцы плазмы сразу замораживали и хранили при -80°C. АВХ Pentra 400 (Horiba ABX Diagnostics, Montpelier, France) использовали для проведения анализа на глюкозу плазмы, НЭЖК (Wako Diagnostics, Richmond, USA) и 3-р-гидроксибутират (Randox, Co. Antrim, UK). Инсулин плазмы измеряли, используя твердофазный иммуноферментный анализ (ELISA) на инсулин крысы (Mercodia, Uppsala, Sweden).
Вторую группу крыс (n=12) делили на 2 подгруппы и в каждой подгруппе определяли исходную активность PDH (базальный уровень) согласно Примеру 3.
Первая подгруппа ("натощак") голодала в течение ночи перед каждым определением активности PDH, причем корм удаляли в 18.00 ч на сутки перед определением. Это соответствовало голоданию в течение 14-18 ч с момента удаления пищи. Эффект голодания на отношение амплитуды пика 13C-бикарбоната к 13C-пирувату показан на Фиг.2.
Во второй подгруппе ("после кормления") активность PDH определяли в состоянии после кормления пищей, получаемой при свободном доступе. После определения базального уровня активности PDH всех крыс восстанавливали и умерщвляли спустя 1 ч для анализа тканевых препаратов и плазмы, как описано выше.
В третьей группе крыс (n=7) активность PDH определяли согласно Примеру 3 в 3 момента времени: исходную активность PDH (базальный уровень), 2 и 4 недели. После исходного определения активности PDH (базального уровня) всех 7 крыс помещали на рацион с высоким содержанием жиров, где 55% калорий составляет насыщенный жир, для индукции модели метаболического синдрома, предшествующего диабету 2 типа. Корм всегда был в свободном доступе. После определения активности PDH в момент времени 4 недели крыс восстанавливали и умерщвляли спустя 1 ч для анализа тканевых препаратов и уровней метаболитов в плазме, как описано выше. На Фиг.3 показано изменение отношения амплитуды пика 13C-бикарбоната к 13C-пирувату по времени.
Ткань сердца от всех животных анализировали для определения активных и суммарных фракций фермента PDH (PDHa и PDHt) согласно протоколу, описанному ранее Seymour et al. (Seymour, A.M. & Chatham, J.C. (1997) J Mol Cell Cardiol 29, 2771-2778). На Фиг.4 показана доля фермента PDH в активной форме. Наблюдается строгое соответствие с результатами активности PDH, которые измерены на основании отношения амплитуд пиков 13C-бикарбоната к 13C-пирувату во всех трех группах. Это дополнительно подтверждено на Фиг.5, где показана строгая корреляция между активностью PDH, измеренной ex vivo на ткани сердца и измеренной на основании отношения амплитуд пиков 13C-бикарбоната к 13C-пирувату.
Пример 3. 13C-МР обнаружение
Пример 3а. Подготовка животного
Всех крыс подвергали анестезии, используя изофлуран (2% в кислороде), и держали на нагретой подстилке. Следили за тем, чтобы температура тела поддерживалась при 37°C. В хвостовую вену вводили катетер, а затем крыс помещали в изготовленную вручную систему удерживания животного. Проводили мониторинг ЭКГ, частоты дыхания и температуры тела и обеспечивали нагрев воздуха. Состояние анестезии поддерживали посредством изофлурана (1,7%), доставляемого через носовой конус.
Пример 3б. Введение и дозирование гиперполяризованного 13C-пирувата
1 см3 среды визуализации, приготовленной в Примере 1, инъецировали находящейся под анестезией крысе в течение 10 с через катетер хвостовой вены.
Пример 3в. 13С-МР визуализация/спектроскопия
Изготовленную вручную 1H/13C треугольную катушку устанавливали над грудной клеткой крысы, локализуя сигнал от сердца. Крыс помещали в 7 Т МР-сканер в виде горизонтального цилиндра, связанный с помощью интерфейса с пультом управления Varian Inova. Правильное положение подтверждали путем снятия осевого протонного флэш-изображения (TE/TR=1,17/2,33 мс, размер матрицы = 64×64, FOV (зона видимости) = 60×60 мм, толщина среза = 2,5 мм, угол отклонения вектора намагничивания возбуждения = 15°). Корректировку синхронизации сердца осуществляли для уменьшения ширины протонной полосы примерно до 120 Гц.
Непосредственно перед инъекцией инициировали синхронизированную по ЭКГ 13C-МР импульсную последовательность спектроскопии. 60 индивидуальных сердечных спектров было снято за 1 минуту после инъекции (TR=1 с, угол отклонения вектора намагничивания возбуждения = 5°, полоса качания = 6000 Гц, снятые точки = 2048, частота центрирована по сигналу пирувата).
Серию сердечных спектров 13C-МР анализировали, используя алгоритм AMARES, выполняемый программным обеспечением jMRUI (Naressi et al., Computers in Biology and Medicine, 31(4), 2001, 269-286 и Naressi et al., Magnetic Resonance Materials in Physics, Biology and Medicine, 12(2-3), 2001, 141-152). Спектры объединяли, а затем базовую линию и DC корректировали на основе последней половины снятых точек. Пики, соответствующие пирувату и бикарбонату, аппроксимировали с предшествующими данными с учетом формы кривой Лоренца, частот пиков, относительных фаз и значений ширины полос.
Максимальную площадь пика пирувата вычисляли для каждой серии спектров и использовали для вычисления максимального соотношения бикарбонат/пируват. Это позволило эффективно нормализовать вариации в поляризации между каждой серией данных. Также вычисляли параметры, описывающие кинетику прогрессирования бикарбоната, а именно время до появления, время до максимума и время распада до половины максимума.
Пример 4. Определение активности PDH согласно способу по изобретению в животных моделях заболевания гипертиреоза
В данное исследование было включено двенадцать самцов крыс Вистар (2 группы по 6) для исследования эффектов гипертиреоза на сердечный метаболизм.
Исходную активность PDH (базальный уровень) определяли у всех крыс согласно Примеру 3. Затем гипертиреоз индуцировали у 6 крыс 7 ежесуточными внутрибрюшинными инъекциями свежеприготовленного трииодтиронина (Т3; 0,2 мг/кг массы тела/сутки). Другие шесть крыс, которые служили в качестве контролей, получали 7 ежесуточных внутрибрюшинных инъекций физиологического раствора в воде (0,9%). После 7 суток введения Т3 снова определяли активность PDH у каждой из 12 крыс согласно способу по изобретению. Отношение амплитуды пика 13C-бикарбоната к 13C-пирувату сравнивали у крыс, которым вводили Т3, против контрольных крыс как на базальном уровне, так и на сутки 7. Результаты четко показывают, что введение Т3 вызывает снижение отношения амплитуды пика 13C-бикарбоната к 13C-пирувату, и это дает снижение активности PDH (Фиг.6).
Крыс умерщвляли спустя 24 ч внутрибрюшинной инъекцией натрия пентобарбитала для получения тканевых препаратов. Сердца быстро вырезали и разрезали на две примерно равные половины. Одну половину сразу замораживали, используя охлажденные N2 алюминиевые щипцы, и хранили при -80°C для последующего биохимического анализа. Интактные митохондрии выделяли из другой половины сердца и использовали для оценки митохондриальной функции.
Пример 5. Определение активности PDH согласно способу по изобретению с использованием среды визуализации, содержащей малат и гиперполяризованный 13C-пируват
Шесть самцов крыс Вистар исследовали в каждом из 4 экспериментальных условий, чтобы определить, позволяет ли инфузия гиперполяризованного 13C-пирувата неинвазивным путем оценить природу регуляции PDH.
В данном примере среду визуализации, содержащую малат и гиперполяризованный 13C-пируват, использовали для выяснения природы регуляции PDH. Поток PDH можно ингибировать либо инактивацией ферментного комплекса PDK, либо также мгновенно посредством ингибирования конечным продуктом. Продемонстрировано, что повышенные отношения NADH/NAD+ или ацетил-CoA/СоА снижают PDH-опосредованное окисление пирувата и, конечно, доступность оксалоацетата для включения ацетил-CoA в цикл Кребса является основной детерминантой внутримитохондриальной концентрации ацетил-CoA. Малат является промежуточным соединением окислительного метаболизма глюкозы и может вступать в цикл Кребса посредством анаплеротической последовательности реакций с повышением общего углеродного потока. Предположили, что использованием среды визуализации, содержащей малат и гиперполяризованный 13C-пируват, можно снизить степень ингибирования PDH конечным продуктом. В случаях высокой активности PDH он должен повышать поток пирувата через ферментный комплекс, как определено путем обнаружения 13C-бикарбоната с помощью 13C-МР. Предположили, что у крыс натощак вследствие уже очень низкой активности PDH ингибирование конечным продуктом было несущественным, и что совместная инфузия малата не должна влиять на обнаруженное образование 13C-бикарбоната.
Каждую из 6 крыс исследовали в соответствии с протоколом, описанным в Примере 3, в сытом состоянии и натощак (для модулирования активности PDH), с 40 мкмоль одного гиперполяризованного 13C-пирувата и 40 мкмоль гиперполяризованного 13C-пирувата, инфузированного совместно с 40 мкмоль малата (для манипулирования потоком цикла Кребса/захватом ацетил-CoA). Среду визуализации, содержащую гиперполяризованный 13C-пируват или малат и гиперполяризованный 13C-пируват, инфузировали через хвостовую вену крысам в МР-сканере и снимали сердечные спектры каждую секунду в течение 1 мин. Детектировали сигналы 13C-пирувата и 13C-бикарбоната, проводили мониторинг преобразования 13C-пирувата в 13C-бикарбонат, и отношение пирувата к бикарбонату использовали в качестве маркера потока PDH.
Инфузия среды визуализации, содержащей малат и гиперполяризованный 13C-пируват, увеличивала поток PDH на 32% по сравнению со средой визуализации, содержащей один гиперполяризованный 13C-пируват, указывая на то, что удаление ацетил-CoA в результате включения в цикл Кребса увеличивает поток PDH. Поток PDH был на 55% ниже у крыс натощак, которым инъецировали один гиперполяризованный 13C-пируват, по сравнению с крысами в сытом состоянии и не изменялся при использовании среды визуализации, содержащей малат и гиперполяризованный 13C-пируват. Здесь низкая активность PDH предотвращала дополнительный поток фермента. Эти результаты, показанные на Фиг.7, подтверждают, что ингибирование конечным продуктом ограничивает поток PDH в сытом состоянии, тогда как активность PDH регулирует окисление пирувата в состоянии натощак. В заключение, в данном исследовании получены данные о том, что гиперполяризованный МР может быть полезен для получения подробной информации о метаболической регуляции, чем только получение информации о состоянии метаболизма.

Изобретение относится к биохимии, в частности к определению активности пируватдегидрогеназного комплекса (PDH комплекса) путем 13C-МР обнаружения (магнитно-резонансного обнаружения на основе изотопа 13C). Сущность способа заключается в том, что определяют изменение активности PDH комплекса у подлежащего исследованию субъекта путем 13C-МР обнаружения (магнитно-резонансного обнаружения на основе изотопа 13C) с использованием среды визуализации, содержащей гиперполяризованный 13C-пируват и при обнаружении сигнала 13C-бикарбоната либо сигнала 13C-бикарбоната и сигнала 13C-пирувата, где указанный гиперполяризованный 13C-пируват выбран из группы, состоящей из гиперполяризованного 13С1-пирувата, 13C1,2-пирувата, 13C1,3-пирувата или 13C1,2,3-пирувата, или любой их комбинации, определяют активность PDH комплекса. Использование заявленного способа позволяет достоверно определить изменения активности PDH комплекса у подлежащего исследованию субъекта. 10 з.п. ф-лы, 7 ил., 5 пр.
1. Способ определения изменений активности пируватдегидрогеназного комплекса (PDH комплекса) у подлежащего исследованию субъекта путем 13C-МР обнаружения (магнитно-резонансного обнаружения на основе изотопа 13C) с использованием среды визуализации, содержащей гиперполяризованный 13C-пируват, при котором обнаруживают сигнал 13C-бикарбоната либо сигнал 13C-бикарбоната и сигнал 13C-пирувата, где указанный гиперполяризованный 13C-пируват выбран из группы, состоящей из гиперполяризованного 13C1-пирувата, 13C1,2-пирувата, 13C1,3-пирувата или 13C1,2,3-пирувата, или любой их комбинации.
2. Способ по п.1, при котором обнаруживают сигналы 13C-бикарбоната и 13С-пирувата.
3. Способ по п.1 или 2, представляющий собой способ определения изменений активности PDH комплекса in vivo у человека или животного, отличного от человека.
4. Способ по п.1 или 2, представляющий собой способ определения изменений активности PDH комплекса in vitro в клеточной культуре, в образцах из организма, в ткани ех vivo или в изолированном органе, имеющих происхождение от человека или животного, отличного от человека.
5. Способ по п.1, где указанный сигнал или сигналы используют для создания метаболического профиля.
6. Способ по п.5, который осуществляют in vivo или in vitro, и где полученную информацию используют при оценке эффективности потенциальных лекарственных средств, которые изменяют активность PDH комплекса.
7. Способ по п.5, который осуществляют in vivo или in vitro, и где полученную информацию используют для оценки ответа на лечение и/или для определения эффективности лечения у больных пациентов, проходящих лечение от их заболевания.
8. Способ по п.5, который осуществляют in vivo или in vitro, и где полученную информацию используют для идентификации пациентов группы риска развития заболевания и/или кандидатов на профилактические меры во избежание развития заболевания.
9. Способ по п.5, который осуществляют in vivo или in vitro, и где полученную информацию используют для раннего обнаружения заболеваний.
10. Способ по п.5, который осуществляют in vivo или in vitro, и где полученную информацию используют для мониторинга прогрессирования заболевания, определения тяжести заболевания или для идентификации и оценки осложнений, связанных с заболеванием.
11. Способ по п.1, где указанная среда визуализации дополнительно содержит малат.
| GOLMAN К et al Metabolic imaging by hyperpolarized C magnetic resonance imaging for in vivo tumor diagnosis | |||
| Cancer Res | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| WO 2006011810 A2, 02.02.2006 | |||
| WO 2006054903 A2, 26.05.2006 | |||
| ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ДЛЯ ПОВЫШЕНИЯ АКТИВНОСТИ ПИРУВАТДЕГИДРОГЕНАЗЫ | 1999 |
|
RU2242224C2 |
Авторы
Даты
2013-07-10—Публикация
2008-09-05—Подача