Изобретение относится к медицине, медицинской и биотехнологической промышленностям, в частности к штаммам грибов-продуцентов биологически активных веществ и препаратам на их основе, и может быть использовано при производстве и применении физиологически активных препаратов и пищевых добавок на основе грибов - продуцентов.
Одной из перспективных групп продуцентов, чей химический состав биологически активных веществ и свойства этих веществ в настоящее время изучены достаточно полно, являются высшие базидиальные грибы.
Исследованием лечебных свойств высших базидиальных грибов и практическим их применением в области медицины занимаются ученые ряда стран на протяжении последних 50-ти лет. Результаты этих исследований особо широко используются в Китае, Японии, Корее, США, Канаде, России и в последнее время в Норвегии.
Среди метаболитов высших грибов выделены и идентифицированы вещества из шляпочных грибов, которые являются иммуномодуляторами и проявляют противоопухолевые, кардиоваскулярные, противовирусные, антибактериальные, противопаразитарные, гепатозащитные и противодиабетические свойства /Материалы IV Международной конференции «Наука и практика грибоводства»/ М., Международная Ассоциация Грибоводов. 1997 г. - 92 с.; Перспективы использования в медицине веществ, образуемых базидиальными грибами. Обзор /International Journal of Medicinal Mushrooms. Vol.3, 31-62, 1999)/.
Известно примерно 200 видов шляпочных грибов, которые обладают ярко выраженными вышеперечисленными свойствами, но только около 10 видов грибов используются для получения лекарственных средств. Однако большинство биологически активных веществ, входящих в состав этих грибов, полностью не определены. Так, например, в Японии, Китае, России, Украине, Белоруссии, США, Канаде и Норвегии были разработаны несколько цитостатиков-полисахаридов, используемых как лекарственные препараты. Их получают при культивировании в погруженных условиях Trametes versicolor (PSK, Krestin; Japan; Glucanova, Norway 2010).
Вместе с тем, создание новых препаратов до настоящего времени во многом сдерживается сложной дорогостоящей технологией получения из базидиомицетов линий чистых культур и веществ, обладающих стабильностью требуемых лечебных свойств. Прежде всего это объясняется тем, что образование ценных для фармакологии метаболитов зависит от условий культивирования продуцента и, по мнению большинства авторов, носит нестабильный штаммозависимый специфический характер.
Поэтому в настоящее время мы не располагаем современными безопасными препаратами на основе биологически активных веществ, получаемых из высших базидиомицетов, с полифункциональной специфической медико-биологической активностью и способностью усиливать проявление противоопухолевой активности, сопровождающейся гепатопротекторным и детоксицирующим действием с нормализацией липидного спектра в сыворотке крови.
Для лечения онкологических заболеваний широко применяются противоопухолевая химиотерапия с использованием целого ряда цитостатиков. К наиболее эффективно используемым относятся циклофосфан, доксорубицин, вепезид, таксаны, метатрексат, 5-фторурацил, применяемые на практике, как отдельно, так и в сочетании друг с другом.
Однако существенным ограничением в достижении максимальной эффективности противоопухолевой терапии является токсичность цитостатиков, широко применяемых в химиотерапии. Именно токсические проявления в ходе их применения и особенно гематологическая токсичность, как правило, ограничивают проведение адекватного лечения. Терапия зачастую проводится сниженными дозами лекарств с увеличением интервалов между курсами и, как результат, лечение бывает не всегда удовлетворительным.
Известно, что при длительно применяемых курсах полихимиотерапии с использованием известных цитостатиков значительно возрастает риск развития заболеваний печени, в т.ч. стеатоза печени, т.н. неалкогольного стеатогепатита (НАСГ) (жировой инфильтрации печени).
Так, например, применение циклофосфана, метатрексата и доксорубицина может вызвать развитие гепатита, сопровождающегося повышением активности в крови ферментов печеночного происхождения (аминотрансфераз, γ-глутамилтранспептидазы, кислой и щелочной фосфатаз), гипербилирубинемией, фиброзом, дистрофией печени с синдромом холестаза IVanSaun М.N., Lee I.K., Washington M.K., Matrisian L, Gorden D.L. High fat diet induced hepatic steatosis establishes a permissive microenvironment for colorectal metastases and promotes primary dysplasia in a murine model // Am. J. Pathol. 2009. V.175(1). P.355-364.; Блохин H.H., Переводчикова Н.И. Химиотерапия опухолевых заболеваний. М.: Медицина, 1984. 303 с.; Spitzer Т., Cirenza E., McAfee S., Foelber R., Zarzin J., Cahill R., Mazumder A. Phase I-II trial of high-dose cyclophosphamide, carboplatin and autologous bone marrow or peripheral blood steam cell rescue // Bone Marrow Transplant. 1995. V.15, №4. P.537-542/.
По этой причине затруднен поиск эффективных препаратов для лечения онкологических заболеваний при развитии НАСГ. Современные подходы к лечению этой патологии направлены главным образом на устранение или ослабление факторов, ведущих к развитию стеатоза: низкокалорийная диета, коррекция гиперлипидемии и гипергликемии, отмена потенциально гепатотоксичных препаратов. Однако эти мероприятия имеют слабую лечебную эффективность и то, только у относительно небольшой части больных.
Более значимые результаты могли бы быть получены у пациентов, страдающих онкологическими заболеваниями, если бы применяемые в химиотерапии цитостатики или препараты «сопровождения» в комплексном лечении больных, дополнительно обладая противоопухолевой активностью, оказывали гепатопротекторное и детоксицирующее действие, проявляющееся в блокировке НАСГ, и нормализовали липидный спектр в сыворотке крови.
Морфологический термин НАСГ, или по другой терминологии "жировая инфильтрация", обозначает патологический процесс, при котором в цитоплазме гепатоцитов происходит прогрессирующее накопление капель жира (Яковенко и др., 2004).
В настоящее время в области профилактики и сохранения здоровья человека самой большой и все более очевидной проблемой является остановка разрушения организма человека от применения химических препаратов.
Именно поэтому в последние 15 лет активно разрабатываются подходы по созданию и применению новых препаратов на основе биологически активных веществ, снижающих токсические проявления противоопухолевых препаратов. Однако до настоящего времени в практической медицине нет препаратов, достаточно эффективных для широкого применения.
К числу известных рекомендованных Министерством здравоохранения РФ такого рода растительных препаратов, начиная с 1996 года, необходимо прежде всего отнести: БАД к пище из бурых морских водорослей «Кламин» /Гигиенический сертификат Госкомсанэпиднадзора РФ №1П - 11/100 от 10.02.1995 г./; «Фитолон» и «Фитолон - М» /Гигиенический сертификат Госкомсанэпиднадзора РФ №1П - 11/101 от 10.02.1995 г./; лекарственное средство из культуры тканей женьшеня «Биоженьшень» /ВФС-42-1890-89/.
Включение в схемы комбинированного и комплексного лечения больных раком молочной железы, пищевода и прямой кишки вышеуказанных растительных адаптогенов позволяет, с одной стороны, ослабить повреждающее действие операционной травмы, химио- и лучевой терапии на организм, уменьшить частоту осложнений специфической терапии, а с другой стороны, повысить защитные силы организма, усилить режим специфического лечения, т.е. добиться синергизма противоопухолевой активности.
Вместе с тем, перечисленные выше препараты (растительные адаптогены) не обладают противоопухолевой активностью, а при их комплексном применении в сочетании с химио- и лучевой терапией не обладают способностью модулировать процессы снижения их гематологической токсичности, с сопровождением детоксицирующего и гепатопротекторного действия и нормализацией липидного спектра в сыворотке крови биологических систем, что значительно осложняет комплексное лечение онкологических больных.
Известен индуктор апоптоза полипептидный комплекс ГА-40, который был разработан в начале 90-х годов в медико-биологическом научно-исследовательском и производственном центре Alexis (Тбилиси, Грузия). Сырьевым источником получения препарата в виде пептидного лиофилизированного порошка служит горное растение Купена горная (Polgonatum varticillatum). После проведения биохимических исследований на предмет количественного и качественного состава было выявлено, что препарат содержит несколько сотен малых пептидов с молекулярной массой 10-50 кД. Для определения состава использовался метод высокоэффективной жидкостной хроматографии (HPLC) с последующей тандемной масс-спектрометрией с использованием LTQ FT ICR спектрометра масс (Hybrid-2D-Linear Quadrupole Ion Trap, Fourier Transform Ion Cyclotron Resonance Mass Spectrometer) (Thermo Electron Corp). /Великий Н.Н. Отчет об определении количественного и качественного состава препарата ГА-40. Институт биохимии им. Палладина НАН Украины, Киев, 2007/.
Препарат ГА-40 прошел серию экспериментов in vitro и in vivo, которые достоверно продемонстрировали ряд терапевтических эффектов его пептидного состава в комплексе, а именно:
- полипептиды препарата ГА-40 взаимодействуют с мембранными структурами атипичных клеток и инициируют механизм апоптоза / Loeb Lawrence A., «Investigation of molecular mechanisms of the anti-carcinogenic action of the GA-40 preparation» University of Washington, School of Medicine, Department of Pathology; WDC, 2005/;
- в опытах in vivo установлено, что введение препарата ГА-40 мышам в дозах 2, 20 и 200 мкг/кг вызывает достоверное увеличение количества антителообразующих клеток в 1,5, 2 и 2,4 раза соответственно по сравнению с животными, не получавшими препарат;
- в опытах in vitro установлено, что совместная культивация препарата ГА-40 в концентрации 100 мкг/мл с мононуклеарными клетками периферической крови здоровых доноров вызывает достоверное повышение продукции интерферона-гамма;
- препарат ГА-40 обладает выраженным антиоксидантным и антистрессовым действием. Он не вызывает аллергических реакций немедленного типа и псевдоаллергических реакций /Ю.М.Лопухин, А.К.Мартынов, «Исследование иммунотропной активности препарата ГА-40», «Исследование клеточных и молекулярных механизмов действия препарата ГА-40», ГУ НИИ ФХМ, Москва, 2006/.
Анализ медико-биологической активности известного препарата ГА-40 - индуктора апоптоза показывает, что несмотря на достоверно продемонстрированный ряд терапевтических эффектов препарата ГА-40 не применяется в практике медицины как препарат «сопровождения» в комплексной терапии онкологических заболеваний, так как не обладает способностью снимать проявление общей токсичности и гематологической токсичности, вызванных применяемыми цитостатиками, при этом оказывать гепатопротекторное и детоксицирующее действие, проявляющееся в блокировке развития НАСГ и нормализовать липидный спектр в сыворотке крови биологических систем.
Именно по тем же причинам ни один из известных методов лечения онкологических больных с применением известных растительных адаптогенов нельзя признать достаточно эффективным и пригодным для широкого применения.
Что касается модуляторов, снижающих токсические проявления противоопухолевых препаратов биологически активными веществами, выделенными из высших базидиомицетов, с полифункциональной медико-биологической активностью, вызывающей или усиливающей совместно с цитостатиками гибель клеток злокачественных опухолей путем индукции в них апоптоза, при этом оказывать гепатопротекторное и детоксицирующее действие, проявляющееся в блокировке развития стеатогепатита и нормализовать липидный спектр в сыворотке крови биологических систем, то сведения о подобного рода соединениях в литературе отсутствуют.
Известен «Препарат, влияющий на тканевой обмен и моделирующий процессы иммунитета в биологических системах, и биологически активная пищевая добавка «Мипро - ВИТ»» /патент РФ 2092179, кл. А61К 35/84, A23L 1/054, 1996 г./, используемый в медицине для профилактики и лечения заболеваний, связанных с нарушениями обмена веществ и функционирования иммунной системы организма, в частности способный стимулировать активность антиоксидантных систем организма и, как следствие, связывать и выводить из организма радионуклиды, кардинально нарушающие тканевый обмен в организме за счет инактивации белков-ферментов. Известный препарат не применяется в медицине как модулятор, снижающий токсические проявления цитостатиков, и в данном направлении не исследован.
Известен «Препарат, влияющий на тканевой обмен и применение штамма гриба Fusarium Sambucinum Fuskel var. ossicolum (berk. etcurf) bilai для его получения /патент РФ 2040932, кл. А61К 35/70, 1993 г./, используемый в медицинской промышленности для производства пищевых добавок и в медицине для профилактики и лечения заболеваний, связанных с нарушением обмена веществ, обладающий адаптогенным и иммуномодулирующим действием. Этот препарат оказывает нормализующее действие на нарушенные обменные процессы в организме, приводящие к сердечно-сосудистым заболеваниям, ожирению, диабету, иммунодефицитным состояниям, авитаминозам, а также сочетается с традиционными терапевтическими средствами, усиливая их действие на организм и снижая побочные неблагоприятные эффекты, в частности при проведении радиотерапии онкологическим больным. Однако данный препарат также не применяется в медицине как модулятор, снижающий токсические проявления противоопухолевых препаратов, так как в этом направлении не исследован.
Известен препарат, влияющий на тканевой обмен, и применение штамма гриба Pleurotus ostreatus 1137 для его получения /патент РФ 2192873, кл. А61К 35/70, 2001 г./, используемый в медицинской и биотехнологической промышленности для производства физиологически активных препаратов и пищевых добавок на основе грибных продуцентов биологически активных веществ, применяемых в медицине для снижения токсических проявлений противоопухолевых препаратов (прототип).
Согласно описанию и формуле этого изобретения известный препарат обладает противоопухолевой активностью и способностью модулировать процесс снижения гематологической токсичности цитостатиков. Препарат производят путем глубинного культивирования гриба Pleurotus ostreatus 1137 (ВКПМ, F-819) с последующим разделением мицелия и культуральной жидкости и выделением из мицелия экстракцией этанолом при кислом или нейтральном значениях pH среды биологически активных веществ с антимикробной активностью, содержащих аминокислоты (глицин, аланин, треонин, серин, лейцин) и углеводы (глюкозу, глюкозамин, арабинозу, ксилозу).
Препарат выполнен в виде обезвоженных гранул или таблеток, или в виде гелеобразного сиропа.
Штамм Pleurotus ostreatus 1137 (ВКПМ, F-819) применяется в качестве продуцента физиологически активных веществ с противоопухолевой активностью.
Кроме того, препарат проявляет антимикробную активность в отношении как грамположительных, так и грамотрицательных бактерий.
На основе описанного в патенте штамма гриба Pleurotus ostreatus 1137 (ВКПМ, F-819) получен препарат, обладающий широким спектром лечебно-профилактического действия, в т.ч. и антиоксидантной активностью.
Опыт применения вышеуказанного препарата (прототипа) показывает, что физиологическое действие препарата заключается в его способности оказывать влияние на тканевой обмен и модулировать процессы снижения гематологической токсичности эффективных и широко применяемых в клинике противоопухолевых препаратов. Применение этого препарата позволяет повысить эффективность противоопухолевой химиотерапии на фоне снижения токсических проявлений цитостатиков при комплексном лечении онкологических заболеваний.
Вместе тем в ходе медико-биологических и клинических испытаний нами установлено, что индивидуальное применение препарата, разработанного в соответствии с патентом РФ №2192873, недостаточно эффективно индуцирует апоптоз раковых клеток и практически обладает низкой физиологической активностью к способности усиливать гепатопротекторное и детоксицирующее действие и нормализовать липидный спектр в сыворотке крови при комплексном лечении онкологических больных.
Поэтому в основу изобретения положено применение штамма Pleurotus ostreatus 1137 для создания на его основе препарата с полифункциональной медико-биологической активностью, влияющего на тканевой обмен, который является индуктором апоптоза, механизм действия которого основан на способности вызывать гибель клеток злокачественных опухолей и при этом оказывать гепатопротекторное и детоксицирующее действие, проявляющееся в блокировке развития стеатогепатита с нормализацией липидного спектра в сыворотке крови биологических систем и не имеющего противопоказаний к применению.
Апоптоз - это форма гибели клетки, проявляющаяся в изменении свойств цитоплазматических мембран, конденсации и фрагментации хроматина /Imyanitov E.N., Kuligina E.Sh., Belogubova E.V., Togo A.V., Hanson K.P. Mechanisms of lung cancer. Drug Discov. Today: Dis. Mech., 2005a, 2, 213-223/.
В связи с тем, что раковые клетки теряют способность к дифференцировке и приобретают способность к неконтролируемому размножению, одной из приоритетных задач терапии рака является подбор препаратов, индуцирующих апоптоз раковых клеток.
Задачей настоящего изобретения является разработка и создание препарата на основе штамма Pleurotus ostreatus 1137 (ВКПМ, F-819) с полифункциональной медико-биологической активностью, влияющего на тканевой обмен и обладающего противоопухолевой активностью с индукцией апоптоза раковых клеток, а также способностью модулировать процесс снижения гематологической токсичности применяемых противоопухолевых препаратов, сопровождающийся гепатопротекторным и детоксицирующим действием с нормализацией липидного спектра в сыворотке крови биологических систем.
Технический результат состоит в повышении качества препарата за счет увеличения его противоопухолевой активности и снижения токсичности препаратов противоопухолевой химиотерапии при одновременном применении вместе с ними заявляемого препарата, обладающего способностью ингибировать размножение клеток рака, а также гепатопротекторнным и детоксицирующим действием, проявляющимся в блокировке развития стеатогепатита и нормализации липидного спектра в сыворотке крови.
Результат достигается тем, что заявляемый препарат с полифункциональной медико-биологической активностью, влияющий на тканевой обмен, получен в результате жидкофазного глубинного культивирования гриба Pleurotus ostreatus 1137 (ВКПМ, F-819) с последующим разделением мицелия и культуральной жидкости и выделением из мицелия биологически активных веществ в виде сгущенного экстракта с антимикробной активностью, который представляет собой фармакологическую субстанцию препарата и обогащен активным началом производного стерола 4-гидрокси-17R-метилинцистерол с молекулярной массой 332,2452 дальтон, полисахаридом β 1-3 глюканом и дигидрокверцетином с молекулярной массой 304,26 дальтон, при этом компоненты взяты в следующем массовом соотношении:
(1):(2):(3):(4) как (79,0-158,0):(1,0-2,0):(10,0-20,0):(10,0-20,0).
Препарат обладает способностью ингибировать размножение клеток рака, а также гепатопротекторным и детоксицирующим действием, проявляющимся в блокировке развития стеатогепатита и нормализации липидного спектра в сыворотке крови биологических систем.
Препарат выполнен в виде геля или сиропа, или таблеток, или обезвоженных гранул.
В вышеприведенном по тексту массовом соотношении компонент (1):(2):(3):(4) в готовой форме заявляемого препарата в качестве 1-го компонента применяют сгущенный экстракт с антимикробной активностью, который представляет собой фармакологическую субстанцию препарата; в качестве 2-го компонента применяют активное начало производного стерола 4-гидрокси-17R-метилинцистерол с молекулярной массой 332,2452 дальтон; в качестве 3-го компонента применяют полисахарид β 1-3 глюканом; в качестве 4-го компонента применяют дигидрокверцетин с молекулярной массой 304,26 дальтон.
Штамм культуры Pleurotus ostreatus 1137 хранится во Всероссийской коллекции Промышленных Микроорганизмов, ГосНИИ генетика под регистрационным номером ВКПМ, F-819 и характеризуется следующими признаками.
Культурно-морфологическая характеристика
1. Рост на агаризованных средах
Агаризованное сусло
Мицелий хорошо развит, ватообразный. Растущий мицелий стелющийся, край колонии войлочный, ровный. Скорость роста высокая: за 7-9 суток после высева в центр чашки Петри диаметром 10 см наблюдается полное обрастание агаровой среды. Цвет мицелия белый. Экзопигмент отсутствует. При длительном культивировании (до 30 суток) цвет мицелия не меняется.
Гифы септированные, ветвление частое, под острым или прямым углом, тип ветвления моноподиальный. Образуются пряжки. Диаметр большинства гиф от 2 до 4 мкм; также присутствуют гифы с диаметром от 1 до 8 мкм.
Пептонно-триптонный агар
Мицелий хорошо развит, войлочный. Рост стелющийся, растущий край паутинный, ровный. Скорость роста высокая. Цвет мицелия белый, при длительном культивировании (более 21 суток) возможны палевые или светло-коричневые участки. Экзопигмент отсутствует.
Соевый агар
Мицелий скудный, паутинный, сквозь мицелий видна агаровая среда. Характер роста стелющийся, растущий край ровный, паутинный. Скорость роста низкая: после высева в центр чашки Петри диаметром 10 см наблюдается полное обрастание агаровой среды только на 12-14 сутки роста. Цвет мицелия белый. Экзопигмент отсутствует.
2. Глубинное культивирование
Глубинное культивирование осуществляется в колбах емкостью 750 мл с объемом среды 40…150 мл на качалке с 200 оборотами в минуту. Засев проводили кусочками агара с мицелием.
Среда с суслом
Число колоний зависит от нагрузки посевного материала. За 10-14 суток роста образуется несколько плотных колоний округлой формы, сформировавшихся вокруг посевного материала, и/или много мелких дочерних колоний. Цвет мицелия от белого до светло-бежевого. Цвет среды в процессе культивирования осветляется. Прозрачность среды не меняется. Вес мицелия находится в прямой зависимости от концентрации сусла в среде (от 0,6 до 3 баллингов).
Среда с соевой мукой
Число точек роста значительное, что связано с иммобилизацией мицелия на частицах соевой муки в среде. Рост густой кашицеобразный. При отстаивании мицелий практически не оседает.
Физиолого-биохимическая характеристика
Штамм, как и другие представители рода Pleurotus, растет на различных источниках растительного сырья, содержащих целлюлозу.
Штамм утилизирует глюкозу, сахарозу, декстрин, крахмал, целлюлозу, глицерин.
В качестве источника азота штамм использует пептон, триптон, соевую и овсяную муку.
Растет в диапазоне температур от 8 до 34°С, сохраняет жизнеспособность при температуре от 0 до 40°С, оптимальная температура для роста 24°С.
Растет при значениях pH от 4 до 8, при оптимуме от 6 до 7.
Строгий аэроб.
Патогенность
Штамм не патогенен для людей и животных, но, как представитель вида Pleurotus ostreatus, фитопатогенен для ослабленных лиственных деревьев. Базидиоспоры могут вызывать аллергические реакции у людей.
Антагонистические свойства
В условиях глубинного культивирования проявляется антимикробная активность в отношении грамположительных, грамотрицательных бактерий и грибов.
Новое назначение штамма Pleurotus ostreatus 1137 заключается в его применении в качестве продуцента биологически активного вещества для создания препарата с полифункциональной медико-биологической активностью, влияющего на тканевой обмен и обладающего способностью ингибировать размножение клеток рака, а также гепатопротекторнным и детоксицирующим действием, проявляющимся в блокировке развития стеатогепатита и нормализации липидного спектра в сыворотке крови биологических систем.
Для поверхностного культивирования Pleurotus ostreatus 1137 и тест-штаммов использовали триптонный агар, а также соевую агаровую среду, овсяную агаровую среду и сусло-агар.
Препарат с полифункциональной медико-биологической активностью, влияющий на тканевой обмен, получали биотехническим способом с использованием гриба Pleurotus ostreatus 1137. Указанная культура выращивалась глубинным способом в жидкой стерильной питательной среде.
Процесс получения препарата включал 6 последовательно выполняемых этапов:
I ЭТАП - выращивание биомассы мицелия:
- селекционные работы со штаммом;
- приготовление посевного материала (на агаризованной среде);
- глубинное культивирование мицелия (выращивание на жидких средах и отделение мицелия от культуральной жидкости).
II ЭТАП - Производство сгущенного экстракта мицелия Pleurotus ostreatus 1137 в виде геля, составляющего фармакологическую субстанцию препарата:
- экстракция;
- фильтрация;
- упаривание экстракта (в вакууме).
III ЭТАП - Выделение из отобранной части сгущенного экстракта мицелия Pleurotus ostreatus 1137 в виде геля активного начала производного стерола 4-гидрокси-17R-метилинцистерол дихлорметаном.
IV ЭТАП - Выделение из переработанного мицелия Pleurotus ostreatus 1137, после экстракции из него сгущенного экстракта в виде геля, полисахарида β 1-3 глюкана, полученного путем ферментативного гидролиза экстрагированного этанолом мицелия.
V ЭТАП - Подготовка готовой формы дигидрокверцетина, используемого в составе препарата в качестве дополнительного вещества к сгущенному экстракту, выделенному из экстракта мицелия Pleurotus ostreatus 1137.
VI ЭТАП - Приготовление готовой формы препарата в виде геля, или сиропа, или таблеток или обезвоженных гранул.
Для определения антимикробной активности экстракта мицелия Pleurotus ostreatus 1137 (фармакологической субстанции) глубинное культивирование мицелия проводили в колбах объемом 750 мл на среде, содержащей 0,65 баллинга сусла; воду водопроводную, pH не корректировали. Также использовали среду Эттера, среду 2663, мясо-пептонный бульон и их модификации. Объем среды в колбах составлял 40…150 мл. Для аэрирования колбы помещали на роторную качалку с 200 об/мин. Культивирование и инкубирование проводили от 7 до 24 суток при температуре 26…28°С в регулируемых асептических условиях на жидкой питательной среде при интенсивном аэрировании.
Тест-штаммы инкубировали при температуре 28…37°С в течение 17…24 час.
Установлено, что из числа испытанных питательных сред наиболее оптимальной для роста мицелия по биомассе и антимикробной активности является 0,65 баллинговое сусло.
Для получения препарата вначале мицелий отделяли от нативного раствора центрифугированием.
Из мицелия биологически активные вещества выделяли экстракцией этанолом при кислом значении pH.
Экстракт упаривали в вакууме до гелеобразного состояния с процентным содержанием воды до 30%. Для биологических испытаний использовали упаренный концентрат в виде геля, выделенный из мицелия при кислом значении pH.
Экстракт мицелия Pleurotus ostreatus 1137 в виде геля представляет собой смесь низкомолекулярных биологически активных веществ, обладающих антимикробной активностью.
Для определения антимикробной активности экстракта мицелия Pleurotus ostreatus 1137 в качестве тест-культур использовали грамположительные и грамотрицательные бактерии.
Грамположительные бактерии:
Bacillus mycoides 537;
Bacillus pumilis NCTC 8241;
Leuconostoc mesenteroides ВКПМ B-4177;
Micrococcus luteus NCTC 8340;
Staphylococcus aureus FDA 209P (MSSA);
Staphylococcus aureus UHA 00761 (MRSA);
Грамотрицательные бактерии:
Escherichia coli ATCC 25922;
Pseudomonas aeruginosa ATCC 27853;
Comamonas terrigena ВКПМ В-7571.
Антимикробную активность экстракта мицелия Pleurotus ostreatus 1137 определяли методом диффузии в агаре.
В чашки Петри диаметром 10 см разливали по 15 мл триптонного агара. На застывшую поверхность среды высевали сплошным газоном тест-культуры.
Концентрат экстракта мицелия Pleurotus ostreatus 1137 в количестве 10 мл наносили на диски фильтровальной бумаги диаметром 6 мм. Диски помещали на поверхность агаровой среды, засеянной тест-культурами.
После суток инкубирования выявляли зоны задержки роста тест-штамма.
В результате установлено, что у данного штамма Pleurotus ostreatus 1137 на 10-14 сутки роста наблюдается наибольшая антимикробная активность в отношении как грамположительных, так и грамотрицательных бактерий (табл.1).
Задача медико-биологических исследований заявляемого препарата состояла в получении данных, гарантирующих безопасность его применения в лечебно-профилактических целях.
Изучены и стандартизованы:
- химический состав препарата, состоящего из: фармакологической субстанции, включающей экстракт мицелия Pleurotus ostreatus 1137 в виде геля; активного начала производного стерола 4-гидрокси-17R-метилинцистерола; полисахарида β 1-3 глюкана; дигидрокверцетина;
- токсическое действие препарата на мышах обоего пола линии BAL В/С, разведения питомника РАМН «Столбовая», в остром эксперименте для двух его доз 100 мг/кг, 200 мг/кг. При этом 100 мг готового препарата в своем составе содержит: 79,0 мг сгущенного экстракта, выделенного из мицелия Pleurotus ostreatus 1137, составляющего фармакологическую субстанцию препарата; 1,0 мг производного стерола 4-гидрокси-17R-метилинцистерола, составляющего активное начало препарата; 10,0 мг полисахарида β 1-3 глюкана; 10,0 мг дигидрокверцетина. 200 мг дозы готового препарата в своем составе содержит: 158,0 мг сгущенного экстракта, выделенного из мицелия Pleurotus ostreatus 1137, составляющего фармакологическую субстанцию препарата; 2,0 мг производного стерола 4-гидрокси-17R-метилинцистерола, составляющего активное начало препарата; 20,0 мг полисахарида β 1-3 глюкана; 20,0 мг дигидрокверцетина;
- действие активного начала производного стерола 4-гидрокси-17R-метилинцистерол в дозах 1,0 мг/кг и 2,0 мг/кг на клеточном уровне in vitro при использовании простой системы культивирования клеток нормальных (фибробласты человека) и трансформированных (Hela);
- противоопухолевая активность препарата на модели солидной опухоли меланомы В16, перевиваемой инбредным мышам BDF1 - гибриды первого поколения f1 (C57B1/6×DBA2) разведения питомника РАМН «Столбовая». Противоопухолевая активность готовой формы препарата и его составляющих веществ изучалась с учетом полученных результатов токсического действия препарата на следующих вариантах применяемых доз:
- вариант 1 - фармакологическая субстанция препарата, включающая сгущенный экстракт мицелия Pleurotus ostreatus 1137 в виде геля в дозе 100 мг/кг;
- вариант 2 - активное начало производное стерола 4-гидрокси-17R-метилинцистерола в дозе 2,0 мг/кг;
- вариант 3 - заявляемый препарат в виде геля в дозе 100 мг/кг;
- вариант 4 - заявляемый препарат в виде сиропа в дозе 6,0 мл/кг, что соответствует дозе 75 мг/кг препарата в виде геля;
- вариант 5 - заявляемый препарат в виде сиропа в дозе 8,0 мл/кг, что соответствует дозе 100 мг/кг препарата в виде геля;
- влияние фармакологической субстанции препарата и циклофосфана на гематологические показатели переферической крови здоровых мышей;
- гиполипидемическое и гепатопротекторное действие препарата и его составляющих веществ при развитии экспериментального стеатоза печени на модели атерогенной диеты (АД) белым нелинейным лабораторным половозрелым самцам крысам, полученным из питомника ФГУП ОПХ «Манихино». При этом гиполипидемическое и гепатопротекторное действие препарата и его составляющих веществ изучалось на следующих вариантах применяемых доз:
- вариант 1 - активное начало (АН Пр) производное стерола 4-гидрокси-17R-метилинцистерола в дозе 2,0 мг/кг;
- вариант 2 - фармакологическая субстанция (ФС Пр) экстракт мицелия Pleurotus ostreatus 1137 в виде геля в дозе 100 мг/кг;
- вариант 3 - заявляемый препарат в виде сиропа в дозе 8,0 мл/кг, что соответствует дозе 100 мг/кг препарата в виде геля.
На основании проведения экспериментальных исследований получены следующие результаты.
А. Изучение химического состава и стандартизация экстракта мицелия Pleurotus ostreatus 1137 в виде геля, составляющего фармакологическую субстанцию препарата, проводилось после упаривания этанольного экстракта в вакууме при t=40-50°С до однородного вязкого состава, состоящего из смеси липофильных и гидрофильных соединений.
В результате изучения химического состава экстракта мицелия Pleurotus ostreatus 1137 в виде геля было определено в процентном соотношении масс входящих в состав экстракта массовых долей следующих биологически-активных веществ: углеводов; аминокислот; высших жирных кислот; органических кислот; витаминов; минеральных веществ, содержание которых в составе фармакологической субстанции оказывает значительное влияние на результативность медико-биологической активности готовой формы заявляемого препарата.
Для изучения химического состава входящих в экстракт мицелия Pleurotus ostreatus 1137 биологически-активных веществ были отобраны образцы сгущенного экстракта в виде геля, полученного в течение 12-ти месяцев (с начала января по декабрь включительно).
Отбор проб экстракта и подготовка их к анализу проводили по ГОСТ 28495, 1511.0-77, ГОСТ 20438-75.
Определение массовой доли углеводов проводили методом сорбционной хромотографии, основанном на хроматографическом разделении углеводов на анализаторе Сахаров Boitronic LC 2000 с рефрактометрической детекцией бицинхенинатом и нингидрином соответственно /ГФ XI, вып.1, с.95 с изменениями/.
Определение содержания в экстракте аминокислот проводили методом ионообменной хроматографии аминокислот на сильном катионообменнике: сульфированном сополимере стирола с дивинилбензолом путем анализа аминокислот на аминокислотном анализаторе «Hitashi» модель 835, Япония, /ГФ XI, вып.1, с.95; S.Moore, D.Sparckman and W.Stein. Хромотография аминокислот на сульфированных полистироловых смолах, Analit. Chem., V.30, p.p.1185-1190. 1958/.
Определение содержания в экстракте высших жирных кислот проводили методом количественного выделения жирных кислот из сложных многокомпонентных природных смесей и последующего хроматографического анализа в виде метиловых эфиров /Руководство по методам контроля качества Р 4.1.1672-03 Минздрав России, 2004 г., ст.24/.
Определение содержания в экстракте органических кислот проводили методом высокоэффективной жидкостной хроматографии на цветном хроматографе «Kontron» с УФ детектором /Руководство по методам контроля качества Р 4.1.1672-03 Минздрав России, 2004 г., ст.109/.
Определение содержания в экстракте витаминов Е, B1, B2, B6, С, D проводили методом жидкостной хроматографии /Руководство по методам контроля качества Р 4.1.1672-03 Минздрав России, 2004 г., ст.51, 58, 62, 69/.
Определение содержания в экстракте витаминов В3, Вс, и РР проводили микробиологическим методом /Official Methods of Analisis, 15 edition, 1990. Association of Official Analytical Chemists. Volume one, p.129/.
Определение содержания в экстракте элементов минеральных веществ проводили методом инверсионной вольт-амперометрии /Руководство по методам контроля качества Р 4.1.1672-03 Минздрав России, 2004 г., ст.99/.
В результате исследования было установлено, что сгущенный экстракт мицелия Pleurotus ostreatus 1137 в виде геля, составляющий фармакологическую субстанцию препарата, в своем составе содержит находящиеся в нем изучаемые биологически-активные вещества в следующем процентном соотношении масс:
- 47,0-48,0% углеводов (глюкоза, галактозам, манноза, арабиноза, галактоза, ксилоза, глюкозамин - всего 7). Из них содержание глюкозы составляет до 90%;
- 3,5-9,6% аминокислот (аспаргин, серин, треонин, глутамин, пролин, глицин, аланин, валин, изолейцин, лейцин, лизин, гистидин, аргинин, цистин, метионин, тирозин, фенилаланин, этаноламин, орнитин, оксилизин - всего 20);
- 0,6-0,9% высших жирных кислот (каприновая (C10;0), лауриновая (C12:0), миристиновая (C14:0), пентадекановая (С15:0), пентадеценовая (C15:1), пальмитиновая (C16:0), пальмитолеиновая (C16:1), гептадекановая (C17:0), гептадеценовая (C17:1), стеариновая (C18:0), олеиновая (C18:1), линолевая (C18:2), арахиновая (C20:0), эруковая (С22:1), - всего 14);
- 1,02-1,26% органических кислот (масляная, молочная, уксусная, яблочная, щавелевая - всего 5);
- 0,6-1,2% витаминов (B1, B2, В3, B6, Bc, PP, E, D, С, каратиноиды - всего 10);
- 1,4-1,9% минеральных веществ (Na), калий (К), кальций (Са), магний (Mg), фосфор (Р), сера (S), железо (Fe), цинк (Zn), марганец (Mn), медь (Cu), алюминий (Al), бор (В), барий (Ва), кремний (Si), стронций (Sr), литий (Li) - всего 16).
При этом необходимо отметить, что минимальные и максимальные значения ингредиентов химического состава биологически-активных веществ, входящих в состав экстракта мицелия Pleurotus ostreatus 1137 из отобранных образцов экстракта, характеризуются только сезонными колебаниями их содержания в составе экстракте, полученного в течение 12-ти месяцев (с начала января по декабрь включительно).
Необходимость дополнительного выделения из состава сгущенного экстракта мицелия Pleurotus ostreatus 1137 первой обогащенной фракции активного начала производного стерола 4-гидрокси-17R-метилинцистерол обоснована прежде всего его очень малым природным содержанием в экстракте мицелия, колеблющимся, в зависимости от сезона культивирования мицелия, например, от 1,0 мг до 5,0 мг (от 0,001% до 0,005%) в 1000,0 мг экстракта, что явно недостаточно для проявления его полифункциональной медико-биологической активности в рекомендуемых для применения дозах готовой формы заявляемого препарата (100,0 мг/кг - 200,0 мг/кг).
Следовательно, если применять заявляемый препарат без дополнительного обогащения фармакологической субстанции активным началом производного стерола 4-гидрокси-17R-метилинцистерол в заявляемых массовых соотношениях ингредиенов (1,0-2,0 массы активного начала производного стерола 4-гидрокси-17R-метилинцистерол от всей массы применяемой дозы препарата), то задача и технический результат заявляемого изобретения не будут выполнены.
В качестве примера реализации получения из сгущенного экстракта мицелия Pleurotus ostreatus 1137 производного стерола 4-гидрокси-17R-метилинцистерол ниже приводится технология его выделения из 1000,0 мг сгущенного экстракта в виде геля, полученного из мицелия Pleurotus ostreatus 1137, культивируемого в весенний период года.
Для получения первой обогащенной фракции в виде производного стерола 4-гидрокси-17R-метилинцистерол, его выделение из сгущенного экстракта мицелия Pleurotus ostreatus 1137 производили дихлорметаном следующим образом.
Отобранную навеску сгущенного экстракта мицелия Pleurotus ostreatus 1137 в виде геля (1000,0 мг) растворяли в 96% этаноле в концентрации 100 мг/мл. Полученный раствор (аликвоты по 400 мкл) разделяли хроматографически на полупрепаративной ВЭЖХ-системе Gilson, состоящей из 2-х насосов с головками 25SC, манометрического модуля, смесителя, инжектора с петлей 500 мкл, колоночного термостата и делителя потока (1:10), УФ-детектора с переменной длиной волны и управляющей программы. Была использована полупрепаративная колонка 24*250 мм с сорбентом Диасорб С16Т (10 мкм). Состав подвижной фазы: 96% этанол/0.1% трифторуксусная кислота в воде 60:40, при скорости потока 10 мл/мин и температуре 30°С. Время анализа - 40 мин, детектирование при длине волны 230 нм, интересующий пик имеет время удерживания 20-25 мин. Фракцию, содержащую интересующий пик, собирали, добавляли 30% раствор аммиака до нейтрального значения pH 6-8 и упаривали на роторном испарителе при температуре 45-55°С на 2/3 по объему до появления опалесценции раствора. К оставшемуся раствору добавляли равный объем дихлорметана, экстрагировали и органический слой отделяли на делительной воронке.
Органический слой упаривали на роторном испарителе без нагревания и растворяли в 1 мл 96% этанола. Полученный раствор (аликвоты по 100 мкл) разделяли с помощью аналитической ВЭЖХ на системе Agilent 1100, состоящей из четырехканального насоса с дегазатором, колоночного термостата, автосамплера, диодно-матричного УФ-детектора и управляющей программы ChemStation. Была использована аналитическая колонка 4,6*250 мм с сорбентом Luna С 18(2) (5 мкм). Состав подвижной фазы: ацетонитрил/вода 79:21, при скорости потока 1 мл/мин и температуре 25°С. Время анализа - 21 мин, детектирование при длине волны 230 нм, интересующий пик имеет время удерживания 15-18 мин. Фракцию, содержащую интересующий пик, собирали и упаривали на роторном испарителе при температуре 45-55°С на 2/3 по объему до появления опалесценции раствора. К оставшемуся раствору добавляли равный объем дихлорметана, экстрагировали и органический слой отделяли на делительной воронке. Органический слой упаривали на роторном испарителе без нагревания, растворяли в 1 мл дихлорметана и сушили в эксикаторе. В этом варианте выход вещества 4-гидрокси-17R-метилинцистерол составил 5 мг.
Для наработки требуемого количества 4-8идрокси-17R-метилинцистерола технологический процесс может неоднократно повторяться или масштабироваться с увеличением применяемого для этих целей исходной массы экстракта мицелия в виде геля.
Хроматограмма исходного раствора (анализ экстракта дихлорметаном на аналитической колонке Luna C18(2) (5 мкм) 4,6*150 мм, подвижная фаза: ацетонитрил/вода/1% ТФУ в воде=79:16:5, скорость потока 1,5 мл/мин при 25°С, детекция при 230 нм, время удерживания интересующего вещества 6-7 мин, время анализа 13 мин) приведена на фиг.1.
Пример полупрепаративного разделения на аналитической ВЭЖХ-системе: анализ фракции после препаративного ВЭЖХ на аналитической колонке Luna C18(2) (5 мкм) 4,6*250 мм подвижная фаза: ацетонитрил/вода 79:21, скорость потока 1,0 мл/мин при 25°С, УФ-детекция при 230 нм приведена на фиг.2 (время удерживания вещества 16 мин).
Хроматограмма очищенного вещества (аликвота 10 мкл: ВЭЖХ на аналитической колонке Luna C18(2) (5 мкм) 4,6*250 мм подвижная фаза: ацетонитрил/вода 79:21, скорость потока 1,0 мл/мин при 25°С, детекция при 230 нм) приведена на фиг.3.
Молекулярная формула C21H32O3 была определена по точной массе методом времяпролетной UPLC/MS/MS масс-спектрометрии.
Результаты определения молекулярного веса и брутто-формулы приведены на фиг.4, 5, 6.
На фиг.4 разница между пиками 688 и 1021 составляет 333. 333.16+23(Na+)=356.16, 332.52*2+23=688.04, 332.54*3+23=1020.62.
На фиг.5 ион 331.38 соответствует массе 332.38. Разница между пиками 331.38 и 663.97 составляет 332.59. 332.34*3-1=996.01, 332.28*4-1=1328.12.
Вывод: молекулярный вес 332.28-333.16.
На фиг.6 приведено определение точной массы, которое проводили методом времяпролетной масс-спектрометрии (TOF).
355.2295=C21H32O3Na+(15 ppm);
333.2452=C21H33O3+(8 ppm).
Проведенные по программе «Structure Elucidator/ACDIabs (Канада)» [Журнал Аналитической химии, 2008, т.63, No. 1, сс.18-26] структурные исследования позволили установить структуру выделенного из экстракта вещества.
Для достижения сформулированной задачи и технического результата заявляемого изобретения, кроме его обогащения первой фракцией в виде производного стерола 4-гидрокси-17R-метилинцистерол, препарат обогащают второй фракцией полисахаридом β 1-3 глюкан и третьей фракцией дигидро-кверцетином.
Необходимость выделения из состава переработанного мицелия Pleurotus ostreatus 1137 высокомолекулярного полисахарида β 1-3 глюкана, после экстракции из него экстракта в виде смеси низкомолекулярных веществ, обосновывается его отсутствием в самом сгущенном экстракте мицелия Pleurotus ostreatus 1137 в виде геля, полученном по выше указанной технологии.
Для получения второй обогащенной фракции β 1-3 глюкана его выделение из переработанного мицелия Pleurotus ostreatus 1137 проводили по технологии экстрагирования из мицелия, превращенного в пудру измельчением в жидком азоте в высокоскоростном блендере 0,5%-ным раствором горячей щелочи (60°С) в течение 1 часа с последующим осаждением из субстрата мицелия полисахарида этанолом и переосаждением им же в соотношении масс этанол: раствор порошка мицелия в щелочи 1:1, 3:1, 4:1 соответственно /Ohno N, Miura N.N, Narajima M, Yadomae T. Biol Pharm Bull. 2000. Jul; 23(7): 866-872. Antitumor 1,3-betaglucan from cultured fruit body of sparassis crippa/.
Определение структуры и содержания моносахаридов в водно-щелочном экстракте мицелия проводили по разработанной методике путем ферментативного и кислого гидролиза с дальнейшей модификацией моноуглеводов и хроматографическим их анализом методом обращено-фазной ВЭЖХ в изократическом режиме на колонке Luna C18(2) 4.6*150 mm (5 um) на хроматографе Agilent 1100. Сбор и обработка хромотограмм осуществлялась с помощью программы Chem Station, версия В.03.01.
Отнесение пиков и расчет концентрации углеводов производили по внутреннему стандарту (глюкозамин) и внешнему стандарту, содержащему смесь пяти анализируемых углеводов в концентрации 1 г/л.
Результаты масс-спектрометрического анализа выделенного полисахарида приведены на фиг.7, 8.
Анализ масс-спектрометрических данных показывает, что образующийся при кислом гидролизе мажорный пик действительно является глюкозой с молекулярной массой 512 дальтон. Два пика с меньшей интенсивностью имеют массу дисахарида (674 дальтон) и деградируют в масс-спектрометре до 512 массы (см. фиг.7).
При ферментативном гидролизе образуются три пика с близкой интенсивностью. Последний пик соответствует глюкозе (512 дальтон), а два других имеют массу 836 и 674 дальтон. Отличия на 324 и 162 дальтона соответствуют три- и дисахариду (см. фиг.8).
Для получения третьей обогащенной фракции применяли промышленно выпускаемый в настоящее время дигидрокверцетин в виде аморфного порошка (3 бета, 5Е, 7Е, 10 альфа, 22Е) - 9, 10 - Секоэргоста - 5,7,22-триен-3-ол с молекулярной массой 304,26 дальтон по ТУ 9197-031-02699613-2006 /Свидетельство о государственной регистрации №77.99.26.У.14068.12.06 от 19.12.2006 г., разрешенный для применения в пищевой и медицинской промышленности (Санитарно-эпидемиологическое заключение 50.15.03.000.М.000056.02.08/.
Определение содержания в составе препарата дигидрокверцетина (таксифолина) проводили методом обращено-фазной ВЭЖХ на колонке Luna С 18(2)4.6*250 mm (5 um) производства «Phenomenex» США с использованием хроматографа Agilent 1100. Сбор и обработка хроматограмм осуществлялась с помощью программы «Chem Station A.09.03» /Руководство по методам контроля качества и безопасности БАД Р4.1.1672-03. Минздрав России. М. 2004. с.134. п 4.11.3. ВЭЖХ/.
Хроматограмма варианта определения показателей подлинности и количественных показателей дигидрокверцетина в препарате приведена на фиг.9.
В целом в составе заявляемого препарата с полифункциональной медико-биологической активностью, влияющего на тканевой обмен, содержатся биологические вещества, обладающие способностью вызывать гибель клеток злокачественных опухолей путем индукции в них апоптоза, при этом оказывать гепатопротекторное и детоксицирующее действие, проявляющееся в блокировке развития стеатогепатита и нормализации липидного спектра в сыворотке крови.
Эти вещества условно можно разделить на три основные группы. Первая группа включает вещества, вызывающие гибель раковых клеток путем запуска в них механизма апоптоза. Вторая группа содержит вещества, усиливающие активность детоксикации печени, связывающие канцерогены и ускоряющие их выведение. Эта группа также содержит природные антиоксиданты, активирующие эндогенную антиокислительную систему. Эти факторы создают надежную защиту организма больных от токсического действия «кислородного стресса», вызываемого химиотерапией и радиационным облучением. Третью группу составляют соединения, усиливающие противоопухолевый иммунный ответ, обычно подавленный у онкологических больных.
Все исследуемые биологические вещества растительного происхождения при разработке химического состава препарата с медико-биологической активностью разрешены к использованию при производстве пищевых продуктов и удовлетворяют по санитарно-гигиеническим показателям Сан ПиН 2.3.2.1078-01 и Сан ПиН 2.3.2.1293-03.
Б. Исследования токсического действия заявляемого препарата с полифункциональной медико-биологической активностью проводили с применением двух доз: 100 мг/кг, 200 мг/кг.
В эксперименте были задействованы две группы мышей по 10 особей в каждой группе.
Исследования проводили на мышах обоего пола линии ВА LB/C с массой ~40 г при однократном внутрижелудочном способе введения препарата. Перед применением препарата каждую его дозу растворяли в 0,5 мл дистиллированной воды. Срок наблюдения составил 14 суток.
Критериями токсического действия исследуемых доз препарата служили: количество павших животных, сроки гибели животных, клиническая картина интоксикации, изменение массы тела в течение всего срока наблюдения, поведение животных, данные аутопсии.
Результаты токсического действия исследуемых доз препарата приведены в табл.2, 3.
В результате проведения указанной серии экспериментов установлено следующее.
При однократном внутрижелудочном введении заявляемого препарата в испытываемых дозах 100 мг/кг, 200 мг/кг в обеих группах мышей внешних клинических проявлений не наблюдалось.
Внешний вид. В течение 14 суток наблюдения животных шерстяной покров гладкий. По внешнему виду животные между группами не отличались. У животных не отмечали ухудшения аппетита. Стул оформлен, обычного цвета.
Поведение. В течение наблюдения животных подавленности общего состояния животных не наблюдалось.
Смертность. Смертности, произошедшей от введения препарата, не выявлено на протяжении всего срока наблюдения.
Масса животных. В течение всего срока наблюдения произведено два контрольных взвешивания. Резкой потери или увеличения массы не выявлено, однако в группе 2 замечено общее снижение массы тела на 1 г (см. табл.4).
Внутренние органы. При аутопсии мышей по окончании опыта (после 14 суток наблюдения) макроскопические внутренние органы без патологии. По состоянию внутренних органов обеих групп мышей они не отличались друг от друга.
По результатам исследования токсического действия заявляемого препарата с полифункциональной медико-биологической активностью установлено, что препарат в применяемых дозах (100 мг/кг и 200 мг/кг) не проявляет токсических эффектов и, в соответствии с классификацией токсичности веществ, относятся к IV классу токсичности (малотоксичные вещества) /Методические рекомендации по экпериментальному (доклиническому) изучению новых фармакологических веществ. 2000/.
Учитывая данные токсических исследований, дальнейшее изучение медико-биологических свойств заявляемого препарата проводилось в двух однократно в сутки применяемых дозах: 100 мг/кг, 200 мг/кг массы животных.
В. При исследовании действия активного начала производного стерола 4-гидрокси-17R-метилинцистерол заявляемого препарата на клеточном уровне in vitro в качестве модели для испытаний использовали культивируемые клетки (нормальные и трансформированные).
Задачей этих исследований было изучение индивидуального действия активного начала препарата в виде 4-гидрокси-17R-метилинцистерол в дозах 1,0 мг/кг и 2,0 мг/кг на клеточном уровне с использованием относительно простой системы культивируемых клеток - нормальных (фибробласты человека) и трансформированных (Hela).
Количественная оценка противоопухолевой эффективности активного начала производного стерола 4-гидрокси-17R-метилинцистерол заявляемого препарата на уровне in vitro проводилась в сравнении с противоопухолевым действием прототипа, т.е. экстракта мицелия Pleurotus ostreatus 1137 (ВКПМ, F - 819) и цитостатика циклофосфан по методу/Li J., Karlsson M.O., Brahmer J., Spitz A., Zhao M.. Hidalgo M., Baker S.D. CYP3A phenotyping approach to predict systemic exposure to EGFR tyrosine kinase inhibitors. J. Natl. Cancer Inst, 2006, 98, 1714-1723/.
Для количественной оценки эффективности действия указанного активного начала производного стерола 4-гидрокси-17R-метилинцистерол заявляемого препарата использовались показатели, характеризующие жизнеспособность популяции культивируемых клеток, в том числе митотический и апоптический индексы. Митотический индекс отражает способность клеточной популяции к размножению, а апоптический индекс показывает долю клеток, активирующих запрограммированную гибель. Известно, что в злокачественных опухолях апоптоз подавлен, что приводит к интенсивному размножению раковых клеток и формированию метастаз /Asahina H., Yamazaki К., Kinoshita I., Sukoh N., Harada M., Yokouchi H., Ishida Т., Ogura S., Kojima Т., Okamoto Y., Fujita Y., Dosaka-Akita H., Isobe H., Nishimura M. A phase II trial of gefitinib as first-line therapy for advanced non-small cell lung cancer with epidermal growth factor receptor mutations. Br. J. Cancer, 2006, 95, 998-1004/.
Полученные результаты показали, что при индивидуальном действии прототип, т.е. экстракт мицелия Pleurotus ostreatus 1137 (ВКПМ, F - 819) в дозах 100 мг/кг, 200 мг/кг, является слабовыраженным индуктором апоптоза и вызывает аномальную сегрегацию хромосом на стадии метафазы и появление хромосомных аберраций типа «мост» на стадии анафазы.
При сочетанием применении экстракта мицелия Pleurotus ostreatus 1137 (ВКПМ, F-819) и циклофосфана проявляется ярко выраженный синергизм, который, в зависимости от их концентрации (экстракт 100 мг/кг, циклофосфан 50 мг/кг или 100 мг/кг) и способа их инсталляции, выражается в частичном подавлении пролиферации и в индукции апоптоза.
Установлено, что сочетанное применение экстракта мицелия Pleurotus ostreatus 1137 (ВКПМ, F-819) и циклофосфана детерминирует способность раковых клеток к включению программы их апоптической гибели. При этом противоопухолевый эффект экстракта мицелия Pleurotus ostreatus 1137 (ВКПМ, F-819) не связан непосредственно с его цитотоксическим действием. Вместе с тем подобный эффект не проявляется у нормальных фибробластов человека.
По результатам исследования активного начала 4-гидрокси-17R-метилинцистерол заявляего препарата установлено, что его применение в дозах 1,0 мг/кг или 2,0 мг/кг в культивируемых трансформированных клетках Hela через 24 часа вызывает ярко выраженный апоптический эффект.
Входящее в заявленный состав препарата активное начало 4-гидрокси-17R-метилинцистерол в применяемых дозах является сильным индуктором апоптоза в культивируемых трансформированных клетках, увеличивая в 20-30 раз, по сравнению с прототипом (экстракт мицелия Pleurotus ostreatus 1137 в виде геля), количество апоптических клеток, что в 10-15 раз превосходит по эффективности применения известный препарат ГА - 40, применение которого при этом не оказывает апоптического и митостатического действия на нормальные фибробласты /Loeb Lawrence A.,«Investigation of molecular mechanisms of the anti-carcinogenic action of the GA-40 preparation» University of Washington, School of Medicine, Department of Pathology; WDC, 2005/.
На основании полученных результатов цитологических исследований культивируемых клеток было установлено, что главным механизмом противоопухолевого эффекта активного начала 4-гидрокси-17R-метилинцистерол заявляемого препарата является стимуляция апоптоза в раковых клетках. Поэтому введенное в разработанный препарат активное начало в виде 4-гидрокси-17R-метилинцистерол в количестве 1,0-2,0 массы от всей массы заявляемого препарата является индуктором апоптоза раковых клеток, увеличивая при этом, как указывалось выше, в 20-30 раз, по сравнению с прототипом, количество апоптических клеток в культивируемых трансформированных клетках Hela.
Г. При изучении противоопухолевой активности заявляемого препарата с полифункциональной медико-биологической активностью у животных на модели солидной опухоли меланома В-16 были проведены четыре серии экспериментов.
а) В первой серии экспериментов исследовалась противоопухолевая активность заявляемого препарата в виде геля и сиропа и его составных частей на модели солидной опухоли меланома В-16.
Эксперименты проведены на инбредных мышах BDF1 - гибриды первого поколения f1(C57Bl6×DBA2) разведения питомника РАМН "Столбовая". В опытах использовано 100 мышей, самцов с массой тела 18-20 г.
В качестве опухолевой тест-системы служила перевиваемая солидная опухоль животных меланома В-16. Опухоль перевивалась в соответствии со стандартным регламентом под кожу правого бока мышей измельченными фрагментами опухолевой ткани, содержащимися в 0,3 мл физиологического раствора хлористого натрия /Трещалина Е.М., Жукова О.С., Герасимова Г.К., Андронова Н.В., Гарин A.M. «Методические указания по изучению противоопухолевой активности фармакологических веществ» // Книга «Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ» (ред. Р.У.Хабриев), издание 2, М., «Медицина», 2005, с.637-651/.
В первой серии эксперимента принимали участие 5 групп мышей (по 8 мышей в каждой группе):
1-я группа - интактный контроль с трансплантированной мышам солидной опухолью меланома В-16;
2-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением сгущенного экстракта мицелия Pleurotus ostreatus 1137 в виде геля, составляющего фармакологическую субстанцию препарата в дозе 100 мг/кг, перорально, десятикратно, ежедневно, в первые 10 суток. В первые сутки препарат вводили через 1 час после трансплантации мышам опухоли и затем в последующие 9 суток ежедневно;
3-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением активного начала 4-гидрокси-17R-метилинцистерол препарата в дозе 2 мг/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток. Метод введения активного начала препарата аналогичен его введению второй группе;
4-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением заявляемого препарата в виде геля в дозе 100 мг/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
5-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением заявляемого препарата в виде сиропа в дозе 6.0 мл/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
б) Во второй серии эксперимента принимали участие 3 группы мышей (по 8 мышей в каждой группе):
1-я группа - интактный контроль с трансплантированной мышам солидной опухолью меланома В-16;
2-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением циклофосфана (ЦФ) в дозе 100 мг/кг, внутрибрюшинно, однократно, в первые сутки;
3-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением сочетанного применения ЦФ в дозе 100 мг/кг внутрибрюшинно, однократно, в первые сутки и фармакологической субстанции препарата в виде геля в дозе 100 мг/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток. В первые сутки препарат вводили через 1 час после трансплантации мышам опухоли и затем в последующие 9 суток ежедневно.
в) В третьей серии эксперимента принимали участие 3 группы мышей (по 8 мышей в каждой группе):
1-я группа - интактный контроль с трансплантированной мышам солидной опухолью меланома В-16;
2-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением ЦФ в дозе 50 мг/кг, внутрибрюшинно, однократно, в первые сутки;
3-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением сочетанного применения ЦФ в дозе 50 мг/кг, внутрибрюшинно, однократно, в первые сутки и активного начала 4-hydroxy-17R-methylincisterol препарата в дозе 2 мг/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
г) В четвертой серии эксперимента принимали участие 3 группы мышей (по 8 мышей в каждой группе):
1-я группа - интактный контроль с трансплантированной мышам солидной опухолью меланома В-16;
2-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением ЦФ в дозе 50 мг/кг, внутрибрюшинно, однократно, в первые сутки;
3-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением сочетанного применения ЦФ в дозе 50 мг/кг внутрибрюшинно, однократно, в первые сутки и заявляемого препарата в виде сиропа в дозе 8.0 мл/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
Ежедневно во всех группах четырех серий эксперимента проводили осмотр животных для оценки наличия и степени выраженности опухоли (визуально и пальпаторно), а также признаков возможной интоксикации. Фиксировали: среднюю массу опухоли (г); торможение роста опухоли (ТРО) (в %); среднюю продолжительность жизни животных (сутки); увеличение средней продолжительности жизни животных экспериментальных групп относительно продолжительности жизни животных контрольной группы (в %).
Результаты исследований четырех серии экспериментов приведены в табл.4-7 и на фиг.10-18.
В частности, на фиг.10 показаны результаты противоопухолевой активности сгущенного экстракта мицелия Pleurotus ostreatus 1137 в виде геля, составляющего фармакологическую субстанцию препарата, на модели солидной опухоли меланома В-16, где:
1 - группа мышей интактного контроля с трансплантированной солидной опухолью меланома В-16;
2 - экспериментальная группа мышей с трансплантированной солидной опухолью меланома В-16 с введением фармакологической субстанции препарата в дозе 100 мг/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
На фиг.11 показаны результаты противоопухолевой активности активного начала производной стерола 4-гидрокси-17R-метилинцистерол заявляемого препарата на модели солидной опухоли меланома В-16, где:
1 - группа мышей интактного контроля с трансплантированной солидной опухолью меланома В-16;
2 - экспериментальная группа мышей с трансплантированной солидной опухолью меланома В-16 и с введением активного начала производной стерола 4-гидрокси-17R-метилинцистерол в дозе 2 мг/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
На фиг.12 показаны результаты противоопухолевой активности заявляемого препарата в виде геля на модели солидной опухоли меланома В-16, где:
1 - группа мышей интактного контроля с трансплантированной солидной опухолью меланома В-16;
2 - экспериментальная группа мышей с трансплантированной солидной опухолью меланома В-16 и с введением заявляемого препарата в виде геля в дозе 100 мг/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
На фиг.13 показаны результаты ингибирования роста солидной опухоли меланома В-16 у мышей под влиянием введенного заявляемого препарата в виде геля, где:
1 - группа мышей интактного контроля с трансплантированной солидной опухолью меланома В-16;
2 - экспериментальная группа мышей с трансплантированной солидной опухолью меланома В-16 и с введением заявляемого препарата в виде геля в дозе 100 мг/кг, перорально, десятикратно, ежедневно, втечение 1…10 суток.
На фиг.14 показана диаграмма выживаемости мышей с солидной опухолью меланома В-16 у мышей, получивших заявляемый препарат в виде геля, где:
1 - группа мышей интактного контроля с трансплантированной солидной опухолью меланома В-16;
2 - экспериментальная группа мышей с трансплантированной солидной опухолью меланома В-16 и с введением заявляемого препарата в виде геля в дозе 100 мг/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
На фиг.15 показаны результаты противоопухолевой активности заявляемого препарата в виде сиропа на модели солидной опухоли меланома В-16, где:
1 - группа мышей интактного контроля с трансплантированной солидной опухолью меланома В-16;
2 - экспериментальная группа мышей с трансплантированной солидной опухолью меланома В-16 и с введением заявляемого препарата в виде сиропа в дозе 6,0 мл/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
На фиг.16 показаны результаты ингибирования роста солидной опухоли меланома В-16 у мышей под влиянием введенного заявляемого препарата в виде сиропа, где:
1 - группа мышей интактного контроля с трансплантированной солидной опухолью меланома В-16;
2 - экспериментальная группа мышей с трансплантированной солидной опухолью меланома В-16 и с введением заявляемого препарата в виде сиропа в дозе 6,0 мл/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
На фиг.17 показана диаграмма выживаемости мышей с солидной опухолью меланома В-16 у мышей, получивших заявляемый препарат в виде сиропа, где:
1 - группа мышей интактного контроля с трансплантированной солидной опухолью меланома В-16;
2 - экспериментальная группа мышей с трансплантированной солидной опухолью меланома В-16 и с введением заявляемого препарата в виде сиропа в дозе 6,0 мл/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
На фиг.18 показаны результаты противоопухолевой активности сочетанного применения заявляемого препарата в виде сиропа и циклофосфана на модели солидной опухоли меланома В-16 (4-я серия экспериментов), где:
1 - группа мышей интактного контроля с трансплантированной солидной опухолью меланома В-16;
2 - экспериментальная группа мышей с трансплантированной солидной опухолью меланома В-16 с введением ЦФ в дозе 50 мг/кг, внутрибрюшинно, однократно, в первые сутки;
3 - экспериментальная группа мышей с трансплантированной солидной опухолью меланома В-16 с введением сочетанного применения ЦФ в дозе 50 мг/кг, внутрибрюшинно, однократно, в первые сутки и заявляемого препарата в виде сиропа в дозе 8,0 мл/кг, перорально, десятикратно, ежедневно, в течение 1…10 суток.
При анализе представленных в табл.4 и показанных на фиг.10-17 данных динамики изменения контролируемых показателей противоопухолевой активности веществ установлена зависимость их активности от типа применяемого состава. Из изученных четырех составов индивидуального применения препаратов наибольшее торможение роста опухоли вызвали заявляемые препараты с полифункциональной медико-биологической активностью в виде геля (4-я группа) и сиропа (5-я группа), которое соответственно на 21-е сутки после перевивки мышам опухоли составили 61% и 55%. При этом средний объем опухоли у мышей этих групп, по сравнению с интактным контролем (1-я группа), на 21-е сутки уменьшился соответственно в 2,9 и 2,5 раза.
Средняя продолжительность жизни животных, принимавших заявляемый препарат, увеличилась по сравнению с группой интактного контроля соответственно на 117% и 109,5% и значительно превосходила среднюю продолжительность жизни животных, применявших фармакологическую субстанцию заявляемого препарата (2-я группа) или его активное начало (3-я группа).
Для наглядной оценки противоопухолевого эффекта заявляемого препарата в виде геля и сиропа на всем протяжении ростингибирующего эффекта опухоли меланома В-16 полученные данные представлены в виде зависимостей, характеризующих динамику изменения размеров опухоли у леченых животных в процентах по отношению к контролю (показатель Т/С%, см. фиг.13, 16).
Приведенные на этих фигурах зависимости подтверждают эффективность торможения роста опухоли на протяжении наблюдаемого периода ее развития, которые по выраженности и характеру противоопухолевого действия имеют свою индивидуальность.
Заявляемый препарат в виде геля или сиропа спустя 11 суток после окончания курса терапии оказывает устойчивое противоопухолевое действие, сохраняющееся на уровне 55-60%.
После исследования противоопухолевой активности заявляемого препарата у животных после их гибели (на 43 сутки перевивки опухоли) извлекалась оставшаяся часть опухоли, с которой были проведены гистологические исследования специалистами клеточной биологии и цитологии. В результате проведенных исследований было установлено, что на большом увеличении (ув.×40) фрагментов поперечных сечений леченой опухоли нет четко выраженной зональности. Под поперечнополосатой мускулатурой присутствуют множественные очаги некротической гибели клеток. Под слоем мышечных волокон располагаются сосуды с клетками крови и многочисленные апоптические клетки.
Многочисленные мелкие сосуды пронизывают опухоль, для клеток которой характерна базофилия, ядра геторогенны по размеру и форме. В опухоли присутствуют многочисленные меланоциты с гранулами. Обширные очаги некроза проникают вглубь опухоли. В составе опухоли на границе лейкоцитарного вала, часто в отдельных лакунах выявляются апоптические клетки с характерными выростами мембран и гетеропикнотичными ядрами. Зоны некроза окружены лейкоцитарным валом (воспаление) из лимфоцитов, макрофагов и нейтрофилов.
Таким образом, в результате индивидуального применения заявляемого препарата в первые 1-10 суток после перевивки мышам солидной опухоли меланома В-16 сделано заключение о том, что оставшаяся после лечения часть опухоли пронизана многочисленными очагами некротической и апоптической гибели клеток. Опухоль активно разрушается.
При анализе представленных в таблицах 5, 6 и 7 и показанных на фигуре 18 данных динамики изменения контролируемых показателей противоопухолевой активности исследуемых фармакологической субстанции и активного начала 4-гидрокси-17R-метилинцистерол, заявляемого препарата (см. табл.5, 6), а также непосредственно заявляемого препарата в виде сиропа (см. табл.7, фиг.18) при их сочетанном применении с циклофосфаном (ЦФ) установлена зависимость активности от применяемого состава.
В результате проведенной серии эксперименов показано, что совместное применение исследуемых составов веществ и ЦФ вызывает глубокое торможение роста опухоли меланома В-16, изменяющееся в пределах от 70% до 96%, по сравнению с нелеченным интактным контролем мышей.
При этом средний объем опухоли у мышей этих групп по сравнению с интактным контролем (1-я группа) уменьшился практически на всем протяжении при испытании фармакологической субстанции с ЦФ в 14,3 раз (см. табл.5), при испытании активного начала 4-гидрокси-17R-метилинцистерол препарата с ЦФ в 3,75 раза (см. табл.6) при испытании заявляемого препарата в виде сиропа с ЦФ в 23 раза (см. табл.7, фиг.18).
Обобщая результаты изучения эффективности сочетанного комбинированного применения заявляемого препарата с полифункциональной медико-биологической активностью в виде сиропа в дозе 8,0 мл/кг в течение первых 1...10 суток и ЦФ в дозе 50 мг/кг однократно, в первые сутки после перепрививки опухоли практически приводит к полному ингибированию опухоли по сравнению с интактным нелеченным контролем, не оказывая при этом отрицательного влияния на противоопухолевый эффект цитостатика.
Более того, необходимо подчеркнуть, что обладая детоксицирующим действием, заявляемый препарат существенным образом улучшает клиническую картину «качества жизни» животных (активность, внешний вид, состояние шерсти, поведенческие реакции, масса тела, отсутствие диареи) по сравнению с животными, получавшими только циклофоссран, а также по сравнению с нелеченными мышами интактного контроля.
Д. При изучении влияния фармакологической субстанции заявляемого препарата
и ЦФ на гематологические показатели периферической крови здоровых животных эксперименты проведены на мышах линии C57B L/6, возраст - 8 недель, вес 23-30 г.
Клетки солидной опухоли В-16 были выращены на среде RPMI с 10% фетальной сывороткой, собраны путем трипсинизации, отмыты трижды средой, ресуспензированы в охлажденном до 4°С фосфатно-солевом буфере PBS и хранились на льду (время хранения не превышало 30 мин). Перевивка опухоли осуществлялась путем подкожной инъекции в спину животного 30 мкл суспензии, содержащей 10 клеток. На пятые сутки после перевивки опухоли животным из числа особей, показывающих стабильный рост опухоли, были сформированы 4 группы мышей (по 4 мыши в каждой группе).
1-я группа - интактный контроль с трансплантированной мышам солидной опухолью меланома В-16;
2-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением ЦФ в дозе 300 мг/кг, внутрибрюшинно, однократно, на 5-е сутки после перевивки опухоли;
3-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением фармакологической субстанции заявляемого препарата в виде геля в дозе 100 мг/кг, внутрибрюшинно, десятикратно, ежедневно, в течение 1…10 суток после введения ЦФ. В первые сутки субстанцию препарата в виде геля вводили через 2 часа после иньекции ЦФ;
4-я группа - трансплантированная мышам солидная опухоль меланома В-16 с введением сочетанного применения ЦФ в дозе 300 мг/кг, внутрибрюшинно, однократно, через 5 суток после перевивки опухоли и фармакологической субстанции заявляемого препарата в виде геля в дозе 100 мг/кг, внутрибрюшинно, десятикратно, ежедневно, в течение 1…10 суток после введения ЦФ.
В ходе эксперимента измерялось количество лейкоцитов в периферической крови (перед введением ЦФ и на первые, четвертые и седьмые сутки после введения ЦФ).
Измерение количества лейкоцитов проводилось по стандартной методике /Е.А.Кост. Справочник по клиническим лабораторным методам исследования. М., Медицина, 1975/.
Результаты этой серии экспериментов приведены в табл.8 и показаны на фиг.19, где:
- группа 1 - интактный контроль (ИК);
- группа 2 - введение мышам ЦФ;
- группа 3 - введение мышам фармакологической субстанции заявляемого препарата (ФС Пр);
- группа 4 - введение мышам сочетанного применения ЦФ и фармакологической субстанции заявляемого препарата (ФС Пр+ЦФ).
Подсчет количества лейкоцитов в периферической крови показал, что фармакологическая субстанция улучшает восстановление лейкоцитов животных после лечения ЦФ (см. фиг.19, табл.8).
В 4-й группе, получавшей ЦФ и фармакологическую субстанцию, количество лейкоцитов на следующий день после введения ЦФ было выше количества лейкоцитов, чем во 2-ой группе, получавшей только ЦФ (соответственно, 43% и 29% от исходного). На третий день количество лейкоцитов в 4-й группе выросло до 51%, в то время как 2-ой группе несколько упало, до 27%. На седьмой день количество лейкоцитов нормализовалось у всех мышей.
Таким образом, применение фармакологической субстанции заявляемого препарата вызывает более раннее и интенсивное восстановление количества лейкоцитов в периферической крови леченых мышей после применения ЦФ и снижает гематотоксичность, в частности, выраженность и продолжительность лейкопении, вызванную введением животным ЦФ в дозе 300 мг/кг веса тела.
Е. При изучении гиполипидемическго и гепатопротекторного действия препарата и его составляющих веществ у животных на модели атерогенной диеты (АД) в эксперименте принимали участие 5 групп беспородных лабораторных половозрелых самцов-крыс с исходной массой тела 300-350 г (по 8 крыс в каждой группе):
1-я группа - интактный контроль (ИК);
2-я группа - атерогенная диета (АД);
3-я группа - АД с активным началом 4-гидрокси-17R-метилинцистерол препарата в дозе 2 мг/кг, перорально, десятикратно, ежедневно, после первых 4 суток применения АД (АН Пр);
4-я группа - АД с применением фармакологической субстанции заявляемого препарата в дозе 100 мг/кг, перорально, десятикратно, ежедневно, после первых 4 суток применения АД(АД+ФС Пр);
5-я группа - АД с применением препарата в виде сиропа в дозе 8 мл/кг, перорально, десятикратно, ежедневно, после первых 4 суток применения АД (АД+Пр сироп).
Все испытываемые вещества вводили крысам перорально с интервалом 3 часа после атерогенной нагрузки в течение последних 10 дней АД.
В течение всего эксперимента вели лист наблюдения: выживаемость, общий вид, состояние и поведение животных, изменение массы тела (взвешивание крыс проводили один раз в неделю).
В конце эксперимента у животных после 18 часов голодания брали кровь из хвостовой вены в центрифужные пробирки. Кровь центрифугировали и отбирали сыворотку для проведения биохимических анализов, а именно: содержание общего холестерина (ХС общ.); холестерина липопротеинов высокой плотности (ХС ЛПВП); холестерина липопротеинов низкой плотности (ХС ЛПНП); холестерина липопротеинов очень низкой плотности (ХС ЛПОНП); триглицеридов (ТГ); индекс атерогенности (ИА); аланинаминотрансферазы (АлАТ); аспартатаминотрансферазы (АсАТ); щелочной фосфотазы (ЩФ).
Анализы проводились унифицированными методами на биохимическом фотометре «Стат факс 1904+» производства США с использованием стандартных наборов реагентов.
В настоящее время для изучения ранних этапов развития НАСГ и тестирования различных средств, необходимых для его лечения, предложены экспериментальные модели, в которых развитие жировой дистрофии печени индуцируется искусственным повышением количества липидов в плазме крови лабораторных животных /Fan et al., 2003; VanSaun et al., 2009; Бивалькевич, Карман, 2010/.
Аналогичная модель использована для изучения действия заявляемого препарата и его составляющих веществ на ранних этапах развития НАСГ.
Для гистологического и ультраструктурного анализа печени исследуемых групп крыс материал забирали у только что забитых животных. Небольшой фрагмент печени отделяли ножницами, переносили в 4% раствор глютарового альдегида на 0,1 М фосфатном буфере Зеренсена. Фрагмент разрезали бритвенным лезвием на кусочки объемом около 1 мм3, полученные образцы переносили в свежую фиксирующую смесь того же состава. Фиксацию проводили при комнатной температуре в течение 4-х часов. Затем образцы промывали в дистиллированой воде и постфиксировали 1% водным раствором тетраоксида осмия в течение 12 часов при +4°С. Образцы обезвоживали в этаноле возрастающей концентрации (70% этанол содержал 2% уранил-ацетата), ацетоне и заключали в эпоксидную смолу по стандартной методике.
Для гистологического анализа изготавливали «полутонкие» срезы толщиной около 1 мкм, окрашивали срезы красителем метиленовым синим и изучали в световом микроскопе с использованием объективов ×10 и ×100.
Для электронной микроскопии ультратонкие срезы толщиной около 80 нм контрастировали 1%-ным водным раствором уранил-ацетата 20 минут и цитратом свинца и фотографировали в электронном микроскопе Hitachi H-700 (Япония).
Результаты исследований этой серии экспериментов приведены на фиг.20, 21 и табл.9, 10, 11.
В частности, на фиг.20 показаны биохимические показатели гиполипидемической активности заявляемого препарата и его составляющих веществ.
На фиг.21 показаны биохимические показатели гепатопротекторной активности препарата и его составляющих веществ.
При анализе результатов световой и электронной микроскопии срезов группы крыс интактного контроля было установлено, что на «полутонких» срезах печени хорошо прослеживается упорядоченное расположение печеночных клеток (гепатоцитов) в виде тяжей (балок). Между балками проходят внутридольковые кровеносные капилляры, в которых располагаются клетки крови, в основном эритроциты. Гепатоциты представлены одно и двуядерными клетками. Ядра имеют 1 или 2 ядрышка, структура хроматина типична для клеток с нормальной метаболической активностью. В равномерной по плотности цитоплазме гепатоцитов визуализируются многочисленные темные глобулы, соответствующие выявляемым гистологическими методами базофильным гранулам. На электронномикроскопных препаратах эти зоны идентифицируются как обособленные участки гранулярного ЭПР. Липидные включения в виде обособленных капель не выявляются. Гепатоциты с признаками некротической гибели или апоптоза отсутствуют.
При анализе результатов световой и электронной микроскопии группы с АД было установлено нарушение расположения печеночных клеток (гепатоцитов). Характерное для нормальной печени расположение печеночных клеток (гепатоцитов) в виде тяжей (балок) нарушается за счет сильного увеличения объема гепатоцитов. Такого рода изменения затрагивают всю площадь печеночной дольки. Соответственно, теряется упорядоченная ориентация внутридольковых капилляров, вместо них формируются лакуны различного размера и формы, содержащие увеличенное по сравнению с контролем количество эритроцитов и лейкоцитов. В целом по структуре внутридольковых капилляров и обогащенности лакун элементами крови картина соответствует венозной гиперемии.
На клеточном уровне АД приводит к формировании в гепатоцитах многочисленных капель липидов. Значительные изменения наблюдаются в структуре ядер: они приобретают неправильную форму (по-видимому, в связи со сдавливанием липидными включениями), хроматин и ядрышки выглядят более компактными по сравнению с контролем. Такая структура ядер возникает в случае частичного повреждения клеточных мембран и может быть идентифицирована как «паранекроз», т.е. обратимое функциональное состояние клетки, предшествующее некрозу. Гепатоциты с признаками некротической гибели или апоптоза отсутствуют.
Во 2-й группе крыс по сравнению с 1-й группой крыс ИК после АД наблюдается повышение уровня ХС на 34% и ТГ на 50%, снижение фракции ХС ЛПВП на 17%, резкое возрастание на 78% ХС ЛПНП и на 40% повышение уровня ХС ЛПОНП (см. фиг.20, табл.9).
При анализе результатов световой и электронной микроскопии 3-й и 4-й и 5-й групп опытных крыс с гепатопротекторным действием заявляемого препарата и его составляющих веществ было установлено, что введение одновременно с холестеролом разных форм препарата блокирует развитие жировой дистрофии печени, вызываемой АД, однако их активность, направленная на нормализацию патологии, сильно различается.
Наибольшей эффективностью, выявленной по гистологическим показателям, обладает активное начало 4-гидрокси-17R-метилинцистерол заявляемого препарата (3-я группа).
Установлено, что введение одновременно с холестеролом этого препарата блокирует развитие жировой дистрофии, вызваемой АД. В печени сохраняется упорядоченное расположение гепатоцитов в виде балок и нормальная структура внутридольковых капилляров. Структура и расположение базофильных гранул остаются близкими к норме, признаки жировой дистрофии в гепатоцитах слабо выражены. Ядра гепатоцитов имеют правильную форму и по общей организации хроматина соответствуют контролю. Таким образом, на основе гистологических исследований можно утверждать, что активное начало препарата проявляет выраженные гепатопротекторные свойства. Однако очевидно, что гистологический анализ, при всей его убедительности, не может считаться единственным критерием для вывода о предотвращении развития стеатоза. Для более точной характеристики используемых препаратов, как возможных гепатопротекторов, были сопоставлены данные гистологического анализа с биохимическими показателями крови, полученными для всех пяти изученных групп животных.
Установлено, что наибольшим эффектом предотвращения дислипидемии в гепатоцитах с нормализацией биохимических показателей крови АлАТ, АсАТ и ЩФ обладает заявляемый препарат в виде сиропа (5-я группа, см. фиг.21, табл.10).
В крови животных, получавших этот препарат, по сравнению с АД понижен уровень ХС на 23%. При этом уровень ТГ понижен на 53% и опускается ниже контрольных значений на 30%, повышается количество ХС ЛПВП на 16%, снижается уровень ХС ЛПНП на 19%, снижается уровень ХС ЛПОНП на 58%. Убедительным свидетельством гепатопротекторного действия препарата является значительное снижение ИА на 38% у животных, которые вместе с высококалорийной диетой получали заявляемый препарат в виде сиропа (см. фиг.20, табл.9).
По результатам патоморфологических исследований состояния внутренних органов экспериментальных групп животных установлено, что исследуемые органы (грудная и брюшная полости крыс, легкие, щитовидная железа, тимус, сердце, слизистая пищевода, желудок, толстый и тонкий кишечник, поджелудочная железа, селезенка, почки, мочевой пузырь, печень) у подопытных животных 3-й, 4-й и 5-й групп не отличаются от 1-й группы ИК крыс.
Средние показатели массы тела животных приведены в табл.11.
Таким образом, в результате применения заявляемого препарата с полифункциональной медико-биологической активностью, влияющего на тканевой обмен, установлено, что после применения препарата развитие деструктивных изменений в печени блокируется как на уровне общей организации печени, так и на клеточном уровне. Незначительное количество жировых включений формируется только в единичных клетках, при этом ядра, митохондрии и другие цитоплазматические органоиды сохраняют структурную нативность. О том, что препарат обладает выраженными цитопротекторными свойствами свидетельствуют биохимические пробы. На фоне действия препарата близко к норме сохраняются показатели, характеризующие деструктивные процессы в печени (ХС), и дислипидемию (ТГ и липопротеины различной плотности).
Заявляемый препарат с полифункциональной медико-биологической активностью получают биотехническим способом с использованием:
- культуры гриба Pleurotus ostreatus 1137 (ВКПМ, F-819) для выращивания биомассы мицелия;
- агара микробиологического по ГОСТ 17206-84;
- сусла пивного пищевого по ГОСТ 51-174-98;
- мицелия гриба вешенки (штамм 1137, ВКПМ, F-819), выращенного в погруженных условиях в жидкой стерильной питательной среде по ТУ 9317-01-87552538-08;
- сгущенного экстракта в виде геля состоящего из смеси низкомолекулярных веществ, выделенного из мицелия Pleurotus ostreatus 1137 по ТУ 9317-01-87552538-08;
- активного начала в виде биологически активного вещества производной стерола 4-гидрокси-17R-метилинцистерол, дополнительно выделенного из сгущенного экстракта мицелия Pleurotus ostreatus 1137 (геля) по разработанной технологии;
- полисахарида β 1-3 глюкана, впервые выделенного из переработанного мицелия Pleurotus ostreatus 1137 после экстракции из него экстракта в виде смеси низкомолекулярных биологически активных веществ;
- дигидрокверцетина, выпускаемого промышленно в виде аморфного порошка с молекулярной массой 304,26 дальтон по ТУ 9197-031-02699613-2006;
- спирта этилового ректификата по ГОСТ Р51652-2000;
- кислоты соляной по ГОСТ 3118-77;
- воды питьевой по ГОСТ 2874, ГОСТ Р 51232-98;
- фруктозы кристаллической, CF4118136AG, фармакопея Германия DAB;
- кислоты лимонной пищевой по ГОСТ 908-79, сорт высший;
- бензоата натрия, 3382SE023494C4, фармакопея Германия DAB;
- дихлорметана ХЧ, ТУ 2631-019-44493179-98, Россия.
Технологический процесс получения препарата с полифункциональной медико-биологической активностью промышленным способом с использованием культуры гриба Pleurotus ostreatus включает 6 этапов и состоит из следующих операций.
На первом этапе выращивания биомассы мицелия селекционные работы со штаммом (поддержание штамма) проводят путем пересева на свежую агаризованную среду. Для проведения селекционной работы проводят рассев спор, выделение моноспоровых вариантов и оценку их свойств, что позволяет поддерживать целевые признаки культуры.
Посевной материал выращивают в пробирках со скошенной агаровой средой, в составе которой присутствуют пивное сусло, агар и вода. После засева пробирки помещают на 10-12 суток в термостат с температурой 28°С.
Глубинное культивирование мицелия осуществляют в жидкой среде, состоящей из водного раствора пивного сусла (10%). Посевной мицелий со скошенного агара вносят в среду из расчета 1 пробирка посевного материала на 1 л среды. Продолжительность культивирования 12-14 суток при постоянном аэрировании. Выращивание проводится в термостатируемом помещении, оснащенном датчиками контроля с самописцами при температуре воздуха t=28°С.
Отделение выращенной биомассы мицелия от культуральной жидкости производят фильтрованием через, например, марлю до полного истечения жидкости из биомассы. Полученный влажный мицелий подвергают экстракции.
На втором этапе осуществляют производство сгущенного экстракта в виде геля, состоящего из смеси низкомолекулярных веществ, образуемых фармакологическую субстанцию заявляемого препарата.
На данном этапе приготовления экстракта мицелия отделенную от культуральной жидкости влажную мицелиальную массу механически измельчают до минимально мелкой фракции и заливают спиртом этиловым ректификатом с добавленной соляной кислотой в концентрации 0,1%. Экстракция проводится в течение 20 часов при температуре 4°С в холодильной камере.
После окончания периода экстракции мицелий отделяют путем фильтрации через марлю, а полученный спиртовой экстракт упаривают в вакуумной установке до состояния вязкого однородного концентрата в форме сгущенного экстракта в виде геля. При этом для контроля на соответствие произведенной фармакологической субстанции берут навеску экстракта и определяют содержание химического состава (углеводов, аминокислот, высших жирных кислот, органических кислот, витаминов, минеральных веществ и воды).
На третьем этапе производят дополнительное выделение активного начала производного стерола 4-гидрокси-17R-метилинцистерол из отобранной части сгущенного экстракта мицелия в виде геля путем его фракционирования дихлорметаном с последующей фильтрацией и лиофилизацией для дальнейшего использования в препарате в качестве обогащающего вещества, вводимого в фармакологическую субстанцию из расчета: на 79,0 или 156 массовых частей фармакологической субстанции - 1,0 или 2,0 массовые части активного гачала в виде производного стерола 4-гидрокси-17R-метилинцистерол.
Выделение производного стерола из сгущенного экстракта мицелия Pleurotus ostreatus 1137 в виде производят выше описанным в изобретении способом.
На четвертом этапе из переработанного мицелия Pleurotus ostreatus 1137 после экстракции из него экстракта в виде смеси низкомолекулярных веществ производят выделение высокомолекулярного полисахарида β 1-3 глюкана путем ферментативного гидролиза экстрагированного этанолом мицелия с целью дальнейшего использования β 1-3 глюкана в препарате в качестве обогащающего вещества, вводимого в фармакологическую субстанцию из расчета: на 79,0 или 156 массовых частей фармакологической субстанции - 10,0 или 20,0 массовые части β1-3 глюкана.
Выделение β 1-3 глюкана из переработанного мицелия производят вышеописанным в изобретении способом. Опытным путем установлено, что, например, из 1000,0 мг сухого переработанного мицелия Pleurotus ostreatus 1137 выделяют до 700,0-750,0 мг β1-3 глюкана.
На пятом этапе производят подготовку товарной формы дигидрокверцетина, используемого в составе препарата в качестве дополнительно введенного антиоксиданта в фармакологическую субстанцию экстракта мицелия Pleurotus ostreatus 1137, с целью дальнейшего его использования в препарате в качестве обогащающего вещества, вводимого в фармакологическую субстанцию из расчета:
на 79,0 или 156 массовых частей фармакологической субстанции - 10,0 или 20,0 массовые части дигидрокверцетина.
Для применения дигидрокверцетина в заявляемом препарате, выполняемом по п.2 в виде геля перед обогащением фармакологической субстанции экстракта мицелия Pleurotus ostreatus 1137 данным веществом предварительно перед его смешиванием с составом экстракта в виде геля, аморфный порошок дигидрокверцетина размельчают до мелкокристаллического порошка (пудры).
Для применения дигидрокверцетина в заявляемом препарате, выполняемом по п.2 в виде сиропа, аморфный порошок дигидрокверцетина предварительно растворяют в приготовленном горячем сиропе фруктозы при температуре 60°С.
Применение аморфного порошка дигидрокверцетина в заявляемом препарате по п.2 в виде таблеток или обезвоженных гранул производят путем его дозирования в фармакологическую субстанцию экстракта Pleurotus ostreatus 1137, приготовленного в виде измельченного мелкокристаллического порошка.
На шестом этапе производят приготовление готовой формы препарата с полифункциональной медико-биологической активностью в виде геля, или сиропа, или таблеток, или обезвоженных гранул.
При этом при приготовлении готовой формы препарата в той или иной из заявляемых по п.2 форм дозировку фармакологической субстанции препарата, содержащей сгущенный экстракт из низкомолекулярных биологически-активных веществ (углеводы, аминокислоты, высшие жирные кислоты, органические кислоты, витамины, минеральные вещества) и обогащенной активным началом производного стерола 4-гидрокси-17R-метилинцистерол с молекулярной массой 332,2452 дальтон, полисахаридом β 1-3 глюканом и дигидрокверцетином с молекулярной массой 304,26 дальтон, производят в следующем массовом соотношении:
(1):(2) (3):(4) как (79,0-158,0):(1,0-2,0):(10,0-20,0):(10,0-20,0),
минимальные и максимальные значения ингредиентов которых приняты в составе препарата исходя из требований токсикологической безопасности и медико-биологической активности применения заявляемого препарата, подтвержденными результатами токсических и медико-биологических испытаний готовой формы препарата и его составляющих компонент.
Примеры приготовления готовой формы заявляемого препарата:
Пример 1
Приготовление готовой формы заявляемого препарата в виде геля осуществляют простым тщательным последовательным перемешиванием приготовленных заранее в требуемом массовом соотношении входящих в состав препарата 1-го, 2-го, 3-го и 4-го компонентов биологически-активных веществ.
На первом этапе, из расчета на 100,0 массовых частей готовой формы заявляемого препарата, взвешивают 79,0 массовых частей сгущенного экстракта мицелия Pleurotus ostreatus 1137 (1-го компонента препарата) и его подогревают до слабовязкого текучего состояния на водяной бане при t=40-50°С.
На втором этапе в 79,0 массовых частей подогретого до t=40-50°С сгущенного экстракта вводят 1,0 массовую часть производного стерола 4-гидрокси-17R-мети-линцистерол (2-го компонента препарата) от 100,0 массовых частей готовой формы заявляемого препарата с последующим тщательным перемешиванием этих компонент при установленной температуре (t=40-50°C) до однородного гомогенного состояния.
На третьем этапе в приготовленную 2-х компонентную смесь сгущенного экстракта мицелия Pleurotus ostreatus 1137 и производного стерола 4-гидрокси-17R-метилинцистерол вводят 10,0 массовых частей полисахарида β 1-3 глюкана (3-го компонента препарата) от 100,0 массовых частей готовой формы заявляемого препарата с последующим тщательным перемешиванием этих компонент при установленной температуре (t=40-50°C) до однородного гомогенного состояния.
На четвертом этапе в приготовленную 3-х компонентную смесь сгущенного экстракта мицелия Pleurotus ostreatus 1137, производного стерола 4-гидрокси-17R-метилинцистерол, полисахарида β 1-3 глюкана вводят 10,0 массовых частей дигидрокверцетина (4-го компонента препарата) от 100,0 массовых частей готовой формы заявляемого препарата с последующим тщательным перемешиванием этих компонент при установленной температуре (t=40-50°C) до однородного гомогенного состояния.
На пятом этапе проводят анализ качества приготовленной готовой формы препарата в виде геля и производят его фасовку по 100,0 мг или 200,0 мг, например, в герметично закрывающиеся стеклянные флаконы и их товарную упаковку.
Пример 2
Приготовление готовой формы заявляемого препарата в виде сиропа осуществляют простым тщательным последовательным перемешиванием приготовленных заранее в требуемом массовом соотношении входящих в состав препарата сиропа, состоящего из смеси 64,0-х массовых частей фруктозы кристаллической, 0,85-ти массовой части кислоты лимонной, 0,15-ти массовой части бензоата натрия, 34,0-х массовых частей воды и 1,0-й массовой части готовой формы препарата в виде геля с применением 1-го, 2-го, 3-го и 4-го компонентов биологически-активных веществ заявляемого препарата, приготовленного в соответствии с выше описанным примером 1.
На первом этапе приготавливают сироп на дистиллированной воде. В предназначенную для приготовления сиропа емкость заливают 34,0-х массовых частей воды от общей массы сиропа и подогревают ее до температуры t=45-50°C.
После подогрева воды в нее вводят 64,0 массовые части фруктозы кристаллической от общей массы сиропа и тщательно ее растворяют в воде при t=45-50°С.
После получения 2-х компонентной смеси сиропа в его состав вводят 0,85 массовой части кислоты лимонной от общей массы сиропа и тщательно ее растворяют в сиропе при t=45-50°C.
После получения 3-х компонентной смеси сиропа в его состав вводят 0,15 массовой части бензоата натрия от общей массы сиропа и тщательно его растворяют в сиропе при t=45-50°C.
На втором этапе приготавливают готовую форму заявляемого препарата в виде геля с применением 1-го, 2-го, 3-го и 4-го компонентов биологическиактивных веществ заявляемого препарата, приготовленного в соответствии с вышеописанным примером 1.
На третьем этапе в приготовленные 99,0 массовых частей состава сиропа вводят 1,0 массовую часть готовой формы заявляемого препарата в виде геля с применением 1-го, 2-го, 3-го и 4-го компонентов биологически-активных веществ заявляемого препарата при t=45-50°C и тщательно перемещивают до однородного гомогенного состояния.
На четвертом этапе приготовленный препарат в виде сиропа охлаждают до комнатной температуры, проводят анализ качества и производят его фасовку, например, по 80,0 мл или 160,0 мл в герметично закрывающиеся стеклянные флаконы и их товарную упаковку.
Таким образом, проведенный комплекс исследований заявляемого препарата, влияющего на тканевой обмен, подтвердил его высокое физиологическое действие с эффективной полифункциональной медико-биологической активностью.
Физиологическое действие препарата, как индуктора апоптоза, с полифункциональной медико-биологической активностью заключается в его способности оказывать влияние на тканевой обмен и ингибировать размножение клеток рака, а также вызывать гепатопротекторное и детоксицирующее действие, проявляющееся в блокировке развития стеатогепатита и нормализации липидного спектра в сыворотке крови биологических систем.
Применение заявляемого препарата на основе штамма Pleurotus ostreatus 1137 (ВКПМ, F-819) с полифункциональной медико-биологической активностью, влияющего на тканевой обмен, позволит повысить противоопухолевую активность при его применении в сочетании с препаратами противоопухолевой химиотерапии, а также снизить токсические проявления в организме при их применении за счет его гепатопротекторного и детоксицирующего действий, что существенно повысит «качество жизни» онкологических больных при профилактике и лечении онкологических заболеваний.
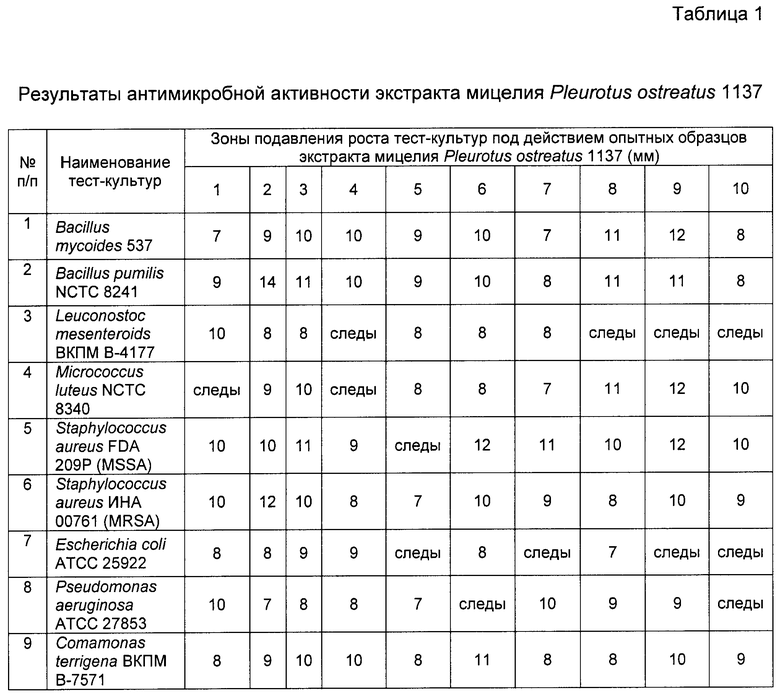


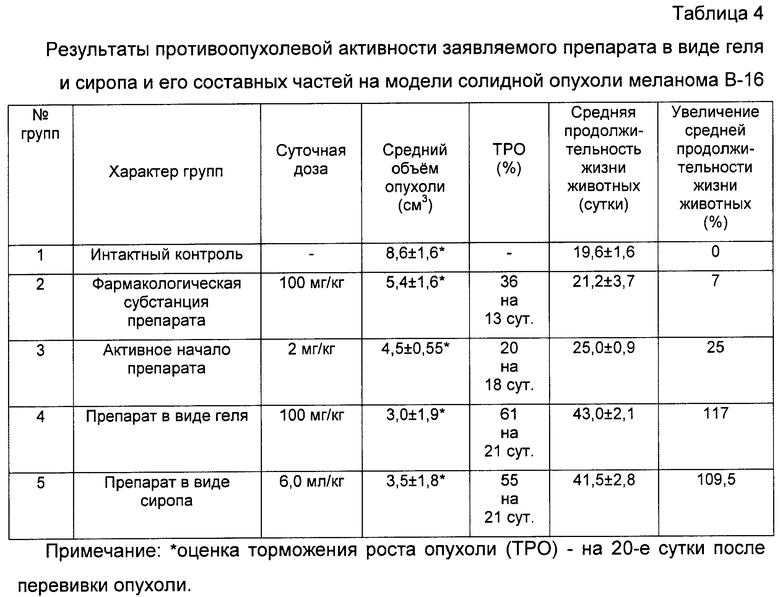
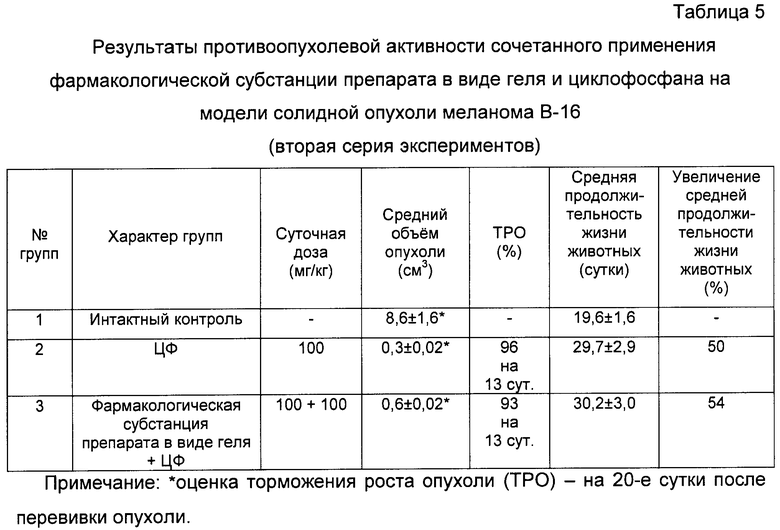
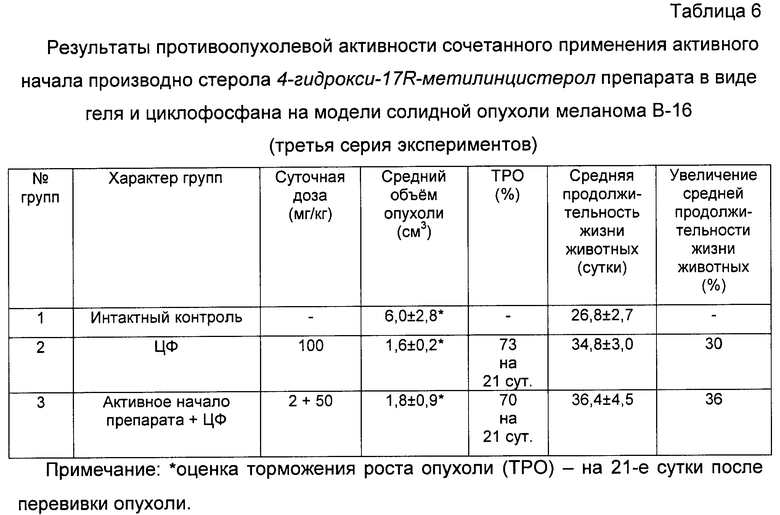
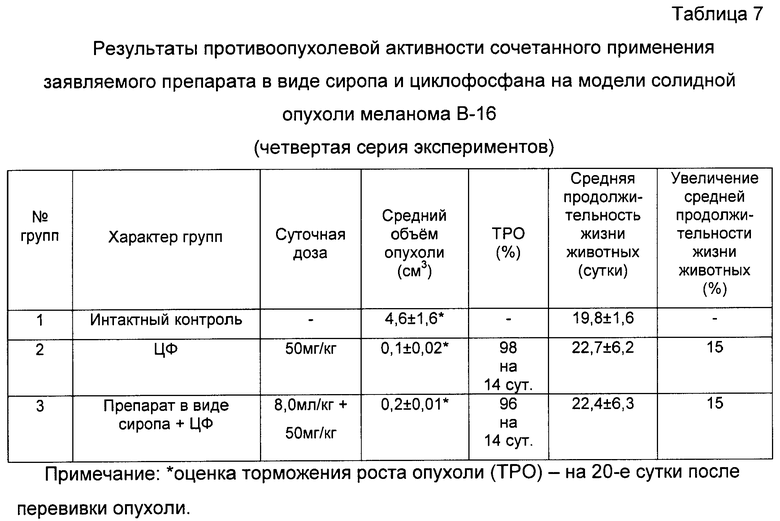
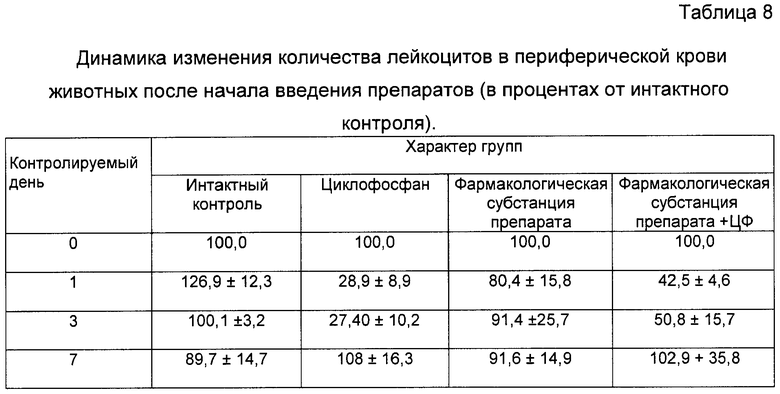
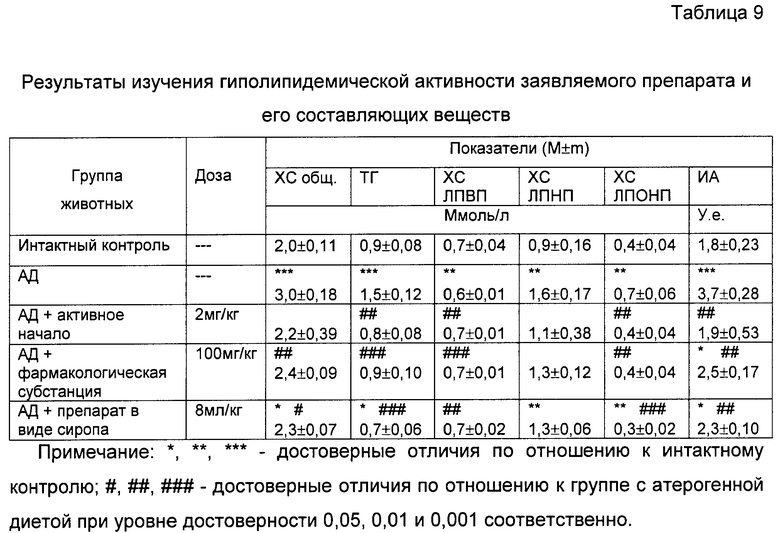
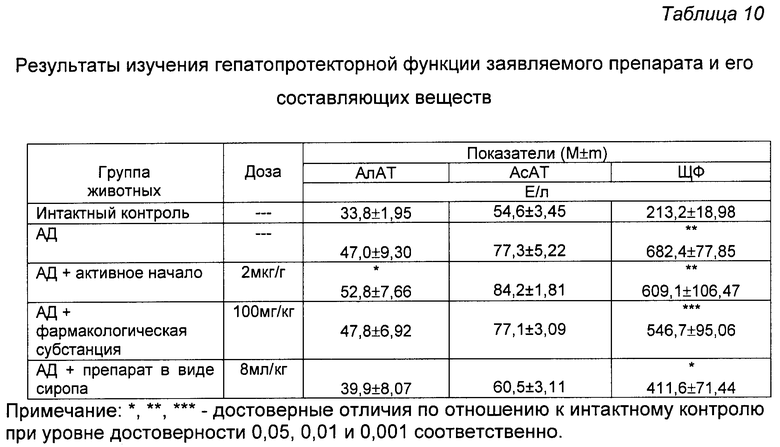
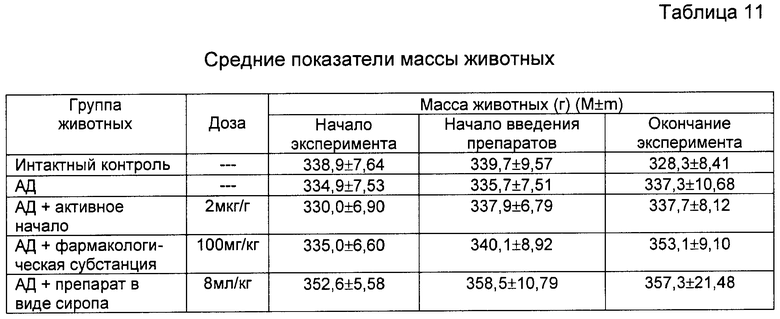
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ 4-Hydroxy-17R-Methylincisterol, ВЛИЯЮЩИЙ НА ТКАНЕВОЙ ОБМЕН, И ПРИМЕНЕНИЕ ШТАММА ГРИБА Pleurotus 1137 ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2010 |
|
RU2435599C1 |
| ПРЕПАРАТ, ВЛИЯЮЩИЙ НА ТКАНЕВОЙ ОБМЕН, И ПРИМЕНЕНИЕ ШТАММА ГРИБА PLEUROTUS 1137 ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2192873C1 |
| Применение препарата "Экстракт мицелия вешенки "РЕВИТАЦЕЛ" на основе штамма гриба Pleurotus ostreatus ВКПМ F-819, влияющего на мужскую репродуктивную функцию | 2016 |
|
RU2634384C1 |
| ПРЕПАРАТ НА ОСНОВЕ ГРИБА PLEUROTUS 1137, ВЛИЯЮЩИЙ НА МУЖСКУЮ РЕПРОДУКТИВНУЮ ФУНКЦИЮ | 2010 |
|
RU2422151C1 |
| ПРЕПАРАТ НА ОСНОВЕ ГРИБА Pleurotus 1137 ДЛЯ КОРРЕКЦИИ ЛЕКАРСТВЕННОЙ НЕПЕРЕНОСИМОСТИ В КОМПЛЕКСНОЙ ТЕРАПИИ ТУБЕРКУЛЕЗА ЛЕГКИХ | 2010 |
|
RU2435600C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, И СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2418062C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНЦИСТЕРОЛА | 2012 |
|
RU2477635C1 |
| ПОСЕВНОЙ МИЦЕЛИЙ БАЗИДИОМИЦЕТА И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2009 |
|
RU2430155C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭМУЛЬСИИ, СОДЕРЖАЩЕЙ НАНО- И МИКРОКАПСУЛИРОВАННЫЕ БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА | 2020 |
|
RU2763171C1 |
| ПИЩЕВОЙ ПРОДУКТ, ОБОГАЩЕННЫЙ ИНУЛИНОМ, ОБЛАДАЮЩИЙ ПРОТИВОСКЛЕРОТИЧЕСКИМ ДЕЙСТВИЕМ | 2017 |
|
RU2630454C1 |
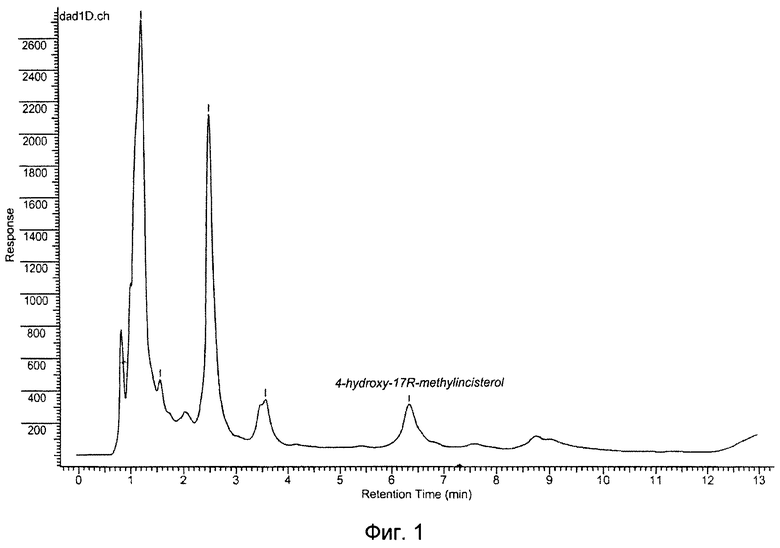
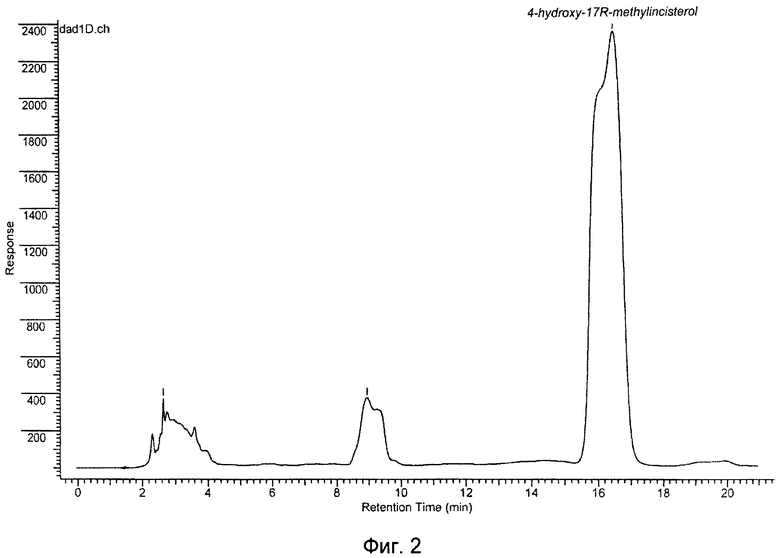
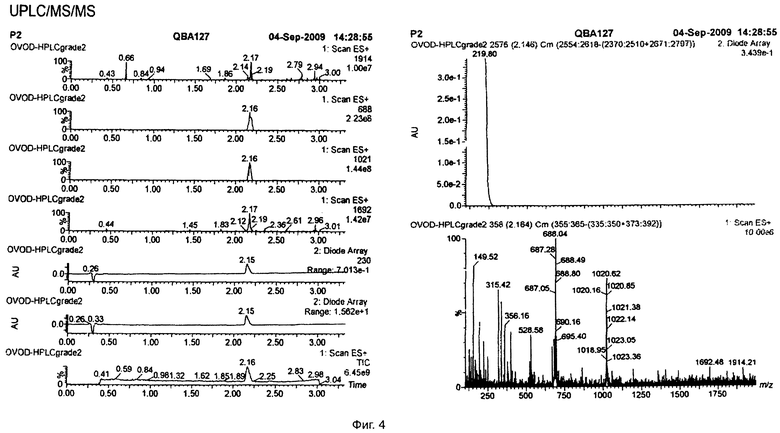
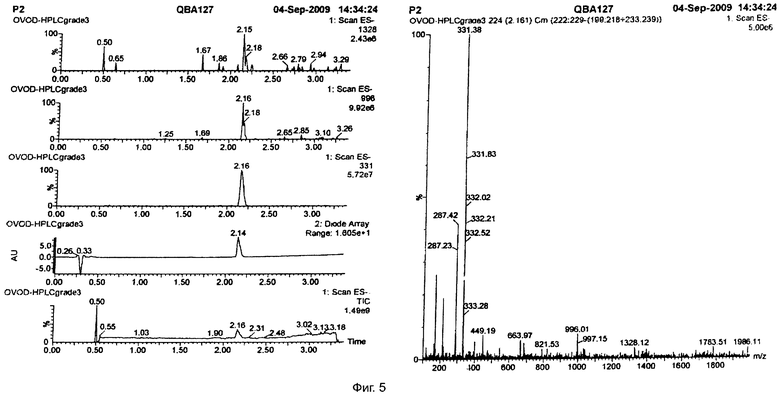
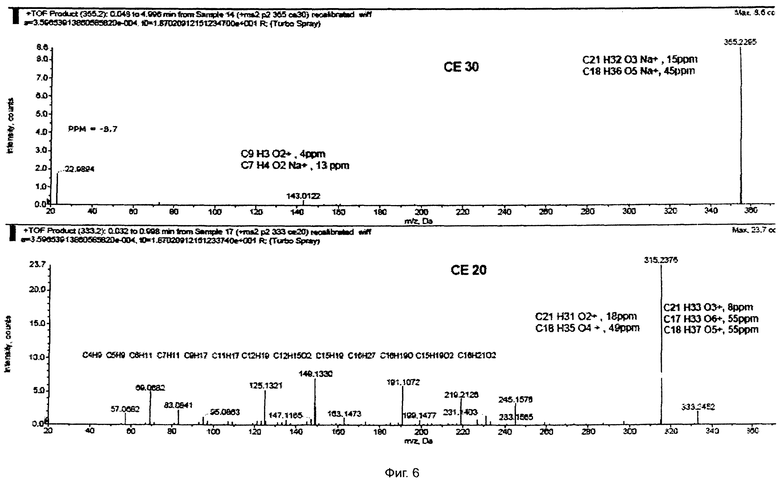
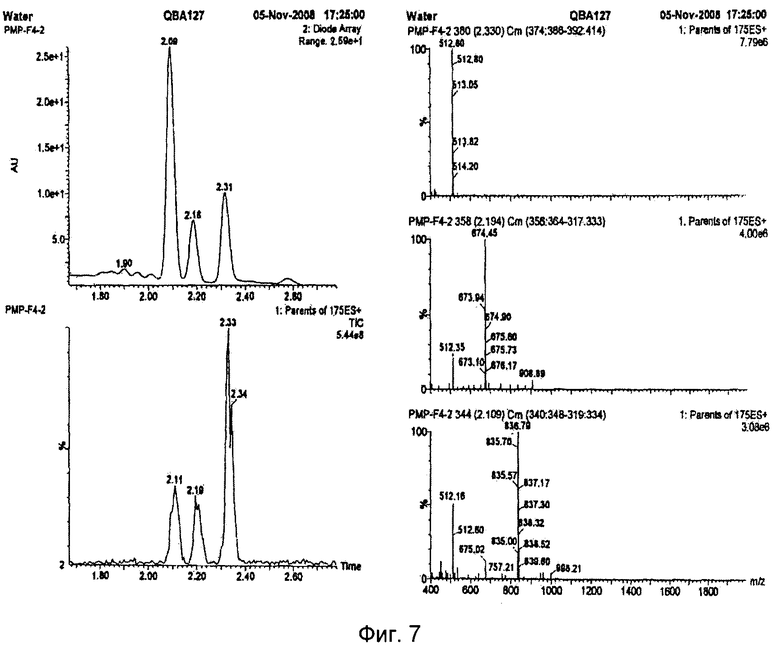
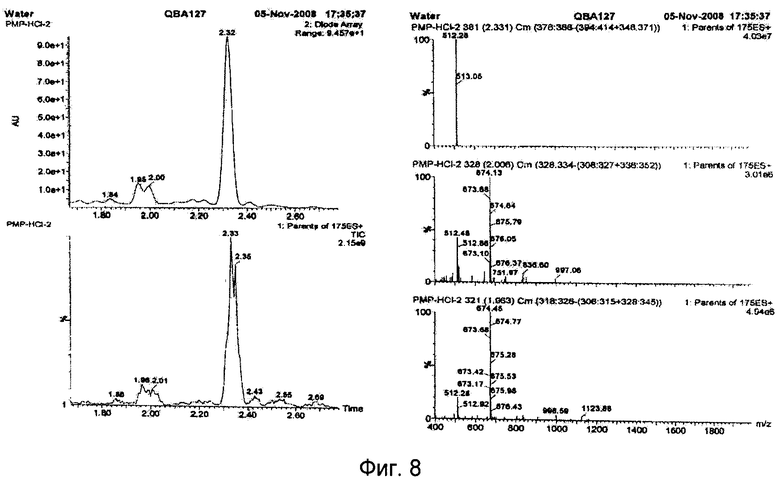
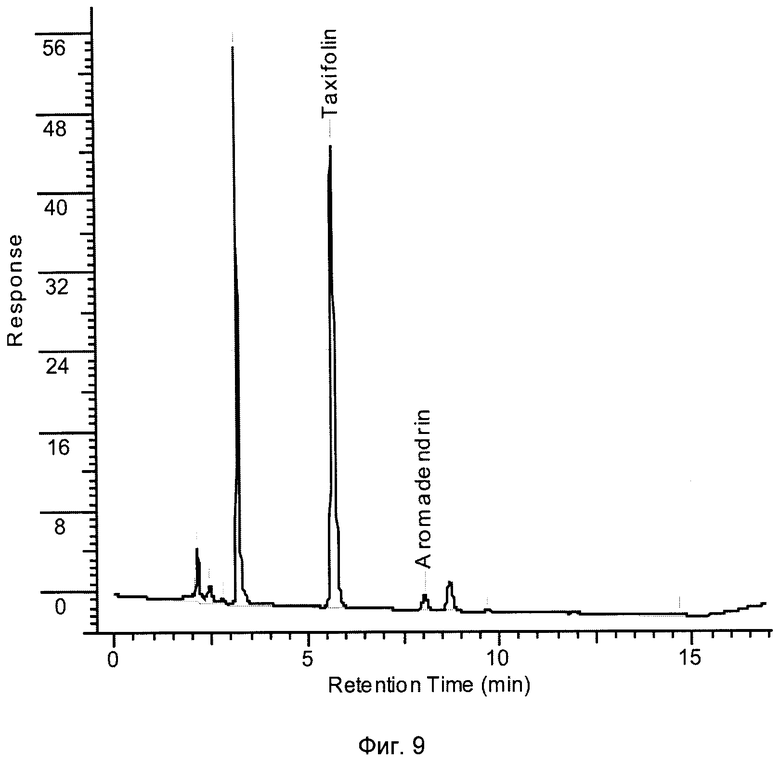
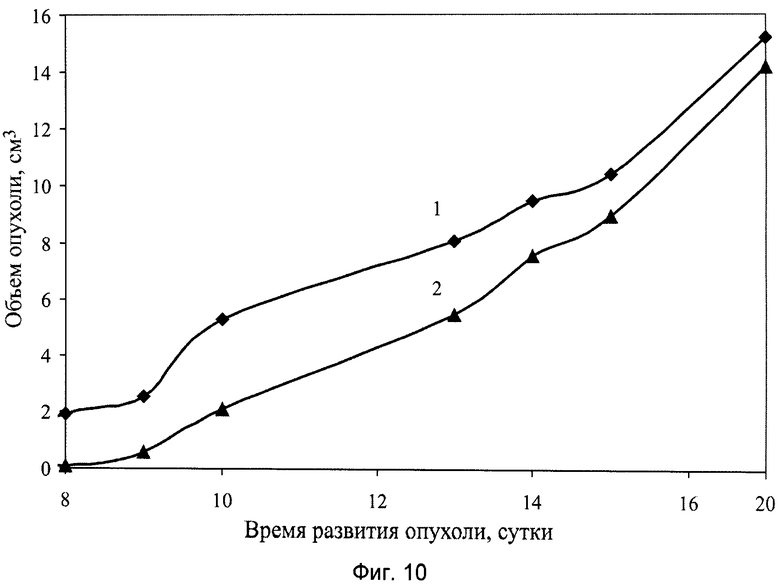
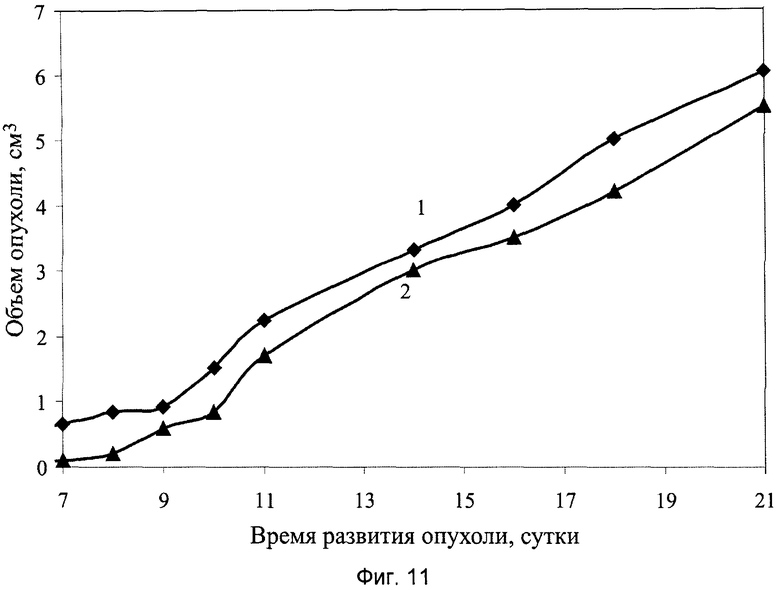
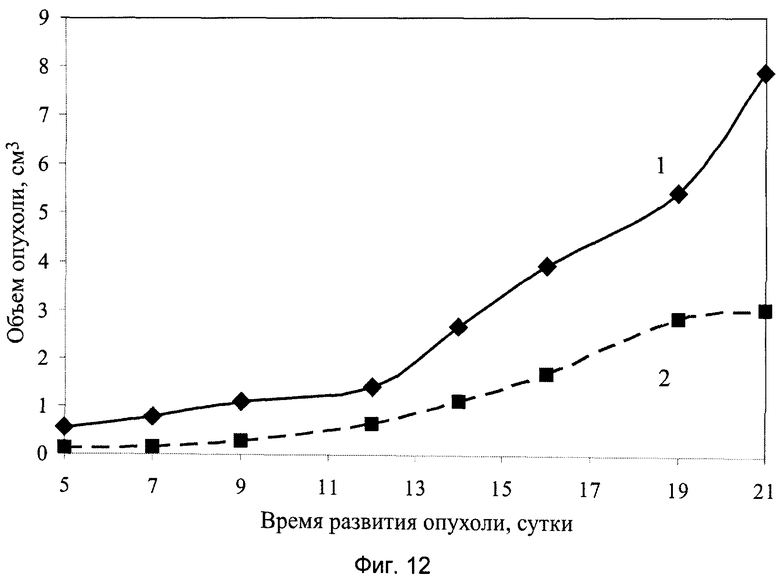
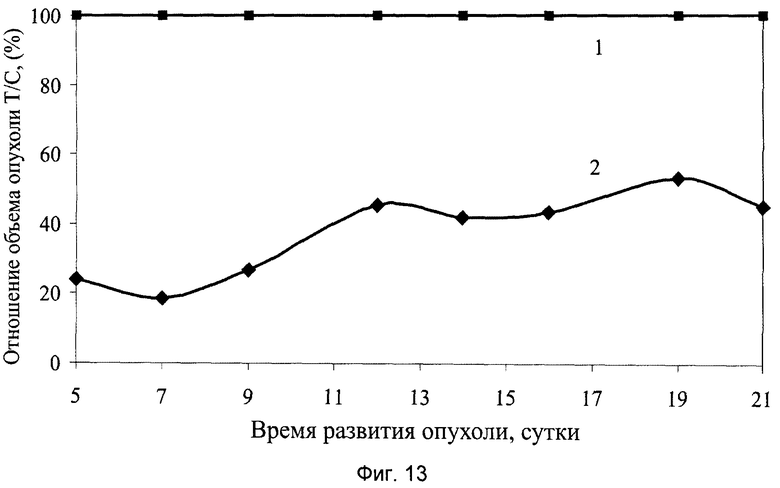
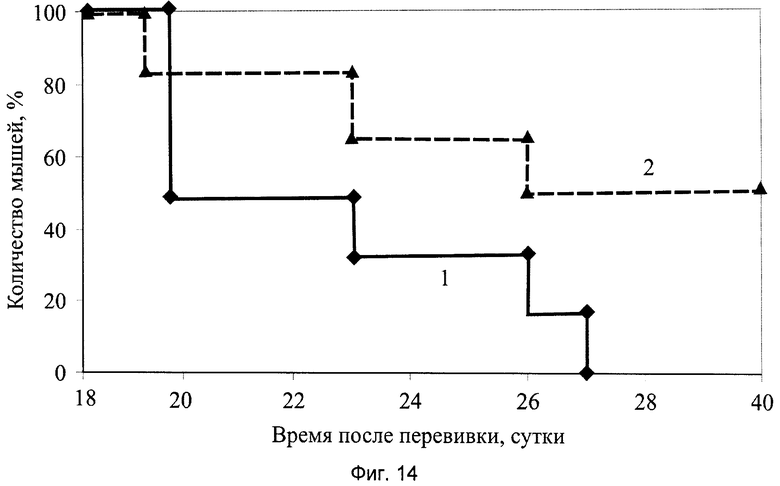
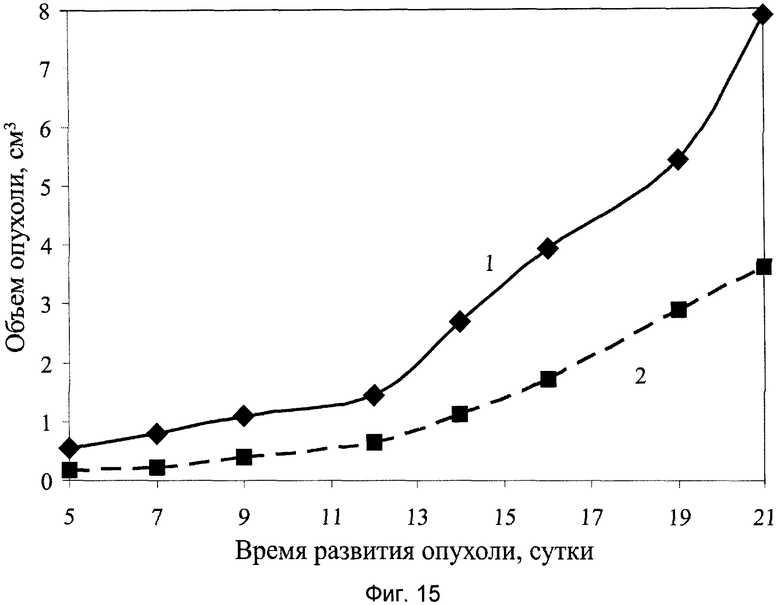
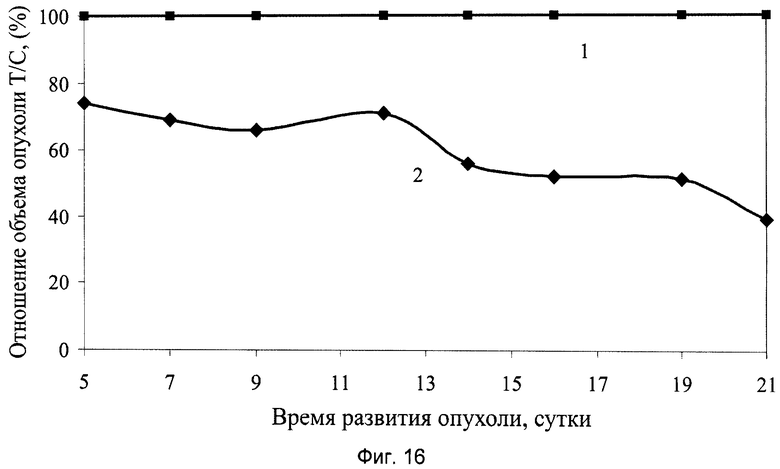
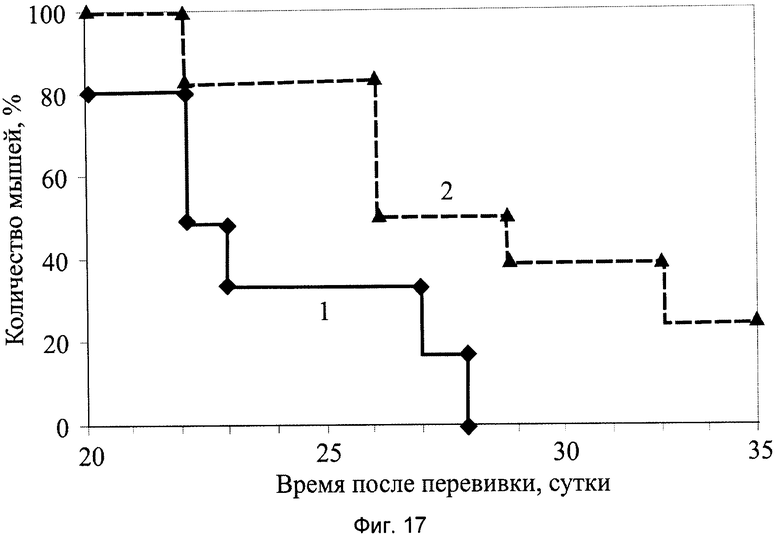
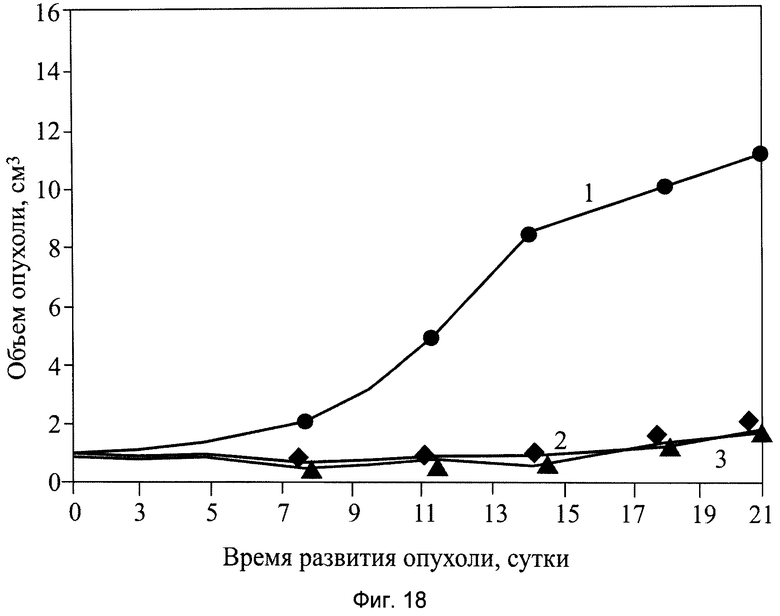
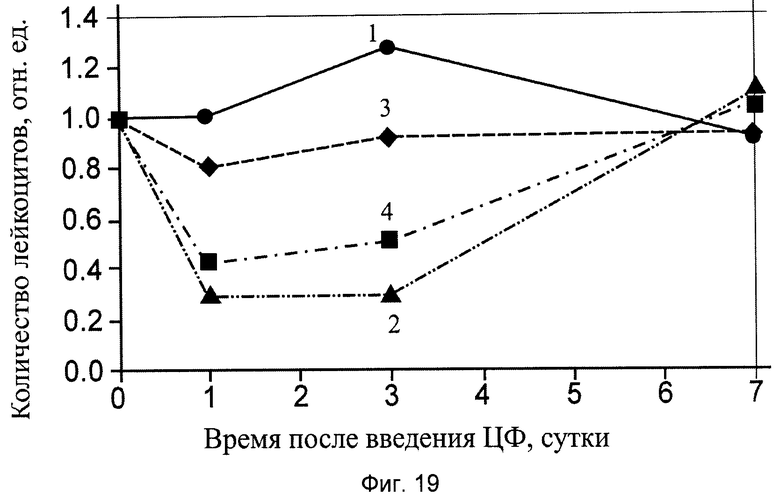
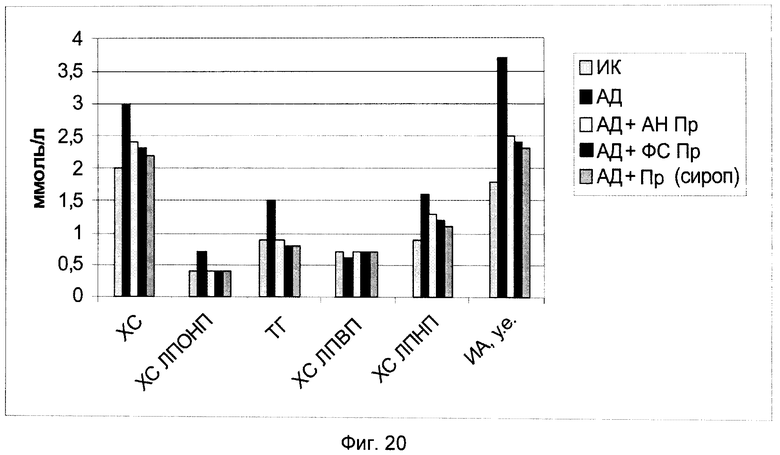
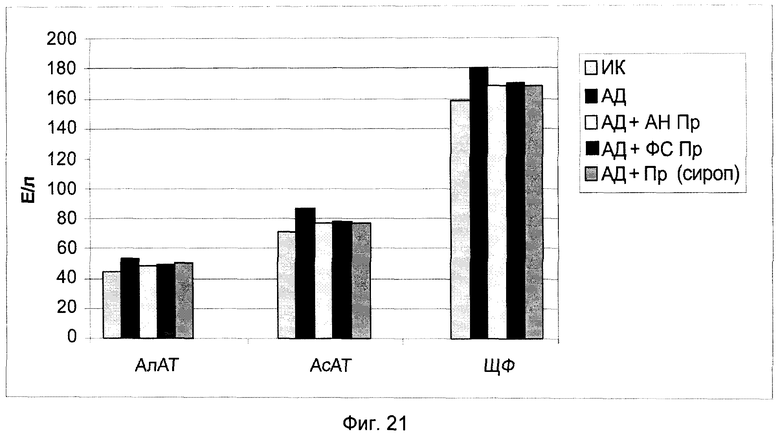
Изобретение относится к биотехнологии. Препарат с полифункциональной медико-биологической активностью, влияющий на тканевой обмен, получают в результате жидкофазного глубинного культивирования гриба Pleurotus ostreatus ВКПМ F-819 с последующим разделением мицелия и культуральной жидкости и выделением из мицелия биологически активных веществ в виде сгущенного экстракта. Полученный экстракт, который представляет собой фармакологическую субстанцию препарата, обогащают активным началом производного стерола 4-гидрокси-17Р-метилинцистерол с молекулярной массой 332,2452 дальтон, полисахаридом β 1-3 глюканом и дигидрокверцетином с молекулярной массой 304,26 дальтон. При этом указанные компоненты взяты в следующем массовом соотношении: (1):(2):(3):(4) как (79,0-158,0):(1,0-2,0):(10,0-20,0):(10,0-20,0). Изобретение позволяет повысить качество препарата за счет увеличения его противоопухолевой активности и снижения токсичности препаратов противоопухолевой химиотерапии при одновременном применении с предложенным препаратом. 1 з.п. ф-лы, 21 ил., 11 табл., 2 пр.
1. Препарат с полифункциональной медико-биологической активностью, влияющий на тканевой обмен, полученный в результате жидкофазного глубинного культивирования гриба Pleurotus ostreatus 1137 (ВКПМ F-819) с последующим разделением мицелия и культуральной жидкости и выделением из мицелия биологически активных веществ в виде сгущенного экстракта с антимикробной активностью, который представляет собой фармакологическую субстанцию препарата и обогащен активным началом производного стерола 4-гидрокси-17R-метилинцистерол с молекулярной массой 332,2452 Да, полисахаридом β 1-3 глюканом и дигидрокверцетином с молекулярной массой 304,26 Да, при следующем массовом соотношении:
(1):(2):(3):(4)как(79,0-158,0):(1,0-2,0):(10,0-20,0):(10,0-20,0)
и обладает способностью ингибировать размножение клеток рака, а также гепатопротекторным и детоксицирующим действием, проявляющимся в блокировке развития стеатогепатита и нормализации липидного спектра в сыворотке крови биологических систем.
2. Препарат по п.1, выполненный в виде геля или сиропа, или таблеток, или обезвоженных гранул.
| ПРЕПАРАТ 4-Hydroxy-17R-Methylincisterol, ВЛИЯЮЩИЙ НА ТКАНЕВОЙ ОБМЕН, И ПРИМЕНЕНИЕ ШТАММА ГРИБА Pleurotus 1137 ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2010 |
|
RU2435599C1 |
| ПРЕПАРАТ, ВЛИЯЮЩИЙ НА ТКАНЕВОЙ ОБМЕН И ПРИМЕНЕНИЕ ШТАММА ГРИБА FUSARIUM SAMBUCINUM FUCKEL VAR OSSICOLUM (BERK.ET CURF) BILAI ДЛЯ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2040932C1 |
| WO 2006119782 А1, 16.11.2006 | |||
| WO 2006119782 A1, 16.11.2006 | |||
| WO 2001027305 A1, 19.04.2001. | |||
Авторы
Даты
2013-07-20—Публикация
2012-06-19—Подача