Группа изобретений относится к биотехнологии, в частности к способам приготовления посевного мицелия базидиомицетов, используемых для культивирования базидиомицетов как в погруженных условиях, так и для поверхностного выращивания плодовых тел.
Известен способ приготовления посевного мицелия базидиомицетов путем их культивирования на стерильной питательной среде, содержащей 20% отвар картофеля, глюкозу или сахарозу в количестве 20 г/л и 15 г агара при 24°С в течение 14 дней (WO 2004/097007, 11.11.2004).
Недостатком описанного способа является длительность процесса приготовления посевного материала.
Известен способ получения посевного мицелия базидиомицетов, предусматривающий приготовление стерильной жидкой питательной среды, содержащей, г/л воды: пшеничную муку - 10-40, картофельный отвар - 50-200 и стимулятор роста, в качестве которого используют суточную культуру бактерий Azospirillum. Приготовленную питательную среду засевают базидиомицетом, культивируют при 26°С в течение 3-х дней, а затем в полученную мицелиальную биомассу вносят суспензию бактерий Azospirillum из расчета 10 мл суспензии на 200 мл среды и затем осуществляют совместное культивирование базидиомицета и вышеуказанных бактерий в течение 14 дней (RU 2249614 С2, 21.03.2003).
Недостатком описанного способа является длительность процесса приготовления посевного мицелия (17 дней) и его трудоемкость, поскольку необходимо дополнительно готовить питательную среду для бактерий и осуществлять их культивирование и подсев бактерий в среду, используемую для приготовления посевного мицелия.
Известен способ получения зернового посевного мицелия при выращивании плодовых тел съедобного базидиального гриба Pleurotus ostreatus, заключающийся в инокуляции зернового субстрата маточным мицелием, выращенным методом погруженного культивирования на жидких питательных средах (UA 36655 А, 16/04/2001). В способе приведен состав двух жидких питательных сред для выращивания маточного мицелия. Среда 1 содержит (г/л): крахмал кукурузный - 40, кукурузный экстракт - 30, (NH4)2SO4 - 1, KH2PO4 - 0,6, K2HPO4 - 0,6, MgSO4×7H2O - 0,3, вода водопроводная - до 1 л. Среда 2 содержит (г/л): крахмал кукурузный - 40, кукурузный экстракт - 15, экстракт ячменно-солодовый - 15, (NH4)2SO4 - 2, KH2PO4 - 0,6, K2HPO4 - 0,6, MgSO4×7H2O - 0,3, вода водопроводная - до 1 л. Процесс приготовления зернового посевного мицелия Pleurotus ostreatus включает выращивание культуры гриба на жидком пивном сусле (4° Б) в стационарных условиях при 24-26°С в течение 7-8 суток, последующий пересев культуры гриба на одну из вышеприведенных питательных жидких сред и культивирование на качалке при 200 об/мин, температуре 24-26°С в течение 3-4 суток, засев полученной погруженной культурой стерильного зернового субстрата и выращивание мицелия при 24-26°С. Полное обрастание зернового субстрата мицелием наступает через 6-8 суток.
Недостатком описанного способа является длительность процесса приготовления посевного мицелия и узкие рамки его применения, т.к. способ предназначен для приготовления посевного мицелия только одного вида базидиомицета и только для процесса получения его плодовых тел.
Известен способ приготовления посевного мицелия Pleurotus djamor, предусматривающий приготовление жидкой питательной среды, содержащей источники углерода, азота, дигидрофосфат калия в количестве 3,0 мас.%, сульфат магния и калия по 0,3 мас.%, засев среды базидиомицетом и культивирование его.
В качестве источников углерода в среду вносят глюкозу, сахарозу, растительное масло.
В качестве источников азота в среду вносят соевую муку, пептон, нитрат натрия, сульфат аммония (Краснопольская и др., Pleurotus djamor: способы культивирования и антимикробные свойства // Микология и фитопатология, 2001. Т.35. Вып.1. С.62-67).
Недостатком описанного способа является длительность процесса приготовления посевного мицелия: в два этапа, первый из которых длится 2-4 суток, а второй - 7-12 суток, а также узкие рамки его применения - только для одного вида рода Pleurotus - P. djamor.
Задачей заявленного способа является ускорение процесса приготовления посевного мицелия без снижения его жизнеспособности и биологической активности, а также расширение области применения для более широкого круга видов базидиомицетов.
Поставленная задача решается за счет того, что в способе приготовления посевного мицелия базидиомицета, включающем приготовление стерильной жидкой питательной среды, содержащей источник углерода, азота, дигидрофосфат калия и сульфат магния, засев приготовленной среды базидиомицетом и культивирование его, согласно изобретению в среду дополнительно вносят стимулятор роста, в качестве которого используют арахидоновую кислоту в количестве 1,0-5,0×10-5 г/л воды, а источник углерода и азота в среду вносят в количествах, соответственно равных 10-40 г/л и 6-20 г/л, дигидрофосфат калия и сульфат магния - в количествах, соответственно равных 2,0-2,8 и 0,2-0,3 г/л воды, а процесс культивирования осуществляют до максимального образования пеллет - шарообразных мицелиальных структур диаметром 1-5 мм.
В среду в качестве источника углерода рекомендуется вносить глюкозу, или сахарозу, или мелассу, или растительное масло, или их смесь. В качестве источника азота - соевую муку, или пшеничную муку, или смесь. Соевую муку можно использовать как генетически модифицированных, так и не модифицированных сортов сои.
Дополнительно в посевную среду можно вносить порошок биомассы базидиомицета в количестве 5-30 г/л воды. В качестве биомассы базидиомицета можно использовать сухой порошок как кондиционных, так и некондиционных плодовых тел или сухой порошок погруженного мицелия базидиомицета, в том числе полученного после его культивирования на производственной среде и выделения из него целевых метаболитов.
При приготовлении посевного мицелия базидиомицета в жидкую питательную среду можно вносить порошок биомассы того же вида базидиомицета или другого вида.
Целесообразно после культивирования посевной мицелий подвергать гомогенизации.
Гомогенизацию посевного мицелия можно осуществлять перед засевом производственной среды в гомогенизаторе в течение 2-6 мин, или путем встряхивания его в колбах с отбойниками на ротационной качалке в течение 2-10 минут при 220-250 об/мин, или в процессе засева производственной среды в биореакторе при включенной мешалке на 300-500 об/мин.
Приготовленный заявляемым способом посевной мицелий базидиомицета сохраняет свою активность при выдерживании при 2-4°С в течение 21-28 суток.
Из базидиальных грибов целесообразно использовать грибы вида Agrocybe aegerita (V.Briganti) Singer, Armillaria mellea (Fr.) Karst, Flammulina velutipes (Curt.:Fr.) Singer, Hericium erinaceus (Bull.:Fr.) Pers., Hypsizygus marmareus (Peck) H.E.Bigelow, Hypsizygus tessulatus (Bulliard:Fr.) Singer, Lentinus edodes (Berk.) Singer, Lyophyllum shimeji (Kawam.) Hongo, Pleurotus eringii (DC.:Fr.) Quel., Pleurotus djamor (Rumphius ex Fries) Boedjin, Pleurotus ostreatus (Jacg.:Fr.) Kumm., Pleurotus saju-cajor (Fries) Singer или другие.
Посевной мицелий базидиомицета, полученный вышеописанным способом, является самостоятельным объектом изобретения.
Технический результат, достигаемый предлагаемой группой изобретений, заключается в упрощении и ускорении процесса приготовления посевного мицелия без снижения его жизнеспособности и биосинтетической активности, а также в унификации процесса приготовления посевного мицелия, так как заявляемый способ может быть применен для широкого круга базидиомицетов. Полученный предложенным способом посевной мицелий может быть использован как для производства плодовых тел базидиомицетов, так и для получения биологически активных веществ при погруженном культивировании продуцентов.
Изобретение поясняется нижеприведенными примерами, которые не охватывают весь объем притязаний заявителя, но и не ограничивают его.
Пример 1. Готовили стерильные жидкие питательные среды, состав которых представлен в таблице, засевали одним из базидиомицетов, культивировали в колбах на ротационной качалке при 200-220 об/мин. Виды базидиомицетов, температура и длительность культивирования приведены в таблице.
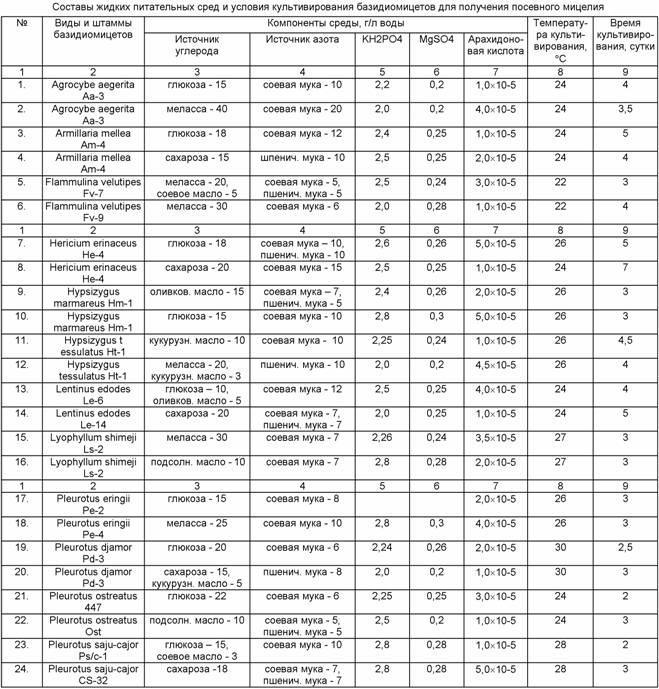
Пример 2. Получение посевного материала Hypsizygus tessulatus штамм Ht-1
Готовили стерильные питательные среды: среду №12 из примера 1 и среду, отличающуюся от среды №12 тем, что в нее был дополнительно внесен порошок мицелия Hypsizygus tessulatus в количестве 10 г/л. Культивирование проводили на ротационной качалке при 200 об/мин и температуре 26°С. Посевной мицелий на среде №12 был получен за 4 суток культивирования, на среде, содержащей порошок биомассы базидиомицета, - за 3 суток.
Пример 3. Получение посевного материала Agrocybe aegerita
Готовили стерильные питательные среды: среду №1 примера 1 и среду, отличающуюся от среды №1 тем, что в нее дополнительно перед стерилизацией был внесен порошок некондиционных плодовых тел Pleurotus ostreatus, являющихся отходом производства, в количестве 5 г/л. Культивирование проводили на ротационной качалке при 180 об/мин и температуре 24°С. Посевной мицелий на среде №1 был получен за 4 суток культивирования, а на среде, содержащей порошок плодовых тел Pleurotus ostreatus, - за 3 суток.
Пример 4. Получение посевного мицелия Pleurotus eringii и использование его для получения биологически активных веществ с антиоксидантными свойствами
Получали посевной мицелий Pleurotus eringii в две стадии. Первую стадию осуществляли по примеру 1, среда №18, вторая стадия включала приготовление среды того же состава, засев ее культурой, полученной на первом этапе, в количестве 5% и выращивание при температуре 26°С в течение 2 суток. Приготовленный в две стадии посевной мицелий Pleurotus eringii использовали для получения биологически активных веществ с антиоксидантными свойствами.
Готовили производственную питательную среду, содержащую (г/л):
Глюкоза - 20
Кукурузный экстракт - 10
Нитрат натрия - 10
Дигидрофосфат калия - 3,0
Сульфат магния - 0,3
Вода - до 1 литра.
Приготовленную среду стерилизовали при 1,2 атм в течение 30 минут. Культивирование осуществляли в колбах на ротационной качалке при 200 об/мин, температуре 26°С в течение 3 суток. Часть колб засевали посевным мицелием Pleurotus eringii, приготовленным на первой стадии культивирования, оставшиеся - посевным мицелием, полученным на второй стадии культивирования. Посевной мицелий, полученный на каждой стадии, вносили в среды по 2%. При использовании одностадийного посевного мицелия длительность культивирования на производственной среде составила 3 суток, выход воздушно-сухого мицелия был 15 г/л. При использовании посевного мицелия, полученного в две стадии, длительность культивирования на производственной среде составила 2,5 суток, выход воздушно-сухого мицелия был 20,2 г/л. Выросший на производственной среде мицелий отделяли от культуральной среды фильтрованием, сушили при 50°С и измельчали до порошкообразного состояния. Далее 1 г измельченной биомассы мицелия заливали 10 мл 75% этанола и экстрагировали при температуре 26°С в течение 24 часов, жидкий экстракт отделяли центрифугированием и определяли его антиоксидантные свойства кулонометрическим способом. Антиоксидантная емкость экстракта в пересчете на кверцетин составила 450 мг/мл экстракта при использовании посевного мицелия, полученного в две стадии, а при использовании одностадийного посевного мицелия - 410 мг/мл.
Таким образом, использование посевного мицелия Pleurotus eringii, приготовленного в два этапа, позволило сократить длительность процесса культивирования на производственной среде, увеличить выход мицелия и повысить его антиоксидантную емкость.
Пример 5. Использование полученного посевного мицелия Hericium erinaceus для приготовления биологически активных веществ, в частности для приготовления противоопухолевого средства
Готовили производственную питательную среду, содержащую (г/л):
Соевое масло - 15
Меласса - 35
Соевая мука - 10
Дигидрофосфат калия - 2,5
Сульфат магния - 0,2
Вода - до 1 л.
Приготовленную среду стерилизовали при 1,2 атм в течение 30 минут. Культивирование осуществляли в биореакторе.
В процессе засева производственной среды осуществляли гомогенизацию посевного мицелия, полученного по примеру 1, среда №7. Для этого после засева производственной питательной среды в течение 3 минут мешалку включали на 450 об/мин, дальнейшее культивирование проводили при 200 об/мин.
Культивирование осуществляли при температуре 25-26°С с подачей воздуха 1,5 объема/объем мин в течение 6 суток. Выход воздушно-сухой биомассы 25 г/л.
После культивирования погруженную культуру подвергали сублимационному высушиванию, затем измельчали и исследовали противоопухолевую эффективность высушенной культуры в дозе 50 мг/кг.
Изучение противоопухолевого действия проводят in vivo на взрослых самцах мышей-гибридов (С57В1/6 × 6DBA/2)F1 с перевиваемой солидной Т-клеточной лимфомой Р388. Мышей получали из питомника. В опыте опухоль прививали под кожу правого бока по 106 клеток в день «0». Лечение начинали через 48 часов после прививки опухоли. Полученное средство вводили перорально с помощью внутригастрального зонда ежедневно 1 раз в сутки в течение 10 суток. Количество мышей в контрольных и экспериментальной группах составляло 8-10 животных. В течение опыта следили за общим состоянием мышей, изменением массы тела, прививаемостью опухоли, динамикой роста опухоли. Массу опухоли рассчитывали по формуле М (мг)=(а×b×с)/2, где М - расчетная масса опухоли, а, b, с - 3 наибольших взаимоперпедикулярных диаметра опухолевого узла в мм. Торможение роста опухоли (ТРО) рассчитывали по формуле: ТРО (%)=(Мк-Мо)/(Мк)×100, где Мк и Мо - средняя расчетная масса опухоли в контроле и опыте соответственно. Достоверность различий средних значений массы опухоли определяли по t-критерию Стъюдента. За достоверные принимали различия при Р≤0,05. Применение полученного противоопухолевого средства обеспечивало достоверное торможение роста опухоли, равное 75%.
Таким образом, приготовленный по предлагаемому способу посевной мицелий Hericium erinaceus позволяет ускорить процесс приготовления посевного материала с 10-17 до 5 суток и сохранить жизнеспособность и биологическую активность посевного мицелия. Использование приготовленного по предлагаемому способу посевного мицелия Hericium erinaceus позволило получить биологически активные метаболиты гриба с высокой противоопухолевой активностью.
Пример 6. Выращивание плодовых тел Pleurotus ostreatus
Готовили субстрат для выращивания Pleurotus ostreatus, содержащий смесь, состоящую из опилок, измельченной соломы и бланшированного зерна в соотношении 1:2:0,5 и мела в количестве 5% от субстрата. Субстрат пастеризовали. Относительная влажность пастеризованного субстрата составляла 65%.
Приготовленный по примеру 1 (среда №21) посевной мицелий Pleurotus ostreatus гомогенизировали в гомогенизаторе в течение 3 мин и равномерно засевали субстрат гомогенизированным посевным мицелием в количестве 0,5% от массы субстрата.
Засеянный субстрат фасовали в полиэтиленовые пакеты диаметром 30 см по 10 кг. Пакеты инкубировали при 24°С в темноте до полного зарастания субстрата мицелием, что выражалось в образовании хорошо развитого белого воздушного мицелия. Этот процесс занял 8 суток. Затем на пакетах делали отверстия и меняли условия микроклимата. Дальнейшее культивирование осуществляли при 14-16°С, освещении и вентиляции до образования плодовых тел. Образование плодовых тел проходило в три волны. Урожай плодовых тел составил 38% от массы сырого субстрата, что на 10% больше, чем с использованием посевного мицелия, приготовленного известным способом по RU 2249614 С2, 21.03.2003.
Таким образом, посевной мицелий, приготовленный заявленным способом, позволяет ускорить процесс образования плодовых тел и увеличить их урожай.
Пример 7. Использование полученного посевного мицелия Lentinus edodes для получения биомассы с высоким содержанием липидов
Готовили производственную среду, содержащую (г/л):
Глюкоза - 20
Пепто - 15
Дигидрофосфат калия - 2,0
Сульфат магния - 0,2
Вода - до 1 л.
Приготовленную среду стерилизовали при 1,2 атм в течение 30 мин. Посевной мицелий, полученный по примеру 1, среда №14, гомогенизировали в колбах с отбойниками на ротационной качалке в течение 7 минут при 250 об/мин и вносили в стерильную производственную среду в количестве 5%. Культивирование проводили в колбах на ротационной качалке 200 об/мин при 24°С в течение 6 суток. По окончании процесса культивирования мицелий отделяли от культуральной жидкости фильтрованием, сушили при 50°С и исследовали на содержание липидов. Содержание липидов в мицелии, определенное по методу, описанному ГОСТ 28178-89, составляло 62%. В жирно-кислотном составе липидов преобладала линолевая кислота.
Таким образом, посевной мицелий, полученный по предлагаемому способу, позволяет увеличить содержание липидов в биомассе на 30-50% по сравнению с известными способами.
Таким образом, поставленная задача решена. Сокращена длительность приготовления посевного мицелия и получен жизнеспособный посевной мицелий, который, как показано, может быть использован как для погруженного культивирования, так и для твердофазного. Использование посевного мицелия для дальнейшего твердофазного культивирования позволяет увеличить урожайность плодовых тел, а для погруженного - увеличить выход и эффективность биологически активных соединений.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, И СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2418062C1 |
| ПОСЕВНОЙ МИЦЕЛИЙ БАЗИДИОМИЦЕТА И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2009 |
|
RU2409658C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЖИДКОФАЗНОЙ ФОРМЫ МАТОЧНОГО МИЦЕЛИЯ ДЛЯ ПОЛУЧЕНИЯ ПЛОДОВЫХ ТЕЛ ШЛЯПОЧНЫХ ПЛАСТИНЧАТЫХ ГРИБОВ | 2015 |
|
RU2610707C1 |
| ГРИБНОЕ ПИВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2608497C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2499040C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОВИРУСНОГО СРЕДСТВА И ПРОТИВОВИРУСНОЕ СРЕДСТВО | 2012 |
|
RU2522880C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНОЛИТИЧЕСКОГО ФЕРМЕНТА | 2020 |
|
RU2758788C1 |
| Питательная среда для глубинного культивирования мицелия базидиальных грибов | 2015 |
|
RU2621870C1 |
| Субстрат для культивирования ксилотрофных базидиомицетов и способ его получения с использованием методов химической модификации лигноцеллюлозного сырья | 2018 |
|
RU2699991C1 |
| СПОСОБ ВЫРАЩИВАНИЯ СЪЕДОБНЫХ ГРИБОВ ИЗ РОДА PLEUROTUS | 2009 |
|
RU2442823C2 |
Группа изобретений относится к биотехнологии. Способ приготовления посевного мицелия базидиомицета включает приготовление стерильной жидкой питательной среды, содержащей источник углерода, азота, дигидрофосфат калия и сульфат магния, засев приготовленной среды и культивирование базидиомицета. При этом в среду дополнительно вносят стимулятор роста - арахидоновую кислоту в количестве 1,0-5,0×10-5 г/л воды. Источники углерода и азота в среду вносят в количестве 10-40 г/л и 6-20 г/л воды, дигидрофосфат калия и сульфат магния - в количествах, соответственно равных 2,0-2,8 и 0,2-0,3 г/л воды. Процесс культивирования осуществляют до максимального образования пеллет. Мицелий, полученный указанным способом, позволяет ускорить процесс образования плодовых тел и увеличить их урожай, также позволяет получать противоопухолевые средства из погруженной культуры базидиомицета, увеличить содержание липидов в биомассе на 25%. 2 н. и 6 з.п. ф-лы, 1 табл.
1. Способ приготовления посевного мицелия базидиомицета, включающий приготовление стерильной жидкой питательной среды, содержащей источник углерода, азота, дигдрофосфат калия и сульфат магния, засев приготовленной среды базидиомицетом и культивирование его, при этом в среду дополнительно вносят стимулятор роста, в качестве которого используют арахидоновую кислоту в количестве 1,0-5,0·10-5 г/л воды, а источник углерода и азота в среду вносят в количествах, соответственно равных 10-40 г/л и 6-20 г/л, дигидрофосфат калия и сульфат магния - в количествах, соответственно равных 2,0-2,8 и 0,2-0,3 г/л воды, а процесс культивирования осуществляют до максимального образования пеллет.
2. Способ по п.1, отличающийся тем, что в процессе приготовления жидкой питательной среды в нее дополнительно вносят сухой порошок биомассы базидиомицета в количестве 5-30 г/л воды.
3. Способ по п.2, отличающийся тем, что в качестве биомассы базидиомицета используют мицелий или плодовые тела вида базидиомицета, выращиваемого при приготовлении посевного мицелия, или другого вида базидиомицета.
4. Способ по п.1, отличающийся тем, что посевной мицелий базидиомицета, полученный после культивирования его на стерильной жидкой питательной среде, пересевают на стерильную жидкую питательную среду и дополнительно культивируют.
5. Способ по п.1, отличающийся тем, что из базидиомицетов используют базидиомицет, выбранный из группы Agrocybe aegerita (V.Briganti) Singer, Armillaria mellea (Fr.) Karst., Flammulina velutipes (Curt.:Fr.) Singer, Hericium erinaceus (Bull.:Fr.) Pers., Hypsizygus marmareus (Peck) H.E.Bigelow, Hypsizygus tessulatus (Bulliard:Fr.) Singer, Lentinus edodes (Berk.) Singer, Lyophyllum shimeji (Kawam.) Hongo, Pleurotus eringii (DC.:Fr.) Quel., Pleurotus djamor (Rumphius ex Fries) Boedjin, Pleurotus ostreatus (Jacg.:Fr.) Kumm., Pleurotus saju-cajor (Fries) Singer.
6. Способ по п.1, отличающийся тем, что после культивирования посевной мицелий гомогенизируют.
7. Способ по п.6, отличающийся тем, что гомогенизацию мицелия осуществляют в процессе засева производственной среды в биореакторе при включенной мешалке на 300-500 об/мин, в течение 2-5 мин.
8. Посевной мицелий базидиомицета, отличающийся тем, что получен по любому из пп.1-7.
| СПОСОБ ЭЛЕКТРОЛИТИЧЕСКОГО ОСАЖДЕНИЯ МЕДИ | 1932 |
|
SU36655A1 |
| СПОСОБ СТИМУЛЯЦИИ РОСТА КУЛЬТУРЫ ВЕШЕНКИ ОБЫКНОВЕННОЙ | 2000 |
|
RU2183056C2 |
| СПОСОБ ВЫРАЩИВАНИЯ СЪЕДОБНЫХ ГРИБОВ И ФОРМИРОВАНИЕ СУБСТРАТНЫХ БЛОКОВ ДЛЯ ИХ ВЫРАЩИВАНИЯ | 2005 |
|
RU2292705C1 |
| Способ получения биомассы базидиомицетов | 1977 |
|
SU1090261A3 |
| БАЗИДИОМИЦЕТЫ, ЭКСТРАКТ БАЗИДИОМИЦЕТОВ, ДИЕТИЧЕСКИЕ ПРОДУКТЫ, ИММУНОСТИМУЛЯТОРЫ И СЪЕДОБНЫЕ БАЗИДИОМИЦЕТЫ | 2004 |
|
RU2307157C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОСЕВНОГО МИЦЕЛИЯ СЪЕДОБНЫХ ГРИБОВ | 2003 |
|
RU2249614C2 |
| КРАСНОПОЛЬСКАЯ Л.М | |||
| и др | |||
| Pleurotus djamor: способы культивирования и антимикробные свойства | |||
| Микология и фитопатология, 2001, т.35, вып.1, с.62-67. | |||
Авторы
Даты
2011-09-27—Публикация
2009-12-30—Подача