ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтическим композициям. В частности, настоящее изобретение относится к фармацевтическим композициям, которые содержат фторхинолоновое антибиотическое лекарственное средство в фармацевтическом носителе, что обеспечивает улучшенную гомогенность, повышенную биологическую доступность, уменьшение мутности или комбинацию данных свойств.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Фторхинолоновые антибиотические лекарственные средства показали эффективность при использовании их в различных фармацевтических применениях. Особенно важным для настоящего изобретения является то, что фторхинолоновые антибиотические лекарственные средства показали эффективность в офтальмических, назальных и ушных фармацевтических композициях для лечения таких заболеваниях, как конъюнктивиты. Однако, фторхинолоновые антибиотические лекарственные средства, в частности моксифлоксацин, могут обладать характеристиками, которые создают трудности при разработке фармацевтических носителей, пригодных для доставки лекарственных средств.
В качестве одного примера, большинство фторхинолонов могут вызывать помутнение при использовании фармацевтических растворов, в особенности, вязких водных растворов (например, офтальмические водные растворы для многократного приема). В качестве следующего примера, большинство фторхинолонов, в особенности гидрофобные фторхинолоны, склонны проявлять меньшую биологическую доступность в таких растворах.
Предыдущие исследовательские работы раскрыли компоненты, пригодные для преодоления трудностей при разработке фармацевтических носителей для фторхинолонов. В качестве одного примера, патент США № 6331540, который полностью включен в данное описание в виде ссылки для любого назначения, рассматривает преимущества использования ксантановой смолы в качестве компонента фармацевтического носителя для фторхинолона, такого как ципрофлоксацин.
Такие разработки, несмотря на то, что они, безусловно, являются необходимыми, все же не преодолевают все недостатки и трудности при получении фармацевтических носителей для фторхинолонов. В связи с этим настоящее изобретение обеспечивает фармацевтические носители для лекарственных средств на основе фторхинолонов, или фармацевтические композиции, которые содержат фторхинолоновые лекарственные средства, где носитель или композиция обладают повышенной гомогенностью, повышенной биологической доступностью, уменьшенной мутностью или комбинацией данных свойств.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, настоящее изобретение направленно на фармацевтический носитель и фармацевтическую композицию, содержащую данный носитель. Фармацевтическая композиция содержит фторхинолоновое лекарственное средство. Фармацевтический носитель обычно включает один или несколько следующих компонентов: i) хлорид натрия в количестве, обеспечивающем отношение масса/объем хлорида натрия к фторхинолоновому лекарственному средству в диапазоне от 0,8 до 2,0; ii) поверхностно-активное вещество, которое обеспечивает гомогенность композиции и/или способствует равномерному распределению фторхинолонового лекарственного средства по фармацевтическому носителю; и/или антимикробное средство на основе боратного/полиольного комплекса.
Фармацевтическая композиция может быть офтальмологическим водным раствором. Фармацевтическая композиция также может находиться в емкости, которая дозирует композицию в виде капель. В предпочтительном варианте осуществления фторхинолоновое лекарственное средство включает или целиком является моксифлоксацином. Также предполагается, что отношение масса/объем хлорида натрия к фторхинолоновому лекарственному средству может находиться в диапазоне от 1,0 до 1,7 и, более предпочтительно, от 1,1 до 1,4. Носитель композиции может также содержать увеличивающий вязкость агент, такой как ксантановая смола. Также предполагается, что фармацевтический носитель может главным образом состоять из хлорида натрия, боратной/полиольной системы, ксантановой смолы, поверхностно-активного вещества, гидроксида натрия и очищенной воды. Композиция, носитель или и то, и другое могут также иметь pH 6,8-7,4.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Сопровождающие чертежи, которые включены и составляют часть настоящего описания, иллюстрируют аспекты изобретения и вместе с описанием служат для объяснения принципов изобретения.
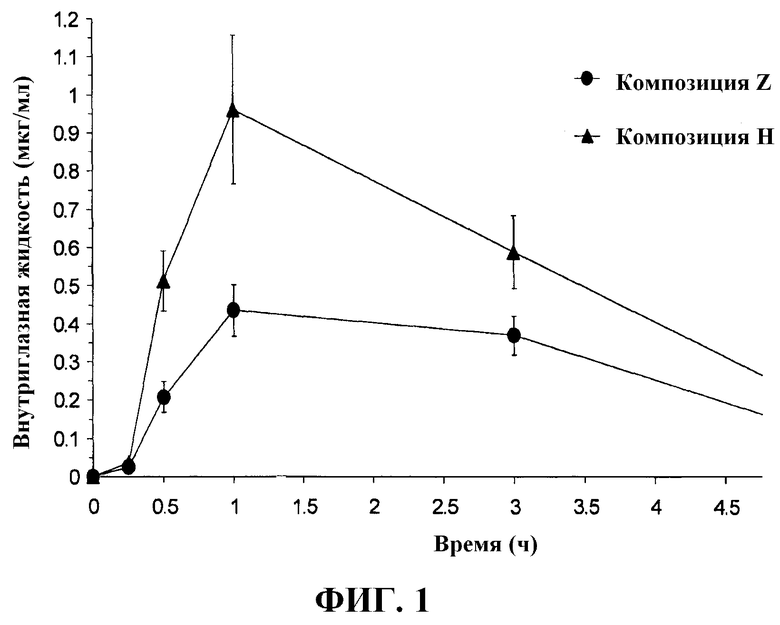
На Фиг.1 представлен график зависимости концентрации фторхинолона во внутриглазной жидкости человека после приема композиции настоящего изобретения и после приема композиции с коммерческим продуктом, содержащей аналогичный фторхинолон.
На Фиг.2 представлен график зависимости концентрации фторхинолона в конъюнктиве глаза человека после приема композиции настоящего изобретения и после приема композиции с коммерческим продуктом, содержащей аналогичный фторхинолон.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не указано особо, то все концентрации компонентов перечислены как процентное (%) отношение массы к объему (масс./об.).
Количество фторхинолонового лекарственного средства, включенного в композиции настоящего изобретения, может быть любым количеством, которое является терапевтически эффективным, и будет зависеть от ряда факторов, включая особенность и силу действия выбранного лекарственного средства. Общая концентрация фторхинолонового лекарственного средства в композиции в основном будет составлять около 1,5% или менее. В офтальмических композициях для местного применения в основном концентрация фторхинолонового лекарственного средства (например, моксифлоксацина) будет не менее примерно 0,2%, более характерно не менее примерно 0,4% и, возможно не менее примерно 0,5%, но в основном будет менее примерно 2,0%, более характерно менее примерно 1,0% и еще более характерно менее примерно 0,7%.
Без ограничения, потенциально пригодные фторхинолоны включают ципрофлоксацин, моксифлоксацин, левофлоксацин, энрофлоксацин, офлоксацин, гатифлоксацин и норфлоксацин. Фторхинолоновое лекарственное средство может включать один фторхинолон или комбинацию нескольких различных фторхинолонов. Также следует понимать, что для настоящего изобретения считается, что наименование конкретных фторхинолонов включает соли и производные этих фторхинолонов, если специально не указано обратное. Например, считается, что название «моксифлоксацин» включает моксифлоксацин HCl и производные моксифлоксацина.
Моксифлоксацин является особенно предпочтительным фторхинолоновым лекарственным средством. Таким образом, в предпочтительном варианте осуществления фторхинолоновое лекарственное средство может быть по меньшей мере 50%, более характерно по меньшей мере 70%, и еще более характерно по меньшей мере 90% по массе моксифлоксацином. Безусловно, в настоящем варианте осуществления фторхинолоновое лекарственное средство может быть практически полностью или полностью моксифлоксацином.
Используемый здесь термин «практически», как он используется для модификации терминов, таких как «полностью», предназначен для обозначения всех количеств, кроме номинального количества.
Композиция и/или носители настоящего изобретения также обычно включают увеличивающий вязкость агент. В качестве увеличивающего вязкость агента могут применяться различные компоненты, в частности полимеры или углеводороды, и увеличивающий вязкость агент может включать один или несколько компонентов. Увеличивающий вязкость агент обычно составляет не менее 0,1%, более характерно не менее 0,3% и еще более характерно не менее 0,6% от композиции и/или носителя настоящего изобретения. Увеличивающий вязкость агент обычно составляет менее 4,0%, более характерно менее 1,2% и еще более характерно менее 0,75% от композиции и/или носителя настоящего изобретения.
В качестве увеличивающего вязкость агента предпочтительным является полисахарид и, в особенности, ксантановая смола. Таким образом, в предпочтительном варианте осуществления увеличивающим вязкость агентом может быть не менее 50%, более характерно не менее 70% и еще более характерно не менее 90% по массе полисахарида и, более конкретно, ксантановой смолы. Безусловно, в настоящем варианте осуществления увеличивающий вязкость агент может быть практически полностью или полностью полисахаридом и, в частности, ксантановой смолой.
Главным образом, ксантановая смола доступна от торговых поставщиков по меньшей мере в двух категориях, пищевой или промышленной категории и фармацевтической категории. При использовании предпочтительно фильтровать даже вещества фармацевтической категории, чтобы конечный фармацевтический продукт обладал повышенной чистотой. Специалист в данной области техники оценивает, что подходящий размер фильтра для проведения фильтрации зависит от размера нежелательных примесей, содержащихся в исходном веществе. Например, в случае композиции в виде раствора, было обнаружено, что ксантановая смола категории Rhodigel Clear от Rhone-Poulenc Inc. должна быть отфильтрована через 0,45 мкм фильтр для удаления клеточного детрита и примесей. Для увеличения общей эффективности процесса очистки фильтрованием можно использовать несколько степеней фильтрации.
Композиция и/или носитель настоящего изобретения может также включать антимикробное средство, такое как средство на основе боратного/полиольного комплекса. Пример одного потенциально подходящего средства описан в патенте США № 6143799, который включен здесь в виде ссылки во всей полноте.
Используемый здесь термин «борат» относится к борной кислоте, солям борной кислоты, боратным производным и другим фармацевтически приемлемым боратам или их комбинации. Наиболее пригодными являются борная кислота, борат натрия, борат калия, борат кальция, борат магния и другие соли борной кислоты такого типа. Бораты взаимодействуют с полиолами, такими как глицерин, пропиленгликоль, сорбитол и маннитол с образованием комплексов бората с полиолом. Тип и соотношение таких комплексов зависит от числа ОН групп полиола при соседних атомах углерода, которые не находятся в транс-конфигурации по отношению друг к другу. Следует понимать, что процентные отношения масса/объем компонентов полиола и бората включают данные количества как в виде комплекса, так и нет.
Используемый в настоящем описании термин «полиол» включает любое соединение, имеющее по меньшей мере одну гидроксильную группу при каждом из двух соседних атомов углерода, которые не находятся в транс-конфигурации по отношению друг к другу. Полиолы могут быть линейными или циклическими, замещенными или незамещенными или их смесью при условии, что полученный комплекс является растворимым в воде и фармацевтически приемлемым. Примеры таких соединений включают сахара, сахарные спирты, сахарные кислоты и уроновые кислоты. Предпочтительными полиолами являются сахара, сахарные спирты, сахарные кислоты, включая, но не ограничиваясь ими, маннитол, глицерин, ксилит, сорбитол и пропиленгликоль. В одном варианте осуществления полиол боратной/полиольной системы является по меньшей мере 70% по массе, более конкретно, по меньшей мере 90% по массе, практически полностью или полностью маннитола, сорбитола или их комбинации.
При использовании антимикробное средство на основе боратного/полиольного комплекса (т.е. вместе борат и полиол) обычно составляет не менее 0,03% масс./об., более характерно не менее 0,2% масс./об. и даже возможно не менее 0,5% масс./об. композиции, носителя или их обоих. При использовании антимикробное средство на основе боратного/полиольного комплекса обычно составляет менее 3% масс./об., более характерно менее 1% масс./об. и даже возможно не менее 0,7% масс./об. носителя, композиции, или их обоих.
Композиции и/или носители настоящего изобретения обычно включают галогениды и, более конкретно, соли галогенидов, не содержащие водород, которые, как правило, улучшают прозрачность композиции и/или носителя. Используемые в настоящем описании галогениды, не содержащие водород, включают все галогениды за исключением галогеноводородов, таких как хлороводород (HCl), где водород обеспечивает положительный заряд, компенсируя отрицательный заряд галогена. Предполагается, что галогениды, не содержащие водород, или соли галогенидов включают один галоген или могут состоять из нескольких различных галогенов. Галогениды, не содержащие водород, или соли галогенидов обычно составляют не менее 0,1% масс./об., более характерно не менее 0,4% масс./об. и даже возможно не менее 0,5% масс./об. и даже более возможно не менее 0,65% масс./об. композиции, носителя или их обоих. Галогениды или соли галогенидов обычно составляют менее 3% масс./об., более характерно менее 1,5% масс./об. и даже возможно менее 1,0% масс./об. носителя, композиции или их обоих.
Подходящие галогениды, не содержащие водород (например, соли галогеноидов), без ограничения включают хлорид натрия, хлорид калия, хлорид кальция, их комбинации и т.п. Так как предполагается, что галогениды, не содержащие водород, настоящего изобретения могут образовывать множество различных компонентов, было успешно обнаружено, что хлорид натрия (NaCl) в чистом виде или практически в чистом виде может обеспечить высокое необходимое снижение мутности или непрозрачности композиции и/или носителя без необходимости в других галогенидах, не содержащих водород. Таким образом, предполагается, что композиция и/или носитель наносящего изобретения полностью или практически не содержат каких-либо галогенидов, не содержащих водород, отличных от NaCl.
Для достижения необходимых уровней мутности предпочтительно иметь конкретные отношения % масс./об. галогенида, не содержащего водород, в композиции по отношению к % масс./об. фторхинолонового лекарственного средства в композиции. Такое отношение обычно находится в диапазоне от 0,7 до 2,2, более предпочтительно от 1,0 до 1,7, и еще более предпочтительно от 1,1 до 1,4. Было показано, что такие соотношения имеют особое значение для комбинации моксифлоксацина с NaCl в присутствии ксантановой смолы.
Мутность композиции, носителя или их обоих является достаточно низкой при измерении в нефелометрических единицах мутности (NTU) согласно Европейскому стандарту EN ISO 7027:1999. Мутность композиции, носителя или их обоих обычно менее 20 NTU, более характерно менее 13 NTU, еще более характерно менее 10 NTU и даже возможно менее 8 NTU. Визуальная прозрачность предпочтительно меньше или равна (≤) PIII, более предпочтительно ≤PII и еще более предпочтительно ≤PI, согласно Главе 2.2.1 Европейской фармакопеи, издание 6.
Для растворимости композиция и/или носитель настоящего изобретения могут включать поверхностно-активное вещество или другой подходящий вспомогательный растворитель. Поверхностно-активное вещество может быть неионным, анионным, катионным, амфотерным или амфифильным. Примеры неионных поверхностно-активных веществ или вспомогательных растворителей включают тилоксапол, полиоксиэтиленовые сложные эфиры сорбитана, полиэтоксилированные касторовые масла, полиэтоксилированные гидрированные касторовые масла, такие как НСО-40, полоксамеры, полиоксиэтиленовые/полиоксопропиленовые поверхностно-активные вещества, полиоксиэтиленовый эфир лаурилового спирта, полиоксиэтиленстеарат, стеарат полиоксиэтиленпропиленгликоля, гидроксиалкилфосфонат, их комбинацию или другие агенты, известные специалисту данной области техники.
Присутствующее поверхностно-активное вещество обычно составляет не менее 0,005% масс./об., более характерно не менее 0,02% масс./об. и даже возможно не менее 0,04% масс./об. композиции, носителя или их обоих. Присутствующее поверхностно-активное вещество также обычно составляет менее 1% масс./об., более характерно менее 0,1% масс./об. и даже возможно менее 0,07% масс./об. носителя, композиции или их обоих.
Было обнаружено, что особенно пригодными в носителях и композициях настоящего изобретения являются поверхностно-активные вещества на основе полиэфироспиртов (например, полиэфир алкиларилового спирта). Было обнаружено, что такие поверхностно-активные вещества способствуют диспергированию фторхинолонового лекарственного средства, в частности моксифлоксацина, по композиции таким образом, что композиция в целом обладает большей гомогенностью. Это особенно важно в случае, если композиция является раствором для многократного приема (например, офтальмическим раствором), который находится в емкости (например, капельнице) и вводится в виде капель. Большая гомогенность может обеспечить более равномерные количества лекарственного вещества, вводимого с каждой каплей. Это в особенности имеет место в том случае, если поверхностно-активное вещество повышает гомогенность в наконечнике-дозаторе, и, было обнаружено, что описанные в настоящем описании поверхностно-активные вещества, в частности алкиларилполиэфироспирт, такой как тилоксапол, способствуют достижению большей гомогенности в наконечниках-дозаторах. Таким образом, предполагается, что поверхностно-активное вещество может содержать не менее 50%, более характерно не менее 70% и еще более характерно не менее 90% по весу полиэфироспирта (например, алкиларилполиэфироспирта, такого как тилоксапол). Безусловно, в данном варианте осуществления поверхностно-активное вещество может практически полностью или полностью являться полиэфироспиртом (например, алкиларилполиэфироспиртом, таким как тилоксапол).
Предполагается, что помимо указанных выше компонентов в композициях или носителях настоящего изобретения могут быть использованы различные дополнительные или альтернативные компоненты. Могут быть включены другие дополнительные терапевтические средства, антимикробные средства, суспендирующие средства и т.п. Другие возможные для композиции или носителя типичные компоненты без ограничения включают вещества, регулирующие тоничность, буферные вещества, антиоксиданты, их комбинации или т.п.
Как будет ясно из приведенных ниже примеров, вода должна составлять значительную часть водного раствора. Для регулирования рН могут быть использованы соляная кислота, гидроксид натрия или другие кислоты или основания.
Описанные здесь компоненты могут быть использованы в виде различных типов фармацевтических композиций или носителей, таких как офтальмические, ушные, назальные и дерматологические композиции или носители, но особенно пригодны для офтальмических растворов, которые обычно являются водными. Примеры таких растворов без ограничения включают офтальмические фармацевтические растворы для наружного применения, которые могут быть использованы при лечении глаукомы, сухости глаз, инфекций, аллергии или воспаления (например, конъюнктивит); растворы для улучшения глазного комфорта у пациентов; и различные другие типы офтальмических растворов, таких как препараты для увлажнения глаз, искусственные слезы, астрингенты и т.д.
Композиции или носители настоящего изобретения обычно получают таким образом, чтобы они были совместимы с глазом и/или другими тканями, которые необходимо ими обработать. Офтальмические композиции или носители, предназначенные для непосредственного применения в глазу, должны быть получены таким образом, чтобы они имели рН и тоничность, которая совместима с глазом.
Композиции обычно должны иметь рН в диапазоне от 4 до 9, предпочтительно от 5,5 до 8,5 и наиболее предпочтительно 5,5 до 8,0. Особенно пригодными являются pH в диапазонах от 6,0 до 7,8 и, более конкретно, от 6,4 или даже от 6,7 до 7,5 или даже до 7,2. Композиции должны иметь осмоляльность от 200 до 400 или 450 миллиосмолей на килограмм (mOsm/кг), более предпочтительно от 240 до 360 mOsm/кг.
Композиции или носители настоящего изобретения обычно предпочтительно обладают достаточной антимикробной активностью, что позволяет им соответствовать некоторым требованиям антисептической эффективности, в частности требованиям антисептической эффективности Фармакопеи США и/или Европейской фармакопеи В.
Требования антисептической эффективности для офтальмических растворов для многократного приема в США и других странах/регионах приведены в следующей таблице:
(логарифмическое снижение микробиального
посевного материала во времени)
Определенные выше стандарты для USP 27 практически идентичны требованиям, приведенным в предыдущих изданиях USP, в частности USP 24, USP 25 и USP 26.
По меньшей мере в некоторых вариантах осуществления настоящего изобретения было обнаружено, что композиция или носитель в целом могут обеспечить необходимую биологическую доступность без необходимости включения дополнительных компонентов. Таким образом, предполагается, что носитель может состоять или практически состоять только лишь из следующих компонентов: увеличивающего вязкость агента; боратной/полиольной системы; поверхностно-активного вещества; галогенида, не содержащего водород; гидроксида натрия или соляной кислоты; и воды или любой их комбинации, как описано в настоящем описании для этих компонентов. Также в данных вариантах осуществления предполагается, что композиция может состоять или практически состоять только лишь из следующих компонентов: фторхинолонового лекарственного средства; увеличивающего вязкость агента; боратной/полиольной системы; поверхностно-активного вещества; галогенида, не содержащего водород; гидроксида натрия или соляной кислоты; и воды или любой их комбинации, как описано в настоящем описании для этих компонентов.
Следующие примеры представлены для иллюстрации дальнейших различных аспектов настоящего изобретения, но не предназначены для ограничения объема изобретения в каком-либо отношении.
ПРИМЕРЫ
Каждый состав, приведенный ниже в таблицах 1 и 2, получают, как указано далее. Готовят исходный раствор ксантановой смолы и пропускают через 1,2 и 4,5 мкм фильтры. К ксантановой смоле добавляют и растворяют хлорид натрия, получая раствор ксантановой смолы. Если имеются, борную кислоту, сорбитол, тилоксапол и моксифлоксацин смешивают с очищенной водой с образованием второго раствора. Все компоненты второго раствора растворяют в ходе перемешивания, и рН доводят за счет добавления NaOH или HCl. Затем второй раствор добавляют к раствору ксантановой смолы и состав смешивают при перемешивании до получения практически гомогенного раствора. Добавляют очищенную воду до конечного объема с образованием конечного раствора, который снова смешивают перемешиванием. Затем конечный раствор нагревают в автоклаве при 124°С в течение 40 минут. Затем стерилизованный конечный раствор охлаждают до комнатной температуры. При необходимости доводят рН за счет добавления NaOH или HCl и добавляют стерилизованную очищенную воду до конечного объема. Конечный раствор смешивают перемешиванием для гомогенизации.
Также было обнаружено, что композиции настоящего изобретения обеспечивают более высокие концентрации фторхинолонового лекарственного средства, в частности моксифлоксацина, в биологической мишени (например, глазах) в течение более короткого времени после введения композиции в мишень. Например, композиция, практически идентичная композиции H таблицы 2, применялась на глазах кроликов, и во внутриглазной жидкости и слезной пленке этих кроликов наблюдались следующие концентрации:
после введения композиции
(мкг/мл)
после введения композиции
(мкг/мл)
Преимущественно, данные концентрации, в частности спустя 5 минут, 10 минут, 15 минут, 30 минут и 60 минут, по меньшей мере вдвое, втрое, в 5 раз или даже в 8 раз превышают концентрации коммерчески доступной композиции моксифлоксацина.
Концентрации моксифлоксацина во внутриглазной жидкости в микрограммах на миллилитр (мкг/мл) в глазах человека при каждом из 5 значений времени отбора представлены в таблице 3, приведенной ниже, и графически показаны на фиг.1. В частности, в таблице и на графике приведены значения концентрации во внутриглазной жидкости после однократного местного применения дозы композиции моксифлоксацина настоящего изобретения (композиция Н, приведенная выше) и после однократного местного применения дозы коммерчески доступной композиции моксифлоксацина, которая имеется в продаже под торговым названием VIGAMOX® от Alcon Laboratories, Fort Worth, TX, 76134. VIGAMOX® представляет композицию Z, которая кроме гидрохлорида моксифлоксацина дополнительно содержит борную кислоту, хлорид натрия и очищенную воду, и также может содержать соляную кислоту/гидроксид натрия для доведения рН до приблизительно 6,8.
Концентрации моксифлоксацина во внутриглазной жидкости в микрограммах на миллилитр (мкг/мл) в глазах человека при каждом из 5 значений времени отбора представлены в таблице 4, приведенной ниже, и графически показаны на фиг.2. В частности, в таблице и на графике приведены значения концентрации в конъюнктивальной ткани после однократного местного применения дозы композиции Н и после местного однократного применения дозы VIGAMOX®.
Как видно из таблиц 3 и 4 и фиг.1 и 2, композиции настоящего изобретения могут обеспечивать значительно более высокие концентрации моксифлоксацина во внутриглазной жидкости и конъюнктивальной ткани человеческого глаза.
Изобретение было описано с использованием ссылок на некоторые предпочтительные варианты осуществления; однако, следует понимать, что оно может быть осуществлено в других конкретных формах или их вариациях без отклонения от его сущности или неотъемлемых характеристик. Следовательно, описанные выше варианты осуществления во всех отношениях должны рассматриваться как пояснительные и неограничивающие притязания, при этом объем изобретения определен прилагаемой формулой изобретения, а не предшествующим описанием.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВ И СПОСОБ ПОЛУЧЕНИЯ ГЛАЗНЫХ КАПЕЛЬ | 2014 |
|
RU2595837C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ОБЛАДАЮЩИЕ ЖЕЛАЕМОЙ БИОДОСТУПНОСТЬЮ | 2009 |
|
RU2503453C2 |
| АЭРОЗОЛЬНЫЕ ФТОРХИНОЛОНЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2428986C2 |
| АЭРОЗОЛЬНЫЕ ФТОРХИНОЛОНЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2603638C2 |
| КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ АНТИБИОТИК И КОРТИКОСТЕРОИД | 2009 |
|
RU2496501C2 |
| ВОДНЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ БОРАТ-ПОЛИОЛЬНЫЕ КОМПЛЕКСЫ | 2009 |
|
RU2477631C2 |
| ТВЕРДАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2002 |
|
RU2234915C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ПРОКТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2814279C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ СУХОСТИ ГЛАЗ | 2008 |
|
RU2470662C2 |
| ПРИМЕНЕНИЕ ЛЕВОФЛОКСАЦИНА В ФОРМЕ АЭРОЗОЛЯ ДЛЯ ЛЕЧЕНИЯ МУКОВИСЦИДОЗА | 2010 |
|
RU2563809C2 |

Изобретение относится к медицине и фармацевтической промышленности и касается композиций, содержащих фторхинолоновое антибиотическое лекарственное средство. Композиции обладают улучшенной гомогенностью, улучшенной биологической доступностью, меньшей мутностью или комбинацией данных свойств. Композиция может быть использована в качестве ушных или назальных композиций, однако является наиболее пригодной в качестве офтальмических композиций. 7 з.п. ф-лы, 4 табл., 2 ил., 12 пр.
1. Водная фармацевтическая композиция, содержащая
моксифлоксацин в диапазоне концентраций от по меньшей мере 0,4 мас./об.% до менее чем 1,0 мас./об.%;
фармацевтический носитель для моксифлоксацина, где фармацетический носитель включает
i. хлорид натрия в количестве, обеспечивающем отношение масса/объем хлорида натрия к моксифлоксацину в диапазоне от 1,0 до 1,7;
ii. поверхностно-активное вещество, которое способствует равномерному распределению моксифлоксацина по фармацевтическому носителю, где поверхностно-активное вещество является полиэфироспиртом;
iii. антимикробное средство на основе боратного/полиольного комплекса и
iv. ксантановую смолу в диапазоне концентраций от по меньшей мере 0,3 мас./об.% до менее чем 1,2 мас./об.%;
где водная фармацевтическая композиция является офтальмическим водным раствором.
2. Композиция по п.1, где фармацевтическая композиция находится в емкости, которая дозирует композицию в виде капель.
3. Композиция по п.1, где отношение масса/объем хлорида натрия к моксифлоксацину находится в диапазоне от 1,0 до 1,5.
4. Композиция по п.1, где отношение масса/объем хлорида натрия к моксифлоксацину находится в диапазоне от 1,1 до 1,4.
5. Композиция по любому из пп.1-4, где моксифлоксацин представляет собой моксифлоксацин HCl.
6. Композиция по любому из пп.1-4, где боратная/полиольная антисептическая система содержит сорбитол.
7. Композиция по любому из пп.1-4, где фармацетический носитель по существу содержит только хлорид натрия, боратную/полиольную систему, ксантановую смолу, поверхностно-активное вещество, гидроксид натрия и очищенную воду.
8. Композиция по любому из пп.1-4, где композиция имеет pH от 6,8 до 7,4.
| WO 00/18386 A2, 06.04.2000 | |||
| WO 2008044733 A, 17.04.2008 | |||
| WO 9321903 A, 11.11.1993 | |||
| Вспомогательные вещества в технологии лекарственных форм | |||
| Текст лекций: Ленинградский Химико-фармацевтический Институт, В.Н | |||
| Большаков | |||
| - Ленинград, 1991, с.27-31. |
Авторы
Даты
2013-10-10—Публикация
2009-05-29—Подача