РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка имеет приоритет предварительной заявки на патент США №61/240092, поданной 4 сентября 2009 года, и предварительной заявки на патент США №61/249231, поданной 6 октября 2009 года, полное содержание которых прямо включено в данное описание посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Предложены способы и композиции для лечения муковисцидоза. В частности, предложены композиции и способы для применения левофлоксацина в форме аэрозоля для лечения муковисцидоза.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Пациенты с муковисцидозом (CF) страдают хроническими инфекциями нижних дыхательных путей, вызываемыми бактериями, включая Pseudomonas aeruginosa. Pseudomonas aeruginosa особенно проблематичны с точки зрения уничтожения и считаются основной причиной заболеваемости и смертности у пациентов с CF.
Аэрозольная доставка антибиотиков прямо в легкие дает возможность увеличить локальную концентрацию антибиотика в участке инфекции и, следовательно, усилить уничтожение бактерий по сравнению с системным введением. В настоящее время раствор тобрамицина для ингаляций является единственным аэрозольным антибиотиком, официально разрешенным для лечения пациентов с CF, вызываемым бактериями, такими как Р. aeruginosa. В связи с развитием устойчивости к тобрамицину и ограниченным эффектом в отношении снижения плотности бактерий в мокроте, существует потребность в улучшенных терапевтических средствах для лечения пациентов с CF, имеющих легочную инфекцию, вызванную устойчивыми ко многим лекарственным средствам бактериями, включая Р. aeruginosa.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Некоторые воплощения настоящего изобретения относятся к композициям, к применению таких композиций и к способам лечения муковисцидоза. Некоторые такие воплощения включают композиции и способы для применения левофлоксацина в форме аэрозоля для лечения муковисцидоза.
Некоторые воплощения включают способы лечения муковисцидоза у человека, имеющего легочную инфекцию, включающую Р. aeruginosa. В некоторых таких воплощениях способы включают введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением снижения плотности Р. aeruginosa в мокроте указанного человека по меньшей мере на 40%, по меньшей мере на 44%, по меньшей мере на 70%, по меньшей мере на 90% и по меньшей мере на 97%. Некоторые такие воплощения включают достижение снижения плотности Р. aeruginosa в мокроте указанного человека по меньшей мере на 0,25 log10 КОЕ (колониеобразующие единицы)/г мокроты, по меньшей мере на 0,50 log10 КОЕ/г мокроты, по меньшей мере на 1,0 log10 КОЕ/г мокроты, по меньшей мере на 1,5 log10 КОЕ/г мокроты и по меньшей мере на 1,8 log10 КОЕ/г мокроты.
Некоторые воплощения включают способы лечения муковисцидоза у человека, включающие введение человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением увеличения FEV1 (объем форсированного выдоха за 1 секунду) по меньшей мере на 2% и увеличения FEF 25-75 (средняя объемная скорость форсированного выдоха в интервале 25-75% жизненной емкости легких) по меньшей мере на 5%, увеличения FEV1 по меньшей мере на 5% и увеличения FEF 25-75 по меньшей мере на 10%, увеличения FEV1 по меньшей мере на 7% и увеличения FEF 25-75 по меньшей мере на 15%, и увеличения FEV1 по меньшей мере на 10% и увеличения FEF 25-75 по меньшей мере на 20%.
Некоторые воплощения включают достижение увеличения FEV1 по меньшей мере на 0,05 л и увеличения FEF 25-75 по меньшей мере на 0,05 л, увеличения FEV1 по меньшей мере на 0,10 л и увеличения FEF 25-75 по меньшей мере на 0,10 л, увеличения FEV1 по меньшей мере на 0,15 л и увеличения FEF 25-75 по меньшей мере на 0,15 л, увеличения FEV1 по меньшей мере на 0,20 л и увеличения FEF 25-75 по меньшей мере на 0,20 л, и увеличения FEV1 по меньшей мере на 0,25 л и увеличения FEF 25-75 по меньшей мере на 0,25 л. Некоторые воплощения включают достижение увеличения FEF 25-75 по меньшей мере на 0,27 л.
Некоторые воплощения включают способы лечения муковисцидоза у человека, включающие введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением относительного риска менее 1,0, где относительный риск является показателем снижения потребности в других антипсевдомонадных противомикробных средствах. В некоторых таких воплощениях относительный риск составляет менее 0,8, менее 0,6, менее 0,4 и менее 0,3.
Некоторые воплощения включают способы лечения муковисцидоза у человека, которому вводят посредством ингаляции агент, выбранный из группы, состоящей из одного или более из следующих: дорназа альфа, азитромицин, сальбутамол, панкрелипаза, хлорид натрия, серетид и ADEK (витамины A, D, Е, К), включающие введение указанному человеку аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион. В некоторых воплощениях агент выбран из группы, состоящей из сальбутамола, панкрелипазы, серетида и ADEK. В некоторых воплощениях человек имеет легочную инфекцию, включающую Р. aeruginosa. Некоторые воплощения включают достижение снижения плотности Р. aeruginosa в мокроте указанного человека по меньшей мере на 0,25 log10 КОЕ/г мокроты, по меньшей мере на 0,50 log10 КОЕ/г мокроты и по меньшей мере на 1,0 log10 КОЕ/г мокроты.
Некоторые воплощения включают способы лечения муковисцидоза у человека, имеющего легочную инфекцию, включающую Р. aeruginosa. Некоторые такие воплощения включают повторяющееся введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, где указанное повторяющееся введение не приводит к более чем 16-кратному увеличению минимальной ингибирующей концентрации (MIC) в отношении штамма Р. aeruginosa у указанного человека, который характеризуется наивысшей MIC относительно других штаммов Р. aeruginosa. В некоторых воплощениях повторяющееся введение не приводит к более чем 8-кратному увеличению минимальной ингибирующей концентрации (MIC) в отношении штамма Р. aeruginosa у указанного человека, который характеризуется наивысшей MIC относительно других штаммов Р. aeruginosa. В некоторых воплощениях повторяющееся введение не приводит к более чем 4-кратному увеличению минимальной ингибирующей концентрации в отношении штамма Р. aeruginosa у указанного человека, который характеризуется наивысшей MIC относительно других штаммов Р. aeruginosa.
Некоторые воплощения включают способы лечения муковисцидоза у человека, имеющего легочную инфекцию, включающую Р. aeruginosa. Некоторые такие воплощения включают повторяющееся введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением увеличения в респираторной части CFQ-R (вопросник для пациентов с CF, пересмотренный вариант) на более чем 1, на более чем 2, на более чем 3, на более чем 4 и на более чем 5.
Некоторые воплощения включают способы снижения сопротивления малых дыхательных путей у человека с муковисцидозом, включающие введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением увеличения FEF 25-75 по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15% и по меньшей мере на 20%. Некоторые воплощения включают достижение увеличения FEF 25-75 по меньшей мере на 0,05 л, по меньшей мере на 0,10 л, по меньшей мере на 0,15 л, по меньшей мере на 0,20 л, по меньшей мере на 0,25 л и по меньшей мере на 0,27 л.
Некоторые воплощения включают способы введения левофлоксацина или офлоксацина человеку, включающие повторяющееся введение указанному человеку аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, где указанное повторяющееся введение не приводит к возникновению артралгии. В некоторых способах введение повторяют по меньшей мере один раз в сутки в течение 14 суток, по меньшей мере один раз в сутки в течение 28 суток и по меньшей мере один раз в сутки в течение 35 суток. В некоторых таких способах введение повторяют по меньшей мере два раза в сутки в течение 14 суток, по меньшей мере два раза в сутки в течение 28 суток и по меньшей мере два раза в сутки в течение 35 суток.
Некоторые воплощения включают способы лечения муковисцидоза у человека, имеющего легочную инфекцию, включающую Р. aeruginosa, и имеющего площадь поверхности тела менее 1,5 м2. Некоторые такие способы включают введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением приведенной к дозе сывороточной AUC (площадь под кривой) по меньшей мере 20 (нг.ч/л)/мг дозы. В некоторых воплощениях введение повторяют один раз в сутки в течение по меньшей мере 14 суток, аэрозоль содержит левофлоксацин или офлоксацин в количестве по меньшей мере 80 мг, 120 мг, 180 мг и 240 мг. Некоторые воплощения включают достижение приведенной к дозе сывороточной AUC по меньшей мере 20 (нг.ч/л)/мг дозы, по меньшей мере 40 (нг.ч/л)/мг дозы, по меньшей мере 60 (нг.ч/л)/мг дозы, по меньшей мере 80 (нг.ч/л)/мг дозы и по меньшей мере 100 (нг.ч/л)/мгдозы.
Некоторые воплощения включают способы лечения муковисцидоза у человека, имеющего легочную инфекцию, включающую Р. aeruginosa, и имеющего площадь поверхности тела менее 1,5 м2. Некоторые такие способы включают введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением приведенной к дозе сывороточной Cmax (максимальная концентрация) более чем 2 мкг/л/мг введенной дозы, более чем 4 мкг/л/мг введенной дозы, более чем 6 мкг/л/мг введенной дозы, более чем 8 мкг/л/мг введенной дозы и более чем 14 мкг/л/мг введенной дозы. В некоторых воплощениях возраст человека составляет менее 15 лет, менее 12 лет, менее 10 лет. В некоторых воплощениях человек имеет массу тела менее 55 кг, менее 45 кг, менее 35 кг, менее 25 кг.
В некоторых вышеизложенных воплощениях раствор состоит по существу из левофлоксацина или офлоксацина и двухвалентного или трехвалентного катиона.
В некоторых вышеизложенных воплощениях раствор не содержит лактозу.
В некоторых вышеизложенных воплощениях раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 50 мМ до примерно 400 мМ и левофлоксацин или офлоксацин в концентрации от примерно 50 мг/мл до примерно 200 мг/мл.
В некоторых вышеизложенных воплощениях раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 100 мМ до примерно 300 мМ и левофлоксацин или офлоксацин в концентрации от примерно 75 мг/мл до примерно 150 мг/мл.
В некоторых вышеизложенных воплощениях раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 150 мМ до примерно 250 мМ и левофлоксацин или офлоксацин в концентрации от примерно 90 мг/мл до примерно 125 мг/мл.
В некоторых вышеизложенных воплощениях раствор имеет осмоляльность от примерно 300 мосмоль/кг до примерно 500 мосмоль/кг и рН от примерно 5 до примерно 8.
В некоторых вышеизложенных воплощениях раствор имеет осмоляльность от примерно 350 мосмоль/кг до примерно 425 мосмоль/кг и рН от примерно 5 до примерно 6,5.
В некоторых вышеизложенных воплощениях раствор имеет рН от примерно 5,5 до примерно 6,5.
В некоторых вышеизложенных воплощениях двухвалентный или трехвалентный катион выбран из магния, кальция, цинка, меди, алюминия и железа.
В некоторых вышеизложенных воплощениях раствор содержит хлорид магния.
В некоторых вышеизложенных воплощениях раствор имеет концентрацию левофлоксацина или офлоксацина от примерно 90 мг/мл до примерно 110 мг/мл, концентрацию хлорида магния от примерно 175 мМ до примерно 225 мМ, рН от примерно 5 до примерно 7, осмоляльность от примерно 300 мосмоль/кг до примерно 500 мосмоль/кг и не содержит лактозу.
В некоторых вышеизложенных воплощениях аэрозоль имеет масс-медианный аэродинамический диаметр от примерно 2 микрон до примерно 5 микрон с геометрическим стандартным отклонением, которое меньше или равно примерно 2,5 микрон.
В некоторых вышеизложенных воплощениях аэрозоль имеет масс-медианный аэродинамический диаметр от примерно 2,5 микрон до примерно 4,5 микрон с геометрическим стандартным отклонением, которое меньше или равно примерно 1,8 микрон.
В некоторых вышеизложенных воплощениях аэрозоль имеет масс-медианный аэродинамический диаметр от примерно 2,8 микрон до примерно 4,3 микрон с геометрическим стандартным отклонением, которое меньше или равно примерно 2 микрон.
Некоторые из вышеизложенных воплощений также включают получение аэрозоля с использованием небулайзера с вибрирующей сеткой-мембраной. В некоторых таких воплощениях небулайзер с вибрирующей сеткой-мембраной представляет собой небулайзер PARI E-FLOW®.
В некоторых вышеизложенных воплощениях количество левофлоксацина или офлоксацина, вводимого в легкое, составляет по меньшей мере примерно 20 мг, по меньшей мере примерно 100 мг, по меньшей мере примерно 125 мг и по меньшей мере примерно 150 мг.
В некоторых вышеизложенных воплощениях по меньшей мере примерно 100 мг аэрозоля вводят в легкое за менее чем примерно 10 минут, менее примерно 5 минут, менее примерно 3 минут, менее примерно 2 минут.
Некоторые из вышеописанных воплощений также включают совместное введение дополнительного активного агента, выбранного из группы, состоящей из антибиотиков, бронхорасширяющих средств, антихолинергических агентов, глюкокортикоидов, ингибиторов эйкозаноидов и их комбинаций.
В некоторых воплощениях антибиотик может включать тобрамицин, азтреонам, ципрофлоксацин, азитромицин, тетрациклин, хинупристин, линезолид, ванкомицин и хлорамфеникол, колистин и их комбинации. В некоторых воплощениях бронхорасширяющее средство может включать сальбутамол, левосальбутерол, тербуталин, фенотерол, тербутлаин, пирбутерол, прокатерол, битолтерол, римитерол, карбутерол, тулобутерол, репротерол, сальметерол, формотерол, арформотерол, бамбутерол, кленбутерол, индактерол, теофиллин, рофлумиласт, циломиласт и их комбинации. В некоторых воплощениях антихолинергический агент может включать ипратропий, тиотропий и их комбинации. В некоторых воплощениях глюкокортикоид может включать преднизон, флутиказон, будесонид, мометазон, циклесонид, беклометазон и их комбинации. В некоторых воплощениях эйкозаноид может включать монтелукаст, пранлукаст, зафрилукаст, зилеутон, раматробан, сератродаст и их комбинации. В некоторых воплощениях совместное введение включает ингаляцию дополнительного активного агента.
Некоторые из вышеизложенных воплощений включают введение аэрозоля один раз в сутки.
Некоторые из вышеизложенных воплощений включают введение аэрозоля два раза в сутки.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает одну или более бактерий, которые могут включать Pseudomonas fluorescens, Pseudomonas acidovorans, Pseudomonas alcaligenes, и Pseudomonas putida, Stenotrophomonas maltophilia, Aeromonas hydrophilia, Escherichia coli, Citrobacter freundii, Salmonella typhimurium, Salmonella typhi, Salmonella paratyphi, Salmonella enteritidis, Shigella dysenteriae, Shigella flexneri, Shigella sonnei, Enterobacter cloacae, Enterobacter aerogenes, Klebsiella pneumoniae, Klebsiella oxytoca, Serratia marcescens, Morganella morganii, Proteus mirabilis, Proteus vulgaris, Providencia alcalifaciens, Providencia rettgeri, Providencia stuartii, Acinetobacter calcoaceticus, Acinetobacter haemolyticus, Yersinia enterocolitica, Yersinia pestis, Yersinia pseudotuberculosis, Yersinia intermedia, Bordetella pertussis, Bordetella parapertussis, Bordetella bronchiseptica, Haemophilus influenzae, Haemophilus parainfluenzae, Haemophilus haemolyticus, Haemophilus parahaemolyticus, Haemophilus ducreyi, Pasteurella multocida, Pasteurella haemolytica, Helicobacter pylori, Campylobacter fetus, Campylobacter jejuni, Campylobacter coli, Borrelia burgdorferi, Vibrio cholera, Vibrio parahaemolyticus, Legionella pneumophila, Listeria monocytogenes, Neisseria gonorrhoeae, Neisseria meningitidis, Burkholderia cepacia, Francisella tularensis, Kingella и Moraxella.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает грамотрицательные анаэробные бактерии.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает одну или более бактерий, которые могут включать Bacteroides fragilis, Bacteroides distasonis, группу гомологии Bacteroides 3452A, Bacteroides vulgatus, Bacteroides ovalus, Bacteroides thetaiotaomicron, Bacteroides uniformis, Bacteroides eggerthii и Bacteroides splanchnicus.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает грамположительные бактерии.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает одну или более бактерий, которые могут включать Corynebacterium diphtheriae, Corynebacterium ulcerans, Streptococcus pneumoniae, Streptococcus agalactiae, Streptococcus pyogenes, Streptococcus milleri; Streptococcus (Группа G); Streptococcus (Группа C/F); Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Staphylococcus intermedius, Staphylococcus hyicus subsp.hyicus, Staphylococcus haemolyticus, Staphylococcus hominis и Staphylococcus saccharolyticus.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает грамположительные анаэробные бактерии.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает одну или более бактерий, которые могут включать Clostridium difficile, Clostridium perfringens, Clostridium tetini и Clostridium botulinum.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает кислотоустойчивые бактерии.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает одну или более бактерий, которые могут включать Mycobacterium tuberculosis, Mycobacterium avium, Mycobacterium intracellulare и Mycobacterium leprae.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает атипичные бактерии.
В некоторых вышеизложенных воплощениях легочная инфекция дополнительно включает одну или более бактерий, которые могут включать Chlamydia pneumoniae и Mycoplasma pneumoniae.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1А и 1 В представлены графики соответственно с линейными осями и полулогарифмическими осями средних арифметических значений концентрации левофлоксацина в сыворотке после введения однократных доз 180 мг в виде раствора для ингаляции 50 мг/мл и 100 мг/мл и после введения 240 мг в виде раствора для ингаляции 100 мг/мл один раз в сутки в течение 7 суток пациенту с CF.
На Фиг.2А и 2В представлены графики соответственно с линейными осями и полулогарифмическими осями средних арифметических значений концентрации левофлоксацина в мокроте после введения однократных доз 180 мг в виде раствора для ингаляции 50 мг/мл и 100 мг/мл и после введения 240 мг в виде раствора для ингаляции 100 мг/мл один раз в сутки в течение 7 суток пациенту с CF.
На Фиг.3 представлен график среднего изменения плотности Р. aeruginosa log10 КОЕ/г мокроты) с течением времени для различных групп лечения в популяции пациентов ЕЕ (оценка эффективности). Пациентам вводили: левофлоксацин 120 мг QD (один раз в сутки), левофлоксацин 240 мг QD, левофлоксацин 240 мг BID (два раза в сутки) или плацебо.
На Фиг.4 представлен график изменения плотности Р. aeruginosa (log10 КОЕ/г мокроты) с течением времени для различных групп лечения в популяции пациентов MITT (оценка безопасности и модифицированного лечения). Пациентам вводили: левофлоксацин 120 мг QD, левофлоксацин 240 мг QD, левофлоксацин 240 мг BID или плацебо.
На Фиг.5 представлен график функции распределения выживаемости с течением времени для различных групп лечения в популяции ЕЕ.
На Фиг.6 представлен график функции распределения выживаемости с течением времени для различных групп лечения в популяции MITT.
На Фиг.7 представлен график процентного изменения FEV1 (л) в День 28 для популяции ЕЕ, которую лечили введением плацебо, 120 мг QD, 240 мг QD или 240 мг BID.
На Фиг.8 представлен график процентного изменения FEV1 (л) относительно плацебо в День 28 для популяции ЕЕ, которую лечили введением 120 мг QD, 240 мг QD или 240 мг BID. *p=0,0102.
На Фиг.9 представлен график категориального изменения FEV1 в процентах от предсказанного значения в День 28 для популяции ЕЕ, которую лечили введением 120 мг QD, 240 мг QD или 240 мг BID. *p=0,0370, **р=0,0037.
На Фиг.10 представлен график зависимости приведенной к дозе сывороточной AUC (нг.ч/л/мг дозы) от массы тела педиатрических пациентов с CF (■ 180 мг (n=7); ◆ 240 мг (n=18)). Среднее значение показано для AUC для левофлоксацина в сыворотке у взрослых пациентов с CF, исследованных в другом клиническом испытании (не показано), и в расчете на среднюю массу тела 71 кг (А; +/- стандартное отклонение).
Фиг.11А представлен график зависимости приведенной к дозе сывороточной AUC (нг.ч/л/мг дозы) от возраста педиатрических пациентов с CF (■180 мг; ◆ 240 мг). На Фиг.11В представлен график зависимости приведенной к дозе сывороточной AUC (нг.ч/л/мг дозы) от BSA (площадь поверхности тела) (■ 180 мг; ◆ 240 мг). На Фиг.11С представлен график зависимости приведенной к дозе сывороточной Cmax (мкг/л/мг введенной дозы) от массы тела педиатрических пациентов с CF (■ 180 мг; ■ 240 мг). На Фиг.11D представлен график зависимости приведенной к дозе сывороточной Cmax (мкг/л/мг введенной дозы) от возраста педиатрических пациентов с CF (■ 180 мг; ◆ 240 мг). На Фиг.11Е представлен график зависимости приведенной к дозе сывороточной Cmax (мкг/л/мг введенной дозы) от BSA (■ 180 мг; ◆ 240 мг).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению конкретных композиций на основе растворов левофлоксацина для ингаляции и конкретным дозировкам и режимам введения для лечения муковисцидоза. В некоторых воплощениях лечение муковисцидоза включает лечение легочных инфекций, связанных с муковисцидозом, таких как инфекции, вызываемые Р. aeruginosa, S. pneumoniae, H. influenzae, Burkholderia sp., Staphylococcus aureus, Stenotrophomonas sp.и М. catarrhalis. Описанные в данной заявке способы лечения муковисцидоза могут включать введение композиций на основе левофлоксацина. В некоторых воплощениях способы лечения муковисцидоза могут также включать достижение снижения плотности конкретных патогенов в легких субъекта. В некоторых воплощениях способы лечения муковисцидоза могут также включать улучшение легочных показателей у субъекта, которые могут быть измерены такими параметрами, как FEV1, FEF 25-72 и тому подобное.
Настоящее изобретение дает несколько преимуществ. Например, аэрозольный левофлоксацин доставляет высокие дозы лекарственного средства прямо в легкое. Высокие дозы предпочтительны для снижения развития устойчивых штаммов. Кроме того, согласно настоящему изобретению предложены композиции с пониженными вредными эффектами, обычно ассоциированными с фторхинолонами, такими как артралгия. Некоторые воплощения предусматривают способы лечения муковисцидоза, которые снижают риск острых обострений у пациентов с CF, имеющих риск обострений.
Дополнительно воплощения предусматривают способы увеличения воздушного потока в легких пациентов с CF. В различных воплощениях вышеуказанные способы осуществляют путем введения левофлоксацина или офлоксацина в форме аэрозоля в дозировках и по схемам введения, достаточных для достижения указанного результата.
Определения
Термин "введение" относится к способу введения дозы противомикробной фармацевтической композиции позвоночному животному. Предпочтительный способ введения может варьировать в зависимости от различных факторов, например от компонентов фармацевтической композиции, участка потенциальной или фактической бактериальной инфекции, вовлеченного микроорганизма и тяжести фактической микробной инфекции. В некоторых воплощениях введение может включать загрузку в инструмент для введения лекарственного средства субъекту. В некоторых таких воплощениях введение может включать загрузку в небулайзер лекарственного средства, которое необходимо ввести пациенту. Таким образом, введенная доза может представлять собой дозу, загруженную в инструмент (например небулайзер).
"Носитель" или "эксципиент" представляет собой соединение или вещество, используемое для облегчения введения соединения, например для увеличения растворимости соединения. Твердые носители включают, например, крахмал, лактозу, дикальцийфосфат, сахарозу и каолин. Жидкие носители включают, например, стерильную воду, физиологический раствор, буферные агенты, неионные поверхностно-активные вещества и пищевые масла, такие как арахисовое масло и кунжутное масло. Кроме того, могут быть включены различные адъюванты, например адъюванты, обычно используемые в данной области. Эти и другие такие соединения описаны в литературе, например в Merck Index, Merck & Company, Rahway, NJ. Рекомендации по включению различных компонентов в фармацевтические композиции, даны, например, в Gilman et al. (Eds.) (1990); Goodman and Gilman's: The Pharmacological Basis of Terapeutics, 8th Ed., Pergamon Press, полное содержание которой включено в данное описание посредством ссылки.
Используемый здесь термин "диагностический" означает, что соединение, способ, система или устройство помогает идентифицировать и охарактеризовать состояние здоровья или заболевание. Диагностический объект может быть использован в стандартных анализах, известных в данной области.
Термин "млекопитающее" использован в его обычном биологическом смысле. Так, конкретно этот термин охватывает людей, крупный рогатый скот, лошадей, собак и кошек, но может также включать другие виды.
Термин "микробная инфекция" относится к нежелательной пролиферации или наличию инвазии патогенных микроорганизмов в организме-хозяине. Этот термин охватывает избыточный рост микроорганизмов, которые в норме присутствуют в или на теле млекопитающего или другого организма. В более общем смысле, микробная инфекция может представлять собой любую ситуацию, при которой популяция(и) микроорганизмов вредит(ят) млекопитающему-хозяину. Так, микробная инфекция имеет место, когда избыточные количества популяции микроорганизмов присутствуют в или на теле млекопитающего, или когда эффекты присутствия популяции(й) микроорганизмов повреждают клетки или другие ткани млекопитающего.
Термин "фармацевтически приемлемый носитель" или "фармацевтически приемлемый эксципиент" охватывает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, задерживающие всасывание, и тому подобное. Использование таких сред и агентов для фармацевтически активных веществ известно в данной области. В терапевтических композициях предусмотрено использование любых общепринятых сред или агентов, за исключением тех, которые несовместимы с активным ингредиентом. Дополнительные активные ингредиенты также могут быть введены в композиции.
Термин "фармацевтически приемлемая соль" относится к солям, которые сохраняют биологическую эффективность и свойства соединений по данному изобретению, и которые не являются биологически или иным образом нежелательными. Во многих случаях соединения по данному изобретению способны образовывать соли с кислотами и/или основаниями благодаря наличию амино и/или карбоксильных групп или групп, подобным им. Фармацевтически приемлемые соли присоединения кислоты могут быть образованы с неорганическими кислотами и органическими кислотами. Неорганические кислоты, из которых могут быть образованы соли, включают, например, соляную кислоту, бромоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Органические кислоты, из которых могут быть образованы соли, включают, например, уксусную кислоту, пропионовую кислоту, нафтойную кислоту, олеиновую кислоту, пальмитиновую кислоту, памовую (эмбоновую) кислоту, стеариновую кислоту, гликолевую кислоту, пирувиновую кислоту, оксалиновую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, аскорбиновую кислоту, глюкогептоновую кислоту, глюкуроновую кислоту, молочную кислоту, лактобионовую кислоту, винную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, пара-толоуолсульфоновую кислоту, салициловую кислоту и т.п. Фармацевтически приемлемые соли присоединения основания могут быть образованы с неорганическими и органическими основаниями. Неорганические основания, из которых могут быть образованы соли, могут включать, например, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п.Особенно предпочтительными являются соли аммония, калия, натрия, кальция и магния. Органические основания, из которых могут быть образованы соли, включают, например, соли с первичными, вторичными и третичными аминами, замещенными аминами, включая существующие в природе замещенные амины, циклическими аминами, основными ионообменными смолами и т.п., конкретно с такими, как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, гистидин, аргинин, лизин, бенетамин, N-метил-глюкамин и этаноламин. Другие кислоты включают додецилсерную кислоту, нафталин-1,5-дисульфоновую кислоту, нафталин-2-сульфоновую кислоту и сахарин.
"Сольват" относится к соединению, образованному в результате взаимодействия растворителя и фторхинолонового противомикробного средства, метаболита или его соли. Подходящими сольватами являются фармацевтически приемлемые сольваты, включая гидраты.
В контексте ответной реакции микроорганизма, такого как бактерия, на противомикробный агент, термин "чувствительность" относится к чувствительности микроорганизма к присутствию противомикробного средства. Так, увеличение чувствительности означает, что микроорганизм будет ингибироваться при более низкой концентрации противомикробного средства в среде, окружающей клетки микроорганизмов. Это эквивалентно тому, что микроорганизм является более чувствительным к противомикробному агенту. В большинстве случаев минимальная ингибирующая концентрация (MIC) этого противомикробного средства будет снижена. MIC90 означает концентрацию, обеспечивающую ингибирование роста в 90% организмов.
Под "терапевтически эффективным количеством" или "фармацевтически эффективным количеством" подразумевается количество фторхинолонового противомикробного средства, раскрытого для данного изобретения, которое оказывает терапевтическое действие. Дозы фторхинолонового противомикробного средства, которые полезны в лечении, представляют собой терапевтически эффективные количества. Таким образом, в данном описании изобретения, терапевтически эффективное количество означает такие количества фторхинолонового противомикробного средства, которые вызывают желаемый терапевтический эффект по результатам клинических испытаний и/или исследований инфекции на животной модели. В конкретных воплощениях фторхинолоновый противомикробный агент вводят в предварительно определенной дозе, и поэтому терапевтически эффективным количеством может быть количество вводимой дозы. Это количество и количество фторхинолонового противомикробного средства может быть рутинно определено специалистом в данной области, и оно будет варьировать в зависимости от нескольких факторов, таких как конкретный вовлеченный микробный штамм. Это количество может также зависеть от роста, массы, пола, возраста и истории болезни пациента. Для профилактического лечения терапевтически эффективным количеством является именно то количество, которое эффективно для предупреждения микробной инфекции.
"Терапевтический эффект" ослабляет, до некоторой степени, один или более симптомов инфекции и включает излечение инфекции. "Излечение" означает, что симптомы активной инфекции устранены, включая общее или существенное устранение избыточных членов жизнеспособного микроорганизма из тех, которые вовлечены в инфекцию, до точки порога или ниже точки порога обнаружения традиционными методами измерений. Однако даже после достижения излечения могут иметь место некоторые долговременные или перманентные эффекты инфекции (такие как обширное повреждение ткани).
Используемый в данном описании термин "терапевтический эффект" определяют как статистически значимое снижение бактериальной нагрузки у хозяина, появление сопротивляемости организма или улучшение симптомов инфекции по результатам измерений в клинических исследованиях на людях или в исследованиях на животных.
"Лечить" или "лечение" в данном описании относится к введению фармацевтической композиции в профилактических и/или терапевтических целях. Термин "профилактическое лечение" относится к лечению пациента, еще не инфицированного, но чувствительного к конкретной инфекции или, иначе, имеющего риск конкретной инфекции, при котором снижается вероятность начала инфекции. Термин "терапевтическое лечение" относится к лечению пациента, уже страдающего инфекцией. Таким образом, в предпочтительных воплощениях лечение представляет собой введение млекопитающему (либо в терапевтических целях, либо в профилактических целях) терапевтически эффективных количеств фторхинолонового противомикробного средства.
Фармакокинетика (РК) относится к периоду действия противомикробной концентрации в организме. Фармакодинамика (PD) относится к взаимосвязи между фармакокинетикой и противомикробной эффективностью in vivo. Параметры PK/PD коррелируют противомикробное воздействие с противомикробной активностью. Степень уничтожения микроорганизмов противомикробным агентом зависит от механизма действия противомикробного средства и определяется либо продолжительностью периода времени, необходимого для уничтожения (время-зависимое), либо эффектом увеличения концентраций (концентрация-зависимое). Для расчета терапевтической эффективности противомикробных средств с разными механизмами действия могут быть использованы разные параметры PK/PD. Параметры PK/PD могут быть использованы для определения биодоступности противомикробных композиций, например биодоступности композиции в легочной системе и/или биодоступности композиции в плазме/сыворотке крови.
Отношение "AUC/MIC" является одним примером параметра PK/PD. AUC определяют как площадь под кривой зависимости концентрации противомикробного средства в плазме/сыворотке крови или в участке локализации инфекции от времени in vivo (у животного или человека).
Например, участок локализации инфекции и/или участок, где измеряют концентрацию, может включать части легочной системы, такие как бронхиальная жидкость и/или мокрота. Соответственно, AUC может включать сывороточную AUC и легочную AUC. AUC(0-t) может включать площадь под кривой за период времени от нуля до конкретного момента времени "t". AUC(0-inf) может включать площадь под кривой от точки времени ноль до бесконечности. Отношение AUC/MIC определяют путем деления 24-часовой AUC для индивидуального противомикробного средства на MIC для того же самого противомикробного средства, определенную in vitro. Активность противомикробных средств с доза-зависимым уничтожением (таких как фторхинолоны) хорошо прогнозируется по величине отношения AUC/MIC.
Отношение "Cmax:MIC" является еще одним параметром PK:PD. Оно описывает максимальную концентрацию лекарственного средства в плазме или ткани по отношению к MIC. Фторхинолоны и аминогликозиды являются примерами, где Cmax:MIC может прогнозировать уничтожение бактерий in vivo, тогда как резистентность может быть подавлена.
"Время превышения MIC" (T>MIC) является еще одним параметром PK/PD. Этот параметр выражается в процентах от дозировочного интервала, в котором уровень в плазме или в участке локализации инфекции превышает MIC. Активность противомикробных средств с время-зависимым уничтожением (таких как бета-лактамы или оксазолидиноны) хорошо прогнозируется по величине показателя Т>М1С.
Термин "дозировочный интервал" относится к времени между введениями двух последовательных доз фармацевтического средства в режимах введения многократных доз. Например, в случае ципрофлоксацина для перорального введения, который вводят два раза в сутки (традиционный режим 400 мг два раза в сутки), и в случае левофлоксацина для перорального введения, который вводят один раз в сутки (500 мг или 750 мг в сутки), дозировочные интервалы составляют 12 часов и 24 часа соответственно.
Используемый в данном описании термин "пиковый период" концентрации фармацевтического средства in vivo определяют как время интервала введения доз фармацевтического средства, когда концентрация фармацевтического средства составляет не менее 50% от его максимальной концентрации в плазме или в участке локализации инфекции. В некоторых воплощениях "пиковый период" используют для описания интервала введения доз противомикробного средства.
"Доставленная вдыхаемая доза" представляет собой количество лекарственного средства, вдыхаемого во время фазы вдоха имитатора дыхания, который равен или менее- 5 микрон, с использованием имитатора, запрограммированного согласно Европейскому стандарту на 15 дыханий в минуту, с соотношением вдох: выдох 1:1.
Фармацевтические композиции
Для назначений способа, описанного в данном документе, фторхинолоновый противомикробный агент, приготовленный с двухвалентным или трехвалентным катионом, имеющим улучшенную легочную биодоступность, можно вводить с использованием ингалятора. В некоторых воплощениях фторхинолоновый противомикробный агент, раскрытый в данном документе, получают в виде фармацевтической композиции, подходящей для образования аэрозоля, с хорошим вкусом, стабильностью при хранении и безопасностью для пациента и переносимостью пациентом. В некоторых воплощениях содержание изоформы изготовленного фторхинолона может быть оптимизировано в отношении переносимости, активности и стабильности противомикробного средства.
Композиции могут содержать двухвалентный или трехвалентный катион. Двухвалентный или трехвалентный катион может представлять собой, например, магний, кальций, цинк, медь, алюминий и железо. В некоторых воплощениях раствор содержит хлорид магния, сульфат магния, хлорид цинка или хлорид меди. В некоторых воплощениях концентрация двухвалентного или трехвалентного катиона может составлять от примерно 25 мМ до примерно 400 мМ, от примерно 50 мМ до примерно 400 мМ, от примерно 100 мМ до примерно 300 мМ, от примерно 100 мМ до примерно 250 мМ, от примерно 125 мМ до примерно 250 мМ, от примерно 150 мМ до примерно 250 мМ, от примерно 175 мМ до примерно 225 мМ, от примерно 180 мМ до примерно 220 мМ и от примерно 190 мМ до примерно 210 мМ. В некоторых воплощениях хлорид магния, сульфат магния, хлорид цинка или хлорид меди может иметь концентрацию от примерно 5% до примерно 25%, от примерно 10% до примерно 20% и от примерно 15% до примерно 20%. В некоторых воплощениях отношение фторхинолона к двухвалентному или трехвалентному катиону может составлять от 1:1 до 2:1 или от 1:1 до 1:2.
Не ограничивающие фторхинолоны для применения, которое описано в данном документе, включают левофлоксацин, офлоксацин, ципрофлоксацин, эноксацин, гатифлоксацин, гемифлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, пефлоксацин, спарфлоксацин, гареноксацин, ситафлоксацин и DX-619.
Композиция может иметь концентрацию фторхинолона, например левофлоксацина или офлоксацина, более чем примерно 50 мг/мл, примерно 60 мг/мл, примерно 70 мг/мл, примерно 80 мг/мл, примерно 90 мг/мл, примерно 100 мг/мл, примерно 110 мг/мл, примерно 120 мг/мл, примерно 130 мг/мл, примерно 140 мг/мл, примерно 150 мг/мл, примерно 160 мг/мл, примерно 170 мг/мл, примерно 180 мг/мл, примерно 190 мг/мл и примерно 200 мг/мл. В некоторых воплощениях композиция может иметь концентрацию фторхинолона, например левофлоксацина или офлоксацина, от примерно 50 мг/мл до примерно 200 мг/мл, от примерно 75 мг/мл до примерно 150 мг/мл, от примерно 80 мг/мл до примерно 125 мг/мл, от примерно 80 мг/мл до примерно 120 мг/мл, от примерно 90 мг/мл до примерно 125 мг/мл, от примерно 90 мг/мл до примерно 120 мг/мл и от примерно 90 мг/мл до примерно 110 мг/мл.
Композиция может иметь осмоляльность от примерно 300 мосмоль/кг до примерно 500 мосмоль/кг, от примерно 325 мосмоль/кг до примерно 450 мосмоль/кг, от примерно 350 мосмоль/кг до примерно 425 мосмоль/кг и от примерно 350 мосмоль/кг до примерно 400 мосмоль/кг.В некоторых воплощениях осмоляльность композиции составляет более чем примерно 300 мосмоль/кг, примерно 325 мосмоль/кг, примерно 350 мосмоль/кг, примерно 375 мосмоль/кг, примерно 400 мосмоль/кг, примерно 425 мосмоль/кг, примерно 450 мосмоль/кг, примерно 475 мосмоль/кг и примерно 500 мосмоль/кг.
Композиция может иметь рН от примерно 4,5 до примерно 8,5, от примерно 5,0 до примерно 8,0, от примерно 5,0 до примерно 7,0, от примерно 5,0 до примерно 6,5, от примерно 5,5 до примерно 6,5 и от 6,0 до примерно 6,5.
Композиция может содержать традиционный фармацевтический носитель, эксципиент или тому подобное (например маннит, лактозу, крахмал, стеарат магния, натрий-сахарин, тальк, целлюлозу, натрий-кросскармелозу, глюкозу, желатин, сахарозу, карбонат магния и т.п.), или вспомогательные вещества, такие как увлажняющие агенты, эмульгирующие агенты, солюбилизирующие агенты, рН-буферные агенты и т.п. (например ацетат натрия, цитрат натрия, производные циклодекстрина, сорбитанмонолаурат, триэтаноламин-ацетат, триэтаноламин-олеат и т.п.). В некоторых воплощениях композиция может не содержать традиционного фармацевтического носителя, эксципиента или т.п.Некоторые воплощения включают композицию, не содержащую лактозу. Некоторые воплощения содержат лактозу в концентрации менее примерно 10%, 5%, 1% или 0,1%. В некоторых воплощениях композиция может состоять по существу из левофлоксацина или офлоксацина и двухвалентного или трехвалентного катиона.
В некоторых воплощениях композиция может содержать левофлоксацин в концентрации от примерно 75 мг/мл до примерно 150 мг/мл, хлорид магния в концентрации от примерно 150 мМ до примерно 250 мМ, может иметь рН от примерно 5 до примерно 7, может иметь осмоляльность от примерно 300 мосмоль/кгдо примерно 500 мосмоль/кг и может не содержать лактозу.
В некоторых воплощениях композиция содержит левофлоксацин в концентрации примерно 100 мг/мл, содержит хлорид магния в концентрации примерно 200 мМ, имеет рН примерно 6,2, имеет осмоляльность примерно 383 мосмоль/кг и не содержит лактозу. В некоторых воплощениях композиция по существу состоит из левофлоксацина в концентрации примерно 100 мг/мл, хлорида магния в концентрации примерно 200 мМ, имеет рН примерно 6,2, имеет осмоляльность примерно 383 мосмоль/кг и не содержит лактозу. В некоторых воплощениях композиция состоит из левофлоксацина в концентрации примерно 100 мг/мл, хлорида магния в концентрации примерно 200 мМ, имеет рН примерно 6,2, имеет осмоляльность примерно 383 мосмоль/кг и не содержит лактозу.
В некоторых воплощениях терапия аэрозольным фторхинолоном может быть назначена в качестве лечения или профилактики в комбинации или в чередующейся терапевтический последовательности с другими аэрозольными, пероральными или парентеральными антибиотиками. В качестве не ограничивающего примера, такие антибиотики могут включать тобрамицин и/или другой аминогликозид, азтреонам, карумонам и тигемонам и/или другой бета- или моно-бактам, ципрофлоксацин и/или другие фторхинолоны, азитромицин и/или другие макролиды или кетолиды, тетрациклин и/или другие тетрациклины, хинупристин и/или другие стрептограмины, линезолид и/или другие оксазолидиноны, ванкомицин и/или другие гликопептиды, хлорамфеникол и/или другие фениколы, и колистин и/или другие полимиксины. В дополнительных воплощениях антибиотик может включать хинолоны, тетрациклины, гликопептиды, аминогликозиды, β-лактамы, рифамицины, макролиды/кетолиды, оксазолидиноны, коумермицины, хлорамфеникол, стрептограмины, триметоприм, сульфаметоксазол или полимикины. В конкретных воплощениях антибиотик из вышеуказанных классов может представлять собой, например, один из указанных ниже. В некоторых воплощениях любой из вышеупомянутых антибиотиков можно вводить любым приемлемым способом или путем, например, аэрозольным, пероральным или парентеральным.
Бета-лактамные антибиотики
Бета-лактамные антибиотики включают, без ограничения, имипинем, меропенем, биапенем, цефаклор, цефадроксил, цефамандол, цефатризин, цефазедон, цефазолин, цефиксим, цефменоксим, цефодизим, цефоницид, цефоперазон, цефоранид, цефотаксим, цефотиам, цефпимизол, цефпирамид, цефподоксим, цефсулодин, цефтазидим, цефтерам, цефтезол, цефтибутен, цефтизоксим, цефтриаксон, цефуроксим, цефузонам, цефаацетрил, цефалексин, цефалоглицин, цефалоридин, цефалотин, цефапирин, цефрадин, цефметазол, цефокситин, цефотетан, азтреонам, карумонам, фломоксеф, моксалактам, амидиноциллин, амоксициллин, ампициллин, азлоциллин, карбенициллин, бензилпенициллин, карфециллин, клоксациллин, диклоксациллин, метициллин, мезлоциллин, нафциллин, оксациллин, пенициллин G, пиперациллин, сулбенициллин, темоциллин, тикарциллин, цефдиторен, SC004, KY-020, цефдинир, цефтибутен, FK-312, S-1090, СР-0467, ВК-218, FK-037, DQ-2556, FK-518, цефозопран, МЕ1228, КР-736, СР-6232, Ro 09-1227, ОРС-20000 и LY206763.
Макролиды
Макролиды включают, без ограничения, азитромицин, кларитромицин, эритромицин, олеандомицин, рокитамицин, розарамицин, рокситромицин и тролеандомицин.
Кетолиды
Кетолиды включают, без ограничения, телитромицин и цетримицин.
Хинолоны
Хинолоны включают, без ограничения, амифлоксацин, циноксацин, ципрофлоксацин, эноксацин, флероксацин, флумеквин, ломефлоксацин, налидиксовую кислоту, норфлоксацин, офлоксацин, левофлоксацин, оксолиновую кислоту, пефлоксацин, розоксацин, темафлоксацин, тосуфлоксацин, спарфлоксацин, клинафлоксацин, моксифлоксацин; гемифлоксацин; гаренофлоксацин; PD131628, PD138312, PD140248, Q-35, АМ-1155, NM394, Т-3761, руфлоксацин, ОРС-17116, DU-6859a (смотри, например, Sato, К. et al, 1992, Antimicrob Agents Chemother. 37:1491-98) и DV-7751a (смотри, например, Tanaka, M. et al, 1992, Antimicrob. Agents Chemother. 37:2212-18).
Тетрациклины, глицилциклины и оксазолидиноны
Тетрациклины, глицилциклины и оксазолидиноны включают, без ограничения, хлортетрациклин, демоклоциклин, доксициклин, лимециклин, метациклин, миноциклин, окситетрациклин, тетрациклин, тигециклин, линезолид и эперозолид.
Аминогликозиды
Аминогликозиды включают, без ограничения амикацин, арбекацин, бутирозин, дибекацин, фортимицины, гентамицин, канамицин, меомицин, нетилмицин, рибостамицин, сисомицин, спектиномицин, стрептомицин и тобрамицин.
Линкозамиды
Линкозамиды включают, без ограничения, клиндамицин и линкомицин.
Стрептограмины
Стрептограмины включают, без ограничения, хинупристин.
Гликопептиды
Гликопептиды включают, без ограничения, ванкомицин.
Полимиксины
Полимиксины включают без ограничения, колистин.
Дополнительные примеры включают фосфомицин, пенициллины, цефалоспорины, карбапенемы, пенемы и карбацефемы.
В некоторых воплощениях композиция может содержать фторхинолон в комбинации с дополнительным активным агентом. Как обсуждается в данном документе, некоторые такие дополнительные активные агенты могут включать антибиотики. Кроме того, дополнительные активные агенты могут включать бронхорасширяющие средства, антихолинергические агенты, глюкокортикоиды, ингибиторы эйкозаноидов и их комбинации. Примеры бронхорасширяющих средств включают сальбутамол, левосальбутерол, тербуталин, фенотерол, тербутлаин, пирбутерол, прокатерол, битолтерол, римитерол, карбутерол, тулобутерол, репротерол, сальметерол, формотерол, арформотерол, бамбутерол, кленбутерол, индактерол, теофиллин, рофлумиласт, циломиласт. Примеры антихолинергических агентов включают ипратропий и тиотропий. Примеры глюкокортикоидов включают преднизон, флутиказон, будесонид, мометазон, циклесонид и беклометазон. Примеры эйкозаноидов включают монтелукаст, пранлукаст, зафрилукаст, зилеутон, раматробан и сератродаст. Дополнительные активные агенты могут также включать пульмозим, гипертонический физиологический раствор, агенты, которые восстанавливают функцию хлоридных каналов при CF, ингалируемые бета-агонисты, ингалируемые антимускариновые агенты, ингалируемые кортикостероиды и ингалируемые ингибиторы фосфодиэстераз. В некоторых воплощениях терапия аэрозольным антибиотиком, назначенная в качестве лечения или профилактики, может быть использована в комбинации и в чередующейся терапевтической последовательности с дополнительным активным агентом. В дополнительных воплощениях дополнительный активный агент можно вводить для лечения один, в составе композиции или с аэрозольной терапией антибиотиком.
Введение
Фторхинолоновые противомикробные агенты, приготовленные с двухвалентными или трехвалентными катионами, можно вводить в терапевтически эффективной дозировке, например в дозировке, достаточной для достижения результатов, описанных в данном документе. Аналогично, способ и схема введения могут быть выбраны для достижения результатов, описанных в данном документе. Например, в некоторых воплощениях вдыхаемая доза, вводимая в легкие, может составлять от примерно 20 мг до примерно 170 мг, от примерно 30 мг до примерно 160 мг, от примерно 40 мг до примерно 150 мг, от примерно 50 мг до примерно 140 мг и от примерно 65 мг до примерно 130 мг. В некоторых воплощениях нагрузочная доза может составлять от примерно 80 мг до примерно 280 мг, от примерно 90 мг до примерно 270 мг, от примерно 100 мг до примерно 260 мг, от примерно 110 мг до примерно 250 мг и от примерно 120 мг до примерно 240 мг. В конкретных воплощениях дозу можно вводить один раз в сутки или два раза в сутки. В некоторых воплощениях терапию проводят в течение по меньшей мере 28 суток.
Введение фторхинолоновых противомикробных средств, раскрытых в данном документе, или их фармацевтически приемлемых солей можно осуществлять любыми способами введения, приемлемыми для агентов, которые имеют подобное применение, включая, без ограничения, ингаляцию аэрозоля. Способы, устройства и композиции для доставки описаны в публикации патентной заявки США №2006-0276483, полное содержание которой включено в данное описание посредством ссылки.
Фармацевтически приемлемые композиции включают твердые, полутвердые, жидкие и аэрозольные лекарственные формы, такие как, например, порошки, жидкости, суспензии, комплексы, липосомы, макрочастицы или тому подобные. Предпочтительно, композиции предоставляют в стандартных лекарственных формах, подходящих для однократного введения точной дозы.
Фторхинолоновый противомикробный агент можно вводить либо сам по себе, либо, в некоторых альтернативах, совместно с традиционным фармацевтическим носителем, эксципиентом или т.п. (например маннитом, лактозой, крахмалом, стеаратом магния, натрий-сахарином, тальком, целлюлозой, натрий-кросскармелозой, глюкозой, желатином, сахарозой, карбонатом магния и т.п.). Если желательно, фармацевтическая композиция может также содержать небольшие количества нетоксичных вспомогательных веществ, таких как увлажняющие агенты, эмульгаторы, солюбилизирующие агенты, рН-буферные агенты и т.п. (например ацетат натрия, цитрат натрия, производные циклодекстрина, сорбитана монолаурат, триэтаноламинацетат, триэтаноламинолеат и т.п.). Как правило, в зависимости от назначенного способа введения, фармацевтическая композиция будет содержать от примерно 0,005% до 95%, предпочтительно от примерно 0,5% до 50% по массе соединения по изобретению. Действующие способы получения таких лекарственных форм известны или будут очевидны специалистам в данной области (смотри, например, Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pennsylvania).
В одном предпочтительном воплощении композиции будут принимать форму стандартной лекарственной формы, такой как флакон, содержащий композицию в виде жидкости, твердого вещества, которое предназначено для суспендирования, сухого порошка, лиофилизата или другую композицию, и поэтому композиция может содержать вместе с активным ингредиентом разбавитель, такой как лактоза, сахароза, дикальцийфосфат или т.п.;
смазывающее вещество, такое как стеарат магния или т.п.; связывющее вещество, такое как крахмал, аравийская камедь, поливинилпирролидон, желатин, целлюлоза, производные целлюлозы или т.п.
Жидкие фармацевтически приемлемые композиции могут быть приготовлены, например, путем растворения, диспергирования и т.д. активного соединения, как оно определено выше, и возможных фармацевтических адъювантов в носителе (например в воде, физиологическом растворе, водной декстрозе, глицерине, гликолях, этаноле или т.п.) с образованием раствора или суспензии. Растворы, предназначенные для распыления в виде аэрозоля, могут быть приготовлены в обычных формах, либо в виде жидких растворов или суспензий, в виде эмульсий, либо в твердых формах, подходящих для растворения или суспендирования в жидкости перед продуцированием аэрозоля и ингаляцией. Процентное содержание активного соединения в таких аэрозольных композициях в значительной степени зависит от его конкретной природы, а также от активности соединения и потребностей субъекта. Однако процентные содержания активного ингредиента от 0,01% до 90% в растворе реально применимы и будут выше, если композиция является твердой и предназначена для последующего разбавления до вышеуказанных процентов. В некоторых воплощениях композиция будет содержать 1,0%-50,0% активного агента в растворе.
В некоторых воплощениях предложенных способов, композиций и применений продолжительность терапии, например терапии антибиотиком в форме аэрозоля, может включать по меньшей мере примерно 1 день/месяц, по меньшей мере примерно 2 дня/месяц, по меньшей мере примерно 3 дня/месяц, по меньшей мере примерно 4 дня/месяц, по меньшей мере примерно 5 дней/месяц, по меньшей мере примерно 6 дней/месяц, по меньшей мере примерно 7 дней/месяц, по меньшей мере примерно 8 дней/месяц, по меньшей мере примерно 9 дней/месяц, по меньшей мере примерно 10 дней/месяц, по меньшей мере примерно 11 дней/месяц, по меньшей мере примерно 12 дней/месяц, по меньшей мере примерно 13 дней/месяц, по меньшей мере примерно 14 дней/месяц, по меньшей мере примерно 15 дней/месяц, по меньшей мере примерно 16 дней/месяц, по меньшей мере примерно 17 дней/месяц, по меньшей мере примерно 18 дней/месяц, по меньшей мере примерно 19 дней/месяц, по меньшей мере примерно 20 дней/месяц, по меньшей мере примерно 21 день/месяц, по меньшей мере примерно 22 дня/месяц, по меньшей мере примерно 23 дня/месяц, по меньшей мере примерно 24 дня/месяц, по меньшей мере примерно 25 дней/месяц, по меньшей мере примерно 26 дней/месяц, по меньшей мере примерно 27 дней/месяц, по меньшей мере примерно 28 дней/месяц, по меньшей мере примерно 29 дней/месяц, по меньшей мере примерно 30 дней/месяц и по меньшей мере примерно 31 день/месяц.
Описанные здесь композиции можно вводить с частотой примерно 1, 2, 3, 4 или более раз в сутки, 1, 2, 3, 4, 5, 6, 7 или более раз в неделю, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более раз в месяц. В конкретных воплощениях композиции вводят два раза в сутки.
Аэрозольная доставка
Для легочного введения верхние дыхательные пути исключаются в пользу средних и нижних дыхательных путей. Доставка лекарственного средства в легкие может быть осуществлена посредством ингаляции аэрозоля через рот и горло. Частицы, имеющие масс-медианный аэродинамический диаметр (MMAD) более чем примерно 5 микрон, обычно не достигают легкого;
вместо этого они ударяются о заднюю стенку горла и проглатываются и возможно всасываются перорально. Частицы, имеющие диаметр от примерно 2 до примерно 5 микрон, являются достаточно маленькими, чтобы достигать верхней-средней области легкого (дыхательные пути, где не происходит газообмен), но слишком большими, чтобы достигать альвеол. Более мелкие частицы, т.е. от примерно 0,5 до примерно 2 микрон, способны достигать альвеолярной области. Частицы, имеющие диаметр менее примерно 0,5 микрон, также могут оседать в альвеолярной области в результате седиментации, хотя очень маленькие частицы могут выдыхаться.
В одном из воплощений небулайзер выбран исходя из возможности обеспечения образования аэрозоля фторхинолонового противомикробного средства, раскрытого в данном документе, имеющего MMAD преимущественно от примерно 2 до примерно 5 микрон. В одном из воплощений доставляемое количество фторхинолонового противомикробного средства обеспечивает терапевтический эффект в отношении респираторных инфекций. Небулайзер может доставлять аэрозоль, имеющий масс-медианный аэродинамический диаметр от примерно 2 микрон до примерно 5 микрон с геометрическим стандартным отклонением, которое меньше или равно примерно 2,5 микрон, масс-медианный аэродинамический диаметр от примерно 2,5 микрон до примерно 4,5 микрон с геометрическим стандартным отклонением, которое меньше или равно примерно 1,8 микрон, и масс-медианный аэродинамический диаметр от примерно 2,8 микрон до примерно 4,3 микрон с геометрическим стандартным отклонением, которое меньше или равно примерно 2 микрон. В некоторых воплощениях аэрозоль может быть образован с использованием небулайзера с вибрирующей сеткой-мембраной. Примером небулайзера с вибрирующей сеткой-мембраной является небулайзер PARI E-FLOW®. Дополнительные примеры небулайзеров приведены в патентах США №№4268460, 4253468, 4046146, 3826255, 4649911, 4510929, 4624251, 5164740, 5586550, 5758637, 6644304, 6338443, 5906202, 5934272, 5960792, 5971951, 6070575, 6192876, 6230706, 6349719, 6367470, 6543442, 6584971, 6601581, 4263907, 5709202, 5823179, 6192876, 6644304, 5549102, 6083922, 6161536, 6264922, 6557549 и 6612303, полное содержание которых включено в данное описание посредством ссылки. Дополнительные примеры коммерческих небулайзеров, которые могут быть использованы с описанными здесь композициями, включают Respirgard II®, Aeroneb®, Aeroneb® Pro и Aeroneb® Go (производитель Aerogen); AERx® и AERx Essence™ (производитель Aradigm); Porta-Neb®, Freeway Freedom™, Sidestream, Ventstream и l-neb (производитель Respironics, Inc.); и PARI LC-Плюс®, PARI LC-Star® (производитель PARI, GmbH). Дополнительные не ограничивающий примеры можно найти также в патенте США №6196219, полное содержание которого включено в данное описание посредством ссылки.
Количество левофлоксацина или офлоксацина, которое может быть введено (в виде вдыхаемой дозы, дозы, загруженной в небулайзер, и/или осажденной дозы), может составлять по меньшей мере примерно 20 мг, примерно 30 мг, примерно 40 мг, примерно 50 мг, примерно 60 мг, примерно 70 мг, примерно 80 мг, примерно 90 мг, примерно 100 мг, примерно 110 мг, примерно 120 мг, примерно 125 мг, примерно 130 мг, примерно 140 мг, примерно 150 мг, примерно 160 мг, примерно 170 мг, примерно 180 мг, примерно 190 мг, примерно 200 мг, примерно 210 мг, примерно 220 мг, примерно 230 мг, примерно 240 мг, примерно 250 мг, примерно 260 мг, примерно 270 мг, примерно 280 мг, примерно 290 мг, примерно 300 мг, примерно 310 мг, примерно 320 мг, примерно 330 мг, примерно 340 мг, примерно 350 мг, примерно 460 мг, примерно 470 мг, примерно 480 мг, примерно 490 мг, примерно 500 мг, примерно 510 мг, примерно 520 мг, примерно 530 мг, примерно 540 мг, примерно 550 мг, примерно 560 мг, примерно 570 мг, примерно 580 мг, примерно 590 мг, примерно 600 мг, примерно 610 мг, примерно 620 мг, примерно 630 мг, примерно 640 мг, примерно 650 мг, примерно 660 мг, примерно 670 мг, примерно 680 мг, примерно 690 мг, примерно 700 мг, примерно 710 мг, примерно 720 мг, примерно 730 мг, примерно 740 мг, примерно 750 мг, примерно 760 мг, примерно 770 мг, примерно 780 мг, примерно 790 мг и примерно 800 мг.
Аэрозоль можно вводить в легкие за менее чем примерно 10 минут, примерно 5 минут, примерно 4 минут, примерно 3 минут, примерно 2 минут и примерно 1 минуту.
Показания
Описанные здесь способы и композиции могут быть использованы для лечения легочных инфекций и расстройств, например муковисцидоза. Некоторые воплощения включают лечение инфекции, включающей одну или более бактерий, которые могут включать Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas acidovorans, Pseudomonas alcaligenes, Pseudomonas putida, Stenotrophomonas sp., например, Stenotrophomonas maltophilia, Aeromonas hydrophilia, Escherichia coli, Citrobacter freundii, Salmonella typhimurium, Salmonella typhi, Salmonella paratyphi, Salmonella enteritidis, Shigella dysenteriae, Shigella flexneri, Shigella sonnei, Enterobacter cloacae, Enterobacter aerogenes, Kfebsiella pneumoniae, Klebsiella oxytoca, Serratia marcescens, Morganella morganii, Proteus mirabilis, Proteus vulgaris, Providencia alcalifaciens, Providencia rettgeri, Providencia stuartii, Acinetobacter calcoaceticus, Acinetobacter haemolyticus, Yersinia enterocolitica, Yersinia pestis, Yersinia pseudotuberculosis, Yersinia intermedia, Bordetella pertussis, Bordetella parapertussis, Bordetella bronchiseptica, Haemophilus influenzae, Haemophilus parainfluenzae, Haemophilus haemolyticus, Haemophilus parahaemolyticus, Haemophilus ducreyi, Pasteurella multocida, Pasteurella haemolytica, Helicobacter pylori, Campylobacter fetus, Campylobacterjejuni, Campylobacter coli, Borrelia burgdorferi, Vibrio cholera, Vibrio parahaemolyticus, Legionella pneumophila, Listeria monocytogenes, Neisseha gonorrhoeae, Neisseha meningitidis, Burkholderia sp., например, Burkholderia cepacia, Francisella tularensis, Kingella и Moraxella. В некоторых воплощениях легочная инфекция может включать грамотрицательные анаэробные бактерии. В дополнительных воплощениях легочная инфекция может включать одну или более бактерий, выбранных из группы, состоящей из Bacteroides fragilis, Bacteroides distasonis, бактерий группы Bacteroides 3452A, Bacteroides vulgatus, Bacteroides ovalus, Bacteroides thetaiotaomicron, Bacteroides uniformis, Bacteroides eggerthii и Bacteroides splanchnicus. В некоторых воплощениях легочная инфекция может включать грамположительные бактерии. В некоторых воплощениях легочная инфекция может включать одну или более бактерий, выбранных из группы, состоящей из Corynebacterium diphtheriae, Corynebactehum ulcerans, Streptococcus pneumoniae, Streptococcus agalactiae, Streptococcus pyogenes, Streptococcus milleri; Streptococcus (Группа G); Streptococcus (Группа C/F); Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Staphylococcus intermedius, Staphylococcus hyicus subsp.hyicus, Staphylococcus haemolyticus, Staphylococcus hominis и Staphylococcus saccharolyticus. В некоторых воплощениях легочная инфекция может включать грамположительные анаэробные бактерии. В некоторых воплощениях легочная инфекция может включать одну или более бактерий, выбранных из группы, состоящей из Closthdium difficile, Clostridium perfringens, Closthdium tetini и Clostridium botulinum. В некоторых воплощениях легочная инфекция может включать кислотоустойчивые бактерии. В некоторых воплощениях легочная инфекция может включать одну или более бактерий, выбранных из группы, состоящей из Mycobacterium tuberculosis, Mycobacterium avium, Mycobacterium intracellulare и Mycobacterium leprae. В некоторых воплощениях легочная инфекция может включать атипичные бактерии. В некоторых воплощениях легочная инфекция может включать одну или более бактерий, выбранных из группы, состоящей из Chlamydia pneumoniae и Mycoplasma pneumoniae. В некоторых воплощениях легочная инфекция может включать неферментирующие грамотрицательные бактерии (NFGNB). Примеры NFGNB могут включать Burkholeria spp., stenotrophomonas spp., acinetobacter spp., pseudomonas spp. и Achromobacter spp. Дополнительные примеры бактерий, в отношении которых пригодны предложенные здесь способы и композиции, можно найти в 'Bergey's Manual of Systematic Bacteriology,' Editor-in-chief: Garrity, George M. Boone, David R.; Castenholz, Richard W. (Eds.) Originally published by Williams & Wilkins, 1984, 2nd ed., (2001), полное содержание которого включено в данное описание посредством ссылки.
Некоторые предложенные здесь способы и композиции могут быть особенно подходящими для лечения легочных инфекций и расстройств, в которые вовлечены штаммы микроорганизмов, которые могут быть трудными для лечения с использованием противомикробного средства, доставляемого парентерально, из-за необходимости в высоких уровнях парентеральной дозы, которые могут вызывать нежелательные побочные эффекты, или из-за отсутствия клинически эффективных противомикробных средств. Например, введение фторхинолонового противомикробного средства в форме аэрозоля прямо в участок инфекции может снижать системное воздействие и может максимизировать количество противомикробного средства в участке микробной инфекции. Такие способы могут быть подходящими для лечения инфекций, в которые вовлечены микроорганизмы, которые чувствительны к фторхинолоновым противомикробным агентам, с целью снижения частоты отбора устойчивых микроорганизмов.
В некоторых воплощениях аэрозольный фторхинолоновый противомикробный агент, приготовленный с двухвалентными или трехвалентными катионами, вводят в дозах, уровни которых достаточны для преодоления возникновения устойчивости у бактерий или для повышения эффективности уничтожения, чтобы устойчивость не развивалась.
Некоторые воплощения описанных здесь способов и композиций включают достижение снижения легочной инфекции. Снижение легочной инфекции может быть измерено с использованием множества разных способов. Например, при легочной инфекции, включающей один или более микроорганизмов, может быть измерено снижение плотности микроорганизмов. В некоторых воплощениях лечение может обеспечивать снижение плотности микроорганизмов по меньшей мере примерно на 1%, примерно на 5%, примерно на 10%, примерно на 15%, примерно на 20%, примерно на 25%, примерно на 30%, примерно на 35%, примерно на 40%, примерно на 45%, примерно на 50%, примерно на 55%, примерно на 60%, примерно на 65%, примерно на 70%, примерно на 75%, примерно на 80%, примерно на 85%, примерно на 90%, примерно на 95% и примерно на 100%. В некоторых воплощениях лечение может обеспечивать снижение плотности микроорганизмов по меньшей мере примерно на 85%, примерно на 86%, примерно на 87%, примерно на 88%, примерно на 89%, примерно на 90%, примерно на 91%, примерно на 92%, примерно на 93%, примерно на 94%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98%, примерно на 99% и примерно на 100%.
Плотность микроорганизмов может быть измерена в образце, взятом у субъекта, например из бронхиального альвеолярного лаважа, мокроты и сыворотки. В некоторых воплощениях плотность микроорганизмов может быть снижена по меньшей мере примерно на 0,1, примерно на 0,2, примерно на 0,3, примерно на 0,4, примерно на 0,5, примерно на 0,6, примерно на 0,7, примерно на 0,8, примерно на 0,8, примерно на 1,0, примерно на 1,1, примерно на 1,2, примерно на 1,3, примерно на 1,4, примерно на 1,5, примерно на 1,6, примерно на 1,7, примерно на 1,8, примерно на 1,9, примерно на 2,0, примерно на 2,1, примерно на 2,2, примерно на 2,3, примерно на 2,4, примерно на 2,5 log10 КОЕ/г мокроты или более.
Некоторые воплощения описанных здесь способов и композиций могут включать достижение улучшения параметра легочной функции. Примеры таких параметров могут включать FEV (объем форсированного выдоха), FEV1 (объем форсированного выдоха за 1 секунду) и FEF 25-75 (средняя объемная скорость выдоха в интервале 25-75% жизненной емкости легких). В некоторых воплощениях FEV1 субъекта может быть увеличен с использованием описанных здесь способов и композиций по меньшей мере на примерно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25% и более. В некоторых воплощениях FEV1 субъекта может быть увеличен с использованием описанных здесь способов и композиций по меньшей мере на примерно 0,01 л, 0,02 л, 0,03 л, 0,04 л и 0,05 л, и по меньшей мере на примерно 0,1 л, 0,2 л, 0,3 л, 0,4 л, 0,5 L, 0,6 л, 0,7 л, 0,8 л, 0,9 л, 1,0 л и более.
В некоторых воплощениях FEF 25-75 субъекта может быть увеличен с использованием описанных здесь способов и композиций по меньшей мере на примерно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24% и 25%. В некоторых воплощениях FEF 25-75 субъекта может быть увеличен с использованием описанных здесь способов и композиций по меньшей мере на примерно 0,01 л, 0,02 л, 0,03 л, 0,04 L и 0,05 л и по меньшей мере на примерно 0,1 л, 0,2 л, 0,3 л, 0,4 л, 0,5 л, 0,6 л, 0,7 л, 0,8 л, 0,9 л, 1,0 л и более.
Некоторые воплощения описанных здесь способов и композиций могут включать снижение потребности для субъекта в других ингалируемых или системных антибиотиках, таких как антипсевдомонадные противомикробные средства. Такое снижение может быть измерено множеством разных способов, например по увеличению времени до необходимости использовать другие ингалируемые или системные антибиотики. Снижение такой потребности может быть измерено различными статистическими средствами. Например, в анализе на выживаемость могут быть использованы показатели относительного риска. В некоторых воплощениях относительный риск составляет менее примерно 1,0, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4, 0,3, 0,2, 0,1 и менее.
Некоторые воплощения описанных здесь способов и композиций могут включать снижение частоты обострений, тяжести обострений, продолжительности обострений или вероятности возникновения обострения. Обострение может быть определено любым из нескольких способов и критериев, предусмотренных такими способами. В некоторых воплощениях у пациента могут встречаться одновременно по меньшей мере 4 симптома/признака из определения обострения Фукса (Fuchs HJ, et al. Effect of aerosolized recombinant human DNase on exacerbations of respiratory symptoms and on pulmonary function in patients with cystic fibrosis. N. Engl. J. Med. 1994; 331:637-642; полное содержание этой публикации включено в данное описание посредством ссылки). Симптомы/признаки, определяемые критериями Фукса, включают: изменение мокроты; новое или увеличившееся кровохарканье; увеличившийся кашель; увеличившаяся диспноэ; недомогание, усталость или сонливость; температура выше 38°С; анорексия или потеря массы тела; боль в придаточных пазухах носа или болезненность придаточных пазух; изменение выделений из придаточных пазух носа; изменение результатов объективного обследования грудной клетки; снижение легочной функции на 10% или более от ранее зарегистрированного значения; и радиографические изменения, свидетельствующие о легочной инфекции.
В некоторых воплощениях пациент с улучшением профиля обострения может иметь по меньшей мере 1, по меньшей мере 2, по меньшей мере 3 и по меньшей мере 4 из указанных ниже признаков/симптомов, где изменения могут относиться к типичным ощущениям пациента, например ежесуточным ощущениям и еженедельным ощущениям.
1) Изменение мокроты. Например, в отношении продуцирования мокроты: у пациентов отсутствуют изменения, имеются немного меньшие или намного меньшие количества мокроты при кашле; или в отношении изменения внешнего вида мокроты: что касается густоты мокроты, пациенты имеют немного менее вязкую или намного менее вязкую мокроту; что касается цвета мокроты, у пациентов имеется улучшение цвета мокроты лучше ("улучшение цвета" означает изменение от коричневого к зеленому к желтому к прозрачному).
2) Кровохарканье. Например, у пациентов имеется небольшое снижение или большое снижение количества крови при кашле.
3) Кашель. Например, что касается интенсивности кашля, пациенты имеют немного более легкий или намного более легкий кашель; что касается частоты кашля, у пациентов кашель немного менее частый или намного менее частый.
4) Диспноэ. Например, что касается диспноэ с нагрузкой, пациенты дышат немного легче или намного легче при осуществлении повседневной деятельности.
5) Недомогание, усталость или сонливость. Например, пациенты имеют немного больше энергии или намного больше энергии, и/или пациенты осуществляют повседневную деятельность, например подъем по лестнице, немного легче или намного легче.
6) Температура. Например, пациенты имеют нормальную температуру, например примерно 37°С, или у пациентов нет недавней истории лихорадки.
7) Анорексия или потеря массы тела. Например, у пациентов отсутствует изменение массы тела или имеется небольшой прирост массы тела, и/или у пациентов имеется небольшое повышение аппетита.
8) Боль в придаточных пазухах носа или болезненность придаточных пазух носа. Например, у пациента отсутствует боль в придаточных пазухах носа или болезненность придаточных пазух носа, или имеется меньшая боль в придаточных пазухах носа или меньшая болезненность придаточных пазух носа.
9) Изменение выделений из придаточных пазух носа. Например, у пациентов имеется улучшение выделений из придаточных пазух носа (уменьшение густоты и/или улучшение цвета).
10) Изменение результатов объективного обследования грудной клетки. Например, пациенты имеют улучшенные признаки при обследовании грудной клетки и могут сообщить, например, о небольшом снижении заложенности в груди или большом снижении заложенности в груди.
11) Легочная функция на 10% или более от ранее зарегистрированного значения. Например, пациенты имеют улучшенную легочную функцию в тестах на легочную функцию.
12) Радиографические изменения, свидетельствующие о легочной инфекции. Например, пациенты демонстрируют улучшенные радиографические изменения, указывающие на снижение легочной инфекции.
В некоторых воплощениях переносимость физических нагрузок и/или уклонение от регулярных мероприятий, например от школы или работы, могут быть измерены как признаки/симптомы обострений.
В Таблице 1 суммированы различные способы, пригодные для измерения обострений.
В: Kraynack N.C et al., Improving care at cystic fibrosis centers through quality improvement. Semin Respir Crit Care Med. 2009 Oct; 30(5):547-58); полное содержание этой публикации включено в данное описание посредством ссылки.
Некоторые воплощения любого из вышеописанных способов включают введение левофлоксацина или офлоксацина в комбинации с двухвалентным или трехвалентным катионом в дозировочном количестве, по схеме введения и/или способом введения, достаточными для достижения указанных выше результатов.
Популяции педиатрических пациентов
Некоторые предложенные здесь воплощения относятся к применению предложенных здесь композиций для лечения муковисцидоза у человека. В некоторых воплощениях человеком является педиатрический пациент. В некоторых воплощениях человек имеет возраст менее примерно 18 лет, менее примерно 17 лет, менее примерно 16 лет, менее примерно 15 лет, менее примерно 14 лет, менее примерно 13 лет, менее примерно 12 лет, менее примерно 11 лет, менее примерно 10 лет, менее примерно 9 лет, менее примерно 8 лет, менее примерно 7 лет, менее примерно 6 лет, менее примерно 5 лет, менее примерно 4 лет, менее примерно 3 лет, менее примерно 2 лет и менее примерно 1 года.
Дозировки аэрозольных терапевтических агентов для педиатрических субъектов могут меньше, чем дозировка для взрослого субъекта. В некоторых воплощениях дозировка может быть определена, в частности, исходя из массы тела субъекта. Например, субъект, имеющий массу тела от примерно 14 кг до примерно 21 кг, может получать дозу примерно 120 мг, субъект, имеющий массу тела от примерно 22 кг до примерно 30 кг, может получать дозу примерно 180 мг, и субъект, имеющий массу тела больше, чем примерно 30 кг, может получать дозу примерно 240 мг. В некоторых воплощениях аэрозольный терапевтический агент можно вводить один раз в сутки или два раза в сутки. В некоторых воплощениях аэрозольный терапевтический агент можно вводить в течение периода времени по меньшей мере примерно 1 сутки, 3 суток, 5 суток, 10 суток, 15 суток, 20 суток и 30 суток. В некоторых воплощениях аэрозольный терапевтический агент можно вводить в течение примерно 14 суток. В конкретных воплощениях аэрозольный терапевтический агент вводят один раз в сутки в течение 14 суток.
В некоторых воплощениях человек имеет массу тела менее примерно 70 кг, менее примерно 60 кг, менее примерно 50 кг, менее примерно 40 кг, менее примерно 30 кг, менее примерно 20 кг и менее примерно 10 кг.
В некоторых воплощениях человек имеет площадь поверхности тела менее примерно 1,8 м2, менее примерно 1,6 м2, менее примерно 1,4 м2, менее примерно 1,2 м2, менее примерно 1,0 м2, менее примерно 0,8 м2, менее примерно 0,6 м2 и менее примерно 0,4 м2.
В некоторых воплощениях лечение одного из вышеуказанных людей включает достижение приведенной к дозе сывороточной AUC по меньшей мере примерно 5 (нг.ч/л)/мг дозы, по меньшей мере примерно 10 (нг.ч/л)/мг дозы, по меньшей мере примерно 20 (нг.ч/л)/мг дозы, по меньшей мере примерно 40 (нг.ч/л)/мг дозы, по меньшей мере примерно 60 (нг.ч/л)/мг дозы, по меньшей мере примерно 80 (нг.ч/л)/мг дозы и по меньшей мере примерно 100 (нг.ч/л)/мг дозы.
В некоторых воплощениях лечение одного из вышеуказанных людей включает достижение приведенной к дозе сывороточной Стах более чем примерно 1 мкг/л/мг введенной дозы, более чем примерно 2 мкг/л/мг введенной дозы, более чем примерно 3 мкг/л/мг введенной дозы, более чем примерно 4 мкг/л/мг введенной дозы, более чем примерно 5 мкг/л/мг введенной дозы, более чем примерно 6 мкг/л/мг введенной дозы, более чем примерно 7 мкг/л/мг введенной дозы, более чем примерно 8 мкг/л/мг введенной дозы, более чем примерно 9 мкг/л/мг введенной дозы, более чем примерно 10 мкг/л/мг введенной дозы, более чем примерно 11 мкг/л/мг введенной дозы, более чем примерно 12 мкг/л/мг введенной дозы, более чем примерно 13 мкг/л/мг введенной дозы, более чем примерно 14 мкг/л/мг введенной дозы, более чем примерно 15 мкг/л/мг введенной дозы и более чем примерно 16 мкг/л/мг введенной дозы.
Некоторые воплощения любого из вышеописанных способов лечения указанных людей включают введение левофлоксацина или офлоксацина в комбинации с двухвалентным или трехвалентным катионом в дозировочном количестве, по схеме введения и/или способом введения, достаточными для достижением указанных выше результатов.
ПРИМЕРЫ
Пример 1 - Фаза Ib клинических исследований с левофлоксацином
Фазу Ib простого слепого, плацебо-контролируемого, с увеличением дозы многоцентрового исследования проводили с целью оценки безопасности, переносимости и фармакокинетического (РК) профиля левофлоксацина в форме аэрозоля, вводимого стабильным пациентам с CF. Все пациенты имели Р. aeruginosa, выращенные из мокроты в пределах предыдущих 24 месяцев и при визите для скрининга. Исследуемое лекарственное средство вводили два раза в сутки в течение вплоть до 14 суток при трех дозах аэрозоля, используя устройство PARI eFlow. Доставленные вдыхаемые дозы (RDD) составляли приблизительно 40 мг, 80 мг и 120 мг на лечение, что соответствует нагрузочным дозам 78 мг, 175 мг и 260 мг соответственно. Таким образом, оцениваемые суммарные ежесуточные RDD составляли 80 мг, 160 мг и 240 мг. Исследуемые лекарственные средства вводили в концентрации 30 мг/мл (для дозы 40 мг) или 50 мг/мл (для доз 80 мг и 120 мг). В Таблице 2 представлены композиции исследованных лекарственных средств.
Во время исследования все пациенты принимали по меньшей мере 1 сопутствующее лекарственное средство. Сопутствующими лекарственными средствами являются лекарственные средства, принимаемые после первой дозы исследуемого лекарственного средства независимо от даты начала приема лекарственного средства. Сопутствующими лекарственными средствами, которые принимали по меньшей мере 20% пациентов, были сальбутамол, дорназа альфа, азитромицин, серетид, панкрелипаза, ADEK, гипертонические растворы и нортаза.
Результаты в отношении эффективности
В Таблице 3 суммированы результаты тестов на легочную функцию для измерений FEV1. Самое большое относительное улучшение FEV1 через 7 и 14 суток после введения доз наблюдалось в группе пациентов, принимавших 120 мг RDD (нагрузочная доза 260 мг) левофлоксацина, со средним улучшением 14,79% и 17,58% соответственно. Среднее улучшение 8,90% длилось в течение 2 недель до последующего визита. Кроме того, у пациентов, принимавших левофлоксацин, наблюдалась зависимость ответной реакции от дозы: у пациентов в группах пациентов, принимающих дозу 80 мг и дозу 120 мг, имелось улучшение FEV1, а у пациентов в группе пациентов, принимающих дозу 40 мг, его не было. Все 9 пациентов в группе пациентов, принимающих дозу 120 мг, имели относительное увеличение FEV1, причем 4 из 9 пациентов имели по меньшей мере 20%-ное увеличение.
6,15
10,20
2,95
16,90
В Таблице 4 представлены относительные изменения от исходных значений по визитам (День 1, 2, 7, 14 и 21) в тестах на легочную функцию в отношении FEVi. В Таблице 3 относительное изменение от исходного значения (CBG) рассчитано как "Результат" FEV1 минус "Исходное значение" FEV1, деленное на "Исходное значение" FEV1.
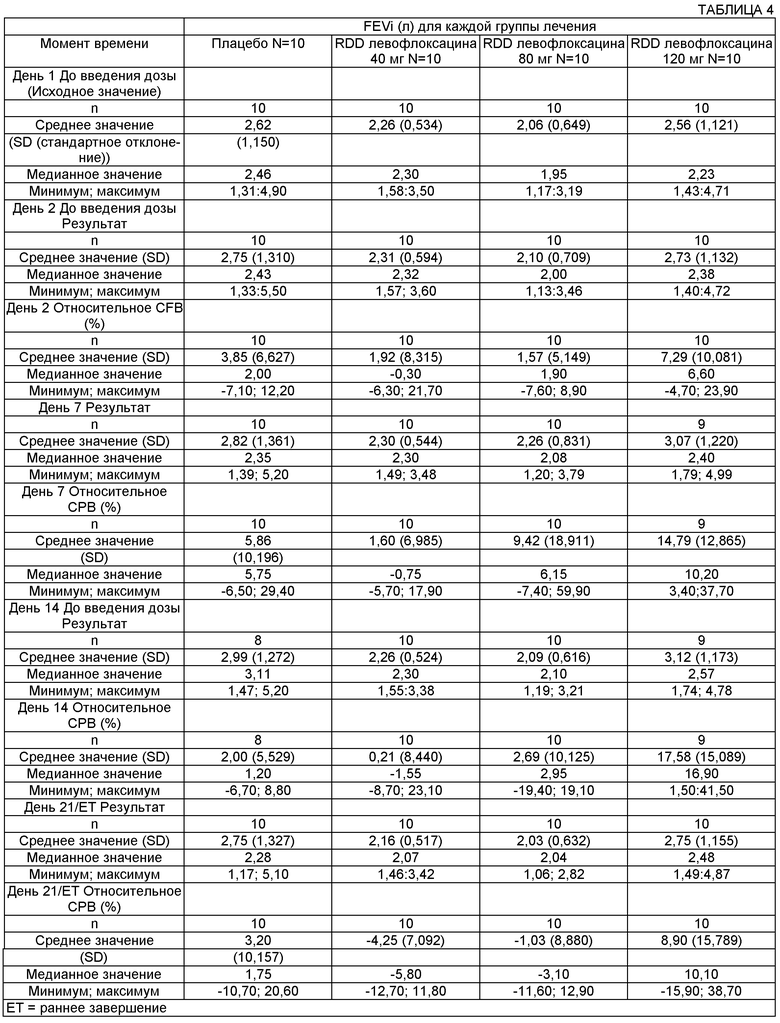
Колониеобразующие единицы Р. aeruginosa в День 1 сравнивали с колониеобразующими единицами в День 7 и День 14. В Таблице 5 суммировано процентное изменение Р. aeruginosa в мокроте (log КОЕ/г) в группах лечения. Уменьшения Р. aeruginosa в мокроте наблюдались в течение всех дней введения доз.
Результаты по безопасности
Никакие серьезные нежелательные явления, связанные с исследуемыми лекарственными средствами, не отмечались. Самые нежелательные явления были неярко выраженными или умеренными по тяжести и самоограничению. Большинство нежелательных явлений были легкими, и наиболее часто наблюдаемыми нежелательными явлениями были жалобы на вкус, кашель и головную боль. Ни один из пациентов, принимающих раствор левофлоксацина для ингаляции, не отвечал критериям непереносимости лекарственного средства. Нежелательные явления, о которых сообщили более чем 1 пациент, принимающий левофлоксацин, включали абдоминальную боль, кашель, прогрессирование заболевания (острое обострение), дизгевзию (плохой вкус), кровохарканье, головную боль, заложенность носа, носоглоточную боль (фарингит), гиперемия дыхательных путей и стерторозное дыхание. В Таблице 6 суммированы нежелательные явления, которые наблюдались у более чем одного пациента с CF, принимающего левофлоксацин. Соответственно, эти результаты продемонстрировали безопасность и переносимость левофлоксацина в многократных дозах в течение 14 суток.
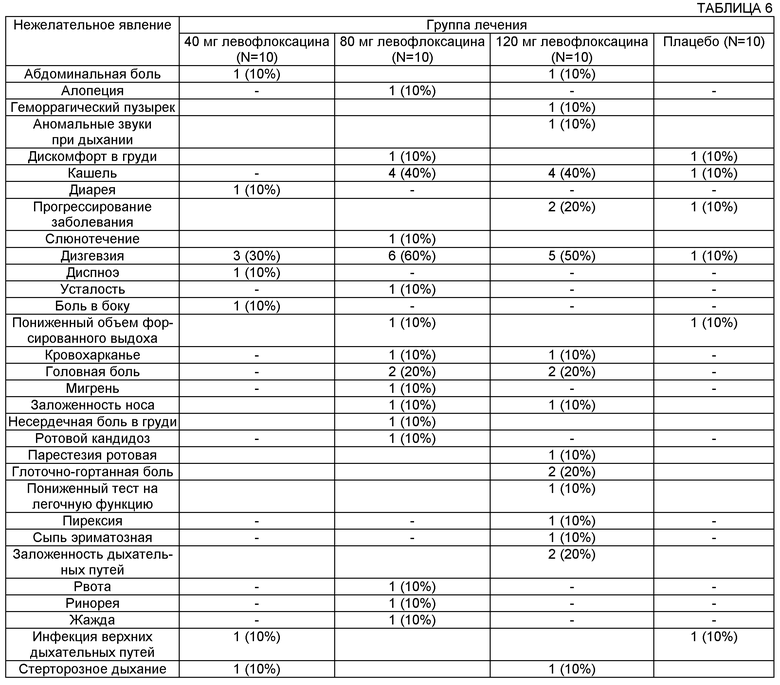
Пример 2 - Фаза 2 клинических исследований с левофлоксацином Фазу 2 многоцентрового, рандомизированного, двойного слепого, плацебо-контролируемого исследования проводили с целью оценки безопасности, переносимости и эффективности трех режимов дозировки левофлоксацина, приготовленного с MgCl2, который вводили в течение 28 суток стабильным CF-пациентам. Оценивали следующие режимы дозировки (в виде небулайзерных нагрузочных доз): 120 мг QD (один раз в сутки); 240 мг QD (один раз в сутки); и 240 мг BID (два раза в сутки). На основе исследований по определению характеристик аэрозоля препарата 100 мг/мл эти нагрузочные дозы 120 и 240 мг соответствуют оцениваемым вдыхаемым доставляемым дозам (RDD), доставляемым с использованием небулайзера PARI eFlow, примерно 65 и 130 мг соответственно. Cmax и AUC левофлоксацина в плазме со всеми режимами дозировки, выбранными для этого исследования, должны обеспечивать концентрации в легочных тканях, превышающие те, которые ассоциируются с бактериальной активностью против CF-патогенов (данные не показаны).
Композиция раствора левофлоксацина и плацебо представлены в Таблице 7. Исследуемое лекарственное средство вводили в виде аэрозоля, используя устройство PARI eFlow® с сеткой-мембраной для доставки частиц меньшего размера, составляющего приблизительно 3,5 мк-4,0 мк.
Критерии включения пациента в исследование включали: (1) возраст по меньшей мере 16 лет; (2) клинически диагностированный CF; (3) способный индуцировать FEV1≥25%, но ≤85% прогнозированное значение при скрининге;
(4) получил по меньшей мере 3 курса ингалируемых противомикробных средств на протяжении предыдущих 12 месяцев и получил по меньшей мере 1 курс ингалируемого тобрамицина/(TOBI®)/колистина за 2 месяца до Визита 1 (День 1), но никто за 28 суток до Визита 1 (День 1); (5) имел образец мокроты при скрининге, положительный в отношении Р. aeruginosa, и историю по меньшей мере 1 положительной культуры мокроты, положительной в отношении Р. aeruginosa в пределах последних 18 месяцев; и (6) клинически стабильный без значительных изменений состояния здоровья в пределах последних 30 суток.
Критерии невключения пациента в исследование включали: (1) применение средства, проходящего клинические исследования, в пределах 30 суток до Визита 1 (День 1); (2) применение любых распыляемых или системных антибиотиков, активных против Р. aeruginosa, в пределах 28 суток до Визита 1 (День 1), иных чем поддерживающий пероральный азитромицин, прием которого необходимо было начать по меньшей мере за 30 суток до Визита 1 (День 1); (3) гиперчувствительность к фторхинолонам или эксципиентам левофлоксацина, приготовленного с MgCl2; (4) непереносимость бронхорасширяющих средств или нежелание применять бронхорасширяющее средство во время исследования; (5) применение пероральных кортикостероидов в дозах, превышающих эквивалент 10 мг преднизона/сутки или 20 мг преднизона через день; (6) изменения метода или графика физиотерапии в пределах 14 суток до Визита 1 (День 1); (7) изменения медицинского режима для лечения CF (например, введение, повышение дозы или отмена терапевтических средств, таких как дорназа альфа, нестероидные противовоспалительные средства, азитромицин, гипертонический физиологический раствор или ингалируемые кортикостероиды) в пределах 30 суток до Визита 1 (День 1); (8) история трансплантации легкого; (9) свидетельство острой инфекции верхних дыхательных путей в пределах 10 суток или инфекции нижних дыхательных путей в пределах 30 суток до Визита 1 (День 1); (10) беременность, кормление грудью или нежелание принимать противозачаточные средства или абстиненция во время участия в исследовании (только женщины); (11) история припадков или низкого порога припадка (например эпилепсии); (12) почечная дисфункция (рассчитанный клиренс креатинина [CrCl]<50 мл/мин) при скрининге; (13) уровни аспартатаминотрансферазы (AST), аланинаминотрансферазы (ALT) или общего билирубина в 3 раза выше верхнего предела нормального (ULN) при скрининге или доказательство тяжелого заболевания печени (например цирроза, воротной гипертензии); (14) история инфекции/серопозитивности вируса иммунодефицита человека (HIV), гепатита В или гепатита С; (15) история кровохарканья г 30 мл в течение любого 24-часового периода времени на протяжении 30 суток до Визита 1; (16) насыщение кислородом<90% на воздухе в помещении при скрининге или Визите 1 (День 1); и (17) относительное уменьшение FEV1(л)>15% от скрининга до Визита 1 (День 1).
Пациентов оценивали в Дни 1, 7, 14 и 28 и затем вплоть до 28 суток после завершения приема исследуемого лекарственного средства, а именно в Дни 42 и 56. Композиция исследуемого лекарственного средства, т.е. левофлоксацина, показана в Таблице 7. Окончание исследования определяли как последний визит последнего пациента. Популяции, участвующие в исследовании, включали: (1) популяция, сформированная по принципу безопасности/модифицированного назначенного лечения (modified intent-to-treat, MITT), в которую входят все пациенты, включенные в исследование, которые принимают по меньшей мере одну дозу исследуемого лекарственного средства; (2) популяция, сформированная для оценки эффективности (ЕЕ), в которую входят все пациенты, включенные в исследование, без больших нарушений протокола, которые принимают по меньшей мере 80% доз исследуемого лекарственного средства на протяжении 28 суток терапии исследуемым лекарственным средством; и (3) фармакокинетическая (РК) популяция, в которую входят все пациенты, которые получают по меньшей мере одну дозу исследуемого лекарственного средства и имеют по меньшей мере один собранный образец крови для РК.
Приблизительно 32 пациента на группу лечения обеспечивали 80%-ную возможность детектировать различие между группами лечения с использованием 2-стороннего ковариационного анализа (ANCOVA), с 5% альфа, допуская стандартное отклонение (SD) 1,5 и среднее изменение log CFU в Р. aeruginosa снижение 0,75, снижение 0,75, нет изменения и увеличение 0,25 для групп лечения левофлоксацином 240 мг BID, левофлоксацином 240 мг QD, левофлоксацином 120 мг QD и плацебо соответственно. При вычислении объема выборки учитывалось 10% случаев выхода из исследования, поэтому пациентов, которые прерывали исследование, не заменяли.
Эффективность оценивали по результатам микробиологического анализа образцов мокроты, по времени до необходимости принимать антипсевдомонадные противомикробные агенты, по результатам опроса согласно Cystic Fibrosis Questionaire-Revised (CFQ-R, вопросник для пациентов с CF, пересмотренный вариант) и по результатам тестов на легочную функцию. В дополнение к этому анализировали сравнение основных показателей эффективности Н0 (отсутствие разницы): среднее уменьшение значений log CFU Р. aeruginosa от начала введения левофлоксацина или плацебо (День 1) до четырех недель спустя является равным для всех четырех групп, в отличие от H1: среднее уменьшение значений log CFU отличается у по меньшей мере одной из четырех групп при использовании модели повторных измерений смешанных эффектов с корректировкой по исходной минимальной ингибирующей концентрации (MIC) левофлоксацина в качестве непрерывной переменной (log по основанию 2 трансформированный), исходной легочной функции и географической области (США в отличие не-США). Попарные сравнения между всеми группами лечения проводили в качестве вторичных анализов.
Конечные показатели эффективности, включая клинические конечные показатели, тесты на легочную функцию и дополнительные микробиологические параметры оценивали как изменение с Дня 1 до последующих визитов, когда собирали данные по конечным показателям. Время до внутривенных/пероральных/ингалируемых антипсевдомонадных противомикробных средств оценивали с Дня 1 до конечного визита, используя анализ выживания. Основной популяцией для анализа эффективности была популяция ЕЕ, но конечные показатели эффективности также анализировали с использованием популяции MITT.
Пациенты, включенные в исследование, имели в среднем 5 курсов антибиотиков в форме аэрозоля в течение предыдущих 12 месяцев. Исходное значение FEV1 (в спрогнозированных процентах) составляло 53% по всему исследованию и не отличалось между группами. Медианное исходное значение MIC всех изолятов Pseudomonas aeruginosa, выделенных из всех пациентов (n=592), по отношению к левофлоксацину составляло 4 мг/л, и MIC90 составлял 16, также аналогичные во всех группах. Эти MIC являются показателями исходной нечувствительности/устойчивости к левофлоксацину, как определено референсными способами CLSI (Институт клинических и лабораторных стандартов) и согласно US FDA (Управление по контролю за качеством пищевых продуктов, медикаментов и косметических средств США).
Сопутствующие лекарственные средства, использованные пациентами во время исследования, включали дорназу альфа, азитромицин, сальбутамол, панкрелипазу, гипертонический раствор хлорида натрия, серетид и ADEK, и они указаны для популяции ЕЕ в Таблице 8. В Таблице 9 указана диспозиция пациентов в исследовании. Представленные результаты исследования продемонстрировали статистически значимые преимущества аэрозольного левофлоксацина по сравнению с плацебо при нескольких клинических и микробиологических измерениях, несмотря на применение сопутствующих лекарственных средств, устойчивость к левофлоксацину и предшествующее применение других антибиотиков в форме аэрозоля, включая тобрамицин и кол истин.
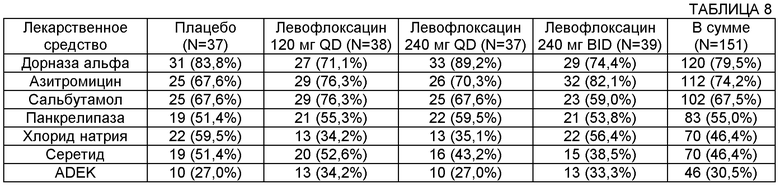
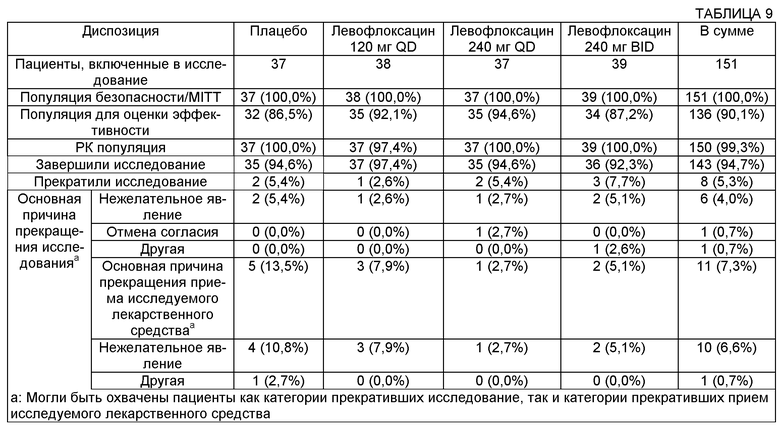
Микробиологические анализы
Изменения плотности Р. aeruginosa (log10 КОЕ/г мокроты) для образцов мокроты, взятых у популяций ЕЕ и MITT, суммированы в Таблицах 10 и 11 соответственно (SD=стандартное отклонение). Изменения MIC для плотности Р. aeruginosa (log10 КОЕ/г мокроты) в отношении левофлоксацина (все организмы) для популяций ЕЕ и MITT показаны в Таблицах 12 и 13 соответственно. Кроме того, изменения наивысших значений MIC для изолятов Р. aeruginosa в отношении левофлоксацина определяли для популяций ЕЕ и MITT, и они суммированы в Таблицах 14 и 15 соответственно. В Таблицах 16 и 17 суммирован процент популяций ЕЕ и MITT соответственно, с категориальными изменениями наивысших значений MIC для изолятов Р. aeruginosa в отношении левофлоксацина. В Таблицах 18 и 19 суммированы изменения плотности неферментирующих грамотрицательных бактерий (NFGNB), за исключением Р. aeruginosa, только у пациентов с положительными количествами NFGNB на исходном уровне для популяций ЕЕ и MITT соответственно. В Таблицах 20 и 21 суммированы изменения для презумптивной плотности S. aureus (log10 КОЕ/г мокроты) только для пациентов с положительными количествами S. aureus на исходном уровне для популяций ЕЕ и MITT соответственно.
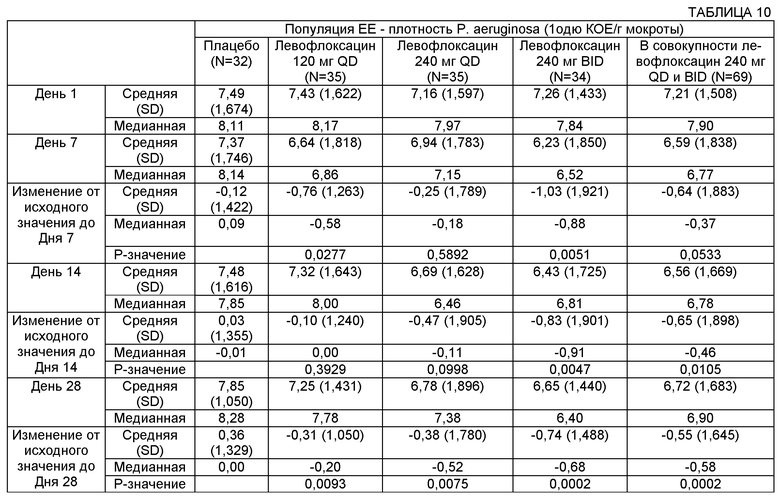
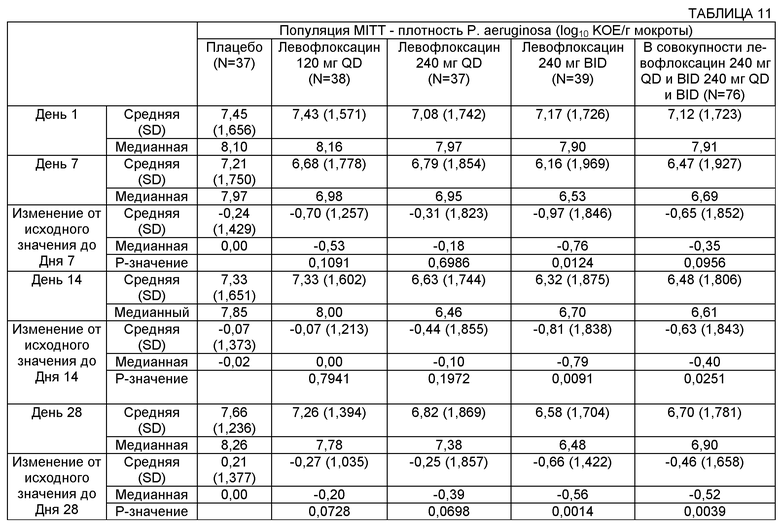
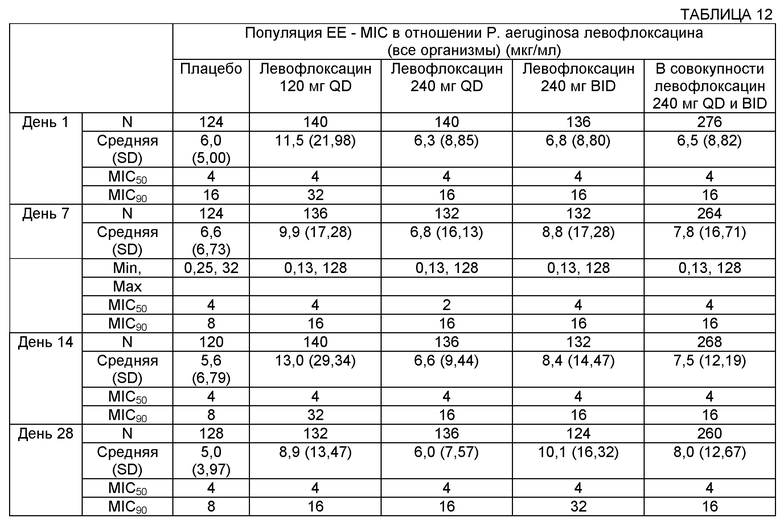

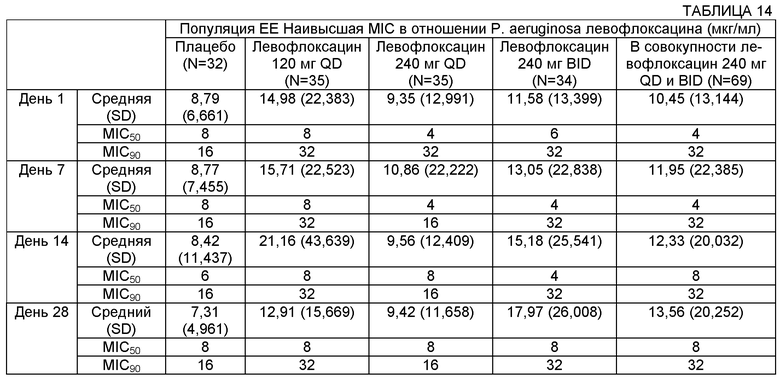

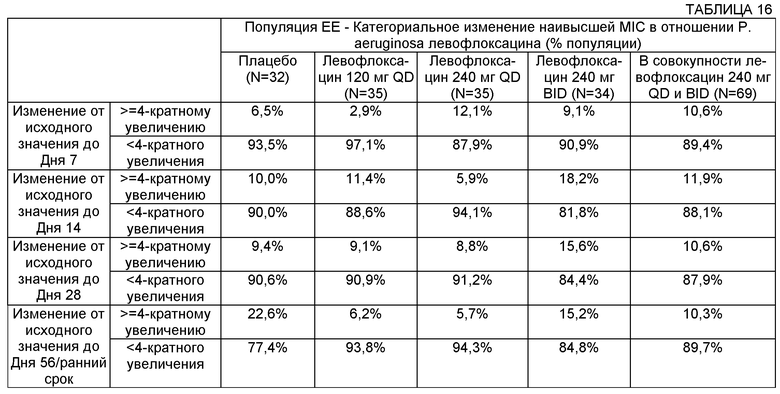
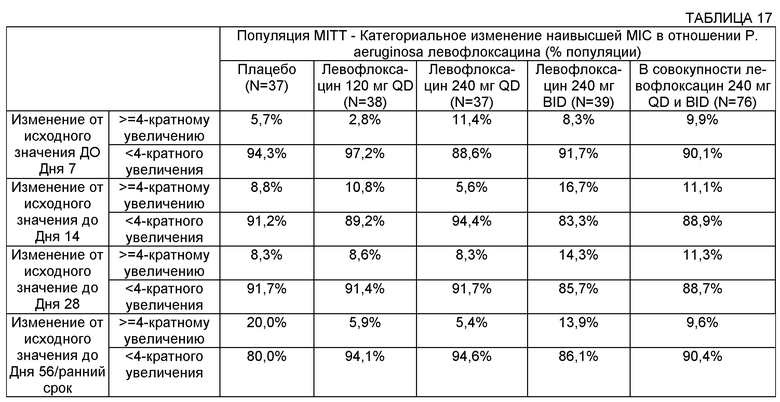
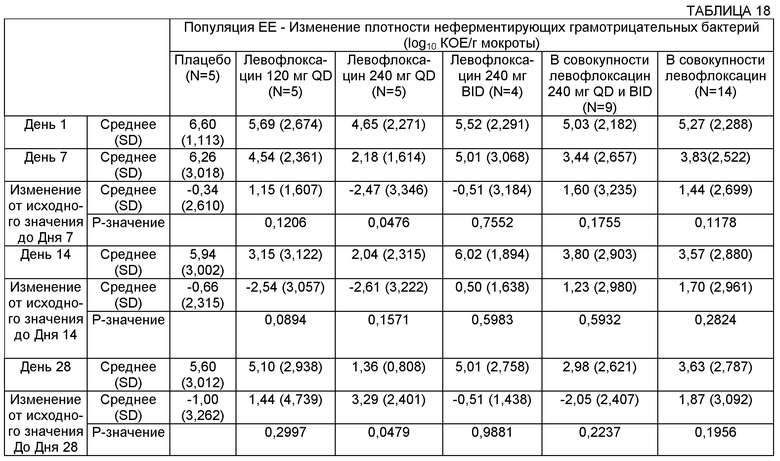
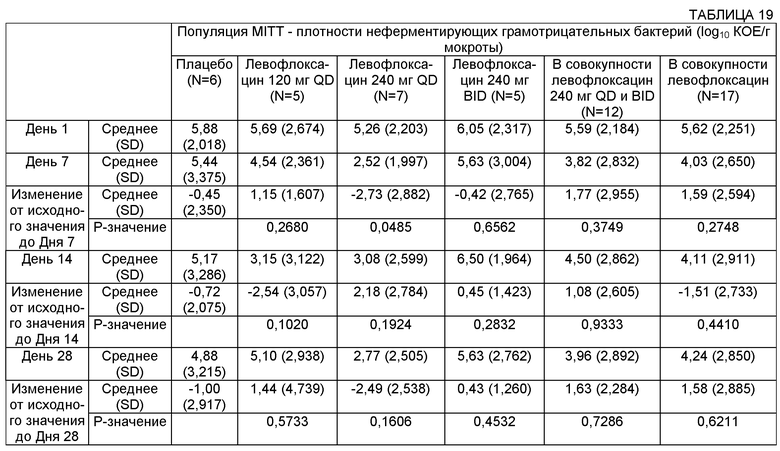
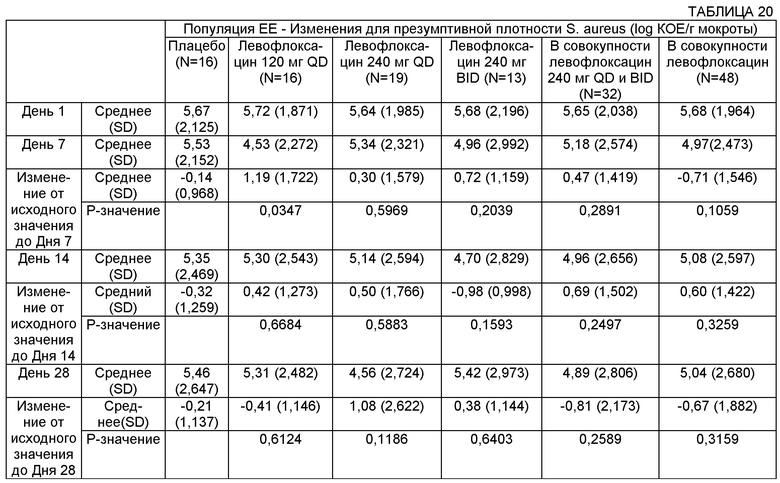
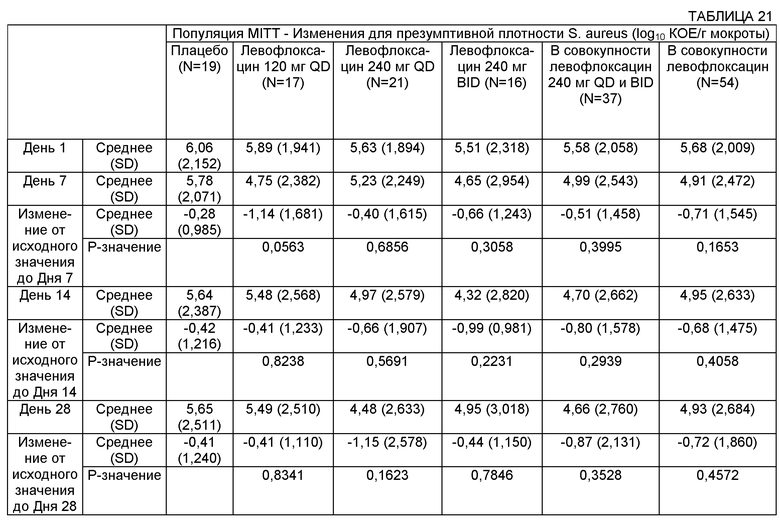
Плотности Р. aeruginosa снижались от исходных значений в День 1 по ходу исследования во всех трех группах лечения левофлоксацином в обеих популяциях ЕЕ и MITT. На Фиг.3 и 4 представлены средние изменения плотности Р. aeruginosa с течением времени для каждой группы лечения.
В популяции ЕЕ имело место снижение плотности Р. aeruginosa у пациентов, которым вводили 240 мг левофлоксацина BID, от медианного значения 7,84 log10 КОЕ/г мокроты в День 1 до медианного значения 6,40 log10 КОЕ/г мокроты в День 28, что означает снижение плотности Р. aeruginosa в мокроте приблизительно 96%. У пациентов, которым вводили 240 мг левофлоксацина QD, имело место снижение плотности Р. aeruginosa от медианного значения 7,97 log10 КОЕ/г мокроты в День 1 до медианного значения 7,38 log10 КОЕ/г мокроты в День 28, что означает снижение плотности Р. aeruginosa в мокроте приблизительно 74%. У пациентов, которым вводили 120 мг левофлоксацина QD, имело место снижение плотности Р. aeruginosa от медианного значения 8,17 log10 КОЕ/г мокроты в День 1 до медианного значения 7,78 log10 КОЕ/г мокроты в День 28, что означает снижение плотности Р. aeruginosa в мокроте приблизительно 59%. Самые большие различия в отношении плотности Р. aeruginosa в мокроте между пациентами, которым вводили плацебо, и пациентами, которым вводили левофлоксацин, составляли 1,62 log10 КОЕ/г мокроты в День 7, 1,39 log10 КОЕ/г мокроты в День 14 и 1,88 log10 КОЕ/г мокроты в День 28.
В популяции MITT имело место снижение плотности Р. aeruginosa density у пациентов, которым вводили 240 мг левофлоксацина BID, от медианного значения 7,90 log10 КОЕ/г мокроты в День 1 до медианного значения 6,48 log10 КОЕ/г мокроты в День 28, что означает снижение плотности Р. aeruginosa в мокроте приблизительно 96%. У пациентов, которым вводили 240 мг левофлоксацина QD, имело место снижение плотности Р. aeruginosa от медианного значения 7,97 log10 КОЕ/г мокроты в День 1 до медианного значения 7,38 log10 КОЕ/г мокроты в День 28, что означает снижение плотности Р. aeruginosa в мокроте приблизительно 74%. У пациентов, которым вводили 120 мг левофлоксацина QD, имело место снижение плотности Р. aeruginosa от медианного значения 8,16 log10 КОЕ/г мокроты в День 1 до медианного значения 7,78 log10 КОЕ/г мокроты в День 28, что означает снижение плотности Р. aeruginosa в мокроте приблизительно 58%. Самые большие различия в отношении плотности Р. aeruginosa в мокроте между пациентами, которым вводили плацебо, и пациентами, которым вводили левофлоксацин, составляли 1,44 log10 КОЕ/г мокроты в День 7, 1,39 log10 КОЕ/г мокроты в День 14 и 1,78 log10 КОЕ/г мокроты в День 28.
Для популяций ЕЕ и MITT исходные значения MIC50 для изолятов Р. aeruginosa из пациентов, которым вводили плацебо, 120 мг QD, 240 мг QD и 240 мг BID, составляли 8 мкг/мл, 8,4 мкг/мл и 6 мкг/мл соответственно. В День 28 значения MIC50 для изолятов Р. aeruginosa из пациентов, которым вводили плацебо, 120 мг QD, 240 мг QD и 240 мг BID, составляли 8 мкг/мл, 8 мкг/мл, 8 мкг/мл и 8 мкг/мл соответственно. Исходные значения MIC90 для изолятов Р. aeruginosa из пациентов, которым вводили плацебо, 120 мг QD, 240 мг QD и 240 мг BID, составляли 16 мкг/мл, 32 мкг/мл, 32 мкг/мл и 32 мкг/мл соответственно. В День 28 значения MIC90 для изолятов Р. aeruginosa из пациентов, которым вводили плацебо, 120 мг QD, 240 мг QD и 240 мг BID, составляли 16 мкг/мл, 32 мкг/мл, 16 мкг/мл и 32 мкг/мл соответственно.
Сходство соответствующих значений MIC50 и MIC90 между Днем 1 и Днем 28 для популяций ЕЕ и MITT указывает на то, что у культур Р. aeruginosa от пациентов не развивалось никакой значительной устойчивости к левофлоксацину.
Клинические оценки - опрос по CFQ-R
Пациенты закончили опрос по частям вопросника CFQ-R, которые включали: респираторную, внешний вид тела, пищеварение, прием пищи, эмоции, ощущение здоровья, физическое состояние, роль/школа, социальную, тяжесть лечения, энергичность и массу тела. В Таблицах 22 и 23 суммированы результаты для респираторной части CFQ-R для популяций ЕЕ и MITT соответственно. В Таблице 24 суммированы изменения оценки для различных частей CFQ-R от исходного значения до Визита 4 в популяции MITT.
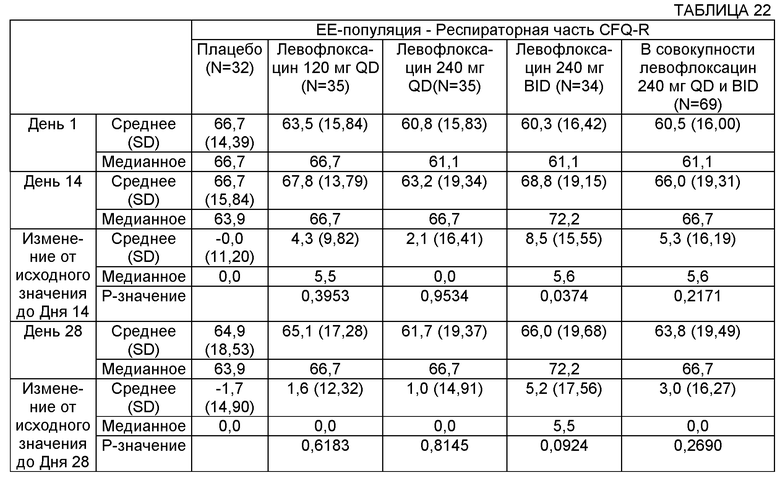
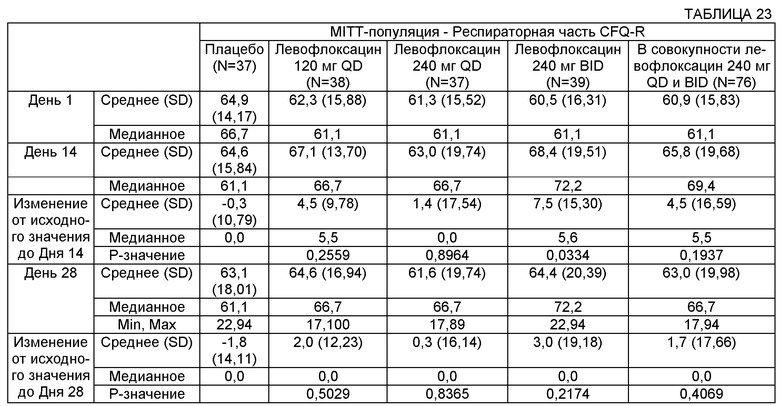
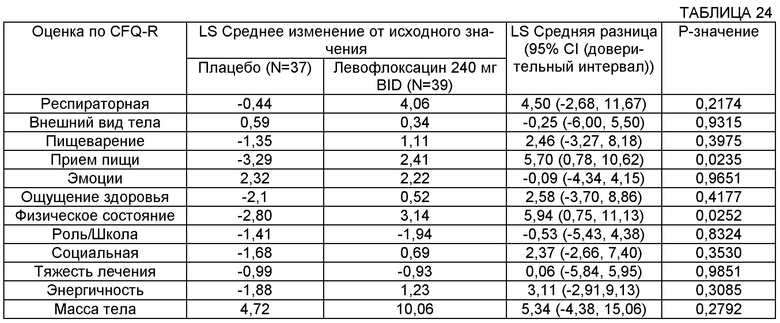
Для популяции ЕЕ средние изменения от исходного значения до Дня 28 для респираторных факторов, определенных по CFQ-R, для пациента, которому вводили плацебо, 120 мг QD, 240 мг QD и 240 мг BID, в группах лечения составляли 1,6, 1,0, 5,2 и 3,0 единиц соответственно. Для популяции MITT средние изменения от исходного значения до Дня 28 для респираторных факторов, измеренных по CFQ-R, для пациентов, которым вводили плацебо, 120 мг QD, 240 мг QD и 240 мг BID, в группах лечения составляли 2,0, 0,3, 3,0 и 1,7 единиц соответственно. Группа пациентов, получавших 240 мг BID в популяции ЕЕ, продемонстрировала статистически значимое улучшение респираторной оценки в День 14.
Оценка приема пищи по CFQ-R также показала улучшение с разницей в группе пациентов, получавших 240 мг BID в популяции MITT, показывающей статистически значимое улучшение в День 28.
Время до потребности у пациентов в антипсевдомонадных противомикробных агентах
Время до введения внутривенных/пероральных/ингалируемых антипсевдомонадных противомикробных средств с Дня 1 до конечного визита измеряли для пациентов с по меньшей мере одним из следующих: снижение переносимости физических нагрузок, увеличение кашля, увеличение мокроты/гиперемия грудной клетки и снижение аппетита. Долю пациентов, которым с течением времени требуются антипсевдомонадные противомикробные агенты (ингалируемые или систематические), анализировали с использованием модели пропорциональных рисков Кокса. В Таблице 25 суммированы результаты по времени до потребности в антипсевдомонадных противомикробных средствах для популяций ЕЕ и MITT.
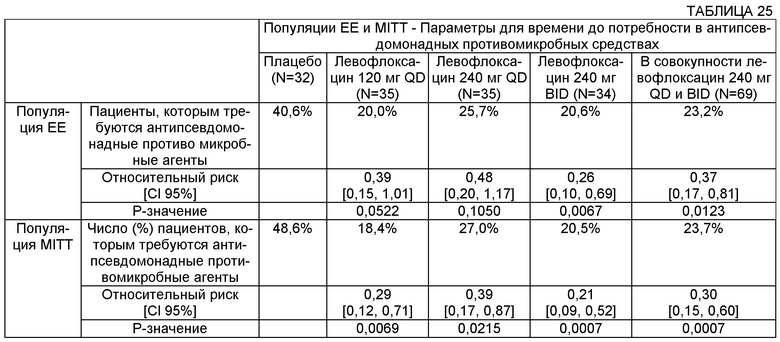
Измеренная потребность в дополнительных антипсевдомонадных противомикробных агентах снижалась во всех группах лечения левофлоксацином. Кроме того, значительные относительные риски наблюдались в группах лечения левофлоксацином. Относительные риски относятся к относительному риску того, что явление может возникнуть. Относительные риски составляли 0,29 для группы пациентов, получавших 120 мг левофлоксацина QD, 0,39 для группы пациентов, получавших 240 мг левофлоксацина QD и 0,21 для группы пациентов, получавших 240 мг левофлоксацина BID в популяции MITT по сравнению с группой плацебо, и были статистически значимыми по сравнению с плацебо. На Фиг.5 и 6 представлены графики функции распределения выживания во времени для каждой группы лечения, и они демонстрируют, что функция распределения выживания для пациентов, которых лечили плацебо, начинает падать при более коротком времени, чем для пациентов, которых лечили левофлоксацином. В сумме, по меньшей мере доза 240 мг BID продемонстрировала значительную эффективность по сравнению с плацебо в День 28 во времени, которое необходимо для антипсевдомонадных противомикробных средств.
Оценка легочной функции
Определяли изменения FEV1 (объем форсированного выдоха за 1 секунду), FVC (форсированная жизненная емкость легких) и FEF 25-75 (средняя объемная скорость форсированного выдоха в интервале 25-75% жизненной емкости легких) с Дня 1 до всех последующих визитов пациентов. В Таблицах 26 и 27 суммированы результаты по измерениям FEV1 в популяциях ЕЕ и MITT соответственно. На Фиг.7 и 8 представлены графики процентного изменения FEV1 (л) и процентного изменения FEV1 (л) по сравнению с плацебо соответственно в День 28 для популяции ЕЕТ, которую лечили плацебо, 120 мг QD, 240 мг QD или 240 мг BID. На Фиг.9 представлен график категориального изменения FEV1 в процентах от предсказанного значения в День 28 для популяции ЕЕТ, которую лечили 120 мг QD, 240 мг QD или 240 мг BID. В Таблицах 28 и 29 суммированы результаты по измерениям предсказанных значений FEV1 в популяциях ЕЕ и MITT соответственно. В Таблицах 30 и 31 суммированы результаты измерений FEF 25-75 в популяциях ЕЕ и MITT соответственно.
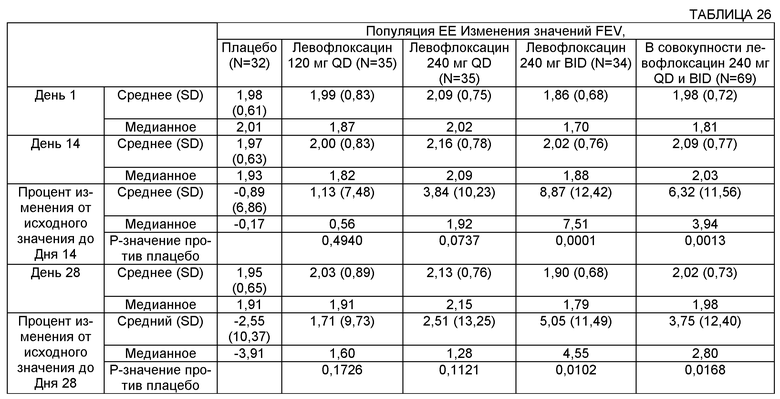
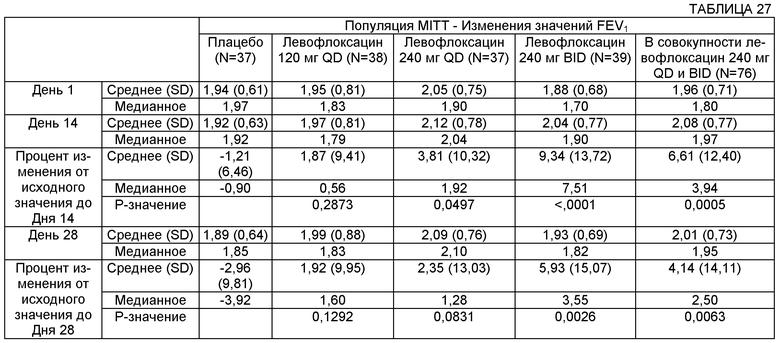
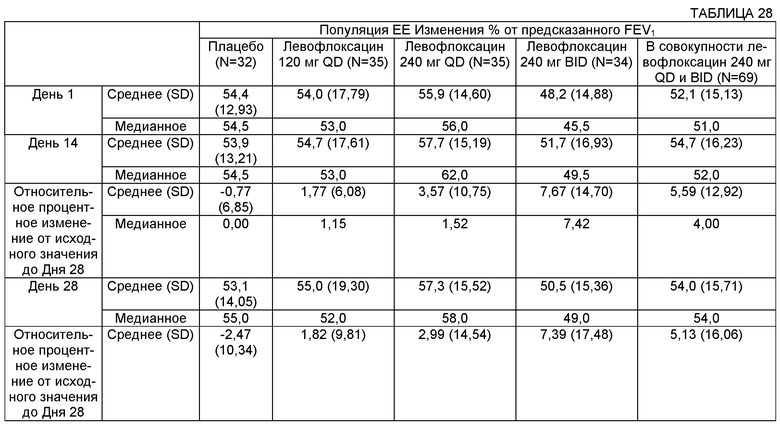
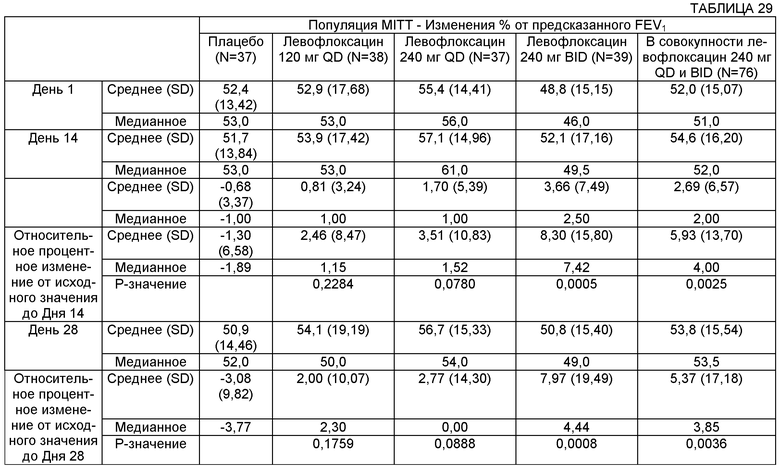

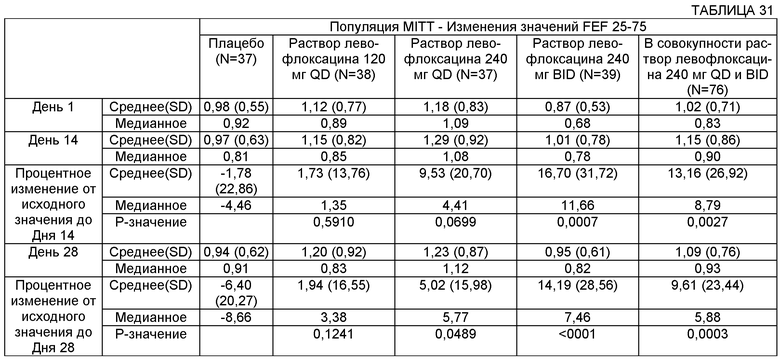
В популяции ЕЕ значения FEV1 для пациентов, которым вводили 240 мг левофлоксацина BID, увеличивались от медианного значения 1,70 л в День 1 (исходное значение) до 1,79 л в День 28, что означает увеличение FEV1 приблизительно на 5%. У пациентов, которым вводили 240 мг левофлоксацина QD, значения FEV1 увеличились от медианного значения 2,02 л в День 1 до медианного значения 2,15 л в День 28, что означает увеличение FEV1 приблизительно на 6%. У пациентов, которым вводили 120 мг левофлоксацина QD, значения FEV1 увеличились от медианного значения 1,87 л в День 1 до медианного значения 1,91 л в День 28, что означает увеличение FEV1 приблизительно на 2%. Самые большие различия для FEV1 между пациентами, которым вводили плацебо, и пациентами, которым вводили левофлоксацин, составляли 0,16 л в День 14 и 0,24 л в День 28.
В популяции MITT значения FEV1 для пациентов, которым вводили 240 мг левофлоксацина BID увеличились от медианного значения 1,70 л в День 1 (исходное значение) до 1,82 л в День 28, что означает увеличение FEV1 приблизительно на 7%. У пациентов, которым вводили 240 мг левофлоксацина QD, значения FEV1 увеличились от медианного значения 1,90 л в День 1 до медианного значения 2,10 л в День 28, что означает увеличение FEV1 приблизительно на 10%. Самые большие различия для FEV1 между пациентами, которым вводили плацебо, и пациентами, которым вводили левофлоксацин, составляли 0,12 л в День 14 и 0,25 л в День 28.
Значения FEF 25-75 относятся к средней скорости потока воздуха, выходящего из легких во время средней порции выдоха. При заболеваниях малых дыхательных путей это значение может быть пониженным. В популяции ЕЕ значения FEF 25-75 для пациентов, которым вводили 240 мг левофлоксацина BID, увеличились от медианного значения 0,68 в День 1 (исходное значение) до 0,78 в День 28, что означает увеличение FEF 25-75 приблизительно на 15%. У пациентов, которым вводили 240 мг левофлоксацина QD, значения FEF 25-75 увеличились от медианного значения 1,10 в День 1 до медианного значения 1,15 в День 28, что означает увеличение FEF 25-75 приблизительно на 4%. У пациентов, которым вводили 120 мг левофлоксацина QD, значения FEF 25-75 увеличились от медианного значения 0,98 в День 1 до медианного значения 1,03 в День 28, что означает увеличение FEF 25-75 приблизительно на 5%. Самые большие различия для FEF 25-75 между пациентами, которым вводили плацебо, и пациентами, которым вводили левофлоксацин, составляли 0,25 л в День 14 и 0,21 л в День 28.
В популяции MITT значения FEF 25-75 для пациентов, которым вводили 240 мг левофлоксацина BID, увеличились от медианного значения 0,68 в День 1 (исходное значение) до 0,82 в День 28, что означает увеличение FEF 25-75 приблизительно на 20%. У пациентов, которым вводили 240 мг левофлоксацина QD, значения FEF 25-75 увеличились от медианного значения 1,09 в День 1 до медианного значения 1,12 в День 28, что означает увеличение FEF 25-75 приблизительно на 3%. Самые большие различия для FEF 25-75 между пациентами, которым вводили плацебо, и пациентами, которым вводили левофлоксацин, составляли 0,27 л в День 14 и 0,21 л в День 28.
Оценка безопасности
Оценивали нежелательные явления и непереносимость лекарственного средства со Дня 1 и до конца исследования. Не сообщалось ни о каких значительных нежелательных явлениях.
Ранее были сообщения об индуцированных фторхинолонами артралгии и миалгии при применении некоторых фторхинолонов, например при лечении синусита (O-Lee Т., et al., "Fluoroquinolone-induced arthralgia and myalgia in the treatment of sinusitis" Am. J. Rhinol. (2005) 19:395-9; полное содержание этой публикации включено в данное описание посредством ссылки). В этом исследовании об артралгии сообщили 5,4% пациентов, которым вводили плацебо. Пациенты, которым вводили препараты левофлоксацина, об артралгии не сообщали.
Пример 3 - Фаза I клинических исследований с участием педиатрических пациентов с CF
Фазу I многоцентрового, открытого исследования проводили с целью оценки безопасности, переносимости и фармакокинетики скорректированных по массе доз левофлоксацина, приготовленного в виде композиции с MgCl2, которые вводили один раз в сутки в течение 14 суток стабильным педиатрическим пациентам с CF. Пациенты были разделены на 2 группы по их возрасту: возраст 6-11 лет и возраст 12-16 лет. Вводимую один раз в сутки дозу левофлоксацина, приготовленного в виде композиции с MgCl2, распределяли следующим образом; пациенты с массой тела 14-21 кг получали дозу 120 мг, пациенты с массой тела 22-30 кг получали дозу 180 мг, и пациенты с массой тела более 30 кг получали дозу 240 мг. В сумме в исследование было включено 27 пациентов, и все пациенты завершили исследование. Было 14 пациентов в возрастной группе 6-11 лет и 13 пациентов в возрастной группе 12-16. Семь пациентов (все в возрастной группе 6-11 лет) получали 180 мг левофлоксацина QD, приготовленного в виде композиции с MgCl2, а остальные 20 пациентов получали 240 мг левофлоксацина QD, приготовленного в виде композиции с MgCl2. На Фиг.10 представлен график зависимости приведенной к дозе сывороточной AUC у педиатрических пациентов с CF от массы тела пациентов. На Фиг.11А-9В представлены графики зависимости приведенной к дозе сывороточной AUC у педиатрических пациентов с CF от возраста пациентов и от BSA соответственно. На Фиг.11С-9Е представлены графики зависимости приведенной к дозе сывороточной Cmax У педиатрических пациентов с CF от массы тела пациентов, от возраста пациентов и от BSA соответственно.
Сывороточные экспозиции левофлоксацина с дозой либо 180, либо 240 мг левофлоксацина, приготовленного в виде композиции с MgCl2, по всей вероятности, находятся в диапазонах, наблюдаемых у взрослых пациентов с CF, исследованных в соответствующих клинических испытаниях (данные не показаны).
Пример 4 - Фаза III клинического исследования
Проводили Фазу III многоцентрового, многонационального, рандомизированного, двойного слепого, плацебо-контролируемого исследования с целью оценки эффективности и безопасности левофлоксацина, приготовленного в виде композиции с MgCl2, у стабильных пациентов с CF. После 14-суточного периода скрининга пациентов рандомизировали при Визите 1/День 1 в соотношении 2:1 для приема левофлоксацина, приготовленного в виде композиции с MgCl2, или плацебо. Рандомизацию формировали по географическому региону (США против не-США), возрасту (12-18 лет против возраста >18 лет) и по спрогнозированному проценту FEV1 (<55% против >55%). Пациенты получали в течение 28 суток либо левофлоксацин, приготовленный в виде композиции с MgCl2, либо плацебо, и наблюдение осуществляли в течение последующих 28 суток. Пациенты должны были оставаться без антипсевдомонадных противомикробных средств, иных чем исследуемое лекарственное средство (левофлоксацин, приготовленный в виде композиции с MgCl2, или плацебо) и поддерживать прием перорального азитромицина (если его принимают) на всем протяжении исследования, если только они не соответствуют определенному протоколом определению обострения, или если исследователями не определено, что имеется необходимость по причинам безопасности. Окончание исследования определяют как последний визит последнего пациента.
Левофлоксацин, приготовленный в виде композиции с MgCl2 (раствор левофлоксацина для ингаляций, Aeroquin™), готовый для введения, будет поставляться в ампулах однократного использования. Каждая ампула содержит 240 мг левофлоксацина, приготовленного в виде композиции с MgCl2, в 2,4 мл (100 мг/мл). Дозу 240 мг <1 ампула) вводят с использованием исследовательского небулайзера PARI eFlow® два раза в сутки (BID) приблизительно через 8-12 часов. Плацебо представляет собой рибовирина 5'-фосфат (солюбилизированная форма витамина В2) в 0,9%-ном физиологическом растворе, готовый для введения, поставляемый в ампулах однократного использования. Каждая ампула содержит 9,6 мкг рибовирина 5'-фосфата в объеме 2,4 мл. Исследовательский небулайзер PARI eFlow® оптимизирован и модифицирован для использования только с левофлоксацином, приготовленным в виде композиции с MgCl2. И левофлоксацин, приготовленный в виде композиции с MgCl2, и плацебо-контроль вводят с использованием этой системы небулайзера. Исследуемые популяции включают: (1) популяция, сформированная по принципу безопасности/модифицированному принципу назначенного лечения (modified intent-to-treat, MITT) (все пациенты, включенные в исследование, получают по меньшей мере одну дозу исследуемого лекарственного средства (левофлоксацин, приготовленный в виде композиции с MgCl2, или плацебо)); (2) популяция, сформированная для оценки эффективности (все пациенты, включенные в исследование, не имеющие нарушений основного протокола, которые получают по меньшей мере 80% доз исследуемого лекарственного средства (левофлоксацин, приготовленный в виде композиции с MgCl2/плацебо); и (3) фармакокинетическая популяция (все пациенты, которые получают по меньшей мере одну дозу исследуемого лекарственного средства (левофлоксацин, приготовленный в виде композиции с MgCl2/плацебо) и имеют по меньшей мере один собранный фармакокинетический (РК) образец крови или мокроты.
Критерии включения пациентов в исследование включали: возраст по меньшей мере 12 лет; масса тела по меньшей мере 30 кг или 66 фунтов; и наличие задокументированного диагноза CF, подтвержденного одним или более клиническими признаками, согласующимися с фенотипом CF. Критерии невключения пациентов в исследование включали: применение агента, проходящего клинические испытания, в период времени в пределах 28 дней до Визита 1; применение любых распыляемых или системных противомикробных активных агентов против Р. aeruginosa в пределах 28 дней до Визита 1, иных чем поддерживающий пероральный азитромицин, которое могло начаться по меньшей мере за 28 дней до Визита 1; и применение пероральных кортикостероидов в дозах, превышающих эквивалент 10 мг преднизона/сутки или 20 мг преднизона через день, при скрининге или Визите 1.
Первичная оценка эффективности
Основной критерий оценки включает время (в сутках) до обострения от исходной точки (Визит 1/День 1) до конечного визита. Чтобы соответствовать критерию оценки пациент должен одновременно иметь 4 из 12 симптомов/признаков, которые укладываются в определение обострения Фукса (Fuchs HJ, et al. Effect of aerosolized recombinant human DNase on exacerbations of respiratory symptoms and on pulmonary function in patients with cystic fibrosis. N. Engl. J. Med. 1994; 331:637-642; полное содержание этой публикации включено в данное описание посредством ссылки).
12 симптомов/признаков, определяемых критериями Фукса, включают: изменение мокроты; новое или увеличившееся кровохарканье; увеличившийся кашель; увеличившаяся диспноэ; недомогание, усталость или сонливость; температура выше 38°С; анорексия или потеря массы тела; боль в придаточных пазухах носа или болезненность придаточных пазух; изменение выделений из придаточных пазух носа; изменение результатов объективного обследования грудной клетки; снижение легочной функции на 10% или более от ранее зарегистрированного значения; и радиографические изменения, свидетельствующие о легочной инфекции.
Вышеуказанные симптомы, связанные с обострением, регистрируют по каждому пациенту, используя стандартизированный вопросник, Вопросник по респираторным и системным симптомам (Respiratory and Systemic Symptoms Questionnaire, RSSQ), при визитах пациентов. Изменения ощущений пациентов соотносят с тем, что пациент считает нормальным повседневным. Ожидается, что пациенты, которым вводили левофлоксацин в форме аэрозоля, приготовленный с MgCl2, будут иметь следующие признаки/симптомы, которые включены в критерии Фукса и которые регистрируют с использованием RSSQ:
1) Увеличение продуцирования мокроты: у пациентов нет изменений, имеются немного меньшие или намного меньшие количества мокроты при кашле.
2) Изменение внешнего вида мокроты: что касается густоты мокроты, пациенты имеют немного меньшую густоту или намного меньшую густоту мокроты; что касается цвета мокроты, у пациентов имеется улучшение цвета мокроты ("улучшение цвета" означает изменение цвета от коричневого к зеленому к желтому к прозрачному).
3) Увеличение заложенности в груди: у пациентов имеется небольшое снижение или большое снижение заложенности в груди.
4) Новое или увеличенное откашливание крови: пациенты имеют небольшое снижение или большое снижение количества откашливаемой крови.
5) Увеличение кашля: в отношении интенсивности кашля, пациенты имеют кашель немного легче или намного легче; в отношении частоты кашля, пациенты кашляют немного менее часто или намного менее часто.
6) Снижение переносимости физических нагрузок: пациенты осуществляют ежедневную деятельность, например подъем по лестнице, немного легче или намного легче.
7) Увеличение диспноэ с нагрузкой: пациенты дышат немного легче или намного легче при осуществлении ежедневной деятельности.
8) Недомогание, усталость или сонливость: пациенты имеют немного больше энергии или намного больше энергии после последнего визита.
9) Лихорадка: пациенты не имеют лихорадки после последнего визита.
10) Потеря массы тела: пациенты не имеют изменения массы тела или имеют небольшой прирост массы тела.
11) Боль в придаточных пазухах носа и болезненность придаточных пазух носа: у пациента нет боли или болезненности.
12) Изменение выделений из придаточных пазух носа: у пациента имеется улучшение выделений из придаточных пазух носа (снижение густоты и/или улучшение цвета).
13) Уклонение от школы или работы (вследствие болезни): у пациента отсутствует уклонение от плановой деятельности.
14) Снижение аппетита: пациент имеет небольшое увеличение аппетита.
Вторичная оценка эффективности
Вторичные критерии оценки включают клинические показатели, показатели легочной функции, микробиологические показатели и показатели по результатам опроса пациентов.
Клинические показатели
Клинические показатели включают время (в сутках) до введения системных (пероральных или в.в. (внутривенных)) и/или ингалируемых антипсевдомонадных противомикробных средств от исходного (Визит 1/День 1) до конечного визита. Чтобы соответствовать этому критерию оценки, пациенты должны иметь по меньшей мере один из четырех респираторных симптомов ухудшения (увеличение кашля, увеличение мокроты/заложенности в груди, снижение переносимости физических нагрузок, снижение аппетита) в момент введения антипсевдомонадного противомикробного средства. Клинические показатели также включают долю пациентов, которые пропустили по меньшей мере 1 день школы/работы из-за ухудшения респираторного статуса.
Представляется, что пациенты, которым вводили левофлоксацин в форме аэрозоля, приготовленный в виде композиции с MgCl2, имеют увеличенное время до введения системных (пероральных или в.в.) и/или ингалируемых антипсевдомонадных противомикробных средств от исходного (Визит 1/День 1) до конечного визита по сравнению с пациентами, которым вводили плацебо. Кроме того, доля пациентов, которым вводили левофлоксацин в форме аэрозоля, приготовленный в виде композиции с MgCl2, которые пропустили по меньшей мере 1 день школы/работы из-за ухудшения респираторного статуса, меньше доли пациентов, которым вводили плацебо, которые пропустили по меньшей мере 1 день школы/работы из-за ухудшения респираторного статуса.
Показатели легочной функции
Показатели легочной функции включают: процентное изменение FEV1 (л) от исходного значения до Дня 28; относительное изменение FEV1 (предсказанный процент) от исходного значения до Дня 28; процентное изменение FEF25-75 (л/с) от исходного значения до Дня 28; процентное изменение FVC (л) от исходного значения до Дня 28; и категориальная оценка процентного изменения FEV1 (л) и относительное изменение предсказанного процента FEV1 от исходного значения до Дня 28.
Представляется, что пациенты, которым вводили левофлоксацин в форме аэрозоля, приготовленный в виде композиции с MgCl2, имеют более благоприятные показатели легочной функции по сравнению с пациентами, которым вводили плацебо.
Микробиологические показатели
Микробиологические показатели включают: изменение плотности Р. aeruginosa (1одю колониеобразующих единиц [CFU] на грамм мокроты) от исходного значения до Дня 28; категориальная оценка изменения плотности Р. aeruginosa (log10 колониеобразующих единиц [CFU] на грамм мокроты) от исходного значения до Дня 28; и изменение плотности Stenotrophomonas sp., Achromobacter sp., Burkholderia sp.и S. aureus (log10 колониеобразующих единиц [CFU] на грамм мокроты) от исходного значения до Дня 28.
Ожидается, что пациенты, которым вводили левофлоксацин в форме аэрозоля, приготовленный в виде композиции с MgCl2, имеют более благоприятные микробиологические показатели, например снижение плотности Р. aeruginosa в мокроте, снижение плотности Stenotrophomonas sp., Achromobacter sp., Burkholden'a sp.и S. Aureus в мокроте, по сравнению с пациентами, которым вводили плацебо.
Показатели по результатам опроса пациентов
Показатели по результатам опроса пациентов включают: изменение в респираторной части CFQ-R от исходного значения до Дня 28; и категориальная оценка изменения в респираторной части CFQ-R от исходного значения до Дня 28.
Представляется, что пациенты, которым вводили левофлоксацин в форме аэрозоля, приготовленный в виде композиции с MgCl2, имеют более благоприятные показатели по результатам опроса, чем пациенты, которым вводили плацебо.
Пример 5 - Антибактериальная активность раствора левофлоксацина для ингаляций против Burkholderia cepacia in vivo
Burkholderia cepacia является оппортунистическим патогеном, способным вызывать легочную инфекцию у пациентов с CF. Инфекции, вызываемые некоторыми штаммами В. cepacia, являются причиной "сепация-синдрома", который характеризуется прогрессирующей и инвазивной некротизирующей пневмонией и септимецией. Большинство б. cepacia имеют высокие MIC в отношении многих антибиотиков. Левофлоксацин в форме аэрозоля, приготовленный в виде композиции с MgCl2, делает возможной аэрозольную доставку высоких концентраций в легкое.
Пять штаммов В. cepacia с MIC левофлоксацина в пределах 0,25-8 мг/л тестировали в мышиной модели легочной инфекции. Самкам мышей BALB/c инъецировали 150 мг/кг циклофосфамида за 3 суток до инфицирования. В День 4 мышам инъецировали 50 мкл бактериальной суспензии (~106 CFU/мл), используя пероральный гаважный шприц с изогнутым округлым наконечником, под изофлурановой анестезией. Лечение левофлоксацином, приготовленным в виде композиции с MgCl2 (60 мг/кг BID), или только физиологическим раствором начинали через 72 часа после инфицирования и продолжали два раза в сутки в течение четырех суток, используя микрораспылительное аэрозольное устройство. Через шестнадцать часов после лечения мышей умерщвляли, легкие собирали, гомогенизировали и высевали на чашки для определения количества колоний (CFU).
Как часть Фазы 2b испытаний левофлоксацина в форме аэрозоля, приготовленного с MgCl2, на пациентах с CF, 16-летний пациент мужского пола, инфицированный В. cepacia (MIC левофлоксацина = >128 мг/л), получал 240 мг QD левофлоксацина, приготовленного с MgCl2, в течение 28 суток.
Левофлоксацин в форме аэрозоля, приготовленный с MgCl2, продуцировал по меньшей мере одну log CFU уничтожения бактерий для всех штаммов в модели мышиной инфекции (Таблица 32). У пациента с CF наблюдалось снижение 1,7 log CFU количества бактерий за 28 суток.
У пациентов с CF наблюдалось увеличение FEV1. В День 1 исследования FEV1 у пациентов составлял 1,21 л, в День 28 он увеличился до 1,30 л, улучшение составило 7%. Из модели популяции рассчитывали значения Cmax и AUC, которые составили приблизительно 12,900 мг/л и 4,400 мг·ч/л соответственно.
Введение аэрозоля левофлоксацина, приготовленного с MgCl2, приводило к значительному уничтожению бактерий в штаммах с широким диапазоном MIC. Неклинические и клинические данные подтверждают перспективную клиническую оценку левофлоксацина, приготовленного с MgCl2, в лечении хронических легочных инфекций, вызываемых В. cepacia.
Если публикации и патенты или патентные заявки, включенные в данное описание посредством ссылки, противоречат описанию, содержащемуся в материалах заявки, то данные материалы заявки отменяют такие противоречащие материалы и/или имеют преимущественное значение по сравнению с такими противоречащими материалами.
Если не дано никакого иного определения, все термины (включая технические и научные термины) имеют их обычное или общеупотребительное для специалиста в данной области значение и не должны ограничиваться конкретным или специальным значением, если в данном описании четко не указано иное.
Использованные в данной заявке термины и фразы, а также их варианты, если четко не указано иное, следует толковать не как ограничение, а как ничем не ограниченные. В качестве примеров изложенного выше, термин "включая" следует понимать как значение "включая, без ограничения" или подобное ему; используемый здесь термин "содержащий" является синонимом терминам "включающий" или "характеризующийся", и он является инклюзивным или ничем не ограниченным и не исключает дополнительных, не перечисленных элементов или стадий способов; термин "пример" использован для того, чтобы дать иллюстративные примеры объекта в описании, не исчерпывающие или не ограничивающие его список; прилагательные, такие как "известный", "обычный", "стандартный", и термины подобного значения не следует толковать как ограничивающие объект данным периодом времени или объектом, доступным как объект данного времени, а вместо этого их следует считать охватывающими известные, обычные или стандартные технологии, которые могут быть доступными или известными в настоящее время или в любое время в будущем; и использование терминов, подобных терминам "предпочтительно", "предпочтительный", "желаемый" или "желательный", и слов подобного значения не следует понимать как подразумевающее, что некоторые признаки являются решающими, существенными или даже важными для структуры или функции изобретения, а вместо этого их следует понимать как просто предназначенные для разъяснения альтернативных или дополнительных признаков, которые могут быть использованы или могут быть не использованы в конкретном воплощении изобретения. Подобным образом, группа объектов, связанных союзом "и", не должны считаться требующей, чтобы каждый и всякий из этих объектов присутствовал в группировке, а следует читать как "и/или", если четко не указано иное. Подобным образом, группу объектов, связанных союзом "или", не следует считать требующей обоюдной эксклюзивности среди этой группы, а следует читать как "и/или", если четко не указано иное. В дополнение к этому, используемые в данной заявке объекты в единственном числе следует толковать как относящиеся к одном или более чем одному (т.е. к по меньшей мере одному) из грамматических объектов статьи. В качестве примера, "элемент" означает один элемент или более чем один элемент.
Присутствие в некоторых случаях расширительных слов и фраз, таких как "один или более", "по меньшей мере", "без ограничения" или иных подобных фраз, не означает, что более узкий случай предполагается или требуется в случаях, где такие расширительные фразы отсутствуют.
Все числа, выражающие количества ингредиентов, условия реакций и так далее, использованные в описании изобретения, следует рассматривать как модифицированные во всех случаях термином "примерно". Соответственно, если не указано иное, изложенные в данном описании числовые параметры являются приблизительными параметрами, которые могут меняться в зависимости от желаемых свойств, которые стремятся получить. Самое меньшее и не как попытка ограничить применение теории эквивалентов к объему любых притязаний в любой заявке, по которой испрашивается приоритет для настоящей заявки, каждый числовой параметр следует трактовать в свете числа значимых цифр и обычно окружающих подходов.
Кроме того, хотя в целях ясности и понимания вышеизложенное описано в некоторых подробностях посредством иллюстраций и примеров, для специалистов в данной области очевидным является то, что на практике могут быть произведены некоторые изменения и модификации. Следовательно, описание и примеры не должны рассматриваться как ограничивающие объем данного изобретения описанными здесь конкретными воплощениями и примерами, и они также охватывают все модификации и альтернативы, подпадающие под объем и замысел данного изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ БАКТЕРИАЛЬНОЙ ИНФЕКЦИИ ЛЕГКИХ С ИСПОЛЬЗОВАНИЕМ ФТОРХИНОЛОНОВ | 2010 |
|
RU2535056C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЛЕГОЧНЫХ НАРУШЕНИЙ СОСТАВАМИ ЛИПОСОМАЛЬНОГО АМИКАЦИНА | 2009 |
|
RU2537238C2 |
| АЭРОЗОЛЬНЫЕ ФТОРХИНОЛОНЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2603638C2 |
| АЭРОЗОЛЬНЫЕ ФТОРХИНОЛОНЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2428986C2 |
| ИНГИБИТОР АЛЬФА1-ПРОТЕИНАЗЫ ДЛЯ ЗАДЕРЖКИ НАЧАЛА ИЛИ ПРОГРЕССИРОВАНИЯ ЛЕГОЧНЫХ ОБОСТРЕНИЙ | 2012 |
|
RU2635482C2 |
| ВНУТРИЛЕГОЧНОЕ ВВЕДЕНИЕ ФЛУОРОХИНОЛОНА | 2009 |
|
RU2497524C2 |
| СТАБИЛЬНЫЕ КОМПОЗИЦИИ АСКОРБИНОВОЙ КИСЛОТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2799046C2 |
| КАТИОНЫ ОДНОВАЛЕНТНЫХ МЕТАЛЛОВ СУХИХ ПОРОШКОВ ДЛЯ ИНГАЛЯЦИЙ | 2011 |
|
RU2640921C2 |
| ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2590706C2 |
| СПОСОБЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ, СВЯЗАННЫЕ С ИНГИБИРОВАНИЕМ TH2 | 2011 |
|
RU2578468C2 |
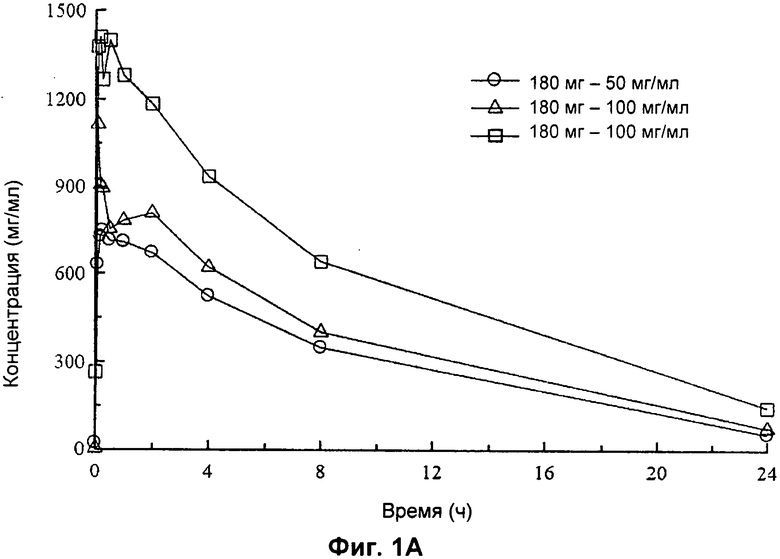
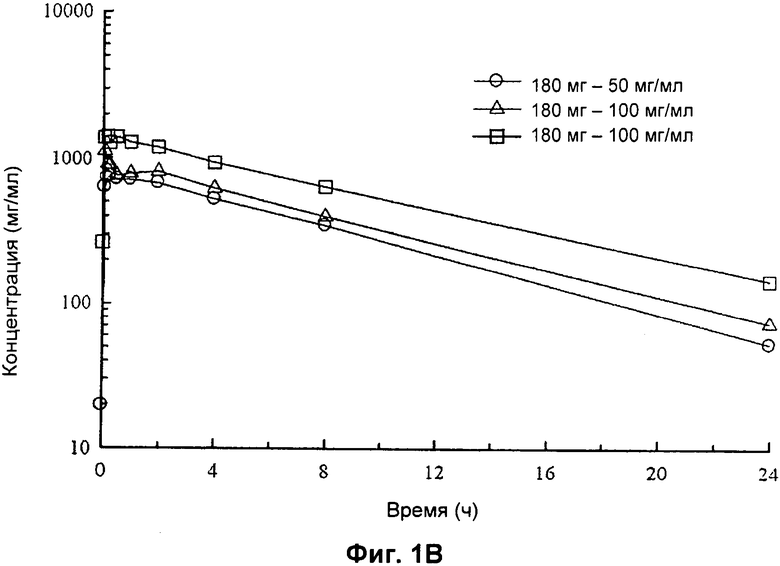

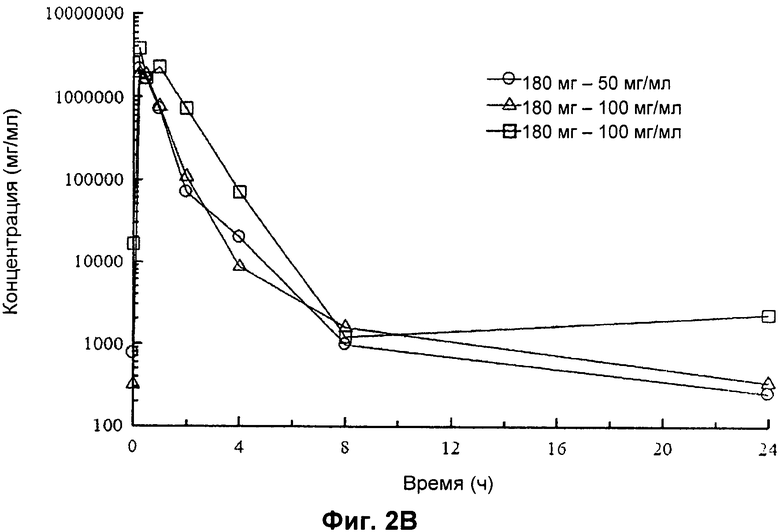
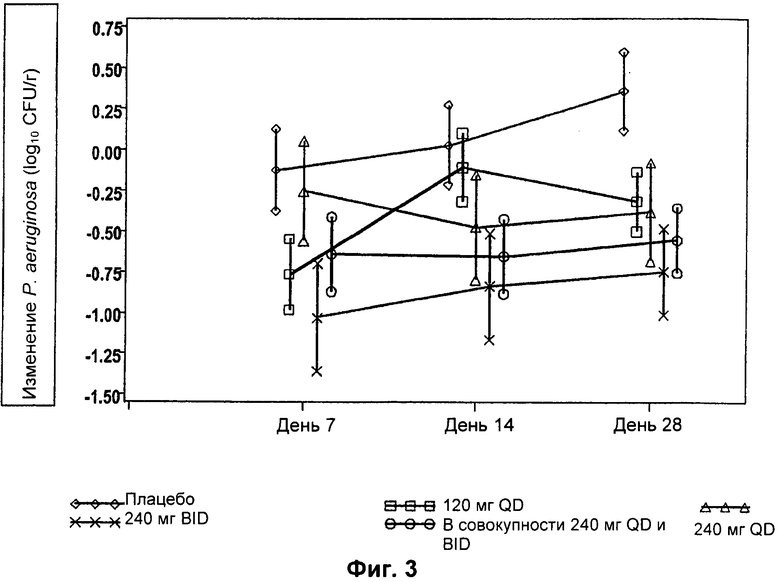
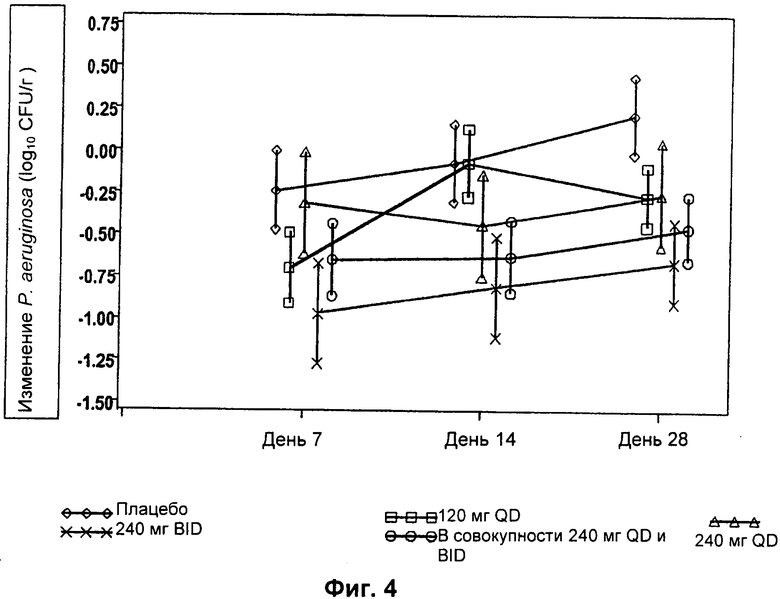
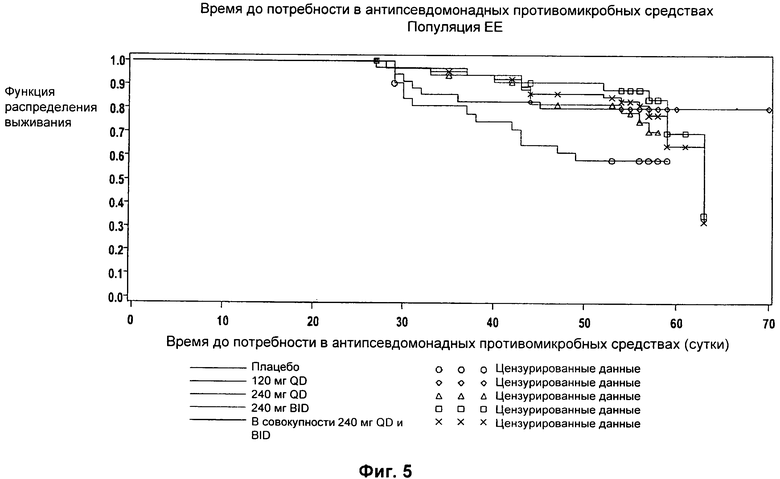
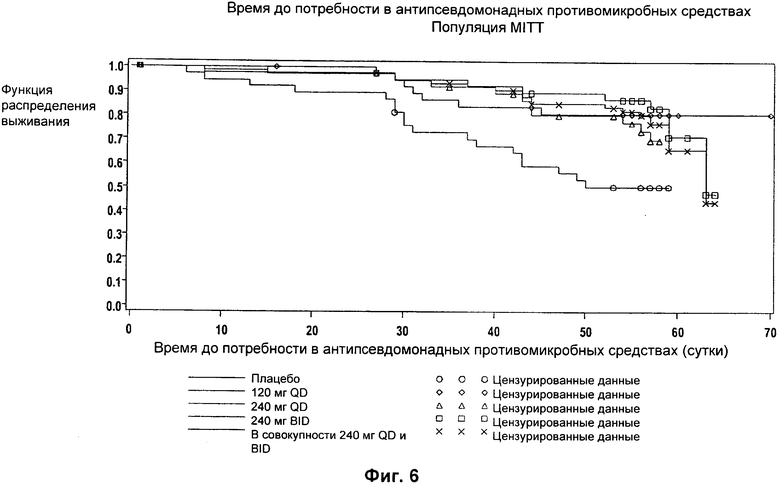
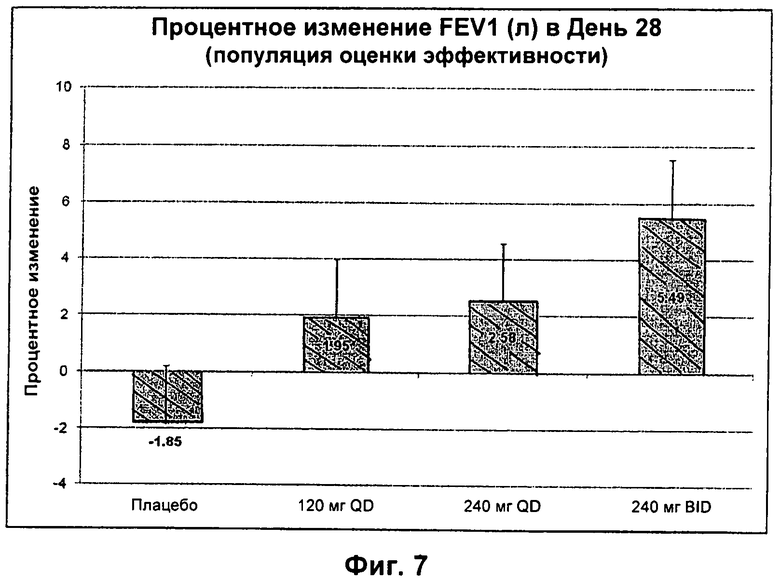
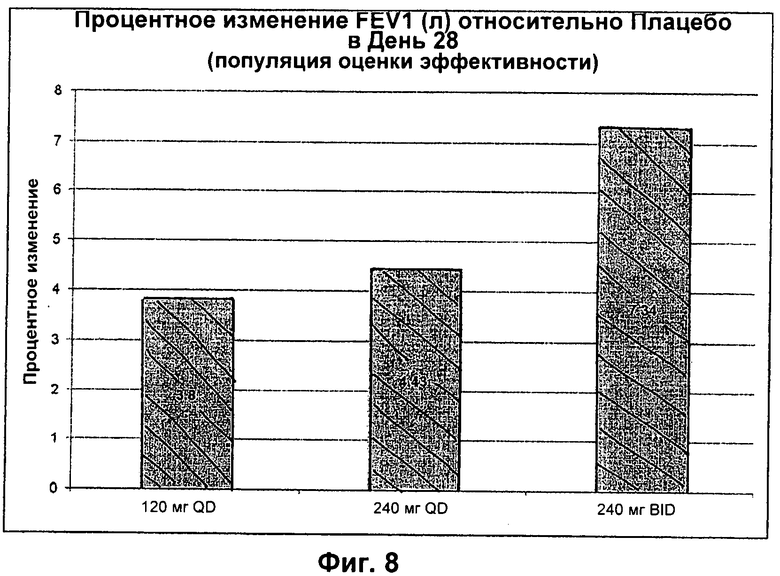

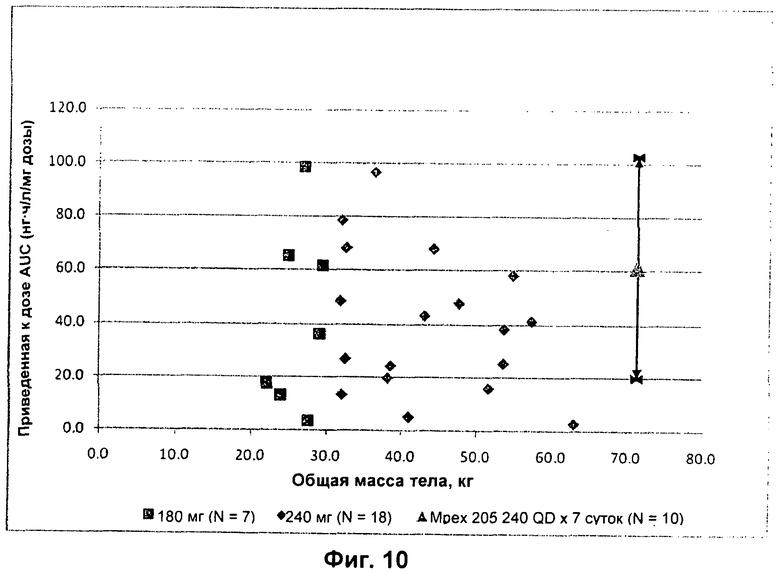
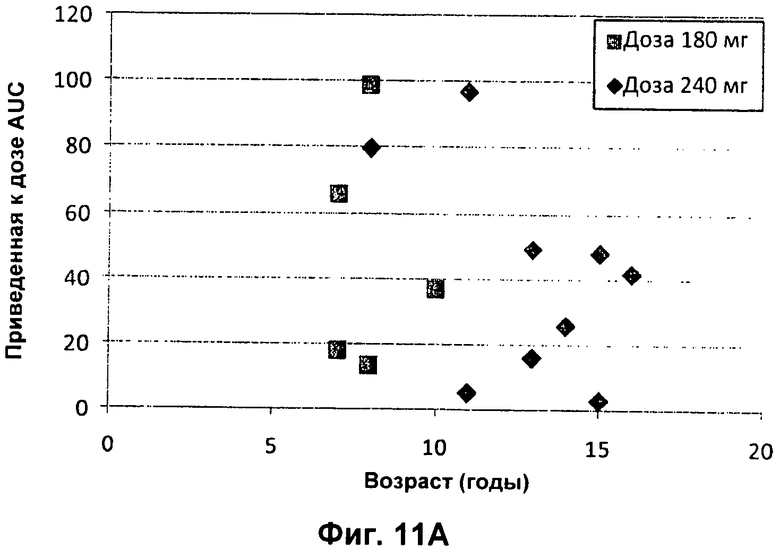
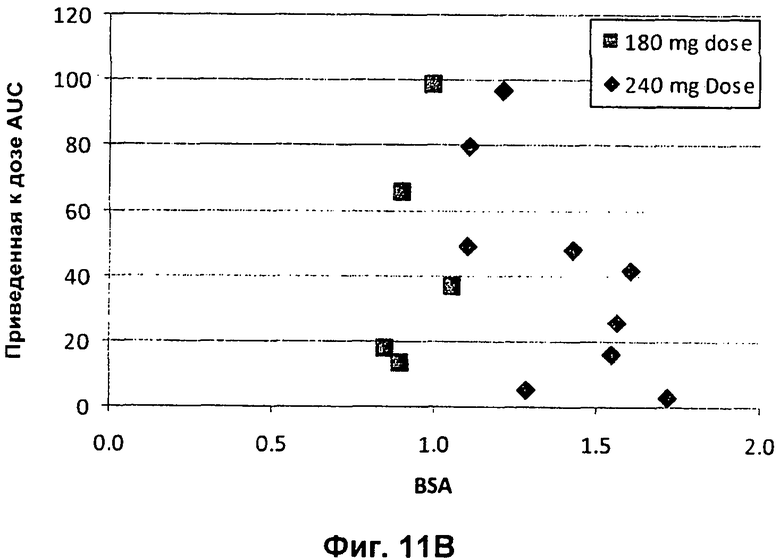
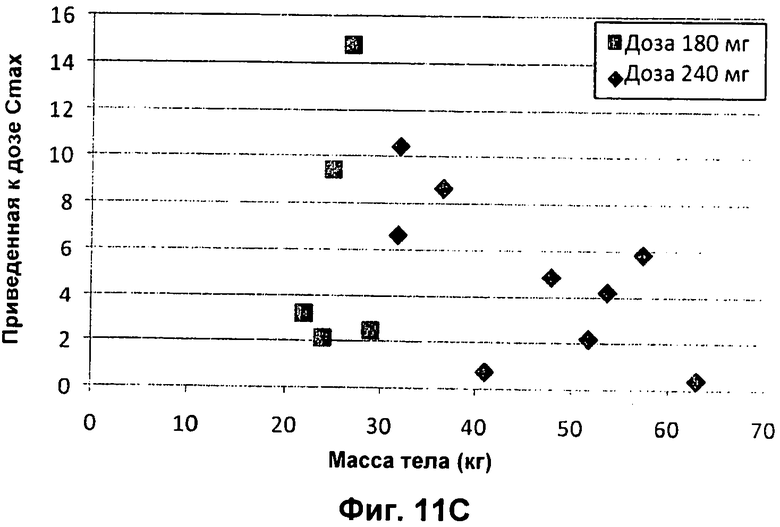
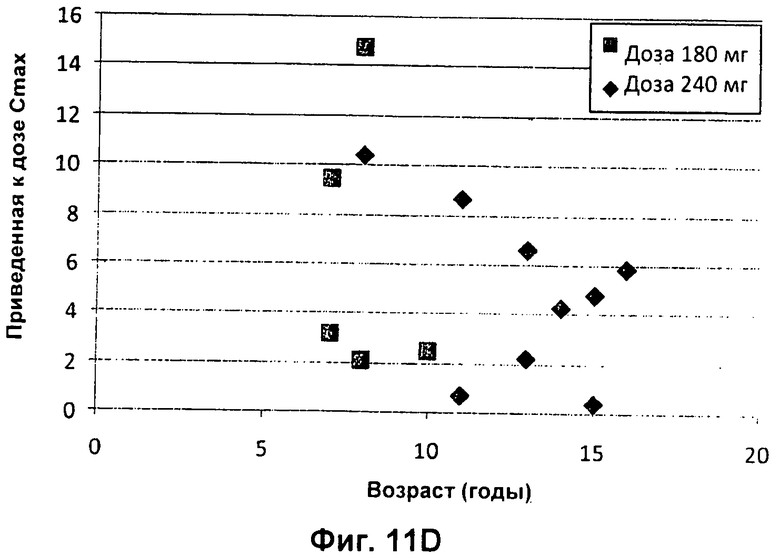
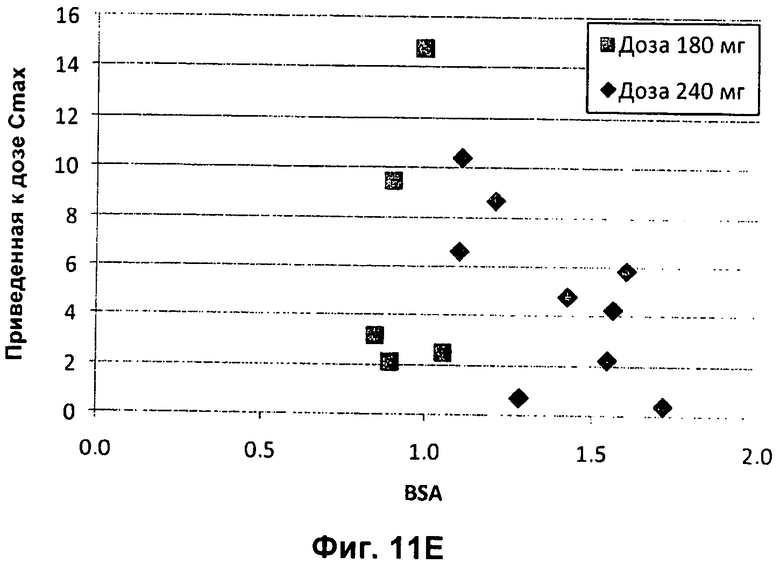
Группа изобретений относится к медицине и может быть использована для лечения муковисцидоза у человека, имеющего легочную инфекцию Р. aeruginosa. Для этого человеку вводят аэрозоль раствора, содержащего левофлоксацин или офлоксацин в концентрации от примерно 50 мг/мл до примерно 200 мг/мл и двухвалентный или трехвалентный катион в концентрации от примерно 50 мМ до примерно 400 мМ. При этом плотность Р. aeruginosa в мокроте указанного человека снижается по меньшей мере на 40%. Также предложены способы лечения муковисцидоза и способ снижения сопротивления малых дыхательных путей. Группа изобретений позволяет уменьшить бронхиальную обструкцию у больных муковисцидозом. 9 н. и 16 з.п. ф-лы, 17 ил., 32 табл., 5 пр.
1. Способ лечения муковисцидоза у человека, где указанный человек имеет легочную инфекцию, включающую Р. aeruginosa, включающий введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением снижения плотности Р. aeruginosa в мокроте указанного человека по меньшей мере на 40%, где указанный раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 50 мМ до примерно 400 мМ и левофлоксацин или офлоксацин в концентрации от примерно 50 мг/мл до примерно 200 мг/мл.
2. Способ по п.1, включающий достижение снижения плотности Р. aeruginosa в мокроте указанного человека по меньшей мере на 0,25 log10 КОЕ/г мокроты.
3. Способ лечения муковисцидоза у человека, включающий введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением увеличения FEV1 (объем форсированного выдоха за 1 секунду) по меньшей мере на 2% и увеличения FEF 25-75 (средняя объемная скорость форсированного выдоха в интервале 25-75% жизненной емкости легких) по меньшей мере на 5%, где указанный раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 50 мМ до примерно 400 мМ и левофлоксацин или офлоксацин в концентрации от примерно 50 мг/мл до примерно 200 мг/мл.
4. Способ по п.3, включающий достижение увеличения FEV1 по меньшей мере на 0,05 л и увеличения FEF 25-75 по меньшей мере на 0,05 л.
5. Способ лечения муковисцидоза у человека, включающий введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением относительного риска менее 1,0, где относительный риск является показателем снижения потребности в других антипсевдомонадных противомикробных средствах, где указанный раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 50 мМ до примерно 400 мМ и левофлоксацин или офлоксацин в
концентрации от примерно 50 мг/мл до примерно 200 мг/мл.
6. Способ лечения муковисцидоза у человека, которому посредством ингаляции вводят агент, выбранный из группы, состоящей из одного или более из следующих: дорназа альфа, азитромицин, сальбутамол, панкрелипаза, хлорид натрия, серетид и ADEK (витамины A, D, Е, К), включающий введение указанному человеку аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, где указанный раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 50 мМ до примерно 400 мМ и левофлоксацин или офлоксацин в концентрации от примерно 50 мг/мл до примерно 200 мг/мл.
7. Способ по п.6, где указанный человек имеет легочную инфекцию, включающую Р. aeruginosa.
8. Способ по п 7, включающий достижение снижения плотности Р. aeruginosa в мокроте указанного человека по меньшей мере на 0,25 log10 КОЕ/г мокроты.
9. Способ лечения муковисцидоза у человека, где указанный человек имеет легочную инфекцию, включающую Р. aeruginosa, включающий повторяющееся введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, где указанное повторяющееся введение не приводит у указанного человека к более чем 16-кратному увеличению минимальной ингибирующей концентрации (MIC) в отношении штамма Р. aeruginosa, который характеризуется наивысшей MIC относительно других штаммов Р. aeruginosa, где указанный раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 50 мМ до примерно 400 мМ и левофлоксацин или офлоксацин в концентрации от примерно 50 мг/мл до примерно 200 мг/мл.
10. Способ лечения муковисцидоза у человека, где указанный человек имеет легочную инфекцию, включающую Р. aeruginosa, включающий определение дозы аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением увеличения в респираторной части CFQ-R (вопросник для пациентов с муковисцидозом, пересмотренный вариант) более чем на 1 и повторяющееся введение этой дозы указанному человеку, нуждающемуся в этом, для лечения муковисцидоза, где указанный раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 50 мМ до примерно 400 мМ и левофлоксацин или офлоксацин в концентрации от примерно 50 мг/мл до
примерно 200 мг/мл.
11. Способ снижения сопротивления малых дыхательных путей у человека с муковисцидозом, включающий введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением увеличения FEF 25-75 по меньшей мере на 5%, где указанный раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 50 мМ до примерно 400 мМ и левофлоксацин или офлоксацин в концентрации от примерно 50 мг/мл до примерно 200 мг/мл.
12. Способ по п.11, включающий достижение увеличения FEF 25-75 по меньшей мере на 0,05 л.
13 Способ лечения муковисцидоза у человека, где указанный человек имеет легочную инфекцию, включающую Р. aeruginosa, и указанный человек имеет площадь поверхности тела менее 1,5 м2, включающий введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением приведенной к дозе сывороточной AUC (площадь под кривой) по меньшей мере 20 (нг.ч/л)/мг дозы, где указанный аэрозоль содержит по меньшей мере 80 мг левофлоксацина или офлоксацина, и где указанное введение повторяют один раз в сутки в течение по меньшей мере 14 суток.
14. Способ лечения муковисцидоза у человека, где указанный человек имеет легочную инфекцию, включающую Р. aeruginosa, и указанный человек имеет площадь поверхности тела менее 1,5 м2, включающий введение указанному человеку, нуждающемуся в таком лечении, аэрозоля раствора, содержащего левофлоксацин или офлоксацин и двухвалентный или трехвалентный катион, с достижением приведенной к дозе сывороточной Cmax (максимальная концентрация) более чем 2 мкг/л/мг введенной дозы, где указанный раствор содержит двухвалентный или трехвалентный катион в концентрации от примерно 50 мМ до примерно 400 мМ и левофлоксацин или офлоксацин в концентрации от примерно 50 мг/мл до примерно 200 мг/мл.
15. Способ по любому из п.п. 1, 3, 5, 6, 9, 10, 11, 13 и 14, где раствор состоит по существу из левофлоксацина или офлоксацина и двухвалентного или трехвалентного катиона.
16. Способ по любому из п.п. 1, 3, 5, 6, 9, 10, 11, 13 и 14,где раствор не содержит лактозу.
17. Способ по любому из п.п. 1, 3, 5, 6, 9, 10, 11, 13 и 14,где раствор имеет осмоляльность от примерно 300 мосмоль/кг до примерно 500 мосмоль/кг и рН от примерно 5 до примерно 8.
18. Способ по любому из п.п. 1, 3, 5, 6, 9, 10, 11, 13 и 14, где раствор содержит хлорид магния.
19. Способ по любому из п.п. 1, 3, 5, 6, 9, 10, 11, 13 и 14, где раствор имеет концентрацию левофлоксацина или офлоксацина от примерно 90 мг/мл до примерно 110 мг/мл, концентрацию хлорида магния от примерно 175 мМ до примерно 225 мМ, рН от примерно 5 до примерно 7, осмоляльность от примерно 300 мосмоль/кг до примерно 500 мосмоль/кг и не содержит лактозу.
20. Способ по любому из п.п.1, 3, 5, 6, 9, 10, 11, 13 и14, где аэрозоль имеет масс-медианный аэродинамический диаметр от примерно 2 микрон до примерно 5 микрон с геометрическим стандартным отклонением, которое меньше или равно примерно 2,5 микрон.
21. Способ по любому из п.п.1, 3, 5, 6, 9, 10, 11, 13 и 14, включающий получение аэрозоля с использованием небулайзера с вибрирующей сеткой-мембраной.
22. Способ по любому из п.п. 1, 3, 5, 6, 9, 10, 11, 13 и 14, где по меньшей мере примерно 20 мг левофлоксацина или офлоксацина вводят в легкое.
23. Способ по любому из п.п. 1, 3, 5, 6, 9, 10, 11, 13 и 14, дополнительно включающий совместное введение дополнительного активного агента, выбранного из группы, состоящей из антибиотиков, бронхорасширяющих средств, антихолинергических агентов, глюкокортикоидов, ингибиторов эйкозаноидов и их комбинаций.
24. Способ по любому из п.п. 1, 3, 5, 6, 9, 10, 11, 13 и 14, включающий введение аэрозоля один раз в сутки.
25. Способ по любому из п.п. 1, 3, 5, 6, 9, 10, 11, 13 и 14, где легочная
инфекция дополнительно включает одну или более бактерий, выбранных из группы, состоящей из Pseudomonas fluorescens, Pseudomonas acidovorans, Pseudomonas alcaligenes и Pseudomonas putida, Stenotrophomonas maltophilia, Aeromonas hydrophilia, Escherichia coli, Citrobacter freundii, Salmonella typhimurium, Salmonella typhi, Salmonella paratyphi, Salmonella enteritidis, Shigella dysenteriae, Shigella flexneri, Shigella sonnei, Enterobacter cloacae, Enterobacter aerogenes, Klebsiella pneumoniae, Klebsiella oxytoca, Serratia marcescens, Morganella morganii, Proteus mirabilis, Proteus vulgaris, Providencia alcalifaciens, Providencia rettgeri, Providencia stuartii, Acinetobacter calcoaceticus, Acinetobacter haemolyticus, Yersinia enterocolitica, Yersinia pestis, Yersinia pseudotuberculosis, Yersinia intermedia, Bordetella pertussis, Bordetella parapertussis, Bordetella bronchiseptica, Haemophilus influenzae, Haemophilus parainfluenzae, Haemophilus haemolyticus, Haemophilus parahaemolyticus, Haemophilus ducreyi, Pasteurella multocida, Pasteurella haemolytica, Helicobacter pylori, Campylobacter fetus, Campylobacter jejuni, Campylobacter coli, Borrelia burgdorferi, Vibrio cholera, Vibrio parahaemolyticus, Legionella pneumophila, Listeria monocytogenes, Neisseria gonorrhoeae, Neisseria meningitidis, Burkholderia cepacia, Francisella tularensis, Kingella и Moraxella.
| WO 2006125132 A2, 23.11.2006 | |||
| WO 2007090646 A1, 16.08.2007 | |||
| LEE C | |||
| et all, Levofloxacin pharmakinetics in adult cystic fibrosis, Chest 2007, 131 (3), pp | |||
| Ножницы для автоматической разрезки металлических полос с приспособлением для контроля развески кусков | 1921 |
|
SU796A1 |
| ПАВЛИНОВА Е.Б | |||
| и др., Оценка эффективности современной муколитической | |||
Авторы
Даты
2015-09-20—Публикация
2010-09-03—Подача