ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу получения стерильного вязкоэластичного биополимера, такого как гиалуроновая кислота, после производства в крупном масштабе.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Изобретение относится к способам получения вязкоэластичных биополимеров после производства в крупном масштабе. Биополимеры, к которым изобретение может быть применено, включают гомополисахариды и гетерополисахариды, в частности, категорию гетерополисахаридов, известных как гликозаминогликаны. Гликозаминогликаны, особенно подходящие для применения в настоящем изобретении, представляют собой гиалуроновую кислоту (НА), хондроитинсульфат, дерматансульфат, кератансульфат, гепарин-и гепарансульфат.
НА является природным биополимером, состоящим из повторяющихся дисахаридных единиц D-глюкуроновой кислоты, находящихся в β-(1-3)-связи с N-ацетил-D-глюкозамином, где каждая дисахаридная единица связана с примыкающими соседями посредством β-(1-4)-связей. Соль гиалуронат натрия (NaHA) обнаруживается при физиологическом pH в суставной синовиальной жидкости, в соединительной ткани, в стекловидном теле глаза и здоровой ткани кожи человека и позвоночных и представляет собой продукт внеклеточной секреции нескольких видов бактерий, в частности, рода Streptococcus.
В настоящее время основные медицинские применения проиводимых продуктов NaHA имеют место в глазной хирургии катаракт и имплантации искусственных хрусталиков, в дерматологических применениях для заполнения морщин и увеличения размера губ и для вязкоэластичных добавок при лечении остеоартрита у людей и крупных млекопитающих. Вязкоэластичные добавки, в частности, в колене предназначены для восстановления нормального реологического гомеостаза структуры суставов (joint network) и для обеспечения непосредственной защиты, смазки, аммортизации, гидродинамического сопротивления и механохимического барьера против стресса. Было показано, что внутрисуставные инъекции NaHA улучшают функцию и подвижность, и уменьшают боль.
Более современные медицинские применения изготавливаемой NaHA включают покрытия для медицинских устройств, продукты для предотвращения адгезии в хирургии, носители для доставки лекарственных средств, материалы для замещения кости и ранозаживляющие материалы.
Продаваемые продукты NaHA включает BioLon™, Biolon™ Prime, BioHy™ (все от Biotechnology General (Израиль) Ltd.), Hyalart™ (Fidia), Synvisc™ Hyalan G-F 20 (Biomatrix), Healon™ (Pharmacia) BD Vise™ (Becton Dickinson) и Orthovisc™ (Anika Therapeutics).
Для коммерческих применений в фармацевтической, косметической и пищевой продукции качество вязкоэластичного биополимера зависит от комбинации параметров вязкости, концентрации и молекулярной массы. Например, HA для фармацевтического применения должна иметь высокую молекулярную массу для обеспечения достаточного удерживания воды, но вязкость должна быть приемлемого уровня для того, чтобы обеспечить простоту введения и обращения, например, возможность введения через шприц. NaHA, обнаруженная в биологических источниках, таких как гребни петуха и культуральная жидкость ферментированных штаммов Streptococcus, часто имеют очень высокую молекулярную массу, т.е. более 3×106 дальтон. Однако процедуры, используемые для их экстракции, очистки и стерилизации, обычно приводят к получению конечного продукта, в котором молекулярная масса значительно уменьшена по сравнению с природным соединением.
Например, лиофилизация NaHA после многократной экстракции индуцирует сублимацию воды, конечным результатом которой является фрагментация высокомолекулярных молекул. Способы с низким рН приводят к образованию поперечных сшивок, которые разрушаются при последующем увеличении pH и вносят вклад в фрагментацию NaHA.
Способы стерилизации, такие как способы с использованием сухого или влажного нагревания, жидких химических веществ, газообразной окиси этилена, УФ-излучения, электронно-лучевого излучения, гамма-излучения, микроволн и ультразвука, все приводят к разрушению линейных молекул, и являются, таким образом, неподходящими для вязкоэластичного биополимерного продукта, в котором молекулярная масса является ключевым параметром для оптимального качества продукта.
Производство NaHA из биологических источников хорошо известно специалистам в данной области техники. Типичный способ очистки в крупном масштабе (для которого существует много вариантов) включает повторяющиеся стадии экстракции, осаждения, абсорбции, центрифугирования и/или фильтрации для удаления загрязнений. Процедуры для выделения NaHA из ферментированных Streptococcus культур раскрыты, например, в патенте США №4780414 и патенте США №4784990 (оба принадлежат BioTechnology General (Израиль) Ltd.), патенте США №5563051, патенте США №5411874 (Fermentech Medical), патенте США №5071751 (патентовладелец Chisso Corp.) и патенте США №5316916.
Патент США №5023175 (патентовладелец Kabushiki) относится к очистке NaHA (MW 2,1×106) для косметического применения посредством диализа с ультрафильтрацией в качестве конечной стадии перед сушкой замораживанием.
Публикация США №2002/0120132 относится к очистке NaHA (MW>7,5×105), вовлекающей реактор с контролируемой температурой и предположительно меньше этанола, чем традиционные способы. Очищенный NaHA сушат под вакуумом или лиофилизируют.
Альтернативные способы производства в крупном масштабе NaHA из стрептококковых культур избегают стадий экстракции/осаждения и основаны, в первую очередь, на способах последовательной фильтрации, как указано, например, в GB 2249315 (патентовладелец Chisso Corp.), WO 95/04132 (заявитель Fidia Corp.) и патенте США №6489467 (патентовладелец Chemedica).
Ни в одном из вышеупомянутых способов не описано получение высокоочищенного, произведенного в крупном масштабе вязкоэластичного биополимера, такого как NaHA, в виде конечного стерильного продукта, подходящего для медицинского применения.
В патенте США №4141973 (патентовладелец Biotrics) раскрыт стерильная HA, полученная посредством широкомасштабной очистки материала из гребешков петуха и растворения конечного продукта в стерильном, забуференном фосфатами растворе. Однако данный препарат имеет заметные количества белка и других примесей.
В патенте США №4517295 (патентовладелец Diagnostic Inc.) раскрыт продукт стрептококковый NaHA, полученный способом, в котором стерильная фильтрация представляет собой конечную стадию. Недостатком описанного способа является производство низкомолекулярного NaHA (средняя MW 5,5×104 дальтон).
В патенте США №5093487 (патентовладелец Mobay Corp.) и патенте США №5316926 (патентовладелец Miles Inc.) раскрыли конечную стерилизацию посредством фильтрации стрептококкового препарата NaHA (средняя MW 1-2×106 дальтон) после способа очистки, включающего метод механической намотки. Цель этого метода намотки состоит в увеличении, как молекулярной массы, так и вязкости, после чего осуществляют тепловую обработку или фильтрацию, предположительно, с целью снижения вязкости, не влияющей на молекулярную массу. Недостатком метода намотки являются его неизвестные эффекты на химический состав NaHA.
Патент США №4782046 (патентовладелец Mobay Corp.) относится к получению конечного продукта NaHA (средняя MW обычно менее 3,0×106 дальтон) посредством стерилизации фильтрацией и/или обработки бета-пропиолактоном перед заполнением шприца. Недостаток обработки бета-пропиолактоном заключается в том, что его следы могут оставаться в препарате после гидролиза, и это может оказать отрицательный эффект на химическую структуру NaHA.
Патент США №5079236 (патентовладелец Hyal Pharmaceutical Corp.) относится к получению препарата посредством растворения очищенного NaHA (средняя MW 5-20×104), возможно содержащего стероид, в нагретом растворе консервантов, например бензоата натрия, метилпарабена и пропилпарабена, корректировки pH и объема, заполнением флаконов и стерилизации флаконов в автоклаве. Стерилизация автоклавированием является разрушительной для молекулярной массы NaHA.
Патент США №5411874 и патент США №5563051 (патентовладелец Fermentech) относятся к получению раствора NaHA медицинской степени чистоты посредством растворения NaHA (средняя MW 1,6-2,5×106), очищенного многократными осаждениями, в стерильном, забуренном фосфатами растворе.
WO 01/28602 (заявители Genetics Institute и Fidia) относится к инъецируемым препаратам, содержащим сложные эфиры HA и остеогенный белок.
Патент США №6221854 (патентовладелец Orquest) относится к инъецируемым препаратам, содержащим NaHA и ростовые факторы.
Ни один из описанных выше документов не раскрывает промышленно применяемые способы получения произведенного в крупном масштабе и очищенного вязкоэластичного биополимера, такого как NaHA, в виде конечного продукта, подходящего для медицинского применения.
Объект изобретения состоит в обеспечении способа получения произведенного в крупном масштабе и очищенного вязкоэластичного биополимера, такого как NaHA, в виде конечного продукта, подходящего для медицинского применения.
Объект изобретения состоит в получении препарата, содержащего высокомолекулярный вязкоэластичный HA, который подходят для введения посредством инъекции в глазную и внутрисуставную области у человека и животных.
Объект изобретения состоит в обеспечении промышленного способа получения NaHA, получаемого в результате производства в крупном масштабе в виде конечного продукта со средней молекулярной массой 3×106 или выше, подходящего для медицинского применения, не подвергающего NaHA сушке замораживанием на любой стадии производства или получения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В изобретении предложен способ получения вязкоэластичного биополимера, включающий стадии:
1) стерилизующей фильтрации растворимого, произведенного в крупном масштабе биополимера посредством пропускания через мембрану, подходящую для стерилизующей фильтрации; и
2) концентрирования указанного биополимера посредством ультрафильтрации до получения желаемой конечной концентрации.
В изобретении также предложен способ получения вязкоэластичного биополимера, включающий стадии:
1) растворения произведенного в крупном масштабе биополимера в подходящей буферной среде для достижения по меньшей мере разбавленной концентрации, достаточной для осуществления стерилизующей фильтрации;
2) стерилизующей фильтрации биополимера путем пропускания через мембрану, подходящую для стерилизующей фильтрации; и
3) концентрирования указанного биополимера посредством ультрафильтрации до получения желаемой конечной концентрации.
В изобретении также предложен способ получения вязкоэластичного препарата гиалуроновой кислоты, включающий стадии:
1) растворения произведенной в крупном масштабе гиалуроновой кислоты в подходящей буферной среде для достижения по меньшей мере разбавленной концентрации, достаточной для осуществления стерилизующей фильтрации;
2) стерилизующей фильтрации растворенной гиалуроновой кислоты путем пропускания через мембрану с абсолютным размером пор 0,2 микрона; и
3) концентрирования гиалуроновой кислоты посредством ультрафильтрации до получения желаемой конечной концентрации.
В дополнительном воплощении вязкоэластичный биополимер не подвергается сушке замораживанием на какой-либо стадии производства в крупном масштабе или получения.
Изобретение подходит для применения с гликозаминогликановыми биополимерами, такими как HA. Изобретение особенно подходит для применения с вязкоэластичными высокомолекулярными биополимерами, например HA, имеющими молекулярную массу в диапазоне от 1×104 до 1×107 дальтон и имеющими индекс псевдопластичности в диапазоне от 600 до 1200.
Препараты, предложенные в данном изобретении, являются высоко очищенными, стерильными, имеют подходящие реологические свойства и находятся в форме, подходящей для инъекции в глазную и внутрисуставную области человека и животных.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В изобретении предложен способ получения вязкоэластичного биополимера, включающий стадии:
1) растворение произведенного в крупном масштабе вязкоэластичного биополимера в подходящей среде для достижения по меньшей мере разбавленной концентрации, достаточной для стерилизующей фильтрации;
2) стерилизующей фильтрации растворенного вязкоэластичного биополимера путем пропускания через мембрану, подходящую для стерилизующей фильтрации; и
3) концентрирования стерилизованного фильтрацией вязкоэластичного биополимера посредством ультрафильтрации до достижения желаемой конечной концентрации.
Способ по изобретению подходит для применения с вязкоэластичными биополимерами, для которого требуется высокоочищенный и стерильный препарат. Вязкоэластичный биополимер может находиться в широком диапазоне молекулярной массы, например, от 1×104 до 1×107 дальтон, но этот способ особенно подходит для применения с вязкоэластичными биополимерами с высокой молекулярной массой, поскольку вязкость зависит и от концентрации и молекулярной массы. В соответствии со способом по изобретению произведенный в крупном масштабе и высокоочищенный вязкоэластичный биополимер подвергают стерилизующей фильтрации при относительно низкой концентрации для обеспечения его эффективного пропускания через фильтрационный аппарат при приложенном давлении, которое не способствует фрагментации биополимера. На конечной стадии способа получения перед заполнением упаковки или устройства стерильный биополимер концентрируют посредством ультрафильтрации до желаемой конечной концентрации.
Как использовано в данной заявке, термин "высокомолекулярная масса" зависит от конкретного получаемого биополимера, но обычно относится к молекулярной массе более 1×106 дальтон. Высокомолекулярный вязкоэластичный биополимер HA обычно находится в диапазоне от 1×106 до 1×107 дальтон, и более конкретно в диапазоне от 2,5×106 до 5,0×106 дальтон. Данный способ также применим к препаратам вязкоэластичных биополимеров, в которых молекулярная масса специально уменьшена. Например, препараты HA с уменьшенной молекулярной массой могут быть получены после обработки излучением, как описано в патенте США №6383344, или в результате обработки ультразвуком и гипохлоритом натрия, как описано в патенте США №6232303. Другие высокие молекулярные массы вязкоэластичного биополимера HA, полезные в способе по изобретению, могут составлять по меньшей мере примерно 1×106 дальтон, по меньшей мере примерно 1×107 дальтон, или по меньшей мере примерно 1×108 дальтон.
Еще одни высокомолекулярные вязкоэластичные биополимеры HA, полезные в способе по изобретению могут иметь не более примерно 2,5×106 дальтон, не более примерно 5,0×106 дальтон, не более примерно 1×107 дальтон, или не более примерно 1×108 дальтон. Напротив, высокомолекулярные вязкоэластичные биополимеры HA могут иметь от примерно 1×106 до примерно 2,5×106 дальтон, от примерно 1×106 до примерно 5,0×106 дальтон, от примерно 1×106 до примерно 1×107 дальтон, от примерно 1×106 до примерно 1×108 дальтон, от примерно 2,5×106 до примерно 5,0×106 дальтон, от примерно 2,5×106 до примерно 1×107 дальтон, от примерно 2,5×106 до примерно 1×108 дальтон, от примерно 5,0×106 до примерно 1×107 дальтон, от примерно 5,0×106 до примерно 1×108 дальтон, или от примерно 1×107 до примерно 1×108 дальтон.
Вязкоэластичный биополимер, подходящий для способа по изобретению, может представлять собой гомополисахарид, т.е. Собранный из одного типа моносахарида, или гетерополисахарид, т.е. собранный из двух или более разных типов моносахаридов. Примеры гомополисахаридов включают карбоксиметилцеллюлозу, хитин, полиманнуроновую кислоту, камедь курдлана, склероглюкан и декстран. Примеры гетерополисахаридов включают гликозаминогликаны, альгинаты, каррагинаны, гуаровую камедь, пектины, камедь бобов рожкового дерева и ксантановую камедь. Способ по изобретению особенно подходит для гликозаминогликанов, также известных в качестве кислых мукополисахаридов, которые состоят из повторяющихся дисахаридных единиц, в которых один из двух моносахаридов всегда представляет либо N-ацетилглюкозамин, либо N-ацетилгалактозамин. Примеры гликозаминогликанов включают HA, хондроитин, хондроитинсульфат A, хондроитинсульфат B, хондроитинсульфат C, дерматансульфат, кератансульфат, гепарин- и гепарансульфат. Как гомо-, так и гетерополисахариды могут иметь линейную или разветвленную структуры. Компонент моносахариды биополимера можно высвобождать кислотным гидролизом и определять аналитическими методами, такими как тонкослойная хроматография и/или жидкостная хроматография высокого давления.
Вязкоэластичный биополимер должен быть растворимым в водном растворе. Те, которые являются растворимыми и жидкими при температурах в диапазоне 10-30°C, больше всего подходят для способа по изобретению, а те, которые являются растворимыми только при повышенных температурах, например камедь бобов рожкового дерева, могут быть также получены с использованием способа по изобретению. Вязкоэластичный биополимер, который обычно является нерастворимым в водном растворе, можно сделать подходящим для способа по изобретению путем дериватизации химической обработкой. Например, хотя целлюлоза является нерастворимой, производная карбоксиметилцеллюлоза, полученная при взаимодействии целлюлозы со щелочью и хлоруксусной кислотой, является растворимой и может быть получена с использованием способа по изобретению.
Согласно изобретению, биополимер может находиться в своей нативной форме или он может быть химически модифицирован и/или дериватизирован. Примеры химической модификации/дериватизации включают поперечное сшивание (патент США №6552184), добавление сульфата (WO 95/25751; WO 98/45335), карбоксильных или гидроксильных групп, присоединение липофильных боковых цепей, введение ацетильных групп и этерификацию с присоединением дополнительных группировок и без присоединения дополнительных группировок (патент ЕР №216453; WO 98/08876). Дополнительные группировки включают лекарственные средства, полисахариды, пектины, агенты визуализации, целевые белки, такие как антитела, ростовые факторы и тому подобное.
Нативная форма биополимера может быть анионной, катионной или нейтральной солевой формой.
Способ по изобретению особенно подходит для HA. Термин "гиалуроновая кислота" (HA) означает гиалуроновую кислоту, ее соли, такие как гиалуронаты натрия, калия, магния, кальция, лизина, аммония, триэтаноламина и пропаноламина, их соли металлов, такие как гиалуронат кобальта, цинка, меди, железа, марганца и лития, и его химически модифицированные и дериватизированные формы, как раскрыто, например, в патенте США №4851521, патенте США №5099013, патенте США №5336767 и патенте США №6017901.
Как использовано в данной заявке, термин "вязкоэластичный" относится к реологическому поведению раствора биополимера, который под действием сдвига демонстрирует как характеристики чисто эластичного материала, т.е. способность сохранять энергию, так и характеристики чисто вязкого материала, т.е. способность рассеивать энергию.
Реологическое поведение является характерным и специфическим и зависит от длины, структуры и заряда биополимера. Некоторые биополимеры, такие как HA, демонстрируют неньютоновское поведение, что указывает на то, что вязкость зависит как от скорости сдвига, так и от температуры, и они демонстрируют псевдопластическое поведение (также известное как "снижение вязкости при сдвиге"), что означает, что вязкость раствора уменьшается в зависимости от увеличения силы трения.
Вязкость конкретного биополимера определяется количественно в виде набора дискретных скоростей сдвига и температур, например, с использованием вискозиметра Брукфилда. Дополнительную информацию можно получить в непрерывном диапазоне сдвига, например, с помощью ротационного вискозиметра Хааке.
Вязкоэластичность может быть определена количественно, как отношение вязкости при низкой скорости сдвига, например, 0,1 с-1, к вязкости при высокой скорости сдвига, например, 1000 с-1. Как использовано в данной заявке, Вязкоэластичность относится к отношению измеренной вязкости при приложенной скорости сдвига 0,1 с-1 к измеренной вязкости при приложенной скорости сдвига 1000 с-1. Это отношение также известно как индекс псевдопластичности (Pl):
Pl=вязкость при скорости сдвига 0,1 с-1/вязкость при скорости сдвига 1000 с-1.
Как использовано в данной заявке, вязкоэластичный биополимер имеет индекс псевдопластичности более примерно 500. Pl является полезным индексом для характеристики поведения биополимера при различных условиях и для сравнения реологического качества среди различных растворов биополимеров.
Биополимер, такой как HA, который используют для вязкоэластичных добавок и вводят посредством внутрисуставной инъекции, требует высокой вязкости при низких скоростях сдвига, так чтобы он мог служить в качестве нетекучей подложки после инъекции, но он также требует низкой вязкости при высокой скорости сдвига, т.е. при доставке, например посредством инъекции (например, с помощью шприца и иглы), так чтобы доставка могла быть допустимо легкой и точной. Отсюда Pl раствора биополимера непосредственно влияет на возможность введения его с помощью шприца.
Возможность введения с помощью шприца представляет собой силу, необходимую для вытеснения раствора биополимера из шприца или используемого шприцеподобного устройства. Возможность введения с помощью шприца может быть протестирована с помощью индикатора силы, например, индикатора силы Mecmesin и выражается в единицах g (гравитации). Например, сила в 200 g позволяет врачу эффективно вытеснять раствор NaHA из шприца и одновременно контролировать количество материала, вводимого в желаемое место, например, во внутрисуставную или глазную область.
Согласно изобретению биополимер может быть получен из биологического источника или он может представлять собой продукт ферментативного или химического синтеза in vitro или их комбинации. Биологический источник может представлять собой бактериальный, дрожжевой, растительный организм, организм амфибий, птиц или млекопитающих. Например, HA может быть выделен из любых ферментированных стрептококковых культур, человеческой пуповины, хряща крупного рогатого скота или гребней петуха. Ферментативный синтез полисахаридов in vitro, включая HA, целлюлозу, полиманнуроновую кислоту и хитин, описан в WO 95/24497. Применение полученного рекомбинантным путем фермента гиалуронансинтазы для синтеза in vitro HA описано в патенте США №6602693. HA, полученная из любого из вышеупомянутых источников, может быть последовательно химически модифицирована или дериватизирована, как описано, например, в патенте США №4851521, патенте США №4713448, патенте США №5336767 и патенте США №5099013.
Дополнительные вязкоэластичные биополимеры, которые представляют собой продукты бактериальной ферментации, включают, например, камедь курдлана (β-1-3-D-глюкан), продуцируемую Alcaligenes faecalis, геллановую камедь (тетрасахаридный скелкт L-рамнозы и D-глюкозы с глицерильными и ацетильными заместителями), продуцируемую Sphingomonas elodea, и ксантановую камедь (β-1-4-D-глюкан с боковыми цепями из маннозы и глюкуроновой кислоты), продуцируемую Xanthomonas campedis.
В области производства HA, предшествующий способ очистки в крупном масштабе имеет много вариаций, которые хорошо известны специалистам в данной области техники. Способы производства в крупном масштабе раствора, содержащего высокомолекулярную HA из ферментированных культур Streptococcus, раскрыты, например, в патенте США №5563051 и патенте США №5316916. Были описаны другие способы производства в крупном масштабе, которые дают твердые формы HA в качестве конечного продукта, как описано в патенте США №4780414.
Однако последующий способ получения является менее вариабельным в том, что обычная практика заключается в последовательном осуществлении концентрирования и стерилизации в качестве конечной последовательности операций перед заполнением упаковки или устройства. Действительно, в соответствии с обычной наилучшей практикой в биофармацевтической промышленности, стерилизация является конечной стадией перед заполнением, и промежуточных стадий специально избегают для минимизации возможности загрязнения.
В способе по изобретению неожиданно отказались от обычной производственной практики и действительно переставили местами стадии, так что стерилизацию (посредством фильтрации через абсолютный фильтр с размером пор 0,22 микрона или меньше) осуществляют перед концентрированном (посредством ультрафильтрации). Стадию концентрирования осуществляют стерильно и можно ожидать, что конечный продукт будет иметь фармацевтическую чистоту самого высокого стандарта без каких-либо компромиссов в стерильности и других параметрах качества. В самом деле, неожиданно, что продукт HA с высокой молекулярной массой и вязкостью может быть получен в большом асептическом масштабе при осуществлении стадии концентрирования в качестве промежуточной стадии междустерилизующей фильтрацией и заполнением.
Этот неожиданный порядок операций является весьма предпочтительным при применении к высокомолекулярному вязкоэластичному биополимеру, такому как HA. Один такой важный аспект состоит в том, что произведенная в крупном масштабен растворенная HA (например, 0,1%; 1 мг/мл) легко проходит через стерилизующий фильтр при применяемом в промышленности уровне давлении для достижения приемлемой скорости потока (например, минимальная скорость потока 750 мл/мин). Прилагаемое давление для пропускания раствора HA через стерилизующий фильтр является достаточно умеренным, чтобы не оказывать отрицательного влияния на молекулярную массу HA.
Обратный способ концентрирования, например, до 1% или 10 мг/мл, затем конечной стерилизации на практике не работает с высокомолекулярным вязкоэластичным биополимером, поскольку высокая концентрация биополимера приводит к многократному блокированию стерилизующего фильтрационного аппарата, в результате чего процедура становится неэффективной и расточительной.
Кроме того, используя способ по изобретению, произведенная в крупном масштабе и простерилизованная посредством фильтрации HA представляет собой многоцелевой промежуточный продукт, который может быть доведен до различных конечных концентраций и/или смешан с дополнительными стерильными эксципиентами или активными ингредиентами для различных конечных препаратов.
В соответствии со способом по изобретению стерилизация вязкоэластичного биополимера должна быть выполнена посредством фильтрации через подходящую мембрану для того, чтобы сохранить высокомолекулярную структуру полимера. Альтернативные способы стерилизации, такие как способы с использованием сухого или влажного нагревания, жидких химических веществ, газообразной окиси этилена, УФ-излучения, электронно-лучевого излучения, гамма-излучения, микроволн или ультразвука, приводят к разрушению длинных линейных молекул, таких как HA.
Предпочтительный способ производства в крупном масштабе, подходящий для данного изобретения, представляет собой способ, который постоянно дает вязкоэластичный биополимерный продукт, который является гомогенным от партии к партии в отношении широкого диапазона физико-химических параметров и параметров чистоты. Способ производства в крупном масштабе представляет собой по существу способ очистки, который должен быть достаточно жестким для того, чтобы удалить мельчайшие количества примесей, происходящих из источника производства (например, бактериальной культуры) и из реагентов для экстракции (например, этанола или хлорида цетилпиридиния), каждый из которых может вызывать побочные реакции при введении пациентам. Для такого продукта, как HA, предназначенного для инъекции пациентам, производство, технические параметры и характеристики произведенной в крупном масштабе HA должны соответствовать признанным в мире стандартам и основным принципам оценки токсичности, уровней эндотоксинов и стерильности.
С другой стороны, способ производства в крупном масштабе не должен включать стадии, которые приводят к чрезмерной фрагментации молекулы HA и одновременно уменьшают ее молекулярную массу, например, до менее чем примерно 3×106 дальтон, или вязкость, или, в другом случае, приводят к отклонениям от характеристических свойств молекулы HA.
Подходящий способ производства в крупном масштабе описан, например, в патенте США №4780414. Такой способ включает следующие стадии:
1) осаждение этанолом культуральной жидкости негемолитического непатогенного, продуцирующего гиалуроновую кислоту ферментированного штамма Streptococcus;
2) растворение осадка, полученного на стадии (1), в смеси хлорид натрия/этанол/древесный уголь;
3) осаждение растворенного материала, полученного на стадии (2), хлоридом цетилпиридиния;
4) растворение осадка, полученного на стадии (3), в смеси хлорид натрия/этанол;
5) обработку растворенного материала, полученного на стадии (4), силикатом магния;
6) фильтрацию обработанного материала, полученного на стадии (5), через абсолютную мембрану 0,65 микрон; и
7) осаждение фильтрата, полученного на стадии (6) этанолом.
Производство и приготовление в виде препарата в крупном масштабе должны осуществлять только на партиях культуральной жидкости, в которой молекулярная масса HA превышает желаемое значение для высокой молекулярной массы HA, например, 3,0±0,6 мегадальтон.
Предпочтительно, способ производства в крупном масштабе должен давать продукт, в котором микробиологическая нагрузка равна нулю или по существу близка к нулю. Предпочтительно, чтобы нулевая или по существу близкая к нулю микробиологическая нагрузка должна достигаться к середине способа производства в крупном масштабе, например, от второй стадии растворения из вышеупомянутого способа. Выпавшую в осадок HA предпочтительно хранят под этанолом и затем сушат под вакуумом и хранят при 4°C в стерильных контейнерах для защиты произведенной в крупном масштабе HA от контаминации перед способом получения препарата.
Произведенная в крупном масштабе HA должна быть охарактеризована посредством оценки чистоты, молекулярной массы, вязкости, pH, удельного вращения, концентрации, % содержания HA и любых других необходимых параметров для того, чтобы проверить консистенцию и качество от партии к партии и тем самым оценить эффективность и пригодность данного способа производства в крупном масштабе. Предпочтительно, чистота произведенной в крупном масштабе HA является такой, что содержание эндотоксина составляет менее 0,25 МЕ/мл и более предпочтительно менее 0,10 МЕ/мл, и содержание белка составляет менее 1 мг/г, поглощение при 257 нм 1% раствор составляет менее 0,20, поглощение при окислительном взрыве при 550 нм составляет менее 0,10, и жизнеспособное количество аэробных бактерий составляет менее 4 KOE/г.Предпочтительно, качество произведенной в крупном масштабе HA является таким, что pH варьируется от 6,0 до 8,0, удельное вращение от 72,8° до 90,8°, число предельной вязкости составляет 2680-3410 мл/г, а молекулярная масса составляет 2,4-3,6×106 дальтон.
Поскольку HA по существу не поглощают при длинах волн выше 240 нм, любое значительное поглощение в диапазоне 240-300 нм обусловлено органическими загрязнениями, такими как белки и нуклеиновые кислоты. Поглощение при 257 нм указывает на загрязнение нуклеотидами, ДНК или РНК, в то время как поглощение при 280 нм указывает на загрязнение белками или аминокислотами. Поглощение при 257 нм ниже определенных пределов, например, 0,2, удобно использовать в качестве показателя чистоты HA. Измеренное поглощение, которое по существу близко к нулю, например менее 0,08, указывает на абсолютную чистоту.
Оценка чистоты дополнительно включает анализ очистки реагентов, например этанола, детергента, используемых в способе производства в крупном масштабе. Такие анализы удобно проводить с помощью ВЭЖХ и они должны указывать на существенное отсутствие реагентов.
Бактериальный эндотоксин (липополисахарид) можно определить количественно, например, с использованием кинетического турбидиметрического LAL анализа (смотри Yin и др. (1972) Biocim. biophvs. Acta. 261:284-289).
Воспалительный материал может быть оценен с использованием клеточного анализа мышиного перитонеального экссудата, который количественно характеризует активность окислительного взрыва после внутрибрюшинной инъекции исследуемого материала, например, как описано в патенте США №4780414.
Измеренное удельное вращение относится к характеристической, зависимой от концентрации Поляризации света HA в растворе. При данной концентрации степень поляризации при определенной длине волны является неотъемлемым свойством молекулы, характеризующейся ее константой удельного вращения [а], значения которой известны из научной литературы (Meyer et al. (1956) Biochim Biophvs Acta 21:506-518; Swann et al. (1968) Biochim Biophvs Acta 156:7-30).
Таким образом, концентрацию HA можно определить по следующей формуле:
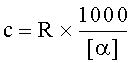
где R=измерение в градусах, проведенное поляриметром, и c=концентрация (г/л).
Концентрация HA также может быть определена посредством колориметрического карбазольного анализа (Bitter и Muir (1962) Anal. Biochem. 4:330-334), который основан на реакции карбазольного реагента и остатков глюкуроната HA, высвобождаемых после исчерпывающего гидролиза.
Молекулярную массу произведенной в крупном масштабе HA определяют с использованием предельного числа вязкости или собственной вязкости (выраженной в объеме на массу), полученных из вискозиметрических измерений и эмпирически установленного уравнения Марка-Хаувинка, как описано в примере I и в патенте США №4780414.
Абсолютные измерения молекулярной массы HA могут быть получены с помощью метода малоуглового лазерного светорассеяния (LALLS), как известно в данной области техники.
Вязкость раствора биополимера может быть измерена при дискретных скоростях сдвига, например, с помощью вискозиметра Брукфилда LVTD, а также при непрерывном спектре скоростей сдвига, например, с помощью ротационного вискозиметра Хааке.
После определения, что партия произведенной в крупном масштабе HA имеет достаточную чистоту, концентрацию, вязкость и молекулярную массу, можно приступать к способу получения в соответствии со способом по изобретению, и все стадии предпочтительно проводят в условиях чистого помещения. Произведенная в крупном масштабе HA наиболее предпочтительно находится в твердой форме, т.е. после осаждения и вакуумной сушки, так что, используя способ по изобретению, ее можно получить в желаемой среде, например буфере и эксципиентах.
Предпочтительно, биополимер не подвергается сушке замораживанием на какой-либо стадии производства или получения в крупном масштабе.
Соответствующее количество произведенной в крупном масштабе HA растворяют в подходящей среде для достижения подходящей концентрации, позволяющей осуществлять стерилизующую фильтрацию.
Подходящая среда для растворения биополимера включает буфер и/или основной эксципиент, находящийся в конечном препарате. Для биополимерных препаратов, предназначенных для инъекции, такой буфер или эксципиент предпочтительно должны быть физиологически приемлемыми. Подходящие среды включают хлорид натрия, забуференный фосфатами физиологический раствор и буферы, содержащие соли цитрат, бикарбонат, ацетат и бензалконий, включая соли металлов. Среда для растворения также может включать дополнительные эксципиенты, присутствиующие в конечном препарате, такие как хелатирующие агенты, агенты изотоничности, противомикробные агенты, противовирусные агенты, консерванты и поверхностно-активные вещества. Среда для растворения также может содержать дополнительные фармакологически активные агенты, такие как антибиотики, противомикробные препараты, противовирусные препараты, стероиды, нестероидные противовоспалительные лекарственные средства, глюкокортикоиды, факторы роста, простагландины, витамины, ферменты, ингибиторы ферментов, антиоксиданты, антигистаминные препараты, пролекарства, анестезирующие агенты, болеутоляющие вещества, антигипертензивные агенты и антиангиогенные агенты.
Для растворения биополимера подходящий сосуд заполняют водой для инъекции (WFI) (70-80% от конечного объема), имеющий температуру 4-50°C. Соответствующие количества реагентов среды (сухих или жидких) добавляют и перемешивают, после чего добавляют соответствующее количество произведенного в крупном масштабе биополимера. WFI добавляют к соответствующему конечному объему для получения раствора, в котором концентрация биополимера позволяет последующую стерилизующую фильтрацию. Способ перемешивания осуществляют до достижения полного растворения биополимера, обычно 10-36 часов для HA.
Возможно, эксципиенты могут быть добавлены к концу периода перемешивания, например, для предотвращения избыточного вспенивания поверхностно-активных веществ.
Соответствующий сосуд для растворения оснащен аппаратом для смешивания, таким как двойная спираль, и имеет вместимость в промышленном масштабе. Сосуд должен закрываться для защиты биополимера от природного и искусственного освещения, что позволяет избежать эффектов фотопотока. Кроме того, материал сосуда для растворения должен быть инертным в отношении биополимера.
Концентрация, полученная способом растворения, должна быть такой, которая делает возможной стерилизующую фильтрацию при промышленно приемлемой скорости потока (например, 750 мл/мин) посредством приложения давления (например, 10-15 фунтов на квадратный дюйм), которое не сказывается отрицательно на молекулярной массе биополимера.
Для НА с молекулярной массой примерно 3×106 дальтон соответствующая концентрация после растворения составляет менее 0,2%, например, 0,1-0,13%; 1,0-1,3 мг/мл.
В соответствии со способом по изобретению за растворением биополимера следует стерилизующая фильтрация с использованием соответствующего фильтра, расположенного в стерилизационном устройстве. Предпочтительно, сосуд для растворения и стерилизационное устройство физически соединены посредством соответствующих трубок и клапанов, которые являются съемными, модульными и стерилизуемыми. Устройства для растворения и стерилизации могут быть расположены в отдельных отсеках, соединенных системой трубок и клапанов, установленных через стенку, разделяющую отсеки. Стерилизационное устройство должно быть оснащено средствами для выполнения стерилизации на месте (SIP) и очистки на месте (CIP) соответствующих компонентов, таких как впускные и выпускные клапаны.
Фильтр стерилизационного устройства должен иметь абсолютный размер пор 0,05-0,2 мкм и должен быть проверен на удержание бактериальных и вирусных частиц с использованием соответствующих схем тестов. Фильтр также предпочтительно подобран для удержания частиц эндотоксина. Фильтр может быть гидрофильным или гидрофобным и может быть выбран на основе гидрофобности и заряда биополимера. Материалы, используемые для стерилизующих фильтров, включают, но не ограничиваются этим, полиэфирсульфон (PES), поливинилиденфторид (PVDF), политетрафторэтилен (PTFE), полипропилен, полиэтилен, полиамид, целлюлозу, ацетат целлюлозы, смешанные сложные эфиры целлюлозы или другие производные целлюлозы и нейлона. Производители подходящих стерилизационных фильтров включают, но не ограничиваются этим, Millipore, Meissner, Sartorius и тому подобное.
Фильтр предпочтительно размещают в картридже, предназначенном для промышленных целей. Такие картриджи обычно поставляются с различными длинами, чаще всего 10, 20 и 30 дюймов, и, соответственно, обеспечивают различные площади фильтрационных поверхностей. Например, 30 дюймовый Durapore™ 0,2 мкм (Millipore) фильтр-картридж обеспечивает площадь поверхности в 20700 см2.
В стандартном способе стерилизации раствора 0,1% NaHA используют гидрофильный 0,2 мкм фильтр-картридж длиной 30 дюймов, например, Durapore™ (Millipore) или Sartobran™ (Sartorius). Фильтрация проводится под давлением 10-15 фунтов на квадратный дюйм (69-103 кПа), а противодавление (back pressure) 1,5-2 бар (150-200 кПа) используют после каждых 15-20 л раствора. Следует поддерживать минимальный расход примерно 750 мл/мин. Фильтры должны быть подвергнуты условию выделения растворенного газа (bubble point) и диффузионному тесту до и после каждого использования. Фильтры можно использовать повторно после очистки и стерилизации в соответствии с рекомендациями производителя и проверки стерилизующих свойств повторно использованных фильтров.
Простерилизованный фильтрацией биополимер подается в устройство для концентрирования, которое соединено с устройством для стерилизации через соответствующую систему трубок и клапанов. Все точки входа и выхода из устройства для концентрирования должны быть оснащены средствами для выполнения SIP и CIP соответствующих компонентов.
Устройство для концентрирования оснащено ультрафильтрационной мембраной. Ультрафильтрационная мембрана может быть из керамики, полисульфона, полиэфирсульфона, ацетата целлюлозы, гидролизованного полиэфирсульфона (ПЭС) или поливинилиденфторида ПВДФ или мембраны из нержавеющей стали. Ультрафильтрационная мембрана может быть в виде пластины и рамки, полых волокон или спирально-намотанных конструкций. Подходящая керамическая мембрана может содержать оксид титана, оксид циркония, оксид алюминия, оксид кремния или их смеси. Ультрафильтрационная мембрана должна иметь размер пор от 0,002 до 0,1 мкм; и размер пор 50 нм является предпочтительным для НА.
Концентрированно посредством ультрафильтрации продолжается до достижения желаемой конечной концентрации биополимера, которая находится в диапазоне от 0,8 до 3,0% мас./об., например примерно 1,0% мас./об., примерно 1,2% мас./об. или примерно 2,0% мас./об. Например, желаемая конечная концентрация для NaHA составляет 1,0-2,0%; 10-20 г/л.
Эффективность способа ультрафильтрации может быть оценена путем определения концентраций биополимера в ультраконцентрате по сравнению с ультрафильтратом. Минимальная концентрация в ультрафильтрате, например, менее 1% по сравнению с концентрацией в ультраконцентрате, свидетельствует о приемлемом уровне эффективности.
После концентрирования до желаемой концентрации раствор биополимера может быть возможно перенесен в промежуточный резервуар, в котором осуществляют дегазирование и перемешивание с целью обеспечения однородности продукта.
Конечный полученный биополимерный продукт затем переносят в подходящий, автоматически наполняющий агрегат, в котором одинаковые аликвоты, например по 0,5 мл, 1,0 мл или 2,0 мл, используют для заполнения блоков подходящего устройства для стерильной упаковки или доставки, такого как флакон, шприц, катетер или небулайзер.
Полученный биополимер должен быть оценен в отношении ключевых параметров качества, в частности, молекулярной массы, концентрации, вязкости, осмоляльности, чистоты, содержания эндотоксина, поглощения, рН и бионагрузки, как это осуществляется для оценки произведенного в крупном масштабе биополимера. Также оценивают дополнительные параметры, связанные с конечным полученным продуктом, такие как возможность введения с помощью шприца и целостность упаковки.
Изобретение относится к получению стерильного вязкоэластичного биополимера, в частности гиалуроновой кислоты, и может быть использовано в медицине. Способ предусматривает стерилизующую фильтрацию произведенного в крупном масштабе биополимера посредством пропускания через мембрану, подходящую для стерилизующей фильтрации; и концентрирование стерильного биополимера посредством ультрафильтрации до концентрации от 0,8 до 3,0% мас./об. Причем концентрация растворимого, произведенного в крупном масштабе биополимера на стадии стерилизующей фильтрации составляет менее 0,2%. В одном из вариантов биополимер является растворимым. В одном из вариантов в качестве биополимера используют гиалуроновую кислоту. Изобретение позволяет получить высокоочищенный вязкоэластичный биополимер, подходящий для медицинского применения, при этом не разрушая структуру биополимера при стерилизующей фильтрации. 4 н. и 15 з.п. ф-лы.
1. Способ получения растворимого вязкоэластичного биополимера, включающий:
(1) стерилизующую фильтрацию растворимого, произведенного в крупном масштабе биополимера посредством пропускания через мембрану, подходящую для стерилизующей фильтрации; и
(2) концентрирование стерильного биополимера посредством ультрафильтрации до желаемой конечной концентрации,
где концентрация растворимого, произведенного в крупном масштабе биополимера на стадии (1) составляет менее 0,2%,
и где желаемая конечная концентрация находится в диапазоне от 0,8 до 3,0% мас./об.
2. Способ получения вязкоэластичного биополимера, включающий:
(1) растворение произведенного в крупном масштабе биополимера в физиологически приемлемой буферной среде для достижения разбавленной концентрации для стерилизующей фильтрации;
(2) стерилизующую фильтрацию произведенного в крупном масштабе биополимера путем пропускания через мембрану, подходящую для стерилизующей фильтрации; и
(3) концентрирование стерильного биополимера посредством ультрафильтрации до желаемой конечной концентрации, где концентрация растворимого, произведенного в крупном масштабе биополимера на стадии (1) составляет менее 0,2%,
и где желаемая конечная концентрация находится в диапазоне от 0,8 до 3,0% мас./об.
3. Способ получения вязкоэластичного препарата гиалуроновой кислоты, включающий:
(1) растворение произведенной в крупном масштабе гиалуроновой кислоты в физиологически приемлемой буферной среде для достижения разбавленной концентрации для стерилизующей фильтрации;
(2) стерилизующую фильтрацию растворенной произведенной в крупном масштабе гиалуроновой кислоты путем пропускания через мембрану с абсолютным размером пор 0,2 мкм; и
(3) концентрирование стерильной гиалуроновой кислоты посредством ультрафильтрации до желаемой конечной концентрации, где концентрация растворимого, произведенного в крупном масштабе биополимера на стадии (1) составляет менее 0,2%,
и где желаемая конечная концентрация находится в диапазоне от 0,8 до 3,0% мас./об.
4. Способ по п.1 или 2, где биополимер выбран из группы, состоящей из гомополисахарида, например карбоксиметилцеллюлозы, хитина, полиманнуроновой кислоты, камеди курдлана или декстрана, гетерополисахарида, например гиалуроновой кислоты, хондроитинсульфата, дерматансульфата, кератансульфата, гепарина, гепарансульфата, агара, альгината, каррагинана, геллановой камеди, гуаровой камеди, камеди бобов рожкового дерева или ксантановой камеди, и их смесей.
5. Способ по пп.1, 2 или 3, где биополимер или произведенная в крупном масштабе гиалуроновая кислота получены из источника, выбранного из группы, состоящей из биологического источника, ферментативного синтеза in vitro, химического синтеза и комбинаций двух или более таких источников.
6. Способ по п.5, где биологический источник выбран из группы, состоящей из бактерии, например штамма рода Streptococcus, например вида Streptococcus species, выбранного из группы, состоящей из Streptococcus equi. Streptococcus pyogenes, Streptococcus equisimilis, Streptococcus dysgalactiae и/или Streptococcus zooepidemicus, и/или штамма рода Streptococcus, который является негемолитическим и непатогенным, дрожжевой клетки, растения, амфибии, птицы и млекопитающего; или где биополимер или произведенная в крупном масштабе гиалуроновая кислота, которые получены из биологического источника, дополнительно включают химическую модификацию, например модификацию, выбранную из группы, состоящей из добавления сульфатных групп, добавления карбоксильных групп, добавления гидроксильных групп, добавления ацетильных групп, этерификации и поперечного сшивания.
7. Способ по п.1, 2 или 3, где вязкоэластичный биополимер или произведенная в крупном масштабе гиалуроновая кислота имеет среднюю молекулярную массу в диапазоне от 1·104 до 1·107 Да, например 3·106±0,6·106 Да.
8. Способ по пп.1, 2 или 3, где произведенные в крупном масштабе биополимер или гиалуроновая кислота выделены из культуральной жидкости от ферментированного штамма рода Streptococcus.
9. Способ по пп.1, 2 или 3, где уровень бактериального эндотоксина в произведенной в крупном масштабе гиалуроновой кислоте составляет менее 0,25 МЕ/мл; и/или где количество жизнеспособных бактериальных клеток в произведенной в крупном масштабе гиалуроновой кислоте составляет менее 100 KОЕ/г, например менее 50 KОЕ/г, например менее 10 KОЕ/г; и/или где уровень белка в произведенной в крупном масштабе гиалуроновой кислоте составляет менее 1 мг/г.
10. Способ по пп.1, 2 или 3, где концентрация растворимого, произведенного в крупном масштабе биополимера или произведенной в крупном масштабе гиалуроновой кислоты на стадии (1) составляет 0,10-0,13%; и/или где ультрафильтрацию осуществляют с использованием керамической мембраны; и/или где желаемая конечная концентрация составляет примерно 1,0% мас./об., примерно 1,2% мас./об. или примерно 2,0% мас./об.
11. Способ по пп.1, 2 или 3, дополнительно включающий асептическое наполнение биополимером или гиалуроновой кислотой подходящего упаковочного устройства, возможно где упаковочное устройство выбрано из группы, состоящей из шприца, флакона, катетера и небулайзера.
12. Способ по пп.1, 2 или 3, где полученный вязкоэластичный биополимер или гиалуроновая кислота имеют индекс псевдопластичности в диапазоне от 500 до 4000, возможно в диапазоне от 600 до 1200, например в диапазоне от 600 до 800.
13. Способ по пп.1, 2 или 3, где стерилизующую фильтрацию осуществляют с использованием мембраны с абсолютным размером пор 0,2 мкм.
14. Способ по п.2, где буферная среда содержит соль металла.
15. Способ по п.3, где все стадии выполняют в условиях чистой комнаты, и/или где произведенная в крупном масштабе гиалуроновая кислота получена способом, включающим:
(1) осаждение этанолом культуральной жидкости от негемолитического, непатогенного, продуцирующего гиалуроновую кислоту ферментированного штамма рода Streptococcus;
(2) растворение осадка, полученного на стадии (1), в смеси хлорид натрия/этанол/древесный уголь;
(3) осаждение растворенного материала, полученного на стадии (2), цетилпиридиния хлоридом;
(4) растворение осадка, полученного на стадии (3), в смеси хлорид натрия/этанол;
(5) обработку растворенного материала, полученного на стадии (4), силикатом магния;
(6) фильтрацию обработанного материала, полученного на стадии (5), через абсолютную мембрану 0,65 мкм; и
(7) осаждение фильтрата, полученного на стадии (6), этанолом.
16. Препарат вязкоэластичной гиалуроновой кислоты, полученной способом по п.3, подходящий для инъекции млекопитающим во время операции.
17. Препарат по п.16, имеющий индекс псевдопластичности более 600;
и/или имеющий среднюю молекулярную массу 3·106±0,6·106 Да;
и/или дополнительно содержащий лекарственное средство; и/или где гиалуроновая кислота химически поперечно сшита; и/или где гиалуроновая кислота образует комплекс с металлом.
18. Способ по любому из пп.1, 2 или 3, где полученные вязкоэластичный биополимер или гиалуроновая кислота являются стабильными и стерильными в течение по меньшей мере одного года.
19. Способ по любому из пп.1, 2 или 3, где не используют никаких консервантов в вязкоэластичном биополимере или гиалуроновой кислоте.
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| 0 |
|
SU308279A1 | |
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРАСТВОРИМЫХ СОЛЕВЫХ КОМПЛЕКСОВ ГИАЛУРОНОВОЙ КИСЛОТЫ (ВАРИАНТЫ) | 2005 |
|
RU2280041C1 |
Авторы
Даты
2013-12-20—Публикация
2008-11-12—Подача