Настоящее изобретение касается нового способа получения высокочистых фракций гиалуроновой кислоты и ее солей. Кроме того, данное изобретение охватывает специфическую фракцию гиалуроновой кислоты и ее соли, в частности ее натриевую соль, получаемую указанным способом и имеющую средний молекулярный вес в определенном специфическом пределе.
Гиалуроновая кислота (ГК) является типичным и очень важным представителем класса макромолекул, известных как гликозаминогликаны (мукополисахариды). ГК является биологическим полимером, который присутствует с идентичной молекулярной структурой во всех соединительных тканях организма позвоночных животных, где она играет структурную и биологическую роль в том отношении, что ее локальные концентрации строго коррелируются мышечным тонусом, трофическими явлениями и восстановлением ткани в случае ее повреждения. Обзорная работа по физиологической роли этих биологических веществ была опубликована в Phys. RW. (Comper W.D., Laurent T.C.) Физиологическая функция полисахаридов соединительной ткани. Phys. RW. 58 (I), 255 - 315, 1978 г). Физическая - химическая природа ГК является характерной для сахаридного биополимера (D-глюкороновая кислота и N-ацетилгликозамин), с поочередной полимеризацией, с образованием длинных неразветвленных молекулярных цепей, различающихся по молекулярному весу, достигающему максимального значения 8000000 Дальтон (Mayer K.,) Химическая структура гиалуроновой кислоты, Fed. Procud., 17, 1075, 1958; Laurent T.C. Химия и молекулярная биология межмолекулярной матрицы, 703 - 732, Academic Press., N.Y., 1970). Поведение данного биополимера в водном растворе таково, что гарантирует специфическое значение вязкости, называемое вязкоупругостью, которое является типичным для некоторых биологических жидкостей, таких как синовиальная жидкость, в которых ГК присутствует с концентрацией 0,12 - 0,24% Balazs E.A. и др. Гиалуроновая кислота и замена стекловидной и водой тканевой жидкости, Mod. Probl. Ophtal., 10, 3 - 21, 1972). Кроме того, обнаружено, что водная тканевая жидкость человеческого происхождения содержит ГК средней концентрации 1,14 мкг/г Laurent U.B.G.: Гиалуронат в водной тканевой жидкости человека. Arch Ophthalmol., 101, 129 - 130, 1983 ).
Собрано достаточное количество опубликованного материала, который показывает, что локальное введение экзогенной ГК имеет явные терапевтические и защитные преимущества при различных паталогических состояния соединительных и эпителиальных тканей, такие как:
- регенерация поврежденной ткани при незаживающих кожных язвах;
- артрозная дегенерация соединительных тканей суставов;
- главная хирургия.
Особенно ценным является способность ГК за счет ее вязкоупругих свойств покрывать ткани, подвергаемые риску повреждения при хирургических операциях. Как утверждают все хирурги, которые использовали ГК, присутствие вязкого слоя экзогенной ГК на тканях, наиболее сильноподвергаемых травматическим воздействиям, таких как роговица, оказывает защитное действие, которое в значительной мере способствует успешному осуществлению операции.
Как защитное, так и облегчающее состояние влияние на заживление ткани при воздействии эндогенной HA на роговицу было показано как на экспериментальных животных /Miller D. и др.: Использование гиалуроната натрия при имплантации внутриглазных хрусталиков у кроликов Ophthalmic. Surgery, 8,(6), 58 - 61, 1977; Miller D. и др. Использование гиалуроната натрия при аутороговичной трансплантации у кроликов. Ophthalmic. Surgery, 11, (1), 19 - 21, 1980; Graue E.L. и др. Защитное действие гиалуроната натрия на эндотелий роговицы. Exp. Eye. Ris, 31, 119 - 127, 1980; Ozaki L, и др. Защитное действие покрытых Геалоном внутриглазных хрусталиков на эндотелий роговицы. Folia Ophthalmologica Japonica, 32, 1301 - 1305; 1981), так и на человеке / Norm M. Предоперационная защита роговицы и соединительной оболочки глаза, Acta Ophthalmologica 59, 587 - 594, 1981; Polaсk F.M. и др. Гиалуронат натрия (Геалон) в кератопластике и имплантации 10 L внутриглазных хрусталиков, Ophthalmologyа, 88, 425 - 431, 1981).
Уже известны некоторые способы получения очищенной гиалуроновой кислоты и определенных фракций высокой степени чистоты, которые используются в терапии, например для указанных выше показаний.
Молекулярные фракции цельных гиалуроновых кислот, полученных непосредственно путем экстракции органических веществ, например из куриных гребешков, имеют молекулярные веса, изменяющиеся в широких пределах, например примерно от 90 - 80% до 0,2% от молекулярного веса цельной гиалуроновой кислоты, предпочтительно в пределах примерно от 5 до 0,2%. Эти фракции могут быть получены из цельных кислот с использованием гидролизующих, или окисляющих, или ферментных химических реагентов или посредством физических процессов, например механического воздействия или обучения, и в связи с этим в одинаковых процедурах очистки образуются первичные экстракты СМ., например, статью Balazs и др. в " Cosmitics and Toilitries." Italien edition N 5/84, стр.8 - 17). Отделение и очистка полученных молекулярных фракций осуществляется известными способами.
Так например, в патенте США N 4141973 описывается способ получения гиалуроновых кислот с молекулярным весом не менее 750000 Дальтон, которые могут использоваться в операциях на глаз ввиду их особой высокой степени чистоты и отсутствия воспалительных эффектов. Данный способ заключается в экстракции натриевой соли гиалуроновой кислоты из исходного материала, удалении кровяных остатков из используемых органов животных, извлечения белков из полученного экстракта, удалении вызывающих воспаление примесей, обработке продукта в водном растворе стерилизующим агентом и осаждении соли гиалуроновой кислоты из водного раствора органическим растворителем. Кровяные остатки удаляются этанолом, НА в форме ее натриевой соли (имеет форму, в которой она находится в исходных материалах) экстрагируется водой, удаление белков осуществляется путем обработки разбавленными кислотами и одновременно экстракцией гидролизованных частей хлороформом или посредством протеолитических ферментов, вредные вызывающие воспаление вещества удаляются путем экстракции хлороформом с величиной pH 6 - 7, и стерилизация осуществляется путем обработки цетилпиридинхлоридом. При таком способе единственно получаемая фракция гиалуроновой кислоты является фракцией, которая подробно описывается в данном патенте как фракция с молекулярным весом 1586000 Дальтон. В отношении химических, физических и биологических свойств данная молекулярная фракция гиалуроновой кислоты соответствует коммерческому продукту, известному под торговым названием "ГЕАЛОН".
Были разработаны новые способы, такие как молекулярная ультрафильтрация. Этим способом очистки можно удалять те фракции ГК, которые имеют молекулярный вес выше или ниже пределов диапазона молекулярных размеров. Так например, в патенте EPO N 01238752, выданном 27.7.1990, описывается способ получения фракций гиалуроната натрия со средними значениями молекулярного веса от 250000 до 350000 Дальтон путем прямой экстракции из данного продукта органических веществ и последующего удаления белков посредством папаина, с двумя молекулярными ультрафильтрациями через мембраны с отсечкой молекулярной фракции 30000 Дальтон, то есть через мембраны, которые улавливают лишь те фракции, которые имеют молекулярные веса более 30000 Дальтон. Этот этап фракционирования очень важен для получения продукта свободного от вторичных воздействий воспалительного характера, поскольку фракции, ответственные за эти эффекты, это фракции с низкими молекулярными весами, например примерно 30000 Дальтон. После последующей молекулярной фильтрации с использованием мембран с пределом исключения 200000 (то есть мембран, улавливающих фракции с молекулярными весами более 200000 Дальтон) полученный отфильтрованный продукт представляет собой фракцию (называемую в данном патенте ГИАЛАСТИНОМ) со средним молекулярным весом в пределах от 50000 до 100000 Дальтон, в то время как часть, оставшаяся на мембране, представляет собой фракцию гиалуроната натрия, которая имеет средний молекулярный вес в пределах от 500000 до 730000 (фракция, называемая ГИАЛЕКТИНОМ).
Настоящее изобретение охватывает другой способ получения фракции гиалуроновой кислоты, которая является высокочистой и имеет определенный диапазон значений молекулярного веса. Эта фракция находит интересное применение в глазной хирургии: данный продукт, безусловно, очень хорошо переносим, не вызывает воспалительных процессов и не вызывает послеоперационных осложнений. Кроме того, данный продукт имеет значительное преимущество в том, что может оставаться на месте после операции, не вызывая при этом послеоперационных осложнений, таких как слишком высокое глазное давление, снижая, таким образом, риск, связанный с его удалением, что практиковалось до сих пор. Эта новая фракция чистой гиалуроновой кислоты в форме ее натриевой соли, в последующем описании будет называться "ГК-1".
Согласно настоящему изобретению можно усовершенствовать процедуры очистки цельных гиалуроновых кислот или их солей, особенно щелочных солей, таких как прежде всего натриевая соль, путем конверсии этих кислот или солей в четвертичные аммониевые соли данного типа. Такое солеобразование может осуществляться в любой из стадий процедуры очистки. Поскольку эти четвертичные аммониевые соли легко растворимы в некоторых органических растворителях, таких как апротонные растворители, особенно, например, N-метилпарролидон, они могут быть экстрагированы такими растворителями из водной фазы, обеспечивая таким путем специальную и дополнительную очистку наряду с примерами, описанными ранее, операция, которая ответственна за степень чистоты продуктов, получаемых в конце данной процедуры. Конверсия гиалуронового компонента в четвертичные аммониевые соли может осуществляться, например, путем обработки водного раствора натриевой соли, содержащего другие соли, такие как, особенно, NaCl, с использованием реактора или колонны, заключающей в себе макромолекулярный сульфоновый ионообменный агент в форме соли, образуемой с четвертичным аммониевым основанием, например, смолу DOWEX M-15, приготовленную в форме тетрабутиламмониевой соли, получаемой путем обработки сульфоновой смолы гидроокисями четвертичного аммония, например гидроокисью тетрабутиламмония. Аммониевая соль проходит в элюат и полностью элюируется ионообменным агентом с водой. Этот водный экстракт выпаривается досуха, и остаточный продукт, состоящий из аммониевой соли полисахарида, растворяется в одном из указанных выше растворителей, после чего нерастворимые твердые фракции фильтруются. Таким образом, способ, отвечающий данному изобретению, в его более общем аспекте, отличается очисткой гиалуроновой кислоты или одной из ее молекулярных фракций или одной из ее солей путем их конверсии в соответствующую четвертичную аммониевую соль с заместителями низшими (C1-6) алифатическими гидрокарбидами.
Кроме того, способ, отвечающий данному изобретению, отличается вводом четвертичной аммониевой соли гиалуроновой кислоты или ее молекулярных фракций в органический растворитель, который способен растворять такие соли, и извлечением из фильтрованного раствора гиалуроновой кислоты или ее молекулярной фракции в форме металлической соли, и, при желании, дальнейшей очисткой полученной соли, уже известным способом. Таким образом, настоящее изобретение касается использования четвертичных аммониевых солей гиалуроновых кислот как в процедурах экстракции полисахарида из органов животного и из общих экстрактов, в которых очистка согласно данному изобретению может осуществляться в любой подходящей стадии данной процедуры, включая операции, в которых осуществляются фрагментация и разделение молекулярных фракций, так и в дальнейших процедурах обработки этих фракций и в последующих операциях очистки уже выделенных фракций, чистых или нечистых, новых или уже известных.
Как говорилось выше, конверсия полисахарида гиалуроновой кислоты может осуществляться в любой нужной стадии очистки, и специалисты в данной области в состоянии сами выбрать, когда это нужно сделать в каждом конкретном случае в соответствии с критериями, диктуемыми определенной комбинацией различных известных этапов, которые были выбраны. Эти обычные известные этапы включают в основном и в общих аспектах следующие:
1) Экстракцию полисахарида (в основном и предпочтительно в форме натриевой соли) из органов животного, предварительно измельченных и гомогенизированных. Обычно это осуществляется с использованием органического растворителя, который может смешиваться с водой, например алифатического спирта или низшего алифатического кетона (C1-6), таких как этанол или ацетон.
2) Удаление беловых веществ путем экстракции подходящими растворителями или путем выпаривания водного раствора экстракта, полученного в 1) c протеалитическим ферментом, таким как папаин, пепсин, тригсин или преназа, в присутствии буферного раствора, например хлоргидрата цистеина - фосфата.
3) Диализ полученного согласно (1) или (2) экстракта.
4) Стерилизацию раствора, полученного в любой из предыдущих стадий, известными бактерицидами, например цетилпиридинхлоридом в растворе хлорида натрия. Эта операция обычно повторяется несколько раз.
5) Разделение фракций полисахарида гиалуроновой кислоты или их соответствующих солей с различными молекулярными весами, или, соответственно, удаление нежелаемых фракций, например с предельными значениями молекулярного веса, то есть значениями молекулярного веса, далекими от нужного диапазона молекулярного размера. Эта операция осуществляется предпочтительно путем молекулярной ультрафильтрации, например, уже известным приемом.
б) Извлечение очищенной фракции или соответствующей соли (например, натриевой соли) из водного раствора путем осаждения подходящим органическим растворителем, например спиртом.
Последовательность осуществления этих этапов, и, возможно, других, которые уже ранее были использованы или разработаны специалистами в данной области, может в значительной мере изменяться. Таким специфическим этапом согласно данному изобретению является этап солеобразования ионов четвертичного аммония, который может быть введен и успешно осуществлен с ожидаемым огромным техническим эффектом.
Аммониевая соль полисахарида может быть непосредственно выделена из ионообменной смолы с помощью вышеупомянутых растворителей, которые способны растворять такие соли, как те, что указаны далее, но предпочтительнее соль аммония сначала экстрагируется водой и выпаривается досуха. Выделенная таким образом соль аммония вводится в вышеупомянутые растворители, и затем раствор фильтруется.
Один из путей осуществления способа данного изобретения заключается в комбинации операций в указанном выше порядке между этапами 2) и 3). Не считая известных приемов очистки и специфического этапа, отвечающего данному изобретению, то есть конверсии металлической соли гиалуроновой кислоты в четвертичные аммониевые соли, согласно следующему аспекту данного изобретения можно использовать хелатообразующие агенты для ионов железа, предпочтительно в указанном выше этапе экстракции 1). Фактически известно, что ионы железа, всегда присутствующие в экстрактах исходной гиалуроновой кислоты, полученных из кровяных остатков используемых органов животных, ответственны за процессы дополимеризации полисахаридной молекулярной цепи. Удаление металлических ионов, как доказано, очень важно для получения фракции гиалуроновой кислоты с относительно высоким молекулярными весами, и это может быть достигнуто путем хелатеобразования. Осуществляя такой прием, можно не только получать гиалуроновые кислоты или их соли с возможно высокими молекулярными весами, но и получить особо чистые продукты, стойкие в водных растворах благодаря полному отсутствию указанных ионов железа.
Таким образом, предпочтительным объектом настоящего изобретения является способ, отличающийся экстракцией органов животных, содержащих гиалуроновую кислоту и/или одну из ее солей, органическим растворителем, который может быть смешан с водой в присутствии хелатообразующих агентов для ионов железа, вводом предварительно высушенного осадка этих промывок в водном растворителе в присутствии протеолетического агента и соответствующего буфера и пропусканием этого раствора, предварительно освобожденного от твердых остатков, через ионообменный препарат, состоящий из макромолекулярной ионообменной смолы в форме одной из ее четвертичных аммониевых солей с радикалами низшего (С1-6) алифатического углеводорода. Элюат, экстрагированный из этой ионообменной смолы, затем высушивается и растворяется в органическом растворителе, способном растворять четвертичные аммониевые соли гиалуроновой кислоты и ее фракции. Аммониевая соль затем превращается в натриевую соль путем добавления водного раствора галогенида натрия, например хлорида или бромида натрия, в органический раствор. Полученный таким путем водный раствор натриевой соли затем экстрагируется органическими растворителями, которые не могут быть смешаны с водой, и при желании подвергается повторному диализу. Полученный раствор затем обрабатывается стерилизующим агентом, и при желании полученный раствор после стерилизации может подвергаться ультрамолекулярной фильтрации. Затем любые нежелаемые фракции полисахарида гиалуроновой кислоты удаляются, и желаемые фракции гиалуроната натрия извлекается уже известными приемами.
Растворители, используемые согласно данному изобретению для растворения четвертичных аммониевых солей, представляют собой апротонные растворители, такие как N-алкилпирролидоны, в частности N-метилпирролидон, диалкилсульфоксиды, диалкилкарбоксиламиды, такие как низшие (C1-6) диалкилсульфоксиды, особенно диметилсульфоксиды, и низшие (C1-6) диалкиламиды низших (C1-6) алифатических кислот, такие как диметил- или диметилформадид- или диметил- или диацетилацетамид.
Тетраалкиламмониевые основания, используемые для получения ионообменной смолы, и, следовательно, характерные аммониевые соли гиалуроновой кислоты согласно данному изобретению представляют собой основания, образуемые с низшими алифатическими радикалами, предпочтительно алкилами, содержащими 1 - 6 атомов углерода. Предпочтение отдается использованию смолы, образующей соль с тетрабутиламмонием.
В указанных выше комбинациях, используемых для процедур экстракции, очистки и выделения гиалуроновых кислот или их молекулярных фракций и их солей, и в частности в указанной выше комбинации, которая является предпочтительной процедурой согласно данному изобретению, желательно использование указанных ниже агентов:
(a) для экстракции исходного материала из органов животного: этанол или ацетон.
(b) в качестве хелатообразующего агента для ионов железа: 1,10 - фенантродин или диметиловое производство.
(c) в качестве протеолитических агентов: те, что указаны выше.
(d) в качестве растворителей для четвертичных аммониевых солей: N - метилпирролиден или диметилсульфоксид.
(e) в качестве растворителя для очистки водного экстракта натриевой соли, полученной из органического раствора аммониевой соли: хлористой метилен, этилацетат.
(f) в качестве стерилизующего агента: цетилпиридинхлорид в присутствии фосфатного буферного раствора.
(g) в качестве органического растворителя для осаждения натриевой соли из очищенного водного раствора, возможно после ультрафильтрации этанол.
В указанные выше процедуры возможно вносить изменения, которые могут способствовать успешному получению еще более чистого конечного продукта. Так например, использование стерилизующих агентов указанного выше типа, то есть четвертичных аммониевых солей с гетероциклическим кольцом, и содержащих длинноцепные алкилы (например цитил), например, цетилпиридинхлорида, может одновременно служить этапом очистки, поскольку ввод их в раствор гиалуроната натрия приводит к образованию соответствующей аммониевой соли с ионом гиалуроновой кислоты. Эти соли осаждаются в водном растворе, и такая обработка дает возможность получать, путем последовательных повторных осаждений промывок осадков и последующего растворения в растворе NaCl, раствор гиалуроната натрия, из которого должны выделяться ультрачистые продукты. Эти продукты особенно полезны в глазной хирургии.
Молекулярная ультрафильтрация осуществляется уже известным приемом. Используются мембраны, например, улавливают фракции с более высокими молекулярными весами, например более 200000 Дальтон, и если желательно, отдельные фракции могут быть извлечены как из отфильтрованного продукта, так и из мембраны. Особенно интересный прием осуществления способа данного изобретения заключается в комбинации указанных выше операций очистки с молекулярной ультрафильтрацией, которая удаляет гиалуроновые фракции с низкими молекулярными весами. Такие фракции, как установлено, ответственны за инициирование воспалительных эффектов при их присутствии в продуктах терапевтического назначения, как это сообщается о фракциях, описанных в указанном выше патенте EPO N 0138572, выданном 25.7.1990.
Следующим предпочтительным объектом данного изобретения является описанный выше способ, заключающий в себе специфическую комбинацию операций очистки, в котором как обязательный этап осуществляется молекулярная ультрафильтрация для удаления молекулярных фракций с низким молекулярным весом, особенно фракций с молекулярным весом менее, чем 30000. При осуществлении данной процедуры, или если говорить еще более точно, при осуществлении процесса, иллюстрированного на примерах 1 и 2, получается фракция гиалуроната натрия, которая является очень ценной с терапевтической точки зрения и которая, как уже говорилось вначале, носит название ГК-1. Она особенно интересна для использования в хирургии глаза.
Гиалуроновые кислоты, описание в имеющейся литературе и рекомендованные для использования в операциях на глаза, не отвечают критериям абсолютного совершенства, особенно ввиду того, что они не могут оставаться на месте после хирургической операции, например после операции катаракты, ввиду присутствия как остатков или следов, вызывающих воспаление веществ, так и компонентов со слишком высоким молекулярным весом, а следовательно с чрезвычайно большой вязкостью. Кроме того, они могут вызвать, как указывалось ранее, нежелательное и опасное увеличение глазного давления.
Экзогенная ГК, введенная в переднюю полость в процессе операции, не должна вызывать отрицательных эффектов на послеоперационное внутриглазное давление и не должна вызвать воспалительных явлений во внутриглазном окружении. Первый отрицательный эффект неоднократно описывался в литературе после использования очень высокомолекулярной ГК, имеющей чрезвычайно высокую вязкость Binkhorst C.D. Воспаление и внутриглазное давление после использования Геалона в хирургии, связанной с внутриглазными хрусталиками. Am Intra - Owlar implant. Soc. J. 6,(4), 342 - 343, 1980; Pape L. G. Внутрикапсуларный и внекапсуларный способ имплантации хрусталиков с Геаленом. Am. Intra - Owlar implant. Soc.J. 6,(4), 342 - 343, 1980; Passo M. S. и др. Внутриглазное давление после хирургии катаракты с использованием Геалона ARVO Abstracts 10, 10:45, 1981; Pereival P. и др.
Практическое использование хрусталиков Boberg Ans и гиалуроната натрия (Гиалонида) Trans. Ophthal . Soc. UK, 102, (2): 294 - 297 , 1982; Mc Rac S. M. и др.: Влияние гиалуроната натрия, сульфата хондрантина и метилцеллюлозы и эндотелий роговицы и внутриглазное давление (Ann. J. Ophthalmol. 95, 332 - 341, 1983).
Приведение практические работы позволили дать рекомендацию удалять данное вещество путем промывки физиологическим солевым раствором после операции. Berson и др. (Berson F.G. и др. Непроходимость водного оттока за счет гиалуроната натрия в энуклеированном человеческом глазе. Am. J. Ophthalmol 95, 668 - 672, 1983) изучали механизм данного нежелательного явления в энуклеированном человеческом глазе после операции, и они считают, что основной причиной этого явления является механическая закупорка дренажной системы в передней полости за счет чрезвычайно высокой вязкости вводимого вещества.
Фракция гиалуроната натрия, которая описывается в патенте США N 4141973, Balazs и имеющая молекулярный вес 1586000 (см. колонку 13 этого патента) является веществом, которое в отношении его физико-химических и биологических свойств является наилучшим для глазных операций продуктом на современном рынке. Он известен под названием "Геалон" и не лишен указанных выше недостатков. В частности, его молекулярный вес чрезвычайно высок и, следовательно, он имеет нежелательно высокую вязкость для некоторых глазных операций.
В самом деле, хотя осуществляемые в данном патенте испытания (для измерения противовоспалительного эффекта) дали хорошие результаты, геалон не может быть оставлен на поверхности послехирургического вмешательства, например после операции катаракты, так как он может вызвать послеоперационные осложнения, такие как повышение глазного давления.
В патенте США 4920104 Dale P. De Vore (принадлежащем Mid. Chem. Products, Mc. Acton Mass) описан и заявлен вязкоупругий раствор гиалуроната натрия в физиологическом солевом растворе, который имеет кинематическую вязкость от 45000 до 64000 сСт и содержит гиалуронат натрия со среднемолекулярным весом в пределах от 1000000 до 2000000 Дальтон. Этот продукт также заявлен для использования в хирургических операциях на глазах, где он может быть использован более успешно, чем другие препараты, благодаря его мизерным послеоперационным побочным эффектам, особенно таким, как повышение послеоперационного глазного давления.
Однако этот продукт также должен быть удален после хирургического вмешательства, как можно заметить из таблиц 2 и 3 в колонке 4 настоящего патента, тогда как таблица 1 показывает, что глазное давление поднимается после хирургического вмешательства, если продукт не удален с поверхности.
В Европейском патенте N 0138572 описывается другая фракция гиалуроната натрия, предназначенная для использования в офтальмологии, которая имеет средний молекулярный вес, изменяющийся в пределах от 500000 до 730000 Дальтон (Гиалектин). Обычно она может использоваться для замены эндобулярных жидкостей, а также в операциях на глаза, таких как катаракта и введение глазных имплантантов. Однако имеется потребность в продуктах с более высокими вязкоупругими свойствами, которые в состоянии сохранять правильные интервалы в передней полости в ходе операции для противобаланса стекловидной реакции с тем, чтобы оказывалось эффективное защитное действие на эндоокулярную структуру без их удаления после операции. Как уже было сказано ранее, данные продукты с высокими молекулярными весами, описанные в имеющейся литературе и используемые в указанных операциях на глаза, должны всегда удаляться после операции. Достоинство настоящего изобретения заключается в том, что разработан оригинальный способ получения фракций гиалуроната натрия с относительно высоким молекулярным весом путем ввода хелатообразующих агентов для ионов железа в экстракционный раствор, что предотвращает, таким образом, дополимеризацию в фракции с низким молекулярным весом, свободные от тех примесей или фракций, которые не позволяют удалить данный продукт в организме. Эта новая фракция согласно данному изобретению, называемая фракцией ГК-1, обладает признаком новизны и является этапом к прогрессу в данной области науки.
Фракция "ГК-1", согласно данному изобретению, получаемая по способу, описанному в примерах 1 и 2, имеет следующие свойства:
- Вязкость: Показатель статической вязкости в пределах от 14,5 до 21 дл/г, измеренный в вискозиметре Убеллоде при 25oC в 0,15 М NaCl с величиной pH 7,0. Эта вязкость соответствует молекулярному весу в пределах от 750000 до 1230000 Дальтон (предпочтительно в пределах от 925000 до 1230000 Дальтон).
- Содержание белка: Содержание белка в расчете на альбумин не превышает 0,2% при измерении согласно испытанию Lowry/Lowry J. и др. Определение белка с использованием реагента фолинфенола. J.Biol. Chem. 193, 265 - 275, 1951).
- Ультрафиолетовый спектр: Спектр ультрафиолетового поглощения, определяемый при 257 нм и 280 нм, не превышает 1,0 A.U. при измерении в водной растворе концентрацией 1% (вес./об.).
- Динамическая вязкость: Динамическая вязкость 1%-ного вес./об. раствора в 0,15 М NaCl при величине pH 7,0, не превышает указанные ниже пределы при определенных скоростях сдвига. Используется ротационный вискозиметр, описанный, например, в публикации U.S. Pharmacopia XXXII ed., (911) стр.1619. Температура измерения составляет 20oC.
Скорость сдвига - Динамическая вязкость (мПа • с при 20oC)
1 сек-1 - Не более чем 20000 мПа • сек
10 сек-1 - Не более чем 2000 мПа • с
100 сек-1 - Не более чем 1000 мПа • с
350 сек-1 - Не более чем 500 мПа • с
Сульфатированный мукополисахарид: Содержание его не превышает 0,07% в расчете на серу, при определении на приборе с индукционно связанной плазмой (I.C.P.) с использованием подходящего вещества в качестве стандарта.
- Железо: Содержание железа не превышает 10 ч./млн. при определении методом спектрального атомного поглощения или методом I.C.P.
- Стабильность: Стабильность буферных изотонических растворов (со значением pH физиологического раствора) фракции НА-1, подвергнутых естественному старению и тепловой стерилизации, измеренная путем определения показателя статической вязкости и выраженная как соответствующее понижение среднего молекулярного веса, не превышает указанных ниже предельных значений
- 97% от исходного значения (хранение при 25oC в течение 6 месяцев)
- 75% от исходного значения стерилизации при 118oC в течение 32 минут)
- 80% от исходного значения стерилизации при 121oC в течение 16 минут)
- 90% от исходного значения стерилизации при 124oC в течение 8 минут).
Гиалуроновая фракции ГК-1 наилучшего качества согласно данному изобретению может быть получена при осуществлении указанных выше экспериментов.
Внутриглазная переносимость фракции ГК-1 у обезьян
Данное испытание проводилось с целью оценки офтальмологической переносимости обезьян после инъекции ГК-1 в стекловидное тело глаза.
1. Испытуемый вид
Шесть молодых зрелых женских особей обезьян циномолгус (Макака фаспикулярис) использовались в этом испытании. Они обладали хорошим здоровьем и не имели выявленных повреждений глаз.
Приматы были выбраны для данного испытания, потому что они считаются лучшим видом для изучения офтальмической переносимости вязкоупругого продукта, используемого в офтальмической хирургии.
Были выбраны обезьяны циномолгус, потому что обезьяны Доурокоу лис, которые ранее использовались для изучения офтальмической переносимости, являются сейчас исчезающим видом и взяты под официальную защиту.
2. Экспериментальные группы и их обработка.
Обозначение группы и уровни доз.
Обезьяны обрабатывались единожды согласно таблице 1.
3. Приготовление и применение смеси.
В день операции обезьяны были анестезированы гидрохлоридом кетамина, разбавленным пентабарбиталом натрия. Затем зрачки были расширены локальным вводом 1,0% тропикамида /Mydriacyl, alcon laboratories/. Роговица, коньюктива, придатки и передний сегмент исследовались с помощью лампощелевого биомикроскопа, а задний сегмент с помощью непрямого офтальмоскопа. Перипалцебральная оболочка была приготовлена для хирургического вмешательства путем использования двух промываний и промыванием напором струи 0,5% повидонйода и стерильного солевого раствора. Стерильная хирургическая простыня и векорасширитель были зафиксированы, а сфера стабилизирована с помощью небольших зубных щипцов. Острое и прямое рассечение использовалось для формирования коньюктивного лоскута, базирующегося на конечности, на расстоянии примерно 10 мм от верхней конечности и параллельно ей, и примерно 10 - 15 мм длиной. Рассечение было проведено через коньюктивную и тенонову капсулу к эписклере. Этот лоскут был приготовлен передним рассечением до конечности, экспонирующей нижележащую склеру, перекрывающую парс плана. На расстоянии примерно 5 - 6 мм от конечности был наложен интрасклеральный матрацный шов 7 - 0 Vicyrl /Ethicon/ со следом примерно 3 мм в сторону.
Использовалась игла 25-го размера для аспирации 0,5 мл стекловидного тела (для двух животных оказалось возможным аспирация только 0,4 мл); это стекловидное тело было замещено равным объемом НА-12 (12 кг/мл) или стерильным солевым раствором. Матрацный шов был обезопасен от возможного просачивания и коньюктивный лоскут заменялся. Было произведено локальное применение антибиотической мази. Осуществляли определение стекловидных клеток в аспирированном стекловидном теле, используя гомоцитометр перед введением и примерно через 48 часов после него.
4. Наблюдение и регистрация.
Примерно через 48 часов после хирургической операции животных анестезировали и осуществляли офтальмоскопическое исследование. Анестезию, делатацию и исследование осуществляли как описано выше. Исследование осуществляли слепым методом, независимо от того, осуществляли ли инъекцию в исследуемый глаз ГК-1 или контрольного материала. Глазные параметры оценивались как показано в стандартной ключевой классификации для глазной оценочной шкалы, приведенной ниже.
Отек конъюктивы, инъекция и выделение; отек роговицы, гем и воспалительная гипермия:
0 = нормальные
+1 = слабые
+2 = умеренные
+3 = сильные или чрезвычайно сильные
Прозрачность стекловидного тела:
0 = прозрачное
1 = слабое помутнение - видимое глазное дно
2 = умеренное помутнение - едва видимое глазное дно
3 = помутнение - красный рефлекс глазного дна
4 = помутнение - серый рефлекс глазного дна
5 = глазное дно невидимо
Глаза препарировали для аспирации с использованием раствора повидонйода, как описано выше. Устанавливали глазное зеркало, и глазное яблоко стабилизировали небольшим зубным иглодержателем. Стекловидное тело (0,1 - 0,2 мл) аспирировалось непосредственно через конъюнктиву и склеру на расстоянии 6 мм от конечности в верхнем височном квадранте. Следили за тем, чтобы был исключен исходный участок хирургического воздействия. Вызывающие воспаление клетки рассчитывали с использованием гемацитометра. Снова наносилась локальная антибиотическая мазь.
РЕЗУЛЬТАТЫ
Данные, представленные в таблице 2, показывают, что НА-1 очень хорошо переносима и не дает никакого глазного раздражения по сравнению с контрольным препаратом (физиологическим солевым раствором).
Двое животных из группы, подвергнутой обработке солевым раствором, показали слабую водную инфильтрацию клеток и воспалительную гипермию. Контрольные значения лейкоцитов стекловидного тела составляли от 10 до 60 на мм3. Один глаз, подвергнутый инъекции НА-1, показан слабую водную инфильтрацию клеток и воспалительную гипермию. Число лейкоцитов стекловидного тела в подвергнутых испытанию глазах составляло от 0 до 30 на мм3.
Таким образом, проведя сопоставления с контрольными экспериментами с физиологическим солевым раствором, можно сделать вывод, что ГК-1 очень хорошо переносима глазными тканями после внутривитреального вытеснения.
Клиническое исследование с целью определения эффективности ГК-1 в сравнении с ГЕАЛОНОМ в хирургии для внекапсулярной катаракты с имплантацией внутриглазных хрусталиков задней полости.
Описанные ниже эксперименты проводились с целью оценки эффективности и безопасности ГК-1 по сравнению с основными пользующимися спросом на рынке вязкоупругими материалами (ГЕАЛОНОМ) при удалении катаракты и имплантации внутриглазных хрусталиков на двух клинических исследованиях. В первом клиническом исследовании проводили испытание ГК-1 и ГЕАЛОНА в одинаковых экспериментальных условиях (в обоих случаях осуществлялась аспирация после хирургической операции). Во втором исследовании основное внимание уделялось безопасности ГК-1 в отношении повышения послеоперационного внутриглазного давления и расчету числа эндотелиальных клеток: во втором исследовании (в котором в отличие от первого оба вязкоупругих материала аспирировались после хирургического воздействия) ГК-1 не удалялась при завершении хирургической операции, в отличие от ГЕАЛОНА, который аспирировался из глаза.
Моделью для проведения обоих исследований являлась оценка ГК-1 в сопоставлении с Геалоном при удалении внекапсулярной катаракты с имплантацией внутриглазных хрусталиков задней полости, осуществляемая из произвольно выбранной параллельной группы невидимым наблюдателем (наблюдения осуществлялись отдельными исследователями). В каждом исследовании могли быть выбраны пациенты с первичным диагнозом старческой катаракты в возрасте старше 18 лет.
В частности:
в первом исследовании было отобрано 217 пациентов, и рандомизация осуществлялась с обработкой препаратами в соотношении примерно 3 : 1 (161 пациент с обработкой ГК-1 и 56 пациентов с обработкой Геалоном).
Оба вязкоупругих материала аспирировались после хирургического воздействия.
Период исследования охватывал предхирургическую оценку, процедуру операции и период, следующий непосредственно после операции. В данном исследовании измеряли глазное давление через 3 часа после операции и в последующих экспериментах через 1, 7 и 30 дней после операции.
Во втором клиническом исследовании были отобраны и рандомизированы пациенты с обработкой препаратами ГК-1 и Геалоном в соотношении примерно 1 : 1, то есть 45 пациентов с обработкой ГК-1 и 46 пациентов с обработкой Геалоном. В данном исследовании НА-1 не аспирировались после хирургического воздействия, в отличие от Геалона, который аспирировался, как описано в первом исследовании.
Период исследования (и соответственно материал исследования на ГК-1) был таким же, как описан выше в первом исследовании.
В данном исследовании послеоперационное внутриглазное давление измеряли через 1, 3, 6 и 9 часов после операции (чаще, чем в первом исследовании) и последующие измерения осуществлялись через 1, 7, 30 и 90 дней после операции. В данном исследовании использовалась также зеркальная микроскопия начиная с отсчетного момента и в период по прошествии 90 дней после операции.
Осуществлялись статистические анализы для оценки сопоставимости основной и обрабатываемой группы (альфа = 0,10) и безопасности и эффективности (альфа = 0,05). Для оценки данных осуществлялись точные испытания Фишера, t - испытания, описательные статистические анализы.
Всего исследовалось 308 пациентов (см. табл. 3).
Никаких существенных различий в отношении демографических, медицинских или катарактных характеристик между двумя обрабатываемыми группами в обоих исследованиях не обнаруживалось.
Предоперационная подготовка и методы.
Хирургическая операция осуществлялась исследователем стандартным хирургическим приемом удаления неосложненной старческой внекапсулярной катаракты с трансплантацией внутриглазных хрусталиков задней полости. Предоперационные (профилактические) лекарственные лечения, анестезия и другие способы лекарственного лечения осуществлялись стандартными приемами, но без использования глазных гипотензивных средств. Прединцизионное внутриглазное давление, насколько возможно, снижали посредством понизителя внутриглазного давления Хонана "Супер Пиики" или мануального ручного способа. Использовались вязкоупругие материалы (ГК-1 и Геалон), как будет описано ниже.
Продукты удалялись после хирургической операции за исключением ГК-1, используемой во втором клиническом испытании; ГК-1 оставалась на месте.
Как ГК-1, так и Геалон вводились в переднюю полость таким образом, чтобы облегчить хирургическую операцию и защитить глазные ткани, в частности:
1-е исследование:
- среднее количество используемой ГК-1 (0,56% при концентрации 12 мг/мл) было значительно больше количества используемого Геалона (0,439 мл при концентрации 10 мг/мл) даже если это различие составляло лишь 0,129 мл.
2-е исследование:
- не было никакого значительного различия между средними количествами используемых вязкоупругих материалов: в этом случае средние количества составляли 0,957 (для ГК-1) и 0,833 (для Геалона).
Проводились нижеследующие испытания до, в процессе и после хирургической операции:
(a) Предшествующая хирургической операции оценка осуществлялась, например, с использованием следующих методов:
- определение остроты зрения (наилучшее проявление), применение тонометрии, метода пахиметрии (для определения толщины роговицы) и щелевого лампового микроскопа и проведение офтальмоскопического исследования,
- метод зеркальной микроскопии (лишь второе исследование): осуществляли расчет числа эндотелиальных клеток с использованием зеркального микроскопа в 10 выбранных точках роговицы. Каждое значение корректировали с использованием соответствующего коэффициента и в результате получали число клеток на квадратный миллиметр, и это значение усредняли, получая типичное значение числа клеток на квадратный миллиметр.
(b) Послеоперационные оценки, такие как:
- определение внутриглазного давления (методом тонометрии) осуществлялись:
- через 3 часа после операции (1-е исследование);
- через 1 - 3 - 6 - 9 часов после операции (2-е исследование).
Офтальмоскопические исследования и исследования с помощью щелевого лампового микроскопа, исследования методами пахиметрии, тонометрии, зеркальной микроскопии (лишь во втором исследовании на определение числа эндотелиальных клеток) и определение остроты зрения (при последующих исследованиях, осуществлялись:
- через 1 - 7 - 30 дней в первом исследовании;
- через 1 - 7 - 30 - 90 дней во втором исследовании.
1. Оперативная оценка - определение характеристик используемых вязкоупругих материалов.
Вязкоупругие характеристики материалов оценивались по облегчению имплантации хрусталиков при использовании подвергаемых обработке групп в обоих клинических исследованиях в сопоставимых пропорциях.
2. Послеоперационные осложнения.
2a) Первое клиническое исследование.
Как можно видеть из таблицы 4:
- Наибольший процент осложнений (у 7,9% всех пациентов) наблюдается в период между хирургической операцией и первым днем, а наименьший процент наблюдается через 7 и 30 дней.
- В первый послеоперационный день число обработанных Геалоном пациентов, имеющих осложнения (14,3%), превышала в 2,5 раза число имеющих осложнения пациентов, обработанных ГК-1 (5,7%). Это различие статистически значительно (p = 0,079y при точном 2-хвостовом определении). Различие на 7 и 30 дни статистически незначительно (p > 0,6 при точном 2-хвостовом определении Фишера).
Осложнения включают повышение внутриглазного давления до 30 мм рт.ст. и более 7/158 = 4,4% пациентов, обработанных ГК-1, 5/56 = 8,9% пациентов, обработанных Геалоном) и отек роговицы, воспаление радужки, конъюнктивит, гифему, отекшее пятно роговицы, истечение из ранки, циклитную оболочку и подконъюнктивальное кровотечение.
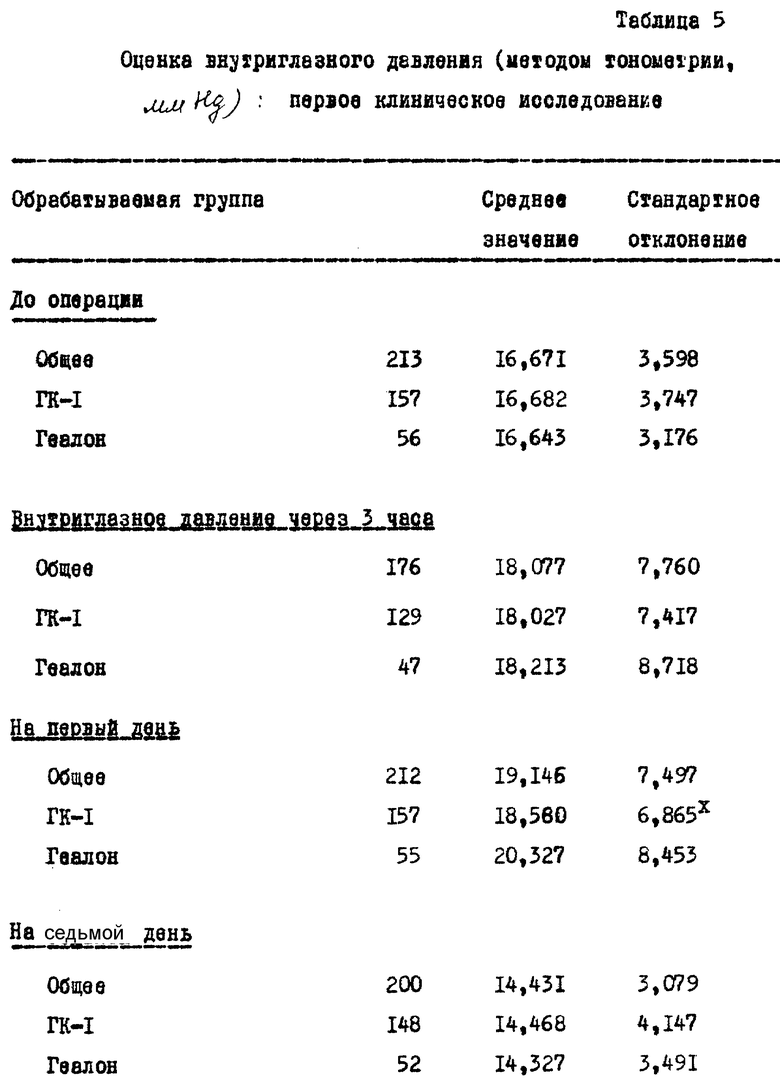
Как видно из таблицы 5, в которой представлены данные тонометрии, полученные в предхирургический и послеоперационный периоды (через 3 часа и через 1 - 7 - 30 дней):
- Никакого значительного различия среднего внутриглазного давления между обрабатываемыми группами не было; однако у пациентов, обработанных Геалоном, повышение среднего внутриглазного давления как через 3 часа, так и через 1 день было больше, и стандартное отклонение внутриглазного давления у этих пациентов было значительно больше, чем у пациентов, обработанных ГК-1, через 1 день.
Исследование методом щелевого лампового микроскопа пахиметрии /для определения толщины роговицы/ и офтальмоскопии не обнаружили различия между двумя группами.
2b) Второе клиническое исследование.
- Послеоперационные осложнения у обработанных Геалоном пациентов (37,0%) несколько превышало послеоперационные осложнения у пациентов, обработанных ГК-1 (26,6%) (таблица 6). Осложнения включали повышение внутриглазного давления 5/42 = 11,9% пациентов, обработанных ГК-1, 11/46 = 23,9% пациентов, обработанных Геалоном), в случае гифемы, истечения из раны, кровотечение из стекловидного тела, помутнение задней капсулы, расщепление сосудистой оболочки глаза, атрофию радужной оболочки глаза и отекшее пятно роговицы.
- Две обрабатываемые группы не отличались статистически ни в отношении средних значений внутриглазного давления, ни в отношении изменчивости внутриглазного давления как в начальный момент, так и в любой момент времени, начиная с 1 дня по 90-й день (таблица 7). Как обнаружено, в течение первых девяти часов после операции Геалон (удаленный из глаза) и ГК-1 (оставалась на месте) приводили к послеоперационному распределению внутриглазного давления, которое отличалось прежде всего в отношении стандартных отклонений. Обработанные Геалоном пациенты имели значительно более высокие стандартные отклонения и значительно более высокую среднюю величину через 1 час после операции, и обработанные ГК-1 пациенты имели более высокие, но лишь в ограниченной степени значительные стандартные отклонения через 6 и 9 часов после операции. Через 1 час после операции, 22,7% обработанных Геалоном пациентов и 10% обработанных ГК-1 пациентов имели внутриглазные давления 21 мм рт. ст. и более. Через 6 часов и через 9 часов после операции сравнимые количественные соотношения пациентов, обработанных ГК-1 (73,2% через 6 часов и через 9 часов после операции сравнимые количественные соотношения пациентов, обработанных ГК-1 (73,2% через 6 часов и 65,0% через 9 часов) и пациентов, обработанных Геалоном (68,2% через 6 часов и 71,4% через 9 часов) имели внутриглазное давление 21 мм рт.ст. и более.
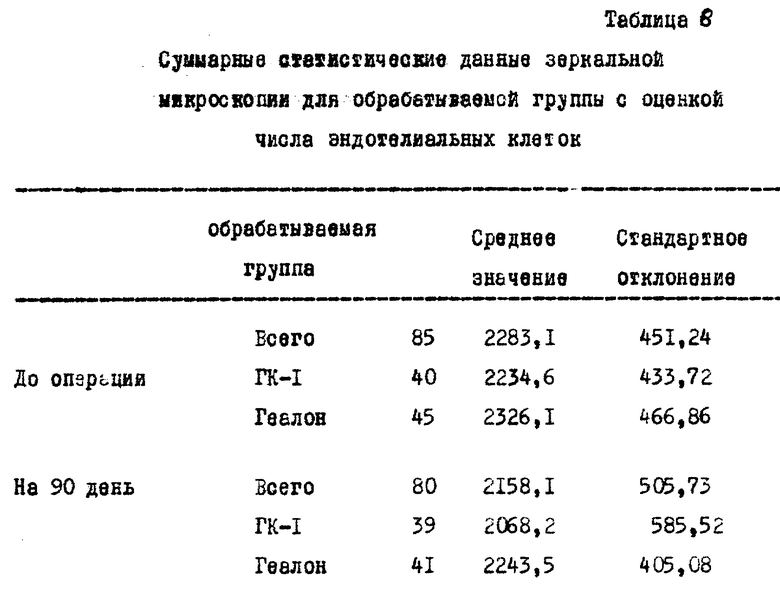
- Никакого различия между двумя исследуемыми группами в отношении наблюдений, изложенных в первом исследовании, не наблюдалось. Аналогичным образом зеркальная микроскопия (число эндотелиальных клеток) не показала значительных различий (таблица 8).
Определение остроты зрения показало, что эффективность двух вязкоупругих материалов сопоставима, в частности:
В первом клиническом исследовании:
Не наблюдалось никакого значительного различия между количественным соотношением обработанных Геалоном (77,8% и обработанных ГК-1 (84,7) пациентов, у которых была достигнута острота зрения 20/40 на 30-й день.
Во втором клиническом исследовании:
Не наблюдалось никакого значительного различия между количественным соотношением обработанных Геалоном пациентов (73,9%) и обработанных ГК-1 пациентов (71,4%), которые достигли остроты зрения 20/40 или более на 30-й день. На 90-й день эти соотношения были почти одинаковы.
Результаты двух описанных здесь клинических исследований показывают значительную эффективность использования ГК-1 при удалении катаракты и имплантации внутриглазных хрусталиков. В частности, показано, что ГК-1 хорошо переносима. Фактически данный продукт вызывает меньше послеоперационных осложнений /примерно в 2,5 раза меньше), чем Геалон, испытываемый в тех же условиях, то есть с удалением данного препарата после операции/ как описано для первого клинического исследования). Из числа послеоперационных осложнений особое внимание следует обратить на повышение внутриглазного давления.
Следует также отметить, что в обоих исследованиях послеоперационное течение болезни у пациентов, обработанных ГК-1 и Геалоном, отличалось в отношении внутриглазного давления. В первом исследовании, в котором ГК-1 и Геалон удалялись после операции, более высокая доля пациентов, обработанных Геалоном, обнаружила увеличение внутриглазного давления за пределы 21 мм рт.ст на первый день, по сравнению с долей пациентов, обработанных ГК-1. Во втором исследовании, когда ГК-1 не удаляли после операции, в отличие от Геалона, профили изменения послеоперационного внутриглазного давления для ГК-1 были сопоставимы.
Таким образом, можно сделать вывод, что в некоторых отношениях эти два вязкоупругих продукта сопоставимы, хотя они отличаются в отношении послеоперационных осложнений: Геалон, удаляемый с глаза, приводит к более сильному повышению внутриглазного давления, чем ГК-1, удаляемый с глаза, и в случае, когда ГК-1 остается на месте после операции, профиль изменения внутриглазного давления сопоставим с профилем изменения давления в случае удаления Геалона после операции. Исходя из этих результатов следует, что наиболее важной особенностью является возможность сохранения на месте ввода ГК-1, и это не вызывает послеоперационных осложнений. Такая возможность сохранения на месте ГК-1 позволяет достигнуть следующие преимущества:
1. Упрощает хирургическую операцию, поскольку исключается этап удаления данного препарата после операции.
2. Уменьшает риск осложнений за счет подготовительных процедур/то есть в процессе аспирации/. Примерами такого риска является травма в результате хирургических операций и связанные с ней последствия.
Настоящее изобретение касается также фармацевтических препаратов, содержащих в качестве активного ингредиента новую молекулярную фракцию гиалуроновой кислоты в форме натриевой соли, НА-1, особенно в форме солевых растворов с нейтральной величиной pH. Выбранная концентрация НА-1 такова, что достигается желаемая степень вязкости, например, достигается вязкость примерно 300 МПа сек / при 350 сек-1) и примерно 10000 сек (при 1 сек-1).
Кроме того, настоящее изобретение касается использования новой фракции (ГК-1) гиалуроната натрия для глазной хирургии, особенно в операциях катаракты или имплантации хрусталиков.
Настоящее изобретение иллюстрируется нижеследующими примерами.
Пример 1
Процедура получения фракции ГК-1 и определение ее характеристик
Куриные гребешки, либо свежие, либо замороженные (3000 г) тонко измельчаются в мясорубке и тщательно гомогенизируются в механическом гомогенизаторе. Полученная паста помещается в стеклянную емкость вместе с 10 объемами безводного ацетона или этанола, содержащего 0,1% (вес./об.) специфического хелатообразующего агента), образующего комплекс с железом).
Примерами используемых хелатообразующих агентов являются 1,10-фенантролин или его диметиловые производные. Стеклянные емкости и специфические хелатообразующие агенты используются для того, чтобы исключить процесс деполимеризации натриевой соли гиалуроновой кислоты, который в противном случае может быть вызван ионами железа от стальных емкостей или кровяных остатков.
Куриные гребешки обрабатываются до тех пор, пока не происходит полное извлечение ионов железа (контроль с помощью приборов: Спектр поглощения комплекса железо - хелатообразующий агент в фазе ацетона или этанола в 1-ом ячейках при длине волны, соответствующей максимальному поглощению 510 нм, в случае 1,10-фенантролина не более, чем 0,005 A.U.).
Последующий процесс промывки осуществляется с использованием тех же объемов безводного ацетона (или этанола) с целью удаления каких-либо остаточных хелатообразующих агентов. Данные обработки осуществляются до тех пор, пока результаты последующего испытания "A" не станут отрицательными.
- Испытание "A": Пять миллилитров ацетона (или этанола) выпаривается путем пропускания умеренного потока азота. Остаточный продукт выпаривания растворяется в 5 мл воды и измеряется спектр поглощения при длине волны, соответствующей максимальному поглощению хелатообразующего агента.
Испытание считается отрицательным, когда спектр поглощения менее, чем 0,1 A.U.
Конечный продукт реакции перемешивается в течение 6 часов со скоростью 50 об. /мин и отстаивается с целью отделения в течение 12 часов, после чего растворитель отсасывается и удаляется.
Процесс этой экстракции повторяется до тех пор, пока влажность удаленного растворителя не достигнет правильного нужного значения (при определении методом Карла - Фишера).
Полученный продукт затем центрифугируется и подвергается сушке в вакууме при подходящей температуре в течение 5 - 8 часов. Выход продукта в данном процессе в форме сухого порошка составляет 500 - 600 г.
Затем 300 граммов сухого порошка подвергается процессу ферментного вываривания вместе с 0,2 граммами подходящего протеолитического агента (папаина, пепсина, трипсина или проназы) в буферной водной среде с фосфатным буфером с использованием такого количества хлоргидрата цистеина, чтобы отношение его к сухому порошку составляло от 20 : 0,01 до 20 : 1. Эта смесь затем перемешивается в течение 24 часов со скоростью 60 об./мин при постоянной температуре 60 - 65oC. Вся масса охлаждается до 25oC с добавлением 60 граммов Целита, и перемешивание продолжается дополнительно в течение часа.
Полученная смесь фильтруется до тех пор, пока не получается прозрачная жидкость.
Этот водный раствор, разбавленный до 2 мг/мл дистиллированной водой, вводится в колонку, наполненную макромолекулярной ионообменной смолой DOWEX M-15, полученной в форме тетрабутиламмония (TBA+) путем обработки гидратом окиси тетрабутиламмония.
Раствор, алюированный из колонки, выпаривается и высушенный остаточный продукт выпаривания растворяется в подходящем объеме N-метилпирролидона (или диметилсульфоксида) до достижения концентрации 2 мг/мл.
Полученный раствор фильтруется, охлаждается при 4oC и к нему добавляется равный объем воды. Осуществляются три последовательные промывки с использованием хлористого метилена, и каждый раз удаляется самая нижняя фаза. Затем верхняя фаза обрабатывается бромидом натрия (NaBr используется вместе с гиалуроновой кислотой в отношении 3 : 1) при температуре 4oC, водный раствор осаждается путем добавления трех объемов этанола, и осадок промывается несколько раз этанолом. Этот осадок солюбилизируется в воде, и полученный раствор подвергается диализу. Этот раствор доводится до 0,1 М путем добавления хлорида натрия, и температура доводится до 50oC. Вводится 45 граммов цетилпиридинхлорида, и одновременно этот продукт перемешивается со скоростью 60 г/мин. Эта смесь перемешивается в течение 60 мин, после чего вводится 50 г Целита. В процессе перемешивания температура продукта снижается до 25oC, и образующийся осадок извлекается путем центрифугирования. Полученный таким путем осадок суспензируется в 0,01 М растворе хлорида натрия (5 литров), содержащего 0,05 цетилпиридинхлорида. Он перемешивается еще в течение 60 минут при 50oC. Температура снижается до 25oC, и осадок центрифугируется.
Затем процесс промывки повторяется три раза, и конечный осадок собирается в трехлитровых емкостях с 0,05 М раствором хлорида натрия, содержащим 0,05% цетилпиридинхлорид. Этот продукт перемешивается со скоростью 60 г/мин в течение 60 минут и поддерживается при постоянной температуре 25oC в течение двух часов. Всплывший слой удаляется путем центрифугирования.
Данная процедура повторяется несколько раз с использованием 0,1 М раствора хлорида натрия, содержащего 0,05% цетилпиридинхлорида. Данная смесь центрифугируется, и всплывший слой удаляется. Осадок диспергируется в 0,30 М растворе хлорида натрия, содержащем 0,05% цетилпиридинхлорида в соотношении 3 : 1.
Смесь перемешивается и осадок и прозрачная жидкость собираются. Экстракция осадка повторяется три раза, каждый раз с использованием 0,5 литра того же водного раствора.
Осадок удаляется, и прозрачная жидкость собирается в одной емкости. При перемешивании температура этой жидкости повышается до 50oC. Эта жидкость затем доводится до 0,23 М посредством хлорида натрия. Вводится 1 грамм цетилпиридинхлорида, и перемешивание осуществляется в течение 12 часов. Смесь охлаждается до 25oC, затем фильтруется, сначала через набивку из Целита, а затем через фильтр (1 мкм).
Полученный раствор подвергается молекулярной ультрафильтрации через мембрану с исключением молекул мол. весом 30000, осуществляется ультрафильтрация 3 исходных объемов с добавлением 0,33 М раствора хлорида натрия. Вводимый раствор хлорида натрия суспензируется, и объем жидкости снижается до четвертой части от ее первоначального объема.
Концентрированный таким путем раствор осаждается при перемешивании (60 г/мин) при температуре 25oC тремя объемами этанола (95%). Осадок извлекается путем центрифугирования, и поверхностный слой удаляется. Этот осадок растворяется в 1 литре 0,1 М раствора хлорида натрия, и процедура осаждения повторяется с тремя объемами 95%-ного этанола.
Этот осадок собирается и промывается, сначала 75% этанолом (три раза), затем абсолютным этанолом (три раза) и в третий раз абсолютным ацетоном (три раза).
Полученный таким путем продукт (фракции ГК-1) имеет средний молекулярный вес в пределах от 750000 Дальтон до 1230000 Дальтон (предпочтительно в пределах от 925000 до 1230000).
Выход гиалуроновой кислоты составляет 0,6% от исходной свежепрепарированной ткани.
Конечный продукт, полученный как описано выше, имеет нижеследующие свойства:
- Молекулярный вес: 1000000 Дальтон.
- Показатель предела вязкости: в пределах от 14,5 до 21 дл/г, при измерении при 25oC в 0,15 М NaCl при величине pH 7,0 с использованием вискозиметра Убелоде. Это соответствует среднему молекулярному весу в пределах от 750000 Дальтон до 1230000 Дальтон (предпочтительно в пределах от 925000 до 1230000 Дальтон).
- Содержание белков: не превышает 0,2% в расчете на Альбумин, при определении методом анализа Лоури /Lowry J. и др: Определение белка с использованием реагента фолинфенола, J.Biol.Chem., 193, 265 - 275, 1951).
- Спектр ультрафиолетового поглощения при 257 нм и при 280 нм не превышает 1,0 A.U. при измерении в 1%-ном (вес./об.) водном растворе.
- Динамическая вязкость 1%-ного раствора (вес./об.) в 0,15 М NaCl при pH 7,0, не превышает нижеследующие предельные значения, определяемые по скоростям сдвига с использованием ротационного вискозиметра, того, что описан в U. S. Pharmocopia XXII ed. (911) стр.1619, при температуре 20oC
Скорость сдвига - Динамическая вязкость (мПа • с при 20oC)
1 с-1 - Не более чем 20000 МПА • с
10 с-1 - Не более чем 2000 мПА • с
100 с-1 - Не более чем 1000 МПА • с
350 с-1 - Не более чем 500 мПА • с
- Содержание сульфатированного микополисахарида в расчете на серу не превышает 0,07% при определении на приборе с индукционно связанной плазмой /I.C.P./ с использованием подходящего стандартного вещества/
- Содержание железа не превышает 10 ч//млн/ при определении по спектру атомного поглощения или способом I.P.C.
Проведено сопоставительное исследование для сравнения фракции ГК-1 и растворов натриевой соли гиалуроновой кислоты, полученных в промышленных масштабах, в отношении содержания в них железа.
Полученные результаты (таблица 9) ясно показывают различные содержания железа: фракциz ГК-1 имеет намного более низкое содержание железа, чем другие продукты
Таблица 9
Содержание железа (ч./млн.) y ГК-1 в равнении с другими продуктами:
Железо, ч./млн.: ГК-1 <10; Образец A 130; Образец B 120; Образец C 40,
где образец A соответствует SODIEHIM (Партия 154);
образец B соответствует BIOCHEMO (Партия 542),
образец C соответствует BIOTECHNOLOGY GENERAL (Партия B-25).
Содержание железа определяли примерно на 0,5 г вещества, которое прокаливалось в платиновом тигле, и остаточный продукт снова растворяли в HNO3 (0,1 М);
стабильность изотонических буферных растворов с pH фракции НА-1, равной pH физиологического раствора, естественного старения с термической стерилизацией, определяли по измерению показателя статической вязкости, и она была выражена как соответствующее снижения среднего молекулярного веса и не превышала следующих значений: 97% от исходной величины (хранение при 25oC в течение 6 месяцев); 75% от исходной величины (стерилизация при 118oC в течение 32 минут; 80% от исходной величины (стерилизация при 121oC в течение 16 минут) 90% от исходной величины (стерилизация при 124oC в течение 8 минут).
Проводили сопоставительное исследование для сравнения изотонического буферного раствора со значением pH НА-1, равного pH физиологического раствора, с аналогичными растворами гиалуроновой кислоты, полученными в промышленных масштабах, с целью определения стабильности в следующих условиях:
- естественное старение (хранение в течение 6 месяцев при комнатной температуре)
- термическая стерилизация в различных условиях.
Использовались материалы фармацевтического назначения и оборудование, которые уже проявили себя надежными для описанных целей.
Использовались, в частности:
Бесцветные стеклянные пробирки со следующими характеристиками:
- стекло: боросиликатное стекло типа 1 (согласно Ph. Eur. lled)
- минимальная толщина стенки: 0,90 мм
- максимальная толщина стенки: 1,00 мм
- стопорные стержни изготовлены из галобутилового каучука со следующими характеристиками:
- тип эластомера: хлорбутил
- инертный наполнитель: каолин
- пигменты: диоксид титана и сажа
- вулканизирующий агент: оксид цинка
- характеристики выделения: согласно Ph. Eur. lled. YI.2.3.1.
- алюминиевые перекрытия с защелкой
- вода для инъекции (согласно Ph. Eur. lled)
Использовались реагенты аналитической степени чистоты.
Для стерилизации использован автоклав Fedеgari модели FOF5 суперспектра.
Показатель статической вязкости определяли в вискозиметре типа Убеллоде с суспензионной средой при температуре 23oC в 0,15 М NaCl и величине pH 7,0.
Соответствующий средний молекулярный вес вычислялся по формуле Марка-Хоуинка (H.Mark: J. Electrochemic, 40, 499, 1934; R.Houwink: J.Prakt. Chem., 157, 15, 1940).
Значения среднего молекулярного веса были выражены как проценты от начальной величины для лучшей оценки тенденций к деполимеризации. Полученные результаты (таблицы 10 и 11) показывают, что НА-1 имеет большую стабильность (по крайней мере в два раза больше), чем стандартные образцы (см. таблицу 9), которые имеют значительно большее содержание железа, чем НА-1.
В таблице:
- Образцы A, B и C те же самые, что использовались для определения содержания железа.
- Обработке подвергались растворы примерно 10 кг/мл каждого продукта в 0,9% (вес./об.) раствора NaCl в 0,002 М фосфатном буфере с величиной pH 7,5;
а) естественное старение при 6-месячной выдержке при комнатной температуре (25oC) в темноте, с контролем через 3 месяца (см. таблицу 10).
в) Стерилизация в автоклаве при следующих условиях:
- Т = 118oC в течение 32 минут (указано как Iс)
- Т = 121oC в течение 16 минут (указано как IIс)
- Т = 124oC в течение 8 минут (указано как IIIс)
с контролем в начале и в конце каждого состояния.
Пример 2
Процедура получения фракции ГК-1 и определение ее характеристик
Куриные гребешки, как свежие, так и замороженные (3000 г), измельчаются в мясорубке и затем тщательно гомогенизируются в механическом гомогенизаторе. Полученная паста обрабатывается в стеклянной емкости четырьмя объемами 95%-ного этанола, содержащего 0,1% (вес./об.) специфического хелатообразующего (связывающего железо в комплекс) агента.
Примерами хелатообразующих агентов являются 1,10-фенантролин (С.А. R.N. 66-71-7) или его диметиловые производные.
Стеклянные емкости и специфические связывающие железо хелатообразующие агенты используются с целью устранения процесса деполимеризации натриевой соли гиалуроновой кислоты, которая в противном случае может быть вызвана ионами железа от стальных емкостей или кровяных остатков.
Куриные гребешки обрабатываются до полного удаления ионов железа (контроль с помощью приборов: определение спектра поглощения комплекса железо-хелатообразующий агент в фазе ацетона или этанола в 1-см ячейках при длине волны, соответствующей максимальному поглощению (510 нм, в случае 1,10-фенантролина не более чем 0,005 A.U.). Дальнейший процесс промывки осуществляется с использованием таких же объемов безводного ацетона (или этанола) для удаления любого остаточного хелатообразующего агента. Данные обработки осуществляются до тех пор, пока результаты последующего испытания "A" не станут отрицательными.
- Испытание "A": осуществляется выпаривание 5 мл фазы ацетона (или этанола) посредством умеренного потока азота. Остаточный продукт выпаривания растворяется в 5 мл воды и измеряется спектр поглощения при длине волны, соответствующей максимальному поглощению хелатообразующего агента.
Испытание рассматривается как отрицательное, когда спектр поглощения менее чем 0,1 A.U.
Конечный продукт реакции перемешивается в течение 6 часов со скоростью 50 об. /мин и отстаивается для разделения в течение 12 часов, после чего растворитель отсасывается и удаляется.
Этот процесс экстракции повторяется до тех пор, пока удаленный растворитель не достигает нужного значения влажности (по методу Карла-Фишера).
Затем полученный продукт центрифугируется и высушивается в вакууме при подходящей температуре в течение не менее чем 8 часов.
Выход продукта в данном процессе в форме сухого порошка составляет 500 - 600 граммов.
Затем 300 граммов этого сухого порошка подвергается ферментному вывариванию с 0,2 граммами подходящего протеолитического агента (папаина, пепсина, трипсина или проназы) в водной буферной среде с фосфатным буфером, с использованием хлоргидрата цистеина в таком количестве, чтобы отношение его к сухому порошку составляло от 20 : 0,01 до 20 : 1. Затем эта смесь перемешивается в течение 24 часов со скоростью 60 об./мин при постоянной температуре 60 - 65oC. По окончании реакции вводится 60 граммов Целита, и вся смесь перемешивается дополнительно в течение часа. Полученная смесь фильтруется до тех пор, пока не получается прозрачная жидкость.
Вводится 45 граммов цетилпиридинхлорида с одновременным перемешиванием со скоростью 60 об./мин. Смесь перемешивается в течение 60 минут, после чего вводится 50 г Целита.
Образуемый таким путем осадок извлекается путем центрифугирования, и он суспензируется в растворе 0,01 М NaCl (5 литров), содержащем 0,05% цетилпиридина.
Перемешивание осуществляется в течение 60 минут при температуре 50oC, затем раствор доводится до температуры 25oC, и осадок центрифугируется.
Процедура промывки повторяется три раза. Осадок извлекается и собирается в 3-литровых емкостях с 0,05 М раствором хлорида натрия, содержащим 0,5% цетилпиридинхлорида.
Перемешивание осуществляется со скоростью 60 об./мин, в течение 60 минут, и затем раствор выдерживается при постоянной температуре 25oC в течение двух часов. Прозрачная всплывшая на поверхность фаза удаляется путем центрифугирования.
Данная процедура повторяется дважды с растворами 0,1 М хлорида натрия, содержащего 0,5% цетилпиридинхлорида. Смесь центрифугируется, и верхняя (всплывшая) фаза удаляется. Осадок диспергируется в растворе 0,30 М хлорида натрия, содержащего 0,05% цетилпиридинхлорида (3 литра).
Смесь перемешивается, и осадок и прозрачная жидкость извлекаются. Осадок экстрагируется второй раз с использованием 1,5 литра того же водного раствора.
Прозрачные жидкости собираются в одну емкость и подвергаются молекулярной ультрафильтрации через мембраны с исключением молекул с мол. весом 30000 Дальтон, затем они концентрируются до объема, составляющего третью часть от исходного объема.
Концентрированный раствор обрабатывается ионообменной макромолекулярной смолой Dowex M-15, полученной в форме тетрабутиламмония (ТВА) и перемешивается в течение ночи.
В суспензию вводится подходящий объем N-метилпирролидона до тех пор, пока не будет достигнуто отношение NMP - H2O 70/30 (об./об.). Затем эта смесь фильтруется, и смола удаляется.
Далее в раствор вводится подходящее количество NaCl и величина pH доводится до >7,5 посредством 1 М NaOH, и этот раствор двукратно промывается хлористым метиленом (CH2Cl2), каждый раз с удалением нижней фазы. Верхняя фаза осаждается при перемешивании со скоростью 60 об./мин при температуре 25oC с тремя объемами этанола (95%).
Осадок извлекается путем центрифугирования, и верхняя фаза удаляется.
Осадок извлекается и промывается, сначала 75%-ным этанолом, затем абсолютным этанолом и наконец ацетоном.
Затем промытый продукт высушивается в вакууме в течение не менее чем 20 часов при температуре 25oC. Высушенный продукт солюбилизируется в воде с осуществлением принципа обратного осмоса, так чтобы получался раствор концентрацией >1 мг/мл. Вводится подходящее количество хлорида натрия так, чтобы получалась молярность от 0,1 до 0,4, и этот раствор подщелачивается 1 М NaOH. Затем этот раствор фильтруется через стерилизующие фильтры.
Раствор осаждается тремя объемами этанола (95%) при перемешивании (60 об./мин) при температуре 25oC.
Осадок выделяется центрифугированием и верхняя фаза удаляется.
Осадок собирается и промывается сначала 75% этанолом, затем - абсолютным этанолом и наконец ацетоном.
Промытый продукт сушится в вакууме в течение не менее 50 часов при температуре 25oC.
Полученный таким образом продукт имеет молекулярный вес 1180000.
Примеры фармацевтических препаратов
Представленные ниже примеры описывают, только лишь с целью иллюстраций, возможно фармацевтические препараты для терапевтического использования фракции ГК-1.
Рецептура 1: 2-мл ампулы, каждая ампула содержит, мг:
натриевую соль гиалуроновой кислоты (ГК-1) - 24,0
одноосновный фосфат натрия 2H2O - 0,1
двухосновный фосфат натрия 12H2O - 1,2
хлорид натрия - 17,0
воду для инъекции до объема - 2,0
Рецептура 2: стерильные, готовые для наполнения 1,1-мл шприцы, каждый шприц содержит, мг:
натриевую соль гиалуроновой кислоты (ГК-1) - 20,0
хлорид натрия - 9,350
одноосновный фосфат натрия 2H2O - 0,055
двухосновный фосфат натрия 12H2O - 0,660
воду для инъекции до объема - 1,1
Рецептура 3: 0,2- мл емкость одной дозы, каждая емкость содержит, мг:
натриевую соль гиалуроновой кислоты (НА-1) - 400,0
хлорид натрия - 440,0
одноосновный фосфат натрия 2H2O - 5,0
двухосновный фосфат натрия 12H2O - 60,0
воду для инъекции до объема - 100,0
Рецептура 4: 0,2-мл емкость одной дозы, каждая емкость содержит, мг:
натриевую соль гиалуроновой кислоты (НА-1) - 200,0
хлорид натрия - 670,0
хлорид калия - 250,0
одноосновный фосфат натрия 2H2O - 5,0
двухосновный фосфат натрия 12H2O - 60,0
воду для инъекции до объема - 100,0
Рецептура 5: 5-мл склянки, каждая склянка содержит, мг:
натриевую соль гиалуроновой кислоты (НА-1) - 200,0
хлорид натрия - 670,0
хлорид калия - 250,0
одноосновный фосфат натрия 2H2O - 5,0
двухосновный фосфат натрия 12H2O - 60,0
этилртутьтиосалицилат натрия - 5,0
воду для инъекции до объема - 100,0
Описанное таким образом изобретение может осуществляться различными путями. Такие варианты его осуществления не следует рассматривать как отклонение от сферы действия и объема изобретения, и все эти модификации, как должно быть ясно для специалиста в данной области, охватываются приведенной ниже формулой изобретения.











Высокочистая фракция гиалуроновой кислоты или ее соли со средним м.в. 750000-123000 Дальтон, содержанием белка не более 0,2% в расчете на альбумин и ультрафиолетовым поглощением при 257 нм и при 280 нм, не превышающим 1,0 A. U. , при измерении в 1% (вес./об.) водном растворе (другие характеристики фракции см. в п. 1 ф-лы изобретения) проявляет высокую эффективность при удалении катаракты и имплантации внутриглазных хрусталиков. 9 с. и 17 з.п. ф-лы, 11 табл.
а) показатель статической вязкости в пределах 14,5 - 21 дл/г при определении при 25oC в 0,15 М NaCl при рН 7,0 с использованием вискозиметра Убеллоде с суспензионной средой;
в) динамическая вязкость 1%-ного раствора (вес./об.) в 0,15 М NaCl при рН 7,0 не превышает указанных ниже предельных значений при определенных скоростях сдвига, с использованием ротационного вискозиметра при температуре 20oC;
Скорость сдвига - Динамическая вязкость (мПа • с при 20oC)
1 с-1 - Не более чем 20000 мПа • с
10 с-1 - Не более чем 2000 мПа • с
100 с-1 - Не более чем 1000 мПа • с
350 с-1 - Не более чем 500 мПа • с
с) содержание сульфатированного мукополисахарида не превышает 0,07% в расчете на серу;
d) содержание железа не превышает 10 ч./млн;
е) стабильность изотонических буферных растворов с величиной рН данной фракции такой же, как у физиологического раствора, подвергнутых естественному старению и термически стерилизованных, определяемая по измерению показателя статической вязкости и выраженная как соответствующее снижение среднего молекулярного веса, не превышает следующих пределов:
97% начального значения (хранение при 25oC в течение 6 месяцев);
75% начального значения (стерилизации при 118oC в течение 32 мин);
80% начального значения (стерилизация при 121oC в течение 16 мин);
90% начального значения (стерилизация при 124oC в течение 8 мин).
а) превращение фракции гиалуроновой кислоты или ее соли в соответствующую четвертичную аммониевую соль путем абсорбции водного раствора указанной фракции соли гиалуроновой кислоты кислотным ионообменником, образующим соль с четвертичным аммониевым основанием;
в) растворение соответствующей четвертичной аммониевой соли в органическом растворителе, способном растворять такие аммониевые соли;
с) фильтрацию раствора и обработку его галогенидом натрия для извлечения гиалуроновой кислоты в форме натриевой соли.
а) показатель статической вязкости в пределах 14,5 - 21 дл/г при определении при 25oC в 0,15 М NaCl при pH 7,0 с использованием вискозиметра Убеллоде со суспензионной средой;
в) динамическая вязкость 1%-ного раствора (вес./об.) в 0,15 М NaCl при рН 7,0 не превышает указанных ниже предельных значений при определенных скоростях сдвига, с использованием ротационного вискозиметра при температуре 20oC;
Скорость сдвига - Динамическая вязкость (мПа • с при 20oC)
1 с-1 - Не более чем 20000 мПа • с
10- с-1 - Не более чем 2000 мПа • с
100 с-1 - Не более чем 1000 мПа • с
350 с-1 - Не более чем 500 мПа • с
с) содержание сульфатированного мукополисахарида не превышает 0,07% в расчете на серу;
d) содержание железа не превышает 10 ч./млн.;
е) стабильность изотонических буферных растворов с величиной рН данной фракции такой же, как у физиологического раствора, подвергнутых естественному старению и термически стерилизованных, определяемая по измерению показателя статической вязкости и выраженная как соответствующее снижение среднего молекулярного веса, не превышает следующих пределов:
97% начального значения (хранение при 25oC в течение 6 месяцев);
75% начального значения (стерилизации при 118oC в течение 32 мин);
80% начального значения (стерилизация при 121oC в течение 16 мин);
90% начального значения (стерилизация при 124oC в течение 8 мин).
| СПОСОБ ПОЛУЧЕНИЯ СУПЕРФОСФАТНЫХ УДОБРЕНИЙ | 0 |
|
SU239355A1 |
| В. Н. ОДИНОКОЕ, В. С. Кадышева и С. А. ЛамброзоНовосибирский филиал Научно-исследовательского института полимеризационных пластмасс | 0 |
|
SU265116A1 |
| Способ получения гиалуроновой кислоты | 1980 |
|
SU950735A1 |
| US 4920104 A, 1990 | |||
| Фрикционный заталкиватель-кантователь труб на автоматическом трубопрокатном станке | 1960 |
|
SU138572A1 |
| Способ получения гиалуроновой кислоты | 1989 |
|
SU1616926A1 |
Авторы
Даты
1999-04-10—Публикация
1992-04-16—Подача